Ингибиторы киназы
Номер патента: 15189
Опубликовано: 30.06.2011
Авторы: Майерс Майкл Рэй, Побанс Марк Эндрю, Блас Де Блас Хесус Андрес, Бастиан Джолие Анне, Ли Течао, Чжун Боюй, Лопес Де Уралде-Гармениа Беатрис, Ших Чуан, Мэйдер Мэри Маргарет, Де Дьес Альфонсо, Худзиак Кевин Джон
Формула / Реферат
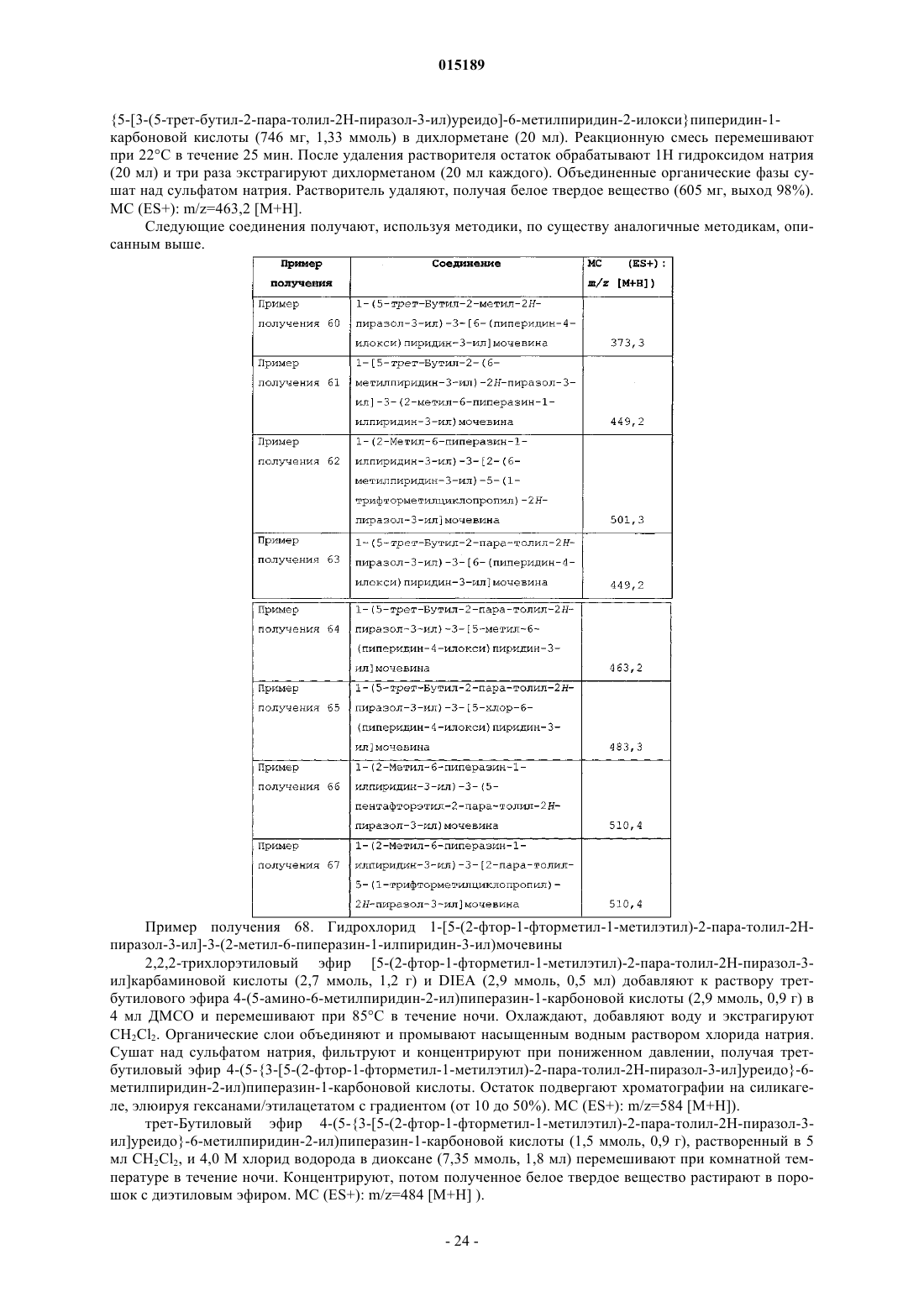
1. Соединение формулы I
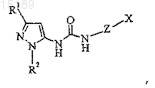
где Z выбран из группы, которая включает
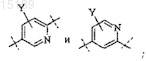
X выбран из группы, которая включает
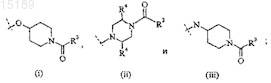
R1 представляет собой С1-С7алкил, необязательно замещенный от одного до шести заместителями, выбранными из группы, которая включает галоген и C1-C4алкилгалоген; С3-С6циклоалкил, необязательно замещенный одним или двумя заместителями, выбранными из группы, которая включает C1-C4алкил и трифторметил; или триметилсилил;
R2 представляет собой фенил, необязательно замещенный С1-С4алкилом, или пиридинил, необязательно замещенный C1-C4алкилом;
Y представляет собой водород, C1-C4алкил, галоген или C1-С4алкилгалоген;
R3 представляет собой С1-С7алкил, необязательно замещенный С3-С6циклоалкилом; C1-C4алкокси; C1-C4алкилгалоген; С3-С6циклоалкил, необязательно замещенный от одного до четырех заместителями, выбранными из группы, которая включает C1-C4алкил и трифторметил; или пиридил, фенил или тиенил, каждый из которых необязательно замещен первым заместителем, выбранным из группы, которая включает галоген, циано, C1-C4алкил, C1-C4алкилгалоген и C1-C4алкокси, и необязательно, кроме того, замещен вторым заместителем, выбранным из группы, которая включает С1-С4алкил и галоген;
R4 представляет собой водород или С1-С4алкил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где X представляет собой
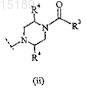
3. Соединение по п.1, где R4 представляет собой водород.
4. Соединение по любому из пп.1 и 2, где R2 представляет собой 4-толил.
5. Соединение по любому из пп.1-3, где R1 представляет собой С1-С7алкил.
6. Соединение по любому из пп.1-3, где R1 представляет собой трет-бутил.
7. Соединение по любому из пп.1-4, где R3 представляет собой 2,6-дифторбензил.
8. Соединение формулы I

1-(5-трет-бутил-2-пара-толил-2Н-пиразол-3-ил)-3-{6-[4-(2,6-дифторбензоил)пиперазин-1-ил]-2-метилпиридин-3-ил}мочевина или его фармацевтически приемлемая соль.
9. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 в комбинации с фармацевтически приемлемым наполнителем, носителем или разбавителем.
10. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для лечения рака.
11. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения рака.
Текст
Настоящее изобретение предлагает ингибиторы киназы формулы I где R1, R2, X и Z являются такими, как описано в данном изобретении, или их фармацевтически приемлемую соль. Бастиан Джолие Анне (US), Блас Де Блас Хесус Андрес (ES), Де Дьес Альфонсо, Худзиак Кевин Джон, Ли Течао (US), Лопес Де Уралде-Гармениа Беатрис (ES), Мэйдер Мэри Маргарет, Майерс Майкл Рэй, Побанс Марк Эндрю, Ших Чуань, Чжун Боюй(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 015189 Предпосылки создания изобретения р 38 киназа представляет собой активированную митогеном протеин (MAP) киназу, которая принадлежит к суперсемейству серин/треонин киназ. Эта киназа активируется внеклеточными факторами, такими как тепло, УФ-свет и осмотическое давление, а также воспалительными раздражителями, такими как липополисахарид. Будучи активированной, р 38 киназа фосфорилирует внутриклеточные протеиновые субстраты, которые регулируют биосинтез провоспалительных цитокинов фактора некроза опухоли(TNF) и интерлейкина-1 (IL-1). Эти цитокины вовлечены в патологии многих хронических воспалительных расстройств (Lee, et al., Ann. N.Y. Acad. Sci., 696, 149-170 (1993); Muller-Ladner, Curr. Opin.Rheumatol., 8, 210-220 (1996, сердечно-сосудистых расстройств и расстройств центральной нервной системы (Salituro, et al., Current Medicinal Chemistry, 6, 807-823 (1999 и аутоиммунных расстройств(Pargellis, et al., Nature Structural Biology, 9(4), 268-272 (2002. Кроме того, фосфорилированная форма активированной митогеном протеин киназы - протеин киназы 2 (или рМАРКАРК 2), также является киназой в р 38 МАРК пути и непосредственно может быть активирована р 38 МАРК. Исследования МАРКАРК 2 у нокаутированных мышей показывают снижение продуцирования цитокинов, предполагая, что МАРКАРК 2 может быть ключевым регулятором воспалительной реакции и также может быть потенциальной мишенью для противовоспалительной терапии (WO 2005120509). Многие соединения мочевины (например, в WO 9923091, WO 01012188, WO 04004720, WO 04037789, WO 99/32111, US 2004/0058961, ЕР 1609789, WO 03072569 и WO 0043384) были идентифицированы как ингибиторы р 38 киназы или ингибиторы цитокинов. Ингибиторы р 38 киназы или ингибиторы цитокинов могут быть дорогостоящими для производства и могут иметь проблемы, связанные с биодоступностью и абсорбцией, которые ограничивают эффекты in vivo и терапевтическое применение. Таким образом, существует потребность в новых лекарственных средствах на основе малых молекул, которые подавляют цитокины, то есть соединений, которые способны ингибировать р 38 киназы с большей эффективностью и большей биодоступностью. Настоящее изобретение предлагает новые ингибиторы р 38 киназы, полезные для лечения состояний, которые являются результатом чрезмерного продуцирования цитокинов. Краткое описание сущности изобретения Настоящее изобретение предлагает соединения формулы IR1 представляет собой C1-C7 алкил, необязательно замещенный от одного до шести заместителями,выбранными из группы, которая включает галоген и C1-C4 алкилгалоген; С 3-С 6 циклоалкил, необязательно замещенный одним или двумя заместителями, выбранными из группы, которая включает С 1-С 4 алкил и трифторметил; или триметилсилил;C1-C4 алкилгалоген; C3-C6 циклоалкил, необязательно замещенный от одного до четырех заместителями,выбранными из группы, которая включает C1-C4 алкил и трифторметил; или пиридил, фенил или тиенил,каждый из которых необязательно замещен первым заместителем, выбранным из группы, которая включает галоген, циано, C1-C4 алкил, C1-C4 алкилгалоген и C1-C4 алкокси, и необязательно, кроме того, замещен вторым заместителем, выбранным из группы, которая включает C1-C4 алкил и галоген; иR4 представляет собой водород или C1-C4 алкил; или их фармацевтически приемлемую соль. Настоящее изобретение также предлагает способ ингибирования р 38 киназы у млекопитающего,включающий введение млекопитающему, который нуждается в таком лечении, эффективного количества-1 015189 соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также предлагает способ подавления продуцирования фактора некроза опухолей(TNF) у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также предлагает способ подавления продуцирования интерлейкина-1 (IL1) у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении,эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение, кроме того, предлагает способ лечения состояний, которые являются результатом чрезмерного продуцирования цитокинов, у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении, соединения формулы I или его фармацевтически приемлемой соли в количестве, которое подавляет цитокины. Настоящее изобретение также предлагает способ ингибирования роста чувствительного новообразования у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении, соединения формулы I или его фармацевтически приемлемой соли в количестве, которое ингибирует р 38. Настоящее изобретение также предлагает способ ингибирования метастаза у млекопитающего,включающий введение млекопитающему, который нуждается в таком лечении, соединения формулы I или его фармацевтически приемлемой соли в количестве, которое ингибирует р 38. Настоящее изобретение также предлагает способ лечения ревматоидного артрита у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении, соединения формулыI или его фармацевтически приемлемой соли в количестве, которое ингибирует р 38. Настоящее изобретение также предлагает фармацевтическую композицию, которая содержит соединение формулы I или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым наполнителем, носителем или разбавителем. Настоящее изобретение также предлагает применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для ингибирования р 38 киназы. Кроме того, настоящее изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при ингибировании р 38 киназы у млекопитающих. Кроме того, настоящее изобретение предлагает фармацевтическую композицию, подходящую для ингибирования р 38 киназы,которая содержит соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми наполнителями, носителями или разбавителями. Настоящее изобретение также предлагает применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для подавления продуцирования фактора некроза опухолей(TNF) . Дополнительно, настоящее изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при подавлении продуцирования фактора некроза опухолей(TNF) у млекопитающих. К тому же, настоящее изобретение предлагает фармацевтическую композицию, подходящую для подавления продуцирования фактора некроза опухолей(TNF), которая содержит соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми наполнителями, носителями или разбавителями. Настоящее изобретение также предлагает применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для подавления продуцирования интерлейкина-1 (IL-1). Дополнительно, настоящее изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при подавлении продуцирования интерлейкина 1 (IL-1) у млекопитающего. К тому же, настоящее изобретение предлагает фармацевтическую композицию, подходящую для подавления продуцирования интерлейкина-1 (IL-1), которая содержит соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми наполнителями, носителями или разбавителями. Настоящее изобретение также предлагает применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения состояний, которые являются результатом чрезмерного продуцирования цитокинов. Дополнительно, настоящее изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при лечении состояний, которые являются результатом чрезмерного продуцирования цитокинов у млекопитающих. К тому же, настоящее изобретение предлагает фармацевтическую композицию, подходящую для лечения состояний, которые являются результатом чрезмерного продуцирования цитокинов, которая содержит соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми наполнителями, носителями или разбавителями. Настоящее изобретение также предлагает применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для ингибирования роста чувствительного новообразования. Дополнительно, настоящее изобретение предлагает соединение формулы I-2 015189 или его фармацевтически приемлемую соль для применения при ингибировании роста чувствительного новообразования у млекопитающих. К тому же, настоящее изобретение предлагает фармацевтическую композицию, подходящую для ингибирования роста чувствительного новообразования, которая содержит соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми наполнителями, носителями или разбавителями. Настоящее изобретение также предлагает применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для ингибирования метастаза. Дополнительно, настоящее изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при ингибировании метастаза у млекопитающих. К тому же, настоящее изобретение предлагает фармацевтическую композицию, подходящую для ингибирования метастаза, которая содержит соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми наполнителями, носителями или разбавителями. Настоящее изобретение также предлагает применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения ревматоидного артрита. Дополнительно, настоящее изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при лечении ревматоидного артрита у млекопитающих. К тому же,настоящее изобретение предлагает фармацевтическую композицию, подходящую для лечения ревматоидного артрита, которая содержит соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми наполнителями, носителями или разбавителями. Детальное описание изобретения Термин "р 38 киназа" обозначает изоформы р 38 и/или р 38 киназы. Термин "подавление продуцирования TNF (IL-1, цитокинов)" обозначает снижение избыточных уровней TNF, IL-1 или другого цитокина in vivo у млекопитающего до нормальных или субнормальных уровней. Такой эффект может быть достигнут с помощью ингибирования высвобождения in vivoTNF, IL-1 или другого цитокина всеми клетками, включая макрофаги; с помощью понижающего регулирования, на геномном уровне, избыточных уровней TNF, IL-1 или другого цитокина in vivo у млекопитающего до нормальных или субнормальных уровней; с помощью ингибирования синтеза TNF, IL1 или другого цитокина как посттрансляционного процесса; или с помощью понижающего регулирования TNF, IL-1 или другого цитокина на трансляционном уровне. Специалист в данной области техники примет во внимание, что определенные соединения формулыI имеют по меньшей мере один хиральный центр. Настоящее изобретение включает все индивидуальные энантиомеры или диастереомеры, а также смеси энантиомеров и диастереомеров указанных соединений,включая рацематы. Предпочтительно соединения формулы I, содержащие по меньшей мере один хиральный центр, существуют в форме индивидуальных энантиомеров или диастереомеров. Индивидуальные энантиомеры или диастереомеры могут быть получены исходя из хиральных реагентов, или с помощью стереоселективных или стереоспецифических способов синтеза. Альтернативно, индивидуальные энантиомеры или диастереомеры могут быть выделены из смесей с помощью стандартных способов хиральной хроматографии или кристаллизации. Специалисту в данной области будет понятно, что соединения согласно настоящему изобретению способны образовывать кислотно-аддитивные соли. Во всех случаях фармацевтически приемлемые соли всех соединений включены в их название. Соединения согласно настоящему изобретению представляют собой амины и соответственно будут реагировать с любой из многочисленных неорганических и органических кислот с образованием фармацевтически приемлемых кислотно-аддитивных солей. Термин "фармацевтически приемлемая соль", как используется в данной заявке, относится к солям соединений формулы I, которые не являются существенно токсичными для живых организмов. Типичные фармацевтически приемлемые соли включают соли, полученные с помощью реакции соединений согласно настоящему изобретению с фармацевтически приемлемыми органическими или неорганическими кислотами. Такие соли включают фармацевтически приемлемые соли, приведенные в Journal of Pharmaceutical Science, 66,2-19 (1977), который известен специалисту в данной области техники. Наиболее предпочтительными являются мезилатные соли соединений формулы I. Соединения формулы I являются ингибиторами р 38 киназы. Таким образом, настоящее изобретение также предлагает способ ингибирования р 38 киназы у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении, соединения формулы I в количестве, которое ингибирует р 38 киназу. Предпочтительно млекопитающим, которое лечат введением соединений формулы I,является человек. Как ингибиторы р 38 киназы соединения согласно настоящему изобретению полезны для подавления продуцирования провоспалительных цитокинов фактора некроза опухоли(TNF) и интерлейкина 1 (IL-1) и, таким образом, для лечения расстройств, которые являются результатом избыточного продуцирования цитокинов. Таким образом, считают, что настоящие соединения будут полезными при лечении воспалительных расстройств, включая экзему, атопический дерматит, ревматоидный артрит, ос-3 015189 теоартрит, воспалительное заболевание кишечника и синдром токсического шока. Также считают, что соединения согласно настоящему изобретению будут полезными при лечении сердечно-сосудистых расстройств, таких как острый инфаркт миокарда, хроническая сердечная недостаточность, атеросклероз,вирусный миокардит, отторжение сердечного аллотрансплантата и сердечная дисфункция, связанная с сепсисом. К тому же, также считают, что соединения согласно настоящему изобретению будут полезными при лечении расстройств центральной нервной системы, таких как менингококковый менингит, болезнь Альцгеймера, болезнь Паркинсона и рассеянный склероз. WO 99/32111, WO 9923091, WO 04004720, WO 03072569. Увеличение массы твердых опухолей обусловлено пролиферацией злокачественных клеток и клеток стромы, включая эндотелиальные клетки. Для увеличения опухоли до размера больше 2-3 мм в диаметре она должна сформировать сосудистую сеть, этот процесс известен под названием ангиогенез. Было сообщено, что подавление вызванного опухолью ангиогенеза под воздействием ангиостатина и эндостатина приводит к противоопухолевому эффекту (O'Reilly, et al., Cell, 88, 277-285 (1997. Было показано,что селективный ингибитор р 38 киназы SB22025 ингибирует ангиогенез (J.R. Jackson, et al., J. Pharmacol.Exp. Therapeutics, 284, 687 (1998. Поскольку ангиогенез является решающим фактором при увеличении массы большинства твердых опухолей, разработка новых ингибиторов р 38 киназы для ингибирования этого процесса является перспективным подходом к противоопухолевой терапии. Этот подход к противоопухолевой терапии может быть лишен токсичных побочных эффектов или развития резистентности к лекарственным средствам, имеющего место при традиционной химиотерапии (Judah Folkman, Endogenous Inhibitors of Angiogenesis, The Harvey Lectures, Series 92, pages 65-82, Wiley-Liss Inc., (1998. Как ингибиторы р 38 киназы соединения согласно настоящему изобретению, таким образом, также полезны при ингибировании роста чувствительных новообразований. Schultz, R. M. Potential of p38 MAPkinase inhibitors in the treatment of cancer. В: Е. Jucker (ed.), Progress in Drug Research, 60, 59-92, (2003). Чувствительное новообразование определено как новообразование, выживание, рост или метастаз которого зависят от р 38 киназы. Чувствительные новообразования включают опухоли головного мозга, мочеполового тракта, лимфатической системы, желудка, гортани и легких (патент US 5717100). Предпочтительно термин "чувствительные новообразования", как используется в данной заявке, включает раки у людей, включая немелкоклеточный рак легких (A. Greenberg, et al., Am. J. Respir. Cell Mol. Biol., 26, 558(2002, карциному молочной железы (J. Chen, et al., J. Biol. Chem., 276, 47901 (2001); B. Salh, et al., Int. J.al., Proc. Am. Assoc. Cancer Res., 43, 9 (2002, колоректальные карциномы (S. Xiong, et al. , Cancer Res.,61, 1727 (2001 и злокачественную меланому (С. Denkert, et al., Clin. Exp. Metastasis, 19, 79 (2002. Также было сообщено, что ингибирование ангиогенеза путем подавления TNF является полезным при ингибировании или профилактике метастаза (патент US 6414150; патент US 6335336). К тому же,подавление TNF предписано при лечении и профилактике кахексии, изнурительного синдрома, от которого страдает приблизительно половина всех больных раком (Т. Yoneda, et al., J. Clin. Invest., 87, 977(1991. К тому же, ингибирование р 38 киназы может быть эффективно при лечении некоторых вирусных состояний, таких как грипп (K. Kujime, et al. , J. Immunology., 164, 3222-3228 (2000, риновирус (S.Griego, et al., J. Immunology, 165, 5211-5220 (2000 и ВИЧ (L. Shapiro, et al., Proc. Natl. Acad. Sci. USA,95, 7422-7426, (1998. Как используется в данной заявке, термин "C1-C7 алкил" относится к линейной или разветвленной,моновалентной, насыщенной алифатической цепи, содержащей от одного до семи атомов углерода, и включает, но не ограничивается, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил,гексил и гептил. Термин "С 1-С 7 алкил" включает в свое определение термин "С 1-С 4 алкил". Как используется в данной заявке, термин "С 1-С 4 алкокси" относится к прямой или разветвленной алкильной цепи, содержащей от одного до четырех атомов углерода, присоединенных к атому кислорода. Типичные C1-C4 алкоксигруппы включают метокси, этокси, пропокси, изопропокси, бутокси, третбутокси и подобные. Как используется в данной заявке, термин "галоген" относится к атому хлора, брома, йода или фтора, если не указано другое. Как используется в данной заявке, термин C1-C4 алкилгалоген" относится к С 1-С 4 алкилу, замещенному до пяти атомами галогена. Типичные C1-C4 алкилгалогенгруппы включают метилгалоген, трифторметил, этилгалоген, бисфторметилэтил, пропилгалоген, изопропилгалоген, бутилгалоген, третбутилгалоген и подобные. Как используется в данной заявке, термин "С 3-С 6 циклоалкил" обозначает полностью насыщенное кольцо, содержащее атомы углерода и водорода, и включает циклопропил и циклобутил. Определенные классы соединений формулы I представляют собой предпочтительные ингибиторы р 38 киназы. В следующих абзацах описаны такие предпочтительные классы:g) R2 представляет собой фенил или пиридинил, каждый из которых необязательно замещен метилом;i) R3 представляет собой фенил или тиенил, каждый из которых необязательно замещен первым заместителем, выбранным из группы, которая включает галоген, циано, C1-C4 алкил, С 1-С 4 алкилгалоген иj) R3 представляет собой фенил, замещенный первым заместителем, выбранным из группы, которая включает галоген, и дополнительно замещенный вторым заместителем, выбранным из группы, которая включает C1-C4 алкил и галоген;m) соединение формулы I является мезилатной солью. Предпочтительные осуществления изобретения включают все комбинации абзацев а)-m). Другие предпочтительные соединения формулы I представляют собой соединения формулы I, в которых X является таким, как описано в абзаце b); R1 является таким, как описано в абзаце е); R2 является таким, как описано в абзаце g); и R4 является таким, как описано в абзаце с) . Также предпочтительно, когда X является таким, как описано в абзаце b); R1 является таким, как описано в абзаце f); R2 является таким, как описано в абзаце h); R3 является таким, как описано в абзацеi); и R4 является таким, как описано в абзаце с). Особенно предпочтительно, когда X является таким, как описано в абзаце b); R2 представляет собой фенил, замещенный в 4-положении C1-C4 алкилом. Наиболее предпочтительно, когда X является таким, как описано в абзаце b). Следующее соединение является также особенно наиболее предпочтительным. Соединения согласно настоящему изобретению могут быть получены с помощью ряда методик, некоторые из которых проиллюстрированы на схемах ниже. Для специалиста в данной области техники будет понятно, что для получения соединений формулы I отдельные стадии на приведенных ниже схемах могут быть изменены. Конкретный порядок стадий, необходимый для получения соединений формулы I,зависит от конкретного соединения, которое синтезируют, исходного соединения и относительной лабильности замещенных компонентов. Ради ясности некоторые заместители были исключены на приведенных ниже схемах, и это обстоятельство не ограничивает информацию, представленную на схемах. Соединения формулы I и промежуточные соединения могут быть получены, как проиллюстрировано на следующей схеме, где R1, R2 и X являются такими, как определено выше: Амин (а) подвергают взаимодействию с подходящим изоцианатом или карбаматом, таким как пиразолил-2,2,2-трихлорэтилкарбамат, с получением соединений формулы I. Например, нагревают раствор амина (1 экв.), трихлорэтил карбамата (1 экв.) и подходящего основания, такого как диизопропилэтиламин (2 экв.) или карбонат калия, в подходящем растворителе, таком как ацетонитрил или диметилсульфоксид (ДМСО). Желаемое соединение потом может быть выделено и, если необходимо и желательно,очищено, используя способы, хорошо известные из уровня техники, такие как хроматография, с получением соединения формулы I. Необходимые амины получают, как проиллюстрировано ниже на схеме 2, где X является таким, как определено выше. Схема 2 Нитрокомпонент (b) восстанавливают в стандартных условиях восстановления, например водородом в присутствии катализатора на основе палладия или боргидридом натрия в присутствии гексагидрата хлорида никеля(II) в подходящем растворителе, таком как низшие алканолы или этилацетат, с получением соответствующего амина (а). Такие стадии восстановления хорошо известны и определены в данной области техники. См. Larock, R., "Comprehensive Organic Transformations," 412, VCH Publishing, Inc., NewYork, 1989. Необходимые нитросоединения получают, как проиллюстрировано на схеме 3 ниже, где Hal представляет собой Cl или F, и X' представляет собой С(О)R3 или подходящую защитную группу PG: Схема 3 2-галоген-4-нитропиридин (е) в подходящем органическом растворителе, таком как THF, подвергают взаимодействию с подходящим 4-гидроксипиперидином и гидридом натрия или трифенилфосфином,с получением соответствующего замещенного пиперидина b(i). Альтернативно, 2-галоген-4 нитропиридин (е) подвергают взаимодействию с подходящим пиперазином и основанием, таким как карбонат калия, трет-бутоксид натрия или триэтиламин, в полярном растворителе, таком как ацетонитрил,N,N-диметилформамид (DMF) или бутанол, с получением соответствующего замещенного пиперазинаb(ii). Амин формулы b(iii) получают с помощью реакции 2-галоген-4-нитропиридина (е) в подходящем растворителе, таком как этанол, с подходящим аминопиперидином, в присутствии подходящего основания, такого как карбонат натрия. Специалисту в данной области техники понятно, что методики, описанные выше, могут быть использованы при получении пиридильных изомеров, предусмотренных в настоящем изобретении. Необходимые пиразолилкарбаматы могут быть получены, как описано на следующей схеме, где R1 2 и R являются такими, как определено выше. 3-аминопиразолы (m) получают, используя условия, хорошо известные из уровня техники; Larock,R., "Comprehensive Organic Transformations", 79, VCH Publishing, Inc., New York, 1989. Например, цианокетон (j) и подходящий гидразин или соль гидразина (k) в подходящем органическом растворителе,таком как этанол, подвергают взаимодействию при повышенной температуре. Полученный пиразол (m) может быть очищен, используя стандартные способы, такие как хроматография на колонке с силикагелем. 2,2,2-Трихлорэтил хлорформиат (n) подвергают взаимодействию с подходяще замещенным 3 аминопиразолом (m) и основанием, например карбонатом натрия, карбонатом калия или пиридином, в подходящем растворителе, например THF или вода/этилацетат, с получением соответствующего 2,2,2 трихлорэтил карбамата (о). Специалист в данной области техники примет во внимание, что соответствующий карбамат может быть получен с помощью реакции 3-аминопиразола с другими активными карбонатами. Соединения формулы I(i) могут быть получены, как продемонстрировано на схеме 5 ниже, где R1,2 3 Из соединения формулы (f) удаляют защитную группу в условиях, хорошо известных из уровня техники. Например, когда защитная группа представляет собой трет-бутокси карбонил, соединение формулы (f) растворяют в подходящем органическом растворителе или смеси растворителей, таком как дихлорметан, и обрабатывают кислотой, такой как соляная кислота в диоксане или трифторуксусная кислота. Снятием защитной группы с N-защищенной-пиперидин замещенной мочевины (f) получают замещенный пиперидин (g), который подвергают взаимодействию с замещенной карбоновой кислотой в стандартных условиях соединения для органических кислот и органических аминов в присутствии агента соединения, такого как гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDCI) или дициклогексилкарбодиимид (DCC), каталитическое количество 4-диметиламинопиридина (DMAP) и 1 гидроксибензотриазола(HOBt) или гексафторфосфата О-(7-азабензотриазол-1-ил)-N,N,N',N'тетраметилурония (HATU), или триэтиламин, в подходящем растворителе, таком как метиленхлорид или ацетонитрил, с получением соединения формулы I (i) . Специалисту в данной области техники понятно,что примеры формулы I(i) могут быть получены исходя из других защищенных пиперидинов, включая различные N-защитные группы, такие как формил, для которых могут быть необходимы другие методики снятия защитных групп, с получением промежуточных соединений (g). Если необходимо или желательно, может быть использована подходящая амино-защитная группа"Pg", такая как трет-бутоксикарбонильный (ВОС) фрагмент. Способы введения этих групп хорошо известны специалисту в данной области техники. Специалисту в данной области техники понятно, что защитные группы могут быть удалены на любой подходящей стадии синтеза соединений согласно настоящему изобретению. Способы введения и удаления азот- и кислород-защитных групп хорошо известны из уровня техники; см., например, Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wileyand Sons, New York, (1999) . Специалисту в данной области техники также понятно, что не все заместители в соединениях формулы I будут толерантными в определенных условиях реакции, которые используются при синтезе соединений. Эти заместители могут быть введены на подходящей стадии синтеза или могут быть защищены, а потом защитная группа, при необходимости или желании, может быть удалена. Сокращения, обозначения и условия, которые используются в примерах и исследованиях, имеют следующие значения: н-BuOH = н-бутанол, DCC = дициклогексилкарбодиимид, DIEA = N,Nдиизопропилэтиламин, ДМСО = диметилсульфоксид, DMF = N,N-диметилформамид, ч = час(ы), HOBt = 1-гидроксибензотриазол, LDA = диизопропиламид лития, EDCI = гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида, EtOAc = этилацетат, EtOH =этанол, Et2O = диэтиловый эфир, МеОН = метанол, NaBH(ОАс)3 = триацетоксиборгидрид натрия, TBAF = фторид тетрабутиламмо-7 015189 ния, Tf2O = ангидрид трифторметансульфоновой кислоты и THF = тетрагидрофуран. Примеры получения Пример получения 1. 2-Хлор-4-метил-5-нитропиридин 4-метил-5-нитропиридин-2-иламин (3,0 ммоль, 0,5 г) растворяют в 0,5 мл серной кислоты. Добавляют 7,6 мл воды и раствор охлаждают до 0 С. Добавляют нитрит натрия (4,5 ммоль, 0,3 г) и смесь перемешивают в течение 2 ч, потом оставляют нагреваться до комнатной температуры. Разбавляют водой и добавляют 10% водный раствор гидроксида натрия до основного рН. Экстрагируют в этилацетате и объединенные органические слои промывают насыщенным водным раствором хлорида натрия. Сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая 4-метил-5 нитропиридин-2-ол. МС (ES): m/z=155 [M+H]. Оксихлорид фосфора (0,6 ммоль, 0,05 мл) и пентахлорид фосфора (0,6 ммоль, 0,12 г) добавляют к 4 метил-5-нитропиридин-2-олу (1,9 ммоль, 0,3 г). Перемешивают при 120 С в течение 1,5 ч. Охлаждают,добавляют ледяную воду и экстрагируют в CH2Cl2. Объединенные органические слои промывают насыщенным водным раствором хлорида натрия. Сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая 2-хлор-4-метил-5-нитропиридин. Пример получения 2. 2,3-Дихлор-5-нитропиридин 5-Нитропиридин-2-ол (20 г, 143 ммоль) помещают в концентрированную HCl (100 мл) . Нагревают до 50 С и потом по каплям добавляют хлорат калия (6,13 г, 50 ммоль), растворенный в воде (100 мл). Перемешивают при 50 С в течение 30 мин. Реакционную смесь охлаждают на ледяной бане. Твердое вещество отфильтровывают и промывают водой. Тщательно сушат, получая 21,13 г (85%) 3-хлор-5 нитропиридин-2-ола. МС (ES) : m/z=173 [М+Н]. Оксихлорид фосфора (11,28 мл, 121 ммоль) помещают в круглодонную колбу и охлаждают до 0 С. Добавляют хинолин (7,15 мл, 60,5 ммоль), потом частями добавляют 3-хлор-5-нитропиридин-2-ол (21,13 г, 121 ммоль). Реакционную смесь нагревают до 120 С в течение 2 ч. Реакционную смесь выливают на лед и растирают в порошок с водой. Твердое вещество отфильтровывают и промывают водой. Тщательно сушат, получая 19,95 г (86%) указанного в заглавии соединения: 1H ЯМРH (400 МГц, ДМСО) 9,20 (с,1 Н) , 8,97 (с, 1 Н). Пример получения 3. трет-Бутиловый эфир 4-(5-амино-6-метилпиридин-2-ил)пиперазин-1 карбоновой кислоты Механически перемешивают смесь 6-хлор-2-метил-3-нитропиридина (Asymchem, 25,00 г, 144,9 ммоль), трет-бутил 1-пиперазинкарбоксилата (29,68 г, 159,4 ммоль) и триэтиламина (23,2 мл, 167 ммоль) в н-BuOH (250 мл) при 50 С под азотом в течение 4 ч, при 65 С в течение 2 ч, потом при комнатной температуре в течение ночи. Добавляют дополнительный трет-бутил 1-пиперазинкарбоксилат (1,5 г) и реакционную смесь нагревают при 65 С в течение 4 ч. Полученную суспензию охлаждают до 30 С, потом добавляют гексаны (75 мл). Суспензию охлаждают до комнатной температуры в течение 1 часа, потом добавляют воду (150 мл). Суспензию выдерживают в течение 45 мин, потом фильтруют. Осадок на фильтре промывают водой (4100 мл), потом гексанами (100 мл) и сушат на воздухе в течение ночи, получая трет-бутиловый эфир 4-(6-метил-5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты в виде блестящих желтых кристаллов (46,30 г, выход 99%. МС (ES): m/z=261 [М+Н-С 4 Н 8] ). Суспензию трет-бутилового эфира 4-(6-метил-5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты (46,00 г, 142,7 ммоль) в THF (750 мл) при комнатной температуре смешивают с Pd/C (5% Aldrich,3,04 г, 1,43 ммоль), потом помещают в атмосферу водорода (встряхивающий аппарат Парра, 40-45 фунт/дюйм 2) в течение 6 ч. Добавляют МеОН (250 мл) и суспензию выдерживают в атмосфере водорода в течение 4 ч при комнатной температуре. Добавляют дополнительный катализатор (3,04 г), потом помещают смесь в атмосферу водорода на 7 ч. Смесь фильтруют через прокладку из целита 521, промывая THF и МеОН, потом концентрируют при пониженном давлении, получая указанное в заглавии соединение в виде бледно-розового твердого вещества. (41,58 г, выход 99%. МС (ES+) : m/z=293 [M+H]) . Следующие соединения получают с помощью способа, по существу аналогичного методикам, описанным выше.(1,76 г, 9,45 ммоль) и триэтиламин (1,76 мл, 12,6 ммоль) помещают в н-бутанол (20 мл). Нагревают до 12 0 С в течение 17 ч. Охлаждают до комнатной температуры и добавляют этилацетат и воду. Органический слой отделяют и промывают водой и насыщенным водным хлоридом натрия. Органический слой собирают, сушат над Mg2SO4, фильтруют и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя 20% EtOAc:гексан, получая 1,14 г (58%) трет-бутилового эфира 4-(5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты. МС (ES): m/z=309 [M+H]. трет-Бутиловый эфир 4-(5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты (1,14 г, 3,70 ммоль) помещают в 1:1 EtOAc:MeOH (20 мл). Добавляют 10% Pd на угле, используя EtOAc (5 мл) . Реакционную смесь очищают и потом добавляют водород. Цикл очищения/наполнения повторяют дважды и реакционную смесь помещают в атмосферу водорода (баллон) и перемешивают при комнатной температуре в течение 20 ч. Реакционную смесь фильтруют через прокладку из целита и осадок на фильтре промывают EtOAc. Фильтрат собирают и концентрируют при пониженном давлении, получая 1,01 г(98%) указанного в заглавии соединения. МС (ES): m/z=279 [M+H]. Следующее соединение получают с помощью способа, по существу аналогичного методикам, описанным выше. Пример получения 8. трет-Бутиловый эфир 4-(5-амино-3-хлорпиридин-2-ил)пиперазин-1 карбоновой кислоты 2,3-Дихлор-5-нитропиридин (2,0 г, 10,36 ммоль), трет-бутиловый эфир пиперазин-1-карбоновой кислоты (2,12 г, 11,40 ммоль) и карбонат калия (1,72 г, 12,43 ммоль) помещают в DMF (20 мл). Нагревают до 80 С в течение 2,5 дней. Охлаждают до комнатной температуры и добавляют этилацетат и воду. Органический слой отделяют и промывают водой и насыщенным водным хлоридом натрия. Органический слой собирают, сушат над Mg2SO4, фильтруют и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя 20% EtOAc:гексан, получая 3,29 г (93%) третбутилового эфира 4-(3-хлор-5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты. МС (ES): m/z=341 [M+H]. трет-Бутиловый эфир 4-(3-хлор-5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты (3,09 г, 9,01 ммоль) помещают в метанол (50 мл). Добавляют гексагидрат хлорида никеля(II) (10,7 г, 45,1 ммоль) и реакционную смесь охлаждают до 0 С. Частями добавляют боргидрид натрия (5,11 г, 135,15 ммоль) и перемешивают при 0 С в течение 2 ч. Добавляют CH2Cl2 и фильтруют через прокладку из целита. Осадок на фильтре промывают CH2Cl2 и фильтрат собирают. К фильтрату добавляют насыщенный водный раствор бикарбоната натрия и органический слой отделяют. Водный слой экстрагируют CH2Cl2 (230 мл). Органические экстракты объединяют, сушат над Mg2SO4, фильтруют и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя 0-70% EtOAc:гексан, получая 1,77 г (63%) указанного в заглавии соединения. МС (ES): m/z=311,2 [M-H]. Пример получения 9. рац-[(транс)-4-(5-Амино-3-метилпиридин-2-ил)-2,5-диметилпиперазин-1 ил]циклопропил-метанон-9 015189 транс-2,5-диметилпиперазин (500 мг, 4,37 ммоль, 1,0 экв.) растворяют в 15 мл безводного дихлорметана. Добавляют ди-трет-бутил дикарбонат (953 мг, 4,37 ммоль, 1,0 экв.), растворенный в 5 мл дихлорметана. Перемешивают при комнатной температуре в течение 20 ч. Белое твердое вещество фильтруют, получая 430 мг N-BOC-транс-2,5-диметилпиперазина (выход 50%). 1 Н ЯМР (метанол-d4) d м.д. 4,11 (м, 1 Н); 3,55 (дд, J=13,6, 1,7 Гц, 1 Н) , 3,23 (дд, J=13,6, 4,0 Гц, 1 Н) ,3,12 (м, 1 Н) , 3,00 (дд, J=12,7, 2,9 Гц, 1 Н) , 2,49 (м, 1 Н) , 1,46 (с, 9 Н) , 1,24 (д, J=7,6, 3 Н), 1,15 (д, J=6,8 Гц,3 Н). 2-хлор-3-метил-5-нитропиридин (310 мг, 1,82 ммоль, 1,0 экв.) и N-BOC-транс-2,5 диметилпиперазин (397 мг, 2,0 ммоль, 1,1 экв.) растворяют в 5 мл безводного DMF, добавляют карбонат калия (251 мг, 1,82 ммоль, 1,0 экв.) и смесь перемешивают в течение 20 ч при 80 С. Раствор выливают в смесь 1:1 об/об EtOAc и ледяной воды. Водную фазу экстрагируют EtOAc (220 мл) и объединенные органические слои промывают водой (320 мл) и насыщенным водным хлоридом натрия (30 мл). Органический раствор сушат над сульфатом натрия и концентрируют при пониженном давлении, получая рац-(транс)-2,5-диметил-4-(3-метил-5-нитропиридин-2 неочищенный трет-бутиловый эфир ил)пиперазин-1-карбоновой кислоты. MC (ES+): m/z=251,2 (M+H). 4 М HCl в диоксане (4,2 мл) добавляют к трет-бутиловому эфиру рац-(транс)-2,5-диметил-4-(3 метил-5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты (0,15 г, 0,43 ммоль) при комнатной температуре и перемешивают. Через один час концентрируют при пониженном давлении, получая 0,138 г дигидрохлорида рац-(транс)-2,5-диметил-1-(3-метил-5-нитропиридин-2-ил)пиперазина в виде белого твердого вещества (количественный). МС (ES): m/z=251,2 [M+H]. Циклопропил карбоновой кислоты (56 мкл, 0,7 ммоль) добавляют к раствору EDCI (0,147 г, 0,77 ммоль), HOBt (0,10 г, 0,77 ммоль), дигидрохлорида рац-(транс)-2,5-диметил-1-(3-метил-5-нитропиридин 2-ил)пиперазина (0,16 г, 0,64 ммоль) в CH2Cl2 (5 мл), потом добавляют DIEA (0,22 мл, 1,28 ммоль) при комнатной температуре в атмосфере N2. Через один час смесь концентрируют, получая остаток. Остаток подвергают хроматографии на силикагеле, элюируя гексан:AcOEt 50-70%, получая 0,114 г рацциклопропил-[(транс)-2,5-диметил-4-(3-метил-5-нитропиридин-2-ил)пиперазин-1-ил]метанонаNH4COOH (0,23 г, 3,5 ммоль) добавляют к рац-циклопропил-[(транс)-2,5-диметил-4-(3-метил-5 нитропиридин-2-ил)пиперазин-1-ил]метанону (0,114 г, 0,35 ммоль) и Pd/C 10% (0,043 г) в EtOH (5 мл) в атмосфере N2 и нагревают при 80 С. Через 2 ч реакционную смесь охлаждают и фильтруют через целит. Концентрируют при пониженном давлении, получая 0,1 г указанного в заглавии соединения (количественный). МС (ES): m/z=289,3[M+H]. Пример получения 10. 1-[4-(5-Амино-4-метилпиридин-2-ил)пиперазин-1-ил]-2,2-диметилпропан-1-он Раствор 2-хлор-4-метил-5-нитропиридина (0,85 ммоль, 0,15 г), гидрохлорида 2,2-диметил-1 пиперазин-1-ил-пропан-1-она (0,94 ммоль, 0,16 г) и триэтиламина (2,12 ммоль, 0,3 мл) перемешивают в герметичной колбе при 80 С в течение ночи. Смесь охлаждают до комнатной температуры, добавляютCH2Cl2 и промывают насыщенным водным хлоридом натрия. Сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая 2,2-диметил-1-[4-(4-метил-5-нитропиридин-2 ил)пиперазин-1-ил]пропан-1-он. Остаток подвергают хроматографии на силикагеле, элюируя гексаны/этилацетат с градиентом (от 30 до 60%). МС (ES): m/z=307 [M+H]. Формиат аммония (1,55 ммоль, 0,1 г) и палладий (уголь) 10% (0,031 ммоль) добавляют к раствору 2,2-диметил-1-[4-(4-метил-5-нитропиридин-2-ил)пиперазин-1-ил]пропан-1-она (0,31 ммоль, 0,09 г) в 2 мл этанола. Раствор перемешивают в течение часа при 90 С. Охлаждают и фильтруют через прокладку из целита и концентрируют при пониженном давлении. Остаток может быть использован без дополнительного очищения. МС (ES): m/z=277 [М+Н]. Следующее соединение получают с помощью способа, по существу аналогичного второй методике,описанной выше.(0,7 ммоль, 0,2 г), растворенные в толуоле, перемешивают под азотом при 100 С в течение 4 ч. Охлаждают до комнатной температуры и добавляют воду. Экстрагируют в этилацетате, промывая органический слой водой и насыщенным водным хлоридом натрия. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая трет-бутиловый эфир 4-(4 хлорпиридин-2-ил)пиперазин-1-карбоновой кислоты в виде остатка. Остаток подвергают хроматографии на силикагеле, элюируя гексаны/этилацетат с градиентом (от 10 до 50%). МС (ES): m/z=298 [M+H]. Стадия В. Раствор трет-бутилового эфира 4-(4-хлорпиридин-2-ил)пиперазин-1-карбоновой кислоты (0,6 г, 1,9 ммоль) в CH2Cl2 (4 мл) обрабатывают при комнатной температуре HCl (4 Н раствор в диоксане, 1,5 мл, 5,9 ммоль), в результате происходит незначительное выделение тепла. Смесь перемешивают в течение 3 ч,добавляют дополнительный HCl (4 Н раствор в диоксане, 1,5 мл, 5,9 ммоль) и перемешивают в течение ночи. Концентрируют при пониженном давлении, получая гидрохлорид 1-(4-хлорпиридин-2 ил)пиперазина, который потом растирают в порошок с Et2O (0,43 г). ЖХМС ES+ (m/z) 198 [М+Н]). Стадия С. Гидрохлорид 1-(4-хлорпиридин-2-ил)пиперазина (2,2 ммоль, 0,4 г), триэтиламин (7,6 ммоль, 1,1 мл) в 13 мл CH2Cl2 и пивалоилхлорид (2,2 ммоль, 0,3 мл) перемешивают в течение ночи при комнатной температуре. Добавляют CH2Cl2 и промывают насыщенным водным хлоридом натрия и водой. Сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая 1-[4-(4 хлорпиридин-2-ил)пиперазин-1-ил]-2,2-диметилпропан-1-он. МС (ES): m/z=282 [M+H]. Стадия D. 1-[4-(4-хлорпиридин-2-ил)пиперазин-1-ил]-2,2-диметилпропан-1-он (1,6 ммоль, 0,4 г) растворяют в серной кислоте (2,3 мл) и раствор охлаждают до 0 С. Добавляют нитрат калия (1,6 ммоль, 0,2 г) и смесь перемешивают, разрешая нагреваться до комнатной температуры, в течение ночи. Смесь разбавляют водой и добавляют 10% гидроксид натрия до основного рН. Экстрагируют в этилацетате. Сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая остаток 1-[4-(4-хлор-5 нитропиридин-2-ил)пиперазин-1-ил]-2,2-диметил-пропан-1-она. Остаток подвергают хроматографии на силикагеле, элюируя смесью гексаны/этилацетат (от 30% до 60%) . МС (ES): m/z=327 [M+H]. Стадия Е. Дитионит натрия (4,5 ммоль, 0,8 г) добавляют к 1-[4-(4-хлор-5-нитропиридин-2-ил)пиперазин-1 ил]-2,2-диметилпропан-1-ону (0,9 ммоль, 0,3 г) в 22 мл смеси 1:1 тетрагидрофурана и воды и 4 мл аммиака. Раствор перемешивают в течение 2 часов при комнатной температуре. Концентрируют при пониженном давлении и остаток экстрагируют в этилацетате. Сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая остаток, который используют без дополнительного очищения. МС (ES): m/z=297 [M+H]. Следующее соединение получают, используя методики, по существу, аналогичные стадиям С-Е,описанным выше. Уксусную кислоту (5 л) помещают в 22-л колбу. Реакционную смесь помещают на баню лед-вода. Частями добавляют пиперазин (355,00 г, 2,0 экв.; 4,06 моль) при перемешивании и температуру увеличивают до 40 С. Добавляют еще 5 л уксусной кислоты. Смесь перемешивают, пока она не станет раствором. Температуру охлаждающей бани корректируют до 13 С. По каплям добавляют 2,6-дифторбензоил хлорид (355,00 г, 1,00 экв.; 2,01 моль; 253,39 мл) в течение 2 ч, одновременно поддерживая температуру реакционной смеси приблизительно 13-15 С. Перемешивают в течение ночи. Концентрируют при пони- 11015189 женном давлении и остаток растворяют в 2 л ледяной воды. Колбу охлаждают на бане лед-вода. Добавляют 5 Н NaOH для корректировки рН до 7,5, одновременно поддерживая температуру реакционной смеси ниже 30 С. Фильтруют при 10 С. Продукт экстрагируют из фильтрата дихлорметаном (42 л). Растворитель удаляют при пониженном давлении. Твердое вещество растворяют в 1,5 л метанола при комнатной температуре и фильтруют. Метанольный раствор концентрируют, потом растворитель заменяют на толуол 2,0 л, получая чистый продукт. Фильтруют, получая (2,6-дифторфенил)пиперазин-1 илметанон. Фильтрат концентрируют и снова фильтруют, получая дополнительный продукт (в сумме 400 г) .(2,6-дифторфенил)пиперазин-1-илметанон (1,07 экв., 1,55 моль, 350,00 г), метанол (37,06 моль, 1,50 л, 1,19 кг), триэтиламин (1,79 моль, 250,00 мл, 181,50 г), 6-хлор-2-метил-3-нитропиридин (1,00 экв., 1,45 моль, 250,00 г) помещали в 5-л колбу с верхней мешалкой. Реакционную смесь перемешивают при комнатной температуре в течение 0,5 ч. Медленно нагревают до 60 С и перемешивание продолжают при 60 С в течение ночи. По каплям добавляют воду (750 мл), одновременно поддерживая температуру при 60 С. Смесь оставляют охлаждаться до комнатной температуры. Фильтруют и осадок на фильтре промывают смесью 2:1 метанол/вода 150 мл, потом дважды МТВЕ. Сушат при пониженном давлении при 45 С,получая (2,6-дифторфенил)-[4-(6-метил-5-нитропиридин-2-ил)пиперазин-1-ил]метанон в виде желтого твердого вещества (535 г).(2,6-дифторфенил)-[4-(6-метил-5-нитропиридин-2-ил)пиперазин-1-ил]метанон (1,00 экв., 1,44 моль,520,00 г), метанол (197,66 моль, 8,00 л, 6,33 кг) и 5% палладий на угле, смоченный THF, (75,00 г) помещают в автоклав на три галлона. Реакционную смесь гидрогенизируют при 50 фунт/дюйм 2 при комнатной температуре, одновременно поддерживая температуру ниже 30 С. Через 0,5 ч охлаждают до 26 С и выдерживают в течение 2 ч. Фильтруют и концентрируют при пониженном давлении. Фильтруют, получая твердые вещества, промывают метанолом, потом гептанами. Дополнительно фильтруют, получая вторую порцию [4-(5-амино-6-метилпиридин-2-ил)пиперазин-1-ил]-(2,6-дифторфенил)метанона. Сушат при пониженном давлении при 45 С (445 г). Пример получения 15. [4-(5-Амино-3-метилпиридин-2-ил)пиперазин-1-ил]-(2,6-дифторфенил)метанон Суспензию 2-хлор-3-метил-5-нитропиридина (27,00 г, 0,156 моль) и трет-бутилового эфира пиперазин-1-карбоновой кислоты (32,03 г, 0,172 моль) в безводном DMF (270 мл) обрабатывают K2CO3 (34,55 г,0,250 моль), потом реакционную смесь нагревают при 80 С под N2 в течение ночи. Полученную реакционную смесь выливают в 1/1 EtOAc/H2O (3,000 мл), слои разделяют, потом водный слой экстрагируютEtOAc (1,000 мл). Объединенные органические слои промывают насыщенным водным хлоридом натрия(31,000 мл, каждого), сушат над MgSO4, фильтруют, потом концентрируют при пониженном давлении,получая желтое твердое вещество. Желтое твердое вещество суспендируют в гексанах/EtOAc, потом полученное твердое вещество восстанавливают с помощью вакуумного фильтрования. Промывают гексанами и вакуумно фильтруют, получая (42,84 г) трет-бутиловый эфир 4-(3-метил-5-нитропиридин-2 ил)пиперазин-1-карбоновой кислоты в виде желтого твердого вещества. Фильтрат концентрируют при пониженном давлении, получая желтое твердое вещество. Желтое твердое вещество суспендируют в гексанах, потом полученное твердое вещество восстанавливают с помощью вакуумного фильтрования, промывают гексанами и сушат с помощью вакуумного фильтрования, получая дополнительный (5,38 г) трет-бутиловый эфир 4-(3-метил-5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты в виде желтого твердого вещества (48,22 г, выход 95,9%). 1C15H22N4O4: С 55,88; Н 6,87; N 17,37. Найдено С 55,94; Н 6,87; N 17,14. Раствор 4 М HCl в диоксане (4 экв.) добавляют к раствору трет-бутилового эфира 4-(3-метил-5 нитропиридин-2-ил)пиперазин-1-карбоновой кислоты (7,77 г, 24,13 ммоль) в DCM (73 мл). Смесь перемешивают при комнатной температуре в течение ночи. Добавляют еще 2 экв. раствора HCl в диоксане. После того, как исходное вещество не было выявлено с помощью ЖХМС, твердое вещество фильтруют и сушат при пониженном давлении, получая 6,91 г гидрохлорида 1-(3-метил-5-нитропиридин-2 ил)пиперазина в виде желтоватого твердого вещества (выход 97%). ES+(m/z): 259 [М+1] . Триэтиламин (3 экв.) по каплям добавляют к суспензии гидрохлорида 1-(3-метил-5-нитропиридин 2-ил)пиперазина (6,91 г, 24,13 ммоль) в DCM (120 мл). Добавляют 2,6-дифторбензоилхлорид (1 экв.). Смесь перемешивают при комнатной температуре в течение ночи. Добавляют дополнительный 2,6 дифторбензоилхлорид (1,6 мл) и триэтиламин (1,5 экв.) для завершения реакции. Реакционную смесь выдерживают в течение ночи. Разбавляют DCM и экстрагируют несколько раз водой. Органический слой сушат над Na2S2O4, фильтруют и растворитель удаляют при пониженном давлении. Твердое вещество несколько раз промывают гексаном, получая 8,08 г (2,6-дифторфенил)-[4-(3-метил-5-нитропиридин-2 ил)пиперазин-1-ил]метанон (выход 93%). ES+(m/z): 363 [М+1].Na2S2O4 (10 экв.) и водный аммиак (3 мл/ммоль, 32%) добавляют к раствору (2,6-дифторфенил)-[4(3-метил-5-нитропиридин-2-ил)пиперазин-1-ил]метанона (3 г, 8,29 ммоль) в THF/H2O (166 мл, 1:1). Пе- 12015189 ремешивают в течение 30 мин, потом слои разделяют. Водный слой экстрагируют DCM, EtOAc и изопропиловым спиртом/EtOAc. Органические слои объединяют и сушат над Na2SO4, фильтруют и растворитель удаляют при пониженном давлении. Неочищенное вещество очищают на колонке Varian SCX и колонку промывают МеОН и потом продукт вымывают 2 М NH3 в МеОН, получая 1,2 г [4-(5-амино-3 метилпиридин-2-ил)пиперазин-1-ил]-(2,6-дифторфенил)метанона (выход 44%). Диизопропил азодикарбоксилат (3,0 мл, 15,5 ммоль) по каплям добавляют к охлажденной смеси 6 метил-5-нитропиридин-2-ола (1,54 г, 10,0 ммоль), трет-бутилового эфира 4-гидроксипиперидин-1 карбоновой кислоты (2,05 г, 10,0 ммоль) и трифенилфосфина (4,02 г, 15,3 ммоль) в THF (25 мл) при 0 С. После окончания добавления охлаждающую баню удаляют и реакционную смесь перемешивают при 22 С в течение ночи. Концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя гексанами и этилацетатом, получая трет-бутиловый эфир 4-(6-метил-5 нитропиридин-2-илокси)пиперидин-1-карбоновой кислоты в виде бесцветного масла (2,69 г, выход 80%).MC(ES): m/z=338,2 [M+H]. Смесь трет-бутилового эфира 4-(6-метил-5-нитропиридин-2-илокси)пиперидин-1-карбоновой кислоты (2,69 г, 8,0 ммоль) и 10% палладия на угле (1,0 г) в этаноле (60 мл) перемешивают при 22 С в атмосфере водорода в течение 2 ч. Палладиевый катализатор отфильтровывают. Фильтрат концентрируют,получая бесцветное масло. Остаток подвергают хроматографии на силикагеле, элюируя гексанами и этилацетатом, получая указанное в заглавии соединение (2,19 г, выход 89%). МС (ES): m/z=308,2 [М+Н]. Следующее соединение получают, используя методику, по существу, аналогичную методике, описанной выше. Пример получения 18. трет-Бутиловый эфир 4-(5-аминопиридин-2-илокси)пиперидин-1-карбоновой кислоты Суспензию предварительно промытого NaH (0,1 г, 2,48 ммоль, 60% дисперсия в минеральном масле) в THF (2 мл) добавляют к ледяному раствору трет-бутилового эфира 4-гидроксипиперидин-1 карбоновой кислоты (0,5 г, 2,48 ммоль) в сухом THF (3 мл). Смесь оставляют перемешиваться в течение 20 мин, потом частями добавляют 2-хлор-5-нитропиридин (0,36 г, 2,26 ммоль). После окончания добавления охлаждающую баню удаляют и реакционную смесь перемешивают при 22 С в течение ночи. Реакционную смесь охлаждают на ледяной бане и добавляют насыщенный водный раствор бикарбоната натрия (5 мл). Реакционную смесь разделяют между этилацетатом (25 мл) и дистиллированной водой (25 мл). Водную фазу выделяют и экстрагируют этилацетатом (335 мл). Объединенные органические фазы сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя гексанами и этилацетатом, получая трет-бутиловый эфир 4-(5 нитропиридин-2-илокси)пиперидин-1-карбоновой кислоты в виде белого твердого вещества (0,55 г, выход 75%). МС (ES): m/z=324,2 [M+H]. Смесь трет-бутилового эфира 4-(5-нитропиридин-2-илокси)пиперидин-1-карбоновой кислоты (2,7 г,8,35 ммоль) и 10% палладия на угле (0,5 г) в этаноле (100 мл) перемешивают при комнатной температуре в атмосфере водорода в течение 4 ч. Фильтруют, чтобы удалить палладиевый катализатор. Фильтрат концентрируют и полученное бесцветное масло подвергают хроматографии на силикагеле, элюируя гексанами и этилацетатом, получая указанное в заглавии соединение в виде белого твердого вещества (2,11 г, 86% (ES+(m/z) 194,2 [М+Н-ВОС]). Пример получения 19. Суспензию предварительно промытого NaH (1,27 г, 31,87 ммоль, 60% дисперсия в минеральном- 13015189 масле) в THF (20 мл) добавляют к ледяному раствору трет-бутилового эфира 4-гидроксипиперидин-1 карбоновой кислоты (6,41 г, 31,87 ммоль) в сухом THF (80 мл). Смесь оставляют перемешиваться в течение 20 минут, потом частями добавляют 2-хлор-3-метил-5-нитропиридин (5 г, 28,97 ммоль). После окончания добавления охлаждающую баню удаляют и реакционную смесь перемешивают при 22 С в течение ночи. Реакционную смесь охлаждают на ледяной бане и добавляют насыщенный водный раствор бикарбоната натрия (50 мл). Реакционную смесь разделяют между этилацетатом (350 мл) и дистиллированной водой (150 мл). Водную фазу выделяют и экстрагируют этилацетатом (1100 мл). Органические слои объединяют и промывают насыщенным водным раствором хлорида натрия (2150 мл). Объединенные органические фазы сушат над сульфатом натрия и концентрируют. Остаток подвергают хроматографии на силикагеле, элюируя гексанами и этилацетатом, получая трет-бутиловый эфир 4-(3-метил-5 нитропиридин-2-илокси)пиперидин-1-карбоновой кислоты в виде белого твердого вещества (6,5 г, выход 67%). МС (ES): m/z=360,3 [M+Na]. Трифторуксусную кислоту (150 мл) добавляют к охлажденному раствору трет-бутилового эфира 4(3-метил-5-нитропиридин-2-илокси)пиперидин-1-карбоновой кислоты (10,12 г, 30 ммоль) в дихлорметане (450 мл). Реакционную смесь перемешивают при 22 С в течение 60 мин. После удаления растворителя остаток обрабатывают 1H гидроксидом натрия (150 мл) и экстрагируют дихлорметаном и этилацетатом. Объединенные органические фазы сушат над сульфатом натрия. Растворитель удаляют, получая 3 метил-5-нитро-2-(пиперидин-4-илокси)пиридин в виде желтого твердого вещества (6,9 г, выход 97%). МС (ES): m/z=238,2 [M+H]. 2-Фторбензоилхлорид (1,74 г, 11,0 ммоль) по каплям добавляют к раствору 3-метил-5-нитро-2(пиперидин-4-илокси)пиридина в дихлорметане (50 мл) и триэтиламине (1,21 г, 12 ммоль) и перемешивают под N2 при комнатной температуре в течение 2 ч. Реакционную смесь промывают дистиллированной водой (320 мл), потом насыщенным водным раствором хлорида натрия (120 мл). Органическую фазу сушат над сульфатом натрия и концентрируют, получая (2-фторфенил)-[4-(3-метил-5 нитропиридин-2-илокси)пиперидин-1-ил]метанон в виде желтого твердого вещества. Смесь (2-фторфенил)-[4-(3-метил-5-нитропиридин-2-илокси)пиперидин-1-ил]метанона (3,58 г, 10 ммоль) и 10% палладия на угле (358 мг) в этаноле (100 мл) перемешивают при 22 С в атмосфере водорода в течение ночи. Фильтруют, чтобы удалить катализатор. Фильтрат концентрируют, получая бесцветное масло. Масло подвергают хроматографии на силикагеле, элюируя гексанами и этилацетатом (1:1),потом 70% этилацетата/гексаны, получая желтое твердое вещество (2,27 г, выход 50%). МС (ES):m/z=330,2 [M+H]. Пример получения 20. трет-Бутиловый эфир 4-(4-аминопиридин-2-илокси)пиперидин-1-карбоновой кислоты 100 мл толуола добавляют к очищенной азотом смеси 2-хлор-4-нитропиридина (4,32 г, 27,2 ммоль),трет-бутил 4-гидроксипиперидин карбоксилата (11,0 г, 54,5 ммоль), карбоната цезия (13,3 г, 40,8 ммоль),ацетата палладия (122 мг, 0,544 ммоль) и 2-(ди-трет-бутилфосфино)-1,1'-бинафтила (271 мг, 0,68 ммоль). Полученную смесь перемешивают в течение ночи при комнатной температуре, потом разделяют между водой и этилацетатом. Водный слой экстрагируют дополнительным этилацетатом и объединенный органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя градиентом от 0 до 20% этилацетата в гексанах, получая трет-бутиловый эфир 4-(4-нитропиридин-2-илокси)пиперидин-1-карбоновой кислоты в виде белого воскоподобного твердого вещества (5,37 г, 61%; ЖХМС ES+ (m/z) 268 [M-tBu]+). Суспензию трет-бутилового эфира 4-(4-нитропиридин-2-илокси)пиперидин-1-карбоновой кислоты(3,0 г, 9,28 ммоль) и 5% Pd/C (151 мг) в EtOAc (150 мл) помещают в атмосферу водорода при 60 фунт/дюйм 2 (встряхивающий аппарат Парра) в течение ночи при температуре окружающей среды. Реакционную смесь фильтруют через прокладку из целита и концентрируют при пониженном давлении,получая указанное в заглавии соединение в виде белого твердого вещества (2,6 г, выход 95%). ЖХМСES+ (m/z) 294 [М+Н]. Пример получения 21. [4-(4-Аминопиридин-2-илокси)пиперидин-1-ил]-(2,6-дифторфенил)метанон 2-Хлор-4-нитропиридин, 3 г (18,9 ммоль), трет-бутиловый эфир 4-гидроксипиперидин-1 карбоновой кислоты, 7,6 г (37,8 ммоль), [1,1']бинафталенил-2-ил-ди-трет-бутил-фосфан, 188 мг (0,47 ммоль), ацетат палладия, 85 мг (0,38 ммоль) и карбонат цезия, 9,2 г (28,4 ммоль), помещают в 500-мл колбу и очищают N2 в течение 10 мин. Потом добавляют сухой толуол (500 мл) и перемешивают при комнатной температуре в атмосфере N2 в течение ночи. Реакционную смесь разделяют между водой иEtOAc (500 мл каждого). Органический слой отделяют. Сушат над MgSO4, фильтруют и растворители выпаривают. Остаток подвергают хроматографии на силикагеле, элюируя смесью EtOAc:гексаны с градиентом от 5 до 20% EtOAc в 10 объемах колонки, получая 1,2 г (выход 34%) трет-бутилового эфира 4(4-нитропиридин-2-илокси)пиперидин-1-карбоновой кислоты, указанного в заглавии соединения, в виде белого твердого вещества (ES+(m/z)=324 [М+Н]) . 8 мл 4 М раствора HCl в Et2O добавляют к 1,2 г трет-бутилового эфира 4-(4-нитропиридин-2 илокси)пиперидин-1-карбоновой кислоты и суспензию перемешивают в течение 4 часов. Растворитель- 14015189 выпаривают и оставшееся твердое вещество растирают в порошок с Et2O, получая 1,1 г дигидрохлорида 4-нитро-2-(пиперидин-4-илокси)пиридина в виде бледно-желтого твердого вещества (выход 100%)(ES+(m/z)=224 [М+Н]). Триэтиламин (2,57 мл, 18,5 ммоль) добавляют к суспензии 1,1 г (3,7 ммоль) дигидрохлорида 4 нитро-2-(пиперидин-4-илокси)пиридина в сухом дихлорметане (50 мл). Потом добавляют хлорид 2,6 дифторбензоила, 0,512 мл (4,07 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду (50 мл) и органический слой отделяют. Сушат MgSO4 и фильтруют. Растворители выпаривают, получая 1,22 г (выход 91%) (2,6-дифторфенил)-[4-(4-нитропиридин-2-илокси)пиперидин-1 ил]метанона в виде желтого твердого вещества (ES+(m/z)=364 [М+Н]). Порошок железа (419 мг, 7,5 ммоль) добавляют к раствору 1,1 г (3,0 ммоль) (2,6-дифторфенил)-[4(4-нитропиридин-2-илокси)пиперидин-1-ил]метанона в ледяной уксусной кислоте (10 мл) и перемешивают при 80 С. Через 15 мин смесь оставляют охлаждаться до комнатной температуры и фильтруют через целит. Прокладку из целита промывают Et2O и EtOAc. Полученный органический слой промывают водой, насыщенным водным раствором NaHCO3 и насыщенным водным раствором хлорида натрия. Органический слой отделяют, сушат над MgSO4 и растворители выпаривают, получая 831 мг (выход 83%) указанного в заглавии соединения в виде белого твердого вещества. (ES+(m/z)=334 [М+Н]). Пример получения 22. трет-Бутиловый эфир 4-(5-аминопиридин-2-иламино)пиперидин-1 карбоновой кислотыN-Boc-4-аминопиперидин (0,9 г, 4,8 ммоль) растворяют в сухом этаноле и добавляют твердый карбонат натрия (0,8 г, 7,9 ммоль) при 0 С, потом добавляют 2-хлор-5-нитропиридин (0,6 г, 3,9 ммоль). Раствор перемешивают при комнатной температуре в течение ночи, потом раствор нагревают при 9 С в течение 6 ч. Перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают при пониженном давлении и неочищенную смесь разделяют между EtOH и водой. Экстрагируют EtOAc и органический слой промывают насыщенным водным раствором хлорида натрия. Органические слои объединяют и сушат над MgSO4. Фильтруют и растворитель выпаривают,получая трет-бутиловый эфир 4-(5-нитропиридин-2-иламино)пиперидин-1-карбоновой кислоты.SnCl2H2O (11,8 ммоль, 2,7 г) добавляют к раствору трет-бутилового эфира 4-(5-нитропиридин-2 иламино)пиперидин-1-карбоновой кислоты (2,4 ммоль, 0,8 г) в 20 мл этилацетата. Раствор перемешивают при комнатной температуре в течение ночи. Добавляют водный раствор NaHCO3, пока рН раствора не станет основным, и экстрагируют этилацетатом. Суспензию фильтруют через прокладку из целита. Органические слои объединяют и промывают насыщенным водным хлоридом натрия, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая указанное в заглавии соединение. МС (ES): m/z=293 [M+H]. Пример получения 23. Метил 1-метилциклогексан карбоксилат Раствор 1-метилциклогексан карбоновой кислоты (7,11 г, 50,0 ммоль) в МеОН (10 мл) и Et2O (40 мл) по каплям обрабатывают триметилсилилдиазометаном (2,0 М/гексаны; 26 мл, 52 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, потом концентрируют при пониженном давлении, получая указанное в заглавии соединение в виде прозрачного бледно-желтого масла Гидроксид калия (486,7 ммоль, 32,1 г) добавляют к раствору 2,3-дигидрокси-2-метилпропионовой кислоты (423,2 ммоль, 50 г) в 300 мл DMF. Раствор перемешивают в течение 1 ч при 100 С, потом добавляют бензилбромид. Раствор перемешивают в течение ночи. Смесь охлаждают и разбавляют этилацетатом. Органический слой промывают водой. Водный слой несколько раз промывают этилацетатом. Органические слои объединяют и сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. 1 Н ЯМР (CDCl3, 300 МГц):м.д.: 7,36-7,32 (м, 5 Н), 5,1 (с, 2 Н), 3,5 (с, 2 Н), 1,21 (с, 6 Н). Пример получения 25. Этиловый эфир 1-фторметилциклопропанкарбоновой кислотыAgF (4,5 экв., 4,56 г) добавляют к раствору этилового эфира 1-фтор-циклобутанкарбоновой кислоты(1,6 г, 8 ммоль) в ацетонитриле (22 мл) и воде (274 мл). Смесь нагревают при 80 С в герметичной колбе в течение 20 ч с энергичным перемешиванием. Смесь оставляют охлаждаться и фильтруют через целит. Растворитель удаляют при пониженном давлении, получая указанное в заглавии соединение в виде масла(0,81 г, выход 61%), которое используют без какого-либо дополнительного очищения. МС (ES):m/z=147,1 [M+H]. Пример получения 26. Метиловый эфир 1-трифторметилциклопропанкарбоновой кислоты 2 М раствор диазометана в гексанах (14,2 мл, 28,45 ммоль) добавляют к раствору 1 трифторметилциклопропан-1-карбоновой кислоты (3,65 г, 23,7 ммоль) в метаноле-гексанах (2,5 мл-22,5 мл). Концентрируют при пониженном давлении и остаток перегоняют, получая указанное в заглавии соединение в виде желтого масла (2,93 г, выход 73%). МС (ES): m/z=169,1 [M+H]. Пример получения 27. 3-Оксо-3-(1-трифторметилциклопропил)пропионитрил 2 М раствор LDA в THF (19,15 мл, 38,3 ммоль) добавляют к охлажденному сухим льдом-ацетоном раствору метилового эфира 1-трифторметил-циклопропан-1-карбоновой кислоты (2,93 г, 17,4 ммоль) и ацетонитрила (1,43 г мл, 34,8 ммоль) в THF (30 мл). Реакционную смесь перемешивают при -70 С в течение 1,5 ч и потом оставляют нагреваться до 22 С в течение 2 ч. Концентрируют, добавляют гексаны и фильтруют, получая желтое твердое вещество. Промывают гексанами и обрабатывают диэтиловым эфиром (250 мл), потом 2 Н HCl (150 мл). Водный слой экстрагируют диэтиловым эфиром (4100 мл). Объединенные органические фазы сушат над сульфатом натрия. Растворитель удаляют, получая 3-оксо-3-(1 трифторметилциклопропил)пропионитрил (2,99 г, выход 97%). МС (ES-): m/z=176,1 [M+H]. Следующие соединения получают, используя методику, по существу, аналогичную методике, описанной выше. Смесь 3-оксо-3-(1-трифторметилциклопропил)пропионитрила (2,66 г, 15,0 ммоль), Nбензгидрилиден-N'-(6-метилпиридин-3-ил) гидразина (TL, 2002, 43, 2171-2173) (4,31 г, 15,0 ммоль) и птолилсульфоновой кислоты (14,29 г, 75,0 ммоль) в этаноле (85 мл) нагревают при 90 С в герметичной колбе в течение 18 ч. После удаления растворителя остаток подвергают хроматографии на силикагеле, элюируя 0-5% метанола в дихлорметане, получая коричневое твердое вещество (2,29 г, выход 54%). МС (ES+): m/z=283,2 Смесь 4,4,5,5,5-пентафтор-3-оксопентаннитрила (4,0 г, 21,4 ммоль) и п-толил-гидразина (10 г, 64,1 ммоль) в этаноле (20 мл) нагревают до 95 С в герметичной колбе в течение 15 ч. После охлаждения до комнатной температуры растворитель удаляют при пониженном давлении, получая желтое твердое вещество. Твердое вещество разделяют между дихлорметаном (250 мл), дистиллированной водой (150 мл) и насыщенным водным раствором бикарбоната натрия (50 мл). Водную фазу выделяют и экстрагируют дихлорметаном (100 мл). Объединенные органические фазы сушат над сульфатом натрия и концентрируют, получая темно-золотое масло. Масло подвергают хроматографии на силикагеле, элюируя этилацетатом и гексанами, получая светло-коричневое твердое вещество (3,24 г, выход 52%). МС (ES+): Пример получения 34. 2,2,2-трихлорэтиловый эфир [5-(1-метилциклопропил)-2-(6-метилпиридин-3 ил)-2 Н-пиразол-3-ил]карбаминовой кислоты Раствор 2,2,2-трихлорэтилхлорформиата (1,80 г, 8,5 ммоль) в THF (10 мл) по каплям добавляют к охлажденному смесью льда с водой раствору 5-(1-трифторметилциклопропил)-2-пара-толил-2H-пиразол 3-иламина (2,29 г, 8,1 ммоль) и пиридина (0,9 мл, 11 ммоль) в THF (30 мл) при -15 С. Перемешивают при-15 С в течение 0,5 ч и потом при 22 С в течение 1 ч, потом реакционную смесь разделяют между дихлорметаном (50 мл) и насыщенным водным раствором бикарбоната натрия (50 мл). Водную фазу выделяют и дважды экстрагируют дихлорметаном (25 мл каждого). Объединенные органические фазы сушат над сульфатом натрия и концентрируют. Остаток подвергают хроматографии на силикагеле, элюируя гексанами и этилацетатом, получая белое твердое вещество (2,46 г, выход 66%). МС (ES+): m/z=457,2 Насыщенный раствор Na2CO3 (2,4 л) добавляют к раствору 5-трет-бутил-2-пара-толил-2H-пиразол 3-иламина (400 г, 1,74 моль) в THF (8 л) и смесь охлаждают до 0 С. Потом по каплям добавляют 2,2,2 трихлорэтилхлорформиат (406,77 г, 1,92 моль) и смесь перемешивают при 0 С в течение 2 ч. Реакционную смесь экстрагируют этилацетатом (36,5 л), сушат над безводным сульфатом магния и концентрируют. Твердое вещество растворяют в минимальном количестве этилацетата и добавляют избыток гексанов для осаждения. Твердое вещество собирают фильтрованием и сушат, получая указанное в заглавии соединение в виде не совсем белого твердого вещества (586 г, выход 83%). 1CH3CN (4,20 мл, 80 ммоль) объединяют в THF (10 мл) и медленно добавляют при перемешивании. Смесь перемешивают при от -65 до -78 С в течение 1 ч, потом баню удаляют и смесь нагревают до комнатной температуры. Реакционную смесь концентрируют до суспензии при пониженном давлении. Добавляют гексаны(150 мл), из суспензии образуется осадок. Твердое вещество собирают вакуумным фильтрованием и промывают гексанами (250 мл). Используемую колбу заменяют на чистую и твердое вещество растворяют на фритте в 50 мл 2,5 М HCl и собирают в колбе. Промывают 20 мл 2,5 М HCl, потом 200 мл Et2O. Слои разделяют в фильтрате и кислую фазу экстрагируют Et2O (150 мл). Et2O органические фазы объединяют, сушатMgSO4, фильтруют и концентрируют при пониженном давлении, получая 3-(1-метилциклопропил)-3 оксопропионитрил в виде прозрачного янтарного масла (3,58 г, 29,1 ммоль, 73%). Масло используют без очищения в реакции с гидрохлоридом толилгидразина (5,23 г, 33,0 ммоль) и этанолом (2 мл/ммоль) при кипячении с обратным холодильником в течение 20 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток разбавляют этилацетатом (250 мл) и промывают водой(260 мл), насыщенным водным NaHCO3 (60 мл) и насыщенным водным хлоридом натрия (60 мл). Органическую фазу сушат MgSO4, фильтруют и концентрируют с помощью ротационного выпаривания. Остаток подвергают хроматографии на силикагеле, элюируя градиентом этилацетата и гексана, получая 5-(1 метилциклопропил)-2-пара-толил-2H-пиразол-3-иламин (4,2238 г, 18,5 ммоль, 46%). ЖХМС (ES+): m/z=228,2[M+H]. Охлажденный (0 С) раствор 5-(1-метилциклопропил)-2-пара-толил-2H-пиразол-3-иламина (5,68 г,25 ммоль) и пиридина (2,2 мл, 27,5 ммоль) в THF (3 мл/ммоль) обрабатывают 2,2,2-трихлорэтил хлорформиатом (3,7 мл, 27,5 ммоль). Температуру реакционной смеси поддерживают при 0 С и через 2 ч добавляют небольшими порциями хлорформиат (0,3 мл) и пиридин (0,2 мл). Через один час реакционную смесь разбавляют водой (150 мл) и экстрагируют EtOAc (3100 мл). Объединенные органические фазы промывают водой (100 мл), насыщенным водным NaHCO3 (50 мл) и насыщенным водным хлоридом натрия (50 мл). Неочищенный сироп перекристаллизовывают из этилацетата/гексанов, получая указанное в заглавии соединение в виде белого твердого вещества (8,18 г, 20,3 ммоль; 81%). ЖХМС (ES+):m/z=402,2/404,2 [M+H]. Альтернативно, 2,2,2-трихлорэтилхлорформиат (3,0 мл, 23 ммоль) по каплям добавляют к раствору 5-(1-метилциклопропил)-2-пара-толил-2H-пиразол-3-иламина (4,75 г, 21 ммоль) в тетрагидрофуране (105 мл) и насыщенном водном карбонате натрия (32 мл) при 0 С. Перемешивают при этой температуре в течение 2 ч. Смесь выливают в воду и фазы разделяют. Водную фазу экстрагируют этилацетатом. Обработка А. Органические слои объединяют и промывают водным хлоридом натрия, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая желтое твердое вещество. Твердое вещество растворяют в минимальном количестве этилацетата и добавляют гексаны до помутнения при перемешивании. Указанное в заглавии соединение кристаллизуют и фильтруют в виде белого твердого вещества. 1 Н ЯМР (ДМСО): 9,89 (ушир.с, 1 Н), 7,31 (д, J=8 Гц, 2 Н), 7,23 (д, J=8 Гц, 2 Н), 6,12 (с, 1 Н), 4,82 (с,2H), 2,31 (с, 3 Н), 1,37 (с, 3 Н), 0,89 (кв, J=4 Гц, 2 Н), 0,71 (кв, J=4 Гц, 2 Н). Обработка В. Растворитель этилацетат заменяют на изопропиловый спирт (91,56 моль). Суспензию перемешивают при 0 С в течение 2 ч, фильтруют, промывают охлажденным изопропиловым спиртом (13,08 моль) и сушат при 40 С при пониженном давлении в течение ночи, получая указанное в заглавии соединение в виде белого кристаллического твердого вещества. Следующее соединение получают, используя методики, по существу, аналогичные методикам, описанным выше.- 18015189 Пример получения 41. 2,2,2-Трихлорэтиловый эфир [5-(1-фторметилциклопропил)-2-пара-толил 2H-пиразол-3-ил]карбаминовой кислоты Раствор LDA получают из диизопропиламина (1,7 мл, 2,2 экв., 12,1 ммоль) и н-BuLi (1,6 М в гексанах, 7,5 мл, 2,2 экв., 12,1 ммоль) в THF 12 мл при -78 С в течение 30 мин под N2. Добавляют раствор этилового эфира 1-фторметилциклопропанкарбоновой кислоты (0,81 г, 5,5 ммоль) в 7 мл THF. Смесь перемешивают и оставляют нагреваться от -78 С до комнатной температуры и перемешивание продолжают при комнатной температуре в течение 5 ч. Добавляют 10 мл насыщенного водного раствора NH4Cl. Добавляют AcOEt и органический слой отделяют, промывают насыщенным водным раствором хлорида натрия. Сушат над Na2SO4 и растворители удаляют, получая коричневое масло (0,42 г, выход 54%). Масло растворяют в 10 мл EtOH и добавляют п-толилгидрозин (0,47 г, 1 экв., 3 ммоль). Смесь нагревают в герметичной колбе при 90 С в течение ночи. Смесь оставляют охлаждаться и растворитель удаляют при пониженном давлении, получая остаток. Остаток подвергают хроматографии на силикагеле, элюируя гексан/AcOEt 15-80%, получая 0,336 г 5-(1-фторметилциклопропил)-2-пара-толил-2H-пиразол-3-иламина в виде масла. МС (ES+): m/z=246,l [M+H].THF под азотом при 0C. Смесь перемешивают при температуре от 0 С до комнатной температуры в течение 5 ч. Нерастворимые вещества отфильтровывают и растворитель из фильтрата удаляют при пониженном давлении, получая масло. Масло подвергают хроматографии (гексан/AcOEt 20-80%), получая 110 мг указанного в заглавии соединения в виде желтого масла. МС (ES+): m/z=420,0 [М+Н]. Пример получения 42. 2,2,2-Трихлорэтиловый эфир (2-пара-толил-5-триметилсиланил-2H-пиразол 3-ил)карбаминовой кислоты Триметилсилил-диазометан (2 М в THF) (25 мл, 50 ммоль) помещают в THF (50 мл). Реакционную смесь охлаждают до -78 С и добавляют диизопропиламид лития (2 М в THF) (25 мл, 50 ммоль) в течение 30 мин. Добавляют метилпропиолат (4,45 мл, 50 ммоль) и перемешивают при -78 С в течение 2 ч. Нагревают до комнатной температуры и перемешивают в течение 18 ч. Добавляют этилацетат, воду и 1 Н HCl. Органический слой отделяют и водный слой экстрагируют этилацетатом (225 мл). Органические экстракты объединяют, сушат над Mg2SO4, фильтруют и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя 0-60% EtOAc:гексан, получая 3,59 г (36%) метилового эфира 5-триметилсиланил-2H-пиразол-3-карбоновой кислоты. Метиловый эфир 5-триметилсиланил-2H-пиразол-3-карбоновой кислоты (1,60 г, 8,07 ммоль) и 4 метилфенил-1-бороновую кислоту (1,64 г, 12,1 ммоль) помещают в CH2Cl2 (30 мл). Добавляют 4 молекулярные сита (1,50 г), потом добавляют ацетат меди(II) (1,61 г, 8,88 ммоль). Потом добавляют триэтиламин (8 мл) и перемешивают при комнатной температуре в течение 2,5 дней. Реакционную смесь фильтруют через прокладку из целита и промывают CH2Cl2. Фильтрат собирают и добавляют насыщенный водный хлорид аммония. Органический слой отделяют и водный слой экстрагируют CH2Cl2(220 мл). Органические экстракты объединяют, сушат над Mg2SO4, фильтруют и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя 0-30% EtOAc:гексан,получая 655 мг (29%) метилового эфира 2-пара-толил-5-триметилсиланил-2H-пиразол-3-карбоновой кислоты. MC (ES+): m/z=289,3 [M+H]. Метиловый эфир 2-пара-толил-5-триметилсиланил-2H-пиразол-3-карбоновой кислоты (665 мг, 2,30 ммоль) помещают в метанол (25 мл). Добавляют 1 Н NaOH (10 мл, 10 ммоль) и нагревают до 50 С в течение 4 ч. Охлаждают до комнатной температуры и концентрируют при пониженном давлении. Добавляют насыщенный водный раствор бикарбоната натрия и CH2Cl2. Органический слой отделяют и водный слой экстрагируют CH2Cl2 (225 мл). Органические экстракты объединяют, сушат над Mg2SO4, фильтруют и концентрируют при пониженном давлении, получая 620 мг (98%) 2-пара-толил-5-триметилсиланил-2Hпиразол-3-карбоновой кислоты. МС (ES+): m/z=275,3 [M+H]. 2-Пара-толил-5-триметилсиланил-2H-пиразол-3-карбоновую кислоту (620 мг, 2,26 ммоль) помещают в трет-бутанол (5 мл) и толуол (5 мл). Добавляют триэтиламин (0,378 мл, 2,71 ммоль), потом добавляют дифенил фосфорилазид (0,586 мл, 2,71 ммоль) и нагревают до 60 С в течение 1 ч. Потом нагревают до 100 С в течение 19 ч. Реакционную смесь концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя 0-30% EtOAc:гексан, получая 504 мг (65%) третбутилового эфира (2-пара-толил-5-триметилсиланил-2H-пиразол-3-ил)карбаминовой кислоты. МС (ES+):(504 мг, 1,46 ммоль) помещают в THF (10 мл). Добавляют 4 М HCl в диоксане (4 мл, 16 ммоль) и нагревают до 60 С в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и загружают на колонку Varian SCX. Колонку промывают МеОН и потом продукт вымывают 2 М NH3 в МеОН. Фильтрат собирают и концентрируют при пониженном давлении, получая 175 мг (49%) 2-пара-толил-5 триметилсиланил-2H-пиразол-3-иламина. 2-пара-толил-5-триметилсиланил-2H-пиразол-3-иламин (170 мг, 0,693 ммоль) помещают в этилаце- 19015189 тат (10 мл). Добавляют карбонат калия (191 мг, 1,38 ммоль) и воду (2 мл). Реакционную смесь перемешивают и добавляют трихлорэтилхлорформиат (0,114 мл, 0,831 ммоль). Перемешивают при комнатной температуре в течение 18 ч. Добавляют воду и этилацетат. Органический слой отделяют и промывают насыщенным водным хлоридом натрия. Органический слой собирают, сушат над Mg2SO4, фильтруют и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя 0-30% EtOAc:гексан, получая 280 мг (96%) указанного в заглавии соединения. МС (ES+): m/z=420,2(100 г) в МеОН (1 л, градиентный растворитель ВЭЖХ) и перемешивают при комнатной температуре в течение выходных (приблизительно 70 ч). Растворитель удаляют и остаток разделяют между EtOAc (1 л) и Н 2 О (100 мл). Водный слой повторно экстрагируют EtOAc и объединенные органические слои сушат над MgSO4. Фильтруют и концентрируют при пониженном давлении, получая метиловый эфир 3 гидрокси-2-гидроксиметил-2-метилпропионовой кислоты. 1 Н ЯМР (CDCl3, 300 МГц):м.д. 3,9 (д, 2 Н, J=11,1 Гц), 3,76 (с, 3 Н), 3,71 (д, 2 Н, J=11,1 Гц), 2,8Tf2O (80 мл) по каплям добавляют к охлажденному (-78 С) раствору метилового эфира 3-гидрокси 2-гидроксиметил-2-метилпропионовой кислоты (32,5 г) в CH2Cl2 (400 мл) и 2,6-лутидине (80 мл). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают, пока при анализе ТСХ не будет выявлено только пятно продукта (приблизительно 2 ч). Разбавляют CH2Cl2 (400 мл) и промывают HCl (3%-водный раствор). Органический слой сушат над MgSO4, фильтруют и концентрируют. Остаток подвергают хроматографии на силикагеле, элюируя гексанами/этилацетатом 5%, получая метиловый эфир 2-метил-2,3-бис-трифторметансульфонилоксипропионовой кислоты в виде бесцветного масла. 1TBAF 1M (132 ммоль, 132 мл) добавляют к раствору метилового эфира 2-метил-2,3-бистрифторметансульфонилокси-пропионовой кислоты (65,9 ммоль, 26,3 г) в 500 мл безводного THF, охлажденного до 0 С. Перемешивают в течение ночи. Концентрируют при пониженном давлении и добавляют CH2Cl2. Органический слой промывают насыщенным водным хлоридом натрия. Органические слои объединяют и сушат над сульфатом натрия,фильтруют и концентрируют при пониженном давлении, получая метиловый эфир 3-фтор-2-фторметил 2-метилпропионовой кислоты. 1H ЯМР (CDCl3, 300 МГц):м.д.: 4,7-4,4 (м, 4 Н), 3,5 (с, 3 Н), 0,98 (т, 3 Н, J=1,7 Гц). К раствору метилового эфира 3-фтор-2-фторметил-2-метилпропионовой кислоты (28,2 ммоль, 4,3 г) в 100 мл безводного THF, охлажденного до -78 С, добавляют LDA 2,0 М (62,0 ммоль, 31 мл), потом добавляют безводный ацетонитрил (56,4 ммоль, 2,9 мл). Перемешивают в течение 2 ч при -78 С и раствор оставляют нагреваться до комнатной температуры в течение ночи. Концентрируют при пониженном давлении и добавляют CH2Cl2. Органический слой промывают насыщенным водным хлоридом натрия и водной 10% HCl. Органические слои объединяют и сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая остаток. Гидрохлорид п-толилгидразина (15,5 ммоль, 2,5 г) и полученный остаток (15,5 ммоль, 2,5 г) перемешивают в 31 мл этанола при 90 С в течение ночи. Концентрируют и остаток растворяют в воде. Добавляют 10% раствор гидроксида натрия и экстрагируют в этилацетате. Органические слои объединяют и сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая 5-(2-фтор-1-фторметил-1-метилэтил)-2-пара-толил-2H-пиразол-3 иламин. Остаток подвергают хроматографии на силикагеле, элюируя гексанами/этилацетатом (от 15% до 50%). MC (ES+): m/z=266 [М+Н]. 2,2,2-Трихлорэтилхлорформиат (8,1 ммоль, 1,1 мл) и водный раствор карбоната натрия (4,8 мл) добавляют к раствору 5-(2-фтор-1-фторметил-1-метилэтил)-2-пара-толил-2H-пиразол-3-иламина (7,3 ммоль, 1,9 г) в 37 мл THF. Перемешивают в течение 24 ч. Раствор выливают в воду и экстрагируют в этилацетате. Органические слои объединяют и промывают насыщенным водным раствором хлорида натрия. Сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая указанное в заглавии соединение. МС (ES+): m/z=440 [M+H]. Следующее соединение получают, используя методики, по существу, аналогичные методикам, описанным выше. Раствор трет-бутилового эфира 4-(5-аминопиридин-2-ил)пиперазин-1-карбоновой кислоты (пример получения 4, 1,05 экв. , 0,5845 г), 2,2,2-трихлорэтилового эфира [5-(1-метилциклопропил)-2-пара-толил 2H-пиразол-3-ил]карбаминовой кислоты (пример получения 39, 1,0 экв., 0,8054 г) и диизопропилэтиламина (2 экв., 0,7 мл) в ДМСО (0,25 М, 8 мл) нагревают до 60 С в течение 6 ч. Полученную смесь охлаждают до температуры окружающей среды и добавляют воду (20 мл). Экстрагируют EtOAc (225 мл), потом объединенные органические фазы промывают водой (10 мл) и насыщенным водным раствором хлорида натрия (10 мл). Сушат над MgSO4, потом остаток подвергают хроматографии на силикагеле, элюируя градиентом 2 М аммиак-метанол в дихлорметане. ЖХМС (ES+): m/z=532,3 [M+H]. Следующие соединения получают, используя методику, по существу, аналогичную методике, описанной выше.(пример получения 3, 41,20 г, 140,9 ммоль), 2,2,2-трихлорэтилового эфира (5-трет-бутил-2-пара-толил 2H-пиразол-3-ил)карбаминовой кислоты (пример получения 38, 57,03 г, 140,9 ммоль) и DIEA (36,8 мл,211,4 ммоль) в ДМСО (500 мл) нагревают при 60-65 С в течение 2,5 ч. В течение последних 30 мин к густой суспензии добавляют дополнительный ДМСО (100 мл). Суспензию охлаждают до комнатной температуры и выдерживают в течение ночи. Добавляют диэтиловый эфир (600 мл) и суспензию перемешивают в течение 1 ч при комнатной температуре. Фильтруют и промывают диэтиловым эфиром(5300 мл), потом сушат на воздухе, получая белое твердое вещество (68,70 г, выход 89% без учета поправки для ДМСО содержит приблизительно 85 мол.% ДМСО. ЖХМС (ES+): m/z=548 [М+Н]. Газообразную соляную кислоту барботируют через раствор трет-бутилового эфира 4-(6-метил-5-3[5-(1-метилциклопропил)-2-пара-толил-2H-пиразол-3-ил]уреидопиридин-2-ил)пиперазин-1-карбоновой кислоты (предполагают 2,74 ммоль) в 1:1 этилацетат:дихлорметан (200 мл) в течение 3 мин, чтобы обеспечить насыщение. Смесь выдерживают в течение 30 мин, потом концентрируют при пониженном давлении до белого твердого вещества. Твердое вещество растворяют в МеОН и загружают на колонку 20 гVarian SCX, промывают дополнительным МеОН. Свободное основание элюируют 1:1 2 М аммиаком в МеОН:дихлорметан. Раствор концентрируют при пониженном давлении, получая белое твердое вещество (1,21 г, 99% за 2 стадии). ЖХМС (ES+): m/z=446 [М+Н]. Следующее соединение получают, используя методики, по существу, аналогичные методикам, описанным выше. Пример получения 52. 1-(5-трет-бутил-2-пара-толил-2H-пиразол-3-ил)-3-(6-пиперазин-1-илпиридин-3-ил)мочевина трет-Бутиловый эфир 4-(5-аминопиридин-2-ил)пиперазин-1-карбоновой кислоты (200 мг, 0,718 ммоль), диизопропилэтиламин (0,125 мл, 0,718 ммоль) и 2,2,2-трихлорэтиловый эфир 5-трет-бутил-2 пара-толил-2H-пиразол-3-ил)карбаминовой кислоты (пример получения 38, 291 мг, 0,718 ммоль) помещают в ДМСО (5 мл) и нагревают до 75 С в течение 17 ч. Охлаждают до комнатной температуры и добавляют EtOAc и воду. Органический слой отделяют и промывают насыщенным водным хлоридом натрия (220 мл). Органический слой собирают, сушат над Mg2SO4, фильтруют и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя 0-70% EtOAc:гексан,получая 328 мг (85%) трет-бутилового эфира 4-5-[3-(5-трет-бутил-2-пара-толил-2H-пиразол-3 ил)уреидо]пиридин-2-илпиперазин-1-карбоновой кислоты. МС (ES+): m/z=534,4 [M+H]). трет-Бутиловый эфир 4-5-[3-(5-трет-бутил-2-пара-толил-2H-пиразол-3-ил)уреидо]пиридин-2 илпиперазин-1-карбоновой кислоты (565 мг, 1,06 ммоль) помещают в THF (10 мл). Добавляют 4 М HCl в диоксане (2,65 мл, 10,6 ммоль) и нагревают до 60 С в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и загружают на колонку Varian SCX. Колонку промывают МеОН и потом продукт вымывают 2 М NH3 в МеОН. Фильтрат собирают и концентрируют при пониженном давлении,получая 411 мг (89%) указанного в заглавии соединения. МС (ES+): m/z=434,2 [M+H]). Следующие соединения получают, используя методики, по существу аналогичные методикам, описанным выше. Пример получения 56. 1-(5-трет-Бутил-2-пара-толил-2H-пиразол-3-ил)-3-(2-метил-6-пиперазин-1 ил-пиридин-3-ил)мочевина Раствор трет-бутилового эфира 4-5-[3-(5-трет-бутил-2-пара-толил-2H-пиразол-3-ил)уреидо]-6 метилпиридин-2-илпиперазин-1-карбоновой кислоты (пример получения 49; 63,20 г, 115,4 ммоль) в МеОН (600 мл) обрабатывают HCl (4 Н раствор в диоксане, 300 мл, 1200 ммоль) при 22 С. Смесь перемешивают в течение 4 ч, потом концентрируют при пониженном давлении (комнатная температура, приблизительно 10 торр, 3 дня), получая дигидрохлорид 1-(5-трет-бутил-2-пара-толил-2H-пиразол-3-ил)-3(2-метил-6-пиперазин-1-илпиридин-3-ил)мочевины в виде не совсем белого порошка (62,2 г - содержит приблизительно 45 мол.% диоксана). ЖХМС (ES+): m/z=448 [M+H]. Раствор дигидрохлорида 1-(5-трет-бутил-2-пара-толил-2H-пиразол-3-ил)-3-(2-метил-6-пиперазин-1 илпиридин-3-ил)мочевины (10 г, 19,2 ммоль) в МеОН загружают на колонку 70 г Varian SCX, промывают МеОН (приблизительно 300 мл). Свободное основание элюируют 1:1 2 М аммиака вMeOH:дихлорметан (150 мл) . Концентрируют при пониженном давлении, получая белое твердое вещество (6,24 г). ЖХМС (ES+): m/z=448 [M+H]. Следующие соединения получают, используя методики, по существу аналогичные методикам, описанным выше. Газообразный азот барботируют через раствор 2,2,2-трихлорэтилового эфира 1-5-трет-бутил-2 пара-толил-2H-пиразол-3-ил)карбаминовой кислоты (пример получения 38, 608 мг, 1,5 ммоль) и третбутилового эфира 4-(5-амино-6-метилпиридин-2-илокси)пиперидин-1-карбоновой кислоты (453 мг, 1,5 ммоль) в ДМСО (3 мл) в течение 5 мин. Потом добавляют N,N-диизопропилэтиламин (500 мкл, 3,0 ммоль). Перемешивают при 60 С в течение ночи, потом реакционную смесь разделяют между этилацетатом (25 мл) и насыщенным водным раствором бикарбоната натрия (50 мл). Водную фазу выделяют и дважды экстрагируют этилацетатом (25 мл каждого). Объединенные органические фазы сушат над сульфатом натрия и концентрируют. Остаток подвергают хроматографии на силикагеле, элюируя гексанами и этилацетатом, получая трет-бутиловый эфир 4-5-[3-(5-трет-бутил-2-пара-толил-2H-пиразол-3 ил)уреидо]-6-метилпиридин-2-илоксипиперидин-1-карбоновой кислоты в виде коричневого твердого вещества (746 мг, выход 88%). МС (ES+): m/z=563,3 [M+H]. Трифторуксусную кислоту (10 мл) добавляют к охлажденному раствору трет-бутилового эфира 4- 23015189 5-[3-(5-трет-бутил-2-пара-толил-2H-пиразол-3-ил)уреидо]-6-метилпиридин-2-илоксипиперидин-1 карбоновой кислоты (746 мг, 1,33 ммоль) в дихлорметане (20 мл). Реакционную смесь перемешивают при 22 С в течение 25 мин. После удаления растворителя остаток обрабатывают 1 Н гидроксидом натрия(20 мл) и три раза экстрагируют дихлорметаном (20 мл каждого). Объединенные органические фазы сушат над сульфатом натрия. Растворитель удаляют, получая белое твердое вещество (605 мг, выход 98%). МС (ES+): m/z=463,2 [M+H]. Следующие соединения получают, используя методики, по существу аналогичные методикам, описанным выше. Пример получения 68. Гидрохлорид 1-[5-(2-фтор-1-фторметил-1-метилэтил)-2-пара-толил-2Hпиразол-3-ил]-3-(2-метил-6-пиперазин-1-илпиридин-3-ил)мочевины 2,2,2-трихлорэтиловый эфир [5-(2-фтор-1-фторметил-1-метилэтил)-2-пара-толил-2H-пиразол-3 ил]карбаминовой кислоты (2,7 ммоль, 1,2 г) и DIEA (2,9 ммоль, 0,5 мл) добавляют к раствору третбутилового эфира 4-(5-амино-6-метилпиридин-2-ил)пиперазин-1-карбоновой кислоты (2,9 ммоль, 0,9 г) в 4 мл ДМСО и перемешивают при 85 С в течение ночи. Охлаждают, добавляют воду и экстрагируютCH2Cl2. Органические слои объединяют и промывают насыщенным водным раствором хлорида натрия. Сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая третбутиловый эфир 4-(5-3-[5-(2-фтор-1-фторметил-1-метилэтил)-2-пара-толил-2H-пиразол-3-ил]уреидо-6 метилпиридин-2-ил)пиперазин-1-карбоновой кислоты. Остаток подвергают хроматографии на силикагеле, элюируя гексанами/этилацетатом с градиентом (от 10 до 50%). МС (ES+): m/z=584 [M+H]). трет-Бутиловый эфир 4-(5-3-[5-(2-фтор-1-фторметил-1-метилэтил)-2-пара-толил-2H-пиразол-3 ил]уреидо-6-метилпиридин-2-ил)пиперазин-1-карбоновой кислоты (1,5 ммоль, 0,9 г), растворенный в 5 мл CH2Cl2, и 4,0 М хлорид водорода в диоксане (7,35 ммоль, 1,8 мл) перемешивают при комнатной температуре в течение ночи. Концентрируют, потом полученное белое твердое вещество растирают в порошок с диэтиловым эфиром. МС (ES+): m/z=484 [М+Н] ).(пример получения 38, 2,0 ммоль, 0,8 г) добавляют к раствору трет-бутилового эфира 4-(5 аминопиридин-2-иламино)пиперидин-1-карбоновой кислоты (2,0 ммоль, 0,6 г) и карбоната калия (2,20 ммоль, 0,3 г) в ацетонитриле (25 мл). Раствор перемешивают в течение 12 ч при комнатной температуре. Добавляют воду и экстрагируют CH2Cl2. Органические слои объединяют и промывают насыщенным водным хлоридом натрия, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая остаток. Остаток подвергают хроматографии на силикагеле, элюируя CH2Cl2:MeOH с градиентом (от 0,5 до 20%), получая трет-бутиловый эфир 4-5-[3-(5-трет-бутил-2-пара-толил-2Hпиразол-3-ил)уреидо]пиридин-2-иламинопиперидин-1-карбоновой кислоты. МС (ES+): m/z=548(2,0 М раствор в диэтиловом эфире, 5 мл, 10 ммоль) при 22 С. Раствор перемешивают в течение ночи при комнатной температуре. Концентрируют при пониженном давлении, получая остаток, потом остаток помещают на картридж SCX, элюируя аммиаком 2,0 Н в метаноле. Указанное в заглавии соединение получают в форме свободного основания. MC (ES): m/z=488 [М+Н]. Пример получения 71. 1-(5-трет-Бутил-2-пара-толил-2H-пиразол-3-ил)-3-[2-(пиперидин-4-илокси) пиридин-4-ил]мочевина(1,2 мл, 6,82 ммоль) в ДМСО (15 мл) нагревают при 60 С в течение 5 дней. Полученную смесь охлаждают до комнатной температуры и разделяют между водой и этилацетатом, используя насыщенный водный раствор хлорида натрия, чтобы способствовать разделению фаз. Водный слой экстрагируют этилацетатом, объединенные органические слои дважды промывают водой, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя градиентом этилацетат в дихлорметане, получая 877 мг (выход 43%) трет-бутилового эфира 4-4-[3-(5-третбутил-2-пара-толил-2H-пиразол-3-ил)уреидо]пиридин-2-илоксипиперидин-1-карбоновой кислоты. ЖХМС ES+ (m/z) 549 [М+Н]. Раствор трет-бутилового эфира 4-4-[3-(5-трет-бутил-2-пара-толил-2H-пиразол-3-ил)уреидо]пиридин-2-илоксипиперидин-1-карбоновой кислоты (877 мг, 1,6 ммоль) в 1:1 EtOAc:DCM (100 мл) обрабатывают барботирующим потоком HCl (г) в течение 3 мин. Полученную смесь выдерживают в течение 30 мин, потом концентрируют при пониженном давлении. Остаток растворяют в МеОН и загружают на колонку 20 г Varian SCX, хорошо промывая МеОН. Свободное основание элюируют 1:1 DCM:2M аммиак в МеОН. Раствор концентрируют при пониженном давлении, получая указанное в заглавии соединение с количественным выходом. ЖХМС ES+ (m/z) 449 [М+Н]. Следующее соединение получают, используя методику, по существу аналогичную методике, описанной выше. Раствор или суспензию 1-[5-(1-метилциклопропил)-2-пара-толил-2H-пиразол-3-ил]-3-(6-пиперазин 1-илпиридин-3-ил)мочевины (пример получения 5, 1 экв., 0,1510 г), 2,2-диметилпентановой кислоты(EDCl, 1,15 экв., 0,0767 г) . Полученную смесь встряхивают при температуре окружающей среды в течение 48 часов, потом промывают насыщенным водным раствором бикарбоната натрия. Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Очищение А: очищают на силикагеле, используя градиент 2 М аммиак-метанол в дихлорметане, градиент - этилацетат в дихлорметане или гексаны. Очищение В: очищают с помощью обратной фазы на колонке Xterra 3075 мм 5 микрон MS C18, используя градиент 10 мМ водный бикарбонат аммония в ацетонитриле, получая указанное в заглавии соединение. ЖХМС (ES+): m/z=544 [M+H]. Следующие соединения получают, используя методики, по существу, аналогичные методикам, описанным выше. Смесь 1-(5-трет-бутил-2-пара-толил-2H-пиразол-3-ил)-3-(2-метил-6-пиперазин-1-илпиридин-3-ил) мочевины (пример получения 56, 157 мг, 0,35 ммоль), триметилуксусной кислоты (54 мг, 0,53 ммоль) и каталитического DMAP (4 мг) в дихлорметане (3,5 мл) обрабатывают гидрохлоридом N-(3 диметиламинопропил)-N'-этилкарбодиимида (EDCI; 101 мг, 0,53 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи, потом промывают насыщенным водным раствором бикарбоната натрия. Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя градиентом 2 М аммиак-метанол в дихлорметане, получая указанное в заглавии соединение в форме свободного основания. ЖХМС (ES+):m/z=532 [M+H]. Раствор или суспензию свободного амина в дихлорметане (5 мл) обрабатывают 2 М метансульфоновой кислотой в дихлорметане (1 экв.; 0,155 мл). Полученную смесь перемешивают, концентрируют под потоком азота и сушат при пониженном давлении, получая соль. Следующие соединения получают, используя методики, по существу аналогичные методикам, описанным выше.
МПК / Метки
МПК: A61K 31/497, A61K 31/44, C07D 401/14
Метки: ингибиторы, киназы
Код ссылки
<a href="https://eas.patents.su/30-15189-ingibitory-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы киназы</a>
Предыдущий патент: Замещенные глицинамиды с антитромботическим и ингибирующим фактор хa действием
Следующий патент: Способ и устройство для получения ферратов щелочных металлов
Случайный патент: Способы извлечения углеводородов с использованием горизонтальных скважин