Ингибиторы c – fms киназы
Номер патента: 13250
Опубликовано: 30.04.2010
Авторы: Моллой Кристофер Дж., Чэнь Цзиньшэн, Дежарле Рене, Баллентайн Шелли К., Рудольф М.Джонатан, Уилсон Кен, Мигалла Санатх, Менти Карл Л., Флорес Кристофер, Иллиг Карл Р., Уолл Марк Дж.
Формула / Реферат
1. Соединения формулы I
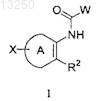
или их сольват, гидрат, таутомер или фармацевтически приемлемая соль, где
А представляет собой фенил или пиридил, каждый из которых может быть замещен одним из хлора, фтора, метила, -N3, -NH2, -NH(C1-6алкил), -N(C1-6алкил)2, -S(С1-6алкил), -О(С1-6алкил) или 4-аминофенила;
W представляет собой пирролил, имидазолил, изоксазолил, оксазолил, 1,2,4-триазолил или фуранил, каждый из которых может быть соединен через любой атом углерода, причем пирролил, имидазолил, изоксазолил, оксазолил, 1,2,4-триазолил или фуранил может содержать один заместитель -Cl, -CN, -NO2,
-OMe или -CF3, соединенный через любой другой углерод;
R2 представляет собой С3-8циклоалкил, тиофенил, дигидросульфонопиранил, фенил, фуранил, тетрагидропиридил или дигидропиранил, каждый из которых может быть независимо замещен одним или двумя из следующих: хлора, фтора и С(1-3)алкила, при условии, что тетрагидропиридил соединен с кольцом А через углерод-углеродную связь;
X представляет собой
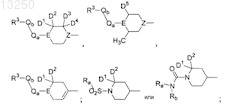
Z представляет собой СН или N;
каждый D1и D2 представляют собой водород;
каждый D3и D4 представляют собой водород;
D5 представляет собой водород или -СН3, где упомянутая -СН3 может принимать относительную син- или антиориентацию;
Ra и Rb независимо представляют собой водород, С3-8циклоалкил, C1-6галогеналкил, арил, apC1-6алкил, гетероарил или гетероаралкил;
Е представляет собой N, S, О, SO или SO2, при условии, что Е может не быть N при одновременном выполнении следующих трех условий: Qa отсутствует, Qb отсутствует и R3представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N, и в случае, когда Е представляет собой S, О, SO, SO2, Qa, Qb, R3 отсутствуют;
Qa отсутствует или представляет собой -СН2-, -СН2СН2- или С(О);
Qb отсутствует или представляет собой -NH-, -СН2-, -СН2СН2- или С(О), при условии, что Qb может не быть С(О), если Qa представляет собой С(О), и при дополнительном условии, что Qb может не быть -NH-, если Е представляет собой N, и Qa отсутствует, и при дополнительном условии, что Qb может не быть -NH-, если R3представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Qb является N;
R3 представляет собой водород, гидроксиС1-6алкиламино, (гидроксиС1-6алкил)2амино, C1-6алкиламино, аминоС1-6алкил, дигидроксиС1-6алкил, C1-6алкокси, диС1-6алкиламино, гидроксиС1-6алкил, -СООН, -CONH2, -CN, -SO2-C1-6алкил-R4, -NH2 или 5- или 6-членное кольцо, которое содержит по крайней мере один гетероатом N и может, необязательно, содержать дополнительный гетерорадикал, выбранный из S, SO2, N и О, и 5- или 6-членное кольцо может быть насыщенным, частично ненасыщенным или ароматическим, где ароматический азот в 5- или 6-членном кольце может присутствовать в виде N-оксида, и 5- или 6-членное кольцо может быть, необязательно, замещено метилом, галогеном, C1-6алкиламино или C1-6алкокси; R3 может также отсутствовать, при условии, что R3 не отсутствует, если Е представляет собой азот;
R4 представляет собой водород, -ОН, С1-6алкокси, карбокси, карбоксамидо или карбамоил;
причем арил представляет собой моноциклическую или бициклическую ароматическую кольцевую систему, содержащую в кольце 6-12 атомов углерода, таких как бензол, бифенил и нафталин;
гетероарил представляет собой 5-7-членную моноциклическую или 8-10-членную бициклическую ароматическую кольцевую систему, включающую 1-4 гетероатома, выбранных из N, О или S.
2. Соединение по п.1, в котором W замещен одной -CN.
3. Соединение по п.1, в котором
А представляет собой пиридил, который может быть замещен одним из хлора, фтора, метила, -N3, -NH2,
-NH(C1-6алкил), -N(C1-6алкил)2, -S(C1-6алкил), -О(C1-6алкил) или 4-аминофенила;
W представляет собой имидазолил (включая 1Н-имидазол-2-ил), который может содержать одну -CN; и
R2 представляет собой С3-8циклоалкил.
4. Соединение по п.1, в котором
W представляет собой имидазолил, 1,2,4-триазолил или фуранил, каждый из которых может быть соединен через любой атом углерода, причем имидазолил, 1,2,4-триазолил или фуранил может содержать одну -Cl или -CN, соединенную с любым другим углеродом;
R2 представляет собой С3-8циклоалкил, тиофенил, замещенный С(1-3)алкилом фенил, дигидропиранил и 1,1-диоксотетрагидротиопиранил;
X представляет собой

Е представляет собой N или SO2, при условии, что Е может не быть N при одновременном выполнении следующих трех условий: Qa отсутствует, Qb отсутствует и R3представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N; и
R3 представляет собой водород, фенил, гидроксилС1-6алкиламино, гидроксиС1-6алкил(C1-6алкил)амино, C1-6 алкиламино, аминоС1-6алкил, дигидроксиС1-6алкил, C1-6алкокси, диС1-6алкиламино, гидроксиС1-6алкил,
-СООН, -CONH2, -CN, -SO2CH3, -NH2, или 5- или 6-членное кольцо, выбранное из группы, состоящей из пиперидинила, морфолинила, имидазолила и пиридила, где 5- или 6-членное кольцо может быть, необязательно, замещено метилом, галогеном, C1-6алкиламино или С1-6алкокси; R3может также отсутствовать, при условии, что R3не отсутствует, если Е представляет собой азот.
5. Соединение по п.1, в котором
А представляет собой фенил, который может быть замещен одним из хлора, фтора или метила;
X представляет собой

и присоединен к фенильному кольцу А в пара-положении относительно азотсодержащего заместителя, как отображено в формуле II
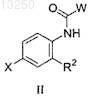
D3 и D4представляют собой водород;
Е представляет собой N или SO2, при условии, что Е может не быть N при одновременном выполнении следующих трех условий: Qa отсутствует, Qb отсутствует и R3представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N; и
R3 представляет собой водород, пиперидинил, C1-6алкиламино, диС1-6алкиламино, гидроксиС1-6алкиламино, (гидроксиС1-6алкил)2амино, имидазолил, 1-метилимидазолил, пиридил, N-оксид пиридила, гидроксиС1-6 алкил, -СООН, -CONH2, -CN, -SO2CH3, -NH2, морфолинил; R3 может также отсутствовать, при условии, что R3не отсутствует, если Е представляет собой азот.
6. Соединение по п.5, в котором
А представляет собой фенил;
W представляет собой фуран-2-ил, 1Н-пиррол-2-ил или 1Н-имидазол-2-ил, в каждом из которых углероды в 4 или 5 положении могут быть замещены -CN;
R2 представляет собой циклоС1-6алкил, дигидросульфонопиранил, фенил, фуранил, тетрагидропиридил или дигидропиранил, каждый из которых может быть независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из хлора, фтора и С(1-3)алкила, при условии, что тетрагидропиридил должен быть соединен с кольцом А через углерод-углеродную связь.
7. Соединение по п.6, в котором
W представляет собой 3Н-2-имидазолил-4-карбонитрил или 5-циано-1Н-пиррол-2-ил;
R2 представляет собой циклогексенил или циклопентенил, каждый из которых может быть замещен хлором, фтором или одной или двумя С(1-3)алкильными группами;
Е представляет собой N, при условии, что Е может не быть N при одновременном выполнении следующих трех условий: Qa отсутствует, Qb отсутствует и R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N;
Z представляет собой СН.
8. Соединение по п.7, в котором
W представляет собой 3Н-2-имидазолил-4-карбонитрил;
Qa представляет собой СО;
R3 представляет собой водород, пиперидинил, гидроксиС1-6алкиламино, (гидроксиС1-6алкил)2амино, C1-6 алкиламино, диС1-6алкиламино, имидазолил, 1-метилимидазолил, пиридинил, N-оксид пиридинила, гидроксиС1-6алкил, -СООН, -CONH2, -CN, -SO2CH3, -NH2, морфолинил.
9. Соединение, выбранное из группы, состоящей из
[4-(4-метилпиперазин-1-ил)-2-(3-метилтиофен-2-ил)фенил]амида 5-цианофуран-2-карбоновой кислоты,
[4-(4-метилпиперазин-1-ил)-2-(2-метилтиофен-3-ил)фенил]амида 5-цианофуран-2-карбоновой кислоты,
[4-(1-ацетилпиперидин-4-ил)-2-(1,2,5,6-тетрагидропиридин-3-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-циклогекс-1-енил-4-(1,1-диоксогексагидро-1l6-тиопиран-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-циклогекс-1-енил-4-(4-метилпиперазин-1-ил)фенил]амида 5-цианофуран-2-карбоновой кислоты,
[2-(3,6-дигидро-2Н-пиран-4-ил)-4-(4-метилпиперазин-1-ил)фенил]амида 5-цианофуран-2-карбоновой кислоты,
[2-(1,1-диоксо-1,2,3,6-тетрагидро-1l6-тиопиран-4-ил)-4-пиперидин-4-илфенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[4-(1-ацетилпиперидин-4-ил)-2-(1,1-диоксо-1,2,3,6-тетрагидро-1l6-тиопиран-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2'-метил-5-(4-метилпиперазин-1-ил)бифенил-2-ил]амида 5-цианофуран-2-карбоновой кислоты,
[2'-фтор-5-(4-метилпиперазин-1-ил)бифенил-2-ил]амида 5-цианофуран-2-карбоновой кислоты,
(4-{4-[(4-циано-1Н-имидазол-2-карбонил)амино]-3-циклогекс-1-енилфенил}пиперидин-1-ил)уксусной кислоты,
[4-(1-карбамоилметилпиперидин-4-ил)-2-циклогекс-1-енилфенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-(4-метилциклогекс-1-енил)-4-пиперидин-4-илфенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-гидроксиэтил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-(4-метилциклогекс-1-енил)-4-(1-пиридин-2-илметилпиперидин-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-гидрокси-1-гидроксиметилэтил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{4-[1-(2-цианоэтил)пиперидин-4-ил]-2-циклогекс-1-енилфенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-морфолин-4-илэтил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
(2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-метансульфонилэтил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-циклогекс-1-енил-4-(1-пиридин-2-илметилпиперидин-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклопент-1-енил-4-[1-(1-метил-1Н-имидазол-2-илметил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
(2-циклопент-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
(2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1Н-пиррол-2-карбоновой кислоты,
[2-циклогекс-1-енил-4-(3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[4-(1-ацетилпиперидин-4-ил)-2-циклогекс-1-енилфенил]амида 4-циано-1Н-пиррол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(1-оксипиридин-3-карбонил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(1-оксипиридин-4-карбонил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(3-морфолин-4-илпропионил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
амида 4-{4-[(4-циано-1Н-имидазол-2-карбонил)амино]-3-циклогекс-1-енилфенил}пиперидин-1-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(пиридин-3-карбонил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
(2-гидроксиэтил)амида 4-{4-[(4-циано-1Н-имидазол-2-карбонил)амино]-3-циклогекс-1-енилфенил}пиперидин-1-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-3Н-имидазол-4-илацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-пиридин-4-илацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
(2-циклогекс-1-енил-4-{1-[2-(1-метил-1Н-имидазол-4-ил)ацетил]пиперидин-4-ил}фенил)амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-пиридин-3-ил-ацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-метансульфонилацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-пиридин-2-илацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[4-(1-ацетилпиперидин-4-ил)-2-циклогекс-1-енилфенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-циклогекс-1-енил-4-(1-{2-[(2-гидроксиэтил)метиламино]ацетил}пиперидин-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-диметиламиноацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-морфолин-4-илацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
трифторуксуснокислой соли {4-[1-(3-амино-3-метилбутирил)пиперидин-4-ил]-2-циклогекс-1-енилфенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
бис(трифторуксуснокислой) соли (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4Н-[1,2,4]триазол-3-карбоновой кислоты,
трифторуксуснокислой соли (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 5-хлор-4Н-[1,2,4]триазол-3-карбоновой кислоты,
бис(трифторуксуснокислой) соли [2-циклогекс-1-енил-4-(цис-2,6-диметилпиперидин-4-ил)фенил]амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
бис(трифторуксуснокислой) соли [2-циклогекс-1-енил-4-(транс-2,6-диметилпиперидин-4-ил)фенил]амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(R)-(+)-(2,3-дигидроксипропионил)пиперидин-4-ил]фенил}амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
трифторуксуснокислой соли [2-циклогекс-1-енил-4-(1-метоксипиперидин-4-ил)фенил]амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
трифторуксуснокислой соли [6-(4,4-диметилциклогекс-1-енил)-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-5-ил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
трифторуксуснокислой соли {4-[1-(2-амино-2-метилпропионил)пиперидин-4-ил]-2-циклогекс-1-енилфенил}амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
[6-циклогекс-1-енил-1'-(2-метансульфонилэтил)-1',2',3',4',5',6'-гексагидро-[2,4']-пиридинил-5-ил]амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-метиламиноацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
трифторуксуснокислой соли [1'-(2-диметиламиноацетил)-6-(4,4-диметилциклогекс-1-енил)-1',2',3',4',5',6'-гексагидро-[2,4']-пиридинил-5-ил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
трифторуксуснокислой соли [6-(4,4-диметилциклогекс-1-енил)-1'-(2-метансульфонилэтил)-1',2',3',4',5',6'-гексагидро-[2,4']-пиридинил-5-ил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
и их сольватов, гидратов, таутомеров и фармацевтически приемлемых солей.
10. Соединение по п.5, выбранное из группы, состоящей из
[4-(4-метилпиперазин-1-ил)-2-(3-метилтиофен-2-ил)фенил]амида 5-цианофуран-2-карбоновой кислоты и
[4-(4-метилпиперазин-1-ил)-2-(2-метилтиофен-3-ил)фенил]амида 5-цианофуран-2-карбоновой кислоты,
и их сольватов, гидратов, таутомеров и фармацевтически приемлемых солей.
11. Соединение по п.6, выбранное из группы, состоящей из
[4-(1-ацетилпиперидин-4-ил)-2-(1,2,5,6-тетрагидропиридин-3-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-циклогекс-1-енил-4-(1,1-диоксогексагидро-1l6-тиопиран-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-циклогекс-1-енил-4-(4-метилпиперазин-1-ил)фенил]амида 5-цианофуран-2-карбоновой кислоты,
[2-(3,6-дигидро-2Н-пиран-4-ил)-4-(4-метилпиперазин-1-ил)фенил]амида 5-цианофуран-2-карбоновой кислоты,
[2-(1,1-диоксо-1,2,3,6-тетрагидро-1l6-тиопиран-4-ил)-4-пиперидин-4-илфенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[4-(1-ацетилпиперидин-4-ил)-2-(1,1-диоксо-1,2,3,6-тетрагидро-1l6-тиопиран-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2'-метил-5-(4-метилпиперазин-1-ил)бифенил-2-ил]амида 5-цианофуран-2-карбоновой кислоты и
[2'-фтор-5-(4-метилпиперазин-1-ил)бифенил-2-ил]амида 5-цианофуран-2-карбоновой кислоты
и их сольватов, гидратов, таутомеров и фармацевтически приемлемых солей.
12. Соединение по п.7, выбранное из группы, состоящей из
(4-{4-[(4-циано-1Н-имидазол-2-карбонил)амино]-3-циклогекс-1-енилфенил}пиперидин-1-ил)уксусной кислоты,
[4-(1-карбамоилметилпиперидин-4-ил)-2-циклогекс-1-енилфенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-(4-метилциклогекс-1-енил)-4-пиперидин-4-илфенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-гидроксиэтил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-(4-метилциклогекс-1-енил)-4-(1-пиридин-2-илметилпиперидин-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-гидрокси-1-гидроксиметилэтил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{4-[1-(2-цианоэтил)пиперидин-4-ил]-2-циклогекс-1-енилфенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-морфолин-4-илэтил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
(2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-метансульфонилэтил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
[2-циклогекс-1-енил-4-(1-пиридин-2-илметилпиперидин-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклопент-1-енил-4-[1-(1-метил-1Н-имидазол-2-илметил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
(2-циклопент-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
(2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1Н-пиррол-2-карбоновой кислоты,
[2-циклогекс-1-енил-4-(3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-4-ил)фенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты и
[4-(1-ацетилпиперидин-4-ил)-2-циклогекс-1-енилфенил]амида 4-циано-1Н-пиррол-2-карбоновой кислоты
и их сольватов, гидратов, таутомеров и фармацевтически приемлемых солей.
13. Соединение по п.8, выбранное из группы, состоящей из
{2-циклогекс-1-енил-4-[1-(1-оксипиридин-3-карбонил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(1-оксипиридин-4-карбонил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(3-морфолин-4-илпропионил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
амида 4-{4-[(4-циано-1Н-имидазол-2-карбонил)амино]-3-циклогекс-1-енилфенил}пиперидин-1-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(пиридин-3-карбонил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
(2-гидроксиэтил)амида 4-{4-[(4-циано-1Н-имидазол-2-карбонил)амино]-3-циклогекс-1-енилфенил}пиперидин-1-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-3Н-имидазол-4-илацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-пиридин-4-илацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
(2-циклогекс-1-енил-4-{1-[2-(1-метил-1Н-имидазол-4-ил)ацетил]пиперидин-4-ил}фенил)амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-пиридин-3-ил-ацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-метансульфонилацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(2-пиридин-2-илацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты и
[4-(1-ацетилпиперидин-4-ил)-2-циклогекс-1-енилфенил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты
и их сольватов, гидратов, таутомеров и фармацевтически приемлемых солей.
14. Соединение, которое представляет собой
[2-циклогекс-1-енил-4-(1-{2-[(2-гидроксиэтил)метиламино]ацетил}пиперидин-4-ил)фенил]амид 4-циано-1Н-имидазол-2-карбоновой кислоты,
и его сольваты, гидраты, таутомеры и фармацевтически приемлемые соли.
15. Соединение, которое представляет собой
{2-циклогекс-1-енил-4-[1-(2-диметиламиноацетил)пиперидин-4-ил]фенил}амид 4-циано-1Н-имидазол-2-карбоновой кислоты,
и его сольваты, гидраты, таутомеры и фармацевтически приемлемые соли.
16. Соединение, которое представляет собой
{2-циклогекс-1-енил-4-[1-(2-морфолин-4-илацетил)пиперидин-4-ил]фенил}амид 4-циано-1Н-имидазол-2-карбоновой кислоты,
и его сольваты, гидраты, таутомеры и фармацевтически приемлемые соли.
17. Соединение, выбранное из группы, состоящей из
трифторуксуснокислой соли {4-[1-(3-амино-3-метилбутирил)пиперидин-4-ил]-2-циклогекс-1-енилфенил} амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
бис(трифторуксуснокислой) соли (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4Н-[1,2,4]триазол-3-карбоновой кислоты,
трифторуксуснокислой соли (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 5-хлор-4Н-[1,2,4]триазол-3-карбоновой кислоты,
бис(трифторуксуснокислой) соли [2-циклогекс-1-енил-4-(цис-2,6-диметилпиперидин-4-ил)фенил]амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
бис(трифторуксуснокислой) соли [2-циклогекс-1-енил-4-(транс-2,6-диметилпиперидин-4-ил)фенил]амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
{2-циклогекс-1-енил-4-[1-(R)-(+)-(2,3-дигидроксипропионил)пиперидин-4-ил]фенил}амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
трифторуксуснокислой соли [2-циклогекс-1-енил-4-(1-метоксипиперидин-4-ил)фенил]амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
трифторуксуснокислой соли [6-(4,4-диметилциклогекс-1-енил)-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-5-ил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
трифторуксуснокислой соли {4-[1-(2-амино-2-метилпропионил)пиперидин-4-ил]-2-циклогекс-1-енилфенил} амида 5-циано-1Н-имидазол-2-карбоновой кислоты и
[6-циклогекс-1-енил-1'-(2-метансульфонилэтил)-1',2',3',4',5',6'-гексагидро-[2,4']-пиридинил-5-ил]амида 5-циано-1Н-имидазол-2-карбоновой кислоты,
и их сольватов, гидратов, таутомеров и фармацевтически приемлемых солей.
18. Соединение, выбранное из группы, состоящей из
{2-циклогекс-1-енил-4-[1-(2-метиламиноацетил)пиперидин-4-ил]фенил}амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
трифторуксуснокислой соли [1'-(2-диметиламиноацетил)-6-(4,4-диметилциклогекс-1-енил)-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-5-ил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты и
трифторуксуснокислой соли [6-(4,4-диметилциклогекс-1-енил)-1'-(2-метансульфонилэтил)-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-5-ил]амида 4-циано-1Н-имидазол-2-карбоновой кислоты,
и их сольватов, гидратов, таутомеров и фармацевтически приемлемых солей.
19. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
20. Фармацевтическая дозированная форма, содержащая фармацевтически приемлемый носитель и приблизительно от 0,5 мг приблизительно до 10 г по крайней мере одного соединения по п.1.
21. Дозированная форма по п.20, приспособленная для парентерального или перорального введения.
22. Способ ингибирования активности протеинтирозинкиназ, включающий приведение в контакт киназы с эффективным ингибирующим количеством по крайней мере одного соединения по п.1.
23. Способ по п.22, в котором протеинтирозинкиназой является c-fms.
24. Способ лечения воспаления у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества по крайней мере одного соединения по п.1.
25. Способ лечения рака у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества по крайней мере одного соединения по п.1.
26. Способ лечения сердечно-сосудистого заболевания у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества по крайней мере одного соединения по п.1.
27. Способ лечения заболеваний с воспалительной компонентой, включающих гломерулонефрит, воспалительное заболевание кишечника, неудачное протезирование, саркоидоз, застойное обструктивное заболевание легких, астму, панкреатит, ВИЧ-инфекцию, псориаз, сахарный диабет, связанный с опухолью ангиогенез, возрастную дистрофию желтого пятна, диабетическую ретинопатию, рестеноз, шизофрению или деменцию при болезни Альцгеймера у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества по крайней мере одного соединения по п.1.
28. Способ лечения боли, включая скелетную боль, обусловленную метастазированием опухоли или остеоартритом, а также висцеральной, воспалительной и нейрогенной боли, у млекопитающего, включающий введение млекопитающему, нуждающемуся в подобном лечении, терапевтически эффективного количества по крайней мере одного соединения по п.1.
29. Способ лечения остеопороза, болезни Пэджета и других заболеваний, в которых болезненность опосредуется резорбцией кости, включая артрит, неудачное протезирование, остеолитическую саркому, миелому и метастазирование опухоли в кости, включающий введение млекопитающему, нуждающемуся в подобном лечении, терапевтически эффективного количества по крайней мере одного соединения по п.1.
30. Способ лечения и профилактики образования метастазов рака яичников, рака матки, рака молочной железы, рака толстой кишки, рака желудка, гистиоцитарного ретикулоэндотелиоза и немелкоклеточной карциномы легкого, включающий введение млекопитающему, нуждающемуся в подобном лечении, терапевтически эффективного количества по крайней мере одного соединения по п.1.
31. Способ лечения аутоиммунных заболеваний, таких как системная красная волчанка, ревматоидный артрит, синдром Шёгрена, рассеянный склероз или увеит, включающий введение млекопитающему, нуждающемуся в подобном лечении, терапевтически эффективного количества по крайней мере одного соединения по п.1.
Текст
013250 Предпосылки создания изобретения Настоящее изобретение относится к новым соединениям, действующим в качестве ингибиторов протеинтирозинкиназ. Более конкретно, настоящее изобретение относится к новым соединениям, действующим в качестве ингибиторов c-fms киназы. Протеинкиназы представляют собой ферменты, которые являются основными компонентами каскада реакций передачи сигнала, катализируя перенос концевого фосфата от аденозин-5'-трифосфата(АТФ) на гидроксигруппу тирозиновых, сериновых и треониновых остатков белков. Как следствие, ингибиторы и субстраты протеинкиназ являются чрезвычайно важными инструментами при установлении физиологических последствий активации протеинкиназ. Было показано, что сверхэкспрессия или ненадлежащая экспрессия нормальных или мутантных протеинкиназ у млекопитающих играет значительную роль в развитии многих заболеваний, включая рак и сахарный диабет. Протеинкиназы могут быть разделены на два класса: протеинкиназы, которые предпочтительно фосфорилируют тирозиновые остатки (протеинтирозинкиназы), и протеиназы, которые предпочтительно фосфорилируют сериновые и/или треониновые остатки (протеинсеринтреонинкиназы). Протеинтирозинкиназы выполняют разнообразные функции, варьирующиеся от стимуляции роста и дифференцировки клеток до подавления пролиферации клеток. Они могут быть определены либо как рецепторные протеинтирозинкиназы, либо как внутриклеточные протеинтирозинкиназы. Рецепторные протеинтирозинкиназы, которые содержат домен связывания внеклеточного лиганда и внутриклеточный каталитический домен со свойственной тирозинкиназе активностью, распределены по 20 подсемействам. Семейство рецепторных тирозинкиназ эпидермального фактора роста (EGF), которое включает рецепторы HER-1, HER-2/neu и HER-3, содержит внеклеточный домен связывания, трансмембранный домен и внутриклеточный цитоплазматический каталитический домен. Связывание с рецептором приводит к инициации множества внутриклеточных зависимых от тирозинкиназ процессов фосфорилирования, что в конечном итоге приводит к транскрипции онкогенов. Рак молочной железы, колоректальный рак и рак предстательный железы связывают с этим семейством рецепторов. Рецептор к инсулину (IR) и рецептор к инсулиноподобному фактору роста 1 (IGF-1R) структурно и функционально сходны, но обладают различными биологическими эффектами. Сверхэкспрессия IGF-1R была ассоциирована с раком молочной железы. Рецепторы к тромбоцитарному фактору роста (PDGF) опосредуют клеточные ответы, которые включают пролиферацию, миграцию и жизнеспособность, и включают рецептор к PDGF, рецептор к фактору стволовых клеток (c-kit) и c-fms. Эти рецепторы связывают с такими заболеваниями, как атеросклероз, фиброз и пролиферативная витреоретинопатия. Рецепторы к фактору роста фибробластов (FGR) состоят из четырех рецепторов, которые отвечают за образование кровеносных сосудов, за переростание лимба и за рост и дифференцировку многочисленных типов клеток. Фактор роста эндотелия сосудов (VEGF), мощный мутоген эндотелиальных клеток, продуцируется в повышенном количестве многими опухолями, включая клетки рака яичников. Известные рецепторы кVEGF связывают с образованием и развитием сосудов и с ангиогенезом. Внутриклеточные протеинтирозинкиназы также известны как нерецепторные протеинтирозинкиназы. Было идентифицировано более 24 таких киназ, распределенных по 11 подсемействам. Серинтреонинпротеинкиназы, подобно клеточным протеинтирозинкиназам, большей частью являются внутриклеточными. Примерами патологических состояний, которые связывают с аномальной активностью протеинтирозинкиназ, являются сахарный диабет, ангиогенез, псориаз, рестеноз, глазные болезни, шизофрения,ревматоидный артрит, сердечно-сосудистые заболевания и рак. Поэтому существует потребность в селективных и мощных низкомолекулярных ингибиторах протеинтирозинкиназ. Заявки на выдачу патента США 6383790, 6346625, 6235746, 6100254 и международные заявки согласно РСТ WO 01/47897,WO 00/27820 и WO 02/068406 свидетельствуют о недавних попытках синтезировать такие ингибиторы. Краткое описание сущности изобретения Настоящее изобретение направлено на удовлетворение текущей потребности в селективных и мощных ингибиторах протеинтирозинкиназ путем предоставления мощных ингибиторов c-fms киназы. Настоящее изобретение относится к новым соединениям формулы I или их сольвату, гидрату, таутомеру или фармацевтически приемлемой соли, где А представляет собой фенил или пиридил, каждый из которых может быть замещен одним из хло-1 013250 ра, фтора, метила, -N3, -NH2, -NH(алкил), -N(алкил)2, -S(алкил), -О(алкил) или 4-аминофенила;W представляет собой пирролил (включая 1 Н-пиррол-2-ил), имидазолил (включая 1 Н-имидазол-2 ил), изоксазолил, оксазолил, 1,2,4-триазолил или фуранил (включая фуран-2-ил), каждый из которых может быть соединен через любой атом углерода, причем пирролил, имидазолил, изоксазолил, оксазолил,1,2,4-триазолил или фуранил может содержать один заместитель -Cl, -CN, -NO2, -ОМе или -CF3, соединенный через любой другой углерод;R2 представляет собой циклоалкил (включая циклогексенил, циклопентенил), тиофенил, дигидросульфонопиранил, фенил, фуранил, тетрагидропиридил или дигидропиранил, каждый из которых может быть независимо замещен одним или двумя из следующих: хлора, фтора и С(1-3)алкила (включая 4,4 диметилциклогексенил, 4-метилциклогексенил, 2-метилтиофенил, 3-метилтиофенил), при условии, что тетрагидропиридил соединен с кольцом А через углерод-углеродную связь;Z представляет собой СН или N; каждый D1 и D2 представляют собой водород или, взятые вместе, образуют двойную связь с кислородом; каждый D3 и D4 представляют собой водород или, взятые вместе, образуют двойную связь с кислородом;D5 представляет собой водород или -СН 3, где упомянутая -СН 3 может принимать относительную син- или антиориентацию;Ra и Rb независимо представляют собой водород, циклоалкил, галогеналкил, арил, аралкил, гетероарил или гетероаралкил; Е представляет собой N, S, О, SO или SO2, при условии, что Е может не быть N при одновременном выполнении следующих трех условий:Qa отсутствует, Qb отсутствует и R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N;Qa отсутствует или представляет собой -СН 2-, -СН 2 СН 2- или С(О);Qb отсутствует или представляет собой -NH-, -СН 2-, -СН 2 СН 2- или С(О), при условии, что Qb может не быть С(О), если Qa представляет собой С(О), и при дополнительном условии, что Qb может не быть-NH-, если Е представляет собой N, и Qa отсутствует, и при дополнительном условии, что Qb может не быть -NH-, если R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Qb является N;-SO2CH3), -NH2 или 5- или 6-членное кольцо, которое содержит по крайней мере один гетероатом N и может необязательно содержать дополнительный гетерорадикал, выбранный из S, SO2, N и О, и 5- или 6 членное кольцо может быть насыщенным, частично ненасыщенным или ароматическим (включая пиперидинил, морфолинил, имидазолил и пиридил), где ароматический азот в 5- или 6-членном кольце может присутствовать в виде N-оксида (включая N-оксид пиридила), и 5- или 6-членное кольцо может быть необязательно замещено метилом, галогеном, алкиламино или алкокси (включая 1-метилимидазолил); R3 может также отсутствовать, при условии, что R3 не отсутствует, если Е представляет собой азот;R4 представляет собой водород, -ОН, алкокси, карбокси, карбоксамидо или карбамоил. Соединения формулы I являются особенно мощными ингибиторами протеинтирозинкиназы c-fms. Настоящее изобретение также относится к способам ингибирования активности протеинтирозинкиназ у млекопитающего путем введения терапевтически эффективного количества по крайней мере одного соединения формулы I. Подробное описание изобретения Настоящее изобретение относится к новым соединениям формулы I или их сольвату, гидрату, таутомеру или фармацевтически приемлемой соли, где А представляет собой фенил или пиридил, каждый из которых может быть замещен одним из хлора, фтора, метила, -N3, -NH2, -NH(алкил), -N(алкил)2, -S(алкил), -О(алкил) или 4-аминофенила;W представляет собой пирролил (включая 1 Н-пиррол-2-ил), имидазолил (включая 1 Н-имидазол-2 ил), изоксазолил, оксазолил, 1,2,4-триазолил или фуранил (включая фуран-2-ил), каждый из которых может быть соединен через любой атом углерода, причем пирролил, имидазолил, изоксазолил, оксазолил,1,2,4-триазолил или фуранил может содержать один заместитель -Cl, -CN, -NO2, -ОМе или -CF3, соединенный через любой другой углерод;R2 представляет собой циклоалкил (включая циклогексенил, циклопентенил), тиофенил, дигидросульфонопиранил, фенил, фуранил, тетрагидропиридил или дигидропиранил, каждый из которых может быть независимо замещен одним или двумя из следующих: хлора, фтора и С(1-3)алкила (включая 4,4 диметилциклогексенил, 4-метилциклогексенил, 2-метилтиофенил, 3-метилтиофенил), при условии, что тетрагидропиридил соединен с кольцом А через углерод-углеродную связь;Z представляет собой СН или N; каждый D1 и D2 представляют собой водород или, взятые вместе, образуют двойную связь с кислородом; каждый D3 и D4 представляют собой водород или, взятые вместе, образуют двойную связь с кислородом;D5 представляет собой водород или -СН 3, где упомянутая -СН 3 может принимать относительную син- или антиориентацию;Ra и Rb независимо представляют собой водород, циклоалкил, галогеналкил, арил, аралкил, гетероарил или гетероаралкил; Е представляет собой N, S, О, SO или SO2, при условии, что Е может не быть N при одновременном выполнении следующих трех условий:Qa отсутствует, Qb отсутствует и R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N;Qa отсутствует или представляет собой -СН 2-, -СН 2 СН 2- или С(О);Qb отсутствует или представляет собой -NH-, -СН 2-, -СН 2 СН 2- или С(О), при условии, что Qb может не быть С(О), если Qa представляет собой С(О), и при дополнительном условии, что Qb может не быть-NH-, если Е представляет собой N, и Qa отсутствует, и при дополнительном условии, что Qb может не быть -NH-, если R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Qb является N;-SO2CH3), -NH2 или 5- или 6-членное кольцо, которое содержит по крайней мере один гетероатом N и может необязательно содержать дополнительный гетерорадикал, выбранный из S, SO2, N и О, и 5- или 6 членное кольцо может быть насыщенным, частично ненасыщенным или ароматическим (включая пиперидинил, морфолинил, имидазолил и пиридил), где ароматический азот в 5- или 6-членном кольце может присутствовать в виде N-оксида (включая N-оксид пиридила), и 5- или 6-членное кольцо может быть необязательно замещено метилом, галогеном, алкиламино или алкокси (включая 1-метилимидазолил);R4 представляет собой водород, -ОН, алкокси, карбокси, карбоксамидо или карбамоил. Примеры осуществления настоящего изобретения включают соединение формулы I, где:a) А представляет собой фенил или пиридил, каждый из которых может быть замещен одним из хлора, фтора, метила, -N3, -NH2, -NH(алкил), -N(алкил)2, -S(алкил), -О(алкил) или 4-аминофенил;c) W представляет собой пирролил (включая 1 Н-пиррол-2-ил), имидазолил (включая 1 Н-имидазол 2-ил), изоксазолил, оксазолил, 1,2,4-триазолил или фуранил (включая фуран-2-ил), каждый из которых может быть соединен через любой атом углерода, причем пирролил, имидазолил, изоксазолил, оксазолил, 1,2,4-триазолил или фуранил может содержать один заместитель -Cl, -CN, -NO2, -ОМе или -CF3, соединенный через любой другой углерод;d) W представляет собой фуран-2-ил, 1 Н-пиррол-2-ил или 1 Н-имидазол-2-ил, в каждом из которых углероды в 4 или 5 положении могут быть замещены -CN;g) R2 представляет собой циклоалкил (включая циклогексенил, циклопентенил), тиофенил, дигидросульфонопиранил, фенил, фуранил, тетрагидропиридил или дигидропиранил, каждый из которых может быть независимо замещен одним или двумя из следующих: хлора, фтора и С(1-3)алкила (включая 4,4 диметилциклогексенил, 4-метилциклогексенил, 2-метилтиофенил, 3-метилтиофенил), при условии, что тетрагидропиридил соединен с кольцом А через углерод-углеродную связь;h) R2 представляет собой циклоалкил (включая циклогексенил, циклопентенил), который может быть замещен одним или двумя С(1-3)алкилами (включая 4,4-диметилциклогексенил, 4 метилциклогексенил);i) R2 представляет собой циклогексенил, который может быть замещен одним или двумя С(1-3)алкилами; о) Z представляет собой СН или N; р) Z представляет собой СН;q) каждый D1 и D2 представляют собой водород или, взятые вместе, образуют двойную связь с кислородом;s) каждый D3 и D4 представляют собой водород или, взятые вместе, образуют двойную связь с кислородом;u) D5 представляет собой водород или -СН 3, где упомянутая -СН 3 может принимать относительную син- или антиориентацию;v) Ra и Rb независимо представляют собой водород, циклоалкил, галогеналкил, арил, аралкил, гетероарил или гетероаралкил;w) Е представляет собой N, S, О, SO или SO2, при условии, что Е может не быть N при одновременном выполнении следующих трех условий:Qa отсутствует, Qb отсутствует и R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N; х) Е представляет собой N, при условии, что Е может не быть N при одновременном выполнении следующих трех условий:Qa отсутствует, Qb отсутствует и R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N; у) Qa отсутствует или представляет собой -СН 2-, -СН 2 СН 2- или С(О);z) Qa отсутствует или представляет собой -СН 2 СН 2- или С(О); аа) Qa отсутствует или представляет собой С(О);cc) Qb отсутствует или представляет собой -NH-, -СН 2-, -СН 2 СН 2- или С(О), при условии, что Qb может не быть С(О), если Qa представляет собой С(О), и при дополнительном условии, что Qb может не быть -NH-, если Е представляет собой N, и Qa отсутствует, и при дополнительном условии, что Qb может не быть -NH-, если R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Qb является N;dd) Qb отсутствует или представляет собой -СН 2 СН 2- или С(О), при условии, что Qb может не быть С(О), если Qa представляет собой С(О); ее) Qb отсутствует или представляет собой С(О), при условии, что Qb может не быть С(О), если Qa представляет собой С(О);-SO2CH3), -NH2 или 5- или 6-членное кольцо, которое содержит по крайней мере один гетероатом N и может необязательно содержать дополнительный гетерорадикал, выбранный из S, SO2, N и О, и 5- или 6 членное кольцо может быть насыщенным, частично ненасыщенным или ароматическим (включая пиперидинил, морфолинил, имидазолил и пиридил), где ароматический азот в 5- или 6-членном кольце может присутствовать в виде N-оксида (включая N-оксид пиридила), и 5- или 6-членное кольцо может быть необязательно замещено метилом, галогеном, алкиламино или алкокси (включая 1-метилимидазолил); R3 может также отсутствовать, при условии, что R3 не отсутствует, если Е представляет собой азот;hh) R3 представляет собой алкиламино (включая метиламино), диалкиламино (включая диметиламино) или -SO2-алкил-R4 (включая -SO2CH3);ll) R4 представляет собой водород; и все сочетания пунктов а)-ll), включительно, изложенные выше в этом документе. Предпочтительными соединениями формулы I являются соединения, в которых W замещен одной-CN. Другими предпочтительными соединениями формулы I являются соединения, в которых А представляет собой пиридил, который может быть замещен одним из хлора, фтора, метила, -N3,-NH2, NH(алкил), -N(алкил)2, -S(алкил), -О(алкил) или 4-аминофенила;W представляет собой имидазолил (включая 1 Н-имидазол-2-ил), который может содержать однуR2 представляет собой циклоалкил. Еще одними предпочтительными соединениями формулы I являются соединения, в которых А представляет собой фенил, который может быть замещен одним из хлора, фтора или метила;D3 и D4 представляют собой водород; Е представляет собой N или SO2, при условии, что Е может не быть N при одновременном выполнении следующих трех условий:Qa отсутствует, Qb отсутствует и R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N; иR3 представляет собой водород, пиперидинил, алкиламино, диалкиламино, гидроксиалкиламино,(гидроксиалкил)2 амино, имидазолил, 1-метилимидазолил, пиридил, пиридил-N-оксид, гидроксиалкил,-СООН, -CONH2, -CN, -SO2CH3, -NH2, морфолинил; R3 может также отсутствовать, при условии, что R3 не отсутствует, если Е представляет собой азот. Более предпочтительными соединениями формулы I являются соединения, в которых А представляет собой фенил;W представляет собой фуран-2-ил, 1 Н-пиррол-2-ил или 1 Н-имидазол-2-ил, в каждом из которых углероды в 4 или 5 положении могут быть замещены -CN;R2 представляет собой циклоалкил, дигидросульфонопиранил, фенил, фуранил, тетрагидропиридил или дигидропиранил, каждый из которых может быть независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из хлора, фтора и С(1-3)алкила, при условии, что тетрагидропиридил должен быть соединен с кольцом А через углерод-углеродную связь. Еще более предпочтительными соединениями формулы I являются соединения, в которыхR2 представляет собой циклогексенил или циклопентенил, каждый из которых может быть замещен хлором, фтором или одной или двумя С(1-3)алкильными группами; Е представляет собой N, при условии, что Е может не быть N при одновременном выполнении следующих трех условий: Qa отсутствует, Qb отсутствует и R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N;Z представляет собой СН. Особенно предпочтительными соединениями формулы I являются соединения, в которыхW представляет собой имидазолил (включая 1 Н-имидазол-2-ил), 1,2,4-триазолил или фуранил(включая фуран-2-ил), каждый из которых может быть соединен через любой атом углерода, причем имидазолил, 1,2,4-триазолил или фуранил может содержать одну -Cl или -CN, соединенную с любым другим углеродом;R2 представляет собой циклоалкил (включая замещенный С(1-3)алкилом циклоалкил, дополнительно включая замещенный С(1-3)алкилом циклопентенил, и замещенный С(1-3)алкилом циклогексенил, дополнительно включая 4-метилциклогексенил), замещенный С(1-3)диалкилом циклоалкил (включая 4,4 диметилциклогексенил), тиофенил (включая замещенный С(1-3)алкилом тиофенил, дополнительно включая 2-метилтиофенил и 3-метилтиофенил), замещенный С(1-3)алкилом фенил (включая метилфенил), дигидропиранил и 1,1-диоксотетрагидротиопиранил; Е представляет собой N или SO2, при условии, что Е может не быть N при одновременном выполнении следующих трех условий: Qa отсутствует, Qb отсутствует и R3 представляет собой аминогруппу или циклический аминорадикал, в котором точкой присоединения к Е является N; и(включая 1-гидроксиэт-2-ил), -СООН, -CONH2, -CN, -SO2CH3, -NH2 или 5- или 6-членное кольцо, выбранное из группы, состоящей из пиперидинила, морфолинила, имидазолила и пиридила, где 5- или 6 членное кольцо может быть неоязательно замещено метилом, галогеном, алкиламино или алкокси-6 013250 представляет собой азот. Наиболее предпочтительными соединениями формулы I являются соединения, в которыхR3 представляет собой водород, пиперидинил, гидроксиалкиламино, (гидроксиалкил)2 амино, алкиламино, диалкиламино, имидазолил, 1-метилимидазолил, пиридил, пиридил-N-оксид, гидроксиалкил,-СООН, -CONH2, -CN, -SO2CH3, -NH2, морфолинил. Соединения формулы I являются особенно мощными ингибиторами c-fms протеинтирозинкиназы. Настоящее изобретение также относится к способам ингибирования активности протеинтирозинкиназ у млекопитающего путем введения терапевтически эффективного количества по крайней мере одного соединения формулы I. Примерами соединений формулы I являются[4-(4-метилпиперазин-1-ил)-2-(2-метилтиофен-3-ил)фенил]амид 5-цианофуран-2-карбоновой кислоты и их сольваты, гидраты, таутомеры и фармацевтически приемлемые соли. Более предпочтительными примерами соединений формулы I являются[2'-фтор-5-(4-метилпиперазин-1-ил)бифенил-2-ил]амид 5-цианофуран-2-карбоновой кислоты и их сольваты, гидраты, таутомеры и фармацевтически приемлемые соли. Еще более предпочтительными примерами соединений формулы I являются[4-(1-ацетилпиперидин-4-ил)-2-циклогекс-1-енилфенил]амид 4-циано-1 Н-пиррол-2-карбоновой ки-7 013250 слоты и их сольваты, гидраты, таутомеры и фармацевтически приемлемые соли. Наиболее предпочтительными примерами соединений формулы I являются 2-циклогекс-1-енил-4-[1-(1-оксипиридин-3-карбонил)пиперидин-4-ил]фениламид 4-циано-1 Нимидазол-2-карбоновой кислоты,2-циклогекс-1-енил-4-[1-(1-оксипиридин-4-карбонил)пиперидин-4-ил]фениламид 4-циано-1 Нимидазол-2-карбоновой кислоты,2-циклогекс-1-енил-4-[1-(3-морфолин-4-илпропионил)пиперидин-4-ил]фениламид 4-циано-1 Нимидазол-2-карбоновой кислоты,амид 4-4-[(4-циано-1 Н-имидазол-2-карбонил)амино]-3-циклогекс-1-енилфенилпиперидин-1 карбоновой кислоты,2-циклогекс-1-енил-4-[1-(пиридин-3-карбонил)пиперидин-4-ил]фениламид 4-циано-1 Н-имидазол 2-карбоновой кислоты,(2-гидроксиэтил)амид 4-4-[(4-циано-1 Н-имидазол-2-карбонил)амино]-3-циклогекс-1-енилфенил пиперидин-1-карбоновой кислоты,2-циклогекс-1-енил-4-[1-(2-3 Н-имидазол-4-илацетил)пиперидин-4-ил]фениламид 4-циано-1 Нимидазол-2-карбоновой кислоты,2-циклогекс-1-енил-4-[1-(2-пиридин-4-илацетил)пиперидин-4-ил]фениламид 4-циано-1 Н-имидазол-2-карбоновой кислоты,(2-циклогекс-1-енил-4-1-[2-(1-метил-1 Н-имидазол-4-ил)ацетил]пиперидин-4-илфенил)амид 4 циано-1 Н-имидазол-2-карбоновой кислоты,2-циклогекс-1-енил-4-[1-(2-пиридин-3-илацетил)пиперидин-4-ил]фениламид 4-циано-1 Н-имидазол-2-карбоновой кислоты,2-циклогекс-1-енил-4-[1-(2-метансульфонилацетил)пиперидин-4-ил]фениламид 4-циано-1 Н-имидазол-2-карбоновой кислоты,2-циклогекс-1-енил-4-[1-(2-пиридин-2-илацетил)пиперидин-4-ил]фениламид 4-циано-1 Н-имидазол-2-карбоновой кислоты или[4-(1-ацетилпиперидин-4-ил)-2-циклогекс-1-енилфенил]амид 4-циано-1 Н-имидазол-2-карбоновой кислоты и их сольваты, гидраты, таутомеры и фармацевтически приемлемые соли. Другим наиболее предпочтительным соединением формулы I является[2-циклогекс-1-енил-4-(1-2-[(2-гидроксиэтил)метиламино]ацетилпиперидин-4-ил)фенил]амид 4 циано-1 Н-имидазол-2-карбоновой кислоты и его сольваты, гидраты, таутомеры и фармацевтически приемлемые соли. Дополнительным наиболее предпочтительным соединением формулы I является 2-циклогекс-1-енил-4-[1-(2-диметиламиноацетил)пиперидин-4-ил]фениламид 4-циано-1 Н-имидазол-2-карбоновой кислоты и его сольваты, гидраты, таутомеры и фармацевтически приемлемые соли. Еще одним наиболее предпочтительным соединением формулы I является 2-циклогекс-1-енил-4-[1-(2-морфолин-4-илацетил)пиперидин-4-ил]фениламид 4-циано-1 Н-имидазол-2-карбоновой кислоты и его сольваты, гидраты, таутомеры и фармацевтически приемлемые соли. Еще одними предпочтительными соединениями формулы I являются трифторуксуснокислая соль 4-[1-(3-амино-3-метилбутирил)пиперидин-4-ил]-2-циклогекс-1 енилфениламида 4-циано-1 Н-имидазол-2-карбоновой кислоты,бис(трифторуксуснокислая) соль-8 013250 5-циано-1 Н-имидазол-2-карбоновой кислоты и их сольваты, гидраты, таутомеры и фармацевтически приемлемые соли. Дополнительными предпочтительными соединениями формулы I являются 2-циклогекс-1-енил-4-[1-(2-метиламиноацетил)пиперидин-4-ил]фениламид 4-циано-1 Н-имидазол-2-карбоновой кислоты,трифторуксуснокислая соль[6-(4,4-диметилциклогекс-1-енил)-1'-(2-метансульфонилэтил)трифторуксуснокислая 1',2',3',4',5',6'-гексагидро-[2,4']пиридинил-5-ил]амида 4-циано-1 Н-имидазол-2-карбоновой кислоты и их сольваты, гидраты, таутомеры и фармацевтически приемлемые соли. Настоящее изобретение также относится к способам ингибирования активности протеинтирозинкиназ у млекопитающего путем введения терапевтически эффективного количества по крайней мере одного соединения формулы I. Предпочтительной тирозинкиназой является c-fms. Считается, что настоящее изобретение включает энантиомерные, диастереомерные и таутомерные формы всех соединений формулы I, а также их рацемические смеси. Кроме того, некоторые из соединений, представленных формулой I, могут являться пролекарствами, т.е. производными действующего лекарства, которые обладают улучшенными по сравнению с действующим лекарством возможностями доставки и лечебным действием. Пролекарства трансформируются in vivo в действующие лекарства посредством ферментативных или химических процессов.I. Определения. Термин алкил относится к радикалам с неразветвленной и с разветвленной цепью, содержащим до 12 атомов углерода, предпочтительно до 6 атомов углерода, если не указано особо, и включает без ограничения метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил, изогексил, гептил, октил, 2,2,4-триметилпентил, нонил, децил, ундецил и додецил. Термин гидроксиалкил относится к радикалам с неразветвленной и с разветвленной цепью, содержащим до 6 атомов углерода, в которых один атом водорода заменен группой ОН. Термин гидроксиалкиламино относится к гидроксиалкильной группе, в которой один атом водорода в углеродной цепи заменен аминогруппой, причем азот является точкой присоединения к оставшейся части молекулы. Термин циклоалкил относится к насыщенному или частично ненасыщенному кольцу, образованному 3-8 атомами углерода. В кольце может необязательно содержаться до 4 алкильных заместителей. Примеры включают циклопропил, 1,1-диметилциклобутил, 1,2,3-триметилциклопентил, циклогексил,циклопентенил, циклогексенил и 4,4-диметилциклогексенил. Термин дигидросульфонопиранил относится к следующему радикалу: Термин гидроксиалкил относится по крайней мере к одной гидроксильной группе, соединенной с любым атомом углерода в алкильной цепи. Термин аминоалкил относится по крайней мере к одной первичной или вторичной аминогруппе,соединенной с любым атомом углерода в алкильной цепи, причем алкильная группа является точкой присоединения к оставшейся части молекулы. Термин алкиламино относится к аминогруппе, содержащей один алкильный заместитель, причем аминогруппа является точкой присоединения к оставшейся части молекулы. Термин диалкиламино относится к аминогруппе, содержащей два алкильных заместителя, причем аминогруппа является точкой присоединения к оставшейся части молекулы. Термин гетероароматический или гетероарил относится к 5-7-членной моноциклической или 810-членной бициклической ароматическим кольцевым системам, любое кольцо которых может состоять из 1-4 гетероатомов, выбранных из N, О или S, где атомы азота и серы могут существовать в любом разрешенном окислительном состоянии. Примеры включают бензимидазолил, бензотиазолил, бензотиенил,бензоксазолил, фурил, имидазолил, изотиазолил, изоксазолил, оксазолил, пиразинил, пиразолил, пиридил, пиримидинил, пирролил, хинолинил, тиазолил и тиенил. Термин гетероатом относится к атому азота, атому кислорода или атому серы, причем атомы азота и серы могут существовать в любом разрешенном окислительном состоянии. Термин алкокси относится к радикалам с неразветвленной или разветвленной цепью, содержащим до 12 атомов углерода, если не указано особо, соединенных с атомом кислорода. Примеры включают метокси, этокси, пропокси, изопропокси и бутокси. Термин арил относится к моноциклической или бициклической ароматическим кольцевым системам, содержащим в кольце 6-12 атомов углерода. В кольце могут необязательно содержаться алкильные заместители. Примеры включают бензол, бифенил и нафтален. Термин аралкил относится к C1-6 алкильной группе, содержащей арильный заместитель. Примеры включают бензил, фенилэтил или 2-нафтилметил.-9 013250 Термин сульфонил относится к группе -S(O)2Ra, где Ra представляет собой водород, алкил, циклоалкил, галогеналкил, арил, аралкил, гетероарил и гетероаралкил. Сульфонилирующий агент добавляет группу -S(O)2Ra к молекуле.II. Применения в терапии. Соединения формулы I представляют собой новые мощные ингибиторы протеинтирозинкиназ, таких как c-fms, и могут быть пригодны для профилактики и лечения расстройств, возникающих в результате воздействий указанных киназ. Настоящее изобретение также относится к способам ингибирования протеинтирозинкиназы, включающим приведение в контакт протеинтирозинкиназы с эффективным ингибирующим количеством по крайней мере одного из соединений формулы I. Предпочтительной тирозинкиназой является c-fms. Соединения по настоящему изобретению также являются ингибиторами активности тирозинкиназы FLT3. В одном примере осуществления ингибирования протеинтирозинкиназы по крайней мере одно из соединений формулы I объединяют с известным ингибитором тирозинкиназ. В различных примерах осуществления настоящего изобретения протеинтирозинкиназы, ингибируемые соединениями формулы I, расположены в клетках, в организме млекопитающего или in vitro. В случае млекопитающих, которые включают людей, вводят терапевтически эффективное количество фармацевтически приемлемой формы по крайней мере одного из соединений формулы I. Настоящее изобретение также относится к способам лечения рака у млекопитающих, включая людей, путем введения терапевтически эффективного количества фармацевтически приемлемой композиции по крайней мере одного соединения формулы I. Представленные в качестве примера виды рака включают без ограничения острый миелолейкоз, острый лимфоцитарный лейкоз, рак яичников, рак матки, рак молочной железы, рак толстой кишки, рак желудка, гистиоцитарный ретикулоэндотелиоз и немелкоклеточную карциному легкого. Настоящее изобретение также относится к способам лечения определенных предраковых состояний, включая миелофиброз. В одном примере осуществления настоящего изобретения эффективное количество, по крайней мере, соединения формулы I вводят в сочетании с эффективным количеством химиотерапевтического вещества. Настоящее изобретение дополнительно относится к способам лечения и профилактики образования метастазов злокачественных опухолей, которые включают без ограничения рак яичников, рак матки, рак молочной железы, рак толстого кишечника, рак желудка, гистиоцитарный ретикулоэндотелиоз и немелкоклеточную карциному легкого. Настоящее изобретение дополнительно относится к способам лечения остеопороза, болезни Пэджета и других заболеваний, в которых болезненность опосредуется резорбцией кости, включая артрит, неудачное протезирование, остеолитическую саркому, миелому и метастазирование опухоли в кости, что часто встречается при злокачественных опухолях, включающих, без ограничения, рак молочной железы,рак предстательной железы и рак толстой кишки. Настоящее изобретение также относится к лечению боли, в частности скелетной боли, обусловленной метастазированием опухоли или остеоартритом, а также висцеральной, воспалительной и нейрогенной боли. Настоящее изобретение также относится к способам лечения сердечно-сосудистых, воспалительных и аутоиммунных заболеваний у млекопитающих, включая людей, путем введения терапевтически эффективного количества фармацевтически приемлемой формы по крайней мере одного из соединений формулы I. Примеры заболеваний с воспалительной компонентой включают гломерулонефрит, воспалительное заболевание кишечника, неудачное протезирование, саркоидоз, застойное обструктивное заболевание легких, астму, панкреатит, ВИЧ-инфекцию, псориаз, сахарный диабет, связанный с опухолью ангиогенез, возрастную дистрофию желтого пятна, диабетическую ретинопатию, рестеноз, шизофрению или деменцию при болезни Альцгеймера. Указанные заболевания могут успешно подвергаться лечению соединениями по настоящему изобретению. Другие заболевания, которые могут успешно подвергаться лечению, включают без ограничения атеросклероз и гипертрофию сердца. Аутоиммунные заболевания, такие как системная красная волчанка, ревматоидный артрит, синдром Шгрена, рассеянный склероз или увеит, могут также подвергаться лечению соединениями по настоящему изобретению. При использовании в качестве ингибиторов протеинтирозинкиназ соединения по настоящему изобретению могут вводиться в эффективном количестве внутри диапазона доз приблизительно от 0,5 мг приблизительно до 10 г, предпочтительно приблизительно от 0,5 приблизительно до 5 г в виде суточной дозы, принимаемой однократно или разделенной на несколько приемов. Вводимая доза может быть изменена с учетом таких факторов, как способ введения, состояние здоровья, вес и возраст получающего лечение, частота лечения и наличие параллельных или независимых способов лечения. Соединения формулы I могут быть включены в состав фармацевтических композиций, включающих любые известные фармацевтически приемлемые носители. Примеры носителей включают без ограничения любые подходящие растворители, дисперсионные среды, покрытия, антибактериальные или противогрибковые средства и придающие изотоничность агенты. Примеры наполнителей, которые могут также являться компонентами состава, включают наполнители, связующие вещества, разрыхлители и- 10013250 смазки. Фармацевтически приемлемые соли соединений формулы I включают традиционные нетоксичные соли или четвертичные аммониевые соли, которые образуют неорганические или органические кислоты или основания. Примеры таких солей добавления кислоты включают ацетат, адипат, бензоат, бензолсульфонат, цитрат, камфорат, додецилсульфат, гидрохлорид, гидробромид, лактат, малеат, метансульфонат, нитрат, оксалат, пивалат, пропионат, сукцинат, сульфат и тартрат. Основные соли включают соли аммония, соли щелочных металлов, таких как соли натрия или калия, соли щелочно-земельных металлов,такие как соли кальция и магния, соли органических оснований, такие как соли дициклогексиламино, и соли с аминокислотами, такими как аргинин. Основные азотсодержащие группы могут быть также кватернизованы, например, алкилгалогенидами. Фармацевтические композиции по настоящему изобретению могут вводиться любым путем, который соответствует предназначенной для них цели. Примеры включают введение парентеральным, подкожным, внутривенным, внутримышечным, интраперитонеальным, чрескожным, трансбуккальным или интраокулярным путями. Альтернативно или одновременно, введение может осуществляться перорально. Подходящие составы для парентерального введения включают водные растворы активных соединений в растворимой в воде форме, например в форме растворимых в воде солей, кислых растворов, щелочных растворов, растворов в декстрозе/воде, придающих изотоничность растворов углеводов и циклодекстриновых комплексов включения. Полиморфы и сольваты Кроме того, соединения по настоящему изобретению могут иметь одну или несколько полиморфных или аморфных кристаллических форм, которые поэтому необходимо включать в объем настоящего изобретения. Кроме того, соединения могут образовывать сольваты, например, с водой (т.е. гидраты) или с обычными органическими растворителями. Используемый в этом документе термин сольват означает физическое связывание соединений по настоящему изобретению с одной или несколькими молекулами растворителя. В этом физическом связывании в различной степени участвуют ионные и ковалентные связи, включая водородные связи. В определенных случаях сольват возможно выделить, например, если одна или несколько молекул растворителя включены в состав кристаллической решетки кристаллического твердого вещества. Подразумевается, что термин сольват охватывает и находящийся в растворе, и изолируемый сольваты. Неограничивающие примеры подходящих сольватов включают этаноляты, метаноляты и т.п. Подразумевается, что в объем настоящего изобретения включены сольваты соединений по настоящему изобретению. Таким образом, в способах лечения по настоящему изобретению термин введение также охватывает средства лечения, уменьшения интенсивности или профилактики описанного в этом документе синдрома, расстройства или заболевания, соединениями по настоящему изобретению или их сольватами, которые несомненно должны быть включены в объем настоящего изобретения, даже не будучи специально раскрытыми. На схеме 1 отражена общая методика получения соединений формулы I. Соединения формулы 1-2 могут быть получены путем ортогалогенирования, предпочтительно броминирования, аминосоединений формулы 1-1, с последующими катализируемыми металлом реакциями сочетания с бороновыми кислотами или бороновыми эфирами (реакции сочетания по Сузуки, где R2M представляет собой R2B(OH)2 или бороновый эфир) или оловоорганическими реактивами (реакции сочетания по Стиле, где R2M представляет собой R2Sn(алкил)3) (для обзора см. N. Miyaura, A. Suzuki, Chem.Rev., 95:2457 (1995), J.K. Stille, Angew. Chem, Int. Ed. Engl, 25: 508024 (1986) и A. Suzuki in MetalCatalyzed Coupling Reactions, F. Deiderich, P. Stang, Eds., Wiley-VCH, Weinheina (1988. Соединения формулы 1-1 могут быть коммерчески доступными, или для получения соединений формулы 1-1 из исходного соединения 1-0 могут быть использованы описанные выше реакции кросс-сочетания, катализируемые палладием. Предпочтительными условиями для броминирования соединений 1-1 являются N-бромсукцинимид(NBS) в подходящем растворителе, таком как N,N-диметилформамид (ДМФА), дихлорметан (DCM) или ацетонитрил. Катализируемые металлом реакции сочетания, предпочтительно реакции сочетания по Сузуки, могут быть осуществлены в соответствии со стандартными методиками, предпочтительно в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4), водного основания, такого как водный Na2CO3, и подходящего растворителя, такого как толуол, этанол, диметоксиэтан (DME) или ДМФА. Соединения формулы I могут быть получены взаимодействием соединений формулы 1-2 с карбоновыми кислотами WCOOH в соответствии со стандартными методиками образования амидной связи (для обзора см. М. Bodansky and A. Bodansky, The Practice of Peptide Synthesis, Springer-Verlag, NY (1984 или взаимодействием с хлорангидридами WCOCl или активированными сложными эфирами WCO2Rq (гдеRq представляет собой уходящую группу, такую как пентафторфенил или N-сукцинимид). Предпочтительными условиями проведения реакции сочетания с WCOOH являются: если W представляет собой фуран, то оксалилхлорид в DCM с ДМФА в качестве катализатора с образованием хлорангидрида WCOCl, а затем реакция сочетания в присутствии триалкиламина, такого как ДИЭА; если W представляет собой пиррол, то гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI) и гидрохлорид 1-гидроксибензотриазол-6-сульфонамидометила (HOBt); и если W представляет собой имидазол, то предпочтительными условиями являются гексафторфосфат бромтрипирролидинофосфония(PyBrOP) и диизопропилэтиламин (ДИЭА) в DCM. Следует понимать, что необязательные заместители в кольце А в формуле I могут содержаться в исходных соединениях 1-1 или 1-3, и в этих случаях синтез проводится по методике, отраженной в схеме 1. Альтернативно, для обеспечения необязательного замещения, указанного для формулы I, целым рядом описанных ниже способов могут вводиться различные заместители соединений формулы I. Уходящая группа "L1", которая содержится в кольце А в формуле 1-0 или 1-3, может быть замещена заранее или на любой стадии процесса, описанного схемой 1. Если такие уходящие группы (предпочтительно фтор или хлор) активированы для нуклеофильной атаки нитрогруппой формулы 1-3, то они могут претерпевать прямое нуклеофильное ароматическое замещение аммиаком или анионом азида, или аминами, спиртами,тиолами и другими нуклеофилами, в присутствии подходящего основания, такого как K2CO3, N,Nдиизопропилэтиламин (ДИЭА) или NEt3. Если уходящая группа подходит для катализируемых металлом реакций сочетания (предпочтительно бром или трифторметансульфонилокси), то может быть проведен целый ряд реакций кросс-сочетания (таких как реакции сочетания по Сузуки или Стиле, обсуждавшихся ранее для введения R2). Другие катализируемые металлом реакции сочетания, которые могут применяться, включают ароматическое и гетероароматическое аминирование и амидирование (для обзоров см. S.L.Buchwald, et al., Top. Curr. Chem., 219:131-209 (2001) и J.F. Hartwig в "Organopalladium Chemistry for Organic Synthesis", Wiley Interscience, NY (2002. Для необязательного замещения метилом могут применяться дополнительные катализируемые металлом реакции кросс-сочетания с 2,4,6 триметилциклотрибороксаном, если L1 представляет собой бром, йод или хлор, активированный нитро(см. М. Gray, et al., Tetrahedron Lett., 41: 6237-40 (2000. В некоторых случаях для получения конечных заместителей формулы I исходные заместители могут быть дериватизованы, как описано ниже. Альтернативный способ введения азотсодержащих гетероциклических заместителей в кольцо А заключается в образовании гетероцикла из аминогруппы кольца А. Аминогруппа может изначально содержаться в исходном соединении в защищенной или незащищенной форме, или может являться результатом восстановления нитрогруппы, которая также может либо изначально содержаться в исходном соединении, или присоединяться в реакции нитрирования. Кроме того, аминогруппа может образовывать в результате восстановления азидной группы, которая может содержаться в исходном соединении или может являться результатом нуклеофильного ароматического замещения активированного галогенида анионом азида, как описано выше. Аминогруппа может также являться результатом нуклеофильного ароматического замещения активированного галогенида (например, в нитрогалогенидном соединении) аммиаком или анионом защищенного эквивалента аммиака, например трет-бутилкарбаматом. Если амин вводится в защищенной форме, то защита может быть снята с амина в соответствии со стандартными изложенными в литературе методиками (например, аминозащитные группы и способы снятия защиты см. в Theodora W. Greene and Peter G.M. Wuts, John Wiley and Sons, Inc., NY (1991. Реакции формирования кольца включают обработку анилиновой аминогруппы подходящим необязательно замещенным диэлектрофилом, предпочтительно дигалогенидом или дикарбонильным соединением, что приводит к образованию двух заместителей в аминогруппы с формированием необязательно замещенного гетероцикла. В случае дигалогенидов, в качестве акцепторов кислоты может быть добавлено любое число подходящих оснований, таких как карбонат калия, гидроксид натрия или триалкиламин, такой как триэтиламин. Таким образом, обработка бис(2-галогенэтил)амином, таким как бис(2-хлорэтил)амин или бис(2 бромэтил)амин, позволяет получить пиперазиновое кольцо (см., например, J. Med. Chem., 29: 640-4(1986) и J. Med. Chem., 46: 2837 (2003. Необязательное замещение атома азота в аминогруппе реактива позволяет охватывать необязательное замещение концевого амина в пиперазине. Например, обработкаN,N-бис(2-хлорэтил)анилином позволяет получить N-фенилпиперазиногруппу. Обработка бис(2- 12013250 галогенэтил)эфиром или бис(2-галогенэтил)тиоэфиром позволяет получить морфолиновое или тиоморфолиновое кольцо соответственно. Другой альтернативный способ прямого замещения с целью введения гетероциклических заместителей в кольцо А заключается в формировании гетероцикла из альдегида (т.е. из формильной группы кольца А). Формильная группа может изначально содержаться в исходном соединении в защищенной или незащищенной форме, или может являться результатом целого ряда известных из литературы реакций формилирования, включая реакцию Вильсмеера-Хаака (для обзора химии формилирования см. G.A.Olah, et al., Chem Rev., 87: (1987, или путем параформилирования нитроароматических соединений (см.A. Katritsky and L. Xie, Tetrahedron Lett., 37:347-50 (1996. И, наконец, подразумевается, что соединения формулы I могут быть в дальнейшем дериватизованы. Защитные группы на соединениях формулы I могут быть сняты в соответствии со стандартными методиками синтеза (Theodora W. Greene and Peter G.M. Wuts, John Wiley and Sons, Inc., NY (1991 и могут быть в дальнейшем подвергнуты дериватизации. Примеры дальнейшей дериватизации соединений формулы I включают без ограничения: если соединения формулы I содержат первичный или вторичный амин, то амин может взаимодействовать с альдегидами или кетонами в присутствии восстановителя, такого как триацетоксиборгидрид натрия (см. Abdel-Magid, J. Og. Chem. 61, pp. 3849-3862, (1996 для восстановительного алкилирования; с хлорангидридами или карбоновыми кислотами и описанным выше реагентом,образующим амидную связь, для образования амидов; с сульфонилхлоридами с получением сульфонамидов; с изоцианатами с получением мочевин; с арил- или гетероарилгалогенидами в присутствии описанного выше палладиевого катализатора (см. представленные выше ссылки на Buchwald и Hartwig) с получением арил- и гетероариламинов. Кроме того, если соединения формулы I содержат арилгалогенид или гетероарилгалогенид, то эти соединения могут вступать в катализируемые металлом реакции с бороновыми кислотами (например, описанные выше реакции сочетания по Сузуки или Стиле), или с аминами или спиртами (реакции сочетания по Бухвальду или Хартвигу, см. представленные выше ссылки наBuchwald и Hartwig). Если соединения формулы I содержат цианогруппу, то в кислотных или щелочных условиях эта группа может быть гидролизована до амидов или кислот. Основные амины могут быть окислены до N-оксидов и, наоборот, N-оксиды могут быть восстановлены до основных аминов. Если соединения формулы I содержат сульфид, ациклический или циклический, то сульфид может быть в дальнейшем окислен до соответствующих сульфоксидов или сульфонов. Сульфоксиды могут быть получены путем окисления с применением подходящего окислителя, такого как один эквивалент метахлорпероксибензойной кислоты (МСРВА), или обработкой NaIO4 (см., например, J. Regan, et al., J. Med. Chem.,46: 4676-86 (2003, а сульфоны могут быть получены с применением 2 экв. МСРВА или обработкой Nоксидом 4-метилморфолина и каталитическим количеством тетроксида осмия (см., например, заявку согласно РСТ WO 01/47919). Схема 2 а На схеме 2 а отражен путь синтеза соединений формулы I. F представляет собой -NQaQbR3-, -O-, S,SO или SO2, и АА представляет собой -NH2 или -NO2. D1 и D2 представлены исключительно с целью иллюстрации; специалисты в данной области техники понимают, что также могут присутствовать D5, D6,D7 и D8. Кетоны формулы 2-1 могут быть преобразованы в винилтрифлаты формулы 2-2 обработкой ненуклеофильным основанием, таким как LDA, с последующим улавливанием полученного енолята трифлат-реагентом, таким как трифторметансульфоновый ангидрид, или предпочтительно Nфенилтрифторметансульфонимид. Осуществлением реакции сочетания по Сузуки бороновых кислот или бороновых эфиров формулы 2-3 с винилтрифлатами формулы 2-2 можно получать соединения формулы 2-4, где Z = С (Synthesis, 993 (1991. Для соединений формулы 2-4 обработка Pd/C может восстанавливать также олефин (и нитро, если- 13013250 АА = NO2) с получением Z = СН, АА = NH2. Соединения формулы 2-4, где F представляет собой -SO2,могут быть получены из соединений формулы 2-4, где АА = -NO2, и F представляет собой сульфид (F =-S-), окислением МСРВА или другими способами, описанными в схеме 1. Для восстановления и нитро, и олефина, нитрогруппа может быть затем восстановлена Pd/C. Соединения формулы 2-4 (АА = NH2) затем преобразуют в соединения формулы 2-5 (которые также представляют собой соединения формулы I, если не требуется дополнительных модификаций), как описано в схеме 1. Соединения формулы 2-5 могут быть в дальнейшем модифицированы для получения дополнительных соединений формулы I. Например, в тех случаях, когда F представляет собой -NQaQbR3-, QaQb = прямая связь, и R3 представляет собой ВОС-защищенную группу (CO2tBu), ВОС-группа может быть снята в соответствии со стандартной методикой, такой как обработка трифторуксусной кислотой (TFA) вDCM (см. Greene and Wuts, ibid.), с получением вторичного амина, который может быть затем дериватизован с получением соединений формулы I. Дополнительная дериватизация включает без ограничения осуществление взаимодействия с альдегидами или кетонами в присутствии восстановителя, такого как триацетоксиборгидрид натрия, с получением соединений формулы II, где F = -NCH2R3 (A. F. AbdelMagid, ibid.); с хлорангидридами или с карбоновыми кислотами и реагентом, образующим амидную связь (как представлено на схеме 1), с получением соединений формулы II, где F = -NCOR3; с сульфонилхлоридами (как представлено на схеме 1) с получением соединений формулы I, где F = -NSO2Ra; с изоцианатами (как представлено на схеме 1) с получением соединений формулы II, где F = -NCONRaRb; или осуществление катализируемых металлами реакций замещения, что отражено на схеме 1, с получением соединений формулы I, где F = -NR3 (см. S.L. Buchwald, et al., ibid.; J.H. Hartwig, ibid.), для представленного выше примера Ra и Rb независимо представляют собой водород, алкил, циклоалкил, галогеналкил, арил, аралкил, гетероарил и гетероаралкил. Схема 2b На схеме 2b показана модификация схемы 2 а для синтеза частично ненасыщенных соединений формулы I. E представляет собой -NQaQbR3-, -О- (D1=D2=Н), -S- (D1=D2=Н), -SO- (D1=D2=Н) или -SO2(D1=D2=Н), и RAA представляет собой -NH2 или -NO2-. Соединения формулы 2-4 получают, как представлено на схеме 2. Если RAA = -NO2, то нитрогруппа может быть восстановлена способом, при котором не происходит восстановления олефинов, таким как восстановление железом и хлоридом аммония. Если RAA формулы 2-4 представляет собой аминогруппу, то в этой стадии нет необходимости, и соединения формулы 2-4 также являются соединениями формулы 2-7. Для полученных соединений формулы 2-7, где Е =-SO2- или -SO-, может осуществляться описанное выше окисление сульфида в соединении 2-4, где RAA = На схеме 3 описано получение промежуточных продуктов для синтеза соединений формулы I, где кольцо А представляет собой пиридил, и R5 представляет собой необязательный заместитель кольца А или одного из гетероциклических заместителей, определенных для соединений формулы I. K = NH2 или- 14013250 другие функциональные группы, такие как NO2, COOH или COOR, которые могут быть в конечном итоге преобразованы в аминогруппу способами, известными из литературы, такими как способы восстановления NO2 (как обсуждается для схемы 1) или перегруппировка Курциуса для СООН (для обзора см. Organic Reactions, 3: 337 (1947. L3 и L4 представляют собой атомы галогена. (K = СООН может быть также получено из K = COOR простым гидролизом, катализируемым основанием или кислотой). В общем, селективность и порядок введения R2 и R5 могут достигаться путем относительной реакционной способности галогенов L3 и L4, выбранных для соединения 3-1, собственной селективности гетероцикла и/или применяемых условий реакции. Пример использования относительной реакционной способности галогенов L3 и L4 для селективного введения R2 и R5 позволяет включать случай, когда в соединениях формулы 3-1, где L3 представляет собой фтор и L4 представляет собой бром, может осуществляться селективная замена фтора нуклеофилом с последующим замещением оставшегося брома при помощи катализируемого металлами замещения (такого как реакции кросс-сочетания по Сузуки или Стиле, как дополнительно изложено ниже). Сходным образом, в соединениях формулы 3-1, где один изL3 и L4 представляет собой йод, а другой представляет собой бром или хлор, может осуществляться селективное катализируемое металлами замещение йода (такого как реакции кросс-сочетания по Сузуки и Стиле, или аминирования по Бухвальд/Хартвиг, как дополнительно изложено ниже) с последующим замещением оставшегося брома или хлора по другой катализируемой металлами реакции замещения на йод. Как проиллюстрировано на схеме 3, уходящая группа L3 в формуле 3-1 может быть сначала замещена с получением соединений формулы 3-3, или уходящая группа L4 может быть сначала замещена с получением соединения формулы 3-2. Затем для получения соединения формулы 3-4 в соединениях 3-2 или 3-3 может быть заменена L3 или L4. Таким образом, прямое нуклеофильное замещение или катализируемое металлом аминирование соединения формулы 3-1 вторичным амином, аммиаком или защищенным амином, таким как третбутилкарбамат (для обзора см. Modern Amination Methods: Ricci, A., Ed.; Wiley-VCH: Weinheim, 2000),может использоваться для введения R5 в соединения формулы 3-2 или 3-3, где R5 представляет собой первичный или вторичный амин, аминогруппу (NH2) и эквивалент амина или защищенную аминогруппу. Катализируемая металлом реакция сочетания соединения 3-1 с бороновыми кислотами или бороновыми эфирами (реакция сочетания по Сузуки, М = группа бороновой кислоты или группа боронового эфира) или с оловоорганическими соединениями (реакция сочетания по Стиле, М = SnR3, где R = алкил или другие определенные выше заместители, как представлено на схеме 1) позволяет получать соединения формулы 3-2 или 3-3. Соединение 3-2 может быть в дальнейшем преобразовано в соединение 3-4 путем катализируемой металлом реакции сочетания по Сузуки или Стиле, как описано выше. L4 в соединении 3-3 может быть также впоследствии замещено R5 с получением соединений формулы 3-4, также путем прямого нуклеофильного замещения или катализируемой металлом реакции с нуклеофилом, или путем той же самой катализируемой металлом реакции кросс-сочетания, как описано выше. Если R5 в формулах (3-2, 3-3 или 3-4) представляет собой защищенный амин и K не является аминогруппой, с нее может быть снята защита для открытия функциональной аминогруппы. Эта функциональная аминогруппа может быть в дальнейшем дериватизована, как представлено на схеме 1. Если группа K в формуле 3-4 не является аминогруппой (такой как описанная выше функциональная группа), то она может быть преобразована в аминогруппу в соответствии с известными из литературы способами (см., например, Comprehensive OrganicTransformations: Larock, R.S.; Wiley and Sons Inc., USA, 1999), и полученный амин 3-5 может использоваться в реакциях образования амидной связи, как представлено на схеме 1, с получением соединений формулы I. Если K в формуле 3-4 представляет собой аминогруппу, то соединение может непосредственно использоваться в реакции амидного сочетания, как описано выше. Схема 4 а На схемах 4 а и 4b представлено получение промежуточных продуктов, которые в дальнейшем мо- 15013250 дифицируют в соответствии со схемой 3, используя в качестве исходного соединения моногалогензамещенное соединение формулы 4-1 и 4-5, путем введения второй уходящей группы после окончания замещения первой уходящей группы. Это также может использоваться для синтеза соединений формулы I,где кольцо А представляет собой пиридин и R5 представляет собой либо необязательный заместитель кольца А, либо один из гетероциклических заместителей. Как показано на схеме 3, оставшиеся положения пиридинового кольца могут быть замещены, как описано в формуле I. K = NH2 или другие функциональные группы, такие как NO2, COOH или COOR, которые могут быть в конечном итоге преобразованы в аминогруппу известными из литературы способами, такими как реакции восстановления или перегруппировка Курциуса, как представлено на схеме 3. L3 и L4 представляют собой атомы галогена. В этих соединениях Т представляет собой либо Н, либо функциональную группу, такую как ОН, которая может быть преобразована в уходящие группы L3 или L4, такие как галоген, трифлат или мезилат, известными из литературы способами (см., например, Nicolai, E., et al., J. Heterocyclic Chemistry, 31, (73), (1994. Путем замещения L3 в соединении формулы 4-1 или L4 в соединении формулы 4-5 способами, описанными в схеме 3, можно получать соединения формулы 4-2 и 4-6. На этой стадии заместитель Т соединений 4-2 или 4-6 может быть преобразован в уходящую группу L4 или L3 (предпочтительно галоген) стандартными способами с получением соединений формулы 4-3 и 4-5. Например, если Т = ОН, то предпочтительными реагентами для осуществления этого преобразования являются тионилхлорид, PCl5, POCl3 или PBr3Perkin Trans., 1370, (1980. Если T = H, то он может быть непосредственно галогенирован (предпочтительно броминирован) с получением соединений формулы 4-3 или 4-7 (см., например, Canibano, V. et al.,Synthesis, 14, 2175, (2001. Предпочтительными условиями для броминирования являются NBS в подходящем растворителе,таком как DCM или ацетонитрил. Соединения формулы 4-3 или 4-7 могут быть преобразованы в соединения формулы 4-4 или 4-8 путем введения оставшихся групп R2 или R5 соответственно, описанными выше способами, а затем в соединения формулы I способами, описанными в схеме 3, для преобразования соединений формулы 3-4 и 3-5 в соединения формулы I. Пример 1. 5-Цианофуран-2-карбоновая кислота. В колбу, оснащенную мешалкой и колонкой Вигре, в атмосфере аргона добавляли 2-формил-5 фуранкарбоновую кислоту (2,8 г, 20 ммоль), гидрохлорид гидроксиламина (2,7 г, 40 ммоль) и безводный пиридин (50 мл). Смесь нагревали до 85 С, добавляли уксусный ангидрид (40 мл) и перемешивали смесь в течение 3 ч. После охлаждения до 60 С добавляли воду (250 мл) и перемешивали смесь при комнатной температуре в течение 70 ч. Смесь подкисляли до рН 2 добавлением концентрированной соляной кислоты и экстрагировали дихлорметаном/изопропанолом (3/1, 8100 мл). Объединенные органические слои промывали водой (100 мл), солевым раствором (100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества желтовато-коричневого цвета (1,26 г, 4,6%). 1 Н-ЯМР (CD3OD; 400 МГц):14,05 (ушир с, 1 Н), 7,74 (д, 1 Н, J=3,8 Гц), 7,42 (д, 1 Н, J=3,8 Гц). Пример 2. 4-Циано-1 Н-пиррол-2-карбоновая кислота. Указанное в заголовке соединение получали по методике, изложенной в литературе (Loader and(триметилсилил)этоксиметилхлорид (SEMCl) (0,95 мл, 5,3 ммоль), K2CO3 (1,40 г, 10,4 ммоль) и ацетон (5 мл) и перемешивали при комнатной температуре в течение 10 ч. Смесь разбавляли EtOAc (20 мл), промывали водой (20 мл) и солевым раствором (20 мл) и сушили органический слой над MgSO4. Неочищенный продукт элюировали с картриджа для твердофазной экстракции (ТФЭ) (20 г силикагеля) 30%(полученного, как на предыдущей стадии) в CCl4 (10 мл) добавляли NBS (0,61 г, 3,4 ммоль) и AIBN (каталитическое количество) и нагревали смесь при 60 С в течение 4 ч. Реакционную смесь разбавлялиEtOAc (30 мл), промывали NaHCO3 (230 мл) и солевым раствором (30 мл), органический слой сушили над Na2SO4, а затем концентрировали. Указанное в заголовке соединение элюировали с картриджа для ТФЭ (20 г силикагеля) 30% EtOAc/гексаном с получением 0,73 г (77%) твердого вещества желтого цвета. Масс-спектр (CI (CH4), m/z), рассчитанный для C10H16BrN3OSi, 302,0/304,0 (М+Н), обнаружено 302,1/304,1. с) Сложный этиловый эфир 4-циано-1-(2-триметилсиланилэтоксиметил)-1 Н-имидазол-2 карбоновой кислоты. К раствору 2-бром-1-(2-триметилсиланилэтоксиметил)-1 Н-имидазол-4-карбонитрила (0,55 г, 1,8 ммоль) (полученного, как на предыдущей стадии) в THF (6 мл) при -40 С по каплям добавляли 2 М раствор i-PrMgCl в THF (1 мл). Реакционную смесь оставляли перемешиваться в течение 10 мин при -40 С,затем охлаждали до -78 С и добавляли этилцианоформиат (0,3 г, 3,0 ммоль). Реакционной смеси позволяли достичь комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь гасили добавлением насыщенного водного NH4Cl, разбавляли EtOAc (20 мл) и промывали солевым раствором (220 мл), органический слой сушили над Na2SO4, а затем концентрировали. Указанное в заголовке соединение элюировали с картриджа для ТФЭ (20 г силикагеля) 30% EtOAc/гексаном с получением 0,4 г (74%) бесцветного масла. Масс-спектр (ESI, m/z), рассчитанный для C13H21N3O3Si, 296,1 (М+Н), обнаружено 296,1.d) Калиевая соль 4-циано-1-(2-триметилсиланилэтоксиметил)-1 Н-имидазол-2-карбоксилата. К раствору сложного этилового эфира 4-циано-1-(2-триметилсиланилэтоксиметил)-1 Н-имидазол-2 карбоновой кислоты (0,4 г, 1,3 ммоль) (полученного, как на предыдущей стадии) в этаноле (3 мл) добавляли раствор 6 М KOH (0,2 мл), реакционную смесь перемешивали в течение 10 мин, а затем концентрировали с получением 0,40 г (100%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (400 МГц, CD3OD)7,98 (с, 1 Н), 5,92 (с, 2 Н), 3,62 (м, 2 Н), 0,94 (м, 2 Н), 0,00 (с, 9 Н). Массспектр (ESI-neg, m/z), рассчитанный для C11H17N3O3Si, 266,1 (М-Н), обнаружено 266,0. Пример 4. [4-(4-Метилпиперазин-1-ил)-2-(3-метилтиофен-2-ил)фенил]амид 5-цианофуран-2-карбоновой кислоты.a) 1-(3-Бром-4-нитрофенил)-4-метилпиперазин. 2-Бром-4-фторнитробензол (949 мг, 4,31 ммоль) добавляли двумя порциями к неразбавленному Nметилпиперазину (8 мл) при 0 С и оставляли смесь нагреваться до комнатной температуры. Реакционную смесь нагревали до 60 С в течение 1 ч, затем разбавляли 50 мл EtOAc и вливали в H2O (50 мл). Слои разделяли, органический слой промывали насыщенным водным NaHCO3, сушили (Na2SO4) и концентрировали в вакууме с получением 580 мг (45%) указанного в заголовке соединения в виде твердого вещества желтого цвета. Масс-спектр (ESI, m/z), рассчитанный для C11H14BrN3O2, 300,0 (М+Н), обнаружено 300,1.b) 4,4,5,5-Тетраметил-2-(3-метилтиофен-2-ил)-[1,3,2]диоксаборолан. К перемешанному раствору 2-бром-3-метилтиофена (337 мг, 1,9 ммоль) в 8 мл THF при -40 С до- 17013250 бавляли n-BuLi (0,8 мл, 2,5 М/гексаны) и оставляли реакционную смесь перемешиваться в течение 30 мин. В это время добавляли 2-изопропокси-4,4,5,5-тетраметил-[1,3,2]диоксаборолан (775 мкл, 3,8 ммоль), реакционную смесь оставляли нагреваться до температуры окружающей среды и продолжали перемешивание в течение 1 ч. Затем реакционную смесь охлаждали до 0 С и гасили добавлением насыщенного водного NaHCO3 (10 мл). Смесь вливали в EtOAc (100 мл), промывали Н 2 О (250 мл), сушили(Na2SO4) и концентрировали в вакууме. Путем очистки остатка препаративной тонкослойной хроматографией на силикагеле (элюируя 20% EtOAc-гексанами) получали 224 мг (53%) указанного в заголовке соединения в виде масла. 1 Н-ЯМР (CDCl3; 400 МГц):1,36 (с, 12 Н), 2,5 (с, 3 Н), 6,99 (д, 1 Н, J=4,8 Гц), 7,50 (д, 1 Н, J=4,8 Гц).c) 1-Метил-4-[3-(3-метилтиофен-2-ил)-4-нитрофенил]пиперазин. В колбу, содержащую 1-(3-бром-4-нитрофенил)-4-метилпиперазин (68 мг, 0,2 ммоль; полученный,как на стадии (а) примера 4), 4,4,5,5-тетраметил-2-(3-метилтиофен-2-ил)-[1,3,2]диоксаборолан (61 мг,0,27 ммоль; полученный, как на предыдущей стадии) и Pd(PPh3)4 (14 мг, 6 мол.%), загружали толуол (3 мл), этанол (3 мл) и 2 М Na2CO3 (4 мл). Полученную смесь нагревали при 80 С в течение 2 ч, а затем вливали в EtOAc (25 мл). Органический слой разделяли, сушили (Na2SO4) и концентрировали в вакууме. Путем очистки препаративной тонкослойной хроматографии на силикагеле (элюируя EtOAc) получали 40 мг (63%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета. Массспектр (ESI, m/z), рассчитанный для C16H19N3O2S, 318,1 (М+Н), обнаружено 318,2.d) [4-(4-Метилпиперазин-1-ил)-2-(3-метилтиофен-2-ил)фенил]амид 5-цианофуран-2-карбоновой кислоты. 1-Метил-4-[3-(3-метилтиофен-2-ил)-4-нитрофенил]пиперазин (60 мг, 0,18 ммоль; полученный, как на предыдущей стадии) перемешивали с 40 мг 5% Pd-C в МеОН (5 мл) в атмосфере Н 2 (1 атм) в течение 2 ч. Реакционную смесь фильтровали через целит и концентрировали в вакууме с получением 40 мг (72%) 4-(4-метилпиперазин-1-ил)-2-(3-метилтиофен-2-ил)фениламина в виде твердого вещества коричневого цвета, которое сразу использовали без дополнительной очистки. С использованием методики, сходной с описанной на стадии (с) примера 9, осуществляли взаимодействие 4-(4-метилпиперазин-1-ил)-2-(3 метилтиофен-2-ил)фениламина (40 мг, 0,13 ммоль) с 5-цианофуран-2-карбонилхлоридом (30 мг, 0,19 ммоль; полученным, как на стадии (с) примера 9) в присутствии ДИЭА (61 мкл, 0,34 ммоль) с получением 18,9 мг (36%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3; 400 МГц):2,13 (с, 3 Н), 2,38 (с, 3 Н), 2,59-2,62 (м, 4 Н), 3,24-3,27 (м, 4 Н), 6,92 (д,1 Н, J=2,8 Гц), 7,06 (д, 1 Н, J=5,1 Гц), 7,15 (д, 1 Н, J=3,7 Гц), 7,19 (д, 1 Н, J=3,7 Гц), 7,02 (дд, 1 Н, J=2,8, 9,0 Гц), 7,42 (д, 1 Н, J=5,1 Гц), 8,11 (с, 1 Н), 8,34 (д, 1 Н, J=9,0 Гц); Масс-спектр (ESI, m/z), рассчитанный для а) 4,4,5,5-Тетраметил-2-(2-метилтиофен-3-ил)-[1,3,2]диоксаборолан. С использованием методики, сходной с описанной на стадии (b) примера 4, 3-бром-4-метилтиофен(571 мг, 3,2 ммоль) обрабатывали n-BuLi (1,41 мл, 2,5 М/гексаны), а затем оставляли взаимодействовать с 2-изопропокси-4,4,5,5-тетраметил-[1,3,2]диоксабороланом (775 мкл, 3,8 ммоль) с получением 189 мгb) 1-Метил-4-[3-(4-метилтиофен-3-ил)-4-нитрофенил]пиперазин. С использованием методики, сходной с описанной на стадии (c) примера 4, оставляли взаимодействовать 1-(3-бром-4-нитрофенил)-4-метилпиперазин (162 мг, 0,54 ммоль), 4,4,5,5-тетраметил-2-(2 метилтиофен-3-ил)-[1,3,2]диоксаборолан (145 мг, 0,64 ммоль) и Pd(PPh3)4 (37 мг, 6 мол.%) с получением 108 мг (71%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1c) 4-(4-Метилпиперазин-1-ил)-2-(4-метилтиофен-3-ил)фениламин. С использованием методики, сходной с описанной на стадии (d) примера 4, 1-метил-4-[3-(4 метилтиофен-3-ил)-4-нитрофенил]пиперазин (100 мг, 0,32 ммоль) перемешивали с 80 мг 5% Pd-C в атмосфере Н 2 с получением 82 мг (89%) указанного в заголовке соединения в виде масла темного цвета, которое использовали сразу без дополнительной очистки. Спектр (ESI, m/z), рассчитанный для C16H21N3S,288,15 (М+Н), обнаружено 288,1.d) [4-(4-Метилпиперазин-1-ил)-2-(4-метилтиофен-3-ил)фенил]амид 5-цианофуран-2-карбоновой ки- 18013250 слоты. С использованием методики, сходной с описанной на стадии (с) примера 9, 5-цианофуран-2 карбонилхлорид (64 мг, 0,41 ммоль; полученный, как на стадии (с) примера 9) оставляли взаимодействовать с 4-(4-метилпиперазин-1-ил)-2-(4-метилтиофен-3-ил)фениламином (80 мг, 0,27 ммоль; полученным,как на предыдущей стадии) в присутствии ДИЭА (0,10 мл, 0,59 ммоль) с получением 25,8 мг (24%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3; 400 МГц):2,09 (с, 3 Н), 2,37 (с, 3 Н), 2,59-2,60 (м, 4 Н), 3,24-3,26 (м, 4 Н), 6,83 (д,1 Н, J=2,9 Гц), 6,98-7,06 (м, 2 Н), 7,14-7,21 (м, 3 Н), 7,96 (с, 1 Н), 8,32 (д, 1 Н, J=9,0 Гц), масс-спектр (ESI,m/z), рассчитанный для C22H22N4O2S, 407,1 (М+Н), обнаружено 407,1. Пример 6. Трифторуксуснокислая соль 2-циклогекс-1-енил-4-[1-(2-гидрокси-1-гидроксиметилэтил)пиперидин-4-ил]фениламида 4-циано-1 Н-имидазол-2-карбоновой кислоты.a) 2-Циклогекс-1-енил-4-[1-(2,2-диметил-[1,3]диоксан-5-ил)пиперидин-4-ил]фениламид 4-циано 1 Н-имидазол-2-карбоновой кислоты. К взвеси трифторуксуснокислой соли (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано 1 Н-имидазол-2-карбоновой кислоты (81 мг, 0,16 ммоль; полученной, как на стадии (b) примера 14) вCH2Cl2 (3 мл) добавляли NEt3 (33 мкл, 0,24 ммоль). Затем раствор обрабатывали 2,2-диметил[1,3]диоксан-5-оном (31 мг, 0,24 ммоль) и оставляли реакционную смесь перемешиваться в течение 3 ч. В это время одной порцией добавляли NaBH(OAc)3 (51 мг, 0,24 ммоль) и оставляли реакционную смесь дополнительно перемешиваться в течение 4 ч. Реакционную смесь разбавляли H2O (10 мл) и экстрагировали EtOAc (225 мл). Органические экстракты сушили (Na2SO4) и концентрировали в вакууме. Путем очистки препаративной тонкослойной хроматографией на силикагеле (элюируя 10% МеОН-CHCl3) получали 22 мг (28%) указанного в заголовке соединения в виде полутвердого вещества не совсем белого цвета. Масс-спектр (ESI, m/z), рассчитанный для C28H35N5O3, 490,2 (М+Н), обнаружено 490,6.b) Трифторуксуснокислая соль 2-циклогекс-1-енил-4-[1-(2-гидрокси-1-гидроксиметилэтил)пиперидин-4-ил]фениламида 4-циано-1 Н-имидазол-2-карбоновой кислоты. К раствору 2-циклогекс-1-енил-4-[1-(2,2-диметил-[1,3]диоксан-5-ил)пиперидин-4-ил]фениламида 4-циано-1 Н-имидазол-2-карбоновой кислоты (22 мг, 0,04 ммоль; полученного как на предыдущей стадии) в THF-H2O (1 мл, 4/1 по объему) добавляли TFA (0,4 мл) и оставляли реакционную смесь перемешиваться в течение 1 ч. Путем удаления растворителя в вакууме получали 14 мг (60%) указанного в заголовке соединения в виде янтарной пены. 1 Н-ЯМР (CD3OD, 400 МГц):1,78-1,90 (м, 4 Н), 2,03-2,16 (м, 3 Н), 2,29 (ушир с, 4 Н), 2,88-2,96 (м,1 Н), 3,37-3,40 (м, 1 Н), 3,46-3,53 (м, 2 Н), 3,74-3,78 (м, 3 Н), 5,83 (с, 1 Н), 7,13 (д, 1 Н, J=2,0 Гц), 7,22 (дд, 1 Н,J=2,0, 8,4 Гц), 8,03 (с, 1 Н), 8,17 (д, 1 Н, J=8,4 Гц); Масс-спектр (ESI, m/z), рассчитанный для C25H31N5O3,450,2 (М+Н), обнаружено 450,2. Пример 7. 2-Циклогекс-1-енил-4-[1-(2-морфолин-4-илацетил)пиперидин-4-ил]фениламид 4 циано-1 Н-имидазол-2-карбоновой кислоты. К раствору сложного этилового эфира морфолин-4-илуксусной кислоты (117 мг, 0,67 ммоль) в этаноле (4 мл) шприцом добавляли 6 н. KOH (110 мкл, 0,67 ммоль) и продолжали перемешивание в течение 3 ч. Путем концентрирования в вакууме получали 122 мг (100%) калиевой соли морфолин-4-илуксусной кислоты. К смеси калиевой соли морфолин-4-илуксусной кислоты (29 мг, 0,15 ммоль), трифторуксуснокислой соли (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1 Н-имидазол-2-карбоновой кислоты (65,1 мг, 0,13 ммоль; полученной как на стадии (b) примера 14) и PyBroP (93 мг, 0,19 ммоль) вCH2Cl2 (4 мл) добавляли ДИЭА (51 мкл, 0,29 ммоль) и оставляли реакционную смесь перемешиваться в течение ночи. Реакционную смесь разбавляли CH2Cl2 (50 мл), промывали H2O (225 мл), сушили(Na2SO4) и концентрировали в вакууме. Путем очистки неочищенного продукта препаративной ТСХ на силикагеле получали 8,1 мг (12%) указанного в заголовке соединения в виде твердого вещества белого цвета. 1 Н-ЯМР (CDCl3; 400 МГц):1,68-2,04 (м, 5 Н), 2,20-2,29 (м, 4 Н), 2,53-2,78 (м, 5 Н), 3,09-3,23 (м, 6 Н),3,35-3,40 (м, 1 Н), 3,72 (ушир с, 4 Н), 4,16-4,22 (м, 1 Н), 4,73-4,77 (м, 1 Н), 5,82 (с, 1 Н), 7,00 (с, 1 Н), 7,12 (дд,1 Н, J=0,6, 8,0 Гц), 7,73 (с, 1 Н), 8,27 (д, 1 Н, J=8,1 Гц), 9,48 (с, 1 Н); Масс-спектр (ESI, m/z), рассчитанный для C28H34N6O3, 503,27 (М+Н), обнаружено 503,1. Пример 8. 2-Циклогекс-1-енил-4-[1-(3-морфолин-4-илпропионил)пиперидин-4-ил]фениламид 4 циано-1 Н-имидазол-2-карбоновой кислоты. В колбу, содержащую калиевую соль 3-морфолин-4-илпропионовой кислоты (94 мг, 0,47 ммоль; полученную из сложного этилового эфира 3-морфолин-4-илпропионовой кислоты в точности, как описано в примере 7), трифторуксуснокислую соль (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4 циано-1 Н-имидазол-2-карбоновой кислоты (179 мг, 0,36 ммоль; полученную, как на стадии (b) примера 14), EDCI (83 мг, 0,43 ммоль) и НОВТ (68 мг, 0,5 ммоль), добавляли ДМФА (4 мл). К перемешанной взвеси добавляли ДИЭА (157 мкл, 0,9 ммоль) и оставляли реакционную смесь перемешиваться в течение ночи. Реакционную смесь разбавляли Н 2 О (10 мл) и экстрагировали EtOAc (225 мл). Объединенные органические экстракты сушили (Na2SO4), концентрировали в вакууме и очищали неочищенный продукт препаративной ТСХ на силикагеле с получением 10,4 мг (6%) указанного в заголовке соединения в виде твердого вещества белого цвета. 1Oakwood) в 12 мл EtOH добавляли 1,52 мл (13,7 ммоль) N-метилпиперазина. Раствор перемешивали при 0 С в течение 0,5 ч, а затем при 60 С в течение 4 ч. Смесь концентрировали в вакууме, растворяли вEtOAc (60 мл), промывали водой (3100 мл) и солевым раствором (100 мл) и сушили (Na2SO4). Путем концентрирования в вакууме и проведения хроматографии на колонке для ТФЭ (50 г силикагеля), элюируя 1-3% МеОН-дихлометаном, получали 1,06 г (77%) указанного в заголовке соединения в виде твердого вещества коричневато-желтого цвета. Масс-спектр (ESI, m/z), рассчитанный для C11H14BrN3O2, 300,0- 20013250 К смеси 200 мг (0,666 ммоль) 1-(3-бром-4-нитрофенил)-4-метилпиперазина (полученного, как на предыдущей стадии), 136 мг (0,999 ммоль) и 77,0 мг (0,0666 ммоль) тетракис(трифенилфосфин)палладия(0) в атмосфере аргона добавляли 4,0 мл дегазированного диметоксиэтана (DME) и 400 мкл (0,799 ммоль) 2,0 М водного Na2CO3. Смесь нагревали при 80 С при перемешивании в атмосфере аргона в течение 14 ч. Охлажденную (до комнатной температуры) смесь концентрировали и подвергали хроматографии на колонке для ТФЭ (10 г силикагеля), элюируя 1-5% МеОН в дихлорметане/гексане (1/1). Фракции продукта обрабатывали 80 мг для обесцвечиния угля, фильтровали, концентрировали, а затем повторно подвергали хроматографии на той же колонке, элюируя 1-3% EtOH-дихлорметаном, с получением 265 мг указанного в заголовке соединения в виде смолы желтого цвета (чистота 75% по оценке по методу 1 Н-ЯМР, в виде смеси с трифенилфосфином), которую использовали в последующей реакции без дополнительной очистки. Масс-спектр (ESI, m/z), рассчитанный для C11H21N3O3, 312,2 (М+Н), обнаружено 312,2. с) [2'-Метил-5-(4-метилпиперазин-1-ил)бифенил-2-ил]амид 5-цианофуран-2-карбоновой кислоты. Смесь 140 мг (0,337 ммоль на основании чистоты 75%) 1-метил-4-(2'-метил-6-нитробифенил-3 ил)пиперазина (полученного, как на предыдущей стадии) и 70 мг 10% палладированного угля (Degussatype E101-NE/W, Aldrich, 50 мас.% воды) в 5 мл THF энергично перемешивали в течение 1 ч в атмосфере водорода (подача из баллона). Смесь фильтровали (целит), промывали дихлорметаном (22 мл), раствор полученного анилина помещали в атмосферу аргона и сразу использовали в последующей реакции. Одновременно с описанным выше восстановлением 55,4 мг (0,404 ммоль) 5-цианофуран-2 карбоновой кислоты (полученной, как в примере 1) в 2,5 мл безводного дихлорметана обрабатывали 52,9 мкл (0,606 ммоль) оксалилхлорида с применением осушительного патрона с CaSO4, а затем 10 мкл безводного ДМФА. Раствор перемешивали в течение 25 мин и быстро концентрировали в вакууме при 2025 С. Полученный 5-цианофуран-2-карбонилхлорид помещали в глубокий вакуум на 2-3 мин, а затем немедленно помещали в атмосферу аргона, охлаждали до 0 С на бане со льдом, обрабатывали раствором полученного ранее анилина, а затем 141 мкл (0,808 ммоль) N,N-диизопропилэтиламина (ДИЭА). После перемешивания в течение 30 мин при комнатной температуре смесь концентрировали в вакууме и подвергали полученный остаток хроматографии на колонке для ТФЭ (20 г силикагеля), элюируя 2-10%EtOH-дихлорметаном, с получением смолы желтого цвета (которую кристаллизовали из EtOAc/гексана) с получением 17,2 мг (13%) чистого указанного в заголовке соединения в виде твердого вещества желтого цвета наряду с 70,3 мг указанного в заголовке соединения, содержащими примеси. Содержащую примеси фракцию растворяли в 50 мл EtOAc, промывали насыщенным водным NaHCO3/1 М K2CO3 (1/1,220 мл) и солевым раствором (20 мл), сушили (Na2SO4) и концентрировали с получением дополнительно 43,4 мг (32%) указанного в заголовке соединения в виде кристаллического твердого вещества желтого цвета (общий выход 45%). 1 Н-ЯМР (CDCl3, 400 МГц):8,32 (д, 1 Н, J=9,0 Гц), 7,73 (ушир с, 1 Н), 7,34-7,54 (м, 3 Н), 7,25 (д, 1 Н,J=7,7 Гц), 7,12, 7,14 (АВ кв, 2 Н, J=3,7 Гц), 7,01 (дд, 1 Н, J=9,0, 2,8 Гц), 3,25-3,27 (м, 4 Н), 2,59-2,62 (м, 4 Н),2,38 (с, 3 Н) и 2,15 (с, 3 Н). Масс-спектр (ESI, m/z), рассчитанный для C21H24N4O3, 401,2 (М+Н), обнаружено 401,1. Пример 10. [2'-Фтор-5-(4-метилпиперазин-1-ил)бифенил-2-ил]амид 5-цианофуран-2-карбоновой кислоты.- 21013250 Следовали методике, описанной на стадии (b) примера 9, используя 75,0 мг (0,250 ммоль) 1-(3 бром-4-нитрофенил)-4-метилпиперазина (полученного, как на стадии (а) примера 9), 136 мг (0,999 ммоль) 2-фторфенилбороновой кислоты, 26,8 мг (0,0232 ммоль) тетракис(трифенилфосфин)палладия(0) и 400 мкл (0,799 ммоль) 2,0 М водного Na2CO3 в DME за исключением того, что смесь нагревали в течение 22 ч. Хроматографией на колонке для ТФЭ (5 г силикагеля), элюируя 1-5% МеОН в дихлорметане/гексане (1/1), получали 95,0 мг указанного в заголовке соединения (чистота 76% по оценке по методу 1 Н-ЯМР, в виде смеси с трифенилфосфином) в виде смолы желтого цвета, которую использовали в последующей реакции без дополнительной очистки. Масс-спектр (ESI, m/z), рассчитанный для C17H18FN3O3, 316,1 (М+Н), обнаружено 316,2. Следовали методике, описанной на стадии (с) примера 9, используя 93,2 мг (0,225 ммоль на основании чистоты 76%) 1-(2'-фтор-6-нитробифенил-3-ил)-4-метилпиперазина (полученного, как на предыдущей стадии), 46 мг 10% палладированного угля, 37,0 мг (0,270 ммоль) 5-цианофуран-2-карбоновой кислоты (полученной, как в примере 1), 35,3 мкл (0,405 ммоль) оксалилхлорида, 5,0 мкл безводного ДМФА и 94,1 мкл (0,540 ммоль) ДИЭА. Хроматографией на колонке для ТФЭ (5 г силикагеля), элюируя 1-4% МеОН/дихлорметаном, получали 69,8 мг (77%) указанного в заголовке соединения в виде смолы желтого цвета. 1 Н-ЯМР (CDCl3; 400 МГц):8,04 (д, 1 Н, J=9,0 Гц), 7,93 (ушир с, 1 Н), 7,434-7,48 (м, 1 Н), 7,37 (тд,1 Н, J=7,5, 1,8 Гц), 7,22-7,31 (м, 2 Н), 7,13, 7,18 (АВ кв, 2 Н, J=3,7 Гц), 7,02 (дд, 1 Н, J=9,0, 2,9 Гц), 6,88 (д,1 Н, J=2,9 Гц), 3,24-3,27 (м, 4 Н), 2,57-2,60 (м, 4 Н) и 2,36 (с, 3 Н). Масс-спектр (ESI, m/z), рассчитанный для Смесь 102 мг (0,340 ммоль) 1-(3-бром-4-нитрофенил)-4-метилпиперазина (полученного, как на стадии (а) примера 9), 59,7 мг (0,474 ммоль) циклогексен-1-илбороновой кислоты, 43,8 мг (0,0379 ммоль) тетракис(трифенилфосфин)палладия(0) в атмосфере аргона обрабатывали 206 мкл (0,412 ммоль) 2,0 М дегазированным водным Na2CO3, 0,6 мл дегазированного безводного толуола и 0,2 мл дегазированного безводного EtOH, и нагревали смесь при 100 С в течение 21 ч. После охлаждения до комнатной температуры смесь вливали в EtOAc (10 мл), промывали солевым раствором (10 мл), сушили (Na2SO4) и концентрировали в вакууме. Хроматографией на колонке для ТФЭ (5 г силикагеля), элюируя 1-3% EtOH в дихлорметане, получали 126 мг указанного в заголовке соединения (чистота 74% по оценке по методу ОФВЭЖХ (колонка С 18), в виде смеси с трифенилфосфином) в виде масла желтого цвета, которое использовали в последующей реакции без дополнительной очистки. Масс-спектр (ESI, m/z), рассчитанный для К 122 мг (0,299 ммоль на основании чистоты 74%) 1-(3-циклогекс-1-енил-4-нитрофенил)-4 метилпиперазина (полученного, как на предыдущей стадии) в 5,0 мл EtOH/вода (2/1) добавляли 83,8 мгTHF (4,0 мл). Раствор полученного анилина помещали в атмосферу аргона и сразу использовали в последующей реакции. 61,6 мг (0,449 ммоль) 5-цианофуран-2-карбоновой кислоты (полученной, как в примере 1) в 2,5 мл безводного дихлорметана обрабатывали 60,0 мкл (0,688 ммоль) оксалилхлорида с применеием осушительного патрона с CaSO4, а затем 10 мкл безводного ДМФА. Раствор перемешивали в течение 25 мин и быстро концентрировали в вакууме при 20-25 С. Остаток помещали в глубокий вакуум на 2-3 мин, затем немедленно помещали в атмосферу аргона, охлаждали до 0 С на бане со льдом, и обрабатывали раствор полученного ранее анилина 104 мкл (0,598 ммоль) ДИЭА. После перемешивания в течение 30 мин при комнатной температуре смесь концентрировали в вакууме, растворяли в EtOAc (20 мл), промывали 1 МK2CO3 (210 мл) и солевым раствором (10 мл), сушили (Na2SO4) и концентрировали в вакууме. Проводили хроматографию полученного остатка на колонке для ТФЭ (10 г силикагеля), элюируя 1-4% МеОН/дихлорметаном, с получением смолы желтого цвета, которую затем кристаллизовали изEt2O/гексана с получением 84,7 мг (72%) указанного в заголовке соединения в виде кристаллического твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3 400 МГц):8,57 (ушир с, 1 Н), 8,26 (д, 1 Н, J=9,0 Гц), 7,20, 7,23 (АВ кв, 2 Н, J=3,7 Гц), 6,86 (дд, 1 Н, J=9,0, 2,9 Гц), 6,74 (д, 1 Н, J=2,9 Гц), 5,84-5,85 (м, 1 Н), 3,20-3,22 (м, 4 Н), 2,57-2,59 (м,4 Н), 2,36 (с, 3 Н), 2,23-2,30 (м, 4 Н) и 1,79-1,84 (м, 4 Н). Масс-спектр (ESI, m/z), рассчитанный для 1-(3-Бром-4-нитрофенил)-4-метилпиперазин (полученный, как на стадии (а) примера 9) (225,1 мг,0,79 ммоль), K2CO3 (310,9 мг, 2,25 ммоль) и 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6 дигидро-2 Н-пиран (Murata, M., et al., Synthesis, 778, (2000 (157 мг, 0,75 ммоль) в диоксане (5 мл) нагревали при 80 С в течение ночи в атмосфере аргона. Реакционную смесь оставляли охлаждаться до комнатной температуры, концентрировали и подвергали послученный остаток хроматографии на силикагеле 1-[3-(3,6-Дигидро-2 Н-пиран-4-ил)-4-нитрофенил]-4-метилпиперазин (полученный, как на предыдущей стадии) (80 мг, 0,26 ммоль) преобразовывали в соответствующий амин с использованием методики,сходной с описанной на стадии (d) примера 4, и проводили сочетание с 5-цианофуран-2 карбонилхлоридом (полученным, как на стадии (с) примера 9, из 137 мг (1,00 ммоль) 5-цианофуран-2 какрбоновой кислоты, полученной, как в примере 1) в CH2Cl2 (2 мл) при 0 С. Продукт выделяли флэшхроматографией на силикагеле (элюируя 50% EtOAc/гексаном-10% MeOH/EtOAc) с получением указанного в заголовке соединения (62,2 мг, 60%). 1 Н-ЯМР (CDCl3, 400 МГц):8,35 (ушир с, 1 Н), 8,12 (д, 1 Н каждый, J=8,76 Гц), 7,24 (д, 1 Н, J=5,08 Гц), 7,19 (д, 1 Н, J=5,08 Гц), 6,88 (дд, 1 Н, J=8,76, 2,7 Гц), 6,73 (д, 1 Н, J=2,7 Гц), 5,88 (ушир с, 1 Н), 4,34 (м,2 Н), 3,94 (т, 2 Н, J=5,3 Гц), 3,23 (м, 4 Н), 2,59 (м, 4 Н), 2,38 (ушир с, 5 Н). LC-MC (ESI, m/z), рассчитанный для C22H24N4O3, 393,1 (М+Н), обнаружено 393,2. Пример 13. Трифторуксуснокислая соль (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4 циано-1 Н-пиррол-2-карбоновой кислоты. Указанное в заголовке соединение получали по методу сочетания Сузуки 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фениламина со сложным трет-бутиловым эфиром 4-трифторметансульфонилокси-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты (Synthesis, 993, (1991 по методике,описанной на стадии (b) примера 35. Масс-спектр (ESI, м/z), рассчитанный для C16H22N2O2, 275,2 (М+Н),обнаружено 275,1. Раствор сложного трет-бутилового эфира 4-(4-аминофенил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты (0,35 г, 1,2 ммоль) (полученного, как на предыдущей стадии) в метаноле гидрировали над 10%Pd/C при давлении 20 фунтов/кв. дюйм в течение 1 ч. Раствор фильтровали и концентрировали с получением 0,35 г (100%) указанного в заголовке соединения в виде твердого вещества желтого цвета. Массспектр (ESI, M/Z), рассчитанный для C16H24N2O2, 277,2 (М+Н), обнаружено 277,1. с) Сложный трет-бутиловый эфир 4-(4-амино-3-бромфенил)пиперидин-1-карбоновой кислоты.(0,20 г, 0,71 ммоль) (полученного, как на предыдущей стадии) в DCM (3 мл) добавляли Nбромсукцинимид (NBS) (0,13 г, 0,71 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 10 ч. Реакционную смесь разбавляли EtOAc (10 мл) и промывали NaHCO3 (210 мл) и солевым раствором (10 мл). Органический слой концентрировали с получением 0,26 г (100%) указанного в заголовке соединения в виде пены желтого цвета. Масс-спектр (ESI, m/z), рассчитанный для В колбу загружали сложный трет-бутиловый эфир 4-(4-амино-3-бромфенил)пиперидин-1 карбоновой кислоты (0,13 г, 0,36 ммоль) (полученный, как на предыдущей стадии), циклогекс-1 енилбороновую кислоту (0,060 г, 0,48 ммоль), Pd(PPh3)4 (0,04 г, 10 мол.%), 2 М водный Na2CO3 (1,5 мл),этанол (1,5 мл) и толуол (3 мл) и нагревали при 80 С в течение 3 ч. Реакционную смесь разбавлялиEtOAc (10 мл), промывали NaHCO3 (210 мл) и солевым раствором (10 мл), органический слой сушили над Na2SO4, а затем концентрировали. Указанное в заголовке соединение элюировали с картриджа для ТФЭ (20 г силикагеля) 30% EtOAc/гексаном с получением 0,10 г (85%) указанного в заголовке соединения в виде масла желтого цвета. Масс-спектр (ESI, m/z), рассчитанный для C22H32N2O2, 357,2 (М+Н), обнаружено 357,1. е) Трифторуксуснокислая соль (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1 Нпиррол-2-карбоновой кислоты. В колбу загружали сложный трет-бутиловый эфир 4-(4-амино-3-циклогекс-1-енилфенил)пиперидин-1-карбоновой кислоты (0,050 г, 0,14 ммоль; полученный, как на предыдущей стадии), 4-циано-1 Нпиррол-2-карбоновую кислоту (0,019 г, 0,14 ммоль; полученную как в примере 2), EDCI (0,040 г, 0,21 ммоль), HOBt (0,019 г, 0,14 ммоль), ДИЭА (0,073 мл, 0,42 ммоль) и DCM (0,5 мл) и перемешивали при 25 С в течение 10 ч. Реакционную смесь наносили непосредственно на картридж для твердофазной экстракции (ТФЭ) (10 г силикагеля) и элюировали полученный промежуточный продукт 30%EtOAc/гексаном. Это соединение перемешивали при комнатной температуре в течение 1 ч в 50%TFA/DCM (2 мл), а затем концентрировали и очищали по методу ОФ-ВЭЖХ (С 18), элюируя 30-50% К раствору калиевой соли 4-циано-1-(2-триметилсиланилэтоксиметил)-1 Н-имидазол-2-карбоксилата (3,34 г, 10,9 ммоль; полученной, как на стадии (d) примера 3) в 20 мл DCM добавляли ДИЭА (3,8 мл, 21,8 ммоль) и PyBroP (5,6 г, 12,0 ммоль) и перемешивали реакционную смесь при 25 С в течение 15 мин. Добавляли раствор сложного трет-бутилового эфира 4-(4-амино-3-циклогекс-1-енилфенил)пиперидин-1-карбоновой кислоты (3,9 г, 10,9 ммоль; полученного, как на стадии (d) примера 13) в 10 мл DCM и перемешивали реакционную смесь в течение 8 ч при 25 С. Реакционную смесь разбавляли EtOAc (60 мл) и промывали NaHCO3 (260 мл) и солевым раствором (100 мл), органический слой сушили над Na2SO4, а затем концентрировали. Указанное в заголовке соединение очищали флэш-хроматографией на силикагеле (элюируя 2% EtOAc/DCM) с получением 5,5 г (85%) указанного в заголовке соединения в виде масла желтого цвета. Масс-спектр (ESI, m/z), рассчитанный для C33H47N5O4Si, 606,2 (М+Н), обнаружено 606,2.b) Трифторуксуснокислая соль (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1 Нимидазол-2-карбоновой кислоты. К раствору сложного трет-бутилового эфира 4-(4-[4-циано-1-(2-триметилсиланилэтоксиметил)-1 Нимидазол-2-карбонил]амино-3-циклогекс-1-енилфенил)пиперидин-1-карбоновой кислоты (1,5 г, 2,5 ммоль; полученного на предыдущей стадии) в 10 мл DCM и 0,3 мл EtOH добавляли 3 мл TFA и перемешивали раствор в течение 3 ч при 25 С. Реакционную смесь разбавляли 5 мл EtOH, a затем концентрировали. Остаток кристаллизовали из метанола и этилового эфира с получением 0,85 г (70%) указанного в заголовке соединения в виде твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, CD3OD):8,18 (д, 1 Н), 8,04 (с, 1 Н), 7,22 (дд, 1 Н), 7,12 (д, 1 Н), 5,76 (м, 1 Н), 3,54 Указанное в заголовке соединение получали из трифторуксуснокислой соли (2-циклогекс-1-енил-4 пиперидин-4-илфенил)амида 4-циано-1 Н-пиррол-2-карбоновой кислоты (полученной, как на стадии (е) примера 13) по методике, описанной в примере 37. 1 Указанное в заголовке соединение получали из трифторуксуснокислой соли (2-циклогекс-1-енил-4- 26013250 пиперидин-4-илфенил)амида 4-циано-1 Н-имидазол-2-карбоновой кислоты (полученной, как на стадии (b) примера 13) по методике, описанной в примере 37. 1 Указанное в заголовке соединение получали из калиевой соли 4-циано-1-(2 триметилсиланилэтоксиметил)-1 Н-имидазол-2-карбоксилата (полученного, как на стадии (d) примера 3) и сложного трет-бутилового эфира 4-[4-амино-3-(4-метилциклогекс-1-енил)фенил]пиперидин-1 карбоновой кислоты (полученного по методике, описанной на стадии (d) примера 13; заменяя циклогекс 1-енилбороновую кислоту 4-метил-1-циклогекс-1-енилбороновой кислотой) по методике, описанной в примере 14. 1 Н-ЯМР (400 МГц, CD3OD):8,18 (д, 1 Н), 8,04 (с, 1 Н), 7,22 (дд, 1 Н), 7,12 (д, 1 Н), 5,80 (м, 1 Н), 3,54,(м, 2 Н), 3,18 (м, 2 Н), 2,94 (м, 1 Н), 2,30 (м, 3 Н), 2,12 (м, 2 Н), 1,92 (м, 5 Н), 1,54 (м, 1 Н), 1,12 (д, 3 Н). Массспектр (ESI, m/z), рассчитанный для C23H27N5O, 390,2 (М+Н), обнаружено 390,2. Пример 18. Трифторуксуснокислая соль (2-циклопент-1-енил-4-пиперидин-4-илфенил)амида 4 циано-1 Н-имидазол-2-карбоновой кислоты. Указанное в заголовке соединение получали из калиевой соли 4-циано-1-(2-триметилсиланилэтоксиметил)-1 Н-имидазол-2-карбоксилата (полученной, как на стадии(d) примера 3) и сложного трет-бутилового эфира 4-(4-амино-3-циклопент-1-енилфенил)пиперидин-1-карбоновой кислоты (полученной по методике, описанной на стадии (d) примера 13; заменяя циклогекс-1-енилбороновую кислоту циклопент-1-илбороновой кислотой) по методике, описанной в примере 14. 1 Н-ЯМР (400 МГц, ДМСО-d6):14,25 (ушир с, 1 Н), 10,00 (с, 1 Н), 8,36 (с, 1 Н), 7,72 (д, 1 Н), 7,18 (м,2 Н), 6,06 (с, 1 Н), 4,12 (м, 1 Н), 3,42 (м, 2 Н), 3,18 (м, 2 Н), 3,00 (м, 3 Н), 2,80 (м, 2 Н), 1,92 (м, 5 Н). Массспектр (ESI, m/z), рассчитанный для C21H23N5O, 362,2 (М+Н), обнаружено 362,2. Пример 19. Ниже представлен альтернативный способ синтеза промежуточного продукта, описанного в примере 1. 5-Цианофуран-2-карбоновая кислота. В трехгорлую круглодонную колбу емкостью 250 мл, оснащенную механической мешалкой, колбонагревателем и холодильником, загружали 5-формил-2-фуранкарбоновую кислоту (9,18 г, 65,6 ммоль) и пиридин (60 мл). Добавляли гидрохлорид гидроксиламина (5,01 г, 72,2 ммоль) и нагревали смесь до 85 С. Добавляли уксусный ангидрид (40 мл) и перемешивали реакционную смесь при 85 С в течение 3 ч,после чего растворитель выпаривали при 40 С при пониженном давлении. Остаток растворяли в воде,подщелачивали добавлением 2,0 н. раствора NaOH до рН 9 и экстрагировали дихлорметаном/2 пропанолом (4/1) до полного удаления пиридина (5200 мл). Водный раствор затем подкисляли добавлением 2,0 н. раствора HCl до рН 2, насыщали твердым NaCl и экстрагировали дихлорметаном/2 пропанолом (4/1, 5200 мл). Объединенные органические экстракты сушили над Na2SO4 и концентрировали в вакууме досуха. Остаток кристаллизовали из дихлорметана с получением 6,80 г указанного в заголовке соединения в виде твердого вещества белого цвета (76%). Масс-спектр (ESI-neg, m/z), рассчитанный для C6H3NO3, 136,0 (М-Н), обнаружено 136,1. В колбу загружали метансульфонилуксусную кислоту (14 мг, 0,10 ммоль), EDCI (30 мг, 0,15 ммоль), HOBt (14 мг, 0,10 ммоль), ДИЭА (36 мкл, 0,20 ммоль) и 0,5 мл DCM и перемешивали при 25 С. Через 10 мин добавляли раствор, содержащий TFA-соль (2-циклогекс-1-енил-4-пиперидин-4 илфенил)амида 4-циано-1 Н-имидазол-2-карбоновой кислоты (40 мг, 0,08 ммоль) (полученную, как на стадии (b) примера 20) и NEt3 (14 мкл, 0,09 ммоль) в 0,5 мл DCM и оставляли реакционную смесь взаимодействовать в течение 10 ч при 25 С. Реакционную смесь наносили на картридж для ТФЭ (5 г силикагеля) и элюировали указанное в заголовке соединение 10% EtOH/EtOAc с получением 10 мг (25%) твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, CDCl3):11,60 (ушир с, 1 Н), 9,52 (с, 1 Н), 8,30 (д, 1 Н), 7,74 (с, 1 Н), 7,60 (дд, 1 Н),7,03 (д, 1 Н), 5,86 (м, 1 Н), 4,84 (м,1 Н), 4,18 (с, 2 Н), 4,12 (м, 1 Н), 3,32 (м, 1 Н), 3,20 (с, 3 Н) , 2,82 (м, 2 Н),2,30 (м, 4 Н), 1,98 (м, 2 Н), 1,84 (м, 5 Н), 1,72 (м, 1 Н). Масс-спектр (ESI, m/z), рассчитанный для В колбу загружали TFA-соль (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1 Нимидазол-2-карбоновой кислоты (88 мг, 0,18 ммоль) (полученную, как на стадии (b) примера 14), пиридин-2-карбальдегид (17 мкл, 0,21 ммоль), NEt3 (30 мкл, 0,21 ммоль), триацетоксиборгидрид натрия (56 мг, 0,25 ммоль) и 0,8 мл 1,2-дихлорэтана и перемешивали в течение 10 ч при 25 С. Растворитель выпаривали и очищали указанное в заголовке соединение по методу ОФ-ВЭЖХ (С 18), элюируя 30-50% CH3CN в 0,1% TFA/H2O в течение 20 мин, с получением 81 мг (78%) твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, ДМСО-d6):14,25 (ушир с, 1 Н), 9,90 (ушир с, 1 Н), 9,79 (с, 1 Н), 8,72 (с, 1 Н), 8,36 Указанное соединение получали по методике, описанной в примере 21, из [2-(4-метилциклогекс-1 енил)-4-пиперидин-4-илфенил]амида 4-циано-1 Н-имидазол-2-карбоновой кислоты (полученного, как в примере 17) и пиридин-2-карбальдегида. 1 Н-ЯМР (400 МГц, ДМСО-d6):14,25 (ушир с, 1 Н), 9,90 (ушир с, 1 Н), 9,79 (с, 1 Н), 8,72 (с, 1 Н), 8,36 Указанное соединение получали из TFA-соли (2-циклопент-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1 Н-имидазол-2-карбоновой кислоты (полученной, как в примере 18) и 1-метил-1 Н-имидазол-2 карбальдегида по методике, описанной в примере 21. 1 Н-ЯМР (400 МГц, CD3OD):8,03 (м, 2 Н), 7,50 (д, 1 Н), 7,42 (с, 1 Н), 7,20 (м, 2 Н), 6,02 (м, 1 Н), 4,22 В колбу загружали TFA-соль (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1 Нимидазол-2-карбоновой кислоты (51 мг, 0,10 ммоль) (полученной, как на стадии (b) примера 14), NEt3 (22 мкл, 0,15 ммоль), триметилсилилизоцианат (16 мкл, 0,11 ммоль) и 1,0 мл DCM и перемешивали в течение 10 ч при 25 С. Растворитель выпаривали и очищали указанное в заголовке соединение по методу ОФ-ВЭЖХ (С 18), элюируя 35-60% CH3CN в 0,1% TFA/H2O в течение 11 мин, с получением 30 мг (70%) твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, ДМСО-d6):14,28 (ушир с, 1 Н), 9,76 (с, 1 Н), 8,34 (с, 1 Н), 7,84 (д, 1 Н), 7,18 (дд,1 Н), 7,08 (д, 1 Н), 6,00 (ушир с, 2 Н), 5,72 (м, 1 Н), 4,18 (м, 2 Н), 2,80-2,60 (м, 3 Н), 2,24-2,10 (м, 4 Н), 1,801,60 (м, 6 Н), 1,50 (м, 2 Н). Масс-спектр (ESI, m/z), рассчитанный для C23H26N6O, 419,2 (М+Н), обнаружено 419,0. Пример 25. Трифторуксуснокислая соль [2-циклогекс-1-енил-4-(3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)фенил]амида 4-циано-1 Н-имидазол-2-карбоновой кислоты. В колбу загружали TFA-соль (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1 Нимидазол-2-карбоновой кислоты (75 мг, 0,15 ммоль) (полученной, как на стадии (b) примера 14), K2CO3(84 мг, 0,60 ммоль), 2-фторпиридин (27 мкл, 0,30 ммоль) и 0,3 мл N,N-диметилацетамида и перемешивали в течение 8 ч при 120 С. Реакционную смесь разбавляли 3 мл H2O и очищали указанное в заголовке соединение по методу ОФ-ВЭЖХ (С 18), элюируя 30-50% CH3CN в 0,1% TFA/H2O в течение 9 мин, с получением 50 мг (75%) твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, CD3OD):8,18 (д, 1 Н), 8,06 (м, 1 Н), 8,02 (с, 1 Н), 7,94 (дд, 1 Н), 7,48 (д, 2 Н), 7,22 Указанное в заголовке соединение получали из TFA-соли (2-циклогекс-1-енил-4-пиперидин-4 илфенил)амида 4-циано-1 Н-имидазол-2-карбоновой кислоты (полученной, как на стадии (b) примера 14) и гидроксиацетальдегида по методике, описанной в примере 21. 1 Н-ЯМР (400 МГц, CD3OD):8,18 (д, 1 Н), 8,02 (с, 1 Н), 7,22 (дд, 1 Н), 7,14 (д, 2 Н), 5,82 (м, 1 Н), 3,94 В колбу загружали TFA-соль (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1 Нимидазол-2-карбоновой кислоты (77 мг, 0,16 ммоль) (полученнуюй, как на стадии (b) примера 14), NEt3(24 мкл, 0,16 ммоль), акрилонитрил (12 мкл, 0,18 ммоль), 0,1 мл МеОН и 1,0 мл 1,2-дихлорэтана и перемешивали в течение 1 ч при 80 С. Реакционную смесь концентрировали, и очищали указанное в заголовке соединение по методу ОФ-ВЭЖХ (С 18), элюируя 30-50% CH3CN в 0,1% TFA/H2O в течение 12 мин, с получением 83 мг (95%) твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, CD3OD):8,18 (д, 1 Н), 8,06 (м, 1 Н), 7,22 (дд, 1 Н), 7,12 (д, 1 Н), 5,82 (м, 1 Н), 3,76 В колбу загружали TFA-соль (2-циклогекс-1-енил-4-пиперидин-4-илфенил)амида 4-циано-1 Нимидазол-2-карбоновой кислоты (50 мг, 0,10 ммоль) (полученную, как на стадии (b) примера 14), NEt3(32 мкл, 0,23 ммоль), 2-бромацетамид (16 мг, 0,12 ммоль) и 0,5 мл DCM и перемешивали в течение 4 ч при 25 С. Реакционную смесь концентрировали и очищали указанное в заголовке соединение по методу ОФ-ВЭЖХ (С 18), элюируя 30-50% CH3CN в 0,1% TFA/H2O в течение 12 мин, с получением 42 мг (75%) твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, ДМСО-d6):14,28 (ушир с, 1 Н), 9,78 (с, 1 Н), 9,50 (ушир с, 1 Н), 8,34 (с, 1 Н), 8,00
МПК / Метки
МПК: A61K 31/4439
Метки: ингибиторы, киназы
Код ссылки
<a href="https://eas.patents.su/30-13250-ingibitory-c-fms-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы c – fms киназы</a>
Предыдущий патент: Производные тиазола
Следующий патент: Белки, содержащие домены vwfa и/или ant_ig
Случайный патент: Способ бурения или заканчивания буровой скважины












