Спироимидазолиновые соединения, способ их получения и фармацевтическая композиция, содержащая их
Номер патента: 2979
Опубликовано: 26.12.2002
Авторы: Ньюмен-Танкреди Адриан, Брокко Морисетт, Корди Алекс, Миллан Марк
Формула / Реферат
1. Спироимидазолиновые соединения формулы (I)
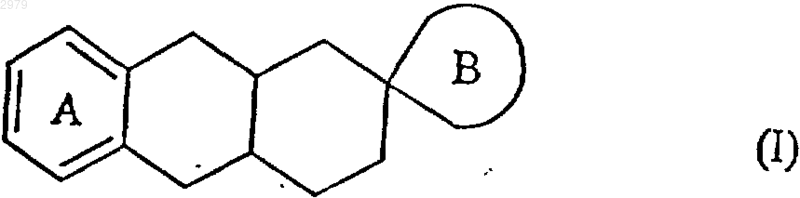
в которой
А представляет бензольное кольцо, незамещенное или замещенное 1-4 одинаковыми или различными группами, выбранными из линейного или разветвленного (С1-С6)алкила, линейного или разветвленного (С1-С6)алкокси, гидрокси, полигалоген-(С1-С6)алкила, в котором алкильный фрагмент является линейным или разветвленным, и галогена,
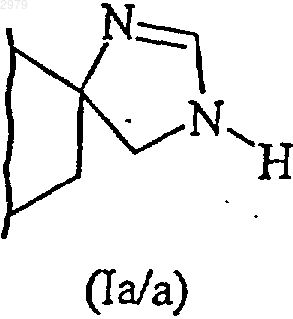
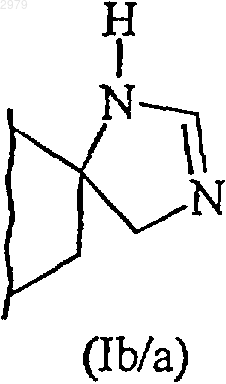
В представляет имидазолиновое кольцо, как представлено в формулах (Iа) и (Ib)
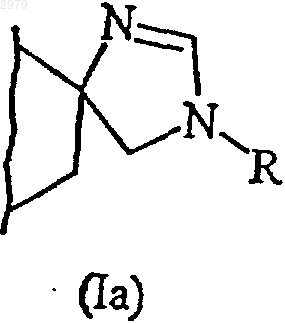

где R представляет атом водорода,
их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
2. Соединения формулы (I) по п.1, в которых В представляет кольцо формулы (Iа), их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
3. Соединения формулы (I) по п.1, в которых кольцо А является незамещенным, их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
4. Соединения формулы (I) по п.1, в которых кольцо А замещено 1-4 одинаковыми или различными группами, выбранными из линейного или разветвленного (С1-С6)алкила, линейного или разветвленного (С1-С6)алкокси, гидрокси, полигалоген-(С1-С6)алкила, в котором алкильный фрагмент является линейным или разветвленным, и галогена, их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
5. Соединения формулы (I) по п.1, имеющие транссоединение колец, их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
6. Соединение формулы (I) по п.1, представляющее спиро[(1,3-диазациклопент-1-ен)-5:2'-(транс-1',2',3',4',4'а,9',9'а,10'-октагидроантрацен)], его таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
7. Соединение формулы (I) по п.1, состоящее из смеси спиро[(1,3-диазациклопент-1-ен)-5:2'(S)-(транс-1',2',3',4',4'а(R),9',9'а(S),10'-октагидроантрацена)] и спиро[(1,3-диазациклопент-1-ен)-5:2'(R)-(транс-1',2',3',4',4'a(S),9',9'a(R),10'-октагидроантрацeнa)], его таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
8. Соединение формулы (I) по п.1, состоящее из смеси спиро[(1,3-диазациклопент-1-ен)-5:2'(S)-(транс-1',2',3',4',4'а(S),9',9'а(R),10'-октагидроантрацена)] и спиро[(1,3-диазациклопент-1-ен)-5:2'(R)-(транс-1',2',3',4',4'а(R),9',9'а(S),10'-октагидроантрацена)], его таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
9. Способ получения соединений формулы (I) по п.1, отличающийся тем, что используют в качестве исходного вещества соединение формулы (II)
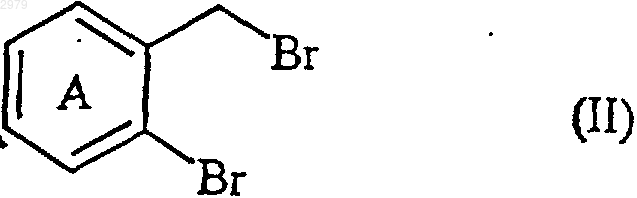
в которой А имеет значения, определенные ранее,
которое конденсируют с енолятом моноэтиленацеталя 1,4-циклогександиона с получением соединения формулы (III)
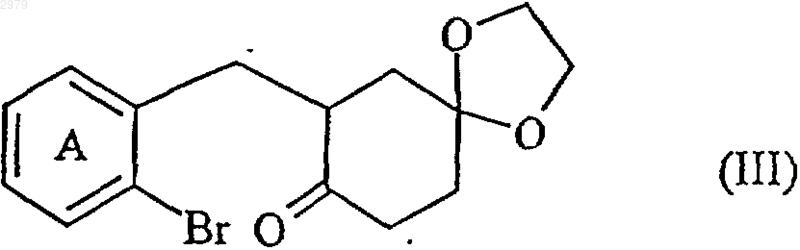
в которой А имеет значения, определенные ранее,
которое подвергают действию иодида метил(трифенил)фосфония с получением соединения формулы (IV)
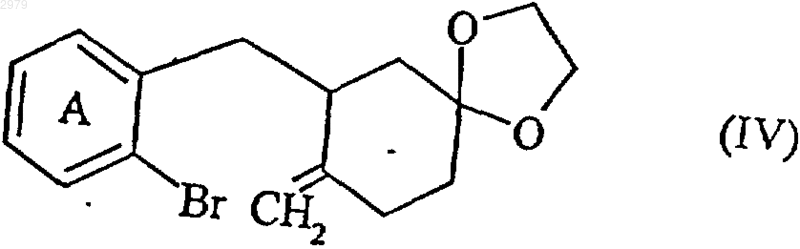
в которой А имеет значения, определенные ранее,
которое циклизуют в присутствии гидрида трибутилолова и АИБН с получением соединения формулы (V)
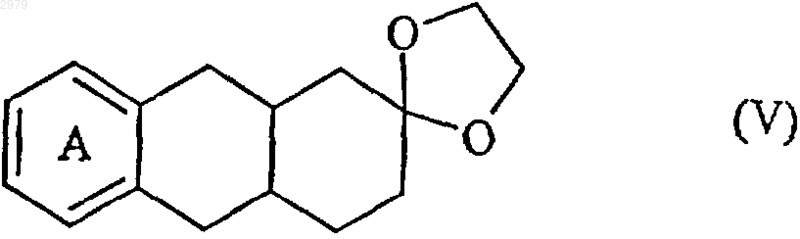
в которой А имеет значения, определенные ранее,
которое подвергают последовательно действию кислой среды с последующей реакцией Штрекера с получением соединения формулы (VI)
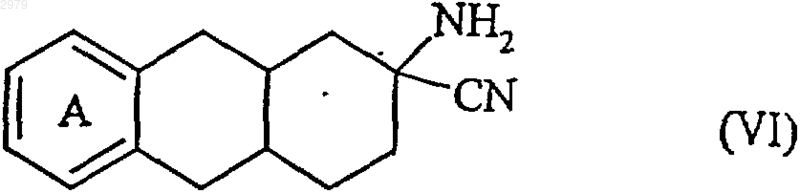
в которой А имеет значения, определенные ранее,
которое подвергают действию восстанавливающего агента, такого, например, как LiAlH4, с получением соединения формулы (VII)
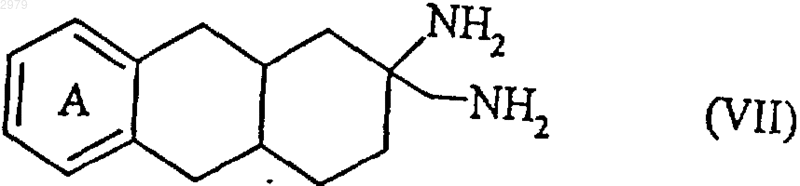
в которой А имеет значения, определенные ранее,
которое подвергают взаимодействию с ацетатом формамидина с получением соединения формулы (I/a), соответствующего соединениям формулы (I)
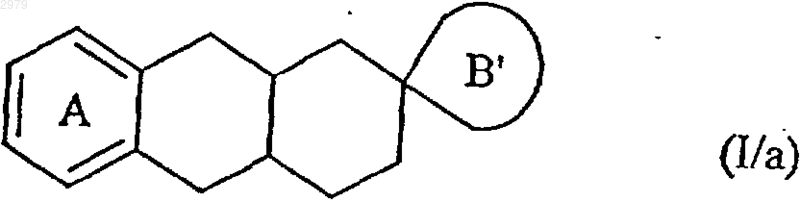
в которой А имеет значения, определенные ранее, и В' представляет незамещенное имидазолиновое кольцо, как представлено в формулах (Ia/a) и (Ib/a)
и которые далее могут быть очищены в соответствии с обычными приемами в процессе выделения, и при желании превращены в аддитивные соли с фармацевтически приемлемой кислотой или основанием с последующим, при необходимости, разделением на изомеры с помощью обычных приемов разделения.
10. Фармацевтическая композиция, включающая в качестве активного ингредиента, по крайней мере, одно из соединений формулы (I) по любому из пп.1-8 или их аддитивную соль с фармацевтически приемлемой кислотой или основанием в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
11. Применение фармацевтической композиции по п.9 для использования при получении лекарственного средства для лечения депрессии, ожирения, приступов страха, тревожных состояний, обсессивно-компульсивных расстройств, нарушений познания, фобий, импульсивных болезненных состояний, связанных со злоупотреблением лекарственными препаратами и отменой их применения, сексуальных расстройств и болезни Паркинсона.
Текст
1 Настоящее изобретение относится к новым спироимидазолиновым соединениям, к содержащим их фармацевтическим композициям и к их применению в качестве 2-адренергических антагонистов и блокаторов обратного захвата моноамина. Адренергическая нервная система играет важную роль на многих уровнях, например, на артериальном, венозном, сердечном и почечном уровнях и на уровне центральной и периферической автономных нервных систем. Следовательно, соединения, способные к взаимодействию с адренергическими рецепторами, могут индуцировать большое число физиологических ответных реакций (кратко, ответов), таких как вазоконстрикция (сужение кровеносных сосудов), вазодиляция (расширение кровеносных сосудов), увеличение или снижение сердечного ритма, изменение силы сокращений сердечной мышцы и изменение метаболической активности. Различные адренергические соединения в прошлом использовались для модификации этих или других физиологических ответов. Спироимидазолиновые соединения, полезные в качестве 1-или 2-адренергических агонистов или частичных агонистов, известны из предшествующего уровня техники (ЕР 635495,ЕР 635496, ЕР 635497). В дополнение к тому, что описанные в настоящем изобретении соединения являются новыми,они обладают профилем 2 адренергического антагониста и блокатора моноаминового обратного захвата, что делает их полезными при лечении депрессии (Drug NewsPerspectives, 4(4), 1991). Главная проблема,стоящая перед антидепрессантами, заключается в том, что им требуется длительное время, чтобы стать эффективными, что связано с их конкретным способом действия. Исследования показали, что объединение 2-адренергического антагониста с ингибитором обратного захвата моноамина (серотонина и/или норадреналина) дает возможность снизить длительность этого промежутка времениPsychopharmacol., 4, стр. 95-100, 1980). Сочетание этих двух действий в одном соединении может привести к новому поколению намного более эффективных антидепрессантов. Среди этих соединений напамезол (патент США 5017584) описан, как обладающий как активностью 2-адренергического антагониста, так и активностью блокирования обратного захвата моноамина. Соединения согласно настоящему изобретению, которые имеют новую структуру, обладают селективным профилем 2-адренергического антагониста и в то же самое время обладают способностью ингибировать обратный захват моноамина. Более конкретно, настоящее изобретение относится к соединениям формулы (I) в которой А представляет бензольное кольцо, незамещенное или замещенное 1-4 одинаковыми или различными группами, выбранными из линейного или разветвленного (C1-С 6)алкила, линейного или разветвленного (C1-C6)алкокси,гидрокси, полигалоген-(C1-С 6)алкила, в котором алкильный фрагмент является линейным или разветвленным, циано, нитро, амино, алкиламино, диалкиламино, тиоалкила, сульфонилалкила,сульфинилалкила, карбокси, алкоксикарбонила,алкилкарбонилокси, формила, карбамоила, карбоксамида, фенила, бензила и атомов галогена; В представляет имидазолиновое кольцо,как представлено в формулах (Iа) и (Ib): где R представляет атом водорода, линейную или разветвленную (C1-C6) алкильную группу или бензильную группу,подразумевается, что "алкил" обозначает линейную или разветвленную (C1-C6) алкильную группу,их таутомерам, энантиомерам и диастереоизомерам и их аддитивным солям с фармацевтически приемлемыми кислотой или основанием. Среди фармацевтически приемлемых кислот можно отметить в качестве неограничивающих примеров хлористо-водородную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту,трифторуксусную кислоту, молочную кислоту,пировиноградную кислоту, малоновую кислоту,янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, метансульфоновую кислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно отметить в качестве неограничивающих примеров гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными соединениями согласно изобретению являются те, в которых R представляет атом водорода. Преимущественно, изобретение относится к соединениям формулы (I), в которой В представляет кольцо формулы (Ia). 3 Предпочтительно, изобретение относится к соединениям формулы (I), в которой А является незамещенным. Когда кольцо А замещено 1-4 одинаковыми или различными группами, предпочтительными заместителями являются линейный или разветвленный (C1-C6)алкил, линейный или разветвленный (C1-C6)алкокси, гидрокси, полигалоген- (C1-С 6)алкил, в котором алкильный фрагмент является линейным или разветвленным, и атомы галогена. Изобретение преимущественным образом относится к соединениям формулы (I), имеющим транс-соединение колец. Еще более конкретно, изобретение относится к спиро[(1,3-диазациклопент-1-ен)-5:2'(транс-1',2',3',4',4'а,9',9'а,10'-октагидроантрацену)] и, предпочтительно, к смеси, образованной спиро[(1,3-диазациклопент-1-ен)-5:2'(S)-(транс 1',2',3',4',4'a(R),9',9'a(S),10'-октагидроантраценом)] и его энантиомером, и к смеси, образованной спиро[(1,3-диазациклопент-1-ен)-5:2'(S)-(транс 1',2',3',4',4'a(S),9',9'a(R),10'-октагидроантраценом)] и его энантиомером. Таутомеры, энантиомеры и диастереомеры и аддитивные соли предпочтительных соединений по изобретению с фармацевтически приемлемыми кислотой или основанием образуют неотъемлемую часть изобретения. Изобретение относится также к способу получения соединений формулы (1), отличающемуся тем, что используют в качестве исходного вещества соединение формулы (II) в которой А имеет значения, определенные ранее, которое конденсируют с енолятом моноэтиленацеталя 1,4-циклогександиона для получения соединения формулы (III) в которой А имеет значения, определенные ранее, которое подвергают действию иодида метил (трифенил)фосфония с получением соединения формулы (IV) в которой А имеет значения, определенные ранее, которое подвергают действию восстанавливающего агента, такого, например, как LiAlH4, с получением соединения формулы (VII) в которой А имеет значения, определенные ранее, которое подвергают взаимодействию с ацетатом формамидина с получением соединения формулы (I/a), частного случая соединений формулы (I) в которой А имеет значения, определенные ранее, и В' представляет незамещенное имидазолиновое кольцо, как представлено в формулах которые могут быть подвергнуты в присутствии основания действию соединения формулы (VIII)(VIII) в которой R' представляет линейную или разветвленную (C1-C6)алкильную группу или бензильную группу, и J представляет собой уходящую группу, такую как атом галогена или тозильная группа, с образованием соединения формулы (I/b), частного случая соединений формулы (I) в которой А имеет значения, определенные ранее, и В" представляет замещенное имидазолиновое кольцо, как представлено в формулах в которой А имеет значения, определенные ранее, которое циклизуют в присутствии гидрида трибутилолова и АИБН (азабисизобутиронитрил) с получением соединения формулы (V) в которой А имеет значения, определенные ранее, которое подвергают, последовательно, действию кислой среды с последующей реакцией в которой А имеет значения, определенные ранее, указанные соединения формул (I/a) и (I/b),составляют полную совокупность соединений 5 формулы (I) и могут быть очищены в соответствии с обычными способами выделения, при желании их превращают в аддитивные соли с фармацевтически приемлемой кислотой или основанием и разделяют, где это уместно, на изомеры обычными способами разделения. Соединения согласно изобретению и содержащие их фармацевтические композиции оказались полезными при лечении депрессии. Действительно, соединения согласно настоящему изобретению являются специфическими 2-адренергическими антагонистами, а также действуют как мощные ингибиторы обратного захвата серотонина и/или норадреналина. По существу, они могут терапевтически использоваться при лечении депрессии, ожирения, приступов страха, тревожных состояний,обсессивно-компульсивных расстройств (навязчивых состояний), нарушений познания, фобий,импульсивных болезненных состояний, связанных со злоупотреблением лекарственными препаратами и отменой их применения, сексуальных расстройств и болезни Паркинсона. Настоящее изобретение относится также к фармацевтическим композициям, содержащим,по крайней мере, одно соединение формулы (I) само по себе или в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами. Среди фармацевтических композиций согласно данному изобретению могут быть упомянуты более конкретно те, которые подходят для перорального, парентерального, назального,чрескожного, ректального, перлингвального,глазного или респираторного введения, и особенно таблетки или драже, сублингвальные таблетки, саше, пакеты, желатиновые капсулы,подъязычные таблетки, пастилки, суппозитории,кремы, мази, кожные гели и ампулы для питья или инъекций. Доза меняется в зависимости от пола, возраста и веса пациента, способа введения, характера терапевтического показания и любого, связанного с данным лечением, и колеблется от 1 до 1000 мг в сутки в виде одного или нескольких введений. Следующие примеры иллюстрируют изобретение, но никоим образом не ограничивают его. Пример 1. Фумарат спиро[(1,3-диазациклопент-1-ен)-5:2'(S)-(транс-1',2',3',4',4'a(R),9',9'a(S),10'-октагидроантрацена)] и фумарат спиро[(1,3-диазациклопент-1-ен)-5:2' (R)-(транс 1',2',3',4',4'а(S),9',9'а(R),10'-октагидроантрацена)]. Стадия 1. 7-(2-Бромбензил)-1,4-диоксаспиро[4.5]декан-8-он. Раствор моноэтиленацеталя 1,4-циклогександиона (20 г, 28 ммоль) в ТГФ (360 мл) добавляют по каплям в атмосфере азота к 1 М раствору диизопропиламида лития в ТГФ (150 6 ммоль, 150 мл), охлажденному до -78 С, и затем смесь оставляют достичь комнатной температуры. После перемешивания в течение 1 ч смесь охлаждают до -78 С и добавляют по каплям 35,2 г (141 ммоль) 2-бромбензилбромида. После перемешивания в течение 30 мин при -78 С температуру смеси поднимают до 0 С. Смесь перемешивают в течение 3 ч при 0 С и затем гидролизуют и экстрагируют диэтиловым эфиром. Органическую фазу промывают насыщенным раствором NaCl, сушат над МgSO4 и концентрируют в вакууме. Указанное в заголовке соединение очищают флэш-хроматографией на колонке. Температура плавления: 123 С Стадия 2:7-(2-бромбензил)-8-метилен-1,4 диоксаспиро[4.5]декан. Раствор трет-пентоксида натрия (70 мл 1 М раствора), полученный непосредственно перед употреблением, добавляют к суспензии иодида метил(трифенил)фосфония (25 г, 61,8 ммоль) в 50 мл толуола, и смесь перемешивают при комнатной температуре в атмосфере азота в течение 20 мин. Добавляют по каплям соединение, полученное на стадии 1 (6,70 г, 20,6 ммоль), растворенное в 50 мл толуола, и реакционную смесь нагревают при кипении с обратным холодильником в течение 3 ч. После охлаждения реакционную смесь гидролизуют насыщенным раствором NH4Cl и экстрагируют диэтиловым эфиром. Органическую фазу промывают насыщенным раствором NaCl, Н 2 О, сушат надMgSO4 и концентрируют в вакууме. Указанное в заголовке соединение очищают флэшхроматографией на колонке (SiO2, толуол/циклогексан: 60/40). Температура плавления: 68 С Стадия 3. 2-Диоксолан-транс-1,2,3,4,4 а,9,9 а,10-октагидроантрацен. Раствор, содержащий соединение, полученное на стадии 2 (5 г, 15,5 ммоль), 510 мг(0,02 ммоль) АИБН и 6,75 г Вu3SnН (23,2 ммоль) в 750 мл толуола нагревают при кипении с обратным холодильником в течение 5 ч 30 мин в атмосфере азота. Растворитель упаривают при пониженном давлении и полученный остаток интенсивно перемешивают в течение 3 ч со смесью диэтилового эфира (120 мл) и насыщенного раствора фторида калия (120 мл). После фильтрования,экстрагирования эфиром, сушки над MgSO4 и концентрирования при пониженном давлении указанное в заголовке соединение очищают флэш-хроматографией на колонке (SiO2, циклогексан/диэтиловый эфир : 80/20). Температура плавления: 71 С Стадия 4. Транс-1,2,3,4,4 а,9,9 а,10-октагидро-2-антраценон. Раствор 6 г (24,6 ммоль) ацеталя, полученного на стадии 3, в 100 мл ацетона и 25 мл воды,и 1,85 г (7,4 ммоль) тозилата пиридиния нагревают при кипении с обратным холодильником в течение 4 ч. Избыток растворителя упаривают в вакууме и затем добавляют 500 мл эфира, и реакционную смесь промывают насыщенным раствором Na2CO3 и насыщенным раствором NaCl. Органическую фазу сушат над MgSO4 и растворитель упаривают при пониженном давлении. Указанное в заголовке соединение получают после очистки флэш-хроматографией на колонке (SiO2, циклогексан/этилацетат : 80/20). Температура плавления: 99 С Стадия 5: 2-Амино-транс-1,2,3,4,4 а,9,9 а,10 октагидро-2-антраценкарбонитрил. К интенсивно перемешиваемому в атмосфере азота раствору, содержащему 1,25 г (6,2 ммоль) соединения, полученного на стадии 4, в 30 мл МеОН и 15 мл воды, добавляют последовательно 410 мг KCN (6,3 ммоль) и 340 мгNH4Cl (6,3 ммоль). После перемешивания в течение 12 ч при 20 С раствор разбавляют CH2Cl2 и экстрагируют CH2Cl2. Органическую фазу промывают насыщенным раствором NaCl, сушат над MgSO4 и упаривают. Остаток обрабатывают 25 мл метанольного раствора аммиака(7 н) и перемешивают в закрытой системе в течение 12 ч при 20 С. Упаривание при пониженном давлении дает указанное в заголовке соединение в чистом виде. Температура плавления: 128 С Элементный микроанализ: Теоретический Найдено Стадия 6. 2-Аминометил-транс-1,2,3,4,4 а,9,9 а,10-октагидро-2-антраценамин. Раствор 1,39 г (6,1 ммоль) нитрила, полученного на стадии 5, в 35 мл ТГФ добавляют по каплям к суспензии LiAlH4 (350 мг, 9,2 ммоль) в 35 мл безводного ТГФ при -20 С в атмосфере азота. Смесь перемешивают в течение 1 ч 30 мин перед гидролизом с помощью 2,3 мл Н 2O,4,6 мл 35%-ного раствора гидроксида натрия и 4,9 мл воды. Полученную суспензию фильтруют, и фильтрат упаривают, получая масло, которое подвергают флэш-хроматографии на колонке: указанное в заголовке соединение выделяют в виде смеси двух диастереоизомеров, которые могут быть разделены посредством ВЭЖХ (Kromasil 100, 10 С 18-210 ммСН 3 СN/Н 2O/СF3 СООН=170/830/5). 2S)-2-аминометил-транс-1,2,3,4,4a(R),9,9a(S),10-октагидро-2-антраценамин и(2R)-2-аминометил-транс-1,2,3,4,4 а(R),9,9a(S),10-октагидро-2-антраценамин) Температура плавления: 183 С Стадия 7. Фумарат спиро[(1,3-диазациклопент-1-ен)-5:2'(S)-(транс-1',2',3',4',4'a(R),9', 8 9'a(S),10'-октагидроантрацена)] и фумарат спиро[(1,3-диазациклопент-1-ен)-5:2'(R)-(транс 1',2',3',4',4'а(S),9',9'a(R),10'-октагидроантрацена)]. Смесь 495 мг (2,2 ммоль) (2S)-2 аминометил-транс-1,2,3,4,4a(R),9,9a(S),10-октагидро-2-антраценамина и (2R)-2-аминометилтранс-1,2,3,4,4a(S),9,9a(R),10-октагидро-2-антраценамина, полученных на стадии 6, и 258 мг(2,5 ммоль) ацетата формамидина в 10 мл EtOH перемешивают при 20 С в атмосфере азота в течение 12 ч. Растворитель удаляют упариванием и остаток берут в 1 н НСl. Кислую фазу промывают эфиром, подщелачивают 35% NaOH и затем экстрагируют CH2Cl2. Органическую фазу промывают насыщенным раствором NaCl, сушат над MgSO4 и упаривают. Твердый остаток растворяют в 10 мл EtOH и обрабатывают раствором фумаровой кислоты (225 мг, 1,9 ммоль) в 10 мл EtOH. Упаривание и перекристаллизация из EtOH дает указанное в заголовке соединение в виде белого порошка. Температура плавления: 233-237 С Пример 2. Фумарат спиро[(1,3-диазациклопент-1-ен)-5:2'(S)-(транс-1',2',3',4',4'a(S),9',9'a(R),10'-октагидроантрацена)] и фумарат спиро[(1,3-диазациклопент-1-ен)-5:2'(R)-(транс-1',2',3',4',4'a(R),9',9'a(S),10'-октагидроантрацена)]. Процедура получения аналогична стадии 7 примера 1, исходя из 2S)-2-аминометил-транс 1,2,3,4,4a(S),9,9a(R),10-октагидро-2-антраценамина и его энантиомера. Температура плавления: 215 С Фармакологическое исследование Пример А. Определение аффинности к 2 адренергическим рецепторам на крысах. Аффинность определяли в сравнительных экспериментах с использованием [3H]-RX 821,002. Мембраны получают из коры головного мозга крысы и инкубируют в трехкратной последовательности с 0,4 нМ [3H]-RX 821,002 и тестируемым продуктом в окончательном объеме 1,0 мл в течение 60 мин при 22 С. Инкубационный буфер содержит 50 нМ Трис-НСl (рН 7,5), 1 мМ ЭДТК и 100 мкМ GppNHp. Неспецифическое связывание определяют с использованием 10 мкМ фенетоламина. Анализ данных В конце инкубирования инкубационную среду фильтруют через фильтры WHATMANGF/B, пропитанные 0,1% полиэтиленимина, и промывают три раза 5 мл охлажденного буфера. Остаточную радиоактивность на фильтрах определяют с помощью жидкостного сцинтиляционного счетчика. Изотермы связывания анализируют методом нелинейной регрессии. Результат Соединения согласно изобретению проявляют специфическую антагонистическую активность в отношении 2-адренергического рецептора, при этом соединение 1, например, имеет pKi 8,0. Пример В. Определение аффинности к сайтам обратного захвата норадреналина у крыс. Аффинность определяли в сравнительных экспериментах с использованием[3 Н]низоксетина. Мембраны получают из фронтальной коры головного мозга крысы и инкубируют в трехкратной последовательности с 2 нМ [3 Н] низоксетина и тестируемым продуктом в окончательном объеме 0,5 мл в течение 4 ч при 4 С. Инкубационный буфер содержит 50 мкМ ТрисНСl (рН 7,4), 120 мМ NaCl и 5 мМ КСl. Неспецифическое связывание определяют с использованием 10 мкМ дезипрамина. Анализ данных В конце инкубирования инкубационную среду фильтруют через фильтры WHATMANGF/B, пропитанные 0,1% полиэтиленимина, и промывают три раза 5 мл охлажденного буфера. Остаточную радиоактивность на фильтрах определяют с помощью жидкостного сцинтиляционного счетчика. Изотермы связывания анализируют методом нелинейной регрессии. Результат Соединения согласно настоящему изобретению проявляют очень хорошую аффинность к сайтам обратного захвата норадреналина. Например, pKi соединения примера 1 составляет 6,7. Пример С. Определение аффинности к сайтам обратного захвата серотонина у крыс. Аффинность определяли в сравнительных экспериментах с использованием[3H]пароксетина. Мембраны получают из фронтальной коры головного мозга крысы и инкубируют в трехкратной последовательности с 0,25 нМ[3H]-пароксетина и холодным лигандом в окончательном объеме 0,4 мл в течение 2 ч при 25 С. Инкубационный буфер содержит 50 мкМ ТрисНСl (рН 7,4), 120 мМ NaCl и 5 мМ КСl. Неспецифическое связывание определяют с использованием 10 мкМ циталопрама. Анализ данных В конце инкубирования инкубационную среду фильтруют через фильтры WHATMANGF/B, пропитанные 0,1% полиэтиленимина, и промывают три раза 5 мл охлажденного буфера. Остаточную радиоактивность на фильтрах определяют с помощью жидкостного сцинтиляционного счетчика. Изотермы связывания анализируют методом нелинейной регрессии. Результат Соединения согласно настоящему изобретению проявляют очень хорошую аффинность к сайтам обратного захвата серотонина. Например, pKi соединения примера 1 составляет 7,8. Пример D. Фармацевтическая композиция Таблетки 1000 таблеток с содержанием 5 мг каждая Соединение примера 1 Пшеничный крахмал Кукурузный крахмал 10 Лактоза Стеарат магния Диоксид кремния Гидроксипропилцеллюлоза в которой А представляет бензольное кольцо, незамещенное или замещенное 1-4 одинаковыми или различными группами, выбранными из линейного или разветвленного (С 1-С 6)алкила, линейного или разветвленного (С 1-С 6)алкокси,гидрокси, полигалоген-(С 1-С 6)алкила, в котором алкильный фрагмент является линейным или разветвленным, и галогена,В представляет имидазолиновое кольцо,как представлено в формулах (Iа) и (Ib) где R представляет атом водорода,их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 2. Соединения формулы (I) по п.1, в которых В представляет кольцо формулы (Iа), их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 3. Соединения формулы (I) по п.1, в которых кольцо А является незамещенным, их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 4. Соединения формулы (I) по п.1, в которых кольцо А замещено 1-4 одинаковыми или различными группами, выбранными из линейного или разветвленного (С 1-С 6)алкила, линейного или разветвленного (С 1-С 6)алкокси, гидрокси, полигалоген-(С 1-С 6)алкила, в котором алкильный фрагмент является линейным или разветвленным, и галогена, их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 5. Соединения формулы (I) по п.1, имеющие транссоединение колец, их таутомеры,энантиомеры и диастереоизомеры и их адди 11 тивные соли с фармацевтически приемлемыми кислотой или основанием. 6. Соединение формулы (I) по п.1, представляющее спиро[(1,3-диазациклопент-1-ен)5:2'-(транс-1',2',3',4',4'а,9',9'а,10'-октагидроантрацен)], его таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 7. Соединение формулы (I) по п.1, состоящее из смеси спиро[(1,3-диазациклопент-1-ен)5:2'(S)-(транс-1',2',3',4',4'а(R),9',9'а(S),10'-октагидроантрацена)] и спиро[(1,3-диазациклопент 1-ен)-5:2'(R)-(транс-1',2',3',4',4'a(S),9',9'a(R),10'октагидроантрацeнa)], его таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 8. Соединение формулы (I) по п.1, состоящее из смеси спиро[(1,3-диазациклопент-1-ен)5:2'(S)-(транс-1',2',3',4',4'а(S),9',9'а(R),10'-октагидроантрацена)] и спиро[(1,3-диазациклопент 1-ен)-5:2'(R)-(транс-1',2',3',4',4'а(R),9',9'а(S),10'октагидроантрацена)], его таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 9. Способ получения соединений формулы(I) по п.1, отличающийся тем, что используют в качестве исходного вещества соединение формулы (II) в которой А имеет значения, определенные ранее,которое конденсируют с енолятом моноэтиленацеталя 1,4-циклогександиона с получением соединения формулы (III) в которой А имеет значения, определенные ранее,которое подвергают действию иодида метил(трифенил)фосфония с получением соединения формулы (IV) в которой А имеет значения, определенные ранее,которое циклизуют в присутствии гидрида трибутилолова и АИБН с получением соединения формулы (V) в которой А имеет значения, определенные ранее, 12 которое подвергают последовательно действию кислой среды с последующей реакцией Штрекера с получением соединения формулы (VI) в которой А имеет значения, определенные ранее,которое подвергают действию восстанавливающего агента, такого, например, как в которой А имеет значения, определенные ранее,которое подвергают взаимодействию с ацетатом формамидина с получением соединения формулы (I/a), соответствующего соединениям формулы (I) в которой А имеет значения, определенные ранее,и В' представляет незамещенное имидазолиновое кольцо, как представлено в формулах (Ia/a) и (Ib/a) и которые далее могут быть очищены в соответствии с обычными приемами в процессе выделения,и при желании превращены в аддитивные соли с фармацевтически приемлемой кислотой или основанием с последующим, при необходимости, разделением на изомеры с помощью обычных приемов разделения. 10. Фармацевтическая композиция, включающая в качестве активного ингредиента, по крайней мере, одно из соединений формулы (I) по любому из пп.1-8 или их аддитивную соль с фармацевтически приемлемой кислотой или основанием в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами. 11. Применение фармацевтической композиции по п.9 для использования при получении лекарственного средства для лечения депрессии,ожирения, приступов страха, тревожных состояний,обсессивно-компульсивных расстройств, нарушений познания, фобий, импульсивных болезненных состояний, связанных со злоупотреблением лекарственными препаратами и отменой их применения, сексуальных расстройств и болезни Паркинсона.
МПК / Метки
МПК: C07D 235/02, A61K 31/4184, A61P 25/24
Метки: содержащая, композиция, соединения, способ, спироимидазолиновые, фармацевтическая, получения
Код ссылки
<a href="https://eas.patents.su/7-2979-spiroimidazolinovye-soedineniya-sposob-ih-polucheniya-i-farmacevticheskaya-kompoziciya-soderzhashhaya-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Спироимидазолиновые соединения, способ их получения и фармацевтическая композиция, содержащая их</a>











