Арил и гетероарил мочевины в качестве ингибиторов снк1 для использования в качестве радиосенсибилизаторов и химиосенсибилизаторов
Номер патента: 14954
Опубликовано: 29.04.2011
Авторы: Годино Джон Джозеф, Кук Адам Уэйд, Киган Кэтлин С., Бэрджесс Лоренс Эдуард, Кауэн Скотт Даглас, Кесицки Эдвард А.
Формула / Реферат
1. Способ ингибирования киназы 1 точек контроля в клетке, включающий стадию контакта клетки с терапевтически эффективным количеством соединения формулы
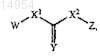
где X1представляет -O-, -S-, -СН2- или -N(R1)-;
X2 представляет -O-, -S- или -N(R1)-;
Y представляет О или S;
W представляет ![]()
Z представляет ![]()
где Z необязательно замещен 1-4 заместителями, представленными R2, a W необязательно замещен 1-3 заместителями, представленными R5;
R1 выбран из группы, состоящей из водорода, С1-6-алкила, С2-6-алкенила, С2-6-алкинила и арила;
R2 выбран из группы, состоящей из галогена, необязательно замещенного C1-6-алкила, где заместители выбраны из галогена, гидрокси, арила, гетероарила, гетероциклоалкила, N(R4)2 и SO2R4, C1-3-алкиленарила, C1-3-алкиленгетероарила, С1-3-алкилен-С3-8-гетероциклоалкила, С1-3-алкилен-SO2-арила; С2-6-алкенила, OCF3, NO2, CN, NC, N(R3)2, OR3, CO2R31, C(O)N(R3)2, C(O)R3, N(R1)C(O)R3, N(R1)C(O)OR3, N(R3)C(O)OR3, N(R3)С(О)-С1-3алкилен-C(O)R3, N(R3)C(O)-C1-3-алкилен-C(O)OR3, N(R3)С(О)-С1-3-алкилен-OR3, N(R3)С(О)-C1-3-алкилен-NHC(O)OR3, N(R3)С(О)-С1-3-алкилен-SO2NR3, C1-3-алкилен-OR3 и SR3;
R3 выбран из группы, состоящей из водорода, C1-6-алкила, С2-6-алкенила, циклоалкила, арила, гетероарила, SO2R4, C1-6-алкила, замещенного одним или более заместителем, выбранным из галогена, гидрокси, арила, гетероарила, гетероциклоалкила, N(R4)2и SO2R4, C1-3-алкиленарила, C1-3-алкиленгетероарила, С1-3-алкилен-С3-8-гетероциклоалкила, С1-3-алкилен-SO2-арила, необязательно замещенного С1-3-алкилен-N(R4)2, OCF3, С1-3-алкилен-N(R4)3+, С3-8-гетероциклоалкила и СН(С1-3-алкилен-N(R4)2)2, или 2 группы R3, взятые вместе, образуют необязательно замещенное 3-6-членное алифатическое кольцо;
R4 выбран из группы, состоящей из водорода, С1-6-алкила, циклоалкила, арила, гетероарила, С1-3-алкиленарила и SO2-C1-6-алкила, или 2 группы R4, взятые вместе, образуют необязательно замещенное 3-6-членное кольцо;
R5 выбран из группы, состоящей из С1-6-алкила, арила, N(R3)2, OR3, галогена, N3, CN, С1-3-алкиленарила, С1-3-алкилен-N(R3)2, C(O)R3и
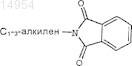
причем циклоалкил представляет собой циклическую С3-8-углеводородную группу;
гетероциклоалкил представляет собой циклическую С3-8-углеводородную группу, содержащую 1-3 гетероатома, выбранных из азота, кислорода или серы;
причем циклоалкильные и гетероциклоалкильные группы могут быть насыщенными или частично ненасыщенными циклическими системами, замещенными, например, группами от одной до трех, независимо выбранными из C1-4-алкила, C1-3-алкилен-ОН, C(=O)NH2, NH2, оксо(=O), арила, трифторэтаноила и ОН, причем гетероциклоалкильные группы необязательно являются далее N-замещенными C1-3-алкиленарилом или C1-3-алкиленгетероарилом;
арил представляет собой моноциклическую или полициклическую ароматическую группу, предпочтительно моноциклическую или бициклическую ароматическую группу, например фенил или нафтил, причем арильная группа может быть незамещенной или замещенной, например, одним или несколькими заместителями и особенно заместителями от одного до четырех, которыми являются галоген, C1-6-алкил, С2-6-алкенил, OCF3, NO2, CN, NC, N(Ra)2, ORb, CO2Rb, C(O)N(Rb)2, C(O)Rb, N(Ra)CORb, N(Ra)C(O)ORb, N(Ra)C(O)ORb, N(Ra)C(O)-C1-3-алкилен-C(O)Rb, N(Rb)CO-C1-3-алкилен-C(O)ORb, N(Rb)CO-C1-3-алкилен-ORb, N(Rb)CO-C1-3-алкилен-NHC(O)ORb, N(Rb)CO-C1-3-алкилен-SO2NRb, C1-3-алкилен-ORb и SRb, где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С2-6-алкенила, циклоалкила, гетероциклоалкила, арила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, гидрокси, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, и Ra имеет значения, указанные ниже;
гетероарил представляет собой моно- или бициклическую кольцевую систему, содержащую по меньшей мере один атом азота, кислорода или серы, необязательно замещенный 1-4 заместителями, выбранными из водорода, C1-6-алкила, C1-6-алкокси, арила, N(Ra)2, ORb и галогена;
где Ra выбран из группы, состоящей из водорода, С1-6-алкила, циклоалкила, арила и SO2C1-6-алкила, или 2 Ra группы вместе образуют необязательно замещенное 3-6-членное кольцо;
Rb выбран из группы, состоящей из водорода, C1-6-алкила, С2-6-алкенила, циклоалкила, гетероциклоалкила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, ОН, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, где Ra определен выше,
или его фармацевтически приемлемой соли либо пролекарства или сольвата.
2. Способ по п.1,
где X1и X2 представляют -N(H)-;
Y представляет О или S;
W необязательно замещен 1-3 заместителями, выбранными из группы, состоящей из C1-6-алкила, арила, N(R3)2и галогена;
Z представляет

где Q выбран из группы, состоящей из водорода, OR3, SR3и N(R3)2;
J представляет CR20;
K представляет CR21;
L представляет CR22;
M представляет CR23;
где каждый из R20, R21 и R22 независимо выбран из группы, состоящей из водорода, галогена, необязательно замещенного C1-6-алкила, С2-6-алкенила, OCF3, NO2, CN, NC, N(R25)2, OR25, CO2R25, C(O)N(R25)2, C(O)R25, N(R24)C(O)R25, N(R24)C(O)OR25, N(R25)C(O)OR25, N(R25)C(O)-C1-3-алкилен-C(O)R25, N(R25)С(О)-C1-3-алкилен-С(О)OR25, N(R25)С(О)С-C1-3-алкилен-OR25, N(R25)С(О)-C1-3-алкилен-NHC(O)OR25, N(R25)С(О)-C1-3-алкилен-SO2NR25, CF3, С1-3-алкилен-N(R25)-SO2-арила, C1-3-алкилен-N(R25)-SO2-гетероарила, С1-3-алкилен-О-С1-3-алкиленарила, С1-3-алкилен-N(R25)-C1-3-алкиленгетероарила, C1-3-алкилен-N(R25)-С(О)R7, С1-3-алкилен-N(R25)С(О)-C1-3-алкилен-OR25, C1-3-алкилен-N(R25)С(О)арила, С1-3-алкилен-N(R25)С(О)-C1-3-алкилен-N(R25)2, С1-3-алкилен-N(R25)С(О)-гетероарила, C1-3-алкилен-OR25 и SR25;
R23 выбран из группы, состоящей из водорода, необязательно замещенного C1-6-алкила и галогена;
R24 выбран из группы, состоящей из водорода, C1-6-алкила, С2-6-алкенила, С2-6-алкинила и арила;
R25 выбран из группы, состоящей из водорода, C1-6-алкила, С2-6-алкенила, циклоалкила, гетероцикла, арила, гетероарила, SO2R26 и C1-6-алкила, замещенного галогеном, гидрокси, арилом, гетероарилом, гетероциклоалкилом, N(R26)2 или SO2R26; и
R26 выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила и SO2-C1-6-алкила, или 2 группы R4, взятые вместе, образуют необязательно замещенное 3-6-членное кольцо.
3. Способ по п.2, где W необязательно замещен 1-3 заместителями, выбранными из группы, состоящей из необязательно замещенного C1-6-алкила, арила, N(R3)2, OR3 и галогена.
4. Способ по п.2,
где J представляет CR20, где R20 выбран из группы, состоящей из водорода, необязательно замещенного C1-6-алкила и галогена;
K представляет CR21;
L представляет CR22;
один из R21 и R22 представляет водород, а другой представляет заместитель, выбранный из группы, состоящей из CO2R25, C(O)N(R25)2, C(O)R25, N(R24)C(O)R25, N(R24)C(O)OR25, N(R25)C(O)OR25, N(R25)С(О)-С1-3-алкилен-C(O)R25, N(R25)С(О)С1-3-алкилен-С(О)OR25, N(R25)С(О)С1-3-алкилен-OR25, N(R25)С(О)-C1-3-алкилен-NHC(О)OR25, N(R25)С(О)-C1-3-алкилен-SO2NR25, CF3, C1-3-алкилен-N(R25)-SO2-арила, C1-3-алкилен-N(R25)-SO2-гетероарила, С1-3-алкилен-O-С1-3-алкиленарила, С1-3-алкилен-N(R25)-C1-3-алкиленарила, С1-3-алкилен-N(R25)-C1-3алкиленгетероарила, C1-3-алкилен-N(R25)-С(О)R7, С1-3-алкилен-N(R25)С(О)-C1-3-алкилен-OR2, С1-3-алкилен-N(R25)С(О)арила, C1-3-алкилен-N(R25)С(О)-C1-3-алкилен-N(R25)2, C1-3-алкилен-N(R25)С(О)гетероарила, С1-3-алкилен-OR25 и SR25.
5. Соединение, имеющее формулу
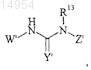
где Y' представляет О или S;
W' представляет собой группу ![]() необязательно замещенную 1-4 заместителями, выбранными из группы, состоящей из C1-6-алкила, арила, N(R7)2, OR7, N3, CN, C(O)R7, C1-3-алкиленарила, C1-3-алкилен-N(R2)2, галогена и
необязательно замещенную 1-4 заместителями, выбранными из группы, состоящей из C1-6-алкила, арила, N(R7)2, OR7, N3, CN, C(O)R7, C1-3-алкиленарила, C1-3-алкилен-N(R2)2, галогена и
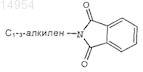
Z' выбран из группы, состоящей из
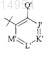
где Q' представляет OR7;
J' выбран из группы, состоящей из CR8;
K' выбран из группы, состоящей из CR9;
L' выбран из группы, состоящей из CR10;
M' выбран из группы, состоящей из CR11;
где R7представляет С1-3-алкилен-С3-8-гетероциклоалкил;
каждый из R8, R9и R10 независимо выбран из группы, состоящей из водорода, галогена, необязательно замещенного C1-6-алкила, С2-6-алкенила, OCF3, NO2, CN, NC, N(R7)2, OR7, CO2R7, C(O)N(R7)2, C(O)R7, N(R13)C(O)R7, N(R13)C(O)OR7, N(R7)C(O)OR7, N(R7)С(О)-C1-3-алкилен-C(O)R7, N(R7)С(О)-С1-3-алкилен-C(O)OR7, N(R7)C(O)C-C1-3-алкилен-OR7, N(R7)С(О)-C1-3-алкилен-NHC(O)OR7, N(R7)C(O)-C1-3-алкилен-SO2NR7, CF3, С1-3-алкилен-N(R12)SO2-арила, С1-3-алкилен-N(R12)SO2-гетероарила, С1-3-алкилен-О-С1-3-алкиленарила, C1-3-алкилен-N(R12)-С1-3-алкиленарила, С1-3-алкилен-N(R12)-C1-3-алкиленгетероарила, С1-3-алкилен-N(R12)C(O)R7, C1-3-алкилен-N(R12)С(О)-C1-3-алкилен-OR2, С1-3-алкилен-N(R12)С(О)арила, C1-3-алкилен-N(R12)С(О)-С1-3-алкилен-N(R12)2, C1-3-алкилен-N(R12)С(О)гетероарила, С1-3-алкилен-OR7и SR7, где R7определен выше;
R11 выбран из группы, состоящей из водорода, необязательно замещенного C1-6-алкила и галогена;
R12 выбран из группы, состоящей из водорода, С1-6-алкила, циклоалкила, арила, гетероарила, C1-3-алкиленарила и SO2-C1-6-алкила, или 2 группы R12, взятые вместе, образуют необязательно замещенное 3-6-членное кольцо; и
R13 представляет водород;
причем циклоалкил представляет собой циклическую С3-8-углеводородную группу;
гетероциклоалкил представляет собой циклическую С3-8-углеводородную группу, содержащую 1-3 гетероатома, выбранных из азота, кислорода или серы;
причем циклоалкильные и гетероциклоалкильные группы могут быть насыщенными или частично ненасыщенными циклическими системами, замещенными, например, группами от одной до трех, независимо выбранными из C1-4-алкила, C1-3-алкилен-ОН, C(=O)NH2, NH2, оксо(=O), арила, трифторэтаноила и ОН; гетероциклоалкильные группы необязательно являются далее N-замещенными C1-3-алкиленарилом или С1-3-алкиленгетероарилом;
арил представляет собой моноциклическую или полициклическую ароматическую группу, предпочтительно моноциклическую или бициклическую ароматическую группу, например фенил или нафтил, причем арильная группа может быть незамещенной или замещенной, например, одним или несколькими заместителями и особенно заместителями от одного до четырех, которыми являются галоген, C1-6-алкил, С2-6-алкенил, OCF3, NO2, CN, NC, N(Ra)2, ORb, CO2Rb, C(O)N(Rb)2, C(O)Rb, N(Ra)CORb, N(Ra)C(O)ORb, N(Ra)C(O)ORb, N(Ra)С(О)-С1-3-алкилен-C(O)Rb, N(Rb)CO-C1-3-алкилен-C(O)ORb, N(Rb)СО-С1-3-алкилен-ORb, N(Rb)СО-С1-3-алкилен-NHC(O)ORb, N(Rb)CO-C1-3-алкилен-SO2NRb, С1-3-алкилен-ORb и SRb, где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С2-6-алкенила, циклоалкила, гетероциклоалкила, арила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, гидрокси, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, и Ra имеет значения, указанные ниже;
гетероарил представляет собой моно- или бициклическую кольцевую систему, содержащую по меньшей мере один атом азота, кислорода или серы, необязательно замещенный 1-4 заместителями, выбранными из водорода, C1-6-алкила, C1-6-алкокси, арила, N(Ra)2, ORb и галогена;
где Ra выбран из группы, состоящей из водорода, С1-6-алкила, циклоалкила, арила и SO2C1-6-алкила, или 2 Ra группы вместе образуют необязательно замещенное 3-6-членное кольцо;
где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С2-6-алкенила, циклоалкила, гетероциклоалкила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, ОН, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, где Ra определен выше,
или его фармацевтически приемлемая соль.
6. Соединение, имеющее формулу
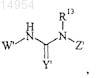
где Y' представляет О или S;
W' представляет группу ![]() необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из C1-6-алкила, арила, N(R7)2, OR7, N3, CN, C(O)R7, C1-3-алкиленарила, С1-3-алкилен-N(R2)2,
необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из C1-6-алкила, арила, N(R7)2, OR7, N3, CN, C(O)R7, C1-3-алкиленарила, С1-3-алкилен-N(R2)2,
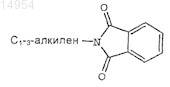
и галогена;
Z' представляет
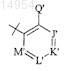
где Q' выбран из группы, состоящей из OR7, SR71 и N(R7)2;
J' представляет CR8;
K' представляет CR9;
L' представляет CR10;
М' представляет CR11;
где R7независимо выбран из группы, состоящей из водорода, C1-6-алкила, С2-6-алкенила, циклоалкила, арила, гетероарила, SO2R12, C1-6-алкила, замещенного одним или более заместителем, выбранным из галогена, гидрокси, арила, гетероарила, гетероциклоалкила, N(R12)2 и SO2R12; C1-3-алкиленарила, C1-3-алкиленгетероарила, С1-3-алкилен-С3-8-гетероциклоалкила, С1-3-алкилен-SO2-арила, необязательно замещенного С1-3-алкилен-N(R12)2, OCF3, С1-3-алкилен-N(R12)3+, С3-8-гетероциклоалкила и СН(С1-3-алкилен-N(R12)2)2, или 2 группы R7, взятые вместе, образуют необязательно замещенное 3-6-членное алифатическое кольцо;
каждый из R8, R9и R10 независимо выбран из группы, состоящей из водорода, галогена, необязательно замещенного C1-6-алкила, С2-6-алкенила, OCF3, NO2, CN, NC, N(R7)2, OR7, CO2R7, C(O)N(R7)2, C(O)R7, N(R13)C(O)R7, N(R13)C(O)OR7, N(R7)C(O)OR7, N(R7)С(О)-C1-3-алкилен-C(O)R7, N(R7)C(O)-C1-3-алкилен-C(O)OR7, N(R7)С(О)C-C1-3-алкилен-OR7, N(R7)С(О)-С1-3-алкилен-NHC(O)OR7, N(R7)С(О)-C1-3-алкилен-SO2NR7, CF3, С1-3-алкилен-N(R12)-SO2-арила, C1-3-алкилен-N(R12)-SO2-гетероарила, С1-3-алкилен-О-С1-3-алкиленарила, С1-3-алкилен-N(R12)-С1-3-алкиленарила, С1-3-алкилен-N(R12)-C1-3-алкиленгетероарила, С1-3-алкилен-N(R12)-С(О)R7, С1-3-алкилен-N(R12)С(О)-C1-3-алкилен-OR2, С1-3-алкилен-N(R12)С(О)арила, С1-3-алкилен-N(R12)С(О)-С1-3-алкилен-N(R12)2, С1-3-алкилен-N(R12)С(О)гетероарила, С1-3-алкилен-OR7и SR7, где R7определен выше;
R11 выбран из группы, состоящей из водорода, необязательно замещенного С1-6-алкила и галогена;
R12 выбран из группы, состоящей из водорода, С1-6-алкила, циклоалкила, арила, гетероарила, C1-3-алкиленарила и SO2-C1-6-алкила, или 2 группы R12, взятые вместе, образуют необязательно замещенное 3-6-членное кольцо; и
R13 выбран из группы, состоящей из водорода, С1-6-алкила, С2-6-алкенила, С2-6-алкинила и арила;
при условии, что когда Q' представляет ОСН3, то по меньшей мере один из R8, R9 и R10 отличается от водорода, СН3, ОСН3 и галогена,
причем циклоалкил представляет собой циклическую С3-8-углеводородную группу;
гетероциклоалкил представляет собой циклическую С3-8-углеводородную группу, содержащую 1-3 гетероатома, выбранных из азота, кислорода или серы;
причем циклоалкильные и гетероциклоалкильные группы могут быть насыщенными или частично ненасыщенными циклическими системами, замещенными, например, группами от одной до трех, независимо выбранными из C1-4-алкила, C1-3-алкилен-ОН, C(=O)NH2, NH2, оксо(=O), арила, трифторэтаноила и ОН; гетероциклоалкильные группы необязательно являются далее N-замещенными C1-3-алкиленарилом или C1-3-алкиленгетероарилом;
арил представляет собой моноциклическую или полициклическую ароматическую группу, предпочтительно моноциклическую или бициклическую ароматическую группу, например фенил или нафтил, причем арильная группа может быть незамещенной или замещенной, например, одним или несколькими заместителями и особенно заместителями от одного до четырех, которыми являются галоген, С1-6-алкил, С2-6-алкенил, OCF3, NO2, CN, NC, N(Ra)2, ORb, CO2Rb, C(O)N(Rb)2, C(O)Rb, N(Ra)CORb, N(Ra)C(O)ORb, N(Ra)C(O)ORb, N(Ra)C(O)-C1-3-алкилен-C(O)Rb, N(Rb)CO-C1-3-алкилен-C(O)ORb, N(Rb)CO-C1-3-алкилен-ORb, N(Rb)CO-C1-3-алкилен-NHC(О)ORb, N(Rb)CO-C1-3-алкилен-SO2NRb, C1-3-алкилен-ORb и SRb, где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С2-6-алкенила, циклоалкила, гетероциклоалкила, арила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, гидрокси, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, и Ra имеет значения, указанные ниже;
гетероарил представляет собой моно- или бициклическую кольцевую систему, содержащую по меньшей мере один атом азота, кислорода или серы, необязательно замещенный 1-4 заместителями, выбранными из водорода, С1-6-алкила, C1-6-алкокси, арила, N(Ra)2, ORb и галогена;
где Ra выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила и SO2C1-6-алкила, или 2 Ra группы вместе образуют необязательно замещенное 3-6-членное кольцо;
Rb выбран из группы, состоящей из водорода, C1-6-алкила, С2-6-алкенила, циклоалкила, гетероциклоалкила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, ОН, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, где Ra определен выше,
или его фармацевтически приемлемые соли либо пролекарства или сольваты.
7. Соединение по п.6, где W' замещен 1-3 заместителями, выбранными из группы, состоящей из метила, CF3, необязательно замещенного арила, N3, бензила, C(O)R7, С1-3-алкилен-N(R12)2, OR7, N(R7)2, галогена и
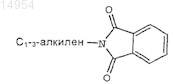
8. Соединение по п.6, где Q' представляет OR7.
9. Соединение по п.6, где Q' представляет ОСН3.
10. Соединение по п.6, где R13 представляет водород.
11. Соединение по п.6, где
J' представляет CR8, где R8 представляет водород, С1-6-алкил и галоген;
K' представляет CR9;
L' представляет CR10;
один из R9и R10 представляет водород, а другой представляет заместитель, выбранный из группы, состоящей из CO2R7, C(O)N(R7)2, C(O)R7, N(R13)C(O)R7, N(R13)C(O)OR7, N(R7)С(О)OR7, N(R7)С(О)-С1-3-алкилен-С(О)R7, N(R7)С(О)-C1-3-алкилен-С(О)OR7, N(R7)C(O)C-C1-3-алкилен-OR7, N(R7)С(О)-C1-3-алкилен-OR7, N(R7)С(О)-C1-3-алкилен-NHC(O)OR7, N(R7)C(O)-C1-3-алкилен-SO2NR7, С1-3-алкилен-OR7, CF3, C1-3-алкилен-N(R12)-SO2-арила, С1-3-алкилен-N(R12)-SO2-гетероарила, C1-3-алкилен-О-С1-3-алкиленарила, С1-3-алкилен-N(R12)-C1-3-алкиленарила, C1-3-алкилен-N(R12)-C1-3-алкиленгетероарила, C1-3-алкилен-N(R12)-C(O)R7, C1-3-алкилен-N(R12)С(О)-C1-3-алкилен-OR2, С1-3-алкилен-N(R12)С(О)арила, C1-3-алкилен-N(R12)С(О)-C1-3-алкилен-N(R12)2, C1-3-алкилен-N(R12)C(O)гетероарила и SR7.
12. Соединение, имеющее структуру
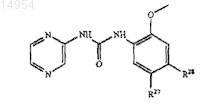
где R27 и R28 представляют
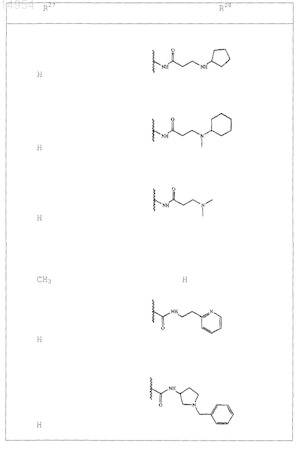
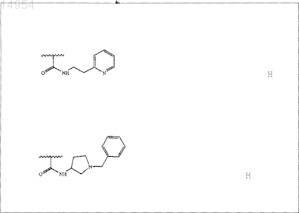
или
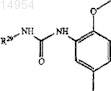
где R29 представляет
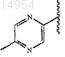
13. Соединение, выбранное из группы, состоящей из
N-(2-диметиламино-1-фенилэтил)-3-метокси-4-[3-(5-метилпиразин-2-ил)уреидо]бензамина;
N-(1-азабицикло[2,2,2]окт-3-ил)-3-метокси-4-[3-(5-метилпиразин-2-ил)уреидо]бензамида;
N-(3-R-1-циклогексилметилпирролидин-3-ил)-3-метокси-4-[3-(5-метилпиразин-2-ил)уреидо]бензамида;
1-[2-(2-диметиламиноэтокси)-5-метилфенил]-3-пиразин-2-илмочевины;
1-[2-(3-диметиламинопропокси)-5-метилфенил]-3-(5-метилпиразин-2-ил)мочевины;
1-(5-метилпиразин-2-ил)-3-[5-метил-2-(пиридин-3-илметокси)фенил]мочевины;
1-[2-(2-диметиламино-1-диметиламинометилэтокси)-5-метилфенил]-3-(5-метилпиразин-2-ил)мочевины;
1-[5-метил-2-(2-(S)-1-метилпирролидин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевины;
1-{5-метил-2-[2-(1-метилпирролидин-2-ил)этокси]фенил}-3-(5-метилпиразин-2-ил)мочевины;
1-{5-метил-2-(1-метилпиперидин-4-илокси)фенил}-3-(5-метилпиразин-2-ил)мочевины;
1-[5-метил-2-(3-(S)-1-метилпиперидин-3-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевины;
1-[5-метил-2-(3-(R)-1-метилпиперидин-3-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевины;
1-[5-метил-2-(1-метилпиперидин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевины;
1-[5-метил-2-(1-метилпиперидин-3-илокси)фенил]-3-(5-метилпиразин-2-ил)мочевины;
1-[5-метил-2-(пиперидин-3-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевины;
1-[5-фтор-2-(1-метилпиперидин-3-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевины;
1-[5-фтор-2-(1-метилпиперидин-4-илокси)фенил]-3-(5-метилпиразин-2-ил)мочевины;
1-[4-фтор-2-(1-метилпиперидин-4-илокси)фенил]-3-(5-метилпиразин-2-ил)мочевины;
1-(2-метокси-4-метиламинометилфенил)-3-(5-метилпиразин-2-ил)мочевины;
1-(4-{[(фуран-3-илметил)амино]метил}-2-метоксифенил)-3-(5-метилпиразин-2-ил)мочевины и
1-{2-метокси-4-[(4-метоксибензиламино)метил]фенил}-3-(5-метилпиразин-2-ил)мочевины.
14. Соединение, выбранное из группы, состоящей из
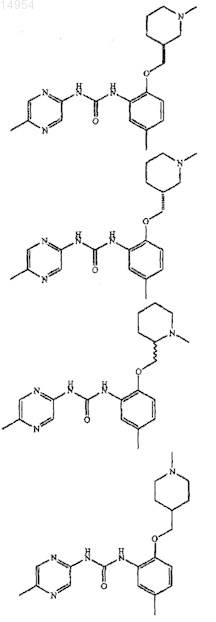
15. Фармацевтическая композиция, включающая соединение по любому из пп.5-14 или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым разбавителем или носителем.
16. Применение соединения по любому из пп.5-14 для получения лекарственного средства для лечения рака, выбранного из группы, состоящей из колоректального рака, рака молочной железы, лейкоза, меланомы, карциномы почечных клеток, рака яичников, рака шейки матки, рака прямой кишки, рака простаты и карциномы легких.
Текст
Киган Кэтлин С., Кесицки Эдвард А.,Годино Джон Джозеф, Кук Адам Уэйд,Кауэн Скотт Даглас, Бэрджесс Лоренс Эдуард (US) Настоящее изобретение относится к сильнодействующим и селективным химиосенсибилизирующим агентам, полезным при лечении заболеваний и состояний, относящихся к повреждению ДНК или повреждениям в репликации ДНК. Настоящие соединения являются ингибиторами киназы точки контроля Chk1. Конкретно, арил- и гетероарилзамещенные производные мочевины демонстрируют значительную активность в ингибировании Chk1. 014954 Перекрестная ссылка на близкие заявки Заявка на данный патент притязает на преимущество предварительной заявки на патент США с регистрационным 60/273124, зарегистрированной 2 марта 2001 г. Техническая область изобретения Настоящее изобретение относится к соединениям, полезным для ингибирования ферментов, которые поддерживают и восстанавливают целостность генетического материала. Более конкретно, настоящее изобретение относится к ряду производных арил- и гетероарилзамещенных мочевин, способам получения соединений и их использованию в качестве терапевтических агентов, например, при лечении рака и других заболеваний, характеризующихся дефектами в репликации дезоксирибонуклеиновой кислоты (ДНК), сегрегации хромосом или делении клеток. Предпосылки создания изобретения Важной и значительной целью в здравоохранении является разработка и обеспечение доступности безопасных и более эффективных лекарственных средств для лечения рака. Большинство химиотерапевтических агентов действует посредством нарушения метаболизма ДНК, синтеза ДНК, транскрипции ДНК или функции веретена микротрубок или посредством нарушения структурной целостности хромосом посредством внесения повреждений в ДНК. Эти процессы воздействуют как на нормальные, так и опухолевые клетки. Сохранение целостности ДНК является существенным для жизнеспособности в нормальных клетках, следовательно, противораковые лекарственные средства имеют самый низкий терапевтический индекс из любого класса лекарственных средств. Индивидуальная клетка создает точную копию ее хромосом и затем сегрегирует каждую копию в две клетки процессом, названным митозом. Митотический цикл можно разделить на три основных события: репликацию ДНК, сегрегацию хромосомы и деление клетки. Клетки имеют механизмы восприимчивости для сохранения порядка этих стадий в отношении друг к другу и обеспечения того, чтобы каждая стадия выполнялась с высокой точностью. Механизмы восприимчивости для этих процессов называют"точками контроля" в L.H. Hartwell et al., Science, Nov. 3, 1989, 246 (4930): 629-34. Сообщалось, что точки контроля клеточного цикла включают по меньшей мере три особых класса полипептидов. Каждый класс полипептидов действует последовательно в ответ на сигналы клеточных циклов или дефекты в хромосомальных механизмах (Carr, (1996) Science, 271: 314-315). Одно семейство белков детектирует или воспринимает повреждение или нарушения ДНК в клеточном цикле. Эти сенсоры включают мутированную атаксию-телеангиэктазию (Atm) и относящуюся к Rad атаксиютелеангиэктазию (Art) (Keegan et al., (1996) Genes Dev., 10: 2423-2437). Другой класс полипептидов амплифицирует и передает сигнал, детектированный детектором, и примером их являются Rad53 (Allen etal., (1994) Genes Dev., 8: 2416-2488) и Chk1. Кроме того, эффекторы клеточного цикла, такие как р 53,опосредуют клеточную ответную реакцию, включая, например, остановку митоза и/или мейоза и апоптоза. Повреждение ДНК можно индуцировать лекарственными средствами, ионизирующим излучением,или оно может самопроизвольно генерироваться в ходе нормального метаболизма. Точки контроля повреждения ДНК гарантируют, что клетки с невосстановленными повреждениями ДНК не прогрессируют в фазу синтеза ДНК или митоз до тех пор, пока хромосомальные повреждения не будут устранены. Остановка клеточного цикла может увеличить благоприятную возможность для репарации ДНК и повысить точность воспроизведения клеточного деления. Повреждение ДНК можно распознать на всем протяжении клеточного цикла. Точки контроля гарантируют, что рост клеток останавливается на фазах циклов множественных клеток. В результате этого пути передачи сигнала циклов множественных клеток могут происходить во время сенсибилизации клеток к повреждающим ДНК агентам. Значительная часть современного понимания функции точек контроля клеточного цикла была получена из исследования клеточных линий, полученных из опухолей. Во многих случаях опухолевые клетки теряют ключевые точки контроля клеточного цикла (Hartwell et al., Science, Dec. 16, 1994; 266(5192): 1821-8). Было сообщение, что ключевой стадией в эволюции клеток в неопластическое состояние является приобретение мутаций, которые инактивируют пути точек контроля клеточного цикла, таких как р 53 (Weinberg, R.A., (1995) Cell. 81: 323-330; Levine, A.J., (1997) Cell. 88: 3234-331). Потеря этих точек контроля клеточного цикла приводит к неадекватной цикличности опухолевых клеток в ответ на повреждающие ДНК агенты. При столкновении с клеточными стрессами, такими как повреждение ДНК и случаи клеточных циклов с пониженной точностью, опухолевые клетки испытывают трудности в изменении кинетик развития клеточного цикла. Следовательно, ингибирование и разрушение дополнительных путей точек контроля повреждения ДНК может далее сенсибилизировать опухолевые клетки к противораковым терапиям, таким как ионизирующее излучение и химиотерапия. Нераковые ткани, которые имеют неповрежденные точки контроля клеточного цикла, обычно являются изолированными от временного повреждения одного пути точки контроля. Опухолевые клетки,однако, имеют дефекты в путях, контролирующих развитие клеточного цикла, так что нарушение дополнительных точек контроля, например точки контроля повреждения ДНК, делает их особенно чувствительными к агентам, повреждающим ДНК. Например, опухолевые клетки, которые содержат мутант р 53,-1 014954 являются дефектными как в точке контроля повреждения ДНК G1, так и в способности сохранять точку контроля повреждения ДНК G2 (Bunz et al., Science, Nov. 20, 1998; 282 (5393): 1497-501; Levine). Ожидается, что ингибиторы точек контроля, которые прицельно действуют на инициацию точки контроля G2 или точки контроля фазы S, дополнительно нарушают способность этих опухолевых клеток репарировать повреждение ДНК и, следовательно, селективно уничтожать их по сравнению с нормальными клетками. Следовательно, как предполагается, ингибиторы точек контроля повышают терапевтический индекс, который является мерой вероятности контроля опухоли относительно вероятности токсичности для нормальной ткани как в результате радиационной терапии, так и системной химиотерапии. Способность ингибиторов точек контроля повышать терапевтический индекс может зависеть от типа опухоли. Опухоли с дефектами клеточного цикла, комплементарные путям точек контроля повреждения ДНК, могут быть наиболее восприимчивыми к лечению ингибиторным лекарственным средством. В противоположность этому, ингибиторы ДНК-РК, другой особый класс потенциальных терапевтических агентов, как предполагается, делают чувствительными опухоли независимо от типа клеток. Систематический подход применения ингибиторов точек контроля и ингибиторов ДНК-РК также может быть эффективным при лечении метастатических заболеваний, на которые не может быть нацеленно направлено ионизирующее излучение. Выдвинута гипотеза, что белки точек контроля Atm и Atr инициируют путь сигнальной трансдукции, приводящий к остановке клеточного цикла в присутствии повреждения ДНК или любого блока для репликации ДНК. Обнаружено, что Atm играет роль в точках контроля повреждения ДНК в ответ на ионизирующее излучение (IR). У пациентов, лишенных функциональной Atm, развивается заболевание атаксия-телеангиэктазия (А-Т). Симптомы А-Т включают крайнюю восприимчивость к ионизирующему излучению (IR), мозжечковую дегенерацию, глазную телеангиэктазию, гонадную недостаточность, иммунодефицит и повышенный риск заболевания раком (Shiloh, Eur. J. Hum. Genet, 1955; 3(2): 116-38). Считается, что фибробласты, взятые у этих пациентов, имеют дефекты в точках контроля G1, S и G2 и являются дефектными в их ответной реакции на IR (Kastan et al., Cell, Nov. 13, 1992; 71(4): 587-97; Scottet al., Int. J. Radiat. Biol., Dec., 1994; 66 (6 Suppl.): S157-63; and Beamish et al., J. Biol. Chem. Aug. 26, 1993; 271(34): 20486-93). Таким образом, Atm может воспринимать повреждение двухцепочечной ДНК, вызванное IR и радиомиметическими лекарственными средствами, и передавать сигнал клеточному циклу для остановки, так что повреждение может быть исправлено.Atr является белком точки контроля, стимулируемым агентами, которые могут вызвать разрывы двухцепочечной ДНК, разрывы одноцепочечной ДНК, и агентами, которые блокируют радиационное излучение на ДНК. Сверхэкспрессия Atr в мышечных клетках на изохромосоме 3q приводит к блокированию дифференциации, аномальному числу центросом, нестабильности хромосом и отменяет остановкуG1 в ответ на IR (Smith et al., Nat. Genet., May 1998; 19(1): 39-46). Сверхэкспрессия неактивного к киназе доминантного негативного мутанта Atr сенсибилизирует клетки к действию IR, ультрафиолетового светаAcad. Sci. USA, June 23, 1998; 95(13): 7445-50). Клетки, содержащие сверхэкспрессированный мутантный штамм Atr, также не достигают успеха в остановке в G2 в ответ на IR. Кроме того, Atr связан с хромосомами в мейотических клетках, где ДНК разрывается и аномальные ДНК-структуры являются устойчивыми в результате процесса мейотической рекомбинации (Keegan et al., Genes Dev. October 1, 1996; 10(19): 433-37). Atr, подобно Atm, также восприимчив к повреждению ДНК и агентам, которые блокируют репликацию ДНК, а также инициирует остановку клеточного цикла у G2 и S для репарации ДНК. Высказана гипотеза, что Chk1 находится в прямом направлении от протеинкиназ Atm и/или Atr в пути сигнальной трансдукции точек контроля повреждения ДНК (см. Sanchez et al., Science, 1997; 277; 277: 1497-1501; патент США 6218109). В клетках млекопитающего Chk1 фосфорилируется в ответной реакции на агенты, которые вызывают повреждение ДНК, в том числе IR, УФ и гидроксимочевину (Sanchez et al., 1997; Lui et al., Genes Dev. 2000; 14: 1448-1459). Фосфорилирование и активация Chk1 в клетках млекопитающего зависит от Atm (Chen et al., 1999) и Atr (Lui et al., 2000). Оказывается, что в дрожжах S. pombe Chk1 также принимает участие в ответной реакции на IR и блокирует репликацию (Boddyet al., 1998; Walworth et al., 1993). Кроме того, обнаружено, что Chk1 фосфорилирует как продукты генаwee1 (O'Connell et al., EMBO J. 1997; 16: 545-554), так и Pds1 (Sanchez et al., Science 1999; 286: 11661171), которые, как известно, являются важными в контроле клеточного цикла. Эти исследования демонстрируют, что Chk1 млекопитающих играет роль в точке контроля повреждения обеих Atm-зависимых ДНК, приводя к остановке у S-фазы. Однако роль Chk1 в точке контроля репликации S-фазы в клетках млекопитающего является еще не объясненной. Интересно, что мыши с дефицитом белка Chk1 являются эмбрионально летальными, что, таким образом, позволяет предположить роль Chk1 в развитии организма кроме его роли в точках контроля повреждения ДНК.Chk1 может вызывать остановку G2 посредством фосфорилирования и инактивирования Cdc25C,фосфатазы с двойной специфичностью, которая обычно дефосфорилирует циклин B/Cdc2, когда клетки прогрессируют в митоз (Fernery et al., Science, Sep. 5, 1997; 277 (5331): 1495-7; Sanchez et al.; Matsuoka etal.; and Blasina et al., Curr. Biol., Jan. 14, 1999; 9(1): 1-10). Этот механизм регуляции активности Cdc2 стимулирует остановку клеточного цикла для препятствия вступления клеток в митоз в присутствии повре-2 014954 ждения ДНК или нерепликацированной ДНК. Сущность изобретения Настоящее изобретение относится к сильнодействующим и селективным химиосенсибилизирующим агентам, полезным при лечении заболеваний и состояний, относящихся к повреждению ДНК или повреждениям в репликации ДНК. Настоящие соединения являются ингибиторами киназы точки контроля Chk1. Конкретно, арил- и гетероарилзамещенные производные мочевины демонстрируют значительную активность в ингибировании Chk1. В одном аспекте настоящее изобретение относится к способу ингибирования киназы точки контроля Chk1, включающему стадию введения соединения формулы (I) или композиции, содержащей его, индивидууму. Соединения формулы (I) являются соединениями структурной формулыR2 выбран из группы, состоящей из галогена, необязательно замещенного C1-6-алкила, где заместители выбраны из галогена, гидрокси, арила, гетероарила, гетероциклоалкила, N(R4)2 и SO2R4, C1-3 алкиленарила, C1-3-алкиленгетероарила, С 1-3-алкилен-С 3-8-гетероциклоалкила, С 1-3-алкилен-SO2-арила,С 2-6-алкенила, OCF3, NO2, CN, NC, N(R3)2, OR3, CO2R31, C(O)N(R3)2, C(O)R3, N(R1)C(O)R3, N(R1)C(O)OR3,N(R3)C(O)OR3,N(R3)C(O)-C1-3 алкилен-С(О)R3, N(R3)C(O)-C1-3-алкилен-C(O)OR3, N(R3)С(О)-C1-33 алкилен-OR , N(R3)С(О)-С 1-3-алкилен-NHC(О)OR3, N(R3)С(О)-С 1-3-алкилен-SO2NR3, С 1-3-алкилен-OR3 иR3 выбран из группы, состоящей из водорода, С 1-6-алкила, С 2-6-алкенила, циклоалкила, арила, гетероарила, SO2R4, С 1-6-алкила, замещенного одним или более заместителем, выбранным из галогена, гидрокси, арила, гетероарила, гетероциклоалкила, N(R4)2 и SO2R4, C1-3-алкиленарила, C1-3 алкиленгетероарила, С 1-3-алкилен-С 3-8-гетероциклоалкила, С 1-3-алкилен-SO2-арила, необязательно замещенного C1-3-алкилен-N(R4)2, OCF3, C1-3-алкилен-N(R4)3+, С 3-8-гетероциклоалкила и СН(С 1-3-алкиленN(R4)2)2, или 2 группы R3, взятые вместе, образуют необязательно замещенное 3-6-членное алифатическое кольцо;R4 выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила, гетероарила, C1-3 алкиленарила и SO2-C1-6-алкила, или 2 группы R4, взятые вместе, образуют необязательно замещенное 36-членное кольцо; причем циклоалкил представляет собой циклическую С 3-8-углеводородную группу; гетероциклоалкил представляет собой циклическую С 3-8-углеводородную группу, содержащую 1-3 гетероатома, выбранных из азота, кислорода или серы; причем циклоалкильные и гетероциклоалкильные группы могут быть насыщенными или частично ненасыщенными циклическими системами, замещенными, например, группами от одной до трех, независимо выбранными из C1-4-алкила, C1-3-алкилен-ОН, C(=O)NH2, NH2, оксо(=O), арила, трифторэтаноила и ОН; гетероциклоалкильные группы необязательно являются далее N-замещенными C1-3-алкиленарилом или C1-3-алкиленгетероарилом; арил представляет собой моноциклическую или полициклическую ароматическую группу, пред-3 014954 почтительно моноциклическую или бициклическую ароматическую группу, например фенил или нафтил, причем арильная группа может быть незамещенной или замещенной, например, одним или несколькими заместителями и особенно заместителями от одного до четырех, которыми являются галоген, C1-6 алкил, С 2-6-алкенил, OCF3, NO2, CN, NC, N(Ra)2, ORb, CO2Rb, C(O)N(Rb)2, C(O)Rb, N(Ra)CORb,N(Ra)C(O)ORb, N(Ra)C(O)ORb, N(Ra)С(О)-С 1-3-алкилен-C(O)Rb, N(Rb)CO-C1-3-алкилен-C(O)ORb, N(Rb)COC1-3-алкилен-ORb, N(Rb)CO-C1-3-алкилен-NHC(O)ORb, N(Rb)CO-C1-3-алкилен-SO2NRb, C1-3-алкилен-ORb иSRb, где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, арила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, гидрокси, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, и Ra имеет значения, указанные ниже; гетероарил представляет собой моно- или бициклическую кольцевую систему, содержащую по меньшей мере один атом азота, кислорода или серы, необязательно замещенный 1-4 заместителями, выбранными из водорода, C1-6-алкила, C1-6-алкокси, арила, N(Ra)2, ORb и галогена; где Ra выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила и SO2C1-6-алкила,или 2 Ra группы вместе образуют необязательно замещенное 3-6-членное кольцо; где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, ОН, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, где Ra определен выше,и являются их фармацевтически приемлемыми солями или сольватами. В другом аспекте настоящее изобретение относится к арил- и гетероарилдизамещенным производным мочевины, имеющим структурную формулу (II)W' представляет собой группу необязательно замещенную 1-4 заместителями, выбранными из группы, состоящей из C1-6-алкила, арила, N(R7)2, OR7, N3, CN, C(O)R7, C1-3-алкиленарила, C1-3 алкилен-N(R2)2, галогена иL' выбран из группы, состоящей из CR10; М' выбран из группы, состоящей из CR11; где R7 представляет С 1-3-алкилен-С 3-8-гетероциклоалкил; каждый из R8, R9 и R10 независимо выбран из группы, состоящей из водорода, галогена, необязательно замещенного С 1-6-алкила, С 2-6-алкенила, OCF3, NO2, CN, NC, N(R7)2, OR7, CO2R7, C(O)N(R7)2,C(O)R7, N(R13)C(O)R7, N(R13)C(O)OR7, N(R7)C(O)OR7, N(R7)C(O)-C1-3-алкилен-C(O)R7, N(R7)С(О)-C1-3 алкилен-С(О)OR7, N(R7)C(O)С-С 1-3-алкилен-OR7, N(R7)C(O)-C1-3-алкилен-NHC(О)OR7, N(R7)С(О)-С 1-3 алкилен-SO2NR7, CF3, С 1-3-алкилен-N(R12)SO2-арила, С 1-3-алкилен-N(R12)SO2-гетероарила, С 1-3-алкиленО-С 1-3-алкиленарила, С 1-3-алкилен-N(R12)-C1-3-алкиленарила, C1-3-алкилен-N(R12)-C1-3-алкиленгетероС 1-3-алкилен-N(R12)С(О)-С 1-3-алкилен-OR2,С 1-3-алкиленарила,С 1-3-алкилен-N(R12)C(O)R7,12 12R12 выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила, гетероарила, C1-3 алкиленарила и SO2-C1-6-алкила, или 2 группы R12, взятые вместе, образуют необязательно замещенное 3-4 014954 6-членное кольцо; иR13 представляет водород; причем циклоалкил представляет собой циклическую С 3-8-углеводородную группу; гетероциклоалкил представляет собой циклическую С 3-8-углеводородную группу, содержащую 1-3 гетероатома, выбранных из азота, кислорода или серы; циклоалкильные и гетероциклоалкильные группы могут быть насыщенными или частично ненасыщенными циклическими системами, замещенными, например, группами от одной до трех, независимо выбранными из C1-4-алкила, C1-3-алкилен-ОН, C(=O)NH2, NH2, оксо(=O), арила, трифторэтаноила и ОН; гетероциклоалкильные группы необязательно являются далее N-замещенными C1-3-алкиленарилом илиC1-3-алкиленгетероарилом; арил представляет собой моноциклическую или полициклическую ароматическую группу, предпочтительно моноциклическую или бициклическую ароматическую группу, например фенил или нафтил, причем арильная группа может быть незамещенной или замещенной, например, одним или несколькими заместителями и особенно заместителями от одного до четырех, которыми являются галоген, C1-6 алкил, С 2-6-алкенил, OCF3, NO2, CN, NC, N(Ra)2, ORb, CO2Rb, C(O)N(Rb)2, C(O)Rb, N(Ra)CORb,N(Ra)C(O)ORb, N(Ra)C(O)ORb, N(Ra)С(O)-C1-3-алкилен-C(O)Rb, N(Rb)CO-C1-3-алкилен-C(O)ORb, N(Rb)COC1-3-алкилен-ORb, N(Rb)CO-C1-3-алкилен-NHC(O)ORb, N(Rb)СО-С 1-3-алкилен-SO2NR13, C1-3-алкилен-ORb иSRb, где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, арила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, гидрокси, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, и Ra имеет значения, указанные ниже; гетероарил представляет собой моно- или бициклическую кольцевую систему, содержащую по меньшей мере один атом азота, кислорода или серы, необязательно замещенный 1-4 заместителями, выбранными из водорода, C1-6-алкила, C1-6-алкокси, арила, N(Ra)2, ORb и галогена; где Ra выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила и SO2C1-6-алкила,или 2 Ra группы вместе образуют необязательно замещенное 3-6-членное кольцо; где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, ОН, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, где Ra определен выше,или их фармацевтически приемлемой соли. Настоящее изобретение также относится к соединению, имеющему формулуL' представляет CR10; М' представляет CR11; где R7 независимо выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, арила, гетероарила, SO2R12, C1-6-алкила, замещенного одним или более заместителем, выбранным из галогена, гидрокси, арила, гетероарила, гетероциклоалкила, N(R12)2 и SO2R12; C1-3-алкиленарила, C1-3 алкиленгетероарила, С 1-3-алкилен-С 3-8-гетероциклоалкила, С 1-3-алкилен-SO2-арила, необязательно замещенного С 1-3-алкилен-N(R12)2, OCF3, C1-3-алкилен-N(R12)3+, С 3-8-гетероциклоалкила и СН(С 1-3-алкилен-5 014954N(R12)2)2, или 2 группы R7, взятые вместе, образуют необязательно замещенное 3-6-членное алифатическое кольцо; каждый из R8, R9 и R10 независимо выбран из группы, состоящей из водорода, галогена, необязательно замещенного C1-6-алкила, С 2-6-алкенила, OCF3, NO2, CN, NC, N(R7)2, OR7, CO2R7, C(O)N(R7)2,C(O)R7, N(R13)C(O)R7, N(R13)C(O)OR7, N(R7)C(O)OR7, N(R7)C(O)-C1-3-алкилен-C(O)R7, N(R7)С(О)-C1-3 алкилен-С(О)OR7, N(R7)C(O)C-C1-3-алкилен-OR7, N(R7)С(О)-С 1-3-алкилен-NHC(О)OR7, N(R7)С(О)-C1-3 алкилен-SO2NR7, CF3, С 1-3-алкилен-N(R12)-SO2-арила, С 1-3-алкилен-N(R12)-SO2-гетероарила, С 1-3-алкиленО-С 1-3-алкиленарила, С 1-3-алкилен-N(R12)-С 1-3-алкиленарила, С 1-3-алкилен-N(R12)-С 1-3-алкиленгетероарила,С 1-3-алкилен-N(R12)-С(О)R7,С 1-3-алкилен-N(R12)С(О)-C1-3-алкилен-OR2,С 1-3-алкилен 12 12R12 выбран из группы, состоящей из водорода, С 1-6-алкила, циклоалкила, арила, гетероарила, С 1-3 алкиленарила и SO2-C1-6-алкила, или 2 группы R12, взятые вместе, образуют необязательно замещенное 36-членное кольцо;R13 выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила и арила; при условии, что когда Q' представляет OCH3, то по меньшей мере один из R8, R9 и R10 отличается от водорода, СН 3, ОСН 3 и галогена,причем циклоалкил представляет собой циклическую С 3-8-углеводородную группу; гетероциклоалкил представляет собой циклическую С 3-8-углеводородную группу, содержащую 1-3 гетероатома, выбранных из азота, кислорода или серы; причем циклоалкильные и гетероциклоалкильные группы могут быть насыщенными или частично ненасыщенными циклическими системами, замещенными, например, группами от одной до трех, независимо выбранными из C1-4-алкила, C1-3-алкилен-ОН, C(=O)NH2, NH2, оксо(=O), арила, трифторэтаноила и ОН; гетероциклоалкильные группы необязательно являются далее N-замещенными C1-3-алкиленарилом или C1-3-алкиленгетероарилом; арил представляет собой моноциклическую или полициклическую ароматическую группу, предпочтительно моноциклическую или бициклическую ароматическую группу, например фенил или нафтил, причем арильная группа может быть незамещенной или замещенной, например, одним или несколькими заместителями и особенно заместителями от одного до четырех, которыми являются галоген, C1-6 алкил, С 2-6-алкенил, OCF3, NO2, CN, NC, N(Ra)2, ORb, CO2Rb, C(O)N(Rb)2, C(O)Rb, N(Ra)CORb,N(Ra)C(O)ORb, N(Ra)C(O)ORb, N(Ra)С(О)-C1-3-алкилен-C(O)Rb, N(Rb)CO-C1-3-алкилен-C(O)ORb, N(Rb)COС 1-3-алкилен-ORb, N(Rb)CO-C1-3-алкилен-NHC(O)ORb, N(Rb)СО-C1-3-алкилен-SO2NRb, С 1-3-алкилен-ORb иSRb, где Rb выбран из группы, состоящей из водорода, С 1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, арила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, гидрокси, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, и Ra имеет значения, указанные ниже; гетероарил представляет собой моно- или бициклическую кольцевую систему, содержащую по меньшей мере один атом азота, кислорода или серы, необязательно замещенный 1-4 заместителями, выбранными из водорода, C1-6-алкила, C1-6-алкокси, арила, N(Ra)2, ORb и галогена; где Ra выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила и SO2C1-6-алкила,или 2 Ra группы вместе образуют необязательно замещенное 3-6-членное кольцо; где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, ОН, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, где Ra определен выше,или его фармацевтически приемлемой соли либо пролекарству или сольватам. Настоящее изобретение относится также к соединению формулыL' представляет CR10; М' представляет CR11; где R7 независимо выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, арила, гетероарила, SO2R12, C1-6-алкила, замещенного одним или более заместителем, выбранным из галогена, гидрокси, арила, гетероарила, гетероциклоалкила, N(R12)2 и SO2R12; C1-3-алкиленарила, C1-3 алкиленгетероарила, C1-3-алкилен-С 3-8-гетероциклоалкила, C1-3-алкилен-SO2-арила, необязательно замещенного С 1-3-алкилен-N(R12)2, OCF3, C1-3-алкилен-N (R12)3+, С 3-8-гетероциклоалкила и СН(C1-3-алкиленN(R12)2)2, или 2 группы R7, взятые вместе, образуют необязательно замещенное 3-6-членное алифатическое кольцо; каждый из R8, R9 и R10 независимо выбран из группы, состоящей из водорода, галогена, необязательно замещенного C1-6-алкила, С 2-6-алкенила, OCF3, NO2, CN, NC, N(R7)2, OR7, CO2R7, C(O)N(R7)2,C(O)R7, N(R13)C(O)R7, N(R13)C(O)OR7, N(R7)C(O)OR7, N(R7)С(О)-С 1-3-алкилен-C(O)R7, N(R7)С(О)-С 1-3 алкилен-С(О)OR7, N(R7)С(О)C-C1-3-алкилен-OR7, N(R7)С(О)-С 1-3-алкилен-NHC(О)OR7, N(R7)С(О)-С 1-3 алкилен-SO2NR7, CF3, С 1-3-алкилен-N(R12)-SO2-арила, С 1-3-алкилен-N(R12)-SO2-гетероарила, C1-3-алкиленO-C1-3-алкиленарила, С 1-3-алкилен-N(R12)-C1-3-алкиленарила, C1-3-алкилен-N(R12)-C1-3-алкиленгетероарила,С 1-3-алкилен-N(R12)-С(О)R7,C1-3-алкилен-N(R12)С(О)-C1-3-алкилен-OR2,С 1-3-алкилен 12 12R12 выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила, гетероарила, C1-3 алкиленарила и SO2-C1-6-алкила, или 2 группы R12, взятые вместе, образуют необязательно замещенное 36-членное кольцо; иR13 выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила и арила; при условии, что когда Q' представляет ОСН 3, то по меньшей мере один из R8, R9 и R10 отличается от водорода, СН 3, ОСН 3 и галогена; причем циклоалкил представляет собой циклическую С 3-8-углеводородную группу; гетероциклоалкил представляет собой циклическую С 3-8-углеводородную группу, содержащую 1-3 гетероатома, выбранных из азота, кислорода или серы; причем циклоалкильные и гетероциклоалкильные группы могут быть насыщенными или частично ненасыщенными циклическими системами, замещенными, например, группами от одной до трех, независимо выбранными из C1-4-алкила, C1-3-алкилен-ОН, C(=O)NH2, NH2, оксо(=O), арила, трифторэтаноила и ОН; гетероциклоалкильные группы необязательно являются далее N-замещенными C1-3-алкиленарилом или C1-3-алкиленгетероарилом; арил представляет собой моноциклическую или полициклическую ароматическую группу, предпочтительно моноциклическую или бициклическую ароматическую группу, например фенил или нафтил, причем арильная группа может быть незамещенной или замещенной, например, одним или несколькими заместителями и особенно заместителями от одного до четырех, которыми являются галоген, C1-6 алкил, С 2-6-алкенил, OCF3, NO2, CN, NC, N(Ra)2, ORb, CO2Rb, C(O)N(Rb)2, C(O)Rb, N(Ra)CORb,N(Ra)C(O)ORb, N(Ra)C(O)ORb, N(Ra)С(О)-C1-3-алкилен-С(О)Rb, N(Rb)CO-C1-3-алкилен-C(O)ORb, N(Rb)COC1-3-алкилен-ORb, N(Rb)CO-C1-3-алкилен-NHC(O)ORb, N(Rb)CO-C1-3-алкилен-SO2NRb, C1-3-алкилен-ORb иSRb, где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, арила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, гидрокси, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, и Ra имеет значения, указанные ниже; гетероарил представляет собой моно- или бициклическую кольцевую систему, содержащую по меньшей мере один атом азота, кислорода или серы, необязательно замещенный 1-4 заместителями, выбранными из водорода, C1-6-алкила, C1-6-алкокси, арила, N(Ra)2, ORb и галогена; где Ra выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила и SO2C1-6-алкила,или 2 Ra группы вместе образуют необязательно замещенное 3-6-членное кольцо; где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, ОН, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, где Ra определен выше,или его фармацевтически приемлемой соли либо пролекарству или сольватам.-7 014954 Настоящее изобретение относится также к фармацевтическим композициям, содержащим одно или несколько соединений структурной формулы, указанной выше, к применению соединений и композиций,содержащих указанные соединения, при терапевтическом лечении заболевания или нарушения. Подробное описание предпочтительных вариантов осуществления Ионизирующее излучение и большинство химиотерапевтических агентов являются терапевтически полезными, поскольку они оказывают полезное влияние на аномальную пролиферацию опухолевых клеток. Клеточные процессы, такие как репарация ДНК и точки контроля клеточного цикла, защищают опухолевые клетки от токсичных действий физических и химических агентов. Лечения, которые модулируют основные молекулярные механизмы развития клеточного цикла и устойчивость к повреждению ДНК,могут потенцировать уничтожение опухолевых клеток и повысить терапевтический индекс существующих терапий. Большинство химиотерапевтических агентов действует посредством разрушения метаболизма ДНК. Поскольку эти процессы совместно используются как нормальными, так и опухолевыми клетками,и поскольку сохранение целостности ДНК является существенным для жизнеспособности клеток, противораковые лекарственные средства имеют самый низкий терапевтический индекс среди любого класса лекарственных средств. Идентификацией и ингибированием клеточных процессов, в которых принимают участие опухолевые клетки, можно повысить эффективность схем радиационного и химиотерапевтического лечения. Нарушение функции белка точек контроля повреждения ДНК обеспечивает новые средства уничтожения опухолевых клеток в отличие от нормальных клеток. Например, Chk1 обеспечивает тот факт,что клетки с неисправленными повреждениями, вызванными некоторыми лекарственными средствами или ионизирующим излучением, не развиваются через фазу синтеза ДНК или митоз до тех пор, пока не будут устранены хромосомные повреждения. В соответствии с этим опухолевые клетки, обработанные ингибитором Chk1 в комбинации с агентом, повреждающим ДНК, можно уничтожить с использованием меньших количеств повреждающего ДНК агента, чем опухолевые клетки, обработанные только агентом,повреждающим ДНК. Повреждение точек контроля клеточного цикла в нормальных клетках предрасполагает индивидуума ко многим болезненным состояниям, таким как рак, атаксия-телангиэстазия, эмбриональные аномальности и различные иммунологические дефекты, ассоциированные с аберрантным развитием В- и Тклеток, или непосредственно вызывает такие болезненные состояния. Аберрантное развитие ассоциируется с патологическими состояниями волчанки, артрита и аутоиммунных заболеваний. Интенсивные усилия исследований поэтому были сфокусированы на идентификации точек контроля клеточного цикла и белках, имеющих существенное значение для деятельности точек контроля. Нераковая ткань, имеющая неповрежденные точки контроля клеток, обычно отделена от временного повреждения пути одной точки контроля, такого как путь Chk1. Опухолевые клетки, однако, имеют множество дефектов в путях, контролирующих развитие клеточного цикла, так что нарушение точки контроля повреждения ДНК может сделать клетки особенно восприимчивыми к повреждающим ДНК агентам. Следовательно, предполагается, что ингибиторы точек контроля повышают терапевтический индекс, который измеряет вероятность контроля опухоли относительно вероятности токсичности ионизирующего излучения и системной химиотерапии для нормальных клеток. В противоположность этому другие классы ингибиторов не могут быть доступными для комбинационной химиотерапии, поскольку как нормальная, так и опухолевая ткань могут сенсибилизироваться подобным образом. Один аспект настоящего изобретения относится к способу ингибирования Chk1, включающему стадию введения терапевтически эффективного количества соединения, имеющего структурную формулуR2 выбран из группы, состоящей из галогена, необязательно замещенного C1-6-алкила, где замести-8 014954 тели выбраны из галогена, гидрокси, арила, гетероарила, гетероциклоалкила, N(R4)2 и SO2R4, C1-3 алкиленарила, C1-3-алкиленгетероарила, С 1-3-алкилен-С 3-8-гетероциклоалкила, С 1-3-алкилен-SO2-арила; С 2-6-алкенила, OCF3, NO2, CN, NC, N(R3)2, OR3, CO2R31, C(O)N(R3)2, C(O)R3, N(R1)C(O)R3, N(R1)C(O)OR3,N(R3)C(O)OR3,N(R3)C(O)-C1-3 алкилен-С(О)R3, N(R3)C(O)-C1-3-алкилен-C(O)OR3, N(R3)С(О)-C1-33 алкилен-OR , N(R3)С(О)-С 1-3-алкилен-NHC(O)OR3, N(R3)С(О)-С 1-3-алкилен-SO2NR3, C1-3-алкилен-OR3 иR3 выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, арила, гетероарила, SO2R4, C1-6-алкила, замещенного одним или более заместителем, выбранным из галогена, гидрокси, арила, гетероарила, гетероциклоалкила, N(R4)2 и SO2R4, C1-3-алкиленарила, C1-3 алкиленгетероарила, C1-3-алкилен-С 3-8-гетероциклоалкила, С 1-3-алкилен-SO2-арила, необязательно замещенного С 1-3-алкилен-N(R4)2, OCF3, C1-3-алкилен-N(R4)3+, С 3-8-гетероциклоалкила и СН(C1-3-алкиленN(R4)2)2, или 2 группы R3, взятые вместе, образуют необязательно замещенное 3-6-членное алифатическое кольцо;R4 выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила, гетероарила, C1-3 алкиленарила и SO2-C1-6-алкила, или 2 группы R4, взятые вместе, образуют необязательно замещенное 36-членное кольцо; причем циклоалкил представляет собой циклическую С 3-8-углеводородную группу; гетероциклоалкил представляет собой циклическую С 3-8-углеводородную группу, содержащую 1-3 гетероатома, выбранных из азота, кислорода или серы; причем циклоалкильные и гетероциклоалкильные группы могут быть насыщенными или частично ненасыщенными циклическими системами, замещенными, например, группами от одной до трех, независимо выбранными из C1-4-алкила, C1-3-алкилен-ОН, C(=O)NH2, NH2, оксо(=O), арила, трифторэтаноила и ОН, причем гетероциклоалкильные группы необязательно являются далее N-замещенными C1-3 алкиленарилом или C1-3-алкиленгетероарилом; арил представляет собой моноциклическую или полициклическую ароматическую группу, предпочтительно моноциклическую или бициклическую ароматическую группу, например фенил или нафтил, причем арильная группа может быть незамещенной или замещенной, например, одним или несколькими заместителями и особенно заместителями от одного до четырех, которыми являются галоген, C1-6 алкил, С 2-6-алкенил, OCF3, NO2, CN, NC, N(Ra)2, ORb, CO2Rb, C(O)N(Rb)2, C(O)Rb, N(Ra)CORb,N(Ra)C(O)ORb, N(Ra)C(O)ORb, N(Ra)С(O)-C1-3-алкилен-C(O)Rb, N(Rb)CO-C1-3-алкилен-C(O)ORb, N(Rb)COС 1-3-алкилен-ORb, N(Rb)CO-C1-3-алкилен-NHC(O)ORb, N(Rb)CO-C1-3-алкилен-SO2NRb, С 1-3-алкилен-ORb иSRb, где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, арила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, гидрокси, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, и Ra имеет значения, указанные ниже; гетероарил представляет собой моно- или бициклическую кольцевую систему, содержащую по меньшей мере один атом азота, кислорода или серы, необязательно замещенный 1-4 заместителями, выбранными из водорода, C1-6-алкила, C1-6-алкокси, арила, N(Ra)2, ORb и галогена; где Ra выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила и SO2C1-6-алкила,или 2 Ra группы вместе образуют необязательно замещенное 3-6-членное кольцо; где Rb выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, гетероарила, SO2Ra и C1-6-алкила, замещенного галогеном, ОН, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, где Ra определен выше,или его фармацевтически приемлемой соли либо пролекарства или сольвата. Более предпочтительными соединениями способа являются соединения структурной формулы,где X1 и X2 представляют -N(H)-;L представляет CR22; М представляет CR23; где каждый из R20, R21 и R22 независимо выбран из группы, состоящей из водорода, галогена, необязательно замещенного C1-6-алкила, С 2-6-алкенила, OCF3, NO2, CN, NC, N(R25)2, OR25, CO2R25, C(O)N(R25)2,C(O)R25, N(R24)C(O)R25, N(R24)C(O)OR25, N(R25)C(O)OR25, N(R25)C(O)-C1-3-алкилен-C(O)R25, N(R25)С(О)С 1-3-алкилен-С(О)OR25,N(R25)С(О)C-C1-3-алкилен-OR25,N(R25)С(О)-C1-3-алкилен-NHC(О)OR25,25 25 25R26 выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила и SO2-С 1-6-алкила,или 2 группы R4, взятые вместе, образуют необязательно замещенное 3-6-членное кольцо. Дополнительными предпочтительными соединениями являются соединения, у которых W необязательно замещен 1-3 заместителями, выбранными из группы, состоящей из необязательно замещенногоC1-6-алкила, арила, N(R3)2, OR3 и галогена. Предпочтительными соединениями по изобретению также являются соединения,где J представляет CR20, где R20 выбран из группы, состоящей из водорода, необязательно замещенного C1-6-алкила и галогена;L представляет CR22 один из R21 и R22 представляет водород, а другой представляет заместитель, выбранный из группы,состоящей из CO2R25, C(O)N(R25)2, C(O)R25, N(R24)C(O)R25, N(R24)C(O)OR25, N(R25)C(O)OR25, N(R25)С(О)C1-3-алкилен-С(О)R25, N(R25)С(О)С 1-3-алкилен-С(О)OR25, N(R25)С(О)С 1-3-алкилен-OR25, N(R25)С(О)-С 1-3 алкилен-NHC(О)OR25, N(R25)С(О)-C1-3-алкилен-SO2NR25, CF3, С 1-3-алкилен-N(R25)-SO2-арил, С 1-3 алкилен-N(R25)-SO2-гетероарил, С 1-3-алкилен-О-С 1-3-алкиленарил, С 1-3-алкилен-N(R25)-C1-3-алкиленарил,C1-3-алкилен-N(R25)-C1-3 алкилен-гетероарил, С 1-3-алкилен-N(R25)-С(О)R7, C1-3-алкилен-N(R25)С(О)-С 1-3 алкилен-OR2, С 1-3-алкилен-N(R25)С(О)арил, С 1-3-алкилен-N(R25)С(О)-С 1-3-алкилен-N(R25)2, C1-3-алкиленN(R25)С(О)гетероарила, C1-3-алкилен-OR25 и SR25. Соединения, предпочтительные для использования в указанном способе, включают также соединения,где J представляет CR20, где R20 выбран из группы, состоящей из водорода, необязательно замещенного C1-6-алкила и галогена;L представляет CR22; один из R21 и R22 представляет водород, а другой представляет заместитель, выбранный из группы,состоящей из CO2R25, C(O)N(R25)2, C(O)R25, N(R24)С(О)R25, N(R24)С(О)OR25, N(R25)C(O)OR25, N(R25)С(О)C1-3-алкилен-С(О)R25, N(R25)С(О)C1-3-алкилен-C(O)OR25, N(R25)С(О)C1-3-алкилен-OR25, N(R25)С(О)-С 1-3 алкилен-NHC(O)OR25, N(R25)С(О)-C1-3-алкилен-SO2NR25, CF3, C1-3-алкилен-N(R25)-SO2-арил, С 1-3 алкилен-N(R25)-SO2-гетероарил, C1-3-алкилен-O-С 1-3-алкиленарил, С 1-3-алкилен-N(R25)-C1-3-алкиленарил,C1-3-алкилен-N(R25)-C1-3 алкилен-гетероарил, С 1-3-алкилен-N(R25)-C(O)R7, С 1-3-алкилен-N(R25)С(О)-С 1-3 алкилен-OR2, C1-3-алкилен-N(R25)С(О)арил, С 1-3-алкилен-N(R25)С(О)-С 1-3-алкилен-N(R25)2, C1-3-алкиленN(R25)С(О)гетероарил, С 1-3-алкилен-OR25 и SR25. Способ ингибирования Chk1 можно также использовать для сенсибилизации опухолевой клетки к химиотерапевтическому агенту. Как таковое, настоящее изобретение относится также к способу сенсибилизации опухолевой клетки к химиотерапевтическому агенту, включающему введение индивидууму вышеуказанного соединения или его соли, сольвата, или производного, или композиции, включающей такое соединение. В другом аспекте настоящее изобретение относится к арил- и гетероарилдизамещенным производным мочевины, имеющим структурную формулуL' представляет CR10; М' представляет CR11; где R7 независимо выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, циклоалкила, арила, гетероарила, SO2R12, C1-6-алкила, замещенного одним или более заместителем, выбранным из галогена, гидрокси, арила, гетероарила, гетероциклоалкила, N(R12)2 и SO2R12; C1-3-алкиленарила, C1-3 алкиленгетероарила, C1-3-алкилен-С 3-8-гетероциклоалкила, С 1-3-алкилен-SO2-арила, необязательно замещенного С 1-3-алкилен-N(R12)2, OCF3, C1-3-алкилен-N(R12)3+, С 3-8-гетероциклоалкила и СН(C1-3-алкиленN(R12)2)2, или 2 группы R7, взятые вместе, образуют необязательно замещенное 3-6-членное алифатическое кольцо; каждый из R8, R9 и R10 независимо выбран из группы, состоящей из водорода, галогена, необязательно замещенного C1-6-алкила, С 2-6-алкенила, OCF3, NO2, CN, NC, N(R7)2, OR7, CO2R7, C(O)N(R7)2,C(O)R7, N(R13)C(O)R7, N(R13)C(O)OR7, N(R7)C(O)OR7, N(R7)C(O)-C1-3-алкилен-C(O)R7, N(R7)С(О)-C1-3 алкилен-С(О)OR7, N(R7)C(O)С-С 1-3-алкилен-OR7, N(R7)С(О)-C1-3-алкилен-NHC(О)OR7, N(R7)С(О)-С 1-3 алкилен-SO2NH7, CF3, C1-3-алкилен-N(R12)-SO2-арила, С 1-3-алкилен-N(R12)-SO2-гетероарила, С 1-3-алкиленО-С 1-3-алкиленарила, C1-3-алкилен-N(R12)-C1-3-алкиленарила, C1-3-алкилен-N(R12)-C1-3-алкиленгетероарила,С 1-3-алкилен-N(R12)-С(O)R7,C1-3-алкилен-N(R12)С(О)-C1-3-алкилен-OR2,С 1-3-алкилен 12 12R12 выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила, гетероарила, C1-3 алкиленарила и SO2-C1-6-алкила, или 2 группы R12, взятые вместе, образуют необязательно замещенное 36-членное кольцо; иR13 выбран из группы, состоящей из водорода, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила и арила; при условии, что когда Q' представляет OCH3, то по меньшей мере один из R8, R9 и R10 отличается от водорода, СН 3, OCH3 и галогена,и их фармацевтически приемлемым солям или сольватам. Предпочтительными соединениями указанной структурной формулы являются соединения, у которых W' замещен 1-3 заместителями, выбранными из группы, состоящей из метила, CF3, необязательно замещенного арила, N3, бензила, C(O)R7, C1-3-алкилен-N(R12)2, OR7, N(R7)2, галогена и- 11014954 алкилен-OR2, С 1-3-алкилен-N(R12)С(О)арила, С 1-3-алкилен-N(R12)С(О)-С 1-3-алкилен-N(R12)2, C1-3-алкиленN(R12)C(O)гетероарила и SR7. Используемый здесь термин "алкил" включает углеводородные группы с неразветвленной или разветвленной цепью, содержащие указанное число атомов углерода, в типичном случае, метильную,этильную и неразветвленные и разветвленные пропильные и бутильные группы. Если не оговорено особо, углеводородная группа может содержать вплоть до 20 атомов углерода. Термин "алкил" включает"мостиковый алкил", т.е. С 6-16-бициклическую или полициклическую углеводородную группу, например норборнил, адамантил, бицикло[2.2.2]октил, бицикло[2.2.1]гептил, бицикло[3.2.1]октил или декагидронафтил. Алкильные группы могут быть замещены, например, гидрокси (ОН), галогеном, арилом, гетероарилом, циклоалкилом, гетероциклоалкилом, амино (N(Ra)2) и сульфонилом (SO2Ra), где Ra выбран из группы, состоящей из водорода, C1-6-алкила, циклоалкила, арила и SO2-С 1-6-алкила, или 2 группы Ra взяты вместе с образованием необязательно замещенного от 3- до 6-членного кольца. Термин "циклоалкил" определяется как циклическая С 3-8-углеводородная группа, например циклопропил, циклобутил, циклогексил и циклопентил. "Гетероциклоалкил" определяется аналогично, как циклоалкил, и включает бициклические и полициклические группы, за исключение того, что кольцо содержит от одного до трех гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы. Циклоалкильные и гетероциклоалкильные группы могут быть насыщенными или частично ненасыщенными циклическими системами, замещенными, например, группами от одной до трех, независимо выбранными из С 1-4-алкила, C1-3-алкилен-ОН, C(=O)NH2, NH2, оксо(=O), арила, трифторэтаноила и ОН; гетероциклоалкильные группы необязательно являются далее N-замещенными C1-3-алкиленарилом илиC1-3-алкиленгетероарилом. Термин "алкенил" определяется идентично "алкилу", за исключением того, что заместитель содержит углерод-углеродную двойную связь. Термин "алкинил" определяется идентично "алкилу", за исключением того, что заместитель содержит углерод-углеродную тройную связь. Термин "алкилен" относится к алкильной группе, имеющей заместитель. Например, термин "C1-3 алкилен-С(О)OR" относится к алкильной группе, содержащей от одного до трех атомов углерода и замещенной группой -С(О)OR. Алкиленовая группа является необязательно замещенной одним или несколькими арилами, гетероарилами и OR7, где R7 имеет указанные выше значения. Термин "галоген" определен здесь как включающий фтор, бром, хлор и йод. Термин "арил", в отдельности или к комбинации, определен здесь как моноциклическая или полициклическая ароматическая группа, предпочтительно моноциклическая или бициклическая ароматическая группа, например фенил или нафтил. Если не указано особо, "арильная" группа может быть незамещенной или замещенной, например, одним или несколькими заместителями и особенно заместителями от одного до четырех, которыми являются галоген, C1-6-алкил, С 2-6-алкенил, OCF3, NO2, CN, NC, N(Ra)2,ORb, CO2Rb, C(O)N(Rb)2, C(O)Rb, N(Ra)CORb, N(Ra)C(O)ORb, N(Ra)C(O)ORb, N(Ra)C(O)-C1-3-алкиленC(O)Rb, N(Rb)CO-C1-3-алкилен-C(O)ORb, N(Rb)CO-C1-3-алкилен-ORb, N(Rb)СО-С 1-3-алкилен-NHC(O)ORb,N(Rb)CO-C1-3-алкилен-SO2NRb, C1-3-алкилен-ORb и SRb, где Rb выбран из группы, состоящей из водорода,C1-6-алкила, С 2-6-алкенила, циклоалкила, гетероциклоалкила, арила, гетероарила, SO2Ra и C1-6-алкила,замещенного галогеном, гидрокси, арилом, гетероарилом, гетероциклоалкилом, N(Ra)2 или SO2Ra, и Ra имеет значения, указанные ранее. Примеры арильных групп включают фенил, нафтил, тетрагидронафтил, 2-хлорфенил, 3-хлорфенил,4-хлорфенил, 2-метилфенил, 4-метоксифенил, 3-трифторметилфенил, 4-нитрофенил, 2-метоксифенил,2,4-метоксихлорфенил и т.п. Термин "арил-С 1-3-алкил" и "гетероарил-С 1-3-алкил" определены как арильная или гетероарильная группа, имеющая C1-3-алкильный заместитель. Термин "гетероарил" определен здесь как моноциклическая или бициклическая система, содержащая один или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, причем система может быть незамещенной или замещенной, например,одним или несколькими заместителями, особенно заместителями от одного до четырех, например водородом, C1-6-алкилом, C1-6-алкокси, арилом, N(Ra)2, ORb и галогеном, где Ra и Rb имеют указанные выше значения. Примеры гетероарильных групп включают, но не ограничиваются ими, тиенил, фурил, пиридил, оксазолил, хинолил, изохинолил, индолил, триазолил, изотиазолил, изоксазолил, имидазолил, бензотиазолил, пиразинил, пиримидинил, тиазолил и тиадиазолил. Термин "гидрокси" определен как -ОН. Термин "3-6-членное кольцо", используемый здесь, относится к карбоциклическим и гетероциклическим алифатическим или ароматическим группам, включающим, но не ограничивающимся перечисленным, морфолинил, пипоридипил, фенил, пиперидинил, фурил, пирролил, имидазолил, пиримидинил и пиридинил, необязательно замещенный одной или несколькими группами, в особенности группами от одной до трех, примеры которых приводятся выше для "арильных" групп. Содержание атомов углерода содержащих углеводород остатков указывается индексом, предназначенным для обозначения минимального и максимального числа атомов углерода в остатке, например"C1-6-алкил" относится к алкильной группе, имеющей от одного до шести атомов углерода включительно.- 12014954 В структурах, показанных здесь, у связи с отсутствующим заместителем является метил, например Когда у атома углерода на кольце не показан присоединенный заместитель, это означает, что атом углерода содержит подходящее число атомов водорода. Кроме того, когда у карбонильной группы или атома азота не показан присоединенный заместитель, это означает, что заместителем является водород,например и R-N является R-NH2. Аббревиатурой метила является Me. Аббревиатурой карбонила (С=(O является СО или С(О). Обозначение N(RX)2, где х представляет альфа или числовой символ, такой как, например, Ra, Rb,4 12R , R и т.п., используют для обозначения двух групп Rx, присоединенных к общему атому азота. Когда используют такое обозначение, группы Rx могут быть одинаковыми или разными и выбраны из группы,определяемой группой Rx. Настоящее изобретение относится также к фармацевтическим композициям, содержащим одно или несколько соединений структурных указанных выше формул, к применению соединений и композиций,содержащих эти соединения, при терапевтическом лечении заболевания или нарушения. Соединения, полезные для способа настоящего изобретения, демонстрируют активность при ингибировании Chk1 in vitro. Соединения настоящего изобретения демонстрируют селективность для Chk1 по сравнению с другими протеинкиназами, включая Cdc2, Chk2, Atr, ДНК-PK, PKA и CaM KII. Соединения настоящего изобретения можно использовать для потенцирования терапевтических действий ионизирующего излучения и/или химиотерапевтических средств, используемых при лечении раковых заболеваний и других нарушений пролиферации клеток у людей или животных. Например, соединения изобретения можно использовать для усиления лечения опухолей, которые обычно лечат антиметаболитом, например метотрексатом или 5-фторурацилом (5-FU). Способ настоящего изобретения включает введение соединения-ингибитора Chk1 в комбинации с химиотерапевтическим агентом, который может действовать с разрушением одноцепочечной и двухцепочечной ДНК или который может блокировать репликацию ДНК или пролиферацию клеток. В альтернативном случае способ настоящего изобретения включает введение соединения-ингибитора Chk1 в комбинации с терапиями, которые включают использование антитела, например герцептина, который обладает активностью в ингибировании пролиферации раковых клеток. В соответствии с этим такие раковые заболевания, как колоректальные раковые заболевания, раковые заболевания головы и шеи, панкреатические раковые заболевания, раковые заболевания молочной железы, желудочные раковые заболевания, раковые заболевания мочевого пузыря, раковые заболевания наружных женских половых органов, лейкозы, лимфомы, меланомы, карциномы почечных клеток, раковые заболевания яичников, опухоли головного мозга, остеосаркомы и карциномы легких, являются восприимчивыми к усиленному лечению в комбинации с ингибиторами Chk1 изобретения. Опухоли и неоплазмы включают рост клеток тканей, где размножение клеток является неконтролируемым и нарастающим. Некоторые такие новообразования являются доброкачественными, но другие называются "злокачественными" и могут привести к смерти организма. Злокачественные неоплазмы или"раковые опухоли" отличаются от доброкачественных новообразований в том, что помимо обладания агрессивной клеточной пролиферацией могут внедряться в окружающие ткани и могут метастазировать. Кроме того, злокачественные новообразования характеризуются тем, что проявляют более высокую потерю дифференцировки (более высокую "дедифференцировку") и организации относительно друг друга и окружающих тканей. Это свойство называют "анаплазией". Неоплазмы, поддающиеся лечению настоящим изобретением, включают также твердые опухоли,т.е. карциномы и саркомы. Карциномы включают злокачественные неоплазмы, образованные из эпителиальных клеток, которые инфильтрируют (т.е. проникают) в окружающие ткани и образуют метастазы. Аденокарциномы являются карциномами, образованными из гландулярной ткани или из тканей, которые образуют узнаваемые грандулярные структуры. Другая широкая категория раковых заболеваний включает саркомы, которые являются опухолями, клетки которых заделываются в фибриллярное или гомогенное вещество, подобное зародышевой соединительной ткани. Изобретение делает также возможным лечение раковых заболеваний миелоидных или лимфоидных систем, в том числе лейкозы, лимфомы и другие раковые заболевания, которые обычно не присутствуют в виде опухолевой массы, но распределены в сосудистых или лимфосетчатых системах. Активность Chk1 ассоциируется с различными формами рака, например в младенческой и педиатрической онкологии, ростом твердых опухолей/злокачественности, мукоидной и круглоклеточной карциномой, локально запущенными опухолями, метастатическим раком, саркомами мягких тканей человека, включая саркому Эвинга, раковыми метастазами, включая лимфатические метастазы, плоскоклеточной карциномой, особенно головы и шеи, плоскоклеточной карциномой пищевода, карциномой полости рта, саркомой полости рта, злокачественностями клеток крови, включая множественную миелому, лей- 13014954 козами, включая острый лимфоцитный лейкоз, острый нелимфоцитный лейкоз, хронический лимфоцитный лейкоз, хронический миелоцитный лейкоз и лейкоз "волосатых" клеток, эффузионной лимфомой(лимфомой на основе полости тела), лимфомой тимуса, раком легких (включая мелкоклеточную карциному, лимфому кожных Т-клеток, лимфому Ходжкина, неходжкинскую лимфому, рак коркового вещества надпочечника, АСТН-продуцирующие опухоли, немелкоклеточные раковые заболевания, рак молочной железы, включая мелкоклеточную карциному и проточную карциному), раковыми заболеваниями желудочно-кишечного тракта (включая рак желудка, рак ободочой кишки, колоректальный рак и полипы, связанные с колоректальной неоплазией), раком поджелудочной железы, раком печени, урологическими раковыми заболеваниями (включая рак мочевого пузыря, такой как первичные поверхностные опухоли мочевого пузыря, инвазивная переходно-клеточная карцинома мочевого пузыря и мышечноинвазивный рак мочевого пузыря), раком простаты, злокачественными заболеваниями женских половых путей (включая карциному яичников, первичные перитонеальные эпителиальные неоплазмы, цервикальную карциному, раковые заболевания эндометрия матки, вагинальный рак, рак наружных женских половых органов, рак матки и твердые опухоли в яичниковом фолликуле), злокачественными заболеваниями мужских половых путей (включая тестикулярный рак и рак полового члена), раком почек (включая гипернефрому), раком головного мозга (включая внутренние опухоли мозга, нейробластому, астроцитные опухоли мозга, глиомы и метастатическую опухолевую клеточную инвазию в центральной нервной системе), раковыми заболеваниями костей (включая остеомы и остеосаркомы), раковыми заболеваниями кожи (включая злокачественную меланому, опухолевое развитие кератиноцитов кожи человека и рак сквамозных клеток), раком щитовидной железы, ретинобластомой, нейробластомой, перитонеальной эффузией, злокачественной плевральной эффузией, мезотелиомой, опухолями Вильмса, раком желчного пузыря, трофобластными неоплазмами, гемангиоперицитомой и саркомой Капоши. Соединения настоящего изобретения могут также потенцировать эффективность лекарственных средств при лечении воспалительных заболеваний. Примерами заболеваний, которым может приносить пользу комбинационная терапия с соединениями, пригодными для способа настоящего изобретения, являются ревматоидные артриты, псориаз, витилиго, гранулематоз Вегенера и системная красная волчанка(SLE). Лечение артрита, гранулематоза Вегенера и SLE часто включает использование иммуносупрессивных терапий, таких как ионизирующее излучение, метотрексат и циклофосфамид. Такие лечения обычно индуцируют, либо непосредственно, либо непрямым действием, повреждение ДНК. Ингибирование активности Chk1 в неисправных иммунных клетках делает клетки более восприимчивыми к регуляции этими стандартными лечениями. Псориаз и витилиго обычно лечат ультрафиолетовым излучением(УФ) в сочетании с псораленом. Настоящие агенты повреждения ДНК индуцируют эффект уничтожения,проявляемый УФ и псораленом, и повышают терапевтический индекс этой лечебной схемы. В общем,соединения, полезные в способах настоящего изобретения, потенцируют контроль клеток при воспалительном заболевании в комбинации с используемыми в настоящее время иммуносупрессивными лекарственными средствами. Настоящее изобретение включает все возможные стереоизомеры и геометрические изомеры соединений настоящего изобретения. Настоящее изобретение включает не только рацемические соединения,но также оптически активные изомеры. Когда соединение по изобретению требуется в виде индивидуального энантиомера, его можно получить либо разделением конечного продукта на оптические антиподы, либо стереоспецифическим синтезом, либо из изомерно чистого исходного материала, либо с использованием хирального вспомогательного реагента, например, см. Z. Ma et al., Tetrahedron: Asymmetry,8(6), pages 883-888 (1997). Разделение конечного продукта, промежуточного продукта или исходного материала на оптические антиподы можно достичь любым подходящим способом, известным в данной области. Кроме того, в ситуациях, когда возможны таутомеры соединений, имеется в виду, что настоящее изобретение включает все таутомерные формы соединений. Как показано здесь позднее, определенные стереоизомеры могут проявлять исключительную способность ингибировать Chk1 в сочетании с химиотерапией или лучевой терапией с меньшими отрицательными действиями, обычно связанными с химиотерапевтическими или радиотерапевтическими лечениями. Пролекарства соединений указанных структурных формул также можно использовать в качестве соединения и в способе настоящего изобретения. Полностью установлено, что подход с пролекарством, в котором соединение превращается в производное в форме, подходящей для изготовления препарата и/или введения, и затем высвобождается в виде лекарственного средства in vivo, успешно используют для временного (например, биообратимого) изменения физико-химических свойств соединения (см. Н.Rev., 15, 83 (1995. Соединения настоящего изобретения могут содержать несколько функциональных групп. Введенные функциональные группы при желании или необходимости можно затем модифицировать для получения пролекарства для дозы готовой препаративной формы и/или введения. Подходящие пролекарства включают, например, производные кислот, подобные амидам, эфирам и т.п. Для специалиста в данной области очевидно также, что в качестве пролекарства можно использовать N-оксиды.- 14014954 Используемый здесь термин "фармацевтически приемлемые соли" относится к соединениям, которые содержат кислотные части и образуют соли с подходящими катионами. Подходящие фармацевтически приемлемые катионы включают катионы щелочного металла (например, натрия или калия) и щелочно-земельного металла (например, кальция или магния). Фармацевтически приемлемые соли соединений по изобретению, которые содержат основный центр, являются кислотно-аддитивными солями, образованными с фармацевтически приемлемыми кислотами. Примеры включают гидрохлоридные, гидробромидные, сульфатные или бисульфатные, фосфатные или гидрофосфатные, ацетатные, бензоатные, сукцинатные, фумаратные, малеатные, лактатные, цитратные, тартратные, глюконатные, метансульфонатные, бензолсульфонатные и п-толуолсульфонатные соли. В свете вышеизложенного, любая ссылка на соединения настоящего изобретения, представленная здесь, предназначается для включения соединений структурных формул, а также их фармацевтически приемлемых солей и сольватов. Соединения настоящего изобретения можно терапевтически ввести в виде неразбавленного химиката, но предпочтительным является введение соединений по изобретению в виде фармацевтической композиции или готовой препаративной формы. В соответствии с этим настоящее изобретение дополнительно предлагает фармацевтические готовые препаративные формы, включающие соединение указанной структурной формулы или его фармацевтически приемлемые соли вместе с одним или несколькими фармацевтически приемлемыми носителями и, необязательно, другими терапевтическими и/или профилактическими ингредиентами. Носители являются "приемлемыми" в смысле совместимости с другими ингредиентами готовой препаративной формы и не являются вредными для его реципиента. Ингибирование киназы точки контроля обычно измеряют с использованием дозозависимого анализа, в котором систему чувствительного анализа контактируют с представляющим интерес соединением на протяжении диапазона концентраций, включая концентрации, при которых не наблюдают действия или наблюдают минимальное действие, через более высокие концентрации, при которых наблюдают частичное действие, до насыщающих концентраций, при которых наблюдают максимальное действие. Теоретически, такие анализы дозозависимого действия соединения-ингибитора можно описать в виде сигмоидальной кривой, представляющей степень ингибирования как функцию концентрации. Кривая теоретически может проходить также через точку, при которой концентрация является достаточной для снижения активности фермента точки контроля до уровня, который представляет 50% уровень разности между минимальной и максимальной активностью фермента в анализе. Эту концентрацию определяют как ингибирующую концентрацию (50%) или величину IC50. Определение величин IC50 предпочтительно проводят с использованием общепринятых способов биохимического (бесклеточного) анализа или способов анализа на клеточной основе. Сравнение эффективности ингибиторов часто проводят относительно сравнительных величин IC50,где более высокое значение IC50 указывает, что испытуемое соединение является менее сильнодействующим, и более низкое значение IC50 указывает, что соединение является более сильнодействующим,чем ссылочное соединение. Соединения, полезные в способе настоящего изобретения, проявляют величину IC50 по меньшей мере 0,1 нМ при измерении с использованием дозозависимого анализа. Предпочтительные соединения проявляют величину IC50 меньше чем 10 мкМ. Более предпочтительные соединения проявляют величину IC50 ниже чем 500 нМ. Еще более предпочтительные соединения настоящего изобретения проявляют величину IC50 ниже чем 250 нМ, ниже чем 100 нм или ниже чем 50 нМ. Соединения и фармацевтические композиции, подходящие для использования в настоящем изобретении, включают соединения и композиции, в которых активный ингредиент вводят в эффективном для достижения предназначенной цели количестве. Более определенно, "терапевтически эффективное количество" означает количество, эффективное для ингибирования развития симптомов или для облегчения существующих симптомов подвергаемого лечению субъекта. Определение эффективного количества находится вполне в пределах возможности специалиста в данной области, особенно в свете предложенного здесь подробного описания."Терапевтически эффективная доза" относится к такому количеству соединения, которое приводит к достижению требуемого действия. Токсичность и терапевтическую эффективность таких соединений можно определить стандартными фармацевтическими процедурами в культурах клеток или на экспериментальных животных, например, для определения LD50 (летальная доза для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции). Отношение между токсическими и терапевтическими действиями дозы является терапевтическим индексом, который выражают как отношение LD50 кED50. Соединения, которые проявляют высокие терапевтические индексы (т.е. токсическая доза, по существу, выше, чем эффективная доза), являются предпочтительными. Полученные данные можно использовать для определения диапазона доз для использования при лечении людей. Доза таких соединений предпочтительно лежит в диапазоне циркулирующих концентраций, которые включают ED50 с небольшой токсичностью или без токсичности. Доза может варьировать в пределах этого диапазона в зависимости от используемого лекарственного средства и используемого пути введения. Точная готовая препаративная форма, путь введения и доза выбирается лечащим врачом в зависимости от состояния пациента. Дозированное количество и интервал можно регулировать индивидуально для обеспечения уровней активного соединения в плазме, которые достаточны для поддержания требуе- 15014954 мых терапевтических действий. Фармацевтические композиции изобретения можно изготовить с включением одного или нескольких цитокинов, лимфокинов, факторов роста или других гемопоэтических факторов, которые могут снизить отрицательные побочные действия, которые могут быть вызваны введением только фармацевтической композиции или могут быть ассоциированы с таким введением. Цитокины, лимфокины, факторы роста или другие гемопоэтические факторы, особенно полезные в фармацевтических композициях изобретения, включают, но не ограничиваются перечисленным, M-CSF, GM-CSF, TNF, IL-1, IL-2, IL-3, IL-4,IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IFN, TNF, G-CSF,Meg-CSF, GM-CSF, тромбопоэтин, фактор стволовых клеток, эритропоэтин, ангиопоэтин, ангиопоэтин,включая Ang-1, Ang-2, Ang-4, Ang-Y и/или подобный ангиопоэтину человека полипептид, фактор васкулярного эндотелиального роста (VEGF), ангиогенин, костный морфогенный белок-1 (ВМР-1), ВМР-2,ВМР-3, ВМР-4, ВМР-5, ВМР-6, ВМР-7, ВМР-8, ВМР-9, ВМР-10, BMP-11, ВМР-12, ВМР-13, ВМР-14,ВМР-15, BMP-рецептор IA, ВМР-рецептор IB, полученный из головного мозга нейротрофический фактор, цилиарный нейтрофильный фактор, рецептор нейтрофильного фактора, индицированный цитокином нейтрофильный хемотактический фактор 1, индуцированный цитокином нейтрофильный хемотактический фактор 2, индуцированный цитокином нейтрофильный хемотактический фактор 2, фактор роста эндотелиальных клеток, эндотелии 1, эпидермальный фактор роста, нейтрофильный аттрактант, полученный из эпителия, фибробластный фактор роста (FGF), FGF 4, FGF 5, FGF 6, FGF 7, FGF 8, FGF 8b,FGF 8 с, FGF 9, FGF 10, FGF кислотный, FGF основный, рецептор 1 нейтрофильного фактора, полученный из глиальной клеточной линии, рецептор 2 нейтрофильного фактора, полученный из глиальной клеточной линии, относящийся к росту белок, относящийся к росту белок, относящийся к росту белок, относящийся к росту белок, связывающий гепарин эпидермальный фактор роста, фактор роста гепатоцитов,рецептор фактора роста гепатоцитов, подобный инсулину фактор роста I, рецептор подобного инсулину фактора роста, подобный инсулину фактор роста II, белок, связывающий подобный инсулину фактор роста, фактор роста кератиноцитов, фактор, ингибирующий лейкоз, рецептор фактора, ингибирующего лейкоз, фактор роста нервов, рецептор фактора роста нервов, нейротрофин-3, нейротрофин-4, фактор роста плаценты, фактор роста плаценты 2, полученный из тромбоцитов фактор роста эндотелиальных клеток, полученный из тромбоцитов фактор роста, полученная из тромбоцитов цепь фактора роста А,полученный из тромбоцитов фактор роста АА, полученный из тромбоцитов фактор роста АВ, полученная из тромбоцитов цепь фактора роста В, полученный из тромбоцитов фактора роста ВВ, рецептор полученного из тромбоцитов фактора роста, рецептор полученного из тромбоцитов фактора роста, фактор,стимулирующий рост пре-В-клеток, фактор стволовых клеток, рецептор фактора стволовых клеток, фактор, трансформирующий рост (TGF), TGF 1, TGF 1.2, TGF 2, TGF 3, TGF 5, латентный TGF 1, TGF, связывающий белок I, TGF-связывающий белок II, TGF-связывающий белок III, рецептор типа I фактора некроза опухоли, рецептор типа II фактора некроза опухоли, рецептор активатора плазминогена типа урокиназы, фактор васкулярного эндотелиального роста и химерные белки и их биологически или иммунологически активные фрагменты. Соединения, полезные по изобретению, можно конъюгировать или связать со вспомогательными частями, которые активируют любые свойства соединения, которые могут быть полезными в способах терапевтического использования. Такие конъюгаты могут повысить доставку соединений к определенному, представляющему интерес анатомическому месту или области (например, опухоли), способны поддерживать терапевтические концентрации соединений в клетках-мишенях, изменяют фармакокинетические и фармакодинамические свойства соединений и/или улучшают терапевтический индекс или профиль безопасности соединений. Подходящие вспомогательные части включают, например, аминокислоту, олигопептиды или пептиды, например антитела, такие как моноклональные антитела и другие,полученные генной инженерией антитела, и природные или синтетические лиганды для рецепторов в клетках- или тканях-мишенях. Другие подходящие вспомогательные средства включают остатки жирных кислот или липидов, применяемые для стимуляции биораспределения или поглощения соединений клетками-мишенями (см., например, Bradley et al., Clin. Cancer Res. (2001) 7: 3229). Терапевтический индекс композиций, включающих одно или несколько соединений изобретения,можно повысить конъюгацией соединения(й) с противоопухолевыми антителами, как ранее описано (например, Pietersz and McKinzie, Immunol. Rev. (1992), 129: 57; Trail et al., Science (1993), 261: 212;Rowlinson-Busza and Epenetos, Curr. Opin. Oncol. 1992; 4:1142). Направленная к опухоли доставка соединений изобретения может повысить терапевтическую пользу посредством минимизации потенциальной неспецифической токсичности, которая может быть результатом лучевой терапии или химиотерапии. В другом аспекте ингибиторы Chk1 и радиоизотопы или химиотерапевтические агенты могут быть конъюгированы с одной и той же молекулой антитела. В альтернативном случае, конъюгированные с ингибитором Chk1, специфичные для опухоли антитела, можно ввести до, во время или после введения конъюгированных с химиотерапевтическим средством противоопухолевых антител или после проведения радиоиммунотерапии. Соединения настоящего изобретения могут повысить терапевтическую пользу лучевой терапии или химиотерапевтического лечения, включая индуцирование химиотерапии, первичной(неоадъювантной) химиотерапии и как адъювантной лучевой терапии, так и адъювантной химиотерапии.- 16014954 Кроме того, лучевая терапия и химиотерапия часто указываются в качестве вспомогательных средств для хирургии при лечении рака. Целью лучевой терапии и химиотерапии при назначении вспомогательного средства является снижение риска рецидива и повышение продолжительности жизни без заболевания при лечении первичной опухоли. Химиотерапию используют в качестве вспомогательного средства для лечения рака ободочной кишки, легких и молочной железы, часто, когда заболевание является метастатическим. Вспомогательная лучевая терапия показана при нескольких заболеваниях, включая раковые заболевания ободочной кишки, легких и молочной железы, как описано выше. Например, ионизирующее излучение часто используют как до, так и после хирургического лечения в качестве компонентов стратегии лечения для ректальной карциномы. Соединения настоящего изобретения, таким образом, являются особенно ценными после хирургической операции при лечении рака в комбинации с лучевой терапии и/или химиотерапии. Соединение настоящего изобретения может также радиосенсибилизировать клетку. Термин "радиосенсибилизировать", используемый здесь, определяют как молекулу, предпочтительно молекулу с низкой молекулярной массой, вводимую человеку или другому животному в терапевтически эффективном количестве для повышения чувствительности клеток, которые подвергают радиосенсибилизации, к электромагнитному излучению и/или стимуляции лечения заболеваний, которые поддаются лечению электромагнитным излучением. Заболевания, которые можно лечить электромагнитным излучением, включают опухолевые заболевания, доброкачественные и злокачественные опухоли и раковые клетки. Лечение электромагнитным излучением других заболеваний, не перечисленных здесь, также рассматривается настоящим изобретением. Термины "электромагнитное излучение" и "ионизирующее излучение", используемые здесь, включают, но не ограничиваются перечисленным, излучение, имеющее длину волны от 10-20 до 100 м. Предпочтительные варианты осуществления настоящего изобретения используют следующие электромагнитные излучения: гамма-излучение (от 10-20 до 10-13 м), рентгеновское излучение (от 10-12 до 10-9 м), ультрафиолетовое излучение (от 10 до 400 нм), видимое излучение (от 400 до 700 нм), инфракрасное излучение (от 700 нм до 1,0 мм) и микроволновое излучение (от 1 мм до 30 см). Многие протоколы лечения рака в настоящее время используют радиосенсибилизаторы, активированные электромагнитным излучением, например рентгеновским излучением. Примеры активируемых рентгеновским излучением радиосенсибилизаторов включают, но не ограничиваются перечисленным,следующие радиосенсибилизаторы: метронидазол, мизонидазол, дезметилмизонидазол, пимонидазол,этанидазол, ниморазол, митомицин С, RSU 1069, SR 4233, Е 09, RB 6145, никотинамид, 5 бромдеоксиуридин (BudR), 5-иоддеоксиуридин (IUdR), бромдеоксицитидин, фтордеоксиуридин (FUdR),гидроксимочевина, цисплатин и их терапевтически эффективные аналоги и производные. Фотодинамическая терапия (PDT) раковых заболеваний использует видимый свет в качестве радиационного активатора сенсибилизирующего агента. Примеры фотодинамических радиосенсибилизаторов включают следующие соединения, но не ограничиваются перечисленным: производные гемопорфирина,PHOTOFRIN, производные бензопорфирина, Npe6, этиопорфирин олова (SnET2), феоборбид-а, бактериохлорофилл-а, нафталоцианины, фталоцианины, фталоцианин цинка и их терапевтически эффективные аналоги и производные. Радиосенсибилизаторы могут быть введены в сочетании с терапевтически эффективным количеством одного или нескольких соединений помимо ингибитора Chk1, причем такие соединения включают,но не ограничиваются перечисленным, соединения, которые стимулируют включение радиосенсибилизаторов в целевые клетки, соединения, которые регулируют поток терапевтических средств, питательных веществ и/или кислорода к целевым клеткам, химиотерапевтические агенты, которые действуют на опухоль с дополнительным ионизирующим излучением или без нее, или другие терапевтически эффективные соединения для лечения ракового или другого заболевания. Примеры дополнительных терапевтических агентов, которые можно использовать в сочетании с радиосенсибилизаторами, включают, но не ограничиваются перечисленным, 5-фторурацил (5-FU), лейковорин, кислород, карбоген, трансфузии эритроцитов, перфторуглероды (например, FLUOSOLW-DA), 2,3-DPG, BW12C, блокаторы кальциевых каналов, пентоксифиллин, соединения, направленные против ангиогенеза, гидралазин и L-BSO. Химиотерапевтические агенты, которые можно использовать, включают, но не ограничиваются перечисленным, алкилирующие агенты, антиметаболиты, гормоны и их антагонисты, радиоизотопы, антитела, а также природные продукты и их комбинации. Соединение-ингибитор настоящего изобретения может быть введено с антибиотиками, такими как доксорубицин и другие аналоги антрациклина, азотными аналогами горчичного газа, такими как циклофосфамид, аналогами пиримидина, такими как 5 фторурацил, цисплатин, гидроксимочевина, таксол и его природные и синтетические производные и т.п. В качестве другого примера, в случае смешанных опухолей, таких как аденокарцинома молочной железы, где опухоли включают гонадотропин-зависимые и гонадотропин-независимые клетки, соединение может быть введено в сочетании с лейпролином или гозерелином (синтетические пептидные аналогиLH-RH). Другие противоопухолевые протоколы включают использование соединения-ингибитора с другими способами лечения, например хирургией или ионизирующим излучением, называемыми здесь так- 17014954 же "дополнительными противоопухолевыми способами". Примеры химиотерапевтических агентов, полезных для способа настоящего изобретения, перечислены в следующей таблице. Примеры химиотерапевтических агентов, которые являются особенно полезными в сочетании с радиосенсибилизаторами, включают, например, адриамицин, камптотецин, карбоплатин, цисплатин, даунорубицин, доксорубицин, интерферон (альфа, бета, гамма), интерлейкин 2, иринотекан, доцетаксел,паклитаксел, топотекан и их терапевтически эффективные аналоги и производные. Как очевидно специалистам, работающим в данной области, ссылка здесь на лечение распространяется на профилактику, а также лечение установленных заболеваний или симптомов. Далее очевидно, что количество соединения изобретения, требуемое для использования при лечении, варьирует с природой подвергаемого лечению состояния и с возрастом и состоянием пациента и в конечном счете определяется штатным врачом больницы или ветеринаром. В общем, однако, дозы, используемые для лечения взрослого человека, обычно находятся в диапазоне от 0,001 до приблизительно 100 мг/кг в день. Требуемую дозу можно удобно ввести в виде одной дозы или нескольких доз, вводимых через подходящие интервалы, например в виде двух, трех, четырех или более субдоз в день. На практике врач определяет фактическую лечебную схему, наиболее подходящую для отдельного пациента, и доза варьирует с возрастом,массой и ответной реакцией отдельного пациента. Вышеуказанные дозы являются примерами среднего случая, но могут быть отдельные случаи, в которых необходимы более высокие или более низкие дозы, и такие дозы находятся в пределах объема настоящего изобретения. Готовые препаративные формы настоящего изобретения могут быть введены стандартным способом для лечения указанных заболеваний, например перорально, парентерально, через слизистую оболочку (например, сублингвально или посредством трансбуккального введения), местно, трансдермально,ректально, посредством ингаляции (например, назальной ингаляции или глубокой ингаляции в легкие). Парентеральное введение включает, но не ограничивается перечисленным, внутривенное, внутриартериальное, внутрибрюшинное, подкожное, внутримышечное, внутритрахеальное и внутрисуставное введение. Парентеральное введение можно выполнить также с использованием способа высокого давления,подобного POWDERJECT. Для перорального введения, включая трансбуккальное введение, композиция может быть в форме- 19014954 таблеток или лепешек, изготовленных общепринятым способом. Например, таблетки и капсулы для перорального введения могут содержать общепринятые эксципиенты, такие как связующие агенты (например, сироп, аравийскую камедь, желатин, сорбит, трагакант, растительную слизь крахмала или поливинилпирролидон), наполнители (например, лактозу, сахар, микрокристаллическую целлюлозу, кукурузный крахмал, фосфат кальция или сорбит), смазывающие вещества (например, стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль или диоксид кремния), дезинтегрирующие агенты (например,картофельный крахмал или натриевую соль гликолята крахмала) или смачивающие агенты (например,лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой способами, хорошо известными в данной области. В альтернативном случае, соединения настоящего изобретения могут быть включены в пероральные жидкие препараты, такие как, например, водные или масляные суспензии, растворы, эмульсии, сиропы или эликсиры. Кроме того, готовые препаративные формы, содержащие указанные соединения,могут быть представлены в виде сухого продукта для образования композиции с водой или другим подходящим наполнителем перед использованием. Жидкие препараты могут содержать общепринятые добавки, например суспендирующие агенты, такие как сироп сорбита, метилцеллюлоза, сироп глюкозы/сахара, желатин, гидроксиэтилцеллюлоза, гидрокосипропилметилцеллюлоза, карбоксиметилцеллюлоза, гель стеарата алюминия и гидрогенизированные пищевые жиры; эмульгирующие агенты, такие как лецитин, моноолеат сорбитана или аравийская камедь; неводные наполнители (которые могут включать пищевые масла), такие как миндальное масло, фракционированное кокосовое масло, маслообразные сложные эфиры, пропиленгликоль и этиловый спирт, и консерванты, такие как метил- или пропил-пгидроксибензоат и сорбиновая кислота. Такие препараты могут быть изготовлены также в виде суппозиториев, например, содержащих общепринятые основы суппозиториев, такие как какао-масло или другие глицериды. Композиции для ингаляции обычно приготовляют в форме раствора, суспензии или эмульсии, которая может быть введена в виде сухого порошка или в форме аэрозоля с использованием общепринятого пропеллента, такого как дихлордифторметан или трихлорфторметан. Типичные местные и чрескожные готовые препаративные формы включают общепринятые водные или неводные наполнители, такие как глазные капли, кремы,мази, лосьоны и пасты, или они имеют форму содержащего лекарственное средство пластыря, повязки или мембраны. Кроме того, композиции настоящего изобретения могут быть изготовлены для парентерального введения инъекцией или непрерывной инфузией. Готовые препаративные формы для инъекции могут быть в форме суспензий, растворов или эмульсий в масляных или водных наполнителях и могут содержать образующие готовую препаративную форму агенты, такие как суспендирующие, стабилизирующие или диспергирующие агенты. В альтернативном случае активный ингредиент может быть в форме порошка для создания препарата с подходящим наполнителем (например, стерильной водой без пирогенов) перед использованием. Композицию по настоящему изобретению можно также изготовить в виде препарата-депо. Такие продолжительно действующие готовые препаративные формы могут быть введены имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. В соответствии с этим, соединения изобретения могут быть изготовлены с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле), ионообменными смолами или в виде плохо растворимых производных (например, плохо растворимой соли). Для ветеринарного использования соединение по изобретению или его нетоксичную соль вводят в виде соответствующей приемлемой готовой препаративной формы в соответствии с обычной ветеринарной практикой. Ветеринар может легко определить схему приема лекарственного средства и путь введения, который является наиболее подходящим для конкретного животного. Таким образом, изобретение предлагает фармацевтическую композицию, включающую соединение по изобретению вместе с его фармацевтически приемлемым разбавителем или носителем. Такая фармацевтическая композиция получена путем смешивания соединения по изобретению вместе с его фармацевтически приемлемым разбавителем или носителем. Настоящее изобретение также предлагает применение соединения по изобретению для получения лекарственного средства длялечения рака, выбранного из группы, состоящей из колоректального рака,рака молочной железы, лейкоза, меланомы, карциномы почечных клеток, рака яичников, рака шейки матки, рака прямой кишки, рака простаты и карциномы легких. Конкретные нелимитирующие примеры соединений структурных формул, имеющих конкретную структуру, обозначают соответствующими номерами соединений, представленными в следующих таблицах, в которых суммированы некоторые из соединений, используемых в способе. Например, структура, обозначенная в виде соединения 1, является соединением структурной формулы, указанной ниже, гдеR27 представляет водород и R28 представляет -CONH(СН 2)2-2-(2-N-метилпирролидил). Соединения, подходящие для указанного способа, включают, но не ограничиваются ими, соединения формулы Некоторые предпочтительные соединения включают соединения 2, 4, 6, 12, 72, 76, 83, 84, 88, 89 и 90. Предпочтительными являются соединения, выбранные из группы, состоящей из Обычно соединения по изобретению можно получить по следующей синтетической схеме. На схеме, представленной ниже, в настоящей области известно, что защитные группы можно использовать,когда необходимо, в соответствии с общими принципами синтетической химии. Эти защитные группы удаляют в конечных стадиях синтеза в основных, кислотных или гидрогенолитических условиях, которые хорошо известны специалистам в данной области. Посредством использования подходящих операций с любыми химическими функциональными группами и защиты их синтез соединений по изобретению, конкретно не указанные здесь, можно выполнить способами, аналогичными схемам, представленным ниже. Если не оговорено особо, все исходные материалы получали из коммерческих источников и использовали без дополнительной очистки. Все продукты реакции и хроматографические фракции анализировали тонкослойной хроматографией на 250 мм пластинках силикагеля, визуализированных УФ(ультрафиолетовым) светом и пятном I2 (йода). Колоночную флэш-хроматографию проводили с использованием силикагеля Biotage 40M (230-400 меш). Продукты и промежуточные продукты очищали флэшхроматографией или ВЭЖХ с обращенной фазой. Как показано ниже, соединения общих структурных формул можно получить следующими общими синтетическими схемами. В общем, ариламин, представленный формулой Ar-NH2, подвергают взаимодействию приблизительно с 0,75-1,25 молярным эквивалентом 4-нитрофенилхлорформиата. Взаимодействие предпочтительно проводят в инертной атмосфере, например азота (N2), и обычно при поддержании низкой температуры (приблизительно 0 С). Образовавшийся продукт обрабатывают приблизительно 0,75-1,25 молярным эквивалентом гетероариламина, представленного формулой HetAr-NH2, предпочтительно в инертной атмосфере при комнатной температуре (приблизительно 25 С) для получения сырого арилпиразилдизамещенного производного мочевины. Более конкретная иллюстрация для получения соединений по изобретению может включать, например, следующую общую схему 2. Стадия 1. Этерификация ТМС-диазометаном. К охлажденному (приблизительно 0 С), перемешиваемому раствору 4-амино-3-метоксибензойной кислоты (5,0 г, 30 ммоль) в сухом метаноле (150 мл) медленно добавляют триметилсилилдиазометан(60 мл 2,0 М раствора в гексанах, 120 ммоль) на протяжении 1 ч. После перемешивания в течение 4 ч реакционную смесь концентрируют при пониженном давлении, растворяют в этилацетате (200 мл), промывают 10% водным карбонатом натрия и насыщенным раствором соли, затем сушат (MgSO4), фильтруют и концентрируют в вакууме, получая при этом требуемый эфир в виде не совсем белого твердого вещества (выход 94%). Общая схема 2 Стадия 2. Процедура получения п-нитрофенилкарбамата. К перемешиваемому охлажденному (приблизительно 0 С) раствору метил-3-амино-4 метоксибензоата (5,0 г, 27,6 ммоль) в сухом дихлорметане (175 мл) добавляют пиридин (2,34 мл,29 ммоль), затем 4-нитрофенилхлорформиат (5,8 г, 29 ммоль) в атмосфере азота (N2). После перемешивания в течение 8 ч реакционную смесь промывают 2 н. водной хлористо-водородной кислотой(2200 мл), насыщенным водным бикарбонатом натрия (2200 мл) и насыщенным раствором соли(200 мл), затем сушат (MgSO4) и фильтруют. Отфильтрованный раствор разбавляют этилацетатом и гексанами (приблизительно 800 мл) до образования осадка. Твердое вещество собирают на воронке Бюхнера с отсасыванием и сушат на воздухе, получая при этом требуемый карбамат в виде белого твердого вещества (выход 70%). Стадия 3. Процедура сочетания карбамата. К перемешиваемому раствору метилового эфира 4-метокси-3-(4-нитрофеноксикарбониламино)бензойной кислоты (30 г, 8,7 ммоль) в сухом N-метилпирролидине (50 мл) добавляют аминопиразин (0,84 г, 8,8 ммоль) в атмосфере N2 при комнатной температуре. Реакционную смесь нагревают до- 24014954 80 С в течение 6 ч, затем дают ей возможность охладиться до комнатной температуры. Разбавление этилацетатом (200 мл) и водой (200 мл) дает требуемую мочевину в виде белого твердого вещества (выход 54%). Стадия 4. Процедура гидролиза гидроксидом лития. К перемешиваемому раствору метилового эфира 4-метокси-4-(3-пиразин-2-илуреидо)бензойной кислоты (1,0 г, 3,3 ммоль) в метаноле (35 мл) добавляют водный гидроксид лития (5 мл 2 н. раствора; 10 ммоль) при комнатной температуре. Реакционную смесь нагревают до 67 С в течение 15 ч, затем ей дают возможность охладиться до комнатной температуры. Реакционную смесь затем разбавляют водой(100 мл) и промывают этилацетатом (2100 мл). Значение рН водного слоя регулируют до рН 5,2 при помощи 2 н. водной хлористо-водородной кислоты и образовавшийся осадок собирают на воронке Бюхнера с отсасыванием и сушат на воздухе, получая при этом требуемую кислоту в виде белого твердого вещества. Стадия 5. Процедура сочетания с HBTU. К перемешиваемому раствору кислоты (30 мг, 0,11 ммоль) в сухом N-метилпирролидиноне (2 мл) добавляют гексафторфосфат О-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (HBTU; 45 мг, 12 моль),4-(2-аминоэтил)морфолин (15,7 л, 0,12 ммоль) и диизопропилэтиламин (34 мкл, 0,2 ммоль) при комнатной температуре в атмосфере азота. Образовавшийся раствор перемешивают 5 ч, затем разбавляют этилацетатом (30 мл) и 10% водным карбонатом натрия (30 мл). После энергичного перемешивания при комнатной температуре в течение 15 мин осадок собирают на воронке Бюхнера с отсасыванием и сушат на воздухе, получая при этом требуемый амид в виде белого твердого вещества (выход 59%). Следующие соединения получали с использованием описанной общей процедуры, дополненной общей схемой 2, но с заменой группы R, показанной в общей схеме 2, на приведенную ниже группу R. Процедура с изоцианатом. К перемешиваемому раствору 2-метокси-5-метилфенилизоцианата (43 мл, 0,3 ммоль) в сухом дихлорэтане (0,4 мл) добавляют 2-аминохиноксалин (43,5 мг, 0,3 ммоль) в реакционном сосуде в атмосфере азота. Сосуд закрывают и нагревают до 80 С на протяжении ночи (14 ч). Реакционную смесь затем фильтруют и остаток промывают дихлорметаном, получая при этом требуемую мочевину в виде белого твердого вещества (выход 91%). Следующие соединения получали с использованием описанной процедуры, дополненной общей схемой 3, но с заменой группы Ar, показанной в общей схеме 3, на группу Ar в приведенной ниже таблице. 1-[2-(1,1-Дифторметокси)фенил]-3-пиразин-2-илмочевина 2-(Дифторметокси)фенилизоцианат (1,0 г, 5,4 ммоль) и аминопиразин (0,51 г, 5,4 ммоль) подвергают взаимодействию в течение 6 ч в кипящем с обратным холодильником диметоксиэтане (20 мл). Реакционную смесь охлаждают до комнатной температуры для осаждения продукта, который собирают фильтрованием, промывают этилацетатом и сушат в вакууме (765 мг, 50%). 1 Н-ЯМР (300 МГц, d6-ДМСО) : 10,49 (шир.с, 1 Н), 10,26 (с, 1 Н), 8,83 (с, 1 Н), 8,35-8,24 (м, 3 Н), 7,537,00 (м, 4 Н). 1-(2-Метилсульфанилфенил)-3-пиразин-2-илмочевина 2-(Метилтиофенил)изоцианат (1,0 г, 6,1 ммоль) и аминопиразин (0,58 г, 6,1 ммоль) подвергают взаимодействию в течение 16 ч в кипящем с обратным холодильником диметоксиэтане (40 мл). Продукт,осажденный из охлажденной реакционной смеси, собирают фильтрованием, промывают диметоксиэтаном и сушат в вакууме (715 мг, 45%). 1 1-(2-Метокси-5-нитрофенил)-3-пиразин-2-илмочевина Смесь 2-метокси-5-нитрофенилизоцианата (5,0 г, 25 ммоль) и аминопиразина (2,5 г, 26 ммоль) в тетрагидрофуране (ТГФ, 250 мл) перемешивают при кипячении с обратным холодильником в течение 24 ч. Продукт осаждают из охлажденной реакционной смеси и собирают фильтрованием, промывают этилацетатом и сушат в вакууме (4,3 г, 57%). 1 1-(5-Амино-2-метоксифенил)-3-пиразин-2-илмочевина Раствор (2-метокси-5-нитрофенил)-3-пиразин-2-илмочевины (соединение 159, пример 3) (16,9 г,55 ммоль) в диметилформамиде (ДМФ, 320 мл) встряхивают в атмосфере Н 2 в присутствии катализатора палладий на угле (Pd/C) (1,6 г, 10% Pd) при 80 С в течение 12 ч. Добавляют вторую порцию катализатора(1,6 г) и встряхивание смеси продолжают в течение дополнительных 8 ч при такой же температуре. Раствор фильтруют через подушку целита с использованием дополнительных 200 мл ДМФ. Фильтрат концентрируют в вакууме и остаток растирают с метанолом (100 мл). Твердое вещество собирают, перемешивают в кипящем метаноле и присутствующие твердые вещества (1,8 г) отфильтровывают и выгружают. Фильтрат выдерживают при 4 С на протяжении ночи. Твердые вещества (1,4 г) удаляют фильтрованием и фильтрат концентрируют в вакууме до получения рыжевато-коричневого твердого вещества(2,6 г). Сырой твердый продукт растирают с ТГФ (200 мл), собирают фильтрованием и сушат в вакууме,получая при этом продукт в виде рыжевато-коричневого твердого вещества (1,85 г, 13%). 1 Н-ЯМР (300 МГц, d6-ДМСО) : 10,10 (с, 1 Н), 9,94 (шир.с, 1 Н), 8,89 (с, 1 Н), 8,32 (с, 1 Н), 8,22 (с, 1 Н),7,58 (с, 1 Н), 7,75 (д, 1 Н), 6,21 (д, 1 Н), 4,70 (с, 2 Н), 3,76 (с, 3 Н). 13 С-ЯМР (75 МГц, d6-ДМСО) : 151,4, 149,4, 142,6, 140,9, 139,8, 137,2, 135,2, 128,7, 112,8, 107,7,106,0, 56,8. Пример 5. Получение соединения 48.- 28014954 Раствор 1-(5-амино-2-метоксифенил)-3-пиразин-2-илмочевины (соединение 14, пример 4) (260 мг,1 ммоль) и янтарного ангидрида (131 мг, 1,3 ммоль) в сухом пиридине (10 мл) перемешивают 16 ч при комнатной температуре. Образовавшееся твердое вещество собирают фильтрованием и растирают с хлороформом и сушат в вакууме, получая при этом не совсем белый продукт (175 мг, 50%). 1(S)-1-(2,2,2-трифторэтаноил)пирролидин-2-карбоновой кислоты Раствор 1-(5-амино-2-метоксифенил)-3-пиразин-2-илмочевины (соединение 14, пример 4) (105 мг,0,4 ммоль) в сухом пиридине (2 мл) при 0 С обрабатывает раствором N-трифторацетил-(S)пролилхлорида (0,1 М в дихлорметане, 4,5 мл, 0,4 5 ммоль) и смесь перемешивают 2 ч при комнатной температуре. Реакционную смесь гасят 1 н. HCl (50 мл) и экстрагируют этилацетатом (350 мл), объединенные органические слои промывают 1 н. HCl (220 мл), водой (20 мл), насыщенным раствором соли(20 мл), сушат над сульфатом натрия и концентрируют в вакууме до образования бежевого твердого вещества (60 мг). Перекристаллизация из ацетонитрила дает конечный твердый продукт (30 мг, 17%). 1 Н-ЯМР (300 МГц, d6-ДМСО) : 10,16-10,06 (м, 3 Н), 8,90 (с, 1 Н), 8,36-8,30 (м, 2 Н), 8,25 (д, J=2,6 Гц,1 Н), 7,42 (дд, J=8,8, 2,6 Гц, 1 Н), 6,98 (д, J=8,8 Гц, 1 Н), 4,57 (дд, J=8,5, 4,4 Гц, 1 Н), 3,88 (с, 3 Н), 3,73 (т,J=6,5 Гц, 1 Н), 2,27-2,21 (м, 1 Н), 2,06-1,90 (м, 3 Н).(МеОН, 5 мл) и воды (приблизительно 0,25 мл) обрабатывают KOH (100 мг, большой избыток). За время 10 мин все ингредиенты находятся в растворе. Реакционную смесь обрабатывают водой (20 мл) и экстрагируют этилацетатом (220 мл). Органические слои объединяют и промывают водой (10 мл) и насыщенным раствором соли (10 мл), сушат сульфатом натрия и концентрируют до образования рыжеватокоричневого твердого вещества (13 мг, 75%). 1N-[4-Метокси-3-(3-пиразин-2-илуреидо)фенил]метансульфонамид Раствор 1-(5-амино-2-метоксифенил)-3-пиразин-2-илмочевины (соединение 14, пример 4) (260 мг,1 ммоль) в сухом пиридине (15 мл) обрабатывают метансульфонилхлоридом (0,08 мл, 1 ммоль) и перемешивают 16 ч при комнатной температуре. Реакционную смесь концентрируют в вакууме и твердый остаток растирают с этанолом, собирают фильтрованием и сушат в вакууме, получая при этом продукт
МПК / Метки
МПК: C07D 239/46, C07D 401/12, C07D 403/12, A61K 31/4965, C07D 241/54, C07D 231/40, C07D 251/22, A61P 35/00, C07D 241/20, C07D 405/12, A61K 31/498
Метки: использования, снк1, ингибиторов, мочевины, химиосенсибилизаторов, арил, гетероарил, радиосенсибилизаторов, качестве
Код ссылки
<a href="https://eas.patents.su/30-14954-aril-i-geteroaril-mocheviny-v-kachestve-ingibitorov-snk1-dlya-ispolzovaniya-v-kachestve-radiosensibilizatorov-i-himiosensibilizatorov.html" rel="bookmark" title="База патентов Евразийского Союза">Арил и гетероарил мочевины в качестве ингибиторов снк1 для использования в качестве радиосенсибилизаторов и химиосенсибилизаторов</a>
Предыдущий патент: Мобильный трехкоординатный программный фрезерный модуль
Следующий патент: Производные фталазина в качестве ингибиторов parp
Случайный патент: Способ получения поликапролактама.












