Способ получения 2-арил-3-арил-5-замещённых пиридинов, используемых в качестве ингибиторов cox-2
Номер патента: 2190
Опубликовано: 28.02.2002
Авторы: Малиакал Ашок, Воланте Ральф П., Пайе Филип Дж., Россен Кай, Сейджер Джесс
Формула / Реферат
1. Способ получения соединений формулы I
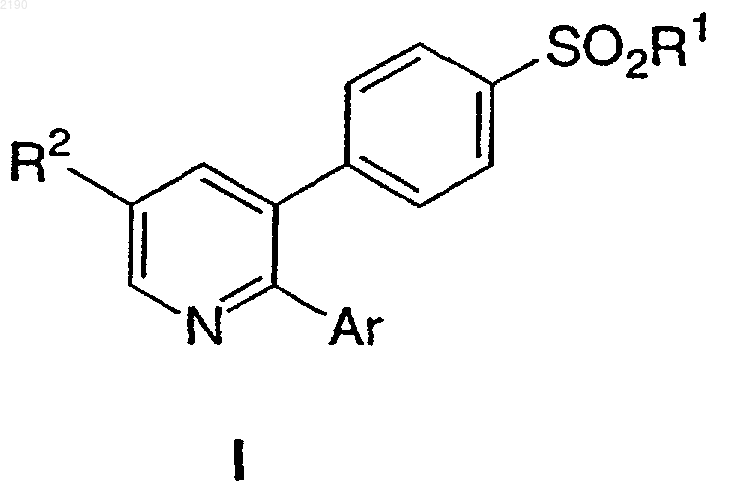
где R1 выбирают из группы, состоящей из
(a) СН3,
(b) NH2,
(c) NНС(O)СF3,
(d) NНСН3;
Аr представляет моно-, ди- или тризамещенный фенил или пиридинил (или его N-оксид), где заместители выбирают из группы, состоящей из
(a) водорода,
(b) галогена,
(c) С1-4алкокси,
(d) С1-4алкилтио,
(e) CN,
(f) С1-4алкила,
(g) С1-4фторалкила,
R2 выбирают из группы, состоящей из
(a) F, Cl, Br, I,
(b) CN,
(c) азида,
включающий конденсацию соединения формулы А1
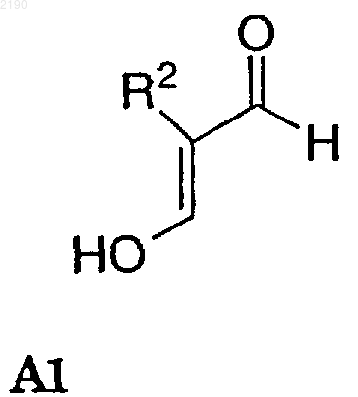
в кислых условиях и, необязательно в присутствии нереакционноспособного растворителя и в присутствии аммониевого реагента, с соединением А2
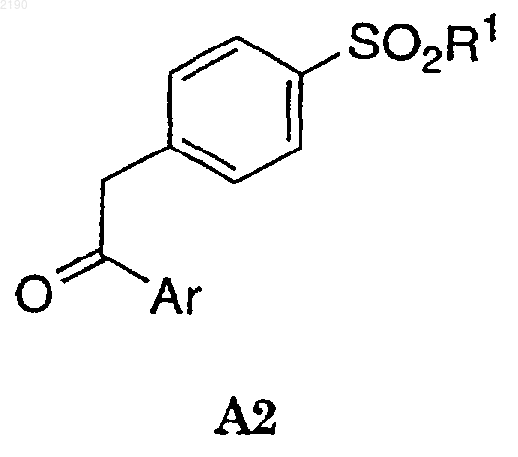
с получением соединения формулы I.
2. Способ по п.1, в котором нереакционноспособный растворитель представляет уксусную кислоту.
3. Способ по п.1, в котором Аr представляет моно-, ди- или тризамещенный 3-пиридинил.
4. Способ по п.1, в котором R1 представляет СН3 или NН2.
5. Способ по п.1, в котором Аr представляет моно- или дизамещенный 3-пиридинил и заместители выбраны из группы, состоящей из
(a) водорода,
(b) галогена,
(c) C1-3алкокси,
(d) C1-3алкилтио,
(e) C1-3алкила,
(f) СF3 и
(g) CN.
6. Способ по п.1, в котором R1 представляет СН3 или NH2; и Аr представляет моно- или дизамещенный 3-пиридинил и заместители выбраны из группы, состоящей из
(a) водорода,
(b) галогена,
(c) C1-3алкила,
(d) СF3 и
(e) CN.
7. Способ по п.1, в котором
R2 представляет Сl;
R1 представляет СН3 или NH2;
Аr представляет монозамещенный 3-пиридинил и заместители выбраны из группы, состоящей из водорода и C1-3алкила.
8. Способ получения соединений формулы I, используемых для лечения воспалительных и других заболеваний, опосредованных циклооксигеназой-2
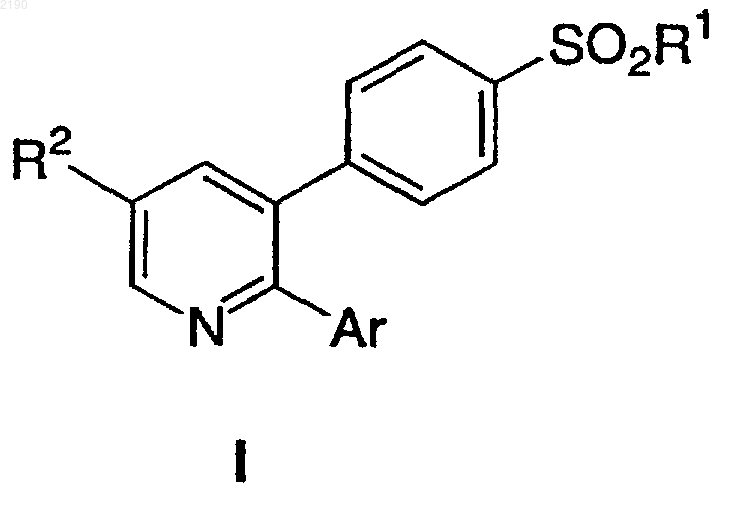
где R1 выбирают из группы, состоящей из
(a) СН3,
(b) NH2,
(c) NHC(O)CF3,
(d) NНСН3;
Аr представляет моно-, ди- или тризамещенный фенил или пиридинил (или его N-оксид), где заместители выбирают из группы, состоящей из
(a) водорода,
(b) галогена,
(c) С1-4алкокси,
(d) С1-4алкилтио,
(e) CN,
(f) С1-4алкила,
(g) С1-4фторалкила,
R2 выбирают из группы, состоящей из
(a) F, Cl, Br, I,
(b) CN,
(c) азида,
включающий
(а) взаимодействие соединения формулы А2
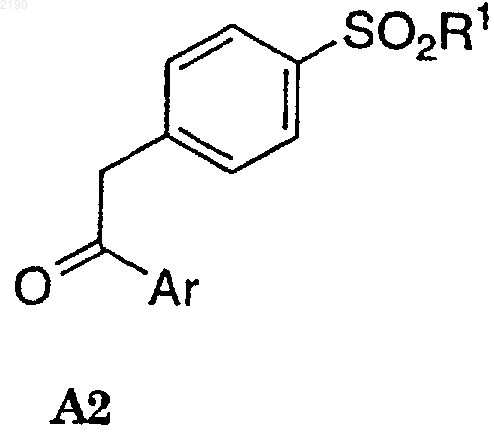
в присутствии второго нереакционноспособного растворителя с сильным основанием с получением енолята формулы В1
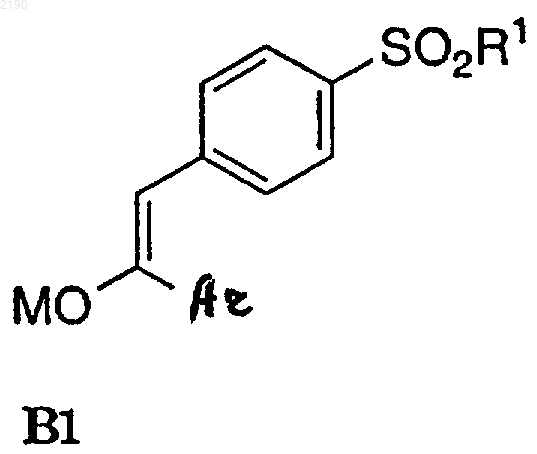
где М представляет калий, литий или натрий, и
(b) взаимодействие соединения формулы В1 в присутствии третьего нереакционноспособного растворителя с соединением формулы В2
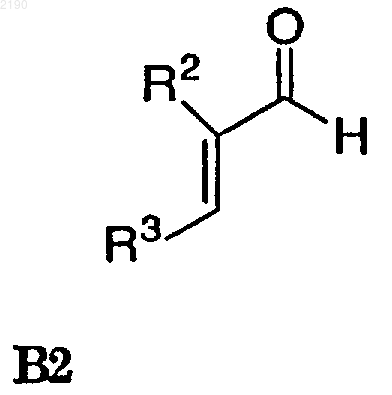
где R3 представляет уходящую группу, такую как тозил, мезил или галоген,
которое после нагревания в присутствии аммониевого реагента дает соединение формулы I.
9. Способ по п.8, в котором Аr представляет моно- или дизaмещенный 3-пиридинил.
10. Способ по п.8, в котором R1 представляет СН3 или NH2.
11. Способ по п.8, в котором Аr представляет моно- или дизамещенный 3-пиридинил, и заместители выбраны из группы, состоящей из
(a) водорода,
(b) галогена,
(c) C1-3алкокси,
(d) C1-3алкилтио,
(e) C1-3алкила,
(f) СF3 и
(g) CN.
12. Способ по п.8, в котором R1 представляет СН3 или NH2; и
Ar представляет моно- или дизамещенный 3-пиридинил и заместители выбраны из группы, состоящей из
(a) водорода,
(b) галогена,
(c) C1-3алкила,
(d) СF3 и
(e) CN.
13. Способ по п.8, в котором
R2 представляет Сl;
R1 представляет СН3 или NH2;
Ar представляет монозамещенный 3-пиридинил и заместители выбраны из группы, состоящей из водорода и C1-3алкила.
14. Способ по п.1, в котором R2 представляет хлор.
15. Способ по п.8, в котором R3 представляет хлор.
16. Способ по п.1 или 8, в котором аммониевый реагент выбирают из аммиака и ацетата аммония.
17. Способ по п.8, в котором сильное основание представляет бис(триметилсилил)амид лития.
18. Способ по п.8, в котором третий нереакционноспособный растворитель представляет толуол.
Текст
1 Предпосылки создания изобретения Данное изобретение относится к способу получения некоторых противовоспалительных соединений. В частности, заявка касается способа получения соединений формулы I, как описано далее, которые являются сильнодействующими ингибиторами циклооксигеназы-2. Нестероидные противовоспалительные лекарственные средства оказывают противовоспалительное, болеутоляющее и жаропонижающее действие и ингибируют гормониндуцированные сокращения матки и рост некоторых видов раковых опухолей за счет ингибирования простагландин G/H синтазы, также известной как циклооксигеназа. До недавнего времени была охарактеризована только одна форма циклооксигеназы, которая соответствовала циклооксигеназе 1 или конститутивному ферменту, первоначально идентифицированному в бычьих семенных пузырьках. Недавно был клонирован, секвенирован и охарактеризован ген второй индуцируемой формы циклооксигеназы (циклооксигеназа-2) из источников, полученных от цыпленка, мыши и человека. Этот фермент отличается от циклооксигеназы-1, которая в настоящее время также была клонирована, секвенирована и охарактеризована из источников, полученных от овцы, мыши и человека. Вторая форма циклооксигеназы, циклооксигеназа-2, быстро и легко индуцируется рядом агентов, включая митогены, эндотоксин, гормоны, цитокины и факторы роста. Так как простагландины играют как физиологическую, так и патологическую роли,авторы настоящего изобретения сделали заключение, что конститутивный фермент, циклооксигеназа-1, является ответственным, большей частью, за эндогенное базальное высвобождение простагландинов, и, следовательно, он важен для их физиологических функций, таких как поддержание работоспособности желудочно-кишечного тракта и почечного кровотока. В противоположность этому, авторами сделан вывод о том, что индуцируемая форма, циклооксигеназа-2, главным образом является ответственной за патологическое действие простагландинов, когда происходит быстрое индуцирование фермента в ответ на такие агенты, как воспалительные агенты, гормоны, факторы роста и цитокины. Таким образом, селективный ингибитор циклооксигеназы-2 будет обладать аналогичными противовоспалительными, жаропонижающими и болеутоляющими свойствами,что и обычные нестероидные противовоспалительные лекарственные средства, и, кроме того,он будет ингибировать гормониндуцированные сокращения матки и обладать потенциальным противораковым действием, но будет иметь пониженную способность индуцировать некоторые основанные на механизме побочные эффекты. В частности, такое соединение должно обладать пониженным потенциалом в отношении желудочно-кишечной токсичности, пониженной 2 возможностью оказания побочного действия на почки, пониженным действием на время кровотечения и, возможно, пониженной способностью индуцировать приступы астмы у аспиринчувствительных субъектов-астматиков. В WO 96/24585, опубликованном 15 августа 1996 г., и WO 96/10012, опубликованном 4 апреля 1996 г., описаны способы получения 2 арил-3-арилпиридинов. В изобретении, раскрытом ниже, 2-арил-3-арилпиридины получают простой для осуществления одностадийной конденсацией из легко доступных исходных материалов. Таким образом, этот способ оказался неожиданно удобным и более эффективным,чем описанный ранее способ, в котором 2-арил 3-арилпиридин получали последовательным постадийным введением арильных групп в центральное пиридиновое кольцо. Более того, способ по настоящему изобретению также имеет то неожиданное преимущество, что не требует ни дорогих палладиевых реагентов, ни проведения ряда последовательных реакций введения защитных групп/снятия защитных групп, как в способе, описанном в предшествующем уровне техники. Получение 2-хлормалондиальдегида было впервые осуществлено Дикманном в 1904 г. (W.Dieckmann, L. Platz, Ber. Deut. Chem. Ges. 1904,37, 4638). По химии 2-галогенмалондиальдегидов имеется подробный обзор 1975 г. (С.Reichardt and К. Halbritter, Angew. Chem. Int. Ed. 1975, 14, 86). В этом обзоре не указан синтез пиридина с использованием таких реагентов. Единственное упоминаемое применение 2 хлормалондиальдегида для получения пиридина- это недавняя патентная заявка (F.J. Urban, US 5206367, Pfizer and Brackeen M., и Howard, H.R.,Заявка на Европейский патент номер 89307339.5(ЕР 0352959), Pfizer), где хлормалондиальдегид сначала превращают в 2,3-дихлоракролеин, который затем конденсируют с енамином, полученным из 1,3-циклогександиона, с образованием циклического пиридина с 28% выходом. В недавнем исчерпывающем обзоре по синтезу и реакционной способности пиридинаKreher, 1992, Georg Thieme Verlag) не приводится примеров применения галогенмалондиальдегидов для синтеза пиридина. Нитромалондиальдегид конденсировали с этил-2-аминокротонатом, получая 5-нитропиридин, хотя и с невысоким выходом (35-50%) (J.M. Hoffman et al.,J. Org. Chem. , 1984, 49, 193 и Р.Е. Fanta, J. Am.Chem. Soc., 1953, 75, 737). Применение производных этоксикарбонилмалондиальдегида дает 5-этоксикарбонилпиридины (S. Torii et al., Synthesis, 1986, 400). Краткое изложение сущности изобретения Изобретение включает способ получения соединений формулы I, используемых для лечения воспалительных заболеваний и других за 3 болеваний, опосредованных циклооксигеназой 2 Подробное описание изобретения В одном из своих аспектов изобретение включает способ получения соединений формулы I, используемых для лечения воспалительных заболеваний и других заболеваний, опосредованных циклооксигеназой-2(a) СН 3,(b) NH2,(c) NНС(O)СF3,(d) NНСН 3; Аr представляет моно-, ди- или тризамещенный фенил или пиридинил (или его Nоксид), где заместители выбирают из группы,состоящей из(a) F, Cl, Br, I,(b) CN,(c) азида,который включает конденсацию соединения формулы А 1 в кислых условиях и, необязательно, в присутствии нереакционноспособного растворителя и в присутствии аммониевого реагента, с соединением А 2 с получением соединения формулы I. Как очевидно для специалистов в данной области, в общем случае реагенты сами по себе обеспечивают кислые условия. Таким образом,применение не вступающей в реакцию кислоты не является необходимым. Однако, добавление 4 кислоты, такой как уксусная или пропионовая,или другой карбоновой кислоты, входит в объем данного изобретения. В данном описании термин нереакционноспособный растворитель включает тетрагидрофуран, диоксан, C1-6 алканол и толуол. В данном описании термин аммониевый реагент включает аммиак и соли аммония, такие как ацетат аммония и пропионат аммония. Более того, термин аммониевый реагент включает смесь разных аммониевых реагентов. Молярное соотношение соединений А 1 и А 2 обычно изменяется от 2:1 до 1:2, предпочтительно 1:1 до 1,5. Обычно используют избыток соединения А 1. Молярное соотношение соединения А 1 и аммониевого реагента обычно изменяется от 1:1 до 1:10. Взаимодействие обычно можно проводить при температуре в диапазоне от 40 до 180 С, предпочтительно от 80 до 140 С,и времени, позволяющем проводить взаимодействие практически до полного завершения, составляющем от 2 до 18 ч, обычно от 6 до 12 ч. В другом аспекте изобретение включает способ получения соединений формулы I, используемых для лечения воспалительных и других заболеваний, опосредованных циклооксигеназой-2Ar представляет моно-, ди- или тризамещенный фенил или пиридинил (или его Nоксид), где заместители выбирают из группы,состоящей из(а) взаимодействие соединения формулы А 2 5 в присутствии второго нереакционноспособного растворителя с сильным основанием с получением енолята формулы В 1 где М представляет калий, литий или натрий. В настоящем описании термин сильное основание включает диизопропиламид лития, калия или натрия, бис(триметилсилил)амид лития,калия или натрия, гидрид лития, калия или натрия и амид лития, калия или натрия. В настоящем описании термин второй нереакционноспособный растворитель включает тетрагидрофуран, диоксан, толуол и простые эфиры. Молярное соотношение соединения А 2 и основания обычно можно изменять от 1:1 до 1:1,5. Обычно используют избыток основания. Реакционную стадию обычно можно проводить при температуре в диапазоне от -80 до 40 С; предпочтительно от -10 до 20 С, и времени, которое позволяет проводить реакцию до практически полного завершения, составляющем от 1 до 3 ч; обычно в течение от 1 до 2 ч.(b) взаимодействие соединения формулы В 1 в присутствии третьего нереакционноспособного растворителя с соединением формулы В 2 где R3 представляет уходящую группу, такую как тозил, мезил или галоген,которое после нагревания в присутствии аммониевого реагента дает соединение формулы I. Для использования в данной реакции третий нереакционноспособный растворитель представляет тетрагидрофуран, толуол и диоксан. Молярное соотношение соединения В 1 и 2,3-дихлоракролеина обычно может изменяться от 1:1,5 до 1,5:1, предпочтительно от 1:1 до 1,5. Обычно используют избыток 2,3 дихлоракролеина. Реакционную стадию обычно можно проводить при температуре в диапазоне от 0 до 80 С; предпочтительно от 20 до 50 С, и времени, позволяющем проводить взаимодействие практически до полного завершения, составляющем от 2 до 18 ч; обычно от 4 до 12 ч. В обоих вариантах изобретения R2 предпочтительно представляет галоген, наиболее 6 предпочтительно F или Сl, наиболее предпочтительно Сl. Предпочтительно, чтобы R3 был таким же, как и R2. В обоих вариантах изобретения предпочтительным подклассом соединений формулы I является тот, в котором Аr представляет собой моно- или дизамещенный пиридинил. В рамках этого подкласса особенно предпочтительны изомеры 3-пиридинила. Опять же, в обоих вариантах изобретения другим предпочтительным подклассом соединений формулы I является тот, в котором R1 представляет СН 3 или NH2. Обычно СН 3 является предпочтительным для специфичности в отношении COX-2, a NH2 является предпочтительным для силы действия. Опять же, в обоих вариантах изобретения другим предпочтительным подклассом соединений формулы I является тот, в котором Аr является незамещенным или замещенным СН 3. Соединение формулы I используется для облегчения боли, жара и воспаления при множестве болезненных состояний, включая ревматическую лихорадку, симптомы, связанные с гриппом или другими вирусными инфекциями,общую простуду, боль в поясничной области и в области шеи, дисменорею, головную боль, зубную боль, различные виды растяжений, миозит,невралгию, синовит, артрит, включая дегенеративные заболевания суставов при ревматоидном артрите (остеоартрит), подагру и анкилозирующий спондилит, бурсит, ожоги, раны, после хирургического вмешательства и стоматологических процедур. Кроме того, такое соединение может ингибировать опухолевые перерождения клеток и метастазный рост опухоли и, следовательно, его можно использовать при лечении рака. Соединения формулы I также могут использоваться для лечения слабоумия, включая пресенильное и старческое слабоумие и, в частности, слабоумие, связанное с болезнью Альцгеймера (т.е. слабоумие Альцгеймера). За счет высокой активности в отношении циклооксигеназы-2 (СОХ-1) и/или селективности к циклооксигеназе-2 по сравнению с циклооксигеназой-1 (СОХ-1), как указано выше, соединения формулы I являются полезными в качестве альтернативы обычным нестероидным противовоспалительным лекарственным средствам (НСПВС), особенно когда имеются противопоказания к таким нестероидным противовоспалительным лекарственным средствам, как,например, для пациентов с пептическими язвами, гастритом, региональным энтеритом, язвенным колитом, дивертикулезом или с рецидивирующими желудочно-кишечными изъязвлениями; при желудочно-кишечном кровотечении,заболеваниях свертываемости крови, включая анемию, такую как гипопротромбиновая анемия, гемофилия, или при других проблемах кровообращения (включая те, которые относятся к понижению или нарушению функции тром 7 боцитов); при почечных заболеваниях (например, почечная недостаточность); перед хирургическим вмешательством или приеме антикоагулянтов; и для пациентов с НСПВСиндуцированной астмой. Соединения по настоящему изобретению являются ингибиторами циклооксигеназы-2 и поэтому полезны для лечения заболеваний, опосредованных циклооксигеназой-2, перечисленных выше. Такая активность проиллюстрирована их способностью селективно ингибировать циклооксигеназу-2 по сравнению с циклооксигеназой-1. Соответственно в одном из анализов способность соединений по данному изобретению к лечению заболеваний, опосредованных циклооксигеназой, может быть продемонстрирована путем измерения количества простагландина Е 2 (PGE2), синтезированного в присутствии арахидоновой кислоты, циклооксигеназы 1 или циклооксигеназы-2 и соединения формулы I. Значения IC50 показывают концентрацию ингибитора, необходимую для обращения синтеза PGE2 на 50% в сравнении с контрольным значением, полученным без ингибирования. Иллюстрируя этот аспект, установили, что соединения из примеров эффективны более чем в 100 раз при ингибировании СОХ-2, чем при ингибировании СОХ-1. Кроме того, для всех из них значение IC50 для СОХ-2 составляет от 1 нМ до 1 мМ. Для сравнения, ибупрофен имеет значение IC50 для СОХ-2, равное 1 мМ, а Индометацин имеет IC50 для СОХ-2 приблизительно 100 нМ. Для лечения любых заболеваний, опосредованных циклооксигеназой, соединения формулы I могут вводиться перорально, местно,парентерально, путем ингаляционного распыления или ректально в виде препаративных форм с единичной дозой, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и растворители. Как использовано в данном описании, термин "парентеральное введение" включает подкожные инъекции,внутривенные, внутримышечные, внутригрудинные инъекции или инфузионные методики. Помимо лечения теплокровных животных, таких как мыши, крысы, лошади, крупный рогатый скот, овцы, собаки, кошки и т.д., соединение по данному изобретению эффективно для лечения людей. Изобретение далее проиллюстрировано следующими неограничивающими примерами,в которых, если не указано иначе:(i) все операции проводили при комнатной температуре или температуре окружающей среды, т.е. при температуре в диапазоне 18-25 С; выпаривание растворителя осуществляли с использованием роторного испарителя при пониженном давлении (600-4000 Па: 4,5-30 мм рт. ст.) при температуре бани до 60 С; протекание реакций контролировали с помощью тонкослойной хроматографии (ТСХ) или высокоэф 002190(ВЭЖХ); время реакции приведено только для иллюстрации; температуры плавления не корректировали, и "разл." указывает разложение; приведенные температуры плавления даны для веществ, полученных описанным способом; в некоторых способах получения полиморфизм может привести к выделению веществ, полученных по тем же методикам, с другими температурами плавления; строение и чистота полученных продуктов были подтверждены, по крайней мере, одним из следующих способов: ТСХ, масс-спектроскопия, спектроскопия ядерного магнитного резонанса (ЯМР) или данными микроанализа; выходы приведены только для иллюстрации; когда они приводятся, данные ЯМР представлены в виде значений дельта (d) для основных тестовых протонов в миллионных долях (м.д.) относительно тетраметилсилана(ТМС) в качестве внутреннего стандарта, которые зарегистрированы при 300 МГц или 400 МГц с использованием указанного растворителя; для обозначения формы сигнала использовали стандартные аббревиатуры: с - синглет; д - дублет; т - триплет; м мультиплет; уш. -уширенный сигнал; и т.д.,кроме того, "Ar" означает ароматические сигналы; химические символы имеют обычные значения; использованы следующие аббревиатуры: об. (объем), вес. (вес), т. кип. (температура кипения), т. пл. (температура плавления), л(миллиграмм(ы, моль (моли), ммоль (миллимоли), экв. (эквивалент(ы. Следующие аббревиатуры имеют указанные значения. Аббревиатуры алкильных групп: 2-Хлормалондиальдегид Кетон В Пропионовая кислота Ацетат аммония Смесь кетона В (5,0 г), 2-хлормалондиальдегида (4,8 г) и ацетата аммония нагревали до 130 С. Образующуюся уксусную кислоту отгоняли и нагревание продолжали при 136 С в течение 15 ч. Реакционную смесь подщелачивали карбонатом натрия, добавляли воду и продукт экстрагировали дихлорметаном (2150 мл). Органические слои обрабатывали активированным углем (Dowex), сушили (МgSO4) и удаляли растворитель, получая соединение 1 в виде белого твердого вещества (3,4 г, 55% выход).N,N-Диметилформамид добавляли к суспензии 2-хлормалондиальдегида (220 мг) в толуоле. Добавляли оксалилхлорид и реакционную смесь перемешивали до полного растворения. Бис(триметилсилил)амид лития (1,8 мл; 1 М в ТГФ) добавляли по каплям к кетону В (500 мг) в ТГФ (15 мл) при -78 С. Реакционную смесь нагревали до температуры окружающей среды в течение 1 ч с получением литиевого енолята В (см. общую формулу В 1), затем охлаждали до -78 С. Добавляли раствор 2,3 дихлоракролеина и температуру доводили до комнатной. Через 1 ч через раствор пропускали газообразный аммиак и через 30 мин добавляли ацетат аммония (1 г). Реакционную смесь нагревали при 60 С в течение 1 ч и выливали в водный раствор гидроксида натрия (2 М; 100 мл). Продукт экстрагировали дихлорметаном (2150 мл), сушили (MgSO4) и удаляли растворитель, получая 1 (500 мг; 80%). Получение исходных веществ Пример получения 1. Синтез 4 метилсульфонилфенилуксусной кислоты. Этилоксалилхлорид и ОДХБ загружали в колбу, оборудованную подвесной механической мешалкой, и охлаждали до 0 С. Медленно добавляли АlСl3. Добавление АlСl3 представляло собой экзотермический процесс. Через капельную воронку в течение 1,5 ч добавляли по каплям тиоанизол 2. Реакционная смесь быстро приобретала темно-фиолетовую окраску. Это добавление также было экзотермическим. Через 1 ч по данным ВЭЖХ реакция завершилась. Реакцию останавливали медленным добавлением 300 мл 1 н. НСl при 0 С. После нагревания до комнатной температуры добавляли воду и ОДХБ (по 50 мл каждого). Слои смешивали и разделяли. Органическую (нижнюю) фазу промывали 1250 мл воды и затем сушили над MgSO4. Остановка реакции также была экзотермической. Во время остановки цвет реакционной смеси изменялся от темно-фиолетового до бледно-зеленого. Высушенный раствор ОДХБ загружали в колбу Мортона, оборудованную механической мешалкой. Добавляли 1 н. растворNaOH (800 мл). Двухфазную смесь интенсивно перемешивали и нагревали до 50 С. Гидролиз с образованием соединения 3 завершался по данным ВЭЖХ за 2-3 ч. Водную фазу, содержащую продукт, непосредственно вводили в реакцию Вольфа-Кишнера. 4-(Метилтио)фенилуксусная кислота. Гидразин и NaOH загружали в колбу Мортона, оборудованную механической мешалкой. После нагревания раствора гидразина до 75 С в течение 35-40 мин добавляли раствор 3 в NaOH. После завершения добавления реакционную смесь кипятили с обратным холодильником в течение 5 дней. По данным ВЭЖХ к этому моменту реакция протекала приблизительно на 95%. Исходное вещество большей частью расходовалось в течение 24 ч, однако, третий пик требует нескольких дней для превращения в 4. Реакцию подкисляли концентрированной НСl до рН=1,5 и экстрагировали EtOAc (1750 мл и 1250 мл). Объединенные, содержащие продукт органические фазы промывали 2250 мл 1 н. НСl. При подкислении реакционная смесь приобретала ярко-желтую окраску. 4-(Метансульфонил)фенилуксусная кислота.(растворенный примерно в 15 мл Н 2 О). Медленно через капельную воронку добавляли перекись водорода в течение примерно 30 мин. Завершение реакции контролировали ВЭЖХ. Реакционную смесь промывали 2400 мл Н 2O и сушили над МgSО 4. По количественной оценке в органическом слое содержалось 61,29 г соединения 5 (71% выход по тиоанизолу). При концентрировании раствора выпадает осадок белого твердого продукта. Суспензию отфильтровывали и промывали гексанами. Выделено 49,02 г 5 (57% по тиоанизолу). Конденсация Иванова-Кляйзена для получения 1-(3-пиридил)-2-(4-метилсульфонилфенил)этан-1-она. 4-Метилсульфонилбензил-3-пиридилкетон, полученный из этилникотината и 4 метилсульфонилфенилуксусной кислоты. 4-Метилсульфонилфенилуксусная кислота (МВ=217) трет-Бутилмагнийхлорид Фенилуксусную кислоту растворяли в ТГФ в атмосфере азота. В течение 5 мин к раствору добавляли 1,9 эквивалента (88,73 мл) третбутилмагнийхлорида. Реакция была экзотермической. Температура поднималась от 20 до 12 50 С. После добавления первого эквивалента трет-бутилмагнийхлорида раствор приобретал красную окраску. Температуру реакции поддерживали равной 50 С. Через 1 ч добавляли 0,5 эквивалента этилникотината. Раствор приобретал желтую окраску и образовывался белый осадок. Через один час при 50 С добавляли 0,5 эквивалента трет-бутилмагнийхлорида. Раствор приобретал красную окраску. Последовательность добавлений повторяли, используя 0,25, 0,125, 0,0625 экв. этилникотината и трет-бутилмагнийхлорида. Реакционную смесь выдерживали в течение 1 ч между каждым добавлением. После последнего добавления реакцию гасили, добавляя в реакционную смесь при интенсивном перемешивании 2 н. соляную кислоту(100 мл). Твердые вещества на дне реакционной смеси растворялись с бурным выделением газа при перемешивании в соляной кислоте. рН водной фазы реакционной смеси доводили до 10 карбонатом натрия. По данным ЖХанализа, выход кетона составлял 91%. Получение 4-метилсульфонилбензальдегида. Получение проводили по способу Ulman Реагенты добавляли к метилсульфоксиду и нагревали при 130 С в течение 18 ч. Метансульфинат натрия был частично нерастворим при комнатной температуре, но переходил в раствор при 130 С. Из раствора выпадал осадок фторида натрия. Реакционную смесь выливали в 300 мл воды. Продукт выпадал в осадок в виде белого твердого вещества. Реакционную смесь отфильтровывали. Выделенный продукт промывали 100 мл воды и 250 мл метанола для удаления метилсульфоксида. Растворитель выпаривали из продукта при пониженном давлении,получая 39,9 г 2 в виде белого порошка (выход выделенного продукта 86%). 13 С-ЯМР (CDCl3): 44,33, 128,25, 130,43,139,70, 145,38, 190,72. 4-Метилсульфонилбензальдегид (2) из 4 хлорбензальдегида. Реагенты добавляли к метилсульфоксиду и нагревали при 130 С в течение 18 ч. Метансульфинат натрия был частично нерастворим при комнатной температуре, но переходил в раствор при 130 С. Из раствора выпадал осадок хлорида натрия. Реакционную смесь выливали в 100 мл воды. Продукт выпадал в осадок в виде белого твердого вещества. Реакционную смесь отфильтровывали. Выделенный продукт промывали 50 мл воды и 225 мл метанола для удаления метилсульфоксида. Растворитель выпаривали из продукта при пониженном давлении, получая 5,1 г 4-метилсульфонилбензальдегида в виде белого порошка Раствор анилина в этаноле (50 мл) добавляли к раствору 3-пиридинкарбоксальдегида в этаноле (100 мл) при 0 С. Через 2 ч добавляли дифенилфосфит и продолжали перемешивание при комнатной температуре в течение 18 ч. Для дополнительного осаждения продукта добавляли метил-трет-бутиловый простой эфир (МТБЭ)(80%) пиридиламинодифенилфосфоната в виде белого твердого вещества. 13 С-ЯМР (СDСl3): К раствору фосфоната (14,0 г) в тетрагидрофуране при -45 С в течение 10 мин добавляли 10% КОН/МеОН (23 мл). Через 10 мин добавляли одной порцией бензальдегид и через 1 ч нагревали реакционную смесь до температуры окружающей среды. Добавляли водную соляную кислоту (2 н., 100 мл) и раствор оставляли на 18 ч. Добавляли EtOAc (200 мл) и воду (200 мл) и органический слой отбрасывали. Кислый слой подщелачивали (рН=9) карбонатом натрия и экстрагировали дихлорметаном (2150 мл). Органические слои объединяли, сушили Раствор анилина в метаноле (5 мл) добавляли к раствору 3-пиридинкарбоксальдегида в метаноле (5 мл) при 0 С. Через 2 ч добавляли дифенилфосфит и продолжали перемешивание при комнатной температуре в течение 18 ч. Добавляли ТГФ (100 мл) и реакционную смесь охлаждали до-40 С. Добавляли 10% КОН/метанол (28 мл) и через 30 мин добавляли 4-метансульфонилбензальдегид. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 18 ч. Добавляли(рН=9) карбонатом натрия и экстрагировали дихлорметаном (2150 мл). Органические слои объединяли, сушили (MgSO4) и концентрировали. Растирание с гексанами давало 4 метилсульфонилбензил-3-пиридилкетон в виде бледно-желтого твердого вещества (9,7 г; 71%). Получение хлормалондиальдегида Получение хлормалондиальдегида можно осуществлять различными путями. Получение из 1,1,2,3,3-пентахлорпропана. Подробное описание эксперимента опубликовано в Houben-Weyl-Muller: Methoden derVerlag, Stuttgart, 1954, page 119. Исходное вещество - 1,1,2,3,3-пентахлорпропан, коммерчески доступен от Pfaltz and Bauer. Получение из мукохлорной кислоты. Следующий способ представляет собой небольшое изменение исходной методики Дикманна (Ber, Deut. Chem. Ges., 1904, 37, 4638). Мукохлорная кислота Анилин Вода К раствору анилина в воде при 85 С в 2 л колбе при интенсивном перемешивании добавляли небольшими порциями в течение 30 мин мукохлорную кислоту. При добавлении мукохлорной кислоты появлялась желтая окраска,которая быстро исчезала. Реакционная смесь оставалась гетерогенной, и фильтрование аликвоты через 30 мин нагревания показало завершение реакции. Реакционную смесь нагревали при 90 С в течение 60 мин, охлаждали до 50 С и отфильтровывали. Осадок на фильтре промывали 50 мл 2 н. НСl и 100 мл Н 2 О. Продукт сушили в токеN2, получая 57 г (100% выход) 3-анилидо-2 хлоракролеина в виде серого твердого вещества. 13 С-ЯМР (ДMCO-d6 в м.д.): 108, 117, 124,129, 140, 147, 182. 3-Анилидо-2-хлоракролеин 5 н. раствор NaOH Раствор 3-анилидо-2-хлоракролеина в 120 мл 5 н. NaOH нагревали при 100 С в течение 90 мин. Темный черный раствор экстрагировали дважды по 50 мл МТБЭ. Первая органическая промывка удаляла большую часть темного цвета раствора, и вторая органическая промывка была лишь слегка окрашена. При охлаждении водной фазы образовывался кристаллический осадок. Продукт представлял собой натриевую соль 3-хлормалондиальдегида. Водную фазу подкисляли, добавляя 60 мл 37% раствора НСl. Водную фазу экстрагировали(МТБЭ/ТГФ 50/50, всего 400 мл) и объединенные органические фазы сушили над МgSO4. После обработки Darco G60 и фильтрования через слой SiO2 раствор упаривали, получая 19,6 г(общий выход 62%) хлормалондиальдегида в виде темного твердого вещества. Перекристаллизация из примерно 10 мл МТБЭ давала 11,13 г чистого хлормалондиальдегида в виде коричневатого твердого вещества. 13 С-ЯМР (ДМСО-d6 в м.д.): 113,175 (уширенный). Получение из хлорацетилхлорида.Arnold (Collect. Czech. Chem. Соmmun.,1961, 26, 3051) отмечает образование 3 диметиламино-2-хлоракролеина при взаимодействии хлоруксусной кислоты с реагентом Вильсмейера, полученным из РОСl3 и ДМФ. Изменение и расширение его способа приводит к получению хлормалондиальдегида в виде Na соли. Оксалилхлорид (280 мл, 3,2 моль) добавляли при 10 С к 1000 мл ДМФ. Реакция была очень экзотермичной и образовывался тяжелый осадок. Через 2 ч выдерживания добавляли хлорацетилхлорид (110 мл, 1,4 моль) и реакционную смесь нагревали при 75 С в течение 3 ч. Анализ аликвоты методом 1H-ЯМР показал полное исчезновение хлорацетилхлорида, и реакционную смесь гасили, добавляя е в 1 л H2O. К охлажденному раствору добавляли 500 мл 50% раствора NaOH. Реакционную смесь кипятили с обратным холодильником в течение 5 ч. При охлаждении образовывался осадок, который отфильтровывали и промывали водой. Рыжевато-коричневое твердое вещество сушили в токе N2, получая рыжевато-коричневое твердое вещество (54% выход). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединений формулы(a) СН 3,(b) NH2,(c) NНС(O)СF3,(d) NНСН 3; Аr представляет моно-, ди- или тризамещенный фенил или пиридинил (или его Nоксид), где заместители выбирают из группы,состоящей из(a) F, Cl, Br, I,(b) CN,(c) азида, 17 включающий конденсацию соединения формулы А 1 в кислых условиях и, необязательно в присутствии нереакционноспособного растворителя и в присутствии аммониевого реагента, с соединением А 2 с получением соединения формулы I. 2. Способ по п.1, в котором нереакционноспособный растворитель представляет уксусную кислоту. 3. Способ по п.1, в котором Аr представляет моно-, ди- или тризамещенный 3-пиридинил. 4. Способ по п.1, в котором R1 представляет СН 3 или NН 2. 5. Способ по п.1, в котором Аr представляет моно- или дизамещенный 3-пиридинил и заместители выбраны из группы, состоящей из(g) CN. 6. Способ по п.1, в котором R1 представляет СН 3 или NH2; и Аr представляет моно- или дизамещенный 3-пиридинил и заместители выбраны из группы, состоящей изR1 представляет СН 3 или NH2; Аr представляет монозамещенный 3 пиридинил и заместители выбраны из группы,состоящей из водорода и C1-3 алкила. 8. Способ получения соединений формулыI, используемых для лечения воспалительных и других заболеваний, опосредованных циклооксигеназой-2(b) NH2,(c) NHC(O)CF3,(d) NНСН 3; Аr представляет моно-, ди- или тризамещенный фенил или пиридинил (или его Nоксид), где заместители выбирают из группы,состоящей из(а) взаимодействие соединения формулы А 2 в присутствии второго нереакционноспособного растворителя с сильным основанием с получением енолята формулы В 1(b) взаимодействие соединения формулы В 1 в присутствии третьего нереакционноспособного растворителя с соединением формулы В 2 где R3 представляет уходящую группу, такую как тозил, мезил или галоген,которое после нагревания в присутствии аммониевого реагента дает соединение формулы I. 9. Способ по п.8, в котором Аr представляет моно- или дизaмещенный 3-пиридинил. 10. Способ по п.8, в котором R1 представляет СН 3 или NH2. 11. Способ по п.8, в котором Аr представляет моно- или дизамещенный 3-пиридинил, и заместители выбраны из группы, состоящей изAr представляет моно- или дизамещенный 3-пиридинил и заместители выбраны из группы,состоящей изAr представляет монозамещенный 3 пиридинил и заместители выбраны из группы,состоящей из водорода и C1-3 алкила. 20 14. Способ по п.1, в котором R2 представляет хлор. 15. Способ по п.8, в котором R3 представляет хлор. 16. Способ по п.1 или 8, в котором аммониевый реагент выбирают из аммиака и ацетата аммония. 17. Способ по п.8, в котором сильное основание представляет бис(триметилсилил)амид лития. 18. Способ по п.8, в котором третий нереакционноспособный растворитель представляет толуол.
МПК / Метки
МПК: A61K 31/4418, C07D 213/61, C07B 43/00
Метки: 2-арил-3-арил-5-замещённых, используемых, ингибиторов, cox-2, получения, качестве, способ, пиридинов
Код ссылки
<a href="https://eas.patents.su/11-2190-sposob-polucheniya-2-aril-3-aril-5-zameshhyonnyh-piridinov-ispolzuemyh-v-kachestve-ingibitorov-cox-2.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 2-арил-3-арил-5-замещённых пиридинов, используемых в качестве ингибиторов cox-2</a>
Предыдущий патент: Применение диазепиноиндолов для приготовления лекарственного продукта, ингибирующего фосфодиэстеразу 4
Следующий патент: Состав и способ для снижения шума и/или загрязнения в системе жидкостного охлаждения двигателя
Случайный патент: Производные тетрагидрохинолина в качестве антагонистов глицина












