Производные пирролопиридина и их применение в качестве модуляторов ppar-рецепторов
Номер патента: 14185
Опубликовано: 29.10.2010
Авторы: Бубиа Бенаисса, Пупардин-Оливье Оливия, Бине Жан, Лежендр Кристиан, Барт Мартин, Доде Пьер
Формула / Реферат
1. Производное пирролопиридина, характеризующееся тем, что оно выбрано из:
i) соединений формулы
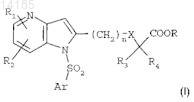
где R1и R2, каждый независимо, представляют собой атом водорода, атом галогена, группу C1-C3-алкил или C1-C4-алкокси либо группу CF3;
R3 и R4, каждый независимо, представляют собой атом водорода или группу C1-C4-алкил;
R представляет собой атом водорода или группу C1-C3-алкил;
n=1, 2 или 3;
X представляет собой одинарную связь или атом кислорода;
Ar представляет собой ароматическое или гетероароматическое ядро, выбранное из групп фенил, пиразолил, имидазолил, тиазолил, оксазолил, изоксазолил, фурил, тиенил, пирролил, пиридил, дифенил, нафтил, 1,2,3,4-тетрагидронафтил, хинолил, изохинолил, 1,2,3,4-тетрагидрохинолил, бензимидазолил, бензопиразинил, индолил, 2,3-дигидроиндолил, бензофурил, 2,3-дигидробензофурил, бензотиазолил, бензотиадиазолил, бензизоксазолил, 3,4-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, 2,3-дигидробензодиоксинил, имидазотиазолил и бензоксазолил, возможно замещенных одним или более (например, 2 или 3) заместителями, выбранными из атомов галогена и групп C1-C6-алкил, C1-C4-алкокси, трифторметил, трифторметокси, нитро, ацетил, ацетиламино и диалкиламино или амино либо гетероциклов оксазолила, тиазолила, пиразолила, пирролидинила, пиридила, пиримидинила, метилпиримидинила или морфолинила,
ii) их фармацевтически приемлемых солей.
2. Соединение по п.1, характеризующееся тем, что Ar представляет собой ароматическое или гетероароматическое ядро, выбранное из групп фенил, пиридил, дифенил, нафтил, хинолил, бензопиразинил, индолил, 2,3-дигидроиндолил, бензофурил, 2,3-дигидробензофурил, бензотиазолил, бензотиадиазолил, бензизоксазолил, 3,4-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, 2,3-дигидробензодиоксинил, имидазотиазолил и бензоксазолил, возможно замещенных одним или более (например, 2 или 3) заместителями, выбранными из атомов галогена и групп C1-C6-алкил, C1-C4-алкокси, трифторметил, трифторметокси, нитро, ацетил, ацетиламино и диалкиламино или амино либо гетероциклов оксазолила, тиазолила, пиразолила, пирролидинила, пиридила, пиримидинила, метилпиримидинила или морфолинила.
3. Соединение по п.1 или 2, характеризующееся тем, что R1представляет собой атом хлора или группу трифторметил.
4. Применение соединения по любому из пп.1-3 в качестве фармакологически активного вещества.
5. Применение соединения по любому из пп.1-3 для изготовления лекарственного средства для лечения гипертриглицеридемии, гиперлипидемии, гиперхолестеринемии, дислипидемии, устойчивости к инсулину, диабета и ожирения.
6. Применение соединения по любому из пп.1-3 для изготовления лекарственного средства для лечения дисфункции эндотелия.
7. Применение соединения по любому из пп.1-3 для изготовления лекарственного средства для лечения сердечно-сосудистых заболеваний, воспалительных заболеваний и нейродегенеративных заболеваний, в частности, таких как болезнь Альцгеймера или болезнь Паркинсона.
8. Фармацевтическая композиция, характеризующаяся тем, что содержит по меньшей мере одно соединение по любому из пп.1-3 в качестве активного вещества.
9. Способ получения соединения по п.1, характеризующийся тем, что включает стадии, состоящие из:
а) проведения реакции галогенирования, предпочтительно реакции йодирования, аминопиридина формулы
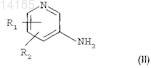
где R1и R2, каждый независимо, представляют собой атом водорода, атом фтора, брома или хлора или группу C1-C4-алкил, C1-C4-алкокси или трифторметил,
с использованием галогенирующего агента, например йода в присутствии сульфата серебра или бензилтриметиламмония дихлориодата, в растворителе при комнатной температуре в течение 5-24 ч с получением соединения формулы

где R1и R2 сохраняют такое же значение, как в исходных соединениях;
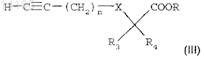
б) взаимодействия в соответствии с реакцией Соногаширы соединения формулы (III) с производным ацетилена формулы
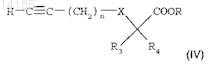
где n=1, 2 или 3;
R3 и R4, каждый независимо, представляют собой атом водорода или группу C1-C4-алкил;
R представляет собой группу C1-C3-алкил;
X представляет собой одинарную связь или атом кислорода;
в присутствии йодида меди, катализатора на основе палладия, например тетракис-(трифенилфосфин)палладия или дихлор-бис-(трифенилфосфин)палладия, и органического основания в растворителе при температуре между 0 и 60°С в течение 2-24 ч с получением соединения формулы
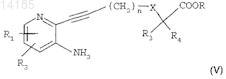
где R1, R2, n, X, R3, R4 и R сохраняют такое же значение, как в исходных соединениях;
в) взаимодействия соединения формулы (V) с арилсульфонилхлоридом формулы
![]()
где Ar представляет собой ароматическое или гетероароматическое ядро, выбранное из групп фенил, пиразолил, имидазолил, тиазолил, оксазолил, изоксазолил, фурил, тиенил, пирролил, пиридил, дифенил, нафтил, 1,2,3,4-тетрагидронафтил, хинолил, изохинолил, 1,2,3,4-тетрагидрохинолил, бензимидазолил, бензопиразинил, индолил, 2,3-дигидроиндолил, бензофурил, 2,3-дигидробензофурил, бензотиазолил, бензотиадиазолил, бензизоксазолил, 3,4-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, 2,3-дигидробензодиоксинил, имидазотиазолил и бензоксазолил, возможно замещенных одним или более (например, 2 или 3) заместителями, выбранными из атомов галогена и групп C1-C6-алкил, C1-C4-алкокси, трифторметил, трифторметокси, нитро, ацетил, ацетиламино и диалкиламино или амино либо гетероциклов оксазолила, тиазолила, пиразолила, пирролидинила, пиридила, пиримидинила, метилпиримидинила или морфолинила,
в присутствии пиридина, возможно в растворителе при комнатной температуре в течение 10-120 мин с получением соединения формулы
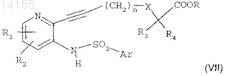
где R1, R2, n, X, R3, R4, R и Ar сохраняют такое же значение, как в исходных соединениях;
г) проведения циклизации соединения формулы (VII), например, посредством действия ацетата меди II в растворителе при температуре, близкой к температуре кипения растворителя, в течение 4-24 ч с получением соединения формулы

где R1, R2, n, X, R3, R4, R и Ar сохраняют такое же значение, как в исходных соединениях;
д) если необходимо, гидролиза эфирной функциональной группы соединения формулы (Ia), например, посредством действия неорганического основания с получением после обработки кислотой соединения формулы (I) в форме свободной кислоты
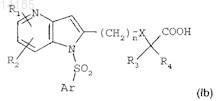
10. Способ получения соединения по п.1, характеризующийся тем, что он включает стадии, состоящие из:
а) взаимодействия соединения формулы (III)

где R1 и R2, каждый независимо, представляют собой атом водорода, хлора или фтора или группу C1-C4-алкил, C1-C4-алкокси или трифторметил,
с арилсульфонилхлоридом формулы
![]()
где Ar представляет собой ароматическое или гетероароматическое ядро, выбранное из групп фенил, пиразолил, имидазолил, тиазолил, оксазолил, изоксазолил, фурил, тиенил, пирролил, пиридил, дифенил, нафтил, 1,2,3,4-тетрагидронафтил, хинолил, изохинолил, 1,2,3,4-тетрагидрохинолил, бензимидазолил, бензопиразинил, индолил, 2,3-дигидроиндолил, бензофурил, 2,3-дигидробензофурил, бензотиазолил, бензотиадиазолил, бензизоксазолил, 3,4-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, 2,3-дигидробензодиоксинил, имидазотиазолил и бензоксазолил, возможно замещенных одним или более (например, 2 или 3) заместителями, выбранными из атомов галогена и групп C1-C6-алкил, C1-C4-алкокси, трифторметил, трифторметокси, нитро, ацетил, ацетиламино и диалкиламино или амино либо гетероциклов оксазолила, тиазолила, пиразолила, пирролидинила, пиридила, пиримидинила, метилпиримидинила или морфолинила,
в растворителе при комнатной температуре и в течение 1-12 ч с получением соединения формулы (VIII)
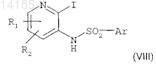
где R1, R2 и Ar сохраняют такое же значение, как в исходных соединениях;
б) взаимодействия соединения формулы (VIII) с производным ацетилена формулы
где n=1, 2 или 3;
R3 и R4, каждый независимо, представляют собой атом водорода или группу C1-C4-алкил;
R представляет собой группу C1-C3-алкил;
X представляет собой одинарную связь или атом кислорода;
в условиях, аналогичных описанным для стадии б) способа по п.9, с получением соединения формулы
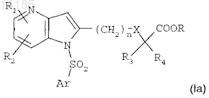
где R1, R2, n, X, R3, R4, R и Ar сохраняют такое же значение, как в исходных соединениях;
в) если необходимо, гидролиза эфирной функциональной группы соединения формулы (Ia), например, посредством действия неорганического основания с получением после обработки кислотой соединения формулы (I) в форме свободной кислоты
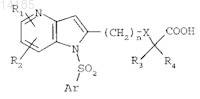
Текст
Изобретение относится к соединениям на основе пирролопиридина общей формулы (I) как определено в формуле изобретения, и к их фармацевтически приемлемым солям присоединения кислоты. Изобретение также относится к способу получения указанных соединений, к фармацевтическим композициям, содержащим их, и к их применению в качестве фармакологически активного вещества, в частности, при лечении гипертриглицеридемии, гиперлипидемии, гиперхолестеринемии, диабета, дисфункции эндотелия, сердечно-сосудистых заболеваний, воспалительных заболеваний и нейродегенеративных заболеваний. 014185 Настоящее изобретение относится к новым соединениям пирролопиридина, к способу их получения и к их терапевтическому применению для предупреждения или лечения патологий, в которые вовлечены ядерные рецепторы типа PPAR (рецепторы активаторов пролиферации пероксисом). Предшествующий уровень техники В терапии известно, что заболевания сердечно-сосудистой системы представляют важный фактор риска для здоровья. Эти заболевания часто являются следствием высокого уровня холестерина и/или триглицеридов и, следовательно, важно поддерживать эти уровни ниже значений, широко признанных профессиональной медициной. В случае холестерина особенно необходимо оценивать количества холестерина, связанного с различными липопротеинами, в целях адаптации терапий таким образом, чтобы снижать уровни холестерина ЛПНП (липопротеинов низкой плотности), в то же время, сохраняя уровни холестерина ЛПВП (липопротеинов высокой плотности). Среди известных семейств соединений, применяемых для регуляции этих параметров, находятся статины, которые являются ингибиторами HMG СоА-редуктазы и дают возможность по существу лечить избыточно высокие уровни холестерина ЛПНП, и соединения семейства фибратов, которые действуют посредством активации ядерных рецепторов PPAR (активируемых пролифератором пероксисом рецепторов альфа) и дают возможность снизить уровни триглицеридов и холестерина. Исследование ядерных рецепторов PPAR привело к идентификации трех подтипов, известных какPPAR, PPAR и PPAR. Эти различные рецепторы посредством связывания с определенными специфичными фрагментами ДНК регулируют экспрессию генов-мишеней, которые кодируют белки, вовлеченные в механизмы регуляции метаболизма липидов (см., например, Current Topics in Medicinal Chemistry, 2003, 3, (14), 1649-1661). Таким образомPPAR экспрессируются по существу в печени и вовлечены в катаболизм жирных кислот посредством регуляции - и -окисления (J. Lipid. Res. (1996) 37, 907-925);PPAR экспрессируются главным образом в жировой ткани и вовлечены в механизмы регуляции гликемии;PPAR экспрессируются повсеместно, но в основном присутствуют в почках, скелетных мышцах,сердце и кишечнике. Подобно другим рецепторам типа PPAR PPAR образуют гетеродимер с RXR (рецептором ретиноида X), и тогда они способны к связыванию с определенными элементами геновмишеней ядра и регулирующими факторами транскрипции. Среди различных исследований, посвященных данному ядерному рецептору, продемонстрировано, например, что активация PPAR дает возможность повысить уровень холестерина ЛПВП у мышей db/db (FEBS Letters (2000), 473, 333-336) и инсулинозависимых макак-резусов с ожирением, а также стимулирует выделение холестерина через Аро А 1 в человеческих клетках ТНР-1 (Proc. Nat. Ac. Sci. USA (2001), 98, 5306-5311). Лечение инсулиннезависимого диабета типа 2 остается неудовлетворительным, несмотря на поступление в продажу различных пероральных гипогликемизирующих производных для облегчения секреции инсулина и для стимуляции его действия на периферические ткани-мишени. Агонисты PPAR в целом описаны для улучшения чувствительности к инсулину, как уже наблюдали с тиазолидиндионами(ТЗД). Новые агонисты PPAR разработаны в терапии диабета типа 2 и/или дислипидемии. Среди новых агонистов PPAR некоторые являются активаторами по меньшей мере двух из трех подтипов PPAR ,и . Возрастание встречаемости данных патологий требует разработки новых терапевтических агентов,которые являются активными в случае этих заболеваний, следовательно, соединения, обладающие отличной гипогликемизирующей активностью и гиполипидемизирующей активностью, при этом избегая побочных эффектов, наблюдаемых с тиазолидиндионами, весьма полезны при лечении и/или профилактике инсулиннезависимого диабета типа 2 для снижения периферической устойчивости к инсулину и нормализации гликемии. В результате исследования различных ядерных рецепторов оказалось, что соединения, которые являются агонистами одновременно двух и предпочтительно трех подтипов рецепторов PPAR, могут обладать крайне благоприятным фармакологическим профилем для одновременного лечения патологий, таких как гиперлипидемия, гиперхолестеринемия и диабет, а также различных заболеваний сердечнососудистой системы, которые являются следствием метаболического синдрома. Настоящее изобретение относится к активаторам или модуляторам рецепторов PPAR. Эти соединения удовлетворяют фармакологическим критериям, упомянутым выше. Среди документов предшествующего уровня техники, в которых упомянуты подобные соединения,известные примеры включают документы WO 97/28149, WO 04/060871, WO 05/016335 и WO 05/016881,в которых описаны агонисты рецептора PPAR, документ WO 01/60807, в котором описаны агонистыPPAR, или документы WO 05/009958 и WO 05/056522, в которых предложены соединения индола, которые являются активными на рецепторах PPAR. Следует также упомянуть документы WO 02/071827 и Bioorganic and Med. Chem. Letter Vol. 14 (11),-1 014185p. 259-2763 (06/2004), где описаны производные, которые являются модуляторами рецепторов RXR, и их терапевтическое применение для лечения патологий, вовлеченных в метаболический синдром. Кроме того, различные соединения пирролопиридина описаны в предшествующем уровне техники,например некоторые промежуточные соединения, раскрытые в документе WO 98/25611, заявленные соединения которого являются активными против тромбоза. Сущность изобретения Настоящее изобретение относится к новым производным пирролопиридина, которые являются активаторами PPAR и выбраны из: где R1 и R2, каждый независимо, представляют собой атом водорода, атом галогена, группу C1-C4 алкил или группу C1-C4-алкокси либо группу CF3;R3 и R4, каждый независимо, представляют собой атом водорода или группу C1-C4-алкил;R представляет собой атом водорода или группу C1-C3-алкил;X представляет собой одинарную связь или атом кислорода;Ar представляет собой ароматическое или гетероароматическое ядро, выбранное из групп фенил,пиразолил, имидазолил, тиазолил, оксазолил, изоксазолил, фурил, тиенил, пирролил, пиридил, дифенил,нафтил, 1,2,3,4-тетрагидронафтил, изохинолил, хинолил, 1,2,3,4-тетрагидрохинолил, бензимидазолил,бензопиразинил, индолил, 2,3-дигидроиндолил, бензофурил, 2,3-дигидробензофурил, бензотиазолил,бензотиадиазолил,бензизоксазолил,3,4-дигидро-1,4-бензоксазинил,1,3-бензодиоксолил,2,3 дигидробензодиоксинил, имидазотиазолил и бензоксазолил, возможно замещенных одним или более(например, 2 или 3) заместителями, выбранными из атомов галогена и групп C1-C6-алкил, C1-C4-алкокси,трифторметил, трифторметокси, нитро, ацетил, ацетиламино и диалкиламино, в которых каждая алкильная группа содержит от 1 до 3 атомов углерода, либо амино, либо гетероциклы оксазолила, тиазолила,пиразолила, пирролидинила, пиридила, пиримидинила, метилпиримидинила или морфолинила,ii) их фармацевтически приемлемых солей. Согласно второму аспекту изобретение относится к вышеупомянутым соединениям для их применения в качестве фармакологически активных веществ, а также к фармацевтическим композициям, содержащим их. Кроме того, изобретение относится к применению по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемых солей в качестве активного вещества для изготовления лекарственного средства, предназначенного для терапевтического применения, в частности для борьбы с гиперхолестеринемией, гиперлипидемией, гипертриглицеридемией, дислипидемией, устойчивостью к инсулину, диабетом или ожирением, а также с сердечно-сосудистыми заболеваниями, которые являются следствием дисбаланса сывороточных липопротеинов. Соединения по изобретению также полезны в качестве активных веществ для лекарственных средств для предупреждения или лечения заболеваний, обусловленных дисфункцией эндотелия, атеросклероза, инфаркта миокарда, гипертензии, проблем сосудов головного мозга, некоторых воспалительных заболеваний, например ревматоидного артрита, и нейродегенеративных заболеваний, в частности, таких как болезнь Альцгеймера или болезнь Паркинсона. Подробное описание В настоящем описании термин "группа C1-Cn-алкил" (где n представляет собой целое число) означает нормальную, разветвленную либо частично или полностью циклическую цепь на основе углеводорода, содержащую от 1 до n атомов углерода, где циклическая часть содержит по меньшей мере 3 атома углерода. Например, и без ограничения, группа C1-C6-алкил может представлять собой группу метил,этил, пропил, бутил, пентил, гексил, 1-метилэтил, 1-метилпропил, 2-метилпропил, 1,1-метилэтил, 1 метилбутил, 1,1-диметилпропил, 1-метилпентил, 1,1-диметилбутил, циклопропил, циклобутил, циклопентил, циклогексил или циклопентилметил. Термин "группа C1-Cn-алкокси" (где n представляет собой целое число) означает группу RO-, в которой R представляет собой алкильную группу, содержащую от 1 до n атомов углерода, как определено выше. Термин "галоген" означает атом фтора, хлора, брома или йода, где предпочтительны атомы фтора и хлора. Соединения формулы (I), в которых R представляет собой атом водорода, представляют собой карбоновые кислоты, которые можно использовать в форме свободных кислот или в форме солей, где указанные соли получают путем объединения кислоты с фармацевтически приемлемым нетоксичным неорганическим или органическим основанием. Среди неорганических оснований, которые можно использовать, находятся, например, гидроксид натрия, гидроксид калия, гидроксид магния и гидроксид кальция. Среди органических оснований, которые можно использовать, находятся, например, амины, аминоспир-2 014185 ты, основные аминокислоты, такие как лизин или аргинин, или соединения, несущие функциональную группу четвертичного аммония, например бетаин или холин. Соединения формулы (I), в которых заместители R3 и R4 являются разными, имеют асимметрический центр. Для этих соединений изобретение охватывает как рацемическое соединение, так и каждый из оптических изомеров, рассмотренный отдельно. Одно конкретное семейство соединений по изобретению включает соединения вышеупомянутой формулы (I), гдеR1 и R2, каждый независимо, представляют собой атом водорода, атом галогена или группу CF3;R3 и R4, каждый независимо, представляют собой атом водорода или группу C1-C4-алкил;R представляет собой атом водорода или группу C1-C3-алкил;X представляет собой одинарную связь или атом кислорода;Ar представляет собой ароматическое или гетероароматическое ядро, выбранное из групп фенил,нафтил, бензотиазолил, 3,4-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, 2,3-дигидробензодиоксинил и бензоксазолил, возможно замещенных одним или более заместителями, выбранными из групп C1-C6 алкил, C1-C4-алкокси и амино. Среди соединений формулы (I) по изобретению предпочтительными соединениями являются те, в которыхR1 и R2, каждый независимо, представляют собой атом водорода, атом галогена, группу C1-C4-алкил или C1-C4-алкокси либо группу CF3;R3 и R4, каждый независимо, представляют собой атом водорода или группу C1-C4-алкил;R представляет собой атом водорода или группу C1-C3-алкил;X представляет собой одинарную связь или атом кислорода;Ar представляет собой ароматическое или гетероароматическое ядро, выбранное из групп фенил,пиридил, дифенил, нафтил, хинолил, бензопиразинил, индолил, 2,3-дигидроиндолил, бензофурил, 2,3 дигидробензофурил, бензотиазолил, бензотиадиазолил, бензизоксазолил, 3,4-дигидро-1,4-бензоксазинил,1,3-бензодиоксолил, 2,3-дигидробензодиоксинил, имидазотиазолил и бензоксазолил, возможно замещенных одним или более (например, 2 или 3) заместителями, выбранными из атома галогена и групп C1-C6 алкил, C1-C4-алкокси, трифторметил, трифторметокси, нитро, ацетил, ацетиламино и диалкиламино, в которых каждая алкильная группа содержит от 1 до 3 атомов углерода, либо амино, либо гетероциклов оксазолил, тиазолил, пиразолил, пирролидинил, пиридил, пиримидинил, метилпиримидинил или морфолинил. Среди соединений по изобретению предпочтительными соединениями также являются те, в которых Ar представляет собой фенильную группу. Соединения, в которых R1 представляет собой атом хлора или группу трифторметил, также предпочтительны. Соединения по изобретению могут быть получены в соответствии с первым способом, который состоит из: а) проведения реакции галогенирования, предпочтительно реакции йодирования, аминопиридина формулы где R1 и R2, каждый независимо, представляют собой атом водорода, атом хлора, брома или фтора,группу C1-C4-алкил или C1-C4-алкокси или группу трифторметил,используя галогенирующий агент, например йод в присутствии сульфата серебра или бензилтриметиламмония дихлориодат, в растворителе, таком как дихлорметан или алифатический спирт, при комнатной температуре в течение 5-24 ч с получением соединения формулы где R1 и R2 сохраняют такое же значение, как в исходных соединениях; б) взаимодействия в соответствии с реакцией Соногаширы (см., например, Tet. Lett., 1975, 4467) соединения формулы (III) с производным ацетилена формулыR3 и R4, каждый независимо, представляют собой атом водорода или группу C1-C4-алкил;R представляет собой группу C1-C3-алкил;X представляет собой одинарную связь или атом кислорода; в присутствии йодида меди, катализатора на основе палладия, например тетракис(трифенилфосфин)палладия или дихлор-бис-(трифенилфосфин)палладия, и органического основания,например триэтиламина, в растворителе, например в диметилформамиде (ДМФ), при температуре между 0 и 60 С в течение 2-24 ч с получением соединения формулы где R1, R2, n, X, R3, R4 и R сохраняют такое же значение, как в исходных соединениях; в) взаимодействия соединения формулы (V) с арилсульфонилхлоридом формулы где Ar представляет собой ароматическое или гетероароматическое ядро, выбранное из групп фенил, пиразолил, имидазолил, тиазолил, оксазолил, изоксазолил, фурил, тиенил, пирролил, пиридил, дифенил, нафтил, 1,2,3,4-тетрагидронафтил, хинолил, изохинолил, 1,2,3,4-тетрагидрохинолил, бензимидазолил, бензопиразинил, индолил, 2,3-дигидроиндолил, бензофурил, 2,3-дигидробензофурил, бензотиазолил, бензотиадиазолил, бензизоксазолил, 3,4-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, 2,3 дигидробензодиоксинил, имидазотиазолил и бензоксазолил, возможно замещенных одним или более(например, 2 или 3) заместителями, выбранными из атома галогена и групп C1-C6-алкил, C1-C4-алкокси,трифторметил, трифторметокси, нитро, ацетил, ацетиламино и диалкиламино, либо амино, либо гетероциклов оксазолил, тиазолил, пиразолил, пирролидинил, пиридил, пиримидинил, метилпиримидинил или морфолинил,в присутствии пиридина, возможно в растворителе, таком как дихлорметан, при комнатной температуре в течение 10-120 мин с получением соединения формулы где R1, R2, n, X, R3, R4, R и Ar сохраняют такое же значение, как в исходных соединениях; г) проведения циклизации соединения формулы (VII), например, посредством действия ацетата меди II (см., например, J. Org. Chem., 2004, 69(4), 1126-1136), в растворителе, таком как 1,2-дихлорэтан, при температуре, близкой к температуре кипения растворителя, в течение 4-24 ч с получением соединения формулы где R1, R2, n, X, R3, R4, R и Ar сохраняют такое же значение, как в исходных соединениях; д) если необходимо, гидролиза эфирной функциональной группы соединения формулы (Ia), например, под действием неорганического основания, такого как гидроксид натрия или гидроксид лития, согласно методикам, которые хорошо известны специалистам в данной области техники, с получением после обработки кислотой соединения формулы (I) в форме свободной кислоты В соответствии с первым вариантом способа получения соединения формулы (I) могут быть получены путем последовательности реакций, состоящей из: а) взаимодействия соединения формулы (III) как получено выше, с арилсульфонилхлоридом формулы где Ar представляет собой ароматическое или гетероароматическое ядро, выбранное из групп фенил, пиразолил, имидазолил, тиазолил, оксазолил, изоксазолил, фурил, тиенил, пирролил, пиридил, дифенил, нафтил, 1,2,3,4-тетрагидронафтил, хинолил, изохинолил, 1,2,3,4-тетрагидрохинолил, бензимидазолил, бензопиразинил, индолил, 2,3-дигидроиндолил, бензофурил, 2,3-дигидробензофурил, бензотиазолил, бензотиадиазолил, бензизоксазолил, 3,4-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, 2,3 дигидробензодиоксинил, имидазотиазолил и бензоксазолил, возможно замещенных одним или более(например, 2 или 3) заместителями, выбранными из атомов галогена и групп C1-C6-алкил, C1-C4-алкокси,трифторметил, трифторметокси, нитро, ацетил, ацетиламино и диалкиламино или амино либо гетероциклов оксазолила, тиазолила, пиразолила, пирролидинила, пиридила, пиримидинила, метилпиримидинила или морфолинила,в растворителе, например в диметилформамиде, предпочтительно в присутствии апротонного основания, например пиридина, при комнатной температуре в течение 1-12 ч с получением соединения формулы (VIII) где R1, R2 и Ar сохраняют такое же значение, как в исходных соединениях; б) взаимодействия соединения формулы (VIII) с производным ацетилена формулыR3 и R4, каждый независимо, представляют собой атом водорода или группу C1-C4-алкил;R представляет собой группу C1-C3-алкил;X представляет собой одинарную связь или атом кислорода; в условиях, аналогичных описанным для стадии б) приведенного выше общего способа, с получением соединения формулы где R1, R2, n, X, R3, R4, R и Ar сохраняют такое же значение, как в исходных соединениях; в) если необходимо, гидролиза эфирной функциональной группы соединения формулы (Ia), например, посредством действия неорганического основания, такого как гидроксид натрия или гидроксид лития, согласно методикам, которые хорошо известны специалистам в данной области техники, с получением после обработки кислотой соединения формулы (I) в форме свободной кислоты Соединения по изобретению в форме солей кислоты формулы (Ib) с неорганическим или органическим основанием могут быть получены общепринятым путем, используя способы, которые хорошо известны специалистам в данной области техники, например путем смешивания стехиометрических количеств кислоты и основания в растворителе, например в воде или в водно-спиртовой смеси, а затем лиофилизации полученного раствора. На некоторых из стадий вышеописанных реакций предпочтительно возможна замена традиционных методов нагревания микроволновым нагреванием с использованием реакторов, приспособленных к данному виду реакции. В данном случае специалисту в данной области техники должно быть понятно, что-5 014185 время "нагревания" значительно меньше по сравнению со временем, необходимым для стандартного нагревания. Примеры, в которых выполнено получение соединений формулы (I), позволяют более ясно понять изобретение. В данных примерах, которые не ограничивают объем изобретения, термином "примеры получения" обозначают примеры, в которых описан синтез промежуточных соединений, а термин "примеры" представляет примеры, в которых описан синтез соединений формулы (I) по изобретению. Среди сокращений мМ означает миллимоли, ТГФ означает тетрагидрофуран, ДМФ означает диметилформамид, ДМЭ означает 1,2-диметоксиэтан, ДХМ означает дихлорметан и PdCl2dppf означает дихлор-1,1'-бис(дифенилфосфино)ферроценпалладий (II). Температуры плавления измеряют на установке Kfler либо с использованием аппарата Mettler, а спектральные значения ядерно-магнитного резонанса характеризуются химическим сдвигом, вычисленным относительно ТМС (тетраметилсилана), числом протонов, связанных с сигналом, и формой сигнала(s для синглета, d для дублета, dd для двойного дублета, t для триплета, q для квартета, quint для квинтета и m для мультиплета). Рабочая частота и используемый растворитель указаны для каждого соединения. Комнатная температура составляет 205 С. Пример получения I. 3-Амино-6-хлор-2-йодпиридин. 23,2 г (180,5 мМ) 5-амино-2-хлорпиридина смешивают в 70 мл дихлорметана (ДХМ) и 180 мл метанола и добавляют 21,6 г (216 мМ) карбоната кальция и 75,3 г (226 мМ) бензилтриметиламмония дихлориодата. Реакционную смесь перемешивают при комнатной температуре в течение 16 ч, а затем фильтруют для удаления неорганических солей. Фильтрат разбавляют водой и экстрагируют ДХМ. Полученную органическую фазу промывают раствором хлорида натрия, а затем насыщенным раствором тиосульфата натрия, высушивают над сульфатом магния и концентрируют при пониженном давлении. Получают масло, которое очищают хроматографией на силикагеле, элюируя смесью циклогексан/этилацетат (80/20, а затем 70/30; об./об.). Таким образом, получают 13,9 г ожидаемого продукта в форме твердого вещества оранжевого цвета (выход=30%). Т. пл.=148 С. Пример получения II. 3-[ди(Бензолсульфонил)амино]-6-хлор-2-йодпиридин. Смесь 13,75 г (54 мМ) соединения согласно примеру получения I и 27,6 мл (216 мМ) бензолсульфонилхлорида в 30 мл пиридина перемешивают в течение 60 ч при комнатной температуре. Затем реакционную смесь разбавляют водой и несколько раз экстрагируют этилацетатом. Органическую фазу промывают нормальным раствором соляной кислоты, а затем раствором хлорида натрия, высушивают над сульфатом магния и концентрируют при пониженном давлении. Ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=96%). Т. пл.=231 С. Пример получения III.N-(6-Хлор-2-йод-3-пиридил)бензолсульфонамид. 15,46 г (29 мМ) соединения согласно примеру получения II смешивают в 170 мл диоксана и добавляют 77 мл водного 3 М раствора гидроксида калия. Реакционную смесь перемешивают при слабом кипении растворителя с обратным холодильником в течение 1 ч, а затем концентрируют при пониженном давлении. Получают твердое вещество бежевого цвета, которое суспендируют в 200 мл воды. Смесь подкисляют до pH примерно 4 добавлением соляной кислоты, а затем экстрагируют дихлорметаном (ДХМ). Органическую фазу высушивают над сульфатом магния, а затем концентрируют при пониженном давлении. Таким образом, получают 10,32 г ожидаемого продукта в форме твердого вещества бежевого цвета(выход=91%). Т. пл.=132 С Пример 1. 5-Хлор-1-(фенилсульфонил)-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. 10,32 г (26,2 мМ) соединения согласно примеру получения III, 30 мл диметилформамида, 460 мг(0,65 мМ) дихлор-бис-(трифенилфосфин)палладия, 250 мг (1,3 мМ) йодида меди и 20 мл диэтиламина смешивают вместе. Затем добавляют 3,5 г (31,25 мМ) метил-4-пентиноата при перемешивании при комнатной температуре и реакционную смесь перемешивают в течение 1 ч при слабом кипении растворителя с обратным холодильником. Затем реакционную смесь разбавляют водой и несколько раз экстрагируют этилацетатом. Органическую фазу промывают раствором хлорида натрия, высушивают над сульфатом магния и концентрируют при пониженном давлении. Полученное коричневое масло очищают хроматографией на силикагеле, элюируя смесью циклогексан/этилацетат (8/2; об./об.). Таким образом, получают 8,02 г ожидаемого продукта в форме желтого твердого вещества (выход: 81%). Т. пл.=108-115 С. Пример 2. 5-Хлор-1-(фенилсульфонил)-1H-пирроло[3,2-b]пиридин-2-пропановая кислота.-6 014185 1,5 г (4 мМ) эфира, полученного согласно примеру 1, смешивают в 5 мл тетрагидрофурана и добавляют раствор 332 мг (7,9 мМ) гидроксида лития (LiOHH2O) в 4 мл воды. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре, а затем подкисляют до pH 3 соляной кислотой и экстрагируют ДХМ. Органическую фазу высушивают над сульфатом магния и концентрируют при пониженном давлении. Получают желтоватое масло, которое кристаллизуется в форме белого твердого вещества(выход=77%). Т. пл.=185-187 С. Пример получения IV. 3-Амино-2-йод-6-(трифторметил)пиридин. 3,85 г (12,3 мМ) сульфата серебра добавляют при перемешивании и при комнатной температуре к раствору 2 г (12,3 мМ) 5-амино-2-(трифторметил)пиридина в 100 мл этанола. Затем добавляют 3,13 г йода и реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Твердое вещество в виде суспензии в растворе удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток после выпаривания растворяют в 200 мл дихлорметана и промывают 5% раствором гидроксида натрия, а затем водой и высушивают над сульфатом магния. Полученный раствор концентрируют при пониженном давлении и, таким образом, получают 3,42 г ожидаемого соединения в форме розового твердого вещества (выход=96%). Т. пл.=127 С. Пример получения V. 6-(3-Амино-6-хлор-2-пиридил)-5-гексиновой кислоты метиловый эфир. 5 г (19,6 мМ) соединения согласно примеру получения I, 20 мл диметилформамида, 345 мг(0,49 мМ) дихлор-бис-(трифенилфосфин)палладия, 187 мг (0,98 мМ) йодида меди и 10 мл диэтиламина смешивают вместе. Затем добавляют 2,97 г (23,5 мМ) метил-5-гексиноата при перемешивании при комнатной температуре и реакционную смесь перемешивают в течение 1 ч при слабом кипении растворителя с обратным холодильником. Затем реакционную смесь разбавляют водой и несколько раз экстрагируют этилацетатом. Органическую фазу промывают раствором хлорида натрия, высушивают над сульфатом магния и концентрируют при пониженном давлении. Полученное остаточное маслянистое соединение очищают хроматографией на силикагеле, элюируя смесью циклогексан/этилацетат (9/1; об./об.). Таким образом, получили 4,15 г ожидаемого продукта в форме масла (выход: 84%). 1 Н ЯМР (300 МГц, ДМСО) : 1.83 (quint, 2H); 2.47 (t, 2H); 2.54 (t, 2 Н); 3.60 (s, 3 Н); 5.63 (s, 2H); 7,10(s, 2H). Пример получения VI. 6-[3-[(6-Бензотиазолилсульфонил)амино]-6-хлор-2-пиридил]-5-гексиновой кислоты метиловый эфир. Готовят раствор 1 г (4 мМ) соединения согласно примеру получения V в 10 мл пиридина и добавляют 1,1 г (4,7 мМ) 6-бензотиазолсульфонилхлорида. Эту смесь перемешивают в течение 3 ч при комнатной температуре, а затем разбавляют водой и экстрагируют этилацетатом. Органическую фазу дважды промывают нормальным раствором соляной кислоты, а затем водой, высушивают над сульфатом магния и концентрируют при пониженном давлении. Остаточное масло очищают хроматографией на силикагеле, элюируя смесью циклогексан/этилацетат (7/3; об./об.). Таким образом, получают 1,07 г ожидаемого соединения в форме желтого твердого вещества (выход=60%). Т. пл.=134 С. Пример 3. 1-(6-Бензотиазолилсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Смесь 1 г (2,22 мМ) эфира согласно примеру получения VI в 3 мл 1,2-дихлорэтана готовят в пробирке для микроволнового реактора и добавляют 403 мг (2,22 мМ) ацетата меди. Эту смесь нагревают микроволнами при 150 С в течение 30 мин, а затем охлаждают, разбавляют 6 мл дихлорметана и фильтруют через фильтр Ватман. Фильтрат концентрируют при пониженном давлении и сырой продукт очищают хроматографией на силикагеле, элюируя смесью циклогексан/этилацетат (8/2; об./об.). Таким образом, получают 500 мг ожидаемого соединения в форме желтого твердого вещества (выход=50%). Т. пл.=55 С. Пример 4. 1-(6-Бензотиазолилсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с соединения, полученного согласно примеру 3, ожидаемый продукт получают в форме твердого вещества бежевого цвета (выход=95%). Т. пл.=178 С. Пример получения VII.N-[2-Йод-6-(трифторметил)-3-пиридил]бензолсульфонамид. 7 г (40 мМ) бензолсульфонилхлорида постепенно добавляют при перемешивании и при комнатной температуре к раствору 2,88 г (10 мМ) соединения согласно примеру получения IV в 25 мл пиридина.-7 014185 Реакционную смесь перемешивают при комнатной температуре в течение 24 ч, а затем наливают в 300 мл охлажденной во льду нормальной соляной кислоты. Полученный осадок отделяют фильтрованием и промывают водой на фильтре, а затем перемешивают в колбе с 40 мл диоксана и 10 мл водного 3 М раствора гидроксида калия при слабом кипении растворителя с обратным холодильником в течение 2 ч. Эту реакционную смесь охлаждают, разбавляют 300 мл воды, подкисляют до pH примерно 1,5 концентрированной соляной кислотой, а затем экстрагируют дихлорметаном. Полученную органическую фазу промывают водой, а затем высушивают над сульфатом магния и концентрируют при пониженном давлении. Таким образом, получают 3,7 г ожидаемого продукта в форме белого твердого вещества (выход=89%). Т. пл.=131 С. Пример получения VIII. 5-[3-Амино-6-хлор-2-пиридил]-4-пентиновой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения V, начиная с метилового эфира 4 пентиновой кислоты, ожидаемый продукт получают в форме желтого твердого вещества (выход=77%). Т. пл.=96-100 С. Путем обработки способом, подобным примеру получения VI, начиная с соответствующих сульфонилхлоридов, получают приведенные ниже соединения. Пример получения IX. 6-[3-[(1,3-Бензодиоксол-5-илсульфонил)амино]-6-хлор-2-пиридил]-5-гексиновой кислоты метиловый эфир. Коричневое твердое вещество, выход=91%. Т. пл.=123 С. Пример получения X. 6-[3-[(2-Амино-5-бензотиазолилсульфонил)амино]-6-хлор-2-пиридил]-5-гексиновой кислоты метиловый эфир. Белое твердое вещество, выход=37%. Т. пл.=66-72 С. Пример получения XI. 6-[6-Хлор-3-[(3,5-диметилфенил)сульфониламино]-2-пиридил]-5-гексиновой кислоты метиловый эфир. Оранжевое масло, выход=98%. 1 Н ЯМР (300 МГц, ДМСО) : 1.74 (quint, 2H); 2.30 (s, 6H); 2.40 (t, 2H); 2.42 (t, 2 Н); 3.61 (s, 3H); 7.28(s, 1H); 7.33 (s, 2H); 7.45 (d, 1H); 7.70 (d, 2H); 10.07 (s, 1H). Пример получения XII. 6-[6-Хлор-3-[(2,5-диметоксифенил)сульфониламино]-2-пиридил]-5-гексиновой кислоты метиловый эфир. Оранжевое твердое вещество, выход=84%. Т. пл.=78-82 С. Пример получения XIII. 6-[6-Хлор-3-[(1-нафталинил)сульфониламино]-2-пиридил]-5-гексиновой кислоты метиловый эфир. Оранжевое твердое вещество, выход=98%. Т. пл.=117 С. Пример получения XIV. 6-[6-Хлор-3-[(3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-ил)сульфониламино]-2-пиридил]-5 гексиновой кислоты метиловый эфир. Коричневое масло, выход=74%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1.75 (quint, 2 Н); 2.41 (m, 4H); 2.78 (s, 3H); 3.28 (m, 2 Н); 3.61 (s, 3 Н); 4.27 (m, 2 Н); 6.78 (d, 1H); 6.88 (s, 1H); 6.89 (d, 1H); 7.44 (d, 1H); 7.71 (d, 1H); 9.80 (s, 1H). Путем обработки способом, подобным примеру получения VI, начиная с эфира согласно примеру получения VIII и соответствующих сульфонилхлоридов, получают приведенные ниже соединения. Пример получения XV. 5-[3-[(5-Бензодиоксолилсульфонил)амино]-6-хлор-2-пиридил]-4-пентиновой кислоты метиловый эфир. Коричневое твердое вещество, выход=92%. Т. пл.=133 С. Пример получения XVI. 5-[3-[(6-Бензотиазолилсульфонил)амино]-6-хлор-2-пиридил]-4-пентиновой кислоты метиловый эфир. Желтое твердое вещество, выход=49%. Т. пл.=137 С.-8 014185 Пример получения XVII. 2-3-(3-Амино-6-хлор-2-пиридил)-2-пропинил]окси]пропановой кислоты этиловый эфир. Путем обработки способом, подобным примеру получения V, начиная с этилового эфира 2-(2 пропинилокси)пропановой кислоты, ожидаемый продукт получают в форме коричневого твердого вещества (выход=73%). Т. пл.=70 С. Пример получения XVIII.N-(6-Хлор-2-йод-3-пиридил)-3-метоксибензолсульфонамид. Путем обработки способом, подобным примеру получения VII, начиная с соединения согласно примеру получения I и 3-метоксибензолсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход=96%). Т. пл.=154 С. Пример получения XIX. 2-3-[3-Амино-6-(трифторметил)-2-пиридил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения V, начиная с соединения согласно примеру получения IV и метилового эфира 2-метил-2-(2-пропинилокси)пропановой кислоты, ожидаемый продукт получают в форме желтого масла (выход=56%). 1 Н ЯМР (250 МГц, ДМСО-d6) : 7.50 (d, 1H); 7.18 (d, 1H); 6.23 (s, 2H); 4.44 (s, 2 Н); 3.68 (s, 3H); 1.42(s, 6H). Пример получения XX. 2-3-[3-Амино-6-(трифторметил)-2-пиридил]-2-пропинил]окси]пропановой кислоты этиловый эфир. 800 мг (2,78 мМ) соединения согласно примеру получения IV, 78 мг (0,28 мМ) трициклогексилфосфина, 20 мл диметилформамида, 97 мг (0,14 мМ) дихлор-бис-(трифенилфосфин)палладия, 26 мг(0,14 мМ) йодида меди и 8 мл трет-бутиламина смешивают вместе. Затем добавляют 1,09 г (7 мМ) этилового эфира 2-(2-пропинилокси)пропановой кислоты при перемешивании при комнатной температуре, и реакционную смесь перемешивают в течение 20 ч при 45-50 С. Затем реакционную смесь охлаждают,разбавляют водой и несколько раз экстрагируют этилацетатом. Объединенные органические фазы промывают раствором хлорида натрия, высушивают над сульфатом магния и концентрируют при пониженном давлении. Полученный сырой продукт очищают хроматографией на силикагеле, элюируя смесью толуол/этилацетат (9/1, а затем 8/2; об./об.). Ожидаемый продукт получают, таким образом, в форме масла (выход: 76%). 1 Н ЯМР (300 МГц, ДМСО-d6) : 7.51 (d, 1H); 7.18 (d, 1H); 6.27 (s, 2H); 4.58 (d, 1 Н); 4.48 (d, 1H); 4.23(q, 1H); 4.12 (q, 2H); 1.31 (d, 3 Н); 1.20 (t, 3 Н). Пример получения XXI. 5-[3-Амино-6-(трифторметил)-2-пиридил]-4-пентиновой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения V, начиная с соединения согласно примеру получения IV и метилового эфира 4-пентиновой кислоты, ожидаемый продукт получают в форме твердого вещества охристой окраски (выход=81%). Т. пл.=90 С. Пример получения XXII. 6-[3-Амино-6-(трифторметил)-2-пиридил]-5-гексиновой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения XXI, начиная с метилового эфира 5 гексиновой кислоты, ожидаемый продукт получают в форме коричневого твердого вещества (выход=94%). Т. пл.=49 С. Пример получения XXIII. 6-(3-Амино-6-хлор-2-пиридил)-6-гептиновой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения V, начиная с метилового эфира 6 гептиновой кислоты, ожидаемый продукт получают в форме желтого масла (выход=85%). 1 Н ЯМР (300 МГц, ДМСО-d6) : 7.09 (s, 2 Н); 5.60 (s, 2 Н); 3.60 (s, 3 Н); 2.50 (m, 2 Н); 2.37 (t, 2H); 1.63(m, 4 Н). Путем обработки способом, подобным примеру получения VII, начиная с соединения согласно примеру получения I и соответствующих сульфонилхлоридов, получают приведенные ниже арил- или гетероарилсульфонамиды. Пример получения XXIV.N-(6-Хлор-2-йод-3-пиридил)-2,3-дихлорбензолсульфонамид. Твердое вещество бежевого цвета, выход=99%. Т. пл.260 С. Пример получения XXVII.N-(6-Хлор-2-йод-3-пиридил)-2,5-диметоксибензолсульфонамид. Твердое вещество бежевого цвета, выход=99%. Т. пл.=147 С. Пример получения XXXI.N-(6-Хлор-2-йод-3-пиридил)-3,5-диметилбензолсульфонамид. Твердое вещество бежевого цвета, выход=99%. Т. пл.=138 С. Пример получения XXXV.N-(2-Бром-6-метил-3-пиридил)бензолсульфонамид. Путем обработки способом, подобным примеру получения VII, начиная с 3-амино-2-бром-6 метилпиридина, ожидаемый продукт получают в форме твердого вещества бежевого цвета (выход=95%). 1 Н ЯМР (250 МГц, ДМСО-d6) : 10.05 (s, 1H); 7.70 (m, 3H); 7.61 (d, 2H); 7.47 (d, 1 Н); 7.25 (d, 1H); 2.39 (s, 3H). Пример получения XXXVII. 3-Амино-2-бром-6-метоксипиридин. Готовят смесь 1,83 г (14,7 мМ) 5-амино-2-метоксипиридина и 1,21 г (14,7 мМ) ацетата натрия в 12 мл уксусной кислоты и осторожно добавляют 0,75 мл (14,7 мМ) брома при перемешивании и при поддержании при комнатной температуре. Реакционную смесь держат при перемешивании в течение 30 мин при комнатной температуре, а затем добавляют 200 мл насыщенного раствора тиосульфата натрия. Полученную водную фазу дважды экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом магния и концентрируют при пониженном давлении. Таким образом, получают 3 г ожидаемого соединения в форме твердого вещества фиолетового цвета (количественный выход). 1 Н ЯМР (250 МГц, ДМСО-d6) : 7.18 (d, 1H); 6.64 (d, 1H); 4.91 (s, 2H); 3.71 (s, 3 Н). Пример получения XXXVIII.(2-Бром-6-метокси-3-пиридил)бензолсульфонамид. Путем обработки способом, подобным примеру получения VII, начиная с 3-амино-2-бром-6- 10014185 метоксипиридина, ожидаемый продукт получают в форме коричневого твердого вещества (выход=50%). 1 Н ЯМР (250 МГц, ДМСО-d6) : 9.92 (s, 1 Н); 7.67 (m, 3 Н); 7.57 (m, 2 Н); 7.45 (d, 1H); 6.84 (d, 1H); 3.80 (s, 3 Н). Пример получения XXXIX. 3-Амино-2-йод-6-метоксипиридин. Путем обработки способом, подобным примеру получения IV, начиная с 5-амино-2 метоксипиридина, ожидаемый продукт получают в форме коричневого масла (выход=6%). 1 Н ЯМР (300 МГц, ДМСО-d6) : 7.08 (d, 1H); 6.62 (d, 1H); 4.81 (s, 2H); 3.71 (s, 3 Н). Пример получения XL.(2-Йод-6-метокси-3-пиридил)бензолсульфонамид. Путем обработки способом, подобным примеру получения VII, начиная с 3-амино-2-йод-6 метоксипиридина, ожидаемый продукт получают в форме коричневого твердого вещества (выход=91%). 1 Н ЯМР (250 МГц, ДМСО-d6) : 9.84 (s, 1H); 7.65 (m, 5H); 7.17 (d, 1H); 6.77 (d, 1H); 3.79 (s, 3 Н). Пример получения XLI.N-(2-Бром-6-метил-3-пиридил)-6-бензотиазолсульфонамид. Путем обработки способом, подобным примеру получения VII, начиная с 3-амино-2-бром-6 метилпиридина и 6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме пасты бежевого цвета (выход=35%). 1 Н ЯМР (250 МГц, ДМСО-d6) : 10.20 (s, 1H); 9.63 (s, 1H); 8.61 (d, 1H); 8.25 (d, 1 Н); 7.85 (dd, 1H); 7.49 (d, 1H); 7.26 (d, 1H); 2.39 (s, 3 Н). Пример получения XLII.N-(6-Хлор-2-йод-3-пиридил)-3-пиридинсульфонамид. Путем обработки способом, подобным примеру получения XVIII, начиная с 3 пиридинсульфонилхлорида, ожидаемый продукт получают в форме пастообразного соединения, которое используют без дальнейшей очистки для получения соединения согласно примеру 252. Пример получения XLIII.N-(6-Хлор-2-йод-3-пиридил)-6-хинолинсульфонамид. Путем обработки способом, подобным примеру получения XVIII, начиная с 6 хинолинсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход=99%) Т. пл.250 С. Пример получения XLIV.N-(2-Йод-6-хлор-3-пиридил)-6-бензотиазолсульфонамид. Путем обработки способом, подобным примеру 50, начиная с 3-амино-2-йод-6-хлорпиридина и 6 бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме твердого вещества оранжевого цвета (выход=33%). Т. пл.=191 С. Пример получения XLV. 5-(Трифторметил)-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 3, начиная с метилового эфира согласно примеру получения XXII, ожидаемый продукт получают в форме твердого вещества бежевого цвета (выход=66%). Т. пл.=137 С. Пример получения XLVI. 6-[6-Хлор-3-(4-фтор-3-нитрофенил)сульфонил]амино]-2-пиридил]-5-гексиновой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с 4-фтор-3 нитробензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход=31%). 1H ЯМР (300 МГц, ДМСО-d6) : 10.63 (s, 1H); 8.41 (dd, 1H); 8.06 (m, 1H); 7.75 (m, 2 Н); 7.46 (d, 1H); 3.61 (s, 3 Н); 2.39 (m, 4 Н); 1.72 (quint, 2H). Пример получения XLVII. 6-[3-(2,1,3-Бензотиадиазол-4-ил)сульфонил]амино]-6-хлор-2-пиридил]-5-гексиновой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с 2,1,3-бензотиадиазол-4 сульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=64%). 1- 11014185 Путем обработки способом, подобным примеру 1, начиная с этилового эфира 2-(2 пропинилокси)пропановой кислоты, ожидаемое соединение получают в форме желтого масла (выход=62%). 1(d, 1H); 6.95 (s, 1H); 7.43 (d, 1H); 7.60 (t, 2H); 7.74 (t, 1H); 8.02 (d, 2H); 8.42 (d, 1H). Пример 6. 2-5-Хлор-1-(фенилсульфонил)-1H-пирроло[3,2-b]пирид-2-ил]метокси]пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 5, ожидаемое соединение получают в форме белого твердого вещества (выход=57%). Т. пл.=153-155 С. Пример 7. 2-5-Хлор-1-(фенилсульфонил)-1H-пирроло[3,2-b]пирид-2-ил]метокси]-2-метилпропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 1, начиная с метилового эфира 2-метил-2-(2 пропинилокси)пропановой кислоты, ожидаемое соединение получают в форме белого твердого вещества(выход=20%). Т. пл.=84-87 С. Пример 8. 2-5-Хлор-1-(фенилсульфонил)-1H-пирроло[3,2-b]пирид-2-ил]метокси]-2-метилпропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 7, ожидаемое соединение получают в форме белого твердого вещества (выход=57%). Т. пл.=183-185 С. Пример 9. 5-Хлор-1-(фенилсульфонил)-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 1, начиная с метилового эфира 5-гексиновой кислоты, ожидаемое соединение получают в форме желтого твердого вещества (выход=38%). Т. пл.=85-90 С. Пример 10. 5-Хлор-1-(фенилсульфонил)-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 9, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=38%). Т. пл.=160-164 С. Пример 11. 3-(1-Бензолсульфонил-5-хлор-1 Н-пирроло[3,2-b]пирид-2-ил)-2,2-диметилпропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 1, начиная с метилового эфира 2,2-диметил-4 пентиновой кислоты, ожидаемое соединение получают в форме желтого масла (выход=82%). 1(t, 2H); 7.72 (t, 1H); 7.82 (d, 2H); 8.42 (d, 1H). Пример 12. 3-(1-Бензолсульфонил-5-хлор-1H-пирроло[3,2-b]пирид-2-ил)-2,2-диметилпропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 11, ожидаемое соединение получают в форме белого твердого вещества (выход=18%). Т. пл.=208-211 С. Пример 13. 2-1-(Фенилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пирид-2-ил]метокси]пропановой кислоты этиловый эфир. Путем обработки способом, подобным примеру 1, начиная с соединения согласно примеру получения VII и этилового эфира 2-(2-пропинилокси)пропановой кислоты, ожидаемое соединение получают в форме бесцветного масла (выход=63%). 1(d, 1H); 7.12 (s, 1H); 7.61 (t, 2H); 7.75 (t, 1H); 7.80 (d, 1H); 8.06 (d, 2H); 8.63 (d, 1H). Пример 14. 2-1-(Фенилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пирид-2-ил]метокси]пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 13, ожидаемое соединение получают в форме белого твердого вещества (выход=56%). Т. пл.=53-57 С. Пример 15. 2-1-(Фенилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пирид-2-ил]метокси]-2 метилпропановой кислоты метиловый эфир.- 12014185 Путем обработки способом, подобным примеру 13, начиная с соединения согласно примеру получения VII и метилового эфира 2-метил-2-(2-пропинилокси)пропановой кислоты, ожидаемое соединение получают в форме желтого масла (выход=30%). 1(t, 1H); 7.83 (d, 1H); 8.05 (d, 2H); 8.64 (d, 1H). Пример 16. 2-1-(Фенилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пирид-2-ил]метокси]-2 метилпропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 15, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=45%). Т. пл.=122-125 С. Пример 17. 1-(Фенилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 13, начиная с метилового эфира 4-пентиновой кислоты, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=91%). Т. пл.=119 С. Пример 18. 1-(Фенилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 17, ожидаемое соединение получают в форме белого твердого вещества (выход=53%). Т. пл.=180 С. Пример 19. 1-(Фенилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 13, начиная с метилового эфира 5-гексиновой кислоты, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=88%). Т. пл.=95 С. Пример 20. 1-(Фенилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 19, ожидаемое соединение получают в форме белого твердого вещества (выход=58%). Т. пл.=168 С. Пример 21. 1-[(2-Амино-6-бензотиазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 3, начиная с соединения согласно примеру получения X, ожидаемое соединение получают в форме желтого твердого вещества (выход=63%). Т. пл.=85-90 С. Пример 22. 1-[(2-Амино-6-бензотиазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с соединения, полученного согласно примеру 21, ожидаемый продукт получают в форме белого твердого вещества (выход=82%). Т. пл.250 С. Пример 23. 1-(1,3-Бензодиоксол-5-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 3, начиная с соединения согласно примеру получения IX, ожидаемое соединение получают в форме желтого твердого вещества (выход=74%). Т. пл.=120 С. Пример 24. 1-(1,3-Бензодиоксол-5-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с соединения, полученного согласно примеру 23, ожидаемый продукт получают в форме твердого вещества бежевого цвета (выход=95%). Т. пл.=160 С. Пример 25. 5-Хлор-1-[(3,5-диметилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 3, начиная с соединения согласно примеру получения XI, ожидаемое соединение получают в форме коричневого твердого вещества (выход=99%). Т. пл.=138 С. Пример 26.- 13014185 5-Хлор-1-[(3,5-диметилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с соединения, полученного согласно примеру 25, ожидаемый продукт получают в форме твердого вещества бежевого цвета (выход=88%). Т. пл.=200 С. Пример 27. 5-Хлор-1-[(2,5-диметоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 3, начиная с соединения согласно примеру получения XII, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=94%). Т. пл.=102 С. Пример 28. 5-Хлор-1-[(2,5-диметоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с соединения, полученного согласно примеру 27, ожидаемый продукт получают в форме белого твердого вещества (выход=95%). Т. пл.=227-231 С. Пример 29. 5-Хлор-1-(1-нафталинилсульфонил)-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 3, начиная с соединения согласно примеру получения XIII, ожидаемое соединение получают в форме желтого масла (выход=86%). 1H ЯМР (300 МГц, ДМСО-d6) : 1.83 (quint, 2H); 2.34 (t, 2H); 2.88 (t, 2H); 3.52 (s, 3 Н); 6.83 (s, 1H); 7.39 (d, 1H); 7.71 (m, 4 Н); 8.14 (m, 1H); 8.30 (m, 1H); 8.37 (m, 2 Н). Пример 30. 5-Хлор-1-(1-нафталинилсульфонил)-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с соединения, полученного согласно примеру 29, ожидаемый продукт получают в форме белого твердого вещества (выход=96%). Т. пл.=202-206 С. Пример 31. 5-Хлор-1-[(3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-ил)сульфонил]-1 Н-пирроло[3,2-b]пиридин-2 бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 3, начиная с соединения согласно примеру получения XIV, ожидаемое соединение получают в форме белого твердого вещества (выход=78%). Т. пл.=106-110 С. Пример 32. 5-Хлор-1-[(3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-ил)сульфонил]-1 Н-пирроло[3,2-b]пиридин-2 бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с соединения, полученного согласно примеру 31, ожидаемый продукт получают в форме белого твердого вещества (выход=98%). Т. пл.=180-183 С. Пример 33. 1-(1,3-Бензодиоксол-5-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 3, начиная с соединения согласно примеру получения XV, ожидаемое соединение получают в форме желтого масла (выход=76%). 1(s, 1H); 7.09 (d, 1H); 7.37 (d, 1H); 7.38 (s, 1H); 7.51 (dd, 1H); 8.40 (s,1H). Пример 34. 1-(1,3-Бензодиоксол-5-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с соединения, полученного согласно примеру 33, ожидаемый продукт получают в форме коричневого твердого вещества (выход=98%). Т. пл.=186 С. Пример 35. 1-(6-Бензотиазолилсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 3, начиная с соединения согласно примеру получения XVI, ожидаемое соединение получают в форме белого твердого вещества (выход=57%). Т. пл.=146 С. Пример 36. 1-(6-Бензотиазолилсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с соединения, полученного согласно примеру 35, ожидаемый продукт получают в форме белого твердого вещества (выход=90%).- 14014185 Т. пл.=248 С. Пример 37. 5-Хлор-1-(фенилсульфонил)-1H-пирроло[3,2-b]пиридин-2-пропановая кислота, натриевая соль. 1,46 г (4 мМ) кислоты, полученной согласно примеру 2, смешивают в 12 мл тетрагидрофурана и добавляют 8 мл (4 мМ) 0,5 н. раствора гидроксида натрия в воде. Эту реакционную смесь перемешивают в течение 2 ч при комнатной температуре, а затем концентрируют при пониженном давлении. Масляный остаток растирают с метанолом и образовавшийся белый осадок отделяют фильтрованием и высушивают в вакууме. Ожидаемую соль получают в форме пылевидного белого твердого вещества (выход=98%). Т. пл.=200 С. Пример 38. 2-1-(2,1,3-Бензотиадиазол-5-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пирид-2 ил]метокси]пропановой кислоты этиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с эфира согласно примеру получения XVII и 2,1,3-бензотиадиазол-5-сульфонилхлорида, ожидаемое соединение получают в форме твердого вещества оранжевого цвета (выход=46%). Т. пл.=77-79 С. Пример 39. 2-1-(2,1,3-Бензотиадиазол-5-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пирид-2 ил]метокси]пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 38, ожидаемое соединение получают в форме белого твердого вещества (выход=16%). Т. пл.=192-194 С. Пример 40. 2-5-Хлор-1-[(2-метил-7-бензотиазолил)сульфонил]-1H-пирроло[3,2-b]пирид-2 ил]метокси]пропановой кислоты этиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с эфира согласно примеру получения XVII и 2-метил-7-бензотиазолсульфонилхлорида, ожидаемое соединение получают в форме бесцветного масла (выход=50%). 1(s, 1H); 5.02 (d, 1H); 4.88 (d, 1H); 4.13 (q, 1H); 4.07 (q, 2H); 2.85 (s, 3H); 1.15 (m, 6 Н). Пример 41. 2-5-Хлор-1-[(2-метил-7-бензотиазолил)сульфонил]-1H-пирроло[3,2-b]пирид-2 ил]метокси]пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 40, ожидаемое соединение получают в форме белого твердого вещества (выход=28%). Т. пл.=203-205 С. Пример 42. 2-5-Хлор-1-[(3-метоксифенил)сульфонил]-1H-пирроло[3,2-b]пирид-2-ил]метокси]-2 метилпропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 1, начиная с соединения согласно примеру получения XVIII и метилового эфира 2-метил-2-(2-пропинилокси)пропановой кислоты, ожидаемое соединение получают в форме белого твердого вещества (выход=33%). Т. пл.=153 С. Пример 43. 2-5-Хлор-1-[(3-метоксифенил)сульфонил]-1H-пирроло[3,2-b]пирид-2-ил]метокси]-2 метилпропановая кислота. Готовят раствор 186 мг (0,41 мМ) эфира, полученного согласно примеру 42, в 7,5 мл уксусной кислоты и добавляют 0,75 мл концентрированной соляной кислоты при перемешивании и при комнатной температуре. Эту реакционную смесь поддерживают при слабом кипении с обратным холодильником в течение 18 ч, а затем концентрируют при пониженном давлении. Остаток после выпаривания растворяют в воде и экстрагируют дихлорметаном. Органическую фазу промывают водой, высушивают над сульфатом магния и концентрируют при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле, элюируя смесью дихлорметан/метанол (градиент от 99/1 до 90/10, об./об.). Ожидаемую кислоту, таким образом, получают в форме твердого вещества бежевого цвета (выход=70%). Т. пл.=130 С. Пример 44. 2-1-[(2-Ацетиламино-6-бензотиазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пирид-2 ил]метокси]пропановой кислоты этиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с эфира согласно примеру получения XVII и 2-ацетиламино-6-бензотиазолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=25%). Т. пл.=100-102 С.- 15014185 Пример 45. 2-1-[(2-Ацетиламино-6-бензотиазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пирид-2 ил]метокси]пропановая кислота. Путем обработки способом, подобным примеру 43, начиная с эфира, полученного согласно примеру 44, ожидаемое соединение получают в форме белого твердого вещества (выход=25%). Т. пл.=257-260 С. Пример 46. 2-1-[(2-Амино-6-бензотиазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пирид-2 ил]метокси]пропановой кислоты этиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с эфира согласно примеру получения XVII и 2-амино-6-бензотиазолсульфонилхлорида, ожидаемое соединение получают в форме желтого твердого вещества (выход=25%). Т. пл.=86-88 С. Пример 47. 2-1-[(2-Амино-6-бензотиазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пирид-2 ил]метокси]пропановая кислота. Путем обработки способом, подобным примеру 43, начиная с эфира, полученного согласно примеру 46, ожидаемое соединение получают в форме белого твердого вещества (выход=65%). Т. пл.=218-220 С. Пример 48. 2-1-(6-Бензотиазолилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пирид-2-ил]метокси]-2 метилпропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения XIX и 6-бензотиазолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=13%). Т. пл.=124-127 С. Пример 49. 2-1-(6-Бензотиазолилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пирид-2-ил]метокси]-2 метилпропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 48, ожидаемое соединение получают в форме белого твердого вещества (выход=16%). Т. пл.=180-182 С. Пример 50. 2-1-(6-Бензотиазолилсульфонил)-5-хлор-1H-пирроло[3,2-b]пирид-2-ил]метокси]пропановой кислоты этиловый эфир. Готовят раствор 350 мг (1,24 мМ) эфира согласно примеру получения XVII в 8 мл пиридина и добавляют 550 мг (2,35 мМ) 6-бензотиазолсульфонилхлорида при перемешивании и при 0 С. Эту реакционную смесь перемешивают при комнатной температуре в течение 24 ч, а затем разбавляют этилацетатом. Эту органическую фазу промывают 2 н. раствором соляной кислоты, а затем водой, высушивают над сульфатом магния и концентрируют при пониженном давлении. Полученное масло растворяют в 10 мл ТГФ, и к этому раствору, охлажденному до 0 С, постепенно добавляют 2,6 мл (2,6 мМ) тетрабутиламмония фторида в виде 1 М раствора в ТГФ. Реакционную смесь перемешивают в течение 24 ч при 4 С, а затем разбавляют в ДХМ. Полученную органическую фазу промывают нормальным раствором соляной кислоты, а затем водой, высушивают над сульфатом магния и концентрируют при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле, элюируя смесью толуол/этилацетат(95/5, а затем 9/1; об./об.). Ожидаемый продукт, таким образом, получают в форме желтого масла (выход=31%). 1H ЯМР (250 МГц, ДМСО-d6) : 9.68 (s, 1H); 9.11 (d, 1H); 8.50 (d, 1H); 8.23 (d, 1H); 8.10 (dd, 1H); 7.43 (d, 1H); 6.96 (s, 1H); 5.08 (d, 1H); 4.96 (d, 1H); 4.25 (q, 1H); 4.12 (q,2H); 1.28 (d, 3 Н); 1.19 (t, 3 Н). Пример 51. 2-1-(6-Бензотиазолилсульфонил)-5-хлор-1H-пирроло[3,2-b]пирид-2-ил]метокси]пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 50, ожидаемое соединение получают в форме белого твердого вещества (выход=40%). Т. пл.=179 С. Пример 52. 2-1-(6-Бензотиазолилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пирид-2 ил]метокси]пропановой кислоты этиловый эфир. Готовят раствор 140 мг (0,443 мМ) соединения согласно примеру получения XX в 2 мл пиридина и добавляют 228 мг (0,98 мМ) 6-бензотиазолсульфонилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 48 ч, а затем разбавляют этилацетатом. Полученную органическую фазу последовательно промывают водой, нормальной соляной кислотой, снова водой, раствором бикар- 16014185 боната натрия и, наконец, раствором хлорида натрия. После высушивания над сульфатом магния и концентрирования получают 242 мг этилового эфира 2-3-[3-(6-бензотиазолилсульфониламино)-6(трифторметил)-2-пиридил]-2-пропинил]окси]пропановой кислоты, и этот продукт растворяют в 5 мл ДХМ в пробирке для реактора, приспособленного для микроволнового нагревания. Добавляют 100 мг(0,5 мМ) моногидрата ацетата меди, и эту смесь нагревают при 150 С в течение 15 мин. Реакционную смесь охлаждают, фильтруют и концентрируют при пониженном давлении. После очистки хроматографией на колонке силикагеля, элюируя смесью толуол/этилацетат (9/1; об./об.), ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=42%). Т. пл.=96 С. Пример 53. 2-1-(6-Бензотиазолилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пирид-2 ил]метокси]пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 52, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=50%). Т. пл.=124 С. Пример 54. 5-Хлор-1-[(2,5-диметоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения VIII и 2,5-диметоксибензолсульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=77%). Т. пл.=127 С. Пример 55. 5-Хлор-1-[(2,5-диметоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 54, ожидаемое соединение получают в форме белого твердого вещества (выход=71%). Т. пл.=204-209 С. Пример 56. 1-[(2-Амино-6-бензотиазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с эфира согласно примеру полученияVIII и 2-амино-6-бензотиазолсульфонилхлорида, ожидаемое соединение получают в форме желтого твердого вещества (выход=38%). Т. пл.=205-215 С. Пример 57. 1-[(2-Амино-6-бензотиазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 56, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=57%). Т. пл.260 С. Пример 58. 5-Хлор-1-[(3,5-диметилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения VIII и 3,5-диметилбензолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=86%). Т. пл.=182-185 С. Пример 59. 5-Хлор-1-[(3,5-диметилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 58, ожидаемое соединение получают в форме белого твердого вещества (выход=99%). Т. пл.=181-186 С. Пример 60. 5-Хлор-1-[(3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-ил)сульфонил]-1H-пирроло[3,2-b]пиридин-2 пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения VIII и 3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-сульфонилхлорида, ожидаемое соединение получают в форме желтого масла (выход=87%). 1- 17014185 Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 60, ожидаемое соединение получают в форме белого твердого вещества (выход=98%). Т. пл.=175-185 С. Пример 62. 5-Хлор-1-(8-хинолилсульфонил)-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения VIII и 8-хинолинсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=59%). Т. пл.=120 С. Пример 63. 5-Хлор-1-(8-хинолилсульфонил)-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 62, ожидаемое соединение получают в форме белого твердого вещества (выход=98%). Т. пл.=183 С. Пример 64. 5-Хлор-1-(1-нафталинилсульфонил)-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения VIII и 1-нафталинсульфонилхлорида, ожидаемое соединение получают в форме желтого маслаH ЯМР (250 МГц, ДМСО-d6) : 8.34 (m, 3 Н); 8.15 (m, 1H); 7.69 (m, 4 Н); 7.39 (d, 1H); 6.81 (s, 1H); 3.56 (s, 3H); 3.12 (t, 2 Н); 2.74 (t, 2H). Пример 65. 5-Хлор-1-(1-нафталинилсульфонил)-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 64, ожидаемое соединение получают в форме белого твердого вещества (выход=86%). Т. пл.=93 С. Пример 66. 1-[(1-Ацетил-2,3-дигидро-1H-индол-5-ил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2 пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения VIII и 1-ацетил-2,3-дигидро-1H-индол-5-сульфонилхлорида, ожидаемое соединение получают в форме коричневого твердого вещества (выход=93%). Т. пл.=66 С. Пример 67. 1-[(1-Ацетил-2,3-дигидро-1H-индол-5-ил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2 пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 66, ожидаемое соединение получают в форме желтого твердого вещества (выход=37%). Т. пл.=216 С. Пример 68. 5-Хлор-1-[3-(трифторметокси)фенилсульфонил]-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения VIII и 3-(трифторметокси)бензолсульфонилхлорида, ожидаемое соединение получают в форме твердого вещества оранжевого цвета (выход=71%). Т. пл.=102 С. Пример 69. 5-Хлор-1-[3-(трифторметокси)фенилсульфонил]-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 68, ожидаемое соединение получают в форме желтого твердого вещества (выход=9%). Т. пл.=146 С. Пример 70. 1-[(3,5-Диметилфенил)сульфонил]-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения XXI и 3,5-диметилбензолсульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=51%). 1- 18014185 Пример 71. 1-[(3,5-Диметилфенил)сульфонил]-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 70, ожидаемое соединение получают в форме белого твердого вещества (выход=91%). Т. пл.=185-189 С. Пример 72. 1-(8-Хинолилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения XXI и 8-хинолинсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=51%). 1H ЯМР (300 МГц, ДМСО-d6) : 8.72 (m, 2H); 8.45 (m, 3H); 7.88 (t, 1H); 7.72 (d, 1H); 7.62 (dd, 1H); 6.76 (s, 1H); 3.60 (s, 3H); 3.54 (t, 2H); 2.88 (t, 2H). Пример 73. 1-(8-Хинолилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 72, ожидаемое соединение получают в форме белого твердого вещества (выход=56%). Т. пл.=216-217 С. Пример 74. 1-(1-Нафталинилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-пропановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения XXI и 1-нафталинсульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=63%). 1H ЯМР (250 МГц, ДМСО-d6) : 8.56 (d, 1H); 8.36 (m, 2 Н); 8.17 (m, 1H); 7.72 (m, 5 Н); 6.98 (s, 1H); 3.56 (s, 3H); 3.15 (t, 2H); 2.77 (t, 2H). Пример 75. 1-(1-Нафталинилсульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-пропановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 74, ожидаемое соединение получают в форме белого твердого вещества (выход=42%). Т. пл.=116-117 С. Пример 76. 5-Хлор-1-(8-хинолилсульфонил)-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 52, начиная с соединения согласно примеру получения V и 8-хинолинсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=25%). Т. пл.=64 С. Пример 77. 5-Хлор-1-(8-хинолилсульфонил)-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 76, ожидаемое соединение получают в форме белого твердого вещества (выход=99%). Т. пл.=186-189 С. Пример 78. 5-Хлор-1-[(2,2-дифтор-1,3-бензодиоксол-5-ил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2,2-дифтор-1,3-бензодиоксол-5 сульфонилхлорида, ожидаемое соединение получают в форме бесцветного масла (выход=95%). 1H ЯМР (250 МГц, ДМСО-d6) : 8.43 (d, 1H); 8.09 (d, 1H); 7.83 (dd, 1H); 7.60 (d, 1H); 7.38 (d, 1H); 6.77 (s, 1H); 3.59 (s, 3H); 3.07 (t, 2H); 2.45 (t, 2H); 1.97 (m, 2H). Пример 79. 5-Хлор-1-[(2,2-дифтор-1,3-бензодиоксол-5-ил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 78, ожидаемое соединение получают в форме белого твердого вещества (выход=78%). Т. пл.=216 С. Пример 80. 5-Хлор-1-[(2-метил-5-бензотиазолил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом,подобным примеру 76,начиная с 2-метил-5 бензотиазолсульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого- 19014185 цвета (выход=79%). Т. пл.=114 С. Пример 81. 5-Хлор-1-[(2-метил-5-бензотиазолил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 80, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=98%). Т. пл.=173 С. Пример 82. 5-Хлор-1-[(2-метил-6-бензотиазолил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом,подобным примеру 76,начиная с 2-метил-6 бензотиазолсульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=69%). Т. пл.=117 С. Пример 83. 5-Хлор-1-[(2-метил-6-бензотиазолил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 82, ожидаемое соединение получают в форме желтого твердого вещества (выход=99%). Т. пл.=184 С. Пример 84. 5-Хлор-1-[(2-метил-7-бензотиазолил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 2-метил-7-бензотиазолсульфонилхлорида, ожидаемое соединение получают в форме желтого твердого вещества (выход=48%). Т. пл.=138 С. Пример 85. 5-Хлор-1-[(2-метил-7-бензотиазолил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 84, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=90%). Т. пл.=225 С. Пример 86. 5-Хлор-1-[(2,3-дигидро-5-бензофурил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом,подобным примеру 76,начиная с 2,3-дигидро-5 бензофурансульфонилхлорида, ожидаемое соединение получают в форме желтого твердого вещества(выход=82%). Т. пл.=201 С. Пример 87. 5-Хлор-1-[(2,3-дигидро-5-бензофурил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 86, ожидаемое соединение получают в форме белого твердого вещества (выход=98%). Т. пл.=225 С. Пример 88. 5-Хлор-1-[(3,5-дихлорфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3,5-дихлорбензолсульфонилхлорида,ожидаемое соединение получают в форме белого твердого вещества (выход=66%). Т. пл.=112-114 С. Пример 89. 5-Хлор-1-[(3,5-дихлорфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 88, ожидаемое соединение получают в форме белого твердого вещества (выход=28%). Т. пл.=164-165 С. Пример 90. 1-[(2-Ацетиламино-6-бензотиазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2-ацетиламино-6 бензотиазолсульфонилхлорида, ожидаемое соединение получают в форме желтого твердого вещества- 20014185 1-[(2-Ацетиламино-6-бензотиазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 90, ожидаемое соединение получают в форме белого твердого вещества (выход=87%). Т. пл.=270 С. Пример 92. 1-[(2-Амино-6-бензоксазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. начиная с 2-амино-6 Путем обработки способом,подобным примеру 76,бензоксазолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=35%). Т. пл.=241 С. Пример 93. 1-[(2-Амино-6-бензоксазолил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 92, ожидаемое соединение получают в форме белого твердого вещества (выход=96%). Т. пл.=273 С. Пример 94. 5-Хлор-1-[(2-фторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2-фторбензолсульфонилхлорида,ожидаемое соединение получают в форме коричневого твердого вещества (выход=87%). Т. пл.=83 С. Пример 95. 5-Хлор-1-[(2-фторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 94, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=92%). Т. пл.=176 С. Пример 96. 5-Хлор-1-2-(трифторметил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 2-(трифторметил)бензолсульфонилхлорида, ожидаемое соединение получают в форме желтого твердого вещества (выход=39%). Т. пл.=127 С. Пример 97. 5-Хлор-1-2-(трифторметил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 96, ожидаемое соединение получают в форме желтого твердого вещества (выход=89%). Т. пл.=171 С. Пример 98. 1-([1,1'-Дифенил]-3-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и [1,1'-дифенил]-3-сульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=68%). 1H ЯМР (300 МГц, ДМСО-d6) : 8.49 (d, 1H); 8.03 (m, 2 Н); 7.78 (d, 1H); 7.66 (m, 3 Н); 7.47 (m, 3 Н); 7.39 (d, 1H); 6.79 (s, 1H); 3.55 (s, 3H); 3.11 (t, 2H); 2.44 (t, 2H); 2.01 (m, 2 Н). Пример 99. 1-([1,1'-Дифенил]-3-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 98, ожидаемое соединение получают в форме белого твердого вещества (выход=23%). Т. пл.=147-149 С. Пример 100. 5-Хлор-1-[(4-фторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 4-фторбензолсульфонилхлорида, ожидаемое соединение получают в форме желтого твердого вещества (выход=29%). Т. пл.=119 С. Пример 101. 5-Хлор-1-[(4-фторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота.- 21014185 Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 100, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=66%). Т. пл.=180 С. Пример 102. 5-Хлор-1-[(3-фторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3-фторбензолсульфонилхлорида,ожидаемое соединение получают в форме коричневого твердого вещества (выход=76%). Т. пл.=104 С. Пример 103. 5-Хлор-1-[(3-фторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 102, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=75%). Т. пл.=163 С. Пример 104. 1-[(1-Ацетил-2,3-дигидро-1H-индол-5-ил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2 бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 1-ацетил-2,3-дигидро-1H-индол-5 сульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=91%). Т. пл.=123 С. Пример 105. 1-[(1-Ацетил-2,3-дигидро-1H-индол-5-ил)сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2 бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 104, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=54%). Т. пл.=226 С. Пример 106. 5-Хлор-1-[(6-хлоримидазо[2,1-b]тиазол-5-ил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 6-хлоримидазо[2,1-b]тиазол-5 сульфонилхлорида, ожидаемое соединение получают в форме бесцветного масла (выход=70%). 1(s, 3 Н); 3.07 (t, 2 Н); 2.44 (t, 2 Н); 1.97 (m, 2 Н). Пример 107. 5-Хлор-1-[(6-хлоримидазо[2,1-b]тиазол-5-ил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 106, ожидаемое соединение получают в форме белого твердого вещества (выход=99%). Т. пл.=186 С. Пример 108. 5-Хлор-1-4-(1H-пиразол-1-ил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 4-(1H-пиразол-1-ил)бензолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=10%). Т. пл.=122-124 С. Пример 109. 5-Хлор-1-4-(1H-пиразол-1-ил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 108, ожидаемое соединение получают в форме белого твердого вещества (выход=58%). Т. пл.=196-207 С. Пример 110. 5-Хлор-1-3-(трифторметил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 3-(трифторметил)бензолсульфонилхлорида, ожидаемое соединение получают в форме желтого твердого вещества (выход=11%). Т. пл.=97 С. Пример 111. 5-Хлор-1-3-(трифторметил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру- 22014185 110, ожидаемое соединение получают в форме желтого твердого вещества (выход=41%). Т. пл.=188 С. Пример 112. 5-Хлор-1-4-(трифторметил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 4-(трифторметил)бензолсульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=27%). Т. пл.=99 С. Пример 113. 5-Хлор-1-4-(трифторметил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 112, ожидаемое соединение получают в форме белого твердого вещества (выход=27%). Т. пл.=185 С. Пример 114. 5-Хлор-1-4-(5-оксазолил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом,подобным примеру 76,начиная с 4-(5 оксазолил)бензолсульфонилхлорида, ожидаемое соединение получают в форме бесцветного масла (выход=50%). 1(s, 3 Н); 3.07 (t, 2 Н); 2.44 (t, 2 Н); 1.97 (m, 2 Н). Пример 115. 5-Хлор-1-4-(5-оксазолил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 114, ожидаемое соединение получают в форме белого твердого вещества (выход=27%). Т. пл.=169-176 С. Пример 116. 1-3,5-бис-(Трифторметил)фенил]сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3,5-бис-(трифторметил)бензолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества(выход=62%). Т. пл.=134-144 С. Пример 117. 1-3,5-бис-(Трифторметил)фенил]сульфонил]-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 116, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=6%). Т. пл.=155-164 С. Пример 118. 5-Хлор-1-[(4-хлор-3-метилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 4-хлор-3-метилбензолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=78%). Т. пл.=111-114 С. Пример 119. 5-Хлор-1-[(4-хлор-3-метилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 118, ожидаемое соединение получают в форме белого твердого вещества (выход=42%). Т. пл.=175-183 С. Пример 120. 1-([1,1'-Дифенил]-4-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с [1,1'-дифенил]-4-сульфонилхлорида,ожидаемое соединение получают в форме белого твердого вещества (выход=85%). Т. пл.=122-124 С. Пример 121. 1-([1,1'-Дифенил]-4-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 120, ожидаемое соединение получают в форме белого твердого вещества (выход=55%). Т. пл.=186-190 С.- 23014185 Пример 122. 5-Хлор-1-[(3,4-дифторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3,4-дифторбензолсульфонилхлорида,ожидаемое соединение получают в форме белого твердого вещества (выход=61%). Т. пл.=96-98 С. Пример 123. 5-Хлор-1-[(3,4-дифторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 122, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=59%). Т. пл.=180-190 С. Пример 124. 5-Хлор-1-[3-(трифторметокси)фенилсульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3-(трифторметокси)бензолсульфонилхлорида, ожидаемое соединение получают в форме коричневого масла (выход=84%). 1H ЯМР (300 МГц, ДМСО-d6) : 8.44 (d, 1H); 7.89 (m, 2 Н); 7.77 (m, 2 Н); 7.39 (d, 1H); 6.80 (s, 1H); 3.58 (s, 3H); 3.06 (t, 2H); 2.44 (t, 2H); 1.96 (quint, 2H). Пример 125. 5-Хлор-1-[3-(трифторметокси)фенилсульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 124, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=37%). Т. пл.=176 С. Пример 126. 1-(1,2,3-Бензотиадиазол-5-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 1,2,3-бензотиадиазол-5-сульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=9%). Т. пл.=219 С. Пример 127. 1-(1,2,3-Бензотиадиазол-5-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 126, ожидаемое соединение получают в форме белого твердого вещества (выход=58%). Т. пл.=227 С. Пример 128. 5-Хлор-1-[4-(трифторметокси)фенилсульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 4-(трифторметокси)бензолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=52%). Т. пл.=109 С. Пример 129. 5-Хлор-1-[4-(трифторметокси)фенилсульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 128, ожидаемое соединение получают в форме белого твердого вещества (выход=88%). Т. пл.=168 С. Пример 130. 5-Хлор-1-[(3-хлорфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3-хлорбензолсульфонилхлорида,ожидаемое соединение получают в форме белого твердого вещества (выход=14%). Т. пл.=107 С. Пример 131. 5-Хлор-1-[(3-хлорфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 130, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=83%). Т. пл.=174 С. Пример 132. 5-Хлор-1-[(4-хлорфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 4-хлорбензолсульфонилхлорида,- 24014185 ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=35%). Т. пл.=108 С. Пример 133. 5-Хлор-1-[(4-хлорфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 132, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=81%). Т. пл.=174 С. Пример 134. 5-Хлор-1-[(3-метоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3-метоксибензолсульфонилхлорида,ожидаемое соединение получают в форме желтого твердого вещества (выход=45%). Т. пл.=90 С. Пример 135. 5-Хлор-1-[(3-метоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 134, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=94%). Т. пл.=139 С. Пример 136. 5-Хлор-1-[(4-метоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 4-метоксибензолсульфонилхлорида,ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=66%). Т. пл.=96 С. Пример 137. 5-Хлор-1-[(4-метоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 136, ожидаемое соединение получают в форме белого твердого вещества (выход=78%). Т. пл.=189 С. Пример 138. 5-Хлор-1-[(4-метилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 4-метилбензолсульфонилхлорида,ожидаемое соединение получают в форме серого твердого вещества (выход=37%). Т. пл.=106 С. Пример 139. 5-Хлор-1-[(4-метилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 138, ожидаемое соединение получают в форме белого твердого вещества (выход=87%). Т. пл.=172 С. Пример 140. 5-Хлор-1-4-(1-метилэтил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 4-(1-метилэтил)бензолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=51%). Т. пл.=75 С. Пример 141. 5-Хлор-1-4-(1-метилэтил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 140, ожидаемое соединение получают в форме белого твердого вещества (выход=88%). Т. пл.=155 С. Пример 142. 5-Хлор-1-3-(2-метил-4-пиримидинил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3-(2-метил-4-пиримидинил)бензолсульфонилхлорида, ожидаемое соединение получают в форме желтого твердого вещества (выход=78%). Т. пл.=140-144 С. Пример 143. 5-Хлор-1-3-(2-метил-4-пиримидинил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 142, ожидаемое соединение получают в форме белого твердого вещества (выход=38%).- 25014185 Т. пл.=178-188 С. Пример 144. 1-(1,2-Бензизоксазол-5-илсульфонил)-5-хлор-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 1,2-бензизоксазол-5-сульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=7%). 1H ЯМР (250 МГц, ДМСО-d6) : 8.42 (d, 1H); 8.32 (d, 1H); 7.98 (dd, 1H); 7.36 (d, 1H); 7.10 (d, 1H); 6.75 (s, 1H); 3.58 (s, 3H); 3.05 (t, 2H); 2.45 (t, 2H); 1.95 (quint, 2H). Пример 145. 1-(1,2-Бензизоксазол-5-илсульфонил)-5-хлор-1 Н-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 144, ожидаемое соединение получают в форме желтого твердого вещества (выход=33%). Т. пл.=226 С. Пример 146. 5-Хлор-1-[2-(трифторметокси)фенилсульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 2-(трифторметокси)бензолсульфонилхлорида, ожидаемое соединение получают в форме пастообразного белого твердого вещества. Пример 147. 5-Хлор-1-[2-(трифторметокси)фенилсульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 146, ожидаемое соединение получают в форме белого твердого вещества (выход=50%). Т. пл.=138 С. Пример 148. 5-Хлор-1-[(3,5-дифторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3,5-дифторбензолсульфонилхлорида,ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=83%). Т. пл.=90 С. Пример 149. 5-Хлор-1-[(3,4-дифторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 148, ожидаемое соединение получают в форме серого твердого вещества (выход=24%). 1H ЯМР (300 МГц, ДМСО-d6) : 12.11 (s, 1H); 8.44 (d, 1H); 7.75 (m, 3H); 7.38 (d, 1H); 6.80 (s, 1H); 3.08 (t, 2 Н); 2.37 (m, 2 Н); 1.94 (m, 2 Н). Пример 150. 5-Хлор-1-[(2,5-дихлорфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2,5-дихлорбензолсульфонилхлорида,ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=65%). Т. пл.=95-105 С. Пример 151. 5-Хлор-1-[(2,5-дихлорфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 150, ожидаемое соединение получают в форме серого твердого вещества (выход=43%). Т. пл.=86-89 С. Пример 152. 5-Хлор-1-[(2-хлорфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2-хлорбензолсульфонилхлорида, получают ожидаемое соединение, которое подвергают взаимодействию непосредственно с получением кислоты. Пример 153. 5-Хлор-1-[(2-хлорфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 152, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=48%). Т. пл.=139 С. Пример 154. 5-Хлор-1-[(2-метилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый- 26014185 эфир. Путем обработки способом, подобным примеру 76, начиная с 2-метилбензолсульфонилхлорида, получают ожидаемое соединение, которое подвергают взаимодействию непосредственно с получением соответствующей кислоты. Пример 155. 5-Хлор-1-[(2-метилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 154, ожидаемое соединение получают в форме белого твердого вещества (выход=66%). Т. пл.=161 С. Пример 156. 5-Хлор-1-[(3-метилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3-метилбензолсульфонилхлорида, получают ожидаемое соединение, которое подвергают взаимодействию непосредственно с получением соответствующей кислоты. Пример 157. 5-Хлор-1-[(3-метилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 156, ожидаемое соединение получают в форме белого твердого вещества (выход=38%). Т. пл.=165 С. Пример 158. 5-Хлор-1-[(2,6-дифторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2,6-дифторбензолсульфонилхлорида,ожидаемое соединение получают в форме белого твердого вещества (выход=76%). Т. пл.=107-109 С. Пример 159. 5-Хлор-1-[(2,6-дифторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 158, ожидаемое соединение получают в форме белого твердого вещества (выход=38%). Т. пл.=192-195 С. Пример 160. 5-Хлор-1-[(2,4,6-трифторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2,4,6-трифторбензолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=71%). 1(t, 2H); 2.41 (t, 2H); 1.94 (quint, 2H). Пример 161. 5-Хлор-1-[(2,4,6-трифторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 160, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=27%). Т. пл.=135-150 С. Пример 162. 5-Хлор-1-[(2,5-диметилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2,5-диметилбензолсульфонилхлорида,ожидаемое соединение получают в форме белого твердого вещества (выход=87%). Т. пл.=92-103 С. Пример 163. 5-Хлор-1-[(2,5-диметилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 162, ожидаемое соединение получают в форме желтого твердого вещества (выход=72%). Т. пл.=106-117 С. Пример 164. 5-Хлор-1-[(3,5-диметоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3,5-диметоксибензолсульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=75%). Т. пл.=109-111 С. Пример 165.- 27014185 5-Хлор-1-[(3,5-диметоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 164, ожидаемое соединение получают в форме белого твердого вещества (выход=27%). Т. пл.=136-138 С. Пример 166. 5-Хлор-1-[4-(1-метилэтокси)фенилсульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 4-(1-метилэтокси)бензолсульфонилхлорида, ожидаемое соединение получают в форме бесцветного масла (выход=88%). 1(sept., 1H); 3.59 (s, 3H); 3.04 (t, 2H); 2.43 (t, 2H); 1.95 (quint, 2H); 1.24 (d, 6H). Пример 167. 5-Хлор-1-[4-(1-метилэтокси)фенилсульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 166, ожидаемое соединение получают в форме белого твердого вещества (выход=97%). Т. пл.=171 С. Пример 168. 5-Хлор-1-[(2-метоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 2-метоксибензолсульфонилхлорида, ожидаемое соединение получают в форме твердого вещества бежевого цвета (выход=41%). Т. пл.=115 С. Пример 169. 5-Хлор-1-[(2-метоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 168, ожидаемое соединение получают в форме белого твердого вещества (выход=89%). Т. пл.=197 С. Пример 170. 5-Хлор-1-[(2-хлор-3-метилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2-хлор-3-метилбензолсульфонилхлорида, ожидаемое соединение получают в форме зеленого масла (выход=57%). 1(s, 1H); 3.55 (s, 3H); 2.86 (t, 2H); 2.35 (m, 5H); 1.85 (quint, 2H). Пример 171. 5-Хлор-1-[(2-хлор-3-метилфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 170, ожидаемое соединение получают в форме белого твердого вещества (выход=16%). Т. пл.=171-174 С. Пример 172. 5-Хлор-1-[(2,4-дифторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2,4-дифторбензолсульфонилхлорида,ожидаемое соединение получают в форме желтого масла (выход=82%). 1H ЯМР (250 МГц, ДМСО-d6) : 8.26 (d, 1H); 8.17 (m, 1H); 7.59 (m, 1H); 7.40 (m, 2 Н); 6.81 (s, 1H); 3.57 (s, 3H); 2.94 (t, 2H); 2.40 (t, 2H); 1.89 (quint, 2H). Пример 173. 5-Хлор-1-[(2,4-дифторфенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 172, ожидаемое соединение получают в форме белого твердого вещества (выход=8%). Т. пл.=172-177 С. Пример 174. 5-Хлор-1-[(2-хлор-4-метоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2-хлор-4-метоксибензолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=75%). Т. пл.=116-118 С. Пример 175. 5-Хлор-1-[(2-хлор-4-метоксифенил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру- 28014185 174, ожидаемое соединение получают в форме белого твердого вещества (выход=78%). Т. пл.=154-156 С. Пример 176. 5-Хлор-1-4-(4-тиазолил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 4-(4-тиазолил)бензолсульфонилхлорида, ожидаемое соединение получают в форме белой пасты (выход=78%). 1(s, 1H); 3.58 (s, 3H); 3.09 (t, 2H); 2.45 (t, 2H); 1.98 (quint, 2H). Пример 177. 5-Хлор-1-4-(4-тиазолил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 176, ожидаемое соединение получают в форме белого твердого вещества (выход=62%). Т. пл.=211-217 С. Пример 178. 5-Хлор-1-4-(1,1-диметилэтил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 4-(1,1-диметилэтил)бензолсульфонилхлорида, ожидаемое соединение получают в форме белого твердого вещества (выход=98%). Т. пл.=107 С. Пример 179. 5-Хлор-1-4-(1,1-диметилэтил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 178, ожидаемое соединение получают в форме белого твердого вещества (выход=89%). Т. пл.=168 С. Пример 180. 5-Хлор-1-[(2,3-дигидро-1,4-бензодиоксин-6-ил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру получения VI, начиная с соединения согласно примеру получения V и 2,3-дигидро-1,4-бензодиоксин-6-сульфонилхлорида, ожидаемое соединение получают в форме коричневого масла (выход=23%). 1H ЯМР (300 МГц, ДМСО-d6) : 8.41 (d, 1H); 7.35 (m, 3H); 7.03 (d, 1H); 6.74 (s, 1H); 4.28 (m, 4 Н); 3.59 (s, 3H); 3.05 (t, 2H); 2.44 (t, 2H); 1.94 (quint, 2H). Пример 181. 5-Хлор-1-[(2,3-дигидро-1,4-бензодиоксин-6-ил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 180, ожидаемое соединение получают в форме белого твердого вещества (выход=95%). Т. пл.=166 С. Пример 182. 5-Хлор-1-[(2-пиридил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 2-пиридинсульфонилхлорида, ожидаемое соединение получают в форме бесцветного масла (выход=50%). 1H ЯМР (250 МГц, ДМСО-d6) : 8.61 (d, 1H); 8.24 (m, 3 Н); 7.74 (m, 1H); 7.34 (d, 1H); 6.77 (s, 1H); 3.58 (s, 3 Н); 3.08 (t, 2H); 2.41 (t, 2H); 1.94 (quint, 2H). Пример 183. 5-Хлор-1-[(2-пиридил)сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 182, ожидаемое соединение получают в форме белого твердого вещества (выход=30%). Т. пл.=187 С. Пример 184. 5-Хлор-1-3-(1-метилэтил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановой кислоты метиловый эфир. Путем обработки способом, подобным примеру 76, начиная с 3-(1-метилэтил)бензолсульфонилхлорида, ожидаемое соединение получают в форме коричневого твердого вещества (выход=73%). Т. пл.=92 С. Пример 185. 5-Хлор-1-3-(1-метилэтил)фенил]сульфонил]-1H-пирроло[3,2-b]пиридин-2-бутановая кислота. Путем обработки способом, подобным примеру 2, начиная с эфира, полученного согласно примеру 184, ожидаемое соединение получают в форме белого твердого вещества (выход=37%).
МПК / Метки
МПК: C07D 471/04, A61K 31/437, A61P 3/06
Метки: качестве, ppar-рецепторов, производные, модуляторов, пирролопиридина, применение
Код ссылки
<a href="https://eas.patents.su/30-14185-proizvodnye-pirrolopiridina-i-ih-primenenie-v-kachestve-modulyatorov-ppar-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пирролопиридина и их применение в качестве модуляторов ppar-рецепторов</a>
Предыдущий патент: Аналоги глюкагонподобного пептида-2 (glp-2)
Следующий патент: Усовершенствования для аналоговых соединений трифосфата 6-тиогуанозина, их применение в областях медицины и способы их получения
Случайный патент: Производные плевромутилина для лечения заболеваний, опосредуемых микробами












