Производные плевромутилина для лечения заболеваний, опосредуемых микробами
Номер патента: 18707
Опубликовано: 30.10.2013
Авторы: Штрикманн Дирк, Манг Роземари, Новак Родгер, Бадегрубер Рудольф, Хайльмайер Вернер, Булюзу Атхиута Рама Хандра Мурти, Ференцик Матиас
Формула / Реферат
1. Соединение формулы (I)
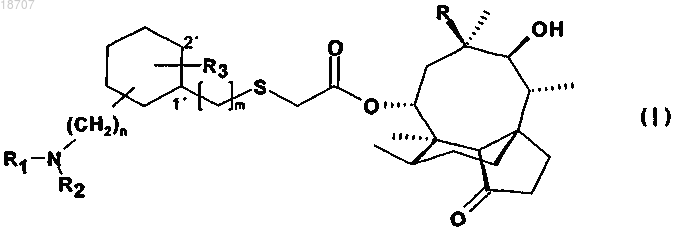
где n равно от 0 до 4;
m равно 0 или 1 при условии, что атом серы и R3 находятся в вицинальном положении (если m=0, тогда R3 находится в положении 2', а если m=1, тогда R3 находится в положении 1');
R представляет этил или винил;
R1 представляет атом водорода или (С1-6)алкил,
R2 представляет атом водорода, или (С3-6)циклоалкил, или незамещенный (С1-6)алкил, или (C1-6)алкил, замещенный одной или несколькими группами из числа таких, как
гидрокси,
метокси,
атом галогена,
(С3-6)циклоалкил, или
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере 1 атом азота или 1 атом азота и 1 дополнительный гетероатом, выбранный из N или О, или
R1 представляет гидрокси и R2 представляет формил;
R3 представляет ОН, OR4, атом галогена, или
при условии, что R3 присоединен в положении 2', R3 представляет -О-(СН2)p-О- с р, равным 2 или 3;
R4 представляет незамещенный (C1-6)алкил или (С3-6)циклоалкил,
в свободной форме или в форме соли и/или сольвата.
2. Соединение по п.1 формулы (II)
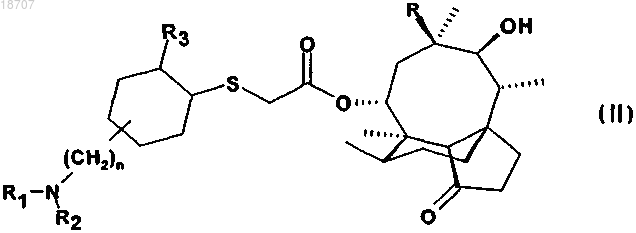
где значения n, R, R1, R2 и R3 те же, что определены в п.1,
в свободной форме или в форме соли и/или сольвата.
3. Соединение по п.1 формулы (III)

где значения n, R, R1 и R2 те же, что определены в п.1,
в свободной форме или в форме соли и/или сольвата.
4. Соединение по п.1 формулы (IV)
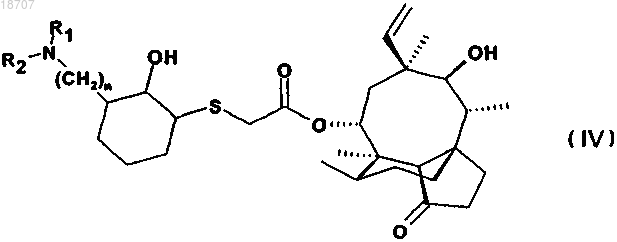
где значения n, R1 и R2 те же, что определены в п.1,
в свободной форме или в форме соли и/или сольвата.
5. Соединение по п.1 формулы (V)
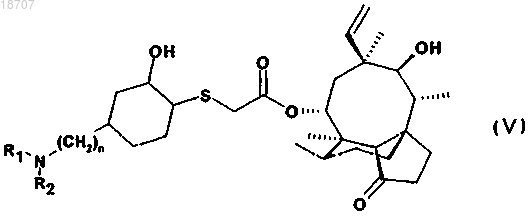
где значения n, R1 и R2 те же, что определены в п.1,
в свободной форме или в форме соли и/или сольвата.
6. Соединение по п.1 формулы (VI)
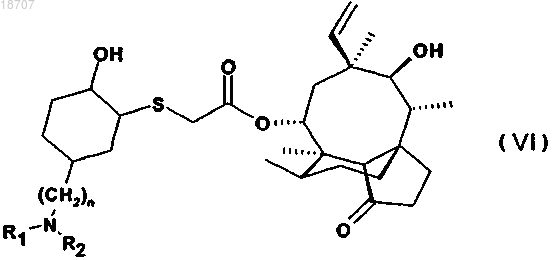
где значения n, R1 и R2 те же, что определены в п.1,
в свободной форме или в форме соли и/или сольвата.
7. Соединение по одному из пп.1-4, выбранное из группы, включающей
14-O-{[(1R,2R,4R)-4-амино-2-гидроксициклогексилсульфанил]ацетил}мутилин;
14-O-{[(1S,2S,4S)-4-амино-2-гидроксициклогексилсульфанил]ацетил}мутилин;
14-O-{[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетил}мутилин;
14-O-{[(1S,2S,5R)-5-амино-2-гидроксициклогексилсульфанил]ацетил}мутилин;
14-O-{[(1R,2R,4S)-4-амино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,4R) диастереомер;
14-O-{[(1R,2R,5R)-5-амино-2-гидроксициклогексилсульфанил]ацетил}мутилин;
14-O-{[(1S,2S,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетил}мутилин;
14-O-{[(1R,2R,3R)-3-амино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,3S) диастереомер;
14-O-{[(1R,2R,4R)-4-диэтиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,4S) диастереомер;
14-O-{[(1R,2R,4R)-4-этиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,4S) диастереомер;
14-O-{[(1R,2R,5S)-5-этиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,5R) диастереомер;
14-O-{[(1R,2R,5S)-5-диэтиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,5R) диастереомер;
14-O-{[(1R,2R,4S)-4-диэтиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,4R) диастереомер;
14-O-{[(1R,2R,5R)-5-диэтиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,5S) диастереомер;
14-O-{[(1R,2R,3R)-3-этиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,3S) диастереомер;
14-O-{[(1R,2R,3R)-3-диэтиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,3S) диастереомер;
14-O-{[(1R,2R,4S)-4-(формилгидроксиамино)-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,4R) диастереомер;
14-O-{[(1R,2R,5S)-5-(формилгидроксиамино)-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,5R) диастереомер;
14-O-{[(1R,2R,3R/S)-3-(формилгидроксиамино)-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,3R/S) диастереомер;
14-O-{[(1R,2R,5S)-2-гидрокси-5-метиламиноциклогексилсульфанил]ацетил}мутилин и его (1S,2S,5R) диастереомер;
14-O-{[(1R,2R,5S)-5-аллиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,5R) диастереомер;
14-O-{[(1R,2R,5S)-2-гидрокси-5-(2-метоксиэтиламино)циклогексилсульфанил]ацетил}мутилин и его (1S,2S,5R) диастереомер;
14-O-{[(1R,2R,4R*)-2-гидрокси-4-(2-гидроксиэтиламино)циклогексилсульфанил]ацетил}мутилин и его (1S,2S,4S*) диастереомер;
14-O-{[(1R,2R,4R*)-4-циклогексиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,4S*) диастереомер;
14-O-{[(1R,2R,4R*)-4-циклопропиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,4S*) диастереомер;
14-O-{[(1R,2R,5S*)-4-циклопропиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,5R*) диастереомер;
14-O-{[(1R,2R,4S*)-4-циклопропиламино-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S,4R*) диастереомер;
14-O-{[(1R,2R,5R*)-2-гидрокси-5-морфолин-4-илциклогексилсульфанил]ацетил}мутилин и его (1S,2S,5S*) диастереомер;
14-O-{[(1R,2R,5S*)-2-гидрокси-5-морфолин-4-илциклогексилсульфанил]ацетил}мутилин и его (1S,2S,5R*) диастереомер;
14-O-{[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетил}-19,20-дигидромутилин и его (1S,2S,5R) диастереомер;
14-O-{[(1R,2R,5S)-5-этиламино-2-гидроксициклогексилсульфанил]ацетил}-19,20-дигидромутилин и его (1S,2S,5R) диастереомер;
14-O-{[(1R,2R,5R)-5-амино-2-гидроксициклогексилсульфанил]ацетил}-19,20-дигидромутилин и его (1S,2S,5S) диастереомер;
14-O-{[(1R,2R)-4-аминометил-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S) диастереомер;
14-O-{[5-амино-2-хлорциклогексилсульфанил]ацетил}мутилин;
14-O-{[4-амино-2-хлорциклогексилсульфанил]ацетил}мутилин;
14-O-[(4-амино-1-гидроксициклогексилметилсульфанил)ацетил]мутилин;
14-O-{[(1R,2R)-2-гидрокси-5-(3-метиламинопропил)циклогексилсульфанил]ацетил}мутилин и его (1S,2S) диастереомер;
14-O-{[(1R,2R)-2-гидрокси-4-(3-метиламинопропил)циклогексилсульфанил]ацетил}мутилин и его (1S,2S) диастереомер;
14-O-{[(1R,2R)-5-(3-аминопропил)-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S) диастереомер;
14-O-{[(1R,2R)-4-(3-аминопропил)-2-гидроксициклогексилсульфанил]ацетил}мутилин и его (1S,2S) диастереомер;
14-O-{[(6R,8R)-8-амино-1,4-диоксаспиро[4.5]дец-6-илсульфанил]ацетил}мутилин и его (6S,8S) диастереомер;
14-O-{[4-амино-2-метоксициклогексилсульфанил]ацетил}мутилин и
14-O-{[5-амино-2-метоксициклогексилсульфанил]ацетил}мутилин,
в свободной форме, в форме соли и/или сольвата.
8. Соединение по п.7, представляющее собой 14-O-{[(1R,2R,4R)-4-амино-2-гидроксициклогексилсульфанил]ацетил}мутилин, в свободной форме или в форме соли и/или сольвата.
9. Соединение по п.7, представляющее собой 14-O-{[(1S,2S,4S)-4-амино-2-гидроксициклогексилсульфанил]ацетил}мутилин в свободной форме или в форме соли и/или сольвата.
10. Применение соединения по любому из пп.1-9 в качестве лекарственного вещества.
11. Способ лечения заболеваний, опосредованных микробами, который включает введение субъекту, нуждающемуся в данном лечении, эффективного количества соединения по одному из пп.1-9.
12. Фармацевтическая композиция, включающая соединение по любому из пп.1-9, в сочетании по меньшей мере с одним фармацевтическим эксципиентом.
Текст
ПРОИЗВОДНЫЕ ПЛЕВРОМУТИЛИНА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ,ОПОСРЕДУЕМЫХ МИКРОБАМИ Манг Роземари, Хайльмайер Вернер,Бадегрубер Рудольф, Штрикманн Дирк, Новак Родгер, Ференцик Матиас, Булюзу Атхиута Рама Хандра Мурти (AT) Медведев В.Н. (RU) где n равно числу от 0 до 4; m равно 0 или 1, при условии, что атом серы и R3 находятся в вицинальном положении (если m=0, тогда R3 находится в положении 2', а если m=1, тогда R3 находится в положении 1'); R представляет этил или винил; R1 представляет атом водорода или(C1-6)алкил; R2 представляет атом водорода, или -(С 3-6)циклоалкил, или незамещенный (C1-6)алкил,или (C1-6)алкил, замещенный одной или несколькими группами из числа таких, как гидрокси,предпочтительно одна или две, метокси, атом галогена, (С 3-6)циклоалкил, или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют 5-7-членное гетероциклическое кольцо,содержащее по меньшей мере 1 атом азота или 1 атом азота и 1 дополнительный гетероатом,например, выбранный из N или О, или R1 представляет гидрокси и R2 представляет формил; R3 представляет ОН, OR4, атом галогена, или при условии, что R3 присоединен в положении 2', R3 представляет -О-(СН 2)p-О- с р, равным 2 или 3; R4 представляет незамещенный (C1-6)алкил или(71)(73) Заявитель и патентовладелец: НАБРИВА ТЕРАПЬЮТИКС АГ (AT) представляет собой антибиотик природного происхождения, например, продуцируемый basidomycetesPleurotus mutilus и P. Passeckerianus, см., например, The Merck Index, 13th edition, item 7617. Разработан ряд дополнительных плевромутилинов, имеющих основную кольцевую структуру плевромутилина и содержащих заместители у гидроксильной группы, например, в качестве противомикробных веществ. Из WO 02/04414 А 1 известны производные плевромутилина, например 14-O-[(аминоциклогексан-2 ил (и -3-ил)сульфанил)ацетил]мутилины; из WO 07/014409 А 1 известны, например, 14-O-[(моно- (или диалкиламино)циклоалкилсульфанил)ацетил]мутилины и из WO 07/000004 А 1 известны, например,[ацилгидроксиамино)циклоалкилсульфанил)ацетил]мутилины. Авторы изобретения обнаружили плевромутилины с интересным действием в сочетании с неожиданной замечательной метаболической стабильностью. Производные плевромутилина согласно изобретению представляют собой соединения формулы (I)m равно 0 или 1 при условии, что атом серы и R3 находятся в вицинальном положении (если m=0,тогда R3 находится в положении 2', а если m=1, тогда R3 находится в положении 1');R представляет этил или винил;R1 представляет атом водорода или (С 1-6)алкил;(C1-6)алкил, замещенный одной или несколькими группами из числа таких, как гидрокси,метокси,атом галогена,(С 3-6)циклоалкил, илиR1 и R2 вместе с атомом азота, к которому они присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере 1 атом азота или 1 атом азота и 1 дополнительный гетероатом, выбранный из N или О, илиR4 представляет незамещенный (C1-6)алкил или (С 3-6)циклоалкил,в свободной форме или в форме соли и/или сольвата. Если в соединении формулы (I) R2 представляет собой (С 1-6)алкил, замещенный одной или несколькими гидроксигруппами, предпочтительно R2 представляет собой (C1-6)алкил, замещенный одной или двумя гидроксигруппами. Предпочтительные соединения настоящего изобретения являются соединениями формулы (II) где значения n, R, R1, R2 и R3 те же, что определены выше,в свободной форме или в форме соли и/или сольвата. Более предпочтительные соединения настоящего изобретения являются соединениями формулы где значения n, R, R1 и R2 те же, что определены выше,в свободной форме или в форме соли и/или сольвата. Наиболее предпочтительные соединения настоящего изобретения являются соединением формулы (IV) где значения n, R1 и R2 те же, что определены выше,в свободной форме или в форме соли и/или сольвата. Особенно предпочтительным является соединение, выбранное из группы, включающей 14-O-[(1R,2R,4R)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилин; 14-O-[(1S,2S,4S)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилин; 14-O-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин; 14-O-[(1S,2S,5R)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин; 14-O-[(1R,2R,4S)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилин и его (1S,2S,4R) диастереомер; 14-O-[(1R,2R,5R)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин; 14-O-[(1S,2S,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин; 14-O-[(1R,2R,3R)-3-амино-2-гидроксициклогексилсульфанил]ацетилмутилин и его (1S,2S,3S) диастереомер; 14-O-[(1R,2R,4R)-4-диэтиламино-2-гидроксициклогексилсульфанил]ацетилмутилин и его(1S,2S) диастереомер; 14-O-[(1R,2R)-5-(3-аминопропил)-2-гидроксициклогексилсульфанил]ацетилмутилин и его (1S,2S) диастереомер; 14-O-[(1R,2R)-4-(3-аминопропил)-2-гидроксициклогексилсульфанил]ацетилмутилин и его (1S,2S) диастереомер; 14-O-[(6R,8R)-8-амино-1,4-диокса-спиро[4.5]дец-6-илсульфанил]ацетилмутилин и его (6S,8S) диастереомер; 14-O-[4-амино-2-метоксициклогексилсульфанил]ацетилмутилин и 14-O-[5-амино-2-метоксициклогексилсульфанил]ацетилмутилин,в свободной форме или в форме соли и/или сольвата. Соединение, относящееся к настоящему изобретению, в настоящем документе также названо "соединением(ями) (согласно изобретению) настоящего изобретения". Соединение настоящего изобретения включает соединение в любой форме, например в свободной форме, в форме соли, в форме сольвата и в форме соли и сольвата. Соли включают предпочтительно фармацевтически приемлемые соли, хотя фармацевтически неприемлемые соли включены в целях, например, получения, выделения, очистки. Соль соединения настоящего изобретения включает аддитивную соль основания или кислоты. Фармацевтически приемлемые основные соли включают соли аммония, такие как триметиламмониевые соли, соли щелочных металлов, такие как соли натрия и калия, соли щелочно-земельных металлов, такие как соли кальция и магния, и соли с органическими основаниями, включающие соли первичных, вторичных и третичных аминов, таких как изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин и N-метил-D-глюкамин, предпочтительно натриевые соли. Аддитивные соли кислоты включают соли соединения настоящего изобретения с кислотой, например гидрофумаровой кислотой, фумаровой кислотой, винной кислотой, этан-1,2-дисульфоновой кислотой, малеиновой кислотой, нафталин 1,5-сульфоновой кислотой, уксусной кислотой, малеиновой кислотой, янтарной кислотой, салициловой кислотой, азелаиновой кислотой, 2-[(2,6-дихлорфенил)амино]бензоуксусной кислотой, хлористоводородной кислотой, дейтерохлорноватой кислотой, предпочтительно хлористо-водородной кислотой. Соединение настоящего изобретения в свободной форме может быть превращено в соответствующее соединение в форме соли и наоборот. Соединение настоящего изобретения в свободной форме или в форме его соли и/или в форме сольвата может быть превращено в соответствующее соединение в свободной форме или в форме соли в несольватированной форме и наоборот. Соединение настоящего изобретения может существовать в форме изомеров и их смесей, например оптических изомеров, диастереоизомеров, цис/трансконформеров. Соединение настоящего изобретения может, например, содержать асимметричные атомы углерода и может, таким образом, существовать в форме энантиомеров или диастереоизомеров и их смесей, например рацематов или диастереомерных смесей. Любой асимметричный атом углерода может находиться в (R)-, (S)- или (R,S)-конфигурации,предпочтительно в (R)- или (S)-конфигурации. Например, в соединении формулы (I) атом углерода циклоалкильного кольца, к которому присоединена группа (CH2)mS, атом углерода циклоалкильного кольца, к которому присоединена группа R3, и атом углерода циклоалкильного кольца, к которому присоединена группа (СН 2)nN(R1R2), являются асимметричными атомами углерода. Заместители, присоединенные к данному асимметричному атому углерода, могут, таким образом, существовать в (R)- и (S)-конфигурации, включая их смеси. Например, если в соединении формулы (I) группа R2 является замещенным алкилом и данный заместитель присоединен к атому углерода боковой цепи данного алкила, то атом углерода, к которому данный заместитель присоединен, является асимметричным атомом углерода и данный заместитель может быть в форме (R)- и (S)конфигурации, включая его смеси. Конфигурация заместителей, присоединенных к асимметричным атомам углерода трициклических мутилинов, является предпочтительно такой же, что и у природного плевромутилина. Изомерные смеси могут быть разделены соответствующим образом, например, согласно, например,аналогично традиционному методу, с получением чистых изомеров. Настоящее изобретение включает соединение настоящего изобретения в любой изомерной форме и в любой изомерной смеси. Настоящее изобретение также включает таутомеры соединения настоящего изобретения, когда такие таутомеры существуют. Соединения настоящего изобретения проявляют фармакологическую активность и являются поэтому пригодными для применения в качестве фармацевтических средств. Например, соединения настоящего изобретения показывают антимикробное, например антибактериальное, действие против грамположительных бактерий, таких как коагулазоположительные Staphylococci, например Staphylococcus aureus, коагулазоотрицательные Staphylococci, например StaphylococcusIn vitro активность против аэробных бактерий определена методом разбавления агара или методом микроразбавлений согласно документам Института клинических и лабораторных стандартов (CLSI,бывший MCCLS) M7-A7, том 26,2: "Методы испытания на антимикробную восприимчивость при разбавлении для бактерий, растущих аэробно - утвержденный стандарт; седьмое издание (2206)"; и испытание против анаэробных бактерий проводили согласно документам Института клинических и лабораторных стандартов (CLSI, бывший MCCLS) M11-A6, том 24,2: "Методы испытания на антимикробную восприимчивость анаэробных бактерий - утвержденный стандарт; шестое издание (2204)" и действие in vivo оценивали на мышиной модели сепсиса против Staphylococcus aureus. Соединения настоящего изобретения являются поэтому подходящими для лечения и профилактики заболеваний, опосредованных микробами, например бактериями. Заболевания, которые можно также лечить, включают, например, заболевания, опосредуемые Helicobacter, такими как Helicobacter pylori, и заболевания, опосредованные Mycrobacterium tuberculosis. Заболевания, которые также можно лечить,-4 018707 включают, в общем, воспалительные заболевания, где микробы опосредуют данное воспаление, например, в том числе угревая сыпь. В другом аспекте настоящее изобретение относится к применению соединения настоящего изобретения в качестве лекарственного средства, предпочтительно в качестве антимикробного средства, такого как антибиотик, например, и антианаэробного средства. В другом аспекте настоящее изобретение относится к применению соединения настоящего изобретения при лечении угревой сыпи. Еще в одном аспекте настоящее изобретение относится к применению соединения настоящего изобретения при получении лекарственного средства для лечения заболеваний, опосредуемых микробами,таких как бактериальные, например заболеваний, опосредуемых бактериями, например, выбранными из Staphylococci, Streptococci, Enterococci; заболеваний, опосредуемых бактериями, например, выбранными из Moraxella, Naemophilus, Legionella, Neisseriaceae; заболеваний, опосредуемых Helicobacter; заболеваний, опосредуемых Mycobacterium tuberculosis; например, заболеваний, опосредуемых Mycoplasms, Chlamydia и облигаторными анаэробными микроорганизмами; и для лечения угревой сыпи. В другом аспекте настоящее изобретение относится к способу лечения заболеваний, опосредуемых микробами, который включает введение субъекту, нуждающемуся в данном лечении, эффективного количества соединения настоящего изобретения, например, в форме фармацевтической композиции. В другом аспекте настоящее изобретение относится к способу лечения угревой сыпи, который включает введение субъекту, нуждающемуся в данном лечении, эффективного количества соединения настоящего изобретения, например, в форме фармацевтической композиции. Лечение включает лечение и профилактику. Для антимикробного и противоугревого лечения соответствующая доза будет, безусловно, меняться в зависимости, например, от химической природы и фармакокинетических свойств используемого соединения настоящего изобретения, индивидуального реципиента, способа введения и природы и тяжести состояния, подлежащего лечению. Однако, в общем, для удовлетворительных результатов для крупных млекопитающих, например людей, указанная дневная доза находится в диапазоне от приблизительно 0,5 мг до 3 г соединения настоящего изобретения, удобно введенного, например, небольшими дозами до четырех раз в день. Соединение настоящего изобретения может быть введено любым удобным путем, например энтеральным, например, включая назальное, буккальное, ректальное, пероральное введение; парентеральным, например, включая внутривенное, внутримышечное, подкожное введение; или локальным, например, включая внутрикожное, внутриносовое, внутритрахеальное введение, например в форме таблеток с покрытием и без покрытия, капсул, растворов или суспензий для инъекций, например в виде ампул, пузырьков, в форме кремов, гелей, паст, порошков для вдыхания, пенок, тинктур, губной помады, капель,спреев, или в форме суппозиториев, например аналогично макролидам, таким как эритромицины, например кларитромицин или азитромицин. Соединение настоящего изобретения может быть введено в форме фармацевтически приемлемой соли, например аддитивной соли кислоты или аддитивной соли основания, например соли металла, или в свободной форме, необязательно в форме сольвата. Соединение настоящего изобретения в форме соли проявляет активность того же порядка, что и соединение в свободной форме, необязательно в форме сольвата. Соединение настоящего изобретения может бытьиспользовано для фармацевтического лечения согласно настоящему изобретению само по себе или в комбинации с одним или несколькими другими фармацевтически активными агентами. Данные другие фармацевтически активные агенты включают,например, другие антибиотики и противовоспалительные агенты и, если соединение настоящего изобретения использовано для лечения угревой сыпи, другие фармацевтические агенты включают дополнительные агенты, которые являются активными против угревой сыпи. Комбинации включают фиксированные комбинации, в которых два или несколько фармацевтически активных агентов содержатся в одном и том же препарате; наборы, в которых два или несколько фармацевтически активных агентов в отдельных препаратах продаются в одной упаковке, например, с инструкцией по применению; и свободные комбинации, в которых фармацевтически активные агенты упакованы по отдельности, но приложена инструкция по одновременному или последовательному введению. В другом аспекте настоящее изобретение относится к фармацевтической композиции, включающей соединение настоящего изобретения в свободной форме или в форме фармацевтически приемлемой соли и/или в форме сольвата в сочетании по меньшей мере с одним фармацевтическим эксципиентом, например носителем или разбавителем, например, включающим наполнители, связующие, дезинтегранты, ста-5 018707 билизаторы течения, лубриканты, сахара и подсластители, отдушки, консерванты, стабилизаторы, смачивающие агенты и/или эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления и/или буферы. Данные фармацевтические композиции могут быть получены согласно, например аналогично, традиционному методу, например смешением, гранулированием, нанесением покрытия, растворением или лиофилизацией. Единичная дозированная форма может содержать, например, от приблизительно 0,5 до приблизительно 2000 мг, например от 10 до приблизительно 500 мг. Соединения настоящего изобретения дополнительно пригодны как ветеринарные агенты, например ветеринарные активные соединения, например, для профилактики и лечения микробных, например бактериальных, заболеваний у животных, таких как, например, домашняя птица, свиньи и телята, и для разбавляющих жидких сред для искусственного осеменения и для методов погружения яиц. Соединение настоящего изобретения может быть полезно в качестве ветеринарного агента и соединение настоящего изобретения может быть полезно для получения ветеринарной композиции, которая может быть использована в качестве ветеринарного агента. Соединение настоящего изобретения может быть полезно в ветеринарном способе профилактики и лечения микробных, например бактериальных, заболеваний, который включает введение реципиенту,нуждающемуся в данном лечении, эффективного количества соединения настоящего изобретения, например, в форме ветеринарной композиции. Представленные ниже по тексту соединения примеров 1-37 показывают величины MIC 2 мг/мл против Staphylococcus aureus АТСС 49951 и Streptococcus pneumoniae ATCC49619. Метаболическую стабильность соединений настоящего изобретения определяли с использованием криоконсервированных первичных человеческих гепатоцитов. 1106 клеток/мл инкубировали в отсутствие и в присутствии 5 и 25 мг/мл тестируемых соединений при 37 С, 5% СО 2 в течение 4 ч. Для оценки деструкции in vitro в условиях анализа образец каждого тестируемого соединения также инкубировали в отсутствие гепатоцитов. Инкубирование останавливали заморозкой реакционной смеси. После ультрафильтрования и промывания фильтра ацетонитрилом раствор образца анализировали на исчезновение исходного соединения или появление метаболита с использованием ЖХ/МС (ионной ловушки). Величина метаболической стабильности соответствует детектированному исходному соединению в % после инкубирования. Для соединений настоящего изобретения введение группы R3, предпочтительно гидроксильной группы, в винцинальное положение к серосодержащему заместителю, присоединенному к циклогексильному кольцу, отмечено неожиданное улучшение в метаболической стабильности микробиологически активных компонентов. Исходное соединение или активный метаболит были более стабильными после инкубирования с первичными человеческими гепатоцитами по сравнению с производными без группыR3, предпочтительно гидроксильной группы, присоединенной к циклогексильному остатку боковой цепи плевромутилина. Например, после 4 ч инкубирования с человеческими гепатоцитами при концентрации соединения 5 мг/мл для смеси гидрохлорида 14-O-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилина и гидрохлорида его (1S,2S,5R) диастереомера - пример 2 настоящего изобретения было найдено 66% исходного соединения, тогда как для смеси гидрохлорида 14-O-[(1R,3R)-3 аминоциклогексилсульфанил]ацетилмутилина и гидрохлорида его (1S,3S) диастереомера - аналогичного производного без гидроксильной группы - можно было детектировать только 24% исходного соединения. Примеры Тривиальное название мутилин относится к систематическому названию по IUPAC(1S,2R,3S,4S,6R,7R,8R,14R)-3,6-дигидрокси-2,4,7,14-тетраметил-4-винилтрицикло[5.4.3.01,8]тетрадекан 9-она. В примерах производные плевромутилина пронумерованы аналогично системе нумерации мутилина, описанной H. Berner (Berner, H.; Schulz, G.; Schneider H. Tetrahedron 1980, 36, 1807-1811). Плевромутилинтиол и плевромутилинтозилят являются соединениями формул(Nagarajan, R. Eli Lilly and Company 1978, US4, 130, 709) (7,10 г, 18 ммоль) в 200 мл тетрагидрофурана добавляли оксид алюминия (40 г, активность по Brockmann I, нейтральный) и полученную смесь перемешивали в течение 40 ч при комнатной температуре. Суспензию фильтровали и концентрировали при пониженном давлении. Остаток подвергали хроматографии (диоксид кремния, циклогексан/этилацетат=1/1) и получали 14-O-[(1R,2R,4R)-4-трет-бутоксикарбониламино-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер (a) (Rf=0,38, 1,34 г, 12%), а также смесь 14-O-[(1R,2R,5S)-5-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,5R) диастереомера и 14-O-[(1R,2R,4S)-4-трет-бутоксикарбониламино-2 гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,4R) диастереомера (b) (Rf=0,26, 2,81 г, 25%) в виде бесцветных аморфных вспененных соединений.MC-ESI (m/z): 630 (MNa+), 1237 (2MNa+). Или стадия А 2. 14-O-[(1R,2R,4R)-4-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер,14-O-[(1R,2R,5S)-5-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер и 14-О-[(1R,2R,4S)-4-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер. К раствору сложного трет-бутилового эфира 3,4-эпоксициклогексилкарбаминовой кислоты (10 г,47 ммоль) и плевромутилинтиола (16,6 г, 42 ммоль) в 200 мл метанола и 20 мл диоксана добавляли 2 н. раствор NaOH (21 мл, 42 ммоль) и полученную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции величину рН доводили до 7 разбавленной HCl и реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли водой и концентрированным раствором соли и трижды экстрагировали этилацетатом. Органические слои сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и после хроматографии (диоксид кремния, циклогексан/этилацетат=1/1) получали 14-O-[(1R,2R,4R)-4-трет-бутоксикарбониламино 2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер (Rf=0,40, 3,1 г, выход 12%), а также смесь 14-O-[(1R,2R,5S)-5-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилина(Rf=0,25, 6,35 г, 25%) в виде бесцветных аморфных вспененных веществ. Или стадия 14-O-[(1R,2R,5S)-5-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер. К раствору плевромутилинтиола (9,25 г, 23,5 ммоль) в 100 мл ацетонитрила (осушенного над молекулярным ситом 4 ) добавляли 1,5-диазабицикло[4.3.0]нон-5-ен (ДБН, 2,9 мкл, 23,5 ммоль), после 1 ч перемешивания при комнатной температуре в атмосфере аргона в смесь загружали сложный третбутиловый эфир син-3,4-эпоксициклогексилкарбаминовой кислоты (4,17 г, 19,5 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли водой и концентрированным раствором соли и трижды экстрагировали дихлорметаном. Органические слои сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и подвергали хроматографии (диоксид кремния, циклогексан/этилацетат=1/1), в результате чего получали 14-O-[(1R,2R,4R)-4-трет-бутоксикарбониламино-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер (Rf=0,38, 5,07 г, 43%), а также 14-O-[(1R,2R,5S)-5-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилин+ (1S,2S,5R) диастереомер (Rf=0,25, 2,95 г, 16,5%) в виде бесцветных аморфных вспененных веществ. Стадия В. 14-O-[(1R,2R,4R)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилин +(1S,2S,4S) диастереомер. К раствору 14-O-[(1R,2R,4R)-4-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,4S) диастереомера (1,34 г, 2,20 ммоль) в 75 мл дихлорметана добавляли трифторуксусную кислоту (4 мл) при 4 С и перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь разбавляли дихлорметаном и осторожно выливали в насыщенный раствор NaHCO3. Фазы разделяли и водный слой дважды промывали дихлорметаном. Объединенные органические слои сушили над сульфатом натрия и фильтровали. После хроматографии (диоксид кремния, этилацетат/метанол/35% раствор аммиака=50/50/1) получали 14-O-[(1R,2R,4R)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер (745 мг, выход 67%) в виде бесцветного аморфного вспененного вещества. 1(1S,2S,4S) диастереомера (325 мг, 0,64 ммоль) в 20 мл диоксана обрабатывали 1 н. HCl (0,64 мл, 0,64 ммоль). После перемешивания при комнатной температуре в течение 30 мин раствор лиофилизировали с получением гидрохлорида 14-O-[(1R,2R,4R)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорида (1S,2S,4S) диастереомера (количественный выход) в виде бесцветного аморфного твердого вещества. 1MC-ESI (m/z): 508 (МН+), 530 (MNa+), 1015 (2 МН+), 1037 (2MNa+), 542 (MCl-). Пример 1 А. 14-O-[(1S,2S,4S)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилин и 14-O-[(1R,2R,4R)4-амино-2-гидроксициклогексилсульфанил]ацетилмутилин. Смесь 14-O-[(1R,2R,4R)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,4S) диастереомера (12 г, 23,6 ммоль) из примера 1, стадия В, разделяли на хиральной колонке (25020 мм(b) (поздно вымываемое соединение, 3,63 г, выход 30%, без поправок) в виде бесцветных вспененных веществ.(1S,2S,5R) диастереомер и 14-О-[(1R,2R,4S)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер. Смесь 14-O-[(1R,2R,5S)-5-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,5R) диастереомера и 14-O-[(1R,2R,4S)-4-трет-бутоксикарбониламино-2 гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,4R) диастереомера (1,12 г, 1,84 ммоль) из примера 1, стадия А, обрабатывали согласно методу примера 1, стадия В. После обработки и хроматографии реакционной смеси (диоксид кремния, этилацетат/метанол/35% раствор аммиака=50/50/1) получили 14-O-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер(Rf=0,33,524 мг,выход 56%) и 14-O-[(1R,2R,4S)-4-амино-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер (b) (Rf=0,22, 160 мг, 17%) в виде бесцветных аморфных вспененных веществ.(д, 1 Н, 14-Н, J=8 Гц), 5,06 (м, 2 Н, 20-Н), 4,51 (ушир.с, 1 Н, 11-ОН), 3,79 (м, 1 Н, 2'-Н), 3,42 (м, 1 Н, 11-Н),АВ-система (vA=3,33, vB=3,23, 22-H, J=15 Гц), 3,04 (м, 1 Н, 4'-Н), 2,82 (м, 1 Н, 1'-Н), 2,40 (ушир.с, 1 Н, 4-Н),1,37 (с, 3 Н, 15-СН 3), 1,06 (с, 3 Н, 18-СН 3), 0,81 (д, 3 Н, 17-СН 3, J=7 Гц), 0,63 (д, 3 Н, 16-СН 3, J=7 Гц). Стадия В. Гидрохлорид 14-O-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,5R) диастереомера. 14-O-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (516 мг, 1,02 ммоль) обрабатывали согласно методу примера 1, стадия С и получали гидрохлорид 14-O-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилина(1S,2S,5R) диастереомера (533 мг, выход 96%) в виде бесцветного аморфного вещества. 1MC-ESI (m/z): 508 (МН+), 530 (MNa+), 1015 (2 МН+), 1037 (2MNa+), 542 (MCl-). Пример 2 А. 14-O-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин и 14-O-[(1S,2S,5R)5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин. Смесь 14-О-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,5R) диастереомера (4,91 г, 9,67 ммоль) из примера 2, стадия А, разделяли на хиральной колонке (25020 ммCHIRALCEL OD-H, н-гептан/изопропанол/диэтиламин=80/20/0,1) и получали 14-O-[(1R,2R,5S)-5 амино-2-гидроксициклогексилсульфанил]ацетилмутилин (а) (рано вымываемое соединение, 2,07 г, выход 42%, без поправок) и 14-O-[(1S,2S,5R)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин (b) (поздно вымываемое соединение, 2,36 г, выход 48%, без поправок) в виде бесцветных аморфных вспененных веществ. омер (152 мг, 0,30 ммоль) из примера 2, стадия А, обрабатывали согласно методу примера 1, стадия С, и получали гидрохлорид 14-O-[(1R,2R,4S)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,4R) диастереомера (148 мг, выход 91%) в виде бесцветного аморфного твердого вещества. 1Chemistry 1994, 22, 172-197) (10 г, 102 ммоль) в 200 мл дихлорметана добавляли ацетилацетонат ванадила (0,5 г, кат.) и трет-бутилгидропероксид (20,4 мл, 5,5 М в декане, 112 ммоль) и перемешивали в течение ночи при комнатной температуре. Полученную реакционную смесь обрабатывали третбутилдиметилсилилхлоридом (16,9 г, 112 ммоль), имидазолом (9,02 г, 132 ммоль) и 4 диметиламинопиридином (2,49 г, 20 ммоль) при 4 С и перемешивали в течение 5 ч при комнатной температуре. Реакционную смесь разбавляли дихлорметаном и затем экстрагировали 10% растворомNaHSO3 и насыщенным раствором соли. Органический слой осушали над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлением и подвергали хроматографии (диоксид кремния, циклогексан/этилацетат=15/1), в результате чего получали трет-бутилдиметил(цис-3,4 эпоксициклогексилокси)силан (Rf=0,35, 18,3 г, выход 79%) в виде бесцветного масла. 1 Н ЯМР (500 МГц, ДМСО-d6, , м.д.): 3,55 (м, 1 Н), 3,00 (м, 2 Н), 2,15 (м, 1 Н), 2,00 (м, 1 Н), 1,80 (м,1 Н), 1,50 (м, 1 Н), 1,35 (м, 1 Н), 1,35 (м, 1 Н), 1,25 (м, 1 Н), 0,83 (с, 9 Н, трет-бутил), 0,0 (с, 9 Н, Si(CH3)2). Стадия В. 14-O-[(1R,2R,5S)-5-(трет-бутилдиметилсилокси)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер. трет-Бутилдиметил(цис-3,4-эпоксициклогексилокси)силан (6,41 г, 28 ммоль) обрабатывали плевромутилинтиолом согласно методу примера 1, стадия А 2. Неочищенный 14-O-[(1R,2R,5S)-5-(третбутилдиметилсилокси)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер получали в виде бесцветной аморфной пенки, которую непосредственно использовали для проведения следующей стадии. 1(м, 1 Н, 5'-Н), 3,15-3,45 (м, 4 Н, 2'-Н, 11-Н, 22-СН 2), 2,92 (м, 1 Н, 1'-Н), 2,38 (ушир.с, 1 Н, 4-Н), 1,36 (с, 3 Н,15-СН 3), 1,05 (с, 3 Н, 18-СН 3), 0,86 (с, 9 Н, трет-бутил), 0,81 (д, 3 Н, 17-СН 3, J=7 Гц), 0,63 (д, 3 Н, 16-СН 3,J=7 Гц), 0,0 (с, 6 Н, Si(CH3)2). Стадия C. 14-O-[(1R,2R,5S)-2,5-дигидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер. К раствору 14-O-[(1R,2R,5S)-5-(трет-бутилдиметилсилокси)-2-гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,5R) диастереомера (9,46 г, 15,1 ммоль) в 25 мл тетрагидрофурана добавляли смесь уксусной кислоты и воды (3:1, 100 мл) и перемешивали в течение 2 дней при 40 С. Реакционную смесь концентрировали почти досуха при пониженном давлении, остаток растворяли в этилацетате и подвергали хроматографии (диоксид кремния, циклогексан/этилацетат=1/3) и получали 14-O[(1R,2R,5S)-2,5-дигидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (Rf=0,27,7,07 г, выход 92%) в виде бесцветного аморфного вспененного вещества. 1D. 14-O-[(1R,2R,5S)-2-гидрокси-5-метансульфонилоксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер. К раствору 14-O-[(1R,2R,5S)-2,5-дигидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,5R) диастереомера (6,07 г, 11,9 ммоль) в 36 мл пиридина добавляли метансульфонилхлорид (1,1 мл, 14,3 ммоль) и полученную смесь перемешивали в течение ночи при комнатной температуре. Затем растворитель выпаривали при пониженном давлении; остаток разбавляли 1 н. HCl и трижды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали и очищали колоночной хроматографией (диок- 10018707 сид кремния,циклогексан/этилацетат=1/1) и получали 14-O-[(1R,2R,5S)-2-гидрокси-5 метансульфонилоксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (Rf=0,15, 2,55 г,выход 36%) в виде бесцветного аморфного вспененного вещества. 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 6,12 (дд, 1 Н, 19-Н, J=11 Гц и 18 Гц), 5,54 (д,1 Н, 14-Н, J=8 Гц), 5,07 (м, 2 Н, 20-Н), 5,00 (т, 1 Н, 2'-ОН, J=5 Гц), 4,78 (м, 1 Н, 5'-Н), 4,50 (д, 1 Н, 11-ОН, J=6 Гц), 3,55-3,25 (м, 4 Н, 2'-Н, 11-Н, 22-Н), 2,91 (м, 1 Н, 1'-Н), 2,38 (ушир.с, 1 Н, 4-Н), 1,36 (с, 3 Н, 15-СН 3), 1,05(с, 3 Н, 18-СН 3), 0,80 (д, 3 Н, 17-СН 3, J=7 Гц), 0,63 (д, 3 Н, 16-СН 3, J=7 Гц). Стадия Е. 14-O-[(1R,2R,5R)-5-азидо-2-гидрокси-5-метансульфонилоксициклогексилсульфанил]ацетилмутилин + (1S,2S,5S) диастереомер. Раствор 14-O-[(1R,2R,5S)-2-гидрокси-5-метансульфонилоксициклогексилсульфанил]ацетилмутилина + (1S,2S,5R) диастереомера (2,55 г, 4,35 ммоль) и азид натрия (0,85 г, 13 ммоль) в 30 мл диметилформамида нагревали в течение 6 ч при 80 С. Реакционную смесь разбавляли водой и насыщенным раствором соли и трижды экстрагировали этилацетатом. Объединенные органические слои промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении и получали неочищенный 14-O-[(1R,2R,5R)-5-азидо-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5S) диастереомер (количественный выход,циклогексан/этилацетат=1/1, Rf=0,35) в виде аморфного вспененного вещества, которое непосредственно использовали на следующей стадии. 1(1S,2S,5S) диастереомер. Трифенилфосфин (1,18 г, 4,50 ммоль) добавляли к раствору 14-О-[(1R,2R,5R)-5-азидо-2 гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,5S) диастереомера (2,4 г, 4,50 ммоль) в 30 мл тетрагидрофурана и перемешивали в течение ночи при комнатной температуре. Затем добавляли воду(приблизительно 3 мл) и реакционную смесь нагревали в течение 1 ч в колбе с обратным холодильником. После выпаривания растворителя остаток растворяли водой и насыщенным раствором соли и трижды экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия, фильтровали и подвергали хроматографии (диоксид кремния, этилацетат/метанол/35% раствор аммиака=100/100/1) и получали 14-O-[(1R,2R,5R)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин+ (1S,2S,5S) диастереомер (Rf=0,3, 1,74 г, выход 79%) в виде бесцветного аморфного вспененного вещества. 1MC-ESI (m/z): 508 (МН+), 530 (MNa+), 1037 (2MNa+). Пример 4 А. 14-O-[(1R,2R,5R)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин и 14-O-[(1S,2S,5S)5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин. Смесь 14-O-[(1R,2R,5R)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,5S) диастереомера (4 г, 7,87 ммоль) из примера 4, стадия F, разделяли на хиральной колонке (25020 ммCHIRALPAK IC, н-гептан/тетрагидрофуран/диэтиламин=70/30/0,1) и получали 14-O-[(1S,2S,5S)-5 амино-2-гидроксициклогексилсульфанил]ацетилмутилин (поздно вымываемое соединение, 1,1 г, выход 28%, без поправок) в виде бесцветного аморфного вспененного вещества. 1MC-ESI (m/z): 508 (МН+), 1037 (2MNa+), 506 (М-Н)-, 542 (MCl-). Пример 5. Гидрохлорид 14-O-[(1R,2R,3R)-3-амино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,3S) диастереомера. Стадия А. 14-O-[(1R,2R,3R)-3-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилин и (1S,2S,3S) диастереомер. Сложный трет-бутиловый эфир цис-2,3-эпоксициклогексилкарбаминовой кислоты (O'Brien, P.,Childs, A.С.; Ensor, G. Organic Letters 2003, 5(26), 4955-4957) (1 г, 4,69 ммоль) обрабатывали плевромутилинтиолом согласно методу примера 1, стадия А 1. После обработки и хроматографии реакционной смеси(Rf=0,5, 1,32 г, 46%) в виде бесцветного аморфного вспененного вещества. 1(1S,2S,3S) диастереомер. 14-О-[(1R,2R,3R)-3-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер (400 мг, 0,658 ммоль) обрабатывали согласно методу примера 1, стадия В. После обработки и хроматографии реакционной смеси (диоксид кремния, этилацетат/метанол=1/5) получали 14-O-[(1R,2R,3R)-3-амино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер (Rf=0,1, 249 мг, 75%) в виде бесцветного аморфного вспененного вещества.MC-ESI (m/z): 508 (МН+), 530 (MNa+), 1015 (2 МН+), 1037 (2MNa+). Стадия С. Гидрохлорид 14-O-[(1R,2R,3R)-3-амино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,4S) диастереомера. 14-O-[(1R,2R,3R)-3-амино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер (249 мг, 0,49 ммоль) обрабатывали согласно методу примера 1, стадия С, и получали гидрохлорид 14-O-[(1R,2R,3R)-3-амино-2-гидроксициклогексилсульфанил]ацетилмутилина(1S,2S,3S) диастереомера (247 мг, выход 93%) в виде бесцветного аморфного вещества. 1(1S,2S,4S) диастереомера (900 мг, 1,77 ммоль) из примера 1, стадия В, в 10 мл дихлорметана добавляли ацетальдегид (2,77 мл, 1 М в дихлорметане) и уксусную кислоту (77 мкл, 1,77 ммоль) и перемешивали в течение 30 мин при комнатной температуре. Полученную реакционную смесь обрабатывали триацетоксиборгидридом натрия (750 мг, 3,54 ммоль) и перемешивали в течение ночи при комнатной температуре,разбавляли дихлорметаном и затем экстрагировали раствором NaHCO3 и насыщенным раствором соли. Органический слой осушали над сульфатом натрия и фильтровали. Фильтрат подвергали хроматографии(1S,2S,4S) диастереомер (b) (163 мг, выход 17%) в виде бесцветных аморфных вспененных веществ. гидрид натрия (880 мг, 60% дисперсия, 22 ммоль) и после 1 ч при перемешивании этилйодид (1,78 мл,22 ммоль). Еще после 2 ч перемешивания при комнатной температуре реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли водой и насыщенным раствором соли и трижды экстрагировали этилацетатом. Органические слои осушали над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и после хроматографии (диоксид кремния, циклогексан/этилацетат=12/1) получали указанное в заголовке соединение (Rf=0,30, 2,88 г, выход 58%) в виде бесцветного твердого вещества. 1 Н ЯМР (400 МГц, CDCl3, , м.д.): 5,61 (м, 2 Н, двойная связь), 4,08 (ушир.с, 1 Н, NCH), 3,15 (м, 2 Н,NCH2), 2,15, 1,75 (2 м, 6 Н), 1,47 (с, 9 Н, трет-бутил), 1,13 (т, 3 Н, NCH2CH3, J=7 Гц). Стадия В. Сложный трет-бутиловый эфир N-этил-N-(цис-3,4-эпоксициклогексил)карбаминовой кислоты. Сложный трет-бутиловый эфир N-этил-N-(циклогекс-3-енил)карбаминовой кислоты (2,87 г, 12,7 ммоль) растворяли в 75 мл дихлорметана и обрабатывали 3-хлорнадбензойной кислотой (4,50 г, 70%, 19 ммоль). После перемешивания при комнатной температуре в течение 20 ч реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли этилацетатом и затем последовательно экстрагировали 10% раствором NaHSO3, насыщенным раствором NaHCO3 и насыщенным раствором соли. Органический слой осушали над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и после хроматографии (диоксид кремния, циклогексан/диоксан=5/1) получали указанное в заголовке соединение (Rf=0,2, 1,50 г, выход 49%). 1(1,5 г, 6,2 ммоль) обрабатывали плевромутилинтиолом согласно методу примера 1, стадия А 1. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/диоксин=3/1) получали 14O-[(1R,2R,5S)-5-(трет-бутоксикарбонилэтиламино)-2-гидроксициклогексилсульфанил]ацетилмутилин +(1S,2S,5R) диастереомер (Rf=0,4, 2,57 г, выход 65%) в виде бесцветного аморфного вспененного вещества.(1S,2S,5R) диастереомер. 14-O-[(1R,2R,5S)-5-(трет-бутоксикарбонилэтиламино)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (2,57 г, 4,04 ммоль) обрабатывали согласно методу примера 1, стадия В. После обработки и проведения хроматографии реакционной смеси (диоксид кремния, этилацетат/метанол/35% раствор аммиака=100/100/1) получали 14-O-[(1R,2R,5S)-5-этиламино-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (Rf=0,3, 1,08 г, 50%) в виде бесцветного аморфного вспененного вещества. 1 Н ЯМР (500 МГц, CDCl3, , м.д., помимо прочего): 6,48 (дд, 1 Н, 19-Н, J=10 Гц и 18 Гц), 5,77 (м, 1 Н,14-Н), 5,36 (м, 1 Н, 20-Н), 5,22 (д, 1 Н, 20-Н, J=17 Гц), 3,45 (д, 1 Н, 2'-Н), 3,37 (д, 1 Н, 11-Н, J=6 Гц), 3,25 (м,1 Н, 22-Н), 2,97 (м, 1 Н, 1'-Н), 2,91 (м, 1 Н, 5'-Н), 2,63 (кв, 2 Н, NCH2, J=7 Гц), 2,10 (ушир.с, 1 Н, 4-Н), 1,46 (с,3 Н, 15-СН 3), 1,18 (с, 3 Н, 18-СН 3), 1,12 (т, 3 Н, NCH2CH3, J=7 Гц), 0,98 (д, 3 Н, 17-СН 3, J=7 Гц), 0,73 (д, 3 Н,16-СН 3, J=7 Гц). Стадия Е. Гидрохлорид 14-O-[(1R,2R,5S)-5-этиламино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,5R) диастереомера. 14-O-[(1R,2R,5S)-5-этиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (86 мг, 0,16 ммоль) обрабатывали согласно методу примера 1, стадия С, с получением гидрохлорида 14-O-[(1R,2R,5S)-5-этиламино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорида (1S,2S,5R) диастереомера (83 мг, выход 90%) в виде бесцветного аморфного вспененного вещества. 1 диастереомер (250 мг, 0,47 ммоль) из примера 7, стадия D, обрабатывали ацетальдегидом (53 мкл,0,93 ммоль) согласно методу примера 6. После обработки и хроматографии реакционной смеси (диоксид кремния,этилацетат/метанол=1/1) получали 14-O-[(1R,2R,5S)-5-диэтиламино-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (Rf=0,2, 230 мг, 87%) в виде бесцветного аморфного вспененного вещества. 1H ЯМР (400 МГц, CDCl3, , м.д., помимо прочего): 6,48 (дд, 1 Н, 19-Н, J=11 Гц и 17 Гц), 5,77 (д, 1 Н,14-Н, J=8 Гц), 5,36 (м, 1 Н, 20-Н), 5,22 (д, 1 Н, 20-Н, J=17 Гц), 3,57, 3,36, 3,21, 3,03, 2,72 (5 м, 6 Н, 1'-Н, 2'-Н,5'-Н, 11-Н, 22-Н), 2,59 (м, 4 Н, NCH2), 2,11 (ушир.с, 1 Н, 4-Н), 1,46 (с, 3 Н, 15-СН 3), 1,18 (с, 3 Н, 18-СН 3),0,98 (т, 6 Н, NCH2CH3, J=7 Гц), 0,88 (д, 3 Н, 17-СН 3, J=7 Гц), 0,73 (д, 3 Н, 16-СН 3, J=7 Гц). Стадия В. Гидрохлорид 14-O-[(1R,2R,5S)-5-диэтиламино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,5R) диастереомера. 14-O-[(1R,2R,5S)-5-диэтиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (230 мг, 0,41 ммоль) обрабатывали согласно методу примера 1, стадия С, с получением гидрохлорида 14-O-[(1R,2R,5S)-5-диэтиламино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорида (1S,2S,5R) диастереомера (223 мг, выход 91%) в виде бесцветного аморфного вещества. 1 Н ЯМР (400 МГц, CDCl3, , м.д., помимо прочего): 11,5 (ушир.с, 3 Н, NH+), 6,46 (дд, 1 Н, 19-Н, J=11 Гц и 17 Гц), 5,74 (д, 1 Н, 14-Н, J=8 Гц), 5,34 (м, 1 Н, 20-Н), 5,22 (д, 1 Н, 22-Н, J=17H), 3,98 (м, 1 Н, 2'-Н),3,60-2,90 (м, 9 Н, 1'-H, 5'-H, 11-H, 22-Н, NCH2), 2,10 (ушир.с, 1 Н, 4-Н), 1,48 (м, 9 Н, NCH2CH3, 15-СН 3),1,18 (с, 3 Н, 18-СН 3), 0,89 (д, 3 Н, 17-СН 3, J=7 Гц), 0,73 (д, 3 Н, 16-СН 3, J=7 Гц).MC-ESI (m/z): 564 (МН+), 586 (MNa+), 1149 (2MNa+), 598 (MCl-). Пример 9. 14-O-[(1R,2R,4S)-4-диэтиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер. 14-O-[(1R,2R,4S)-4-амино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер (680 мг, 1,34 ммоль) из примера 2, стадия А, обрабатывали согласно методу примера 6. После обработки и хроматографии реакционной смеси (диоксид кремния, этилацетат/метанол=1/1) получали 14-O-[(1R,2R,4S)-4-диэтиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер (Rf=0,2, 129 мг, 17%) в виде бесцветного аморфного вспененного вещества. 1MC-ESI (m/z): 536 (МН+), 558 (MNa+), 534 (М-Н)-. Пример 10. 14-O-[(1R,2R,5R)-5-диэтиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5S) диастереомер. 14-O-[(1R,2R,5R)-5-амино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5S) диастереомер (420 мг, 0,827 ммоль) из примера 4, стадия F, обрабатывали согласно методу примера 6. После обработки и хроматографии реакционной смеси (диоксид кремния, этилацетат/метанол/35% раствор аммиака=50/50/1) получали 14-O-[(1R,2R,5R)-5-диэтиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5S) диастереомер (Rf=0,2, 95 мг, 20%) в виде бесцветного аморфного вспененного вещества. 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 6,13 (дд, 1 Н, 19-Н, J=11 Гц и 18 Гц), 5,55 (д,1 Н, 14-Н, J=8 Гц), 5,05 (м, 2 Н, 20-Н), 4,79 (м, 1 Н, 2'-ОН), 3,55-3,15 (м, 2'-Н, 5'-Н, 11-Н, 22-Н), 2,58 (м, 1 Н,1'-Н), 2,40 (м, 5 Н, NCH2, 4-H), 1,37 (с, 3 Н, 15-СН 3), 1,06 (с, 3 Н, 18-СН 3), 0,92 (т, 3 Н, NCH2CH3, J=7 Гц),0,83 (д, 3 Н, 17-СН 3, J=7 Гц), 0,63 (д, 3 Н, 16-СН 3, J=7 Гц).(O'Brien, P.; Childs, A.С.; Ensor, G. Organic Letters 2003, 5(26), 4955-4957) (14,9 г, 68,9 ммоль) и 2,4,6 триметилбензилмеркаптана (11,5 г, 68,9 ммоль) в 50 мл метанола добавляли 10 н. раствор NaOH (5 мл, 50 ммоль) и полученную смесь перемешивали в течение 16 ч при комнатной температуре. Реакционную смесь разбавляли водой и насыщенным раствором соли и трижды экстрагировали этилацетатом. Органические слои осушали над сульфатом натрия и фильтровали. Фильтрат подвергали хроматографии (диоксид кремния, циклогексан/этилацетат=5/1) и получали сложный трет-бутиловый эфир [(1R,2R,3R)-2 гидрокси-3-(2,4,6-триметилбензилсульфанил)циклогексил]карбаминовой кислоты + (1S,2S,3S) диастере- 14018707 омер (Rf=0,25, 5,92 г, выход 23%) в виде бесцветного аморфного вспененного вещества. 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д.): 6,78 (с, 2 Н, аромат.-Н), 6,15 (ушир.д, ОН), 4,95 (ушир.д, NH),3,75 (д, 1 Н, SCH2), 3,68 (м, 2 Н), 3,02 (м, 1 Н, SCH), 2,30 (с, 9 Н, СН 3), 2,30, 1,90, 1,40 (3 м, 6 Н), 1,35 (с, 9 Н,трет-бутил). Стадия В. Сложный трет-бутиловый эфир [(1R,2R,3R)-2-(трет-бутилдиметилсиланилокси)-3-(2,4,6 триметилбензилсульфанил)циклогексил]карбаминовой кислоты + (1S,2S,3S) диастереомер. Раствор сложного трет-бутилового эфира[(1R,2R,3R)-2-гидрокси-3-(2,4,6 триметилбензилсульфанил)циклогексил]карбаминовой кислоты + (1S,2S,3S) диастереомер (2,46 г, 6,49 ммоль) в 50 мл диметилформамида обрабатывали трет-бутилдиметилсилилхлоридом (978 мг, 6,49 ммоль) и имидазолом (552 мг, 8,11 ммоль) и перемешивали при 80 С в течение 5 дней. Реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли 0,1 н. HCl и трижды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, осушали над сульфатом натрия и фильтровали. После хроматографии (диоксид кремния, циклогексан/этилацетат=10/1) получали сложный трет-бутиловый эфир(1S,2S,3S) диастереомер (Rf=0,25, 3,0 г, выход 94%). 1 Н ЯМР (500 МГц, ДМСО-d6, , м.д.): 6,80 (с, 2 Н, аромат.-Н), 6,20 (ушир.д, NH), 3,90, 3,75, 3,63 (3 м,4H, NCH, ОСН, SCH2), 2,98 (м, 1 Н, SCH), 2,30 (с, 9 Н, СН 3), 1,90, 1,50, 1,33 (3 м, 6 Н), 1,35 (с, 9 Н, С-третбутил), 0,85 (с, 9 Н, Si-трет-бутил), 0,0 (с, 6 Н, Si(CH3)2). Стадия С. Сложный трет-бутиловый эфир [(1R,2R,3R)-2-(трет-бутилдиметилсиланилокси)-3-(2,4,6 триметилбензилсульфанил)циклогексил]этилкарбаминовой кислоты + (1S,2S,3S) диастереомер. Раствор сложного трет-бутилового эфира [(1R,2R,3R)-2-(трет-бутилдиметилсиланилокси)-3-(2,4,6 триметилбензилсульфанил)циклогексил]карбаминовой кислоты + (1S,2S,3S) диастереомера (3,0 г, 6,08 ммоль) обрабатывали этилйодидом согласно методу примера 7, стадия А. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=3/1) получали сложный третбутиловый эфир [(1R,2R,3R)-2-(трет-бутилдиметилсиланилокси)-3-(2,4,6-триметилбензилсульфанил)циклогексил]этилкарбаминовой кислоты + (1S,2S,3S) диастереомер (1,20 г, 38%).MC-ESI (m/z): 544 (MNa+), 1065 (2MNa+). Стадия D. Сложный трет-бутиловый эфир [(1R,2R,3R)-2-(трет-бутилдиметилсиланилокси)-3 меркаптоциклогексил]этилкарбаминовой кислоты + (1S,2S,3S) диастереомер. Раствор сложного трет-бутилового эфира [(1R,2R,3R)-2-(трет-бутилдиметилсиланилокси)-3-(2,4,6 триметилбензилсульфанил)циклогексил]этилкарбаминовой кислоты + (1S,2S,3S) диастереомера (1,20 г,2,30 ммоль) в 10 мл тетрагидрофурана и 20 мл жидкого аммиака обрабатывали в атмосфере аргона при 78 С натрием (106 мг, 4,60 ммоль) и перемешивали при -78 С в течение 1 ч. Затем добавляли твердый хлорид аммония и реакционную смесь нагревали до комнатной температуры, разбавляли тетрагидрофураном и продували азотом. Оставшуюся смесь фильтровали и концентрировали при пониженном давлении, в результате чего получали неочищенный сложный трет-бутиловый эфир [(1R,2R,3R)-2-(третбутилдиметилсиланилокси)-3-меркаптоциклогексил]этилкарбаминовой кислоты + (1S,2S,3S) диастереомер (количественный выход), который непосредственно использовали на следующей стадии.MC-ESI (m/z): 412 (MNa+), 801 (2MNa+). Стадия Е. 14-O-[(1R,2R,3R)-3-(трет-бутоксикарбонилэтиламино)-2-(трет-бутилдиметилсиланилокси)циклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер. Неочищенный сложный бутиловый эфир [(1R,2R,3R)-2-(трет-бутилдиметилсиланилокси)-3 меркаптоциклогексил]этилкарбаминовой кислоты + (1S,2S,3S) диастереомер (895 мг, 2,30 ммоль) растворяли в 30 мл тетрагидрофурана и последовательно обрабатывали плевромутилинтозилатом (979 мг,1,84 ммоль) и трет-бутоксидом калия (206 мг, 1,84 ммоль) и полученную смесь перемешивали в течение 16 ч при комнатной температуре. После выпаривания растворителя остаток разбавляли 1 н. HCl и трижды экстрагировали этилацетатом. Объединенные органические слои промывали раствором NaHCO3 и насыщенным раствором соли, осушали над сульфатом натрия и фильтровали. После хроматографии (диоксид кремния, циклогексан/этилацетат=10/1) получали 14-O-[(1R,2R,3R)-3-(трет-бутоксикарбонилэтиламино)-2-(трет-бутилдиметилсиланилокси)циклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер (Rf=0,5, 468 мг, выход 27%). 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 6,14 (дд, 1 Н, 19-Н, J=11 Гц и 18 Гц), 5,55 (д,1 Н, 14-Н, J=8 Гц), 5,05 (м, 2 Н, 20-Н), 4,49 (м, 1 Н, 11-ОН), 3,94 (м, 1 Н, 2'-Н), 3,43 (т, 1 Н, 11-Н, J=6 Гц),3,28, 3,04 (2 м, 5 Н, 1'-H, 22-H, NCH2), 2,40 (ушир.с, 1 Н, 4-Н), 1,40 (с, 9 Н, трет-бутил), 1,36, 1,35 (2 с, 3 Н,15-СН 3), 1,05 (с, 3 Н, 18-СН 3), 0,87 (с, 9 Н, Si-трет-бутил), 0,81 (д, 3 Н, 17-СН 3, J=7 Гц), 0,64, 0,62 (2 д, 3 Н,16-СН 3, J=7 Гц), 0,05, -0,05 (2 с, 6 Н, Si(CH3)2). Стадия 14-O-[(1R,2R,3R)-3-(трет-бутоксикарбонилэтиламино)-2-(трет-бутилдиметилсиланилокси)циклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер (468 мг, 0,624 ммоль) обрабатывали трифторуксусной кислотой в течение ночи согласно методу примера 1, стадия Е. После обработки и хроматографии реакционной смеси (диоксид кремния, этилацетат/метанол=1/2) получали 14-O[(1R,2R,3R)-3-этиламино-2-(трет-бутилдиметилсиланилокси)циклогексилсульфанил]ацетилмутилин +(1S,2S,3S) диастереомер (a) (Rf=0,6, 144 мг, выход 36%) и 14-O-[(1R,2R,3R)-3-этиламино-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер (b) (Rf=0,25, 177 мг, выход 53%) в виде бесцветных твердых веществ.MC-ESI (m/z): 536 (МН+), 558 (MNa+), 1071 (2 МН+), 1093 (2MNa+), 534 (М-Н)-. Пример 12. 14-O-[(1R,2R,3R)-3-диэтиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер. Стадия А. 14-O-[(1R,2R,3R)-3-диэтиламино)-2-(трет-бутилдиметилсиланилокси)циклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер. 14-O-[(1R,2R,3R)-3-этиламино-2-(трет-бутилдиметилсиланилокси)циклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер (144 мг, 0,222 ммоль) из примера 11, стадия F, обрабатывали ацетальдегидом (25 мкл, 0,444 ммоль) согласно методу примера 6. После обработки и хроматографии реакционной смеси (диоксид кремния, этилацетат/метанол=2/1) получали 14-O-[(1R,2R,3R)-3 диэтиламино)-2-(трет-бутилдиметилсиланилокси)циклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер (Rf=0,5, 110 мг, 73%) в виде бесцветного аморфного вспененного вещества. 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 6,14 (дд, 1 Н, 19-Н, J=11 Гц и 18 Гц), 5,53 (д,1 Н, 14-Н, J=7 Гц), 5,05 (м, 2 Н, 20-Н), 4,98 (м, 1 Н, 11-ОН), 3,97 (м, 1 Н, 2'-Н), 3,42 (т, 1 Н, 11-Н, J=6 Гц),3,24 (м, 2 Н, Н-22), 3,00 (м, 1 Н, 1'-Н), 2,70 (м, 1 Н, 3'-Н), 2,55 (м, 4 Н, NCH2), 2,40 (ушир.с, 1 Н, 4-Н), 1,36 (с,3 Н, 15-СН 3), 1,05 (с, 3 Н, 18-СН 3), 0,87 (м, 15 Н, NCH2CH3, Si-трет-бутил), 0,81 (д, 3 Н, 17-СН 3, J=7 Гц),0,62, 0,60 (2 д, 3 Н, 16-СН 3, J=7 Гц), 0,07 (с, 6 Н, Si(CH3)2). Стадия В. 14-O-[(1R,2R,3R)-3-диэтиламино-2-гидроксициклогексилсульфанил]ацетилмутилин +(1S,2S,3S) диастереомер. К раствору 14-O-[1R,2R,3R)-3-диэтиламино)-2-(трет-бутилдиметилсиланилокси)циклогексилсульфанил]ацетилмутилина + (1S,2S,3S) диастереомера (101 мг, 0,149 ммоль) в 5 мл тетрагидрофурана добавляли тетрабутиламмонийфторид (0,44 мл, 1 М в тетрагидрофуране, 0,447 ммоль). После перемешивания при комнатной температуре в течение 2 дней реакционную смесь концентрировали при пониженном давлении, разбавляли раствором NaHCO3 и дважды экстрагировали этилацетатом. Объединенные органические слои осушали над сульфатом натрия и фильтровали. Фильтрат подвергали хроматографии(диоксид кремния, этилацетат/метанол=1/2) и получали 14-O-[(1R,2R,3R)-3-диэтиламино-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,3S) диастереомер (Rf=0,2, 8 мг, выход 10%) в виде бесцветного аморфного вспененного вещества. 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 6,15, 6,14 (2 дд, 1 Н, 19-Н, J=11 Гц и 18 Гц),5,54 (д, 1 Н, 14-Н, J=8 Гц), 5,05 (м, 2 Н, 20-Н), 4,99, 4,42 (2 м, 2 Н, 11-ОН, 2'-ОН), 3,87 (м, 1 Н, 2'-Н), 3,42 (т,1 Н, 11-Н, J=6 Гц), 3,25 (м, 2 Н, Н-22), 3,05 (м, 1 Н, 1'-Н), 2,60 (м, 3 Н, 3'-Н, NCH2), 2,40 (ушир.с, 1 Н, 4-Н),1,35 (с, 3 Н, 15-СН 3), 1,05 (с, 3 Н, 18-СН 3), 0,90 (м, 6 Н, NCH2CH3), 0,81 (д, 3 Н, 17-СН 3, J=7 Гц), 0,62, 0,61(7S,8S) диастереомер. 7,8-эпокси-1,4-диокса-спиро[4.5]декан (Zhang, L.; Koreeda, М. Organic Letters 2002, 4(21), 37553758) (6,25 г, 40 ммоль) и плевромутилинтиол (8 г, 20 ммоль) обрабатывали согласно методу примера 1,стадия А 2. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=1/1) получали 14-O-[(7R,8R)-7-гидрокси-1,4-диокса-спиро[4.5]дец-8 илсульфанил]ацетилмутилин + (7S,8S) диастереомер (Rf=0,3, 8,40 г, выход 76%) в виде бесцветного аморфного вспененного вещества. 1MC-ESI (m/z): 573 (MNa+), 549 (М-Н)-. Или стадия А 2. 14-O-[(7R,8R)-7-гидрокси-1,4-диокса-спиро[4.5]дец-8 илсульфанил]ацетилмутилин + (7S,8S) диастереомер и 14-O-[(7R,8R)-8-гидрокси-1,4-диоксаспиро[4.5]дец-7-илсульфанил]ацетилмутилин + (7S,8S) диастереомер. 7,8-эпокси-1,4-диокса-спиро[4.5]декан (6,24 г, 39,95 ммоль) и плевромутилинтиол (16,4 г, 41,7 ммоль) обрабатывали согласно методу примера 1, стадия A3. После обработки и хроматографии реакционной смеси (диоксид кремния, этилацетат/толуол=1/1) получали смесь 14-O-[(7R,8R)-7-гидрокси-1,4 диокса-спиро[4.5]дец-8-илсульфанил]ацетилмутилина + (7S,8S) диастереомера, а также 14-O-[(7R,8R)8-гидрокси-1,4-диокса-спиро[4.5]дец-7-илсульфанил]ацетилмутилина + (7S,8S) диастереомера (Rf=0,24,4,40 г, выход 20%) в виде бесцветного твердого вещества. 1(7S,8S) диастереомера (8,4 г, 15,3 ммоль) со стадии А 1 в 50 мл диметилформамида обрабатывали третбутилдифенилсилилхлоридом (5,16 мл, 19,8 ммоль) и имидазолом (1,66 г, 24,4 ммоль) и перемешивали в течение ночи при 80 С. Реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли водой и насыщенным раствором соли и трижды экстрагировали этилацетатом. Объединенные органические слои промывали водой и насыщенным раствором соли, осушали над сульфатом натрия и фильтровали. После хроматографии (диоксид кремния, циклогексан/этилацетат=1/1) получали 14-O[(7R,8R)-7-(трет-бутилдифенилсиланилокси)-1,4-диокса-спиро[4.5]дец-8-илсульфанил]ацетилмутилинMC-ESI (m/z): 811 (MNa+). Стадия С. 14-O-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-4-оксоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер. 14-O-[(7R,8R)-7-(трет-бутилдифенилсиланилокси)-1,4-диокса-спиро[4.5]дец-8 илсульфанил]ацетилмутилин + (7S,8S) диастереомер (8,03 г, 10,2 ммоль) растворяли в 100 мл дихлорметана и обрабатывали монтмориллонитом K10 (10 г) в течение 3 дней при комнатной температуре. После фильтрования через целит реакционную смесь концентрировали при пониженном давлении и подвергали хроматографии (диоксид кремния, циклогексан/этилацетат=2/1) и получали 14-O-[(1R,2R)-2(трет-бутилдифенилсиланилокси)-4-оксоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомерD. 14-O-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-4-гидроксииминоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер. К раствору 14-O-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-4-оксоциклогексилсульфанил]ацетилмутилина + (1S,2S) диастереомера (2,50 г, 3,36 ммоль) в 10 мл диметилформамида добавляли гидрохлорид гидроксиламина (233 мг, 3,36 ммоль) и триэтиламин (0,47 мл, 3,36 ммоль) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, разбавляли водой и насыщенным раствором соли и трижды экстрагировали этилацетатом. Объединенные органические слои дважды промывали водой, осушали над сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении и получали неочищенный 14-O-[(1R,2R)-2-(третбутилдифенилсиланилокси)-4-гидроксииминоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер (количественный выход, циклогексан/этилацетат=2/1, Rf=0,25, 0,35), который использовали на следующей стадии без дополнительной очистки.(1S,2S,4R) диастереомер и 14-O-[(1R,2R,4R)-2-(третбутилдифенилсиланилокси)-4-гидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер. 14-O-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-4-гидроксииминоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер (2,55 г, 3,36 ммоль) растворяли в 10 мл уксусной кислоты и обрабатывали цианоборгидридом натрия (210 мг, 3,36 ммоль) в течение 90 мин при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли растворомNaHCO3 и трижды экстрагировали этилацетатом. Объединенные органические слои осушали над сульфатом натрия и фильтровали. Фильтрат подвергали хроматографии (диоксид кремния, циклогексан/этилацетат=2/3), в результате чего получали 14-O-[(1R,2R,4S)-2-(трет-бутилдифенилсиланилокси)4-гидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер (a) (Rf=0,5, 590 мг,выход 23%) и 14-O-[(1R,2R,4R)-2-(трет-бутилдифенилсиланилокси)-4-гидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер (b) (Rf=0,3, 670 мг, выход 26%).F. 14-О-[(1R,2R,4S)-2-(трет-бутилдифенилсиланилокси)-4-формилгидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер. К раствору 14-O-[(1R,2R,4S)-2-(трет-бутилдифенилсиланилокси)-4-гидроксиаминоциклогексилсульфанил]ацетилмутилина + (1S,2S,4R) диастереомера (474 мг, 0,622 ммоль) в 15 мл третбутилметилового простого эфира добавляли 2,2,2-трифторэтилформиат (594 мкл, 6,22 ммоль) и кипятили в колбе с обратным холодильником в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры и по каплям добавляли к 150 мл гептана. Выпавший осадок отделяли фильтрованием и получали 14-O-[(1R,2R,4S)-2-(трет-бутилдифенилсиланилокси)-4-формилгидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер (307 мг, выход 62%, циклогексан/этилацетат=1/3, Rf=0,5) в виде бесцветного твердого вещества. 1G. 14-O-[(1R,2R,4S)-4-(формилгидроксиамино)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер. 14-O-[(1R,2R,4S)-2-(трет-бутилдифенилсиланилокси)-4-формилгидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер (215 мг, 0,272 ммоль) в 10 мл тетрагидрофурана обрабатывали тетрабутиламмонийфторидом (1,36 мл, 1 М в ТГФ, 1,36 ммоль) и перемешивали в течение 24 ч при комнатной температуре. Реакционную смесь разбавляли смесью воды, раствора NaHCO3 и насыщенного раствора соли (1:1:1) и трижды экстрагировали этилацетатом. Объединенные органические слои осушали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток добавляли по каплям к 250 мл гептана. Выпавший осадок отделяли фильтрованием и получали 14-O[(1R,2R,4S)-4-(формилгидроксиамино)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер (97 мг, выход 65%, дихлорметан/метанол=9/1, Rf=0,4) в виде бесцветного твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 9,65, 9,25 (2 ушир.с, 1 Н, NOH), 8,2, 7,9 (2 с,1 Н, СНО), 6,13 (м, 1 Н, 19-Н), 5,54 (д, 1 Н, 14-Н, J=8 Гц), 5,05 (м, 2 Н, 20-Н), 4,49 (д, 1 Н, 11-ОН, J=6 Гц),3,42 (т, 1 Н, 11-Н, J=6 Гц), 2,40 (ушир.с, 1 Н, 4-H), 1,36 (с, 3 Н, 15-СН 3), 1,06 (с, 12 Н, 18-СН 3), 0,81 (д, 3 Н,17-СН 3, J=7 Гц), 0,63 (д, 3 Н, 16-СН 3, J=6 Гц).(1S,2S,5R) диастереомер. Стадия A. (7R,8R)-8-(2,4,6-триметилбензилсульфанил)-1,4-диокса-спиро[4.5]декан-7-ол + (7S,8S) диастереомер. 7,8-эпокси-1,4-диокса-спиро[4.5]декан (Zhang, L.; Koreeda, М. Organic Letters 2002, 4(21), 37553758) (22 г, 120 ммоль) обрабатывали 2,4,6-триметилбензилмеркаптаном (20 г, 120 ммоль) согласно методу примера 1, стадия А 2. После обработки и хроматографии реакционной смеси (диоксид кремния,циклогексан/этилацетат=2/1) получалиMC-ESI (m/z): 345 (MNa+), 667 (2MNa+). Стадия В. Сложный (7R,8R)-7-(2,4,6-триметилбензилсульфанил)-1,4-диокса-спиро[4.5]дец-8 иловый эфир уксусной кислоты + (7S,8S) диастереомер. К раствору трифенилфосфина (26,5 г, 101 ммоль) в 500 мл тетрагидрофурана в атмосфере аргона добавляли изопропилазодикарбоксилат (19,6 мл, 101 ммоль) и перемешивали в течение 30 мин. Затем добавляли (7R,8R)-8-(2,4,6-триметилбензилсульфанил)-1,4-диокса-спиро[4.5]декан-7-ол + (7S,8S) диастереомер (27,7 г, 86 ммоль) в 150 мл тетрагидрофурана и уксусную кислоту (7,7 мл, 135 ммоль) и реакционную смесь нагревали при 80 С в течение 24 ч. Полученную реакционную смесь концентрировали при пониженном давлении и подвергали хроматографии (диоксид кремния, циклогексан/этилацетат/метанол=3/1),в результате чего получали сложный(7R,8R)-7-(2,4,6 триметилбензилсульфанил)-1,4-диокса-спиро[4.5]дец-8-иловый эфир уксусной кислоты + (7S,8S) диастереомер (Rf=0,4, 7,0 г, выход 22%). 1MC-ESI (m/z): 387 (MNa+). Стадия С. (7R,8R)-7-меркапто-1,4-диокса-спиро[4.5]декан-8-ол + (7S,8S) диастереомер. Сложный (7R,8R)-7-(2,4,6-триметилбензилсульфанил)-1,4-диокса-спиро[4.5]дец-8-иловый эфир уксусной кислоты + (7S,8S) диастереомер (6,33 г, 17,4 ммоль) обрабатывали натрием (1,6 г, 69,5 ммоль) согласно методу примера 11, стадия D. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=1/1) получали (7R,8R)-7-меркапто-1,4-диокса-спиро[4.5]декан-8-ол +(7R,8R)-7-меркапто-1,4-диокса-спиро[4.5]декан-8-ол + (7S,8S) диастереомер (1,36 г, 7,15 ммоль) обрабатывали плевромутилинтозилатом (3,8 г, 7,15 ммоль) согласно методу примера 11, стадия Е. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=1/1) получали 14-O-[(7R,8R)-8-гидрокси-1,4-диокса-спиро[4.5]дец-7-илсульфанил]ацетилмутилин + (7S,8S) диастереомер (Rf=0,25, 1,90 г, 48%) в виде бесцветного аморфного вспененного вещества.MC-ESI (m/z): 573 (MNa+), 1123 (2MNa+), 549 (M-H)-, 585 (MCl-). Стадия Е. 14-O-[(7R,8R)-8-(трет-бутилдифенилсиланилокси)-1,4-диокса-спиро[4.5]дец-7 илсульфанил]ацетилмутилин + (7S,8S) диастереомер. 14-O-[(7R,8R)-8-гидрокси-1,4-диокса-спиро[4.5]дец-7-илсульфанил]ацетилмутилин + (7S,8S) диастереомер (1,90 г, 3,45 ммоль) обрабатывали согласно методу примера 13, стадия В. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=3/2) получали 14-O[(7R,8R)-8-(трет-бутилдифенилсиланилокси)-1,4-диокса-спиро[4.5]дец-7-илсульфанил]ацетилмутилин+ (7S,8S) диастереомер в виде бесцветного аморфного вспененного вещества. 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 7,7-7,35 (м, 10 Н, аромат.-Н), 6,13, 6,12 (2 дд,1 Н, 19-Н, J=11 Гц и 18 Гц), 5,53 (д, 1 Н, 14-Н, J=7 Гц), 5,05 (м, 2 Н, 20-Н), 4,50 (м, 1 Н, 11-ОН), 3,78 (м, 4 Н,ОСН 2 СН 2 О), 3,70 (м, 1 Н, 1'-Н), 3,42 (м, 1 Н, 11-Н), 3,05 (м, 3 Н, 2'-Н, 22-Н), 2,40 (ушир.с, 1 Н, 4-Н), 1,36,1,34 (2 с, 3 Н, 15-СН 3), 1,05 (с, 3 Н, 18-СН 3), 1,00 (с, 9 Н, Si-трет-бутил), 0,81 (д, 3 Н, 17-СН 3, J=7 Гц), 0,60,0,58 (2 д, 3 Н, 16-СН 3, J=7 Гц). СтадияF. 14-O-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-5-оксоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер. 14-O-[(7R,8R)-8-(трет-бутилдифенилсиланилокси)-1,4-диокса-спиро[4.5]дец-7 илсульфанил]ацетилмутилин + (7S,8S) диастереомер (1,65 г, 2,09 ммоль) обрабатывали согласно методу примера 13, стадия С. Неочищенный 14-O-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-5 оксоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер (1,34 г, выход 86%, циклогек- 19018707 сан/этилацетат=2/1, Rf=0,3) получали в виде бесцветного аморфного вспененного вещества, которое непосредственно использовали на следующей стадии. 1(1S,2S) диастереомер (1,34 г, 1,80 ммоль) обрабатывали согласно методу примера 13, стадия D. Неочищенный 14-O-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-5-гидроксииминоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер (количественный выход, циклогексан/этилацетат=1/1, Rf=0,6) получали в виде бесцветного аморфного вспененного вещества, которое непосредственно использовали на следующей стадии. Стадия Н. 14-O-[(1R,2R,5S)-2-(трет-бутилдифенилсиланилокси)-5-гидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер и 14-O-[(1R,2R,5R)-2-(трет-бутилдифенилсиланилокси)-5-гидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,5S) диастереомер. 14-O-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-5-гидроксииминоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер (2,55 г, 3,36 ммоль) обрабатывали согласно методу примера 13,стадия Е. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=1/3) получали 14-O-[(1R,2R,5S)-2-(трет-бутилдифенилсиланилокси)-5-гидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (a) (Rf=0,4, 220 мг, выход 16%) и 14O-[(1R,2R,5R)-2-(трет-бутилдифенилсиланилокси)-5-гидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,5S) диастереомер (b) (Rf=0,25, 560 мг, выход 41%).I. 14-О-[(1R,2R,5S)-2-(трет-бутилдифенилсиланилокси)-5-формилгидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер. 14-O-[(1R,2R,5S)-2-(трет-бутилдифенилсиланилокси)-5-гидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (215 мг, 0,282 ммоль) обрабатывали согласно методу примера 13, стадия F. После выделения выпавшего осадка фильтрованием получили 14-O-[(1R,2R,5S)-2-(третбутилдифенилсиланилокси)-5-формилгидроксиаминоциклогексилсульфанил]ацетилмутилин(1S,2S,5R) диастереомер (135 мг, выход 61%, циклогексан/этилацетат=1/3, Rf=0,65) в виде бесцветного твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 9,8, 9,3 (2 ушир.с, 1 Н, NOH), 8,2, 7,9 (2 ушир.с, 1 Н, СНО), 7,60-7,35 (м, 10 Н, аромат.-Н), 6,11, 6,09 (2 дд, 1 Н, 19-Н, J=11 Гц и 18 Гц), 5,50 (д, 1 Н,14-Н, J=8 Гц), 5,00 (м, 2 Н, 20-Н), 4,47 (д, 1 Н, 11-ОН, J=6 Гц), 3,40 (т, 1 Н, 11-Н, J=6 Гц), 2,37 (ушир.с, 1 Н,4-Н), 1,32, 1,30 (2 с, 3 Н, 15-СН 3), 1,03 (с, 12 Н, 18-СН 3, Si-трет-бутил), 0,82, 0,80 (д, 3 Н, 17-СН 3, J=7 Гц),0,55 (д, 3 Н, 16-СН 3, J=6 Гц). СтадияJ. 14-O-[(1R,2R,5S)-5-(формилгидроксиамино)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер. 14-O-[(1R,2R,5S)-2-(трет-бутилдифенилсиланилокси)-5-формилгидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (130 мг, 0,164 ммоль) обрабатывали согласно методу примера 13, стадия G. После выделения выпавшего осадка фильтрованием получили 14-O[(1R,2R,5S)-5-(формилгидроксиамино)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (77 мг, выход 85%, дихлорметан/метанол=9/1, Rf=0,4) в виде бесцветного твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 9,7, 9,3 (2 ушир.с, 1 Н, NOH), 8,2, 7,9 (2 с, 1 Н,СНО), 6,13 (дд, 1 Н, 19-Н, J=11 Гц и 18 Гц), 5,53 (д, 1 Н, 14-Н, J=8 Гц), 5,06 (м, 2 Н, 20-Н), 4,91 (д, 1 Н, 2'ОН), 4,49 (д, 1 Н, 11-ОН, J=6 Гц), 4,2, 3,7 (2 м, 2 Н, 2'-Н, 5'-Н), 3,41 (т, 1 Н, 11-Н, J=6 Гц), 3,28 (м, 2 Н, 22-Н),3,13 (м, 1 Н, 1'-Н), 2,40 (ушир.с, 1 Н, 4-Н), 1,35 (с, 3 Н, 15-СН 3), 1,06 (с, 12 Н, 18-СН 3), 0,81 (д, 3 Н, 17-СН 3,- 20018707(6S,7S) диастереомер. 6,7-эпокси-1,4-диокса-спиро[4.5]декан (Vankar, Y.D.; Reddy M.V.; Chaudhuri, N.C. Tetrahedron 1994,50(37), 11057-11078) (16,24 г, 104 ммоль) и плевромутилинтиол (20,5 г, 52 ммоль) обрабатывали согласно методу примера 1, стадия А 1. После обработки и хроматографии реакционной смеси (диоксид кремния,циклогексан/диоксан=2/1) получали 14-O-[(6R,7R)-6-гидрокси-1,4-диокса-спиро[4.5]дец-7 илсульфанил]ацетилмутилин + (6S,7S) диастереомер (Rf=0,5, 15,6 г, выход 55%) в виде бесцветного аморфного вспененного вещества. 1H ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 6,13 (дд, 1 Н, 19-Н, J=11 Гц и 18 Гц), 5,53 (д,1 Н, 14-Н, J=7 Гц), 5,05 (м, 2 Н, 20-Н), 4,90 (м, 1 Н, 2'-ОН), 4,47 (м, 1 Н, 11-ОН), 3,97 (м, 1 Н, 2'-Н), 3,32 (м,1 Н, 11-Н), 3,50-3,20 (м, 2 Н, 22-Н), 2,80 (м, 1 Н, 1'-Н), 2,40 (ушир.с, 1 Н, 4-Н), 1,35, 1,34 (2 с, 3 Н, 15-СН 3),1,05 (с, 3 Н, 18-СН 3), 0,81 (д, 3 Н, 17-СН 3, J=7 Гц), 0,62 (д, 3 Н, 16-СН 3, J=6 Гц). Стадия В. 14-O-[(1R,2R)-2-гидрокси-3-оксоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер. 14-O-[(6R,7R)-6-гидрокси-1,4-диокса-спиро[4.5]дец-7-илсульфанил]ацетилмутилин + (6S,7S) диастереомер (15,6 г, 28,4 ммоль) обрабатывали согласно методу примера 13, стадия С. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=1/1) получали 14-O[(1R,2R)-2-гидрокси-3-оксоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер (Rf=0,4, 3,14 г, выход 22%) в виде бесцветного аморфного вспененного вещества. 1(3,14 г, 6,19 ммоль) обрабатывали согласно методу примера 13, стадия D. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=1/1) получали 14-O-[(1R,2R)-2 гидрокси-3-гидроксииминоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер (Rf=0,2,1,75 г, выход 54%) в виде бесцветного аморфного вспененного вещества. 1D. 14-O-[(1R,2R,3R/S)-2-гидрокси-3-гидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,3R/S) диастереомер. 14-O-[(1R,2R)-2-гидрокси-3-гидроксииминоциклогексилсульфанил]ацетилмутилин + (1S,2S) диастереомер (1,75 г, 3,35 ммоль) обрабатывали согласно методу примера 13, стадия Е. После обработки и хроматографии реакционной смеси (диоксид кремния, этилацетат/метанол=10/1) получали 14-O[(1R,2R,3R/S)-2-гидрокси-3-гидроксиаминоциклогексилсульфанил]ацетилмутилин + (1S,2S,3R/S) диастереомер (Rf=0,2, 1,34 г, выход 65%) в виде бесцветного аморфного вспененного вещества. 1 Н ЯМР (400 МГц, ДМСО-d6, , м.д., помимо прочего): 7,1 (ушир.с, 1 Н, NH/OH), 6,12, 6,11 (2 дд, 1 Н,19-Н, J=11 Гц и 18 Гц), 5,53 (д, 1 Н, 14-Н, J=8 Гц), 5,05 (м, 2 Н, 20-Н), 4,90 (м, 1 Н, 2'-ОН), 4,5 (м, 1 Н, 11 ОН), 3,41 (т, 1 Н, 11-Н, J=6 Гц), 3,73, 3,53, 3,30, 3,14, 3,01, 2,87 (6 м, 5 Н, 1'-Н, 2'-Н, 3'-Н, 22-Н), 2,40(1S,2S,3R/S) диастереомер (899 мг, 1,72 ммоль) обрабатывали согласно методу примера 13, стадия F. После отделения осадка фильтрованием получали 14-O-[(1R,2R,3R/S)-3-(формилгидроксиамино)-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,3R/S) диастереомер (724 мг, выход 76%, дихлорметан/метанол=9/1, Rf=0,5) в виде бесцветного твердого вещества. 1Helvetica Chimica Acta 2004, 87, 2764-2789) (3 г, 15,2 ммоль) и метилйодид (0,95 мл, 15,2 ммоль) обрабатывали в течение 1 ч согласно методу примера 7, стадия А. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат + 10/1) получали указанное в заголовке соединение(Rf=0,22, 2,04 г, выход 64%) в виде бесцветного твердого вещества. 1 Н ЯМР (200 МГц, CDCl3, , м.д.): 5,64 (ушир.с, 2 Н, двойная связь), 4,17 (ушир.с, 1 Н, NCH), 2,74 (с,3 Н, NCH3), 2,13, 1,70 (2 м, 6 Н), 1,47 (с, 9 Н, трет-бутил). Стадия В. Сложный трет-бутиловый эфир N-метил-N-(цис-3,4-эпоксициклогексил)карбаминовой кислоты. Сложный трет-бутиловый эфир N-метил-N-(циклогекс-3-енил)карбаминовой кислоты (2 г, 9,5 ммоль) и 3-хлорнадбензойную кислоту (2,2 г, 70%, 8,9 ммоль) обрабатывали в течение 1 ч согласно методу примера 7, стадия В. После обработки получали неочищенное соединение, указанное в заголовке(диоксид кремния, циклогексан/этилацетат=3/1, Rf=0,25, 1,79 г, выход 79%). 1 Н ЯМР (200 МГц, CDCl3, , м.д.): 4,0 (ушир.с, 1 Н, NCH), 3,15 (ушир.с, 2H, эпоксид), 2,67 (с, 3 Н,NCH3), 2,30-1,10 (м, 6 Н), 1,47 (с, 9 Н, трет-бутил). Стадия С. 14-O-[(1R,2R,5S)-5-(трет-бутоксикарбонилметиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер. Сложный трет-бутиловый эфир N-метил-N-(цис-3,4-эпоксициклогексил)карбаминовой кислоты (1,7 г, 7,5 ммоль) обрабатывали плевромутилинтиолом (2,95 г, 7,5 ммоль) согласно методу примера 1, стадияA3. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=2/1) получали 14-O-[(1R,2R,5S)-5-(трет-бутоксикарбонилметиламино)-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (Rf=0,23, 1,3 г, выход 28%) в виде бесцветного твердого вещества. 1(1S,2S,5R) диастереомер. 14-O-[(1R,2R,5S)-5-(трет-бутоксикарбонилметиламино)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (1,3 г, 2,1 ммоль) обрабатывали согласно методу примера 1,стадия В. После обработки и хроматографии реакционной смеси (диоксид кремния, дихлорметан/метанол/изопропанол/вода/уксусная кислота=80/20/6/3/2) с последующей экстракцией основанием получали 14-О-[(1R,2R,5S)-2-гидрокси-5-метиламиноциклогексилсульфанил]ацетилмутилин(1S,2S,5R) диастереомер (Rf=0,4, 690 мг, 63%) в виде бесцветного твердого вещества. 1(с, 3 Н, NCH3), 1,37 (с, 3 Н, 15-СН 3), 1,06 (с, 3 Н, 18-СН 3), 0,82 (д, 3 Н, 17-СН 3, J=7 Гц), 0,64 (д, 3 Н, 16-СН 3,J=7 Гц). Стадия Е. Гидрохлорид 14-O-[(1R,2R,5S)-2-гидрокси-5-метиламиноциклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,5R) диастереомера. 14-О-[(1R,2R,5S)-2-гидрокси-5-метиламиноциклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (690 мг, 1,32 ммоль) обрабатывали согласно методу примера 1, стадия С, и получали гидрохлорид 14-O-[(1R,2R,5S)-2-гидрокси-5-метиламиноциклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,5R) диастереомера (731 мг, количественный выход) в виде бесцветного твердого вещества. 1Helvetica Chimica Acta 2004, 87, 2764-2789) (3 г, 15,2 ммоль) и аллилйодид (1,4 мл, 15,2 ммоль) обрабатывали в течение ночи согласно методу примера 7, стадия А. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=10/1) получали указанное в заголовке соединение (Rf=0,55, 2,0 г, выход 55%) в виде бесцветного твердого вещества. 1(ушир.с, 1 Н, NCH), 2,14, 1,74 (2 м, 6 Н), 1,45 (с, 9 Н, трет-бутил). Стадия В. Сложный трет-бутиловый эфир N-аллил-N-(цис-3,4-эпоксициклогексил)карбаминовой кислоты. Сложный трет-бутиловый эфир N-аллил-N-(циклогекс-3-енил)карбаминовой кислоты (2 г, 8,4 ммоль) и 3-хлорнадбензойную кислоту (2,2 г, 70%, 8,9 ммоль) обрабатывали в течение ночи согласно методу примера 7, стадия В. После обработки получали неочищенное указанное в заголовке соединение(ушир.с, 2 Н, эпоксид), 2,30-1,20 (м, 6 Н), 1,47 (с, 9 Н, трет-бутил). Стадия С. 14-O-[(1R,2R,5S)-5-(трет-бутоксикарбонилаллиламино)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер. Сложный трет-бутиловый эфир N-аллил-N-(цис-3,4-эпоксициклогексил)карбаминовой кислоты (1,9 г, 7,5 ммоль) обрабатывали плевромутилинтиолом (2,95 г, 7,5 ммоль) согласно методу примера 1, стадия А 2. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=3/1-1/1) получали смесь 14-O-[(1R,2R,5S)-5-(трет-бутоксикарбонилаллиламино)-2 гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,5R) диастереомера и плевромутилиндисульфида (циклогексан/этилацетат=1/1, Rf=0,21, 2,49 г). 1(1S,2S,5R) диастереомер. Смесь 14-O-[(1R,2R,5S)-5-(трет-бутоксикарбонилаллиламино)-2-гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,5R) диастереомера и плевромутилиндисульфида (2,4 г) обрабатывали согласно методу примера 1, стадия В. После обработки и хроматографии реакционной смеси (диоксид кремния,дихлорметан/метанол/изопропанол/вода/уксусная кислота=80/20/6/3/2) с последующей экстракцией основанием получали 14-О-[(1R,2R,5S)-5-аллиламино-2-гидроксициклогексилсульфанил]ацетилмутилин+ (1S,2S,5R) диастереомер (Rf=0,5, 250 мг) в виде бесцветного твердого вещества. 1MC-ESI (m/z): 548 (МН+), 546 (М-Н)-, 582 (MCl-). Стадия Е. Гидрохлорид 14-O-[(1R,2R,5S)-5-аллиламино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,5R) диастереомера. 14-О-[(1R,2R,5S)-5-аллиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (250 мг, 0,46 ммоль) обрабатывали согласно методу примера 1, стадия С, и получали гидрохлорид 14-O-[(1R,2R,5S)-2-гидрокси-5-этиламиноциклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,5R) диастереомера (273 мг, количественный выход без поправок) в виде бесцветного твердого вещества. 1Helvetica Chimica Acta 2004, 87, 2764-2789) (3 г, 15,2 ммоль) и 2-бромэтилметиловый простой эфир (1,43 мл, 15,2 ммоль) обрабатывали в течение ночи согласно методу примера 7, стадия А. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=7/1) получали указанное в заголовке соединение (Rf=0,33, 1,2 г, выход 31%) в виде бесцветного твердого вещества. 1N-(2-метоксиэтил)-N-(цис-3,4 эпоксициклогексил)карбаминовой кислоты. Сложный трет-бутиловый эфир N-(2-метоксиэтил)-N-(циклогекс-3-енил)карбаминовой кислоты (1,2 г, 4,7 ммоль) и 3-хлорнадбензойную кислоту (1,2 г, 70%, 4,87 ммоль) обрабатывали в течение двух дней согласно методу примера 7, стадия В. После обработки получали неочищенное указанное в заголовке соединение (диоксид кремния, циклогексан/этилацетат=3/1, Rf=0,33, 1,08 г, выход 85%). 1 Н ЯМР (200 МГц, CDCl3, , м.д.): 3,94 (ушир.с, 1 Н, NCH), 3,50-3,05 (м, 9 Н, NCH2CH2OCH3, эпоксид), 2,30-1,20 (м, 6 Н), 1,45 (с, 9 Н, трет-бутил). Стадия С. 14-O-[(1R,2R,5S)-5-(трет-бутоксикарбонил)-2-(метоксиэтиламино)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер. Сложный трет-бутиловый эфир N-(2-метоксиэтил)-N-(цис-3,4-эпоксициклогексил)карбаминовой кислоты (1,08 г, 4,0 ммоль) обрабатывали плевромутилинтиолом (1,57 г, 4,0 ммоль) согласно методу примера 1, стадия А 2. После обработки и хроматографии реакционной смеси (диоксид кремния, циклогексан/этилацетат=1/2) получали 14-O-[(1R,2R,5S)-5-(трет-бутоксикарбонил)-2-(метоксиэтиламино)-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (Rf=0,5, 500 мг, выход 19%) в виде бесцветного твердого вещества. 1D. 14-O-[(1R,2R,5S)-2-гидрокси-5-(2-метоксиэтиламино)циклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер. 14-О-[(1R,2R,5S)-5-(трет-бутоксикарбонил)-2-(метоксиэтиламино)-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (500 мг, 0,75 ммоль) обрабатывали согласно методу примера 1, стадия В. После обработки и хроматографии реакционной смеси (диоксид кремния, дихлорметан/метанол/изопропанол/вода/уксусная кислота=80/20/6/3/2) с последующей экстракцией основанием получали 14-О-[(1R,2R,5S)-2-гидрокси-5-(2-метоксиэтиламино)циклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (Rf=0,6, 330 мг, 78%) в виде бесцветного твердого вещества. 1(1S,2S,5R) диастереомер (330 мг, 0,58 ммоль) обрабатывали согласно методу примера 1, стадия С, и получали гидрохлорид 14-О-[(1R,2R,5S)-2-гидрокси-5-(2-метоксиэтиламино)циклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,5R) диастереомера (335 мг, количественный выход, без поправок) в виде бесцветного твердого вещества. 1 Пример 19. Гидрохлорид 14-O-[(1R,2R,4R)-2-гидрокси-4-(2-гидроксиэтиламино)циклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,4S) диастереомера. Стадия А. 14-O-[(1R,2R,4R/S)-2-(трет-бутилдифенилсиланилокси)-4-(2-гидроксиэтиламино)циклогексилсульфанил]ацетилмутилин + (1S,2S,4R/S) диастереомер. К раствору 14-О-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-4-оксоциклогексилсульфанил]ацетилмутилина + (1S,2S) диастереомера (1,50 г, 2,01 ммоль) из примера 13, стадия С, в 20 мл дихлорметана добавляли этаноламин (0,12 мл, 2,01 ммоль) и изопропоксид титана(IV) (0,7 мл, 2,52 ммоль) и перемешивали в течение 2 ч при комнатной температуре. Полученную реакционную смесь обрабатывали цианоборгидридом натрия (126 мг, 2 ммоль) в течение ночи при комнатной температуре, разбавляли дополнительным количеством дихлорметана и экстрагировали раствором NaHCO3. Органический слой осушали над сульфатом натрия и фильтровали. Фильтрат подвергали хроматографии (диоксид кремния,дихлорметан/метанол=30/1),в результате чего получали 14-O-[(1R,2R,4R/S)-2-(третбутилдифенилсиланилокси)-4-(2-гидроксиэтиламино)циклогексилсульфанил]ацетилмутилин + гидрохлорид (1S,2S,4R/S) диастереомер (Rf=0,3, 230 мг, выход 14%). 1MC-ESI (m/z): 790 (МН+), 824 (MCl-). Стадия В. 14-O-[(1R,2R,4R)-2-гидрокси-4-(2-гидроксиэтиламино)циклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер. К раствору 14-O-[(1R,2R,4R/S)-2-(трет-бутилдифенилсиланилокси)-4-(2-гидроксиэтиламино)циклогексилсульфанил]ацетилмутилина + (1S,2S,4R/S) диастереомера (230 мг, 0,29 ммоль) в 15 мл ацетонитрила добавляли HF (40% водный раствор, 2 капли) и перемешивали в течение ночи при комнатной температуре. В реакционную смесь добавляли раствор NaHCO3 и экстрагировали дихлорметаном. Объединенные органические слои осушали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. После хроматографии (диоксид кремния, дихлорметан/метанол=6/1) получали указанное в заголовке соединение (Rf=0,4, 50 мг, выход 31%). 1 Н ЯМР (400 МГц, CDCl3, , м.д., помимо прочего): 6,48 (дд, 1 Н, 19-Н, J=11 Гц и 17 Гц), 5,76, 5,68(1S,2S,4S) диастереомер (50 мг, 0,091 ммоль) обрабатывали согласно методу примера 1, стадия С, и получали гидрохлорид 14-O-[(1R,2R,4R)-2-гидрокси-4-(2-гидроксиэтиламино)циклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,4S) диастереомера (43 мг, выход 80%) в виде бесцветного твердого вещества. 1 Н ЯМР (500 МГц, CDCl3, , м.д., помимо прочего): 6,46 (дд, 1 Н, 19-Н, J=11 Гц и 17 Гц), 5,76 (д, 1 Н,14-Н, J=8 Гц), 5,37 (д, 1 Н, 20-Н, J=11 Гц), 5,23 (д, 1 Н, 20-Н, J=17 Гц), 3,95 (м, 2 Н, NCH2CH2OH, J=5 Гц),3,58 (м, 1 Н, 2'-Н), 3,40-3,10 (м, 5 Н, 11-Н, 22 Н, NCH2CH2OH), 2,72 (м, 1 Н, 1'-Н), 2,11 (ушир.с, 1H, 4-Н),1,46 (с, 3 Н, 15-СН 3), 1,18 (с, 3 Н, 18-СН 3), 0,89 (д, 3 Н, 17-СН 3, J=7 Гц), 0,73 (д, 3 Н, 16-СН 3, J=7 Гц).MC-ESI (m/z): 552 (МН+), 586 (MCl-). Пример 20. Гидрохлорид 14-O-[(1R,2R,4R)-4-циклогексиламино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,4S) диастереомера. Стадия А. 14-О-[(1R,2R,4R)-2-(трет-бутилдифенилсиланилокси)-4-(2-гидроксиэтиламино)циклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер. Осуществили взаимодействие 14-O-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-4-оксоциклогексилсульфанил]ацетилмутилина + (1S,2S) диастереомера (1,50 г, 2,01 ммоль) из примера 13, стадия С,с циклогексиламином (0,23 мл, 1,01 ммоль) согласно методу примера 19, стадия А. После обработки и хроматографии реакционной смеси (диоксид кремния, дихлорметан/метанол=30/1) получили 14-O[(1R,2R,4R)-2-(трет-бутилдифенилсиланилокси)-4-циклогексиламиноциклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер (Rf=0,13, 150 мг, выход 9%). 1(1S,2S,4S) диастереомер. 14-O-[(1R,2R,4R)-2-(трет-бутилдифенилсиланилокси)-4 циклогексиламиноциклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер (100 мг, 0,121 ммоль) обрабатывали HF (40% водный раствор, 30 капель) в течение 5 ч согласно методу примера 19,стадия В. После обработки и хроматографии реакционной смеси (диоксид кремния, дихлорметан/метанол=10/1) получали указанное в заголовке соединение (Rf=0,13, 23 мг, выход 32%). 1(1S,2S,4S) диастереомер (23 мг, 0,039 ммоль) обрабатывали согласно методу примера 1, стадия С, и получали гидрохлорид 14-O-[(1R,2R,4R)-4-циклогексил-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,4S) диастереомера (26 мг, количественный выход, без поправок) в виде бесцветного твердого вещества. 1 Н ЯМР (500 МГц, CDCl3, , м.д., помимо прочего): 9,3 (ушир.с, 2 Н, NH2+), 6,46 (дд, 1 Н, 19-Н, J=11 Гц и 17 Гц), 5,75 (д, 1 Н, 14-Н, J=8 Гц), 5,38 (д, 1 Н, 20-Н, J=12 Гц), 5,22 (д, 1 Н, 20-Н, J=17 Гц), 3,50-3,00(1S,2S,4S) диастереомер. Стадия А. 14-O-[(1R,2R,4R)-2-(трет-бутилдифенилсиланилокси)-4-циклопропиламиноциклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер. Осуществляли взаимодействие 14-O-[(1R,2R)-2-(трет-бутилдифенилсиланилокси)-4 оксоциклогексилсульфанил]ацетилмутилина + (1S,2S) диастереомера (750 мг, 1,01 ммоль) из примера 13, стадия С, с циклопропиламином (0,07 мл, 1,01 ммоль) в 40 мл дихлорметана согласно методу примера 19, стадия А. После обработки цианоборгидридом натрия добавляли этанол (0,7 мл) и смесь перемешивали в течение ночи при комнатной температуре. После обработки и хроматографии реакционной смеси (диоксид кремния, дихлорметан/метанол=30/1) получали 14-O-[(1R,2R,4R)-2-(третбутилдифенилсиланилокси)-4-циклопропиламиноциклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер (Rf=0,35, 283 мг, выход 36%). 1MC-ESI (m/z): 786 (МН+), 784 (М-Н)-. Стадия В. 14-O-[(1R,2R,4R)-4-циклопропиламино-2 гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер. 14-O-[(1R,2R,4R)-2-(трет-бутилдифенилсиланилокси)-4 циклопропиламиноциклогексилсульфанил]ацетилмутилин + (1S,2S,4S) диастереомер (223 мг, 0,284 ммоль) обрабатывали в течение ночи тетрабутиламмонийфторидом согласно методу примера 13, стадияG. После обработки и хроматографии реакционной смеси (диоксид кремния, дихлорметан/метанол=10/1) получали указанное в заголовке соединение (Rf=0,2, 10 мг, выход 6%). 1(7S,8S) диастереомер (3,96 г, 7,19 ммоль) растворяли в 50 мл диоксана и обрабатывали 4 н. HCl (5 мл,20 ммоль) в течение 6 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, обрабатывали раствором NaHCO3 и трижды экстрагировали этилацетатом. Органические слои осушали над сульфатом натрия и подвергали хроматографии (диоксид кремния, циклогексан/диоксан=2/1) и получали смесь указанных в заголовке соединений (Rf=0,30, 860 мг, выход 24%). 1(1S,2S) диастереомера и 14-O-[(1R,2R)-2-гидрокси-5 оксоциклогексилсульфанил]ацетилмутилина + (1S,2S) диастереомера (250 мг, 0,493 ммоль) с циклопропиламином (0,03 мл, 0,493 ммоль) в 15 мл дихлорметана согласно методу примера 19, стадия А. После обработки цианоборгидридом натрия добавляли этанол (0,7 мл) и смесь перемешивали в течение ночи при комнатной температуре. После обработки и хроматографии реакционной смеси (диоксид кремния,дихлорметан/метанол=20/1) получали 14-O-[(1R,2R,5S)-4-циклопропиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (а) (дихлорметан/метанол=10/1, Rf=0,22, 34 мг,выход 13%) и 14-O-[(1R,2R,4S)-4-циклопропиламино-2-гидроксициклогексилсульфанил]ацетилмутилин + (1S,2S,4R) диастереомер (b) (дихлорметан/метанол=10/1, Rf=0,13, 26 мг, выход 4%).(1S,2S,5R) диастереомер (34 мг, 0,062 ммоль) обрабатывали согласно методу примера 1, стадия С, и получали гидрохлорид 14-O-[(1R,2R,5R)-4-циклопропиламино-2-гидроксициклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,5S) диастереомера (24 мг, выход 66%) в виде бесцветного твердого вещества. 1(1S,2S,4R) диастереомер (10 мг, 0,018 ммоль) из примера 21, стадия В, обрабатывали согласно методу примера 1, стадия С, и получали указанное в заголовке соединение (20 мг, количественный выход, без поправок) в виде бесцветного твердого вещества. 1(270 мг, 0,533 ммоль) из примера 22, стадия А, обрабатывали морфолином (0,05 мл, 0,533 ммоль) в 10 мл дихлорметана согласно методу примера 19, стадия А. После добавления цианоборгидрида натрия добавляли этанол (0,6 мл) и смесь перемешивали в течение ночи при комнатной температуре. После обработки и хроматографии реакционной смеси (диоксид кремния, дихлорметан/метанол=20/1) получали 14-O[(1R,2R,5R)-2-гидрокси-5-морфолин-4-илциклогексилсульфанил]ацетилмутилин + (1S,2S,5S) диастереомер (а) (дихлорметан/метанол=10/1, Rf=0,32, 23 мг, выход 7%) и 14-O-[(1R,2R,5S)-2-гидрокси-5 морфолин-4-илциклогексилсульфанил]ацетилмутилин + (1S,2S,5R) диастереомер (b) (дихлорметан/метанол=10/1), Rf=0,27, 40 мг, выход 13%).(1S,2S,5S) диастереомер (10 мг, 0,017 ммоль) обрабатывали согласно методу примера 1, стадия С, и получали гидрохлорид 14-O-[(1R,2R,5R)-2-гидрокси-5-морфолин-4-илциклогексилсульфанил]ацетилмутилина + гидрохлорид (1S,2S,5S) диастереомера (20 мг, количественный выход, без поправок) в виде бесцветного твердого вещества. 1(1S,2S,5R) диастереомер (26 мг, 0,045 ммоль) из примера 24, стадия А, обрабатывали согласно методу примера 1, стадия С, и получали указанное в заголовке соединение (15 мг, выход 54%) в виде бесцветного твердого вещества. 1MC-ESI (m/z): 578 (МН+), 600 (MNa+), 612 (MCl-). Пример 26. Гидрохлорид 14-O-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетил-19,20 дигидромутилина + гидрохлорид (1S,2S,5R) диастереомера. Стадия A. 14-O-[(1R,2R,5S)-5-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетил-19,20-дигидромутилин + (1S,2S,5R) диастереомер. К раствору 14-O-[(1R,2R,5S)-5-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетилмутилина + (1S,2S,5R) диастереомера (1 г, 1,65 ммоль) из примера 1, стадия А, в 20 мл этанола добавляли палладий на угле (10%, 515 мг, 0,48 ммоль) и гидрировали в течение ночи при комнатной температуре. Реакционную смесь обрабатывали дихлорметаном, фильтровали и фильтрат концентрировали досуха при пониженном давлении, в результате чего получали 14-O-[(1R,2R,5S)-5-третбутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетил-19,20-дигидромутилин + (1S,2S,5R) диастереомер (1 г, количественный выход) в виде бесцветного твердого вещества.MC-ESI (m/z): 632 (MNa+). Стадия В. 14-O-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетил-19,20 дигидромутилин + (1S,2S,5R) диастереомер. 14-O-[(1R,2R,5S)-5-трет-бутоксикарбониламино-2-гидроксициклогексилсульфанил]ацетил-19,20 дигидромутилин + (1S,2S,5R) диастереомер (1 г, 1,64 ммоль) обрабатывали согласно методу примера 1,стадия В. После обработки и хроматографии реакционной смеси (диоксид кремния,этилацетат/метанол/35% раствор аммиака=33/66/1) получали 14-O-[(1R,2R,5S)-5-амино-2 гидроксициклогексилсульфанил]ацетил-19,20-дигидромутилин + (1S,2S,5R) диастереомер (Rf=0,35,590 мг, выход 71%) в виде бесцветного твердого вещества. 1(м, 6 Н, 16-СН 3, 20-Н). Стадия С. Гидрохлорид 14-O-[(1R,2R,5S)-5-амино-2-гидроксициклогексилсульфанил]ацетил 19,20-дигидромутилина + гидрохлорид (1S,2S,5R) диастереомера 14-O-[(1R,2R,5S)-5-амино-2 гидроксициклогексилсульфанил]ацетил-19,20-дигидромутилин + (1S,2S,5R) диастереомер (590 мг, 1,16 ммоль) обрабатывали согласно методу примера 1, стадия С, и получали гидрохлорид 14-О-[(1R,2R,5S)5-амино-2-гидроксициклогексилсульфанил]ацетил-19,20-дигидромутилина + гидрохлорид (1S,2S,5R) диастереомера (566 мг, выход 89%) в виде бесцветного твердого вещества. 1MC-ESI (m/z): 510 (МН+), 544 (MCl-). Пример 27. Гидрохлорид 14-O-[(1R,2R,5S)-5-этиламино-2-гидроксициклогексилсульфанил]ацетил-19,20 дигидромутилина + гидрохлорид (1S,2S,5R) диастереомера. Стадия А. 19,20-Дигидроплевромутилинтиол. Раствор 19,20-дигидроплевромутилинтозилата (Egger, Н.; Reinshagen, H. Journal of Antibiotics 1976,29, 915-927) (11,5 г, 22,2 ммоль) в 50 мл ацетона обрабатывали мочевиной (1,69 г, 22,2 ммоль) при кипячении в колбе с обратным холодильником в течение 1,5 ч. Реакционную смесь выпаривали досуха при пониженном давлении и растворяли в этаноле. В раствор добавляли метабисульфит натрия (4,57 г, 24,0 ммоль), растворенный в 20 мл воды, и 100 мл этилацетат. Двухфазную смесь кипятили в колбе с обратным холодильником в течение 1,5 ч при интенсивном перемешивании. После охлаждения до комнатной температуры фазы разделяли и водную фазу трижды экстрагировали этилацетатом. Объединенные органические слои осушали над сульфатом натрия, фильтровали и растворитель выпаривали при пониженном давлении. После хроматографии (диоксид кремния, циклогексан/этилацетат=2/1) получали 19,20 дигидроплевромутилинтиол (циклогексан/этилацетат=4/3, Rf=0,24, 3 г, выход 34%). 1 Н ЯМР (500 МГц, ДМСО-d6, , м.д., помимо прочего): 5,53 (д, 1 Н, 14-Н, J=8 Гц), 4,40 (д, 1 Н, 11 ОН, J=6 Гц), 3,36 (т, 1 Н, 11-Н, J=6 Гц), 3,25 (м, 2 Н, 22-Н), 2,85 (т, 1 Н, CH, J=8 Гц), 2,38 (ушир.с, 1 Н, 4-Н),1,37 (с, 3 Н, 15-СН 3), 0,87 (с, 3 Н, 18-СН 3), 0,83 (д, 3 Н, 17-СН 3, J=7 Гц), 0,65 (м, 6 Н, 16-СН 3, 20-Н). Стадия В. 14-O-[(1R,2R,5S)-5-(трет-бутоксикарбонилэтиламино)-2-гидроксициклогексилсульфанил]ацетил-19,20-дигидромутилин + (1S,2S,5R) диастереомер. Сложный трет-бутиловый эфир N-этил-N-(цис-3,4-эпоксициклогексил)карбаминовой кислоты(2,8 г, 11,6 ммоль) из примера 7, стадия В, обрабатывали 19,20-дигидроплевромутилинтиолом (4,60 г,11,6 ммоль) согласно методу примера 1, стадия A3, в течение двух дней при комнатной температуре. По- 29
МПК / Метки
МПК: A61K 31/215, C07C 323/52, A61P 31/00
Метки: лечения, производные, опосредуемых, микробами, заболеваний, плевромутилина
Код ссылки
<a href="https://eas.patents.su/30-18707-proizvodnye-plevromutilina-dlya-lecheniya-zabolevanijj-oposreduemyh-mikrobami.html" rel="bookmark" title="База патентов Евразийского Союза">Производные плевромутилина для лечения заболеваний, опосредуемых микробами</a>
Предыдущий патент: Шина для большегрузных транспортных средств, арматура гребня, который содержит по меньшей мере один слой окружных усилительных элементов
Следующий патент: Производные морфолинопиримидина, используемые при заболеваниях, связанных с mtor киназой и/или pi3k
Случайный патент: Фармацевтическая композиция для лечения связанных с мср-1 воспалительных заболеваний