Производные пропионамида, полезные в качестве модуляторов андрогенных рецепторов
Номер патента: 12430
Опубликовано: 30.10.2009
Авторы: Мойланен Ану, Вольфарт Герд, Каллио Пекка, Карьялайнен Арья, Термекангас Олли, Хухтала Пааво, Ратилайнен Яри
Формула / Реферат
1. Производные пропионамида формулы (I)
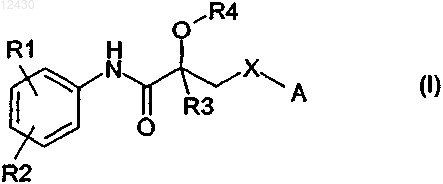
в которой R1 представляет (С1-С7)алкил, гидрокси(С1-С7)алкил или -СНО;
R2 представляет нитро, циано или атом галогена;
R3 представляет (С1-С7)алкил;
R4 представляет атом водорода;
X представляет О или NH;
А является группой, выбранной из
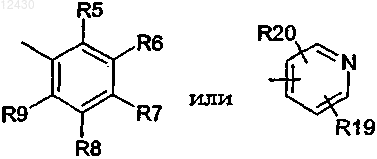
в которых R5, R6, R7, R8 и R9 независимо представляют атом водорода, атом галогена, нитро, циано, (C1-C7)алкил, галоген (С1-С7)алкил, циано (С1-С7)алкил, гидрокси(С1-С7)алкил, (C1-C7)алкокси(С1-С7)алкил, -NHCOR10, -COR11, -OR12, -NHSO2R13 или -SF15 или R6 и R7 образуют вместе с любым атомом(ами) кольца, с которым они связаны, 6-членное ароматическое карбоциклическое кольцо или 5-членное гетероциклическое кольцо, содержащее 1 атом азота или 2 атома кислорода;
R10 и R11 независимо представляют (С1-С7)алкил, галоген(C1-С7)алкил, амино(С1-С7)алкил, ди(C1-C7)алкиламино(С1-С7)алкил, фенил, галогенфенил, -N(R16)2 или -OR17;
R12 и R15 независимо представляют атом водорода, (С1-С7)алкил, галоген(С1-С7)алкил или моно- или ди(С1-С7)алкиламино(С1-С7)алкил;
R13 представляет (C1-C7)алкил;
R16 и R17 независимо представляют атом водорода или (С1-С7)алкил;
R19 и R20 независимо представляют атом водорода или атом галогена;
и их фармацевтически приемлемые соли.
2. Соединение по п.1, в котором R4 представляет атом водорода и R3 является метилом.
3. Соединение по п.1 или 2, в котором X представляет О.
4. Соединение по одному из пп.1-3, в котором R1 представляет метил или гидроксиметил и R2 является нитро или циано.
5. Соединение по одному из пп.1-4, в котором R5, R6, R7, R8 и R9 независимо представляют атом водорода, атом галогена, нитро, циано, (С1-С7)алкил, (С1-С7)алкокси, галоген(C1-C7)алкил, гидрокси(С1-С7)алкил или -NHCOR10, где R10 является (C1-C7)алкилом, галоген(С1-С7)алкилом, гидрокси или (С1-С7)алкокси.
6. Соединение по п.5, в котором по меньшей мере один из R5, R6, R7, R8 и R9 представляет атом галогена.
7. Соединение по п.6, в котором по меньшей мере два из R5, R6, R7, R8 и R9 выбраны из группы, состоящей из атома галогена, циано и ацетамидо.
8. Фармацевтическая композиция, содержащая соединение формулы (I) вместе с фармацевтически приемлемым носителем.
9. Способ лечения или профилактики зависимых от андрогенного рецептора состояний, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I).
10. Способ по п.9, включающий пероральное введение терапевтически эффективного количества соединения формулы (I).
Текст
012430 Область техники, к которой относится изобретение Настоящее изобретение относится к терапевтически активным соединениям и их фармацевтически приемлемым солям, пригодным при лечении зависимых от ядерного рецептора, особенно стероидного рецептора и, в частности, андрогенного рецептора (AR) состояний, и к фармацевтическим композициям,содержащим такие соединения. В частности, изобретение раскрывает новые нестероидные соединения,структурные производные пропионанилида, имеющие применимость в качестве тканеселективных модуляторов андрогенных рецепторов (SARM). Соединения по изобретению, которые обладают агонистической активностью по отношению к AR, пригодны для гормональной терапии, особенно при лечении или профилактике таких заболеваний, как гипогонадизм у мужчин, и связанных с возрастом состояний, таких как андропауза. Описание предшествующего уровня техники Ядерные гормональные рецепторы составляют семейство индуцируемых лигандами факторов транскрипции, члены которого принимают участие во многих физиологических функциях и функциях развития. В течение последних 20 лет было открыто более шестидесяти близких в структурном и функциональном отношении белков, относящихся к данному семейству. Семейство ядерных гормональных рецепторов включает, в дополнении к классическим стероидным гормонам (рецептор эстрогенов, рецептор прогестерона, рецептор андрогена, рецептор глюкокортикоидов и рецептор минералокортикоидов) также, например, рецепторы тиреоидного гормона, витамина D и ретиноидов. Кроме того, подгруппа так называемых орфановых рецепторов, для которых до настоящего времени не установлено лигандов, также относится к данному семейству белков. См. Mangelsdorf et al., Cell (1995) 83 (6): 835-839 и представленные там ссылки. Проводятся интенсивные исследования, направленные на идентификацию новых модуляторов для данных белков, конечной целью которых является изыскание новых препаратов и возможностей лечения состояний и заболеваний, модулируемых ядерными/стероидными рецепторами. В течение десятилетий стероидные андрогены применяли для лечения заболеваний, возникающих в результате недостаточной функции андрогенов. Они также привлекали внимание для использования в заместительной гормональной терапии у мужчин пожилого возраста и в регуляции фертильности у мужчин. Однако имеющиеся в настоящее время стероидные андрогены, такие как синтезированный тестостерон и его производные, имеют значительные ограничения. Тестостерон быстро разрушается в печени и, таким образом, обладает низкой системной биодоступностью при пероральном введении. Кроме того,доступные композиции на основе тестостерона для перорального введения, например, метилтестостерона, связаны с изменениями функции печени. Предпринимались различные другие попытки преодолеть данные недостатки стероидных андрогенов при их использовании в качестве терапевтических средств,но с ограниченным успехом. Имеющиеся в настоящее время композиции тестостерона, используемые в клинической практике, включают, например, инъекции, пластыри и гели. В последние годы существует растущий интерес к разработке нестероидных модуляторов для стероидных рецепторов для терапевтического применения. Было показано, что нестероидные лиганды могут обеспечить лучшую селективность в отношении рецепторов и иметь лучшие физико-химические,фармакокинетические и фармакологические свойства. В настоящее время в клинике используются нестероидные антагонисты (антиандрогены) для андрогенных рецепторов (AR), чтобы противодействовать нежелательным эффектам избыточных количеств андрогенов. В противоположность, совсем недавно сообщалось о нестероидных агонистах AR, которые будут эффективными при лечении заболеваний, возникающих в результате недостаточности андрогенов. По-прежнему структурные элементы нестероидных лигандов, которые приведут к оптимальной агонистической активности и тканевой селективности, еще слабо определены. Описаны нестероидные пропионанилиды, обладающие способностью модулировать рецепторы андрогенов, например, в патентных публикациях ЕР 100172, ЕР 253503, WO 98/53826 и WO 02/16310. Конструирование модуляторов AR на основе пропионанилидов было сконцентрировано на соединениях, в которых анилидное кольцо замещено двумя электронакцепторными заместителями, такими как атом галогена, циано, трифторметил или нитро, поскольку сообщалось, что такое замещение повышает аффинность связывания лиганда с андрогенным рецептором. См., например, Tucker H. et al., J. Med.Chem.,1988, 31, 954-959. Сущность изобретения В настоящее время было установлено, что соединения формулы (I) представляют собой эффективные модуляторы ядерных рецепторов, в частности модуляторы андрогенных рецепторов. Соединения формулы (I) проявляют очень высокую аффинность и активность в отношении андрогенного рецептора и обладают применимостью в качестве тканеселективных модуляторов андрогенного рецептора (SARM). Было установлено, что соединения формулы (I), которые обладают агонистической активностью в отношении AR, являются особенно пригодными для применения в гормональной терапии, особенно при лечении или профилактике таких состояний, как гипогонадизм у мужчин, и связанных с возрастом состояний, таких как андропауза, например, для обеспечения тканеселективного андрогенного или анаболического эффектов. Например, по одному предпочтительному варианту осуществления изобретения положительные андрогенные эффекты получают без сопутствующей отрицательной стимуляции простаты.-1 012430 Соединения по изобретению также в основном являются малоэффективными для сдерживания эффекта в рецепторе прогестерона, в частности антагонистического эффекта. Полагается, что сопутствующий антагонизм в отношении прогестерона может оказывать положительный эффект, поскольку было показано, что антагонистическое действие прогестерона повышает толерантность к глюкозе на некоторых моделях на животных. Соединения по изобретению также обеспечивают хорошую переносимость и достаточную растворимость в воде. Соединения по настоящему изобретению имеют структуру, представленную формулой (I), в которойR2 представляет нитро, циано или атом галогена; в которых R5, R6, R7, R8 и R9 независимо представляют атом водорода, атом галогена, нитро, циано,(C1-C7)алкил, галоген(C1-C7)алкил, циано (C1-C7)алкил, гидрокси(C1-C7)алкил, (C1-C7)алкокси(C1-C7)алкил, -NHCOR10, -COR11, -OR12, -NHSO2R13 или -SR15; или R6 и R7 образуют вместе с любым атомом(ами) кольца, с которым они связаны, 6-членное ароматическое карбоциклическое кольцо или 5-членное гетероциклическое кольцо, содержащее 1 атом азота или 2 атома кислорода;R12 и R15 независимо представляют атом водорода, (C1-C7)алкил, галоген(C1-C7)алкил или моно- или ди(С 1-С 7)алкиламино(C1-C7)алкил;R16 и R17 независимо представляют атом водорода или (C1-C7)алкил;R19 и R20 независимо представляют атом водорода или атом галогена; и их фармацевтически приемлемые соли. В одной группе предпочтительных соединений находятся соединения формулы (Ib), в которой R1,R2, R3, R4, R5, R6, R7, R8 и R9 имеют значения, определенные выше. В другой группе предпочтительных соединений находятся соединения формул (I) или (Ib), в которых R1 представляет метил или гидроксиметил, и R2 является нитро или циано. В другой группе предпочтительных соединений находятся соединения формул (I) или (Ib), в которых R4 представляет атом водорода, и R3 является метилом. В другой группе предпочтительных соединений находятся соединения формул (I) или (Ib), в которых R5, R6, R7, R8 и R9 независимо представляют атом водорода, атом галогена,нитро, циано, (C1-C7)алкил, (С 1-С 7)алкокси, галоген(С 1-С 7)алкил, гидрокси(C1-C7)алкил или -NHCOR10,где R10 является (C1-C7)алкилом, галоген(С 1-С 7)алкилом, гидрокси или (С 1-С 7)алкокси. Особенно предпочтительными являются соединения формул (I) или (Ib), в которых по меньшей мере один из R5, R6, R7,R8 и R9 представляет атом галогена, предпочтительно атом фтора. Наиболее предпочтительно, когда по меньшей мере два из R5, R6, R7, R8 и R9 выбраны из группы, состоящей из атома галогена, предпочтительно атома фтора, циано и ацетамидо. Особенно предпочтительно, когда R6 представляет атом галогена, предпочтительно атом фтора. Настоящее изобретение также относится к способу лечения или профилактики зависимых от андрогенного рецептора (AR) состояний, включающему введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I). Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение формулы (I) вместе с фармацевтически приемлемым носителем.-2 012430 Краткое описание фигур На фигуре показана андрогенная и анаболическая актизность соединения по изобретению в отношении мышцы levator ani, семенного пузырька и вентральной области простаты у неполовозрелых крыссамцов Spraquely Dawley. Подробное описание изобретения Соединения по изобретению можно получить различными способами синтеза аналогично способам,известным в литературе, с использованием подходящих исходных соединений. В частности, соединения по изобретению можно получить аналогично общим способам, описанным в WO 98/53826. Например,соединения по изобретению можно получить, например, аналогично или по схемам реакций 1 или 2: Схема реакций 1 (способ А)-3 012430 Соединения формулы (I), в которых группа А представляет собой пиридиновое кольцо или его производное, можно получить аналогично тому, как представлено на схемах реакций 1 или 2, с использованием подходящего гидроксильного производного пиридина на последней стадии. Соединения формулы(I), в которых X представляет -NH, можно получить аналогично тому, как представлено на схемах реакций 1 или 2, с использованием подходящего производного анилина на последней стадии. Фармацевтически приемлемые соли, например аддитивные соли кислоты как органических, так и неорганических кислот, хорошо известны в области фармации. Неограничивающие примеры таких солей включают хлориды, бромиды, сульфаты, нитраты, фосфаты, сульфонаты, формиаты, тартраты, малеаты,цитраты, бензоаты, салицилаты и аскорбаты. Фармацевтически приемлемые сложные эфиры, когда они являются приемлемыми, можно получить известными способами с использованием фармацевтически приемлемых кислот, которые являются обычными в области фармации и которые сохраняют фармакологические свойства свободной формы. Неограничивающие примеры таких сложных зфиров включают сложные эфиры алифатических или ароматических спиртов, например метиловый, этиловый, пропиловый, изопропиловый, бутиловый, изобутиловый, втор-бутиловый, трет-бутиловый эфиры. Сложные фосфатные эфиры и сложные карбонатные эфиры также входят в объем изобретения. Используемые в данном описании термины имеют следующие значения. Термин атом гало или галогена, используемый в данном описании как таковой или как часть другой группы, относится к атомам хлора, брома, фтора или йода. Термин (С 1-С 7)алкил, используемый в данном описании как таковой или как часть другой группы, относится к радикалу с нормальной, разветвленной или циклической цепью, содержащему 1-7 атомов углерода. Типичные примеры (С 1-С 7)алкила включают, но не ограничиваются ими, метил, этил, нпропилом, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, нгексил, циклопентил, циклогексил и тому подобное. Термин (С 2-С 7)алкенил, используемый в данном описании как таковой или как часть другой группы, относится к радикалу с нормальной, разветвленной или циклической цепью, содержащему 2-7 атомов углерода и содержащему двойную связь(и). Термин гидрокси, используемый в данном описании как таковой или как часть другой группы,относится к -ОН-группе. Термин гидрокси(С 1-С 7)алкил, используемый в данном описании, относится по меньшей мере к одной гидроксильной группе, имеющей значения, определенные выше, связанной с исходной молекулярной группой посредством (С 1-С 7)алкильной группы, определенной выше. Типичные примеры гидрокси(С 1-С 7)алкила включают, но не ограничиваются ими, гидроксиметил, 2,2-дигидроксиэтил, 1 гидроксиэтил, 3-гидроксипропил, 1-гидроксипропил, 1-метил-1-гидроксиэтил, 1-метил-1-гидроксипропил и тому подобное. Термин галоген(С 1-С 7)алкил, используемый в данном описании, относится по меньшей мере к одному атому галогена, имеющему значения, определенные выше, связанному с исходной молекулярной группой посредством (C1-C7)алкильной группы, определенной выше. Типичные примеры галоген(С 1 С 7)алкила включают, но не ограничиваются ими, фторметил, дифторметил, трифторметил, 2-хлорэтил, 3 бромпропил и тому подобное. Термин циано, используемый в данном описании как таковой или как часть другой группы, относится к -CN-группе. Термин циано(С 1-С 7)алкил, используемый в данном описании, относится к цианогруппе, имеющей значения, определенные выше, связанной с исходной молекулярной группой посредством (C1C7)алкильной группы, определенной выше. Типичные примеры циано(C1-C7)алкила включают, но не ограничиваются ими, цианометил, 1-цианоэтил, 1-цианопропил, 2-цианопропил и тому подобное. Термин амино, используемый в данном описании как таковой или как часть другой группы, относится к -NH2-группе. Термин амино(C1-C7)алкил, используемый в данном описании, относится по меньшей мере к одной аминогруппе, имеющей значения, определенные выше, связанной с исходной молекулярной группой посредством (С 1-С 7)алкильной группы, определенной выше. Типичные примеры амино(С 1-С 7)алкила включают, но не ограничиваются ими, аминометил, 2-аминоэтил, 1-аминоэтил, 2,2-диаминоэтил, 3 аминопропил, 2-аминопропил, 4-аминобутил, 1-метил-1-аминоэтил и тому подобное. Термин моно- или ди(С 1-С 7)алкиламино, используемый в данном описании как таковой или как часть другой группы, относится к одной или двум С 1-С 7 алкильным группам, имеющим значения, определенные выше, связанным с исходной молекулярной группой посредством аминогруппы, определенной выше. Типичные примеры моно- или ди(C1-C7)алкиламино включают, но не ограничиваются ими, метиламино, этиламино, пропиламино, бутиламино, диметиламино, диэтиламино, N-этил-N-метиламино и тому подобное. Термин моно- или ди(С 1-С 7)алкиламино(C1-C7)алкил, используемый в данном описании, относится к моно- или ди(С 1-С 7)алкиламиногруппе, имеющей значения, определенные выше, связанной с исходной молекулярной группой посредством (С 1-С 7)алкильной группы, определенной выше. Типичные примеры моно- или ди(C1-C7)алкиламино(C1-C7)алкила включают, но не ограничиваются ими, N,N-4 012430 диметиламинометил, N,N-диэтиламинометил, N-метиламиноэтил, N-метиламинопропил, N-этил-Nметиламинометил и тому подобное. Термин (C1-С 7)алкокси, используемый в данном описании как таковой или как часть другой группы, относится к -O-(С 1-С 7)алкилу, где (С 1-С 7)алкил имеет значения, определенные выше. Типичные примеры (С 1-С 7)алкокси включают, но не ограничиваются ими, метокси, этокси, пропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси и тому подобное. Термин (C1-C7)алкокси(C1-C7)алкил, используемый в данном описании, относится по меньшей мере к одной (C1-C7)алкоксигруппе, имеющей значения, определенные выше, связанной с исходной молекулярной группой посредством (С 1-С 7)алкильной группы, определенной выше. Типичные примеры(C1-C7)алкокси(C1-C7)алкила включают, но не ограничиваются ими, метоксиметил, этоксиметил, 2 метоксиэтил, 2-этоксиэтил, 3,3-диметоксипропил, 2,4-диметоксибутил и тому подобное. Термин (C6-C10)арил, используемый в данном описании как таковой или как часть другой группы,относится к моноциклической или бициклической группе, содержащей 6-10 атомов углерода в кольцевой части. Типичные примеры (C6-C10)арила включают, но не ограничиваются ими, фенил, нафтил и тому подобное. Термин (С 2-С 7) ацил, используемый в данном описании как таковой или как часть другой группы,относится к алкилкарбонильной или алкенилкарбонильной группе, содержащей 2-7 атомов углерода, и ее примеры включают ацетил, пропаноил, изопропаноил, бутаноил, втор-бутаноил, трет-бутаноил и пентаноил. Термин замещенный, используемый в данном описании в отношении различных остатков, относится к заместителям-галогенам, таким как атомы фтора, хлора, брома, йода, или заместителям, таким как (С 1-С 7)алкил, галоген(С 1-С 7)алкил, гидрокси, амино, (С 1-С 7)алкокси, (С 2-С 7)ацил(С 1-С 7)алкиламино,амино(C1-C7)алкил, нитро, циано или тиол. Замещенные группы могут содержать 1-3, предпочтительно 1 или 2, наиболее предпочтительно 1 из вышеуказанных заместителей. Определение формулы (I), представленной выше, включает все возможные стереоизомеры соединений, включая геометрические изомеры, например, Z- и Е-изомеры (цис- и трансизомеры) и оптические изомеры, например диастереоизомеры и энантиомеры, и все пролекарственные сложные эфиры, например фосфатные эфиры и карбонатные эфиры. Кроме того, изобретение включает в объем как индивидуальные изомеры, так и любые их смеси, например, рацемические смеси. Индивидуальные изомеры можно получить с использованием соответствующих изомерных форм исходного соединения или их можно разделить после получения конечного соединения обычными методами разделения. Для разделения оптических изомеров, например, энантиомеров, из их смеси можно использовать обычные методы разделения, например, дробную кристаллизацию. Примеры предпочтительных соединений формулы (I) включают: 3-(4-ацетиламино-3-фторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид;-5 012430 3-(3-хлор-4-цианофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. Соединения по изобретению можно вводить пациенту в терапевтически эффективных количествах обычно в пределах примерно от 0,1 до примерно 1000 мг в день в зависимости от возраста, массы, этнической группы, состояния пациента, заболевания, которое лечат, пути введения и используемого модулятора андрогенов (AR). Соединения по изобретению можно получать в виде композиций в дозированных формах с использованием принципов, известных в данной области. Его можно давать пациенту как таковое или в комбинации с подходящими фармацевтическими эксципиентами в виде таблеток, гранул, капсул, суппозиториев, эмульсий, суспензий или растворов. Осуществить выбор подходящих ингредиентов для композиции является обычным для специалистов в данной области. Очевидно понятно, что можно также использовать подходящие носители, растворители, гелеобразующие ингредиенты, образующие дисперсию ингредиенты, антиоксиданты, красители, подсластители, смачивающие вещества и другие ингредиенты, обычно используемые в данной области технологии. Композиции, содержащие активное соединение, можно вводить энтерально или парентерально, при этом пероральный путь является предпочтительным. Содержание активного соединения в композиции составляет примерно от 0,5 до 100%,предпочтительно примерно от 0,5% до примерно 20% от массы всей композиции. Настоящее изобретение будет пояснено более подробно последующими примерами. Примеры предназначены только для иллюстративных целей и не ограничивают объем изобретения, определенного формулой изобретения. Опыты Опыт 1. Тест связывания AR. Вентральные области простат получали от крыс, кастрированных за 24 ч до эвтаназии. Свежеотобранные образцы простаты измельчали и отмывали буфером A (Schilling and Liao, Prostate, 5: 581-588,1984). Затем измельченную ткань гомогенизировали в 3 объемах буфера А, содержащего ингибиторы протеазы (Complete, Mini, EDTA-free Roche). Гомогенат центрифугировали при 30000 g в течение 30 мин. Полученные супернатанты обрабатывали 1 объемом суспензии покрытого декстраном угля (12,5 г активированного угля, 12,5 г декстрана на литр буфера А) для удаления эндогенных стероидов. Пробы инкубировали в течение 5 мин и центрифугировали при 16000 g в течение 10 мин. Аликвотные порции обработанного углем цитозоля отбирали для проведения тестов с андрогенным рецептором. Все операции проводили при температуре 0-4 С. Концентрацию андрогенных рецепторов в цитозоле определяли, как описано (Isomaa et al., Endocrinology, 111: 833-843, 1982) с небольшими модификациями. Цитозольные препараты готовили, как описано выше, и связанные и свободные стероиды разделяли обработкой равным объемом суспензии декстран-уголь в течение 5 мин при 4 С с последующим центрифугированием при 16000 g в течение 10 мин. Связанную радиоактивность определяли расчетом супернатантных фракций в 1 мл OptiPhase HiSafe 3 или OptiPhase Supermix (PerkinElmer). Цитозольные препараты метили 1 нМ [3 Н]-миболероном в течение ночи при 0 С (в целом). Для определения связывающей AR активности соединений по настоящему изобретению (тестируемых соединений) исследовали активность тестируемых соединений конкурировать со связыванием [3 Н]7,17 диметил-17-гидрокси-4-эстрен-3-она ([3 Н]-миболерона). 1 нМ [3 Н]-миболерон и тестируемые соединения в двух концентрациях (0,2 и 2 мкМ) инкубировали в течение ночи при 0 С. Для определения неспецифического связывания проводили инкубацию параллельных проб с использованием [3 Н]-миболерона в концентрации 1 нМ с 500-кратным молярным избытком немеченого тестостерона. Для каждой пробы использовали от двух до четырех параллельных проб. После инкубации разделяли связанные и свободные стероиды, как описано выше, и определяли связанную радиоактивность. Способность тестируемых соединений связывать AR выражали в виде снижения связанной радиоактивности, полученной с 1 нМ Опыт 2. Агонизм и антагонизм в отношении AR у неполовозрелых крыс-самцов. Указанное в заголовке примера 3 соединение, сокращенно здесь соединение А, затем исследовали в опыте в условиях in vivo. Агокизм и антагонизм соединения при подкожном введении тестировали на неполовозрелых крысах-самцах Spraquely Dawley в трехдневном опыте при анализе относительной массы вентральной области простаты, семенного пузырька и мышцы levator ani. В качестве соединения сравнения использовали тестостерон. Сначала тестостеронпропионат (сокращенно ТР) и соединение А растворяли в ДМСО и затем в наполнителе кунжутном масле. В опыте использовали интактных крыс-самцов Spraquely Dawley (18-19 дневных) с массой тела 50 г. Крыс взвешивали и произвольно распределяли на пять групп по 5 животных в каждой группе (табл. 1). Соединение А (в дозах 2 и 20 мг/кг) и тестостеронпропионат (в дозе 5 мг/кг) вводили подкожно (п/к) в область шеи/спины животных в постоянном объеме 100 мкл раствора/животное/день. Животным препараты вводили один раз в день в течение трех дней и регистрировали клинические признаки во время введения. В конце опыта животных взвешивали и подвергали эвтаназии-7 012430 асфиксией CO2. Извлекали вентральную область простаты, семенные пузырьки и мышцу levator ani, охлаждали и взвешивали. Для статистической обработки массы всех органов нормализовали к значениям массы тела и анализировали однофакторной программой ANOVA для установления статистически достоверного различия. Таблица 2. Группы животных и схема опыта Результаты представлены на фигуре. Соединение А проявило андрогенную и анаболическую активность. Относительные массы вентральной области простаты, семенного пузырька и мышцы levator ani достоверно повышались при введении тестостеронпропионата. По сравнению с тестостеронпропионатом соединение А проявляло тканевую селективность. В дозе 20 мг/кг оно четко повышало относительную массу мышцы levator ani и достоверно относительную массу семенного пузырька, но оказывало только минимальное воздействие на относительную массу простаты. Кроме того, соединение А показало достоверную антагонистическую активность в отношении семенного пузырька. Ни тестостеронпропионат, ни соединение А не оказывали воздействия на массу тела (данные не представлены). На фигуре а означает агонизм, р 0,01 по сравнению с группой наполнителя, b означает антагонизм, р 0,05 по сравнению с группой тестостерона, столбцы представляют среднее значениеSEM. Примеры Пример 1. (Способ А) 3-(4-Ацетиламинофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил) пропионамид. а) 2-Метил-N-(3-метил-4-нитрофенил)акриламид. 3-Метил-4-нитроанилин (2,0 г, 13 ммоль) в N,N-диметилацетамиде (DMAC) (6 мл) добавляли по каплям к охлажденному раствору метакрилоилхлорида (2,0 мл, 20,7 ммоль) в атмосфере азота, поддерживая температуру реакционной смеси в пределах 0-5 С. Раствору давали нагреться до комнатной температуры и смесь перемешивали в течение ночи. Смесь выливали в воду (70 мл) и экстрагировали этилацетатом (440 мл). Органическую фазу промывали насыщенным раствором Na2CO3 (320 мл) и водой(150 мл), сушили над Na2SO4 и упаривали. Выход неочищенного продукта составил 4,17 г (содержалDMA, теоретический выход 2,9 г), и его использовали без дополнительной очистки. 1 Н ЯМР (ДМСО-d6): 1,97 (3H, с), 2,55 (3H, с), 5,62 (1 Н, м), 5,96 (1 Н, м), 7,80 (2 Н, м), 8,05 (1 Н, м),10,22 (1 Н, с).b) (3-Метил-4-нитрофенил)амид 2-метилоксиран-2-карбоновой кислоты. м-Хлорпероксибензойную кислоту (6,7 г, 29,9 ммоль) добавляли порциями при 60 С к раствору 2 метил-N-(3-метил-4-нитрофенил)акриламида (2,9 г, 13,2 ммоль) и 2,6-ди-трет-бутил-4-метилфенола (66 мг) в 1,2-дихлорэтане (80 мл). Перемешивание продолжали при 60 С в течение 6 ч и реакционной смеси давали нагреться до комнатной температуры. Осажденную м-хлорбензойную кислоту отфильтровывали и фильтрат экстрагировали 1 М раствором Na2CO3 (460 мл). Органическую фазу сушили над Na2SO4 и упаривали. Выход составлял 3,05 г. 1c) 3-(4-Ацетиламинофенокси)-2-гидрокси-2-метил-N-(3-метил-4 нитрофенил)пропионамид. Раствор 4-ацетамидофенола (2,9 г, 19 ммоль) в ТГФ (60 мл) добавляли по каплям к перемешиваемой суспензии гидрида натрия (0,46 г, 19 ммоль, 60% дисперсия в минеральном масле) в ТГФ (60 мл) и температуру реакционной смеси поддерживали ниже 5 С во время добавления. Смесь перемешивали в течение 10 мин и добавляли раствор (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты (3,05 г, 13 ммоль) в ТГФ (120 мл). Смесь нагревали до 60 С, перемешивали при данной температуре в течение 7 ч и давали охладиться до комнатной температуры. Растворитель выпаривали и остаток растворяли в смеси вода (150 мл)-этилацетат (150 мл). рН доводили до 2-3 2 М раствором HCl и фазы разделяли. Водную фазу экстрагировали этилацетатом (4150 мл). Объединенную органическую фазу промывали 1 М раствором Na2CO3 (5100 мл), сушили над Na2SO4 и упаривали. Маслянистый остаток кристаллизовали из смеси этилацетат-диэтиловый эфир (10 : 1). Неочищенный продукт перекристаллизовывали из этилацетата. Выход составлял 2,5 г. 1a) N-(2-Фтор-4-гидроксифенил)ацетамид. Уксусный ангидрид (1,3 мл, 13,8 ммоль) добавляли по каплям к раствору 4-амино-3-фторфенола(1,0 г, 7,9 ммоль) в уксусной кислоте (25 мл) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, добавляли воду (2 мл) и перемешивание продолжали в течение 30 мин при комнатной температуре. Смесь упаривали досуха в вакууме. Выход неочищенного продукта составлял 1,3 г (100%), и его использовали без дополнительной очистки. 1b) 4-(4-Ацетиламино-3-фторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. Соединение синтезировали способом, описанным в примере 1 с. В качестве исходных соединений использовали N-(2-фтор-4-гидроксифенил)ацетамид (0,5 г, 3,0 ммоль) и (3-метил-4-нитрофенил)амид 2 метилоксиран-2-карбоновой кислоты (0,6 г, 2,5 ммоль). Продукт кристаллизовали из смеси этилацетатдиэтиловый эфир (1:1). Выход составлял 0,39 г. 1(26 мл) и охлаждали на ледяной бане и раствор разбавляли ацетоном (26 мл). Раствор метакрилоилхлорида (6,3 мл, 65,1 ммоль) в ацетоне (26 мл) и 2 М раствор NaOH (34 мл) одновременно добавляли в течение 1 ч к раствору D-пролина. После добавления полученную смесь перемешивали в течение 3 ч при комнатной температуре. Смесь упаривали при 40 С, экстрагировали диэтиловым эфиром (240 мл) и подкисляли до рН 2 концентрированной HCl. Полученную смесь экстрагировали этилацетатом (350 мл),сушили над Na2SO4 и упаривали. Выход составлял 11,5 г (теоретический выход 8,0 г), и продукт использовали без дополнительной очистки.NBS (16 г, 89,9 ммоль) растворяли в ДМФА (50 мл) и добавляли при комнатной температуре к раствору (2R)-1-(2-метилакрилоил)пирролидин-2-карбоновой кислоты (11,5 г, содержит 8,0 г соответствующего исходного соединения, 43,4 ммоль) в ДМФА (50 мл). Смесь перемешивали в течение 20 ч и упаривали при 80-90 С. Остаток смешивали с водой (250 мл) и экстрагировали эгилацетатом (480 мл). Объединенные этилацетатные фазы промывали 1 М раствором NaHCO3 (250 мл) и водой (150 мл). Органическую фазу сушили над Na2SO4 и упаривали. Выход неочищенного масла составил 9,3 г. Добавляли этилацетат (10 мл) и смесь перемешивали на ледяной бане. Осажденный продукт отфильтровывали и промывали охлажденным этилацетатом. Выход составлял 1,2 г. 1(3R,8aR)-3-Бромметил-3-метилтетрагидропирроло[2,1-с][1,4]оксазин-1,4-дион (1,1 г, 4,2 ммоль) растворяли в концентрированной HCl (10 мл) и кипятили с обратным холодильником в течение 7 ч. Смесь охлаждали до комнатной температуры. Добавляли воду (20 мл) и смесь экстрагировали этилацетатом (320 мл). Объединенную органическую фазу упаривали и остаток смешивали с толуолом (5 мл). Кристаллизованный продукт отфильтровывали и промывали толуолом. Выход составлял 0,74 г. 1d) (2R)-3-Бром-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. Тионилхлорид (0,48 мл, 6,6 ммоль) добавляли по каплям к раствору (2R)-3-бром-2-гидрокси-2 метилпропионовой кислоты (1,0 г, 5,5 ммоль) в 10 мл DMA при температуре от -5 до -10 С. Смесь перемешивали в течение 2 ч и к вышеуказанной смеси добавляли раствор 3-метил-4-нитроанилина (0,83 г, 5,5 ммоль) в 7 мл DMA. Полученную смесь перемешивали в течение 3 ч при комнатной температуре и выливали в воду (250 мл). Водную фазу экстрагировали этилацетатом (450 мл), сушили над Na2SO4 и упаривали. Выход желаемого соединения составлял 2,5 г (содержит также DMA), и его использовали без дополнительной очистки. 1e) (2S)-3-(4-Ацетиламинофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. Раствор 4-ацетамидофенола (0,62 г, 4,1 ммоль) в ТГФ (7 мл) добавляли по каплям к перемешивае-9 012430 мой суспензии гидрида натрия (0,27 г, 6,8 ммоль, 60% дисперсия в минеральном масле) в ТГФ (6 мл) и во время добавления температуру поддерживали ниже 5 С. Смесь перемешивали в течение 10 мин и добавляли раствор (2R)-3-бром-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамида (0,36 г, 2,7 ммоль) в ТГФ (7 мл). Смесь перемешивали при комнатной температуре в течение 30 мин, затем при 60 С в течение 5 ч и давали охладиться до комнатной температуры. Растворитель выпаривали и остаток растворяли в смеси вода (80 мл) - этилацетат (80 мл). рН доводили до 2-3 2 М раствором HCl и фазы разделяли. Органическую фазу промывали 1 М раствором Na2CO3 (630 мл), сушили над Na2SO4 и упаривали. Маслянистый остаток кристаллизовали из этилацетата. Выход составлял 0,27 г. 1(2S)-3-(4-Ацетиламино-3-фторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил) пропионамид получали способом В, как описано в примере 3e, исходя из 4-ацетил-3-фторфенола и N-[3-метил-4(нитро)фенил]-(2R)-3-бром-2-гидрокси-2-метилпропанамида. 1H ЯМР (400 МГц, ДМСО-d6): 1,43 (3H, с), 2,53 (3H, с), 4,02 (1 Н, д, J=9,9 Гц), 4,28 (1 Н, д, J=9,9 Гц),6,27 (1 Н, с), 6,95 (1 Н, дд, J=8,9 Гц, J=2,8 Гц), 7,25 (1 Н, д, J=2,8 Гц), 7,49 (1 Н, д, J=8,9 Гц), 7,88 (1 Н, дд,J=9,0 Гц, J=2,3 Гц), 7,93 (1 Н, д, J=2,0 Гц), 8,04 (1 Н, д, J=9,0 Гц), 10,17 (1 Н, с). Пример 7. Этиловый эфир 4-[2-гидрокси-2-(3-метил-4-нитрофенилкарбамоил)пропокси]бензойной кислоты. Этиловый эфир 4-[2-гидрокси-2-(3-метил-4-нитрофенилкарбамоил)пропокси]бензойной кислоты получали, как описано в примере 1, исходя из этил 4-гидроксибензоата и 1,2-эпокси-2-метил-N-(3-метил 4-нитрофенил)-2-пропанамида. 1H ЯМР (400 МГц, ДМСО-d6): 1,43 (3H, с), 2,53 (3H, с), 3,98 (1 Н, д, J=9,6 Гц), 4,22 (1 Н, д, J=9,6 Гц),6,22 (1 Н, с), 6,93-6,98 (2 Н, м), 7,52-7,56 (2 Н, м), 7,88 (1 Н, дд, J=9,0 Гц, J=2,2 Гц), 7,93 (1 Н, д, J=1,9 Гц),8,04 (1 Н, д, J=9,0 Гц). Пример 14. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-феноксипропионамид. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-феноксипропионамид получали, как описано в примере 1, исходя из фенола и 1,2-эпокси-2-метил-N-(3-метил-4-нитрофенил)-2-пропанамида. 1H ЯМР (400 МГц, ДМСО-d6): 1,44 (3H, с), 2,53 (3H, с), 3,97 (1 Н, д, J=9,6 Гц), 4,21 (1 Н, д, J=9,6 Гц),6,21 (1 Н, с), 6,90-6,95 (3H, м), 7,24-7,29 (2 Н, м), 7,89 (1 Н, дд, J=2,3 Гц, J=9,0 Гц), 7,94 (1 Н, д, J=2,0 Гц),8,04 (1 Н, д, 3J=9,0 Гц), 10,16 (1 Н, с). Пример 15. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-(4-трифторметилфенокси)пропионамид. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-(4-трифторметилфенокси)пропионамид получали,как описано в примере 1, исходя из п-гидроксибензотрифторида и (3-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат(1 Н, д, 4J=2,2 Гц), 8,08 (1 Н, д, 3J=8,9 Гц), 8,9 (1 Н, уш.с, -NHCO-). Пример 16. 3-(4-Ацетилфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(4-Ацетилфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 4'-гидроксиацетофенона и (3-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат (95:5) в качестве элюента. Кристаллизация из толуола, т.пл. 153155 С. 1Jgem=9,1 Гц), 4,53 (1 Н, д, 2Jgem=9,1 Гц), 6,96 (2 Н, д, 3J=8,9 Гц), 7,58 (1 Н, дд, 3J=8,9 Гц, 4J=2,4 Гц), 7,66 (1 Н,д, 4J=2,3 Гц), 7,94 (2 Н, д, 3J=8,9 Гц), 8,09 (1 Н, д, 3J=9,0 Гц), 8,95 (1 Н, уш.с, -NHCO-). Пример 17. 3-(4-Цианофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(4-Цианофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 4-цианофенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента. Кристаллизация из толуола. 1Jgem=9,9 Гц), около 6,3 (1 Н, уш.с, -ОН), 7,10 (2 Н, д, 3J=8,8 Гц), 7,75 (2 Н, д, 3J=8,8 Гц), 7,88 (1 Н, дд, 3J=9,0 Гц, 4J=2,3 Гц), 7,93 (1 Н, д, 4J=2,0 Гц), 8,04 (1 Н, д, 3J=9,0 Гц), около 10,2 (1 Н, уш.с, -NHCO-). Пример 18. 3-(3-Фторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(3-Фторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 3-фторфенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента. Кристаллизация из смеси толуол/гептан, т.пл. 83-86 С. 1J=2,3 Гц), 7,94 (1 Н, д, 4J=2,0 Гц), 8,04 (1 Н, д, 3J=8,9 Гц), 10,17 (1 Н, уш.с, -NHCO-). Пример 19. 3-(2-Фторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(2-Фторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 2-фторфенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат (90:10) в качестве элюента. Кристаллизация из смеси этилацетат/гептан, т.пл. 94-96 С. 1J=2,2 Гц), 7,93 (1 Н, д, 4J=2,0 Гц), 8,04 (1 Н, д, 3J=9,0 Гц), 10,17 (1 Н, уш.с, -NHCO-). Пример 20. 2-Гидрокси-3-[4-(2-гидроксиэтил)фенокси]-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 2-Гидрокси-3-[4-(2-гидроксиэтил)фенокси]-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 4-гидроксифенилового спирта (1,45 экв), гидрида натрия (2,9 экв) и (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты (1 экв). Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента (9:1-4:6). 1a) 4-Амино-3-трифторметилфенол 4-Нитро-3-трифторметилфенол (0,414 г; 2,0 ммоль) растворяли в 25 мл ледяной уксусной кислоты и добавляли небольшими порциями в течение 10 мин цинковую пыль(2,62 г; 40 ммоль), давая температуре подняться до +40 С. Смесь перемешивали в течение 10 мин и фильтровали. Пыль промывали 3x10 мл ледяной уксусной кислотой и фильтрат упаривали досуха с получением 0,212 г 4-амино-3-трифторметилфенола. 1b) N-(4-Гидрокси-2-трифторметилфенил)ацетамид. 4-Амино-3-трифторметилфенол (0,212 г; 1,2 ммоль) растворяли в 10 мл ледяной уксусной кислоты в атмосфере азота и добавляли уксусный ангидрид (0,3 мл; 3,0 ммоль) с последующим перемешиванием в течение 1 ч при комнатной температуре. В реакционную смесь добавляли воду (0,5 мл) и затем упаривали досуха. Добавляли толуол (50 мл) и упаривание повторяли с получением количественного выхода чистого N-(4-гидрокси-2-трифторметилфенил)ацетамида. 1H ЯМР (400 МГц, ДМСО-d6): 1,43 (3H, с), 2,41 (3H, с), 2,53 (3H, с), 3,96 (1 Н, д, J=9,6 Гц), 4,20 (1 Н,д, J=9,6 Гц), 6,21 (1 Н, с), 6,87-6,93 (2 Н, м), 7,17-7,25 (2 Н, м), 7,88 (1 Н, дд, J=9,0 Гц, J=2,3 Гц), 7,93 (1 Н, д,J=2,0 Гц), 8,04 (1 Н, д, J=9,0 Гц), 10,15 (1 Н, с). Пример 35. 3-(3-Фтор-4-нитрофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(3-Фтор-4-нитрофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали,как описано в примере 1, исходя из 3-фтор-4-нитрофенола и (3-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. ЯМР (ДМСО-d6): 1,46 (3H, с), 2,53 (3H, с), 4,16 (1 Н, д, J=10,1 Гц), 4,41 (1 Н, д, J=10,1 Гц), 6,36 (1 Н,уш.с), 6,96 (1 Н, м), 7,22 (1 Н, м), 7,88 (1 Н, дд, J=9,0 Гц и 2,1 Гц), 7,90 (1 Н, д, J=2,1 Гц), 8,04 (1 Н, д, J=9,0 Гц), 8,24 (1 Н, м), 10,19 (1 Н, с). Пример 36. 3-[4-(4-Хлорбензоил)фенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-[4-(4-Хлорбензоил)фенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 4-хлор-4'-гидроксибензофенона и (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента. Кристаллизация из изопропанола. 1Jgem=9,7 Гц), около 6,3 (1 Н, уш.с, -ОН), 7,09 (2 Н, д, 3J=8,8 Гц), 7,62 (2 Н, д, 3J=8,5 Гц), 7,70 (2 Н, д, 3J=8,6 Гц), 7,72 (2 Н, д, 3J=9,0 Гц), 7,89 (1 Н, дд, 3J=9,0 Гц, 4J=2,3 Гц), 7,94 (1 Н, д, 4J=2,2 Гц), 8,05 (1 Н, д, 3J=9,0 Гц), около 10,2 (1 Н, уш.с, -NHCO-). Пример 37. 3-(3-Хлорфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(3-Хлорфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 3-хлорфенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента (10:90-40:90). Кристаллизация из толуола, т.пл. 104107 С. 1J=8,2 Гц), 7,89 (1 Н, дд, 3J=9,0 Гц, 4J=2,3 Гц), 7,94 (1 Н, д, 4J=2,2 Гц), 8,04 (1 Н, д, 3J=9,0 Гц), 10,17 (1H,уш.с, -NHCO-). Пример 38. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-пентафторфен-илоксипропионамид. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-пентафторфен-илоксипропионамид получали, как описано в примере 1, исходя из пентафторфенола и 1,2-эпокси-2-метил-N-(3-метил-4-нитрофенил)-2 пропанамида. 1a) 4-Амино-2-метилбензонитрил. 3-Метил-4-нитробензонитрил (1,0 г, 6 ммоль) растворяли в уксусной кислоте (15 мл). Добавляли воду (3,75 мл) и смесь нагревали при температуре в пределах 90-95 С. В течение 1,5 ч добавляли желез- 14012430 ный порошок (2,5 г) и полученную смесь нагревали в течение 1 ч. Добавляли еще одну порцию воды(3,75 мл) и нагревание продолжали еще в течение 2 ч. Раствору давали охладиться до комнатной температуры, смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (440 мл). Органическую фазу промывали 5% раствором NaHCO3 (150 мл) и водой (150 мл), сушили над Na2SO4 и упаривали. Неочищенный продукт использовали без дополнительной очистки. 1(2S)-3-(4-Циано-3-фторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 3, исходя из 2-фтор-4-гидроксибензонитрила и (2R)-3-бром-2-гидрокси-2 метил-N-(3-метил-4-нитрофенил)пропионамида по следующей методике. Раствор 2-фтор-4-гидроксибензонитрила (0,2 г, 1,4 ммоль), (2R)-3-бром-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамида (0,37 г, 1,2 ммоль), K2CO3 (0,34 г, 2,5 ммоль) и бензилтриэтиламмонийхлорида (0,028 г, 0,1 ммоль) в метилэтилкетоне (40 мл) кипятили с обратным холодильником в течение 5 ч. Смесь охлаждали до комнатной температуры и упаривали. Остаток распределяли между этилацетатом (50 мл) и водой (50 мл) и фазы разделяли. Органическую фазу промывали 1 М раствором Na2CO3 (420 мл) и водой (120 мл), сушили над Na2SO4 и упаривали. Неочищенный продукт очищали флэш-хроматографией (элюент CH2Cl2). 1(1 Н, уш.с), 6,96 (1 Н, м), 7,18 (1 Н, м), 7,80 (1 Н, м), 7,88 (1 Н, дд, J=9,0 Гц и 2,1 Гц), 7,91 (1 Н, д, J=2,1 Гц),8,03 (1 Н, д, J=9,0 Гц), 10,21 (1 Н, с). Пример 44. 3-(4-Хлор-3-нитрофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(4-Хлор-3-нитрофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали,как описано в примере 1, исходя из 4-хлор-3-нитрофенола и (3-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-0,2% метанол). 1J=9,0 Гц, J=2,3 Гц), 7,92 (1H, д, J=2,0 Гц), 8,03 (1H, д, J=9,0 Гц), 10,15 (1H, с). Пример 45. 3-(4-Фтор-3-трифторметилфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил) пропионамид. 3-(4-Фтор-3-трифторметилфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 4-фтор-3-(трифторметил)фенола и (3-метил-4-нитрофенил) амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографиейH ЯМР (400 МГц, ДМСО-d6): 1,44 (3H, с), 2,53 (3H, с), 4,06 (1 Н, д, J=9,9 Гц), 4,32 (1 Н, д, J=9,9 Гц),6,23 (1 Н, с), 7,24-7,31 (2 Н, м), 7,38-7,43 (1 Н, м), 7,87 (1 Н, дд, J=9,0 Гц, J=2,1 Гц), 7,91 (1 Н, д, J=2,0 Гц),8,03 (1 Н, д, J=9,0 Гц), 10,14 (1 Н, с). Пример 46. 2-Гидрокси-3-[4-(2-метоксиэтил)фенокси]-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 2-Гидрокси-3-[4-(2-метоксиэтил)фенокси]-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 4-метоксиэтилфенола и (3-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-1% метанол). 1c) 3-(4-Фторфенокси)-2-гидрокси-2-метил-N-(2-метил-3-нитрофенил)пропионамид. 3-(4-Фторфенокси)-2-гидрокси-2-метил-N-(2-метил-3-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 4-фторфенола и (2-метил-3-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт счищали флэш-хроматографией (смесь дихлорметан-1% метанол). 1(1 Н, с). Пример 48. 3-(3-Хлор-4-фторфенокси)-2-гидрокси-2-метил-N-(2-метил-3-нитрофенил)пропионамид. 3-(3-Хлор-4-фторфенокси)-2-гидрокси-2-метил-N-(2-метил-3-нитрофенил) пропионамид получали,как описано в примере 1, исходя из 3-хлор-4-фторфенола и (2-метил-3-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан 1% метанол). 1H ЯМР (400 МГц, ДМСО-d6): 1,44 (3H, с), 2,27 (3H, с), 3,99 (1 Н, д, J=9,8 Гц), 4,23 (1 Н, д, J=9,8 Гц),6,15 (1 Н, с), 6,92-6,97 (1 Н, м), 7,17-7,20 (1 Н, м), 7,29-7,35 (1 Н, м), 7,41-7,46 (1 Н, м), 7,66-7,69 (1 Н, м),7,72-7,75 (1 Н, м), 9,72 (1 Н, с). Пример 49. 2-Гидрокси-3-[4-(2-метоксиэтил)фенокси]-2-метил-N-(2-метил-3-нитрофенил)пропионамид. 2-Гидрокси-3-[4-(2-метоксиэтил)фенокси]-2-метил-N-(2-метил-3-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 4-метоксиэтилфенола и (2-метил-3-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-2% метанол). 1a) Этиловый эфир (2-фтор-4-гидроксифенил)карбаминовой кислоты. Этилхлорформиат (0,37 мл, 3,9 ммоль) добавляли к перемешиваемому раствору 4-амино-3 фторфенола (0,5 г, 3,9 ммоль) в 2 мл 10% раствора NaOH. Реакционную смесь нагревали при 80 С в течение 30 мин. После охлаждения раствор подкисляли хлористоводородной кислотой с получением продукта.b) Этиловый эфир 2-фтор-4-[2-гидрокси-2-(3-метил-4-нитрофенилкарбамоил)пропокси]фенил карбаминовой кислоты. Этиловый эфир 2-фтор-4-[2-гидрокси-2-(3-метил-4-нитрофенилкарбамоил)пропокси]фенилкарбаминовой кислоты получали, как описано в примере 1, исходя из этилового эфира (2-фтор-4 гидроксифенил)карбаминовой кислоты и (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-1,8% метанол). 1a) (5-Амино-2-нитрофенил)метанол. К раствору 5-амино-2-нитробензойной кислоты (3,0 г, 16,4 ммоль) в 40 мл тетрагидрофурана добавляли 50 мл комплекса боран-тетрагидрофуран (1,0 М раствор в ТГФ). Смесь кипятили с обратным холодильником в течение 1 ч. Обычная обработка давала продукт. 1d) 3-(4-Циано-3-фторфенокси)-2-гидрокси-N-(3-гидроксиметил-4-нитрофенил)-2-метилпропионамид. 3-(4-Циано-3-фторфенокси)-2-гидрокси-N-(3-гидроксиметил-4-нитрофенил)-2-метилпропионамид получали, как описано в примере 1 с, исходя из 2-фтор-4-гидроксибензонитрила и (3-гидроксиметил-4 нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-6,6% метанол). 1(1 Н, дд, J=9,0 Гц, J=2,4 Гц), 8,09 (1 Н, д, J=9,0 Гц), 8,34 (1 Н, д, J=2,4 Гц), 10,24 (1 Н, с). Пример 52. 3-(4-Фторфениламино)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. Смесь (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты (0,2 г, 0,85 ммоль), 4 фторанилина (0,18 г, 1,7 ммоль) и перхлората натрия (0,21 г, 1,7 ммоль) в 2 мл ацетонитрила кипятили с обратным холодильником в течение 6 ч. После обработки реакционной смеси неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-1% метанол). 1H ЯМР (400 МГц, ДМСО-d6): 1,41 (3H, с), 2,51 (3H, с), 3,10 (1 Н, дд, J=12,7 Гц, J=4,6 Гц), 3,41 (1 Н,дд, J=12,7 Гц, J=7,7 Гц), 5,26 (1 Н, м), 6,02 (1 Н, с), 6,62-6,66 (2 Н, м), 6,84-6,89 (2 Н, м), 7,79-7,83 (2 Н, м),8,02 (1 Н, д, J=8,9 Гц), 9,99 (1 Н, с). Пример 53. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-(4-трифторметилфениламино)пропионамид. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-(4-трифторметилфениламино)пропионамид получали, как описано в примере 52, исходя из 4-(трифторметил)анилина и (3-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-1,5% метанол). 1(2 Н, м), 8,01 (1 Н, д, J=8,9 Гц), 10,02 (1 Н, с). Пример 54. 2-Гидрокси-3-(4-метокси-3-трифторметилфениламино)-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 2-Гидрокси-3-(4-метокси-3-трифторметилфениламино)-2-метил-N-(3-метил-4-нитрофенил) пропионамид получали, как описано в примере 52, исходя из 3-амино-6-метоксибензотрифторида и (3-метил-4 нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш- 17012430 хроматографией (смесь дихлорметан-1,5% метанол). 1H ЯМР (400 МГц, ДМСО-d6): 1,41 (3H, с), 2,51 (3H, с), 3,12 (1H, дд, J=13,0 Гц, J=4,8 Гц), 3,45 1H,дд, J=13,0 Гц, J=7,7 Гц), 3,71 (3H, с), 5,42 (1 Н, м), 6,00 (1 Н, с), 6,88 (1 Н, дд, J=8,9 Гц, J=2,7 Гц), 6,92 (1 Н,д, J=2,7 Гц), 6,97 (1 Н, д, J=8,9 Гц), 7,78 (1 Н, дд, J=8,9 Гц, J=2,3 Гц), 7,81 (1 Н, д, J=1,9 Гц), 8,00 (1 Н, д,J=8,9 Гц), 9,98 (1 Н, с). Пример 55. 3-(4-Цианофениламино)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(4-Цианофениламино)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 52, исходя из 4-аминобензонитрила и (3-метил-4-нитрофенил)амида 2-метилоксиран 2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-5% метанол). 1(2 Н, м), 8,01 (1 Н, д, J=8,9 Гц), 10,02 (1 Н, с). Пример 56. 3-(3-Хлор-4-цианофениламино)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(3-Хлор-4-цианофениламино)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 52, исходя из 4-амино-2-хлорбензонитрила и (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметак-3% метанол). 1H ЯМР (400 МГц, ДМСО-d6): 1,40 (3H, с), 2,52 (3H, с), 3,27 (1 Н, дд, J=13,8 Гц, J=5,5 Гц), 3,55 (1 Н,дд, J=13,8 Гц, J=6,9 Гц), 6,12 (1 Н, с), 6,72 (1 Н, дд, J=8,8 Гц, J=2,2 Гц), 6,90 (1 Н, д, J=2,2 Гц), 6,95-6,98 (1 Н,м), 7,46 (1 Н, д, J=8,7 Гц), 7,80 (1 Н, дд, J=8,9 Гц, J=2,3 Гц), 7,83 (1 Н, д, J=2,0 Гц), 8,02 (1 Н, д, J=8,9 Гц),10,05 (1 Н, с). Пример 57. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-(пиридин-3-илоксо)пропионамид. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-(пиридин-3-илоксо)пропионамид получали, как описано в примере 1, исходя из 3-гидроксипиридина и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-9% метанол). 1H ЯМР (400 МГц, ДМСО-d6): 1,45 (3H, с), 2,53 (3H, с), 4,06 (1 Н, д, J=9,8 Гц), 4,31 (1 Н, д, J=9,8 Гц),6,26 (1 Н, с), 7,28-7,32 (1 Н, м), 7,38-7,41 (1 Н, м), 7,87-7,93 (2 Н, м), 8,03 (1 Н, д, J=8,9 Гц), 8,15-8,17 (1 Н, м),8,26 (1 Н, д, J=2,4 Гц), 10,15 (1 Н, с). Пример 58. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-(пиридин-4-илоксо)пропионамид. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-(пиридин-4-илоксо)пропионамид получали, как описано в примере 1, исходя из 4-гидроксипиридина и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-7% метанол). 1(1 Н, с). Пример 59. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-(пиридин-2-илоксо)пропионамид. 2-Гидрокси-2-метил-N-(3-метил-4-нитрофенил)-3-(пиридин-2-илоксо)пропионамид получали, как описано в примере 1, исходя из 2-гидроксипиридина и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-2% метанол). 1H ЯМР (400 МГц, CDCl3): 1,53 (3H, с), 2,61 (3H, с), 4,58 (1 Н, д, J=12,3 Гц), 4,72 (1 Н, д, J=12,3 Гц),6,87 (1 Н, д, J=8,3 Гц), 7,00 (1 Н, т, J=6,1 Гц), 7,56 (1 Н, д, J=8,9 Гц), 7,64-7,69 (2 Н, м), 7,81 (1 Н, с), 8,03 (1 Н,д, J=8,9 Гц), 8,11 (1 Н, д, J=5,0 Гц), 9,33 (1 Н, с). Пример 60. 3-(2-Хлорпиридин-3-илоксо)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(2-Хлорпиридин-3-илоксо)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1, исходя из 2-хлор-3-гидроксипиридина и (3-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-2% метанол). 1N-(4-Фтор-3-метилфенил)-3-(4-фторфенокси)-2-гидрокси-2-метилпропионамид получали, как описано в примере 1 с, исходя из 4-фторфенола и (4-фтор-3-метилфенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-1,4% метанол). 1H ЯМР (400 МГц, ДМСО-d6): 1,40 (3H, с), 2,00 (3H, с), 2,20 (3H, с), 3,90 (1 Н, д, J=9,5 Гц), 4,15 (1 Н,д, J=9,5 Гц), 6,03 (1 Н, с), 6,84 (2 Н, д, J=8,7 Гц), 7,03-7,08 (1 Н, м), 7,44 (2 Н, д, J=8,7 Гц), 7,54-7,57 (1 Н, м),7,67-7,69 (1 Н, м), 9,62 (1 Н, с), 9,75 (1 Н,с). Пример 63. 3-(3-Хлор-4-цианофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(3-Хлор-4-цианофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали,как описано в примере 1, исходя из 2-хлор-4-гидроксибензонитрила и (2-метил-3-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-1,2% метанол). 1H ЯМР (400 МГц, ДМСО-d6): 1,55 (3H, с), 2,30 (3H, с), 3,03 (1 Н, д, J=5,1 Гц), 3,15 (1 Н, д, J=5,1 Гц),7,86 (1 Н, д, J=8,9 Гц), 8,08 (1 Н, дд, J=8,9 Гц, J=2,6 Гц), 8,15 (1 Н, д, J=2,5 Гц), 9,13 (1 Н, с). с) 3-(4-Циано-3-фторфенокси)-2-гидрокси-2-метил-N-(2-метил-4-нитрофенил)пропионамид. 3-(4-Циано-3-фторфенокси)-2-гидрокси-2-метил-N-(2-метил-4-нитрофенил)пропионамид получали,как описано в примере 1 с, исходя из 2-фтор-4-гидроксибензонитрила и (2-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-1,3% метанол). 1H ЯМР (400 МГц, ДМСО-d6): 1,46 (3H, с), 2,37 (3H, с), 4,13 (1 Н, д, J=10,1 Гц), 4,37 (1H, д, J=10,1 Гц), 6,51 (1H, с), 6,95-6,98 (1H, м), 7,17-7,21 (1H, м), 7,78-7,83 (1H, м), 8,05-8,12 (2H, м), 8,18 (1 Н, д, J=2,3 Гц), 9,57 (1 Н, с). Пример 65. 3-(3-Хлор-4-цианофенокси)-2-гидрокси-2-метил-N-(2-метил-4-нитрофенил)пропионамид. 3-(3-Хлор-4-цианофенокси)-2-гидрокси-2-метил-N-(2-метил-4-нитрофенил)пропионамид получали,как описано в примере 64 с, исходя из 2-хлор-4-гидроксибензонитрила и (2-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией (смесь дихлорметан-1,3% метанол). 1(0,2 г, 0,51 ммоль) растворяли в дихлорметане (10 мл) и добавляли оксид марганца (IV) (0,4 г, 4,6 ммоль). Смесь перемешивали при комнатной температуре в течение 48 ч. Твердый окислитель удаляли фильтрованием и растворитель выпаривали. Неочищенный продукт очищали флэш-хроматографией (смесь ди- 19012430 хлорметан-3% метанол). 1(1 Н, с), 10,55 (1 Н, с). Пример 67. 3-[4-(2-Диметиламиноэтокси)фенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил) пропионамид. а) [2-(4-Бензилоксифенокси)этил]диметиламин. 4-(Бензилокси)фенол (2,89 г, 0,01443 моль) в диметилформамиде (15 мл) и гидрохлорид 2(диметиламино)этилхлорида (2,32 г, 0,01611 моль) одновременно добавляли небольшими порциями к 5565% дисперсии гидрида натрия в минеральном масле (0,033 моль) в диметилформамиде (5 мл) при 0 С. Затем смеси давали нагреться до 90 С и перемешивание продолжали в течение 1,5 ч. Охлажденную смесь выливали в воду. Полученную смесь экстрагировали толуолом. Объединенные экстракты промывали 2,5 М раствором NaOH и водой и сушили над Na2SO4. Толуол выпаривали и полученный продукт использовали, как таковой, на следующей стадии. 1 Н ЯМР (300 МГц, ДМСО-d6): 2,20 (6 Н, с), 2,58 (2 Н, т, 3J=5,9 Гц), 3,96 (2 Н, т, 3J=5,9 Гц), 5,03 (2 Н, с),6,85 (2 Н, д, 3J=9,3 Гц), 6,92 (2 Н, д, 3J=9,3 Гц), 7,30-7,44 (5 Н, м).b) 4-(2-Диметиламиноэтокси)фенол. Перемешиваемый раствор [2-(4-бензилоксифенокси)этил]диметиламина (3,36 г, 0,01238 моль) в смеси 6 М HCl (67 мл)-этанол (33,5 мл) кипятили с обратным холодильником в течение 6,5 ч. Затем этанол выпаривали и рН доводили до 8 2,5 М раствором NaOH. Продукт экстрагировали этилацетатом. Экстракты промывали водой и сушили над Na2SO4. Удаление растворителя при пониженном давлении давало неочищенный продукт, который очищали флэш-хроматографией на силикагеле с использованием смеси гептан/этилацетат (9:1-6:4) в качестве градиентного элюента. 1c) 3-[4-(2-Диметиламиноэтокси)фенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-[4-(2-Диметиламиноэтокси)фенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 4-(2-диметиламиноэтокси)фенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Продукт экстрагировали при рН 8. Неочищенный продукт очищали флэш-хроматографией с использованием смеси дихлорметан-метанол в качестве градиентного элюента (метанол 0-20%). Кристаллизация из толуола. 1H ЯМР (400 МГц, ДМСО-d6): 1,42 (3H, с), 2,19 (6 Н, с), 2,53 (3H, с), 2,57 (2 Н, т, 3J=5,8 Гц), 3,90 (1 Н,2 д, Jgem=9,6 Гц), 3,95 (2 Н, т, 3J=5,9 Гц), 4,14 (1 Н, д, 2Jgem=9,5 Гц), 6,18 (1 Н, с, -ОН), 6,83 (4 Н, с), 7,88 (1 Н,дд, 3J=9,0 Гц, 4J=2,3 Гц), 7,93 (1 Н, д, 4J=1,8 Гц), 8,04 (1 Н, д, 3J=9,0 Гц), 10,14 (1 Н, с, -NHCO-). Пример 68. 3-(4-Цианометилфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(4-Цианометилфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали,как описано в примере 1 с, исходя из 4-гидроксибензилцианида и (3-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента (9:1-7:3) Кристаллизация из толуола,т.пл. 143-145 С. 1P.G. Baraldi et al. J. Med. Chem. 45 (2002) 115) и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали дважды флэш-хроматографией с использованием сначала смеси гептан/этилацетат в качестве градиентного элюента (9:1-8:2) и затем только дихлорметана. 1H ЯМР (400 МГц, ДМСО-d6): 1,43 (3H, с), 2,53 (3H, с), 2,93 (2 Н, т, 3J=7,1 Гц), 3,77 (2 Н, т, 3J=1, 1 Гц), 3,95 (1 Н, д, 2Jgem=9,6 Гц), 4,19 (1 Н, д, 2Jgem=9,6 Гц), около 6,2 (1 Н, уш.с, -ОН), 6,85 (2 Н, д, 3J=8,6 Гц),7,16 (2 Н, д, 3J=8,7 Гц), 7,89 (1 Н, дд, 3J=9,0 Гц, 4J=2,3 Гц), 7,94 (1 Н, д, 4J=2,2 Гц), 8,04 (1 Н, д, 3J=9,0 Гц),около 10,2 (1 Н, уш.с, -NHCO-). Пример 70. 2-Гидрокси-3-(4-гидроксиметилфенокси)-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 2-Гидрокси-3-(4-гидроксиметилфенокси)-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 4-гидроксибензилового спирта и (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента (95:5-25:75).(1 Н, с, -NHCO-). Пример 71. 2-Гидрокси-3-(4-гидроксифенокси)-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 2-Гидрокси-3-(4-гидроксифенокси)-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из гидрохинона и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента (9:1-6:4). 1J=2,4 Гц), 7,93 (1 Н, д, 4J=2,1 Гц), 8,04 (1 Н, д, 3J=9,0 Гц), 8,92 (1 Н, уш.с, ArOH), 10,13 (1 Н, уш.с, -NHCO-). Пример 72. 3-(3-Цианофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(3-Цианофенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 3-цианофенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента. Кристаллизация из толуола, т.пл. 107-110 С. 1(1 Н, т, 3J=7,8 Гц), 7,87 (1 Н, дд, 3J=9,0 Гц, 4J=2,3 Гц), 7,91 (1 Н, д, 4J=9,0 Гц, 4J=1,9 Гц), 8,03 (1 Н, д, 3J=9,0 Гц), около 10,1 (1 Н, уш.с, -NHCO-). Пример 73. 3-(3-Фтор-5-трифторметилфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил) пропионамид. 3-(3-Фтор-5-трифторметилфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 3-фтор-5-(трифторметил) фенола и (3-метил-4 нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента. Кристаллизация из смеси толуол/гептан. 1(1 Н, д, 4J=1,9 Гц), 8,03 (1 Н, д, 3J=9,0 Гц), 10,15 (1 Н, уш.с, -NHCO-). Пример 74. 3-(3,5-Дифторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(3,5-Дифторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 3,5-дифторфенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента (95:5-70:30). Кристаллизация из толуола, т.пл. 104106 С. 1 Н ЯМР (400 МГц, ДМСО-d6): 1,43 (3H, с), 2,53 (3H, с), 4,01 (1 Н, д, 2Jgem=9,9 Гц), 4,27 (1 Н, д, 2Jgem=9,8 Гц), около 6,3 (1 Н, уш.с, -ОН), 6,71 (2 Н, дд, 3JHF=9,5 Гц, 4JHH=2,1 Гц), 6,76 (1 Н, tт, 3JHF=9,4 Гц, 4JHH=2,3 Гц), 7,87 (1 Н, дд, 3J=9,0 Гц, 4J=2,4 Гц), 7,92 (1 Н, д, 4J=2,2 Гц), 8,04 (1 Н, д, 3J=9,0 Гц), около 10,1 (1 Н, уш.с,-NHCO-). Пример 75. 3-(2,3-Дифторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(2,3-Дифторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 2,3-дифторфенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали дважды флэш-хроматографией с использованием сначала смеси гептан/этилацетат (8:2) и затем дихлорметана в качестве элюента. Растирание в гептане,т.пл. 68-73 С. 1 Н ЯМР (300 МГц, ДМСО-d6): 1,44 (3H, с), 2,53 (3H, с), 4,11 (1 Н, д, 2Jgem=9,9 Гц), 4,31 (1 Н, д,2Jgem=9,8 Гц), 6,28 (1 Н, с, -ОН), 6,93-7,14 (3H, м), 7,86 (1 Н, дд, 3J=8,9 Гц, 4J=2,3 Гц), 7,91 (1 Н, д, 4J=2,1 Гц),8,03 (1 Н, д, 3J=8,9 Гц), 10,15 (1 Н, с, -NHCO-). Пример 76. 3-(2,6-Дифторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(2,6-Дифторфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 2,6-дифторфенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента (9:1-7:3). 1 Н ЯМР (400 МГц, ДМСО-d6): 1,40 (3H, с), 2,53 (3H, с), 4,16 (1 Н, д, 2Jgem=10,0 Гц), 4,31 (1 Н, д,2- 21012430 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента (9:1-5:5). Кристаллизация из смеси CH2Cl2/EtOH/гептан, т.пл. 84-87 С. 1 Н ЯМР (400 МГц, ДМСО-d6): 1,45 (3H, с), 2,53 (3H, с), 4,07 (1 Н, д, 2Jgem=9,8 Гц), 4,33 (1 Н, д,2J=8,3 Гц,), 7,88 (1 Н, дд, 3J=8,9 Гц, 4J=2,3 Гц), 7,92 (1 Н, д, 4J=2,0 Гц), 8,03 (1 Н, д, 3J=9,0 Гц), 10,15 (1 Н,уш.с, -NHCO-). Пример 78. 3-(3,5-Дихлорфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-(3,5-Дихлорфенокси)-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 3,5-дихлорфенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве элюента (9:1). Кристаллизация из толуола, т.пл. 141-143 С. 1 Н ЯМР (400 МГц, ДМСО-d6): 1,42 (3H, с), 2,53 (3H, с), 4,05 (1 Н, д, 2Jgem=10,1 Гц), 4,31 (1H, д,2a) 4-(3-Хлорпропил)фенол. 3-(4-Гидроксифенил)-1-пропанол (0,97 г, 0,006374 моль) и концентрированную HCl (20 мл) нагревали при 100 С в течение 14 ч. После охлаждения реакционную смесь выливали в воду и экстрагировали этилацетатом. Экстракты промывали водой, сушили и концентрировали в вакууме с получением неочищенного продукта. Очистка флэш-хроматографией (смесь гептан/этилацетат 9:1) давала чистый продуктTravaux Chimiques des Pays-Bas 114 (2) (1995) 65) и (3-метил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат (75:25) в качестве элюента, т.пл. 131-133 С. 1 Н ЯМР (400 МГц, ДМСО-d6): 1,42 (3H, с), 2,53 (3H, с), 3,88-3,93 (3H, м), 4,14-4,18 (3H, м), около 6,2 (1 Н, уш.с, -ОН), 6,86 (4 Н, с), 7,88 (1 Н, д, 3J=9,0 Гц), 7,92 (1 Н, с), 8,04 (1 Н, д, 3J=9,0 Гц), около 10,1(1 Н, уш.с, -NHCO-). Пример 81. 2-Гидрокси-3-(4-метоксиметилфенокси)-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 2-Гидрокси-3-(4-метоксиметилфенокси)-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали,как описано в примере 1 с, исходя из 4-(метоксиметил)фенола (J.M. Saa et al., J. Org. Chem. 53 (1988) 4263; D.R. Dimmel and D. Shepard, J. Org. Chem. 47 (1982) 22) и (3-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали с использованием флэшхроматографии несколько раз (смесь дихлорметан/метанол 99:1, гептан/этилацетат в качестве градиентного элюента (9:1-7:3), дихлорметан/метанол 99,5:0,5). 1 Н ЯМР (400 МГц, ДМСО-d6): 1,43 (3H, с), 2,53 (3H, с), 3,22 (3H, с), 3,97 (1 Н, д, 2Jgem=9,6 Гц), 4,20(1 Н, д, 3J=9,0 Гц), 7,93 (1 Н, с), 8,04 (1 Н, д, 3J=9,0 Гц), 10,13 (1 Н, уш.с, -NHCO-). Пример 82. 3-[4-(2-Фторэтил)фенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. Раствор 2-гидрокси-3-[4-(2-гидроксиэтил)фенокси]-2-метил-N-(3-метил-4-нитрофенил)пропионамида (полученного в примере 20, 300 мг, 0,0008012 моль) в сухом CH2Cl2 (3 мл) обрабатывали DeoxoFluor (195 мг, 0,0008813 моль) в сухом CH2Cl2 (1 мл) при температуре от -15 до -10 С. Раствор перемешивали в течение 2 ч при 0 С и затем в течение 3 суток при комнатной температуре. Добавляли насыщенный раствор NaHCO3 и смесь экстрагировали дихлорметаном. Объединенные экстракты промывали- 22012430 водой, сушили над Na2SO4, фильтровали и упаривали в вакууме. Неочищенный продукт очищали с использованием дихлорметана в качестве элюента. Кристаллизация из толуола давала желаемое соединение в виде чистых кристаллов: т.пл. 102-105 С. 1(875 мг, 0,003954 моль) в CH2Cl2 (3 мл) при температуре -76 С. Раствор перемешивали при -10 С в течение 3 ч. Добавляли насыщенный раствор NaHCO3 и смесь экстрагировали дихлорметаном. Объединенные экстракты промывали водой, сушили над Na2SO4, фильтровали и упаривали в вакууме. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента (9:1-5:5). Кристаллизация из смеси дихлорметан/гептан давала желаемое соединение. 1(10 мл) нагревали при 100 С в течение 1,5 ч. После охлаждения реакционную смесь выливали в воду и экстрагировали этилацетатом. Экстракты промывали водой, сушили и концентрировали в вакууме с получением неочищенного продукта. Очистка флэш-хроматографией (смесь гептан/этилацетат 9:1) давала чистый продукт (2,01 г, 92%). 1b) 3-[4-(2-Бромэтил)фенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-[4-(2-Бромэтил)фенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали,как описано в примере 1 с, исходя из 4-(2-бромэтил) фенола и (3-метил-4-нитрофенил) амида 2 метилоксиран-2-карбоновой кислоты. Очистка флэш-хроматографией на силикагеле (смесь дихлорметан/метанол 99:1 или толуол/метанол 99,5:0,5) давала неочищенный продукт. Конечную очистку проводили препаративной ВЭЖХ. 1 Н ЯМР (400 МГц, CDCl3): 1,59 (3H, с), 2,63 (3H, с), 3,10 (2 Н, т, 3J=7,5 Гц), около 3,5 (-ОН), 3,52J=8,6 Гц), 7,57 (1 Н, дд, 3J=8,9 Гц, 4J=2,3 Гц), 7,65 (1 Н, д, 4J=2,2 Гц), 8,06 (1 Н, д, 3J=8,9 Гц), 9,00 (1 Н, с,-NHCO-). Пример 85. 2-Гидрокси-3-[4-(2-йодэтил)фенокси]-2-метил-N-(3-метил-4-нитрофенил)пропионамид. а) 4-(2-Йодэтил)фенол. Трифенилфосфин (1,57 г, 0,006 моль) и имидазол (0,41 г, 0,006 моль) добавляли в сухой дихлорметан (20 мл). Когда имидазол был в растворе, добавляли йод (1,52 г, 0,006 моль). После осаждения гидройодид имидазола добавляли (4-гидроксифенэтиловый)спирт (0,69 г, 0,005 моль). Смесь перемешивали при комнатной температуре в течение 4 ч. Добавляли воду и смесь экстрагировали дихлорметаном. Экстракты промывали водой, сушили и концентрировали в вакууме с получением неочищенного продукта. Очистка флэш-хроматографией (смесь гептан/этилацетат в качестве градиентного элюента 9:1-6:4) давала чистый продукт. 1b) 2-Гидрокси-3-[4-(2-йодэтил)фенокси]-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 2-Гидрокси-3-[4-(2-йодэтил)фенокси]-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали,как описано в примере 1 с, исходя из 4-(2-йодэтил)фенола и (3-метил-4-нитрофенил)амида 2-метилоксиран-2-карбоновой кислоты. Очистка флэш-хроматографией на силикагеле (смесь гептан/этилацетат в качестве градиентного элюента 9:1-6:4) давала неочищенный продукт. Конечную очистку проводили препаративной ВЭЖХ. 1- 23012430 Карбонат калия (7,53 г, 0,05448 моль) добавляли к раствору гидрохинона (2,00 г, 0,01816 моль) и 1,2-дибромэтана (3,39 г, 0,01805 моль) в ацетоне (50 мл). Смесь кипятили с обратным холодильником в течение 6 ч в атмосфере азота. Полученную смесь фильтровали, добавляли воду и рН доводили до 2-3. Смесь экстрагировали этилацетатом. Экстракты промывали водой, сушили над безводным Na2SO4,фильтровали и упаривали. Неочищенный продукт очищали флэш-хроматографией на силикагеле с использованием смеси гептан/этилацетат в качестве градиентного элюента (95:5-70:30) с получением чистого желаемого соединения в виде белых кристаллов. 1b) 3-[4-(2-Бромэтокси)фенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. 3-[4-(2-Бромэтокси)фенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 4-(2-бромэтокси)фенола и (3-метил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией на силикагеле с использованием смеси гептан/этилацетат в качестве градиентного элюента (9:1-6:4). Желаемое соединение кристаллизовали из дихлорметана, т.пл. 135-138 С. 1H ЯМР (400 МГц, ДМСО-d6): 1,42 (3H, с), 2,53 (3H, с), 3,75 (2 Н, т, 3J=5,5 Гц), 3,92 (1 Н, д, 2Jgem=9,6 Гц), 4,15 (1 Н, д, 2Jgem=9,5 Гц), 4,23 (2 Н, т, 3J=5,4 Гц), 6,16 (1 Н, уш.с, -ОН), 6,36 (4 Н, с), 7,88 (1 Н, дд, 3J=9,0 Гц, 4J=2,2 Гц), 7,92 (1 Н, д, 4J=1,7 Гц), 8,04 (1 Н, д, 3J=8,9 Гц), 10,12 (1 Н, уш.с, -NHCO-). Пример 87. 3-[4-(2-Хлорэтил)-3-фторфенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. а) 3-Фтор-4-(2-гидроксиэтил)фенол. Комплекс боран-тетрагидрофуран (1,0 М раствор в ТГФ, 22 мл, 0,02200 моль) добавляли по каплям к раствору (2-фтор-4-гидроксифенил)уксусной кислоты (Р.С. Belanger et al. EP 106565 B1, 2,27 г, 0,01145 моль) в сухом ТГФ (40 мл) в атмосфере азота при -10 С и полученный раствор перемешивали в течение 2 ч при -10 С. Добавляли воду и продукт экстрагировали этилацетатом. Объединенные экстракты промывали водой, сушили и упаривали в вакууме с получением продукта. 1b) 4-(2-Хлорэтил)-3-фторфенол. 4-(2-Хлорэтил)-3-фторфенол получали, как описано в примере 74 а, исходя из 3-фтор-4-(2 гидроксиэтил)фенола. Неочищенный продукт очищали флэш-хроматографией на силикагеле с использованием смеси гептан/этилацетат в качестве элюента (85:15). 1c) 3-[4-(2-Хлорэтил)-3-фторфенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид 3-[4-(2-Хлорэтил)-3-фторфенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид получали, как описано в примере 1 с, исходя из 4-(2-хлорэтил)-3-фторфенола и (3-метил-4-нитрофенил) амида 2-метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием дихлорметана в качестве элюента. Продукт кристаллизовали из смеси дихлорметан/гептан, т.пл. 77-79 С. 1N-(3-Этил-4-нитрофенил)-2-метилакриламид получали, как описано в примере 1 а, исходя из 3-этил 4-нитрофениламина (W. Pfleiderer et al. патент США 2002/0146737 А 1) и метакрилоилхлорида. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат (9:1) в качестве элюента. 1b) (3-Этил-4-нитрофенил)амид 2-метилоксиран-2-карбоновой кислоты. 3-Хлорпероксибензойную кислоту (14,71 г, 0,08524 моль) добавляли порциями к кипящему раствору N-(3-этил-4-нитрофенил)-2-метилакриламида (6,68 г, 0,02852 моль) и 2,6-ди-трет-бутил-4-метилфенола (149 мг) в дихлорметане (180 мл). После кипячения с обратным холодильником в течение 5 ч реакционной смеси давали охладиться до комнатной температуры. Осажденную 3-хлорбензойную кислоту отфильтровывали и фильтрат экстрагировали три раза 1 М раствором Na2CO3 и водой. Органическую фазу сушили над безводным Na2SO4, фильтровали и упаривали. Неочищенный продукт очищали флэшхроматографией с использованием дихлорметана в качестве элюента. 1c) 3-(4-Цианофенокси)-N-(3-этил-4-нитрофенил)-2-гидрокси-2-метилпропионамид. 3-(4-Цианофенокси)-N-(3-этил-4-нитрофенил)-2-гидрокси-2-метилпропионамид получали, как описано в примере 1 с, исходя из 4-цианофенола и (3-этил-4-нитрофенил)амида 2-метилоксиран-2 карбоновой кислоты. Неочищенный продукт очищали флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента (9:1-6:4). 1H ЯМР (400 МГц, ДМСО-d6): 1,21 (3H, т, 3J=7,4 Гц), 1,45 (3H, с), 2,86 (2 Н, кв, 3J=7,5 Гц), 4,09 (1 Н,2 д, Jgem=9,9 Гц), 4,33 (1 Н, д, 2Jgem=9,8 Гц), 6,26 (1 Н, уш.с, -ОН), 7,11 (2 Н, д, 3J=8,8 Гц), 7,74 (2 Н, д, 3J=8,7 Гц), 7,89 (1 Н, д, 3J=9,1 Гц), 7,94 (1 Н, с), 7,98 (1 Н, д, 3J=8,9 Гц), 10,17 (1 Н, уш.с, -NHCO-). Пример 89. 3-(4-Циано-3-фторфенокси)-N-(3-этил-4-нитрофенил)-2-гидрокси-2-метилпропионамид. 3-(4-Циано-3-фторфенокси)-N-(3-этил-4-нитрофенил)-2-гидрокси-2-метилпропионамид получали,как описано в примере 1 с, исходя из 2-фтор-4-гидроксибензонитрила и (3-этил-4-нитрофенил)амида 2 метилоксиран-2-карбоновой кислоты. Неочищенный продукт очищали дважды флэш-хроматографией с использованием смеси гептан/этилацетат в качестве градиентного элюента, и конечную очистку проводили препаративной ВЭЖХ. 1a) 3-(2-Фтор-4-гидроксифенил)-1,1-диметилмочевина. 4-Амино-3-фторфенол (0,47 г, 3,0 ммоль) растворяли в 15 мл сухого ТГФ в атмосфере азота, охлаждали до 0 С и добавляли по каплям N,N'-диметилкарбамилхлорид (0,28 мл, 3,0 ммоль). Реакционной смеси давали нагреться до комнатной температуры и затем кипятили с обратным холодильником в течение 4 ч. Реакционную смесь вновь охлаждали до 0 С, добавляли 0,2 мл воды и реакционную смесь фильтровали. Маточный раствор упаривали, растворяли в 25 мл EtOAc, промывали 10 мл 1 М раствора Na2CO3, 10 мл воды и сушили над Na2SO4. Продукт очищали хроматографией (EtOAc:толуол 1:1). 1a) N-(2-Фтор-4-гидроксифенил)метансульфонамид. 4-Амино-3-фторфенол (0,254 г, 2,0 ммоль) растворяли в 10 мл сухого пиридина в атмосфере азота и охлаждали до 0 С. Добавляли по каплям метансульфонилхлорид (0,17 мл, 2,1 ммоль) и перемешивали в течение 3 суток при комнатной температуре. Реакционную смесь упаривали, добавляли 25 мл толуола и упаривали вновь. Выпаривание толуола повторяли. Остаток растворяли в 25 мл EtOAc, промывали 20 мл воды и выпаривали досуха с получением красно-коричневого твердого N-(2-фтор-4-гидроксифенил)метансульфонамида. 1(1 Н, с). Пример 93. 3-[4-(2-Аминоацетиламино)-3-фторфенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. а) Трет-бутиловый эфир (2-фтор-4-гидроксифенилкарбамоил)карбаминовой кислоты. Трет-бутоксикарбониламиноуксусную кислоту (=Вос-глицин) (0,256 г, 2,0 ммоль) растворяли в 10 мл CH2Cl2 в атмосфере азота, охлаждали до 0 С. Добавляли DCC (0,412 г, 2,0 ммоль) и давали нагреться до комнатной температуры. Добавляли 4-амино-3-фторфенол (0,350 г, 2,0 ммоль) в 10 мл CH2Cl2 с последующим добавлением 5 мл ТГФ. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре, кипятили с обратным холодильником в течение 2 ч и перемешивали в течение ночи при комнатной температуре. Реакционную смесь упаривали, растворяли в 30 мл EtOAc и добавляли некоторое количество гептана для осаждения остатков (DHU), образовавшихся из DCC. Осадок отфильтровывали и промывали гептаном. Маточный раствор упаривали, растворяли в 10 мл EtOAc и добавляли по каплям 2 мл толуола для осаждения. После фильтрования фильтрат упаривали с получением третбутилового эфира (2-фтор-4-гидроксифенилкарбамоил)карбаминовой кислоты. 1c) 3-[4-(2-Аминоацетиламино)-3-фторфенокси]-2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамид. Трет-бутиловый эфир (2-фтор-4-[2-гидрокси-2-(3-метил-4-нитрофенилкарбамоилметил)карбаминовой кислоты (0,160 г, 0,3 ммсль) растворяли в 5 мл CH2Cl2 в атмосфере азота и охлаждали до 0 С. Добавляли по каплям трифторуксусную кислоту (0,5 мл) и реакционной смеси давали нагреться до комнатной температуры с последующим перемешиванием при комнатной температуре в течение 2 ч. Реакционную смесь упаривали досуха, остаток растворяли в 25 мл EtOAc и промывали 10 мл воды. Добавляли толуол (25 мл) и осторожно упаривали досуха с получением 3-[4-(2-аминоацетиламино)-3-фторфенокси]2-гидрокси-2-метил-N-(3-метил-4-нитрофенил)пропионамида. 1(1 Н, д, J=9,3 Гц), 6,25 (1 Н, с), 6,78 (1 Н, д, J=9,0 Гц), 6,95 (1 Н, д, J=13,0 Гц), 7,60-7,72 (1 Н, м), 7,88 (1 Н, д,J=8,8 Гц), 7,93 (1 Н, с), 8,00-8,15 (4 Н, м), 10,05 (1 Н, с), 10,12 (1 Н, с). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные пропионамида формулы (I)R2 представляет нитро, циано или атом галогена; в которых R5, R6, R7, R8 и R9 независимо представляют атом водорода, атом галогена, нитро, циано,(C1-C7)алкил, галоген (С 1-С 7)алкил, циано (С 1-С 7)алкил, гидрокси(С 1-С 7)алкил, (C1-C7)алкокси(С 1 С 7)алкил, -NHCOR10, -COR11, -OR12, -NHSO2R13 или -SF15 или R6 и R7 образуют вместе с любым атомом(ами) кольца, с которым они связаны, 6-членное ароматическое карбоциклическое кольцо или 5 членное гетероциклическое кольцо, содержащее 1 атом азота или 2 атома кислорода;R12 и R15 независимо представляют атом водорода, (С 1-С 7)алкил, галоген(С 1-С 7)алкил или моно- или ди(С 1-С 7)алкиламино(С 1-С 7)алкил;R16 и R17 независимо представляют атом водорода или (С 1-С 7)алкил;R19 и R20 независимо представляют атом водорода или атом галогена; и их фармацевтически приемлемые соли. 2. Соединение по п.1, в котором R4 представляет атом водорода и R3 является метилом. 3. Соединение по п.1 или 2, в котором X представляет О. 4. Соединение по одному из пп.1-3, в котором R1 представляет метил или гидроксиметил и R2 является нитро или циано. 5. Соединение по одному из пп.1-4, в котором R5, R6, R7, R8 и R9 независимо представляют атом водорода, атом галогена, нитро, циано, (С 1-С 7)алкил, (С 1-С 7)алкокси, галоген(C1-C7)алкил, гидрокси(С 1 С 7)алкил или -NHCOR10, где R10 является (C1-C7)алкилом, галоген(С 1-С 7)алкилом, гидрокси или (С 1 С 7)алкокси. 6. Соединение по п.5, в котором по меньшей мере один из R5, R6, R7, R8 и R9 представляет атом галогена. 7. Соединение по п.6, в котором по меньшей мере два из R5, R6, R7, R8 и R9 выбраны из группы, состоящей из атома галогена, циано и ацетамидо. 8. Фармацевтическая композиция, содержащая соединение формулы (I) вместе с фармацевтически приемлемым носителем. 9. Способ лечения или профилактики зависимых от андрогенного рецептора состояний, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I). 10. Способ по п.9, включающий пероральное введение терапевтически эффективного количества соединения формулы (I).
МПК / Метки
МПК: C07D 213/68, C07C 255/58, A61P 5/26, A61K 31/277, C07C 235/24, A61K 31/167, A61P 15/16, A61K 31/395
Метки: производные, рецепторов, андрогенных, пропионамида, качестве, полезные, модуляторов
Код ссылки
<a href="https://eas.patents.su/28-12430-proizvodnye-propionamida-poleznye-v-kachestve-modulyatorov-androgennyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пропионамида, полезные в качестве модуляторов андрогенных рецепторов</a>












