Замещённые производные метиленамида в качестве модуляторов протеинтирозинфосфатаз ( ртрs )
Номер патента: 12260
Опубликовано: 28.08.2009
Авторы: Бомбрун Агнеш, Свиннен Доминик, Гонсалес Жером, Жербер Патрик, Питте Пьер-Андре
Формула / Реферат
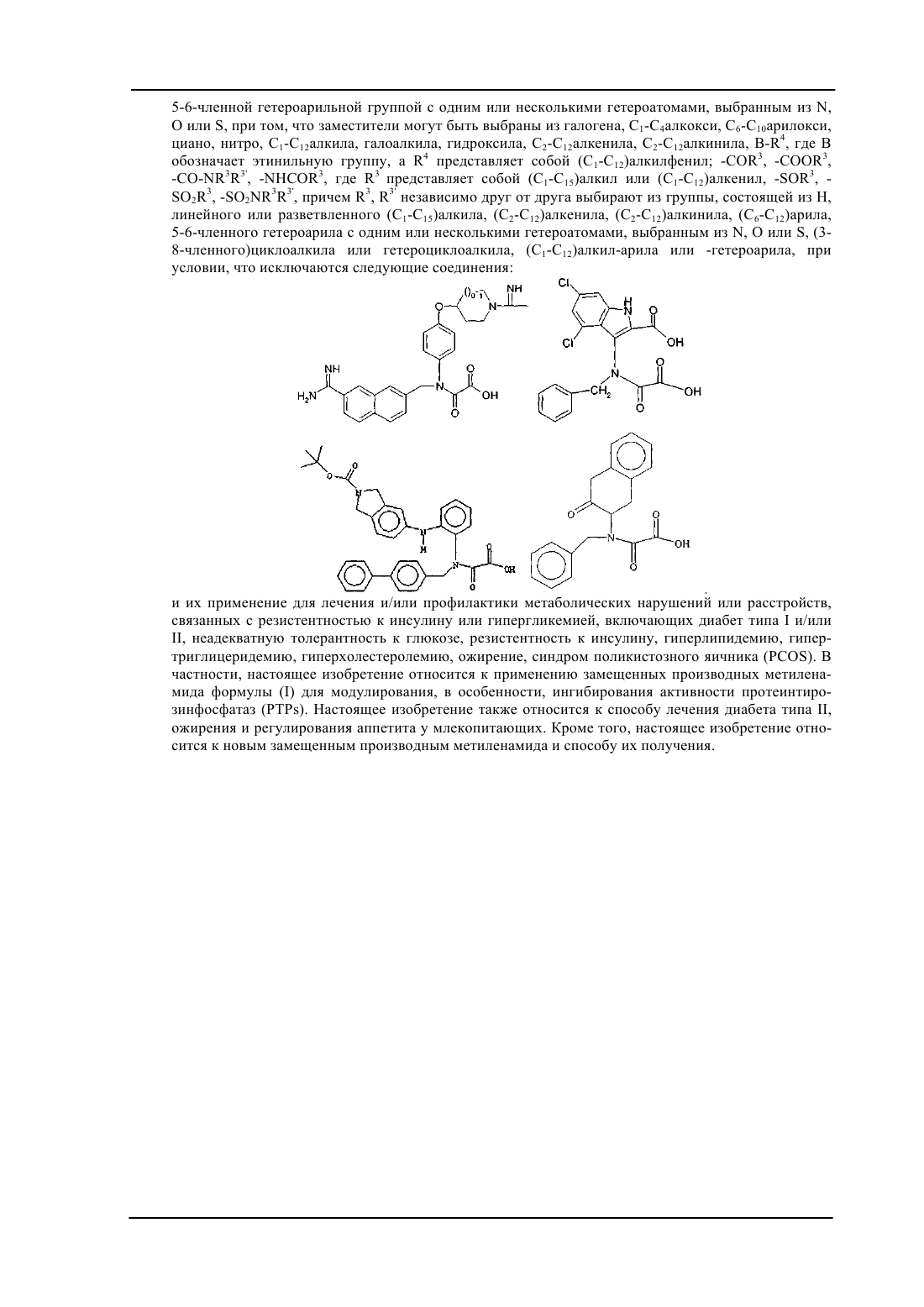
1. Замещенное производное метиленамида формулы (I)

а также его геометрические изомеры, его оптически активные формы, такие как энантиомеры, диастереомеры, и его рацематные формы, а также его фармацевтически приемлемые соли, где
R1 выбирают из группы, состоящей из (С1-С15)алкила, фрагментов СН2А или СН2СН2А (где А означает необязательно замещенный (С6-С12)арил или необязательно замещенный (С6-С12)гетероарил), необязательно замещенных (С6-С14)арила, (3-8-членного)циклоалкила, (С1-С12)алкиларила, моно-, би- или трициклического гетероарила с конденсированными кольцами или (3-8-членного)гетероциклила или (С1-С12)алкилгетероциклила, и которые содержат 1-3 гетероатомов, выбранных из кислорода, азота или серы;
R2a и R2b, каждый независимо друг от друга, выбирают из группы, которая включает или состоит из Н или (С1-С12)алкила;
Cy представляет собой необязательно замещенный (С6-С12)арил, 5-6-членную гетероарильную группу с одним или несколькими гетероатомами, выбранными из N, О или S; тиенил или фенил, замещенный необязательно замещенной (С6-С12)арильной группой или необязательно замещенной 5-6-членной гетероарильной группой с одним или несколькими гетероатомами, выбранными из N, О или S,
при том, что заместители могут быть выбраны из галогена, (С1-С4)алкокси, (С6-С10)арилокси, циано, нитро, (С1-С12)алкила, галоалкила, гидроксила, (С2-С12)алкенила, (С2-С12)алкинила, B-R4, где В обозначает этинильную группу, a R4 представляет собой (С1-С12)алкилфенил; -COR3, -COOR3, -CO-NR3R3', -NHCOR3, где R3 представляет собой (С1-С15)алкил или (С1-С12)алкенил, -SOR3, -SO2R3, -SO2NR3R3', причем R3, R3' независимо друг от друга выбирают из группы, состоящей из Н, линейного или разветвленного (С1-С15)алкила, (С2-С12)алкенила, (С2-С12)алкинила, (С6-С12)арила, 5-6-членного гетероарила с одним или несколькими гетероатомами, выбранными из N, О или S, (3-8-членного)циклоалкила или гетероциклоалкила, (С1-С12)алкил-арила или -гетероарила,
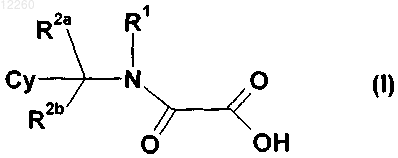
при условии, что исключаются следующие соединения:

2. Замещенные производные метиленамида по п.1, где R2a и R2b, каждый, представляют собой Н.
3. Замещенное производное метиленамида по п.1 или 2, где Cy представляет собой тиенильную или фенильную группу.
4. Замещенное производное метиленамида по п.3, где Cy представляет собой тиенил, фенил, замещенный фенильной или оксадиазольной группой или одним или двумя фрагментами, выбранными из группы, состоящей из -NH-CO-R3, -SO2-NR3R3' или -CO-NR3R3', в которых R3, R3' независимо выбирают из Н, (С1-С15)алкила, (С2-С12)алкенила, (С2-С12)алкинила, (С6-С12)арила, 5-6-членного гетероарила с одним или несколькими гетероатомами, выбранными из N, О или S, (3-8-членного)циклоалкила или гетероциклоалкила, (С1-С12)алкиларила или (С1-С12)алкилгетероарила.
5. Замещенное производное метиленамида по п.4, согласно которому R3' представляет собой Н и R3 выбирают из группы, состоящей из дифенилэтила, додецила, октила, 4-пентилбензила, этилтиофен-2-ила, пентадецила, тридецила, гексилоксифенила или (2-этил)гексила.
6. Замещенный метиленамид по п.1, согласно которому Cy представляет собой фенильную, пиридинильную, нафтильную или бензофуранильную группу, которая замещена радикалом B-R4, где В означает этинильную группу и R4 представляет собой (С1-С12)алкилфенил.
7. Замещенный метиленамид по п.6, согласно которому Cy представляет собой фенил, замещенный радикалом B-R4, где В означает этинильную группу и R4 представляет собой (С6-С16)алкил.
8. Замещенное производное метиленамида по любому из пп.1-7, согласно которому R1 означает фрагмент -СН2-А или -СН2-СН2-А, где А представляет собой необязательно замещенный (С6-С12)арил, гетероарил, определенные, как в п.1, (3-8-членный)гетероциклоалкил или (3-8-членный)циклоалкил.
9. Замещенное производное метиленамида по любому из пп.1-7, согласно которому R1 означает А, где А представляет собой (С6-С12)арил, гетероарил, определенные, как в п.1, (3-8-членный)гетероциклоалкил или (3-8-членный)циклоалкил.
10. Замещенное производное метиленамида по п.8 или 9, где А выбирают из группы, состоящей из фенильной, пиридинильной, бензо-1,3-диоксоланильной, бифенильной, нафтильной, хиноксалинильной, тиазолильной, тиенильной, фуранильной или пиперидинильной группы, которая необязательно замещена одной или двумя группами циано, галоген, NO2, (С1-С6)алкокси, арилокси или гетероарилокси, (С1-С6)тиоалкокси, (С1-С12)алкил, (С1-С12)алкил-Х (где X представляет собой галоген), (С2-С12)алкенил, (С2-С12)алкинил, арил, гетероарил, (3-8-членный)циклоалкил или гетероциклоалкил, (С1-С12)алкиларил или (С1-С12)алкилгетероарил, (С2-С12)алкениларил или (С2-С12)алкенилгетероарил, (С2-С12)алкиниларил или (С2-С12)алкинилгетероарил, -COR3, -COOR3, -CO-NR3R3', -NHCOR3, где R3 представляет собой (С1-С12)алкил или (С1-С12)алкенил, -SOR3, -SO2R3, -SO2NR3R3', причем R3, R3' независимо друг от друга выбирают из группы, состоящей из Н, линейного или разветвленного (С1-С12)алкила, (С2-С12)алкенила, (С2-С12)алкинила, арила, гетероарила, (3-8-членного)циклоалкила или гетероциклоалкила.
11. Замещенное производное метиленамида по любому из пп.1-5 и 8-10, где
R2a и R2b, каждый, представляют собой Н;
R1 означает -СН2-А, где А представляет собой фенил, необязательно замещенный группой циано, галоген, метокси, гидрокси, фенокси, -NO2, трифторметил;
Cy представляет собой тиенил, фенил или бифенил, который замещен группой -SO2R3, -CO-NR3R3', в которых R3' означает Н и R3 означает (С7-С12)алкил, предпочтительно (С8-С12)алкил и особенно предпочтительно додецильную группу.
12. Замещенное производное метиленамида по любому из пп.1-5 и 8-10, где
R2a и R2b, каждый, представляют собой Н;
R1 означает -СН2-А, где А представляет собой фенил, необязательно замещенный группой циано, галоген, метокси, гидрокси, фенокси, -NO2, трифторметил;
Cy представляет собой тиенил, фенил или бифенил, замещенный группой -SO2R3, -CO-NR3R3', в которой R3' означает Н и R3 означрхт (С7-С15)алкил, предпочтительно (С8-С15)алкил и особенно предпочтительно додецильную группу.
13. Замещенное производное метиленамида формулы (I') по любому из пп.1-5 или 8-10

где R1 выбирают из группы, состоящей из фенила, бензила, фенэтила, 1-метилбензила, который может быть замещен (С1-С6)алкильной группой или циклоалкильной группой;
Cy представляет собой фенильную или бифенильную группу, замещенную фрагментом, выбранным из группы, состоящей из -NH-CO-R3, -CO-NH-R3, или оксадиазольной группы, замещенной радикалом R3, где R3 представляет собой (С7-С15)алкил, предпочтительно (С8-С15)алкил и особенно предпочтительно додецильную группу.
14. Замещенное производное метиленамида по любому из предшествующих пунктов, выбранное из следующей группы соединений:
(бензил{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
оксо{{4-[(пентадециламино)карбонил]бензил}[4-(трифторметил)бензил]амино}уксусная кислота;
(бензил{4-[(пентадециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
(бензил{4-[(тридециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
[бензил(4-{[додецил(метил)амино]карбонил}бензил)амино](оксо)уксусная кислота;
{(4-{[додецил(метил)амино]карбонил}бензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
([1-(трет-бутоксикарбонил)-4-пиперидинил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[3-(трифторметил)бензил]амино}(оксо)уксусная кислота;
({[1-(трет-бутоксикарбонил)-4-пиперидинил]метил}{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
оксо{[4-(тридеканоиламино)бензил][4-(трифторметил)бензил]амино}уксусная кислота;
[бензил(4-{[4-(гексилокси)бензоил]амино}бензил)амино](оксо)уксусная кислота;
оксо{[4-(трифторметил)бензил][4-(10-ундеценоиламино)бензил]амино}уксусная кислота;
оксо{{4-[(9Е)-9-тетрадеценоиламино]бензил}-[4-(трифторметил)бензил]амино}уксусная кислота;
{бензил[4-(тридеканоиламино)бензил]амино}(оксо)уксусная кислота;
{{4-[(2-гидроксидодецил)амино]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
оксо{[4-(трифторметил)бензил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
{({5-[(додециламино)сульфонил]-2-тиенил}метил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}({1-[(4-метоксифенил)сульфонил]-4-пиперидинил}метил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(2-карбокси-1-фенилэтил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(2-метокси-1-метилэтил)амино](оксо)уксусная кислота;
(4-бром{4-[(додециламино)карбонил]бензил}анилино)(оксо)уксусная кислота;
({4-[(додециламино)карбонил]бензил}анилино)(оксо)уксусная кислота;
([2-(3-хлорфенил)этил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[2-(3-метоксифенил)этил]амино}(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[(d,l)-транс-2-фенилциклопропил]амино}(оксо)уксусная кислота;
([(d,l)-транс-2-(бензилокси)циклопентил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
({4-[(додециламино)карбонил]бензил}-4-феноксианилино)(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(1,2,3,4-тетрагидро-1-нафталенил)амино](оксо)уксусная кислота;
((1-бензил-4-пиперидинил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[2-(4-феноксифенил)этил]амино}(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[2-(2-феноксифенил)этил]амино}(оксо)уксусная кислота;
((2-[1,1'-бифенил]-4-илэтил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
(([1,1'-бифенил]-3-илметил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
(3-(бензилокси){4-[(додециламино)карбонил]бензил}анилино)(оксо)уксусная кислота;
([4-(бензоиламино)бензил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
N-(карбоксикарбонил)-N-{4-[(додециламино)карбонил]бензил}-3-фенил-b-аланин;
{{4-[(додециламино)карбонил]бензил}[4-(1,2,3-тиадиазол-4-ил)бензил]амино}(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(4-пентилбензил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(1-фенилэтил)амино](оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[1-(1-нафтил)этил]амино}(оксо)уксусная кислота;
(бензил{3-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{{3-[(додециламино)карбонил]бензил}[4-(метилсульфонил)бензил]амино}(оксо)уксусная кислота;
((3-цианобензил){3-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{{3-[(додециламино)карбонил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
[(4-хлорбензил)(3-{[(4-пентилбензил)амино]карбонил}бензил)амино](оксо)уксусная кислота;
оксо{[4-({[2-(2-тиенил)этил]амино}карбонил)бензил][4-(трифторметил)бензил]амино}уксусная кислота;
{бензил[(3'-{[(2,2-дифенилэтил)амино]карбонил}[1,1'-бифенил]-4-ил)метил]амино}(оксо)уксусная кислота;
{(3-цианобензил)[(3'-{[(2,2-дифенилэтил)амино]карбонил}[1,1'-бифенил]-4-ил)метил]амино}(оксо)уксусная кислота;
{(4-хлорбензил)[(3'-{[(2,2-дифенилэтил)амино]карбонил}[1,1'-бифенил]-4-ил)метил]амино}(оксо)уксусная кислота;
{[(3'-{[(2,2-дифенилэтил)амино]карбонил}[1,1'-бифенил]-4-ил)метил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
((3-цианобензил){[3'-({[2-(4-феноксифенил)этил]амино}карбонил)[1,1'-бифенил]-4-ил]метил}амино)(оксо)уксусная кислота;
оксо{{[3'-({[2-(4-феноксифенил)этил]амино}карбонил)[1,1'-бифенил]-4-ил]метил}-[4-(трифторметил)бензил]амино}уксусная кислота;
[(3-цианобензил)({3'-[(октиламино)карбонил][1,1'-бифенил]-4-ил}метил)амино](оксо)уксусная кислота;
[(4-хлорбензил)({3'-[(октиламино)карбонил][1,1'-бифенил]-4-ил}метил)амино](оксо)уксусная кислота;
{({3'-[(октиламино)карбонил][1,1'-бифенил]-4-ил}метил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(3-цианобензил)[(3'-{[(3-фенилпропил)амино]карбонил}[1,1'-бифенил]-4-ил)метил]амино}(оксо)уксусная кислота;
[(3-цианобензил)({3'-[(додециламино)карбонил][1,1'-бифенил]-4-ил}метил)амино](оксо)уксусная кислота;
[(4-хлорбензил)({3'-[(додециламино)карбонил][1,1'-бифенил]-4-ил}метил)амино](оксо)уксусная кислота;
{({3'-[(додециламино)карбонил][1,1'-бифенил]-4-ил}метил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{бензил[(3'-{[(4-пентилбензил)амино]карбонил}[1,1'-бифенил]-4-ил)метил]амино}(оксо)уксусная кислота;
{(3-цианобензил)[(3'-{[(4-пентилбензил)амино]карбонил}[1,1'-бифенил]-4-ил)метил]амино}(оксо)уксусная кислота;
{(4-хлорбензил)[(3'-{[(4-пентилбензил)амино]карбонил}[1,1'-бифенил]-4-ил)метил]амино}(оксо)уксусная кислота;
оксо{[(3'-{[(4-пентилбензил)амино]карбонил}[1,1'-бифенил]-4-ил)метил][4-(трифторметил)бензил]амино}уксусная кислота;
оксо{[(3'-{[(4-фенилбутил)амино]карбонил}[1,1'-бифенил]-4-ил)метил][4-(трифторметил)бензил]амино}уксусная кислота;
{(3-цианобензил)[(3'-{[(2-мезитилэтил)амино]карбонил}[1,1'-бифенил]-4-ил)метил]амино}(оксо)уксусная кислота;
{(4-хлорбензил)[(3'-{[(2-мезитилэтил)амино]карбонил}[1,1'-бифенил]-4-ил)метил]амино}(оксо)уксусная кислота;
{[(3'-{[(2-мезитилэтил)амино]карбонил}[1,1'-бифенил]-4-ил)метил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
((4-хлорбензил){[3'-({[2-(4-метоксифенил)этил]амино}карбонил)[1,1'-бифенил]-4-ил]метил}амино)(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(4-метоксибензил)амино](оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[4-(метилсульфонил)бензил]амино}(оксо)уксусная кислота;
[{3-[(додециламино)карбонил]бензил}(4-метоксибензил)амино](оксо)уксусная кислота;
{{3-[(додециламино)карбонил]бензил}[3-(трифторметил)бензил]амино}(оксо)уксусная кислота;
({4-[(додециламино)карбонил]бензил}{[6-(трифторметил)-3-пиридинил]метил}амино)(оксо)уксусная кислота;
4-[((карбоксикарбонил){3-[(додециламино)карбонил]бензил}амино)метил]бензойная кислота;
({3-[(додециламино)карбонил]бензил}{4-[гидрокси(оксидо)амино]бензил}амино)(оксо)уксусная кислота;
[{3-[(додециламино)карбонил]бензил}(2-фторбензил)амино](оксо)уксусная кислота;
[{3-[(додециламино)карбонил]бензил}(2-пиридинилметил)амино](оксо)уксусная кислота;
[{3-[(додециламино)карбонил]бензил}(3-тиенилметил)амино](оксо)уксусная кислота;
[{3-[(додециламино)карбонил]бензил}(4-гидроксибензил)амино](оксо)уксусная кислота;
[{3-[(додециламино)карбонил]бензил}(4-феноксибензил)амино](оксо)уксусная кислота;
({3-[(додециламино)карбонил]бензил}{[6-(трифторметил)-3-пиридинил]метил}амино)(оксо)уксусная кислота;
3-[((карбоксикарбонил){3-[(додециламино)карбонил]бензил}амино)метил]бензойная кислота;
5-[((карбоксикарбонил){3-[(додециламино)карбонил]бензил}амино)метил]-2-тиофенкарбоновая кислота;
({4-[(додециламино)карбонил]бензил}{4-[гидрокси(оксидо)амино]бензил}амино)(оксо)уксусная кислота;
((1,3-бензодиоксол-5-илметил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(2-фторбензил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(4-феноксибензил)амино](оксо)уксусная кислота;
4-[((карбоксикарбонил){4-[(додециламино)карбонил]бензил}амино)метил]бензойная кислота;
5-[((карбоксикарбонил){4-[(додециламино)карбонил]бензил}амино)метил]-2-тиофенкарбоновая кислота;
[{3-[(додециламино)карбонил]бензил}(2-тиенилметил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(изопропил)амино](оксо)уксусная кислота;
((3,5-дихлорбензил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
[(3,5-дихлорбензил)(4-{[(3,3-дифенилпропил)амино]карбонил}бензил)амино](оксо)уксусная кислота;
[(4-{[(2-[1,1'-бифенил]-4-илэтил)амино]карбонил}бензил)(3,5-дихлорбензил)амино](оксо)уксусная кислота;
[(1,3-бензодиоксол-5-илметил)(4-{[(2-[1,1'-бифенил]-4-илэтил)амино]карбонил}бензил)амино](оксо)уксусная кислота;
(2,3-дигидро-1Н-инден-1-ил{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{2,3-дигидро-1Н-инден-1-ил[4-({[2-(4-феноксифенил)этил]амино}карбонил)бензил]амино}(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(4-пиридинилметил)амино](оксо)уксусная кислота;
([4-(диметиламино)бензил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(3-пиридинилметил)амино](оксо)уксусная кислота;
((4-цианобензил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(1,3-тиазол-2-илметил)амино](оксо)уксусная кислота;
({4-[(додециламино)карбонил]бензил}{[2-(4-морфолинил)-1,3-тиазол-5-ил]метил}амино)(оксо)уксусная кислота;
[{3-[(додециламино)карбонил]бензил}(4-пиридинилметил)амино](оксо)уксусная кислота;
[{3-[(додециламино)карбонил]бензил}(3-пиридинилметил)амино](оксо)уксусная кислота;
[{3-[(додециламино)карбонил]бензил}(3-гидроксибензил)амино](оксо)уксусная кислота;
((4-цианобензил){3-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
[{3-[(додециламино)карбонил]бензил}(1,3-тиазол-2-илметил)амино](оксо)уксусная кислота;
({3-[(додециламино)карбонил]бензил}{[2-(4-морфолинил)-1,3-тиазол-5-ил]метил}амино)(оксо)уксусная кислота;
((1,3-бензодиоксол-5-илметил){3-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(2-тиенилметил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(2-пиридинилметил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(3-тиенилметил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(4-гидроксибензил)амино](оксо)уксусная кислота;
3-[((карбоксикарбонил){4-[(додециламино)карбонил]бензил}амино)метил]бензойная кислота;
[циклопентил({5-[(додециламино)сульфонил]-2-тиенил}метил)амино](оксо)уксусная кислота;
[бензил({5-[(додециламино)сульфонил]-2-тиенил}метил)амино](оксо)уксусная кислота;
(({5-[(додециламино)сульфонил]-2-тиенил}метил){3-[гидрокси(оксидо)амино]бензил}амино)(оксо)уксусная кислота;
[({5-[(додециламино)сульфонил]-2-тиенил}метил)(4-метоксибензил)амино](оксо)уксусная кислота;
[({5-[(додециламино)сульфонил]-2-тиенил}метил)(2-фторбензил)амино](оксо)уксусная кислота;
{({5-[(додециламино)сульфонил]-2-тиенил}метил)[4-(метилсульфонил)бензил]амино}(оксо)уксусная кислота;
[({5-[(додециламино)сульфонил]-2-тиенил}метил)(4-феноксибензил)амино](оксо)уксусная кислота;
4-{[(карбоксикарбонил)({5-[(додециламино)сульфонил]-2-тиенил}метил)амино]метил}бензойная кислота;
(({5-[(додециламино)сульфонил]-2-тиенил}метил){[6-(трифторметил)-3-пиридинил]метил}амино)(оксо)уксусная кислота;
{({5-[(додециламино)сульфонил]-2-тиенил}метил)[3-(трифторметил)бензил]амино}(оксо)уксусная кислота;
[(3-хлорбензил)({5-[(додециламино)сульфонил]-2-тиенил}метил)амино](оксо)уксусная кислота;
{[(5-{[(3,3-дифенилпропил)амино]сульфонил}-2-тиенил)метил][3-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(3-хлорбензил)[(5-{[(3,3-дифенилпропил)амино]сульфонил}-2-тиенил)метил]амино}(оксо)уксусная кислота;
оксо{{[5-({[2-(4-феноксифенил)этил]амино}сульфонил)-2-тиенил]метил}[3-(трифторметил)бензил]амино}уксусная кислота;
((3-хлорбензил){[5-({[2-(4-феноксифенил)этил]амино}сульфонил)-2-тиенил]метил}амино)(оксо)уксусная кислота;
{[(5-{[(2-[1,1'-бифенил]-4-илэтил)амино]сульфонил}-2-тиенил)метил][3-(трифторметил)бензил]амино}(оксо)уксусная кислота;
(({1-[(циклогексиламино)карбонил]-4-пиперидинил}метил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
([(1-{[4-(диметиламино)анилино]карбонил}-4-пиперидинил)метил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[(1-гексаноил-4-пиперидинил)метил]амино}(оксо)уксусная кислота;
({4-[(додециламино)карбонил]бензил}{[1-(3-иодбензоил)-4-пиперидинил]метил}амино)(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[(1-{(2Е)-3-[3-(трифторметил)фенил]-2-пропеноил}-4-пиперидинил)метил]амино}(оксо)уксусная кислота;
({4-[(додециламино)карбонил]бензил}{[1-(2-хиноксалинилкарбонил)-4-пиперидинил]метил}амино)(оксо)уксусная кислота;
[({1-[(4-метоксифенил)сульфонил]-4-пиперидинил}метил)-(4-{[(4-феноксибензил)амино]карбонил}бензил)амино](оксо)уксусная кислота;
[{[1-(3-иодбензоил)-4-пиперидинил]метил}(4-{[(4-феноксибензил)амино]карбонил}бензил)амино](оксо)уксусная кислота;
оксо{(4-{[(4-феноксибензил)амино]карбонил}бензил)[(1-{(2Е)-3-[3-(трифторметил)фенил]-2-пропеноил}-4-пиперидинил)метил]амино}уксусная кислота;
{{4-[(додециламино)карбонил]фенил}[2-(метоксикарбонил)бензил]амино}(оксо)уксусная кислота;
[[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2-бромбензил]-(4-иодбензил)амино](оксо)уксусная кислота;
[(2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил)(4-иодбензил)амино](оксо)уксусная кислота;
[{2-бром-4-[(додециламино)карбонил]бензил}(4-иодбензил)амино](оксо)уксусная кислота;
[(2,6-дибром-4-{[(4-пентилбензил)амино]карбонил}бензил)(4-иодбензил)амино](оксо)уксусная кислота;
((4-иодбензил){[4'-({[2-(4-феноксифенил)этил]амино}карбонил)-1,1'-бифенил-4-ил]метил}амино)(оксо)уксусная кислота;
{[2-бром-4-({[2-(4-феноксифенил)этил]амино}карбонил)бензил][(4'-фтор-1,1'-бифенил-3-ил)метил]амино}(оксо)уксусная кислота;
{[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2-бромбензил][(4'-фтор-1,1'-бифенил-3-ил)метил]амино}(оксо)уксусная кислота;
{(2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил)[(4'-фтор-1,1'-бифенил-3-ил)метил]амино}(оксо)уксусная кислота;
{[2,6-дибром-4-({[2-(4-феноксифенил)этил]амино}карбонил)бензил][(4'-фтор-1,1'-бифенил-3-ил)метил]амино}(оксо)уксусная кислота;
{[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2,6-дибромбензил][(4'-фтор-1,1'-бифенил-3-ил)метил]амино}(оксо)уксусная кислота;
{(2,6-дибром-4-{[(4-пентилбензил)амино]карбонил}бензил)[(4'-фтор-1,1'-бифенил-3-ил)метил]амино}(оксо)уксусная кислота;
{{2,6-дибром-4-[(додециламино)карбонил]бензил}[(4'-фтор-1,1'-бифенил-3-ил)метил]амино}(оксо)уксусная кислота;
([(4'-фтор-1,1'-бифенил-3-ил)метил]{[4'-({[2-(4-феноксифенил)этил]амино}карбонил)-1,1'-бифенил-4-ил]метил}амино)(оксо)уксусная кислота;
{({4'-[(додециламино)карбонил]-1,1'-бифенил-4-ил}метил)[(4'-фтор-1,1'-бифенил-3-ил)метил]амино}(оксо)уксусная кислота;
{(2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил)-[2-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
{(2,6-дибром-4-{[(4-пентилбензил)амино]карбонил}бензил)-[2-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
оксо{{[4'-({[2-(4-феноксифенил)этил]амино}карбонил)-1,1'-бифенил-4-ил]метил}-[2-(трифторметокси)бензил]амино}уксусная кислота;
{({4'-[(додециламино)карбонил]-1,1'-бифенил-4-ил}метил)[2-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
[[2-бром-4-({[2-(4-феноксифенил)этил]амино}карбонил)бензил](3-феноксибензил)амино](оксо)уксусная кислота;
[[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2-бромбензил](3-феноксибензил)амино](оксо)уксусная кислота;
[(2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил)(3-феноксибензил)амино](оксо)уксусная кислота;
[[2,6-дибром-4-({[2-(4-феноксифенил)этил]амино}карбонил)бензил]-(3-феноксибензил)амино](оксо)уксусная кислота;
[[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2,6-дибромбензил](3-феноксибензил)амино](оксо)уксусная кислота;
[(2,6-дибром-4-{[(4-пентилбензил)амино]карбонил}бензил)(3-феноксибензил)амино](оксо)уксусная кислота;
[{2,6-дибром-4-[(додециламино)карбонил]бензил}(3-феноксибензил)амино](оксо)уксусная кислота;
оксо((3-феноксибензил){[4'-({[2-(4-феноксифенил)этил]амино}карбонил)-1,1'-бифенил-4-ил]метил}амино)уксусная кислота;
оксо[[(4'-{[(4-пентилбензил)амино]карбонил}-1,1'-бифенил-4-ил)метил](3-феноксибензил)амино]уксусная кислота;
[({4'-[(додециламино)карбонил]-1,1'-бифенил-4-ил}метил)(3-феноксибензил)амино](оксо)уксусная кислота;
[[2-бром-4-({[2-(4-феноксифенил)этил]амино}карбонил)бензил](2-иодбензил)амино](оксо)уксусная кислота;
[[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2-бромбензил](2-иодбензил)амино](оксо)уксусная кислота;
[(2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил)(2-иодбензил)амино](оксо)уксусная кислота;
[{2-бром-4-[(додециламино)карбонил]бензил}(2-иодбензил)амино](оксо)уксусная кислота;
([2-бром-4-({[2-(4-феноксифенил)этил]амино}карбонил)бензил]{[2'-(трифторметил)-1,1'-бифенил-4-ил]метил}амино)(оксо)уксусная кислота;
([4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2-бромбензил]{[2'-(трифторметил)-1,1'-бифенил-4-ил]метил}амино)(оксо)уксусная кислота;
((2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил){[2'-(трифторметил)-1,1'-бифенил-4-ил]метил}амино)(оксо)уксусная кислота;
({2-бром-4-[(додециламино)карбонил]бензил}{[2'-(трифторметил)-1,1'-бифенил-4-ил]метил}амино)(оксо)уксусная кислота;
([4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2,6-дибромбензил]{[2'-(трифторметил)-1,1'-бифенил-4-ил]метил}амино)(оксо)уксусная кислота;
((2,6-дибром-4-{[(4-пентилбензил)амино]карбонил}бензил){[2'-(трифторметил)-1,1'-бифенил-4-ил]метил}амино)(оксо)уксусная кислота;
({2,6-дибром-4-[(додециламино)карбонил]бензил}{[2'-(трифторметил)-1,1'-бифенил-4-ил]метил}амино)(оксо)уксусная кислота;
(({4'-[(додециламино)карбонил]-1,1'-бифенил-4-ил}метил){[2'-(трифторметил)-1,1'-бифенил-4-ил]метил}амино)(оксо)уксусная кислота;
[[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2-бромбензил](1,1'-бифенил-2-илметил)амино](оксо)уксусная кислота;
[(1,1'-бифенил-2-илметил)(2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил)амино](оксо)уксусная кислота;
((1,1'-бифенил-2-илметил){2-бром-4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{(1,1'-бифенил-2-илметил)[2,6-дибром-4-({[2-(4-феноксифенил)этил]амино}карбонил)бензил]амино}(оксо)уксусная кислота;
[[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2,6-дибромбензил](1,1'-бифенил-2-илметил)амино](оксо)уксусная кислота;
[(1,1'-бифенил-2-илметил)(2,6-дибром-4-{[(4-пентилбензил)амино]карбонил}бензил)амино](оксо)уксусная кислота;
((1,1'-бифенил-2-илметил){2,6-дибром-4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{(2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил)-[4-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
{{2-бром-4-[(додециламино)карбонил]бензил}[4-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
{(2,6-дибром-4-{[(4-пентилбензил)амино]карбонил}бензил)[4-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
{(2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил)[3-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
{{2-бром-4-[(додециламино)карбонил]бензил}[3-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
{(2,6-дибром-4-{[(4-пентилбензил)амино]карбонил}бензил)[3-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
{{2,6-дибром-4-[(додециламино)карбонил]бензил}[3-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
{({4'-[(додециламино)карбонил]-1,1'-бифенил-4-ил}метил)[3-(трифторметокси)бензил]амино}(оксо)уксусная кислота;
[[2-бром-4-({[2-(4-феноксифенил)этил]амино}карбонил)бензил](4-феноксибензил)амино](оксо)уксусная кислота;
[[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2-бромбензил](4-феноксибензил)амино](оксо)уксусная кислота;
[(2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил)(4-феноксибензил)амино](оксо)уксусная кислота;
[{2-бром-4-[(додециламино)карбонил]бензил}(4-феноксибензил)амино](оксо)уксусная кислота;
[[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2,6-дибромбензил](4-феноксибензил)амино](оксо)уксусная кислота;
[(2,6-дибром-4-{[(4-пентилбензил)амино]карбонил}бензил)(4-феноксибензил)амино](оксо)уксусная кислота;
{[4-({[2-(1,1'-бифенил-4-ил)этил]амино}карбонил)-2-бромбензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(2-бром-4-{[(4-пентилбензил)амино]карбонил}бензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{2-бром-4-[(додециламино)карбонил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(2,6-дибром-4-{[(4-пентилбензил)амино]карбонил}бензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{2,6-дибром-4-[(додециламино)карбонил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
оксо{[(4'-{[(4-пентилбензил)амино]карбонил}-1,1'-бифенил-4-ил)метил][4-(трифторметил)бензил]амино}уксусная кислота;
{{2-бром-4-[(додециламино)карбонил]бензил}[3-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{2,6-дибром-4-[(додециламино)карбонил]бензил}[3-(трифторметил)бензил]амино}(оксо)уксусная кислота;
оксо{[(4'-{[(4-пентилбензил)амино]карбонил}-1,1'-бифенил-4-ил)метил][3-(трифторметил)бензил]амино}уксусная кислота;
{(4-дибензо[b,d]фуран-4-илбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(4-дибензо[b,d]фуран-4-илбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
({4-[(додециламино)карбонил]бензил}{1-[4-(трифторметил)фенил]этил}амино)(оксо)уксусная кислота;
({4-[(додециламино)карбонил]бензил}{1-[4-(трифторметил)фенил]этил}амино)(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{({4'-[(октиламино)карбонил]-1,1'-бифенил-4-ил}метил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
оксо{(4-тетрадец-1-инилбензил)[4-(трифторметил)бензил]амино}уксусная кислота;
{(4-додец-1-инилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[4-(трифторметил)фенил]амино}(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(2-метоксифенил)амино](оксо)уксусная кислота;
((1,2-дифенилэтил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
N-(карбоксикарбонил)-N-{4-[(додециламино)карбонил]бензил}-L-фенилаланин;
[{4-[(додециламино)карбонил]бензил}(3-феноксифенил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(2-изопропоксифенил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(4-иодфенил)амино](оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[3-фтор-4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
((3-хлор-2-метилфенил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
4'-((карбоксикарбонил){4-[(додециламино)карбонил]бензил}амино)-1,1'-бифенил-2-карбоновая кислота;
((2,4-дихлорбензил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(1-фенилпропил)амино](оксо)уксусная кислота;
([2-(4-хлорфенил)пропил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(4-изопропоксифенил)амино](оксо)уксусная кислота;
([4-(бензилокси)фенил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[2-(трифторметил)бензил]амино}(оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(2-метоксибензил)амино](оксо)уксусная кислота;
([(1R)-1-(4-хлорфенил)этил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
((3,4-дихлорбензил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
((1-бензотиен-3-илметил){4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
([2-(2,6-дихлорфенил)этил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
({4-[(додециламино)карбонил]бензил}{2-[3-(трифторметил)фенил]этил}амино)(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[2-(3-фторфенил)этил]амино}(оксо)уксусная кислота;
([(1S)-1-(4-хлорфенил)этил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[(1S)-1-фенилэтил]амино}(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]бензил}[(1R)-1-фенилэтил]амино}(оксо)уксусная кислота;
([3-(бензилокси)фенил]-{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
N-(карбоксикарбонил)-N-{4-[(додециламино)карбонил]бензил}-D-фенилаланин;
{{4-[(додециламино)карбонил]фенил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[(додециламино)карбонил]фенил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
оксо{{1-[4-(трифторметил)фенил]этил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
оксо{{1-[4-(трифторметил)фенил]этил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
([(2-бутил-1-бензофуран-3-ил)метил]{4-[(додециламино)карбонил]бензил}амино)(оксо)уксусная кислота;
{(1-{4-[(додециламино)карбонил]фенил}этил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(1-{4-[(додециламино)карбонил]фенил}этил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{(4-{[(4-октилфенил)амино]карбонил}бензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(3-хлорбензил)[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{(3-хлорбензил)[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{{циклопентил[4-(трифторметил)фенил]метил}-[4-(тридеканоиламино)бензил]амино}(оксо)уксусная кислота;
оксо([4-(трифторметил)бензил]{[4-(3-ундецил-1,2,4-оксадиазол-5-ил)-1-нафтил]метил}амино)уксусная кислота;
оксо([4-(трифторметил)бензил]{[4-(3-ундецил-1,2,4-оксадиазол-5-ил)-1-нафтил]метил}амино)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{{циклопентил[4-(трифторметил)фенил]метил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{{циклопентил[4-(трифторметил)фенил]метил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{(4-дибензо[b,d]фуран-4-илфенил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(4-дибензо[b,d]фуран-4-илфенил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{[4-(октилокси)бензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{[4-(октилокси)бензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
[[2-(3-хлорфенил)этил](4-дец-1-инилбензил)амино](оксо)уксусная кислота;
([2-(3-хлорфенил)этил]{4-[(1Z)-дец-1-енил]бензил}амино)(оксо)уксусная кислота;
{[2-(3-хлорфенил)этил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[2-(3-хлорфенил)этил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
оксо{{(1R)-1-[4-(трифторметил)фенил]этил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
оксо{{(1R)-1-[4-(трифторметил)фенил]этил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
оксо{[4-(трифторметил)фенил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
оксо{[4-(трифторметил)фенил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
оксо{{(1S)-1-[4-(трифторметил)фенил]этил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
оксо{{(1S)-1-[4-(трифторметил)фенил]этил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
[(3-хлорбензил)(4-дец-1-инилбензил)амино](оксо)уксусная кислота;
[(3-хлорбензил)(4-дец-1-инилбензил)амино](оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
[[2-(3-хлорфенил)этил](4-окт-1-инилбензил)амино](оксо)уксусная кислота;
[[2-(3-хлорфенил)этил](4-окт-1-инилбензил)амино](оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. 1-деокси-1-(метиламино)глюцитолом);
{(4-дец-1-инилбензил)[4-(трифторметил)фенил]амино}(оксо)уксусная кислота;
((4-дец-1-инилбензил)-{1-[4-(трифторметил)фенил]этил}амино)(оксо)уксусная кислота;
((4-дец-1-инилбензил){1-[4-(трифторметил)фенил]этил}амино)(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{{1-метил-1-[4-(трифторметил)фенил]этил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{{1-метил-1-[4-(трифторметил)фенил]этил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{[2-(3-хлорфенил)этил][4-(3-октил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[2-(3-хлорфенил)этил][4-(3-октил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с-1-деокси-1-(метиламино)глюцитолом);
{[4-(3-октил-1,2,4-оксадиазол-5-ил)бензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{[4-(3-октил-1,2,4-оксадиазол-5-ил)бензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{{[4-(додецилокси)-1-нафтил]метил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{[4-(додецилокси)-1-нафтил]метил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
[(4-бромбензил)(4-окт-1-инилбензил)амино](оксо)уксусная кислота;
[{4-[(додециламино)карбонил]бензил}(2-гидрокси-1-фенилэтил)амино](оксо)уксусная кислота;
((4-дец-1-инилбензил){1-метил-1-[4-(трифторметил)фенил]этил}амино)(оксо)уксусная кислота;
((4-дец-1-инилбензил){1-метил-1-[4-(трифторметил)фенил]этил}амино)(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
оксо{{4-[(9Z)-тетрадец-9-еноиламино]бензил}-[4-(трифторметил)бензил]амино}уксусная кислота;
{(4-дец-1-инилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
оксо{[4-(трифторметил)бензил][3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
оксо{[4-(трифторметил)бензил][3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{(4-додецилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(4-додецилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{[4-({[(2-бутил-1-бензофуран-3-ил)метил]амино}карбонил)бензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(4-{[4-(бензилокси)бензоил]амино}бензил)-[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(3,5-дихлорбензил)[4-(тридеканоиламино)бензил]амино}(оксо)уксусная кислота;
{(3,5-дихлорбензил)[4-(тридеканоиламино)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{{4-[(4-октилфенил)этинил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
оксо{[4-(трифторметил)бензил][4-(5-ундецил-1,2,4-оксадиазол-3-ил)бензил]амино}уксусная кислота;
оксо{[4-(трифторметил)бензил][4-(5-ундецил-1,2,4-оксадиазол-3-ил)бензил]амино}уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{{4-[2-(4-октилфенил)этил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(4-{[4-(гептилокси)фенил]этинил}бензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[(4-бутилфенил)этинил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[(4-гексилфенил)этинил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[(4-гексилфенил)этинил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
оксо{(4-{[4-(пентилокси)фенил]этинил}бензил)[4-(трифторметил)бензил]амино}уксусная кислота;
оксо{{4-[(4-пропилфенил)этинил]бензил}[4-(трифторметил)бензил]амино}уксусная кислота;
[[2-(3-хлорфенил)этил](4-додец-1-инилбензил)амино](оксо)уксусная кислота;
[[2-(3-хлорфенил)этил](4-додец-1-инилбензил)амино](оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{(4-окт-1-инилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{[4-(11-гидроксиундец-1-инил)бензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{[4-(11-метокси-11-оксоундец-1-инил)бензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
11-[4-({(карбоксикарбонил)[4-(трифторметил)бензил]амино}метил)фенил]ундец-10-иновая кислота;
{(4-{[4-(бензилокси)фенил]этинил}бензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(4-{2-[4-(гептилокси)фенил]этил}бензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[2-(4-бутилфенил)этил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[2-(4-гексилфенил)этил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[2-(4-гексилфенил)этил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
оксо{(4-{2-[4-(пентилокси)фенил]этил}бензил)[4-(трифторметил)бензил]амино}уксусная кислота;
оксо{{4-[2-(4-пропилфенил)этил]бензил}[4-(трифторметил)бензил]амино}уксусная кислота;
11-[4-({(карбоксикарбонил)[4-(трифторметил)бензил]амино}метил)фенил]ундецановая кислота;
{[4-(11-гидроксиундецил)бензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(4-додец-1-инилбензил)[4-(трифторметил)фенил]амино}(оксо)уксусная кислота;
{(4-додец-1-инилбензил)[4-(трифторметил)фенил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
оксо([4-(трифторметил)бензил]{4-[2-(3-ундецил-1,2,4-оксадиазол-5-ил)этил]бензил}амино)уксусная кислота;
оксо([4-(трифторметил)бензил]{4-[2-(3-ундецил-1,2,4-оксадиазол-5-ил)этил]бензил}амино)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{{4-[2-(3-октил-1,2,4-оксадиазол-5-ил)этил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[2-(3-октил-1,2,4-оксадиазол-5-ил)этил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{{4-[(4-октилбензоил)амино]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{4-[(4-октилбензоил)амино]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
оксо{[(1-тридеканоилпиперидин-4-ил)метил][4-(трифторметил)бензил]амино}уксусная кислота;
{{[1-(4-октилбензоил)пиперидин-4-ил]метил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{[1-(4-октилбензоил)пиперидин-4-ил]метил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. с 1-деокси-1-(метиламино)глюцитолом);
{[(3-дец-1-инил-1-бензофуран-5-ил)метил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{[(3-додец-1-инил-1-бензофуран-5-ил)метил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
оксо{({3-[(4-пропилфенил)этинил]-1-бензофуран-5-ил}метил)-[4-(трифторметил)бензил]амино}уксусная кислота;
[(4-додец-1-инилбензил)(4-фторбензил)амино](оксо)уксусная кислота;
[бис(4-окт-1-инилбензил)амино](оксо)уксусная кислота;
{[(6-додец-1-инилпиридин-3-ил)метил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(3-додец-1-инилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{[2-(2-фторфенил)этил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[2-(2-фторфенил)этил][3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[2-(2-фторфенил)этил][4-(3-октил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[2-(3,4-дихлорфенил)этил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[2-(3,4-дихлорфенил)этил][3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[2-(3,4-дихлорфенил)этил][4-(3-октил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[2-(1,1'-бифенил-4-ил)этил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[2-(1,1'-бифенил-4-ил)этил][3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[2-(1,1'-бифенил-4-ил)этил][4-(3-октил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
оксо{5,6,7,8-тетрагидронафталин-1-ил-[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
оксо{5,6,7,8-тетрагидронафталин-1-ил-[3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
[[4-(3-октил-1,2,4-оксадиазол-5-ил)бензил](5,6,7,8-тетрагидронафталин-1-ил)амино](оксо)уксусная кислота;
{(1,1'-бифенил-3-илметил)[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{(1,1'-бифенил-3-илметил)[3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{(1,1'-бифенил-3-илметил)[4-(3-октил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусэря кислота;
{(1-бензотиен-3-илметил)[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{(1-бензотиен-3-илметил)[3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{(1-бензотиен-3-илметил)[4-(3-октил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
оксо{[2-(трифторметил)бензил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
оксо{[2-(трифторметил)бензил][3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
{[4-(3-октил-1,2,4-оксадиазол-5-ил)бензил][2-(трифторметил)бензил]амино}(оксо)уксусная кислота;
оксо{[3-(трифторметил)бензил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
оксо{[3-(трифторметил)бензил][3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
{[4-(3-октил-1,2,4-оксадиазол-5-ил)бензил][3-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(2-метоксибензил)[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{(2-метоксибензил)[3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{(2-метоксибензил)[4-(3-октил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
оксо{{4-[(трифторметил)сульфонил]бензил}[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
оксо{{4-[(трифторметил)сульфонил]бензил}[3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}уксусная кислота;
([4-(3-октил-1,2,4-оксадиазол-5-ил)бензил]{4-[(трифторметил)сульфонил]бензил}амино)(оксо)уксусная кислота;
{1,3-бензодиоксол-5-ил-[4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{1,3-бензодиоксол-5-ил-[3-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{1,3-бензодиоксол-5-ил-[4-(3-октил-1,2,4-оксадиазол-5-ил)бензил]амино}(оксо)уксусная кислота;
{[(4-додец-1-инил-1-нафтил)метил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{[(4-дец-1-инил-1-нафтил)метил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
оксо{[4-(трифторметил)бензил][4-(4-ундецил-1,3-тиазол-2-ил)бензил]амино}уксусная кислота;
{(4-дец-1-инилбензил)[2-(2-фторфенил)этил]амино}(оксо)уксусная кислота;
{(4-додец-1-инилбензил)[2-(2-фторфенил)этил]амино}(оксо)уксусная кислота;
{{[4-(додецилокси)-1-нафтил]метил}[2-(2-фторфенил)этил]амино}(оксо)уксусная кислота;
{[2-(2-фторфенил)этил][4-(октилокси)бензил]амино}(оксо)уксусная кислота;
{(4-дец-1-инилбензил)[2-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(4-додец-1-инилбензил)[2-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{[4-(додецилокси)-1-нафтил]метил}[2-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{[4-(октилокси)бензил][2-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(4-дец-1-инилбензил)[2-(3,4-дихлорфенил)этил]амино}(оксо)уксусная кислота;
[[2-(3,4-дихлорфенил)этил](4-додец-1-инилбензил)амино](оксо)уксусная кислота;
([2-(3,4-дихлорфенил)этил]{[4-(додецилокси)-1-нафтил]метил}амино)(оксо)уксусная кислота;
{[2-(3,4-дихлорфенил)этил][4-(октилокси)бензил]амино}(оксо)уксусная кислота;
({4-[(4-гексилфенил)этинил]бензил}{1-метил-1-[4-(трифторметил)фенил]этил}амино)(оксо)уксусная кислота;
{[4-(5-циклогексилпент-1-инил)бензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{{3-[(4-гексилфенил)этинил]бензил}[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{[4-(4-этил-3-гидроксиокт-1-инил)бензил][4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(2-дец-1-инилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота;
{(4-дец-1-инилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с L-лизином;
{(4-дец-1-инилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с трометаминамином (т.е. с (2-амино-2-гидроксиметил)-1,3-пропандиолом);
{(4-дец-1-инилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусная кислота, соль с L-аргинином;
натриевая соль {(4-дец-1-инилбензил)[4-(трифторметил)бензил]амино}(оксо)уксусной кислоты.
15. Применение замещенного производного метиленамида формулы (I)
а также его геометрических изомеров, его оптически активных форм, таких как энантиомеры, диастереомеры, и его рацематных форм, а также его фармацевтически приемлемых солей, где
R1 выбирают из группы, состоящей из (С1-С15)алкила, фрагментов СН2А или СН2СН2А (где А означает необязательно замещенный (С6-С12)арил или необязательно замещенный (С6-С12)гетероарил), необязательно замещенных (С6-С14)арила, (3-8-членного)циклоалкила, (С1-С12)алкиларила, моно-, би- или трициклического гетероарила с конденсированными кольцами или (3-8-членного)гетероциклила или (С1-С12)алкилгетероциклила, и которые содержат 1-3 гетероатома, выбранных из кислорода, азота или серы;
R2a и R2b, каждый независимо друг от друга, выбирают из группы, которая включает или состоит из Н или (С1-С12)алкила;
Cy представляет собой необязательно замещенный (С6-С12)арил, 5-6-членную гетероарильную группу с одним или несколькими гетероатомами, выбранными из N, О или S; тиенил или фенил, замещенный необязательно замещенной (С6-С12)арильной группой или необязательно замещенной 5-6-членной гетероарильной группой с одним или несколькими гетероатомами, выбранными из N, О или S,
при том, что заместители могут быть выбраны из галогена, (С1-С4)алкокси, (С6-С10)арилокси, циано, нитро, (С1-С12)алкила, галоалкила, гидроксила, (С2-С12)алкенила, (С2-С12)алкинила, B-R4, где В обозначает этинильную группу, a R4 представляет собой (С1-С12)алкилфенил; -COR3, -COOR3, -CO-NR3R3', -NHCOR3, где R3 представляет собой (С1-С15)алкил или (С1-С12)алкенил, -SOR3, -SO2R3, -SO2NR3R3', причем R3, R3' независимо друг от друга выбирают из группы, состоящей из Н, линейного или разветвленного (С1-С15)алкила, (С2-С12)алкенила, (С2-С12)алкинила, (С6-С12)арила, 5-6-членного гетероарила с одним или несколькими гетероатомами, выбранными из N, О или S, (3-8-членного)циклоалкила или гетероциклоалкила, (С1-С12)алкил-арила или -гетероарила,
при условии, что исключаются следующие соединения:
в качестве лекарственного средства, предназначенного для лечения или профилактики заболеваний, опосредованных РТР18.
16. Применение замещенного производного метиленамида по п.15, в котором
R2a и R2b, каждый, представляют собой Н;
R1 означает -СН2-А, где А представляет собой фенил или тиенил, необязательно замещенный группой циано, галоген, метокси, гидрокси, фенокси, -NO2, трифторметил;
Cy представляет собой тиенил, фенил или бифенил, который замещен группой -SO2R3, -CO-NR3R3', где R3' означает Н и R3 означает (С7-С15)алкил, предпочтительно (С8-С15)алкил и особенно предпочтительно додецильную группу.
17. Применение замещенного производного метиленамида по п.15, в котором
R2a и R2b, каждый, представляют собой Н;
R1 выбирают из группы, состоящей из фенила, бензила, фенэтила, 1-метилбензила, который может быть замещен (С1-С6)алкильной группой шыш циклоалкильной группой;
Cy представляет собой фенильную или бифенильную группу, замещенную фрагментом, выбранным из группы, состоящей из -NH-CO-R3, -CO-NH-R3, или оксадиазольную группу, замещенную радикалом R3, где R3 представляет собой (С7-С15)алкил, предпочтительно (С8-С15)алкил и особенно предпочтительно додецильную группу.
18. Применение замещенного производного метиленамида формулы (I)
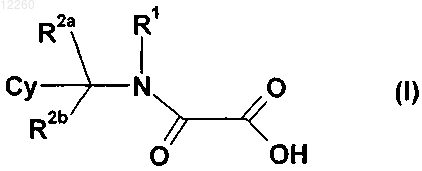
а также его геометрических изомеров, его оптически активных форм, таких как энантиомеры, диастереомеры, и его рацематные формы, а также его фармацевтически приемлемых солей, где
R1 выбирают из группы, состоящей из (С1-С15)алкила, фрагментов СН2А или СН2СН2А (где А означает необязательно замещенный (С6-С12)арил или необязательно замещенный (С6-С12)гетероарил), необязательно замещенных (С6-С14)арила, (3-8-членного)циклоалкила, (С1-С12)алкиларила, моно-, би- или трициклического гетероарила с конденсированными кольцами или (3-8-членного)гетероциклила или (С1-С12)алкилгетероциклила, и которые содержат 1-3 гетероатома, выбранных из кислорода, азота или серы;
R2a и R2b, каждый независимо друг от друга, выбирают из группы, которая включает или состоит из Н или (С1-С12)алкила;
Cy представляет собой необязательно замещенный (С6-С12)арил, 5-6-членную гетероарильную группу с одним или несколькими гетероатомами, выбранными из N, О или S; тиенил или фенил, замещенный необязательно замещенной (С6-С12)арильной группой или необязательно замещенной 5-6-членной гетероарильной группой с одним или несколькими гетероатомами, выбранными из N, О или S,
при том, что заместители могут быть выбраны из галогена, (С1-С4)алкокси, (С6-С10)арилокси, циано, нитро, (С1-С12)алкила, галоалкила, гидроксила, (С2-С12)алкенила, (С2-С12)алкинила, B-R4, где В обозначает этинильную группу, a R4 представляет собой (С1-С12)алкилфенил; -COR3, -COOR3, -CO-NR3R3', -NHCOR3, где R3 представляет собой (С1-С15)алкил или (С1-С12)алкенил, -SOR3, -SO2R3, -SO2NR3R3', причем R3, R3' независимо друг от друга выбирают из группы, состоящей из Н, линейного или разветвленного (С1-С15)алкила, (С2-С12)алкенила, (С2-С12)алкинила, (С6-С12)арила, 5-6-членного гетероарила с одним или несколькими гетероатомами, выбранными из N, О или S, (3-8-членного)циклоалкила или гетероциклоалкила, (С1-С12)алкил-арила или -гетероарила,
для получения лекарственного средства для лечения и/или профилактики метаболических нарушений или расстройств, связанных с резистентностью к инсулину или гипергликемией, включающих диабет типа I и/или II, неадекватную толерантность к глюкозе, резистентность к инсулину, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, ожирение, синдром поликистозного яичника (PCOS).
19. Применение замещенного производного метиленамида формулы (I)
а также его геометрических изомеров, его оптически активных форм, таких как энантиомеры, диастереомеры, и его рацематных форм, а также его фармацевтически приемлемых солей, где
R1 выбирают из группы, состоящей из (С1-С15)алкила, фрагментов CH2A или СН2СН2А (где А означает необязательно замещенный (С6-С12)арил или необязательно замещенный (С6-С12)гетероарил), необязательно замещенных (С6-С14)арила, (3-8-членного)циклоалкила, (С1-С12)алкиларила, моно-, би- или трициклического гетероарила с конденсированными кольцами или (3-8-членного)гетероциклила или (С1-С12)алкилгетероциклила, и которые содержат 1-3 гетероатома, выбранных из кислорода, азота или серы;
R2a и R2b, каждый независимо друг от друга, выбирают из группы, которая включает или состоит из Н или (С1-С12)алкила;
Cy представляет собой необязательно замещенный (С6-С12)арил, 5-6-членную гетероарильную группу с одним или несколькими гетероатомами, выбранными из N, О или S; тиенил или фенил, замещенный необязательно замещенной (С6-С12)арильной группой или необязательно замещенной 5-6-членной гетероарильной группой с одним или несколькими гетероатомами, выбранными из N, О или S,
при том, что заместители могут быть выбраны из галогена, (С1-С4)алкокси, (С6-С10)арилокси, циано, нитро, (С1-С12)алкила, галоалкила, гидроксила, (С2-С12)алкенила, (С2-С12)алкинила, B-R4, где В обозначает этинильную группу, a R4 представляет собой (С1-С12)алкилфенил; -COR3, -COOR3, -CO-NR3R3', -NHCOR3, где R3 представляет собой (С1-С15)алкил или (С1-С12)алкенил, -SOR3, -SO2R3, -SO2NR3R3', причем R3, R3' независимо друг от друга выбирают из группы, состоящей из Н, линейного или разветвленного (С1-С15)алкила, (С2-С12)алкенила, (С2-С12)алкинила, (С6-С12)арила, 5-6-членного гетероарила с одним или несколькими гетероатомами, выбранными из N, О или S, (3-8-членного)циклоалкила или гетероциклоалкила, (С1-С12)алкил-арила или -гетероарила,
для получения лекарственного средства для лечения и/или профилактики диабета типа II, ожирения или для регулирования аппетита.
20. Применение замещенного производного метиленамида по п.18 или 19, где
R2a и R2b, каждый, представляют собой Н;
R1 означает -СН2-А, где А представляет собой фенил или тиенил, необязательно замещенный группой циано, галоген, метокси, гидрокси, фенокси, -NO2, трифторметил;
Cy представляет собой тиенил, фенил или бифенил, замещенный -SO2R3, -CO-NR3R3', где R3' означает Н и R3 означает (С7-С15)алкил, предпочтительно (С8-С15)алкил и особенно предпочтительно додецильную группу.
21. Применение замещенного производного метиленамида по пп.17-19, где
R2a и R2b, каждый, представляют собой Н;
R1 выбирают из группы, состоящей из фенила, бензила, фенэтила, 1-метилбензила, который может быть замещен (С1-С6)алкильной группой или циклоалкильной группой;
Cy представляет собой фенильную или бифенильную группу, замещенную фрагментом, выбранным из группы, состоящей из -NH-CO-R3, -CO-NH-R3, или оксадиазольной группы, замещенной радикалом R3, где R3 означает (С7-С15)алкил, предпочтительно (С8-С15)алкил и особенно предпочтительно додецильную группу.
22. Применение замещенного производного метиленамида по любому из пп.18-21 для получения лекарственного средства, модулирующего активность протеинтирозинфосфатаз (PTPs).
23. Применение по п.22, согласно которому протеинтирозинфосфатрчр (РТР) представляет собой РТР1В.
24. Применение по п.22, согласно которому указанное модулирование заключается в ингибировании активности РТР1В.
25. Применение по п.24, предназначенное для лечения или профилактики нарушений или расстройств, медиатором которых является РТР1В.
26. Фармацевтическая композиция, обладающая способностью к модулированию активности протеинтирозинфосфатазы (РТР), предназначенная для лечения и/или профилактики метаболических нарушений, связанных с резистентностью к инсулину и гипергликемии, содержащая по меньшей мере одно замещенное производное метиленамида по любому из пп.1-14 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
27. Фармацевтическая композиция по п.26, дополнительно включающая по меньшей мере одно дополнительное лекарственное средство, выбранное из группы, состоящей из инсулина, ингибиторов альдозаредуктазы, ингибиторов a-глюкозидазы, агентов на основе сульфонилмочевины, бигуанидов (например, метформина), тиазолидинов, антагонистов PPARs, c-Jun киназы или GSK-3 ингибиторы.
28. Фармацевтическая композиция по п.27, согласно которому указанное дополнительное лекарственное средство выбирают из группы, состоящей из инсулина быстрого действия, инсулина среднего по продолжительности действия, инсулина длительного действия и сочетания инсулина среднего по продолжительности действия и инсулина быстрого действия, миналрестата, толрестата, сорбинила, метосорбинила, зополрестата, эпалрестата, зенарестата, имирестата, поналрестата, ONO-2235, GP-1447, СТ-112, BAL-ARI 8, AD-5467, ZD5522, М-16209, NZ-314, M-79175, SPR-210, ADN 138 или SNK-860, миглитола, акарбозы, глипизида, глибурида, хлорпропамида, толбутамида, толазамида или глимерпририда.
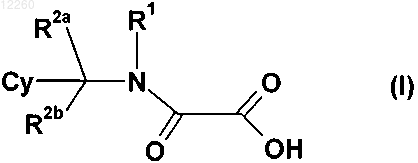
29. Способ получения замещенного производного метиленамида по любому из пп.1-15, включающий стадию конденсации производного амина формулы
(III-0) и сложного эфира формулы LG2-CO-CO-OR8, с последующим гидролизом, где Cy, R1, R2a, R2b являются такими, как определены в п.1, R8 представляет собой (С1-С6)алкил или циклоалкил и LG2 означает отщепляемую группу, выбранную из Cl, N-гидроксисукцинимидной группы или бензотриазол-1-ильной группы.
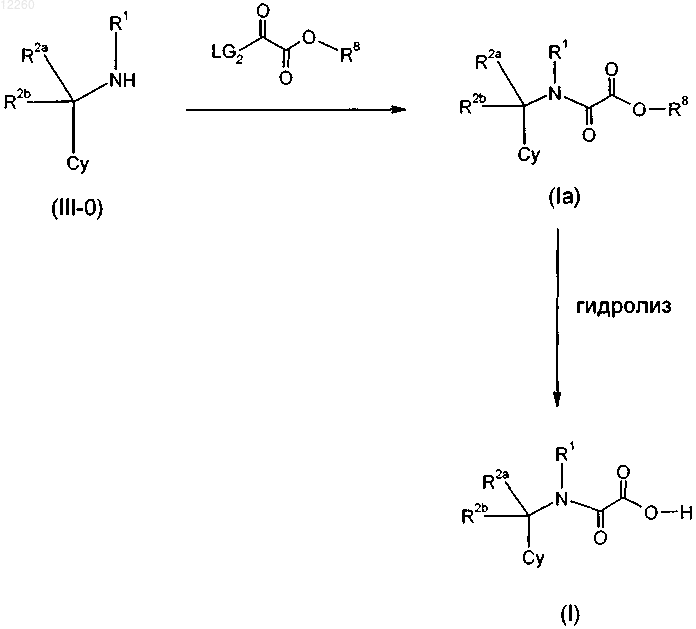
30. Способ получения замещенного производного метиленамида по любому из пп.1-5 и 9-15, включающий стадию получения соответствующего сложного эфира формулы (I-1)
где X представляет собой -СО- или -SO2-, LG1 обозначает Cl, ОН, -OBn, О-алкил или О-алкиларил, R1, R2a, R2b, R3 и R3' являются такими, как определены в пп.1, 4, и последующую стадию гидролиза с получением при этом производного метиленамида формулы (I).
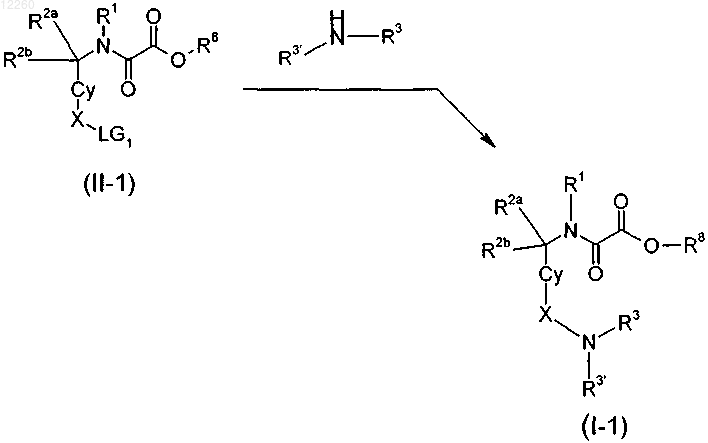
31. Способ получения замещенного производного метиленамида формулы (I) по любому из пп.1-5, 9-11, 14 и 15, включающий стадию получения соответствующего сложного эфира формулы (I-2)
где LG1 представляет собой Cl, ОН, OBn, О-алкил или О-алкиларил, R8 представляет собой (С1-С6)алкил или циклоалкил, Р означает Н или защитную группу, выбранную из Boc или Fmoc, R1, R2a, R2b, R3 и R3' являются такими, как определено в пп.1, 4, и последующую стадию гидролиза с получением при этом производного метиленамида формулы (I).
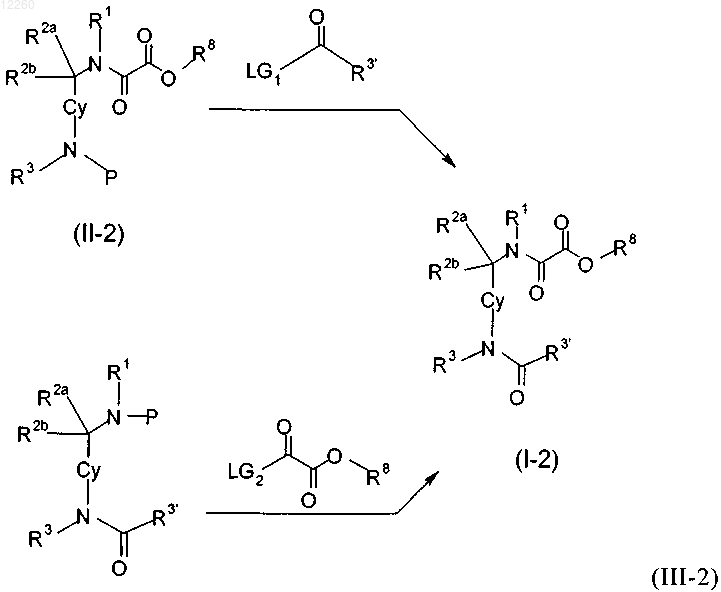
32. Способ получения замещенного производного метиленамида по любому из пп.1-11 и 15, включающий стадию получения соответствующего сложного эфира формулы (I-4)
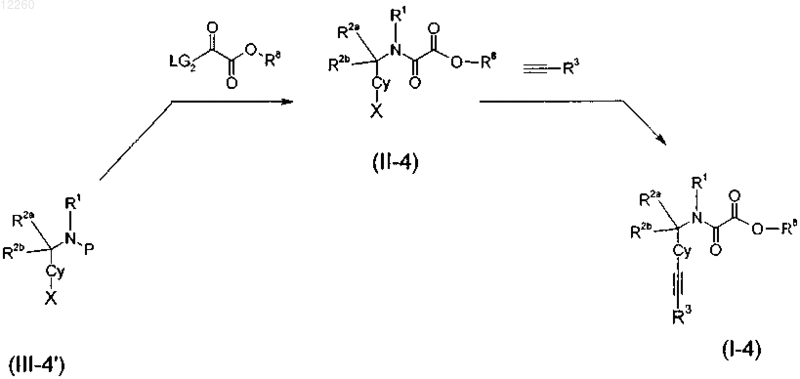
где X означает атом галогена, выбранный из группы, состоящей из Br, I Cl, или отщепляемую группу, такую как -OSO2CF3, R8 представляет собой алкильную группу, LG2 выбирают из Cl, N-гидроксисукцинимидной группы или бензотриазол-1-ильной группы, Р представляет собой Н или защитную группу, выбранную из Boc или Fmoc, R1, R2a, R2b и R3 являются такими, как определено в пп.1, 4, и последующую стадию гидролиза с получением при этом производного метиленамида формулы (I).
Текст
012260 Область техники, к которой относится изобретение Настоящее изобретение относится к замещенным производным метиленамида формулы (I), в частности, предназначенным для лечения и/или профилактики метаболических нарушений или расстройств,связанных резистентностью к инсулину или гипергликемией, включая диабет типа I и/или II, неадекватную толерантность к глюкозе, резистентность к инсулину, гиперлипидемию, гипертриглицеридемию,гиперхолестеринемию, ожирение, синдром поликистозного яичника (PCOS-от англ. polycystic ovary syndrome). Соединения, являющиеся предметом настоящего изобретения, особенно пригодны для лечения диабета типа II, для лечения ожирения или регулирования аппетита. В частности, настоящее изобретение относится к замещенным производным метиленамида, предназначенным для модулирования, в особенности, ингибирования активности протеинтирозинфосфатаз (PTPs от англ. protein tyrosine phosphatase), в частности, РТР 1 В. Предшествующий уровень техники Хорошо известна широкая распространенность резистентности к инсулину у непереносящих глюкозу пациентов. В статье: Reaven et al., American Journal of Medicine, v. 60, p. 80 (1976) описано использование непрерывной инфузии глюкозы и инсулина (методика инфузии инсулин/глюкозы с использованием зажимов) и тесты на толерантность при пероральном введении глюкозы для установления резистентности к инсулину для различных групп испытуемых, не страдающих ожирением и избыточным образованием кетоз. Показано, что у этих испытуемых варьировалась толерантность к глюкозе - от граничных значений толерантности до явной гипергликемии в состоянии натощак. Группы диабетиков в этих исследованиях включали как инсулинзависимых (ИЗ), так и инсулиннезависимых (ИНЗ) пациентов. Сопутствующим эффектом резистентности к инсулину, который легче всего установить, является гиперинсулинемия, которая может быть измерена у пациента посредством точного измерения концентрации инсулина в плазме крови, участвующей в кровообращении. Наличие гиперинсулинемии может являться результатом резистентности к инсулину, такой как у инсулиннезависимых пациентов, страдающих ожирением и/или диабетом, и/или у непереносящих глюкозу пациентов, или у инсулинзависимых пациентов, как следствие избыточных инъекций инсулина, по сравнению с нормальным физиологическим эндокринным высвобождением гормона поджелудочной железой. Связь гиперинсулинемии и резистентности к инсулину с ожирением и с ишемическими заболеваниями больших кровеносных сосудов (например, с атеросклерозом) хорошо установлена в результате многочисленных экспериментальных, клинических и эпидемиологических исследований (Stout, Metabolism, v. 34, p. 7 (1985. Статистически значимое повышение содержания инсулина в плазме через 1 и 2 ч после перорального приема глюкозы коррелирует с повышенным риском коронарных заболеваний. Поскольку при проведении большинства из этих исследований фактически исключали пациентов с диабетом, данные относительно риска возникновения атеросклеротических заболеваний при диабете не столь многочисленны, но свидетельствуют о той же тенденции, что и у пациентов без диабета. Однако согласно статистике заболеваемости и смертности доля атеросклеротических заболеваний для страдающих диабетом превышает эту величину для лиц, у которых нет диабета (Pyorala et al.; Jarrett. Diabetes/Metabolism Reviews, v. 5, p. 547(1989. Связь гиперинсулинемии и резистентности к инсулину с синдромом поликистоза яичников (PCOS) также хорошо известна (Diamanti-Kandarakis et al.; Therapeutic effects of metformin on insulin resistance andPathogenESIs; Endocrine Reviews, v. 18(6), 774-800 (1997. Независимые факторы риска - ожирение и гипертензия по отношению к атеросклеротическим заболеваниям также связаны с резистентностью к инсулину. При использовании комбинации таких методик,как инфузия инсулина/глюкозы использованием зажимов, инфузия меченой глюкозы и непрямая калориметрия было показано, что резистентность к инсулину в случае эссенциальной гипертензии локализуется в периферических тканях (главным образом, в мышцах) и непосредственно коррелирует со степенью выраженности гипертензии (DeFronzo and Ferrannini, Diabetes Care, v. 14, p. 173 (1991. При гипертензии у страдающих ожирением людей резистентность к инсулину приводит к гиперинсулинемии, которую рассматривают как механизм ограничения дальнейшего прироста массы посредством термогенеза,однако, инсулин также усиливает реабсорбцию натрия в почках и стимулирует периферическую нервную систему почек, сердца и сосудистой сети, приводя к гипертензии. Полагают, что резистентность к инсулину обычно является следствием дефекта в сигнальной системе инсулинового рецептора, на участке связывания инсулина с рецептором. Накопленные наукой данные, свидетельствующие о резистентности к инсулину в основных тканях (мускулатура, печень, жировая ткань), которые реагируют на инсулин, в значительной степени подтверждают, что дефект в системе передачи сигнала, в которой участвует инсулин, присущ процессам на ранних стадиях сигнального каскада,в особенности, киназной активности инсулинового рецептора, которая, по-видимому, снижена (MounibMol. Med., v. 78, p. 473-482 (2000. Протеинтирозинфосфатазы (PTPs) играют важную роль в регулировании фосфорилирования белков-1 012260 и являются аналогами киназ. Среди классических ферментов PTPs выделяют два типа: (i) нерецепторные или внутриклеточные PTPs и (ii) рецептороподобные PTPs. Большая часть внутриклеточных PTPs содержит только один каталитический домен, в то время как большинство рецептороподобных ферментов содержит два домена. Каталитический домен состоит из приблизительно 250 аминокислот (Niels Peterof diabebetes; Current Opinion in Drug DiscoveryDevelopment, v. 3(5), p. 527-540 (2000. Взаимодействие инсулина с его рецептором приводит к фосфорилированию некоторых молекул тирозина внутри белка-рецептора, таким образом происходит активация рецепторной киназы. PTPs дефосфорилирует активированный инсулиновый рецептор, ослабляя активность тирозинкиназы. PTPs может также модулировать пост-рецепторную систему передачи сигнала, катализируя дефосфорилирование клеточных субстратов киназы инсулинового рецептора. По-видимому, ферменты, которые наиболее склонны к ассоциации с инсулиновым рецептором, вследствие этого влияют на регулирование активности киназы инсулинового рецептора, эти ферменты включают РТР 1 В, LAR, РТР- и SH-PTP2 (Lori Klaman et al.; Increased Energy Expenditure, Decreased Adiposity, and Tissue-Specific insulin sensitivity in Protein-Tyrosine Phosphatase 1B-Deficient Mice; Molecular and Cellular Biology, p. 5479-5489 (2000.PTP1B является членом семейства протеинтирозинкиназ. Этот белок величиной 50 кДа содержит сохранившийся фосфатазный домен на участке аминокислотных остатков 30-278 и локализуется на цитоплазматической поверхности эндоплазматической сети посредством 35 С-концевых остатков. Его взаимодействие с другими белками происходит с участием богатых пролином участков и SH2 совместимых последовательностей. Как полагают, РТР 1 В действует как негативный регулятор в инсулиновой системе передачи сигнала. Показано (McGuire et al., Diabetes, v. 40, p. 939 (1991, что у не переносящих глюкозу пациентов, не страдающих диабетом, наблюдается в значительной степени повышенный уровень РТР активности в мышечной ткани по сравнению с обычными субъектами, и установлено, что инфузия не способна подавить активность РТР, как это происходит у пациентов, чувствительных к действию инсулина. Сообщается (Meyerovitch et al., J. Clinical Invest., v. 84, p. 976 (1989 о значительном повышении РТР активности в печени, наблюдаемой в печени на двух моделях инсулинзависимого диабета на грызунах, у генетически диабетических крыс линии ВВ, а также у STZ-индуцированных диабетических крыс. Наблюдалось (Sredy et al. Metabolism, 44, 1074, (1995 аналогичное повышение РТР активности в печени страдающих ожирением диабетических мышей линии ob/ob, которые представляют типичную модель инсулиннезависимого диабета на мышах. В работе Zhang et al., Curr. Opin. Chem. Biol., 5(4), 416-23 (2001) установлено, что PTPs также имеют отношение к большому числу других заболеваний, включая рак. Показано (Bjorge, J.D. et al., J. Biol.Chem., 275(52), 41439-46 (2000, что РТР 1B является первичной протеинтирозинфосфатазой, способной дефосфорилировать c-Src в некоторых линиях раковых клеток молочной железы человека, при этом высказывается предположение относительно регулирующей роли РТР 1 В для контролирования c-Src киназной активности. В статье Pathre et al., J. Neurosci. Res., 63(2), 143-150 (2001) описывается, что PTP1B является регулятором разгибания с участием нейритов, медиатором которого являются молекулы адгезии клеткаклетка и клетка-матрикс. Кроме того, в статье Shock L.P. et al., Mol. Brain. Res., 28(1), 110-16 (1995) показано, что отчетливое перекрывание ряда PTPs выражается в развитии мозга и почечной ткани Мюллера,включая 2 новых PTPs, которые могут принимать участие в передаче информации между нервными клетками. Рецептор инсулина (IR) представляет собой прототипичный тирозинкиназный рецептор, связывание лигандов с которыми и димеризация приводят к автофосфорилированию множества тирозинов. За этим следует последовательное задействование все большего количества рецепторов и фосфорилирование IRS1-4 (в зависимости от ткани) и PI3K. Хотя противодиабетическое действие ванадийсодержащих соединений было известно уже в девятнадцатом веке, только недавно стало понятно, что эти ингибиторы стимулируют каскад сигнальных реакций, в которых участвует инсулин, посредством блокирования действия РТР. Согласно имеющимся данным относительно участия IR (инсулиновый рецептор) и IRS-1 в этом процессе оба белка характеризуются повышенным фосфорилированием тирозина у мышей с мутированным РТР 1 В. Имеющиеся данные уверенно подтверждают, что, в частности, РТР 1 В является перспективной мишенью для разработки лекарственных средств, предназначенных для лечения диабета и ожирения (Brian P. Kennedy and Chidambaram Ramachandran; Protein Tyrosine Phosphatase-1B in Diabetes;Biochemical Pharmacology, Vol. 60, 877-883, (2000. Еще одним белком, причастным к развитию ожирения, является лептин. Лептин представляет собой пептидный гормон, который играет центральную роль в процессах питания и ожирения (Ahima R.S. et al.,Leptin. Annu. Rev. Physiol. v. 62 p. 413-437 (2000. Недавно было высказано предположение, что РТР 1B является негативным регулятором по отношению к сигнальному процессу лептина, и предложен механизм, в соответствии с которым лептин может служить регулятором ожирения. Кроме того, известно, что фармакологические ингибиторы по отношению к РТР 1 В рассматривают как альтернативу лептину или как дополнение к лептину при лечении ожирения, возникающего вследствие резистентности к лептину(Developmental Cell., vol. 2, p. 497-503 (2002. Среди прочих соединений в качестве ингибиторов по отношению к PTPs предлагали использовать некоторые небольшие молекулы (WO 02/18321). Сущность изобретения Настоящее изобретение относится к замещенным производным метиленамида формулы (I) Такие соединения подходят для лечения и/или профилактики метаболических нарушений или расстройств, связанных с резистентностью к инсулину или гипергликемией, включая диабет типа I и/или II,неадекватную толерантность к глюкозе, резистентность к инсулину, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, ожирение, синдром поликистозного яичника (PCOS). Соединения согласно настоящему изобретению являются ингибиторами протеинтирозинфосфатаз (PTPs). Подробное описание изобретения В следующих абзацах приведены определения различных химических фрагментов, из которых состоят соединения согласно настоящему изобретению, предполагается, что данные определения единообразно применяются в настоящем описании и в формуле изобретения, если только специально не будет приведено более широкое определение."PTPs" представляют собой протеинтирозинфосфатазы и включают, например, РТР 1 В, ТС-РТР,РТР- , DEP-1, LAR, SHP-1, SHP-2, GLEPP-1, РТР- , РТР-, VHR, hVH5, LMW-PTP, PTEN."С 1-С 12-алкил" или "С 1-С 12-алкил" относится к линейным или разветвленным моновалентным алкильным группам, содержащим от 1 до 12 или от 1 до 15 атомов углерода. Примерами групп, подпадающих под это определение, являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-гексил, н-октил, н-нонил, н-додецил, тридецил, пентадецил, н-пентил и подобные им группы в линейной или разветвленной форме."Арил" относится к ненасыщенным ароматическим карбоциклическим группам, содержащим от 6 до 14 атомов углерода, содержащим одно кольцо (например, фенил) или несколько конденсированных колец (например, нафтил). Предпочтительные группы арил включают фенил, нафтил, фенантренил и подобные им группы."Гетероарил" относится к моноциклической гетероароматической или к бициклической или трициклической гетероароматической группе с конденсированными кольцами. Конкретные примеры гетероароматических групп включают необязательно замещенные пиридил, пирролил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил,1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил; 1,3,4-триазинил, 1,2,3 триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил,бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил,5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил."С 1-С 12-алкилгетероарил" относится к С 1-С 12-алкильным группам, содержащим гетероарильный заместитель, такие группы включают 2-фурилметил, 2-тиенилметил, 2-(1 Н-индол-3-ил)этил и подобные им группы."Алкенил" относится к алкенильным группам, предпочтительно содержащим от 2 до 6 атомов углерода и имеющим по меньшей мере в 1 или 2 участках алкенильную ненасыщенность. Предпочтительные алкенильные группы включают этенил (-СН=СН 2), н-2-пропенил (аллил, -СН 2 СН=СН 2) и подобные им группы."Алкинил" относится к алкинильным группам, содержащим от 2 до 18 атомов углерода и имеющим по меньшей мере в 1-2 участках алкинильную ненасыщенность, например этинил (-ССН), пропаргил"Алкокси" относится к группе -O-R, в которой R включает "С 1-С 12-алкил", или "арил", или "гетероарил", или "С 1-С 12-алкиларил", или "С 1-С 12-алкилгетероарил". Предпочтительные алкоксигруппы включают, например, наряду с другими группами такие группы, как метокси, этокси, фенокси и подоб-3 012260 ные им группы."Аминокарбонил" относится к группе -C(O)NRR', в которой каждый из R, R' независимо включает водород, или С 1-С 12-алкил, или арил, или гетероарил, или "С 1-С 12-алкиларил", или "С 1-С 12-алкилгетероарил"."Ациламино" относится к группе -NR(CO)R', в которой каждый из R, R' независимо представляет собой водород, или "С 1-С 12-алкил", или "арил", или "гетероарил", или "С 1-С 12-алкиларил", или "С 1-С 12 алкилгетероарил"."Галоген" относится к атомам фтора, хлора, брома и иода. Термин "замещенный или незамещенный": если не наложено иное ограничение посредством определения индивидуальных заместителей, то указанные выше группы, такие как "алкил", "алкенил", "алкинил", "арил", "гетероарил" и т.д., могут быть необязательно замещенными от 1 до 5 заместителями, выбранными из группы, состоящей из следующих заместителей: "С 1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6 алкинил", "циклоалкил", "гетероциклоалкил", "С 1-С 6-алкиларил", "С 1-С 6-алкилгетероарил", "С 1-С 6 алкилциклоалкил", "С 1-С 6-алкилгетероциклоалкил", "амино", "аммоний", "ацил", "ацилокси", "ациламино", "аминокарбонил", "алкоксикарбонил", "уреидо", "арил", "карбамат", "гетероарил", "сульфинил","сульфонил", "алкокси", "сульфанил", "галоген", "карбокси", тригалогенметил, циано, гидрокси, меркапто, нитро и подобных им заместителей. В качестве альтернативы указанное замещение может также включать случаи, когда соседние заместители могут объединяться в кольцо, особенно когда в объединение вовлекаются смежные функциональные заместители, образуя таким образом, например, лактамы,лактоны, циклические ангидриды, а также ацетали, тиоцатели, аминали, полученные посредством образования кольцевой системы в целях получения защитной группы."Тиоалкокси" относится к группам -S-R, в которых R включает "С 1-С 12-алкил", или "арил", или "гетероарил", или "С 1-С 12-алкиларил", или "С 1-С 12-алкил гетероарил". Предпочтительные тиоалкоксигруппы включают тиометокси, тиоэтокси и подобные им группы. Термин "фармацевтически приемлемые соли или комплексы" относится к солям или комплексам указанных ниже соединений формулы (I). Примеры таких солей включают, не ограничиваясь указанным,соли-продукты присоединения оснований, полученные взаимодействием соединений формулы (I) с органическими или неорганическими основаниями, такими как гидроксиды, карбонаты или бикарбонаты катионов-металлов, выбранных из группы, состоящей из щелочных металлов (натрия, калия или лития),щелочно-земельных металлов (например, кальция или магния), или такими как органические первичные,вторичные или третичные алкиламины. Соли с аминами, полученные взаимодействием с метиламином,диметиламином, триметиламином, этиламином, диэтиламином, триэтиламином, морфолином, N-Me-Dглюкамином, N,N'-бис(фенилметил)-1,2-этандиамином, трометамином, этаноламином, диэтаноламином,этилендиамином, N-метилморфолином, прокаином, пиперидином, пиперазином и им подобными рассматриваются как входящие в объем настоящего изобретения. Также в объем изобретения включаются соли-продукты присоединения кислоты, образованные с неорганическими кислотами (например, хлороводородной кислотой, бромоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и подобными им кислотами), а также соли, образованные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, виннокаменная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, 4,4'-метиленбис(3-гидрокси-2-нафтойная кислота), альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота."Фармацевтически активное производное" относится к любому соединению, которое после введения реципиенту будет способно непосредственно или опосредованно проявлять активность, описанную в тексте заявки. Термин "опосредованно" также включает пролекарства, которые могут быть превращены в активную форму лекарственного средства посредством воздействия эндогенных ферментов или в результате метаболизма. Указанные пролекарства включают собственно активное соединениелекарственное средство и маскирующую химическую группу. Термин "энантиомерный избыток" (эи) относится к продуктам, которые получают асимметрическим синтезом, т.е. синтезом, включающим использование не рацемических исходных веществ и/или реагентов или синтезом, включающим по меньшей мере одну энантиоселективную стадию, причем при этом достигается получение одного из энантиомеров в избытке, составляющем по меньшей мере приблизительно 52% (эи). Без проведения асимметрического синтеза, например, при отсутствии соответствую-4 012260 щих сложных эфиров замещенных производных метиленамидов формулы I, обычно получают рацемические продукты, которые также обладают ингибирующей активностью в отношении РТР. Указанные формулы также включают таутомеры соединений, представленных этими формулами,геометрические изомеры, оптически активные формы, такие как энантиомеры, диастереомеры и рацематные формы, а также фармацевтически приемлемые соли таких соединений. Предпочтительные фармацевтически приемлемые соли соединений формулы (I) представляют собой соли-продукты присоединения оснований, полученные взаимодействием соединений формулы (I) с фармацевтически приемлемыми основаниями, такими как N-метил-D-глюкамин, трометамин, натриевые, калиевые или кальциевые соли-карбонаты, бикарбонаты или гидроксиды. Замещенные производные метиленамида согласно настоящему изобретению соответствуют формуле (I) Формула (I) включает также геометрические изомеры, оптически активные формы, включая энантиомеры, диастереомеры и рацематные формы, а также фармацевтически приемлемые соли и фармацевтически активные производные этого соединения. Заместители R1, R2a, R2b и Cy в формуле (I) определяются следующим образом.R1 выбирают из группы, состоящей из замещенного или незамещенного (С 1-С 12)алкила, предпочтительно замещенного или незамещенного (С 1-С 6)алкила, замещенного или незамещенного (С 2 С 12)алкенила, замещенного или незамещенного (С 2-С 12)алкинила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного (3-8 членного)циклоалкила или гетероциклоалкила, замещенного или незамещенного (С 1-С 12)алкиларила или замещенного или незамещенного (С 1-С 12)алкилгетероарила, замещенного или незамещенного (С 2 С 12)алкениларила или (С 2-С 12)алкенилгетероарила, замещенного или незамещенного (С 2 С 12)алкиниларила или (С 2-С 12)алкинилгетероарила. Согласно предпочтительному воплощению настоящего изобретения, R1 представляет собой А, где А означает замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный (3-8-членный)гетероциклоалкил или (3-8-членный)циклоалкил, в частности замещенный или незамещенный фенил. Согласно другому предпочтительному воплощению настоящего изобретения А представляет собой фрагмент формулы -СН 2-А или -СН 2-СН 2-А, где А означает замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный (3-8-членный)гетероциклоалкил или замещенный или незамещенный (3-8-членный)циклоалкил. В частности, А может представлять собой фенильную, пиридинильную, бензо-1,3-диоксоленильную, бифенильную, нафтильную, хиноксалинильную, тиазолильную, тиенильную, фуранильную или пиперидинильную группу, которая необязательно замещена одним или двумя фрагментами, выбранными из группы, состоящей из циано, галогена,NO2, (С 1-С 6)алкокси, арилокси или гетероарилокси, (С 1-С 6)тиоалкокси, необязательно галогенированного(С 1-С 6)алкила, (С 2-С 6)алкенила, (С 2-С 6)алкинила, арила, гетероарила, (3-8-членного)циклоалкила или гетероциклоалкила, (С 1-С 6)алкиларила или гетероарила, (С 2-С 6)алкениларила или гетероарила, (С 2 С 6)алкиниларила или гетероарила, -COR3, -COOR3, -CO-NR3R3', -NHCOR3, где R3 представляет собой (С 1 С 6)алкил или (С 2-С 6)алкенил, -SOR3, -SO2R3, -SO2NR3R3', причем R3, R3', каждый независимо друг от друга, выбирают из группы, состоящей из Н, линейного или разветвленного (С 1-С 6)алкила, (С 2-С 6)алкенила,(С 2-С 6)алкинила, арила, гетероарила, (3-8-членного)циклоалкила или гетероциклоалкила.R2a и R2b, каждый независимо друг от друга, выбирают из группы, которая включает или состоит из Н или из замещенного или незамещенного (С 1-С 12)алкила, предпочтительно каждый из R2a и R2b представляет собой Н.Cy представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный (3-8-членный)циклоалкил или гетероциклоалкил. Указанные арил или гетероарил включают фенил, нафтил, фенантренил, пирролил, фурил, тиенил,имидазолил, пиридил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4 триазолил, 1,2,3-оксадиазолил, бензо(1,2,5)оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4 оксадиазолил, тетразолил, 1,3,4-триазинил, 1,2,3-триазинил, бензопиримидинил, бензофурил, [2,3 дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3H-индолил, бензимидазолил, бензотиазолил, бензоксазолил, пиридазинил, пиримидил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, хинолил, изохинолил, тетразолил, 5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, ксантенил, бензохинолил, оксоланил, пиролидинил, пиразолидинил, 2 Н-бензо[d]1,3-диоксоленил, инданил, имидазолидинил, 1,2,4-оксадиазолидинил, 1,2,5-оксадиазолидинил, 1,3,4-оксадиазолидинил или изоксазолидинил. В частности, Cy представляет собой замещенный или незамещенный тиенил или фенил, например-5 012260 бифенильную группу. Более конкретно, Cy может представлять собой замещенный или незамещенный тиенил, замещенный или незамещенный фенил, который может быть замещен замещенным или незамещенным арилом или замещенным или незамещенным гетероарилом, например оксадиазолом, или замещенным или незамещенным циклоалкильным фрагментом, или Cy представляет собой замещенный или незамещенный тиенил, замещенный или незамещенный фенил, который может быть замещен одним или двумя фрагментами, выбранными из группы, состоящей из NH-CO-R3, -SO2-NR3R3' или -CO-NR3R3', где R3, R3' независимо выбирают из Н, замещенного или незамещенного (С 1-С 15)алкила, замещенного или незамещенного (С 2-С 12)алкенила, замещенного или незамещенного (С 2-С 12)алкинила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного (3-8 членного)циклоалкила или замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного (С 1-С 12)алкиларила или гетероарила, замещенного или незамещенного (С 2-С 12)алкениларила или (С 2-С 12)алкенилгетероарила, замещенного или незамещенного (С 2-С 12)алкиниларила или (С 2 С 12)алкинилгетероарила. В соответствии с одним из вариантов осуществления настоящего изобретения R3' представляет собой Н, и R3 выбирают из группы, состоящей из дифенилэтила, додецила, октила, 4-пентилбензила, 4 феноксифенэтила, этилтиофен-2-ила, пентадецила, тридецила, гексилоксифенила, (2-этил)гексила. В соответствии с другим вариантом осуществления настоящего изобретения Cy представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный (3-8-членный)циклоалкил или -гетероциклоалкил, замещенный замещенным или незамещенным (С 2-С 18)алкинильным фрагментом. В соответствии с другим вариантом осуществления настоящего изобретения Cy представляет собой замещенный или незамещенный фенил, замещенный или незамещенный пиридинил, замещенный или незамещенный нафтил или замещенную или незамещенную группу - бензофуранил, замещенную B-R4, в котором В представляет собой этинильную группу и R4 представляет собой замещенный или незамещенный (С 6-С 16)алкил, замещенный или незамещенный (3-8-членный)циклоалкил, замещенный или незамещенный (С 1-С 12)алкил-(3-8-членный)циклоалкил, замещенный или незамещенный фенил или замещенный или незамещенный (С 1-С 12)алкилфенил. Особенно предпочтительно Cy представляет собой фенил,замещенный группой B-R4, в котором В означает этинильную группу, и R4 представляет собой замещенный или незамещенный (С 6-С 16)алкил. В соответствии с другим вариантом осуществления настоящего изобретения R2a и R2b, каждый,представляет собой Н, R1 представляет собой -СН 2-А или -СН 2-СН 2-А, где А представляет собой фенил или тиенил, необязательно замещенный циано, галогеном, метокси, гидрокси, фенокси, -NO2, трифторметилом, в то время как Cy представляет собой тиенил, фенил или бифенил, замещенный группой-SO2R3, -CO-NR3R3', в которых R3' представляет собой Н, и R3 представляет собой (С 7-С 12)алкил, предпочтительно (С 8-С 12)алкил и особенно предпочтительно додецильную группу. В качестве альтернативы R3 представляет собой (С 7-С 15)алкил, в частности (С 8-С 15)алкил и наиболее предпочтительно додецильную группу. Более предпочтительными являются такие соединения формулы (I')R1 выбирают из группы, состоящей из фенила, бензила, фенэтила, 1-метилбензила, которые могут быть замещены (С 1-С 6)алкильной группой или циклоалкильной группой;Cy представляет собой фенильную или бифенильную группу, необязательно замещенную радикалом -NH-CO-R3, -CO-NH-R3 или оксадиазольную группу, замещенную радикалом R3, который представляет собой (С 2-С 12)алкил, (С 7-С 15)алкил, предпочтительно (С 8-С 15)алкил и особенно предпочтительно додецильную группу. Некоторое очень небольшое количество соединений, удовлетворяющих формуле (I), описано в документах, относящихся к предшествующему уровню техники. Следующие соединения являются таковыми. а). Соединения формулы (I), в которой Cy представляет собой амидинонафтильный фрагмент, R1 представляет собой фенильную группу, которая является замещенной в пара-положении-Опиперидиновым или -О-пирролидиновым фрагментом. Такие соединения описаны в заявке WO 96/16940 (Yamanouchi Pharmaceutical Co.), и сообщается,что они препятствуют агрегации тромбоцитов. Такие соединения направленно ингибируют активированный фактор свертывания крови X и указывается, что они полезны в качестве агентов, препятствующих образованию тромбов. б). Соединение формулы (I), в котором Cy представляет собой фенильную группу, R2a и R2b, каждый, представляет собой Н, R1 представляет собой индольный фрагмент. Указанное выше конкретное соединение описано в заявке ЕР-483881 (Merrel Dow Pharmaceuticals),при этом сообщается, что оно является полезным для лечения заболеваний и состояний, связанных с нейродегенеративными расстройствами. в). Соединение формулы (I), в которой Cy представляет собой бифенильную группу, R2a и R2b, каждый, представляет собой Н, R1 представляет собой фенильную группу, которая является замещенной в орто-положении группой трет-бутил-5-аминоизоиндолин-2-карбоксилат. Это конкретное соединение упоминается в заявке WO 00/23428 (Takeda Chemical Industries Ldt.) в качестве промежуточного соединения при синтезе производных 1,5-бензодиазепина. Для указанного соединения не приводятся сведения о каком-либо медицинском использовании. г). Соединение формулы (I), в которой Cy представляет собой фенильную группу, R2a и R2b, каждый, представляет собой Н, R1 представляет собой 2,3,4-тригидронафталин-1-он. Указанное выше соединение описано в статье в J. Chem.Soc., Perkin Trans 1(10), p. 2126-33 (1980) без указания относительно какой-либо биологической активности или на терапевтического применения. Промежуточные соединения или пролекарства, которые могут претерпевать превращение с образованием при этом замещенных производных метиленамида формулы (I), посредством гидролиза, представляют собой сложные эфиры соединений формул (I-1) и (I-2) и включают следующие соединения: бензиловый эфир 4-(бензил[этокси(оксо)ацетил]аминометил)бензойной кислоты; этиловый эфир (бензил 4-[(додециламино)карбонил]бензиламино)(оксо)уксусной кислоты; бензиловый эфир 4-([этокси(оксо)ацетил][4-(трифторметил)бензил]аминометил)бензойной кислоты; этиловый эфир оксо 4-[(пентадециламино)карбонил]бензил-[4-(трифторметил)бензил]аминоуксусной кислоты; этиловый эфир (4-[додецил(метил)амино]карбонилбензил)-[4-(трифторметил)бензил]амино(оксо)уксусной кислоты; трет-бутиловый эфир 4-4-[(бензилокси)карбонил]бензил[этокси(оксо)ацетил]аминопиперидин 1-карбоновой кислоты; трет-бутиловый эфир 4-4-[(додециламино)карбонил]бензил[этокси(оксо)ацетил]аминопиперидин-1-карбоксилат; этиловый эфир 4-[(додециламино)карбонил]бензил-[4-(трифторметил)бензил]амино(оксо)уксусной кислоты; этиловый эфир 4-[(додециламино)карбонил]бензил-[3-(трифторметил)бензил]амино(оксо)уксусной кислоты; трет-бутиловый эфир 4-(4-[(додециламино)карбонил]бензил[этокси(оксо)ацетил]аминометил) пиперидин-1-карбоновой кислоты; этиловый эфир 4-[(трет-бутоксикарбонил)амино]бензил-[4-(трифторметил)бензил]амино(оксо) уксусной кислоты; этиловый эфир (4-аминобензил)[4-(трифторметил)бензил]амино(оксо)уксусной кислоты; этиловый эфир оксо[4-(тридеканоиламино)бензил][4-(трифторметил)бензил]аминоуксусной кислоты; этиловый эфир [бензил(4-[4-(гексилокси)бензоил]аминобензил)амино](оксо)уксусной кислоты; этиловый эфир (бензил 4-[(трет-бутоксикарбонил)амино]бензиламино)(оксо)уксусной кислоты; этиловый эфир [(4-аминобензил)(бензил)амино](оксо)уксусной кислоты; этиловый эфир оксо[4-(трифторметил)бензил][4-(ундец-10-еноиламино)бензил]аминоуксусной кислоты; этиловый эфир оксо 4-[(9 Е)-тетрадец-9-еноиламино]бензил-[4-(трифторметил)бензил]аминоуксусной кислоты; этиловый эфир бензил[4-(тридеканоиламино)бензил]амино(оксо)уксусной кислоты; этиловый эфир 4-[(2-гидроксидодецил)амино]бензил-[4-(трифторметил)бензил]амино(оксо)уксусной кислоты; этиловый эфир оксо[4-(трифторметил)бензил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]амино уксусной кислоты; этиловый эфир (5-[(додециламино)сульфонил]тиен-2-илметил)-[4-(трифторметил)бензил]амино(оксо)уксусной кислоты; трет-бутиловый эфир 4-(4-[(бензилокси)карбонил]бензил[этокси(оксо)ацетил]аминометил)пиперидин-1-карбоновой кислоты; этиловый эфир [4-[(додециламино)карбонил]бензил(1-[(4-метоксифенил)сульфонил]пиперидин 4-илметил)амино](оксо)уксусной кислоты; этиловый эфир 4-[(додециламино)карбонил]бензил-[1-(1-нафтил)этил]амино(оксо)уксусной кислоты; этиловый эфир (бензил 3-[(додециламино)карбонил]бензиламино)(оксо)уксусной кислоты; этиловый эфир [бензил(5-[(додециламино)сульфонил]тиен-2-илметил)амино](оксо)уксусной кислоты; трет-бутиловый эфир 4-(4-[(додециламино)карбонил]бензил[этокси(оксо)ацетил]аминометил) пиперидин-1-карбоновой кислоты; этиловый эфир [4-[(додециламино)карбонил]бензил(пиперидин-4-илметил)амино](оксо)уксусной кислоты; этиловый эфир [циклопентил(5-[(додециламино)сульфонил]тиен-2-илметил)амино](оксо)уксусной кислоты. Другим аспектом настоящего изобретения является применение соединений формулы (I) в качестве лекарственных средств. Предпочтительными замещенными производными метиленамида являются такие соединения, в которых R2a и R2b, каждый, представляет собой Н, R1 означает -СН 2-А, где А представляет собой фенил или тиенил, необязательно замещенный циано, галоген, метокси, гидрокси, фенокси, -NO2, трифторметил, Cy представляет собой тиенил, фенил или бифенил, замещенный радикалами -SO2R3, -CO-NR3R3', в которыхR3' представляет собой Н и R3 представляет собой (С 7-С 15)алкил, предпочтительно (С 8-С 15)алкил и особенно предпочтительно додецильную группу. Особенно предпочтительными замещенными производными метиленамида являются такие соединения, в которых R2a и R2b, каждый, представляет собой Н, R1 выбирают из группы, состоящей из фенила,бензила, фенэтила, 1-метилбензила, который может быть замещенным (С 1-С 6)алкильной группой или циклоалкильной группой, Cy представляет собой фенильную или бифенильную группу, замещенную фрагментом, выбранным из группы, состоящей из -NH-CO-R3, -CO-NH-R3 или оксадиазольной группы,замещенной радикалом R3, где R3 представляет собой (С 7-С 15)алкил, в частности (С 8-С 15)алкил, и особенно предпочтительно додецильную группу. Соединения формулы (I) полезны для лечения и/или профилактики метаболических нарушений или расстройств, связанных в резистентностью к инсулину или гипергликемией, которые включают диабет-8 012260 типа I и/или II, неадекватную толерантность к глюкозе, резистентность к инсулину, гиперлипидемию,гипертриглицеридемию, гиперхолестеринемию, ожирение или синдром поликистозного яичника (PCOS). В соответствии с одним из вариантов осуществления изобретения соединения формулы (I) особенно пригодны для лечения и/или профилактики диабета типа II, ожирения и для регулирования аппетита у млекопитающих. Соединения формулы (I) пригодны для модулирования активности PTPs, в частности активности РТР 1 В. Вследствие этого полагают, что соединения согласно настоящему изобретению пригодны для лечения и/или профилактики заболеваний, медиатором которых являются PTPs, в частности РТР 1 В. Указанное лечение включает процесс модулирования, в особенности обратное регулирование или ингибирование ферментов PTPs, в частности РТР 1 В. Еще один вариант осуществления настоящего изобретения относится к фармацевтической композиции, включающей производное метиленамида формулы (I) и по меньшей мере одно дополнительное лекарственное средство (в частности, противодиабетический агент). Согласно одному из вариантов осуществления настоящего изобретения дополнительные противодиабетические агенты выбирают из группы, которая включает или состоит из инсулина (или имитаторов инсулина), ингибиторов альдозаредуктазы, ингибиторов -глюкозидазы, агентов на основе сульфонилмочевины, бигуанидов (например, такого как метформин), тиазолидинов (например, таких как пиоглитизон, розиглитазон, см. WO 02/100396) илиPPAR-агонистов, или ингибиторов c-Jun киназы или GSK-3. Инсулины, которые подходят для использования согласно способу, являющемуся предметом настоящего изобретения, включают инсулины быстрого действия, инсулины среднего по продолжительности действия, инсулины длительного действия и сочетание инсулинов среднего по продолжительности действия и инсулинов быстрого действия. Ингибиторы альдозаредуктазы, используемые в соответствии со способом, являющимся предметом настоящего изобретения, включают известные из предшествующего уровня техники ингибиторы. Они входят в следующий перечень, который не ограничивает объем изобретения: а) тетроновые производные спироизохинолинпирролидина, описанные в патенте США 4927831(Malamas), указано в настоящем описании в качестве ссылки, которые включают ARI-509, также известный как миналрестат (minalrestat) или спиро[изохинолин-4(1 Н),3'-пирролидин]-1,2',3,5'(2 Н)тетрон и их аналоги,б) 2-[(4-бром-2-фторфенил)метил]-6-фтор-(9CI); в) соединения согласно патенту США 4439617, указано в настоящем описании в качестве ссылки,которые включают толрестат (Tolrestat), также известный как глицин, N-6-метокси-5-(трифторметил)-1 нафталенил]тиоксометил]-N-метил-(9CI) или AY-27773 и их аналоги; г) сорбинил (sorbinil) (регистрационный номер 68367-52-2), также известный как спиро[4 Н-1 бензопиран-4,4'-имидазолин]-2',5'-дион, 6-фтор-2,3-дигидро-, (4S)-(9CI) или СР 45634; д) метосорбинил (methosorbinil); е) зополрестат (zopolrestat), который представляет собой 1-фталазинуксусную кислоту, 3,44 дигидро-4-оксо-3-5-(трифторметил)-2-бензотиазолил]метил]-(9CI) (регистрационный номер 110703-941); ж) эпалрестат (epalrestat), который представляет собой 3-тиазолидинуксусную кислоту, 5-[(2 Е)-2 метил-3-фенил-2-пропенилиден]-4-оксо-2-тиоксо-, (5Z)-(9CI) (регистрационный номер 82150-09-9); з) зенарестат (zenarestat, регистрационный номер 112733-40-6) или 3-[(4-бром-2-фторфенил)метил]7-хлор-3,4-дигидро-2,4-диоксо-1(2 Н)-хиназолинуксусную кислоту; и) имирестат (imirestat), также известный как 2,7-дифторспиро(9 Н-флуорен-9,4'-имидазолидин)2',5'-дион; к) поналрестат (ponalrestat, регистрационный номер 72702-95-5), который представляет собой 1 фталазинуксусную кислоту, 3-[(4-бром-2-фторфенил)метил]-3,4-дигидро-4-оксо-(9CI), также известный как сталил (Stalil) или статил (Statyl); л) ONO-2235, который представляет собой 3-тиазолидинуксусную кислоту, 5-(2 Е)-2-метил-3 фенил-2-пропенилиден-4-оксо-2-тиоксо-, (5Z)-(9CI); м) GP-1447, который представляет собой 3-[(4,5,7-трифторбензотиазол-2-ил)метил]-5 метилфенилуксусную кислоту; н) СТ-112, который представляет собой 5-(3-этокси-4-пентилоксифенил)-2,4-тиазолидендион; о) BAL-ARI 8, который представляет собой глицин, N-[(7-фтор-9-оксо-9 Н-ксантен-2 ил)сульфонил]-N-метил-(9CI), регистрационный номер 124066-40-6; п) AD-5467, который представляет собой 2,3-дигидро-2,8-бис(1-метилэтил)-3-тиоксокс-4 Н-1,4 бензооксазин-4-уксусную кислоту в виде соли-хлорида 4 Н-1,4-бензооксазин-4-уксусная кислота, 2,3 дигидро-2,8-бис(1-метилэтил)-3-тиоксо-(9CI); р)(3',5'-диметил-4'-нитрометилсульфонил-2-(2 толил)ацетанилид); с) 3,4-дигидро-2,8-диизопропил-3-тиоксо-2 Н-1,4-бензооксазин-4-уксусная кислота; т) 1-[(3-бром-2-бензофуранил)сульфонил]-2,4-имидазолидиндион (М-16209),-9 012260 у) NZ-314, который представляет собой 1-имидазолидинуксусную кислоту, 3-[(3 нитрофенил)метил]-2,4,5-триоксо-9(CI) (регистрационный номер 128043-99-2),ф) 1-фталазинуксусная кислота, 3,4-дигидро-4-оксо-3-[(5-трифторметил)-2-бензотиазолил]метил; х) М-79175, который представляет собой спиро[4 Н-1-бензопиран-4,4'-имидазолидин]-2',5'-дион; 6 фтор-2,3-дигидро-2-метил-, (2R,4S)-(9CI); ц) SPR-210, который представляет собой 2 Н-1,4-бензотиазин-2-уксусную кислоту, 3,4-дигидро-3 оксо-4-[(4,5,7-трифтор-2-бензотиазолил)метил]-(9CI); 8'-хлор-2'-3'ч) спиро[пирролидин-3,6'(5'Н)-пирроло[1,2,3-de][1,4]бензоксазин]-2,5,5'-трион,дигидро-(9CI) (также известный как AND 138 или 8-хлор-2',3'-дигидроспиро[пиролизин-3,6'(5 Н)пирроло-[1,2,3-de][1,4]бензооксазин]-2,5,5'-трион); ш) 6-фтор-2,3-дигидро-2',5'-диоксо-(2S-цис)-спиро[4 Н-1-бензопиран-4,4'-имидазолидин]-2 карбоксамид (также известный как SNK-860); или фармацевтически приемлемые соли одного или более из указанных соединений. К числу наиболее предпочтительных ингибиторов альдозаредуктазы согласно настоящему изобретению относятся миналрестат, толрестат, сорбинил, метосорбинил, зополрестат, эпалрестат, зенарестат,имирестат и реналрестат или указанные соединения в виде фармацевтически приемлемых солей. Ингибиторы -глюкозидазы, которые подходят для использования в соответствии со способом, являющимся предметом настоящего изобретения, включают миглитол (miglitol) или акарбозу (acarbose) или их фармацевтически приемлемые соли. Агенты на основе сульфонилмочевины, которые подходят для использования в соответствии со способом, являющимся предметом настоящего изобретения, включают глипизид (glipizide), глибурид(glyburide) (глибенкламид), хлорпропамид (clorpropamide), толбутамид (tolbutamide), толазамид (tolazamide) и глимепирид (glimepiride) или их фармацевтически приемлемые соли. Предпочтительно указанные дополнительные фармацевтически приемлемые агенты выбирают из группы, состоящей из инсулина быстрого действия, инсулина среднего по продолжительности действия,инсулина длительного действия, сочетания инсулина среднего по продолжительности действия и инсулина быстрого действия, иналрестата, толрестата, сорбинила, метасорбинила, зопорестата, эпалрестата,зенарестата, имирестата, поналрестата, ONO-2235, GP-1447, СТ-112, BAL-ARI 8, AD-5467, ZD5522, М 16209, NZ-314, М-79175, SPR-210, ADN 138 или SNK-860, миглитола, акарбозы, глипизида, глибутирида,хлорпропамида, толбутамида, толазамида или глимепририда. Еще одной целью настоящего изобретения является разработка способа получения замещенных производных метиленамида формулы I. Замещенные производные метиленамида согласно настоящему изобретению могут быть получены из легко доступных исходных веществ, с использованием приведенных ниже общих способов синтеза и методик. Следует отметить, что в том случае, когда приводятся типичные или предпочтительные экспериментальные условия (т.е. температура реакции, время, количество молей реагента, растворители и т.п.), также могут быть использованы и другие условия проведения реакции, если не указано иное. Оптимальные условия проведения реакции могут варьироваться в зависимости от вида конкретных используемых реагентов и растворителей, но такие условия могут быть установлены специалистом в данной области техники при проведении обычных экспериментов для оптимизации. Далее приводятся общие способы и методики получения соединений формулы (Ia). Заместители соединения (Ia) являются такими, как определено выше, и R8 представляет собой Н,(С 1-С 6)алкил или (3-8-членную)циклоалкильную группу. Как правило, замещенные производные метиленамида, соответствующие общей формуле (I), могут быть получены несколькими способами с использованием как синтеза в растворе, так и твердофазного синтеза. В зависимости от химической природы радикалов Cy, R1, R2a, R2b и R8 некоторые способы будут более предпочтительными, чем другие, такой выбор наиболее подходящего способа может быть сделан специалистом в данной области техники. Синтез в растворе. Как правило, замещенные производные метиленамида формулы (I) могут быть синтезированы посредством получения сначала сложных эфиров (Ia) и их последующего гидролиза с образованием при этом замещенного производного метиленамида, соответствующего общей формуле (I). а). Карбоксамид- и сульфонамидзамещенные производные метиленамида формулы (I). Приведенные ниже общие способы получения карбоксамид- и сульфонамидных замещенных производных метиленамида формулы (I), в которой R1, R2a, R2b и Cy являются такими, как определено выше,проиллюстрированы на приведенной ниже схеме А.- 10012260 Замещенные производные метиленамида формулы (I) могут быть получены конденсацией соответствующих производных карбоновой кислоты (LG2-CO-CO-R8), где LG2 представляет собой отщепляемую группу, включая Cl, N-гидроксисукцинимидную или бензотриазол-1-ильную группу и первичного или вторичного амина Cy-CR2aR2b-NHR1. Получение указанных амидных производных осуществляют, используя способы и методики, хорошо известные специалисту в данной области техники и предназначенные для формирования амидной связи при взаимодействии амина и карбоновой кислоты или производного карбоновой кислоты (например, хлорангидрида), с использованием обычных конденсирующих агентов, например, таких как ДИПК, ЭДК, ТБТУ, DECP, ДЦК, РуВОР, изобутилхлорформиат или других агентов в присутствии или без использования оснований, таких как ТЭА, ДИЭА, NMM в подходящем растворителе, например, таком как ДХМ, ТГФ или ДМФ. Замещенные метиленамиды формулы (Ia) затем подвергают гидролизу под воздействием основания (например, NaOH), что приводит к получению целевых соединений формулы (I). Схема А Общая схема синтеза согласно настоящему изобретению также включает получение соединений формулы (I), в которых Cy в частности замещен группой -CO-NR3R3', -NH-CO-R3 или -SO2-R3R3', так как это показано на приведенных ниже схемах, где R3 и R3' являются такими, как определено выше, и в соответствии с этими схемами химические превращения соединений формулы (Ia) также позволяют получить соединения формулы (I). б). Карбоксамид- и сульфонамидзамещенные производные метиленамида формулы (I-1). Следующие общие способы получения карбоксамид- и сульфонамидных замещенных производных метиленамида формулы (I-1), т. е. соединений формулы (I), в которых Cy является таким, как определено выше и замещен либо группой -CO-NR3R3' (X = -СО-), либо группой -SO2-NR3R3' (X = -SO2-)-, проиллюстрированы на схеме 1, приведенной ниже. Замещенные производные метиленамида формулы (I-1), в которой Cy замещен группой -CO-NR3R3',могут быть получены из соответствующих производных кислоты (II-1), в которых LG1 представляет собой подходящую отщепляемую группу, включая ОН, Cl, О-алкил или О-алкиларил, и из первичного или вторичного амина -NHR3R3', в котором R3, R3' независимо друг от друга выбирают из группы, состоящей из Н, (С 1-С 15)алкила, (С 2-С 12)алкенила, (С 2-С 12)алкинила, арила, гетероарила, (3-8-членного)циклоалкила или гетероциклоалкила, (С 1-С 12)алкиларила или гетероарила, (С 2-С 12)алкениларила или (С 2 С 12)алкенилгетероарила, (С 2-С 12)алкиниларила или (С 2-С 12)алкинилгетероарила. Общая методика такого синтеза приводится в примерах (см. способ А), с использованием условий и методик, хорошо известных специалисту в данной области техники и используемых для формирования амидной связи при взаимодействии амина и карбоновой кислоты или производного карбоновой кислоты (например, хлорангидрида), с использованием обычных конденсирующих агентов, например, таких как ДИПК, ЭДК, ТБТУ,DECP, ДЦК, РуВОР, изобутилхлорформиат или другие в присутствии или без использования оснований, например, таких как ТЭА, ДИЭА, NMM в подходящем растворителе, таком как ДХМ, ТГФ или ДМФ. Замещенные производные метиленамидов формулы (I-1), в которой Cy замещен группой -SO2NR3R3' (X = -SO2-), также могут быть получены из соответствующих производных сульфоновой кислоты(II-1), в которых LG1 представляет собой отщепляемую группу, например, такую как ОН, Cl, Оалкиларил или О-алкил, и из первичного или вторичного амина NHR3R3' (см. схему 1; способ А). Производные карбоновой кислоты (II-1) (где X = -СО- или -SO2-) могут быть получены из соответствующего амина (III-1'), где Р = Н, посредством конденсации со сложным эфиром, как показано на стадии 1. В этом случае LG2 представляет собой отщепляемую группу (например, Cl, Nгидроксисукцинимидную, бензотриазол-1-ильную группу). Указанные амины (III-1'), в которых Р означает Н, могут быть получены удалением защитной группы из соответствующих защищенных производных, в которых Р означает защитную группу, например,такую как Boc или Fmoc. В отношении способов введения защиты и удалении защиты см. "ProtectingG.M. Wuts, "Protective Groups in Organic Synthesis", 3rd edition, John WileySons Inc., 1999 (NY). Согласно дополнительному способу замещенные производные метиленамидов формулы (I-1), в которых Cy замещен группой -CO-NR3R3' или -SO2NR3R3' (X = -СО- или -SO2-), могут быть получены из соответствующих аминов (III-1) посредством конденсации со сложным эфиром формулы LG2-CO-COOR8, в которой R8 представляет собой алкильную группу, и LG2 означает отщепляемую группу, например, такую как Cl, N-гидроксисукцинимидная или бензотриазол-1-ильная группа, как показано выше на схеме 1 (способ Б). Соединения (III-1), в которых Р означает Н или любую защитную группу, такую как Boc или Fmoc,могут быть получены взаимодействием соответствующего производного карбоновой или сульфоновой кислоты (III-1') (Х=-СО-, X=-SO2- соответственно), причем LG1 означает отщепляемую группу, например, такую как ОН, Cl или О-алкил, с первичными или вторичными аминами NHR3R3', с последующим использованием методики проведения реакции в растворе, как описано в примерах и показано на схеме 1(способ Б). в). Замещенные производные метиленамида формулы (I-2). В соответствии с еще одним способом согласно настоящему изобретению замещенные производные метиленамида формулы (I-2), т.е. замещенные производные метиленамида формулы (I), в которойCy замещен группой -NR3COR3', a R3 и R3' являются такими, как определено выше, могут быть получены из соответствующего амина (II-2), где Р' означает Н, и LG1-CO-R3' (XI) (Х = -СО-), с последующим использованием методики, описанной в примерах и показанной на схеме 2 (способ С). LG1 означает подходящую отщепляемую группу, например, такую как Cl, ОН или О-алкил. Схема 2 Амины формулы (II-2), в которой Р' означает Н, могут быть получены удалением защитной группы из соответствующих защищенных форм, где Р' означает защитную группу, например, такую как Boc илиFmoc. Амины формулы (II-2), в которой Р' означает Н или любую защитную группу, такую как Boc илиFmoc, могут быть получены из соответствующего амина (III-2'), где Р представляет собой Н, посредством конденсации со сложным эфиром, как показано на стадии 1. При этом LG2 означает защитную группу(например, такую как Cl, N-гидроксисукцинимидная группа, бензотриазол-1-ильная группа). Указанные амины (III-2'), в которых Р означает Н, могут быть получены удалением защитной группы из соответствующих защищенных форм, где Р означает защитную группу, например, такую как Boc или Fmoc. Согласно другому варианту осуществления настоящего изобретения замещенные производные метиленамида (I-2), в которой Cy является таким, как определено выше, могут быть замещены группой-NR3COR3' и могут быть получены из соответствующих аминов (III-2), где Р означает Н, посредством конденсации со сложным эфиром LG2-CO-COOR8, в котором R8 представляет собой (С 1-С 6)алкил, предпочтительно этил или метил, и LG2 означает отщепляемую группу, как описано выше (см. схему 2 (способ Г. Амины (III-2), в которых Р означает Н, могут быть получены удалением защитной группы из соответствующих защищенных форм, в которых Р означает защитную группу, например, такую как Boc илиFmoc. Соединения (III-2), в которых Р означает Н или любую защитную группу, такую как Boc или Fmoc,получают взаимодействием соответствующих аминов (III-2'), где Р' означает Н, с производными формулы LG1-CO-R3' (XI) (Х = -СО-), LG1 представляет собой отщепляемую группу, например, такую как Cl,ОН или О-алкил, с последующим использованием методики, описанной в примерах и представленной выше при описании способа Г. Соединения формулы (I-2), в которых X не является функциональной карбонильной группой, могут быть получены заменой соединений формулы (XI) соединениями, содержащими подходящую функциональную группу, например, сульфонилхлоридами, изоцианатами, изотиоцианатами, хлорформиатами,замещенными алкилгалогенидами, эпоксидами или другими соединениями с получением при этом сульфонамида, мочевины, тиомочевины, карбамата, замещенных алкильных производных, замещенных , аминоспиртов или других соединений, соответственно. г). Получение соединений-предшественников формулы (I-3). В соответствии с другим способом замещенные производные метиленамида формулы (I-3), т.е. замещенные производные метиленамида формулы (I), в которой радикал Cy является замещенным оксадиазольной группой (в качестве примера гетероарильной группы), и R3 является таким, как определено выше, могут быть получены из соответствующего производного кислоты формулы (II-1), в которой LG1 означает подходящую отщепляемую группу, например, такую как Cl, ОН или О-алкил, и оксима имида формулы (X), с последующим использованием методики, описанной в примерах и представленной на схеме 3 (способ Д). Таким образом, исходные соединения-производные кислоты формулы (II-1) взаимодействуют с оксимом имида формулы (X) при использовании обычных конденсирующих агентов, например, таких как ДИПК, ЭДК, ТБТУ, DECP, ДЦК, РуВОР, изобутилхлорформиат или другие в подходящем растворителе, например, таком как ДХМ, с последующей обработкой основанием, например, таким как пиридин, для того, чтобы способствовать циклизации с получением при этом оксадиазола формулы (I-3). В соответствии с альтернативным способом замещенные производные метиленамидов формулы (I3) могут быть получены из соответствующих аминов (III-3) посредством конденсации со сложным эфиром LG2-CO-CO-OR8, в котором R8 представляет собой алкильную или циклоалкильную группу, и LG2 означает отщепляемую группу, например, такую как Cl, N-гидроксисукцинимидная группа или бензотриазол-1-ильная группа, как показано на схеме 3 (способ Е). Соединения (III-3), в которых Р означает Н, могут быть получены удалением защитной группы из соответствующих защищенных форм, в которых Р означает защитную группу, например, такую как Boc или Fmoc. Соединения (III-3), в которых Р означает Н или какую-либо защитную группу, например, такую какBoc или Fmoc, могут быть получены из их соединений-предшественников формулы (III-1') и оксима амида формулы (X) в соответствии с методиками, которые описаны в примерах и показаны на схеме 3 д). Получение соединений-предшественников формулы (I-4). В соответствии с другим способом замещенные производные метиленамида формулы (I-4), т.е. замещенные производные метиленамида формулы (I), в которых Cy замещен группой X, и X представляет собой атом галогена (например, Br, I, Cl) или подходящую отщепляемую группу, например, такую как-OSO2CF3, могут быть получены из соответствующих производных кислоты формулы (II-4), в соответствии с методиками, которые описаны в примерах и показаны на схеме 4 (способ Ж). Таким образом, производные формулы (II-4) могут вступать во взаимодействие с замещенным алкином формулы (XII) в присутствии или без использования таких добавок, как соли меди (I) в сочетании с палладиевыми катализаторами (например, такими как тетракис(трифенилфосфин)палладий) и аминами(например, такими как триэтиламин). Предпочтительные условия включают применение бромида меди(I), тетракис(трифенилфосфин)палладия с триэтиламином, например, при 90 С. Согласно еще одному способу замещенные производные метиленамида формулы (I-4) могут быть получены из соответствующих аминов (III-4) посредством конденсации со сложным эфиром LG2-COCO-OR8, в котором R8 означает алкильную группу, и LG2 представляет собой отщепляемую группу, например, такую как Cl, N-гидроксисукцинимидная группа или бензотриазол-1-ильная группа, как показано на схеме 4 (способ Ж). Соединения (III-4), в которых Р означает Н, могут быть получены удалением защитной группы из соответствующих защищенных форм, в которых Р представляет собой защитную группу (например, Boc или Fmoc). Соединения (III-4), в которых Р означает Н или какие-либо защитные группы (например, Boc илиFmoc), могут быть получены из соответствующих соединений-предшественников формулы (III-4') и алкина формулы (XII) в соответствии с методиками, описанными в примерах и показанных на схеме 4 е). Получение соединений-предшественников формулы (III). Соединения-предшественники формулы (III), (включая III-1', III-1, III-2', III-2, III-3, III-4 или III-4'),указанные на схемах 1, 2, 3 и 4, в которых Cy может быть замещен фрагментом Q, таким как замещен- 14012260 ный или незамещенный арил или замещенный или незамещенный гетероарил, например, такой как оксадиазол, замещенный или незамещенный циклоалкильный фрагмент, или -CO-NR3R3', -COOR3, -NP'R3,-NR3COR3', -CO-LG1, -SO2-LG1, -SO2NR3R3', -CC-R3, где R3 и R3' могут быть независимо друг от друга замещенными или незамещенными (С 1-С 15)алкилом или группой X, где группа X является такой, как определено выше в пункте д), могут быть получены из соответствующих соединений-предшественников формул (VII), (VIII) или (IX), с использованием разнообразных методик синтеза, примеры которых приведены ниже на схеме 5. Соединения формулы (III), в которых R2b означает Н, могут быть получены, например, алкилированием аминов (IV), в которых R1 является таким, как определено выше, и Р означает Н или подходящую защитную группу, например, такую как Boc или Fmoc, карбонильными производными (IX), где R2a является таким, как определено выше. Взаимодействие (см. схему 5, способ И) может быть осуществлено в присутствии подходящего восстанавливающего агента, который включает NaBH(OAc)3, NaBH3CN,NaBH4 или водород, с использованием подходящего катализатора, например, такого как Pd/C или PtO2. В качестве альтернативы соединения формулы (III) могут быть получены посредством алкилирования аминов формулы (IV) производными формулы (VIII), в которой LG означает подходящую отщепляемую группу, включающую Cl, Br, I, ОН, OMs, OTs (см. способ К). R2a и R2b являются такими, как определено выше. Также соединения формулы (III) могут быть получены посредством алкилирования аминов формулы (VII), с использованием алкилирующих агентов формулы (VI), в которой LG означает вышеуказанную отщепляемую группу (схема 5, способ Л). Еще один альтернативный способ показан на схеме 5, способ М. Этот вариант осуществления способа относится к получению соединения формулы (III) алкилированием аминов формулы (VII) карбонильными производными (V), где А является таким, как определено выше, в присутствии восстанавливающего агента, например, такого как NaBH(OAc)3, NaBH3CN, NaBH4 или водород с использованием подходящего катализатора, например, такого как Pd/C или PtO2, для того, чтобы получить соединения формулы (III), в которой R1 означает -СН-R5-А, где R5 выбирают из группы, состоящей из (С 1-С 12)алкила,предпочтительно (С 1-С 6)алкила, (С 2-С 12)алкенила, (С 2-С 12)алкинила, арила, гетероарила, (3-8 членного)циклоалкила или гетероциклоалкила, (С 1-С 12)алкиларила или (С 1-С 12)алкилгетероарила, (С 2 С 12)алкениларила или (С 2-С 12)алкенилгетероарила, (С 2-С 12)алкиниларила или (С 2-С 12)алкинилгетероарила. Схема 5 Соединения-предшественники формул (IV), (V), (VI), (VII), (VIII) или (IX) являются либо коммерчески доступными, либо могут быть легко получены из коммерчески доступных исходных веществ, например, это соединения, которые могут быть выбраны из следующей группы:(D,L)-транс-2-бензилоксициклопентиламин, 1-(1-нафтил)этиламин, 1,2,3,4-тетрагидро-1-нафтиламин, 1,2-додециленоксид, 1-аминоиндан, 1-деокси-1-(метиламино)глюцитол, 2-(амино-2-гидроксиметил)-1,3-пропандиол, 2-(2,4,6-триметилфенил)этиламин, 2-(3-хлорфенил)этиламин, 2-(3-метоксифенил) этиламин, 2-(4-бифенил)этиламин, 2-(4-метоксифенил)этиламин, 2,2-дифенилэтиламин, 2-амино-1- 15012260 метоксипропан, 2-фторбензальдегид, 2-формилтиазол, 2-морфолино-1,3-тиазол-5-карбальдегид, 2 феноксифенэтиламин, гидрохлорид сложного этилового эфира 2-фенилглицина, 2-пиридинкарбоксальдегид, 2-хиноксалоилхлорид, 2-тиофенкарбоксальдегид, 3-(бензилокси)анилин, 3-(трифторметил) бензальдегид, 3,3-дифенилпропиламин, 3,5-дихлорбензиламин, 3-аминофенилтрифторметилсульфон, 3 карбоксибензальдегид, 3-хлорбензальдегид, 3-цианобензальдегид, 3-гидроксибензальдегид, 3-иодбензоилхлорид, 3-нитробензальдегид, 3-фенилбензиламин гидробромид, 3-фенилпропиламин, 3 пиридинкарбоксальдегид, 3-тиофенкарбоксальдегид, 4-(1,2,3-тиадиазол-4-ил), гидрохлорид бензиламина,4-(аминометил)-1-N-Вос-анилин, 4-(диметиламино)фенилизоцианат, 4-(метилсульфонил)бензальдегид,4-(трифторметил)бензиламин, 4-амино-1-бензилпиперидин, 4-бензамидобензиламин, 4-броманилин, 4 хлорметилбензоилхлорид, 4-хлорбензальдегид, 4-цианобензальдегид, 4-диметиламинобензальдегид, 4 формилбензойная кислота, бензиловый эфир 4-формилбензойной кислоты, 4-гидроксибензальдегид, 4 метоксибензолсульфонилхлорид, 4-нитробензальдегид, гидрохлорид 4-N-пентилбензиламина, гидрохлорид 4-пентилбензиламина, 4-феноксианилин, 4-феноксибензальдегид, 4-феноксибензиламин, 4 феноксифенэтиламин, 4-фенилбутиламин, 4-пиридинкарбоксальдегид, 4-толилбороновая кислота, 5 формил-2-тиофенкарбоновая кислота, 6-(трифторметил)пиридин-3-карбоксальдегид, анилин, бензальдегид, бензоилпероксид, бензиламин, этиловый эфир хлороксоуксусной кислоты, цис-дельта-9-транстетрадеценоилхлорид, циклогексилизоцианат, циклогексилизоцианат, циклопентанон, D,L-3-амино-3 фенилпропионовая кислота, D,L-альфа-метилбензиламин, додециламин, Fmoc-(3-аминометил)бензойная кислота, Fmoc-(4-аминометил)бензойная кислота, гексаноилхлорид, изопропиламин, моногидрат гидроксида лития, сложный трет-бутиловый эфир 1-фенилглицина, метиловый эфир 4-формилбензойной кислоты, N-бромсукцинимид, октиламин, пара-анисовый альдегид, пентадециламин, пиперонал, пиперониламин, цианоборгидрид натрия, триацетоксиборгидрид натрия, тетрабутиламмоний иодид, тетрадец-9 еноилхлорид, тетракистрифенилфосфин палладий(0), тиофен-2-этиламин, гидрохлорид транс-2 фенилциклопропиламина, транс-3-(трифторметил)циннамоилхлорид, тридекановая кислота, тридеканоилхлорид. Предпочтительный способ получения соединений формулы (III) показан на приведенной выше схеме 5, способ И. В соответствии с этим способом восстановительное аминирование карбонильных соединений формулы (IX), в которой Q означает -СОО-Bn, осуществляют с использованием аминов формулы(IV) и восстанавливающего агента, например, такого как NaBH(OAc)3 в подходящем растворителе, например, таком как ДХЭ или ТГФ. Таким образом, этот способ позволяет получить амин формулы (III), в которой Q означает C(O)OBn. В соответствии со способом, показанным на схеме 1 (способ А), полученный амин (III) подвергают конденсации со сложным эфиром LG2-CO-COO-R8, где R8 означает (С 1-С 6)алкил или циклоалкил, предпочтительно этил или метил, и LG2 означает отщепляемую группу, например, такую как Cl, в присутствии основания, такого как ДИЭА в апротонном растворителе (например, таком как ДХМ или ТГФ), получая при этом замещенные производные метиленамида формулы (II-1). Последующее снятие бензильной защиты обычными методами с использованием Н 2/Pd и затем конденсация полученной кислоты, гдеX означает СО, и LG1 означает -OBn, с аминами -NHR3R3', по обычной методике с использованием карбодиимида или по обычной методике с использованием смешанного ангидрида, позволяют таким образом при использовании вспомогательных методик получить целевые соединения формулы (I-1), где R8 представляет собой этил или метил (см. схему 1). Указанные последними соединения могут быть подвергнуты гидролизу с получением при этом соединений формулы (Ia) согласно настоящему изобретению, где R8 означает Н, посредством их обработки гидроксидом, например, таким как NaOH, в подходящем протонном растворителе (например, таком как EtOH), с последующим подкислением реакционной смеси. Согласно еще одному предпочтительному способу получения соединений формулы (Ia), карбонильные производные формулы (IX) (см. схему 5), где Q означает -CONR3R3' могут быть получены из соответствующих коммерчески доступных или получаемых из коммерчески доступных исходных веществ-предшественников, в которых Q означает -СООН, и аминов HNR3R3', с использованием обычных методов с использованием карбодиимида или смешанного ангидрида. Восстановительное аминирование карбонильных производных формулы (IX), где Q означает -CONR3R3', аминами формулы (IV) с использованием восстановительного агента, такого как NaBH(OAc)3 в подходящем растворителе, например,таком как ДХЭ или ТГФ, позволяет получить амин формулы (III), в которой Q означает -CONR3R3', с последующим использованием способов, указанных как способ И на схеме 5. Полученный амин (III) подвергают конденсации с эфиром LG2-CO-COO-R8, в котором R8 представляет собой (С 1-С 6)алкил или циклоалкил, предпочтительно этил или метил, и LG2 означает отщепляемую группу, например, такую как Cl, в присутствии основания, такого как ДИЭА, в апротонном растворителе (например, таком как ДХМ или ТГФ) с получением при этом сложного эфира (I-1). Указанное последним соединение может быть подвергнуто гидролизу с получением при этом соединений формулы (Ia) согласно настоящему изобретению, в которых R8 означает Н, посредством их обработки гидроксидом, например, таким как NaOH,в подходящем протонном растворителе (например, таком как EtOH), с последующим подкислением реакционной смеси.- 16012260 Соли соединений формулы (I) с основаниями получают обычным образом, как известно специалисту в данной области техники. В частности, получение солей с N-Me-D-глюкамином и трометамином(т.е. 2-амино-2-(гидроксиметил)-1,3-пропандиолом) согласно настоящему изобретению позволяет получить водорастворимые производные и улучшить биодоступность. Способы получения замещенных метиленамидов формулы (I) согласно настоящему изобретению,получаемые в соответствии с вышеуказанными методиками, имеют определенные преимущества, поскольку являются удобными и экономичными, в том смысле, что эти способы состоят из небольшого числа стадий. ж). Синтез с использованием твердофазных реакций или реакций в системе твердая фаза/раствор. В соответствии с еще одним общим подходом замещенные метиленамиды общей формулы (Ia), в которой заместители R1, R2a, R2b и Cy являются такими, как определено выше, могут быть получены с использованием твердофазных реакций или реакций в системе твердая фаза/раствор таким образом, как описано в примерах и показано выше на схемах 1, 2, 3, 4, 5 и 6, с использованием хорошо известных методов (например, такого как IRORI). Специалисту в данной области техники будет понятно, что, по существу, те же самые условия синтеза, методы и реагенты, как и приведенные выше на схемах 1, 2, 3 и 4 для синтеза соединений формулы (Ia) в растворе, могут быть использованы для твердофазного синтеза или синтеза в системе твердая фаза/раствор с получением при этом указанных соединений. При проведении такого твердофазного синтеза или синтеза в системе твердая фаза/раствор значения R3 являются такими, как определено выше. Отщепление от смолы осуществляют в кислой среде, получая при этом соответствующие замещенные производные метиленамида формулы (Ia). Необходимо понимать, что дополнительно к смолам, указанным в примерах, например, таким как альдегидные смолы Sasrin, для твердофазного синтеза соединений общей формулы (Ia) могут быть использованы другие подходящие реагенты, в частности, смолы, известные специалисту в данной области техники. Закрашенные кружочки на приведенной ниже схеме 6 обозначают частички смолы, к которым в процессе твердофазного синтеза присоединяются соединения. В соответствии с одним особенно предпочтительным вариантом осуществления способа связанные со смолой амины формулы NHR3R6(D), в которой R6 представляет собой любую подходящую смолу(схема 6), и R3 является таким, как определено выше в настоящем описании, являются коммерчески доступными как таковые или могут быть легко получены из доступных смол, например, таких как, альдегидные смолы Sasrin или бромсодержащие смолы Wang и аминов, в обычных условиях восстановительного аминирования или алкилирования, хорошо известных специалисту в данной области техники. Связанные со смолой амины формулы NHR3R6 (D) затем могут быть подвергнуты ацилированию соединениями формулы (VIII-1'), в которой X означает -СО-, и LG1 означает Cl, в присутствии основания, например, такого как ДИЭА, в подходящем растворителе, например, таком как NMП или ДХМ; или X также может означать -SO2-, и LG1 может означать Cl, в обычных условиях, включающих использование основания, например, такого как ДИЭА в апротонном растворителе, например, таком как ДХМ или ТГФ,с получением при этом соединений формулы (VIII-1) (схема 6, способ О). В соответствии с методами, показанными на схеме 5 (способ К), замещение отщепляемой группыLG от связанного со смолой промежуточного соединения (VIII-1) посредством реакции с аминамиNHPR1 (IV) в присутствии иодида, такого как TBAI или NaI, в подходящем растворителе, например, таком как NMП, при подходящей температуре, например, такой как 80 С, может приводить к получению связанных со смолой соединений формулы (III-1). В заключение, эти соединения подвергают конденсации со сложным эфиром LG2-CO-COO-R8, где R8 предпочтительно представляет собой этил или метил, иLG2 означает отщепляемую группу, например, такую как Cl, в присутствии основания, например, такого как ДИЭА, в апротонном растворителе (например, таком как ДХМ или ТГФ) с получением при этом связанного со смолой сложного эфира (I-1). Указанные последними соединения могут быть подвергнуты гидролизу с получением при этом соединений формулы (Ia) согласно настоящему изобретению, в которых R8 означает Н, посредством их обработки гидроксидом, например, таким как NaOH в подходящем растворителе (таком как ТГФ). Отщепление от смолы осуществляют в кислой среде (например, такой как раствор в ДХМ, содержащий 20% ТФУ), получая при этом соответствующие замещенные производные метиленамида формулы (Ia). В соответствии с другим предпочтительным методом синтеза (способ О) связанные со смолой амины формулы NHR6R3 (D), в которой R6 относится к подходящей смоле (схема 6) могут быть подвергнуты ацилированию с использованием соединений формулы (VII-1'), в которых X означает -СО-, LG1 означает ОН, R1, R2a, R2b, R3 и R5 являются такими, как определено выше, и Р означает защитную группу, например, такую как Fmoc или Pht, в обычных условиях с использованием конденсирующего агента, например, такого как РуВОР, в подходящем растворителе, например, таком как NМП или ДХМ, с получением при этом связанных со смолой соединений формулы (VII-1). Эти связанные со смолой амины формулы NHR6R3 могут быть подвергнуты сульфонилированию соединениями формулы (VII-1'), в которой X означает -SO2-, LG1 означает Cl, и Р означает защитную группу, такую как Fmoc или Pht, в обычных условиях, включающих использование основания, например, такого как ДИЭА, с получением при этом связанных со смолой соединений формулы (VII-1). Указанные последними промежуточные соединения могут быть подвергнуты удалению защитной группы в общепринятых условиях и затем алкилированию в соответствии с методиками, показанными на схеме 5 (способ З) с получением при этом соединений формулы (III-1). В заключение, эти соединения превращают в целевые замещенные производные метиленамидов формулы (Ia) согласно описанным выше методикам. При использовании в качестве лекарственных средств замещенные производные метиленамида согласно настоящему изобретению обычно вводят в виде фармацевтической композиции. Таким образом,фармацевтические композиции, включающие соединение формулы (I) и фармацевтически приемлемые носитель, разбавитель или наполнитель также входят в объем настоящего изобретения. Специалисту в данной области техники известно множество таких носителей, разбавителей или наполнителей, подходящих для приготовления фармацевтической композиции. Соединения согласно настоящему изобретению вместе с обычно используемыми вспомогательными веществами, носителями, разбавителями или наполнителями могут быть использованы для приготовления фармацевтической композиции и соответствующих дозированных форм и в таком виде могут применяться в виде твердых форм, таких как таблетки или наполненные капсулы, или в виде жидких форм, таких как растворы, суспензии, эмульсии, эликсиры или капсулы, заполненные этими жидкими формами, все эти формы предназначены для перорального введения или в виде стерильных растворов для инъекций для парентерального введения (включая подкожное введение). Такие фармацевтические композиции и полученные из них единичные дозированные формы могут включать ингредиенты в общепринятых соотношениях, с использованием или без использования дополнительных активных соединений или составных частей, и такие единичные дозированные формы могут содержать любое эффективное количество активного ингредиента, соответствующее предполагаемому интервалу используемых дневных дозировок. При использовании в качестве лекарственных средств замещенные производные метиленамида согласно настоящему изобретению обычно вводят в виде фармацевтической композиции. Такие композиции могут быть получены способами, хорошо известным в области фармацевтики, и включают по меньшей мере одно активное соединение. Как правило, соединения согласно настоящему изобретению вводят в фармацевтически эффективном количестве. Количество соединения, которое необходимо ввести,обычно определяется врачом с учетом таких существенных обстоятельств, как состояние, подлежащее лечению, выбранный способ введения, конкретное вводимое соединение, возраст, масса и реакции конкретного пациента, степень выраженности симптомов у пациента и тому подобного. Фармацевтические композиции согласно настоящему изобретению могут быть введены множест- 18012260 вом способов, включая пероральное, ректальное, трансдермальное, подкожное, внутривенное, внутримышечное и интраназальное введение. Композиции для перорального введения могут находиться в виде жидких растворов или суспензий, хранимых в контейнерах, или в виде нерасфасованного порошка. Однако чаще всего композиции представлены в виде единичных дозированных форм для того, чтобы облегчить точное дозирование. Термин "единичные дозированные формы" относится к физически дискретным единицам, используемым как однократная доза для пациентов-людей и других млекопитающих,каждая единичная форма содержит определенное количество активного соединения, рассчитанное таким образом, чтобы обеспечить необходимый терапевтический эффект, в сочетании с подходящим фармацевтическим наполнителем. Типичные единичные дозированные формы включают предварительно заполненные ампулы или шприцы предварительно установленного объема в случае жидкой композиции,или пилюли, таблетки, капсулы или подобное в случае твердых композиций. В таких композициях замещенное производное метиленамида согласно настоящему изобретению представляет обычно меньший по количеству компонент (от приблизительно 0,1 до приблизительно 50 мас.% или предпочтительно от приблизительно 1 до приблизительно 40 мас.%), а остальное составляют различные наполнители или носители и добавки, облегчающие переработку, необходимые для изготовления целевых дозированных форм. Жидкие формы, пригодные для перорального введения, могут включать подходящий водный или неводный носитель с добавкой буферов, суспендирующих и диспергирующих агентов, подкрашивающих веществ, веществ, улучшающих вкус и запах и подобных им веществ. Твердые формы могут включать,например, любой из следующих ингредиентов или соединений сходной природы: связующее, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, например, такой как крахмал или лактоза, средство, способствующее распаду лекарственной формы, такое как альгиновая кислота, примогель (Primogel) или кукурузный крахмал; смазывающее вещество, такое как стеарат магния, агент, облегчающий скольжение, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или агент, улучшающий вкус и запах, такой как мятное масло, метилсалицилат или апельсиновый ароматизатор. Основой композиций для инъекций обычно является стерильный физиологический раствор для инъекций, забуференный фосфатом физиологический раствор или другие пригодные для инъекций носители, известные из предшествующего уровня техники. Как указывалось выше, замещенные производные метиленамида формулы (I) в таких композициях являются меньшим по количеству компонентом, их количество обычно варьируется от 0,05 до 10 мас.%, а остальное составляет пригодный для инъекций носитель и тому подобное. Описанные выше компоненты для перорального введения или композиции для инъекций являются довольно типичными. Сведения о других материалах, а также методиках приготовления и тому подобном можно найти в Remington's Pharmaceutical Sciences, 17th Edition, Part 8, 1985, Marck Publishing Company, Easton, Pennsylvania, включено в настоящее описание в качестве ссылки. Соединения согласно настоящему изобретению также могут быть введены в виде форм с замедленным высвобождением или в виде систем доставки лекарственного средства с замедленным высвобождением. Описание наиболее типичных материалов для изготовления лекарственных форм с замедленным высвобождением можно найти в Remington's Pharmaceutical Sciences. Далее настоящее изобретение будет проиллюстрировано некоторыми примерами, которые не следует рассматривать как ограничивающие объем настоящего изобретения. Здесь и далее в приведенных примерах используются следующие сокращения: мин (минута), ч (час), г (грамм), мг (миллиграмм),ммоль (миллимоль), т. пл. (температура плавления), экв. (эвивалент), мл (миллилитр), мкл (микролитры),ХИАД (химическая ионизация при атмосферном давлении), ИЭС (ионизация электроспреем), л (литры),AcOEt (этилацетат), Boc (трет-бутоксикарбонил), CH3CN (ацетонитрил), ДБУ (диазабицикло[5,4,0]ундец 7-ен), ДЦК (дициклогексилкарбодиимид), ДХЭ (дихлорэтан), ДИЭА (диизопропилэтиламин), Fmoc (9 флуоренилметоксикарбонил), CDCl3 (дейтерированный хлороформ), с-Нех (циклогексан), ДХМ (дихлорметан), ДИПК (диизопропилкарбодиимид), ДМАП (4-диметиламинопиридин), ДМФ (диметилформамид), ДМСО (диметилсульфоксид), ДМСО-d6 (дейтерированный диметилсульфоксид), ЭДК (1-(3 диметиламинопропил)-3-этилкарбодиимид), EtOAc (этилацетат), Et2O (простой диэтиловый эфир), EtOH- 19012260 ЖХВР: колонка 50 мм 4,6 мм, симметричный C8, Waters; УФ-детектирование при 254 нм; скорость потока: 2 мл/мин; условия А: 8 мин, градиент от 0,1% ТФУ в Н 2 О до 0,07% ТФУ в CH3CN; условия Б: 10 мин, градиент от 0,1% ТФУ в Н 2 О до 0,07% ТФУ в CH3CN. Полупрепаративная обращено-фазовая ЖХВР проводится следующим образом: колонка Supelcosil ABZ+Plus (25 см 21,2 мм, 12 мкм); УФдетектирование при 54 и 220 нм; скорость потока 20 мл/мин; условия В: 10 мин, градиент от 30% CH3CN в 0,1% ТФУ в CH3CN до 100% CH3CN, с последующим элюированием в течение 5 мин 100%-нымZMD (ИЭС). Данные ЯМР-спектроскопии, приведенные в примерах, которые представлены ниже, получают следующим образом: 1 Н-ЯМР: Bruker DPX-300, МГц. Примеры Пример 1. (Бензил 4-[(додециламино)карбонил]бензиламино)(оксо)уксусная кислота. Стадия а). Получение вторичного амина формулы (III) в соответствии со способом И (см. схему 5),например бензилового эфира 4-(бензиламинометил)бензойной кислоты. К раствору бензилового эфира 4-формилбензойной кислоты (5,00 г, 20,81 ммоль) (соединение описано в Bioorg. Med.Chem.; 5; 9; 1873-82 (1997 и бензиламина (2,453 г, 22,89 ммоль) в ДХЭ (150 мл) добавляют в один прием NaBH(OAc)3 (6,175 г, 29,14 ммоль), и перемешивают полученную смесь в течение ночи при комнатной температуре. Добавляют к реакционной смеси 30 мл насыщенного водного раствораNaHCO3, водный слой отделяют и экстрагируют, используя ДХМ (3200 мл). Объединенные органические слои высушивают над MgSO4, отфильтровывают и концентрируют, получая при этом маслянистое желтоватое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (AcOEt/c-Hex в соотношении от 4/1 до 1/1 в течение приблизительно 1 ч), получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (4,780 г, 69%). 1 Н ЯМР (CDCl3, 300 МГц)7,95 (m, 2 Н), 7,37-7,16 (m, 12 Н), 5,27 (s, 2H), 3,77 (s, 2H), 3,70 (s, 2H).+ М (ИЭС): 332,2. ЖХВР (условия Б), время удерживания: 4,26 мин (чистота по данным ЖХВР: 98,5%). Стадия б). Получение сложного эфира оксаминовой кислоты формулы (II-1) в соответствии со способом А (см. схему 1), например бензилового эфира 4-[(бензилэтоксиоксалиламино)метил]бензойной кислоты. К раствору бензилового эфира 4-(бензиламинометил)бензойной кислоты (4,50 г, 13,58 ммоль) и ТЭА (2,748 г, 27,16 ммоль) в безводном ТГФ (100 мл) при 0 С в инертной атмосфере добавляют по каплям раствор этилового эфира хлор(оксо)уксусной кислоты (2,781 г, 20,37 ммоль) в ТГФ (10 мл). Реакционную смесь перемешивают при 0 С в течение 2 ч. Растворитель упаривают и добавляют 100 мл ДХМ. Добавляют 20 мл насыщенного водного раствора NaHCO3, затем отделяют водный слой и экстрагируют,используя ДХМ (350 мл). Объединенные органические слои высушивают над MgSO4, отфильтровывают и концентрируют, получая при этом маслянистое желтоватое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (AcOEt/c-Hex в соотношении от 4/1 до 2/1 в течение приблизительно 1 ч), получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (5,810 г, 99%). 1 Н ЯМР (CDCl3, 300 МГц)7,95 (m, 2 Н), 7,37-7,11 (m, 12 Н), 5,30 (s, 2 Н), 4,44 (m, 2 Н), 4,31-4,22 (m,4 Н), 1,22 (t, J=7,5 Гц, 3 Н). М+(ХИАД): 432,0. ЖХВР (условия Б), время удерживания: 7,2 мин (чистота по данным ЖХВР: 99,4%). Стадия в). Получение сложного эфира оксаминовой кислоты формулы (II-1), например 4[(бензилэтоксиоксалиламино)метил]бензойной кислоты. Через суспензию 10% Pd/C (300 мг) в EtOH (50 мл) медленно барботируют Н 2 (1 атм.) в течение 15 мин при комнатной температуре. К этой суспензии затем добавляют раствор бензилового эфира 4[(бензилэтоксиоксалиламино)метил]бензойной кислоты (5,500 г, 12,75 ммоль) в 15 мл EtOH. Полученную реакционную смесь перемешивают в атмосфере H2 (1 атм.) в течение 5 ч при комнатной температуре. Реакционную смесь отфильтровывают через слой целита для того, чтобы удалить катализатор. Растворитель упаривают, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества, которое используют на последующей стадии без дополнительной очистки (4,217 г, 97%). 1 Н ЯМР (CDCl3, 300 МГц)8,07 (m, 2 Н), 7,37-7,11 (m, 7 Н), 4,51 (m, 2 Н), 4,39-4,30 (m, 4 Н), 1,27 (m,3 Н). M-(ХИАД): 340,0; М+(ХИАД): 342,0. ЖХВР (условия А), время удерживания: 4,31 мин (чистота по данным ЖХВР: 99,1%). Стадия г). Получение сложного эфира оксаминовой кислоты формулы (I-1) в соответствии со способом А (см. схему 1), например этилового эфира (бензил 4-[(додециламино)карбонил]бензиламино)(оксо)уксусной кислоты, с использованием гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида. К раствору 4-[(бензилэтоксиоксалиламино)метил]бензойной кислоты (1500 мг, 4,39 ммоль) в безводном ТГФ (15 мл) при комнатной температуре в инертной атмосфере добавляют ЭДК (1,261 г, 6,58 ммоль) и додециламин (1,018 г, 5,49 ммоль). Полученную смесь перемешивают в течение ночи при комнатной температуре. Растворитель упаривают, затем полученный остаток растворяют в ДХМ (30 мл) и- 20012260 промывают 1 Н водным раствором HCl (2 мл). Объединенные органические слои высушивают надMgSO4, отфильтровывают и концентрируют, получая при этом бесцветное маслянистое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (AcOEt/с-Нех в соотношении от 3/1 до 1/1 в течение приблизительно 15 мин), получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (500 мг, 22%). 1 Н ЯМР (CDCl3, 300 МГц)7,75 (m, 2H), 7,37-7,26 (m, 7 Н), 6,09 (br s, 1H), 4,5 (m, 2 Н), 4,36-4,30 (m,4 Н), 3,45 (m, 2 Н), 1,62 (m, 3 Н), 1,36-1,27 (m, 20 Н), 0,88 (m, 3 Н). M-(ИЭС): 507,2. ЖХВР (условия А), время удерживания: 6,98 мин (чистота по данным ЖХВР: 99,9%). Стадия д). Получение оксаминовой кислоты формулы (I), например (бензил 4-[(додециламино) карбонил]бензиламино)(оксо)уксусной кислоты. К раствору этилового эфира (бензил 4-[(додециламино)карбонил]бензиламино)(оксо)уксусной кислоты (690 мг, 1,36 ммоль) в EtOH (4 мл) добавляют 1 Н водный раствор NaOH (1,36 мл, 1,36 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Растворители упаривают, остаток растворяют в EtOAc (20 мл) и промывают 1 Н водным раствором HCl (5 мл). Водный слой отделяют и промывают, используя EtOAc (210 мл). Объединенные органические слои высушивают над MgSO4, отфильтровывают и концентрируют, получая при этом указанное в заголовке соединение в виде белого твердого вещества (603 мг, 93%). 1 Н ЯМР (CD3OD, 300 МГц)7,80 (m, 2 Н), 7,45-7,28 (m, 6 Н), 7,22 (m, 1 Н), 4,54 (s, 2H), 4,50 (s, 2H),3,38 (t, 2 Н, J=6,5 Гц), 1,64 (m, 2 Н), 1,38-1,21 (m, 18 Н), 0,88 (t, 3 Н, J=6,6 Гц). М-(ИЭС): 479,2 ЖХВР (условия А), время удерживания: 6,01 мин (чистота по данным ЖХВР: 98,6%). Элементный анализ, вычислено для C29H40N2O4: С, 72,47; Н, 8,39; N, 5,83%. Найдено: С, 72,30; Н, 8,36; N, 5,79%. Пример 2. (Бензил 4-[(додециламино)карбонил]бензиламино)(оксо)уксусная кислота, соль с трометамином (т.е. с 2-амино-2-гидроксиметил-1,3-пропандиолом). Смесь (бензил 4-[(додециламино)карбонил]бензиламино)(оксо)уксусной кислоты (1,842 г, 3,83 ммоль), трис(гидроксиметил)аминометана (0,464 г, 3,83 ммоль) и EtOH (38 мл) нагревают до тех пор,пока не образуется гомогенный раствор. Растворитель удаляют в вакууме, остаток растворяют в смесиH2O/EtOH в соотношении 9/1. Полученный раствор лиофилизуют, получая при этом указанное в заголовке соединение в виде пушистого белого порошка (2,299 г, 99%).(чистота по данным ЖХВР: 98,6%). Элементный анализ, вычислено для C29H40N2O4C4H11NO3: С, 65,86; Н, 8,54; N, 6,98%. Найдено: С, 65,10; Н, 8,78; N, 6,90%. Пример 3. (Бензил(4-[(додециламино)карбонил]бензиламино)(оксо)уксусная кислота, соль с Nметил-D-глюкамином (т.е. 1-деокси-1-(метиламино)глюцитолом). Применяют ту же самую методику, что и в примере 2, но используют N-метил-D-глюкамин и получают при этом указанное в заголовке соединение в виде белого твердого вещества (89%).C29H40N2O4C7H17NO51,2H2O: С, 61,99; Н, 8,24; N, 6,02%. Найдено: С, 61,84; Н, 8,60; N, 5,99%. Пример 4. Оксо 4-[(пентадециламино)карбонил]бензил-[4-(трифторметил)бензил]аминоуксусная кислота. Стадия а). Получение бензилового эфира 4-([4-(трифторметил)бензил]аминометил)бензойной кислоты. Применяют ту же самую методику, что и в примере 1 (стадия а), но используют 4-трифторметилбензиламин и получают при этом указанное в заголовке соединение в виде желтого маслянистого вещества (74%). М+(ЖХ/МС (ИЭС: 400,3. ЖХВР (условия А), время удерживания: 3,76 мин (чистота по данным ЖХВР: 97,6%). Стадия б). Получение бензилового эфира 4-([этокси(оксо)ацетил][4-(трифторметил)бензил]аминометил)бензойной кислоты. Применяют ту же самую методику, что и в примере 1 (стадия б), но используют бензиловый эфир 4([4-(трифторметил)бензил]аминометил)бензойной кислоты и получают при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (95%). 1 Н ЯМР (CDCl3, 300 МГц)7,95 (t, 2 Н, J=8,3 Гц), 7,48 (m, 2 Н), 7,37-7,13 (m, 9 Н), 5,25 (br s, 2H), 4,41(br s, 2 Н), 4,27-4,18 (m, 4 Н), 1,20 (t, 3H, J=7,0 Гц). М-(ЖХ/МС (ИЭС: 498,1; М+(ЖХ/МС (ИЭС: 500,3. ЖХВР (условия А), время удерживания: 6,14 мин (чистота по данным ЖХВР: 98,9%). Стадия в). Получение 4-([этокси(оксо)ацетил][4-(трифторметил)бензил]аминометил)бензойной кислоты. Применяют ту же самую методику, что и в примере 1 (стадия в), но используют бензиловый эфир 4([этокси(оксо)ацетил][4-(трифторметил)бензил]аминометил)бензойной кислоты и получают при этом указанное в заголовке соединение в виде бесцветного вспененного вещества (84%). М-(ЖХ/МС (ИЭС: 408,2; М+(ЖХ/МС (ИЭС: 410,1. ЖХВР (условия А), время удерживания: 4,43- 21012260 мин (чистота по данным ЖХВР: 98,9%). Стадия г). Получение этилового эфира оксо 4-[(пентадециламино)карбонил]бензил[4(трифторметил)бензил]аминоуксусной кислоты. Применяют ту же самую методику, что и в примере 1 (стадия г), но используют 4([этокси(оксо)ацетил][4-(трифторметил)бензил]аминометил)бензойную кислоту и получают при этом указанное в заголовке соединение в виде белого твердого вещества (78%).M-(ИЭС): 617,2. ЖХВР (условия А), время удерживания: 7,54 мин (чистота по данным ЖХВР: 97,7%). Стадия д). Получение оксо 4-[(пентадециламино)карбонил]бензил[4-(трифторметил)бензил]аминоуксусной кислоты. Применяют ту же самую методику, что и в примере 1 (стадия д), но используют этиловый эфир оксо 4-[(пентадециламино)карбонил]бензил[4-(трифторметил)бензил]аминоуксусной кислоты и получают при этом указанное в заголовке соединение в виде бесцветного вспененного вещества (84%). 1H ЯМР (CD3OD, 300 МГц)7,77 (m, 2H), 7,58 (m, 3 Н), 7,44 (d, 1H, J=8,3 Гц), 7,38 (d, 1H, J=8,3 Гц),7,30 (d, 1 Н, J=8,3 Гц), 4,56-4,50 (m, 4 Н), 3,37 (t, 2 Н, J=7,2 Гц), 1,64 (m, 2 Н), 1,30 (m, 24 Н), 0,91 (t, 3 Н, J=6,6 Гц). M-(ЖХ/МС (ИЭС: 589,1; М+(ЖХ/МС (ИЭС: 591,1. ЖХВР (условия А), время удерживания: 7,25 мин (чистота по данным ЖХВР: 98,1%). Пример 5. (Бензил 4-[(пентадециламино)карбонил]бензиламино)(оксо)уксусная кислота. Стадия а). Получение вторичного амина формулы (III) в соответствии со способом И (см. схему 5),например бензилового эфира 4-(бензиламинометил)бензойной кислоты. К раствору бензилового эфира 4-формилбензойной кислоты (5,00 г, 20,81 ммоль) и бензиламина(2,453 г, 22,89 ммоль) в ДХЭ (150 мл) добавляют в один прием NaBH(OAc)3 (6,175 г, 29,14 ммоль) и перемешивают полученную смесь в течение ночи при комнатной температуре. К реакционной смеси добавляют 30 мл насыщенного водного раствора NaHCO3, водный слой отделяют и промывают, используя ДХМ (3200 мл). Объединенные органические слои высушивают над MgSO4, отфильтровывают и концентрируют, получая при этом маслянистое желтоватое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (AcOEt/c-Hex в соотношении от 4/1 до 1/1 в течение приблизительно 1 ч), получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (4,780 г, 69%). 1 Н ЯМР (CDCl3, 300 МГц)7,95 (m, 2 Н), 7,37-7,16 (m, 12 Н), 5,27 (s, 2H), 3,77 (s, 2H), 3,70 (s, 2H).+ М (ИЭС): 332,2. ЖХВР (условия Б), время удерживания: 4,26 мин (чистота по данным ЖХВР: 98,5%). Стадия б). Получение сложного эфира оксаминовой кислоты формулы (II-1) в соответствии со способом А (см. схему 1), например бензилового эфира 4-[(бензилэтоксиоксалиламино)метил]бензойной кислоты. К раствору бензилового эфира 4-(бензиламинометил)бензойной кислоты (4,50 г, 13,58 ммоль) и ТЭА (2,748 г, 27,16 ммоль) в безводном ТГФ (100 мл) при 0 С в инертной атмосфере добавляют по каплям этиловый эфир хлороксоуксусной кислоты (2,781 г, 20,37 ммоль). Реакционную смесь перемешивают при 0 С в течение 2 ч. Большую часть растворителя упаривают и затем добавляют 100 мл ДХМ. Добавляют к реакционной смеси 20 мл насыщенного водного раствора NaHCO3, водный слой отделяют и экстрагируют, используя ДХМ (350 мл). Объединенные органические слои высушивают над MgSO4,отфильтровывают и концентрируют, получая при этом маслянистое желтоватое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (AcOEt/c-Hex в соотношении от 4/1 до 2/1 в течение приблизительно 1 ч), получая при этом бензиловый эфир 4-[(бензилэтоксиоксалиламино)метил]бензойной кислоты в виде бесцветного маслянистого вещества (5,810 г,99%). 1 Н ЯМР (CDCl3, 300 МГц)7,95 (m, 2H), 7,37-7,11 (m, 12 Н), 5,30 (s, 2 Н), 4,44 (m, 2 Н), 4,31-4,22 (m,4 Н), 1,22 (m, 3 Н). М+(ХИАД): 432,0. ЖХВР (условия Б), время удерживания: 7,2 мин (чистота по данным ЖХВР: 99,4). Стадия в). Получение сложного эфира оксаминовой кислоты формулы (II-1), например 4[(бензилэтоксиоксалиламино)метил]бензойной кислоты. Через суспензию 10% Pd/C (300 мг) в EtOH (50 мл) медленно барботируют при комнатной температуре Н 2 (1 атм.) в течение 15 мин при комнатной температуре. К этой суспензии затем добавляют раствор бензилового эфира 4-[(бензилэтоксиоксалиламино)метил]бензойной кислоты (5,500 г, 12,75 ммоль), растворенного в 15 мл EtOH. Полученную реакционную смесь перемешивают при 1 атм. Н 2 в течение 5 ч при комнатной температуре. Полученную реакционную смесь отфильтровывают через слой целита для того, чтобы удалить катализатор. Упаривают EtOH, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества, которое используют на последующей стадии без дополнительной очистки (4,217 г, 97%). 1 Н ЯМР (CDCl3, 300 МГц)8,07 (m, 2 Н), 7,37-7,11 (m, 7 Н), 4,51 (m, 2 Н), 4,39-4,30 (m, 4 Н), 1,27 (m,3 Н). M-(ХИАД): 340,0; М+(ХИАД): 342,0. ЖХВР (условия А), время удерживания: 4,31 мин (чистота по данным ЖХВР: 99,1%).- 22012260 Стадия г). Получение сложного эфира оксаминовой кислоты формулы (I-1) в соответствии со способом А (см. схему 1), например этилового эфира (бензил 4-[(пентадециламино)карбонил]бензиламино)(оксо)уксусной кислоты, с использованием циклогексилкарбодиимида на носителе. К раствору 4-[(бензилэтоксиоксалиламино)метил]бензойной кислоты (102 мг, 0,3 ммоль) и пентадециламина (39,9 мг, 0,2 ммоль) в ДХМ (2 мл) добавляют в один прием N-циклогексилкарбодиимид, Nметилполистирол HL (Novabiochem, 355 мг, 0,6 ммоль, загрузка: 1,69 ммоль/г) и полученную реакционную смесь перемешивают в течение ночи при комнатной температуре. Отфильтровывают смолу и растворители упаривают в вакууме, получая при этом бесцветное маслянистое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (EtOAc), получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (39 мг, 35%). 1 Н ЯМР (CDCl3, 300 МГц)7,75 (m, 2 Н), 7,37-7,26 (m, 7 Н), 6,13 (br s, 1H), 4,5 (m, 2 Н), 4,36-4,30 (m,4 Н), 3,45 (m, 2 Н), 1,62 (m, 2 Н), 1,36-1,27 (m, 26 Н), 0,88 (t, J= 8,0 Гц, 3 Н). M-(ХИАД): 549,1; М+(ХИАД): 551,4. ЖХВР (условия А), время удерживания: 7,46 мин (чистота по данным ЖХВР: 98,2%). Стадия д). Получение оксаминовой кислоты формулы (I-1), например (бензил 4[(пентадециламино)карбонил]бензиламино)(оксо)уксусной кислоты. К раствору этилового эфира (бензил 4-[(пентадециламино)карбонил]бензиламино)(оксо)уксусной кислоты (28,0 мг, 0,051 ммоль) в EtOH (1 мл) добавляют NaOH (14,9 мг, 0,37 ммоль), растворенный в Н 2 О (0,37 мл) и перемешивают полученную реакционную смесь при комнатной температуре в течение 2 ч. Растворители упаривают, затем к остатку добавляют EtOAc (5 мл) и 1 Н водный раствор HCl (1 мл). Водный слой отделяют и экстрагируют, используя EtOAc (25 мл). Объединенные органические слои высушивают над MgSO4, отфильтровывают и концентрируют, получая при этом белое твердое вещество(t, 2 Н, J=7,0 Гц), 1,54 (m, 2 Н), 1,26 (m, 24 Н), 0,90 (t, J=7,5 Гц, 3 Н). M-(ХИАД): 521,6. ЖХВР (условия А),время удерживания: 6,96 мин (чистота по данным ЖХВР: 98,4%). Пример 6. (Бензил 4-[(тридециламино)карбонил]бензиламино)(оксо)уксусная кислота. Стадия а). Получение этилового эфира (бензил 4-[(тридециламино)карбонил]бензиламино)(оксо) уксусной кислоты. Применяют ту же самую методику, что и в примере 5, стадия г), но используют тридециламин, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (40%).M-(ХИАД): 523,2; М+(ХИАД): 521,2. ЖХВР (условия А), время удерживания: 7,06 мин (чистота по данным ЖХВР: 99,2%). Стадия б). Получение (бензил 4-[(тридециламино)карбонил]бензиламино)(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 5, стадия д), но используют этиловый эфир(бензил 4-[(тридециламино)карбонил]бензиламино)(оксо)уксусной кислоты, получая при этом указанное в заголовке соединение в виде белого твердого вещества (94%). 1 Н ЯМР (CD3OD, 300 МГц)7,73 (m, 2 Н), 7,40 (m, 1H), 7,29-7,16 (m, 6 Н), 4,45-4,36 (m, 4 Н), 3,34 (t,2H, J=7,2 Гц), 1,57 (m, 2 Н), 1,30-1,23 (m, 20 Н), 0,84 (t, 3 Н, J=6,6 Гц). M-(ХИАД): 493,2. ЖХВР (условия А), время удерживания: 6,47 мин (чистота по данным ЖХВР: 99,6%). Пример 7. [Бензил(4-[додецил(метил)амино]карбонилбензил)амино](оксо)уксусная кислота. Стадия а). Получение этилового эфира (бензил 4-[(тридециламино)карбонил]бензиламино)(оксо) уксусной кислоты. Применяют ту же самую методику, что и в примере 5, стадия г), но используют додецилметиламин,получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (54%). ЖХВР (условия А), время удерживания: 7,13 мин (чистота по данным ЖХВР: 92,5%). Стадия б). Получение [бензил(4-додецил(метил)аминокарбонилбензил)амино](оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 5, стадия д), но используют этиловый эфир(бензил 4-[(тридециламино)карбонил]бензиламино)(оксо)уксусной кислоты, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (86%). 1 Н ЯМР (CD3OD, 300 МГц)7,46 (m, 1 Н), 7,38-7,24 (m, 8 Н), 4,51-4,43 (m, 4 Н), 3,54 (m, 1 Н), 3,30 (m,1 Н), 3,07 (s, 1,5 Н), 2,95 (d, 1,5 Н, J=4,1 Гц), 1,69-1,58 (2m, 2 Н), 1,40-1,18 (m, 18 Н), 0,89 (m, 3 Н). M-(ЖХ/МС(ИЭС: 493,5; М+(ЖХ/МС (ИЭС: 495,8. ЖХВР (условия А), время удерживания: 6,47 мин (чистота по данным ЖХВР: 99,9%). Пример 8. (4-[Додецил(метил)амино]карбонилбензил)-[4-(трифторметил)бензил]амино(оксо) уксусная кислота. Стадия а). Получение этилового эфира (4-[додецил(метил)амино]карбонилбензил)[4(трифторметил)бензил]амино(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 5, стадия г), но используют 4([этокси(оксо)ацетил][4-(трифторметил)бензил]аминометил)бензойную кислоту и додецилметиламин,- 23012260 получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (56%). ЖХВР (условия А), время удерживания: 7,41 мин (чистота по данным ЖХВР: 82%). Стадия б). Получение (4-[додецил(метил)амино]карбонилбензил)-[4-(трифторметил)бензил] амино(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 5, стадия д), но используют этиловый эфир (4[додецил(метил)амино]карбонилбензил)[4-(трифторметил)бензил]амино(оксо)уксусной кислоты, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (68%). 1 Н ЯМР (CD3OD, 300 МГц)7,7-7,52 (m, 3H), 7,50-7,30 (m, 5 Н), 4,62-4,5 (m, 3,5 Н), 3,85 (m, 0,5 Н),3,54 (m, 1 Н), 3,30 (m, 1H), 3,07 (s, 1,5H), 2,95 (m, 1,5 Н), 1,72-1,52 (2m, 2 Н), 1,50-1,10 (m, 18 Н), 0,95 (m,3 Н). M-(ЖХ/МС (ИЭС: 562,1; М+(ЖХ/МС (ИЭС: 563,8. ЖХВР (условия А), время удерживания: 6,81 мин (чистота по данным ЖХВР: 90,5%). Пример 9. ([1-(трет-Бутоксикарбонил)-4-пиперидинил]4-[(додециламино)карбонил]бензиламино)(оксо)уксусная кислота. Стадия а). Получение трет-бутилового эфира 4-(4-[(бензилокси)карбонил]бензиламино)пиперидин-1-карбоновой кислоты. Применяют ту же самую методику, что и в примере 5, стадия а), но используют 1-Boc-4-аминопиперидин, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (83%). М+(ЖХ/МС (ИЭС: 425,5. ЖХВР (условия А), время удерживания: 3,52 мин (чистота по данным ЖХВР: 97,8%). Стадия б). Получение трет-бутилового эфира 4-4-[(бензилокси)карбонил]бензил[этокси(оксо) ацетил]аминопиперидин-1-карбоновой кислоты. Применяют ту же самую методику, что и в примере 5, стадия б), но в качестве исходного соединения используют трет-бутиловый эфир 4-(4-[(бензилокси)карбонил]бензиламино)пиперидин-1 карбоновой кислоты, получая при этом указанное в заголовке соединение в виде желтого вспененного вещества (99%).M-(ХИАД): 523,4. ЖХВР (условия А), время удерживания: 5,7 мин (чистота по данным ЖХВР: 98,4%). Стадия в). Получение 4-([1-(трет-бутоксикарбонил)пиперидин-4-ил][этокси(оксо)ацетил]амино метил)бензойной кислоты. Применяют ту же самую методику, что и в примере 5, стадия в), но в качестве исходного соединения используют трет-бутиловый эфир 4-4-[(бензилокси)карбонил]бензил[этокси(оксо)ацетил]амино пиперидин-1-карбоновой кислоты, получая при этом указанное в заголовке соединение в виде белого вспененного вещества (99%). ЖХВР (условия А), время удерживания: 4,1 мин (чистота по данным ЖХВР: 95,7%). Стадия г). Получение трет-бутилового эфира 4-4-[(додециламино)карбонил]бензил[этокси(оксо) ацетил]аминопиперидин-1-карбоновой кислоты. Применяют ту же самую методику, что и в примере 5, стадия г), но в качестве исходного соединения используют 4-([1-(трет-бутоксикарбонил)пиперидин-4-ил][этокси(оксо)ацетил]аминометил)бензойную кислоту, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (25%).M-(ЖХ/МС (ИЭС: 600,8; +(ЖХ/МС (ИЭС: 602,5. ЖХВР (условия А), время удерживания: 6,75 мин (чистота по данным ЖХВР: 99,1%). Стадия д). Получение ([1-(трет-бутоксикарбонил)-4-пиперидинил]4-[(додециламино)карбонил] бензиламино)(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 5, стадия д), но в качестве исходного соединения используют трет-бутиловый эфир 4-4-[(додециламино)карбонил]бензил[этокси(оксо)ацетил] аминопиперидин-1-карбоновой кислоты, получая при этом указанное в заголовке соединение в виде желтого маслянистого вещества (55%). 1 Н ЯМР (CD3OD, 300 МГц)7,79 (m, 2H), 7,47 (d, 0,5H, J=8,3 Гц), 7,24 (d, 1,5H, J=8,3 Гц), 4,64 (m,2H), 4,08 (m, 2 Н), 3,90 (m, 1 Н), 3,40 (t, 2 Н, J=7,2 Гц), 2,73 (m, 2 Н), 1,64 (m, 1 Н), 1,50 (m, 5 Н), 1,35-1,13 (m,28 Н), 0,91 (t, J=7,9 Гц, 3 Н). M-(ЖХ/МС (ИЭС: 572,8; М+(ЖХ/МС (ИЭС: 574,5 ЖХВР (условия А), время удерживания: 6,18 мин (чистота по данным ЖХВР: 99,2%). Пример 10. 4-[(Додециламино)карбонил]бензил[4-(трифторметил)бензил]амино(оксо)уксусная кислота. Стадия а). Получение амида формулы (IX), в которой Q означает -CONR3R3', например N-додецил 4-формилбензамида, с использованием изобутилхлорформиата. К раствору 4-формилбензойной кислоты (22,5 г, 149,9 ммоль) и 4-метилморфолина (18,2 г, 180,0 ммоль) в безводном ТГФ (200 мл) при -15 С добавляют в инертной атмосфере по каплям изобутилхлорформиат (22,5 г, 165,0 ммоль). Через 15 мин добавляют в один прием додециламин (30,56 г, 164,9 ммоль) и полученную смесь перемешивают в течение 3 ч при комнатной температуре. Растворитель упаривают в- 24012260 вакууме, затем полученный остаток растворяют в ДХМ (200 мл) и промывают 0,1 Н водным растворомHCl (330), насыщенным раствором соли (130 мл). Объединенные органические слои высушивают надMgSO4, отфильтровывают и концентрируют с получением при этом белого порошка (45 г). Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (EtOAc/c-Нех в соотношении от 4/1 до 1/1 в течение приблизительно 1 ч), получая при этом указанное в заголовке соединение в виде белого пушистого твердого вещества (38 г, 80%). 1 Н ЯМР (CDCl3, 300 МГц)10,06 (s, 1 Н), 7,76 (m, 4 Н), 6,18 (m, 1 Н), 3,44 (q, 2H, J=13 Гц, J=7,2 Гц),1,61 (m, 2 Н), от 1,4 до 1,2 (m, 18H), 0,86 (t, 3 Н, J=7,0 Гц). M-(ЖХ/МС (ИЭС: 316,3; М+(ЖХ/МС (ИЭС: 318,3. ЖХВР (условия А), время удерживания: 5,9 мин (чистота по данным ЖХВР: 98,7%). Стадия б). Получение вторичного амина формулы (III) в соответствии со способом И (см. схему 5),например N-додецил-4-[(4-трифторметилбензиламино)метил]бензамида. К раствору N-додецил-4-формилбензамида (3 г, 9,45 ммоль) и 4-трифторметилбензиламина (1,82 г,10,4 ммоль) в ДХЭ (25 мл) добавляют в один прием NaBH(OAc)3 (2,80 г, 13,23 ммоль) и перемешивают полученную смесь в течение ночи при комнатной температуре. К реакционной смеси добавляют 5 мл насыщенного водного раствора NaHCO3, водный слой отделяют и промывают, используя ДХМ (320 мл). Объединенные органические слои высушивают над MgSO4, отфильтровывают и концентрируют,получая при этом маслянистое желтоватое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (EtOAc/c-Нех в соотношении от 15/85 до 75/25 в течение приблизительно 1 ч), получая при этом указанное в заголовке соединение в виде белого твердого вещества(2,66 г, 59%). 1 Н ЯМР (CDCl3, 300 МГц)7,76 (d, 2H, J=8,3 Гц), 7,61 (d, 2H, 8,1 Гц), 7,49 (d, 2H, J=8,1 Гц), 7,40 (d,2H, J=8.2 Гц), 6,12 (br s, 1H), 3,86 (s, 4H), 3,43 (q, 2H, J=13,0 Гц, J=7,0 Гц), 1,63 (m, 2H), 1,6 до 1,2 (br s,18H), 0,86 (t, 3 Н, J=7,0 Гц). М-(ЖХ/МС (ИЭС: 475,32; М+(ЖХ/МС (ИЭС: 477,4. ЖХВР (условия А),время удерживания: 4,97 мин (чистота по данным ЖХВР: 95,1%). Стадия в). Получение сложного эфира оксаминовой кислоты формулы (II-1) в соответствии со способом А (см. схему 1), например этилового эфира 4-[(додециламино)карбонил]бензил[4(трифторметил)бензил]амино(оксо)уксусной кислоты. К раствору N-додецил-4-[(4-трифторметилбензиламино)метил]бензамида (2,60 г, 5,46 ммоль) и ТЭА (1,104 г, 10,91 ммоль) в безводном ТГФ (20 мл) при 0 С в инертной атмосфере добавляют по каплям этиловый эфир хлороксоуксусной кислоты (1,117 г, 8,18 ммоль). Реакционную смесь перемешивают при 0 С в течение 1,25 ч. Растворители упаривают и добавляют 50 мл ДХМ. К реакционной смеси добавляют 20 мл Н 2 О, водный слой отделяют и экстрагируют, используя ДХМ (350 мл). Объединенные органические слои высушивают над MgSO4, отфильтровывают и концентрируют. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (AcOEt/c-Hex в соотношении от 1/3 до 1/2 в течение приблизительно 1 ч), получая при этом указанное в заголовке соединение в виде желтого твердого вещества (2,770 г, 88%). 1 Н ЯМР (CDCl3, 300 МГц)7,73 (m, 2 Н), 7,60 (m, 2 Н), 7,37-7,23 (m, 4 Н), 6,09 (br s, 1 Н), 4,5 (s, 2 Н),4,37-4,32 (m, 4 Н), 3,43 (m, 2 Н), 1,60 (m, 2 Н), 1,36-1,20 (m, 21 Н), 0,86 (m, 3 Н). M-(ЖХ/МС (ИЭС: 575,5; М+(ЖХ/МС (ИЭС: 577,4. ЖХВР (условия А), время удерживания: 6,84 мин (чистота по данным ЖХВР: 99,2%). Стадия г). Получение оксаминовой кислоты формулы (I), например 4-[(додециламино)карбонил] бензил[4-(трифторметил)бензил]амино(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 1, стадия д), но в качестве исходного соединения используют этиловый эфир 4-[(додециламино)карбонил]бензил[4-(трифторметил)бензил]амино(оксо)уксусной кислоты, получая при этом указанное в заголовке соединение в виде белого порошкаN, 5,11%. Найдено: С, 65,65; Н, 7,18; N, 5,08%. Пример 11. 4-[(Додециламино)карбонил]бензил[4-(трифторметил)бензил]амино(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. 1-деокси-1-(метиламино)глюцитолом). Применяют ту же самую методику, что и в примере 2, но используют N-метил-D-глюкамин и 4[(додециламино)карбонил]бензил[4-(трифторметил)бензил]амино(оксо)уксусную кислоту, получая при этом указанное в заголовке соединение в виде белого порошка (81%).- 25012260 Стадия а). Получение N-додецил-4-([3-(трифторметил)бензил]аминометил)бензамида. Применяют ту же самую методику, что и в примере 10, стадия б), но в качестве исходного соединения используют 3-трифторметилбензиламин, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (55%). 1(m, 3H), 7,41 (d, 2H, J=8,1 Гц), 3,75 (s, 2H), 3,72 (s, 2 Н), 3,38-3,28 (m, 2 Н), 1,50 (m, 2 Н), 1,23 (br s, 18H),0,84 (t, 3H, J=8,0 Гц). М+(ЖХ/МС (ИЭС: 477,5. ЖХВР (условия А), время удерживания: 4,90 мин (чистота по данным ЖХВР: 95,3%). Стадия б). Получение этилового эфира 4-[(додециламино)карбонил]бензил[3(трифторметил)бензил]амино(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 10, стадия в), но в качестве исходного соединения используют N-додецил-4-([3-(трифторметил)бензил]аминометил)бензамид, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (97%). М+(ЖХ/МС (ИЭС: 577,6. ЖХВР (условия А), время удерживания: 6,98 мин (чистота по данным ЖХВР: 97,4%). Стадия в). Получение 4-[(додециламино)карбонил]бензил[3-(трифторметил)бензил]амино(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 10, стадия г), но в качестве исходного соединения используют этиловый эфир 4-[(додециламино)карбонил]бензил[3-(трифторметил)бензил]амино(оксо)уксусной кислоты, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (82%). 1 Н ЯМР (ДМСО-d6, 300 МГц)7,85-7,55 (m, 6 Н), 7,35 (d, 1H, J=8,2 Гц), 7,23 (d, 1H, J=8,2 Гц), 4,55(t, J=6,7 Гц, 3 Н). M-(ЖХ/МС (ИЭС: 547,4; М+(ЖХ/МС (ИЭС: 549,4. ЖХВР (условия А), время удерживания: 6,69 мин (чистота по данным ЖХВР: 97,9%). Пример 13. 4-[(Додециламино)карбонил]бензил[3-(трифторметил)бензил]амино(оксо)уксусная кислота, соль с N-метил-D-глюкамином (т.е. 1-деокси-1-(метиламино)глюцитолом). Применяют ту же самую методику, что и в примере 2, но используют N-метил-D-глюкамин и 4[(додециламино)карбонил]бензил[3-(трифторметил)бензил]амино(оксо)уксусную кислоту, получая при этом указанное в заголовке соединение в виде белого пушистого порошка (82%). М-(ЖХ/МС (ИЭС: 547,4; М+(ЖХ/МС (ИЭС: 549,4. ЖХВР (условия А), время удерживания: 6,69 мин (чистота по данным ЖХВР: 99,1%). Элементный анализ, вычислено для C30H39F3N2O4C7H17NO5: С 59,74; Н 7,59; N 5,65%. Найдено: С 59,13; Н 7,90; N 5,57%. Пример 14. ([1-(трет-Бутоксикарбонил)-4-пиперидинил]метил 4-[(додециламино)карбонил]бензиламино)(оксо)уксусная кислота. Стадия а). Получение трет-бутилового эфира 4-[(4-[(додециламино)карбонил]бензиламино)метил]пиперидин-1-карбоновой кислоты. Применяют ту же самую методику, что и в примере 10, стадия б), но в качестве исходного соединения используют 4-(аминометил)-1-N-Вос-пиперидин, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (31%).M-(ИЭС): 514,2. ЖХВР (условия Б), время удерживания: 6,2 мин (чистота по данным ЖХВР: 96,2%). Стадия б). Получение трет-бутилового эфира 4-(4-[(додециламино)карбонил]бензил[этокси(оксо)ацетил]аминометил)пиперидин-1-карбоновой кислоты. Применяют ту же самую методику, что и в примере 10, стадия в), но в качестве исходного соединения используют трет-бутиловый эфир 4-[(4-[(додециламино)карбонил]бензиламино)метил]пиперидин 1-карбоновой кислоты, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (81%). 1 Н ЯМР (CDCl3, 300 МГц)7,75 (m, 2H), 7,30 (m, 2 Н), 6,25 (br s, 1 Н), 4,49-4,30 (m, 2 Н), 4,40-4,20(m, 31 Н), 0,86 (m, 3 Н). M-(ХИАД): 614,2; М+(ХИАД): 616,4. ЖХВР (условия Б), время удерживания: 8,8 мин (чистота по данным ЖХВР: 97,8%). Стадия в). Получение ([1-(трет-бутоксикарбонил)-4-пиперидинил]метил 4-[(додециламино)карбонил]бензиламино)(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 10, стадия г), но в качестве исходного соединения используют трет-бутиловый эфир 4-(4-[(додециламино)карбонил]бензил[этокси(оксо)ацетил] аминометил)пиперидин-1-карбоновой кислоты, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (97%). 1 Н ЯМР (CDCl3, 300 МГц)7,72 (m, 2 Н), 7,26 (m, 2 Н), 6,21(m, 1 Н), 4,84 (br s, 1H), 4,69 (br s, 1H),4,10 (m, 2H), 3,45 (m, 3H), 3,20 (m, 1H), 2,63 (m, 2H), 1,85 (m, 1H), 1,61 (m, 4H), 1,45-1,05 (m, 30 Н), 0,88 (t,J=8,0 Гц, 3 Н). M-(ХИАД): 586,2. ЖХВР (условия А), время удерживания: 8,15 мин (чистота по данным- 26012260 ЖХВР: 91,6%). Пример 15. Оксо[4-(тридеканоиламино)бензил][4-(трифторметил) бензил]аминоуксусная кислота. Стадия а). Получение вторичного амина формулы (III) в соответствии со способом И (см. схему 5),например трет-бутилового эфира 4-([4-(трифторметил)бензил]аминометил)фенилкарбаминовой кислоты. К раствору 4-(аминометил)-1-N-Вос-анилина (1,778 г, 8,0 ммоль) и 4-трифторметилбензальдегида(1,156 г, 6,64 ммоль) в ДХЭ (50 мл) добавляют в один прием NaBH(OAc)3 (2,374 г, 11,20 ммоль) и перемешивают смесь в течение ночи при комнатной температуре. К реакционной смеси добавляют 15 мл насыщенного водного раствора NaHCO3, водный слой отделяют и промывают, используя ДХМ (3200 мл). Объединенные органические слои высушивают над MgSO4, отфильтровывают и концентрируют. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (AcOEt/c-Hex в соотношении 1/1, затем в соотношении 7/3), получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (2,688 г, 88%). 1 Н ЯМР (ДМСО-d6, 300 МГц)9,3 (s, 1H), 7,66 (d, 2H, J=8,0 Гц), 7,56 (d, 2 Н, J=8,0 Гц), 7,37 (d, 2H,J=8,5 Гц), 7,20 (d, 2H, J=8,5 Гц), 3,73 (s, 2H), 3,59 (s, 2H), 1,47 (s, 9H). M-(ЖХ/МС (ИЭС: 379,2; М+(ЖХ/МС (ИЭС: 381,4. ЖХВР (условия А), время удерживания: 3,38 мин (чистота по данным ЖХВР: 99,1%). Стадия б). Получение сложного эфира оксаминовой кислоты формулы (II-2) в соответствии со способом В (см. схему 2), например этилового эфира 4-[(трет-бутоксикарбонил)амино]бензил[4(трифторметил)бензил]амино(оксо)уксусной кислоты. К раствору трет-бутилового эфира 4-([4-(трифторметил)бензил]аминометил)фенилкарбаминовой кислоты (2,69 г, 7,07 ммоль) и ДИЭА (1,83 г, 14,13 ммоль) в безводном ДХМ (30 мл) при 0 С в инертной атмосфере добавляют по каплям этиловый эфир хлор(оксо)уксусной кислоты (1,06 г, 7,77 ммоль). Реакционную смесь перемешивают в течение 3 ч при 0 С, затем 1 ч при комнатной температуре. Добавляют 1 Н водный раствор HCl (5 мл) и экстрагируют смесь, используя ДХМ (330 мл). Объединенные органические слои промывают водой (320 мл), высушивают над MgSO4, отфильтровывают и концентрируют,получая при этом маслянистое желтоватое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (AcOEt/c-Hex 1/4), получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (2,980 г, 88%). М-(ЖХ/МС (ИЭС: 479,3. ЖХВР (условия А), время удерживания: 5,65 мин (чистота по данным ЖХВР: 99,9%). Стадия в). Удаление защитной группы сложного эфира оксаминовой кислоты формулы (II-2) (см. схему 2), например получение этилового эфира (4-аминобензил)[4-(трифторметил)бензил]амино(оксо)уксусной кислоты. К раствору этилового эфира 4-[(трет-бутоксикарбонил)амино]бензил[4-(трифторметил)бензил] амино(оксо)уксусной кислоты (2,980 г, 6,2 ммоль) в ДХМ (40 мл) добавляют ТФУ (10 мл) и перемешивают полученную реакционную смесь в течение 4 ч при комнатной температуре. Растворители упаривают в вакууме с получением при этом оранжевого маслянистого вещества. Полученный неочищенный продукт растворяют в Et2O, промывают насыщенным водным раствором NaHCO3, водой (220 мл) и насыщенным раствором соли (120 мл). Объединенные органические слои высушивают над MgSO4, отфильтровывают и концентрируют, получая при этом оранжевое маслянистое вещество (2,245 г, 95%). 1 Н ЯМР (CDCl3, 300 МГц)7,59 (m, 2 Н), 7,33 (m, 2 Н), 7,01 (m, 2 Н), 6,65 (m, 2 Н), 4,49 (s, 1 Н), 4,404,28 (m, 4 Н), 4,20 (s, 1H), 1,38-1,26 (m, 3 Н). M-(ЖХ/МС (ИЭС: 379,1. ЖХВР (условия А), время удерживания: 3,3 мин (чистота по данным ЖХВР: 92,4%). Стадия г). Получение сложного эфира оксаминовой кислоты формулы (I-2) в соответствии со способом В (см. схему 2), например этилового эфира оксо [4-(тридеканоиламино)бензил][4(трифторметил)бензил]аминоуксусной кислоты. К холодному (0 С) раствору этилового эфира (4-аминобензил)-[4-(трифторметил)бензил]амино(оксо)уксусной кислоты (800 мг, 2,10 ммоль) и ДИЭА (326 мг, 2,52 ммоль) в ДХМ (10,0 мл) добавляют в инертной атмосфере тридеканоилхлорид (539 мг, 2,31 ммоль). Полученную реакционную смесь перемешивают 1 ч при 0 С, затем 3,5 ч при комнатной температуре. Добавляют 1 Н водный раствор HCl (2 мл) и экстрагируют смесь, используя ДХМ (330 мл). Объединенные органические слои промывают водой(320 мл), высушивают над MgSO4, отфильтровывают и концентрируют, получая при этом бесцветное маслянистое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (AcOEt/c-Hex в соотношении 1/4), получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (1,067 г, 88%). 1 Н ЯМР (CDCl3, 300 МГц)7,59 (m, 2 Н), 7,50 (m, 2 Н), 7,38 (d, 2 Н, J=8,1 Гц), 7,29 (d, 2H, J=8,0 Гц),7,18 (m, 2 Н), 4,47 (m, 2 Н), 4,37-4,28 (m, 4 Н), 2,34 (t, 2 Н, J=7,5 Гц), 1,71 (m, 2 Н), 1,38-1,26 (m, 21 Н), 0,87 (t,J=8,1 Гц, 3 Н). M-(ЖХ/МС (ИЭС: 575,2; М+(ЖХ/МС (ИЭС: 577,0. ЖХВР (условия А), время удерживания: 7,1 мин (чистота по данным ЖХВР: 98,2%).- 27012260 Стадия д). Получение сложного эфира оксаминовой кислоты формулы (I-2), например оксо[4(тридеканоиламино)бензил][4-(трифторметил)бензил]аминоуксусной кислоты. Применяют ту же самую методику, что и в примере 1, стадия д), но используют в качестве исходного соединения этиловый эфир оксо [4-(тридеканоиламино)бензил][4-(трифторметил)бензил]аминоуксусной кислоты, получая при этом указанное в заголовке соединение в виде белого порошка (99%). 1 Н ЯМР (CD3OD, 300 МГц)7,65-7,12 (m, 8H), 4,54 (s, 2H), 4,45 (s, 2 Н), 2,34 (t, J=6,9 Гц, 2 Н), 1,691,63 (m, 2 Н), 1,40-1,22 (m, 18 Н), 0,87 (t, J=8,6 Гц, 3 Н). (ЖХ/МС (ИЭС: 547,5; М+(ЖХ/МС (ИЭС: 549,3. ЖХВР (условия А), время удерживания: 6,56 мин (чистота по данным ЖХВР: 99,6%). Элементный анализ, вычислено для C30H39F3N2O4C7H17NO5: С, 59,74; Н, 7,59; N, 5,65%. Найдено: С, 59,54; Н, 7,68; N,5,53%. Пример 16. Оксо[4-(тридеканоиламино)бензил]-4-(трифторметил)бензил]аминоуксусная кислота,соль с N-метил-D-глюкамином (т.е. 1-деокси-1-(метиламино)глюцитолом). Применяют ту же самую методику, что и в примере 2, но используют N-метил-D-глюкамин и оксо[4-(тридеканоиламино)бензил][4-(трифторметил)бензил]аминоуксусную кислоту, получая при этом указанное в заголовке соединение в виде белого порошка (83%). М-(ЖХ/МС (ИЭС: 547,5; М+(ЖХ/МС (ИЭС: 549,3. ЖХВР (условия А), время удерживания: 6,56 мин (чистота по данным ЖХВР: 99,6%). Элементный анализ, вычислено для C30H39F3N2O4C7H17NO5: С,59,74; Н, 7,59; N, 5,65%. Найдено: С, 59,54; Н, 7,68; N, 5,53%. Пример 17. [Бензил(4-[4-(гексилокси)бензоил]аминобензил)амино](оксо)уксусная кислота. Стадия а). Получение трет-бутилового эфира 4-[(бензиламино)метил]фенилкарбаминовой кислоты. Применяют ту же самую методику, что и в примере 15, стадия а), но используют 4-(аминометил)-1N-Вос-анилин и бензальдегид, получая при этом указанное в заголовке соединение в виде белого твердого вещества (61%). М+ (ИЭС): 313,2. ЖХВР (условия А), время удерживания: 2,89 мин (чистота по данным ЖХВР: 99,4%). Стадия б). Получение этилового эфира (бензил 4-[(трет-бутоксикарбонил)амино]бензиламино)(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 15, стадия б), но используют трет-бутиловый эфир 4-[(бензиламино)метил]фенилкарбаминовой кислоты, получая при этом указанное в заголовке соединение в виде коричневого вспененного вещества (89%). М(ХИАД): 411,0; М+(ХИАД): 413,2. ЖХВР(условия А), время удерживания: 5,32 мин (чистота по данным ЖХВР: 98,1%). Стадия в). Получение этилового эфира [(4-аминобензил)(бензил)амино](оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 15, стадия в), но используют этиловый эфир(бензил 4-[(трет-бутоксикарбонил)амино]бензиламино)(оксо)уксусной кислоты, получая при этом указанное в заголовке соединение в виде коричневого маслянистого вещества (99,9%). ЖХВР (условия А),время удерживания: 2,69 мин (чистота по данным ЖХВР: 91,5%). Стадия г). Получение этилового эфира [бензил(4-[4-(гексилокси)бензоил]аминобензил)амино](оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 15, стадия г), но используют 4-гексилоксибензоил хлорид и этиловый эфир [(4-аминобензил)(бензил)амино](оксо)уксусной кислоты, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (58%). М-(ИЭС): 515,2. ЖХВР (условия А), время удерживания: 6,0 мин (чистота по данным ЖХВР: 94,9%). Стадия д). Получение [бензил(4-[4-(гексилокси)бензоил]аминобензил)амино](оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 15, стадия д), но используя этиловый эфир [бензил(4-[4-(гексилокси)бензоил]аминобензил)амино](оксо)уксусной кислоты, получая при этом указанное в заголовке соединение в виде белого резиноподобного вещества (99,9%). 1 Н ЯМР (CD3OD, 300 МГц)7,93 (d, 2 Н, J=8,3 Гц), 7,67 (m, 2 Н), 7,38-7,25 (m, 7 Н), 7,02 (d, 2H, J=9,0 Гц), 4,43 (m, 4 Н), 4,06 (t, 2 Н, J=6,4 Гц), 1,81 (m, 2 Н), 1,50 (m, 2 Н), 1,38 (m, 4 Н), 0,88 (t, J=7,9 Гц, 3 Н). M(ЖХ/МС (ИЭС: 487,4; М+(ЖХ/МС (ИЭС: 489,4. ЖХВР (условия А), время удерживания: 5,42 мин(чистота по данным ЖХВР: 96,4%). Пример 18. Оксо[4-(трифторметил)бензил][4-(10-ундеценоиламино)бензил]аминоуксусная кислота. Стадия а). Получение этилового эфира оксо[4-(трифторметил)бензил][4-(ундец-10 еноиламино)бензил]аминоуксусной кислоты. Применяют ту же самую методику, что и в примере 15, стадия г), но используя этиловый эфир (4 аминобензил)[4-(трифторметил)бензил]амино(оксо)уксусной кислоты и ундец-10-еноилхлорид, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (71%). ЖХВР (условия А), время удерживания: 6,7 мин (чистота по данным ЖХВР: 99%). Стадия б). Получение оксо[4-(трифторметил)бензил][4-(10-ундеценоиламино)бензил]аминоук- 28012260 сусной кислоты. Применяют ту же самую методику, что и в примере 15, стадия д), но используя этиловый эфир оксо[4-(трифторметил)бензил][4-(ундец-10-еноиламино)бензил]аминоуксусной кислоты, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (89%). 1 Н ЯМР (CDCl3, 300 МГц)10,2 (s, 1H), 8,03 (d, 1H, J=8,0 Гц), 7,61-7,51 (m, 3H), 7,50-7,44 (t, 1 Н,J=9,0 Гц), 7,38 (d, 1 Н, J=7,9 Гц), 7,29 (d, 1 Н, J=7,1 Гц), 7,17 (d, 1H, J=7,7 Гц), 7,11 (d, 1 Н, J=7,7 Гц), 5,845,75 (m, 1 Н), 5,02-4,91 (m, 2 Н), 4,58-4,44 (m, 4 Н), 2,38 (m, 2 Н), 2,06 (m, 2 Н), 1,7 (br s, 2H), 1,29 (br s, 10H).(чистота по данным ЖХВР: 99,4%). Пример 19. Оксо 4-[(9 Е)-9-тетрадеценоиламино]бензил-[4-(трифторметил)бензил]аминоуксусная кислота. Стадия а). Получение этилового эфира оксо 4-[(9 Е)-тетрадец-9-еноиламино]бензил[4(трифторметил)бензил]аминоуксусной кислоты. Применяют ту же самую методику, что и в примере 15, стадия г), но используют этиловый эфир(4-аминобензил)[4-(трифторметил)бензил]амино(оксо)уксусной кислоты и тетрадец-9-еноилхлорид,получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (81%).M-(ЖХ/МС (ИЭС: 588,0. ЖХВР (условия А), время удерживания: 7,3 мин (чистота по данным ЖХВР: 96,9%). Стадия б). Получение оксо 4-[(9 Е)-9-тетрадеценоиламино]бензил[4-(трифторметил)бензил]аминоуксусной кислоты. Применяют ту же самую методику, что и в примере 15, стадия д), но используют этиловый эфир оксо 4-[(9 Е)-тетрадец-9-еноиламино]бензил[4-(трифторметил)бензил]аминоуксусной кислоты, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (94%). 1 Н ЯМР (CD3OD, 300 МГц)7,58-7,00 (m, 8 Н), 5,30-5,19 (m, 2 Н), 4,45 (s, 2H), 4,37 (s, 2 Н), 2,26 (t,2 Н, J=7,3 Гц), 1,98-1,88 (m, 4 Н), 1,66-1,53 (m, 2 Н), 1,32-1,16 (m, 12 Н), 0,80 (t, 3H). M-(ЖХ/МС (ИЭС: 559,7; М+(ЖХ/МС (ИЭС: 561,2. ЖХВР (условия А), время удерживания: 6,72 мин (чистота по данным ЖХВР: 98,9%). Пример 20. Оксо 4-[(9 Е)-9-тетрадеценоиламино]бензил-[4-(трифторметил)бензил]аминоуксусная кислота, соль с N-метил-D-глюкамином (т.е. 1-деокси-1-(метиламино)глюцитолом). Применяют ту же самую методику, что и в примере 2, но используют N-метил-D-глюкамин и оксо 4-[(9 Е)-9-тетрадеценоиламино]бензил-[4-(трифторметил)бензил]аминоуксусную кислоту, получая при этом указанное в заголовке соединение в виде белого пушистого порошка (93,8%).M-(ЖХ/МС (ИЭС: 559,7; М+(ЖХ/МС (ИЭС: 561,2. ЖХВР (условия А), время удерживания: 6,72 мин (чистота по данным ЖХВР: 98,9%). Элементный анализ, вычислено для C31H39F3N2O4C7H17NO5: С,60,38; Н, 7,47; N, 5,56%. Найдено: С, 60,19; Н, 7,70; N,5,36%. Пример 21. Бензил[4-(тридеканоиламино)бензил]амино(оксо)уксусная кислота. Стадия а). Получение этилового эфира бензил[4-(тридеканоиламино)бензил]амино(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 5, стадия г), но используют этиловый эфир [(4 аминобензил)(бензил)амино](оксо)уксусной кислоты и тридекановую кислоту, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (39%).M-(ИЭС): 507,2. ЖХВР (условия А), время удерживания: 7 мин (чистота по данным ЖХВР: 91,3%). Стадия б). Получение оксо 4-[(9 Е)-9-тетрадеценоиламино]бензил-[4-(трифторметил)бензил] аминоуксусной кислоты. Применяют ту же самую методику, что и в примере 15, стадия д), но используют этиловый эфир бензил[4-(тридеканоиламино)бензил]амино(оксо)уксусной кислоты, получая при этом указанное в заголовке соединение в виде белого резиноподобного вещества (99%). 1 Н ЯМР (CD3OD, 300 МГц)7,54 (m, 2 Н), 7,38-7,15 (m, 7 Н), 4,43 (m, 4 Н), 2,38 (t, 2H, J=7,3 Гц), 1,69(m, 2 Н), 1,27 (m, 18 Н), 0,90 (t, J=8,0 Гц, 3 Н). М-(ИЭС): 479,2. ЖХВР (условия А), время удерживания: 6,19 мин (чистота по данным ЖХВР: 94,9%). Пример 22. 4-[(2-Гидроксидодецил)амино]бензил[4-(трифторметил)бензил]амино(оксо)уксусная кислота. Стадия а). Получение этилового эфира 4-[(2-гидроксидодецил)амино]бензил[4(трифторметил)бензил]амино(оксо)уксусной кислоты. К раствору этилового эфира (4-аминобензил)-[4-(трифторметил)бензил]амино(оксо)уксусной кислоты (38 мг, 0,10 ммоль) и 1,2-додециленоксида (22 мг, 0,12 ммоль) в 1,0 мл CH3CN добавляют в один прием перхлорат магния (27 мг, 0,12 ммоль) в инертной атмосфере. Реакционную смесь перемешивают 24 ч при комнатной температуре. Добавляют 2 мл Н 2 О и экстрагируют полученную смесь, используяEtOAc (25 мл), высушивают над MgSO4, фильтруют, затем растворители упаривают в вакууме с получением при этом светло-желтого маслянистого вещества (61 мг). После очистки на SiO2 (AcOEt/c-Hex) получают указанное в заголовке соединение в виде бесцвет- 29012260 ного маслянистого вещества (15,3 мг, 27%). 1 Н ЯМР (CDCl3, 300 МГц)7,61-7,46 (m, 2 Н), 7,36-7,21 (m, 2 Н), 7,05-6,88 (m, 2 Н), 6,61-6,47 (m, 2 Н),4,43 (s, 1 Н), 4,38-4,17 (m, 4 Н), 4,14 (s, 1H), 3,17 (br s, 1H), 3,25-3,13 (m, 1 Н), 3,01-2,81 (m, 1 Н), 1,55-1,05(оксо)уксусной кислоты. Применяют ту же самую методику, что и в примере 1, стадия д), используют этиловый эфир 4[(2-гидроксидодецил)амино]бензил[4-(трифторметил)бензил]амино(оксо)уксусной кислоты, получая при этом указанное в заголовке соединение в виде желтого твердого вещества (90%). 1 Н ЯМР (CD3OD, 300 МГц)7,57 (m, 2 Н), 7,46 (m, 1 Н), 7,33 (m, 1 Н), 7,18 (d, 1H, J=7,5 Гц), 7,10 (d,1 Н, J=7,2 Гц), 6,83 (m, 2 Н), 4,69 (b rs, 1 Н), 4,48 (br s, 2 Н), 4,38 (s, 1H), 3,72 (br s, 1 Н), 3,25-3,15 (m, 1 Н),3,13-2,98 (m, 1 Н), 1,47 (br s, 2H), 1,26 (br s, 16H), 0,86 (br s, 3 Н). М-(ЖХ/МС (ИЭС: 535,0; М+(ЖХ/МС(ИЭС: 537,1. ЖХВР (условия А), время удерживания: 5,11 мин (чистота по данным ЖХВР: 88,5%). Пример 23. Оксо[4-(трифторметил)бензил][4-(3-ундецил-1,2,4-оксадиазол-5-ил)бензил]аминоуксусная кислота. Стадия а). Получение N-гидроксидодеканимидамида. К раствору ундецилцианида (1,810 г, 9,98 ммоль) в EtOH (20 мл) добавляют 50%-ный водный раствор гидроксиламина (1 мл), и полученную реакционную смесь перемешивают при 70 С в течение 48 ч. Растворители упаривают, полученное белое твердое вещество растворяют в EtOAc (100 мл) и промывают, используя Н 2 О (220 мл), высушивают над MgSO4, фильтруют, растворители упаривают в вакууме,получая при этом указанное в заголовке соединение в виде белого твердого вещества (2,001 г, 94%). 1 Н ЯМР (CDCl3, 300 МГц)6,21-4,99 (br s, 1 Н), 4,49 (br s, 2 Н), 2,07 (t, J=7,6 Гц, 2 Н), 1,55-1,40 (m,2H), 1,34-1,09 (m, 16 Н), 0,81 (t, J=7,0 Гц, 3 Н). Стадия б). Получение бензилового эфира 4-трет-бутоксикарбонил)-[4-(трифторметил)бензил] аминометил)бензойной кислоты. К раствору бензилового эфира 4-([4-(трифторметил)бензил]аминометил)бензойной кислоты (3,60 г, 9,01 ммоль) и триэтиламина (1,094 г, 10,82 ммоль) в ДХМ (50 мл) добавляют ди-трет-бутилдикарбонат(2,164 г, 9,91 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 5 ч. Добавляют Н 2 О (10 мл) и экстрагируют смесь, используя ДХМ (350 мл). Объединенные органические слои промывают 1 Н водным раствором HCl (10 мл), насыщенным водным растворомNaHCO3, водой (220 мл) и насыщенным раствором соли (120 мл). Объединенные органические слои высушивают над MgSO4, отфильтровывают и концентрируют, получая при этом бесцветное маслянистое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле(AcOEt/c-Hex в соотношении 5/95), получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (4,303 г, 96%). 1 Н ЯМР (CDCl3, 300 МГц)8,12 (d, J=8,1 Гц, 2 Н), 7,67 (d, J=8,1 Гц, 2 Н), 7,60-7,22 (m, 9H), 5,46 (s,2H), 4,57 (s, 2H), 4,58 (s, 2H), 1,56 (s, 9H). ЖХВР (условия А), время удерживания: 6,55 мин (чистота по данным ЖХВР: 99,7%). Стадия в). Получение 4-трет-бутоксикарбонил)-[4-(трифторметил)бензил]аминометил)бензойной кислоты. Через суспензию 10% Pd/C (917 мг) в EtOH (25 мл) медленно барботируют Н 2 (1 атм.) в течение 15 мин при комнатной температуре. К этой суспензии затем добавляют раствор бензилового эфира 4 трет-бутоксикарбонил)-[4-(трифторметил)бензил]аминометил)бензойной кислоты (4,303 г, 8,61 ммоль), растворенного в EtOH (5 мл). Реакционную смесь перемешивают при 1 атм. Н 2 в течение 4,5 ч при комнатной температуре. Полученную реакционную смесь отфильтровывают через слой целита для того, чтобы удалить катализатор. Упаривают EtOH, получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества, которое используют на последующей стадии без дополнительной очистки (3,520 г, 99%). 1 Н ЯМР (CDCl3, 300 МГц)8,11 (d, J=8,1 Гц, 2 Н), 7,62 (d, J=8,1 Гц, 2 Н), 7,45-7,21 (m, 4H), 5,54 (s,2H), 4,45 (s, 2H), 1,50 (s, 9H). ЖХВР (условия А), время удерживания: 5,42 мин (чистота по данным ЖХВР: 96,1%). Стадия г). Получение трет-бутилового эфира 4-[(додеканимидоиламино)окси]карбонилбензил[4(трифторметил)бензил]карбаминовой кислоты. К раствору 4-трет-бутоксикарбонил)[4-(трифторметил)бензил]аминометил)бензойной кислоты(102 мг, 0,25 ммоль), N-гидроксидодеканимидамида (70 мг, 0,33 ммоль) и ДМАП (3 мг, 0,03 ммоль) в безводном ДХМ (15 мл) добавляют ЭДК (62 мг, 0,33 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 14 ч. После упаривания растворителей получают маслянистое вещество. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (AcOEt/c-Hex в соотношении 80/20), получая при этом указанное в заголовке соединение в виде бесцветного маслянистого вещества (36 мг, 24%).
МПК / Метки
МПК: A61P 3/10, C07C 237/42, C07C 317/32, C07C 233/56, C07D 211/26, C07C 255/60, A61K 31/16, C07D 333/34
Метки: производные, замещённые, модуляторов, качестве, ртрs, протеинтирозинфосфатаз, метиленамида
Код ссылки
<a href="https://eas.patents.su/30-12260-zameshhyonnye-proizvodnye-metilenamida-v-kachestve-modulyatorov-proteintirozinfosfataz-rtrs.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые производные метиленамида в качестве модуляторов протеинтирозинфосфатаз ( ртрs )</a>
Предыдущий патент: Устройство управления электроприводами экскаватора
Следующий патент: Лекарственные формы, содержащие ингибитор протонного насоса и прокинетический агент
Случайный патент: Замещенные фенильные производные в качестве антагонистов эндотелина