Производные пиримидина для использования в качестве лигандов ваниллоидных рецепторов и их применение для терапии боли
Номер патента: 10265
Опубликовано: 30.06.2008
Авторы: Норман Марк Г., Фэлси Джеймс Р., Гор Виджей Кешев, Кэтон Джоди, Доерти Элизабет М., Бэлан Ченера, Вонг Ху-Линг
Формула / Реферат
1. Соединение, обладающее структурой
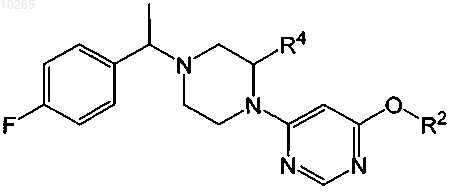
или его любая фармацевтически приемлемая соль, где
R2 является независимо частично замещённым или незамещённым 8-, 9-, 10- или 11-членным бициклическим кольцом, содержащим 1, 2, 3 или 4 атома N, О и S, где атомы углерода кольца замещены 0, 1 или 2 оксогруппами и кольцо замещено 0, 1, 2 или 3 заместителями, выбранными из ряда групп:
С1-8алкил-, С1-4галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa,
-C(=NRa)NRaRa, -ORa, -OC(=O)Rb, -OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6алкилNRaRa,
-ОС2-6алкилORа, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb,
-S(=O)2N(Ra)C(=O)NRaRa, -NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa,
-N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6алкилNRaRa и -NRaC2-6алкилORа;
R4 является атомом Н или метилом;
Ra является независимо, в каждом случае, атомом Н или Rb; и
Rb является независимо, в каждом случае, фенилом, бензилом или С1-6алкилом, где фенил, бензил и С1-6алкил замещены 0, 1, 2 или 3 заместителями, выбранными из ряда групп: галоген-, С1-4алкил-, С1-3галогеналкил-, -ОС1-4алкил-, -NH2, -NHC1-4алкил, -N(С1-4алкил)С1-4алкил.
2. Соединение по п.1, или любая его фармацевтически приемлемая соль, или гидрат,
где R2 является независимо частично замещённым или незамещённым 8-, 9-, 10- или 11-членным бициклическим кольцом, содержащим 1, 2, 3 или 4 атомов N, О и S, где атомы углерода кольца замещены 0, 1 или 2 оксогруппами и кольцо замещено 0, 1, 2 или 3 заместителями, выбранными из ряда групп: С1-8алкил-, С1-4галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa,
-C(=NRa)NRaRa, -ORa, -OC(=O)Rb, -OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -ОС2-6алкилNRа,
-ОС2-6алкилORа, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb,
-S(=O)2N(Ra)C(=O)NRaRa, -NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6aлкилNRaRa и -NRaC2-6алкилORa.
3. Соединение по п.1, или любая его фармацевтически приемлемая соль или гидрат, где R2 является хинолин-8-илом, бензоксазол-4-илом, бензотиазол-4-илом или хиноксалинон-5-илом, один из которых замещён 0, 1, 2 или 3 заместителями, выбранными из ряда групп: С1-8алкил-, С1-4галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb, -OC(=O)NRaRa,
-OC(=O)N(Ra)S(=O)2Rb, -OC2-6алкилNRaRa, -ОС2-6алкилORa, -SRa, -S(=O)Rb, -S(=O)2Rb,
-S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa,
-N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,
-N(Ra)S(=O)2NRaRa, -NRaC2-6алкилNRaRa и -NRaC2-6aлкилORa.
4. Соединение по п.1, или любая его фармацевтически приемлемая соль, или гидрат, где R3 является атомом Н и R3' является метилом.
5. Применение соединений по пп.1-4 в качестве медикаментов.
6. Применение соединений по пп.1 -4 в производстве медикаментов для лечения острых, воспалительных и невропатических болей, зубной боли, общей головной боли, мигрени, концентрированной головной боли, смешанных сосудистых и несосудистых синдромов, головной боли при давлении, общих воспалений, артрита, ревматических болезней, остеоартрита, воспалительных нарушений деятельности кишечника, тревожности, депрессии, воспалительных глазных нарушений, воспалительных или нестабильных нарушений деятельности мочевого пузыря, псориаза, кожных болезней с элементами воспаления, хронических воспалительных состояний, воспалительной боли и сопутствующей гипералгезии и аллодинии, невропатической боли и сопутствующей гипералгезии и аллодинии, диабетической невропатической боли, каузалгии, симпатических болей, деаффернатических синдромов, астмы, эпителиальных повреждений или дисфункций кожи, обычного герпеса, нарушений внутренней подвижности в дыхательной, генитоуринарной, пищеварительной или сосудистой областях, ран, ожогов, аллергических кожных реакций, зуда, витилиго, общих пищеварительных расстройств, гастритной язвы, язвы двенадцатиперстной кишки, диареи, гастритных поражений, вызванных некротизирующими агентами, роста волос, вазомоторного или аллергического ринита, бронхиальных расстройств или расстройств мочевого пузыря.
7. Фармацевтическая композиция, включающая соединения по любому из пп.1-4 и фармацевтически приемлемые разбавители или носители.
Текст
010265 Данная заявка испрашивает приоритет предварительной патентной заявки США No. 60/543896, зарегистрированной 11 февраля 2004, которая полностью приведена в данном изобретении в качестве ссылки. Предпосылки изобретения Ваниллоидный рецептор 1 (ВР 1) является молекулярной целью капсаицина, активного ингредиента красного перца. Julius et al. сообщал о молекулярном клонировании ВР 1 (Caterina et al., 1997). ВР 1 служит неселективным катионным каналом, который активируется или сенсибилизируется рядом различных раздражителей, включая капсаицин и резинифератоксин (экзогенные активаторы), тепловое и кислотное стимулирование и продукты метаболизма липидного бислоя, анандамид (Premkumar et al., 2000, Szabo etal., 2000, Gauldie et al., 2001, Olah et al., 2001) и метаболиты липоксигеназы (Hwang et al., 2000). BP1 ярко выражен в первичных сенсорных нейронах (Caterina et al., 1997) у крыс, мышей и людей (Onozawa et al.,2000, Mezey et al., 2000, Helliwell et al., 1998, Cortright et al., 2001). Такие сенсорные нейроны присутствуют во многих внутренних органах, включая кожу, кости, мочевой пузырь, пищеварительный тракт и лгкие; ВР 1 также выражен в других нейронных и не нейронных тканях, включая в том числе ядра ЦНС,почки, желудок и Т-клетки (Nozawa et al., 2001, Yiangou et al., 2001, Birder et al., 2001). Предположительно, его выраженность в этих различных клетках и органах может относиться к таким их основным функциям, как клеточные сигналы и клеточное деление. Ещ до молекулярного клонирования ВР 1, эксперименты с капсаицином обнаружили наличие капсаицин-чувствительного рецептора, который способен повышать чувствительность сенсорных нейронов у людей, крыс и мышей (Holzer, 1991; Dray, 1992, Szallasi and Blumberg 1996, 1999). Результатом сильной капсаициновой активации у людей была боль в месте иньекции, а у других существ - повышение поведенческой чувствительности к сенсорным раздражителям (Szallasi and Blumberg, 1999). Применение капсаицина к человеческой коже вызывает болезненную реакцию, характеризующуюся не только ощущением тепла и боли в месте обработки, но и более широкой областью гипералгезии и аллодинии, двумя характерными симтомами состояния невротической боли у человека (Holzer, 1991). В совокупности, это свидетельствует о том, что повышенная активность ВР 1 играет значительную роль в возникновении и развитии болезненных состояний. Было также показано, что местные или внутрикожные иньекции капсаицина вызывают местную вазодилатацию и образование эдемы (Szallasi and Blumberg 1999, Singh et al.,2001). Это свидетельствует о том, что капсаицин, посредством активации ВР 1, может регулировать афферентные и эфферентные функции сенсорных нервов. Вовлечнность сенсорных нервов в заболевание может, таким образом, изменяться молекулами, воздействующими на функцию ваниллоидного рецептора повышать или понижать активность сенсорных нервов. Мыши с генами, лишнными ВР 1, демонстрируют пониженную сенсорную чувствительность к температурным и кислотным раздражителям (Caterina et al., 2000). Это говорит в поддержку концепции того,что ВР 1 служит не только для генерации болевой реакции (например, через температурный, кислотный или капсаициновый раздражитель), но и для поддержки базисной активности сенсорных нервов. Это наблюдение соответствует исследованиям, демонстрирующим вовлечнность в заболевание капсаицинчувствительных нервов. Первичные сенсорные нервы у человека и других существ могут быть дезактивированы продолжительной капсаициновой стимуляцией. Это вызывает обесчувствование первичного сенсорного нерва путм активации рецептора, и такое понижение активности сенсорного нерва in vivo делает субъекта менее чувствительным к последующим болевым раздражителям. В этой связи и капсаицин, и резинфератоксин (экзогенный активатор ВР 1), вызывают обесчувствование и были использованы в доказательствах многих концептуальных исследований в in vivo моделях болезней (Holzer, 1991, Dray 1992, Szallasi and Blumberg 1999). Библиография Birder-LA. Kanai-AJ. de-Groat-WC. Kiss-S. Nealen-ML.Wang-H. Bian-D. Zhu-D. Zajic-G. Loeloff-R. Lile-J. Wild-K. Treanor-J. Curran-E. (2000) Inflammationinduced upregulation of VR1 in rat spinal cord and DRG correlates with enhanced nociceptive processing. Society for Neuroscience Abstracts 26:1-2: 632.15. Сущность изобретения Данное изобретение включает в себя новый класс соединений, пригодных для лечения заболеваний,таких как заболевания с участием ваниллоидных рецепторов, а также прочие расстройства, такие как воспалительные и невропатические боли и болезни с участием сенсорных нервных функций, такие как астма, ревматический артрит, остеоартрит, воспалительные расстройства мочевого пузыря, недержание мочи, мигрени и псориаз. Компоненты изобретения особенно пригодны для лечения острых, воспалительных и невропатических болей, зубной боли, общей головной боли, мигрени, концентрированной головной боли, смешанных сосудистых и несосудистых синдромов, головной боли при давлении, общих воспалений, артрита, ревматических болезней, остеоартрита, воспалительных нарушений деятельности кишечника, тревожности, депрессии, воспалительных глазных нарушений, воспалительных или нестабильных нарушений деятельности мочевого пузыря, псориаза, кожных болезней с элементами воспаления, хронических воспалительных состояний, воспалительной боли и сопутствующей гипералгезии и аллодинии, невропатической боли и сопутствующей гипералгезии и аллодинии, диабетической невропатической боли, каузалгии, симпатических болей, деаффернатических синдромов, астмы, эпителиальных повреждений или дисфункций кожи, обычного герпеса, нарушений внутренней подвижности в дыхательной, генитоуринарной, пищеварительной или сосудистой областях, ран, ожогов, аллергических кожных реакций, зуда, витилиго, общих пищеварительных расстройств, гастритной язвы, язвы двенадцатиперстной кишки, диареи, гастритных поражений, вызванных некротизирующими агентами, роста волос,вазомоторного или аллергического ринита, бронхиальных расстройств или расстройств мочевого пузыря. Соответственно, изобретение также включает в себя фармацевтические составы, содержащие эти соединения, способы лечения заболеваний с участием ваниллоидных рецепторов, таких как воспалительные или невропатические боли, астма, ревматический артрит, остеоартрит, воспалительные расстройства мочевого пузыря, недержание мочи, мигрени и псориаз, с использованием соединений и составов этого изобретения, а также промежуточные продукты и процессы, используемые для приготовления соединений этого изобретения. Соединения этого изобретения описываются следующей общей структурной формулой: или их фармацевтически пригодные соли, при этом R1, R2, R3, R3', R4 и X описаны ниже. Вс написанное выше обобщает определнные аспекты изобретения, но не означает, и не должно быть истолковано, как какое-либо ограничение изобретения. Все цитируемые патенты, патентные заявки и прочие публикации включены в виде ссылок на свои полные версии. Подробное описание изобретения Один из аспектов данного изобретения относится к соединениям, соответствующим следующей структурной формуле: или любым их фармацевтически пригодным солям или гидратам, где X является атомами N или С; обозначает одинарную связь, а когда X является С, то обознапри этом, когда X является N, то чает одинарную или двойную связь;R1 является насыщенным, частично насыщенным или ненасыщенным 5-, 6- или 7-членным кольцом, содержащим 1, 2, 3 или 4 атома N, О или S, при этом атомы углерода кольца являются замещнными 0, 1 или 2 оксогруппами, и кольцо замещено 0, 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-, С 1-4 галогеналкил-,галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb,-OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb,-S(=O)2Rb, -S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(O)2N(Ra)C(=O)ORb, S(=O)2N(Ra)C(=O)NRaRa, NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORa; или R1 является фенил-замещнным 1, 2 или 3 заместителями из ряда групп С 1-8 алкил-, Сl-4 галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb,-C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb, -OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb,-S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb,-N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRаС 2-6 алкилORа;R2 является независимо частично насыщенным или ненасыщенным 8-, 9-, 10- или 11-членным бициклическим кольцом, содержащим 1, 2, 3 или 4 атома N, О и S, при этом атомы углерода кольца замещены 0, 1 или 2 оксо группами, и кольцо замещено 0, 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-, С 1-4 галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb, -OC(=O)NRaRa,-OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, - ОС 2-6 алкилORа, -SRa, -S(=O)Rb, -S(=O)2Rb, - S(=O)2NRaRa,-S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa, -N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилОRa; или R2 является независимо частично насыщенным или ненасыщенным 9-, 10 или 11-членным бициклическим карбоциклическим кольцом, замещнным 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-, С 1-4 алкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa,-OC(=O)Rb, -OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -OC2-6 алкилORa, -SRa, -S(=O)Rb,-S(=O)2Rb, -S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa,-N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa,-NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORа;R3 и R3' являются независимо, в каждом случае, атомом H, метилом или этилом; или R3 и R3' оба могут быть объединены с атомом углерода, к которому они присоединены, образуя циклопропил;Rb является независимо, в каждом случае, фенилом, бензилом или С 1-6 алкилом, где фенил, бензил и С 1-6 алкил замещены 0, 1, 2 или 3 заместителями из ряда групп: галоген-, Сl-4 алкил-, Сl-3 галогеналкил-,-ОСl-4 алкил, -NH2, -NHCl-4 алкил, -N(Сl-4 алкил)Сl-4 алкил. Один из аспектов данного изобретения относится к соединениям, соответствующим следующей структурной формуле: или любым их фармацевтически пригодным солям, гдеR2 является независимо частично замещнным или незамещнным 8-, 9-, 10- или 11-членным бициклическим кольцом, содержащим 1, 2, 3 или 4 атомов N, О и S, при этом атомы углерода кольца замещены 0, 1 или 2 оксогруппами, и кольцо замещено 0, 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-,С 1-4 галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa,-OC(=O)Rb, -OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb,-S(=O)2Rb, -S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa,-NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORа; или R2 является независимо частично замещнным или незамещнным 9-, 10- или 11-членным бициклическим карбоциклическим кольцом, замещнным 1, 2 или 3 заместителями из ряда групп: Сl-8 алкил-, Сl-4 галогеналкил-, галоген-, циано-, нитро-C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb, -OC(=O)NRaRa,-OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,-S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa, -N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORa;R5 независимо в каждом случае является одним из ряда Н, С 1-8 алкил-, С 1-4 галогеналкил-, галоген-,циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb, -OC(=O)NRaRa,-OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,-S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa, -N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORа групп;Rb является независимо, в каждом случае, фенилом, бензилом или Сl-6 алкилом, при этом фенил, бензил и Сl-6 алкил замещены 0, 1, 2 или 3 заместителями из ряда групп: галоген-, Сl-4 алкил-, Сl-3 галогеналкил-, -ОСl-4 алкил, -NH2, -НСl-4 алкил, -N(Сl-4 алкил)Сl-4 алкил. Другой из аспектов данного изобретения относится к соединениям, соответствующим следующей структурной формуле: или любым их фармацевтически пригодным солям, где обозначает одинарную связь, а коX является N или С; при этом, когда X является атомом N, то гда X является атомом С, то обозначает одинарную или двойную связь;R1 является насыщенным, частично насыщенным или ненасыщенным 5-, 6- или 7-членным кольцом, содержащим 1, 2, 3 или 4 атома N, О или S, при этом атомы углерода кольца являются замещнными 0, 1 или 2 оксогруппами, и кольцо замещено 0, 1, 2 или 3 заместителями из ряда групп: Сl-8 алкил-, Сl-4 галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb,-OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb, -S(=O)2Rb,-S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa, -N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6aлкилNRaRa и -NRaC2-6 алкилORa; или R1 является фенил-замещнным 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-, С 1-4 галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa,-C(=NRa)NRaRa, -ORa, -OC(=O)Rb, -OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -ОС 2-6 алкилNRaRa, -OC2-6 алкилORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb,-S(=O)2N(Ra)C(=O)NRaRa, -NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa,-N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORа;R2 является независимо частично насыщенным или ненасыщенным 8-, 9-, 10- или 11-членным бициклическим кольцом, содержащим 1, 2, 3 или 4 атома N, О и S, при этом атомы углерода кольца замещены 0, 1 или 2 оксогруппами, и кольцо замещено 0,1,2 или 3 заместителями из ряда групп: С 1-8 алкил-,С 1-4 галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa,-4 010265R3 и R3' являются независимо, в каждом случае, атомом Н, метилом или этилом; или R3 и R3' оба могут быть объединены с атомом углерода, к которому они присоединены, образуя циклопропил;Rb является независимо, в каждом случае, фенилом, бензилом или Сl-6 алкилом, где фенил, бензил и Сl-6 алкил замещены 0, 1, 2 или 3 заместителями из ряда галоген-, Сl-4 алкил, Сl-3 галогеналкил-, -ОСl-4 алкил, -NH2,-NHCl-4 алкил, -N(Сl-4 алкил)Сl-4 алкилгрупп. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, данное изобретение может быть описано следующей общей структурной формулой или его любая фармацевтически пригодная соль, гдеR2 является независимо частично замещнным или незамещнным 8-, 9-, 10- или 11-членным бициклическим кольцом, содержащим 1, 2, 3 или 4 атомов N, О и S, при этом атомы углерода кольца замещены 0, 1 или 2 оксогруппами, и кольцо замещено 0, 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-,С 1-4 галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa,-OC(=O)Rb, -OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb,-S(=O)2Rb, -S(=O)2NRaRa, - S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa,-NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORа;R5 независимо в каждом случае является одним из ряда Н, С 1-8 алкил-, С 1-4 галогеналкил-, галоген-,циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb, -OC(=O)NRaRa,-OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,-S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa, -N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилRaRa и -RaC2-6 алкилORа групп;Rb является независимо, в каждом случае, фенилом, бензилом или С 1-6 алкилом, при этом фенил,бензил и С 1-6 алкил замещены 0, 1, 2 или 3 заместителями из ряда групп: галоген-, С 1-4 алкил-, С 1-3 галогеналкил-, -ОСl-4 алкил-, -NH2, -NHCl-4 алкил, -N(С 1-4 алкил)С 1-4 алкил. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, данное изобретение может быть описано следующей общей структурной формулой: или его любая фармацевтически пригодная соль, где:R2 является независимо частично замещнным или незамещнным 8-, 9-, 10- или 11-членным бициклическим кольцом, содержащим 1, 2, 3 или 4 атомов N, О и S, при этом атомы углерода кольца замещены 0, 1 или 2 оксогруппами, и кольцо замещено 0, 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-,Сl-4 галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa,-OC(=O)Rb, -OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb,-S(=O)2Rb, -S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa,-NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORа;Rb является независимо, в каждом случае, фенилом, бензилом или Сl-6 алкилом, при этом фенил,бензил и С 1-6 алкил замещены 0, 1, 2 или 3 заместителями из ряда групп: галоген-, С 1-4 алкил-, С 1-3 галогеналкил-, -ОС 1-4 алкил, -NH2, -NHCl-4 алкил, -N(С 1-4 алкил)С 1-4 алкил. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, X является ато-5 010265 обозначает одинарную связь. мом N и В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, X является атообозначает двойную связь. мом С и В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, X является атомом С и обозначает одинарную связь. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R1 является насыщенным, частично насыщенным или ненасыщенным 5-, 6- или 7-членным кольцом, содержащим 1, 2,3 или 4 атома N, О или S, при этом атомы углерода кольца являются замещнными 0, 1 или 2 оксогруппами, и кольцо замещено 0, 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-, С 1-4 галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb,-OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -OC2-6 алкилORa, -SRa, -S(=O)Rb, -S(=O)2Rb,-S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa,-N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORa. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R1 является пиридинилом, фуранилом, тиофенилом или пиримидинилом, любой из которых замещн 0, 1, 2 или 3 заместителями из ряда С 1-8 алкил, С 1-4 галогеналкил и галоген. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R1 является пиридинилом, фуранилом, тиофенилом или пиримидинилом, любой из которых замещн 1, 2 или 3 заместителями из ряда С 1-8 алкил, С 1-4 галогеналкил и галоген. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R1 является пиридинилом, фуранилом, тиофенилом или пиримидинилом. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R1 является фенилом, замещнным 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-, С 1-4 галогеналкил-, галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, - OC(=O)Rb, -OC(=O)NRaRa,-OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,-S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa, -N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилОRa. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R1 является фенилом, замещнным 1, 2 или 3 заместителями из ряда групп С 1-8 алкил-, С 1-4 галогеналкил-, галоген- и-ORa; В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R2 является независимо частично замещнным или незамещнным 8-, 9-, 10- или 11-членным бициклическим кольцом,содержащим 1, 2, 3 или 4 атомов N, О и S, при этом атомы углерода кольца замещены 0, 1 или 2 оксо группами, и кольцо замещено 0, 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-, С 1-4 галогеналкил-,галоген-, циано-, нитро-, -C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb,-OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb, -S(=O)2Rb,-S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa,-N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORа. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R2 является независимо частично замещнным или незамещнным, 9-, 10- или 11-членным бициклическим кольцом,содержащим 1, 2, 3 или 4 атомов N, О и S, при этом атомы углерода кольца замещены 0, 1 или 2 оксо группами и кольцо замещено 0, 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-, С 1-4 галогеналкил-,галоген-, циано-, нитро-, -C(=O)Rb, - C(=O)ORb, -C(=O)NRaRa, -C(=NRa)NRaRa, -ORa, -OC(=O)Rb,-OC(=O)NRaRa, -OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -OC2-6 алкилORa, -SRa, -S(=O)Rb, -S(=O)2Rb,-S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa,-N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORa; В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R2 является хинолин-8-илом, бензоксазол-4-илом, бензотиазол-4-илом или хиноксалинон-5-илом, один из которых замещн 0, 1, 2 или 3 заместителями из ряда групп: С 1-8 алкил-, С 1-4 галогеналкил-, галоген-, циано-, нитро-,-C(=O)Rb, -C(=O)ORb, -C(=O)NRaRa, C(=NRa)NRaRa, -ORa, -OC(=O)Rb, -OC(=O)NRaRa,-OC(=O)N(Ra)S(=O)2Rb, -OC2-6 алкилNRaRa, -ОС 2-6 алкилORа, -SRa, -S(=O)Rb, -S(=O)2Rb,-S(=O)2NRaRa, -S(=O)2N(Ra)C(=O)Rb, -S(=O)2N(Ra)C(=O)ORb, -S(=O)2N(Ra)C(=O)NRaRa, -NRaRa,-N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алкилNRaRa и -NRaC2-6 алкилORа. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R3 является атомом Н. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R3' является ме-6 010265 тилом. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R3 и R3' оба могут быть объединены с атомом углерода, к которому они присоединены, образуя циклопропил. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R4 является атомом Н. В другом варианте, в сочетании с любым выше- или нижеприведнным вариантом, R4 является метилом. Другой аспект данного изобретения относится к методам лечения острых, воспалительных и невропатических болей, зубной боли, общей головной боли, мигрени, концентрированной головной боли,смешанных сосудистых и несосудистых синдромов, головной боли при давлении, общих воспалений,артрита, ревматических болезней, остеоартрита, воспалительных нарушений деятельности кишечника,тревожности, депрессии, воспалительных глазных нарушений, воспалительных или нестабильных нарушений деятельности мочевого пузыря, псориаза, кожных болезней с элементами воспаления, хронических воспалительных состояний, воспалительной боли и сопутствующей гипералгезии и аллодинии, невропатической боли и сопутствующей гипералгезии и аллодинии, диабетической невропатической боли,каузалгии, симпатических болей, деаффернатических синдромов, астмы, эпителиальных повреждений или дисфункций кожи, обычного герпеса, нарушений внутренней подвижности в дыхательной, генитоуринарной, пищеварительной или сосудистой областях, ран, ожогов, аллергических кожных реакций,зуда, витилиго, общих пищеварительных расстройств, гастритной язвы, язвы двенадцатиперстной кишки, диареи, гастритных поражений, вызванных некротизирующими агентами, роста волос, вазомоторного или аллергического ринита, бронхиальных расстройств или расстройств мочевого пузыря, включая этап назначения соединения, соответствующего любому из вышеописанных представлений. Другой аспект данного изобретения относится к фармацевтическим составам, содержащим соединения, соответствующие любым вышеописанным представлениям и фармацевтически приемлемые разбавители или носители. Другой аспект данного изобретения относится к использованию соединений, соответствующих любым вышеописанным представлениям, в качестве медикаментов. Другой аспект данного изобретения относится к использованию соединений, соответствующих любым вышеописанным представлениям в призводстве медикаментов для лечения острых, воспалительных и невропатических болей, зубной боли, общей головной боли, мигрени, концентрированной головной боли, смешанных сосудистых и несосудистых синдромов, головной боли при давлении, общих воспалений, артрита, ревматических болезней, остеоартрита, воспалительных нарушений деятельности кишечника, тревожности, депрессии, воспалительных глазных нарушений, воспалительных или нестабильных нарушений деятельности мочевого пузыря, псориаза, кожных болезней с элементами воспаления, хронических воспалительных состояний, воспалительной боли и сопутствующей гипералгезии и аллодинии,невропатической боли и сопутствующей гипералгезии и аллодинии, диабетической невропатической боли, каузалгии, симпатических болей, деаффернатических синдромов, астмы, эпителиальных повреждений или дисфункций кожи, обычного герпеса, нарушений внутренней подвижности в дыхательной,генитоуринарной, пищеварительной или сосудистой областях, ран, ожогов, аллергических кожных реакций, зуда, витилиго, общих пищеварительных расстройств, гастритной язвы, язвы двенадцатиперстной кишки, диареи, гастритных поражений, вызванных некротизирующими агентами, роста волос, вазомоторного или аллергического ринита, бронхиальных расстройств или расстройств мочевого пузыря. Соединения из данного изобретения могут иметь, в общем виде, несколько асимметрических центров и обычно изображаются в виде рацемических смесей. Данное изобретение включает в себя рацемические смеси, частично рацемические смеси, а также отдельные энантиомены и диастереомеры. Если не обозначено иначе, следующие определения применимы к терминам, используемым в описании и формуле."C-alkyl" означает алкильную группу, включающую минимуми максисуматомов углерода в разветвлнной, циклической или линейной взаимосвязи, или любые их комбинации, при этомиявляются целыми числами. Алкильные группы, описанные в этом разделе, могут содержать одну или две двойные или тройные связи. Примерами С 1-6 алкилов могут служить, но не ограничиваться этим, следующие:"Бензогруппа", одна или в комбинации, означает дивалентный радикал С 4 Н 4=, одно представление которого -СН=СН-СН=СН-, который будучи вицинально присоединнным к другому кольцу, образует бензол-образное кольцо, например тетрагидронафтилен, индол и подобные. Термины "оксо" и "тиоксо" обозначают группу =О (как в карбониле) и =S (как в тиокарбониле), соответственно."Гало" или "галоген" означает атом галогена из ряда F, Cl, Br и I."Cv-wгалоалкил" означает алкильную группу, как описано выше, при этом любое количество - минимум один - атомов водорода алкильной цепочки замещены на F, Cl, Br или I."Гетероцикл" означает кольцо, включающее минимум один атом углерода и по крайней мере один атом из ряда N, О и S. Примеры гетероциклов, которые могут быть найдены в формуле, включают, но не ограничиваются, следующими:"Доступные атомы азота" - это те атомы азота, которые являются частью гетероцикла и закреплены двумя одинарными связями (например, в пиперидине), оставляя внешнюю связь доступной для замещения на, напр. Н или СН 3."Фармацевтически приемлемая соль" означает соль, приготовленную общепринятыми способами,хорошо известными специалистам в данной области. "Фармакологически приемлемые соли" включают основные соли неорганических и органических кислот, включая, но не ограничиваясь, следующими: соляная кислота, бромоводородная кислота, серная кислота, фосфорная кислота, метансульфоновая кислота, этансульфоновая кислота, малоновая кислота, уксусная кислота, щавелевая кислота, винная кислота,лимонная кислота, молочная кислота, фумаровая кислота, янтарная кислота, малеиновая кислота, салициловая кислота, бензойная кислота, фенилуксусная кислота, миндальная кислота и подобные. Если соединения из данного изобретения содержат кислотную функцию, такую как карбоксигруппа, то подходящие фармацевтически приемлемые катионные пары для карбокси группы хорошо известны специалистам в данной области и включают щелочные, щелочно-земельные, аммониевые, четвертичные аммониевые катионы и подобные. Для дополнительных примеров "фармакологически приемлемых солей" see"Насыщенный или ненасыщенный" включают заместители, насыщенные атомами водорода, заместители, полностью ненасыщенные атомами водорода и заместители, частично насыщенные атомами водорода."Уходящая группа", в общем смысле, относится к группам, с лгкостью замещаемым нуклеофилами, такими как амины, тиол или спирт. Уходящие группы хорошо известны специалистам в этой области. Примеры таких уходящих групп включают, но не ограничиваются, следующими: Nгидроксисукцинимид, N-гидроксибензотриазол, галоиды, трифлаты, тозилаты, и подобные. Предпочтительные уходящие группы указаны, где это необходимо. "Защитная группа", в общем смысле, относится к группам, хорошо известным специалистам в этой области, которые используются для предотвращения-8 010265 избранных реакционных групп, каких как карбокси, амино, гидрокси, меркапто, и подобные, от вступления в нежелательные реакции - нуклеофильные, электрофильные, окисления, восстановления, и подобные. Предпочтительные защитные группы указаны, где это необходимо. Примеры защитных групп для аминогруппы включают, но не ограничиваются, следующими: аралкил, замещнный аралкил, циклоалкенил алкил и замещнный циклоалкенил алкил, аллил, замещнный аллил, ацил, алкоксикарбонил,аралкоксикарбонил, силил, и подобные. Примеры аралкилов включают, но не ограничиваются, следующими: бензил, ортометилбензил, тритил и бензгидрил, которые могут быть опционально замещнными следующими группами: алкил, алкокси, гидрокси, нитро, ациламино, ацил, и подобные, и солями, такими как фосфониевые и аммониевые соли. Примеры арильных групп включают фенил, нафтил, инданил,антраценил, 9-(9-фенилфторенил), фенантранил, дюренил, и подобные. Примеры циклоалкенил алкильных или замещнных циклоалкенил алкильных радикалов, предпочтительно состоящих из 6-10 атомов углерода, включают, но не ограничиваются, циклогексенил метил, и подобные. Подходящие ацильные,алкоксикарбонильные и аралкоксикарбонильные группы включают бензилоксикарбонил, третбутоксикарбонил, изо-бутоксикарбонил, бензоил, замещнный бензоил, бутирил, ацетил, трифторацетил,трихлороацетил, фталоил, и подобные. Смесь защитных групп может быть использована для для защиты одной и той же аминогруппы, например, первичная аминогруппа может быть защищена и аралкильной группой, и аралкоксикарбонильной группой. Аминозащитные группы могут также образовывать гетероциклическое кольцо с участием азота, к которому они присоединяются, например, 1,2 бис(метилен)бензол, фталимидил, сукцинимидил, малеимидил, и подобные, а также когда эти гетероциклические группы могут в дальнейшем включать примыкающие арильные и циклоалкильные кольца. В дополнение к этому, гетероциклические группы могут быть моно-, ди-или три-замещнными, такими как нитрофталимидил. Аминогруппы также могут быть защищены от нежелательных реакций, таких как окисление, путм образования дополнительной соли, такой как гидрохлорид, толуолсульфоновой кислоты, трифторуксусной кислоты, и подобной. Многие аминозащитные группы также подходят для защиты карбоксильных, гидроксильных и меркаптогрупп. Например, аралкильные группы. Алкильные группы являются также подходящими группами для защиты карбоксильных и меркаптогрупп, например третбутип. Силилзащитные группы, это атомы кремния, опционально замещнные одной или более алкильной,арильной или аралкильной группами. Подходящие силилзащитные группы включают, но не ограничиваются, следующими: триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил, диметилфенилсилил, 1,2-бис(диметилсилил)бензол, 1,2-бис(диметилсилил)этан и дифенилметилсилил. Силилирование аминогрупп приводит к моно-или ди-силиламиногруппам. Силилирование аминоспиртовых соединений может привести к N,N,О-трисилил производным. Снятие силильной функции с силилэфирного фрагмента с лгкостью достигается обработкой, например, гидроксидом металла или аммонийфторидными реагентами, как в форме отдельной реакционной стадии, так и in situ в ходе реакции со спиртовой группой. Подходящими силилирующими агентами являются, например, триметилсилилхлорид, трет-бутилдиметилсилилхлорид, фенилдиметилсилилхлорид, дифенилметилсилилхлорид или продукты их комбинации с имидазолом или ДМФ. Методы силилирования аминов и снятия силилзащитных групп хорошо известны специалистам в этой области. Способы приготовления этих аминопроизводных из соответствующих аминокислот, амидов аминокислот и эфиров аминокислот также хорошо знакомы специалистам в области органической химии, включающей химию амнокислот, эфиров аминокислот и аминоспиртов. Защитные группы снимаются в таких условиях, которые не затрагивают прочие оставшиеся части молекулы. Эти методы хорошо известны специалистам в этой области и включают кислотный гидролиз,гидрогенолиз, и так далее. Предпочтительным методом является снятие защитной группы, как, например, в случае снятия бензилоксикарбонильной группы гидрогенолизом с использованием палладия на угле, в подходящем растворителе, таком как спирт, уксусная кислота и их смеси. Третбутоксикарбонильная защитная группа может быть снята с использованием неорганической или органической кислоты, такой как HCl или трифторуксусная кислота, в подходящем растворителе, таком как диоксан или хлористый метилен. Образующаяся соль амина может быть легко нейтрализована с образованием свободногро амина. Карбоксильная защитная группа, такая как метил, этил, бензил, трет-бутил,4-метоксифенилметил и подобные, может быть снята в условиях гидролиза и гидрогенолиза, которые хорошо знакомы специалистам в этой области. Необходимо заметить, что соединения, описанные в данном изобретении, могут содержать такие группы, которые могут существовать в виде таутомерных форм, таких как циклические и ациклические амидиновые и гуанидиновые группы, гетероарильные группы, замещнные по гетероатому (Y' = О, S,NR), и им подобные, как проиллюстрировано следующими примерами: и если одна из форм названа, описана, изображена и/или заявлена в данной заявке, то все прочие таутомерные формы считаются включнными под этим именем, описанием, изображением и/или формулой. Пролекарства, состоящие из соединений, включнных в данное изобретение, также являются частью данного изобретения. Пролекарством является активное или неактивное соединение, химически модифицированное посредством физиологической обработки in vivo, такой как гидролиз, метаболизм и им подобные, образующее соединение, являющееся частью данного изобретения, и если это пролекарство прописывается пациенту. Способы и технологии, используемые в изготовлении и использовании пролекарств, хорошо известны специалистам в этой области. Общее обсуждение пролекарств, включая эфиры, можно найти в Svensson and Tunek Drug Metabolism Reviews 165 (1988) и Bundgaard Design of Prodrugs, Elsevier (1985). Примеры скрытого карбоксилатного аниона включают разнообразие сложных эфиров, таких как алкил (например, метил, этил), циклоалкил (например, циклогексил), аралкил (например,бензил, р-метоксибензил), и алкилкарбонилоксиалкил (например, пивалоилоксиметил). Амины могут быть скрыты в виде арилкарбонилоксиметилзамещнных производных, которые раскрываются эстеразами in vivo с образованием свободного медикамента и формальдегида (Bungaard J. Med. Chem. 2503(1989. Также, медикаменты, содержащие кислотную NH группу, такие как имидазол, имид, индол и им подобные, могут быть скрыты с помощью N-ацилоксиметильных групп (Bundgaard Design of Prodrugs,Elsevier (1985. Гидроксильные группы могут быть скрыты как сложные и простые эфиры. ЕР 039,051(Sloan and Little, 4/11/81) описывает пролекарства гидроксамовых кислот Манниха, их приготовление и использование. В описании и формуле этого изобретения встречаются перечисления объектов с использованием выражений "выбранный из рядаи " и "являетсяили " (иногда называемые группами Маркуша). В тех случаях, когда подобные выражения используются в данной заявке, то имеется в виду, если не указано иначе, включение всей группы в целом, а также каждого отдельного е члена, или любой е подгруппы. Использование подобной терминологии объясняется в основном необходимостью компактности и никоим образом не направлено на ограничение исключения отдельных элементов или подгрупп в случае необходимости. Экспериментальная часть Все использованные реагенты, если не указано иначе, были приобретены у коммерческих распространителей и использовались без дополнительной очистки. Все части являются весовыми, температура указана в градусах Цельсия, если не указано иначе. Все реакции, проводившиеся с использованием микроволн, осуществлялись с помощью Smith Synthesizer от Personal Chemistry, Uppsala, Sweden. Все вещества, для которых приведены ЯМР спектры, соответствуют своим заявленным структурам. Температура плавления определялась с помощью аппарата Buchi и приведена в некорректированном виде. Данные масс-спектров были получены методом электрораспылительной ионизации. Все продукты, приведнные в примерах, были очищены до степени чистоты 90%, что подтверждено методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Хиральное разделение по методу ВЭЖХ производилось с использованием колонки Chirobiotic TAG от Advanced Separation Technologies Inc. Если не указано иначе, все реакции проводились при комнатной температуре. Список используемых сокращений:MP-carbonate - макропористая полистиреновая анионообменная смола, которая является смолоприсоединнным эквивалентом карбоната тетраалкиламмония. ч - час мин - минута Пример 1.(а) 4-(6-Хлоро-пиримидин-4-илокси)-бензотиазол-2-иламин. В 100-мл круглодонную колбу, содержащую 4,6-дихлоро-пиримидин (9,0 г, 60 ммоль, Aldrich) и 2 аминобензотиазол-4-ол (5,0 г, 30 ммоль, CarboGen) добавили карбонат калия (4,1 г, 30 ммоль, Aldrich) и диметилсульфоксид (10 мл). Реакционную смесь нагревали при 95 С с перемешиванием в течение 4,5 ч и при комнатной температуре в течение 16 ч. Образовавшийся осадок выделили фильтрованием, промыли водой (500 мл) и дихлорометаном (500 мл), высушили in vacuo и идентифицировали в качестве целевого продукта, представляющего собой жлтый порошок.(b) N-[4-(6-Хлоро-пиримидин-4-илокси)-бензотиазол-2-ил]ацетамид. Смесь 4-(6-хлоро-пиримидин-4-илокси)-бензотиазол-2-иламина, пример 1(а), (4,0 г, 14 ммоль), толуола (10 мл) и уксусного ангидрида (4,1 мл, 43 ммоль, Aldrich) нагревали при 85 С с перемешиванием в течение 2 ч и затем перемешивали при комнатной температуре в течение 16 ч. Растворитель отогнали при пониженном давлении и образовавшийся оранжевый осадок суспендировали в дихлорометане, выделили фильтрованием, высушили в вакууме и идентифицировали в качестве целевого продукта, представляющего собой белый порошок. Т.пл.: 268-275 С. MS (ESI, pos. ion.) m/z: 321 (M+1).DMF (6 мл) и карбонат калия (2,6 г, 18,8 ммоль). Реакционную смесь нагревали при 80 С с перемешиванием в течение 1 ч, оставили достигнуть комнатной температуры и разбавили водой (100 мл). Зелный осадок отфильтровали, промыли метанолом, высушили в вакууме и идентифицировали как целевой продукт. MS (ESI, pos. ion.) m/z: 471 (M+1).(d) N-[4-(6-Пиперазин-1-ил-пиримидин-4-илокси)бензотиазол-2-ил]ацетамид. К суспензии 4-[6-(2-ацетиламино-бензотиазол-4-илокси)пиримидин-4-ил]пиперазин-1 карбоксильной кислотой трет-бутилового эфира, примера 1 (с), (0,45g, 0,96 ммоль) в дихлорометане (60 мл) добавили TFA (15 мл, 195 ммоль, Aldrich) при перемешивании при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч погасили концентрированным раствором NaHCCO3 и проэкстрагировали CH2Cl2 (2100 мл). Объединнные органические фазы высушили над Na2SO4, отфильтровали, и упарили in vacuo. Тврдый белый остаток суспендировали в МеОН, отфильтровали, высушили в вакууме и идентифицировали как целевой продукт. Т.пл.: 250,3-255,8 С. MS (ESI, pos. ion.)(е)N-[4-(6-4-[(1S,1R)-1-(2-Фторфенил)этил]пиперазин-1-илпиримидин-4-илокси)бензотиазол-2 ил]ацетамид. Раствор титан(IV) изопропоксида (0,14 мл, 4,48 ммоль, Aldrich), N-[4-(6-пиперазин-1-илпиримидин-4-илокси)бензотиазол-2-ил]ацетамида, примера l(d), (0,06 г, 0,16 ммоль), и 2'-фтороацетофенона (0,03 мл, 0,24 ммоль, Aldrich) в THF (0,6 мл) нагревали при 75 С с перемешиванием в течение 16 ч. Реакционную смесь охладили до -48 С и разбавили THF (3 мл). Добавили боргидрид натрия(0,02 г, 0,48 ммоль) и реационную смесь оставили нагреваться до комнатной температуры при перемешивании в течение 5 ч. К смеси по каплям добавили МеОН (2 мл), и водный раствор NaOH (1N, 50 мл). Продукт проэкстрагировли этилацетатом (250 мл). Объединнные экстракты высушили над Na2SO4,отфильтровали и упарили in vacuo. Остаток очистили методом колоночной хроматографии (градиент: 05% МеОН/ СН 2Cl2) и продукт идентифицировали как целевой в виде светло-жлтого порошка. Т.пл.: 202,6-204,3 С. MS (ESI, pos. ion.) m/z: 493,2 (M+1). Пример 2.(а) 4-[(1S,1R)-1-(4-Фторфенил)этил]пиперазин-1-карбоксильной кислотой трет-бутиловый эфир. К раствору пиперазин-1-карбоксильной кислотой трет-бутилового эфира (0,39 г, 2,2 ммоль, Fluka) и 4-фтороацетофенона (0,39 мл, 3,3 ммоль, Aldrich) в THF (2 мл) добавили титан(IV) изопропоксид (1,9 мл,6,6 ммоль, Aldrich) и реакционную смесь перемешивали при 75 С в течение 18 ч в атмосфере азота. Смесь охладили до -48 С, обработали NaBH(OAc)3 (1,23 г, 6,44 ммоль, Aldrich) и метанолом (1 мл) и оставили нагреваться до комнатной температуры в течение 3,5 ч. Реакционную смесь разбавили EtOАс(100 мл) и промыли водным раствором NaOH (IN, 3100 мл). Органический слой отделили, высушили над Na2SO4, отфильтровали и упарили in vacuo. Остаток очистили методом колоночной хроматографии(градиент: 0-4% МеОН/ СН 2Cl2) и продукт идентифицировали как целевой в виде жлтого масла. MS(b) 1-[(1S,1R)-1-(4-Фторфенил)этил]пиперазин. К раствору 4-[(1S,1R)-1-(4-фторофенил)этил]пиперазин-1-карбоксильной кислотой трет-бутилового эфира, примера 2(а), (0,42 г, 1,36 ммоль) в СН 2Cl2 (5 мл) по каплям добавили TFA (0,5 мл, 6,5 ммоль, Aldrich) при перемешивании при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и упарили при пониженом давлении. Остаток высушили в вакууме и идентифицировали в качастве сырого целевого продукта, который использовали в следующей стадии без дополнительной очистки.(с) N-[4-6-4-[(1S,1R)-1-(4-Фторфенил)этил]пиперазин-1-илпиримидин-4-илокси)бензотиазол-2 ил]ацетамид. К раствору 1-[(1S,1R)-1-(4-фторофенил)этил]пиперазина (сырой продукт из стадии (b), описанной выше) в DMF (4 мл) добавили N-[4-(6-хлоропиримидин-4-илокси)бензотиазол-2-ил]ацетамид, пример 1(b), (0,25 г, 0,76 ммоль) и NaHCO3 (0,42 г, 3,04 ммоль). Реакционную смесь перемешивали при 85 С в течение 5 ч, охладили до комнатной температуры и разбавили водой (20 мл). Смесь проэкстрагировали СН 2Cl2 (225 мл) и объединнные органические фазы высушили над Na2SO4, отфильтровали и упарили при пониженном давлении. Остаток очистили методом колоночной хроматографии (градиент: 0-5% МеОН/СН 2Cl2) и продукт идентифицировали как целевой в виде жлтого аморфного порошка. Т.пл.: 247,3 С. MS (ESI, pos. ion.) m/z: 493 (M+1). Дополнительные примеры Нижеследующие примеры были приготовлены из N-[4-(6-хлоропиримидин-4-илокси)бензотиазол 2-ил]ацетамида (пример 1(b по общему методу, описанному для приготовления примера 2, или с его небольшим модификациями:(а) 4-[(1S)-1-(4-Фторфенил)этил]пиперазин-1-карбоксильной кислотой трет-бутиловый эфир и 4[(1R)-1-(4-фторофенил)этил]пиперазин-1-карбоксильной кислотой трет-бутиловый эфир. Два энантиомера 4-[(1S,1R)-1-(4-фторофенил)этил]пиперазин-1-карбоксильной кислотой третбутилового эфира, пример 2 (а), (1,29 г, 4,2 ммоль) были разделены методом хиральной ВЭЖХ (100% МеОН/0,08% АсОН / 0,02% триэтил амин). Первую фракцию собрали и упарили in vacuo получив третбутиловый эфир 4-[(1S)-1-(4-фторофенил)этил]пиперазин-1-карбоксильной кислотой в виде светложлтого масла. Вторую фракцию собрали и упарили in vacuo, получив 4-[(1R)-1-(4 фторофенил)этил]пиперазин-1-карбоксильной кислотой трет-бутиловый эфир в виде светло-жлтого масла.(b) N-[4-(6-4-[(1S)-1-(4-Фторфенил)этил]пиперазин 1-ил-пиримидин-4-илокси)бензотиазол-2-ил]ацетамид. К суспензии трет-бутилового эфира 4-[1(S)-(4-фторофенил)этил]пиперазин-1-карбоксильной кислоты, пример 21(а), (0,42 г, 1,35 ммоль) в СН 2Cl2 (2 мл) добавили TFA (0,5 мл, 6,5 ммоль, Aldrich) при перемешивании при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и упарили при пониженом давлении. Остаток растворили в DMF (3 мл) и к раствору добавили N-[4-(6 хлоропиримидин-4-илокси)бензотиазол-2-ил]ацетамид, пример 1(b), (0,43 г, 1,35 ммоль) и карбонат цезия (1,3 г, 4,05 ммоль). Реакционную смесь нагревали при 85 С при перемешивании, при этом протекание реакции контролировалось методом тонкослойной хроматографии (5% МеОН/СН 2Cl2). По окончании реакции смесь охладили до комнатной температуры и разбавили водой (40 мл). Образовавшийся светло-жлтый осадок отфильтровали и высушили в вакууме. Осадок очистили методом колоночной хроматографии (градиент: 0-5% МеОН/СН 2Cl2), получив целевой продукт в виде аморфного белого порошка. Т.пл.: 243,6-245,7 С. MS (ESI, pos. ion.) m/z: 493 (M+1). Пример 22.N-[4-(6-4-[(1R)-1-(4-Фторфенил)этил]пиперазин 1-ил-пиримидин-4-илокси)бензотиазол-2 ил]ацетамид. В соответствии с методами, описанными в примере 21(b), трет-бутиловый эфир 4-[(1R)-1-(4-фторофенил)этил]пиперазин-1-карбоксильной кислоты, пример 21(b), (0,48 г, 1,6 ммоль), N-[4-(6-хлоропиримидин-4-илокси)бензотиазол-2-ил]ацетамид и пример 1(b), (0,512 г, 1,6 ммоль) привели к образованию целевого продукта в виде белого порошка. Т.пл.: 243,8-245,9 С. MS (ESI, pos. ion.) m/z: 493 (M+1). Пример 23.(а) 8-(6-Хлоропиримидин-4-илокси)хинолин-2-иламин. В 50-мл, круглодонную колбу, содержащую 4,6-дихлоропиримидин (0,5 г, 3,4 ммоль, Aldrich), 2-амино-8-гидроксихинолин (0,54 г, 3,4 ммоль, Sigma) и DMF (4 мл) добавили карбонат калия (1,9 г, 13,6 ммоль). Суспензию перемешивали в течение 5 ч в атмосфере азота при 75 С. Реакционную смесь охладили до комнатной температуры, разбавили водой (50 мл) и проэкстрагировали с помощью СН 2Cl2 (275 мл). Объединнные экстракты высушили над Na2SO4,отфильтровали и упарили in vacuo. Остаток очистили методом колоночной хроматографии (градиент: 050% EtOAc/гексан) и продукт идентифицировали как целевой в виде белого порошка. Т.пл.: 185-186 С.(b) 1-[(1R)-1-(4-Фторфенил)этил]-4-(толуол-4-сульфонил)пиперазин. Смесь N,N-бис(2-хлороэтил)-р-толуолсульфонамида (tech. 90%, 46,8 г, 158 ммоль, Lancaster) и (1R)1-(4-фторофенил)этиламин (20 г, 144 ммоль, SynQuest) в N,N-диизопропилэтиламине (50 мл) нагревали при 125 С при перемешивании в атмосфере азота в течение 18 ч. Реакционную смесь охладили ниже 100 С и 7/3 смесь EtOH/ H2O (120 мл) медленно добавили при перемешивании. Смесь оставили достичь комнатной температуры и продолжили перемешивать в течение 2,5 ч. Тврдый осадок отфильтровали и промыли Н 2 О (350 мл) и гексаном (250 мл). Осадок высушили в вакууме при 50 С в течение 18 ч и перемешивали в 1:1 смеси EtOH/Н 2 О (140 мл) в течение 75 мин. Тврдый осадок отфильтровали, промыли с помощью 1:1 смеси EtOH/ H2O (40 мл) и 7:3 смеси EtOH/Н 2 О (20 мл) и высушили в вакууме при 50 С в течение 6 ч и идентифицировали как целевой продукт в виде белого порошка. MS (ESI, pos. ion.)%, 200 мл, Aldrich) перемешивали при комнатной температуре в атмосфере азота в течение 48 ч. Медленно добавили воду (200 мл) и смесь перемешивали в течение 2 ч при комнатной температуре. Тврдый осадок отфильтровали и осадок с фильтра промыли с помощью Н 2 О (250 мл). Фильтрат и промывочную воду объединили и проэкстрагировали с помощью толуола (450 мл). Водную часть охладили на ледяной бане и по частям обработали тврдым КОН (235 г) до рН 10. Водный раствор проэкстрагировали толуолом (350 мл) и этилацетатом (50 мл). Объединнные органические экстракты промыли брайном (100 мл), высушили над MgSO4, отфильтровали и упарили при пониженном давлении. Остаток высушили в вакууме, получив целевое соединение в виде светло-коричневого порошка. MS (ESI, pos.(d) 8-(6-4-[(1R)-(4-Фторфенил)этил]пиперазин-1-илпиримидин-4-илокси)хинолин-2-иламин. К раствору 1-[(1R)-(4-фторофенил)этил]пиперазина, пример 23(с), (0,15 г, 0,72 ммоль) и 8-(6-хлоропиримидин-4-илокси)хинолин-2-иламина, пример 23(а), (0,19 г, 0,72 ммоль) в DMF (4 мл) добавили карбонат калия (0,7 г, 2,2 ммоль) и реакционную смесь нагревали при 85 С при перемешивании в атмосфере азота в течение 8 ч. Реакционную смесь оставили достигнуть комнатной температуры и разбавили водой(20 мл). Образовавшийся белый тврдый осадок отфильтровали и растворили в СH2Cl2 (20 мл). Раствор промыли водой (250 мл), высушили над Na2SO4, отфильтровали и упарили при пониженом давлении. Остаток очистили методом колоночной хроматографии (градиент: 0-5% MeOH/CH2Cl2) и перекристаллизовали в EtOAc/гексан и идентифицировали как целевой продукт в виде белого порошка. MS (ESI, pos. 8-(6-4-[(1S)-(4-Фторфенил)этил]пиперазин-1-илпиримидин-4-илокси)хинолин-2-иламин. 1-[(1S)-(4-Фторфенил)этил]пиперазин (0,15 г, 0,72 ммоль, приготовленный из (1S)-l-(4 фторофенил)этиламина (SynQuest) в соответствии с пунктами (b) и (с) примера 23), прореагировал с 8-(6 хлоропиримидин-4-илокси)хинолин-2-иламином (0,19 г, 0,72 ммоль) в условиях, аналогичных описанным в примере 23(d) и продукт реакции идентифицировали как целевой продукт в виде белого порошка. Т.пл.: 167 С. MS (ESI, pos. ion.) m/z: 445 (M+1) Пример 25.(а) 3-Метокси-2-нитрофениламин. Смесь 2-амино-3-нитрофенола (25,0 г, 162 ммоль, Aldrich) и К 2 СО 3 (27 г, 195 ммоль) в DMF (65 мл) перемешивали при комнатной температуре в течение 1 ч. Добавили метилиодид (12,2 мл, 195 ммоль, Al- 16010265drich) и реакцию перемешивали при комнатной температуре в течение 30 ч. Реакцию разбавили водой и трижды проэкстрагировали с помощью EtOAc. Объединнные органические слои высушили над Na2SO4,отфильтровали и упарили in vacuo. Тмно-красный остаток перекристаллизовали из гексана получив целевое соединение в виде оранжевых игольчатых кристаллов. MS (ESI, pos. ion) m/z: 169 (M+1).(b) 3-Метоксибензол-1,2-диамин сульфат. Смесь 3-метокси-2-нитрофениламина, пример 25 (а), (4,6 г, 27 ммоль), железного порошка (10,7 г,191 ммоль, Aldrich), EtOH (130 мл) и Н 2 О (10 мл) нагрели при 50 С. Раствор HCl (12,1 М, 1,7 мл) добавили по каплям при перемешивании. Смесь кипятили в течение 3 ч и оставили охладиться до комнатной температуры. После нейтрализации с помощью NaOH и фильтрования через Celite, растворитель упарили in vacuo и остаток проэкстрагировали в смеси CH2Cl2 и насыщенного водного раствора NaHCO3. После экстракции с помощью CH2Cl2 (3x), объединнные органические слои упарили. Остаток перерастворили в EtOH (30 мл) и обработали концентрированной H2SO4 до прекращения образования осадка. Образовавшийся осадок удалили фильтрацией, промыли EtOH и высушили в вакууме в течение 20 ч при комнатной температуре и идентифицировали как целевой продукт в виде белого порошка. MS (ESI, pos.(с) 3-Амино-8-метокси-1H-хиноксалин-2-он и 3-амино-5-метокси-1H-хиноксалин-2-он. К суспензии 3-метоксибензол-1,2-диамин сульфата, пример 25(b), (2,36 г, 10 ммоль) в EtOH (15 мл) и Н 2 О (1 мл) добавили NaHCO3 (1,68 г, 20 ммоль, JT Baker). Когда образование газа закончилось, добавили этиловый эфир этоксииминоуксусной кислотой (1,6 г, 11 ммоль, приготовленный в соответствии сJ. Chem. Soc. Perkin. Trans. 1, 1999, 1789) и смесь перемешивали при комнатной температуре в течение 16 ч. Реакцию разбавили насыщенным водным NaHCO3 и проэкстрагировали с помощью 25% iPrOH/CHCl3(5 х). Объединнные органические слои высушили над Na2SO4, отфильтровали и упарили invacuo. Очистка методом колоночной хроматографии (градиент: 0-5% МеОН/CH2Cl2) привела к получению 3-амино-8-метокси-1H-хиноксалин-2-она в виде светло-жлтого порошка [MS (ESI, pos. ion) m/z: 192 (M+1)] и 3-амино-5-метокси-1H-хиноксалин-2-она в виде светло-жлтого порошка [MS (ESI, pos. ion)(25 мл) добавили AlCl3 (0,97 г, 7,4 ммоль, Aldrich) и смесь кипятили с перемешиванием в течение 2 ч. Реакционную смесь охладили до комнатной температуры и погасили осторожным добавлением насыщенного водного NaHCO3. Образовавшуюся смесь проэкстрагировали 25% i-PrOH/CHCl3 (5 х). Объединнные органические экстракы высушили над Na2SO4, отфильтровали и упарили in vacuo с образованием коричневого порошка. MS (ESI, pos. ion) m/z: 178 (M+1).(е) 4-Хлоро-6-4-[(1S,1R)-1-(4-фторофенил)этил]пиперазин-1-илпиримидин. При реакции 1-[(1S,1R)-1-(4-фторфенил)этил]пиперазина и примера 2(b), (0,87 г, 4,2 ммоль) с 4,6 дихлоропиримидином (0,7 г, 4,6 ммоль, Aldrich) в условиях, описанных в примере 1(с), получили продукт и идентифицировали его как целевой, в виде белого порошка. MS (ESI, pos. ion.) m/z: 321 (M+1).- 17010265 Смесь 4-хлоро-6-4-[(1S,1R)-1-(4-фторофенил)этил]пиперазин-1-ил-пиримидина, пример 25(е),(0,18 г, 0,56 ммоль), 3-амино-5-гидрокси-1 Н-хиноксалин-2-она, пример 25(d), (0,10 г, 0,56 ммоль) и К 2 СО 3 (0,12 г, 0,85 ммоль, Aldrich) в DMF (5 мл) нагревали при 80 С с перемешиванием в течение 24 ч. После охлаждения до комнатной температуры, добавили Cs2CO3 (0,36 г, 1,1 ммоль, Aldrich) и смесь перемешивали при 90 С в течение 96 ч. Смесь охладили до комнатной температуры, разбавили Н 2 О и проэкстрагировали с помощью 25% i-PrOH/CHCl3 (5 х). Объединнные органические экстракы высушили над Na2SO4, отфильтровали и упарили in vacuo. Остаток очистили методом колоночной хроматографии(градиент: 0-5% (2 М NH3 в МеОН)/CH2Cl2) и продукт идентифицировали как целевой в виде белого аморфного порошка. MS (ESI, pos. ion) m/z: 462.2 (M+1). Пример 26.(а) 3-Амино-5-(6-хлоропиримидин-4-илметил)-1 Н-хиноксалин-2-он. К раствору 4,6-дихлоропиримидина (0,30 г, 2,0 ммоль, Aldrich) и 3-амино-5-гидрокси-1 Нхиноксалин-2-она, пример 25(d), (0,35 г, 2,0 ммоль) в DMF (10 мл) добавили К 2 СО 3 (0.33 г, 2.4 ммоль,Aldrich) и смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь разбавили Н 2 О и светло-жлтый тврдый осадок отфильтровали. Отфильтрованный осадок промыли Н 2 О, высушили на воздухе и идентифицировали как целевой продукт. MS (ESI, pos. ion) m/z: 290.1 (M+1).DMF (5 мл). К раствору добавили Cs2CO3 (0,38 г, 1,2 ммоль) и смесь нагревали при 85 С с перемешиванием в течение 8 ч. Реакционную смесь охладили до комнатной температуры, разбавили Н 2 О и тврдый осадок отфильтровали. Отфильтровалиный осадок промыли Н 2 О, очистили методом колоночной хроматографии (градиент: 0-5% (2 М NH3 в МеОН)/CH2Cl2) и продукт идентифицировали как целевой в виде белого порошка. Т. пл.: 292,2-293,9 С, MS (ESI, pos. ion) m/z: 462,2 (M+1). Пример 27. 3-Амино-5-(6-4-[(1S)-1-(4-фторофенил)этил]пиперазин-1-илпиримидин-4-илокси)-1H-хиноксалин-2-он. Вещество приготовлено в соответствии с процедурой, использованной в примере 26(b) путм реакции 3-амино-5-(6-хлоропиримидин-4-илметил)-1 Н-хиноксалин-2-она, пример 26(а), (0,20 г, 0,69 ммоль) с 1-[(1S)-1-(4-фторофенил)этил]пиперазином (0,14 г, 0,69 ммоль, приготовлен из (1S)-1-(4 фторофенил)этанамина (SynQuest) в соответствии с шагами (b) и (с) примера 23). Целевой продукт выделили в виде белого порошка. Т. пл.: 294,5-295,3 С, MS (ESI, pos. ion) m/z: 462,2 (M+1). Пример 28.(а) 7-(6-Хлоропиримидин-4-илокси)хинолин. Смесь 7-гидроксихинолина (0.387 г, 2.67 ммоль, Acros), 4,6-дихлоропиримидина (0,398 г, 2,67 ммоль, Aldrich) и карбоната калия (0,369 г, 2,67 ммоль, Aldrich) в DMF (3 мл) перемешивали при комнатной температуре в течение 16 ч и затем нагревали в микроволновой печи при 100 С в течение 5 мин. Реакционную смесь оставили охладиться до комнатной температуры и отфильтровали. Отфильтровалиный осадок промыли метанолом (5 мл) и фильтрат упарили при пониженном давлении. Красноватокоричневый остаток очистили методом колоночной хроматографии (градиент: 0-50% EtOAc/гексан) с получением целевого соединения в виде желтоватого аморфного порошка. MS (ESI, pos. ion.) m/z: 258(b) 7-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)хинолин. Раствор 7-(6-хлоропиримидин-4-илокси)хинолина из шага (а), описанного выше (0,045 г, 0,18 ммоль), и 1-(1-(4-фторофенил)этил)пиперазина, пример 2(b), (0.036 г, 0.17 ммоль,) в DMSO (0.5 мл) нагревали в микроволновой печи при 170 С в течение 5 мин. Реакционную смесь оставили охладиться до комнатной температуры и упарили при пониженом давлении. Остаток очистили методом препаративной ВЭЖХ [градиент: 10-90 % MeCN /(0,1% TFA в MeCN/H2O)] с образованием желаемого продукта в видеTFA соли. Соль растворили в DCM (25 мл) и нейтрализовали насыщенным раствором NaHCO3 (5 мл). Слой DCM отделили, высушили над безводным сульфатом натрия и отфильтровали. Фильтрат упарили и остаток высушили в вакууме и идентифицировали как целевой продукт в виде светло-жлтого масла. MS(0,442 г, 2,97 ммоль, Aldrich) в условиях, аналогичных описанным в примере 28(а), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 258 (M+1).(b) 5-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)изохинолин. 5-(6-Хлоропиримидин-4-илокси)изохинолин из шага (а) описанного выше (0,213 г, 0,83 ммоль) прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,175 г, 0,84 ммоль) в условиях,аналогичных описанным в примере 28(b), и продукт идентифицировали как целевой в виде белого аморфного порошка. MS (ESI, pos. ion.) m/z: 430 (M+1). Пример 30.(а) 8-(6-Хлоропиримидин-4-илокси)хинолин. 8-Гидроксихинолин (0,435 г, 3,00 ммоль, Sigma) прореагировал с 4,6-дихлоропиримидином (0,449 г,3,01 ммоль, Aldrich) в условиях, аналогичных описанным в примере 28(а), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 258 (M+1).(b) 8-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)хинолин. 8-(6-Хлоропиримидин-4-илокси)хинолин из шага (а), описанного выше (0,130 г, 0,51 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,105 г, 0,50 ммоль) в условиях, аналогичных описанным в примере 28(b), и продукт идентифицировали как целевой в виде белого масла. MS(0,.295 г, 1,98 ммоль, Aldrich) в условиях, аналогичных описанным в примере 28(а), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 258 (M+1).(b) 7-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)изохинолин. Смесь 7-(6-хлоропиримидин-4-илокси)изохинолина из шага (а), описанного выше (0,038 г, 0,15 ммоль), 1-(1-(4-фторофенил)этил)пиперазина, пример 2(b), (0,031 г, 0,15 ммоль) и диизопропилэтиламина (0,050 мл, 0,29 ммоль) в EtOH (0,75 мл) нагревали в микроволновой печи при 165 С в течение 6 мин. Реакционную смесь охладили до комнатной температуры и упарили при пониженом давлении. Остаток очистили методом препаративной ВЭЖХ [градиент: 10-90% MeCN/(0,1% TFA в MeCN H2O)] с образованием желаемого продукта в виде TFA соли. Соль растворили в DCM (25 мл) и нейтрализовали насыщенным раствором NaHCO3 (5 мл). Слой DCM отделили, высушили над безводным сульфатом натрия и отфильтровали. Фильтрат упарили и остаток высушили в вакууме и идентифицировали как целевой продукт в виде белого масла. MS (ESI, pos. ion.) m/z: 430 (M+1). Пример 32.(0,348 г, 2,34 ммоль, Aldrich) в условиях, аналогичных описанным в примере 28(а), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 258 (M+1).(b) 3-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)изохинолин. 3-(6-Хлоропиримидин-4-илокси)изохинолин из шага (а), описанного выше (0,070 г, 0,27 ммоль),прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,057 г, 0,27 ммоль) в условиях,аналогичных описанным в примере 31(b), и продукт идентифицировали как целевой в виде белого аморфного порошка. MS (ESI, pos. ion.) m/z: 430 (M+1). Пример 33. а) 4-Фтор-6-(4-(1-(4-фторофенил)этил)пиперазин-1-ил)пиримидин. К смеси 1-[(1S,1R)-1-(4-фторофенил)этил]пиперазина, пример 2(b), (0,50 г, 2,4 ммоль) и 4,6 дифторопиримидина (0,28 мл, 2,4 ммоль, ABCR) в DMF (8 мл) добавили карбонат цезия (2,3 г, 7,2 ммоль) при перемешивании при 0 С. Реакционную смесь перемешивали при 0 С в течение 20 мин, разбавили Н 2 О (20 мл) и проэкстрагировали с помощью DCM (240 мл). Объединнные органические экстракы промыли Н 2 О (240 мл), высушили над Na2SO4 и отфильтровали. Фильтрат упарили и остаток высушили в вакууме, получив целевое соединение. MS (ESI, pos. ion.) m/z: 305 (M+1)b) 2-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)хинолин. К раствору 4-фторо-6-(4-(1-(4-фторофенил)этил)пиперазин-1-ил)пиримидина из шага (а), описанного выше (0,178 г, 0,59 ммоль), и хинолин-2-ола (0,085 г, 0,59 ммоль, Aldrich) в DMSO (2,0 мл) добавили 95% гидрида натрия (0,027 г, 1,13 ммоль, Aldrich). Смесь перемешивали при комнатной температуре в течение 15 мин и затем нагревали в микроволновой печи при 170 С в течение 5 мин. Реакционную смесь оставили охладиться до комнатной температуры и упарили при пониженом давлении. Остаток очистили методом препаративной ВЭЖХ [градиент: 10-90% MeCN /(0,1% TFA в MeCN/Н 2 О)] с образованием желаемого продукта в виде TFA соли. Соль растворили в DCM (25 мл) и нейтрализовали насыщенным раствором NaHCO3 (5 мл). Слой DCM отделили, высушили над безводным сульфатом натрия и отфильтровали. Фильтрат упарили и остаток высушили в вакууме и идентифицировали как целевой продукт в виде белого масла. MS (ESI, pos. ion.) m/z: 430 (M+1).(а) 4-(6-Хлоропиримидин-4-илокси)хинолин. Смесь 4-гидроксихинолина (0,435 г, 2,99 ммоль, Aldrich), 4,6-дихлоропиримидина (0,453 г, 3,04 ммоль, Aldrich) и МР-карбонатной смолы (0,369 г, 2,67 ммоль, 2,73 ммоль/г, Argonaut) в NMP (2,5 мл) перемешивали при комнатной температуре в течение 2 ч и затем нагревали в микроволновой печи при 100 С в течение 5 мин. Реакционную смесь охладили до комнатной температуры и смолу удалили фильтрацией. Отфильтровалиный осадок промыли метанолом (10 мл) и объединнные фильтраты упарили при пониженном давлении. Красновато-коричневый остаток очистили методом колоночной хроматографии (градиент: 0-5% MeOH/DCM) с получением целевого соединения в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 258 (M+1).(b) 4-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)хинолин. 4-(6-Хлоропиримидин-4-илокси)хинолин из шага (а), описанного выше (0,060 г, 0,23 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,049 г, 0,24 ммоль) в условиях, аналогичных описанным в примере 31(b), и продукт идентифицировали как целевой в виде белого масла. MS(а) 2,3-Дигидробензо[b][1,4]диоксин-6-ил ацетат. Раствор 1-(2,3-дигидробензо[b][1,4]диоксин-6-ил)этанона (1,548 г, 8,69 ммоль, Aldrich) и 3 хлоропероксибензойной кислотой (4,35 г, 19,41 ммоль, 77 вес.%, Aldrich) в DCM (55 мл) нагревали при 65 С в течение 17,5 ч на масляной бане. Реакционную смесь оставили охладиться до комнатной температуры и разбавили DCM (150 мл) и водой (50 мл). Слой DCM отделили, промыли насыщенным растворомNaHCO3 (100 мл) и брайном (25 мл), высушили над безводным сульфатом натрия и отфильтровали. Фильтрат упарили и остаток высушили в вакууме и идентифицировали как целевой продукт в виде аморфного порошка. MS (ESI, pos. ion.) m/z: 195 (M+1).(b) 2,3-Дигидробензо[b][1,4]диоксин-6-ол. Раствор 2,3-дигидробензо[b][1,4]диоксин-6-ил ацетата из шага (а), описанного выше (1,65 г, 10,84 ммоль, Aldrich) в МеОН (80 мл), перемешивали с 2,5 N NaOH (120 мл) при комнатной температуре в течение 21 ч. The МеОН упарили при пониженом давлении и остаток разбавили EtOAc (200 мл). СлойEtOAc отделили, высушили над безводным сульфатом натрия и отфильтровали. Фильтрат упарили и остаток высушили в вакууме с образованием красновато-коричневого порошка. Порошок суспендировали в МеОН (10 мл) и отфильтровали. Отфильтрованный осадок высушили в вакууме и идентифицировали как целевой продукт в виде аморфного порошка. MS (ESI, pos. ion.) m/z: 153 (M+1).(с) 4-Хлоро-6-(2,3-дигидробензо[b][1,4]диоксин-6-илокси)пиримидин. Смесь 2,3-дигидробензо[b][1,4]диоксин-6-ола из шага (b), описанного выше (0,500 г, 3,29 ммоль),4,6-дихлоропиримидина (0,417 г, 2,80 ммоль, Aldrich) и МР-карбонатной смолы (1,41 г, 4,09 ммоль, 2,9 ммоль/г, Argonaut) в NMP (3.0 мл) перемешивали при комнатной температуре в течение 2 ч и затем нагревали в микроволновой печи при 110 С в течение 6 мин. Реакционную смесь охладили до комнатной температуры и смолу удалили фильтрацией. Отфильтрованный осадок промыли метанолом (10 мл) и фильтрат упарили при пониженом давлении. Красновато-коричневый остаток очистили методом колоночной хроматографии на силикагеле (градиент: 0-5% MeOH/DCM) с получением целевого соединения в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 265 (M+1).(0,156 г, 0,59 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,123 г, 0,59 ммоль) в условиях, аналогичных описанным в примере 31(b), и продукт идентифицировали как целевой в виде белого масла. MS (ESI, pos. ion.) m/z: 437 (М+1). Пример 36.(а) 3-Оксо-3,4-дигидро-2 Н-бензо[b][1,4]оксазин-6-ил ацетат. 6-Ацетил-2 Н-бензо[b][1,4]оксазин-3(4 Н)-он (1,133 г, 5,93 ммоль, Aldrich) обработали 3 хлоропероксибензойной кислотой (3,15 г, 14,06 ммоль, 77 вес.%, Aldrich) в условиях, аналогичных описанным в примере 35(а), и продукт идентифицировали как целевой в виде аморфного порошка. MS (ESI,pos. ion.) m/z: 208 (M+1).(b) 6-Гидрокси-2 Н-бензо[b][1,4]оксазин-3(4 Н)-он. 3-Оксо-3,4-дигидро-2 Н-бензо[b][1,4]оксазин-6-ил ацетат из шага (а), описанного выше (1,21 г, 5,84 ммоль, Aldrich) в МеОН (80 мл) прореагировал с 2,5 N NaOH (120 мл) в условиях, аналогичных описанным в примере 35(b), и продукт идентифицировали как целевой в виде аморфного порошка. MS (ESI,pos. ion.) m/z: 166 (M+1).(с) 6-(6-Хлоропиримидин-4-илокси)-2 Н-бензо[b][1,4]оксазин-3(4 Н)-он. 6-Гидрокси-2H-бензо[b][1,4]оксазин-3(4 Н)-он из шага (b), описанного выше (0,325 г, 1,97 ммоль),прореагировал с 4,6-дихлоропиримидином (0,264 г, 1,77 ммоль, Aldrich) в условиях, аналогичных описанным в примере 35(с), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 278 (M+1).(0,085 г, 0,31 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,067 г, 0,32 ммоль) в условиях, аналогичных описанным в примере 31(b), и продукт идентифицировали как целевой в виде белого масла. MS (ESI, pos. ion.) m/z: 450 (M+1). Пример 37.(а) 5-(6-Хлоропиримидин-4-илокси)хинолин. 5-Гидроксихинолин (0,292 г, 2,01 ммоль, Aldrich) прореагировал с 4,6-дихлоропиримидином (0,3 г,2,01 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 258 (M+1).(b) 5-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)хинолин. Смесь 5-(6-хлоропиримидин-4-илокси)хинолина из шага (а), описанного выше (0,130 г, 0,51 ммоль),1-(1-(4-фторофенил)этил)пиперазин, пример 2(b), (0,107 г, 0,51 ммоль) и PS-ДИЕА смолу (0,40 г, 1,49 ммоль, 3,72 ммоль/г, Argonaut), перемешивали в EtOH (4,0 мл) при комнатной температуре в течение 2 ч и затем нагревали в микроволновой печи при 160 С в течение 6 мин. Реакционную смесь оставили охладиться до комнатной температуры и смолу удалили фильтрацией. Смолу промыли метанолом (10 мл) и объединнные фильтраты упарили при пониженом давлении. Смолистый остаток растворили в МеОН(2,5 мл) и очистили методом препаративной ВЭЖХ [градиент: 10-90% MeCN /(0,1% TFA в MeCN/ Н 2 О)] с образованием желаемого продукта в виде TFA соли. Соль растворили в DCM (25 мл) и нейтрализовали насыщенным раствором NaHCO3 (5 мл). Слой DCM отделили, высушили над безводным сульфатом натрия, и отфильтровали. Фильтрат упарили и остаток высушили в вакууме и идентифицировали как целевой продукт в виде белого масла. MS (ESI, pos. ion.) m/z: 430 (M+1). Пример 38.(а) 6-(6-Хлоропиримидин-4-илокси)изохинолин. 6-Гидроксиизохинолин (0,294 г, 2,03 ммоль, JW Pharma Lab) прореагировал с 4,6 дихлоропиримидином (0,302 г, 2,03 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а),и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.)(b) 6-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)изохинолин. 6-(6-Хлоропиримидин-4-илокси)изохинолин из шага (а), описанного выше (0,136 г, 0,53 ммоль),прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0.112 г, 0.54 ммоль) в условиях,аналогичных описанным в примере 37(b). Сырой продукт очистили методом препаративной ВЭЖХ [градиент 10-90% MeCN (0,1% TFA) H2O (0,1% TFA)] и идентифицировали как целевой продукт в виде белого масла. MS (ESI, pos. ion.) m/z: 430 (M+1). Пример 39.(а) 6-(6-Хлоропиримидин-4-илокси)-3,4-дигидро-2 Н-бензо[b][1,4]оксазин. 3,4-Дигидро-2 Н-бензо[b][1,4]оксазин-6-ол (0,152 г, 1,01 ммоль, Matrix) прореагировал с 4,6 дихлоропиримидином (0,15 г, 1,01 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а) и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.)(b) 6-(6-(4-(l-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)-3,4-дигидро-2 Нбензо[b][1,4]оксазин. 6-(6-Хлоропиримидин-4-илокси)-3,4-дигидро-2 Н-бензо[b][1,4]оксазин из шага (а), описанного выше (0,043 г, 0,17 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,040 г,0,19 ммоль) в условиях, аналогичных описанным в примере 31(b), и продукт идентифицировали как целевой в виде аморфного белого порошка. MS (ESI, pos. ion.) m/z: 436 (М+1). Пример 40.(0,449 г, 3,01 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 258 (M+1).(b) 4-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)изохинолин. 4-(6-Хлоропиримидин-4-илокси)изохинолин из шага (а) описанного выше (0,162 г, 0,63 ммоль) прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,135 г, 0,65 ммоль) в условиях,аналогичных описанным в примере 31(b), и продукт идентифицировали как целевой в виде аморфного белого порошка. MS (ESI, pos. ion.) m/z: 430 (M+1). Пример 41.(а) 2,3-Дигидробензо[b][1,4]диоксин-5-ол. Смесь бензол-1,2,3-триола (4,39 г, 34,81 ммоль, Aldrich), 1,2-дибромэтана (1 мл, 11,6 ммоль,Aldrich) и карбоната калия (1,60 г, 11,58 ммоль, Aldrich) в 2-бутаноне (300 мл, Aldrich) нагревали до кипячения в течение 18,5 ч при перемешивании на масляной бане. Реакционную смесь охладили до комнатной температуры и разбавили DCM (100 мл) и водой (50 мл). Слой DCM отделили, промыли 10% водным раствором Na2S2O3 (50 мл) и брайном (100 мл), высушили над безводным сульфатом натрия, отфильтровали и упарили. Остаток очистили методом колоночной хроматографии (градиент: 0-5%MeOH/DCM) и продукт идентифицировали как целевой в виде аморфного порошка. MS (ESI, pos. ion.)(b) 4-Хлоро-6-(2,3-дигидробензо[b][1,4]диоксин-5-илокси)пиримидин. 2,3-Дигидробензо[b][1,4]диоксин-5-ол из шага (а), описанного выше (0,247 г, 1,62 ммоль) прореагировал с 4,6-дихлоропиримидином (0,232 г, 1,56 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS(0,234 г, 0,88 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,185 г, 0,89 ммоль) в условиях, аналогичных описанным в примере 31(b), и продукт идентифицировали как целевой в виде аморфного белого порошка. MS (ESI, pos. ion.) m/z: 437 (M+1). Пример 42.(а) 6-(6-Хлоропиримидин-4-илокси)хинолин. 6-Гидроксихинолин (0,432 г, 2,98 ммоль, Aldrich) прореагировал с 4,6-дихлоропиримидином (0,445 г, 2,99 ммоль, Aldrich) в условиях, аналогичных описанным в примере 28(а), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 258 (M+1).(b) 6-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)хинолин. 6-(6-Хлоропиримидин-4-илокси)хинолин из шага (а), описанного выше (0,135 г, 0,52 ммоль), про- 24010265 реагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,109 г, 0,52 ммоль) в условиях, аналогичных описанным в примере 28(b), и продукт идентифицировали как целевой в виде белого аморфного порошка. MS (ESI, pos. ion.) m/z: 430 (M+1). Пример 43.(а) 5-(6-Хлоропиримидин-4-илокси)-3,4-дигидроизохинолин-1(2 Н)-он. 5-Гидрокси-3,4-дигидроизохинолин-1(2 Н)-он (0,274 г, 1,68 ммоль, Chempacific) прореагировал с 4,6-дихлоропиримидином (0,251 г, 1,69 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI,pos. ion.) m/z: 276 (M+1).(0,214 г, 0,78 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,162 г, 0,78 ммоль) в условиях, аналогичных описанным в примере 37(b), и продукт идентифицировали как целевой в виде белого масла. MS (ESI, pos. ion.) m/z: 448 (M+1). Пример 44.(а) 4-Гидрокси-1 Н-бензо[d]имидазол-2(3 Н)-он. К суспензии 2,3-диаминофенола (1,24 г, 10 ммоль, Aldrich) в THF (25 мл) добавили карбонилдиимидазол (1,62 г, 10 ммоль, Aldrich). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч и упарили in vacuo. Масляный остаток суспендировали в МеОН и тврдый осадок отфильтровали. Отфильтрованный осадок высушили в вакууме и идентифицировали как целевой продукт. MS(b)4-(6-Хлоропиримидин-4-илокси)-1 Н-бензо[d]имидазол-2(3 Н)-он. 4-Гидрокси-1 Н-бензо[d]имидазол-2(3 Н)-он из шага (а), описанного выше (150 мг, 1 ммоль), прореагировал с 4,6-дихлоропиримидином (149 мг, 1 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой. MS (ESI, pos. ion.) m/z: 263 (M+1).(c) 4-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)-1 Н-бензо[d]имидазол 2(3 Н)-он. 4-(6-Хлоропиримидин-4 илокси)-1 Н-бензо[d]имидазол-2(3 Н)-он из шага (b), описанного выше (45 мг, 0,17 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (42 мг, 0,2 ммоль) в условиях, аналогичных описанным в примере 28(b), и продукт идентифицировали как целевой в виде белого аморфного порошка. MS (ESI, pos. ion.) m/z: 435,2 (M+1). Пример 45.(а) 2-Метил-1 Н-бензо[d]имидазол-4-ол. Смесь 2,3-диаминофенола (620 мг, 5 ммоль, Aldrich) и ледяной уксусной кислоты (5 мл) нагревали в- 25010265 микроволновой печи при 200 С в течение 5 мин. Реакционную смесь охладили до комнатной температуры и упарили in vacuo и идентифицировали как целевой продукт в виде чрного масла. MS (ESI, pos. ion.)(b) 4-(6-Хлоропиримидин-4-илокси)-2-метил-1 Н-бензо[d]имидазол. 2-Метил-1H-бензо[d]имидазол-4-ол из шага (а), описанного выше (148 мг, 1 ммоль), прореагировал с 4,6-дихлоропиримидином (148 мг, 1 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде жлтого аморфного порошка. MS (ESI, pos. ion.)(с) 4-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)-2-метил-1 Н-бензо[d]имидазол. 4-(6-Хлоропиримидин-4-илокси)-2-метил-1 Н-бензо[d]имидазол из шага (b), описанного выше (30 мг, 0.12 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (0,15 ммоль) в условиях, аналогичных описанным в примере 37(b), и продукт идентифицировали как целевой в виде масла. MS (ESI, pos. ion.) m/z: 433,2 (M+1). Пример 46.(а) 7-(6-Хлоропиримидин-4-илокси)-1 Н-индол. 7-Гидроксииндол (400 мг, 3 ммоль, Synchem) прореагировал с 4,6-дихлоропиримидином (450 мг, 3 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде белого порошка. MS (ESI, pos. ion.) m/z: 246,1 (M+1).(b) 7-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)-1 Н-индол. 7-(6-Хлоропиримидин-4-илокси)-1 Н-индол из шага (а), описанного выше (95 мг, 0,39 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (85 мг, 0,4 ммоль) в условиях, аналогичных описанным в примере 37(b), и продукт идентифицировали как целевой в виде бесцветного порошка. MS (ESI, pos. ion.) m/z: 418,2 (M+1). Пример 47.(а) 6-(6-Хлоропиримидин-4-илокси)-1 Н-индол. 6-Гидроксииндол (266 мг, 2 ммоль, Peakdale) прореагировал с 4,6-дихлоропиримидином (298 мг, 2 ммоль, Aldrich) в условиях, аналогичных описанным в примере 28(а), и продукт идентифицировали как целевой в виде бесцветного масла. MS (ESI, pos. ion.) m/z: 246,2 (M+1).(b) 5-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)-1 Н-индол. 6-(6-Хлоропиримидин-4-илокси)-1 Н-индол из шага (а), описанного выше (123 мг, 0,5 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (104 мг, 0.5 ммоль) в условиях, аналогичных описанным в примере 28(b), и продукт идентифицировали как целевой в виде белого порошка.(а) 8-(6-Хлоропиримидин-4-илокси)Н-имидазо[1,2-а]пиридин. Имидазо[1,2-а]пиридин-8-ол (67 мг, 0,5 ммоль) приготовлен, как описано в WO 2004/014871, прореагировал с 4,6-дихлоропиримидином (75 мг, 0,5 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде бесцветной плнки. MS (ESI, pos. ion.)(b) 8-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)Н-имидазо[1,2-а]пиридин. 8-(6-Хлоропиримидин-4-илокси)Н-имидазо[1,2-а]пиридин из шага (а), описанного выше (25 мг, 0,1 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (25 мг, 0,12 ммоль) в условиях, аналогичных описанным в примере 37(b), и продукт идентифицировали как целевой в виде жлтой плнки. MS (ESI, pos. ion.) m/z: 419,3 (M+1). Пример 49.(а)4-(6-Хлоропиримидин-4-илокси)-1 Н-индол. 4-Гидроксииндол (133 мг, 1 ммоль, Aldrich) прореагировал с 4,6-дихлоропиримидином (185 мг, 1,25 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде жлтого порошка. MS (ESI, pos. ion.) m/z: 246 (M+1).(b) 4-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)-1 Н-индол. 4-(6-Хлоропиримидин-4-илокси)-1H-индол из шага (а), описанного выше (200 мг, 0.8 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (167 мг, 0,8 ммоль) в условиях, аналогичных описанным в примере 28(b), с образованием 105 мг (32%) целевого соединения в виде белого аморфного порошка. MS (ESI, pos. ion.) m/z: 418,2 (M+1). Пример 50.(а) 5-Гидрокси-1 Н-бензо[d]имидазол-2(3 Н)-он. К 5-метокси-1 Н-бензо[d]имидазол-2(3 Н)-ону (164 мг, 1 ммоль, Lancaster) в DCM (2 мл) добавили 1 М раствора трихлорида алюминия в нитробензоле (1 мл, 1 ммоль, Aldrich). Реакционную смесь перемешивали при комнатной температуре в течение 4 дней и упарили in vacno. Остаток отфильтровали через Celite, и отфильтрованный осадок промыли DCM. Промывочный DCM удалили и отфильтрованный осадок промыли МеОН. Тмно-коричневый промывочный МеОН упарили при пониженом давлении. Остаток очистили методом колоночной хроматографии (градиент: 5-20% МеОН/CH2Cl2) и продукт идентифицировали как целевой в виде светло-жлтого порошка. MS (ESI, pos. ion.) m/z: 151 (M+1).(b) 5-(6-Хлоропиримидин-4-илокси)-1 Н-бензо[d]имидазол-2(3 Н)-он. 5-Гидрокси-1H-бензо[d]имидазол-2(3 Н)-он из шага (а) описанного выше (100 мг, 0,66 ммоль), прореагировав с 4,6-дихлоропиримидином (105 мг, 0,7 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде плнки. MS (ESI, pos. ion.) m/z: 263(с) 5-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)-1 Н-бензо[d]имидазол 2(3 Н)-он. 5-(6-Хлоропиримидин-4-илокси)-1 Н-бензо[d]имидазол-2(3 Н)-он из шага (b), описанного выше (95 мг, 0,37 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (80 мг, 0.38 ммоль) в условиях, аналогичных описанным в примере 28(b), и продукт идентифицировали как целевой в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 435,2 (M+1). Пример 51.(а) 5-(6-Хлоропиримидин-4-илокси)-3,3-диметилиндолин-2-он. 5-Гидрокси-3,3-диметилиндолин-2-он (177 мг, 1 ммоль, RinTech) прореагировал с 4,6 дихлоропиримидином (149 мг, 1 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде масла. MS (ESI, pos. ion.) m/z: 290 (M+1).(b) 5-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)-3,3-диметилиндолин-2-он. 5-(6-Хлоропиримидин-4-илокси)-3,3-диметилиндолин-2-он из шага (а), описанного выше (56 мг, 0,2 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (40 мг, 0.19 ммоль) в условиях, аналогичных описанным в примере 28(b), и продукт идентифицировали как целевой в виде бесцветного порошка. MS (ESI, pos. ion.) m/z: 462,2 (M+1). Пример 52.(а) 4-(6-Хлоропиримидин-4-илокси)бензо[d]тиазол-2-амин. 2-Аминобензо[d]тиазол-4-ол (166 мг, 1 ммоль, Carbogen) прореагировал с 4,6 дихлоропиримидином, (150 мг, 1 ммоль, Aldrich) в условиях, аналогичных описанным в примере 34(а), и продукт идентифицировали как целевой в виде белого порошка. MS (ESI, pos. ion.) m/z: 279 (M+1).(b) 4-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)бензо[d]тиазол-2-амин. 4-(6-Хлоропиримидин-4-илокси)бензо[d]тиазол-2-амина из шага (а), описанного выше (150 мг, 0,54 ммоль), прореагировал с 1-(1-(4-фторофенил)этил)пиперазином, пример 2(b), (115 мг, 0.55 ммоль) в условиях, аналогичных описанным в примере 28(b), и продукт идентифицировали как целевой в виде аморфного порошка. MS (ESI, pos. ion.) m/z: 451,2 (M+1). Пример 53.(а) 2-Гидрокси-6-(2-метокси-2-оксоэтил)бензойная кислота. К раствору 3-гидроксигомофталиевой кислоты (4,5 г, 23 ммоль, Apin) в МеОН (100 мл) добавили по каплям ацетилхлорид (10 мл, 9.1 г, 115 ммоль, Aldrich) при перемешивании при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и растворитель упарили при пониженном давлении с получением целевого соединения в виде белого порошка. 1 Н NMR (400 MHz, DMSO-d6)ppm: 3,57 (s, 3H), 3,84 (s, 2H), 6,78 (d, J=7,43 Hz, 1H), 6,86 (d, J=8,22(b) 8-Гидрокси-1 Н-изохромен-3(4 Н)-он. К раствору 2-гидрокси-6-(2-метокси-2-оксоэтил)бензойной кислоты из шага (а), описанного выше(4,2 г, 20 ммоль) в безводном THF (10 мл), добавили по каплям раствор боран-метил сульфидного комплекса в THF (25 мл, 50 ммоль, 2,0 М, Aldrich) при перемешивании при комнатной температуре в атмосфере N2. Реакционную смесь перемешивали при кипячении в течение 3,5 ч, оставили охладиться до 25 С и погасили медленным добавлением 5N HCl (20 мл). После окончания добавления смесь перемешивали при кипячении в течение 10 мин и оставили охладиться до 25 С. Смесь упарили in vacuo до объма-50 мл, разбавили водой (200 мл) и проэкстрагировали с помощью EtOAc (2200 мл). Объединнные органические экстракты промыли насыщенным раствором NaCl (100 мл), высушили над Na2SO4, отфильтровали и упарили in vacuo с получением белого порошка. Порошок очистили хроматографией на силикагеле (градиент: 15-50% EtOAc в гексане) с получением целевого продукта в виде белого порошка. 1 Н NMR (400 MHz, DMSO-d6)ppm: 3,52 (s, 2H), 5,11 (s, 2H), 6,54 (d, J=7,43 Hz, 1H), 6,57 (d, J=8,22Chymotrypsin. Methods Enzym, 1917(46), 216-220]. Смесь 8-гидрокси-1 Н-изохромен-3(4 Н)-она из шага (b), описанного выше (1,0 г, 6,1 ммоль) и мочевины (2,2 г, 37 ммоль, Aldrich), нагревали при 200 С на масляной бане с перемешиванием в течение 30 мин. Реакционную смесь оставили охладиться до 25 С, обработали 1N HCl (50 мл) и DCM (50 мл) и перемешивали в течение 5 ч для получения суспензии. Суспензию отфильтровали и отфильтрованный осадок промыли 1N HCl (50 мл), водой (50 мл), и DCM (50 мл). Объединили промывочный DCM и фильтрат, промыли насыщенным раствором NaCl (30 мл) и упарили при пониженом давлении. Остаток высушили в вакууме с получением целевого продукта в виде коричневого порошка. 1 Н NMR (400 MHz, DMSO-d6)ppm: 3,36 (s, 2 H), 4,23 (s, 2 H), 6,61 (d, J=7,43 Hz, 1H), 6,68 (d,J=7,82 Hz, 1H), 7,03 (t, J =7,83 Hz, 1H), 7,92 (s, 1H), 9,66 (s, 1H).(S)-8-(6-(4-(1-(4-Фторфенил)этил)пиперазин-1-ил)пиримидин-4-илокси)-1,2-дигидроизохинолин-3(4 Н)-он гидрохлорид. Раствор 8-гидрокси-1,2-дигидроизохинолин-3(4 Н)-она из шага (с), описанного выше (200 мг, 1,2 ммоль) в безводном DMF (5 мл), продули N2 и обработали гранулярным К 2 СО 3 (1 г, 7,2 ммоль, Aldrich) и 4,6-дифторопиримидином (140 мг, 1,2 ммоль, ABCR). Реакционную смесь перемешивали при 25 С в течение 1 ч. Затем добавили 1-[(1-S)-1-(4-фторфенил)этил]пиперазин, (200 мг, 0,96 ммоль, приготовлен как описано в примере 27) и смесь нагревали при 50 С с перемешиванием в течение 30 мин. Реакционную смесь оставили достигнуть комнатной температуры и разбавили EtOAc (100 мл). Раствор EtOAc декантировали с порошка К 2 СО 3, промыли насыщенным раствором NaHCO3 (50 мл), водой (50 мл), насыщенным NaCl (50 мл), высушили над Na2SO4 и отфильтровали. Фильтрат упарили in vacuo и остаток очистили методом колоночной хроматографии (градиент: 1-10% MeOH/EtOAc) с образованием чистого продукта в виде тврдого вещества. Порошок растворили в EtOAc (50 мл) и МеОН (5 мл) и обработали 1N HCl вEt2O (20 мл, Aldrich). Смесь упарили при пониженом давлении и остаток высушили в вакууме с получением целевого соединения в виде светло-жлтого аморфного порошка. MS (ESI, pos. ion.) m/z: 448 (M+1).(а) 3-Метоксибензол-1,2-диамин дигидрохлорид. Смесь 3-метокси-2-нитрофениламина, пример 25 (а), (18,0 г, 107 ммоль), палладия на угле (10 вес.%, 1,8 г, 1,7 ммоль, Aldrich) и МеОН (130 мл) перемешивали в атмосфере Н 2 в течение 40 ч. Смесь отфильтровали через Celite и фильтрат упарили in vacuo. Остаток растворили в Et2O и обработали 1 МHCl в Et2O (230 мл, 230 ммоль, Aldrich). Вещество выделили фильтрованием и промыли Et2O. Вещество с фильтра отделили и высушили в вакууме и идентифицировали как целевой продукт в виде светлорозового порошка. MS (ESI, pos. ion.) m/z: 139 (M-HCl2-).(b) 8-Метокси-1 Н-хиноксалин-2-он и 5-метокси-1 Н-хиноксалин-2-он. Раствор 3-метоксибензол-1,2-диамин дигидрохлорида из шага (а), описанного выше (5,28 г, 25 ммоль), в EtOH (30 мл) и Н 2 О (70 мл) нейтрализовали осторожным добавлением тврдого NaHCO3. Добавили раствор этилглиоксилата (50% в толуол, 5,45 мл, 27,5 ммоль, Fluka) и смесь перемешивали при комнатной температуре в течение 24 ч. Смесь разбавили насыщенным водным раствором NH4Cl и проэкстрагировали с помощью 25% /-PrOH/CHCl3 (4 х). Объединнные органические экстракы высушили надNa2SO4, отфильтровали и упарили in vacuo. Очистка остатка методом колоночной хроматографии (градиент: 0-2,5% 2 М NH3 в MeOH/CH2Cl2) привела к получению 8-метокси-1H-хиноксалин-2-она в виде белого порошка [MS (ESI, pos. ion) m/z: 177 (M+1)] и 5-метокси-1 Н-хиноксалин-2-она в виде белого порошка(100 мл, 1073 ммоль, Aldrich) нагревали при 105 С в течение 4 ч. Реакционную смесь оставили охладиться до комнатной температуры и упарили in vacuo. Остаток поместили в смесь насыщенного водного раствора NaHCO3 и CH2Cl2 и перемешивали в течение 3 ч. Слой CH2Cl2 отделили и водную фазу проэкстрагировали CH2Cl2 (3 х). Экстракты CH2Cl2 объединили, высушили над Na2SO4 и отфильтровали через силикагель. Отфильтровалиный осадок промыли EtOAc и фильтраты объединили. Упаривание растворителей привело к тврдому остатку, который высушили в вакууме с получением целевого соединения. MS(d) 8-Метоксихиноксалин-2-иламин. Смесь 2-хлоро-8-метоксихиноксалина из шага (с), описанного выше (5,75 г, 29,5 ммоль), концентрированного NH4OH (30 мл, Baker) и EtOH (3 мл) нагревали до 110 С в реакторе высокого давления в течение 28 ч. Реакционную смесь охладили до комнатной температуры и разбавили Н 2 О. Тврдый осадок отфильтровали и промыли Н 2 О. Вещество с фильтра очистили на короткой колонке силикагеля, используя в качестве элюентов 1% MeOH/CH2Cl2 (500 мл) и 10% MeOH/CH2Cl2 (500 мл). Вторую фракцию отделили и упарили in vacuo. Порошок остатка перекристаллизовали из МеОН и идентифицировали как целевой продукт. MS (ESI, pos. ion.) m/z: 176 (M+1).(150 мл), обработали BBr3 (4,05 мл, 43 ммоль, Aldrich) и нагревали до 44 С в течение 6 дней. Смесь оставили охладиться до комнатной температуры, погасили насыщенным водным раствором NaHCO3 и проэкстрагировали с помощью 25% i-PrOH/CHCl3 (5 х). Объединнные органические экстракы высушили надNa2SO4, отфильтровали и упарили. Остаток высушили в вакууме и идентифицировали как целевой продукт. MS (ESI, pos. ion.) m/z: 162 (M+1).
МПК / Метки
МПК: C07D 413/12, C07D 405/12, C07D 401/12, A61K 31/506, C07D 417/14, C07D 471/04, C07D 417/12, A61P 29/00, C07D 403/12
Метки: терапии, рецепторов, лигандов, применение, производные, пиримидина, ваниллоидных, боли, использования, качестве
Код ссылки
<a href="https://eas.patents.su/30-10265-proizvodnye-pirimidina-dlya-ispolzovaniya-v-kachestve-ligandov-vanilloidnyh-receptorov-i-ih-primenenie-dlya-terapii-boli.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиримидина для использования в качестве лигандов ваниллоидных рецепторов и их применение для терапии боли</a>
Предыдущий патент: Гетероциклокарбоксамидные производные
Следующий патент: Субмикронные композиции, содержащие мезотрион
Случайный патент: Переворачиваемый инструмент для сельскохозяйственных чизель-культиваторов и тому подобного












