Производные имидазопиримидина в качестве лигандов для гамк рецепторов
Номер патента: 6234
Опубликовано: 27.10.2005
Авторы: Гудэйкр Саймон Чарльз, Мур Кевин Уилльям, Стрит Лесли Джозеф, Чемберс Марк Стюарт, Дженнингз Эндрю, Секереш Хелен Джейн, Льюис Ричард Томас, Джоунс Филип, Хэллетт Дэвид Джеймс
Формула / Реферат
1. Соединение формулы IIA или его фармацевтически приемлемая соль
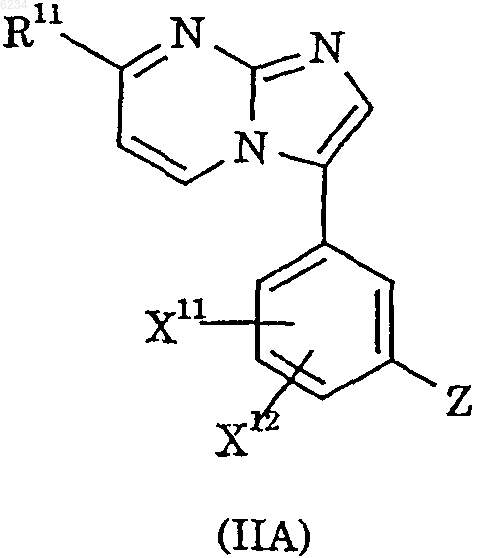
где X11 обозначает фтор;
X12 обозначает водород или фтор;
Z обозначает арильную или гетероарильную группу, любая из которых может быть необязательно замещена одним или более заместителями, выбранными из галогена и циано;
R11 обозначает водород, C1-6алкил, галоген(C1-6)алкил, дигалоген(C1-6)алкил, гидрокси(C1-6)алкил, дигидрокси(C1-6)алкил, C1-6алкокси(C1-6)алкил, ди(C1-6)алкокси(C1-6)алкил, циано(C1-6)алкил, C2-6алкоксикарбонил(C1-6)алкил, гетероарил, C1-6алкилгетероарил, гетероарил(C1-6)алкил, галоген, циано, трифторметил, формил, C2-6алкилкарбонил, C2-6алкоксикарбонил или -CR5=NOR6;
R5 обозначает водород или C1-6алкил; и
R6 обозначает водород, C1-6алкил, гидрокси(C1-6)алкил или ди(C1-6)алкиламино(C1-6)алкил.
2. Соединение по п.1, представленное формулой IIB, или его фармацевтически приемлемая соль
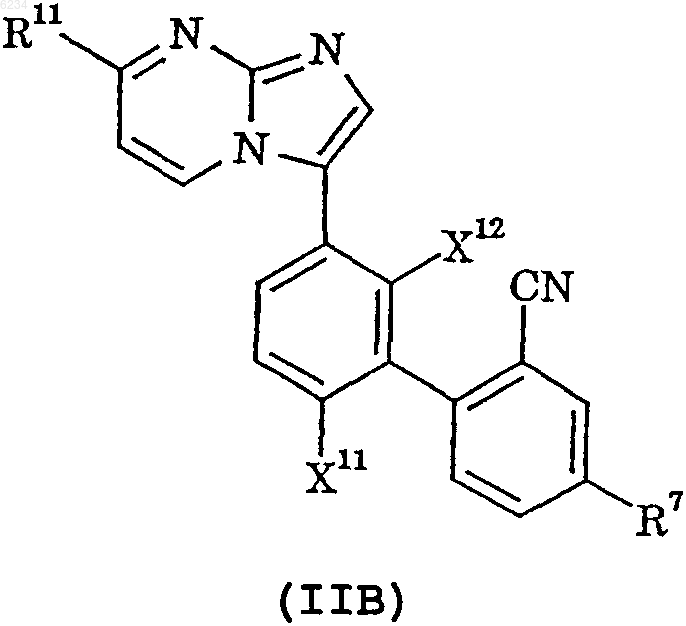
где X11, X12 и R11 такие, как определено в п.1, и
R7 обозначает водород, фтор или хлор.
3. Соединение по п.2, где R7 обозначает фтор.
4. Соединение по п.3, где R11 обозначает трифторметил.
5. Соединение по п.1, представленное формулой IIC, или его фармацевтически приемлемая соль
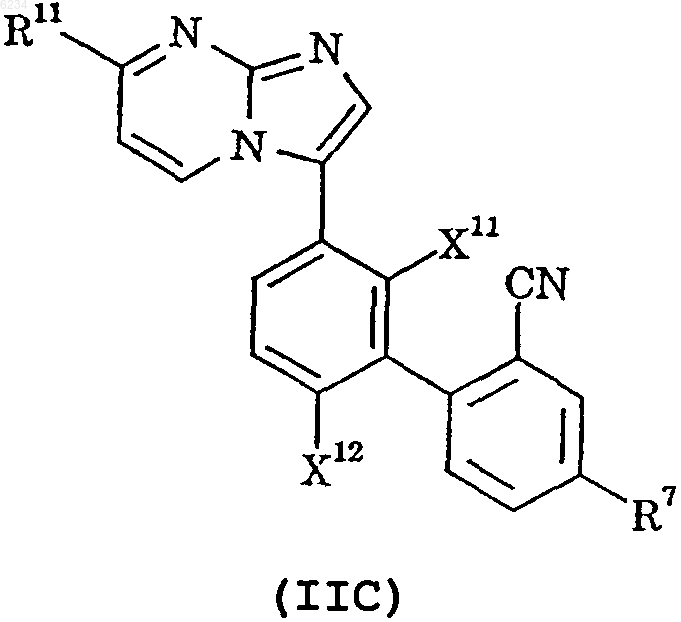
где X11, X12 и R11 такие, как определено в п.1, и
R7 такой, как определено в п.2.
6. Соединение по п.1, представленное формулой IID, или его фармацевтически приемлемая соль
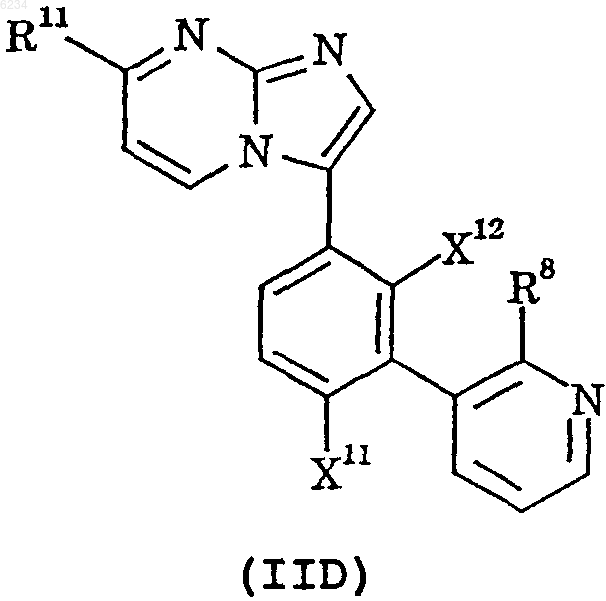
где X11, X12 и R11 такие, как определено в п.1, и
R8 обозначает водород, фтор или циано.
7. Соединение по п.6, где R8 обозначает водород.
8. Соединение по п.7, где R11 обозначает 2-гидроксипроп-2-ил.
9. Соединение по п.1, представленное формулой IIE, или его фармацевтически приемлемая соль
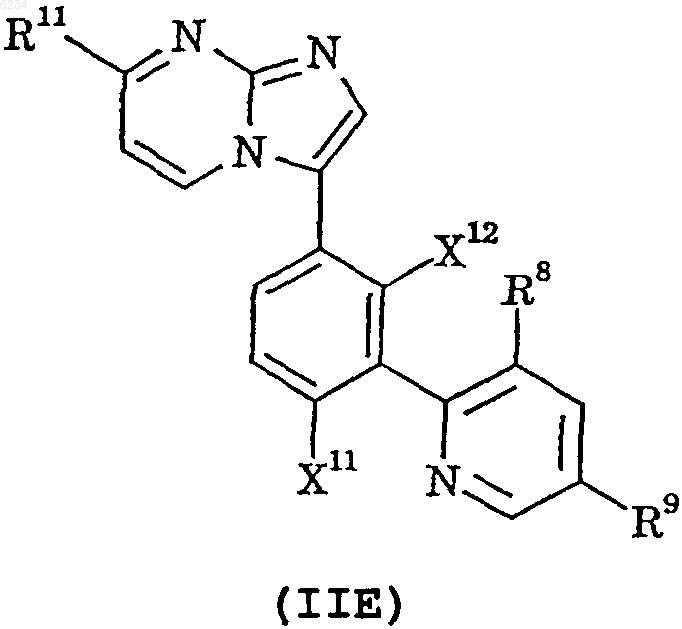
где X11, X12 и R11 такие, как определено в п.1;
R8 такой, как определено в п.6; и
R9 обозначает водород или фтор.
10. Соединение по любому одному из пп.2-9, где X12 обозначает водород.
11. Соединение, выбираемое из
2'-фтор-5'-(имидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
1'-фтор-5'-(7-метилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
5'-(7-ацетилимидазо[1,2-a]пиримидин-3-ил)-2'-фторбифенил-2-карбонитрила;
2'-фтор-5'-(7-изопропилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
2'-фтор-5'-(7-трет-бутилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
2'-фтор-5'-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-[7-(1-фтор-1-метилэтил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-(7-гидроксиметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
2'-фтор-5'-[7-(1-гидроксиэтил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-[7-(1-фторэтил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-[7-(2-метилтиазол-5-ил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
5'-[7-(1,1-дифторэтил)имидазо[1,2-a]пиримидин-3-ил]-2' -фторбифенил-2-карбонитрила;
5'-(7-хлоримидазо[1,2-a]пиримидин-3-ил)-2'-фторбифенил-2-карбонитрила;
5'-(7-дифторметилимидазо[1,2-a]пиримидин-3-ил)-2'-фторбифенил-2-карбонитрила;
2'-фтор-5'-(7-метоксиметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
3-(2'-циано-6-фторбифенил-3-ил)имидазо[1,2-a]пиримидин-7-карбонитрила;
2'-фтор-5'-[7-(3-метил[1,2,4]оксадиазол-5-ил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-[7-(оксазол-5-ил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-[7-(гидроксииминометил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
5'-{7-[1-(2-диметиламиноэтоксиимино)метил]имидазо[1,2-a]пиримидин-3-ил}-2'-фторбифенил-2-карбонитрила;
3'-(7-дифторметилимидазо[1,2-a]пиримидин-3-ил)-4'-фторбифенил-2-карбонитрила;
2'-фтор-5'-(7-фторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
2'-фтор-5'-[7-(фуран-3-ил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-[7-(тиен-3-ил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-[7-(пиридин-2-ил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
7-(1,1-дифторэтил)-3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидина;
2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
3'-фтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
3'-фтор-5'-(7-гидроксиметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
2'-фтор-3'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
3-[4-фтор-3-(пиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[4-фтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2'-фтор-5'-[7-([1,2,4]триазол-1-илметил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-[7-(имидазол-1-илметил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-[7-([1,2,3]триазол-1-илметил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-[7-([1,2,3]триазол-2-илметил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
3-[4-фтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[2,4-дифтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[2,4-дифтор-3-(пиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2-{3-[4-фтор-3-(пиридин-4-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
3-[2-фтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2-{3-[2-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
3-[2-фтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2-{3-[2-фтор-3-(пиридин-4-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
3-[2-фтор-3-(пиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2-{3-[2-фтор-3-(пиридин-2-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
3-[4-фтор-3-(пиридазин-3-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2-[2-фтор-5-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)фенил]никотинонитрила;
3-[4-фтор-3-(пиридин-2-ил)фенил]имидазо[1,2-a]пиримидина;
3,2'-дифтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
6,2'-дифтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
5,2'-дифтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
4,2'-дифтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
2',6'-дифтор-3'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
3-[4-фтор-3-(пиразин-2-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[4-фтор-3-(пиримидин-2-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[2-фтор-5-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)фенил]пиридин-2-карбонитрила;
3-[4-фтор-3-(5-фторпиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
7-(1,1-дифторэтил)-3-[4-фтор-3-(пиридин-4-ил)фенил]имидазо[1,2-a]пиримидина;
7-(1,1-дифторэтил)-3-[2,4-дифтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидина;
и его фармацевтически приемлемые соли.
12. Соединение, выбираемое из
2-{3-[2,4-дифтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
1-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}этанона;
3'-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-a]пиримидин-3-ил]-4,2',6'-трифторбифенил-2-карбонитрила;
2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-1,2-диола;
3-[2-фтор-5-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)фенил]тиофен-2-карбонитрила;
3-{2-фтор-5-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-a]пиримидин-3-ил]фенил}тиофен-2-карбонитрила;
3-{2,6-дифтор-3-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-a]пиримидин-3-ил]фенил}тиофен-2-карбонитрила;
3-[4-фтор-3-(3-фторпиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
4-хлор-2'-фтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила;
2-{3-[4-фтор-3-(пиразин-2-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
2-{3-[4-фтор-3-(5-фторпиридин-2-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
3-[4-фтор-3-(3-фторпиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2-{3-[4-фтор-3-(3-фторпиридин-2-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
3-[3-(3,5-дифторпиридин-2-ил)-4-фторфенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2-{3-[3-(3,5-дифторпиридин-2-ил)-4-фторфенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
3-[2,4-дифтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2-{3-[2,4-дифтор-3-(пиридин-4-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
4,2'-дифтор-5'-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-a]пиримидин-3-ил]бифенил-2-карбонитрила;
2'-фтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-3-карбонитрила;
2'-фтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-4-карбонитрила;
3-[2,4-дифтор-3-(пиридин-3-ил)фенил]-7-(1-фтор-1-метилэтил)имидазо[1,2-a]пиримидина;
7-(1-фтор-1-метилэтил)-3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидина;
метилового эфира 2-{3-[2,4-дифтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}-2-метилпропионовой кислоты;
2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}-2-метилпропионитрила;
2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}-2-метилпропан-1-ола;
3-[4-фтор-3-(4-фторпиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[4-фтор-3-(пиррол-1-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидина;
3-[4-фтор-3-(5-фторпиридин-2-ил)фенил]имидазо[1,2-a]пиримидина;
3-[2,4-дифтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидина;
3-[5-фтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[2-фтор-5-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[4-фтор-3-(пиридазин-4-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[4-фтор-3-(имидазол-1-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[4-фтор-3-(изотиазол-4-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
3-[4-фтор-3-(пиримидин-5-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
и его фармацевтически приемлемые соли.
13. Соединение, выбираемое из
3-[4-фтор-3-(тиазол-2-ил)фенил]-7-трифторметилимидазо [1,2-a] пиримидина;
2-{2-фтор-5-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-a]пиримидин-3-ил]фенил}никотинонитрила;
4-[2-фтор-5-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)фенил]никотинонитрила;
4-{2-фтор-5-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-a]пиримидин-3-ил]фенил}никотинонитрила;
3-[2-фтор-5-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)фенил]изоникотинонитрила;
2-{3-[4-фтор-3-(пиридазин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
2-{3-[4-фтор-3-(пиридазин-4-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
3-[4-фтор-3-(пиразол-1-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2-{3-[4-фтор-3-(пиразол-1-ил)фенил]имидазо[1,2-a]пиримидин -7-ил}пропан-2-ола;
3-[4-фтор-3-([1,2,4]триазол-1-ил)фенил]-7-трифторметилимидазо[1,2-a]пиримидина;
2-{3-[4-фтор-3-([1,2,4]триазол-1-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
2-{3-[4-фтор-3-(5-фторпиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола;
и его фармацевтически приемлемые соли.
14. Фармацевтическая композиция, включающая соединение формулы IIA по п.1 или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем.
15. Применение соединения формулы IIA по п.1 или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения и/или профилактики неблагоприятных неврологических состояний.
16. Способ получения соединения по п.1, который включает
взаимодействие соединения формулы III с соединением формулы IV
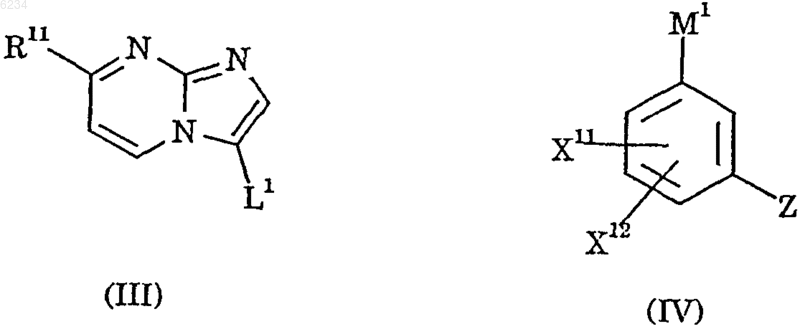
где X11, X12, Z и R11 такие, как определено в п.1, L1 обозначает приемлемую уходящую группу, а M1 обозначает остаток бороновой кислоты -B(OH)2 или ее циклического сложного эфира, образованного с органическим диолом, или М1 обозначает группу -Sn(Alk)3, в которой Alk является C1-6алкильной группой, в присутствии катализатора на основе переходного металла.
17. Способ получения соединения по п.1, который включает
взаимодействие соединения формулы V с соединением формулы VI

где X11, X12, Z и R11 такие, как определено в п.1, а L1 и M1 такие, как указано выше; в присутствии катализатора на основе переходного металла.
18. Способ получения соединения по п.1, который включает
взаимодействие соединения формулы VII с соединением формулы VIII
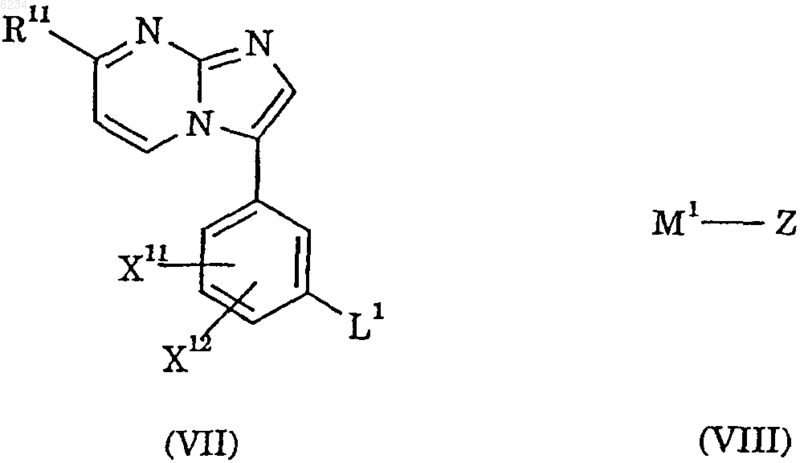
где X11, X12, Z и R11 такие, как определено в п.1, а L1 и M1 такие, как определено выше; в присутствии катализатора на основе переходного металла.
19. Способ получения соединения по п.1, который включает
взаимодействие соединения формулы IX с соединением формулы X

где X11, X12, Z и R11 такие, как определено в п.1, а L1 и M1 такие, как определено выше; в присутствии катализатора на основе переходного металла.
20. Способ получения соединения по п.1, который включает
взаимодействие соединения формулы XV с соединением формулы XVI
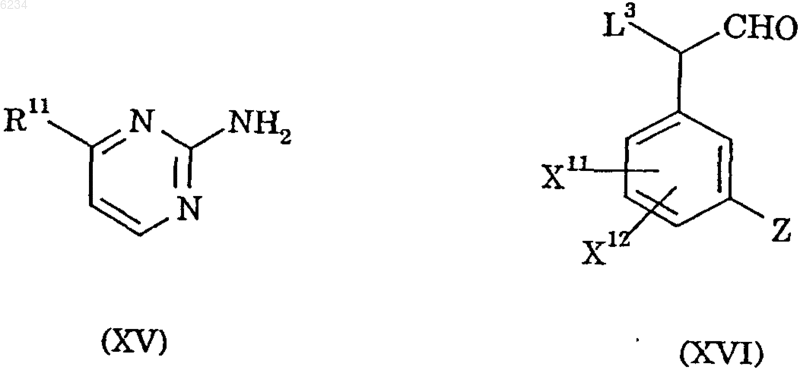
где X11, X12, Z и R11 такие, как определено в п.1, а L3 обозначает приемлемую уходящую группу.
21. Способ получения соединения по п.1, который включает
взаимодействие соединения формулы XX с соединением формулы XXI
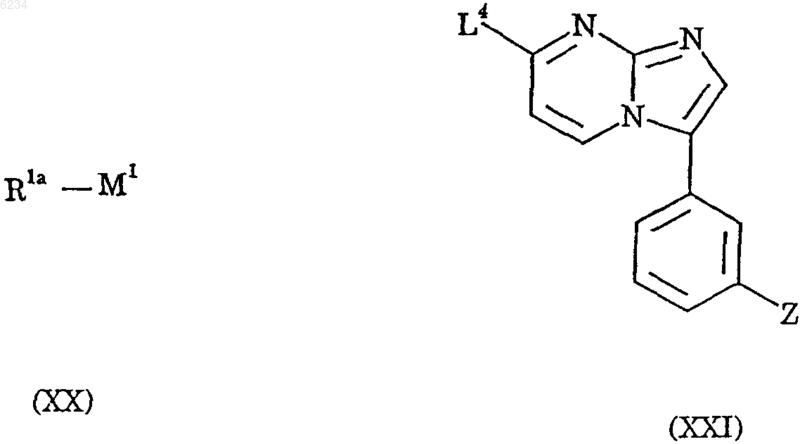
где Z такой, как определено в п.1, M1 такой, как определено выше, R1a обозначает арильный или гетероарильный остаток, а L4 обозначает приемлемую уходящую группу; в присутствии катализатора на основе переходного металла.
22. Способ получения соединения по п.1, который включает
взаимодействие соединения формулы XXII
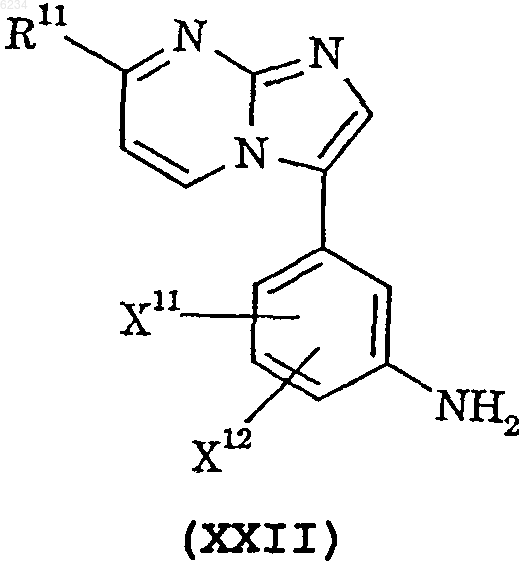
где X11, X12 и R11 такие, как определено в п.1, с 2,5-диметокситетрагидрофураном.
23. Способ получения по пп.16-22, который дополнительно включает стадию превращения, когда это приемлемо, первоначально полученного соединения формулы IIA в другое соединение формулы IIA стандартными способами.
24. Споёюс лечения и/или профилактики неблагоприятных неврологических состояний, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы IIA по п.1 или его фармацевтически приемлемой соли.
25. 2{3-[4-Фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a] пиримидин-7-ил}пропан-2-ол или его фармацевтически приемлемая соль.
26. Бисгидрохлоридная соль 2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола.
27. Фармацевтическая композиция, включающая 2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ол или его фармацевтически приемлемую соль, в сочетании с фармацевтически приемлемым носителем.
28. Фармацевтическая композиция, включающая бисгидрохлоридную соль 2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола в сочетании с фармацевтически приемлемым носителем.
29. Применение 2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо [1,2-a]пиримидин-7-ил}пропан-2-ола или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения и/или профилактики тревожных состояний.
30. Применение бисгидрохлоридной соли 2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола для изготовления лекарственного средства для лечения и/или профилактики тревоги.
31. Способ лечения и/или профилактики тревоги, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества 2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола или его фармацевтически приемлемой соли.
32. Способ лечения и/или профилактики тревоги, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества бисгидрохлоридной соли 2-{3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-a]пиримидин-7-ил}пропан-2-ола.
33. 4,2'-Дифтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрил.
34. Фармацевтическая композиция, включающая 4,2'-дифтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрил в сочетании с фармацевтически приемлемым носителем.
35. Применение 4,2'-дифтор-5'-(7-трифторметилимидазо [1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила для изготовления лекарственного средства для лечения и/или профилактики тревоги.
36. Способ лечения и/или профилактики тревоги, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества 4,2'-дифтор-5'-(7-трифторметилимидазо[1,2-a]пиримидин-3-ил)бифенил-2-карбонитрила.
Текст
006234 Данное изобретение относится к классу производных имидазопиримидинов и их применению в терапии. Более конкретно, данное изобретение относится к аналогам имидазо[1,2-а]пиримидина, содержащим замещенную фенильную группу в положении 3. Данные соединения являются лигандами для ГАМКA рецепторов и, следовательно, полезны для лечения тяжелых психических состояний. Рецепторы для основного ингибирующего нейромедиатора, гамма-аминомасляной кислоты(ГАМК), разделяют на два основных класса: (1) ГАМКA рецепторы, которые являются членами надсемейства лиганд-активируемых ионных каналов, и (2) ГАМКB рецепторы, которые могут быть членами надсемейства рецепторов, связываемых с G-белками. С тех пор, как были клонированы первые кДНК,кодирующие индивидуальные субъединицы ГАМКA рецепторов, количество известных членов этого ряда в семействе выросло и в настоящее время включает по меньшей мере шесть -субъединиц, четыре-субъединицы, три -субъединицы, одну -субъединицу, одну -субъединицу и две -субъединицы. Хотя знания о разнообразии генетического семейства ГАМКA рецепторов представляют огромный шаг вперед в нашем понимании этого лиганд-активируемого ионного канала, осмысление степени разнообразия подтипов все еще находится в начальной стадии. Установлено, что -субъединица, -субъединица и -субъединица составляют минимальное требование для образования полностью функционального ГАМКA рецептора, экспрессированного временно трансфицирующими клетками кДНК. Как указано выше, -, - и -субъединицы также существуют, но присутствуют только в незначительной степени в популяциях ГАМКA рецепторов. Исследование размера рецепторов и визуализация с помощью электронной микроскопии позволяют сделать вывод, что, подобно другим членам семейства лиганд-активируемых ионных каналов, нативный ГАМКA рецептор существует в пентамерной форме. Выбор по меньшей мере одной -, одной - и одной-субъединицы из популяции, содержащей семнадцать членов, делает возможным существование более чем 10000 комбинаций пентамерных субъединиц. И это не учитывая того, что в этих расчетах пренебрегают дополнительными перестановками, которые возможны, если расположение субъединиц вокруг ионного канала не имеет ограничений (т.е. существует 120 возможных вариантов для рецептора, состоящего из пяти различных субъединиц). Совокупности подтипов рецепторов, которые действительно существуют, включают (среди многих других) следующие: 122, 21, 22/32, 32/3, 4, 532/3, 62 и 6. Совокупности подтипов, содержащих 1-субъединицу, имеются в большинстве участков мозга, и считается, что они отвечают более чем за 40% ГАМКA рецепторов у крыс. Полагают, что совокупности подтипов, содержащих 2- и 3-субъединицы, соответственно отвечают за примерно 25% и 17% ГАМКA рецепторов у крыс. Совокупности подтипов, содержащих 5-субъединицу, преобладают в гиппокампе и коре головного мозга и, как полагают, составляют около 4% ГАМКA рецепторов у крыс. Характерным свойством всех известных ГАМКA рецепторов является наличие ряда сайтов модуляции, один из которых представляет собой сайт связывания бензодиазепина (БЗ). БЗ-связывающий сайт,самый изученный из модуляторных сайтов ГАМКA рецепторов, является сайтом, посредством которого анксиолитики, например диазепам и темазепам, осуществляют свое действие. До клонирования семейства генов ГАМКA рецепторов бензодиазепинсвязывающий сайт исторически разделяли на два подтипа,БЗ 1 и БЗ 2, на основании исследований связывания радиолиганда. Показано, что БЗ 1 подтип фармакологически эквивалентен ГАМКА рецепторам, включающим 1-субъединицу в сочетании с - и 2 субъединицами. Это наиболее распространенный подтип ГАМКA рецепторов; полагают, что к нему относится почти половина всех ГАМКA рецепторов мозга. Двумя другими главными совокупностями являются 22 и 32/3 подтипы. Вместе они составляют еще приблизительно 35% общей популяции ГАМКA рецепторов. По-видимому, в фармакологическом отношении данная комбинация эквивалентна БЗ 2 подтипу, что было определено ранее связыванием радиолигандов, хотя БЗ 2 подтип может также включать популяции, содержащие 5 подтипы. Физиологическая роль таких подтипов до сих пор непонятна, так как неизвестны достаточно селективные агонисты и антагонисты в отношении их. В настоящее время считают, что агенты, действующие как БЗ агонисты на 12, 22 или 33 подтипы, будут обладать требуемыми анксиолитическими свойствами. Соединения, которые являются модуляторами бензодиазепинсвязывающего сайта ГАМКA рецептора, действуя как БЗ агонисты, далее в данной заявке называют агонисты ГАМКA рецепторов. 1-Селективные агонисты ГАМКA рецепторов алпидем и золпидем прописывают в клинике в качестве снотворных агентов, предполагая, что, по меньшей мере, некоторый седативный эффект, связанный с известными анксиолитиками, которые действуют через бензодиазепинсвязывающий сайт, передается посредством ГАМКA рецепторов, содержащих 1 субъединицу. Таким образом, полагают, что агонисты ГAМКA рецепторов, которые лучше взаимодействуют с 2- и/или 3-субъединицами, чем с 1, будут эффективны для лечения тревоги при их склонности вызывать пониженное седативное действие. Кроме того, агенты, которые являются обратными агонистами в отношении 5-субъединицы, вероятно, будут полезны для усиления познавательной способности, например, у субъектов, страдающих состояниями деменции, такими как болезнь Альцгеймера.-1 006234 Агенты, которые являются антагонистами или обратными агонистами в отношении 1, могли бы использоваться для реверсии седативного или гипнотического эффекта, вызванного 1 агонистами. Соединения по данному изобретению, будучи селективными лигандами ГАМКA рецепторов, применимы, следовательно, для лечения и/или профилактики ряда разнообразных нарушений центральной нервной системы. Такие нарушения включают тревожные расстройства, такие как паника с агорафобией или без нее, агорафобия без панического анамнеза, боязнь животных и другие фобии, включая социальные фобии, обсессивно-компульсивные расстройства, стрессовые нарушения, включая посттравматические и острые стрессовые расстройства, и генерализованное или индуцированное каким-либо соединением тревожное нарушение; неврозы; конвульсии; мигрень; депрессивные или биполярные расстройства,например одноэпизодное или рецидивирующее масштабное психическое расстройство, дистемические расстройства, биполярные маниакальные расстройства типа I и типа II и циклотимическое нарушение; психотические расстройства, включая шизофрению; нейродегенеративные нарушения, возникающие в результате церебральной ишемии; повышенная активность из-за недостатка внимания; нарушения речи,включая заикание; и нарушения циркадного ритма, например, у субъектов, страдающих из-за перелета через несколько часовых поясов или сменной работы. Дополнительные нарушения, для которых селективные лиганды для ГАМКA рецепторов могут быть полезны, включают боль и ноцицепцию; рвоту, включая сильную, задержанную и рецидивирующую рвоту, в частности рвоту, вызванную химиотерапией или облучением, а также укачивание, послеоперационную тошноту и рвоту; нарушения питания, включая невротическую анорексию и булимию; предменструальный синдром; мышечный спазм или спастичность, например, у пациентов с параличом нижних конечностей; расстройства слуха, включая шум в ушах и связанное с возрастом снижение слуха; непроизвольное мочеиспускание; и последствия, вызванные злоупотреблением какими-либо веществами или зависимостью от них, включая алкогольную абстиненцию. Селективные лиганды для ГАМКA рецепторов могут быть полезны для усиления познавательных способностей, например, у субъектов, страдающих состоянием деменции, например болезнью Альцгеймера; и могут также быть эффективны в качестве лекарственных средств при премедикации перед анестезией или малыми процедурами, такими как эндоскопия, включая гастроэндоскопию. Кроме того, соединения по данному изобретению могут быть полезны в качестве радиолигандов в тестах по определению соединений, способных к связыванию ГАМКA рецепторов человека. Данное изобретение относится к классу производных имидазопиримидина, которые обладают требуемыми свойствами связывать различные подтипы ГАМКA рецепторов. Соединения по данному изобретению обладают хорошим сродством в качестве лигандов к 2-, и/или 3-, и/или 5-субъединицам ГАМКA рецепторов человека. Соединения по данному изобретению могут взаимодействовать преимущественно с 2- и/или 3- субъединицами по сравнению с 1-субъединицей; и/или могут взаимодействовать преимущественно с 5-субъединицей по сравнению с 1-субъединицей. Соединения по данному изобретению являются лигандами подтипов ГАМКA рецепторов, имеющими сродство связывания (Ki) с 2-, и/или 3-, и/или 5-субъединицами (как определено анализом, приведенном ниже в данном описании), равное 200 нМ или менее, обычно 100 нМ или менее и в идеальном случае 20 нМ или менее. Соединения по данному изобретению могут обладать селективным сродством к 2-, и/или 3-, и/или 5-субъединицам, минимум в 2 раза большим, приемлемо минимум в 5 раз большим и преимущественно минимум в 10 раз большим, чем сродство к 1-субъединице. Однако соединения, которые не являются селективными с точки зрения их сродства связывания с 2-, и/или 3-, и/или 5-субъединицами в сравнении с 1-субъединицей, также входят в объем притязаний данного изобретения; такие соединения должны проявлять функциональную селективность в виде нулевой или слабой(положительной или отрицательной) эффективности в отношении 1-субъединицы и в виде (i) профиля полного или частичного агониста в отношении 2- и/или 3-субъединиц и/или (ii) профиля обратного агониста в отношении 5-субъединицы. Данное изобретение относится к соединению формулы IIA или его фармацевтически приемлемой солиX12 обозначает водород или фтор;Z обозначает арильную или гетероарильную группу, любая из которых может быть необязательно замещена одним или более заместителями, выбранными из галогена и циано;R5 обозначает водород или C1-6 алкил; иR6 обозначает водород, C1-6 алкил, гидрокси(C1-6)алкил или ди(C1-6)алкиламино(C1-6)алкил. Данное изобретение также относится к соединению формулы IIА, представленной выше, или его фармацевтически приемлемой соли, гдеZ, X11, X12, R5 и R6 такие, как определено выше. Для применения в медицине соли соединений формулы IIА должны быть фармацевтически приемлемыми солями. Однако другие соли могут быть полезны при получении соединений по данному изобретению или их фармацевтически приемлемых солей. Подходящие фармацевтически приемлемые соли соединений по данному изобретению включают соли, образованные за счет присоединения кислоты, которые могут, например, быть получены смешиванием раствора соединения по данному изобретению с раствором фармацевтически приемлемой кислоты, такой как хлористо-водородная кислота, серная кислота, метансульфокислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, щавелевая кислота, лимонная кислота, винная кислота, угольная кислота или фосфорная кислота. Кроме того, в тех случаях, где соединения по данному изобретению имеют кислотный остаток, ик подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов, например соли натрия или калия; соли щелочно-земельных металлов, например соли кальция или магния; и соли, образованные подходящими органическими лигандами, например четвертичные аммониевые соли. Приемлемые алкильные группы включают линейные и разветвленные алкильные группы, содержащие от 1 до 6 атомов углерода. Типичные примеры включают метильные и этильные группы и линейные или разветвленные пропильные, бутильные и пектильные группы. Конкретными алкильными группами являются метил, этил, н-пропил, изопропил, изобутил, трег-бутил и 2,2-диметилпропил. Установленные выражения, такие как С 1-6 алкокси, C1-6 алкиламино и C1-6 алкилсульфонил, интерпретируются соответственно. Конкретные арильные группы включают фенил и нафтил, особенно фенил. Приемлемые гетероарильные группы включают пиридинильную, хинолинильную, изохинолинильную, пиридазинильную, пиримидинильную, пиразинильную, фурильную, бензофурильную, дибензофурильную, тиенильную, бензтиенильную, пирролильную, индолильнуго, пиразолильную, индазолильную,оксазолильную, изоксазолильную, тиазолильную, изотиазолильную, имидазолильную, бензимидазолильную, оксадиазолильную, тиадиазолильную, триазолильную и тетразолильную группы. Выражение гетероарил(С 1-6)алкил, используемое в данном описании, включает фурилметил, фурилэтил, тиенилметил, тиенилэтил, оксазолилметил, оксазолилэтил, тиазолилметил, тиазолилэтил, имидазолилметил, имидазолилэтил, оксадиазолилметил, оксадиазолилэтил, тиадиазолилметил, тиадиазолилэтил, триазолилметил, триазолилэтил, тетразолилметил, тетразолилэтил, пиридинилметил, пиридинилэтил, пиримидинилметил, пиразинилметил, хинолинилметил и изохинолинилметил. Термин галоген, используемый в данном описании, включает фтор, хлор, бром и иод, особенно фтор или хлор. В тех случаях, когда в соединениях по данному изобретению имеется по меньшей мере один асимметрический центр, они соответственно могут существовать в виде энантиомеров. В тех случаях, когда в соединениях по данному изобретению имеется два или более асимметрических центра, они, кроме того,могут существовать в виде диастереоизомеров. Следует понимать, что все такие изомеры и их смеси при любом соотношении изомеров входят в объем притязаний данного изобретения. Арильная или гетероарильная группа Z в соединениях приведенной выше формулы может быть незамещенной или замещена одним или более заместителями, выбираемыми из галогена и циано. Обычно группа Z будет незамещенной или замещена одним или двумя заместителями. Соответственно, группа Z является незамещенной или монозамещена. Выбранные значения для заместителя Z включают фенил, пиридинил, пиридазинил, пиримидинил,пиразинил, тиенил, тиазолил, изотиазолил, пирролил, пиразолил, имидазолил, триазолил и тетразолил,причем любая из указанных групп может быть необязательно замещена одним или более заместителями,выбираемыми из галогена и циано. Индивидуальные значения для заместителя Z включают фенил, пиридинил, пиридазинил, пиримидинил, пиразинил, тиенил, тиазолил, изотиазолил, пирролил, имидазолил, триазолил и тетразолил, причем любая из указанных групп может быть необязательно замещена одним или более заместителями,выбираемыми из галогена и циано.-3 006234 Репрезентативные значения для заместителя Z включают фенил, пиридинил, пиридазинил, пиримидинил, пиразинил, тиенил, тиазолил, имидазолил и триазолил, причем любая из указанных групп может быть необязательно замещена одним или более заместителями, выбираемыми из галогена и циано. Типичные значения Z включают фенил, пиридинил, пиридазинил, пиримидинил и пиразинил, причем любая из указанных групп может быть необязательно замещена одним или более заместителями, выбираемыми из галогена и циано. В одном предпочтительном варианте осуществления данного изобретения Z обозначает необязательно замещенную фенильную группу, в частности монозамещенный или дизамещенный фенил. Еще в одном предпочтительном варианте осуществления данного изобретения Z обозначает необязательно замещенный пиридинил, особенно незамещенный или монозамещенный пиридин-2 ил, пиридин-3-ил или пиридин-4-ил. Примеры приемлемых заместителей в группе Z включают фтор, хлор и циано. Примеры конкретных заместителей в группе Z включают фтор и циано; и в особенности циано. Подробные значения Z включают цианофенил, (циано)(фтор)фенил, (хлор)(циано)фенил, пиридинил, фторпиридинил, дифторпиридинил, цианопиридинил, пиридазинил, пиримидинил, пиразинил, цианотиенил, тиазолил, изотиазолил, пирролил, пиразолил, имидазолил и триазолил. Приемлемые значения Z включают цианофенил, (циано)(фтор)фенил, (хлор)(циано)фенил, пиридинил, фторпиридинил, дифторпиридинил, цианопиридинил, пиридазинил, пиримидинил, пиразинил, цианотиенил, тиазолил, изотиазолил, пирролил, имидазолил и триазолил. Типичные значения Z включают цианофенил, (циано)(фтор)фенил, (хлор)(циано)фенил, пиридинил,фторпиридинил, дифторпиридинил, цианопиридинил, пиридазинил, пиримидинил, пиразинил, цианотиенил, изотиазолил, пирролил и имидазолил. Иллюстративные значения Z включают цианофенил, (циано)(фтор)фенил, пиридинил, фторпиридинил, цианопиридинил, пиридазинил, пиримидинил, пиразинил, цианотиенил, тиазолил, имидазолил и триазолил. Индивидуальные значения Z включают цианофенил, (циано)(фтор)фенил, пиридинил, фторпиридинил, цианопиридинил, пиридазинил, пиримидинил и пиразинил. Конкретные значения Z включают 2-цианофенил, 2-циано-4-фторфенил, пиридин-2-ил, пиридин-3 ил и 3-цианопиридин-2-ил. В одном из вариантов осуществления данного изобретения Z обозначает 2-циано-4-фторфенил. В другом варианте осуществления данного изобретения Z обозначает пиридин-3-ил. В одном из предпочтительных вариантов осуществления данного изобретения X12 обозначает водород. Еще в одном варианте X12 обозначает фтор. Соответственно, R5 обозначает водород или метил, особенно водород. Соответственно, R6 обозначает водород, метил, этил, гидроксиэтил или диметиламиноэтил. Конкретные значения R6 включают водород, гидроксиэтил и диметиламиноэтил. Обычно R6 обозначает водород или диметиламиноэтил, особенно водород. В тех случаях, когда R11 обозначает гетероарил, данной группой соответственно является пиридинил, фурил, тиенил или оксазолил. В тех случаях, когда R11 обозначает C1-6 алкилгетероарил, данной группой соответственно является метилтиазолил (например, 2-метилтиазол-5-ил) или метилоксадиазолил (например, 3-метил[1,2,4]оксадиазол-5-ил). В тех случаях, когда R11 обозначает гетероарил(C1-6)алкил, данной группой соответственно является имидазолилметил или триазолилметил. Индивидуальные значения R11 включают водород, метил, фторметил, дифторметил, гидроксиметил,метоксиметил, диметоксиметил, гидроксиэтил (особенно 1-гидроксиэтил), фторэтил (особенно 1-фторэтил), дифторэтил (особенно 1,1-дифторэтил), диметоксиэтил (особенно 1,1-диметоксиэтил), изопропил,гидроксипропил (особенно 2-гидроксипроп-2-ил), дигидроксипропил (особенно 1,2-дигидроксипроп-2 ил), фторпропил (особенно 2-фторпроп-2-ил), цианопропил (особенно 2-цианопроп-2-ил), метоксикарбонилпропил (особенно 2-метоксикарбонилпроп-2-ил), трет-бутил, гидроксибутил (особенно 1-гидрокси-2 метилпроп-2-ил), пиридинил, фурил, тиенил, оксазолил, метилтиазолил, метилоксадиазолил, имидазолилметил, триазолилметил, хлор, циано, трифторметил, формил, ацетил, метоксикарбонил и -CR5=NOR6,где R5 и R6 определены выше. Перечисленные значения R11 включают водород, метил, фторметил, дифторметил, гидроксиметил,метоксиметил, диметоксиметил, гидроксиэтил (особенно 1-гидроксиэтил), фторэтил (особенно 1-фторэтил), дифторэтил (особенно 1,1-дифторэтил), диметоксиэтил (особенно 1,1-диметоксиэтил), изопропил,гидроксипропил (особенно 2-гидроксипроп-2-ил), фторпропил (особенно 2-фторпроп-2-ил), трет-бутил,пиридинил, фурил, тиенил, оксазолил, метилтиазолил,метилоксадиазолил, имидазолилметил, триазолилметил, хлор, циано, трифторметил, формил, ацетил, метоксикарбонил и -CR5=NOR6, где R5 и R6 определены выше. В одном из предпочтительных вариантов осуществления данного изобретения R11 обозначает 2 гидроксипроп-2-ил. В другом предпочтительном варианте осуществления данного изобретения R11 обозначает трифторметил.-4 006234 Данное изобретение преимущественно относится к соединению формулы IIА, приведенной выше,или к его фармацевтически приемлемой соли, гдеX11, X12 и R11 такие, как определено выше. Одна репрезентативная группа соединений формулы IIА, приведенной выше, представлена соединениями формулы IIB и их фармацевтически приемлемыми солями где Х 11, X12 и R11 такие, как определено выше, а R7 обозначает водород, фтор или хлор. Соответственно, R7 обозначает водород или фтор. В одном из вариантов осуществления данного изобретения R7 является водородом. В другом варианте осуществления данного изобретения R7 является фтором. Еще в одном варианте осуществления данного изобретения R7 является хлором. Еще одна репрезентативная группа соединений формулы IIА, приведенной выше, представлена соединениями формулы IIC и их фармацевтически приемлемыми солями где X11, X12 и R11 такие, как определено выше для формулы IIA; иR7 такой, как определено выше для формулы IIB. Дополнительная репрезентативная группа соединений формулы IIА, приведенной выше, представлена соединениями формулы IID и их фармацевтически приемлемыми солями где X11, X12 и R11 такие, как определено выше для формулы IIA; aR8 обозначает водород, фтор или циано. Соответственно, R8 обозначает водород или циано, особенно водород. В одном из вариантов осуществления данного изобретения R8 является водородом. В дополнительном варианте осуществления данного изобретения R8 является фтором. Еще в одном варианте осуществления данного изобретения R8 является цианогруппой. Еще одна дополнительная репрезентативная группа соединений формулы IIА, приведенной выше,представлена соединениями формулы IIЕ и их фармацевтически приемлемыми солями где Х 11, X12 и R11 такие, как определено выше для формулы IIА; аR8 такой, как определено выше для формулы IID, иR9 обозначает водород или фтор. Соответственно, R8 обозначает водород. В другом варианте осуществления данного изобретения R9 обозначает фтор. Конкретные соединения, входящие в объем притязаний данного изобретения, включают 2'-фтор-5'-(имидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 2'-фтор-5'-(7-метилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 5'-(7-ацетилимидазо[1,2-а]пиримидин-3-ил)-2'-фторбифенил-2-карбонитрил; 2'-фтор-5'-(7-изопропилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 2'-фтор-5'-(7-грет-бутилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 2'-фтор-5'-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-(1-фтор-1-метилэтил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 1'-фтор-5'-(7-гидроксиметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 2'-фтор-5'-[7-(1-гидроксиэтил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-(1-фторэтил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-(2-метилтиазол-5-ил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 5'-[7-(1,1-дифторэтил)имидазо[1,2-а]пиримидин-3-ил]-2'-фторбифенил-2-карбонитрил; 5'-(7-хлоримидазо[1,2-а]пиримидин-3-ил)-2'-фторбифенил-2-карбонитрил; 5'-(7-дифторметилимидазо[1,2-а]пиримидин-3-ил)-2'-фторбифенил-2-карбонитрил; 2'-фтор-5'-(7-метоксиметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 3-(2'-циано-6-фторбифенил-3-ил)имидазо[1,2-а]пиримидин-7-карбонитрил; 2'-фтор-5'-[7-(3-метил[1,2,4]оксадиазол-5-ил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-(оксазол-5-ил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-(гидроксииминометил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 5'-7-[(2-диметиламиноэтоксиимино)метил]имидазо[1,2-а]пиримидин-3-ил-2'-фторбифенил-2-карбонитрил; 3'-(7-дифторметилимидазо[1,2-а]пиримидин-3-ил)-4'-фторбифенил-2-карбонитрил; 2'-фтор-5'-(7-фторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 2'-фтор-5'-[7-(фуран-3-ил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-(тиен-3-ил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-(пиридин-2-ил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 7-(1,1-дифторэтил)-3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин; 2-3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол; 3'-фтор-5'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 3'-фтор-5'-(7-гидроксиметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 2'-фтор-3'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 3-[4-фтор-3-(пиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин; 3-[4-фтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин; 2'-фтор-5'-[7-([1,2,4]триазол-1-илметил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-(имидазол-1-илметил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-([1,2,3]триазол-1-илметил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-([1,2,3]триазол-2-илметил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 3-[4-фтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин; 3-[2,4-дифтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин; 3-[2,4-дифтор-3-(пиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин; 2-3-[4-фтор-3-(пиридин-4-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол; 3-[2-фтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин; 2-3-[2-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол; 3-[2-фтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин;-7 006234 3-[4-фтор-3-(пиразол-1-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин; 2-3-[4-фтор-3-(пиразол-1-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол; 3-[4-фтор-3-([1,2,4]триазол-1-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин; 2-3-[4-фтор-3-([1,2,4]триазол-1-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол; 2-3-[4-фтор-3-(5-фторпиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол; и их фармацевтически приемлемые соли. Данное изобретение также относится к способу лечения и/или профилактики тревоги, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы IIA, определенного выше, или его фармацевтически приемлемой соли, или его пролекарства. Дополнительно данное изобретение относится к способу лечения и/или профилактики конвульсий(например, у пациентов, страдающих эпилепсией или аналогичными расстройствами), который включает введение эффективного количества соединения формулы IIА, определенного выше, или его фармацевтически приемлемой соли, или его пролекарства. Сродство связывания (Ki) соединений по данному изобретению для 3-субъединицы ГАМКA рецептора человека достаточно удобно определяется измерением по методике, приведенной ниже в данном описании. Сродство связывания (Ki) соединений-анксиолитиков по данному изобретению с 3-субъединицей составляет в идеале 50 нМ, предпочтительно 10 нМ или менее и более предпочтительно 5 нМ или менее. Соединения-анксиолитики по данному изобретению должны, по идее, вызывать, по меньшей мере,40%, предпочтительно, по меньшей мере, 50% и более предпочтительно, по меньшей мере, 60% потенцирование ГАМК ЕС 20 ответа в стабильно трансфицированных рекомбинантных клеточных линиях, экспрессирующих 3-субъединицу ГАМКA рецептора человека. Кроме того, соединения по данному изобретению теоретически должны вызывать максимум 30%, предпочтительно максимум 20% и более предпочтительно максимум 10% потенцирование ГАМК ЕС 20 ответа в устойчиво трансфицированных рекомбинантных клеточных линиях, экспрессирующих 1-субъединицу ГАМКA рецептора человека. Потенцирование ГАМК EC20 ответа в постоянно трансфицированных рекомбинантных клеточных линиях, экспрессирующих 3- и 1-субъединицы ГАМКA рецептора человека, может быть определено подходящим образом по методикам, аналогично описанным Wafford et al., в Mol. Pharmacol., 1996, 50,670-678. Методику осуществляют соответственно с использованием культур постоянно трансфицированных эукариотных клеток, обычно постоянно трансфицированных Ltk-фибробластных клеток мышей. Соединения по данному изобретению могут проявлять анксиолитическую активность, что может быть продемонстрировано положительным ответом в тестах приподнятого лабиринта и условнорефлекторного запрещения питья (ср. Dawson et al., Psychopharmacology, 1995, 121, 109-117). Кроме того,соединения по данному изобретению, вероятно, по существу, не являются седативными, что может быть подтверждено соответствующим результатом, полученным из теста на чувствительность ответа (натягивания цепочки) (ср. Bayley et al., J. Psychopharmacol., 1996, 10, 206-213). Соединения по данному изобретению могут также проявлять противосудорожную активность. Это может быть продемонстрировано способностью блокировать припадки, вызванные пентилентетразолом, у крыс и мышей, следуя методике, аналогично описанной Bristow et al., в J. Pharmacol. Exp. Ther., 1996, 279, 492-501. Еще один аспект данного изобретения относится к способу лечения и/или профилактики нарушений познавательных функций, в том числе состояний деменции, таких как болезнь Альцгеймера, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы IIА, определенного выше, или его фармацевтически приемлемой соли. Улучшение познавательных функций может быть показано тестированием соединений в водном лабиринте Морриса, как описано McNamara и Skelton, в Psychobiolоgу, 1993, 21, 101-108. Дополнительные подробности релевантной методики описаны в заявке WO 96/25948. Когнитивные расстройства, для которых соединения по данному изобретению могут быть полезны,включают делирий, деменцию, амнестические расстройства и нарушения познавательной способности (в том числе ослабление памяти, связанное с возрастом), обусловленные травмой или ранением, инсультом,болезнью Паркинсона и синдромом Дауна. Любое из таких состояний может быть связано со злоупотреблением каким-либо вредным веществом или абстиненцией. Примеры деменции включают деменцию типа Альцгеймера с ранним или поздним проявлением и сосудистую деменцию, любая из которых может быть неосложненной или сопровождаться делирием, бредом или депрессией; и деменцию, вызванную ВИЧ инфекцией, травмой головы, болезнью Паркинсона или болезнью Якоба-Крейтцфельда. Чтобы вызвать поведенческие эффекты, соединения по данному изобретению должны, по идее,проникать в мозг; другими словами, данные соединения должны быть способны преодолевать так называемый гематоэнцефалический барьер. Предпочтительно, если соединения по данному изобретению способны проявлять свое полезное терапевтическое действие после перорального введения. Изобретение также относится к фармацевтическим композициям, включающим одно или более соединений по данному изобретению в сочетании с фармацевтически приемлемым носителем. Предпочтительно, если данные композиции находятся в единичных дозированных формах, таких как таблетки, пилюли, капсулы, порошки, гранулы, стерильные растворы или суспензии для парентерального введения,-8 006234 дозированные аэрозоли или жидкие спреи, капли, ампулы, автоинжекторные устройства или суппозитории; для перорального, парентерального, интраназального, сублингвального или ректального введения или введения посредством ингаляции или инсуффляции (вдуванием). Для получения твердых композиций, таких как таблетки, главный активный ингредиент смешивают с фармацевтическим носителем, например обычными ингредиентами таблеток, такими как кукурузный крахмал, лактоза, сахароза, сорбит,тальк, стеариновая кислота, стеарат магния, дикальцийфосфат или камеди, и другими фармацевтическими разбавителями, например водой, и получают твердую предрецептурную композицию, содержащую гомогенную смесь соединения по данному изобретению или его фармацевтически приемлемой соли. Когда об этих предрецептурных композициях говорят как о гомогенных, это означает, что активный ингредиент диспергирован равномерно по всей композиции таким образом, что она может быть легко разделена на равноэффективные единичные дозированные формы, такие как таблетки, пилюли и капсулы. Указанную твердую предрецептурную композицию затем разделяют на стандартные лекарственные формы типа описанных выше, содержащих от 0,1 до около 500 мг активного ингредиента по данному изобретению. Типичные единичные дозированные формы содержат от 10 до 100 мг, например 1, 2, 5, 10, 25, 50 или 100 мг, активного ингредиента. Таблетки или пилюли новой композиции могут быть покрыты оболочкой или могут быть составлены иным образом для получения лекарственной формы, обладающей преимуществами пролонгированного действия. Например, таблетка или пилюля может состоять из внутреннего и внешнего дозируемых компонентов, причем последний является оболочкой для первого компонента. Эти два компонента могут быть разделены энтеросолюбильным слоем, который препятствует распаду внутреннего компонента в желудке и позволяет ему проходить неповрежденным в двенадцатиперстную кишку или высвобождаться с задержкой. Для таких энтеросолюбильных слоев или покрытий могут быть использованы разнообразные материалы, включая ряд полимерных кислот и смесей полимерных кислот с такими веществами, как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы для перорального введения или для инъекций, в которые могут быть включены новые композиции по данному изобретению, содержат водные растворы, соответствующим образом ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии со съедобными маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и аналогичные фармацевтические наполнители. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают синтетические и природные камеди, такие как трагакант, аравийская камедь, альгинат, декстран, натрийкарбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин. Приемлемая доза для лечения неврологических расстройств составляет около 0,01-250 мг/кг в день,предпочтительно около 0,05-100 мг/кг в день и особенно предпочтительно около 0,05-5 мг/кг в день. Схема введения может составлять 1-4 раза в день. Соединения по данному изобретению могут быть получены способом, который включает взаимодействие соединения формулы III с соединением формулы IV где Х 11, X12, Z и R11 такие, как определено выше, L1 обозначает подходящую уходящую группу, а М 1 обозначает остаток бороновой кислоты -В(ОН)2 или ее циклического сложного эфира с органическим диолом, например пинаколом, 1,3-пропандиолом или неопентилгликолем, или М 1 обозначает -Sn(Аlk)3, гдеAlk представляет C1-6 алкильную группу, обычно н-бутильную; в присутствии катализатора на основе переходного металла. Уходящая группа L1 обычно является атомом галогена, например брома. Подходящим катализатором на основе переходного металла для использования в реакции между соединениями III и IV является тетракис(трифенилфосфин)палладий(0). Реакцию удобно проводить при повышенной температуре в таком растворителе, как N,N-диметилацетамид, 1,4-диоксан или тетрагидрофуран, предпочтительно в присутствии фосфата калия, иодида меди(I), карбоната натрия или цезия. Альтернативно, в качестве катализатора на основе переходного металла может быть использован дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II). В этом случае реакцию удобно проводить при повышенной температуре в таком растворителе, как N,N-диметилформамид, предпочтительно в присутствии фосфата калия. По альтернативной методике соединения по данному изобретению могут быть получены способом,который включает взаимодействие соединения формулы V с соединением формулы VI где Х 11, X12, Z, R11, L1 и М 1 такие, как определено выше; в присутствии катализатора на основе переходного металла; в условиях, аналогичных условиям, описанным выше для реакции между соединениями III и IV. По другой методике соединения по данному изобретению могут быть получены способом, который включает взаимодействие соединения формулы VII с соединением формулы VIII где X11, X12, Z, R11, L1 и М 1 такие, как определено выше; в присутствии катализатора на основе переходного металла; в условиях, аналогичных описанным выше для реакции между соединениями III и IV. В соединениях формулы VII, представленной выше, уходящей группой L1 обычно является трифторметансульфонилокси (трифлилокси) или атом галогена, например брома. Альтернативно, соединения по данному изобретению могут быть получены способом, который включает взаимодействие соединения формулы IX с соединением формулы X где X11, X12, Z, R11, L1 и М 1 такие, как определено выше; в присутствии катализатора на основе переходного металла; в условиях, аналогичных описанным выше для реакции между соединениями III и IV. В случаях, когда М 1 в промежуточных соединениях формулы IV и IX, приведенных выше, обозначает остаток бороновой кислоты -В(ОН)2 или ее циклического сложного эфира, образованного с пинаколом или неопентилгликолем, релевантные соединения IV или IX могут быть получены взаимодействием бис(пинаколат)дибора или бис(неопентилгликолят)дибора, соответственно, с соединением формулы VIA или VIIA где X11, X12, Z и R11 такие, как определено выше, a L2 обозначает гидроксигруппу или приемлемую уходящую группу; в присутствии катализатора на основе переходного металла. В тех случаях, когда L2 обозначает уходящую группу, такой группой обычно является трифлилоксигруппа; или атом галогена, такого как бром. Подходящим катализатором на основе переходных металлов для использования в реакции между бис(пинаколат)дибором или бис(неопентилгликолят)дибором и соединением формулы VIA или VIIA является дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II). Реакцию удобно проводить при повышенной температуре в таком растворителе, как 1,4-диоксан (необязательно с диметилсульфоксидом),обычно в присутствии 1,1'-бис(дифенилфосфино)ферроцена и/или ацетата калия.- 10006234 В тех случаях, когда L1/L2 в промежуточных соединениях формул VII/VIIA, приведенных выше,обозначает трифлилоксигруппу, релевантные соединения VII/VIIA могут быть получены взаимодействием соответствующего соединения формулы XI где X11, X12 и R11 такие, как определено выше; с ангидридом трифторметансульфокислоты, обычно в присутствии пиридина. Аналогичные условия можно использовать для превращения промежуточного соединения формулы VIA, приведенной выше, где L2 обозначает гидроксигруппу, в соответствующее соединение формул VI/VIA, где L1/L2 обозначает трифлилоксигруппу. Промежуточные соединения формулы XI, приведенной выше, могут быть получены из соответствующего метоксизамещенного предшественника формулы XII где Х 11, X12 и R11 такие, как определено выше; обработкой бромистым водородом, обычно в уксусной кислоте, при кипячении с обратным холодильником. Промежуточные соединения формулы XII, приведенной выше, могут быть получены взаимодействием соединения III, определенного выше, с соответствующим соединением формулы XIII где X11, X12 и М 1 такие, как определено выше; в присутствии катализатора на основе переходного металла; в условиях, аналогичных описанным выше для реакции между соединениями III и IV. В частности,подходящим катализатором на основе переходного металла для использования в реакции между соединениями III и XIII является тетракис(трифенилфосфин)палладий(0), в случае которого реакцию удобно проводить при повышенной температуре в таком растворителе, как водный 1,2-диметоксиэтан, предпочтительно в присутствии карбоната натрия. В тех случаях, когда М 1 в промежуточных соединениях формулы V, приведенной выше, обозначает-Sn(Alk)3 и Alk такой, как определено выше, данное соединение может быть получено взаимодействием соединения формулы III, приведенной выше, с реагентом формулы (Alk)3Sn-Hal, в которой Hal обозначает атом галогена, обычно хлора. Реакцию удобно проводить обработкой соединения III изопропилмагнийхлоридом, обычно в таком растворителе, как тетрагидрофуран, с последующим добавлением станнильного реагента (Alk)3Sn-Hal. В тех случаях, когда L1 в промежуточных соединениях формулы III, представленной выше, обозначает бром, данное соединение может быть получено бромированием соответствующего соединения формулы XIV где R11 такой, как определено выше; обычно обработкой бромом в метаноле в присутствии ацетата натрия и также, необязательно, бромида калия.- 11006234 Промежуточные соединения формулы XIV могут быть получены взаимодействием хлорацетальдегида или бромацетальдегида, или их ацеталей, например диметил- или диэтилацеталя, с соответствующим соединением формулы XV где R11 такой, как определено выше. Когда в качестве одного из реагентов используют хлорацетальдегид или бромацетальдегид, реакцию удобно проводить путем нагревания реагентов в основных условиях в подходящем растворителе,например в присутствии метоксида натрия или гидрокарбоната натрия в низшем алканоле, таком как метанол и/или этанол, при температуре дефлегмации растворителя. Когда в качестве одного из реагентов используют производные ацеталей хлорацетальдегида или бромацетальдегида, например их диметилили диэтилацеталь, реакция особенно эффективна при нагревании в кислых условиях в подходящем растворителе, например водной бромисто-водородной кислоте в низшем алканоле, таком как метанол или этанол, обычно при температуре дефлегмации растворителя. Соединения по данному изобретению могут быть получены еще одним способом, который включает взаимодействие соединения формулы XV, приведенной выше, с соединением формулы XVI где Х 11, X12 и Z такие, как определено выше; a L3 обозначает приемлемую уходящую группу; в условиях,аналогичных описанным выше для реакции между хлорацетальдегидом или бромацетальдегидом, или их ацеталями, и соединением XV. Подходящая уходящая группа L3 является атомом галогена, например брома. Промежуточные соединения формулы XIV могут быть получены также взаимодействием соединения формулы XVII или XVIII с соединением формулы XIX или с аддитивной солью последнего соединения с кислотой, например его полусульфатом где R11 такой, как определено выше, a Alk1 обозначает C1-6 алкил. Типичные значения Alk1 включают метил и этил. Реакцию удобно проводить путем нагревания реагентов в основных условиях в подходящем растворителе, например низшем алкоксиде, таком как метоксид или этоксид натрия в низшем алканоле,таком как метанол или этанол, обычно при температуре дефлегмации растворителя. Соединения по данному изобретению, где R11 обозначает гетероарильный остаток, могут быть получены еще одним способом, который включает взаимодействие соединения формулы XX с соединением формулы XXI где Z и М 1 такие, как определено выше, R1a обозначает гетероарильный остаток, a L4 обозначает подходящую уходящую группу; в присутствии катализатора на основе переходного металла. Уходящая группа L4 обычно является атомом галогена, например хлора.- 12006234 Подходящим катализатором на основе переходного металла для использования в реакции между соединениями XX и XXI является тетракис(трифенилфосфин)палладий(0), в случае которого реакцию удобно проводить при повышенной температуре в таком растворителе, как N,N-диметилацетамид, обычно в присутствии фосфата калия или в присутствии хлорида лития и иодида меди(I). Альтернативно,подходящим катализатором на основе переходного металла может быть трис(дибензилиденацетон)дипалладий(0), при использовании которого реакцию удобно проводить при повышенной температуре в таком растворителе, как 1,4-диоксан, обычно в присутствии три-трет-бутилфосфина и карбоната цезия. Когда L4 в указанных выше соединениях формулы XXI представляет атом галогена, данные соединения соответствуют соединениям формулы IIА, определенным выше, где R11 представляет галоген, и они, следовательно, могут быть получены любым из способов, описанных выше для получения соединений по данному изобретению. Соединения по данному изобретению, в которых Z представляет пиррол-1-ил, могут быть получены взаимодействием соединения формулы XXII где X11, X12 и R11 такие, как определено выше, с 2,5-диметокситетрагидрофураном. Реакцию удобно проводить при повышенной температуре в таком растворителе, как уксусная кислота. Промежуточные соединения формулы XXII, приведенной выше, могут быть получены взаимодействием соединения формулы III, определенной выше, с соответствующим соединением формулы XXIII где Х 11, X12 и М 1 такие, как определено выше; в присутствии катализатора на основе переходного металла; в условиях, аналогичных описанным выше для реакции между соединениями III и XIII. Указанное выше соединение формулы XIX является коммерчески доступным от Sigma-AldrichCompany Ltd., Dorset, United Kingdom. Исходные соединения формул VI, VIII, X, XIII, XV, XVI, XVII, XVIII, XX и XXIII в тех случаях, когда они не являются коммерчески доступными, могут быть получены способами, аналогично описанным в прилагаемых примерах, или стандартными способами, хорошо известными в данной области. Следует понимать, что любое соединение формулы IIА, первоначально полученное любым из указанных выше способов, может быть, когда это приемлемо, затем превращено в другое соединение формулы IIA по методикам, известным в данной области. Например, соединение формулы IIА, где R11 представляет ди(C1-6)алкокси(C1-6)алкил, может быть превращено в соответствующее соединение формулыIIА, где R11 представляет C2-6 алкилкарбонил, путем гидролиза минеральной кислотой, обычно водным раствором хлористо-водородной кислоты. Соединение, где R11 представляет формил, может быть восстановлено триацетоксиборгидридом натрия в соответствующее соединение, где R11 представляет гидроксиметил. Соединение формулы IIА, где R11 представляет гидроксиметил, может быть окислено в соответствующее соединение формулы IIА, где R11 представляет формил, обработкой диоксидом марганца. Полученное таким образом формильное производное может быть конденсировано с производным гидроксиламина формулы H2N-OR6 с получением соединения формулы IIА, где R11 представляет -CH=NOR6. Кроме того, соединение формулы IIА, в котором R11 представляет -CH=NOH, может быть обработано триэтиламином в присутствии 1,1'-карбонилдиимидазола с получением соответствующего соединения формулы IIА, где R11 представляет цианогруппу. Альтернативно, соединение формулы IIА, где R11 представляет формил, может быть подвергнуто взаимодействию с реагентом Гриньяра с получением соединения формулы IIА, где R11 представляет гидрокси(C1-6)алкил, и данное соединение может быть, в свою очередь, окислено действием диоксида марганца в соответствующее соединение формулы IIА, где R11 представляет С 2-6aлкилкарбонил. Последнее соединение может быть затем конденсировано с производным гидроксиламина формулы H2N-OR6 с получением соединения формулы IIА, где R11 представляет-CR5=NOR6. Соединение формулы IIА, где R11 представляет гидрокси(C1-6)алкил, может быть превращено в соответствующее соединение формулы IIА, где R11 представляет фтор(C1-6)алкил, обработкой триф- 13006234 торидом (диэтиламино)серы (DAST). Аналогично, соединение формулы IIА, где R11 представляет С 211 6 алкилкарбонил, может быть превращено в соответствующее соединение формулы IIА, где R представ 11 ляет дифтор(C1-6)алкил, обработкой DAST. Соединение формулы IIА, где R представляет -СОСН 3,можно обработать тиоацетамидом в присутствии трибромида пиридиния с получением соответствующего соединения формулы IIА, где R11 представляет 2-метилтиазол-5-ил. Кроме того, соединение формулыIIА, где R11 представляет формил, можно обработать (п-толилсульфонил)метилизоцианидом (TosMIC) в присутствии карбоната калия с получением соответствующего соединения формулы IIА, где R11 представляет оксазол-5-ил. Соединение формулы IIА, где R11 представляет гидроксиметил, можно обработать тетрабромидом углерода и трифенилфосфином с получением соответствующего соединения формулыIIА, где R11 представляет бромметил, которое затем может быть подвергнуто взаимодействию (обычно insitu) с натриевой солью имидазола или 1H-[1,2,4]триазола с получением соединения формулы IIА, где R11 представляет имидазол-1-илметил или [1,2,4]триазол-1-илметил соответственно; или с натриевой солью 1H-[1,2,3]триазола с получением смеси соединений формулы IIА, где R11 представляет [1,2,3]триазол-1 илметил и [1,2,3]триазол-2-илметил. В тех случаях, когда по любому из способов получения соединений по данному изобретению, описанных выше, получают смесь продуктов, целевой продукт можно выделить из смеси на соответствующей стадии обычными методами, такими как препаративная ВЭЖХ или колоночная хроматография, используя, например, силикагель и/или оксид алюминия в сочетании с подходящей системой растворителей. В тех случаях, когда описанные выше способы получения соединений по данному изобретению дают смеси стереоизомеров, данные изомеры можно разделить общепринятыми методами, такими как препаративная хроматография. Новые соединения могут быть получены в рацемической форме или в виде индивидуальных энантиомеров энантиоспецифическим синтезом или разделением. Новые соединения могут быть разделены на энантиомеры стандартными методами, такими как препаративная ВЭЖХ или образование диастереомерных пар путем получения соли с оптически активной кислотой, такой как(-)-ди-п-толуоил-d-винная кислота и/или (+)-ди-п-толуоил-1-винная кислота, с последующей фракционной кристаллизацией и регенерацией свободного основания. Новые соединения могут быть также разделены путем образования диастереомерных сложных эфиров или амидов с последующим их хроматографическим разделением и удалением вспомогательного хирального агента. В ходе любой из приведенных выше серий последовательных синтезов может быть необходимым и/или желательным защитить чувствительные или реакционноспособные группы любых молекул, участвующих в данных синтезах. Такую защиту можно обеспечить введением обычных защитных групп, таких как описанные в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; иT.W. GreeneP.G.M. Wuts, Protective Groups in Organic Synthesis, John WileySons, 3rd edition, 1999. Затем защитные группы могут быть удалены на одной из подходящих последующих стадий с использованием методов, известных в данной области. Получение соединений по данному изобретению иллюстрируется примерами, приведенными ниже. Соединения по данному изобретению эффективно ингибируют связывание [3 Н]-флумазенила с бензодиазепинсвязывающим сайтом ГАМКA рецепторов человека, содержащих 2-, и/или 3-, и/или 5 субъединицы и постоянно (стабильно) экспрессируемых в Ltk- клетках. Реагенты Забуференный фосфатом физиологический раствор (ЗФР); буферный раствор для анализа: 10 мМ КН 2 РO4, 100 мМ КСl, рН 7,4 при комнатной температуре,[3H]-флумазенил: (18 нМ для 132 клеток, 18 нМ для 232 клеток, 10 нМ для 332 клеток,10 нМ для 532 клеток) в буфере для анализа; флунитразепам 100 мкМ в буфере для анализа; клетки, ресуспендированные в буфере для анализа (10 мл на один планшет). Сбор клеток От клеток отделяют супернатант. Добавляют ЗФР (приблизительно 20 мл). Клетки соскабливают и помещают в центрифужную пробирку (объемом 50 мл). Процедуру повторяют с дополнительными 10 мл ЗФР, чтобы гарантировать извлечение большей части клеток. Клетки осаждают центрифугированием на настольной центрифуге в течение 20 мин при 3000 об/мин и затем замораживают, если необходимо. Осадок после центрифугирования ресуспендируют в 10 мл буферного раствора на один клеточный планшет(25 см х 25 см). Анализ Анализ можно проводить в глубоких 96-луночных планшетах или в пробирках. В каждой пробирке содержится 300 мкл аналитического буферного раствора; 50 мкл [3H]-флумазенила (конечная концентрация для 132: 1,8 нМ; для 232: 1,8 нМ; для 332: 1,0 нМ; для 532: 1,0 нМ); 50 мкл буферного раствора или растворителя-носителя (например, 10% ДМСО), если соединения растворяют в 10% ДМСО;- 14006234 тестируемое соединение или флунитразепам (для определения неспецифического связывания) в 10 мкМ конечной концентрации; 100 мкл клеток. Анализируемые образцы инкубируют в течение 1 ч при 40 С, затем фильтруют с помощью коллектора клеток Tomtec или Brandel через фильтры GF/B и промывают охлажденным льдом буферным раствором для анализа (3 х 3 мл). Фильтры высушивают и определяют радиоактивность с помощью жидкостного сцинтилляционного счетчика. Ожидаемые значения для полного связывания составляют 3000-4000 распадов/мин и менее 200 распадов/мин для неспецифического связывания, если используют жидкостной сцинтилляционный счетчик, или 1500-2000 распадов/мин для полного связывания и менее 200 распадов/мин для неспецифического связывания, если подсчет проводят с помощью сцинцилляционного счетчика на основе твердого расплава. Параметры связывания определяют методом нелинейного регрессионного анализа (метод наименьших квадратов), на основании которых можно рассчитать константу ингибирования Ki для каждого тестируемого соединения. Соединения в прилагаемых примерах были проанализированы с использованием указанных выше тестов, и было найдено, что они все имеют значение Ki замещения [3 Н]-флумазенила 2-, и/или 3-,и/или 5-субъединицами ГАМКA рецептора человека, равное 100 нМ или менее. Пример 1. 2'-Фтор-5'-(имидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил. Смесь 2-бром-1-фтор-4-нитробензола (полученного по методике, описанной Groweiss в Org. Proc.(7,35 г, 9 ммоль) в 1,4-диоксане (900 мл, содержащие 18 мл диметилсульфоксида) дегазируют азотом в течение 1 ч, затем нагревают при 90 С в течение 14 ч. Реакционную смесь охлаждают до комнатной температуры и затем концентрируют в вакууме. Остаток перемешивают с 2 н раствором гидроксида натрия(1 л) в течение 10 мин, затем фильтруют. Фильтрат экстрагируют диэтиловым эфиром (2 х 750 мл) и органические экстракты отбрасывают. Водный слой охлаждают до 0 С, затем обрабатывают 36% хлористоводородной кислотой (приблизительно 175 мл), добавляемой по каплям в течение 15 мин до рН 5. Полученный осадок оставляют стоять на 2 ч при 0 С, затем отфильтровывают и промывают охлажденной льдом водой. Твердое вещество песочного цвета сушат в вакууме (300 мм рт.ст.) над пентоксидом фосфора, получая 2-(2-фтор-5-нитрофенил)-4,4,5,5-тетраметил[1,3,2]диоксаборолан (76,1 г, 95%): H (400 МГц,CDCl3) 1,38 (12 Н, с), 7,17 (1 Н, дд, J 9 и 9), 8,32 (1 Н, ддд, J 9, 5 и 3), 8,64 (1 Н, дд, J 5 и 3). Смесь 2-бромбензонитрила (34,6 г, 190 ммоль), 2-(2-фтор-5-нитрофенил)-4,4,5,5-тетраметил[1,3,2] диоксаборолана (76,1 г, 285 ммоль) и фторида калия (36,4 г, 627 ммоль) в тетрагидрофуране (600 мл) дегазируют азотом в течение 30 мин, после чего обрабатывают трис(дибензилиденацетон)дипалладием(0)(1,74 г, 1,9 ммоль), затем три-трет-бутилфосфином (38 мл 0,1 М раствора в 1,4-диоксане, 3,8 ммоль), затем реакционную смесь перемешивают в течение 30 мин при комнатной температуре и нагревают при 50 С в течение 1 ч до завершения реакции сочетания. Подобную суспензии реакционную смесь разбавляют водой (3 л) и перемешивают при комнатной температуре в течение 90 мин. Полученное твердое вещество отфильтровывают, промывают водой, затем изогексаном и сушат в вакууме над пентоксидом фосфора, получая 2'-фтор-5'-нитробифенил-2-карбонитрил в виде твердого вещества бежевого цвета (46 г,100%): H (360 МГц, CDCl3) 7,37-7,42 (1 Н, м), 7,53 (1H, д, J 8), 7,59 (1 Н, тд, J 8 и 1), 7,75 (1 Н, тд, J 8 и 1),7,83 (1H, дд, J 8 и 1), 8,35-8,39 (2 Н, м). Охлажденную (0 С) суспензию 2'-фтор-5'-нитробифенил-2-карбонитрила (24,2 г, 100 ммоль) в этаноле(150 мл) и тетрагидрофуране (150 мл) обрабатывают дигидратом хлорида олова(II) (67,7 г, 300 ммоль) и смесь перемешивают при комнатной температуре в течение 12 ч. Растворитель удаляют в вакууме и остаток обрабатывают охлажденным льдом 2 н раствором гидроксида натрия (750 мл). Полученную суспензию перемешивают в течение 60 мин, затем экстрагируют дихлорметаном (2 х 400 мл). Органические слои объединяют, промывают водой, насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и концентрируют, получая твердое вещество красного цвета. Перекристаллизация из толуола дает 5'-амино-2'-фторбифенил-2-карбонитрил в виде твердого вещества кремового цвета (16 г,75%): H (400 МГц, СDСl3) 3,65 (2 Н, уш.), 6,67-6,73 (2 Н, м), 7,00 (1H, т, J 9), 7,44-7,49 (2 Н, м), 7,64 (1H,тд, J 9 и 2), 7,75 (1H, дд, J 8 и 2); m/z (ES+) 213 (МН). Раствор 5'-амино-2'-фторбифенил-2-карбонитрила (7,85 г, 37 ммоль) в 1,4-диоксане (25 мл) обрабатывают 48% бромисто-водородной кислотой (125 мл), полученную суспензию перемешивают и охлаждают до 3 С (внутренняя температура). Раствор нитрита натрия в воде (5 мл) добавляют по каплям в течение 20 мин, поддерживая внутреннюю температуру 5 С. Перемешивание при температуре 5 С продолжают в течение 2 ч, затем реакционную смесь выливают в охлажденный (5 С) раствор свежеочищенного бромида меди(I) (6,37 г, 44 ммоль) в 48% бромисто-водородной кислоте (50 мл). Полученную реакционную смесь пурпурного цвета перемешивают при 5 С в течение 10 мин, затем нагревают до 50 С в течение 20 мин. Реакционную смесь разбавляют охлажденной льдом водой (500 мл) и экстрагируют этилацетатом (2 х 250 мл). Органические слои объединяют, промывают 5% водным раствором сульфита натрия, насыщенным водным раствором хлорида аммония, сушат над безводным сульфатом магния,- 15006234 фильтруют и предварительно адсорбируют непосредственно на силикагель. Очистка хроматографией на силикагеле с элюированием изогексаном (содержащим 1% метанола) при градиенте этилацетата (2-10%) дает бесцветное масло, которое кристаллизуется при стоянии с получением 5'-бром-2'-фторбифенил-2 карбонитрила в виде белого твердого вещества (6,5 г, 64%): H (400 МГц, СDСl3) 7,09-7,14 (1 Н, м), 7,457,57 (4 Н, м), 7,66 (1 Н, тд, J 8 и 2), 7,77 (1 Н, дд, J 8 и 2). Смесь 5'-бром-2'-фторбифенил-2-карбонитрила (1,1 г, 4 ммоль), ацетата калия (1,18 г, 12 ммоль) и бис(пинаколат)дибора (1,17 г, 4,6 ммоль) растворяют в 1,4-диоксане, содержащем 1% об./об. диметилсульфоксида (15 мл), и этот раствор дегазируют азотом в течение 5 мин. Добавляют аддукт дихлор[1,1'бис(дифенилфосфино)ферроцен]палладия(II) с дихлорметаном (98 мг, 0,12 ммоль) и затем реакционную смесь нагревают при 90 С в течение 16 ч. После охлаждения до комнатной температуры реакционную смесь распределяют между этилацетатом и водой. Органическую фазу промывают насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и предварительно адсорбируют непосредственно на силикагель. Очистка хроматографией на силикагеле с элюированием изогексаном (содержащим 1% метанола) при градиенте этилацетата (2-10%) дает бесцветное масло, которое кристаллизуется при стоянии с получением 2'-фтор-5'-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бифенил-2-карбонитрила в виде белого твердого вещества (1,3 г, 100%): H (400 МГц, СDСl3) 1,34 (12 Н, с), 7,21 (1 Н, дд, J 10 и 8), 7,45-7,52 (2 Н, м), 7,65 (1 Н, тд, J 8 и 2), 7,74-7,78 (1 Н, м), 7,83 (1H, дд, J 8 и 2), 7,88 (1H, ддд, J 8, 5 и 2). Раствор 2-аминопиримидина (0,5 г, 5,26 ммоль), диэтилацеталя бромацетальдегида (2,07 г, 10,5 ммоль) и 48% водной бромисто-водородной кислоты (0,5 мл) в этаноле (5 мл) кипятят с обратным холодильником в течение 18 ч. Реакционную смесь охлаждают и предварительно адсорбируют непосредственно на силикагель. Очистка флэш-хроматографией с элюированием дихлорметаном (содержащим 1% конц. аммиака) при градиенте метанола (1-3%) дает твердое вещество, которое растирают с 5% диэтиловым эфиром в изогексане, получая имидазо[1,2-а]пиримидин (0,51 г, 82%) в виде твердого вещества желтокоричневого цвета: H (400 МГц, CDCl3) 6,92 (1H, дд, J 7 и 4), 7,59 (1H, д, J 1), 7,84 (1H, д, J 1), 8,49 (1H,дд, J 7 и 2), 8,58 (1H, дд, J 7 и 2). Имидазо[1,2-а]пиримидин (0,20 г, 1,68 ммоль) и ацетат натрия (207 мг, 2,52 ммоль) растворяют в метаноле (2 мл), который был насыщен бромидом калия, и полученную смесь охлаждают до -10 С перед добавлением по каплям брома (269 мг, 1,68 ммоль) в течение 5 мин. После завершения добавления смесь гасят добавлением 1 М раствора сульфита натрия (2 мл) и удаляют растворитель в вакууме. Остаток обрабатывают водой (15 мл) и насыщенным раствором гидрокарбоната натрия (15 мл) и экстрагируют этилацетатом (2 х 50 мл). Органические слои объединяют, затем промывают насыщенным раствором соли(40 мл), сушат над безводным сульфатом натрия и упаривают, получая не совсем белое твердое вещество. Полученное твердое вещество очищают хроматографией на силикагеле с элюированием дихлорметаном (содержащим 1% конц. aммиака) при градиенте метанола (1-2%), получая 3-бромимидазо[1,2-а]пиримидин (0,29 г, 87%) в виде белого твердого вещества: H (400 МГц, СDСl3) 7,02 (1H, дд, J 7 и 4), 7,83(1H, с); 8,43 (1H, дд, J 7 и 2), 8,59 (1H, дд, J 7 и 2). 3-Бромимидазо[1,2-а]пиримидин (198 мг, 1,00 ммоль), фосфат калия (425 мг, 2,00 ммоль) и 3'(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бифенил-2-карбонитрил (581 мг, 1,80 ммоль) в N,N-диметилацетамиде (3 мл) дегазируют азотом в течение 15 мин. Добавляют тетракис(трифенилфосфин)палладий(0) (58 мг, 0,05 ммоль) и полученную смесь нагревают при 80 С в течение 18 ч. Смеси дают охладиться до комнатной температуры, разбавляют водой (50 мл) и насыщенным раствором гидрокарбоната натрия (20 мл), затем экстрагируют этилацетатом (2 х 75 мл). Объединенные органические фракции промывают насыщенным раствором соли (40 мл), сушат над безводным сульфатом натрия и упаривают, получая масло черного цвета. Полученное масло очищают хроматографией на силикагеле с элюированием дихлорметаном (содержащим 1% конц. аммиака) при градиенте метанола (1-3%). Выделенное твердое вещество растирают с диэтиловым эфиром, получая 2'-фтор-5'-(имидазо[1,2-а]пиримидин-3-ил)бифенил 2-карбонитрил в виде не совсем белого порошка: H (360 МГц, CDCl3) 6,96 (1 Н, дд, J 7 и 4), 7,41 (1 Н, т, J 9), 7,55 (1 Н, тд, J 8 и 1), 7,59-7,65 (3 Н, м), 7,71 (1 Н, тд, J 8 и 1), 7,84 (1 Н, дд, J 8 и 1), 7,92 (1 Н, с), 8,61 (1 Н,дд, J 7 и 2), 8,86 (1 Н, д, J 7 и 2); m/z (ES+) 315 (МН). Препаративный пример А. 7-Метилимидазо[1,2-а]пиримидин и 5-метилимидазо[1,2-а]пиримидин. Метоксид натрия (1,62 г, 30 ммоль) добавляют к перемешиваемому раствору полусульфата 2-аминоимидазола (2,64 г, 20 ммоль) и 1,1-диметокси-3-бутанона (2 мл) в этаноле (25 мл). Смесь кипятят с обратным холодильником в течение 8 ч, дают охладиться до комнатной температуры, затем предварительно адсорбируют непосредственно на силикагель. Очистка хроматографией на силикагеле с элюированием дихлорметаном (содержащим 1% конц. аммиака) при градиенте метанола (1-4%) приводит к получению смеси (95:5) 7-метилимидазо[1,2-а]пиримидина и 5-метилимидазо[1,2-а]пиримидина, соответственно (1,68 г, 64%), в виде кристаллического вещества белого цвета: H (400 МГц, СDСl3, 7-метилизомер) 2,64 (3 Н, с), 6,74 (1 Н, д, J 7), 7,45 (1 Н, д, J 1), 7,73 (1 Н, д, J 1), 8,29 (1 Н, д, J 7). Препаративный пример В. 3-Бром-7-(1,1-диметоксиэтил)имидазо[1,2-а]пиримидин. Эфират трифторида бора (17,03 г, 120,0 ммоль) добавляют по каплям в течение 15 мин к охлажденному(-40 С) раствору триэтилортоформиата (14,82 г, 100,0 ммоль) в дихлорметане (50 мл). Перемешивание про- 16006234 должают в течение 10 мин, затем раствор переносят на баню со смесью лед-вода и перемешивают в течение 20 мин при 0 С. Смесь охлаждают до -78 С и добавляют 3,3-диметокси-2-бутанон (6,61 г, 50,0 ммоль),затем в течение 15 мин добавляют по каплям N,N-диизопропилэтиламин (19,39 г, 150,0 ммоль). Перемешивание продолжают в течение 1 ч, затем раствор выливают в энергично перемешиваемую смесь насыщенного раствора гидрокарбоната натрия (500 мл) и дихлорметана (200 мл). Органическую фазу отделяют,промывают охлажденным льдом 1 М раствором серной кислоты (2 х 500 мл) и ледяной водой (2 х 500 мл),сушат над безводным сульфатом натрия и упаривают, получая 1,1-диэтокси-4,4-диметоксипентан-3-он(11,72 г, 100%) в виде оранжевого масла. 1,1-Диэтокси-4,4-диметоксипентан-3-он конденсируют с полусульфатом 2-аминоимидазола, как описано в примере А, получая 7-(1,1-диметоксиэтил)имидазо[1,2-а]пиримидин (6,61 г, 64%) в виде белого твердого вещества: H (400 МГц, СDСl3) 1,70 (3 Н, с), 3,28 (6 Н, с), 7,30 (1 Н, д, J 7), 7,55 (1 Н, д, J 1), 7,84(1 Н, д, J 1), 8,43 (1 Н, д, J 7). 7-(1,1-Диметоксиэтил)имидазо[1,2-а]пиримидин (207 мг, 1,00 ммоль) бромируют, как описано в примере 1, получая 3-бром-7-(1,1-диметоксиэтил)имидазо[1,2-а]пиримидин (197 мг, 69%) в виде белого твердого вещества: H (360 МГц, СDСl3) 1,70 (3 Н, с), 3,28 (6 Н, с), 7,43 (1 Н, д, J 7), 7,82 (1 Н, с), 8,39 (1 Н, д, J 7). Препаративный пример С. 2'-Циано-2-фторбифенил-3-бороновая кислота. Смесь 2-бромбензонитрила (5,1 г, 28 ммоль), 2-фторбензолбороновой кислоты (4,9 г, 35 ммоль) и фторида калия (5,37 г, 92 ммоль) в тетрагидрофуране (50 мл) дегазируют азотом в течение 10 мин. Смесь обрабатывают последовательно трис(дибензилиденацетон)дипалладием(0) (510 мг, 0,56 ммоль) и три(трет)-бутилфосфином (5,6 мл 0,2 М раствора в 1,4 диоксане, 1,12 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 15 мин. Полученную суспензию нагревают при 50 С в течение 30 мин для того, чтобы израсходовать остающиеся исходные вещества, и затем охлаждают до комнатной температуры. Реакционную смесь фильтруют, промывая слой осадка на фильтре тетрагидрофураном (50 мл). Фильтрат упаривают досуха и остаток распределяют между этилацетатом и водой. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния,фильтруют и предварительно адсорбируют непосредственно на силикагель. Очистка хроматографией на силикагеле с элюированием изогексаном при градиенте этилацетата (1-4%) дает 2'-фторбифенил-2 карбонитрил в виде твердого бледно-желтого вещества (5,5 г, 100%): H (360 МГц, CDCl3) 7,19-7,29 (2 Н,м), 7,40-7,52 (4 Н, м), 7,65 (1 Н, ддд, J 8, 8 и 1), 7,79 (1H, дд, J 8 и 1). Охлажденный (-78 С) раствор н-бутиллития (11,7 мл 2,5 М раствора в гексанах, 29,1 ммоль) в тетрагидрофуране (100 мл) обрабатывают 2,2,6,6-тетраметилпиперидином (5,16 мл) и перемешивают при -78 С в течение 15 мин. Реакционную смесь затем обрабатывают охлажденным (0 С) раствором 2'-фторбифенил 2-карбонитрила (5,50 г) в тетрагидрофуране (15 мл), добавляемым по каплям в течение 10 мин. Полученную смесь перемешивают при -78 С в течение 2 ч и затем обрабатывают триметилборатом (6,30 мл), добавляемым по каплям в течение 5 мин. Реакционную смесь перемешивают при -78 С в течение 10 мин,затем дают нагреться до комнатной температуры. Добавляют 2 н хлористо-водородную кислоту (5 мл) и смесь упаривают досуха. Остаток перемешивают с 2 н хлористо-водородной кислотой (95 мл) в течение 30 мин и затем экстрагируют диэтиловым эфиром (2 х 100 мл). Органические слои объединяют, экстрагируют 2 н раствором гидроксида натрия (100 мл) и органический слой отбрасывают. Водный слой охлаждают до 0 С и подкисляют (рН 6) 36% хлористо-водородной кислотой. После перемешивания при 0 С в течение 1 ч полученное твердое вещество отфильтровывают и сушат. Кристаллизация из смеси диэтиловый эфир/изогексан дает 2'-циано-2-фторбифенил-3-бороновую кислоту в виде твердого вещества желтого цвета (4,50 г, 67%): H (360 МГц, СDСl3) 5,23 (1 Н, с), 5,25 (1 Н, с), 7,33 (1 Н, м), 7,42-7,56 (3 Н, м), 7,65(1 Н, м), 7,77 (1 Н, м), 7,93 (1 Н, м). Препаративный пример D. 3-Бром-7-(1-метил-1-триэтилсиланилоксиэтил)имидазо[1,2-а]пиримидин. Триэтилсилилтрифторметансульфонат (4,85 мл, 21,5 ммоль) добавляют по каплям в течение 15 мин к охлажденному (-50 С) раствору 2-(3-бромимидазо[1,2-а]пиримидин-7-ил)пропан-2-ола (5,0 г, 19,5 ммоль) и-50 С в течение 20 мин, затем дают нагреться до комнатной температуры за 10 ч. Реакционную смесь разбавляют дихлорметаном (100 мл) и промывают 1 н хлористо-водородной кислотой (100 мл) и водой(100 мл), сушат над безводным сульфатом магния, фильтруют и упаривают. Полученное масло красного цвета очищают флэш-хроматографией на сухих колонках с силикагелем, элюируя дихлорметаном при градиенте метанола (0-3%), с получением 3-бром-7-(1-метил-1-триэтилсиланилоксиэтил)имидазо[1,2-а]пиримидина в виде бледно-желтого масла, которое кристаллизуется при стоянии (6,21 г, 86%): H (400 МГц,СDСl3) 0,64 (6 Н, кв, J 8), 0,97 (9 Н, т, J 8), 7,50 (1 Н, д, J 7), 7,72 (1 Н, с), 8,35 (1 Н, д, J 7), 10,36 (1H, д, J 7);m/z (ES+) 358 (MH). Пример 2. 7-(1,1-Дифторэтил)-3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин. 2-Бром-1-фтор-4-нитробензол растворяют в тетрагидрофуране (75 мл) и этаноле (75 мл) и добавляют дигидрат хлорида олова(II); полученную смесь перемешивают при комнатной температуре в течение 4 ч. Растворитель выпаривают и остаток обрабатывают охлажденным льдом 2 н раствором гидроксида натрия (200 мл). Полученную суспензию перемешивают в течение 30 мин, затем экстрагируют дихлор- 17006234 метаном (3 х 200 мл). Объединенную органическую фазу промывают водой (200 мл) и насыщенным раствором соли (200 мл), сушат над безводным сульфатом магния, фильтруют и упаривают, получая 3-бром 4-фторфениламин (7,92 г, 92%) в виде масла желтого цвета: H (360 МГц, CDCl3) 3,53 (2 Н, с), 6,53-6,57(1 Н, м), 6,83-6,85 (1 Н, м), 6,90 (1 Н, дд, J 9 и 9). Смесь 3-бром-4-фторфениламина (7,92 г, 41,7 ммоль), диэтил(3-пиридил)борана (6,74 г, 45,9 ммоль),тетракис(трифенилфосфин)палладия(0) (0,96 г, 0,83 ммоль) и карбоната калия (17,26 г, 125 ммоль) в 1,2 диметоксиэтане (30 мл) и воде (15 мл) нагревают при 80 С в течение 20 ч. После охлаждения до комнатной температуры реакционную смесь распределяют между этилацетатом (500 мл) и водой (500 мл). Органический слой промывают насыщенным раствором соли (400 мл), сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Очистка остатка флэш-хроматографией на силикагеле с элюированием дихлорметаном при градиенте этилацетата (0-20%) дает 4-фтор-3-(пиридин-3-ил)фениламин (3,64 г, 46%) в виде бесцветного масла, которое затвердевает при стоянии с получением белого твердого вещества: H (360 МГц, CDCl3) 3,65 (2 Н, с), 6,65-6,72 (2 Н, м), 6,99 (1 Н, дд, J 9 и 9), 7,33-7,37(1 Н, м), 7,84-7,86 (1 Н, м), 8,58 (1H, д, J 4), 8,76 (1 Н, м). Теплый раствор 4-фтор-3-(пиридин-3-ил)фениламина (3,64 г, 19,3 ммоль) в 1,4-диоксане (10 мл) обрабатывают 48% водным раствором бромисто-водородной кислоты (100 мл). К полученной суспензии,охлажденной до 0 С, добавляют по каплям в течение 20 мин раствор нитрита натрия (1,53 г, 22,2 ммоль) в воде (4 мл). После перемешивания при 0 С в течение 2 ч охлажденный (0 С) раствор бромида меди(I)(8,31 г, 57,9 ммоль) в 48% водном растворе бромисто-водородной кислоты (30 мл) добавляют к реакционной смеси, которую перемешивают в течение 10 мин при 0 С, затем нагревают при 50 С в течение 20 мин. Реакционную смесь охлаждают до комнатной температуры, выливают в охлажденный льдом концентрированный раствор аммиака (500 мл) и продукт экстрагируют в этилацетат (500 мл). Органический слой промывают водой (300 мл) и насыщенным раствором соли (300 мл), сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме с получением темного масла. Очистка с помощью флэшхроматографии на сухих колонках с силикагелем с элюированием изогексаном при градиенте этилацетата (10-30%) дает 3-(5-бром-2-фторфенил)пиридин (3,1 г, 64%) в виде твердого белого вещества: H (360 МГц, СDСl3) 7,09 (1 Н, дд, J 9 и 1), 7,37-7,40 (1 Н, м), 7,46-7,51 (1H, м), 7,56-7,59 (1 Н, м), 7,83-7,86 (1H, м),8,63-8,65 (1H, м), 8,77-8,79 (1H, м). 3-(5-Бром-2-фторфенил)пиридин (3,1 г, 12,3 ммоль), ацетат калия (3,62 г, 36,9 ммоль) и бис(пинаколат)дибор (3,75 г, 14,8 ммоль) растворяют в 1,4-диоксане (40 мл) и диметилсульфоксиде (0,8 мл) и смесь дегазируют азотом в течение 15 мин. Добавляют аддукт дихлор[1,1'бис(трифенилфосфино)ферроцен]палладия(II) с дихлорметаном (300 мг, 0,37 ммоль) и смесь нагревают при 90 С в течение 18 ч. Смесь охлаждают до комнатной температуры и распределяют между диэтиловым эфиром (200 мл) и 2 н раствором хлористо-водородной кислоты (50 мл). Органический слой отбрасывают, водную фазу доводят до рН 8 добавлением 4 н раствора гидроксида натрия и экстрагируют диэтиловым эфиром (2 х 500 мл). Органический слой промывают насыщенным раствором соли (50 мл), сушат над безводным сульфатом натрия, фильтруют и предварительно адсорбируют непосредственно на силикагель. Очистка колоночной флэш-хроматографией на силикагеле с элюированием 25% раствором этилацетата в изогексане дает 3-[2-фтор-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]пиридин (2,64 г, 72%) в виде желтого масла, которое кристаллизуется при стоянии: H (360 МГц, CDCl3) 1,35 (12 Н, с),7,20 (1H, дд, J 10 и 8), 7,35-7,39 (1H, м), 7,81-7,91 (3 Н, м), 8,61 (1H, дд, J 5 и 2), 8,82 (1H, с). К охлажденному (0 С) раствору 2,2-дифторпропионовой кислоты (полученной по методике, описанной в патенте США 5859051; 2,20 г, 20,0 ммоль) в дихлорметане (15 мл) добавляют по каплям оксалилхлорид (2,79 г, 22,0 ммоль) в течение 10 мин. Полученную смесь перемешивают в течение 10 мин при 0 С, затем дают нагреться до комнатной температуры в течение ночи. Смесь охлаждают до -10 С и добавляют через канюлю к охлажденному (-10 С) раствору этилвинилового эфира (1,59 г, 22,0 ммоль) и пиридина (1,74 г, 22,0 ммоль) в дихлорметане (50 мл). Реакционную смесь перемешивают в течение 10 мин при -10 С и затем в течение 5 ч при комнатной температуре. Коричневый раствор разбавляют дихлорметаном (30 мл) и промывают охлажденной льдом 1 М серной кислотой (2 х 50 мл) и ледяной водой (2 х 50 мл),сушат над безводным сульфатом натрия и упаривают, получая неочищенный 1-этокси-4,4-дифторпент-1 ен-3-он (3,28 г, 100%) в виде оранжевого масла: H (400 МГц, СDСl3) 1,38 (3 Н, т, J 7), 1,71 (3 Н, т, J 19),4,05 (2 Н, кв, J 7), 5,94 (1 Н, дт, J 12 и 1), 7,81 (1 Н, д, J 12). 1-Этокси-4,4-дифторпент-1-ен-3-он (3,28 г, 20,0 ммоль) в этаноле (10 мл) добавляют по каплям в течение 10 мин к теплой (60 С) суспензии полусульфата 2-аминоимидазола (3,96 г, 30,0 ммоль) и метоксида натрия (2,16 г, 40,0 ммоль) в этаноле (40 мл). Полученную смесь кипятят с обратным холодильником в течение 18 ч, затем охлаждают до комнатной температуры и предварительно адсорбируют непосредственно на силикагель. Очистка хроматографией на силикагеле с элюированием дихлорметаном (содержащим 1% конц. аммиака) при градиенте метанола (1-3%) дает 7-(1,1-дифторэтил)имидазо[1,2-а]пиримидин (1,80 г, 49%) в виде не совсем белого твердого вещества: H (400 МГц, CDCl3) 2,14 (3 Н, т, J 19),7,26 (1 Н, д, J 7), 7,64 (1 Н, д, J 1), 7,92 (1 Н, д, J 1), 8,56 (1 Н, д, J 7).- 18006234 7-(1,1-Дифторэтил)имидазо[1,2-а]пиримидин (0,30 г, 1,64 ммоль) бромируют, как описано в примере 1, получая 3-бром-7-(1,1-дифторэтил)имидазо[1,2-а]пиримидин (0,25 г, 59%) в виде белого твердого вещества: H (400 МГц, СDСl3) 2,14 (3 Н, т, J 19), 7,39 (1 Н, д, J 7), 7,90 (1H, с), 8,53 (1 Н, д, J 7). 3-Бром-7-(1,1-дифторэтил)имидазо[1,2-а]пиримидин (113 мг, 0,43 ммоль) подвергают сочетанию с 3-[2-фтор-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]пиридином, как описано в примере 1,получая 7-(1,1-дифторэтил)-3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин в виде белого порошка: H (360 МГц, ДМСО) 2,11 (3 Н, т, J 7), 7,36 (1 Н, д, J 7), 7,55-7,64 (2 Н, м), 7,83-7,87 (1 Н, м), 7,998,01 (1 Н, м), 8,11-8,13 (1 Н, м), 8,21 (1 Н, с), 8,66 (1 Н, дд, J 5 и 1), 8,91 (1 Н, с), 9,27 (1 Н, д, J 7). Пример 3. 2-3-[4-Фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол. Раствор 3-гидрокси-3-метил-2-бутанона (10,75 мл, 100 ммоль) и триэтиламина (21 мл, 150 ммоль) в дихлорметане (125 мл) обрабатывают уксусным ангидридом (11,8 мл, 125 ммоль), затем 4-диметиламинопиридином (610 мг, 5 ммоль) и перемешивают реакционную смесь при комнатной температуре в течение 14 ч. Добавляют метанол (10 мл) и продолжают перемешивание в течение еще 30 мин, затем концентрируют полученную смесь в вакууме. Остаток растворяют в эфире (300 мл) и промывают 0,5 н хлористо-водородной кислотой (2 х 300 мл), водой, насыщенным водным раствором гидрокарбоната натрия,сушат над безводным сульфатом магния, фильтруют и упаривают досуха, получая 1,1-диметил-2 оксопропиловый эфир уксусной кислоты в виде желтой жидкости (13,5 г, 94%): H (400 МГц, СDСl3) 1,46(6 Н, с), 2,09 (3 Н, с), 2,12 (3 Н, с). 1,1-Диметил-2-оксопропиловый эфир уксусной кислоты превращают в 4,4-диэтокси-1,1-диметил-2 оксобутиловый эфир уксусной кислоты, как описано в примере В, и конденсируют с полусульфатом 2 аминоимидазола, как описано в примере А, получая 2-(имидазо[1,2-а]пиримидин-7-ил)пропан-2-ол в виде оранжевого твердого вещества: H (400 МГц, CDCl3) 1,60 (6 Н, с), 5,31 (1 Н, с), 7,10 (1 Н, д, J 7), 7,54(1 Н, д, J 1), 7,72 (1 Н, д, J 1), 8,49 (1 Н, д, J 7). 2-(Имидазо[1,2-а]пиримидин-7-ил)пропан-2-ол бромируют, как описано в примере 1, получая 2-(3 бромимидазо[1,2-а]пиримидин-7-ил)пропан-2-ол в виде не совсем белого твердого вещества: H (400 МГц,СDСl3) 1,62 (6 Н, с), 4,20 (1 Н, с), 7,17 (1 Н, д, J7), 7,76 (1 Н, с), 8,40 (1 Н, д, J 7). 2-(3-Бромимидазо[1,2-а]пиримидин-7-ил)пропан-2-ол подвергают сочетанию с 3-[2-фтор-5-(4,4,5,5 тетраметил[1,3,2]диоксаборолан-2-ил)фенил]пиридином, как описано в примере 1, получая 2-3-[4-фтор 3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол в виде белого твердого вещества. Бисгидрохлоридная соль (из смеси этилацетат/этанол): H (400 МГц, ДМСО) 1,56 (6 Н, с), 7,73 (1 Н, дд, J 11 и 9), 7,81-7,90 (3 Н, м), 8,09 (1 Н, дд, J 7 и 2), 8,42 (1 Н, дд, J 7 и 1), 8,55 (1 Н, с), 8,81 (1 Н, дд, J 5 и 1), 9,06Chem., 1997, 34(2), 509-513; 500 мг, 3,1 ммоль) и диэтилацеталя бромацетальдегида (1,38 мл, 9,2 ммоль) в этаноле (10 мл) обрабатывают бромисто-водородной кислотой (0,5 мл 48% водного раствора) и затем нагревают при 70 С в течение 12 ч. Реакционную смесь охлаждают до комнатной температуры и предварительно адсорбируют непосредственно на силикагель. Очистка хроматографией на силикагеле с элюированием дихлорметаном (содержащим 1% концентрированного аммиака) при градиенте метанола (15%) дает 7-трифторметилимидазо[1,2-а]пиримидин (500 мг, 87%) в виде твердого вещества кремового цвета: H (400 МГц, СDСl3) 7,22 (1 Н, д, J 7), 7,74 (1 Н, д, J 1), 8,03 (1 Н, д, J 1), 8,67 (1 Н, д, J 7). 7-Трифторметилимидазо[1,2-а]пиримидин (0,20 г, 1,07 ммоль) бромируют, как описано в примере 1, получая 3-бром-7-трифторметилимидазо[1,2-а]пиримидин (0,28 г, 98%) в виде белого твердого вещества: H (400 МГц, CDCl3) 7,35 (1 Н, д, J 7), 8,02 (1 Н, с), 8,62 (1 Н, д, J 7). К охлажденному (-78 С) раствору 3-бром-7-трифторметилимидазо[1,2-а]пиримидина (1,0 г, 3,78 ммоль) в тетрагидрофуране (20 мл) добавляют изопропилмагнийхлорид (2,08 мл 2 М раствора в тетрагидрофуране,4,16 ммоль). После перемешивания в течение 5 мин добавляют хлорид трибутилолова (1,2 мл, 4,42 ммоль) и реакционную смесь перемешивают в течение 10 мин при -78 С, затем дают нагреться до комнатной температуры, получая раствор 3-трибутилстаннил-7-трифторметилимидазо[1,2-а]пиримидина в тетрагидрофуране (приблизительно 0,15 М): m/z (ES+) 474, 476, 478 (MH). К 3-трибутилстаннил-7-трифторметилимидазо[1,2-а]пиримидину (73 мл 0,13 М раствора в тетрагидрофуране, 9,44 ммоль) добавляют 5-бром-2-фторнитробензол (4,20 г, 19 ммоль), затем тетракис(трифенилфосфин)палладий(0) (0,62 г). Полученную смесь кипятят с обратным холодильником в течение 4 ч. Растворитель выпаривают при пониженном давлении и остаток хроматографируют на силикагеле с элюированием 30% раствором этилацетата в дихлорметане, получая 3-(4-фтор-3-нитрофенил)-7 трифторметилимидазо[1,2-а]пиримидин: H (400 МГц, ДМСО) 7,59 (1 Н, д, J 7), 7,83 (1 Н, дд, J 11 и 9),8,18 (1 Н, м) , 8,36 (1 Н, с), 8,53 (1H, дд, J 7 и 2), 9,36 (1 Н, д, J 7); m/z (ES+) 327 (МН). К суспензии 3-(4-фтор-3-нитрофенил)-7-трифторметилимидазо[1,2-а]пиримидина (0,819 г, 2,51 ммоль) в этаноле (10 мл) добавляют безводный хлорид олова(II) (2,0 г). После перемешивания при комнатной температуре в течение 2 ч полученный раствор обрабатывают 30% гидроксидом аммония (40 мл). Смесь перемешивают в течение 10 мин, затем концентрируют при пониженном давлении. Остаток обрабатыва- 19006234 ют этанолом и упаривают при пониженном давлении для удаления оставшейся воды. Остаток затем кипятят с 10% раствором метанола в дихлорметане и нерастворимые вещества отделяют фильтрованием. Фильтрат упаривают в вакууме, остаток обрабатывают горячим 50% раствором толуола в этилацетате, а нерастворимые вещества удаляют фильтрованием. Фильтрат упаривают при пониженном давлении и остаток перекристаллизовывают из горячего толуола с получением 2-фтор-5-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)фениламина: H (400 МГц, ДМСО) 5,42 (2 Н, уш.), 6,87 (1H, м), 7,07 (1H, дд, J 9 и 2), 7,20 (1H, дд, J 12 и 8), 7,50 (1H, д, J 7), 8,13 (1H, с), 9,18 (1H, д, J 7); m/z (ES+) 297 (МН). К охлажденной (4 С) смеси бромида меди(II) (0,285 г) и безводного ацетонитрила (4 мл) добавляют трет-бутилнитрит (0,20 мл), затем по каплям в течение 5 мин добавляют раствор 2-фтор-5-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)фениламина (0,297 г, 1 ммоль) в ацетонитриле (8 мл). Реакционную смесь затем перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь очищают хроматографией на силикагеле с элюированием 10% раствором этилацетата в дихлорметане, получая 3(3-бром-4-фторфенил)-7-трифторметилимидазо[1,2-а]пиримидин: m/z (ES+) 360, 362 (МН). К раствору 3-(3-бром-4-фторфенил)-7-трифторметилимидазо[1,2-а]пиримидина (0,190 г, 0,528 ммоль) в N,N-диметилформамиде (5 мл) добавляют 2-(три-н-бутилстаннил)пиридин (0,265 г), затем аддукт дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) с дихлорметаном (0,187 г). Полученную смесь нагревают при 100 С в течение 9 ч. Растворитель выпаривают при пониженном давлении и остаток хроматографируют на силикагеле с элюированием 4% раствором метанола в дихлорметане. Остаток затем помещают на картридж с сильной катионообменной смолой. При элюировании метанолом появляются примеси неосновного характера. Дальнейшее элюирование 2 М раствором аммиака в метаноле дает неочищенный продукт. Дополнительная очистка препаративной тонкослойной хроматографией на силикагеле с использованием в качестве элюента 4% раствора метанола в дихлорметане и перекристаллизация остатка из смеси толуол/изогексан дают 3-[4-фтор-3-(пиридин-2-ил)фенил]-7-трифторметилимидазо[1,2 а]пиримидин в виде желтых игл: H (400 МГц, ДМСО) 7,46 (1 Н, м), 7,53 (1 Н, д, J 7), 7,61 (1 Н, дд, J 11 и 9), 7,86-7,91 (2 Н, м), 7,95-7,99 (1 Н, м), 8,24 (1 Н, дд, J 7 и 2), 8,30 (1 Н, с), 8,74-8,76 (1H, м) , 9,27(1 Н, д, J 7); m/z (ES+) 359 (MH). Пример 5. 3-[4-Фтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин. 3-(3-Бром-4-фторфенил)-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 3-(трин-бутилстаннил)пиридином, как описано в примере 4, получая 3-[4-фтор-3-(пиридин-3-ил)фенил]-7 трифторметилимидазо[1,2-а]пиримидин: H (400 МГц, ДМСО) 7,51 (1 Н, д, J 7), 7,53-7,64 (2 Н, м), 7,857,89 (1 Н, м), 8,03 (1 Н, дд, J 7 и 2), 8,12 (1 Н, дд, J 8 и 2), 8,34 (1 Н, с), 8,66 (1 Н, дд, J 5 и 2), 8,90 (1 Н, т, J 2),9,38 (1 Н, д, J 7); m/z (ES+) 359 (МН). Пример 6. 3-[4-Фтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин. Раствор 3-(3-бром-4-фторфенил)-7-трифторметилимидазо[1,2-а]пиримидина (70 мг, 0,19 ммоль) и 4-(три-н-бутилстаннил)пиридина (107 мг, 0,29 ммоль) в N,N-диметилацетамиде (3 мл) дегазируют азотом. Добавляют тетракис(трифенилфосфин)палладий(0) (30 мг, 0,026 ммоль) и иодид меди(I) (15 мг,0,079 ммоль) и полученную смесь нагревают при 80 С в течение 6 ч. Растворитель выпаривают в вакууме и остаток распределяют между дихлорметаном и водой, слои разделяют и водный слой повторно экстрагируют дихлорметаном. Объединенные органические слои промывают насыщенным раствором соли,сушат (МgSO4) и упаривают. Остаток очищают с помощью препаративной тонкослойной хроматографии на силикагеле, используя в качестве элюента смесь 30% этилацетат/дихлорметан, и получают желтое твердое вещество. Дополнительная очистка препаративной тонкослойной хроматографией на силикагеле с элюированием смесью 2% метанол/дихлорметан дает 3-[4-фтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин в виде твердого вещества кремового цвета: H (360 МГц, ДМСО) 7,52(1 Н, с), 8,72 (2 Н, м), 9,37 (1 Н, д, J 7); m/z (ES+) 359 (МН). Альтернативный способ. 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 4-[2-фтор-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]пиридином (ср. с примером 9, приведенным ниже), как описано в примере 1, получая 3-[4-фтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин в виде твердого вещества кремового цвета. Пример 7. 3-[2,4-Дифтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин. Смесь 3-бром-2,4-дифторфениламина (полученного по методике, описанной в eвропейской патентной заявке ЕР-А-0184384; 12,5 г, 60 ммоль), диэтил(3-пиридил)бора (10,6 г, 72 ммоль) и карбоната калия(16,6 г, 120 ммоль) в тетрагидрофуране (150 мл) и воде (50 мл) дегазируют азотом в течение 15 мин. К смеси добавляют тетракис(трифенилфосфин)палладий(0) (2,1 г, 1,8 ммоль) и полученную реакционную смесь кипятят с обратным холодильником в течение 4 дней. Смесь охлаждают до комнатной температуры и удаляют большую часть тетрагидрофурана на роторном испарителе. Остаток разбавляют водой (250 мл),экстрагируют этилацетатом (300 мл), органические слои промывают водой, насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и предварительно адсорбируют непосредственно на силикагель. Очистка хроматографией на силикагеле с элюированием изогексаном (содержащим 1%- 20006234 триэтиламина) при градиенте этилацетата (10-50%) дает 2,4-дифтор-3-(пиридин-3-ил)фениламин в виде твердого вещества кремового цвета (5,8 г, 47%): H (400 МГц, СDСl3) 3,69 (2 Н, уш.), 6,72-6,88 (2 Н, м),7,39 (1 Н, дд, J 8 и 5), 7,80 (1 Н, д, J 8), 8,62 (1 Н, дд, J 5 и 1), 8,72 (1 Н, с). 2,4-Дифтор-3-(пиридин-3-ил)фениламин бромдезаминируют, как описано в примере 2, получая 3(3-бром-2,6-дифторфенил)пиридин в виде белого твердого вещества: H (400 МГц, CDCl3) 6,97 (1 Н, ддд, J 9, 9 и 2), 7,40-7,44 (1 Н, м), 7,55-7,60 (1 Н, м), 7,77-7,81 (1 Н, м), 8,66 (1 Н, дд, J 5 и 2), 8,71 (1 Н, с). Смесь 3-(3-бром-2,6-дифторфенил)пиридина (2,97 г, 11 ммоль), ацетата калия (2,16 г, 22 ммоль) и бис(неопентилгликолят)дибора (2,86 г, 12,7 ммоль) в 1,4-диоксане (30 мл) нагревают при 90 С в течение 16 ч. Реакционную смесь охлаждают, фильтруют (промывая осадок на фильтре небольшим количеством диэтилового эфира) и фильтрат концентрируют в вакууме. Остаток распределяют между диэтиловым эфиром (100 мл) и 1 М раствором гидроксида натрия (100 мл) и отбрасывают органический слой. Водный слой промывают дополнительным количеством диэтилового эфира и затем охлаждают на бане с ледяной водой. Добавлением 36% хлористо-водородной кислоты доводят рН до приблизительно 6 и выдерживают в течение 1 ч. Полученное твердое вещество отфильтровывают и сушат в вакууме, получая 2,4 дифтор-3-(пиридин-3-ил)бензолбороновую кислоту (2,2 г, 85%) в виде серого твердого вещества: m/z(ES+) 236 (МН). 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 2,4-дифтор-3-(пиридин 3-ил)бензолбороновой кислотой, как описано в примере 1, получая 3-[2,4-дифтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин в виде не совсем белого твердого вещества. Бисгидрохлоридная соль (из смеси этилацетат/этанол): H (400 МГц, ДМСО) 7,60-7,65 (2 Н, м), 7,90-7,96 (2 Н, м),8,34 (1 Н, с), 8,47 (1 Н, д, J 8), 8,87 (1 Н, дд, J 5 и 1), 9,08 (1 Н, с), 9,32 (1H, дд, J 7 и 3). Пример 8. 3-[2,4-Дифтор-3-(пиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин. Смесь 3-бром-2,4-дифторфениламина (5,2 г, 25 ммоль), 2-(три-н-бутилстаннил)пиридина (11,0 г,30 ммоль), хлорида лития (10,6 г, 250 ммоль) и иодида меди(I) (476 мг, 2,5 ммоль) в тетрагидрофуране(100 мл) дегазируют азотом в течение 20 мин и затем к смеси добавляют тетракис(трифенилфосфин)палладий(0). Полученную реакционную смесь кипятят с обратным холодильником в течение 5 дней. Смесь охлаждают до комнатной температуры, затем распределяют между этилацетатом и 10% гидроксидом аммония. Органический слой промывают водой, насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и предварительно адсорбируют непосредственно на силикагель. Очистка хроматографией на силикагеле с элюированием изогексаном (содержащим 0,5% триэтиламина) при градиенте этилацетата (20-50%) дает 2,4-дифтор-3-(пиридин-2-ил)фениламин в виде коричневого масла (550 мг,11%): H (400 МГц, CDCl3) 3,65 (2 Н, уш.), 6,74-6,84 (2 Н, м), 7,31 (1H, ддд, J 7, 5 и 1), 7,46-7,51 (1H, м),7,78 (1H, ддд, J 8, 8 и 2), 8,74-8,77 (1H, м); m/z (ES+) 207 (МН). 2,4-Дифтор-3-(пиридин-2-ил)фениламин бромдезаминируют, как описано в примере 2, получая смесь (50:50) 2-(3-бром-2,6-дифторфенил)пиридина и 2-(2,6-дифторфенил)пиридина в виде бесцветного масла, которое используют без дополнительной очистки: m/z (ES+) 269/272 и 192 (MH). Смесь неочищенного 2-(3-бром-2,6-дифторфенил)пиридина (300 мг, 1,1 ммоль), ацетата калия (220 мг,2,2 ммоль) и бис(пинаколат)дибора (350 мг, 1,4 ммоль) в 1,4-диоксане (3 мл) нагревают при 90 С в течение 14 ч. Реакционную смесь охлаждают, фильтруют (промывая осадок на фильтре небольшим количеством диэтилового эфира) и фильтрат концентрируют в вакууме. Остаток перемешивают с 2 н раствором гидроксида натрия (20 мл) в течение 10 мин и затем фильтруют. Фильтрат промывают диэтиловым эфиром (2 х 20 мл) и органические слои отбрасывают. Водную фазу охлаждают на бане с ледяной водой, доводят рН до приблизительно 8 добавлением 5 н хлористо-водородной кислоты, затем экстрагируют диэтиловым эфиром. Органический слой сушат над безводным сульфатом магния, фильтруют и упаривают досуха, получая 2-[2,6-дифтор-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]пиридин (170 мг,48%) в виде бледно-желтого (цвета соломы) твердого вещества: m/z (ES+) 318 (MH). 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 2-[2,6-дифтор-3-(4,4,5,5 тетраметил[1,3,2]диоксаборолан-2-ил)фенил]пиридином, как описано в примере 1, получая 3-[2,4-дифтор-3-(пиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин в виде бледно-желтого твердого вещества. Бисгидрохлоридная соль (из смеси этилацетат/этанол): H (360 МГц, ДМСО) 7,55 (1 Н, дд, J 9 и 9), 7,62-7,68 (2 Н, м), 7,86-7,96 (2 Н, м), 8,14 (1 Н, ддд, J 8, 8 и 2), 8,38 (1H, с), 8,84 (1 Н, д, J 5), 9,30 (1 Н, дд,J 7 и 3); m/z (ES+) 377 (MH). Пример 9. 2-3-[4-Фтор-3-(пиридин-4-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол. К дегазированному раствору 2-бром-1-фтор-4-нитробензола (6,44 г, 29,3 ммоль), 4-(три-н-бутилстаннил)пиридина (14,0 г, 38,0 ммоль), хлорида лития (12,4 г, 293 ммоль) и иодида меди(I) (0,56 г, 2,93 ммоль) в N,N-диметилацетамиде (40 мл) добавляют тетракис(трифенилфосфин)палладий(0) (1,69 г, 1,46 ммоль) и реакционную смесь нагревают при 80 С в течение 18 ч. После охлаждения до комнатной температуры растворитель выпаривают, остаток разбавляют дихлорметаном (800 мл), полученную смесь энергично перемешивают в течение 30 мин и затем фильтруют. Органический слой промывают водой (500 мл) и насыщенным раствором соли (300 мл), сушат над безводным сульфатом магния, фильтруют и упаривают, получая масло черного цвета. Остаток очищают хроматографией на силикагеле с элюированием изо- 21006234 гексаном (содержащим 1% метанола и 1% триэтиламина) при градиенте этилацетата (20-50%), получая 4-(2-фтор-5-нитрофенил)пиридин в виде не совсем белого твердого вещества (5,60 г, 88%): H (360 МГц,CDCl3) 7,38 (1 Н, т, J 9), 7,50-7,53 (2 Н, м), 8,30-8,35 (1 Н, м), 8,41-8,44 (1 Н, м), 8,76-8,78 (2 Н, м). К раствору 4-(2-фтор-5-нитрофенил)пиридина (1,0 г, 5,58 ммоль) в этаноле (30 мл) и этилацетате(10 мл) добавляют оксид платины(IV) (52 мг) и смесь перемешивают в атмосфере водорода (40 psi=40 фунтов/кв.дюйм) в течение 35 мин. Реакционную смесь фильтруют через мелкозернистую стекловолокнистую фильтровальную бумагу и фильтрат упаривают досуха, получая 4-фтор-3-(пиридин-4-ил)фениламин (862 мг, 100%) в виде белого твердого вещества: H (360 МГц, СDСl3) 3,49 (2 Н, с), 6,66-6,70 (1 Н, м),6,71-6,76 (1 Н, м), 6,99 (1 Н, т, J 9), 7,44-7,46 (2 Н, м), 8,66 (2 Н, д, J 5). 4-Фтор-(3-пиридин-4-ил)фениламин (0,58 г, 3,08 ммоль) бромдезаминируют по методике, приведенной в примере 2, получая 4-(5-бром-2-фторфенил)пиридин (464 мг, 60%) в виде белого твердого вещества: H (360 МГц, CDCl3) 7,38 (1 Н, т, J 9), 7,59-7,62 (2 Н, м), 7,68-7,73 (1 Н, м), 7,84 (1 Н, дд, J 7 и 3),8,68 (2 Н, д, J 5 и 3). Смесь 4-(5-бром-2-фторфенил)пиридина (3,8 г, 15,1 ммоль), ацетата калия (2,96 г, 30,1 ммоль) и бис(пинаколат)дибора (4,21 г, 16,6 ммоль) в 1,4-диоксане (50 мл) и диметилсульфоксиде (1 мл) дегазируют азотом в течение 1 ч. Добавляют аддукт дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) с дихлорметаном (370 мг, 0,5 ммоль) и полученную смесь нагревают при 90 С в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют и осадок на фильтре промывают диэтиловым эфиром. Фильтрат упаривают досуха и остаток в течение 20 мин перемешивают с охлажденным льдом 2 н раствором гидроксида натрия (100 мл). Водную смесь фильтруют и фильтрат промывают диэтиловым эфиром (2 х 75 мл). Органические слои отбрасывают, водную фазу охлаждают до 0 С и доводят рН до 8 добавлением 36% хлористо-водородной кислоты. Полученное твердое вещество отфильтровывают и растирают с диэтиловым эфиром, получая 4-фтор-3-(пиридин-4-ил)бензолбороновую кислоту в виде желтовато-коричневого твердого вещества (1,51 г, 46%): H (360 МГц, ДМСО) 7,34 (1 Н, дд, J 11 и 8), 7,61 (2 Н, д, J 5), 7,88-7,92 (1 Н, м), 8,05 (1H, дд, J 8 и 1), 8,26 (2 Н, с), 8,70 (2 Н, д, J 5); m/z (ES+) 218(MH). Водный фильтрат экстрагируют диэтиловым эфиром. Органическую фазу промывают водой,насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и упаривают, получая 4-[2-фтор-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]пиридин в виде темного масла (1,28 г,29%), которое затвердевает при стоянии в течение нескольких дней: H (360 МГц, CDCl3) 1,36 (12 Н, с),7,19 (1H, дд, J 11 и 8), 7,50-7,53 (2 Н, м), 7,82-7,87 (1H, м), 7,93 (1H, дд, J 8 и 1), 8,67 (2 Н, дд J 4 и 1); m/z(ES+) 300 (МН). 2-(3-Бромимидазо[1,2-а]пиримидин-7-ил)пропан-2-ол подвергают сочетанию с 4-фтор-3-(пиридин 4-ил)бензолбороновой кислотой, как описано в примере 1, получая 2-3-[4-фтор-3-(пиридин-4-ил)фенил] имидазо[1,2-а]пиримидин-7-илпропан-2-ол в виде белого твердого вещества (240 мг, 58%). Бисгидрохлоридная соль (из смеси этилацетат/этанол): H (360 МГц, ДМСО) 1,56 (6 Н, с), 7,77 (1H, дд, J 11 и 9),7,85 (1H, д, J 7), 7,94-7,98 (1H, м), 8,12-8,15 (3 Н, м), 8,55 (1H, с), 8,95 (2 Н, д, J 6), 9,38 (1H, д, J 7); m/z(ES+) 349 (МН). Пример 10. 3-[2-Фтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин. 3-Бромпиридин и 2-фторбензолбороновую кислоту подвергают сочетанию по методике, описанной в примере 1, получая 3-(2-фторфенил)пиридин в виде бледно-желтого масла, которое кристаллизуется при стоянии: H (360 МГц, ДМСО) 7,33-7,40 (2 Н, м), 7,46-7,55 (2 Н, м), 7,61 (1 Н, ддд, J 8, 8 и 2), 7,96-8,01(1H, м), 8,61 (1 Н, дд, J 5 и 2), 8,77 (1H, с). 3-(2-Фторфенил)пиридин литиируют и подвергают взаимодействию с триметилборатом, как описано в примере С, получая 2-фтор-3-(пиридин-3-ил)бензолбороновую кислоту в виде белого твердого вещества: m/z (ES+) 218 (МН). 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 2-фтор-3-(пиридин-3-ил) бензолбороновой кислотой, как описано в примере 1, получая 3-[2-фтор-3-(пиридин-3-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин в виде не совсем белого твердого вещества. Бисгидрохлоридная соль (из смеси этилацетат/этанол): H (360 МГц, ДМСО) 7,62 (2 Н, дд, J 7 и 7), 7,85-7,96 (3 Н, м), 8,36 (1H,с), 8,58 (1H, д, J 8), 8,86 (1H, дд, J 5 и 1), 9,14 (1H, с), 9,33 (1H, дд, J 7 и 3); m/z (ES+) 359 (МН). Пример 11. 2-3-[2-Фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол. 2-(3-Бромимидазо[1,2-а]пиримидин-7-ил)пропан-2-ол подвергают сочетанию с 2-фтор-3-(пиридин 3-ил)бензолбороновой кислотой, как описано в примере 1, получая 2-3-[2-фтор-3-(пиридин-3-ил)фенил] имидазо[1,2-а]пиримидин-7-илпропан-2-ол в виде белого твердого вещества. Бисгидрохлоридная соль(1H, дд, J 7 и 3); m/z (ES+) 349 (МН). Пример 12. 3-[2-Фтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин. Смесь гидрохлорида 4-бромпиридина (7,5 г, 38,6 ммоль) и 2-фторбензолбороновой кислоты (6,75 г,48 ммоль) в тетрагидрофуране (80 мл) и 2 М растворе карбоната натрия (58 мл) дегазируют азотом в течение 20 мин, затем добавляют тетракис(трифенилфосфин)палладий(0) (1,34 г, 1,2 ммоль) и полученную- 22006234 реакционную смесь кипятят с обратным холодильником в течение 24 ч. Смесь охлаждают до комнатной температуры, затем распределяют между этилацетатом и 10% карбонатом натрия. Органический слой промывают водой, насыщенным раствором гидрокарбоната натрия, сушат над безводным сульфатом магния, фильтруют и предварительно адсорбируют непосредственно на силикагель. Очистка хроматографией на силикагеле с элюированием изогексаном (содержащим 0,5% триэтиламина) при градиенте этилацетата (20-40%) дает 4-(2-фторфенил)пиридин в виде желтого масла, которое кристаллизуется при стоянии (6,26 г, 94%): H (400 МГц, СDСl3) 7,17-7,22 (1 Н, м), 7,26 (1 Н, ддд, J 8, 8 и 1), 7,38-7,44 (1 Н, м),7,47-7,50 (3 Н, м) , 8,68 (2 Н, д, J 4); m/z (ES+) 174 (МН). 4-(2-Фторфенил)пиридин литиируют и подвергают взаимодействию с триметилборатом, как описано в примере С, получая 2-фтор-3-(пиридин-4-ил)бензолбороновую кислоту в виде твердого белого вещества: m/z (ES+) 218 (МН). 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 2-фтор-3-(пиридин-4-ил) бензолбороновой кислотой, как описано в примере 1, получая 3-[2-фтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин в виде твердого белого вещества. Бисгидрохлоридная соль (из смеси этилацетат/этанол): H (400 МГц, ДМСО) 7,64-7,70 (2 Н, м), 7,95-8,01 (2 Н, м), 8,37 (1 Н, с), 8,39 (2 Н, с),9,05-9,07 (2 Н, м), 9,40 (1 Н, дд, J 7 и 3); m/z (ES+) 359 (МН). Пример 13. 2-3-[2-Фтор-3-(пиридин-4-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол. 2-(3-Бромимидазо[1,2-а]пиримидин-7-илпропан-2-ол подвергают сочетанию с 2-фтор-3-(пиридин 4-ил)бензолбороновой кислотой, как описано в примере 1, получая 2-3-[2-фтор-3-(пиридин-4-ил)фенил] имидазо[1,2-а]пиримидин-7-илпропан-2-ол в виде белого твердого вещества. Бисгидрохлоридная соль (из смеси этилацетат/этанол): H (360 МГц, ДМСО) 1,56 (6 Н, с), 7,69 (1 Н, дд, J 8 и 8), 7,84-7,92 (2 Н, м), 7,998,04 (1 Н, м), 8,21 (2 Н, д, J 6), 8,53 (1 Н, с), 8,98 (2 Н, д, J 6), 9,30 (1H, дд, J 7 и 3); m/z (ES+) 349 (МН). Пример 14. 3-[2-Фтор-3-(пиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин. 2-Бромпиридин и 2-фторбензолбороновую кислоту подвергают сочетанию по методике, описанной в примере 12, получая 2-(2-фторфенил)пиридин в виде бледно-желтого масла, которое кристаллизуется при стоянии: H (400 МГц, СDСl3) 7,13-7,19 (1H, м), 7,24-7,28 (2 Н, м), 7,35-7,41 (1H, м), 7,73-7,81 (2 Н, м),7,97 (1H, ддд J 8, 8 и 2), 8,72-8,74 (1H, м); m/z (ES+) 174 (МН). 2-(2-Фторфенил)пиридин литиируют и подвергают взаимодействию с триметилборатом, как описано в примере С, получая 2-фтор-3-(пиридин-2-ил)бензолбороновую кислоту в виде белого твердого вещества: m/z (ES+) 218 (МН). 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 2-фтор-3-(пиридин-2-ил) бензолбороновой кислотой, как описано в примере 1, получая 3-[2-фтор-3-(пиридин-2-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин в виде белого твердого вещества. Бисгидрохлоридная соль (из смеси этилацетат/этанол): H (360 МГц, ДМСО) 7,61-7,71 (3 Н, м), 7,87-7,91 (1H, м), 8,07-8,11 (2 Н, м), 8,208,24 (1H, м), 8,42 (1H, с), 8,87 (1H, дд, J 5 и 1), 9,42 (1H, дд, J 7 и 3); m/z (ES+) 359 (МН). Пример 15. 2-3-[2-Фтор-3-(пиридин-2-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол. 2-(3-Бромимидазо[1,2-а]пиримидин-7-ил)пропан-2-ол подвергают сочетанию с 2-фтор-3-(пиридин 2-ил)бензолбороновой кислотой, как описано в примере 1, получая 2-3-[2-фтор-3-(пиридин-2-ил)фенил] имидазо[1,2-а]пиримидин-7-илпропан-2-ол в виде белого твердого вещества. Бисгидрохлоридная соль(из смеси этилацетат/этанол): H (360 МГц, ДМСО) 1,57 (6 Н, с), 7,62 (1 Н, дд, J 7 и 5), 7,64 (1H, с), 7,807,85 (1H, м), 7,89 (1 Н, д, J 7), 8,03 (1H, с), 8,10-8,19 (2 Н, м), 8,62 (1H, с), 8,83 (1H, д, J 5), 9,35 (1H, дд, J 7 и 3); m/z (ES+) 349 (МН). Пример 16. 3-[4-Фтор-3-(пиридин-2-ил)фенил]имидазо[1,2-а]пиримидин. К охлажденному (-78 С) раствору 3-бромимидазо[1,2-а]пиримидина (500 мг, 2,5 ммоль) в тетрагидрофуране (20 мл) добавляют изопропилмагнийхлорид (1,39 мл 2,0 М раствора в тетрагидрофуране, 2,78 ммоль). После перемешивания в течение 5 мин добавляют хлорид три-н-бутилолова (0,8 мл, 2,90 ммоль) и реакционную смесь перемешивают в течение 10 мин при -78 С, затем дают нагреться до комнатной температуры, получая раствор 3-трибутилстаннилимидазо[1,2-а]пиримидина в тетрагидрофуране: m/z (ES+) 407,409, 411 (МН). К раствору добавляют 2-(5-бром-2-фторфенил)пиридин (100 мг, 0,4 ммоль), тетракис(трифенилфосфин)палладий(0) (150 мг, 0,13 ммоль) и смесь кипятят с обратным холодильником в течение 2 ч. Реакционной смеси дают охладиться до комнатной температуры и удаляют растворитель. Очистка хроматографией на силикагеле с элюированием дихлорметаном, содержащим 4% метанола, и последующая перекристаллизация из смеси толуол/диэтиловый эфир дают 3-[4-фтор-3-(пиридин-2-ил)фенил]имидазо[1,2 а]пиримидин в виде белого твердого вещества: H (400 МГц, CDCl3) 8,73-8,75 (1H, м), 8,68 (1H, дд, J 7 и 2), 8,60 (1H, дд, J 4 и 2), 8,23 (1H, дд, J 7 и 2), 7,49 (1H, с), 7,87-7,90 (1H, м), 7,79-7,84 (1H, м), 7,53-7,58(1H, м), 7,30-7,38 (2 Н, м), 6,94 (1H, дд, J 7 и 4); m/z (ES+) 291 (MH). Пример 17. 3,2'-Дифтор-5'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил. Смесь 2,6-дифторбензонитрила (19,0 г, 137 ммоль) и этанола (200 мл), предварительно насыщенную газообразным аммиаком, нагревают при 140 С в автоклаве в течение 6 ч (конечное давление 200 фунтов/кв.дюйм (13,6 атм или 1,36 МПа. Смеси дают охладиться до комнатной температуры, упаривают- 23006234 досуха и растирают с водой (200 мл). Твердое вещество отфильтровывают и оставляют сушиться на воздухе, получая 2-амино-6-фторбензонитрил (18,0 г, 97%) в виде не совсем белого твердого вещества: H(360 МГц, CDCl3) 4,53 (3 Н, с), 6,44-6,52 (2 Н, м), 7,24-7,30 (1 Н, м). 2-Амино-6-фторбензонитрил (18,0 г, 132 ммоль) растворяют в горячем 1,4-диоксане (20 мл), добавляют 48% бромисто-водородную кислоту (200 мл) и смесь охлаждают до 0 С, затем в течение 1,5 ч добавляют по каплям раствор нитрита натрия (10,5 г, 152 ммоль) в воде (20 мл). Полученную смесь перемешивают в течение 1,5 ч при 0 С и выливают в охлажденный (0 С) раствор бромида меди(I) (56,8 г, 396 ммоль) в 48% бромисто-водородной кислоте (50 мл). Раствор перемешивают при 0 С в течение 15 мин, затем при 50 С в течение 20 мин. Смесь охлаждают до комнатной температуры, разбавляют водой (1200 мл) и экстрагируют этилацетатом (2 х 400 мл). Объединенные органические слои промывают 10% водным раствором аммиака (400 мл), водой (400 мл) и насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и упаривают досуха с получением масла оранжевого цвета. Очистка хроматографией на силикагеле с элюированием изогексаном при градиенте этилацетата (2-4%) дает 2-бром-6 фторбензонитрил (18,5 г, 70%) в виде белого твердого вещества: H (400 МГц, CDCl3) 7,17-7,23 (1 Н, ддд,J 8, 8 и 1), 7,44-7,52 (2 Н, м). Суспензию 2-бром-6-фторбензонитрила (2,50 г, 12,5 ммоль), фторида калия (2,40 г, 41,3 ммоль) и 2(2-фтор-5-нитрофенил)-4,4,5,5-тетраметил[1,3,2]диоксаборолана (4,67 г, 17,5 ммоль) в тетрагидрофуране(50 мл) дегазируют азотом в течение 30 мин. Добавляют трис(дибензилиденацетон)дипалладий(0) и тритрет-бутилфосфин (0,2 М раствор в 1,4-диоксане, 3,7 мл) и смесь перемешивают при комнатной температуре в течение 15 мин, затем при 50 С в течение 18 ч. После охлаждения до комнатной температуры полученную темную суспензию выливают в 0,5 М раствор гидроксида натрия (500 мл) и энергично перемешивают в течение 2 ч. Темное твердое вещество отфильтровывают, промывают водой (100 мл) и изогексаном (50 мл) и сушат на воздухе, получая 3,2'-дифтор-5'-нитробифенил-2-карбонитрил в виде чернокоричневого твердого вещества (3,25 г, 100%): H (360 МГц, CDCl3) 7,32-7,44 (3 Н, м), 7,71-7,77 (1 Н, м),8,35-8,41 (2 Н, м). 3,2'-Дифтор-5'-нитробифенил-2-карбонитрил (3,25 г, 12,5 ммоль) в тетрагидрофуране (20 мл) и этаноле (20 мл) обрабатывают дигидратом хлорида олова(II) (9,86 г, 43,8 ммоль) и смесь перемешивают при комнатной температуре в течение 18 ч. Растворитель выпаривают и остаток перемешивают с 2 н раствором гидроксида натрия (40 мл) в течение 2 ч. Полученную суспензию разбавляют водой (100 мл) и экстрагируют дихлорметаном (3 х 200 мл). Объединенные органические слои промывают водой (200 мл), насыщенным раствором соли (200 мл), сушат над безводным сульфатом натрия, фильтруют и упаривают, получая 5'-амино-3,2'-дифторбифенил-2-карбонитрил в виде коричневого твердого вещества (2,87 г, 100%):H (360 МГц, СDСl3) 3,74 (2 Н, с), 6,66-6,75 (2 Н, м), 7,01 (1 Н, дд, J 9 и 9), 7,19-7,30 (2 Н, м), 7,59-7,65 (1 Н, м). 5'-Амино-3,2'-дифторбифенил-2-карбонитрил (2,87 г, 12,5 ммоль) растворяют в горячем 1,4-диоксане (4 мл), добавляют 48% бромисто-водородную кислоту (40 мл) и смесь охлаждают до 0 С, затем в течение 20 мин добавляют по каплям раствор нитрита натрия (0,86 г, 12,5 ммоль) в воде (1,5 мл). Полученную смесь перемешивают в течение 1,5 ч при 0 С, затем выливают в охлажденный (0 С) раствор бромида меди(I) (5,38 г, 37,5 ммоль) в 48% бромисто-водородной кислоте (10 мл). Раствор перемешивают при 0 С в течение 15 мин, затем нагревают при 50 С в течение 20 мин. Смесь охлаждают до комнатной температуры, разбавляют водой (500 мл) и экстрагируют этилацетатом (2 х 300 мл). Объединенные органические слои промывают 10% водным раствором аммиака (200 мл), водой (200 мл), насыщенным раствором соли (200 мл), сушат над безводным сульфатом магния, фильтруют и упаривают досуха, получая твердое вещество черного цвета. Очистка хроматографией на силикагеле с элюированием изогексаном (содержащим 0,5% метанола) при градиенте этилацетата (2-6%) дает 5'-бром-3,2'-дифторбифенил 2-карбонитрил (2,48 г, 68%) в виде желтого твердого вещества: H (400 МГц, CDCl3) 7,13 (1 Н, дд, J 9 и 9),7,27-7,30 (2 Н, м), 7,53-7,59 (2 Н, м), 7,64-7,69 (1 Н, м). Смесь 5'-бром-3,2'-дифторбифенил-2-карбонитрила (2,48 г, 8,43 ммоль), ацетата калия (2,48 г, 25,3 ммоль) и бис(неопентилгликолят)дибора (2,48 г, 11,0 ммоль) в 1,4-диоксане (40 мл), содержащем диметилсульфоксид (0,8 мл), дегазируют азотом в течение 20 мин. Добавляют аддукт дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) и дихлорметана (200 мг, 0,25 ммоль) и реакционную смесь нагревают в течение 24 ч при 90 С. Смесь охлаждают до комнатной температуры, затем распределяют между 2 н раствором гидроксида натрия (75 мл) и диэтиловым эфиром (100 мл) и органический слой отбрасывают. Водный экстракт подкисляют (рН 5) 36% хлористо-водородной кислотой и затем экстрагируют диэтиловым эфиром (2 х 75 мл). Органические экстракты промывают водой (50 мл), насыщенным раствором соли(75 мл), сушат над безводным сульфатом магния и упаривают, получая 5'-(5,5-димeтил[1,3,2]диoкcaбopинaн-2-ил)-3,2'-дифторбифенил-2-карбонитрил в виде коричневого масла (2,5 г, 95%), которое кристаллизуется при стоянии: H (360 МГц, СDСl3) 1,03 (6 Н, с), 3,77 (4 Н, с), 7,17-7,25 (2 Н, м), 7,30 (1 Н, д, J 8), 7,597,65 (1 Н, м), 7,81-7,91 (2 Н, м). 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 5'-(5,5-диметил[1,3,2]диоксаборинан-2-ил)-3,2'-дифторбифенил-2-карбонитрилом, как описано в примере 1, получая 3,2'-дифтор 5'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил в виде не совсем белого твер- 24006234 дого вещества: H (360 МГц, CDCl3) 7,31 (2 Н, дд, J 7 и 3), 7,43-7,49 (2 Н, м), 7,64-7,75 (3 Н, м), 8,10 (1 Н, с),9,04 (1 Н, д, J 7); m/z (ES+) 401 (МН). Пример 18. 6,2'-Дифтор-5'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил. Смесь 2,3-дифторбензонитрила (19,0 г, 137 ммоль) и этанола (200 мл), предварительно насыщенную газообразным аммиаком, нагревают в автоклаве при 140 С в течение 8 ч (конечное давление 200 фунтов/кв.дюйм (13,6 атм или 1,36 МПа. Смеси дают охладиться до комнатной температуры и упаривают досуха. Остаток растворяют в воде (400 мл) и экстрагируют диэтиловым эфиром (2 х 300 мл). Объединенные органические экстракты промывают водой (300 мл) и насыщенным раствором соли (250 мл), сушат над безводным сульфатом магния, фильтруют и упаривают. Растирание с изогексаном (150 мл) дает 2 амино-3-фторбензонитрил (9,8 г, 50%) в виде не совсем белого твердого вещества: H (360 МГц, СDСl3) 4,47 (2 Н, с), 6,65-6,71 (1 Н, м), 7,14-7,20 (2 Н, м). 2-Амино-3-фторбензонитрил подвергают бромдезаминированию, как описано в примере 17, получая 2-бром-3-фторбензонитрил в виде светло-коричневого твердого вещества: H (360 МГц, СDСl3) 7,627,68 (1 Н, м), 7,74-7,85 (1H, ддд, J 9, 9 и 1), 7,74-7,85 (1H, ддд, J 8, 1 и 1). 2-Бром-3-фторбензонитрил (2,50 г, 12,5 ммоль) подвергают сочетанию с 2-(2-фтор-5-нитрофенил)4,4,5,5-тетраметил[1,3,2]диоксабороланом, как описано в примере 17, получая 6,2'-дифтор-5'-нитробифенил-2-карбонитрил в виде черного твердого вещества: H (400 МГц, СDСl3) 7,40-7,44 (1H, м), 7,47-7,52(1H, м), 7,59-7,67 (2 Н, м), 8,37-8,44 (2 Н, м). 6,2'-Дифтор-5'-нитробифенил-2-карбонитрил (3,25 г, 12,5 ммоль) восстанавливают по методике,описанной в примере 17, получая 5'-амино-6,2'-дифторбифенил-2-карбонитрил в виде коричневого масла: H (360 МГц, СDСl3) 3,74 (2 Н, с), 6,68 (1H, м), 6,73-6,77 (1H, м), 7,02 (1H, дд, J 9 и 9), 7,37-7,49 (2 Н,м), 7,56-7,65 (1H, м). 5'-Амино-6,2'-дифторбифенил-2-карбонитрил подвергают бромдезаминированию, как описано в примере 17, получая 5'-бром-6,2'-дифторбифенил-2-карбонитрил в виде светло-коричневого твердого вещества: H (360 МГц, СDСl3) 7,13 (1H, дд, J 9 и 9), 7,37-7,49 (2 Н, ддд, J 9, 9 и 1), 7,57-7,62 (4 Н, м). 5'-Бром-6,2'-дифторбифенил-2-карбонитрил превращают в 6,2'-дифтор-5'-(4,4,5,5-тетраметил[1,3,2] диоксаборолан-2-ил)бифенил-2-карбонитрил по методике, описанной в примере 1. Продукт получают в виде коричневого масла, кристаллизующегося при стоянии: H (360 МГц, CDCl3) 1,34 (12 Н, с), 7,21 (1 Н,дд, J 8 и 2), 7,38-7,51 (2 Н, м), 7,57-7,59 (1 Н, м), 7,85 (1 Н, дд, J 8 и 2), 7,90-7,94 (1 Н, м). 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 6,2'-дифтор-5'-(4,4,5,5 тетраметил[1,3,2]диоксаборолан-2-ил)бифенил-2-карбонитрилом, как описано в примере 1, получая 6,2'дифтор-5'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил в виде не совсем белого твердого вещества: H (400 МГц, CDCl3) 7,29 (1 Н, д, J 7), 7,44-7,71 (6 Н, м), 8,11 (1H, с), 9,00 (1 Н, д, J 7); m/z (ES+) 401 (МН). Пример 19. 5,2'-Дифтор-5'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил. 2-Бром-4-фторбензонитрил подвергают сочетанию с 2-(2-фтор-5-нитрофенил)-4,4,5,5-тетраметил[1,3,2]диоксабороланом, как описано в примере 17, получая 5,2'-дифтор-5'-нитробифенил-2-карбонитрил в виде черного твердого вещества: H (360 МГц, СDСl3) 7,25-7,33 (2 Н, м), 7,40-7,44 (1H, м), 7,86 (1H, дд, J 9 и 6), 8,35-8,42 (2 Н, м). 5,2'-Дифтор-5'-нитробифенил-2-карбонитрил восстанавливают по методике, описанной в примере 17, получая 5'-амино-5,2'-дифторбифенил-2-карбонитрил: H (360 МГц, СDСl3) 3,68 (2 Н, с), 6,67-6,76 (2 Н,м), 7,02 (1H, дд, J 9 и 9), 7,12-7,27 (2 Н, м), 7,78 (1H, дд, J 9 и 6). 5'-Амино-5,2'-дифторбифенил-2-карбонитрил подвергают бромдезаминированию, как описано в примере 17, получая 5'-бром-5,2'-дифторбифенил-2-карбонитрил в виде светло-коричневого твердого вещества: H (400 МГц, СDСl3) 7,13 (1H, дд, J 9 и 9), 7,19-7,23 (2 Н, м), 7,52-7,60 (2 Н, м), 7,81 (1H, дд, J 8 и 5). 5'-Бром-5,2'-дифторбифенил-2-карбонитрил превращают в 5'-(5,5-диметил[1,3,2]диоксаборинан-2 ил)-5,2'-дифторбифенил-2-карбонитрил, как описано в примере 17. Продукт получают в виде коричневого масла, кристаллизующегося при стоянии: H (400 МГц, CDCl3) 1,03 (6 Н, с), 3,77 (4 Н, с), 7,15-7,24 (3 Н,м), 7,77 (1 Н, дд, J 9 и 6), 7,83 (1 Н, дд, J 8 и 2), 7,87-7,91 (1 Н, м). 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 5'-(5,5-диметил[1,3,2]диоксаборинан-2-ил)-5,2'-дифторбифенил-2-карбонитрилом, как описано в примере 1, получая 5,2'-дифтор 5'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил в виде не совсем белого твердого вещества: H (360 МГц, СDСl3) 7,25-7,31 (2 Н, м), 7,44-7,50 (1 Н, м), 7,67 (1 Н, ддд, J 9, 5 и 2), 7,67 (1H,с), 7,69 (1 Н, с), 7,88 (1H, дд, J 9 и 6), 8,11 (1H, с), 9,05 (1H, д, J 7); m/z (ES+) 401 (МН). Пример 20. 4,2'-Дифтор-5'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил. 2-Бром-5-фторбензонитрил подвергают сочетанию с 2-(2-фтор-5-нитрофенил)-4,4,5,5-тетраметил[1,3,2]диоксабороланом, как описано в примере 17, получая 4,2'-дифтор-5'-нитробифенил-2-карбонитрил в виде черного твердого вещества: H (360 МГц, CDCl3) 7,38-7,56 (4 Н, м), 8,33-8,40 (2 Н, м). 4,2'-Дифтор-5'-нитробифенил-2-карбонитрил восстанавливают по методике, описанной в примере 17, получая 5'-амино-4,2'-дифторбифенил-2-карбонитрил: H (360 МГц, СDСl3) 3,66 (2 Н, с), 6,66-6,70 (1H,м), 6,71-6,74 (1H, м), 7,00 (1H, дд, J 9 и 9), 7,33-7,38 (1H, м), 7,44-7,49 (1H, м).(1 Н, дд, J 10 и 8), 7,33-7,38 (1 Н, м), 7,44-7,50 (2 Н, м), 7,81 (1 Н, дд, J 8 и 2), 7,85-7,90 (1 Н, м). 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 5'-(5,5-диметил[1,3,2]диоксаборинан-2-ил)-4,2'-дифторбифенил-2-карбонитрилом, как описано в примере 1, получая 4,2'-дифтор 5'-(7-трифторметилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил в виде не совсем белого твердого вещества: H (400 МГц, СDСl3) 7,29 (1 Н, д, J 7), 7,42-7,48 (2 Н, м), 7,57 (1 Н, дд, J 8 и 3), 7,61-7,66 (3 Н,м), 8,10 (1 Н, с), 9,02 (1 Н, д, J 7); m/z (ES+) 401 (МН). Пример 21. 7-(1,1-Дифторэтил)-3-[4-фтор-3-(пиридин-4-ил)фенил]имидазо[1,2-а]пиримидин. 3-Бром-7-(1,1-дифторэтил)имидазо[1,2-а]пиримидин превращают в 7-(1,1-дифторэтил)-3-трибутилстаннилимидазо[1,2-а]пиримидин по методике, описанной в примере 4: m/z (ES+) 470, 472, 474 (MH). 7-(1,1-Дифторэтил)-3-трибутилстаннилимидазо[1,2-а]пиримидин подвергают взаимодействию с 4(5-бром-2-фторфенил)пиридином по методике, описанной в примере 4, получая 7-(1,1-дифторэтил)-3-[4 фтор-3-(пиридин-4-ил)фенил]имидазо[1,2-а]пиримидин в виде белого твердого вещества: H (360 МГц,CDCl3) 2,16 (3 Н, т, J 19), 7,31 (1 Н, д, J 7), 7,43 (1 Н, дд, J 10 и 8), 7,54 (2 Н, дд, J 6 и 1), 7,57-7,66 (2 Н, м),8,00 (1 Н, с), 8,67 (1 Н, д, J 7), 8,74 (2 Н, д, J 6); m/z (ES+) 355 (МН). Пример 22. 7-(1,1-Дифторэтил)-3-[2,4-дифтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин. 7-(1,1-Дифторэтил)-3-трибутилстаннилимидазо[1,2-а]пиримидин подвергают взаимодействию с 3(3-бром-2,6-дифторфенил)пиридином по методике, описанной в примере 4, получая 7-(1,1-дифторэтил)3-[2,4-дифтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин в виде белого твердого вещества: H(1H, м), 7,85 (1H, дд, J 8 и 1), 8,03 (1 Н, с), 8,39 (1H, дд, J 7 и 3), 8,69 (1H, д, J 5 и 3), 8,78 (1H, с); m/z (ES+) 373 (МН). Пример 23. 2-3-[2,4-Дифтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол. Смесь 2-(3-бромимидазо[1,2-а]пиримидин-7-ил)пропан-2-ола (256 мг, 1,0 ммоль) и 2,4-дифтор-3(пиридин-3-ил)бензилбороновой кислоты (352 мг, 1,5 ммоль) в тетрагидрофуране (3 мл) и карбоната натрия (1,25 мл 2 М раствора в воде, 2,5 ммоль) дегазируют азотом в течение 10 мин. Добавляют тетракис(трифенилфосфин)палладий(0) (58 мг, 0,05 ммоль) и полученную смесь нагревают при 65 С в течение 24 ч. Реакционную смесь охлаждают до комнатной температуры, затем распределяют между дихлорметаном и насыщенным водным раствором гидрокарбоната натрия. Органический слой сушат над безводным сульфатом магния, фильтруют и предварительно адсорбируют непосредственно на силикагель. Очистка хроматографией на силикагеле с элюированием дихлорметаном (содержащим 1% концентрированного аммиака) при градиенте метанола (1-5%) дает 2-3-[2,4-дифтор-3-(пиридин-3 ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол в виде бледно-желтого масла, которое затвердевает при стоянии (200 мг, 44%). Бисгидрохлоридная соль (из смеси этилацетат/этанол): H (360 МГц, d6-ДМСО) 1,56 (6 Н, с), 7,62(1H, с), 9,27 (1H, дд, J 7 и 3). Пример 24. 1-3-[4-Фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-илэтанон. 3-Бром-7-(1,1-диметоксиэтил)имидазо[1,2-а]пиримидин подвергают сочетанию с 4-фтор-3-(пиридин-3-ил)бензолбороновой кислотой, как описано в примере 23, получая 7-(1,1-диметоксиэтил)-3-[4 фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин в виде оранжевой пены, которую растворяют в 2,5 н хлористо-водородной кислоте и перемешивают в течение 15 ч при 50 С. После охлаждения до комнатной температуры реакционную смесь нейтрализуют добавлением твердого гидрокарбоната натрия и полученное твердое вещество отфильтровывают. Твердое вещество растворяют в смеси дихлорметан/метанол (1:1) и адсорбируют на силикагеле. Флэш-хроматография на колонке с силикагелем с элюированием дихлорметаном, содержащим 1% аммиака и 5% метанола, дает 1-3-[4-фтор-3-(пиридин-3 ил)фенил]имидазо[1,2-а]пиримидин-7-илэтанон в виде желтого твердого вещества: H (360 МГц, d6 ДМСО) 2,71 (3 Н, с), 7,54-7,63 (3 Н, м), 7,84-7,88 (1 Н, м), 8,01 (1 Н, дд, J 8 и 2), 8,10-8,13 (1 Н, м), 8,34 (1H,с), 8,66 (1 Н, дд, J 5 и 2), 8,90 (1H, с), 9,24 (1H, д, J 7). Пример 25. 3'-[7-(1-Гидрокси-1-метилэтил)имидазо[1,2-а]пиримидин-3-ил]-4,2',6'-трифторбифенил 2-карбонитрил. Смесь 2,6-дифторбромбензола (125,5 г, 650 ммоль) в 98% серной кислоте (250 мл) охлаждают на бане с ледяной водой и затем обрабатывают смесью (1:1) 98% серной кислоты и дымящей азотной кислоты (100 мл), добавляя с такой скоростью, чтобы внутренняя температура не превышала 35 С. Сразу после завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 3 ч, затем выливают на лед. Полученную смесь разбавляют водой (конечный объем 5 л), образовавшееся- 26006234 твердое вещество отфильтровывают, промывают водой, затем сушат в вакууме над пентоксидом фосфора, получая 2-бром-1,3-дифтор-4-нитробензол в виде твердого вещества кремового цвета (145 г, 94%): H(360 МГц, CDCl3) 7,10-7,15 (1H, м), 8,09-8,16 (1H, м). Смесь 2-бром-1,3-дифтор-4-нитробензола (30 г, 130 ммоль) и дигидрата хлорида олова(II) в 36% хлористо-водородной кислоте (150 мл) нагревают до 40 С. Медленно добавляют диэтиловый эфир (20 мл),чтобы вызвать растворение. Сразу же в растворе быстро происходит реакция, и эфир выкипает. После нагревания при 60 С в течение 1 ч реакционную смесь охлаждают и выливают в ледяную воду (1,5 л). Раствор подщелачивают (рН 13) 30% водным раствором гидроксида натрия, поддерживая внутреннюю температуру ниже 20 С. Полученную серую суспензию энергично перемешивают с хлороформом (2 х 500 мл),органические слои объединяют, промывают водой, сушат над безводным сульфатом магния, содержащим 2 г угля для обесцвечивания, фильтруют и упаривают досуха. Растирание с изогексаном дает 3-бром-2,4 дифторфениламин в виде твердого вещества желтовато-коричневого цвета (23 г, 85%): H (360 МГц,СDСl3) 3,51 (2 Н, уш.), 6,65-6,70 (1 Н, м), 6,75-6,80 (1 Н, м). 2-Бром-5-фторбензонитрил превращают в 5-фтор-2-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил) бензонитрил, как описано в примере 1, получая твердое вещество бледно-желтого цвета (цвета соломы):H (360 МГц, СDСl3) 1,38 (12 Н, с), 7,27 (1 Н, ддд, J 8, 8 и 2), 7,39 (1H, дд, J 9 и 2), 7,90 (1 Н, дд, J 8 и 6). Раствор 3-бром-2,4-дифторфениламина (5,2 г, 25 ммоль) и 5-фтор-2-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензонитрила (7,10 г, 28,8 ммоль) в тетрагидрофуране (95 мл) и воде (5 мл) обрабатывают фторидом калия (4,8 г, 82,5 ммоль) и полученную смесь дегазируют азотом в течение 10 мин, затем добавляют трис(дибензилиденацетон)дипалладий(0) (460 мг, 0,5 ммоль) и три-трет-бутилфосфин (2,5 мл 0,2 М раствора в 1,4-диоксане, 0,5 ммоль). Реакционную смесь нагревают при 50 С в течение 2 ч, затем охлаждают до комнатной температуры. Смесь выливают в охлажденный льдом 0,5 н раствор гидроксида натрия (750 мл), перемешивают в течение 10 мин и твердый продукт отфильтровывают. Твердый продукт растирают с водой и сушат, получая 3'-амино-4,2',6'-трифторбифенил-2-карбонитрил в виде серого порошка (6,6 г), который используют без дополнительной очистки: H (360 МГц, СDСl3) 3,74 (2 Н, уш.),6,79-6,89 (2 Н, м), 7,36-7,42 (1H, м), 7,45-7,51 (2 Н, м). 3'-Амино-4,2',6'-трифторбифенил-2-карбонитрил бромдезаминируют, как описано в примере 1, получая 3'-бром-4,2',6'-трифторбифенил-2-карбонитрил в виде оранжевого твердого вещества: H (360 МГц,CDCl3) 6,97-7,03 (1H, м), 7,39-7,54 (3 Н, м), 7,62-7,68 (1H, м). 3'-Бром-4,2',6'-трифторбифенил-2-карбонитрил подвергают взаимодействию с бис(пинаколат)дибором, как описано в примере 1, получая 3'-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-4,2',6'-трифторбифенил-2-карбонитрил в виде желто-коричневого твердого вещества: m/z (ES+) 360 (MH). 2-(3-Бромимидазо[1,2-а]пиримидин-7-ил)пропан-2-ол подвергают сочетанию с 3'-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-4,2',6'-трифторбифенил-2-карбонитрилом, как описано в примере 23, получая 3'-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-а]пиримидин-3-ил]-4,2',6'-трифторбифенил-2-карбонитрил в виде не совсем белого твердого вещества: H (400 МГц, d6-ДМСО) 1,51 (6 Н, с), 7,42 (1 Н, д, J 7),7,54-7,58 (1 Н, м), 7,39-7,85 (1 Н, м), 7,89-7,96 (3 Н, м), 8,14 (1 Н, дд, J 9 и 2), 8,78 (1 Н, дд, J 7 и 3). Пример 26. 2-3-[4-Фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-1,2-диол. Охлажденный (-10 С) раствор метилизопропенилкетона (42 г, 500 ммоль) в ацетоне (200 мл) обрабатывают одновременно, но независимо (без предварительного смешивания) растворами перекиси водорода (27,5 мас.% в воде, 61,9 г, 500 ммоль) и водного гидроксида натрия (10 мл, 4 н), добавляя по каплям с такой скоростью, чтобы внутренняя температура не превышала -5 С. После завершения добавления реакционную смесь перемешивают в течение 12 ч при -10 С. По данным ЯМР, реакция завершается приблизительно на 50%, поэтому добавляют дополнительные количества перекиси водорода (27,5 мас.% в воде, 61,9 г) и водного раствора гидроксида натрия (10 мл, 4 н) и продолжают перемешивание при -10 С в течение 16 ч. Реакционную смесь нейтрализуют 4 н раствором серной кислоты (20 мл) и затем по каплям добавляют в течение 15 мин в колбу с оксидом марганца(IV) (10 г). Полученную смесь фильтруют через мелкозернистую стекловолокнистую фильтровальную бумагу (GF/A) и ацетон удаляют отгонкой при атмосферном давлении, получая неочищенный 1-(2-метилоксиранил)этанон в виде бесцветной жидкости, которую используют далее без дополнительной очистки: H (360 МГц, d6-ДМСО) 1,36 (3 Н, с), 1,97(3 Н, с), 2,91 (1 Н, д, J 5), 3,12 (1 Н, д, J 5). Неочищенный образец 1-(2-метилоксиранил)этанона, полученный выше, разбавляют водой до объема 300 мл и обрабатывают 70% перхлорной кислотой (10 мл). Полученную смесь кипятят с обратным холодильником в течение 6 ч, затем охлаждают до комнатной температуры. Смесь фильтруют для удаления черных твердых частиц и фильтрат нейтрализуют твердым гидрокарбонатом натрия. Водный фильтрат насыщают твердым хлоридом натрия, фильтруют (для удаления избытка последнего) и подвергают непрерывной экстракции дихлорметаном в течение 3 дней. Органическую фазу сушат над безводным сульфатом магния, фильтруют и упаривают досуха. Остаток очищают флэш-хроматографией на сухих колонках с элюированием изогексаном при градиенте эфира (20-100%), получая 3,4-дигидрокси-3 метилбутан-2-он в виде бледно-желтого масла (30 г, 51% в 2 стадии): H (360 МГц, CDCl3) 1,29 (3 Н, с),2,29 (3 Н, с), 2,50 (1 Н, уш.), 3,64 (1 Н, д, J 12), 3,85 (1 Н, д, J 12), 4,15 (1 Н, уш.).- 27006234 Смесь 3,4-дигидрокси-3-метилбутан-2-она (4,13 г, 35 ммоль), ацетона (25 мл) и моногидрата птолуолсульфокислоты (33 мг, 0,18 ммоль) в изогексане (75 мл) нагревают в аппарате Дина-Старка в течение 10 ч. Растворитель удаляют отгонкой при атмосферном давлении и остаток очищают хроматографией на силикагеле. Элюирование 50% раствором эфира в изогексане дает 1-(2,2,4-триметил[1,3]диоксолан-4-ил)этанон в виде бледно-желтой жидкости (5,1 г, 92%): H (360 МГц, d6-ДМСО) 1,29 (3 Н, с), 1,34(3 Н, с), 4,05 (1 Н, д, J 9), 4,49 (1 Н, д, J 9), 7,27 (1 Н, д, J 7), 7,71 (1 Н, д, J 1), 7,92 (1H, д, J 1), 8,98 (1H, д, J 7). 7-(2,2,4-Триметил[1,3]диоксолан-4-ил)имидазо[1,2-а]пиримидин бромируют, как описано в примере 1, получая 3-бром-7-[2,2,4-триметил[1,3]диоксолан-4-ил)имидазо[1,2-а]пиримидин в виде не совсем белого твердого вещества: H (400 МГц, d6-ДМСО) 1,31 (3 Н, с), 1,47 (3 Н, с), 1,57 (3 Н, с), 4,06 (1 Н, д, J 9),4,47 (1 Н, д, J 9), 7,40 (1 Н, д, J 7), 7,88 (1 Н, с), 8,81 (1 Н, д, J 7). 3-Бром-7-(2,2,4-триметил[1,3]диоксолан-4-ил)имидазо[1,2-а]пиримидин подвергают сочетанию с 3[2-фтор-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]пиридином, как описано в примере 23,получая 3-[4-фтор-3-(пиридин-3-ил)фенил]-7-(2,2,4-триметил[1,3]диоксолан-4-ил)имидазо[1,2-а]пиримидин в виде оранжевого масла: H (400 МГц, d6-ДМСО) 1,33 (3 Н, с), 1,47 (3 Н, с), 1,59 (3 Н, с), 4,08 (1 Н, д, J 9), 4,49 (1 Н, д, J 9), 7,31 (1 Н, д, J 7), 7,54-7,59 (2 Н, м), 7,77-7,81 (1H, м), 7,94 (1 Н, дд, J 7 и 2), 8,01 (1H, с),8,09-8,12 (1H, м), 8,65 (1H, дд, J 5 и 2), 8,89 (1H, с), 9,08 (1H, д, J 7). 3-[4-Фтор-3-(пиридин-3-ил)фенил]-7-(2,2,4-триметил[1,3]диоксолан-4-ил)имидазо[1,2-а]пиримидин(1,00 г, 2,47 ммоль) перемешивают в 2 н растворе хлористо-водородной кислоты (20 мл) при 70 С в течение 10 мин. Реакционной смеси дают охладиться и загружают на картридж с сильным катионообменником. Примеси неосновного характера удаляют элюированием метанолом. Элюирование 10% раствором аммиака в метаноле дает 2-3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-1,2-диол в виде масла (450 мг), которое затвердевает при стоянии. Бисгидрохлоридная соль (из смеси этилацетат/этанол): H (360 МГц, d6-ДMCO) 1,50 (3 Н, с), 3,67 (2 Н, м), 7,74 (1H, дд, J 11 и 8), 7,89 (3 Н, м),8,13 (1H, дд, J 7 и 2), 8,51 (1H, д, J 8), 8,58 (1H, с), 8,85 (1H, дд, J 5 и 1), 9,12 (1H, с), 9,40 (1H, д, J 7). Пример 27. 3-[2,4-Дифтор-3-(пиридин-4-ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин. Суспензию гидрохлорида 4-бромпиридина (6,81 г, 35 ммоль) в тетрагидрофуране (100 мл) обрабатывают гидроксидом натрия (8,75 мл 4 н раствора в воде) и смесь перемешивают при комнатной температуре в течение 5 мин. Добавляют 2,6-дифторбензолбороновую кислоту (6,36 г, 40 ммоль) и фторид калия (6,71 г, 116 ммоль) и смесь дегазируют азотом в течение 10 мин перед добавлением трис(дибензилиденацетон)дипалладия(0) (640 мг, 0,7 ммоль), затем три-трет-бутилфосфина (7 мл 0,2 М раствора в 1,4 ммоль диоксане). Полученную смесь перемешивают при комнатной температуре в течение 15 мин, затем нагревают при 50 С в течение 30 мин. Реакционную смесь разбавляют дихлорметаном, затем экстрагируют охлажденным льдом 1 н раствором гидроксида натрия (х 2). Органические слои сушат над безводным сульфатом магния, фильтруют и адсорбируют на силикагеле. Очистка хроматографией на силикагеле с элюированием изогексаном (содержащим 0,5% метанола и 0,5% триэтиламина) при градиенте этилацетата (20-30%) дает 4-(2,6-дифторфенил)пиридин в виде белого твердого вещества (3,2 г, 48%): H (400 МГц, СDСl3) 6,99-7,06 (2 Н, м), 7,32-7,39 (1 Н, м), 7,40-7,42 (2 Н, м), 8,71 (2 Н, д, J 6). 4-(2,6-Дифторфенил)пиридин превращают в 2,4-дифтор-3-(пиридин-4-ил)бензолбороновую кислоту, используя методику, описанную в примере С: m/z (ES+) 235 (МН). 3-Бром-7-трифторметилимидазо[1,2-а]пиримидин подвергают сочетанию с 2,4-дифтор-3-(пиридин 4-ил)бензолбороновой кислотой, как описано в примере 23, получая 3-[2,4-дифтор-3-(пиридин-4 ил)фенил]-7-трифторметилимидазо[1,2-а]пиримидин в виде белого твердого вещества. Дигидрохлорид(из смеси этилацетат/этанол): H (400 МГц, ДМСО) 7,60-7,65 (2 Н, м), 7,96-8,01 (1 Н, м), 8,16 (2 Н, д, J 6),8,34 (1 Н, с), 9,00-9,02 (2 Н, м), 9,34 (1 Н, дд, J 7 и 3); m/z (ES+) 377 (МН). Пример 28. 2-3-[2,4-Дифтор-3-(пиридин-4-ил)фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол. 2-(3-Бромимидазо[1,2-а]пиримидин-7-ил)пропан-2-ол подвергают сочетанию с 2,4-дифтор-3-(пиридин 4-ил)бензолбороновой кислотой, как описано в примере 23, получая 2-3-[2,4-дифтор-3-(пиридин-4-ил) фенил]имидазо[1,2-а]пиримидин-7-илпропан-2-ол в виде не совсем белого твердого вещества. Дигидрохлорид (из смеси этанол/этилацетат): H (360 МГц, ДМСО) 1,56 (6 Н, с), 7,62-7,67 (1 Н, м), 7,85 (1 Н, д, J 7),7,88-7,94 (1 Н, м), 7,99 (2 Н, д, J 6), 8,50 (1H, с), 8,94 (2 Н, д, J 6), 9,26 (1 Н, дд, J 7 и 3); m/z (ES+) 367 (МН). Пример 29. 4,2'-Дифтор-5'-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2 карбонитрил. 2-(3-Бромимидазо[1,2-а]пиримидин-7-ил)пропан-2-ол подвергают сочетанию с 5'-(5,5-диметилTetrahedron Lett., 1979, 3357-3360, что дает после перегонки с использованием колонки Vigreux, 47% выход смеси (94:6) целевого фторсодержащего соединения и 3-метил-3-бутен-2-она в виде бесцветного масла: т.кип. 74-76 С; H (360 МГц, СDСl3) 1,45 (6 Н, д, J 22), 2,28 (3 Н, д, J 5). 3-Фтор-3-метилбутан-2-он превращают в 1,1-диэтокси-4-фтор-4-метилпентан-3-он, как описано в примере В, и конденсируют с полусульфатом 2-аминоимидазола, как в примере А, получая 7-(1-фтор-1 метилэтил)имидазо[1,2-а]пиримидин в виде оранжевого масла, которое кристаллизуется при стоянии: H(400 МГц, CDCl3) 1,77 (6 Н, д, J 22), 7,21 (1H, дд, J 7 и 2), 7,54 (1H, д, J 1), 7,79 (1H, д, J 1), 8,45 (1H, д, J 7). 7-(1-Фтор-1-метилэтил)имидазо[1,2-а]пиримидин бронируют, как описано в примере 1, получая 3 бром-7-(1-фтор-1-метилэтил)имидазо[1,2-а]пиримидин в виде не совсем белого твердого вещества: H(360 МГц, СDСl3) 1,78 (6 Н, д, J 22), 7,35 (1 Н, д, J 7 и 2), 7,77 (1 Н, с), 8,42 (1H, д, J 7). 3-Бром-7-(1-фтор-1-метилэтил)имидазо[1,2-а]пиримидин подвергают сочетанию с 2,4-дифтор-3(пиридин-3-ил)фенилбороновой кислотой, как описано в примере 23, получая 3-[2,4-дифтор-3-(пиридин 3-ил)фенил]-7-(1-фтор-1-метилэтил)имидазо[1,2-а]пиримидин в виде белого твердого вещества: H (360 МГц,CDCl3) 1,80 (6 Н, д, J 22), 7,21-7,29 (2 Н, м), 7,46 (1H, дд, J 8 и 5), 7,50-7,57 (1H, м), 7,85 (1H, д, J 8), 7,92(1H, с), 8,31 (1H, дд, J 7 и 3), 8,70 (1H, дд, J 5 и 1), 8,79 (1H, с); m/z (ES+) 369 (МН). Пример 31. 7-(1-Фтор-1-метилэтил)-3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин. 3-Бром-7-(1-фтор-1-метилэтил)имидазо[1,2-а]пиримидин подвергают сочетанию с 3-[2-фтор-5(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]пиридином, как описано в примере 23, получая 7-(1 фтор-1-метилэтил)-3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин в виде белого твердого вещества после перекристаллизации из смеси этилацетат/изогексан: H (360 МГц, СDСl3) 1,74 (6 Н, д, J 22), 7,26 (1H, дд, J 1 и 2), 7,53-7,60 (2 Н, м), 7,80 (1H, ддд, J 8, 5 и 2), 7,94 (1H, дд, J 8 и 2), 8,05 (1H, с), 8,10(1H, ддд, J 8, 4 и 2), 8,65 (1H, дд, J 5 и 1,5), 8,89 (1H, с), 9,13 (1H, д, J 7); m/z (ES+) 351 (МН). Пример 32. Метиловый эфир 2-3-[2,4-дифтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7 ил-2-метилпропионовой кислоты. Метил 2,2-диметилацетоацетат превращают в метиловый эфир 5,5-диэтокси-2,2-диметил-3-оксопентановой кислоты, как изложено в примере В, затем конденсируют с полусульфатом 2-аминоимидазола по методике примера А, получая метиловый эфир 2-(имидазо[1,2-а]пиримидин-7-ил)-2-метилпропионовой кислоты в виде коричневого масла: H (360 МГц, CDCl3) 1,67 (6 Н, с), 3,70 (3 Н, с), 6,85 (1 Н, д, J 7),7,48 (1 Н, д, J 1), 7,76 (1 Н, д, J 1), 8,34 (1 Н, д, J 7). Метиловый эфир 2-(имидазо[1,2-а]пиримидин-7-ил)-2-метилпропионовой кислоты бромируют так же, как описано в примере 1, получая метиловый эфир 2-(3-бромимидазо[1,2-а]пиримидин-7-ил)-2 метилпропионовой кислоты в виде не совсем белого твердого вещества: H (400 МГц, CDCl3) 1,68 (6 Н, с),3,69 (3 Н, с), 6,98 (1 Н, д, J 7), 7,75 (1 Н, с), 8,32 (1 Н, д, J 7). Метиловый эфир 2-(3-бромимидазо[1,2-а]пиримидин-7-ил)-2-метилпропионовой кислоты и 2,4-дифтор-3-(пиридин-3-ил)бензолбороновую кислоту подвергают сочетанию таким же образом, как описано в примере 23, получая метиловый эфир 2-3-[2,4-дифтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-ил-2-метилпропионовой кислоты в виде белого твердого вещества: H (360 МГц, СDСl3) 1,69 (6 Н,с), 3,70 (3 Н, с), 6,91 (1 Н, д, J 7), 7,20-7,25 (1 Н, м), 7,43-7,47 (1 Н, м), 7,50-7,57 (1 Н, м), 7,84-7,87 (1H, м),7,89 (1H, с), 8,21 (1 Н, дд, J 7 и 3), 8,69 (1 Н, дд, J 5 и 2), 8,78 (1H, д, J 1); m/z (ES+) 409 (МН). Пример 33. 2-3-[4-Фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-ил-2-метилпропионитрил. 2,2-Диметил-3-оксобутиронитрил получают из 3-метил-2-бутанона, как описано Rasmussen (Synthesis,1973, 682), получая, после перегонки при пониженном давлении, требуемый нитрил в виде бесцветного масла: т.кип. 74-76 С (30 мм рт.ст.); H (360 МГц, СDСl3) 1,51 (6 Н, с), 2,43 (3 Н, с). 2,2-Диметил-3-оксобутиронитрил превращают в 5,5-диэтокси-2,2-диметил-3-оксопентаннитрил, как описано в примере В, затем конденсируют с полусульфатом 2-аминоимидазола по методике примера А,получая 2-(имидазо[1,2-а]пиримидин-7-ил)-2-метилпропионитрил в виде белого твердого вещества: H(400 МГц, CDCl3) 1,84 (6 Н, с), 7,27 (1H, д, J 7), 7,58 (1H, д, J 1), 7,84 (1H, д, J 1), 8,49 (1H, д, J 7). 2-(Имидазо[1,2-а]пиримидин-7-ил)-2-метилпропионитрил бромируют так же, как описано в примере 1, получая 2-(3-бромимидазо[1,2-а]пиримидин-7-ил)-2-метилпропионитрил в виде не совсем белого твердого вещества: H (400 МГц, CDCl3) 1,84 (6 Н, с), 7,39 (1 Н, д, J 7), 7,82 (1 Н, с) 8,46 (1 Н, д, J 7). 2-(3-Бромимидазо[1,2-а]пиримидин-7-ил-2-метилпропионитрил и 4-фтор-3-(пиридин-3-ил)бензолбороновую кислоту подвергают сочетанию по методике примера 23, получая 2-3-[4-фтор-3-(пиридин-3 ил)фенил]имидазо[1,2-а]пиримидин-7-ил-2-метилпропионитрил в виде белого твердого вещества: H(5,00 г, 43,0 ммоль) защищают в виде ацетата по методике примера 3, затем превращают в диэтилацеталь, как описано в примере В, и конденсируют с полусульфатом 2-аминоимидазола, как описано в примере А, получая 2-(имидазо[1,2-а]пиримидин-7-ил)-2-метилпропан-1-ол (1,43 г, 17%) в виде белого твердого вещества: H (360 МГц, CDCl3) 1,37 (6 Н, с), 3,87 (2 Н, с), 5,29 (1 Н, с), 6,93 (1 Н, д J 7), 7,47 (1 Н, д, J 1),7,74 (1H, д, J 1), 8,37 (1 Н, д, J 7). 2-(Имидазо[1,2-а]пиримидин-7-ил)-2-метилпропан-1-ол бромиругот, как описано в примере 1, получая 2-(3-бромимидазо[1,2-а]пиримидин-7-ил)-2-метилпропан-1-ол в виде не совсем белого твердого вещества: H (360 МГц, CDCl3) 1,38 (6 Н, с), 3,88 (2 Н, с), 7,07 (1 Н, д, J 7), 7,72 (1 Н, с), 8,35 (1 Н, д, J 7). 2-(3-Бромимидазо[1,2-а]пиримидин-7-ил)-2-метилпропан-1-ол превращают в 3-бром-7-(1,1-диметил-2-триэтилсиланилоксиэтил)имидазо[1,2-а]пиримидин по методике примера D, получая бесцветное масло, которое кристаллизуется при стоянии: H (360 МГц, СDСl3) 0,55 (6 Н, кв, J 8), 0,88 (9 Н, т, J 8), 1,40(6 Н, с), 3,77 (2 Н, с), 7,17 (1 Н, д, J 7), 7,71 (1 Н, с), 8,27 (1 Н, д, J 7). 3-Бром-7-(1,1-диметил-2-триэтилсиланилоксиэтил)имидазо[1,2-а]пиримидин подвергают сочетанию с 4-фтор-3-(пиридин-3-ил)бензолбороновой кислотой (323 мг, 1,28 ммоль) по методике примера 23 и снимают защиту растворением в 3 н хлористо-водородной кислоте и нагреванием при 48 С в течение 14 ч,получая 2-3-[4-фтор-3-(пиридин-3-ил)фенил]имидазо[1,2-а]пиримидин-7-ил-2-метилпропан-1-ол в виде белого порошка: H (360 МГц, CDCl3) 1,39 (6 Н, с), 3,54 (1 Н, т, J 7), 3,89 (1 Н, д, J 7), 6,99 (1 Н, д, J 7),7,35-7,45 (2 Н, м), 7,51-7,60 (2 Н, м), 7,83 (1 Н, с), 7,90-7,94 (1 Н, м), 8,53 (1 Н, д, J 7), 8,68 (1 Н, дд, J 5 и 2),8,83 (1 Н, c); m/z (ES+) 363 (МН). Примеры 35-38. Представленные ниже соединения получают по методикам, аналогично описанным выше. Дополнительные примеры. Следующие соединения также получают по методикам, описанным в данной заявке: 2'-фтор-5'-(7-метилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 5'-(7-ацетилимидазо[1,2-а]пиримидин-3-ил)-2'-фторбифенил-2-карбонитрил; 2'-фтор-5'-(7-изопропилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 2'-фтор-5'-(7-трет-бутилимидазо[1,2-а]пиримидин-3-ил)бифенил-2-карбонитрил; 2'-фтор-5'-[7-(1-гидрокси-1-метилэтил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил; 2'-фтор-5'-[7-(1-фтор-1-метилэтил)имидазо[1,2-а]пиримидин-3-ил]бифенил-2-карбонитрил;
МПК / Метки
МПК: C07D 487/04, A61P 39/00
Метки: рецепторов, производные, имидазопиримидина, лигандов, качестве, гамк
Код ссылки
<a href="https://eas.patents.su/30-6234-proizvodnye-imidazopirimidina-v-kachestve-ligandov-dlya-gamk-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные имидазопиримидина в качестве лигандов для гамк рецепторов</a>












