Производные триазола в качестве антагонистов вазопрессина
Номер патента: 10132
Опубликовано: 30.06.2008
Авторы: Брайанс Джастин Стивен, Джонсон Патрик Стивен, Робертс Ли Ричард, Рикманс Томас
Формула / Реферат
1. Соединение формулы (I)
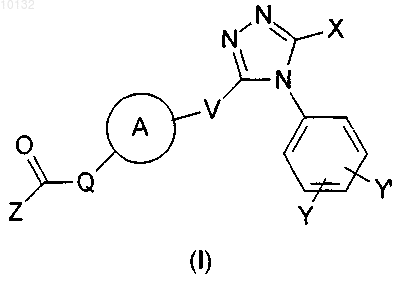
или его фармацевтически приемлемое производное, где
X представляет собой -[CH2]a-R или -[CH2]a-O-[CH2]b-R;
а представляет собой число, выбранное из чисел от 0 до 6;
b представляет собой число, выбранное из чисел от 0 до 6;
R представляет собой Н, CF3 или Het;
Het представляет собой 5- или 6-членное насыщенное, частично насыщенное или ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное одной или более группами, независимо выбранными из W;
Y представляет собой заместители в количестве один или более, независимо выбранные из -[O]c-[CH2]d-R1, которые в каждом случае могут быть одинаковыми или разными;
c, в каждом случае независимо, представляет собой число, выбранное из 0 или 1;
d, в каждом случае независимо, представляет собой число, выбранное из чисел от 0 до 6;
R1, в каждом случае независимо, представляет собой Н, галогено, CF3, CN или Het1;
Het1, в каждом случае независимо, представляет собой 5- или 6-членное ненасыщенное гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота;
V представляет собой прямую связь или -О-;
кольцо А представляет собой 5-7-членное насыщенное гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, причем кольцо А возможно замещено одной или более группами, выбранными из C1-6алкила, фенила или гидрокси;
Q представляет собой прямую связь или -N(R2)-;
R2 представляет собой атом водорода или С1-6алкил;
Z представляет собой -[O]e-[CH2]f-R3, фенильное кольцо (возможно конденсированное с бензольным кольцом или Het2, причем эта группа в целом возможно замещена одной или более группами, независимо выбранными из W) или Het3 (возможно конденсированный с бензольным кольцом или Het4, причем эта группа в целом возможно замещена одной или более группами, независимо выбранными из W);
R3 представляет собой С1-6алкил (возможно замещенный одной или более группами, независимо выбранными из W), C3-6циклоалкил, С3-6циклоалкенил, фенил (возможно замещенный одной или более группами, независимо выбранными из W), Het5 или NR4R5;
е представляет собой число, выбранное из 0 или 1;
f представляет собой число, выбранное из чисел от 0 до 6;
Het2 и Het5 независимо представляют собой 5- или 6-членное насыщенное, частично насыщенное или ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное одной или более группами, выбранными из W;
Het3 представляет собой 4-6-членное насыщенное, частично насыщенное или ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное одной или более группами, выбранными из W;
Het4 представляет собой 6-членное ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное одной или более группами, выбранными из W;
R4 и R5 независимо представляют собой атом водорода, С1-6алкил, C1-6алкилокси, С3-8циклоалкил (возможно конденсированный с С3-8циклоалкилом) или Het6, причем R4 и R5 возможно независимо замещены одной или более группами, выбранными из С1-6алкила, C1-6алкилокси, С3-8циклоалкила (возможно конденсированного с С3-8циклоалкилом) или фенила;
Het6 представляет собой 5- или 6-членное насыщенное, частично насыщенное или ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное одной или более группами, выбранными из W;
W, независимо в каждом случае, представляет собой галогено, [O]gR6, SO2R6, SR6, SO2NR6R7, [O]h[CH2]iCF3, [O]jCHF2, фенил (возможно замещенный галогено, C1-6алкилом или C1-6алкилокси), CN, фенокси (возможно замещенный галогено), ОН, бензил, NR6R7, NCOR6, бензилокси, оксо, CONHR6, NSO2R6R7, COR6, С1-6алкилен-NCOR7, Het7;
R6 представляет собой водород, C1-6алкил, C3-6циклоалкил, С3-6циклоалкенил или C1-6алкилен-О-С1-6алкил;
R7 представляет собой водород или C1-6алкил;
i представляет собой число, выбранное из чисел от 0 до 6;
h представляет собой число, выбранное из 0 или 1;
g представляет собой число, выбранное из 0 или 1;
j представляет собой число, выбранное из 0 или 1;
Het7 представляет собой 5- или 6-членное насыщенное, частично насыщенное или ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное R6, и/или R7, и/или оксогруппой.
2. Соединение по п.1, где X представляет собой -[CH2]a-R.
3. Соединение по п.2, где R представляет собой Het.
4. Соединение по любому из пп.1-3, где Y представляет собой галогено.
5. Соединение по любому из пп.1-4, где V представляет собой прямую связь.
6. Соединение по любому из пп.1-5, где Q представляет собой прямую связь.
7. Соединение по любому из пп.1-6, где кольцо А представляет собой шестичленное кольцо.
8. Соединение по любому из пп.1-7, где Z представляет собой фенил.
9. Соединение по любому из пп.1-8, где Z замещен галогено.
10. Соединение по п.1, выбранное из
(3-хлорфенил)-{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4Н-[1,2,4]триазол-3-ил]пиперидин-1-ил}метанона,
(4-хлорфенил)-{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-ил}метанона,
(5-хлор-2-фторфенил)-{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4Н-[1,2,4]триазол-3-ил]пиперидин-1-ил}метанона,
{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-ил}-(3,5-дифторфенил)метанона,
{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-ил}-(3-фторфенил)метанона,
{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-ил}-(2,3-дифторфенил)метанона,
(3-хлор-2-фторфенил)-{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4Н-[1,2,4]триазол-3-ил]пиперидин-1-ил}метанона,
(3-хлор-4-фторфенил)-{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4Н-[1,2,4]триазол-3-ил]пиперидин-1-ил}метанона,
{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4Н-[1,2,4]триазол-3-ил]-пиперидин-1-ил}-(4-трифторметилфенил)метанона,
{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4Н-[1,2,4]триазол-3-ил]пиперидин-1-ил}-(3-трифторметилфенил)метанона,
{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4Н-[1,2,4]триазол-3-ил]пиперидин-1-ил}-(2-трифторметилфенил)метанона,
(3-хлор-5-фторфенил)-{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-ил}метанона,
{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4Н-[1,2,4]триазол-3-ил]пиперидин-1-ил}-(4-дифторметилфенил)метанона,
{4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4Н-[1,2,4]триазол-3-ил]пиперидин-1-ил}-(1Н-индазол-3-ил)метанона
и их фармацевтически приемлемых производных.
11. Применение соединения по любому из пп.1-10 в качестве лекарства.
12. Способ лечения млекопитающего, включая человека, для лечения расстройства, при котором показан антагонист V1a, включающий введение терапевтически эффективного количества соединения по любому из пп.1-10.
13. Способ лечения млекопитающего, включая человека, для лечения тревоги, сердечно-сосудистого заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), дисменореи (первичной и вторичной), эндометриоза, рвоты (включая морскую болезнь), задержки внутриутробного развития плода, воспаления (включая ревматоидный артрит), боли в животе, возникающей во время овуляции, преэклампсии, преждевременной эякуляции, преждевременных (досрочных) родов или болезни Рейно, включающий введение терапевтически эффективного количества соединения по любому из пп.1-10 пациенту, страдающему таким расстройством.
14. Способ лечения по п.12 или 13, где расстройство представляет собой дисменорею (первичную или вторичную).
15. Применение соединения по любому из пп.1-10 в изготовлении лекарства для лечения расстройства, при котором показан антагонист рецептора V1a.
16. Применение соединения по любому из пп.1-10 в изготовлении лекарства для лечения тревоги, сердечно-сосудистого заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), дисменореи (первичной и вторичной), эндометриоза, рвоты (включая морскую болезнь), задержки внутриутробного развития плода, воспаления (включая ревматоидный артрит), боли в животе, возникающей во время овуляции, преэклампсии, преждевременной эякуляции, преждевременных (досрочных) родов или болезни Рейно.
17. Применение по п.15 или 16, где расстройство представляет собой дисменорею (первичную или вторичную).
18. Фармацевтическая композиция, содержащая соединение по любому из пп.1-10 вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
19. Комбинация (А) соединения по любому из пп.1-10 и (Б) другого фармакологически активного ингредиента.
20. Комбинация по п.19, где (Б) является пероральным контрацептивом, ингибитором PDEV (фосфодиэстераза V), ингибитором СОХ (циклооксигеназа), NO-донором или L-аргинином.
21. Применение комбинации по п.19 или 20 для изготовления лекарства для комбинированной терапии одновременным, последовательным или раздельным введением для лечения дисменореи.
22. Способ лечения дисменореи, включающий введение субъекту, нуждающемуся в таком лечении, комбинации количеств (А) и (Б) по п.19 или 20, которые вместе являются эффективными.
23. Фармацевтический продукт, содержащий комбинацию (А) и (Б) по п.19 или 20, в качестве комбинированного препарата для одновременного, раздельного или последовательного использования в лечении дисменореи (первичной или вторичной).
Текст
010132 Данное изобретение относится к производным триазола и к способам получения таких производных, к промежуточным соединениям, используемым в получении таких производных, к композициям,содержащим такие производные, и к применениям таких производных. Производные триазола по настоящему изобретению являются антагонистами вазопрессина. В частности, они являются антагонистами рецептора V1a и имеют множество терапевтических применений, в частности в лечении дисменореи (первичной и вторичной). В области менструальных нарушений имеется высокая неудовлетворенная потребность, и, по оценкам, таким нарушениям до некоторой степени подвержены вплоть до 90% всех менструирующих женщин. До 42% женщин пропускают работу или другие виды деятельности из-за менструальной боли, и в результате в США теряется, по оценкам, около 600 млн рабочих часов в год Coco, A.S. (1999). Primarydysmenorrhoea [Review] [30 refs]. American Family Physician, 60, 489-96. Менструальная боль в нижней части живота вызывается гиперактивностью миометрия и пониженным кровотоком в матке. Эти патофизиологические изменения приводят к боли в животе, которая распространяется на спину и ноги. Это может приводить к тому, что женщины чувствуют тошноту, имеют головные боли и страдают бессонницей. Это состояние называется дисменореей и может быть классифицировано либо как первичная, либо как вторичная дисменорея. Первичную дисменорею диагностируют, когда не выявляется отклонение от нормы, вызывающее это состояние. Это затрагивает до 50% женского населения Coco, A.S. (1999). Primary dysmenorrhoea.[Review] [30 refs]. American Family Physician, 60, 489-96; Schroeder, B.Sanfilippo, J.S. (1999). Dysmenorrhoea and pelvic pain in adolescents. [Review] [78 refs]. Pediatric Clinics of North America, 46, 555-71. При наличии основного гинекологического расстройства, такого как эндометриоз, воспалительное заболевание в области таза (PID), фиброзные опухоли или раковые опухоли, диагностируют вторичную дисменорею. Вторичную дисменорею диагностируют только у приблизительно 25% женщин, страдающих дисменореей. Дисменорея может иметь место в сочетании с меноррагией, на которую приходится около 12% обращений в гинекологические амбулаторно-поликлинические учреждения. В настоящее время женщин, страдающих первичной дисменореей, лечат нестероидными противовоспалительными лекарственными средствами (NSAID) или пероральными контрацептивными пилюлями. В случаях вторичной дисменореи может быть предпринято хирургическое вмешательство с целью коррекции основного гинекологического расстройства. Женщины, страдающие дисменореей, имеют уровни содержания вазопрессина в крови, которые выше, чем у здоровых женщин в одно и то же время менструального цикла. Ингибирование фармакологических действий вазопрессина на маточные рецепторы вазопрессина может предотвращать дисменорею. Таким образом, соединения по настоящему изобретению потенциально полезны в лечении широкого диапазона расстройств, в частности агрессии, болезни Альцгеймера, нервной анорексии, тревоги, тревожного расстройства, астмы, атеросклероза, аутизма, сердечно-сосудистого заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), катаракты,заболевания центральной нервной системы, цереброваскулярной ишемии, цирроза, когнитивного расстройства, болезни Кушинга, депрессии, сахарного диабета, дисменореи (первичной и вторичной), рвоты(включая морскую болезнь), эндометриоза, желудочно-кишечного заболевания, глаукомы, гинекологического заболевания, заболевания сердца, задержки внутриутробного развития плода, воспаления (включая ревматоидный артрит), ишемии, ишемической болезни сердца, опухоли легкого, расстройства мочеиспускания, боли в животе, возникающей во время овуляции, неоплазмы, нефротоксичности, инсулиннезависимого диабета, ожирения, обсессивно-компульсивного расстройства, повышенного внутриглазного давления, преэклампсии, преждевременной эякуляции, преждевременных (досрочных) родов, легочного заболевания, болезни Рейно, почечного заболевания, почечной недостаточности, мужской или женской сексуальной дисфункции, септического шока, нарушения сна, повреждения спинного мозга,тромбоза, инфекции мочеполовых путей или мочекаменной болезни. Особый интерес представляют следующие заболевания или расстройства: тревога, сердечнососудистые заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность,отек, гипернатриемию), дисменорея (первичная и вторичная), эндометриоз, рвота (включая морскую болезнь), задержка внутриутробного развития плода, воспаление (включая ревматоидный артрит), боль в животе, возникающая во время овуляции, преэклампсия, преждевременная эякуляция, преждевременные(досрочные) роды и болезнь Рейно. Соединения по изобретению и их фармацевтически приемлемые соли и сольваты имеют преимущество в том, что они являются селективными ингибиторами рецептора V1a (и поэтому по всей вероятности оказывают сниженные побочные эффекты), они могут быстрее начинать свое действие, они могут действовать сильнее, они могут действовать дольше, они могут иметь лучшую биодоступность или они могут обладать другими свойствами, более желательными, чем у соединений предшествующего уровня техники. В соответствии с настоящим изобретением предложено соединение формулы (I) или его фармацевтически приемлемое производное, гдеX представляет собой -[CH2]a-R или -[CH2]a-O-[CH2]b-R; а представляет собой число, выбранное из чисел от 0 до 6;b представляет собой число, выбранное из чисел от 0 до 6;Het представляет собой 5- или 6-членное насыщенное, частично насыщенное или ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное одной или более группами, независимо выбранными из W;Y представляет собой заместители в количестве один или более, независимо выбранные из -[O]c[CH2]d-R1, которые в каждом случае могут быть одинаковыми или разными; с в каждом случае независимо представляет собой число, выбранное из 0 или 1;d в каждом случае независимо представляет собой число, выбранное из чисел от 0 до 6;R1 в каждом случае независимо представляет собой Н, галогено, CF3, CN или Het1;Het1 в каждом случае независимо представляет собой 5- или 6-членное ненасыщенное гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы,либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота;V представляет собой прямую связь или -О-; кольцо А представляет собой 5-7-членное насыщенное гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, причем кольцо А возможно замещено одной или более группами, выбранными из С 1-6 алкила, фенила или гидрокси;Q представляет собой прямую связь или -N(R2)-;R2 представляет собой атом водорода или С 1-6 алкил;Z представляет собой -[O]e-[CH2]f-R3, фенильное кольцо (возможно конденсированное с бензольным кольцом или Het2, причем эта группа в целом возможно замещена одной или более группами, независимо выбранными из W) или Het3 (возможно конденсированный с бензольным кольцом или Het4, причем эта группа в целом возможно замещена одной или более группами, независимо выбранными из W);R3 представляет собой С 1-6 алкил (возможно замещенный одной или более группами, независимо выбранными из W), С 3-6 циклоалкил, С 3-6 циклоалкенил, фенил (возможно замещенный одной или более группами, независимо выбранными из W), Het5 или NR4R5; е представляет собой число, выбранное из 0 или 1;f представляет собой число, выбранное из чисел от 0 до 6;Het2 и Het5 независимо представляют собой 5- или 6-членное насыщенное, частично насыщенное или ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное одной или более группами, выбранными из W;Het3 представляет собой 4-6-членное насыщенное, частично насыщенное или ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное одной или более группами, выбранными из W;Het4 представляет собой 6-членное ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное одной или более группами, выбранными из W;R4 и R5 независимо представляют собой атом водорода, C1-6 алкил, C1-6 алкилокси, С 3-8 циклоалкил(возможно конденсированный с С 3-8 циклоалкилом) или Het6, причем R4 и R5 возможно независимо замещены одной из более группами, выбранными из C1-6 алкила, C1-6 алкилокси, C3-8 циклоалкила (возможно конденсированного с С 3-8 циклоалкилом) или фенила;Het6 представляет собой 5- или 6-членное насыщенное, частично насыщенное или ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное одной или более группами, выбранными из W;W независимо в каждом случае представляет собой галогено, [O]gR6, SO2R6, SR6, SO2NR6R7,-2 010132R7 представляет собой водород или С 1-6 алкил;i представляет собой число, выбранное из чисел от 0 до 6;Het7 представляет собой 5- или 6-членное насыщенное, частично насыщенное или ароматическое гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, либо (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, возможно замещенное R6,и/или R7, и/или оксогруппой. В альтернативном воплощении предложено соединение формулы (I') или его фармацевтически приемлемое производное, гдеX представляет собой -[CH2]a-R или -[CH2]a-O-[CH2]b-R; а представляет собой число, выбранное из чисел от 0 до 6;b представляет собой число, выбранное из чисел от 0 до 6;Het представляет собой 5- или 6-членное гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота;c и c' независимо представляют собой число, выбранное из 0 или 1;d и d' независимо представляют собой число, выбранное из чисел от 0 до 6;R1 и R1' независимо представляют собой Н, галогено, CF3 или Het1;Het1 представляет собой 5- или 6-членное ненасыщенное гетероциклическое кольцо, содержащее либо (а) от 1 до 4 атомов азота, (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атом азота; кольцо А представляет собой 5- или 6-членное насыщенное гетероциклическое кольцо, содержащее по меньшей мере один атом азота;Z представляет собой -[O]e-[CH2]f-R2, фенильное кольцо (возможно конденсированное с фенильным кольцом или 5-, или 6-членным насыщенным, частично ненасыщенным или ароматическим гетероциклическим кольцом и/или возможно замещенное одной или более группами, независимо выбранными изW) или 6-членное ароматическое гетероциклическое кольцо (возможно конденсированное с фенильным кольцом или 6-членным ароматическим гетероциклическим кольцом и/или возможно замещенное одной или более группами, независимо выбранными из W);f представляет собой число, выбранное из чисел от 0 до 6;R4 представляет собой водород или C1-6 алкил;i представляет собой число, выбранное из чисел от 0 до 6;Het2 представляет собой 5- или 6-членную насыщенную, частично ненасыщенную или ароматическую гетероциклическую группу, содержащую либо (а) от 1 до 4 атомов азота, (б) 1 атом кислорода или 1 атом серы, либо (в) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, причем эта гетероцикличе-3 010132 ская группа возможно замещена R3, и/или R4, и/или оксигруппой. В вышеуказанных определениях галогено означает фторо, хлоро, бромо или йодо. Группы алкил,алкилен и алкилокси, содержащие указанное количество атомов углерода, могут быть неразветвленными или разветвленными. Примеры алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил,втор-бутил и трет-бутил. Примеры алкилокси включают метокси, этокси, н-пропокси, изопропокси, нбутокси, изобутокси, втор-бутокси и трет-бутокси. Примеры алкилена включают метилен, 1,1-этилен,1,2-этилен, 1,1-пропилен, 1,2-пропилен, 1,3-пропилен и 2,2-пропилен. Het представляет собой гетероциклическую группу, примеры которой включают тетрагидрофуранил, тетрагидротиофенил, пирролидинил,тетрагидропиранил, тетрагидротиопиранил, пиперидинил, 1,4-диоксанил, 1,4-оксатианил, морфолинил,1,4-дитианил, пиперазинил, 1,4-азатианил, 3,4-дигидро-2 Н-пиранил, 5,6-дигидро-2 Н-пиранил, 2 Нпиранил, 1,2,3,4-тетрагидропиридинил, 1,2,5,6-тетрагидропиридинил, пирролил, фуранил, тиофенил, пиразолил, имидазолил, изоксазолил, оксазолил, изотиазолил, тиазолил, 1,2,3-триазолил, 1,3,4-триазолил, 1 окса-2,3-диазолил, 1-окса-2,4-диазолил, 1-окса-2,5-диазолил, 1-окса-3,4-диазолил, 1-тиа-2,3-диазолил, 1 тиа-2,4-диазолил, 1-тиа-2,5-диазолил, 1-тиа-3,4-диазолил, тетразолил, пиридинил, пиридазинил, пиримидинил и пиразинил. Предпочтительным соединением является соединение, в котором X представляет собой СН 2 ОСН 3. Более предпочтительным является соединение, в котором X представляет собой -[CH2]aR. Предпочтительным соединением является соединение, в котором а представляет собой число, выбранное из чисел от 0 до 5. Более предпочтительным является соединение, в котором а представляет собой число, выбранное из чисел от 0 до 4. Еще более предпочтительным является соединение, в котором а представляет собой число, выбранное из чисел от 0 до 3. Еще более предпочтительным является соединение, в котором а представляет собой число, выбранное из чисел от 0 до 2. Наиболее предпочтительным является соединение, в котором а представляет собой число 1. Предпочтительным соединением является соединение, в котором R представляет собой Н. Более предпочтительным соединением является соединение, в котором R представляет собой Het. Еще более предпочтительным является соединение, в котором R представляет собой триазолил. Предпочтительным соединением является соединение, в котором Y представляет собой один или два заместителя. Более предпочтительным соединением является соединение, в котором Y представляет собой единственный заместитель. Предпочтительным соединением является соединение, в котором Y представляет собой галогено. Более предпочтительным соединением является соединение, в котором Y представляет собой хлоро и/или фторо. Предпочтительным соединением является соединение, в котором V представляет собой прямую связь. Предпочтительным соединением является соединение, в котором Q представляет собой прямую связь. Более предпочтительным соединением является соединение, в котором и V, и Q представляют собой прямую связь. Предпочтительным соединением является соединение, в котором кольцо А содержит 2 атома азота. Более предпочтительным соединением является соединение, в котором кольцо А содержит 1 атом азота. Предпочтительным соединением является соединение, в котором кольцо А представляет собой 5 членное кольцо. Более предпочтительным соединением является соединение, в котором кольцо А представляет собой 6-членное кольцо. Еще более предпочтительным соединением является соединение, в котором кольцо А представляет собой пиперидинилен. Предпочтительным соединением является соединение, в котором кольцо А присоединено к V через атом азота. Более предпочтительным соединением является соединение, в котором кольцо А присоединено к Q через атом азота. Предпочтительным соединением является соединение, в котором кольцо А присоединено как к Q, так и к V через атом азота. Предпочтительным соединением является соединение, в котором Z представляет собой Het3. Het3 может представлять собой возможно замещенную группу, выбранную из индазолила, индолила, инденила, пиразолила, пиперидинила, пиридинила, пиримидинила, пирролила, тиазолила, бензотиенила, бензотиазолила, хинолинила, бензоксазинила, изоксазолила, имидазолила, фурила, бензофурила, циннолинила, морфолинила, хроменила или их производных. Более предпочтительным соединением является соединение, в котором Z представляет собой фенил. Предпочтительным соединением является соединение, в котором Z является моно- или дизамещенным. Более предпочтительным соединением является соединение, в котором Z является монозамещенным. Предпочтительным соединением является соединение, в котором Z замещен трифторметилом. Более предпочтительным соединением является соединение, в котором Z замещен галогено. Более предпочтительным соединением является соединение, в котором Z замещен хлоро и/или фторо. Конкретными предпочтительными соединениями по изобретению являются соединения, перечисленные ниже в разделе Примеры, и их фармацевтически приемлемые соли, в частности(4-хлорфенил)-4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4 Н-[1,2,4]триазол-3-ил]пиперидин 1-илметанон,(5-хлор-2-фторфенил)-4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4 Н-[1,2,4]триазол-3-ил]пиперидин-1-илметанон,4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-ил-(3,5 дифторфенил)метанон,4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4 Н-[1,2,4]триазол-3-ил]пиперидин-1-ил-(3-фторфенил)метанон,4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-ил-(2,3 дифторфенил)метанон,(3-хлор-2-фторфенил)-4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-илметанон,(3-хлор-4-фторфенил)-4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4 Н-[1,2,4]триазол-3-ил]пиперидин-1-илметанон,4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-ил-(4-трифторметилфенил)метанон,4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4 Н-[1,2,4]триазол-3-ил]пиперидин-1-ил-(3 трифторметилфенил)метанон,4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4 Н-[1,2,4]триазол-3-ил]пиперидин-1-ил-(2 трифторметилфенил)метанон,(3-хлор-5-фторфенил)-4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-илметанон,4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4H-[1,2,4]триазол-3-ил]пиперидин-1-ил-(4 дифторметилфенил)метанон,4-[4-(4-хлорфенил)-5-[1,2,3]триазол-2-илметил-4 Н-[1,2,4]триазол-3-ил]пиперидин-1-ил-(1Hиндазол-3-ил)метанон и их фармацевтически приемлемые производные. Фармацевтически приемлемые производные соединений формулы (I) по изобретению включают соли, сольваты, комплексы, полиморфы, пролекарства, стереоизомеры, геометрические изомеры, таутомерные формы и изотопные варианты соединений формулы (I). Предпочтительно фармацевтически приемлемые производные соединений формулы (I) включают соли, сольваты, эфиры и амиды соединений формулы (I). Более предпочтительными фармацевтически приемлемыми производными соединений формулы (I) являются соли и сольваты. Фармацевтически приемлемые соли соединений формулы (I) включают их соли присоединения кислоты и основания. Подходящие соли присоединения кислоты образуются из кислот, которые образуют нетоксичные соли. Примеры включают соли ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат, борат, камзилат, цитрат, эдизилат, эзилат, формиат, фумарат, глуцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изотионат, D- и Lлактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напзилат, никотинат, нитрат, оротат,оксалат, пальмитат, памоат, фосфат, гидрофосфат, дигидрофосфат, сахарат, стеарат, сукцинат, сульфат,D- и L-тартрат, тозилат и трифторацетат. Особенно подходящей солью является безилатное производное соединений по настоящему изобретению. Подходящие соли оснований образуются из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Обзор по подходящим солям см. в Stahl and Werrnuth, Handbook of Pharmaceutical Salts: Properties,Selection and Use, Wiley-VCH, Weinheim, Germany (2002). Фармацевтически приемлемая соль соединения формулы (I) легко может быть получена смешиванием вместе растворов соединения формулы (I) и желаемой кислоты или основания, где как подходит. Соль может быть осаждена из раствора и собрана фильтрованием, или она может быть выделена выпариванием растворителя. Степень ионизации соли может варьировать от полностью ионизированной до почти неионизированной. Соединения по изобретению могут существовать как в несольватированной, так и в сольватированной форме. Термин "сольват" использован здесь для описания молекулярного комплекса, содержащего соединение по изобретению и одну или более молекул фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" используется, когда вышеуказанным растворителем является вода. В объем изобретения входят комплексы, такие как клатраты, комплексы включения лекарственное средство-хозяин, где, в отличие от вышеупомянутых сольватов, лекарственное средство и хозяин присутствуют в стехиометрических или нестехиометрических количествах. В объем изобретения также входят комплексы лекарственного средства, содержащие два или более органических и/или неорганических компонентов, которые могут быть в стехиометрических или нестехиометрических количествах. Полу-5 010132 ченные комплексы могут быть ионизированными, частично ионизированными или неионизированными. Обзор таких комплексов см. в J Pharm Sci, 64 (8), 1269-1288 by Haleblian (August 1975). Далее все ссылки на соединения формулы (I) и фармацевтически приемлемые производные включают ссылки на их соли, сольваты и комплексы и на сольваты и комплексы их солей. Соединения по изобретению включают соединения формулы (I), как они определены здесь выше,их полиморфы, пролекарства и изомеры (включая оптические, геометрические и таутомерные изомеры),которые определены ниже, и меченные изотопами соединения формулы (I). Как указано, данное изобретение охватывает все полиморфы соединений формулы (I), как определено выше. Также в объем этого изобретения входят так называемые "пролекарства" соединений формулы (I). Так, некоторые производные соединений формулы (I), которые сами могут иметь небольшую фармакологическую активность или могут не иметь фармакологической активности, при введении их в или на организм, могут превращаться, например в результате гидролитического расщепления, в соединения формулы (I), имеющие желаемую активность. Такие производные называются "пролекарствами". Дополнительную информацию об использовании пролекарств можно найти в "Prodrugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T. Higuchi and W. Stella) и в "Bioreversible Carriers in Drug Design",Pergamon Press, 1987 (ed. E.В. Roche, American Pharmaceutical Association). Пролекарства в соответствии с изобретением могут быть получены, например, путем замещения соответствующей функциональной группы, присутствующей в соединениях формулы (I), определенными группировками, известными специалистам в данной области как "прогруппировки", как описано, например, в "Design of Prodrugs" by H Bundgaard (Elsevier, 1985). Некоторые примеры пролекарств в соответствии с изобретением включают:(1) если соединение формулы (I) содержит функциональную карбоновокислотную группу (-СООН),то его сложный эфир, например, замещение атома водорода С 1-8 алкилом;(2) если соединение формулы (I) содержит функциональную спиртовую группу (-ОН), то его простой эфир, например, замещение атома водорода C1-8 алканоилоксиметилом; и(3) если соединение формулы (I) содержит функциональную первичную или вторичную аминогруппу (-NH2 или -NHR, где RН), то его амид, например, замещение одного или обоих атомов водорода С 1-10 алканоилом. Дополнительные примеры замещающих групп в соответствии с вышеуказанными примерами и примеры других типов пролекарств можно найти в вышеупомянутых ссылках. Наконец, некоторые соединения формулы (I) сами могут действовать как пролекарства других соединений формулы (I). В объем изобретения также входят метаболиты соединений формулы (I) при их образовании in vivo. Соединения формулы (I), содержащие один или более асимметрических атомов углерода, могут существовать в виде двух или более стереоизомеров. Если соединение формулы (I) содержит группу алкенил или алкенилен, возможны геометрические цис/транс (или Z/E) изомеры, и если соединение содержит, например, кето или оксимную группу или ароматическую группировку, может иметь место таутомерная изомерия ("таутомерия"). Отсюда следует, что одно соединение может проявлять более чем один тип изомерии. В объем настоящего изобретения входят все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы (I), включая соединения, проявляющие более чем один тип изомерии, и смеси одного или более чем одного из них. В объем изобретения также входят соли присоединения кислоты или основания, где противоион является оптически активным, например D-лактат или L-лизин,или рацемические, например DL-тартрат или DL-аргинин. Цис/транс-изомеры могут быть разделены общепринятыми методами, хорошо известными специалистам, например фракционной кристаллизацией и хроматографией. Общепринятые методы получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной ВЭЖХ. Альтернативно, рацемат (или рацемический предшественник) может быть подвергнут взаимодействию с подходящим оптически активным соединением, например спиртом, или, когда соединение формулы (1) содержит кислотную или основную группировку, с кислотой или основанием, такой(им) как винная кислота или 1-фенилэтиламин. Полученная диастереомерная смесь может быть разделена хроматографией и/или фракционной кристаллизацией, и один или оба диастереомера могут быть превращены в соответствующий(е) чистый(е) энантиомер(ы) способами, общеизвестными специалисту. Хиральные соединения по изобретению (и их хиральные предшественники) могут быть получены в энантиомерно-обогащенной форме с использованием хроматографии, обычно ВЭЖХ, на асимметрической смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, содержащей от 0 до 50% изопропанола, обычно от 2 до 20%, и от 0 до 5% алкиламина, обычно 0,1% диэтиламина. Концентрирование элюата дает обогащенную смесь. Стереоизомерные конгломераты могут быть разделены общепринятыми методами, известными спе-6 010132 циалистам, см., например, "Stereochemistry of Organic Compounds" by E.L. Eliel (Wiley, New York, 1994). Настоящее изобретение также охватывает все фармацевтически приемлемые изотопные варианты соединения формулы (I), где один или более атомов заменены атомами, имеющими такой же атомный номер, но атомную массу или массовое число, отличающуюся(ееся) от атомной массы или массового числа, обычно обнаруживаемой(ого) в природе. Примеры изотопов, подходящих для введения в соединения по изобретению, включают изотопы водорода, такие как 2 Н и 3 Н, углерода, такие как 11 С, 13 С и 14 С, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 32 Р, серы, такие как 35S, фтора, такие как 18F, йода, такие как 123I и 125I, и хлора, такие как 36Cl. Некоторые меченные изотопом соединения формулы (I), например те, в которые введен радиоактивный изотоп, полезны в исследованиях тканевого распределения лекарственного средства и/или субстрата. Радиоактивные изотопы тритий, т.е. 3 Н, и углерод-14, т.е. 14 С, особенно полезны для этой цели ввиду легкости их введения и готовых средств детектирования. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может дать определенные терапевтические преимущества благодаря большей метаболической стабильности, например увеличенного времени полужизни in vivo, или сниженным требованиям к дозировке и, следовательно, может быть предпочтительным в некоторых случаях. Замещение позитрон-испускающими изотопами, такими как 11 С, 18F, 15O и 13N, может быть полезным в исследованиях методом позитронно-эмиссионной томографии (PET) для изучения заселенности субстрата рецепторами. Меченные изотопами соединения формулы (I), как правило, могут быть получены общепринятыми способами, известными специалистам, или способами, аналогичными описанным в прилагаемых примерах и подготовительных примерах с использованием соответствующих меченных изотопами реагентов вместо немеченых реагентов, использованных прежде. Фармацевтически приемлемые сольваты в соответствии с изобретением включают сольваты, где растворитель кристаллизации может быть изотопно-замещенным, например D2O, d6-ацетон и d6-DMSO. Соединения по изобретению полезны в терапии. Поэтому следующим аспектом данного изобретения является применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата в качестве лекарства. Соединения по изобретению обладают активностью антагонистов V1a. В частности, они полезны в лечении целого ряда состояний, в том числе агрессии, болезни Альцгеймера, нервной анорексии, тревоги, тревожного расстройства, астмы, атеросклероза, аутизма, сердечно-сосудистого заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), катаракты, заболевания центральной нервной системы, цереброваскулярной ишемии, цирроза, когнитивного расстройства, болезни Кушинга, депрессии, сахарного диабета, дисменореи (первичной и вторичной),рвоты (включая морскую болезнь), эндометриоза, желудочно-кишечного заболевания, глаукомы, гинекологического заболевания, заболевания сердца, задержки внутриутробного развития плода, воспаления(включая ревматоидный артрит), ишемии, ишемической болезни сердца, опухоли легкого, расстройства мочеиспускания, боли в животе, возникающей во время овуляции, неоплазмы, нефротоксичности, инсулин-независимого диабета, ожирения, обсессивно-компульсивного расстройства, повышенного внутриглазного давления, преэклампсии, преждевременной эякуляции, преждевременных (досрочных) родов,легочного заболевания, болезни Рейно, почечного заболевания, почечной недостаточности, мужской или женской сексуальной дисфункции, септического шока, нарушения сна, повреждения спинного мозга,тромбоза, инфекции мочеполовых путей или мочекаменной болезни. Особый интерес представляет дисменорея (первичная или вторичная), более конкретно первичная дисменорея. Таким образом, следующим аспектом этого изобретения является способ лечения млекопитающего,включая человека, для лечения расстройства, при котором показан антагонист V1a, включающий введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли или сольвата млекопитающему. В частности, соединения формулы (I) полезны в лечении тревоги, сердечно-сосудистого заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), дисменореи (первичной и вторичной), эндометриоза, рвоты (включая морскую болезнь), задержки внутриутробного развития плода, воспаления (включая ревматоидный артрит), боли в животе, возникающей во время овуляции, преэклампсии, преждевременной эякуляции, преждевременных (досрочных) родов или болезни Рейно. Еще более конкретно, они полезны в лечении дисменореи (первичной или вторичной). Следующим аспектом настоящего изобретения является применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата в изготовлении лекарства для лечения расстройства,при котором показан антагонист рецептора V1a. Все соединения формулы (I) могут быть получены по методикам, описанным в общих способах,представленных ниже, или конкретными способами, описанными в разделе Примеры и в разделе Подготовительные примеры, или их общепринятыми модификациями. Настоящее изобретение также охватывает любой или один или более из этих способов получения соединений формулы (I), в дополнение к-7 010132 любым новым промежуточным соединениям, использованным в них. Если не указано иное, то в данном описании изобретенияcat означает катализатор или каталитический. В приведенных ниже общих способах R, R1, R2, R3, кольцо А, V, X, Q, Z, Y, Y', Het, Het1 и Het2 такие, как определено выше для соединения формулы (I), если не оговорено иное. Если Q представляет собой NR2 или Q представляет собой прямую связь, присоединенную к атому азота в кольце А, то соединения формулы (I) могут быть получены согласно схеме 1. Схема 1PG представляет собой подходящую защитную группу для N, обычно бензил, BOC или CBz, и предпочтительно BOC. Соединения формулы (II) могут быть получены как описано в WO 9703986 А 1 19970206 или путем взаимодействия соответствующего сложного низшего алкилового эфира (например, метилового или этилового) с гидразином в стандартных условиях, как проиллюстрировано в подготовительных примерах ниже. Стадия (а). Соединения формулы (III) могут быть получены путем взаимодействия гидразина (II) с подходящим ацеталем (например, N,N-диметилацетамид-диметилацеталем) в подходящем растворителе,таком как THF или DMF, при температуре от комнатной температуры до примерно 60 С, в течение времени вплоть до 18 ч. Полученное промежуточное соединение затем может быть обработано в условиях кислотного катализа (например, p-TSA или TFA) в высококипящем растворителе (например, толуоле или ксилоле) в течение примерно 18 ч с получением соединения формулы (III). Предпочтительные условия: 1,5-2,0 экв. ацеталя (например, N,N-диметилацетамид-диметилацеталя, триэтилортопропионата) в THF или DMF при температуре от комнатной температуры до 60 С в течение примерно 18 ч и далее p-TSA или TFA (катализатор) в толуоле при температуре дефлегмации в течение 18 ч. Стадия (б). Образование триазола (IV) может быть достигнуто в результате взаимодействия соединения (III) с подходящим анилином в присутствии подходящего кислотного катализатора, такого какTFA или p-TSA, в подходящем высококипящем растворителе (например, толуоле или ксилоле) при по-8 010132 вышенной температуре. Предпочтительные условия: 0,5-1,0 экв. TFA, 1,0-2,0 экв. анилина в толуоле при примерно температуре дефлегмации в течение времени до 18 ч. Стадия (в). Удаление защитной группы с соединения (IV) осуществляют с использованием стандартной методологии, как описано в "Protective Groups in Organic Synthesis" by T.W. Greene and P. Wutz. Когда PG представляет собой BOC, предпочтительными условиями являются: 4 М HCl в диоксане вMeOH, диоксане или DCM при температуре от комнатной температуры до примерно 50 С в течение времени вплоть до 18 ч; или 2,2 М HCl в MeOH в течение времени вплоть до 18 ч при комнатной температуре; или TFA в DCM при комнатной температуре в течение около 1 ч. Альтернативно, когда PG представляет собой BOC, соединение (V) может быть получено прямо из соединения (III) путем обработки избытком TFA, обычно 1,1-1,5 экв., и соответствующим анилином в толуоле при температуре дефлегмации реакционной смеси в течение времени вплоть до 4 дней. Стадия (г). Соединения формулы (I) могут быть получены путем взаимодействия амина (V) с подходящей кислотой или хлорангидридом, где Т представляет собой ОН или Cl). Реакция сочетания может быть осуществлена с использованием любого из+ амин (V) с избытком кислого основания в подходящем растворителе или(2) кислота ZCO2H с традиционным агентом сочетания + амин (V), возможно, в присутствии катализатора с избытком основания в подходящем растворителе. В типичных случаях условия являются следующими:(1) хлорангидрид амин (V) (возможно с избытком триамина, такого как Et3N, основание Хюнига или NMM) в DCM или THF, без нагревания, в течение времени от 1 до 24 ч; или(2) кислота ZCO2H, WSCDI/DCC и HOBT/HOAT, амин, избыток NMM, Et3N или основание Хюнига, в THF, DCM, DMA или EtOAc, при комнатной температуре в течение времени от 4 до 48 ч; или кислота ZCO2H, PYBOP/PyBrOP/O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония гексафторфосфат, избыток амина, избыток NMM, Et3N или основания Хюнига, в THF, DCM, DMA или EtOAc, при комнатной температуре в течение времени от 4 до 24 ч. Предпочтительными условиями являются 1 экв. амина (V), 1,0-1,5 экв. 1,5-5 экв. NMM, Et3N или основания Хюнига в DCM при комнатной температуре в течение времени вплоть до 18 ч; или 1 экв. амина (V), 1,2 экв. ZCO2H, 1,2-1,5 экв. HOBT, 1,2-1,5 экв. WSCDI, 2-4 экв. Et3N, в DCM при комнатной температуре в течение 24 ч; или 1 экв. амина (V), 1,2-1,5 экв. ZCO2H, 1,2-2,0 экв. HBTU, 5 экв. Et3N или NMM в DMA или DCM,при температуре между комнатной и 60 С в течение времени вплоть до 24 ч. Соединения формулы (IV), где Q представляет собой NR2 или Q представляет собой прямую связь,присоединенную к атому азота в кольце А, которое в свою очередь присоединено к триазольному кольцу через атом азота, может быть альтернативно получено как описано на схеме 2 ниже, и они представлены как соединения (IVA). Схема 2 Стадия (д). Соединения формулы (VIIIA) могут быть получены взаимодействием приблизительно эквимолярных количеств изотиоцианата (VI) и амина (VII) в подходящем растворителе (например EtOH или DCM) при комнатной температуре в течение времени от 2 до 72 ч. Предпочтительные условия: 1-1,1 экв. (VI), 1 экв. (VII), в EtOH или DCM, при комнатной температуре в течение 0,5-2 ч. Соединения формул (VI) и (VII) имеются в продаже или их можно получить из известных соедине-9 010132 ний с использованием стандартных химических превращений. Стадия (е). Соединения формулы (IXA) могут быть получены метилированием тиомочевины(VIIIA) с использованием подходящего метилирующего агента (например, MeI или MeTosylate) в присутствии подходящего основания (например, KOt-Bu) в подходящем растворителе (например, THF или простом эфире) при температуре между 0 С и температурой дефлегмации этой реакционной смеси в течение примерно 18 ч. Предпочтительные условия: 1 экв. (VIIIA), 1-1,2 экв. KOt-Bu, 1-1,2 экв. MeI илиMeTosylate, в THF, при температуре между 10 С и комнатной температурой в течение времени вплоть до 18 ч. Стадия (ж). Соединения формулы (IVA) могут быть получены взаимодействием соединения (IXA) с подходящим гидразидом (XCONHNH2), возможно в условиях кислотного катализа (например, TFA илиp-TSA) в подходящем растворителе (например, THF или н-BuOH), при температуре между комнатной температурой и температурой дефлегмации реакционной смеси. Предпочтительные условия: 0,5 экв.TFA, избыток гидразида (XCONHNH2), в THF при температуре дефлегмации в течение времени вплоть до 18 ч. Соединения формулы (VIIIA), где Q представляет собой NR2 или Q представляет собой прямую связь, присоединенную к атому азота в кольце А, которое в свою очередь присоединено к триазольному кольцу через атом азота, может быть альтернативно получено как показано на схеме 3. Схема 3 Соединения формулы (X) имеются в продаже, или они могут быть получены из известных соединений с использованием стандартных химических превращений. Соединения формулы (XI) могут быть получены из изотиоцианата (VI) и амина (X) способами, аналогичными способам, описанным выше для стадии (д). Стадия (з). Соединения формулы (VIIIA) могут быть получены путем защиты реакционноспособного атома азота с использованием стандартной методологии, как описано в "Protective Groups in OrganicSynthesis" by T.W. Greene and P. Wutz. Когда PG представляет собой ВОС, предпочтительными условиями являются 1 экв. амина (XI), 1 экв. ди-трет-бутилдикарбоната в DCM и диоксане, при комнатной температуре, в течение примерно 3 ч. Соединения формулы (VIII), где Q представляет собой NR2 или Q представляет собой прямую связь, присоединенную к атому азота в кольце А, которое в свою очередь присоединено к триазольному кольцу через атом углерода, могут быть получены как представлено на схеме 4, где они представлены как соединения (VIIIБ). Схема 4 Стадия (и). Соединения формулы (XIV) могут быть получены сочетанием анилина (XIII) с кислотой(XII) способом, аналогичным способу, описанному выше в стадии (г). Предпочтительные условия: 1 экв. кислоты (XII), 1,1 экв. амина (XIII), 1,2 экв. WSCDI, 3 экв. Et3N в MeCN при комнатной температуре в течение примерно 3 дней. Стадия (к). Соединение формулы (VIIIБ) получают тионированием соединения (XIV) обработкой подходящим тионирующим агентом, таким как реагент Лавессона, в высококипящем растворителе (например, толуоле) при температуре между комнатной температурой и температурой дефлегмации реакционной смеси. Предпочтительные условия: 1 экв. (XIV), 0,5 экв. реагента Лавессона в толуоле, при температуре между комнатной температурой и температурой дефлегмации, в течение времени до 18 ч. Соединения формулы (III), где Q представляет собой NR2 или Q представляет собой прямую связь,которая присоединена к атому азота в кольце А, могут быть альтернативно получены как показано на схеме 5. Стадия (л). Диацилгидразиды (XV) могут быть получены сочетанием гидразидов (II) с кислотой или где Т представляет собой Cl или ОН) способом, аналогичным способу, описанхлорангидридом ному выше в стадии (г). Предпочтительные условия: 1 экв. гидразида (II), 1,1 экв. XCO2H, 1,1 экв.WSCDI, 1,1 экв. HOBT, 1,2 экв. Et3N, в DMF при комнатной температуре в течение 18 ч. Стадия (м). Оксадиазол (III) может быть получен циклизацией соединения (XV), обычно в условиях кислотного катализа (например, полифосфорная кислота, POCl3, трифторметилсульфоновый ангидрид/пиридин или 1-метилимидазол), возможно в подходящем растворителе (например, DCM), при температуре между 0 С и температурой дефлегмации реакционной смеси. Предпочтительные условия: 1 экв.(XV), избыток пиридина или 1-метилимидазола, 1,5-2 экв. трифторметилсульфонового ангидрида, вDCM, при температуре между 0 С и комнатной температурой в течение времени вплоть до 3 ч. Соединения формулы (XV) могут быть альтернативно получены сочетанием кислоты (XII) с подходящим гидразидом (XCONHNH2) способом, аналогичным способу, описанному выше в стадии (г). Предпочтительные условия: 1 экв. кислоты (XII), 1 экв. гидразида, 1,02 экв. WSDCl, в DCM при температуре между 0 С и комнатной температурой. Соединения формулы (III), где X представляет собой CH2N-связанный-Het, может быть альтернативно получен как показано на схеме 6. Схема 6 Стадия (н). Соединения формулы (XVI) могут быть получены взаимодействием гидразида (II) с хлорацетилхлоридом в присутствии подходящего 3 аминного основания (например, Et3N или NMM) в подходящем растворителе (например, EtOAc или DCM) при температуре между 0 С и комнатной температурой в течение примерно 18 ч. Предпочтительные условия: 1 экв. (II), 1 экв. ацетилхлорида, 1,1 экв.NMM, в DCM, при температуре от 10 С до комнатной температуры, в течение времени вплоть до 18 ч. Соединения формулы (XVII) могут быть получены циклизацией соединения (XVI) способом, аналогичным способу, описанному в стадии (м) выше. Стадия (о). Соединения формулы (III) могут быть получены взаимодействием соединения (XVII) с подходящим Het (содержащим реакционноспособный атом N) в присутствии подходящего основания(например Et3N или K2CO3), в подходящем растворителе (например DMF или MeCN), при температуре между комнатной температурой и температурой дефлегмации реакционной смеси, в течение примерно 18 ч. Предпочтительные условия: 1 экв. (XVII), 1,4 экв. K2CO3, 2 экв. Het, в DMF при комнатной температуре в течение 18 ч. Соединения формулы (I), где Q представляет собой NR2, или Q представляет собой прямую связь,которая присоединена к атому азота в кольце А, могут быть альтернативно получены как показано на схеме 7.Ra представляет собой С 1-4 алкил или бензил и предпочтительно представляет собой Me или Et. Стадия (п). Соединение формулы (XIX) может быть получено взаимодействием амина (XVIII) с подходящей кислотой или хлорангидридом где Т представляет собой ОН или Cl) способом, аналогичным способу, описанному выше в стадии (г). Предпочтительные условия: 1 экв. (XVIII), 0,9 экв.ZCOCl, 1,1 экв. Et3N, в DCM, при температуре между 10 С и комнатной температурой в течение примерно 3 ч. Стадия (р). Гидразид формулы (XX) может быть получен обработкой сложного эфира (XIX) избытком гидразина в подходящем растворителе (например, EtOH или MeOH) при температуре дефлегмации реакционной смеси в течение времени вплоть до 18 ч. Предпочтительные условия: 1 экв. (XIX), 2-4 экв. гидразина, в MeOH при температуре дефлегмации, в течение времени между 10 и 48 ч. Соединения формулы (XXI) могут быть получены взаимодействием гидразида (XX) с с использованием способов, описанных выше в стадии (л). Соединения формулы (XXII) могут быть получены циклизацией соединения (XXI) с использованием способов, описанных выше в стадии (м). Соединения формулы (I) могут быть получены из оксадиазола (XXII) с подходящим анилином, как описано выше в стадии (б). Альтернативно, соединения формулы (XXII) могут быть получены прямо из соединения (XX) взаимодействием с соответствующим ацеталем (например, триэтилортопропионатом, N,N-диметилацетамиддиметилацеталем) способом, аналогичным способу, описанному выше в стадии (а). Соединения формулы (XXII), где X представляет собой CH2-N-связанный-Het, могут быть альтернативно получены как показано на схеме 8. Схема 8 Соединения формулы (XXIII) могут быть получены взаимодействием гидразида (XX) с хлорацетилхлоридом способом, аналогичным способу, описанному выше в стадии (н). Оксадиазол (XXIV) может быть получен циклизацией соединения (XXIII) способом, аналогичным способу, описанному выше в стадии (м). Соединение (XXII) может быть получено взаимодействием соединения (XXIV) с подходящим Het(содержащим реакционноспособный атом N), как описано выше в стадии (о). Соединения формулы (I), где кольцо А присоединено к триазольному кольцу через атом азота, могут быть альтернативно получены как показано на схеме 9. Соединения формулы (XXV) либо имеются в продаже, либо могут быть получены из имеющихся в продаже соединений с использованием стандартных химических превращений. Соединения формулы (XXVI) могут быть получены взаимодействием соединения (XXV) с соответствующим изотиоцианатом (VI) способом, аналогичным способу, описанному выше в стадии (д). Соединение формулы (XXVII) может быть получено алкилированием соединения (XXVI) способом, аналогичным способу, описанному выше в стадии (е). Соединение формулы (I) может быть получено взаимодействием соединения (XXVII) с подходящим гидразидом, как описано выше в стадии (ж). Соединения формулы (I), где Q представляет собой прямую связь, которая присоединена к атому углерода в кольце А, которое в свою очередь присоединено к триазольному кольцу через атом азота в кольце А, и Z представляет собой NR4R5, могут быть получены как показано на схеме 10. Схема 10Ra представляет собой С 1-4 алкил или бензил и предпочтительно представляет собой Me или Et. Соединения формулы (XXVIII) либо имеются в продаже, либо могут быть получены из имеющихся в продаже соединений с использованием стандартных химических превращений. Соединения формулы (XXIX) могут быть получены взаимодействием соединения (XXVIII) с соответствующим изотиоцианатом (VI) способом, аналогичным способу, описанному выше в стадии (д). Соединение формулы (XXX) может быть получено алкилированием соединения (XXIX) способом,аналогичным способу, описанному выше в стадии (е). Соединение формулы (XXXI) может быть получено взаимодействием соединения (XXX) с подходящим гидразидом, как описано выше в стадии (ж). Стадия (с). Гидролиз сложного эфира (XXXI) с использованием подходящего кислотного или основного катализатора, предпочтительно основания щелочного металла (например, NaOH, KOH илиLiOH) в подходящем водном растворителе (например диоксане или MeOH) при температуре между ком- 13010132 натной температурой и температурой дефлегмации реакционной смеси, в течение времени от 2 до 48 ч. Предпочтительные условия: 1 экв. (XXXI), 5-10 экв. раствора NaOH, в диоксане при температуре между комнатной температурой и температурой дефлегмации, в течение времени от 2 до 16 ч. Соединения формулы (I) могут быть получены взаимодействием Z-H (содержащим реакционноспособный атом N) с кислотой (XXXII) способом, аналогичным способу, описанному выше для стадии (г). Предпочтительные условия: 1 экв. кислоты (XXXII), 1,5 экв. амина (ZH), 4 экв. Et3N, 1,5 экв. WSCDI, 1,5 экв. HOBT, в DCM при комнатной температуре, в течение 24 ч. Соединения формулы (XXXII) могут быть альтернативно получены гидролизом соответствующего нитрильного соединения (XXXIII) в стандартных условиях (например, 5 экв. KOH, 1 экв. нитрила(XXXIII), в этаноле/диметиловом эфире этиленгликоля при температуре дефлегмации). Соединения формулы (XXXIII) могут быть получены как показано на схеме 11. Схема 11 Соединения формулы (XXXIII), где Q представляет собой прямую связь, и кольцо А присоединено к триазольному кольцу через атом азота, могут быть получены из соответствующего изотиоцианата (VI) способами, аналогичными способам, описанным в схеме 9. и нитрила, содержащего кольцо А,Соединения формулы (I), где V представляет собой атом кислорода, могут быть получены как показано на схеме 12. Схема 12 Стадия (т). Соединение формулы (XXXV) может быть получено взаимодействием гидразида(XCONHNH2) с изотиоцианатом (VI) способом, аналогичным способу, описанному выше в стадии (д). Предпочтительные условия: 1 экв. изотиоцианата, 1 экв. гидразида, в EtOH при комнатной температуре в течение 72 ч. Стадия (у). Соединения формулы (XXXVI) могут быть получены циклизацией соединения (XXXV) в кислотных или щелочных условиях, предпочтительно в условиях основного катализа (например, гидроксид щелочного металла) в водном растворителе (например, вода/EtOH) при повышенной температуре в течение примерно 24 ч. Предпочтительные условия: 1 экв. (XXXV), 10 экв. Водный NaOH(водный) в EtOH при 80 С в течение 18 ч. Стадия (ф). Алкилирование соединения (XXXVI) с получением соединения (XXXVII) может быть достигнуто обработкой подходящим алкилирующим агентом (например MeI или Me-Tozylate) способом,аналогичным способу, описанному выше в стадии (е). Предпочтительные условия: 1 экв. (XXXVI), 1 экв.KOt-Bu, 1 экв. Me-Tosylate, в THF, при температуре между комнатной температурой и температуре дефлегмации, в течение 3 ч. Стадия (х). Соединения формулы (XXXVIII) могут быть получены окислением соединения(XXXVII) обработкой подходящим окислителем (например, mCPBA или пероксид водорода) в подходящем растворителе (например, DCM) при комнатной температуре в течение примерно 18 ч. Предпочтительные условия: 1 экв. (XXXVII), 4 экв. mCPBA, в DCM, при комнатной температуре, в течение 18 ч. Стадия (ц). Соединения формулы (I) могут быть получены взаимодействием сульфоксида(XXXVIII) с избытком спирта (XXXIX) в присутствии подходящего основания (например, NaH или KOtBu), в подходящем растворителе (например, THF или эфир) при температуре между 0 и комнатной в течение времени вплоть до 18 ч. Предпочтительные условия: 1 экв. (XXXVIII), 2 экв. NaH, 2 экв. спирта(XXXIX), в THF в течение 18 ч при комнатной температуре. Соединения формулы (XXXIX) либо имеются в продаже, либо могут быть получены из имеющихся в продаже соединений с использованием стандартных химических превращений. Некоторые соединения формул (I), (III), (IV), (V), (XXII) и (XXXI) могут быть подвергнуты взаимным превращениям функциональных групп (например, алкилирование или гидролиз) с получением альтернативных соединений формул (I), (III), (IV), (V), (XXII) или (XXXI) соответственно. Соединения по изобретению, предназначенные для фармацевтического применения, можно вводить в виде кристаллических или аморфных продуктов. Они могут быть получены, например, в виде твердых масс, порошков или пленок такими способами, как осаждение, кристаллизация, сублимационная сушка,распылительная сушка или сушка выпариванием. Для этой цели можно использовать микроволновую или радиочастотную сушку. Их можно вводить одни или в комбинации с одним или более другими соединениями по изобретению или в комбинация с одним или более другими лекарственными средствами (или в виде любой их комбинации). Как правило, их будут вводить в виде композиции вместе с одним или более фармацевтически приемлемыми эксципиентами. Термин "эксципиент" использован здесь для описания любого ингредиента, иного чем соединение(я) по изобретению. Выбор эксципиента в большой степени зависит от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы. Еще одним аспектом данного изобретения является фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль или сольват вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем. В еще одном воплощении предложена фармацевтическая композиция для введения либо для профилактики, либо когда начинается боль. Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их получения будут очевидны специалистам в данной области. Такие композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences, 19th Edition (MackPublishing Company, 1995). Соединения по изобретению можно вводить перорально. Пероральное введение может включать проглатывание, так что соединение попадает в желудочно-кишечный тракт, или может быть использовано трансбуккальное или сублингвальное введение, при котором соединение поступает в кровоток прямо из ротовой полости. Препараты, подходящие для перорального введения, включают твердые препараты, такие как таблетки, капсулы, которые содержат частицы, жидкости или порошки, лепешки (в том числе заполненные жидкостью), жевательные резинки, мульти- и наночастицы, гели, твердые растворы, липосомы, пленки,овули, спреи и жидкие препараты. Жидкие препараты включают суспензии, растворы, сиропы и эликсиры. Такие препараты можно использовать в качестве наполнителей в мягких или твердых капсулах, и, как правило, они содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более эмульгирующих агентов и/или суспендирующих агентов. Жидкие препараты могут быть также получены путем разведения твердого вещества, например из саше. Соединения по изобретению можно также использовать в быстрорастворимых, быстрораспадающихся лекарственных формах, таких как описанные в Expert Opinion in Therapeutic Patents, 11 (6), 981986, by Liang and Chen (2001). Для таблеточных лекарственных форм в зависимости от дозы лекарственное средство может составлять от 1 до 80 мас.% от массы лекарственной формы, в более типичных случаях от 5 до 60 мас.% от массы лекарственной формы. В дополнение к лекарственному средству таблетки обычно содержат рарыхлитель. Примеры разрыхлителей включают крахмальный гликолят натрия, карбоксиметилцеллюлозу в натриевой форме, карбоксиметилцеллюлозу в кальциевой форме, натрий-кроскармеллозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, замещенную низшим алкилом гидроксипропилцеллюлозу, крахмал, предварительно желатинизированный крахмал и альгинат натрия. Обычно разрыхлитель составляет от 1 до 25 мас.%, предпочтительно от 5 до 20 мас.% от массы лекарственной формы. Связывающие агенты обычно используют для придания когезивных свойств таблеточному препарату. Подходящие связывающие агенты включают микрокристаллическую целлюлозу, желатин, сахара,полиэтиленгликоль, природные и синтетические камеди, поливинилпирролидон, предварительно желатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат,безводная и тому подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат двухосновного фосфата кальция. Таблетки возможно могут содержать также поверхностно-активные агенты, такие как лаурилсуль- 15010132 фат натрия и полисорбат 80, и глиданты, такие как диоксид кремния и тальк. Если они присутствуют,поверхностно-активные агенты могут составлять от 0,2 до 5 мас.% от массы таблетки, а глиданты могут составлять от 0,2 до 1 мас.% от массы таблетки. Таблетки также обычно содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазывающие вещества обычно составляют от 0,25 до 10 мас.%, предпочтительно от 0,5 до 3 мас.% от массы таблетки. Другие возможные ингредиенты включают антиоксиданты, красители, корригенты, консерванты и агенты, маскирующие вкус. Типичные таблетки содержат до примерно 80% лекарственного средства, от примерно 10 до примерно 90 мас.% связывающего вещества, от примерно 0 до примерно 85 мас.% разбавителя, от примерно 2 до примерно 10 мас.% разрыхлителя и от примерно 0,25 до примерно 10 мас.% смазывающего вещества. Таблеточные смеси можно прессовать непосредственно или с помощью катка до формования таблеток. Таблеточные смеси или порции смесей перед таблетированием альтернативно могут быть подвергнуты влажной, сухой грануляции или грануляции из расплава, расплавлению-застыванию или экструзии. Конечный препарат может содержать один или более слоев и может быть покрыт оболочкой или может быть без оболочки и даже может быть инкапсулированным. Изготовление таблеток рассмотрено в Pharmaceutical Dosage Forms: Tablets. Vol. 1, by H. Liebermanand L. Lachman (Marcel Dekker, New York, 1980). Потребляемые пероральные пленки для использования в ветеринарии или для людей обычно представляют собой сгибаемые водорастворимыми или набухающими в воде тонкопленочными лекарственными формами, которые могут быть быстрорастворимыми или мукоадгезивными, и обычно содержат соединение формулы (I), пленкообразующий полимер, связывающее вещество, растворитель, увлажнитель, пластификатор, стабилизатор или эмульгатор, агент, модифицирующий вязкость, и растворитель. Некоторые компоненты этого препарата могут выполнять более чем одну функцию. Соединение формулы (I) может быть растворимым или не растворимым в воде. Растворимое в воде соединение в типичных случаях составляет от 1 до 80 мас.%, в более типичных случаях от 20 до 50 мас.% от растворенных веществ. Менее растворимые соединения могут составлять большую часть композиции, в типичных случаях до 88 мас.% растворенных веществ. Альтернативно, соединение формулы(I) может быть в форме гранул, состоящих из множества частиц. Пленкообразующий полимер может быть выбран из природных полисахаридов, белков или синтетических гидроколлоидов, и в типичных случаях он присутствует в диапазоне от 0,01 до 99 мас.%, в более типичных случаях в диапазоне от 30 до 80 мас.%. Другие возможные ингредиенты включают антиоксиданты, красители, вещества, улучшающие вкус и запах, консерванты, вещества, стимулирующие слюноотделение, охлаждающие вещества, сорастворители (включая масла), смягчители, наполнители, пеногасители, поверхностно-активные вещества и вещества, маскирующие вкус. Пленки в соответствии с изобретением обычно получают испарительной сушкой тонкой водной пленки, нанесенной на отделяемую подложку или бумагу. Это может быть сделано в сушильном шкафу или в туннельной печи, обычно в комбинированном аппарате для нанесения и сушки покрытия, или сублимационной сушкой, или вакуумированием. Могут быть приготовлены твердые препараты для перорального введения с немедленным и/или модифицированным высвобождением. Препараты с модифицированным высвобождением включают препараты с отсроченным, длительным, импульсным, контролируемым, нацеленным и программированным высвобождением. Подходящие препараты с модифицированным высвобождением для целей данного изобретения раскрыты в патенте США 6106864. Детали других подходящих технологий высвобождения, таких как высокоэнергетические дисперсии и осмотические и покрытые оболочкой частицы, описаны в Pharmaceutical Technology On-line. 25(2), 1-14, by Verma et al (2001). Применение жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298. Соединения по изобретению можно также вводить прямо в кровоток, в мышцу или во внутренний орган. Подходящие способы парентерального введения включают внутривенный, внутриартериальный,внутрибрюшинный, интратекальный, внутрижелудочковый, интрауретральный, внутригрудинный, внутричерепной, внутримышечный и подкожный. Подходящие устройства для парентерального введения включают игольные (в том числе микроигольные) инъекторы, безыгольные инъекторы и инфузионную технику. Парентеральные препараты обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно до pH от 3 до 9), но для некоторых применений они могут быть более предпочтительно приготовлены в виде стерильного неводного раствора или в виде сухой формы для использования совместно с подходящим носителем,таким как стерильная апирогенная вода.- 16010132 Получение парентеральных препаратов в стерильных условиях, например, лиофилизацией легко может быть осуществлено по стандартным фармацевтическим методикам, общеизвестным специалистам в данной области. Растворимость соединений формулы (I), используемых в получении парентеральных растворов,можно увеличить с использованием соответствующих способов приготовления препаратов, таких как введение агентов, повышающих растворимость. Могут быть приготовлены препараты для парентерального введения с немедленным и/или модифицированным высвобождением. Препараты с модифицированным высвобождением включают препараты с отсроченным, длительным, импульсным, контролируемым, нацеленным и программированным высвобождением. Так, соединения по изобретению могут быть приготовлены в виде твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в виде имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких препаратов включают покрытые лекарственным средством стенты и микросферы из сополимера dl-молочной кислоты и гликолевой кислоты (PGLA). Соединения по изобретению можно также вводить местно на кожу или слизистую оболочку, то есть дермально или трансдермально. Типичные препараты для этой цели включают гели, гидрогели, лосьоны,растворы, кремы, мази, опудривающие средства, повязки, пенки, пленки, кожные пластыри, облатки,имплантаты, губки, фибры, бандажи и микроэмульсии. Также можно использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Можно вводить усилители проницаемости, см., например, J PharmSci, 88 (10), 955-958, by Finnin and Morgan (October 1999). Другие способы местного введения включают доставку электропорацией, ионтофорез, фонофорез,сонофорез и микроигольную или безыгольную (например, Powderject, Bioject и т.д.) инъекцию. Могут быть приготовлены препараты для местного введения с немедленным и/или модифицированным высвобождением. Препараты с модифицированным высвобождением включают препараты с отсроченным, длительным, импульсным, контролируемым, нацеленным и программированным высвобождением. Соединения по изобретению можно также вводить интраназально или ингаляцией обычно в форме сухого порошка (либо одного в виде смеси, например в виде сухой смеси с лактозой, либо в виде частицы смешанных компонентов, например смешанных с фосфолипидами, такими как фосфатидилхолин) из сухого порошкового ингалятора или в виде аэрозольного спрея из контейнера под давлением, насоса,пульверизатора, распылителя (предпочтительно распылителя с электродинамическим продуцированием тонкого тумана) или небулайзера с использованием или без использования подходящего пропеллента,такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для интраназального применения порошок может содержать биоадгезивный агент, например хитозан или циклодекстрин. Контейнер под давлением, насос, распылитель, пульверизатор или небулайзер содержит раствор или суспензию соединения(й) по изобретению, содержащий, например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, солюбилизации или продления высвобождения активного компонента, пропеллент(ы) в качестве растворителя и возможно поверхностно-активное вещество, такое как сорбитана триолеат, олеиновая кислота или олигомолочная кислота. Перед применением в приготовлении препарата в виде сухого порошка или суспензии лекарственный продукт микронизируют до размера, подходящего для доставки ингаляцией (обычно менее 5 мкм). Этого можно достичь любым подходящим способом измельчения, таким как измельчение в вихревой мельнице, измельчение в псевдоожиженном слое, обработка сверхкритической жидкостью с образованием наночастиц, гомогенизация под высоким давлением или распылительная сушка. Могут быть приготовлены капсулы (сделанные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для применения в ингаляторе или инсуффляторе, которые содержат порошковую смесь соединения по изобретению, подходящей порошковой основы, такой как лактоза или крахмал, и модификатора рабочих характеристик, такого как l-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, предпочтительно последняя. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящий препарат-раствор для применения в распылителе с использованием электродинамики для продуцирования тонкого тумана может содержать от 1 мкг до 20 мг соединения по изобретению на срабатывание, и объем срабатывания может варьировать от 1 до 100 мкл. Типичный препарат может содержать соединение формулы (I), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые можно использовать вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. К препаратам по изобретению, которые предназначены для ингаляционного/интраназального введения, могут быть добавлены подходящие корригенты, такие как ментол и левоментол, или подсластители, такие как сахарин или натриевая соль сахарина. Могут быть приготовлены препараты для ингаляционного/интраназального введения с немедленным и/или модифицированным высвобождением с использованием, например, PGLA. Препараты с мо- 17010132 дифицированным высвобождением включают препараты с отсроченным, длительным, импульсным, контролируемым, нацеленным и программированным высвобождением. В случае сухих порошковых ингаляторов и аэрозолей единицу дозировки определяют с помощью клапана, который доставляет отмеренное количество. Суммарная суточная доза обычно должна быть в диапазоне от 0,01 мкг до 15 мг, которые можно вводить одной дозой или, как правило, разделенными дозами на протяжении суток. Соединения по изобретению можно вводить ректально или вагинально, например, в форме суппозитория, пессария или клизмы. Традиционной суппозиторной основой является масло какао, но могут быть использованы различные альтернативы, где как подходит. Могут быть приготовлены препараты для ректального/вагинального введения с немедленным и/или модифицированным высвобождением. Препараты с модифицированным высвобождением включают препараты с отсроченным, длительным, импульсным, контролируемым, нацеленным и программированным высвобождением. Соединения по изобретению можно также вводить прямо в глаз или ухо, обычно в форме капель микронизированной суспензии или раствора в изотоническом с установленным pH стерильном физиологическом растворе. Другие препараты, подходящие для глазного и ушного введения, включают мази,биоразлагаемые (например, рассасывающиеся гелевые губки, коллаген) и небиоразлагаемые (например,силикон) имплантаты, пластинки, линзы и системы, состоящие из частиц или пузырьков, такие как ниосомы или липосомы. Полимеры, такие как поперечно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридные полимеры, например гелановая камедь, могут быть введены в состав вместе с консервантом, таким как хлорид бензалкония. Такие препараты могут также доставляться ионтофорезом. Могут быть приготовлены препараты для глазного/ушного введения с немедленным и/или модифицированным высвобождением. Препараты с модифицированным высвобождением включают препараты с отсроченным, длительным, импульсным, контролируемым, нацеленным и программированным высвобождением. Соединения по изобретению могут быть объединены с растворимыми макромолекулярными веществами, такими как циклодекстрин и его подходящие производные или содержащие полиэтиленгликоль полимеры, для улучшения их растворимости, скорости растворения, маскирования вкуса, биологической доступности и/или стабильности для введения любым вышеупомянутым способом. Например, обнаружено, что комплексы лекарственного средства с циклодекстрином обычно полезны для большинства лекарственных форм и путей введения. Можно использовать как комплексы включения, так и комплексы невключения. В качестве альтернативы прямому комплексообразованию с лекарственным средством циклодекстрин может быть использован в качестве вспомогательной добавки, то есть в качестве носителя, разбавителя или солюбилизатора. Чаще всего для этих целей используют альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в международных заявкахWO 91/11172, WO 94/02518 и WO 98/55148. Поскольку может быть желательным введение комбинации активных соединений, например, для лечения конкретного заболевания или состояния, в объем настоящего изобретения входит то, что две или более фармацевтические композиции, по меньшей мере одна из которых содержит соединение в соответствии с данным изобретением, могут быть объединены в форме набора, подходящего для совместного введения композиций. Таким образом, набор по изобретению содержит две или более отдельные фармацевтические композиции, по меньшей мере одна из которых содержит соединение формулы (I) в соответствии с данным изобретением, и средство для раздельного содержания указанных композиций, такие как контейнер, секционный флакон или секционный пакет из фольги. Примером такого набора является общеизвестная блистерная упаковка, используемая для упаковки таблеток, капсул и тому подобного. Набор по изобретению особенно подходит для введения разных лекарственных форм, например пероральной и парентеральной, для введения отдельных композиций с разными интервалами дозировки или для титрования отдельных композиций одна относительно другой. В помощь соблюдению режима лечения набор обычно содержит указания по введению и может быть снабжен так называемой памяткой. Для введения пациентам-людям суммарная суточная доза соединений по изобретению обычно находится в пределах от 0,01 до 15 мг, разумеется, в зависимости от способа введения. Суммарную суточную дозу можно вводить одной или разделенными дозами, и по усмотрению врача, она может выходить за пределы приведенного здесь типичного диапазона. Эти дозировки рассчитаны на среднего субъекта-человека, имеющего массу от примерно 60 до примерно 70 кг. Врач без труда сможет определить дозы для субъектов, чья масса выходит за пределы этого диапазона, например младенцев и стариков. Во избежание сомнений, здесь "лечение" включает куративное, паллиативное и профилактическое лечение. Соединения по настоящему изобретению могут быть протестированы в скринингах, изложенных- 18010132 ниже. 1.0. Анализ связывания V1A на фильтре. 1.1. Получение мембран. Анализы связывания рецепторов выполняли на клеточных мембранах, полученных из клеток CHO(яичников китайского хомячка), стабильно экспрессирующих человеческие рецепторы V1A (CHO-hV1A). Клеточная линия CHO-hV1A была любезно предоставлена по лицензионному соглашению Марком Тибонье (Marc Thibonnier), Dept. of Medicine, Case Western Reserve University School of Medicine, Cleveland,Ohio. Как обычно, клетки CHO-hV1A содержали при 37 С в увлажненной атмосфере с 5% CO2 в питательной смеси DMEM/Hams F12 с добавлением 10%-ной фетальной бычьей сыворотки, 2 мМ Lглутамина, 15 мМ HEPES и 400 мкг/мл G418. Для массовой продукции клеточного осадка приросшие клетки CHO-hV1A выращивали до 90-100%-ной конфлюэнтности в роллерных флаконах на 850 см 2, содержащих среду, представляющую собой питательную смесь DMEM/Hams F12 с добавлением 10%-ной фетальной бычьей сыворотки, 2 мМ L-глутамина и 15 мм HEPES. Конфлюэнтные клетки CHO-hV1A промывали забуференным фосфатами физиологическим раствором (PBS), собирали в охлажденный льдомPBS и центрифугировали при 1000 об./мин. Клеточный осадок хранили при -80 С до использования. Клеточный осадок оттаивали на льду и гомогенизировали в буфере для получения мембран, состоящем из 50 мМ Трис-HCl, pH 7,4, 5 мМ MgCl2 и обогащенном коктейлем ингибиторов протеаз (Roche). Клеточный гомогенат центрифугировали при 1000 об./мин, 10 мин, 4 С, и супернатант удаляли и хранили на льду. Оставшийся осадок гомогенизировали и центрифугировали, как указано выше. Суперантанты объединяли в пул и центрифугировали при 25000g в течение 30 мин при 4 С. Осадок ресуспендировали в замораживающем буфере, состоящем из 50 мМ Трис-HCl, pH 7,4, 5 мм MgCl2 и 20% глицерина, и хранили небольшими аликвотами при -80 С до использования. Концентрацию белка определяли с использованием реагента Брэдфорда (Bradford) и бычьего сывороточного альбумина (BSA) в качестве стандарта. 1.2. Связывание V1A на фильтре. На каждой новой партии мембран выполняли исследования линейности белка с последующим связыванием насыщения. Концентрацию мембран выбирали так, чтобы получить специфическое связывание на линейной части кривой. Затем выполняли исследования связывания насыщения с использованием различных концентраций [3 Н]-аргинин-вазопрессина, [3H]-AVP, (0,05-100 нМ) и определяли Kd и Вмакс. Соединения тестировали на их влияние на связывание [3H]-AVP с мембранами CHO-hV1A (3H-AVP; удельная активность 65,5 Ки/ммоль; NEN Life Sciences). Соединения растворяли в диметилсульфоксиде(DMSO) и разводили до рабочей концентрации 10% DMSO буфером для анализа, содержащим 50 мМ Трис-HCl pH 7,4, 5 мМ MgCl2 и 0,05% BSA. 25 мкл соединения и 25 мкл [3 Н]-AVP (конечная концентрация при или ниже Kd, определенной для партии мембран, обычно 0,5-0,6 нМ) наносили на 96-луночный круглодонный полипропиленовый планшет. Реакцию связывания инициировали добавлением 200 мкл мембран и планшеты мягко встряхивали в течение 60 мин при комнатной температуре. Реакцию останавливали быстрым фильтрованием с использованием устройства для сбора клеток Filtemate Cell Harvester (Packard Instruments) через 96-луночный планшет Unifilter GF/B, который предварительно замачивали в 0,5%-ном полиэтиленимине для предотвращения слипания пептидов. Фильтры промывали три раза 1 мл ледяного промывочного буфера, содержащего 50 мМ Трис-HCl pH 7,4 и 5 мМ MgCl2. Планшеты сушили и в каждую лунку добавляли 50 мкл Microscint-0 (Packard Instruments). Планшеты герметизировали и считывали на сцинтилляционном счетчике TopCount Microplate Scintillation Counter (Packard(MCPVP) (Sigma). Данные по связыванию радиолиганда анализировали с использованием четырехпараметрического логистического уравнения с минимумом, принятым за 0%. Наклон аппроксимировали свободно, и для валидных кривых он был между -0,75 и -1,25. Специфическое связывание рассчитывали вычитанием среднего cpm (число импульсов в минуту) NSB из среднего суммарного cpm. Для тестируемых соединений количество лиганда, связанного с рецептором, выражали как % связывания = (cpm образца - среднее cpm NSB)/cpm специфического связывания 100. % Связывания наносили на график против концентрации тестируемого соединения и строили сигмоидальную кривую. Ингибиторную константу диссоциации (Ki) вычисляли, используя уравнение Ченга-Прусоффа (Cheng-Prusoff):Ki=IC50/(1+[L]/Kd), где [L] означает концентрацию лиганда, присутствующего в лунке, и Kd означает константу диссоциации радиолиганда, полученную в результате анализа графика Скэтчарда (Scatchard). 2.0. Функциональный анализ V1A. Ингибирование опосредованной AVP/V1A-R мобилизации Са 2+ с помощью FLIPR (Fluorescent Imaging Plate Reader, планшет-ридер с флюорометрической визуализацией)(Molecular Devices). Высвобождение внутриклеточного кальция измеряли в клетках CHO-hV1A с использованием FLIPR,который позволяет быстро детектировать кальций после активации рецепторов. Клеточная линия CHOhV1A была любезно предоставлена по лицензионному соглашению Марком Тибонье (Marc Thibonnier),Dept. of Medicine, Case Western Reserve University School of Medicine, Cleveland, Ohio. Как обычно, клетки CHO-VA1 содержали при 37 С в увлажненной атмосфере с 5% СО 2 в питательной смеси DMEM/HamsF12 с добавлением 10%-ной фетальный бычьей сыворотки, 2 мМ L-глутамина, 15 мМ HEPES и 400 мкг/мл G418. В полдень перед анализом клетки высевали при плотности 20000 клеток на лунку в черные стерильные 96-луночные планшеты с прозрачным дном, позволяющим проверять клетки и измерять флуоресценцию через дно каждой лунки. Промывочный буфер, содержащий забуференный фосфатами физиологический раствор Дульбекко (DPBS) и 2,5 мМ пробенецида и нагрузочный краситель, состоящий из культуральной среды для клеток, содержащей 4 мкМ Fluo-3-AM (растворенного в DMSO и плюроновой кислоте) (Molecular Probes) и 2,5 мМ пробенецида, готовили в день анализа. Соединения растворяли в DMSO и разводили в буфере для анализа, состоящем из DPBS, содержащего 1% DMSO, 0,1% BSA и 2,5 мМ пробенецида. Клетки инкубировали с 100 мкл нагрузочного красителя на лунку в течение 1 ч при 37 С в увлажненной атмосфере с 5% CO2. После нагрузки красителем клетки промывали три раза в 100 мкл промывочного буфера, используя промыватель планшетов Денли (Denley). По 100 мкл промывочного буфера оставляли в каждой лунке. Внутриклеточную флуоресценцию измеряли с использованиемFLIPR. Считывание данных по флуоресценции производили через интервалы в 2 с с 50 мкл тестируемого соединения, добавляемых через 30 с. Затем производили 155 дополнительных измерений через интервалы в 2 с для детектирования любой агонистической активности соединения. Затем добавляли 50 мкл аргинин-вазопрессина (AVP) так, чтобы конечный объем анализируемого образца был 200 мкл. Дополнительные считывания флуоресценции производили через интервалы в 1 с в течение 120 с. Ответы измеряли как пиковую интенсивность флуоресценции (FI). Для фармакологической характеризации базальнуюFI вычитали из каждого флуоресцентного ответа. Для кривых зависимости доза AVP-ответ каждый ответ выражали как % от ответа на наивысшую концентрацию AVP в этом ряду. Для определения IC50 каждый ответ выражали как % от ответа на AVP. Значения IC50 преобразовывали в модифицированные значенияKb, используя уравнение Ченга-Прусоффа, которое учитывает концентрацию агониста, [А], ЕС 50 агониста и наклон (кривой): Kb=IC50/(2+[А]/А 50]n)1/n-1, где [А] означает концентрацию AVP, А 50 означает ЕС 50AVP из кривой зависимости доза-ответ, и n означает наклон кривой зависимости доза AVP-ответ. Соединения по изобретению можно вводить одни или в комбинации с одним или более другими соединениями по изобретению или в комбинации с одним или более другими лекарственными средствами(или в виде любой их комбинации). Соединения по настоящему изобретению можно вводить в комбинации с пероральным контрацептивом. Таким образом, в еще одном аспекте изобретения предложен фармацевтический продукт, содержащий антагонист V1a и пероральный контрацептив, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении дисменореи. Соединения по настоящему изобретению можно вводить в комбинации с ингибитором фосфодиэстеразы-5 (PDE5). Таким образом, в еще одном аспекте изобретения предложен фармацевтический продукт, содержащий антагонист V1a и ингибитор PDEV, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении дисменореи. Ингибиторы PDEV, полезные для комбинирования с антагонистами V1a, включают, но без ограничения ими:(1) ингибиторы PDE5, упомянутые в публикациях международных патентных заявок WO 03/000691, WO 02/64590, WO 02/28865, WO 02/28859, WO 02/38563, WO 02/36593, WO 02/28858, WO 02/00657, WO 02/00656, WO 02/10166, WO 02/00658, WO 01/94347, WO 01/94345, WO 00/15639 и WO 00/15228;(3) пиразоло[4,3-d]пиримидин-7-оны, раскрытые в ЕР-А-0463756; пиразоло[4,3-d]пиримидин-7 оны, раскрытые в ЕР-А-0526004; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в публикации международной патентной заявки WO 93/06104; изомерные пиразоло[3,4-d]пиримидин-4-оны, раскрытые в публикации международной патентной заявки WO 93/07149; хиназолин-4-оны, раскрытые в публикации международной патентной заявки WO 93/12095; пиридо[3,2-d]пиримидин-4-оны, раскрытые в публикации международной патентной заявки WO 94/05661; пурин-6-оны, раскрытые в публикации международной патентной заявки WO 94/00453; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в публикации международной патентной заявки WO 98/49166; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в публикации международной патентной заявки WO 99/54333; пиразоло[4,3-d]пиримидин-4-оны, раскрытые в ЕР-А 0995751; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в публикации международной патентной заявкиWO 00/24745; пиразоло[4,3-d]пиримидин-4-оны, раскрытые в ЕР-А-0995750; гексагидропиразино[2',1':6,1]пиридо[3,4-b]индол-1,4-дионы, раскрытые в публикации международной заявки WO 95/19978; пиразоло[4,3-d]пиримидин-4-оны, раскрытые в WO 00/27848; имидазо[5,1-f][1,2,4]триазиноны,раскрытые в ЕР-А-1092719 и в публикации международной заявки WO 99/24433, и бициклические соединения, раскрытые в публикации международной заявки WO 93/07124; пиразоло[4,3-d]пиримидин-7 оны, раскрытые в публикации международной заявки WO 01/27112; пиразоло[4,3-d]пиримидин-7-оны,раскрытые в публикации международной заявки WO 01/27113; соединения, раскрытые в ЕР-А-1092718,и соединения, раскрытые в ЕР-А-1092719; трициклические соединения, раскрытые в ЕР-А-1241170; алкилсульфоновые соединения, раскрытые в публикации международной заявки WO 02/074774; соединения, раскрытые в публикации международной заявки WO 02/072586; соединения, раскрытые в публика- 20010132 ции международной заявки WO 02/079203, и соединения, раскрытые в WO 02/074312;[4,3-d]пиримидин-7-он (см. WO 98/49166); 3-этил-5-[5-(4-этилпиперазин-1-илсульфонил)-2-(2-метоксиэтокси)пиридин-3-ил]-2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он (см. WO 99/54333); (+)-3-этил-5-[5-(4-этилпиперазин-1-илсульфонил)-2-(2-метокси-1(R)-метилэтокси)пиридин-3 ил]-2-метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он, также известный как 3-этил-5-5-[4 этилпиперазин-1-илсульфонил]-2-([(1R)-2-метокси-1-метилэтил]окси)пиридин-3-ил-2-метил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он (см. WO 99/54333); 5-[2-этокси-5-(4-этилпиперазин-1 илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он,также известный как 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазин (см. WO 01/27113, пример 8); 5-[2 изобутокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-(1-метилпиперидин-4-ил)-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он (см. WO 01/27113, пример 15); 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-фенил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он(см. WO 01/27113, пример 66); 5-(5-ацетил-2-пропокси-3-пиридинил)-3-этил-2-(1-изопропил-3 азетидинил)-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он (см. WO 01/27112, пример 124); 5-(5 ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он (см. WO 01/27112, пример 132); (6R,12aR)-2,3,6,7,12,12 а-гексагидро-2-метил-6-(3,4 метилендиоксифенил)пиразино[2',1':6,1]пиридо[3,4-b]индол-1,4-дион (тадалафил, IC-351, Cialis), то есть соединение примеров 78 и 95 из публикации международной заявки WO 95/19978, а также соединение примеров 1, 3, 7 и 8; 2-[2-этокси-5-(4-этилпиперазин-1-ил-1-сульфонил)-фенил]-5-метил-7-пропил 3H-имидазо[5,1-f][1,2,4]триазин-4-он (варденафил, LEVITRA), также известный как 1-3-(3,4-дигидро 5-метил-4-оксо-7-пропилимидазо[5,1-f]-аз-триазин-2-ил)-4-этоксифенил]сульфонил]-4-этилпиперазин, то есть соединение примеров 20,19, 337 и 336 из публикации международной заявки WO 99/24433; соединение примера 11 из публикации международной заявки WO 93/07124 (EISAI); соединения 3 и 14 из(Bayer); FR229934 и FR226807 (Fujisawa) и SCH-51866. Содержание публикаций патентных заявок и журнальных статей и, в частности, общие формулы терапевтически активных соединений из формул изобретения и приведенные там примеры соединений включены в данное описание во всей их полноте ссылкой на них. Предпочтительно ингибитор PDEV выбран из силденафила, тадалафила, варденафила, DA-8159 и 5[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-она. Наиболее предпочтительно ингибитор PDE5 представляет собой силденафил и его фармацевтически приемлемые соли. Цитрат силденафила является предпочтительной солью. Соединения по настоящему изобретению можно вводить в комбинации с донорами NO. Таким образом, в еще одном аспекте изобретения предложен фармацевтический продукт, содержащий антагонистV1a и донор NO, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении дисменореи. Соединения по настоящему изобретению можно вводить в комбинации с L-аргинином или как соль аргинат. Таким образом, в следующем аспекте изобретения предложен фармацевтический продукт, со- 21010132 держащий антагонист V1a и L-аргинин, в качестве комбинированного препарата для одновременного,раздельного или последовательного применения в лечении дисменореи. Соединения по настоящему изобретению можно вводить в комбинации с ингибитором циклооксигеназы (COX). Таким образом, в следующем аспекте изобретения предложен фармацевтический продукт,содержащий V1a-антагонист и ингибитор COX, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении дисменореи. Ингибиторы COX, полезные для комбинирования с соединениями по настоящему изобретению,включают, но без ограничения ими:(2) мелоксикам (регистрационный номер CAS 71125-38-7; описан в патенте США 4233299), или его фармацевтически приемлемая соль, или его пролекарство;(4) хроменовые селективные ингибиторы COX-2, описанные в патенте США 6077850 и патенте США 6034256;(5) соединения, описанные в публикациях международных патентных заявок WO 95/30656, WO 95/30652, WO 96/38418 и WO 96/38442, и соединения, описанные в публикации заявки на европейский патент 799823, вместе с их фармацевтически приемлемыми производными;(6) целекоксиб (патент США 5466823), валдекоксиб (патент США 5633272), деракоксиб (патент США 5521207), рофекоксиб (патент США 5474995), эторикоксиб (публикация международной патентной заявки WO 98/03484), JTE-522 (публикация заявки на японский патент 9052882), или его фармацевтически приемлемая соль, или его пролекарство;(7) парекоксиб (описан в патенте США 5932598), который представляет собой терапевтически эффективное пролекарство трициклического селективного ингибитора COX-2 валдекоксиба (описан в патенте США 5633272), в частности натриевая соль парекоксиба;(8) АВТ-963 (описан в публикации международной патентной заявки WO 00/24719);Ther. Patents. 8(1), 21-29 (1997, NS-398 (раскрыт в патенте США 4885367), SD 8381 (описан в патенте США 6034256), BMS-347070 (описан в патенте США 6180651), S-2474 (описан в публикации европейского патента 595546) и МК-966 (описан в патенте США 5968974);(10) соединения и фармацевтически приемлемые производные, описанные в патенте США 6395724, патенте США 6077868, патенте США 5994381, патенте США 6362209, патенте США 6080876, патенте США 6133292, патенте США 6369275, патенте США 6127545, патенте США 6130334, патенте США 6204387, патенте США 6071936, патенте США 6001843, патенте США 6040450, публикации международной патентной заявки WO 96/03392, публикации международной патентной заявки WO 96/24585, патенте США 6340694, патенте США 6376519, патенте США 6153787, патенте США 6046217, патенте США 6329421, патенте США 6239137, патенте США 6136831, патенте США 6297282, патенте США 6239173, патенте США 6303628, патенте США 6310079, патенте США 6300363, патенте США 6077869, патенте США 6140515, патенте США 5994379, патенте США 6028202, патенте США 6040320, патенте США 6083969, патенте США 6306890, патенте США 6307047, патенте США 6004948, патенте США 6169188, патенте США 6020343, патенте США 5981576, патенте США 6222048, патенте США 6057319, патенте США 6046236, патенте США 6002014, патенте США 5945539, патенте США 6359182, публикации международной патентной заявки WO 97/13755, публикации международной патентной заявки WO 96/25928, публикации международной патентной заявки WO 96/374679, публикации международной патентной заявки WO 95/15316, публикации международной патентной заявки WO 95/15315, публикации международной патентной заявки WO 96/03385, публикации международной патентной заявки WO 95/00501, публикации международной патентной заявки WO 94/15932, публикации международной патентной заявки WO 95/00501, публикации международной патентной заявки WO 94/27980, публикации международной патентной заявки WO 96/25405, публикации международной патентной заявки WO- 22010132 96/03388, публикации международной патентной заявки WO 96/03387, патенте США 5344991, публикации международной патентной заявки WO 95/00501, публикации международной патентной заявкиWO 96/16934, публикации международной патентной заявки WO 96/03392, публикации международной патентной заявки WO 96/09304, публикации международной патентной заявки WO 98/47890 и публикации международной патентной заявки WO 00/24719. Содержание любой из патентных заявок и, в частности, общие формулы терапевтически активных соединений из формул изобретения и приведенные там примеры соединений включены в данное описание во всей их полноте ссылкой на них. Приведенные ниже подготовительные примеры и примеры иллюстрируют получение соединений формулы (I). Спектры 1 Н-ядерного магнитного резонанса (ЯМР) во всех случаях соответствуют предложенным структурам. Характеристические химические сдвигиприведены в миллионных долях по нисходящей от тетраметилсилана с использованием общепринятых сокращений для обозначения главных пиков: например, s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет; br, широкий. Масс-спектры (m/z) были записаны с использованием либо электрораспылительной ионизации (ЭРИ), либо химической ионизации при атмосферном давлении (ХИАД). Использованы следующие сокращения для общеизвестных растворителей: CDCl3, дейтерированный хлороформ; D6-DMSO, дейтериродиметилсульфоксид; CD3OD,дейтерирометанол; THF, тетрагидрофуран. "Аммиак" относится к концентрированному раствору аммиака в воде, имеющему удельный вес 0,88. Если была использована тонкослойная хроматография (ТСХ), то это относится к ТСХ на силикагеле с использованием пластин из силикагеля 60 F254, Rf означает расстояние, пройденное соединением, деленное на расстояние, пройденное фронтом растворителя на пластине ТСХ. Когда используется микроволновое излучение, двумя использованными микроволновыми приборами являются Emrys Creator и Emrys Liberator, оба поставляются фирмой Personal Chemistry Ltd. Диапазон мощности 15-300 Вт при 2,45 ГГц. Эффективная мощность питания варьируется в ходе взаимодействия для поддержания постоянной температуры. Подготовительный пример 1. 4-(5-Метил-[1,3,4]оксадиазол-2-ил)пиперидин-1-карбоновой кислоты трет-бутиловый эфир.WO 9703986 А 1 19970206) (37 ммоль, 1 экв.) в 40 мл THF добавляли 8,1 мл диметилформамида диметилацеталя (55,4 ммоль, 1,5 экв.). Эту реакционную смесь затем перемешивали при 50 С в течение 4 ч под азотом. Растворитель удаляли при пониженном давлении, остаток растворяли в 40 мл толуола и добавляли 400 мг паратолуолсульфоновой кислоты. Эту смесь затем нагревали при 100 С под азотом в течение 18 ч, летучие вещества удаляли при пониженном давлении, и остаток распределяли между метиленхлоридом и водным раствором бикарбоната натрия. Органическую фазу сушили над сульфатом магния и фильтровали. Летучие вещества удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле с использованием метиленхлорида/метанола в качестве элюента (от 98:2 об./об. до 95:5 об./об.) с получением 8,07 г соединения, указанного в заголовке, в виде белого твердого вещества (81%). 1 Н-ЯМР (400 МГц, CD3OD):1.42 (s, 9H), 1.70 (m, 2H), 2.05 (m, 2H), 2.50 (s, 3H), 3.00 (m, 2H), 3.15 4,0 г соединения подготовительного примера 1 (15 ммоль, 1 экв.) растворяли в 100 мл толуола, добавляли 2,1 г парахлоранилина (16,5 ммоль, 1,1 экв.) и затем 2 мл TFA. Раствор нагревали при 110 С в течение 16 ч, добавляли 2 мл TFA и нагревали раствор при 110 С дополнительно 48 ч. Затем реакционную смесь охлаждали, добавляли водный раствор бикарбоната натрия и декантировали органическую фазу. Водную фазу подщелачивали карбонатом калия и экстрагировали четыре раза метиленхлоридом(50 мл). Метиленхлоридный раствор сушили над сульфатом магния и растворитель удаляли в вакууме с- 23010132 получением 2,90 г соединения, указанного в заголовке, в виде белого твердого вещества. 1 Н-ЯМР (400 МГц, CDCl3):1.60-2.00 (m), 2.20 (s, 3H), 2.40-2.80 (m, 5H), 3.10 (m, 2H), 7.10 (d, 2H),7.55 (d, 2H); ЖХ-МС: m/z ХИАД+, 277 [МН]+. Подготовительный пример 2 б. 4-[4-(4-Хлорфенил)-5-метил-4 Н-1,2,4-триазол-3-ил]пиперидина гидрохлорид. Соляную кислоту в диоксане (4 М, 10 мл) добавляли к охлажденному (5 С) раствору соединения подготовительного примера 1 (1,32 г, 4,76 ммоль) в метаноле (30 мл) и раствору давали нагреться до комнатной температуры с перемешиванием в течение следующих 90 мин. ТСХ-анализ показал, что исходное вещество осталось, поэтому добавляли дополнительное количество соляной кислоты в диоксане(4 М, 10 мл) и перемешивали эту реакционную смесь еще 4 ч. Смесь концентрировали при пониженном давлении и остаток подвергали азеотропной перегонке с толуолом (3) с получением соединения, указанного в заголовке, 1,4 г. 1 Н-ЯМР (400 МГц, DMSO-d6):1.86 (m, 4 Н), 2.25 (m, 3H), 2.80-2.97 (m, 3H), 3.22 (m, 2H), 7.64 (m,2H), 7.77 (d, 2H). Подготовительный пример 3. 1-(3-Хлорбензоил)пиперидин-4-карбоновой кислоты этиловый эфир. Раствор этилизонипекотата (27,6 г, 175 ммоль) в дихлорметане (50 мл) добавляли по каплям в течение 10 мин к раствору 3-хлорбензоилхлорида (20 мл, 160 ммоль) и триэтиламина (28 мл, 200 ммоль) в дихлорметане (500 мл), охлаждали до температуры от 10 до 15 С. Эту реакционную смесь затем перемешивали при комнатной температуре в течение 3 ч и концентрировали при пониженном давлении. Остаток разбавляли эфиром, раствор промывали 1 н. соляной кислотой, раствором карбоната натрия (3) и рассолом. Затем его сушили над MgSO4 и упаривали при пониженном давлении с получением соединения, указанного в заголовке, в виде твердого вещества, 44,4 г. 1 Н-ЯМР (400 МГц, CDCl3):1.24 (t, 3H), 1.62-2.10 (m, 4H), 2.58 (m, 1H), 2.98-3.16 (m, 2H), 3.70 (m,1H), 4.15 (q, 2H), 4.49 (m, 1H), 7.24 (m, 1H), 7.31-7.40 (m, 3H). МСНР (LRMS, масс-спектрометрия низкого разрешения): m/z (ХИАД+) 296 [МН]+. Подготовительный пример 4. 1-(3-Хлорбензоил)пиперидин-4-карбоновой кислоты гидразид. Смесь эфира подготовительного примера 3 (44,4 г, 0,15 моль) и гидразингидрата (30 мл, 0,58 моль) в метаноле (120 мл) нагревали с обратным холодильником в течение 10 ч и затем оставляли охлаждаться до комнатной температуры. Смесь концентрировали при пониженном давлении и продукт подвергали кристаллизации из смеси этилацетат/эфир с получением соединения, указанного в заголовке, в виде твердого вещества, 32,5 г. 1 Н-ЯМР (400 МГц, CDCl3):1.62-1.98 (m, 4H), 2.36 (m, 1H), 2.78-3.09 (m, 2 Н), 3.64-4.00 (m, 2H),4.65 (m, 1H), 7.04 (m, 1H), 7.26 (m, 1H), 7.36 (m, 3H). МСНР: m/z (ХИАД+) 282 [МН]+. Подготовительный пример 5. 1-(3-Хлорбензоил)пиперидин-4-карбоновой кислоты N'-(2-хлорацетил)гидразид.- 24010132 Ацетилхлорид (4,3 мл, 53 ммоль) добавляли по каплям в течение 30 мин к охлажденному льдом раствору гидразида подготовительного примера 4 (10 г, 35,5 ммоль) и N-метилморфолина (5,4 г, 53 ммоль) в дихлорметане (200 мл) так, чтобы поддерживать внутреннюю температуру ниже 10 С. Затем давали реакционной смеси нагреться до комнатной температуры и перемешивали ее в течение следующих 18 ч. Эту реакционную смесь разбавляли этилацетатом, промывали насыщенным раствором бикарбоната натрия и затем рассолом. Раствор сушили над MgSO4, концентрировали при пониженном давлении, и остаток растирали с эфиром с получением указанного в заголовке соединения в виде белого твердого вещества, 10,2 г. 1 Н-ЯМР (400 МГц, CD3OD):1.66-1.84 (m, 3H), 1.98 (m, 1 Н), 2.61 (m, 1 Н), 2.99 (m, 1 Н), 3.19 (m,1 Н), 3.74 (m, 1 Н), 4.14 (s, 2 Н), 4.60 (m, 1 Н), 7.35 (dd, 1H), 7.46 (m, 3H). МСНР: m/z (ЭРИ+) 358 [МН]+. Подготовительный пример 6. Трифторуксусный ангидрид (9,45 мл, 57 ммоль) добавляли по каплям в течение 30 мин к охлажденному раствору (0-5 С) соединения подготовительного примера 5 (10,2 г, 28,5 ммоль) и пиридина (11,5 мл, 142,5 ммоль) в дихлорметане (300 мл). Сразу после окончания добавления полученную розовую суспензию перемешивали в течение следующих 90 мин при 10 С. Эту реакционную смесь осторожно вливали в насыщенный раствор бикарбоната натрия (600 мл) и слои разделяли. Органическую фазу промывали дополнительно насыщенным раствором бикарбоната натрия (2), сушили над MgSO4 и обрабатывали обесцвечивающим углем. Затем смесь фильтровали и фильтрат упаривали при пониженном давлении с получением указанного в заголовке соединения, 13 г. 1 Н-ЯМР (400 МГц, CD3OD):1.80-1.97 (m, 2H), 2.08 (m, 1H), 2.22 (m, 1H), 3.15-3.40 (m, 3H), 3.76 4-Гидразинокарбонилпиперидин-1-карбоновой кислоты трет-бутиловый эфир (см. WO 2000039125,получение 27) (25 г, 103 ммоль) растворяли в дихлорметане (300 мл) и затем добавляли 4 метилморфолин (12,5 мл, 113 ммоль). Смесь охлаждали с использованием ледяной бани и добавляли по каплям хлорацетилхлорид (8,2 мл, 103 ммоль). Затем давали этой реакционной смеси нагреться до комнатной температуры и перемешивали ее в течение 4 ч. Реакционную смесь распределяли с водным раствором бикарбоната натрия, сушили над сульфатом магния, фильтровали и фильтрат упаривали с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (29,6 г). МСНР Гидразид подготовительного примера 7 (5,0 г, 15,6 ммоль) суспендировали в дихлорметане (200 мл) и затем добавляли пиридин (6,4 мл, 78 ммоль) и охлаждали смесь до 10 С. Добавляли по каплям в течение 15 мин трифторуксусный ангидрид (6,6 мл, 39 ммоль) и затем перемешивали смесь при комнатной температуре в течение 3 ч. Затем эту реакционную смесь распределяли с водой (50 мл), органический слой сушили над сульфатом магния, фильтровали и фильтрат упаривали при пониженном давлении. Остаток очищали хроматографией на силикагеле с использованием метанола в дихлорметане в качестве элюента (2:98) с получением указанного в заголовке соединения в виде белого твердого вещества (2,95 г). 1 Н-ЯМР (400 МГц, CD3OD):1.45 (s, 9H), 1.74 (m, 2H), 2.19 (m, 2H), 3.04 (m, 2 Н), 3.24 (m, 1 Н), 4.09 Смесь соединения подготовительного примера 8 (8 г, 26,5 ммоль), триазола (3,7 г, 53 ммоль) и карбоната калия (5,2 г, 38 ммоль) в N,N-диметилформамиде (60 мл) перемешивали при комнатной температуре в течение 18 ч. Затем смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и рассолом, слои разделяли и органический раствор сушили над MgSO4 и концентрировали при пониженном давлении с получением указанных в заголовке соединений в виде смеси изомеров. 1 Н-ЯМР (400 МГц, CD3OD):1.43 (s, 9H), 1.62-1.78 (m, 2H), 2.02 (m, 2H), 3.00 (m, 2 Н), 3.19 (m, 1 Н),4.03 (m, 2 Н), 5.95, 5.99 (2xs, 2H), [7.77 (s), 7.80 (d), 8.18 (s) суммарный 2 Н]. Подготовительный пример 9 б. 4-(5-[1,2,3]Триазол-2-илметил-[1,3,4]оксадиазол-2-ил)пиперидин-1 карбоновой кислоты трет-бутиловый эфир. Дихлорметан (500 мл) добавляли к суспензии гидразида подготовительного примера 170 (132,3 г,375 ммоль) в 1-метилимидазоле (120 мл) и полученный раствор охлаждали на ледяной/ацетоновой бане. Добавляли по каплям в течение 2,5 ч трифторметилсульфоновый ангидрид (92 мл, 561 ммоль) так, чтобы поддерживать температуру этой реакционной смеси ниже 0 С. По окончании добавления эту реакционную смесь перемешивали в течение следующих 20 мин. Затем ее гасили добавлением 2 М соляной кислоты (350 мл). Фазы разделяли и водный слой экстрагировали дихлорметаном (200 мл). Объединенные органические растворы промывали рассолом, сушили над MgSO4 и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с использованием дихлорметана в качестве элюента с получением указанного в заголовке соединения в виде вязкого масла. Подготовительный пример 10. (3-Хлорфенил)-[4-(5-[1,2,3]триазол-2-илметил-[1,3,4]оксадиазол-2 ил)пиперидин-1-ил]метанон. Смесь соединения подготовительного примера 6 (2 г, 5,9 ммоль), триазола (810 мг, 11,75 ммоль) и карбоната калия (1,2 г, 8,85 ммоль) в ацетонитриле (20 мл) перемешивали при комнатной температуре в течение 30 мин, а затем еще 1 ч при 50 С. Эту реакционную смесь фильтровали, промывали этилацетатом и фильтрат концентрировали при пониженном давлении. Оставшееся коричневое масло распределяли между этилацетатом и водой, слои разделяли и органическую фазу промывали дополнительным количеством воды, затем рассолом. Раствор сушили над MgSO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле с использованием дихлорметана:метанола (от 100:0 до 95:5) с получением указанного в заголовке соединения (202 мг). 1 Н-ЯМР (400 МГц, CD3OD):1.76-1.90 (m, 2H), 2.02 (m, 1H), 2.18 (m, 1H), 3.12-3.38 (m, 3H), 3.72 Трифторуксусную кислоту (1 мл, 13,2 ммоль) добавляли к раствору соединений подготовительного примера 9 а (8,8 г, 26,5 ммоль) и 4-хлоранилина (5 г, 39,75 ммоль) в толуоле (200 мл) и эту реакционная смесь перемешивали при температуре дефлегмации в течение 5 ч. Охлажденную смесь разбавляли дихлорметаном, затем промывали 1 н. раствором гидроксида натрия и рассолом и упаривали при пониженном давлении. Оставшееся коричневое масло очищали колоночной хроматографией на силикагеле с гра- 26010132 диентным элюированием дихлорметаном:метанолом:аммиаком 0,88 (от 100:0:0 до 90:10:1) и затем повторной колоночной хроматографией с градиентным элюированием этилацетатом:метанолом:аммиаком 0,88 (от 100:0:0 до 90:10:1) с получением указанного в заголовке соединения (2,3 г). 1 Н-ЯМР (400 МГц, CD3OD):1.42 (s, 9H), 1.68-1.82 (m, 4H), 2.62-2.78 (m, 3H), 4.08 (m, 2H), 5.70 (s,2H), 7.24 (d, 2H), 7.56 (d, 2H), 7.59 (s, 2H). МСНР: m/z (ХИАД+) 444 [МН]+. Подготовительный пример 11 б. 4-[4-(4-Хлорфенил)-5-[1,2,3]триазол-2-илметил-4 Н-[1,2,4]триазол 3-ил]пиперидин-1-карбоновой кислоты трет-бутиловый эфир.N-Метилимидазол (4,66 г, 56,75 ммоль) и дихлорметан (20 мл) добавляли к бис-ацилгидразиду подготовительного примера 170 (5,00 г, 14,19 ммоль) и полученный раствор охлаждали до -20 С. Добавляли ангидрид трифторметансульфоновой кислоты (6,00 г, 21,28 ммоль), поддерживая температуру ниже 0 С. После окончания добавления реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 15 ч. Реакционную смесь гасили H2O (10 мл), фазы разделяли и водный слой реэкстрагировали дихлорметаном (10 мл). Объединенные органические фазы сушили над сульфатом магния,фильтровали и дихлорметан отгоняли и заменяли толуолом под вакуумом с получением толуольного раствора промежуточного оксадиазола (объем примерно 20 мл). К этому толуольному раствору добавляли 4-хлоранилин (1,90 г, 14,90 ммоль), затем трифторуксусную кислоту (0,81 г, 7,09 ммоль) и перемешивали эту реакционную смесь при 85 С в течение 5,5 ч. Смесь охлаждали до температуры окружающей среды и перемешивали с 1,8 н. водным аммиаком (14 мл) в течение 5 мин. Фазы разделяли, органическую фазу разбавляли трет-бутилметиловым эфиром (20 мл) и затем перемешивали в течение 15 ч. Полученный твердый осадок собирали фильтрованием, промывая трет-бутилметиловым эфиром (25 мл), с получением указанного в заголовке соединения в виде бежевого твердого вещества (2,72 г). 1 Н-ЯМР (400 МГц, CDCl3):1.43 (s, 9H), 1.72 (d, 2H), 1.85 (bm, 2H), 2.56 (m, 1 Н), 2.66 (bd, 2 Н), 4.09 4 М соляную кислоту в диоксане (10 мл) добавляли к раствору соединения подготовительного примера 11 а (2,3 г, 5,2 ммоль) в метаноле (30 мл) и эту реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Раствор концентрировали при пониженном давлении, остаток разбавляли дихлорметаном и подщелачивали 1 н. раствором гидроксида натрия до pH 10, и слои разделяли. Водную фазу реэкстрагировали дихлорметаном и объединенные органические растворы сушили над MgSO4 и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде пены (1,65 г). 1 Н-ЯМР (400 МГц, CD3OD):1.79 (m, 4H), 2.48 (m, 2H), 2.65 (m, 1H), 3.02 (m, 2 Н), 5.70 (s, 2 Н), 7.22 Этилацетат (30 мл) добавляли к смеси соединения подготовительного примера 11 б (6,5 г,14,6 ммоль) и п-толуолсульфоновой кислоты моногидрата (8,4 г, 44,2 ммоль) и эту реакционную смесь перемешивали при комнатной температуре в течение 17 ч. Твердый осадок собирали фильтрованием и промывали этилацетатом (20 мл) с получением указанного в заголовке соединения в виде белого твердого вещества (9,32 г). 1 Н-ЯМР (400 МГц, DMSO-d6):1.85 (m, 4H), 2.26 (s, 6H), 2.83 (m, 3H), 3.24 (m, 2H), 5.68 (s, 2H),7.10 (d, 4H), 7.32 (d, 2H), 7.47 (d, 4H), 7.54 (d, 2H), 7.65 (s, 2 Н), 8.29 (m, 1 Н), 8.49 (m, 1 Н). МСНР: m/z Смесь тетразол-1-илуксусной кислоты (5 г, 39 ммоль) и 4 М соляной кислоты в диоксане (100 мкл) в метаноле (50 мл) нагревали с обратным холодильником в течение 18 ч. Охлажденную смесь упаривали при пониженном давлении с получением соединения, указанного в заголовке. 1 Н-ЯМР (400 МГц, DMSO-d6):3.74 (s, 3H), 5.58 (s, 2 Н), 9.39 (s, 1H); ЖХ-МС: m/z ХИ+ АД 143[МН]+. Подготовительный пример 14. (3-Метилизоксазол-5-ил)ацетоилхлорид.N,N-Диметилформамид (несколько капель), затем оксалилхлорид (9,5 мл, 106 ммоль) добавляли по каплям к охлажденному (10 С) раствору (3-метилизоксазол-5-ил)уксусной кислоты (5 г, 35,4 ммоль) в дихлорметане (50 мл) и раствору давали нагреться до комнатной температуры. Эту реакционную смесь перемешивали в течение следующих 3 ч, затем концентрировали при пониженном давлении. Остаток подвергали азеотропной перегонке с толуолом с получением соединения, указанного в заголовке. 1 Н-ЯМР (400 МГц, CDCl3):2.30 (s, 3H), 4.32 (s, 2 Н), 6.18 (s, 1H). Подготовительный пример 15. Этил-(2-метил-1 Н-имидазол-1-ил)ацетат. Карбонат калия (8,42 г, 61 ммоль) добавляли к раствору 2-метилимидазола (5 г, 61 ммоль) в тетрагидрофуране (100 мл) и эту суспензию перемешивали в течение 30 мин. Добавляли этилбромацетат (6,75 мл, 61 ммоль) и перемешивали эту реакционную смесь в течение еще 30 мин при комнатной температуре. Смесь фильтровали, промывали смесью дихлорметан:метанол (90:10). Фильтрат упаривали при пониженном давлении и неочищенный продукт очищали колоночной хроматографией на силикагеле с использованием дихлорметана:метанола:аммиака 0,88 (93:7:0,5) в качестве элюента с получением указанного в заголовке соединения в виде масла, 5,28 г. 1 Н-ЯМР (400 МГц, CDCl3):1.26 (t, 3H), 2.35 (s, 3H), 4.22 (q, 2H), 4.58 (s, 2 Н), 6.81 (s, 1 Н), 6.94 (s,1 Н). ЖХ-МС: m/z ХИАД+169 [МН]+. Подготовительный пример 16. 2-(1 Н-Тетразол-1-ил)ацетогидразид. Гидразингидрат (3,2 г, 63 ммоль) добавляли к раствору эфира подготовительного примера 13 (3 г,21,1 ммоль) в метаноле (18 мл) и эту смесь нагревали при дефлегмации в течение 18 ч. Охлажденную реакционную смесь концентрировали при пониженном давлении и остаток подвергали азеотропной перегонке с толуолом с получением соединения, указанного в заголовке. 1 Н-ЯМР (400 МГц, DMSO-d6):5.18 (s, 2H), 9.38 (s, 1H). ЖХ-МС: m/z ХИАД+ 143 [МН]+. Подготовительный пример 17. [1,2,3]Триазол-1-ил-уксусной кислоты этиловый эфир и 1,2,3-Триазол (19,00 кг, 275 моль) загружали в течение 30 мин в суспензию карбоната калия (42,15 кг, 305 моль) в этаноле (80 л) и промывали этанолом (2 л). Медленно добавляли раствор этилбромацетата(45,8 кг, 274 моль) в этаноле (30 л) и промывали этанолом (2 л). В течение этого времени температуру реакции поддерживали ниже 20 С. Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Суспензию фильтровали, промывая остаток этанолом (25 л и 17 л) и затем фильтрат концентрировали при пониженном давлении. Концентрат растворяли в этилацетате (120 л) и этот раствор промывали 1 н. соляной кислотой (140 л, 720 л, 415 л). Водные промывные жидкости объединяли и экстрагировали этилацетатом (321 л). Органические фазы объединяли, сушили над сульфатом магния, фильтровали и концентрировали досуха с получением смеси указанных в заголовке соединений (25 кг). Спектроскопический 1 Н-ЯМР-анализ показал, что это была смесь изомеров N-2/N-1 в соотношении 6:5. Гидразингидрат (8,65 кг, 270 моль) добавляли к охлажденному (ниже 10 С) раствору смеси эфиров подготовительного примера 17 (19 кг) в этаноле (69 л), поддерживая температуру ниже 20 С во время добавления. Эту реакционную смесь перемешивали при температуре между 14 и 19 С в течение 3 ч, затем к ней добавляли еще этанол (25 л) и продукт собирали фильтрованием и промывали этанолом (10 л). Неочищенное твердое вещество очищали перекристаллизацией из этанола (120 л), затем троекратной перекристаллизацией из метанола (105 л, 120 л и 90 л) с получением после сушки в вакууме указанного в заголовке соединения (4,53 кг). 1 Н-ЯМР (400 МГц, DMSO-d6):4.33 (s, 2H), 5.02 (s, 2H), 7.77 (s, 2H), 9.40 (s, 1H). Подготовительный пример 19. 2-(2-Метил-1 Н-имидазол-1-ил)ацетогидразид. Соединение, указанное в заголовке, получили в виде белого твердого вещества из соединения подготовительного примера 15 и гидразина, следуя процедуре, описанной в подготовительном примере 16,за исключением того, что использовали 5 экв. гидразина и использовали изопропанол в качестве реакционного растворителя. 1 Н-ЯМР (400 МГц, CD3OD):2.35 (s, 3H), 4.60 (s, 2H), 6.81 (s, 1H), 6.99 (s, 1 Н). ЖХ-МС: m/z ХИАД+ 155 [МН]+. Подготовительный пример 20. 2-(3-Метил-1,2,4-оксадиазол-5-ил)ацетогидразид. Соединение, указанное в заголовке, получили из метилового эфира 3-метил-1,2,4-оксадиазол-5-илуксусной кислоты (NL 7807076) и гидразина, следуя процедуре, описанной в подготовительном примере 16, за исключением того, что использовали 8 экв. гидразина и использовали изопропанол в качестве реакционного растворителя. 1 Н-ЯМР (400 МГц, CDCl3):2.42 (s, 3H), 3.86 (s, 2H), 6.89 (br s, 1H), 8.18 (brs, 1H). Подготовительный пример 21. 2-(Пиримидин-2-илокси)ацетогидразид. Смесь этил-2-пиримидинилоксиацетата (GB 2373186, стадия i, пример 368) (4,4 г, 24,15 ммоль) и гидразингидрата (5 мл, 160 ммоль) в изопропаноле (30 мл) нагревали с обратным холодильником в течение 1 ч. Затем эту смесь охлаждали и концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле с использованием дихлорметана:метанола:аммиака 0,88 (от 100:0:0 до 100:10:1) с получением указанного в заголовке соединения, 600 мг. 1 Н-ЯМР (400 МГц, CDCl3):4.98 (s, 3H), 7.04 (m, 1H), 8.58 (d, 2H); ЖХ-МС: m/z ХИАД+ 169 [МН]+. Подготовительный пример 22. трет-Бутил-2-[(3-метилизоксазол-5-ил)ацетил]гидразинкарбоксилат. К охлажденному (10 С) раствору хлорангидрида подготовительного примера 14 (5,64 г, 35,4 ммоль) в дихлорметане (200 мл) медленно добавляли триэтиламин (24 мл, 17 ммоль) и затем трет-бутилкарбазат(5,6 г, 42,5 ммоль) и перемешивали эту реакционную смесь при комнатной температуре в течение 18 ч. Реакционную смесь разбавляли этилацетатом и осадок отфильтровывали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле с градиентным элюированием этилацетатом:пентаном (от 50:50 до 100:0) с получением соединения, указанного в заго- 29010132 ловке. 1 Н-ЯМР (400 МГц, CDCl3):1.47 (s, 9H), 2.30 (s, 3H), 3.77 (s, 2H), 6.15 (s, 1H), 6.45 (brs, 1H), 7.59 Оксалилхлорид (5,16 мл, 59,2 ммоль) добавляли к раствору -(3,5-диметил-4-изоксазолил)пропионовой кислоты (J. Org. Chem. 59(10); 1994; 2882) (2,5 г, 14,8 ммоль) в дихлорметане (50 мл) и N,Nдиметилформамиде (1 капля) и раствор перемешивали при комнатной температуре в течение 30 мин. Смесь концентрировали при пониженном давлении и остаток подвергали азеотропной перегонке с дихлорметаном (5) с получением коричневой жидкости. Ее растворяли в дихлорметане (25 мл) и порциями добавляли трет-бутилкарбазат (2,93 г, 22,2 ммоль). Смесь разбавляли дополнительным количеством дихлорметана (23 мл) и эту реакционную смесь перемешивали в течение 18 ч при комнатной температуре. Смесь концентрировали при пониженном давлении, остаток суспендировали в дихлорметане, полученный осадок отфильтровывали и фильтрат упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с градиентным элюированием дихлорметаном:метанолом:аммиаком 0,88 (от 95:5:0,5 до 90:10:1) с получением указанного в заголовке соединения в виде масла, 3,08 г. 1 Н-ЯМР (400 МГц, CDCl3):1.45 (s, 9H), 2.21 (s, 3H), 2.36 (m, 4H), 2.45 (m, 1 Н), 2.60-2.73 (m, 2H),6.48 (br s, 1H), 7.42 (br s, 1H). ЖХ-МС: m/z ЭРИ+ 306 [MNa]+. Подготовительный пример 24. 2-(3-Метилизоксазол-5-ил)ацетогидразида гидрохлорид. Смесь соединения подготовительного примера 22 (1,6 г, 6,3 ммоль) в 4 М соляной кислоте в диоксане (20 мл) и метаноле (60 мл) перемешивали при комнатной температуре в течение 3 ч. Раствор концентрировали при пониженном давлении до небольшого объема, полученный осадок отфильтровывали,промывали дихлорметаном и сушили с получением указанного в заголовке соединения, 810 мг. 1 Н-ЯМР (400 МГц, DMSO-d6):2.20 (s, 3H), 3.86 (s, 2H), 6.24 (s, 1H). ЖХ-МС: m/z ХИАД+ 156 Раствор соединения подготовительного примера 23 (3,08 г, 10,87 ммоль) в 2,2 М метанольной соляной кислоте (50 мл) перемешивали при комнатной температуре в течение 18 ч. Раствор концентрировали при пониженном давлении, и остаток подвергали азеотропной перегонке с толуолом. Неочищенный продукт растирали со смесью пентан/эфир и затем с эфиром и полученное твердое вещество отфильтровывали с получением указанного в заголовке соединения в виде не совсем белого твердого вещества, 1,39 г. 1 Н-ЯМР (400 МГц, DMSO-d6):2.22 (s, 3H), 2.27 (t, 2 Н), 3.35 (s, 3H), 2.66 (t, 2H), 6.75 (brs, 1H). ЖХМС: m/z ХИАД+ 184 [MH]+. Подготовительный пример 26. трет-Бутил-2-(гидразинокарбонил)морфолин-4-карбоксилат. Смесь 4-(трет-бутил)-2-метил 2,4-морфолинкарбоксилата (WO 03/018576, пример 1, часть i) (2,03 г,8,3 ммоль), гидразингидрата (1,2 мл, 24 ммоль) и метанола (50 мл) нагревали с обратным холодильником в течение 4 дней. Охлажденную смесь упаривали при пониженном давлении, остаток распределяли между водой и этилацетатом и слои разделяли. Органическую фазу сушили над MgSO4 и упаривали при по- 30
МПК / Метки
МПК: C07D 405/14, C07D 471/04, C07D 401/04, C07D 413/14, A61P 25/00, C07D 401/14, A61K 31/454, C07D 487/04
Метки: антагонистов, качестве, вазопрессина, триазола, производные
Код ссылки
<a href="https://eas.patents.su/30-10132-proizvodnye-triazola-v-kachestve-antagonistov-vazopressina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные триазола в качестве антагонистов вазопрессина</a>
Предыдущий патент: Способ получения (r)-(-)-5(2-аминопропил)-2-метоксибензолсульфонамида
Следующий патент: Производные формамида, пригодные в качестве адренорецептора
Случайный патент: Двигатель мэлоуна на диоксиде углерода в жидком растворе


































