1,2-дигидро-2-оксохинолиновые соединения в качестве лигандов рецептора 5-нт4
Номер патента: 20227
Опубликовано: 30.09.2014
Авторы: Нироджи Рамакришна, Бхирапунени Геопинадх, Патнала Срирамахандра Мурти, Схинде Анил Карбхари, Мохаммед Абдул Рашид, Равула Йотхсна, Камбхампати Рама Састри, Джаяраджан Прадип, Ахмад Иштияк, Джасти Венкатесварлу, Кандикере Нагарадж Вишвоттам
Формула / Реферат
1. Соединение общей формулы (I)
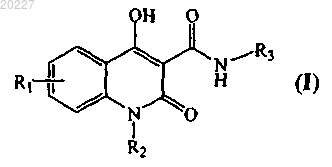
или его фармацевтически приемлемые соли;
где R1 представляет собой водород, гидрокси, галоген, нитро, амин или метокси;
R2 представляет собой водород, (С1-С4)алкил или -СН2-фенил;
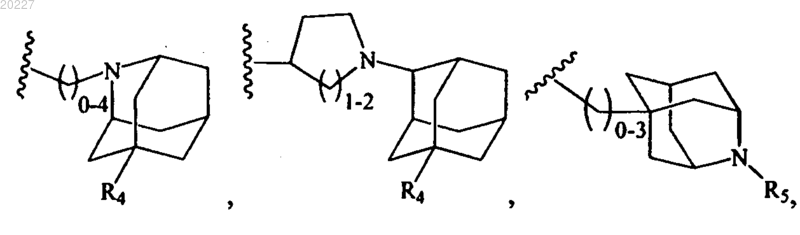
R3 представляет собой
R4 представляет собой водород, гидрокси или фенил;
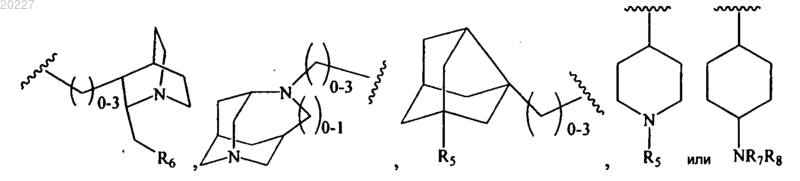
R5 представляет собой водород, (С1-С4)алкил или пирролидин;
R6 представляет собой фенил или пиридин;
R7 и R8 вместе с атомом N образуют морфолин или пирролидин.
2. Соединение по п.1, которое выбрано из группы, состоящей из
гидрохлорида N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1-изобутил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[1-(трицикло[3.3.1.13.7]дец-2-ил)пирролидин-3-ил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[(5-гидрокси-2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-[(5-фенил-2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[(1,4-диазатрицикло[4.3.1.13.8]ундец-4-ил)пропил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1-изобутил-6-метокси-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-6-хлор-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-6-фтор-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-6-бром-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-6-амино-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[2-(пиридин-3-илметил)-1-азабицикло[2.2.2]окт-3-ил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[2-(пиридин-2-илметил)-1-азабицикло[2.2.2]окт-3-ил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-(2-метил-2-азатрицикло[3.3.1.13.7]дец-5-ил)-4-гидрокси-1-изопропил-2-оксо-1,2-дигидро-хинолин-3-карбоксамида;
N-(2-изопропил-2-азатрицикло[3.3.1.13.7]дец-5-ил)-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-(2-бензил-1-азабицикло[2.2.2]окт-3-ил)-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)этил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-(2-бутил-2-азатрицикло[3.3.1.13.7]дец-5-ил)-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-(2-этил-2-азатрицикло[3.3.1.13'7]дец-5-ил-метил)-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-(1-бутилпиперидин-4-ил)-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[(1-(пирролидин-1-ил)трицикло[3.3.1.03.7]нонан-3-ил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-6-нитро-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-(2-азатрицикло[3.3.1.13.7]дец-5-ил)-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-1-бензил-4-гидрокси-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-(4-(морфолин-4-ил)циклогексил)-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
гидрохлорида N-(4-(пирролидин-1-ил)циклогексил)-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;
или их фармацевтически приемлемых солей.
3. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемые наполнители.
4. Фармацевтическая композиция по п.3 для лечения заболеваний, связанных с рецептором 5-HT4.
5. Применение соединения по п.1 в получении лекарственного средства для лечения заболеваний, связанных с рецептором 5-HT4.
6. Применение соединения по п.5 для лечения клинических состояний, таких как заболевание центральной нервной системы, болезнь Альцгеймера, когнитивное расстройство или боль.
Текст
1,2-ДИГИДРО-2-ОКСОХИНОЛИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ЛИГАНДОВ РЕЦЕПТОРА 5-НТ 4(71)(73) Заявитель и патентовладелец: СУВЕН ЛАЙФ САЙЕНСИЗ ЛИМИТЕД (IN) Настоящее изобретение относится к новым 1,2-дигидро-2-оксохинолиновым соединениям формулы (I) и их производным, пролекарствам, таутомерам, стереоизомерам, полиморфам,сольватам, гидратам, метаболитам, N-оксидам, фармацевтически приемлемым солям и содержащим их композициям. Настоящее изобретение также относится к способу получения вышеуказанных новых соединений и их производных, пролекарств, таутомеров, стереоизомеров,полиморфов, сольватов, гидратов, метаболитов, N-оксидов, фармацевтически приемлемых солей и содержащих их композиций. Соединения по настоящему изобретению используют в лечении/профилактике различных расстройств, которые опосредованы активностью рецептора 5-НТ 4. Область изобретения Настоящее изобретение относится к новым 1,2-дигидро-2-оксохинолиновым соединениям формулы(I) и их производным, пролекарствам, таутомерам, стереоизомерам, полиморфам, сольватам, гидратам,метаболитам, N-оксидам, фармацевтически приемлемым солям и содержащим их композициям. Настоящее изобретение также относится к способу получения вышеуказанных новых соединений и их производных, пролекарств, таутомеров, стереоизомеров, полиморф, сольватов, гидратов, метаболитов, N-оксидов, фармацевтически приемлемых солей и содержащих их композиций. Соединения по настоящему изобретению используют в лечении/профилактике различных расстройств, которые опосредованы активностью рецептора 5-HT4. Уровень техники Серотониновые (5-гидрокситриптамин, 5-HT) рецепторы представляют собой группу сопряженных с G белком рецепторов (GPCRs) и управляемых лигандами ионных каналов (LGICs), обнаруженных в центральной и периферической нервных системах. Семейство рецепторов 5-HT в настоящее время имеет семь основных подклассов, семейство 5-HT1 (например, 5-HT1A), семейство 5-HT2 (например, 5-HT2A5-HT2C), 5-HT3, 5-HT4, 5-HT5, 5-HT6 и 5-HT7, и взаимодействие серотонина с этими различными рецепторами связано с широким рядом физиологических функций. Соответственно, существовал большой интерес к развитию терапевтических агентов, нацеленных на конкретные подтипы рецепторов 5-HT. Новый рецептор 5-гидрокситриптамина (5-HT), позитивно сопряженный с аденилатциклазой, идентифицирован в 1988 г. Dumuis и коллегами в эмбриональных нейронах мыши с колликулитом (Dumuis etal., 1988 а, b). Рецептор был условно назван 5-HT4 вследствие его невозможности классификации по Bradleyet al. (1986). С тех пор рецептор 5-HT4 был официально признан (Humphre et al., 1993) и идентифицирован во множестве различных типов тканей (для обзора см. FordClarke, 1993). В частности, в последнее время велась активная работа по исследованию рецепторов 5-HT4 и идентификации взаимодействующих с ними фармацевтических агентов. (См., например, обзор Langlois and Fischmeister, 5-HT4 Receptor Ligands: Applications и New Prospects, J. Med. Chem. 2003, 46, 319-344.) Модуляторы рецепторов 5-HT4 (например, агонисты и антагонисты) находят применение для лечения ряда заболеваний, таких как гастроэзофагеальная рефлюксная болезнь, желудочно-кишечное заболевание,нарушение перистальтики желудка, неязвенная диспепсия, функциональная диспепсия, синдром раздраженной толстой кишки, констипация, диспепсия, эзофагит, гастроэзофагиальное заболевание, тошнота, заболевания центральной нервной системы, болезнь Альцгеймера, когнитивное расстройство, рвота, мигрень,неврологическое заболевание, боль и сердечно-сосудистые расстройства, такие как порок сердца и аритмия сердца (Corsi M. et al., Pharmacological analysis of 5-hydroxytryptamine effects on electrically stimulatedright atrium, Naunyn-Schmiedeberg's Arch. Pharmacol. 1991, 344(2), 150-159). В патентах США/патентных публикациях США 5726187, США 7419989, США 7534889, США 20060194842, США 20080207690 и США 20080269211 описаны некоторые соединения рецептора 5-HT4. Несмотря на то что были описаны некоторые модуляторы 5-HT4, все еще существует потребность в соединениях, применяемых для модулирования 5-HT4. Наши поиски с целью обнаружения новых и эффективных лигандов в качестве модуляторов рецепторов 5-HT4 привели к открытию 1,2-дигидро-2 оксохинолиновых соединений формулы (I), демонстрирующих очень высокое сродство к рецептору 5HT4. Соответственно, целью настоящего изобретения является обеспечение соединений, которые используются в качестве терапевтических средств в лечении/профилактике ряда заболеваний или расстройств,связанных с рецептором 5-HT4. Сущность изобретения Настоящее изобретение относится к новым лигандам рецептора 5-HT4 - соединениям формулы (I) и их производным, пролекарствам, таутомерам, стереоизомерам, полиморфам, сольватам, гидратам, метаболитам, N-оксидам, фармацевтически приемлемым солям и содержащим их композициямR7 и R8 представляют собой водород, алкил, циклоалкил или гетероциклил; необязательно R7 и R8 вместе с атомом N могут образовывать 4-9-членные кольца, которые включают один или несколько гетероатомов, выбранных из С, О, N, S. Настоящее изобретение относится к применению терапевтически эффективного количества соединения формулы (I) для получения лекарственного средства в лечении/профилактике различных расстройств, связанных с рецепторами 5-HT4. В частности, соединения по изобретению применяются в лечении различных расстройств, таких как гастроэзофагеальная рефлюксная болезнь, желудочно-кишечное заболевание, нарушение перистальтики желудка, неязвенная диспепсия, функциональная диспепсия, синдром раздраженной толстой кишки,констипация, диспепсия, эзофагит, гастроэзофагиальное заболевание, тошнота, заболевание центральной нервной системы, болезнь Альцгеймера, когнитивное расстройство, рвота, мигрень, неврологическое заболевание, боль и сердечно-сосудистые расстройства, такие как порок сердца и сердечная аритмия. В другом аспекте изобретение относится к фармацевтическим композициям, содержащим терапевтически эффективное количество по меньшей мере одного соединения формулы (I) и его производных,пролекарств, таутомеров, стереоизомеров, полиморфов, сольватов, гидратов, метаболитов, N-оксидов и фармацевтически приемлемых солей в смеси по меньшей мере с одним подходящим носителем, разбавителями, адъювантами или наполнителями. В другом аспекте изобретение также относится к радиомеченному соединению формулы (I) для применения в медицинской диагностике или терапии, а также к использованию радиомеченного соединения формулы (I) для получения лекарственного средства, применяемого для лечения различных расстройств, связанных с рецепторами 5-HT4. В другом аспекте изобретение относится к применению соединения по настоящему изобретению в сочетании по меньшей мере еще с одним активным ингредиентом при получении лекарственного средства для лечения/профилактики вышеуказанных заболеваний и состояний. Еще в одном аспекте изобретение относится к композициям, содержащим соединения формулы (I),и к способам их применения. Еще в одном аспекте изобретение дополнительно относится к способу получения соединения формулы (I) и его производных, пролекарств, таутомеров, стереоизомеров, полиморфов, сольватов, гидратов,метаболитов, N-оксидов и фармацевтически приемлемых солей. Типичные соединения по настоящему изобретению включают соединения, конкретно перечисленные ниже, и их производные, пролекарства, таутомеры, стереоизомеры, полиморфы, сольваты, гидраты,метаболиты, N-оксиды и фармацевтически приемлемые соли. Однако настоящее изобретение не следует рассматривать как ограниченное только этими примерами соединений. Гидрохлорид N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида; гидрохлорид N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1-изобутил-2-оксо-1,2-дигидрохинолин-3-карбоксамида;N-[(5-бутокси-2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамид. Подробное описание изобретения Если не указано иного, следующие термины, используемые в описании и формуле изобретения,имеют значения, указанные далее. Термин "галоген" обозначает фтор, хлор, бром или йод. Термин "алкил" обозначает углеводородный радикал с прямой или разветвленной цепью, состоящий только из атомов углерода и водорода, не содержащий ненасыщенность, имеющий от 1 до 8 атомов углерода и который присоединен к остатку молекулы одинарной связью. Примеры "алкильных" групп включают метил, этил, н-пропил, изопропил и т.п. Термин "алкенил" обозначает алифатическую углеводородную группу с прямой или разветвленной цепью, содержащую двойную связь углерод-углерод и содержащую 2-10 атомов углерода. Типичные"алкенильные" группы включают этенил, 1-пропенил, 2-пропенил (аллил), изопропенил, 2-метил-1 пропенил, 1-бутенил, 2-бутенил и т.п. Термин "алкинил" обозначает с прямой или разветвленной цепью гидрокарбинильный радикал, содержащий по меньшей мере одну углерод-углерод тройную связь и содержащий 2-10 атомов углерода. Типичные "алкинильные" группы включают этинил, пропинил, бутинил и т.п. Термин "алкокси" обозначает алкильную группу, присоединенную посредством кислородного мостика к остальной части молекулы. Типичные "алкокси" группы включают метокси, этокси, пропилокси,изопропилокси и т.п. Термин "циклоалкил" обозначает неароматические моно- или мультициклические кольцевые системы, содержащие 3-12 атомов углерода. Типичные "циклоалкильные" группы включают циклопропил,циклобутил, циклопентил и т.п. Термин "галогеналкил" обозначает алкильные радикалы с прямой или разветвленной цепью, содержащие 1-3 атома углерода. Типичные "галогеналкильные" группы включают фторметил, дифторметил, трифторметил, трифторэтил, фторэтил, дифторэтил и т.п. Термин "галогеналкокси" обозначает алкокси радикалы с прямой или разветвленной цепью, содержащие 1-3 атома углерода. Типичные "галогеналкокси" группы включают фторметокси, дифторметокси,трифторметокси, трифтопентокси, фтопентокси, дифтопентокси и т.п. Термин "арил" обозначает любую функциональную группу или заместитель, полученный из простого ароматического кольца. Типичные "арил" группы включают фенил, нафтил, тиофенил, индолил и т.п. Термин "аралкил" обозначает аралкильный кольцевой радикал, непосредственно связанный с алкильной группой. Термин "гетероарил" обозначает органические соединения, которые содержат кольцевую структуру, содержащую атомы, помимо атома углерода, такие как сера, кислород или азот, как часть кольца. Эти дополнительные атомы могут неоднократно повторяться в кольце. Эти кольца могут быть или простыми ароматическими кольцами, или неароматическими кольцами. Типичные "гетероарильные" группы включают пиридин, пиримидин, бензотиофен, фурил, диоксаланил, пирролил, оксазолил, пиридил, пиридазинил, пиримидинил и т.п. Термин "гетероаралкил" обозначает гетероарильный кольцевой радикал, непосредственно связанный с алкильной группой. Термин "гетероциклил" обозначает 3-12-членные кольца, чьи кольцевые структуры включают 1-3 гетероатома; эти дополнительные атомы могут неоднократно повторяться в кольце. Типичные "гетероциклильные" группы включают пирролидинил, пиперидинил, морфолинил и т.п. Следующие группы могут быть замещенными или незамещенными, они представляют собой циклоалкил, арил, аралкил, гетероаралкил, гетероарил и гетероциклил. Необязательно заместители в этих группах могут быть выбраны из группы, состоящей из водорода, гидрокси, галогена, нитро, тио, оксо,карбоксильной группы, амина, амида, алкила, алкокси, галогеналкила или галогеналкокси. Термин "стереоизомеры" является общим термином для всех изомеров индивидуальных молекул,которые отличаются только расположением своих атомов в пространстве. Он включает зеркальные изомеры (энантиомеры), геометрические (цис-транс) изомеры и изомеры соединений с более чем одним хиральным центром, которые не являются зеркальными отображениями друг друга (диастереомеры). Термин "пролекарство" используется для обозначения соединения, способного превращаться, или непосредственно, или косвенно, в соединения, описанные в настоящем документе, под воздействием ферментов, желудочной кислоты и т.п., в естественных физиологических условиях (например, ферментативного окисления, восстановления и/или гидролиза). Термин "сольват" используется для описания молекулярного комплекса между соединениями по настоящему изобретению и молекулами растворителя. Примеры сольватов включают, но ими не ограничиваются, соединения по изобретению в сочетании с водой, изопропанолом, этанолом, метанолом, диметилсульфоксидом (DMSO), этилацетатом, уксусной кислотой, этаноламином или их смесями. Термин "гидрат" может использоваться в случае, когда указанным растворителем является вода. В настоящем изобретении конкретно предусмотрено, что больше чем одна молекула растворителя может быть ассоциирована с одной молекулой соединений по настоящему изобретению, например, в гидрате. Кроме того, в настоящем изобретении конкретно предусмотрено, что меньше чем одна молекула растворителя может быть ассоциирована с одной молекулой соединений по настоящему изобретению, например, в полугидрате. Кроме того, сольваты по настоящему изобретению рассматриваются как сольваты соединений по настоящему изобретению, которые сохраняют биологическую эффективность в негидратной форме соединений. Термин "таутомеры" включает легко взаимопревращающиеся изомерные формы соединения в установленном равновесии. Примером является кето-енольная таутомерия. Термин "полиморфы" включает кристаллографически отличные формы соединений с химически идентичными структурами. Термин "метаболит" относится к веществу, полученному путем метаболизма. Термин "производное" относится к соединению, полученному из соединения в соответствии с формулой (I), и его таутомерам, стереоизомерам, полиморфам, сольватам, гидратам, N-оксидам и их фармацевтически приемлемым солям, простым химическим способом, преобразующим одну или несколько функциональных групп, например окислением, гидрированием, алкилированием, этерификацией, галогенированием и т.п. Термины "лечение", "лечить" или "обработка" охватывает все значения, такие как предупредительные, профилактические и паллиативные меры. Фраза "фармацевтически приемлемые соли" обозначает, что вещество или композиция должны быть химически и/или токсикологически совместимы, наряду с другими содержащимися в лекарственном препарате ингредиентами, с млекопитающим, подвергаемым лечению посредством этого препарата. Фраза "терапевтически эффективное количество" обозначает "количество соединения по настоящему изобретению, которое: (i) лечит или предотвращает конкретное заболевание, состояние или расстройство; (ii) ослабляет, улучшает или устраняет один или несколько симптомов конкретного заболевания,состояния или расстройства; (iii) предотвращает или задерживает появление одного или нескольких симптомов конкретного заболевания, состояния или расстройства, описанного в настоящем документе". Термин "модулятор" обозначает соединения, агонисты, антагонисты, лиганды, субстраты и ферменты,которые непосредственно или косвенно оказывают влияние на регулирование рецепторной активности. Коммерчески приобретенные реагенты использовали без дополнительной очистки. Комнатная температура составляла 25-30C. IR были взяты с использованием KBr и в твердом состоянии. Если не указано иное, все масс-спектрографические анализы выполняли в условиях ESI. 1 Н-ЯМР спектр регистрировали на спектрометре Bruker с частотой 400 МГц. В качестве растворителя использовали дейтерированный хлороформ (99,8% D). Тетраметилсилан (TMS) использовали в качестве внутреннего стандарта. Значения химических сдвигов выражены в частях на миллион . Для мультиплетности сигналов ЯМР использовали следующие сокращения: s=синглет, bs=уширенный синглет, d=дублет, t=триплет,q=квартет, qui=квинтет, h=гептет, dd=двойной дублет, dt=двойной триплет, tt=тройной триплет,m=мультиплет. Хроматографией является колоночная хроматография, выполняемая с использованием силикагеля с размером зерен 100-200 меш и под давлением азота (флэш-хроматография). Соединения по изобретению могут быть использованы в сочетании с другими терапевтическими агентами или средствами, используемыми для лечения/профилактики состояний, как указано выше. Такие агенты или средства включают модуляторы рецептора 5-HT3, модуляторы рецептора 5-HT6, ингибиторы протонного насоса, селективные ингибиторы повторного поглощения серотонина, трициклические антидепрессанты, модуляторы рецепторов холецистокинина, модуляторы рецепторов мотилина, ингибиторы синтазы оксида азота, агонисты или модуляторы рецептора GABAB, модуляторы рецепторов нейрокинина, модуляторы рецепторов пептида, кодируемого геном кальцитонина, стимулирующие слабительные средства, осмотические слабительные средства, фекальные умягчители, добавки пищевых волокон, антациды, GI релаксанты, лоперамид, дифеноксилат, средства от вздутия, противорвотные антагонисты допамина D2, стабилизаторы тучных клеток, DPP IV ингибиторы, ингибиторы холинэстеразы, 2 адреномиметики, антагонисты НМДА рецептора, агонисты M1 мускаринового рецептора, аллостерические модуляторы, антагонисты гистаминового H2-рецептора, антагонисты гистаминового H3-рецептора,производные ксантина, блокаторы кальциевых каналов, аналоги простагландина, опиоидные аналгетики,аналоги соматостатина или активаторы С 1-канала. В сочетании по настоящему изобретению соединения по настоящему изобретению и вышеуказан-6 020227 ные элементы сочетания могут быть введены раздельно (например, набор элементов) или совместно в одной фармацевтической композиции (например, капсула или таблетка). Кроме того, введение элемента сочетания по настоящему изобретению может быть выполнено до, одновременно или после введения другого элемента сочетания. Если соединения по настоящему изобретению и один или несколько дополнительных активных ингредиентов присутствуют в раздельных композициях, эти раздельные композиции могут быть введены одновременно или последовательно. Для лечения или профилактики вышеуказанных заболеваний или состояний соединения по изобретению могут применяться в сочетании с иммунологическими методами, такими как, например, иммунизация А бета пептидом или его производными или введение анти-А бета пептидных антител. Соответственно, изобретение относится к применению соединения по настоящему изобретению в сочетании по меньшей мере с одним дополнительным активным ингредиентом для получения лекарственного средства для лечения или профилактики вышеуказанных заболеваний и состояний. Широкий ряд радиоизотопов является легко доступным, включая изотопы водорода, углерода, азота, кислорода, фосфора, серы, йода, фтора, брома и хлора. Например: 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O,17O, 18O, 31P, 32P, 35S, 123I, 124I, 125I, 131I, 18F, 75Br, 76Br, 77Br, 8Br и 36Cl. Соединение общей формулы (I) может быть мечено радиоактивным изотопом с использованием стандартных способов, хорошо известных в области органической химии. Альтернативно, соединение формулы (I) может быть мечено радиоактивным изотопом в качестве заместителя в одном из исходных веществ или в промежуточном соединении, используемом в синтезе соединения формулы (I). Например,см. Arthur Murry III, D. Lloyd Williams; Organic Synthesis with Isotopes, vol. I and II, Interscience PublishersInc., N.Y. (1958) and Melvin Calvin et al. Isotopic Carbon John Wiley and Sons Inc., N.Y. (1949). Синтез радиомеченных соединений может быть обычно выполнен поставщиком радиоизотопов,специализирующимся на синтезе, по заказу, соединений, меченных радиоактивным изотопом, для проведения исследований, например Amersham Corporation, Arlington Heights, IL; Cambrige Isotopes Laboratories,Inc. Andover, MA; Wizard Laboratories, West Sacramento, CA; ChemSyn Laboratories, Lexena, S; AmericanRadiolabeled Chemicals, Inc.St.Louis, MO. Меченные радиоактивным изотопом аналоги соединений формулы (I) могут быть использованы в клинических исследованиях оценки роли лигандов рецептора 5-HT4 в ряде заболеваний, в которых, как полагают, вовлечены лиганды рецептора 5-HT4. Радиомеченные соединения формулы (I) используют в качестве радиоактивных агентов и биомаркеров для медицинской терапии и диагностики. Такие радиомеченные соединения также используют в качестве фармакологических инструментов для исследования функций и активности 5-HT4. Например,изотопно меченные соединения, в частности, используют в SPECT (однофотонная эмиссионная компьютерная томография) и в PET (позитронно-эмиссионная томография). Фармацевтические композиции Для применения соединений формулы (I) в терапии они будут обычно получены в виде фармацевтической композиции в соответствии со стандартной практикой получения лекарственных средств. Фармацевтические композиции по настоящему изобретению могут быть получены обычным способом с использованием одного или нескольких фармацевтически приемлемых носителей. Таким образом,активные соединения по изобретению могут быть получены в форме для перорального, буккального,интраназального, парентерального (например, внутривенного, внутримышечного или подкожного) или ректального введения или в форме, подходящей для введения путем ингаляции или инсуффляций. Для перорального введения фармацевтические композиции могут быть получены в форме, например, таблеток или капсул, полученных обычными способами с фармацевтически приемлемыми наполнителями, такими как связующие вещества (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза,микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтегрирующие вещества (например, картофельный крахмал или натриевый гликолят крахмала) или смачивающие вещества (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут быть в форме, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для разведения водой или другим подходящим носителем перед применением. Такие жидкие лекарственные препараты могут быть получены обычными способами с помощью фармацевтически приемлемых добавок, таких как суспендирующие вещества (например, сорбитный сироп, метилцеллюлоза или гидрогенизированные пищевые жиры); эмульгирующие вещества (например, лецитин или гуммиарабик); неводные носители (например, миндальное масло,сложные фиры масел или этиловый спирт) и консерванты (например, метил или пропил п-гидроксибензоаты или сорбиновая кислота). Для буккального введения композиция может быть получена в форме таблеток или пастилок, полученных обычным способом. Активные соединения по изобретению могут быть получены в форме для парентерального введения путем инъекции, включая использование обычных методов катеризации или вливания. Композиции для инъекции могут быть представлены в лекарственной форме для однократного введения, например в ампулах или в многодозовых контейнерах, с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать вещества для получения лекарственных препаратов, такие как суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может быть в форме порошка для восстановления с помощью подходящего носителя, например стерильной апирогенной воды, перед применением. Активные соединения по изобретению могут также быть получены в виде композиций для ректального введения, таких как свечи или удерживающая клизма, например, содержащие обычные основы для свечей, такие как масло какао или другие глицериды. Для интраназального введения или введения путем ингаляции активные соединения по изобретению обычно доставляют в форме распыляемого аэрозоля из находящегося под давлением контейнера или распылителя или из капсулы, используя ингалятор или инсуффляторы. В случае находящегося под давлением аэрозоля подходящим газом-вытеснителем является, например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ, и дозировочная единица может быть определена путем обеспечения клапаном для подачи измеренного количества. Лекарственное средство для находящегося под давлением контейнера или распылителя может содержать раствор или суспензию активного соединения, тогда как для капсулы лекарственное средство предпочтительно должно быть в форме порошка. Капсулы и картриджи (полученные, например, из желатина) для использования в ингаляторе или инсуффляторе могут содержать порошковую смесь соединения по изобретению и подходящую порошковую основу, такую как лактоза или крахмал. Аэрозольные композиции для лечения описанных выше состояний (например, мигрень) у среднего взрослого человека предпочтительно получены таким образом, чтобы отмеренная доза или "пшик" аэрозоля содержали от 20 до 1000 мкг соединения по изобретению. Полная суточная доза, введенная с помощью аэрозоля, будет находиться в пределах от 100 мкг до 10 мг. Введение может осуществляться несколько раз в сутки, например 2, 3, 4 или 8 раз, обеспечивая, например, 1, 2 или 3 дозы каждый раз. Эффективное количество соединения общей формулы (I) или его производные, как определено выше, могут быть использованы для получения лекарственного средства с помощью обычных фармацевтических вспомогательных веществ, носителей и добавок. Такая терапия включает множественный выбор: например введение двух совместимых соединений одновременно в одной лекарственной форме или введение каждого соединения индивидуально в отдельной дозе; или, если требуется, в том же самом временном интервале или раздельно, чтобы максимизировать благоприятное воздействие или минимизировать потенциальные побочные эффекты лекарственных средств в соответствии с известными принципами фармакологии. Доза активных соединений может изменяться в зависимости от факторов, таких как способ введения, возраст и вес пациента, характер и тяжесть заболевания, подвергаемого лечению, и аналогичных факторов. Соответственно, любая ссылка в настоящем документе на фармацевтически эффективное количество соединений общей формулы (I) относится к вышеуказанным факторам. Предполагаемая доза активных соединений по настоящему изобретению, или для перорального, парентерального, назального или буккального введения, среднему взрослому человеку для лечения описанных выше состояний составляет от 0,1 до 200 мг активного ингредиента на разовую дозу, которая может быть введена, например, 1-4 раза в день. Настоящее изобретение относится к соединениям и их фармацевтической композиции, которая применяется в лечении/профилактике различных расстройств, связанных с 5-HT4 рецепторами. Способ получения Соединения формулы (I) могут быть получены в соответствии со схемой I, как показано ниже: Схема I Способ по настоящему изобретению включает взаимодействие сложноэфирного соединения формулы (59) с соединением амина с использованием подходящего растворителя с получением соединения формулы (I), где все являются такими, как описано выше. Растворитель, используемый в вышеуказанном взаимодействии, выбран из группы, состоящей, например, из этанола, тетрагидрофурана, дихлорметана, дихлорэтана, толуола, диметилформамида, диметилсульфоксида и т.п. или их смеси, и предпочтительно при использовании толуола. Основание может быть или может не быть использовано в вышеуказанном взаимодействии. Если используется основание,-8 020227 то основание в вышеуказанном взаимодействии выбрано из группы, состоящей из гидроксида натрия,гидроксида калия, карбоната натрия, карбоната калия и водного раствора аммиака. При отсутствии основания продолжительность взаимодействия может находиться в пределах 1-5 ч, предпочтительно в пределах 2-3 ч. В присутствии основания продолжительность взаимодействия может находиться в пределах 15-20 ч, предпочтительно в пределах 16-19 ч. Соединение формулы (59) синтезировали способом, описанным в получении 10. Соединения амина получали экспериментальными способами, как описано в получениях 1-9. Соединения, полученные вышеуказанным способом по настоящему изобретению, могут быть преобразованы в другое соединение по настоящему изобретению посредством дополнительных химических модификаций с использованием хорошо известных взаимодействий, таких как окисление, восстановление, введение защитных групп, снятие защитных групп, реакция перегруппировки, галогенирование,гидроксилирование, алкилирование, алкилтиолирование, деметилирование, О-алкилирование, O-ацилирование, N-алкилирование, N-алкенилирование, N-ацилирование, N-цианирование, N-сульфонилирование, реакция связывания, с использованием металлов переходной валентности и т.п. При необходимости, любая или более чем одна из следующих стадий может быть выполнена:i) преобразование соединения формулы (I) в другое соединение формулы (I);ii) удаление любых защитных групп илиiii) получение его фармацевтически приемлемой соли, сольвата или пролекарства. Процесс (i) может быть выполнен с использованием обычных способов взаимного превращения,таких как эпимеризация, окисление, восстановление, алкилирование и нуклеофильное или электрофильное ароматическое замещение и гидролиз сложных эфиров или образование амидной связи. В процессе (ii) примеры защитных групп и способы их удаления можно найти в Т.W. Greene "ProtectiveGroups in Organic Synthesis" (J. Wiley and Sons, 1991). Подходящие защитные группы амина включают сульфонил (например, тозил), ацил (например, ацетил, 2',2',2'-трихлорэтоксикарбонил, бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например, бензил), которые могут быть удалены путем гидролиза (например, используя кислоту, такую как хлористо-водородная или трифторуксусная кислота) или восстановлением (например, гидрогенолиз бензильной группы или удаление 2',2',2'-трихлорэтоксикарбонильной группы восстановлением, используя цинк в уксусной кислоте), в зависимости от ситуации. Другие подходящие защитные группы амина включают трифторацетил, который может быть удален гидролизом, катализируемым основанием, или бензильную группу, связанную с твердофазной смолой,такую как 2,6-диметоксибензильная группа, связанная со смолой Merrifield (Ellman linker), которая может быть удалена гидролизом, катализируемым кислотой, например трифторуксусной кислотой. В процессе (iii) фармацевтически приемлемые соли могут быть получены обычно взаимодействием с подходящей кислотой или производным кислоты, как подробно описано выше. Сольваты могут быть получены обработкой соответствующими растворителями, и пролекарства могут быть получены дополнительными химическими преобразованиями, такими как алкилирования, этерификации и т.п. Некоторые соединения формулы (I) способны существовать в стереоизомерных формах (например,диастереомеры и энантиомеры), и изобретение охватывает каждую из этих стереоизомерных форм и их смеси, включая рацематы. Различные стереоизомерные формы могут быть разделены друг от друга обычными способами, такими как растворение; диастереоизомерные разделения и т.д., или любой данный изомер может быть получен путем стереоспецифического или асимметрического синтеза. Изобретение также относится к таутомерным формам и их смесям. Стереоизомеры, как правило, обычно получают в виде рацематов, которые могут быть разделены на оптически активные изомеры способом, известным per se. В случае соединений общей формулы (I),имеющих асимметрический атом углерода, настоящее изобретение относится к D-форме, L-форме и D,Lсмесям, и в случае соединения общей формулы (I), содержащего ряд асимметрических атомов углерода,к диастереоизомерным формам, и изобретение относится ко всем этим стереоизомерным формам и к их смесям, включая рацематы. Эти соединения общей формулы (I), которые имеют асимметрический атом углерода и, как правило, получены в виде рацематов, могут быть разделены одно от другого обычными способами, или любой данный изомер может быть получен путем стереоспецифического или асимметрического синтеза. Однако с самого начала также возможно использование оптически активного соединения, соответственно, оптически активное энантиомерное или диастереоизомерное соединение затем получают в качестве конечного соединения. Стереоизомеры соединений общей формулы (I) могут быть получены одним или несколькими способами, представленными ниже.i) Один или несколько реагентов могут быть использованы в своей оптически активной форме.ii) Оптически чистый катализатор или хиральные лиганды вместе с металлическим катализатором могут быть использованы в процессе восстановления. Металлическим катализатором может быть родий,рутений, индий и т.п. Хиральные лиганды могут предпочтительно быть хиральными фосфинами (Principlesiii) Смесь стереоизомеров может быть разделена обычными способами, такими как образование диастереоизомерных солей с помощью хиральных кислот, или хиральных аминов, или хиральных ами-9 020227 носпиртов, хиральных аминокислот. Затем полученная смесь диастереомеров может быть разделена способами, такими как фракционная кристаллизация, хроматография и т.п., за которыми следует дополнительная стадия выделения оптически активного продукта путем гидролиза производного или реакцией нейтрализации (Jacques et. al., "Enantiomers, Racemates and Resolution", Wiley Interscience, 1981).iv) Смесь стереоизомеров может быть разделена обычными способами, такими как микробиологическое разделение, разделение диастереоизомерных солей, образованных с помощью хиральных кислот или хиральных оснований. Хиральными кислотами, которые могут быть использованы, могут быть винная кислота, миндальная кислота, молочная кислота, камфорсульфоновая кислота, аминокислоты и т.п. Хиральными основаниями, которые могут быть использованы, могут быть алкалоиды хинного дерева, бруцин или основная аминокислота, такие как лизин, аргинин и т.п. В случае соединений общей формулы (I), имеющих геометрический изомеризм, настоящее изобретение относится ко всем этим геометрическим изомерам. Подходящие фармацевтически приемлемые соли будут очевидны для специалиста в данной области и включают соли, описанные в J. Pharm. Sci., 1977, 66, 1-19, такие как соли добавления кислоты, полученные с помощью неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, азотная или фосфорная кислота, и органических кислот, таких как янтарная, малеиновая, уксусная,фумаровая, лимонная, яблочная, винная, бензойная, п-толуиловая, п-толуолсульфоновая, бензолсульфоновая кислота, метансульфоновая или нафталинсульфоновая кислота. Настоящее изобретение включает в свой объем все возможные стехиометрические и нестехиометрические формы. Фармацевтически приемлемые соли, образующие часть настоящего изобретения, могут быть получены обработкой соединения формулы (I) 1-6 эквивалентами основания, такого как гидрид натрия, метоксид натрия, этоксид натрия, гидроксид натрия, трет-бутоксид калия, гидроксид кальция, ацетат кальция, хлорид кальция, гидроксид магния, хлорид магния и т.п. Могут быть использованы растворители,такие как вода, ацетон, эфир, ТГФ, метанол, этанол, трет-бутанол, диоксан, изопропанол, изопропиловый эфир или их смеси. Соединения формулы (I) могут быть получены в кристаллической или некристаллической форме и,если в кристаллической, могут необязательно быть сольватированы, например, в виде гидрата. Настоящее изобретение включает в свой объем стехиометрические сольваты (например, гидраты), а также соединения, содержащие изменяющиеся количества растворителя (например, воду). Различные полиморфы соединения общей формулы (I), образующие часть настоящего изобретения,могут быть получены кристаллизацией соединения формулы (I) в различных условиях, например, применяя различные обычно используемые растворители или их смеси для рекристаллизации, кристаллизации при различных температурах; различные, в процессе кристаллизации, режимы охлаждения в пределах от очень быстрого до очень медленного. Полиморфы могут также быть получены постепенным или быстрым охлаждением соединения после нагревания или плавления. Присутствие полиморфов может быть определено посредством спектроскопии ЯМР твердого тела, инфракрасной спектроскопии, дифференциальной сканирующей калориметрии, порошковой рентгеновской дифракции или подобных методов. Фармацевтически приемлемые сольваты соединений формулы (I), образующие часть настоящего изобретения, могут быть получены обычными способами, такими как растворение соединений формулы(I) в растворителях, таких как вода, метанол, этанол, смесь растворителей, например ацетон-вода, диоксан-вода, N,N-диметилформамид-вода и т.п., предпочтительно вода, и рекристаллизация, с использованием различных способов кристаллизации. Пролекарства по настоящей заявке могут быть получены из соединения формулы (I) хорошо известным способом. Обычные способы отбора и получения подходящих производных пролекарства описаны, например, в Design of prodrugs (1985); Wihnan, Biochem. Soc. Trans, 1986, 14, 375-82; Stella et al.,Prodrugs: A chemical approach to targeted drug delivery in directed drug delivery, 1985, 247-67, каждый из которых включен в настоящий документ полностью посредством ссылки. Таутомеры соединений формулы (I) могут быть получены хорошо известным способом. Способы получения подходящих таутомеров описаны, например, в Smith M.B., March J. (2001). Advanced OrganicN-Оксиды соединений формулы (I) могут быть получены хорошо известным способом. Способы получения подходящих N-оксидов описаны в March's Advanced Organic Chemistry: Reactions, Mechanisms,and Structure, Michael B. Smith, Jerry March Wiley-Interscience, 5th edition, 2001. Гидраты соединений формулы (I) могут быть получены хорошо известным способом. В случае соединений общей формулы (I), имеющих геометрический изомеризм, настоящее изобретение относится ко всем этим геометрическим изомерам. Примеры Новые соединения по настоящему изобретению были получены в соответствии со следующими способами с использованием подходящих материалов и проиллюстрированы следующими конкретными примерами. Наиболее предпочтительными соединениями по изобретению являются любые или все, конкретно приведенные в данных примерах. Указанные соединения, однако, не следует рассматривать как составляющие только один класс соединений в качестве изобретения, но образовывать класс может любая комбинация соединения или его фрагментов сама по себе. Следующие примеры подробно иллюстрируют получение соединений по настоящему изобретению. Специалисту в данной области нетрудно понять, что для получения этих соединений в следующих препаративных способах могут быть использованы известные варианты условий реакций и способов. Получение 1. Получение соединения формулы (8). Стадия (i). Получение соединения формулы (2). К перемешиваемому раствору соединения формулы (1) (R4=H) (20,0 г, 133,1 ммоль) в метансульфоновой кислоте (125 г) в течение 2 ч по частям добавляли азид натрия (9,0 г, 39,8 ммоль). В процессе добавления температуру поддерживали при 20-25 С. Выделение газообразного азота прекращалось спустя 2 ч после завершения прибавления. После перемешивания в течение еще часа при комнатной температуре реакционный раствор разбавляли 100 мл воды. По частям осторожно добавляли избыток 50%-го раствора гидроксида калия, без внешнего охлаждения. Экзотермическая реакция давала раствор, который экстрагировали 1 раз эфиром. Водный слой подкисляли концентрированной соляной кислотой. Выпавшую в осадок органическую кислоту собирали с помощью фильтрации, промывали пятью 50 мл-ми порциями дистиллированной воды и затем сушили в вакуумной сушке над пентоксидом фосфора с получением соединения формулы (2) (R4=H) (17,9 г). Выход: 81%. Точка плавления: 196-198 С. 1H-HMP (CDCl3):12,2-11,2 (ушир.с, 1 Н), 5,80-5,50 (м, 2 Н), 2,62-2,54 (м, 1 Н), 2,45-1,80 (м, 7 Н),1,80-1,65 (м, 2 Н), 1,60-1,52 (м, 1 Н). ИК (см-1): 3266, 3022, 2924, 2896, 2632, 1682, 1436, 1411, 1331, 1304, 1268, 1244, 1103, 1008, 965,935, 872, 714, 616. МС (m/z): 167 [М+Н+]. Стадия (ii). Получение соединения формулы (3). К перемешиваемому раствору соединения формулы (2) (R4=H) (5 г, 30,0 ммоль) в дихлорэтане (50 мл),добавляли триэтиламин (8,3 мл, 60,0 ммоль), а затем дифенилфосфорил азид (7,1 мл, 33 ммоль). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре, затем кипятили с обратным холодильником в течение 2 ч. Добавляли бензиловый спирт (5,2 мл, 49,9 ммоль) и кипятили с обратным холодильником в течение еще 5 ч. Реакционную смесь разбавляли хлороформом и насыщенным водным раствором бикарбоната натрия. Два слоя разделяли, и органический слой промывали водой, насыщенным солевым раствором, сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении с получением сырого продукта, который очищали с помощью флеш-хроматографии на колонке с силикагелем, что давало соединение формулы (3) (R4=H) (3,24 г). Выход: 40%. 1 Н-ЯМР (CDCl3):7,42-7,27 (м, 5 Н), 6,12-6,05 (м, 1 Н), 5,95 (ушир.д, 1 Н), 5,88-5,75 (м, 1 Н), 5,06 (дд,J=19,6, 12,3 Гц, 2 Н), 4,15-4,0 (м, 1 Н), 2,50-2,30 (м, 2 Н), 2,25-2,15 (м, 1 Н), 2,10-1,90 (м, 2 Н), 1,90-1,67 (м,4 Н), 1,62-1,50 (м, 1 Н). ИК (см-1): 3431, 3364, 3018, 2928, 2145, 1708, 1578, 1507, 1487, 1386, 1216, 1062, 861, 758, 668. МС (m/z): 272 [М+Н+]. Стадия (iii). Получение соединения формулы (4). К перемешиваемому раствору соединения формулы (3) (R4=H) (3,2 г, 11,8 ммоль) в тетрахлориде углерода (47 мл), охлаждаемому до 0 С, добавляли раствор брома в тетрахлориде углерода (5% мас./об.) до устойчивого оранжевого цвета раствора. Легколетучие растворители удаляли при пониженном давлении с получением сырой реакционной смеси, которую очищали с помощью флеш-хроматографии на силикагеле с получением соединения формулы (4) (R4=H) (3,4 г) и соединения формулы (5) (R4=H) (1,32 г). 1 Стадия (iv). Получение соединения формулы (5). К перемешиваемому раствору соединения формулы (4) (R4=H) (6,5 г, 18,5 ммоль) в изопропаноле(10 мл), охлаждаемому до 0 С, добавляли раствор сухого хлористого водорода в изопропаноле (74 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Легколетучие растворители удаляли при пониженном давлении с получением сырого продукта, который растирали в эфире с получением соединения формулы (5) (R4=H) (2,4 г). Выход: 60%. 1MC (m/z): 216, 218 [М+Н+]. Стадия (v). Получение соединения формулы (6). К перемешиваемому раствору соединения формулы (5) (R4=H) (4,55 г, 21 ммоль) в сухом тетрагидрофуране (42 мл), охлаждаемому до 0 С, добавляли раствор литийалюминийгидрида (1 М в тетрагидрофуране, 31,5 мл, 31,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч,затем гасили добавлением воды (1,2 мл), водного раствора гидроксида натрия (15%, 1,23 мл) и воды (3,5 мл),в этой последовательности. Реакционную смесь фильтровали через небольшой слой из целита, фильтрат сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением соединения формулы (6) (R4=H) (2,125 г). Выход: 74%. 1MC (m/z): 138 [М+Н+]. Стадия (vi). Получение соединения формулы (7). К перемешиваемому раствору соединения формулы (6) (R4=H) (2,1 г, 15,4 ммоль) в метаноле (31 мл),охлаждаемому до 0 С, добавляли акрилонитрил (1 мл, 15,4 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение 16 ч. После завершения реакции легколетучие растворители удаляли при пониженном давлении и сырой продукт очищали с помощью флешхроматографии на силикагеле с получением соединения формулы (7) (R4=H) (2,12 г). Выход: 73%. 1H-ЯМР (CDCl3):2,94 (т, J=7,0 Гц, 2 Н), 2,84 (ушир.с, 2 Н), 2,44 (т, J=6,9 Гц, 2 Н), 2,08-1,95 (м, 6 Н),1,81 (ушир.с, 2 Н), 1,70-1,52 (м, 4 Н). МС (m/z): 191 [М+Н+]. Стадия (vii). Получение соединения формулы (8). К перемешиваемому раствору соединения формулы (7) (R4=H) (2,1 г, 11,04 ммоль) в метанольном аммиаке (7 М, 44 мл) добавляли никель Ренея (40 мас.%, 0,84 г). Реакционную смесь перемешивали в атмосфере водорода (баллон под давлением) в течение 16 ч. Реакционную смесь фильтровали через целит,фильтрат сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением соединения формулы (8) (R4=H) (2,14 г). Выход: 100%. 1H-ЯМР (CDCl3):3,0-2,70 (м, 6 Н), 2,15-1,95 (м, 6 Н), 1,90-1,60 (м, 4 Н), 1,60-1,50 (м, 4 Н). МС (m/z): 195 [М+Н+]. Получение 2. Получение соединения формулы (10). Стадия (i). Получение соединения формулы (9). К перемешиваемой смеси соединения формулы (6) (R4=H) (0,9 г, 6,5 ммоль), карбоната калия (1,2 г,9,18 ммоль) и тетрабутиламмониййодида (242 мг, 0,65 ммоль) в ацетонитриле (43 мл) добавляли хлорацетонитрил (0,48 мл, 7,78 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 5 ч. Легколетучие растворители удаляли; остаток разбавляли водой и экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Сырой продукт очищали с помощью флеш-хроматографии на силикагеле с получением соединения формулы (9) (R4=H) (0,92 г). Выход: 80%. 1H-ЯМР (CDCl3):3,65 (с, 2 Н), 3,0 (ушир.с, 2 Н), 2,10-2,0 (м, 6 Н), 1,82 (ушир.с, 2 Н), 1,65-1,57 (м,4 Н). МС (m/z): 177 [М+Н+]. Стадия (ii). Получение соединения формулы (10). К перемешиваемому раствору соединения формулы (9) (R4=H) (919 мг, 5,2 ммоль) в сухом тетрагидрофуране (10 мл), охлаждаемому до 0 С, добавляли литийалюминийгидрид (1 М в тетрагидрофуране,7,8 мл). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение 30 мин. Реакцию гасили путем добавления кусочков льда и фильтровали через небольшой слой из цели- 12020227 та. Фильтрат упаривали досуха и очищали с помощью флеш-хроматографии на силикагеле с получением соединения формулы (10) (R4=H) (0,61 г). Выход: 64%. 1 Н-ЯМР (CDCl3):2,81 (ушир.с, 2 Н), 2,78-2,65 (м, 4 Н), 2,12-1,92 (м, 6 Н), 1,81 (ушир.с, 2 Н), 1,651,50 (м, 4 Н). МС (m/z): 181 [М+Н+]. Получение 3. Получение соединения формулы (23). Стадия (i). Получение соединения формулы (11). Адамантанон (50 г, 333 ммоль) добавляли при перемешивании к азотной кислоте (98%, 440 мл) при температуре ледяной бани в течение периода времени 15 мин. Реакционную смесь перемешивали при комнатной температуре в течение 72 ч и затем нагревали при температуре 60 С в течение 2 ч до выпаривания большей части диоксида азота. Избыток азотной кислоты отгоняли при пониженном давлении. При охлаждении светло-желтое масло затвердевало. Реакционную смесь разбавляли водой (200 мл) и концентрированной серной кислотой (75 мл). Полученный прозрачный желтый раствор нагревали на паровой бане в вытяжном шкафу в течение 1 ч. Реакционную смесь нейтрализовали с помощью 30%-го водного раствора гидроксида натрия и, пока теплая, экстрагировали хлороформом. Экстракты объединяли, промывали насыщенным солевым раствором и концентрировали в вакууме. Сырой продукт растворяли в дихлорметане (15 мл) и гексан добавляли до прекращения образования осадка. Твердый продукт выделяли с помощью фильтрации и сушили в вакууме с получением соединения формулы (11) (40,9 г). Выход: 74%. Область плавления: 278,8-300 С. 1(м, 1 Н). ИК: 3410, 2929, 2855, 2645, 1725, 1539, 1452, 1351, 1288, 1116, 1055, 927, 900, 797. МС (m/z): 167 [М+Н+]. Стадия (ii). Получение соединения формулы (12). К перемешиваемому раствору соединения формулы (11) (20,0 г, 120,3 ммоль) в бензоле (365 мл) добавляли трифторметансульфоновую кислоту (10,7 мл, 60,2 ммоль) в течение периода времени 40 мин при комнатной температуре. После перемешивания реакционной смеси в течение 5 мин при комнатной температуре ее кипятили с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали до 0 С и добавляли насыщенный водный раствор бикарбоната натрия (150 мл) в течение периода времени 30 мин. Два слоя разделяли, водный слой экстрагировали эфиром, и объединенный органический слой промывали водой, насыщенным солевым раствором, сушили над безводным сульфатом натрия, и растворитель упаривали при пониженном давлении с получением соединения формулы (12) в виде твердого вещества белого цвета (21,2 г). Выход: 78%. Область плавления: 53,8-60,9 С. 1 Н-ЯМР (CDCl3):7,37-7,22 (м, 4 Н), 7,17-7,10 (м, 1 Н), 2,67 (ушир.с, 2 Н), 2,37-2,25 (м, 2 Н), 2,25-2,15(м, 4 Н), 2,15-2,0 (м, 5 Н). ИК (см-1): 2912, 2850, 1716, 1597, 1495, 1444, 1294, 1059, 960, 758, 701. МС (m/z): 227 [М+Н+]. Стадия (iii). Получение соединения формулы (13). Соединение формулы (13) получали таким же способом, который описан для стадии (i) метода получения 1, используя соединение формулы (12). 1 Н-ЯМР (CDCl3):7,50-7,30 (м, 4 Н), 7,27-7,15 (м, 1 Н), 5,80-5,70 (м, 1 Н), 5,70-5,60 (м, 1 Н), 2,90-2,56(м, 4 Н), 2,55-2,10 (м, 3 Н), 2,10-2,0 (м, 1 Н), 2,0-1,67 (м, 2 Н). ИК (см-1): 3500, 3302, 2917, 1689, 1493, 1355, 1248, 947, 758, 699. МС (m/z): 243 [М+Н+]. Стадия (iv). Получение соединения формулы (14). Соединение формулы (14) получали таким же способом, который описан для стадии (ii) метода получения 1, используя соединение формулы (13). 1 Н-ЯМР (CDCl3):7,45-7,25 (м, 8 Н), 7,25-7,17 (м, 2 Н), 6,18-5,70 (м, 2 Н), 5,20-5,12 (м, 2 Н), 5,10 (дд,J=24,l, 12,3 Гц, 1 Н), 4,20-4,10 (м, 1 Н), 3,20-3,0 (м, 2 Н), 2,90-2,81 (м, 1 Н), 2,27-2,10 (м, 1 Н), 2,10-2,0 (м,1 Н), 1,97-1,70 (м, 4 Н). ИК (см-1): 3440, 3019, 1709, 1619, I486, 1386, 1216, 1072, 957, 757. МС (m/z): 348 [М+Н+]. Стадия (v). Получение соединения формулы (15). Соединение формулы (15) получали таким же способом, который описан для стадии (iii) метода получения 1, используя соединение формулы (14). 1(м, 3 Н), 2,15-1,70 (м, 6 Н). ИК (см-1): 3019, 2927, 1626, 1592, 1485, 1382, 1215, 1084, 956, 860, 757. МС (m/z): 426, 428 [М+Н+]. Стадия (vi). Получение соединения формулы (16). Соединение формулы (16) в виде гидрохлоридной соли получали таким же способом, который описан для стадии (iv) метода получения 1, используя соединение формулы (15). 1 Н-ЯМР (CDCl3):9,81 (ушир.с, 1 Н), 9,76 (ушир.с, 1 Н), 7,44-7,30 (м, 4 Н), 7,30-7,25 (м, 1 Н), 4,96(ушир.с, 1 Н), 4,10-3,95 (м, 2 Н), 2,80-2,30 (м, 6 Н), 2,20-2,02 (м, 2 Н), 1,96-1,85 (м, 1 Н). ИК (см-1): 3438, 2922, 2787, 2470, 1582, 1494, 1431, 1381, 1348, 1109, 1004, 754, 701. МС (m/z): 292, 294 [М+Н+]. Стадия (vii). Получение соединения формулы (17). Соединение формулы (17) получали таким же способом, который описан для стадии (v) метода получения 1, используя соединение формулы (16). 1 Н-ЯМР (CDCl3):7,40-7,30 (м, 4 Н), 7,25-7,20 (м, 1 Н), 3,80-3,70 (м, 3 Н), 2,48-2,25 (м, 5 Н), 2,10-1,95(м, 4 Н), 1,90-1,80 (м, 2 Н). ИК (см-1): 3422, 3153, 2915, 2846, 1599, 1492, 1443, 1105, 1022, 756, 698. МС (m/z): 214 [М+Н+]. Стадия (viii). Получение соединения формулы (18). К перемешиваемому раствору соединения формулы (17) (1,3 г, 6,1 ммоль) в дихлорметане (20 мл),охлаждаемому до 0 С, добавляли триэтиламин (1,1 мл, 7,9 ммоль) и Boc ангидрид (1,46 г, 6,7 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение 16 ч. Легколетучие растворители удаляли при пониженном давлении и сырую массу очищали с помощью флеш-хроматографии на силикагеле с получением соединения формулы (18) (1,3 г). Выход: 68%. 1(м, 1 Н), 2,05-1,83 (м, 7 Н), 1,78-1,64 (м, 3 Н), 1,48 (с, 9 Н). ИК (см-1): 2984, 2926, 2855, 1687, 1447, 1403, 1361, 1167, 1100, 1077, 753, 702. МС (m/z): 314 [М+Н+]. Стадия (ix). Получение соединения формулы (19). К перемешиваемой смеси соединения формулы (18) (2,0 г, 6,3 ммоль), тетрахлорида углерода (16 мл),ацетонитрила (16 мл) и воды (25 мл), охлаждаемой до 0 С, добавляли перйодат натрия (5,98 г, 28 ммоль) и гидрат хлорида рутения(III) (0,08 г, 0,4 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и, после перемешивания в течение 3 ч, разбавляли изопропиловым эфиром (100 мл) и перемешивали в течение 15 мин до образования осадка черного цвета RuO2. Реакционную смесь затем фильтровали через слой из целита и слои разделяли. Органический слой промывали 1 н. раствором гидроксида натрия. Органический слой сушили над сульфатом натрия и растворитель упаривали при пониженном давлении с получением непрореагировавшего исходного продукта (1,4 г). Объединенный водный слой подкисляли концентрированной соляной кислотой и экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и растворитель удаляли при пониженном давлении с получением соединения формулы (19) (0,6 г). Выход: 33%.(м, 3 Н), 1,46 (с, 9 Н). ИК (см-1): 3472, 3367, 3018, 2932, 1702, 1678, 1418, 1365, 1216, 1170, 1116, 1103, 758, 668. МС (m/z): 280 [М-Н+]. Стадия (х). Получение соединения формулы (20). Соединение формулы (20) получали таким же способом, который описан для стадии (ii) метода получения 1, используя соединение формулы (19). 1H-ЯМР (CDCl3):7,42-7,30 (м, 4 Н), 7,30-7,20 (м, 1 Н), 5,04 (с, 2 Н), 4,70 (ушир.с, 1 Н), 4,50-4,42 (м,1 Н), 4,38-4,32 (м, 1 Н), 2,30-2,20 (м, 1 Н), 2,18-1,87 (м, 5 Н), 1,85-1,52 (м, 5 Н), 1,46 (с, 9 Н). ИК (см-1): 3406, 3019, 2931, 1592, 1579, 1485, 1389, 1215, 1049, 955, 861, 757, 669. МС (m/z): 387 [М+Н+]. Стадия (xi). Получение соединения формулы (21). К перемешиваемому раствору соединения формулы (20) (0,497 г, 1,28 ммоль) в дихлорметане (10 мл),охлаждаемому до 0 С, добавляли трифторуксусную кислоту (1,28 мл). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение 2 ч. Легколетучие растворители удаляли при пониженном давлении, остаток разбавляли 10%-м водным раствором бикарбоната натрия и экстрагировали дихлорметаном, получая соединение формулы (21) (0,35 г). Выход: 97%. 1(м, 1 Н), 2,30-2,10 (м, 8 Н), 1,80-1,70 (м, 2 Н). ИК (см-1): 3431, 3019, 2956, 2868, 1664, 1629, 1593, 1485, 1388, 1288, 1216, 1056, 757, 668. МС (m/z): 287 [М+Н+]. Стадия (xii). Получение соединения формулы (22). К соединению формулы (21) (170 мг, 0,59 ммоль) добавляли муравьиную кислоту (2 мл) и формальдегид (4 мл) и реакционную смесь перемешивали при температуре 80 С в течение 4 ч. Реакцию гасили водой и насыщенным водным раствором карбоната калия и смесь экстрагировали дихлорметаном. Экстракт сушили над сульфатом натрия и уменьшали в объеме и остаток очищали с помощью флешхроматографии на силикагеле с получением соединения формулы (22) (R5=метил) (200 мг). Выход: количественный. 1 Н-ЯМР (CDCl3):7,40-7,20 (м, 5 Н), 5,05 (с, 2 Н), 4,65 (ушир.с, 1 Н), 3,08-2,97 (м, 2 Н), 2,53 (с, 3 Н),2,32-2,20 (м, 2 Н), 2,20-2,14 (м, 1 Н), 2,06-1,95 (м, 3 Н), 1,70-1,50 (м, 5 Н). ИК (см-1): 3432, 3019, 2929, 2857, 1719, 1592, 1487, 1379, 1284, 1216, 1049, 757, 668. МС (m/z): 301 [М+Н+]. Стадия (xiii). Получение соединения формулы (23). К перемешиваемому раствору соединения формулы (22) (R5=метил) (0,4 г, 1,3 ммоль) в метаноле(1,6 мл), в атмосфере азота, добавляли Pd/C (10%, 0,20 г). Использовали двуслойный баллон, наполненный газообразным водородом. После перемешивания в течение 16 ч при комнатной температуре реакционную смесь фильтровали через небольшой слой из целита и фильтрат упаривали при пониженном давлении с получением соединения формулы (23) (R5=метил) (0,2 г). Выход: 90%. 1H-ЯМР (CDCl3):3,10-3,0 (м, 2 Н), 2,52 (с, 3 Н), 2,20-2,10 (м, 1 Н), 2,10-1,84 (м, 5 Н), 1,70-1,60 (м,2 Н), 1,50-1,35 (м, 3 Н). ИК (см-1): 3413, 3019, 2928, 2854, 1627, 1581, 1486, 1383, 1216, 1084, 954, 757, 668. МС (m/z): 167 [М+Н+]. Получение 4. Получение соединения формулы (27). Стадия (i). Получение соединения формулы (24). К перемешиваемому раствору соединения формулы (17) (2,5 г, 11,73 ммоль) в дихлорметане (47 мл),охлаждаемому до 0 С, добавляли триэтиламин (2,45 мл, 17,6 ммоль), 4-диметиламинопиридин (122 мг,1,0 ммоль) и уксусный ангидрид (1,56 мл, 15,2 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение 2 ч. Легколетучие растворители удаляли при пониженном давлении и сырой продукт растворяли в воде и экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия и растворитель удаляли с получением соединения формулы (24) (3,0 г). Выход: 100%. 1 Н-ЯМР (CDCl3):7,40-7,30 (м, 4 Н), 7,25-7,15 (м, 1 Н), 5,10-4,95 (м, 1 Н), 4,25-4,18 (м, 1 Н), 2,35-2,25(м, 1 Н), 2,12 (с, 3 Н), 2,05-1,55 (м, 10 Н). МС (m/z): 256 [М+Н+]. Стадия (ii). Получение соединения формулы (25). Соединение формулы (25) получали таким же способом, который описан для стадии (ix) метода получения 3, используя соединение формулы (24). 1(м, 5 Н), 1,75-1,55 (м, 5 Н). МС (m/z): 224 [М+Н+]. Стадия (iii). Получение соединения формулы (26). К перемешиваемому раствору соединения формулы (25) (400 мг, 1,79 ммоль) в ацетонитриле (7 мл) при комнатной температуре добавляли пиридин (0,16 мл, 1,97 ммоль), Boc ангидрид (470 мг, 2,15 ммоль). Через 1 ч добавляли твердый аммоний бикарбонат (230 мг, 2,9 ммоль) и реакционную смесь перемешивали в течение 12 ч. Легколетучие растворители удаляли в вакууме и сырой продукт очищали путем хроматографии на колонке с силикагелем с получением соединения формулы (26) (250 мг). Выход: 63%. 1 Н-ЯМР (ДМСО-d6):7,03 (ушир.с, 1 Н), 6,79 (ушир.с, 1 Н), 4,72-4,67 (м, 1 Н), 4,12-4,06 (м, 1 Н), 2,152,08 (м, 1 Н), 1,94 (с, 3 Н), 1,90-1,55 (м, 10 Н).MC (m/z): 223 [М+Н+]. Стадия (iv). Получение соединения формулы (27). К перемешиваемому раствору соединения формулы (26) (240 мг, 1,08 ммоль) в сухом тетрагидрофуране, охлаждаемому до 0 С, добавляли 1 М раствор литийалюминийгидрида в тетрагидрофуране (3,5 мл,3,5 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры, затем кипятили с обратным холодильником в течение 6 ч. Реакционную смесь охлаждали до 0 С, осторожно добавляли кусочки льда и перемешивали в течение 30 мин, затем фильтровали через небольшой слой из целита. Фильтрат упаривали и сырой продукт очищали с помощью флеш-хроматографии на силикагеле с получением соединения формулы (27) (R5=метил) (160 мг). Выход: 76%. 1 Н-ЯМР (CDCl3):3,10-3,0 (м, 2 Н), 2,80-2,70 (кв, 2 Н), 2,36 (с, 2 Н), 2,20-1,20 (м, 9 Н), 1,11 (т, 3 Н),0,90-0,75 (м, 2 Н).MC (m/z): 195 [М+Н+]. Получение 5. Получение соединения формулы (32). Стадия (i). Получение соединения формулы (29). К перемешиваемому раствору соединения формулы (28) (2,0 г, 13,2 ммоль) в метансульфоновой кислоте (12,5 г) по частям в течение 2 ч добавляли азид натрия (0,9 г, 3,98 ммоль). В процессе добавления температуру поддерживали при 20-25 С. Выделение газообразного азота прекращалось через 2 ч после завершения прибавления. После перемешивания в течение еще часа при комнатной температуре реакционный раствор разбавляли 100 мл воды. Осторожно по частям добавляли избыток 50%-го раствора гидроксида калия, без внешнего охлаждения. В результате экзотермической реакции образовывался раствор,который экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением сырого продукта, который очищали с помощью флеш-хроматографии на силикагеле с получением соединения формулы (29) (1,56 г). Выход: 71%. 1 Стадия (ii). Получение соединения формулы (30). К перемешиваемому раствору соединения формулы (29) (1,5 г, 9,0 ммоль) в сухом тетрагидрофуране (36 мл) добавляли боран в тетрагидрофуране (1 М, 18 мл). Реакционную смесь кипятили с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до 0 С и гасили путем добавления 1 н. раствора соляной кислоты. Слои разделяли и водный слой промывали этилацетатом, затем подщелачивали с помощью 50%-го раствора гидроксида натрия и экстрагировали смесью 1:9 метанол:хлороформ. Объединенный органический слой сушили над безводным сульфатом натрия и сырой продукт очищали с помощью флеш-хроматографии на силикагеле с получением соединения формулы (30) (1,16 г). Выход: 85%. 1(м, 2 Н). МС (m/z): 153 [М+Н+]. Стадия (iii). Получение соединения формулы (31). Соединение формулы (31) получали таким же способом, который описан для стадии (vi) метода получения 1, используя соединение формулы (30). 1MC (m/z): 206 [М+Н+]. Стадия (iv). Получение соединения формулы (32). Соединение формулы (32) получали таким же способом, который описан для стадии (vi) метода получения 1, используя соединение формулы (31). 1MC (m/z): 210 [М+Н+]. Получение 6. Получение соединения формулы (41). Стадия (i). Получение соединения формулы (34). К соединению формулы (33) (22 г, 93,3 ммоль) в тетрагидрофуране (195 мл) добавляли через канюлю при температуре 0 С свежеприготовленный метилмагниййодид в эфире (1 М, 253 мл). После перемешивания при 0 С в течение 0,5 ч реакционную смесь гасили путем добавления насыщенного водного раствора хлорида аммония. Органический слой отделяли и водный слой экстрагировали диэтиловым эфиром. Объединенный органический слой промывали водой, насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением соединения формулы (34) в виде твердого вещества не совсем белого цвета (22,4 г). Выход: 95%. Область плавления: 98-100,4 С. 1 Н-ЯМР (CDCl3):7,42-7,28 (м, 4 Н), 7,24-7,18 (м, 1 Н), 2,47-2,42 (м, 1 Н), 2,32-2,25 (м, 1 Н), 2,14-2,01(м, 3 Н), 1,96-1,85 (м, 5 Н), 1,80-1,67 (м, 2 Н), 1,60-1,54 (м, 2 Н), 1,54-1,45 (м, 1 Н), 1,41 (с, 3 Н). МС (m/z): 243 [М+Н+]. Стадия (ii). Получение соединения формулы (35). К соединению формулы (34) (6,6 г, 27,3 ммоль), растворенному в смеси уксусной кислоты (5,8 мл) и тетрагидрофурана (29 мл), добавляли по каплям через дополнительную воронку при охлаждении на ледяной бане раствор гипохлорида натрия (4%, 272 мл) в течение периода времени 15 мин. Добавляли твердый тетрабутиламмониййодид (1,0 г, 2,7 ммоль) и реакционную смесь перемешивали в течение 1,5 ч. Два слоя разделяли, водный слой экстрагировали диизопропиловым эфиром и объединенный органический слой промывали водой, насыщенным солевым раствором, сушили над сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток растворяли в метаноле (14 мл), добавляли твердый гидроксид калия (3,0 г, 54,6 ммоль) и смесь кипятили с обратным холодильником в течение 1 ч. Растворитель упаривали при пониженном давлении и сырой продукт очищали с помощью хроматографии на колонке с получением соединения формулы (35) (2,85 г) в виде вязкой жидкости. Выход: 44%. 1(м, 1 Н), 2,22 (с, 3 Н), 2,10-1,92 (м, 4 Н), 1,92-1,75 (м, 4 Н), 1,82-1,70 (м, 1 Н). ИК (см-1): 2924, 2867, 1697, 1445, 1356, 1223, 757, 699. МС (m/z): 241 [М+Н+]. Стадия (iii). Получение соединения формулы (36). К перемешиваемой смеси соединения формулы (35) (2,8 г, 11,66 ммоль), полученной, как описано в получении 1, тетрахлорида углерода (24 мл), ацетонитрила (24 мл) и воды (36 мл), охлаждаемой до 0 С,добавляли перйодат натрия (11,2 г, 52,2 ммоль), затем гидрат хлорида рутения(III) (0,13 г, 0,6 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь разбавляли изопропиловым эфиром (100 мл) и перемешивали в течение 15 мин, образовывался черный осадок RuO2. Реакционную смесь затем фильтровали через слой из целита и органический слой экстрагировали 1 н. раствором гидроксида натрия (325 мл). Органический слой сушили над сульфатом натрия; растворитель упаривали в вакууме с получением непрореагировавшего исходного продукта (1,32 г, 5,5 ммоль). Водный слой подкисляли концентрированной соляной кислотой и экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором,сушили над сульфатом натрия и растворитель удаляли при пониженном давлении с получением соединения формулы (36) (0,9 г) в виде твердого вещества не совсем белого цвета. Выход: 35%. Область плавления: 90-95,0 С. 1 Н-ЯМР (CDCl3):2,80-2,72 (м, 1 Н), 2,56-2,50 (м, 1 Н), 2,44-2,37 (м, 1 Н), 2,20 (с, 3 Н), 2,18-2,09 (м,1 Н), 2,02-1,85 (м, 4 Н), 1,85-1,72 (м, 3 Н), 1,68-1,62 (м, 1 Н). ИК (см-1): 2935, 1694, 1413, 1357, 974, 746. МС (m/z): 207 [М-Н+] . Стадия (iv). Получение соединения формулы (37). Соединение формулы (37) получали таким же способом, который описан для стадии (х) метода получения 3, используя соединение формулы (36). 1 Н-ЯМР (CDCl3):7,40-7,27 (м, 5 Н), 5,05 (с, 2 Н), 4,95 (ушир.с, 1 Н), 2,75-2,65 (м, 1 Н), 2,47 (ушир.с,1 Н), 2,50-2,42 (м, 1 Н), 2,28-2,15 (м, 1 Н), 2,17 (с, 3 Н), 2,10-1,82 (м, 4 Н), 1,80-1,70 (м, 2 Н), 1,70-1,53 (м, 2 Н). МС (m/z): 314 [М+Н+]. Стадия (v). Получение соединения формулы (38). Соединение формулы (38) получали таким же способом, который описан для стадии (xiii) метода получения 3, используя соединение формулы (37). 1 Н-ЯМР (CDCl3):2,72-2,65 (м, 1 Н), 2,52-2,47 (м, 1 Н), 2,17 (с, 3 Н), 2,15-2,08 (м, 1 Н), 1,98-1,86 (м,2 Н), 1,80-1,50 (м, 7 Н). МС (m/z): 180 [М+Н+]. Стадия (vi). Получение соединения формулы (39). К раствору соединения формулы (38) (173 мг, 1,0 ммоль) в диметилформамиде (2,5 мл) добавляли безводный триэтиламин (0,4 мл, 2,9 ммоль) и суспензию перемешивали при комнатной температуре в течение 2 ч. Добавляли 1,4-дибромбутан (0,17 мл, 1,2 ммоль) и смесь нагревали при температуре 60 С в течение 26 ч. К холодной смеси добавляли воду (15 мл) и раствор промывали этилацетатом. Водную фазу подщелачивали с помощью 2 н. гидроксида натрия и экстрагировали этилацетатом. Объединенные органические экстракты промывали водой, сушили с помощью безводного сульфата натрия, фильтровали и растворитель удаляли в вакууме досуха с получением соединения формулы (39) (R5=пирролидин-1 ил) (117 мг). Выход: 52%. 1H-ЯМР (CDCl3):2,80-2,68 (м, 4 Н), 2,68-2,63 (м, 1 Н), 2,53-2,48 (м, 1 Н), 2,24-2,19 (м, 1 Н), 2,18 (с,3 Н), 2,0-1,90 (м, 2 Н), 1,90-1,50 (м, 11 Н). МС (m/z): 234 [М+Н+]. Стадия (vii). Получение соединения формулы (40). К перемешиваемому раствору гидроксида натрия (6,3 г, 158,0 ммоль), воды (54,0 мл) и 1,4-диоксана(7 мл) при температуре 0 С добавляли бром (3,2 мл, 59,0 ммоль) и перемешивали в течение 5 мин. Полученный таким образом раствор гипобромита добавляли по каплям к перемешиваемому раствору соединения формулы (39) (R5=пирролидин-1-ил) (3,0 г, 10,53 ммоль) в 1,4-диоксане (14 мл) при температуре ледяной бани. Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь охлаждали до 0 С, подкисляли (pH 2-3) с помощью 5 н. соляной кислоты и промывали этилацетатом. Водный слой упаривали досуха и сырой продукт очищали с помощью флешхроматографии на силикагеле с получением соединения формулы (40) (R5=пирролидин-1-ил) (2,27 г). Выход: 75%. 1- 18020227 МС (m/z): 236 [М+Н+]. Стадия (viii). Получение соединения формулы (41). К перемешиваемому раствору соединения формулы (40) (R5=пирролидин-1-ил) (3,0 г, 10,45 ммоль) в хлороформе (21 мл) добавляли концентрированную серную кислоту (4,2 мл, 78,9 ммоль), затем по частям добавляли твердый азид натрия (2,38 г, 36,6 ммоль), таким образом, чтобы температура реакционной смеси не поднималась выше 40 С. После завершения прибавления реакционную смесь нагревали до 45 С и перемешивали в течение 2 ч. Реакционную смесь охлаждали до 0 С, разбавляли водой и экстрагировали этилацетатом. Водный слой подщелачивали с помощью 50%-го раствора гидроксида натрия и экстрагировали хлороформом. Объединенный органический слой промывали насыщенным солевым раствором,сушили над гидроксидом натрия и растворитель удаляли при пониженном давлении с получением соединения формулы (41) (R5=пирролидин-1-ил) в виде твердого вещества не совсем белого цвета (2,0 г). Выход: 76%. 1(м, 13 Н). МС (m/z): 207 [М+Н+]. Получение 7. Получение соединения формулы (43). К перемешиваемому раствору 2-[(2-пиридинил)метил]-1-азабицикло[2.2.2]октан-3-она (42) (1 г,4,6 ммоль, 1 экв.) в сухом метаноле (6,6 мл), в атмосфере азота, добавляли 1 М раствор хлорида цинка в эфире (0,9 мл, 0,9 ммоль, 0,2 экв.). После перемешивания при комнатной температуре в течение 30 мин данную смесь обрабатывали твердым формиатом аммония (3,48 г, 55,37 ммоль, 11,96 экв.). После перемешивания в течение еще часа при комнатной температуре по частям добавляли твердый цианборгидрид натрия (0,581 г, 9,2 ммоль, 2 экв.). Реакционную смесь далее перемешивали при комнатной температуре в течение ночи и реакцию останавливали путем добавления воды (5 мл). Погашенную реакционную смесь распределяли между 5 М раствором гидроксида натрия (10 мл) и хлороформом (20 мл). Водный слой экстрагировали хлороформом (20 мл) и объединенные органические слои сушили с помощью сульфата натрия, фильтровали и концентрировали. Это давало 2,97 г продукта в виде смолы желтого цвета(43, R6=2-пиридинил). Анализ GC-MS показал, что продукт представляет собой смесь 90:10 цис- и трансаминов со следами соответствующего спирта. Выход: 98%. 1H-ЯМР (CDCl3):8,55 (д, J=5,0 Гц, 1 Н), 7,61 (т, J=7,6 Гц, 1 Н), 7,25 (д, J=7,9 Гц, 1 Н), 7,13 (дд, J=7,3,5,0 Гц, 1 Н), 3,15-2,70 (м, 8 Н), 2,0-1,30 (м, 5 Н). МС (m/z): 218 [М+Н+]. Получение 8. Получение соединения формулы (46). Стадия (i). Получение соединения формулы (44). К перемешиваемому раствору гидрохлоридной соли пиперидин-4-она (3,6 г, 26,5 ммоль) в ацетонитриле (106 мл) добавляли карбонат цезия (25,9 г, 79,7 ммоль). После перемешивания в течение 30 мин добавляли хлорбутан (4,16 мл, 39,85 ммоль), затем йодид натрия (11,96 г, 79,7 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 2 ч и фильтровали через слой из целита. Фильтрат упаривали досуха при пониженном давлении и сырой продукт очищали с помощью хроматографии на колонке с силикагелем с получением соединения формулы (44) (R5=н-бутил) (2,92 г). Выход: 71%. 1 Н-ЯМР (CDCl3):2,85-2,70 (м, 4 Н), 2,55-2,40 (м, 6 Н), 1,60-1,50 (м, 2 Н), 1,45-1,30 (м, 2 Н), 0,94 (т,J=7,2 Гц, 3 Н). МС (m/z): 156 [М+Н+]. Стадия (ii). Получение соединения формулы (45). К раствору соединения формулы (44) (R5=н-бутил) (2,9 г, 18,7 ммоль), пиридина (2,5 мл, 32,1 ммоль) в этаноле (85 мл) добавляли гидрохлорид гидроксиламина (2,23 г, 32,1 ммоль) и кипятили с обратным холодильником в течение 2 ч. Легколетучие растворители удаляли при пониженном давлении; сырой продукт растворяли в воде и экстрагировали 10%-м раствором метанольного аммиака в хлороформе. Объе- 19020227 диненный органический слой сушили над безводным Na2SO4 и растворитель упаривали при пониженном давлении с получением оксима формулы (45) (R5=н-бутил) (2,0 г). Выход: 63,0%. 1(м, 2 Н), 0,93 (т, J=7,2 Гц, 3 Н). МС (m/z): 171 [М+Н+]. Стадия (iii). Получение соединения формулы (46). К перемешиваемому раствору соединения формулы (45) (R5=н-бутил) (1,6 г, 9,39 ммоль) в нпропаноле (37 мл) по частям добавляли металлический натрий (2,3 г, 100 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 1 ч. Реакционную смесь разбавляли н-пропанолом, водой и перемешивали в течение 30 мин. Легколетучие растворители удаляли при пониженном давлении и сырой продукт очищали с помощью флеш-хроматографии на силикагеле с получением амина формулы (45)(м, 2 Н), 1,55-1,25 (м, 6 Н), 0,91 (т, J=7,3 Гц, 3 Н). МС (m/z): 157 [М+Н+]. Получение 9. Получение соединения формулы (53). Стадия (i). Получение соединения формулы (48). К перемешиваемому раствору соединения формулы (47) (1,0 г, 5,44 ммоль) в дихлорметане (22 мл),охлаждаемому до 0 С, добавляли бензиламин (0,62 мл, 5,72 ммоль), уксусную кислоту (0,3 мл, 5,44 ммоль),затем триацетоксиборгидрид натрия (1,8 г, 8,51 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение 7 ч. После охлаждения реакционной смеси до 0 С реакцию гасили путем добавления насыщенного водного раствора бикарбоната натрия. Два слоя разделяли, водный слой экстрагировали дихлорметаном, объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный таким образом сырой продукт очищали с помощью флеш-хроматографии на силикагеле с получением соединения формулы (48) (1,18 г). Выход: 79%. 1H-ЯМР (CDCl3):7,40-7,20 (м, 5 Н), 3,81 (с, 2 Н), 3,65-3,42 (м, 2 Н), 3,42-3,28 (м, 2 Н), 3,25-3,08 (м,1 Н), 2,12-2,02 (м, 1 Н), 1,83-1,70 (м, 1 Н), 1,46 (с, 9 Н). МС (m/z): 277 [М+Н+]. Стадия (ii). Получение соединения формулы (49). К перемешиваемому раствору соединения формулы (48) (1,15 г, 4,16 ммоль) в метаноле (16,6 мл) добавляли 10% Pd/C (345 мг). Водород под давлением подавали с помощью двухслойного баллона и реакционную смесь перемешивали в течение 16 ч. Реакционную смесь фильтровали через небольшой слой из целита и фильтрат удаляли при пониженном давлении. Сырой продукт очищали с помощью флешхроматографии на силикагеле с получением соединения формулы (49) (640 мг). Выход: 82%. 1(м, 1 Н), 1,46 (с, 9 Н). МС (m/z): 187 [М+Н+]. Стадия (iii). Получение соединения формулы (50). К перемешиваемому раствору соединения формулы (49) (620 мг, 3,33 ммоль) в дихлорметане(6,5 мг, 0,5 ммоль) и уксусный ангидрид (0,35 мл, 3,66 ммоль). После перемешивания реакционной смеси в течение 1 ч реакционную смесь разбавляли дихлорметаном, промывали водой, насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением соединения формулы (50) (759 мг). Выход: 100%. 1 Стадия (iv). Получение соединения формулы (51). К соединению формулы (50), охлаждаемому до 0 С, добавляли раствор сухого хлористого водорода в изопропаноле (3 М, 5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч; легколетучие растворители удаляли при пониженном давлении. Сырой продукт растирали в гексане, затем в эфире с получением соединения формулы (51) в виде гидрохлоридной соли (506 мг). Выход: 93%. 1 Н-ЯМР (ДМСО-d6):9,39 (ушир.с, 1 Н), 9,34 (ушир.с, 1 Н), 8,34 (ушир.с, 1 Н), 4,28-4,18 (м, 1 Н),3,33-3,22 (м, 2 Н), 3,22-3,12 (м, 1 Н), 3,0-2,88 (м, 1 Н), 2,10-2,0 (м, 1 Н), 1,85-1,72 (м, 1 Н), 1,80 (с, 3 Н). МС (m/z): 12 9 [М+Н+]. Стадия (v). Получение соединения формулы (52). Соединение формулы (52) (R4=H) получали таким же способом, который описан для стадии (i) метода получения 9, используя соединение формулы (51). Выход: 52%. 1 Н-ЯМР (CDCl3):5,81 (ушир.с, 1 Н), 4,55-4,40 (м, 1 Н), 3,0-2,80 (м, 1 Н), 2,75-2,60 (м, 1 Н), 2,50-2,35(м, 1 Н), 2,30-2,0 (м, 5 Н), 1,98 (с, 3 Н), 2,0-1,75 (м, бН), 1,75-1,60 (м, 5 Н), 1,50-1,40 (м, 2 Н). МС (m/z): 263 [М+Н+]. Стадия (vi). Получение соединения формулы (53). К соединению формулы (52) (R4=H) (249 мг, 0,95 ммоль) добавляли 6 н. раствор соляной кислоты (4 мл) и реакционную смесь кипятили с обратным холодильником в течение 4 ч. Легколетучие растворители удаляли при пониженном давлении, сырой продукт разбавляли аммиаком в метаноле и неорганические соли удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении с получением соединения формулы (53) (R4=H) (208 мг). Выход: 100%. 1H-ЯМР (ДМСО-d6):7,56 (ушир.с, 2 Н), 3,70-3,60 (м, 1 Н), 2,83-2,70 (м, 1 Н), 2,68-2,52 (м, 2 Н), 2,382,25 (м, 1 Н), 2,20-2,02 (м, 4 Н), 1,90-1,83 (м, 2 Н), 1,83-1,60 (м, 9 Н), 1,40-1,30 (м, 2 Н). ИК (см-1): 3313, 3103, 2985, 2909, 2848, 2523, 1601, 1579, 1495, 1444, 1382, 1217, 1158, 1145, 1068,1046, 1031, 877. МС (m/z): 221 [М+Н+]. Получение 10. Получение соединения формулы (59). Стадия (i). Получение соединения формулы (55). К перемешиваемому раствору соединения формулы (54) (R1=H) (12,9 г, 94,06 ммоль) в метаноле(188 мл), охлаждаемому до 0 С, в течение периода времени 30 мин добавляли тионилхлорид (27,4 мл,376,2 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры, затем кипятили с обратным холодильником в течение 18 ч. Легколетучие растворители удаляли при пониженном давлении; остаток разбавляли этилацетатом и охлаждали до температуры ледяной бани. Добавляли 10%-й водный раствор бикарбоната натрия и два слоя разделяли. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением соединения формулы (55) (R1=H) (12,2 г). Выход: 85,8%. 1 Н-ЯМР (CDCl3):7,86 (д, J=8,0 Гц, 1 Н), 7,27 (т, J=8,4 Гц, 1 Н), 6,70-6,60 (м, 2 Н), 5,90-5,50 (ушир.с,2 Н), 3,87 (с, 3 Н). МС (m/z): 152 [М+Н+]. Стадия (ii). Получение соединения формулы (56). К перемешиваемому раствору соединения формулы (55) (R1=H) (13,2 г, 87,3 ммоль) в дихлорметане(174 мл), охлаждаемому до 0 С, добавляли уксусную кислоту (10 мл, 174 ммоль) и 2,2-диметоксипропан(64,1 мл, 523,6 ммоль). После перемешивания в течение 15 мин при той же температуре добавляли триацетоксиборгидрид натрия (30,3 г, 143,2 ммоль) и реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение 16 ч. Реакционную смесь разбавляли дихлорметаном и промывали 10%-м насыщенным водным раствором бикарбоната натрия, насыщенным солевым раствором,сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Сырой продукт очищали с помощью флеш-хроматографии на силикагеле с получением соединения формулы 1 Н), 6,55 (т, J=7,5 Гц, 1 Н), 3,85 (с, 3 Н), 3,80-3,65 (м, 1 Н), 1,27 (д, J=6,3 Гц, 6 Н). МС (m/z): 194 [М+Н+]. Стадия (iii). Получение соединения формулы (57). К перемешиваемому раствору соединения формулы (56) (R1=H, R2=изопропил) (12,2 г, 63,1 ммоль) в смеси 1:2 метанола и воды (126 мл), охлаждаемому до 0 С, добавляли гидроксид натрия (2,5 г, 63,1 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и затем кипятили с обратным холодильником в течение 16 ч. Легколетучие растворители удаляли при пониженном давлении и остаток сушили в вакууме при температуре 70 С в течение нескольких часов с получением соединения формулы(57) (R1=H, R2=изопропил) (12,4 г). Выход: 97,7%. 1 Н-ЯМР (D2O):7,62 (д, J=8,0 Гц, 1 Н), 7,25 (т, J=8,3 Гц, 1 Н), 6,81 (д, J=8,3 Гц, 1 Н), 6,65 (т, J=7,5 Гц,1 Н), 3,62-3,50 (м, 1 Н), 1,07 (д, J=6,2 Гц, 6 Н). МС (m/z): 178 [М-Н+]. Стадия (iv). Получение соединения формулы (58). К перемешиваемой суспензии соединения формулы (57) (R1=H, R2=изопропил) (5,1 г, 25,3 ммоль) в сухом дихлорметане (25 мл), охлаждаемому до 0 С, добавляли трифосген (15 г, 50,56 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение 16 ч. Добавляли воду и дихлорметан и два слоя разделяли. Органический слой промывали водным раствором бикарбоната натрия, насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением соединения формулы (58) (R1=H, R2=изопропил) (6,25 г,сырой продукт), который использовали на следующей стадии без дополнительной очистки. 1H-ЯМР (CDCl3):8,18 (д, J=8,0 Гц, 1 Н), 7,74 (т, J=8,3 Гц, 1 Н), 7,33 (д, J=8,3 Гц, 1 Н), 7,28 (т, J=7,5 Гц,1 Н), 4,82-4,75 (м, 1 Н), 1,62 (д, J=6,2 Гц, 6 Н). МС (m/z): 206 [М+Н+]. Стадия (v). Получение соединения формулы (59). К перемешиваемому раствору соединения формулы (58) (R1=H, R2=изопропил) (6,25 г, сырой продукт,полученный в предыдущей реакции) в сухом диметилформамиде, охлаждаемому до 0 С, добавляли диметилмалонат (5,2 мл, 45,6 ммоль) и гидрид натрия (60%-я дисперсия в минеральном масле, 2,0 г, 50,2 ммоль). Реакционную смесь перемешивали при комнатной температуре, затем при температуре 100 С в течение 2 ч. Растворитель удаляли при пониженном давлении и сырую массу разбавляли смесью лед-вода. Полученную таким образом смесь подкисляли концентрированным раствором соляной кислоты и экстрагировали дихлорметаном. Объединенный органический слой промывали насыщенным солевым раствором,сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Сырой продукт очищали с помощью флеш-хроматографии на силикагеле с получением соединения формулы(59) (R1=H, R2=изопропил) (2,6 г). Выход: 39% в 2 стадиях. 1 Н-ЯМР (CDCl3):14,05 (с, 1 Н), 8,22 (д, J=8,0 Гц, 1 Н), 7,64 (т, J=8,4 Гц, 1 Н), 7,51 (д, J=8,5 Гц, 1 Н),7,23 (т, J=7,5 Гц, 1 Н), 5,90-5,10 (ушир.с, 1 Н), 4,04 (с, 3 Н), 1,63 (д, J=6,2 Гц, 6 Н). МС (m/z): 262 [М+Н+]. Пример 1. Получение гидрохлорида N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1 изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида. К перемешиваемому раствору соединения формулы (59) (R1=H, R2=изопропил) (305 мг, 1,15 ммоль) в толуоле (11 мл) добавляли соединения формулы (8) (453,6 мг, 2,29 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 2 ч. Легколетучие растворители удаляли при пониженном давлении, и сырой продукт очищали с помощью флеш-хроматографии на силикагеле, и продукт обрабатывали изопропанольным раствором HCl с получением гидрохлорида N-[(2-азатрицикло[3.3.1.13.7]дец-2 ил)пропил]-4-гидрокси-1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоксамида (384 мг). Выход: 77%. 1(м, 2 Н), 1,55 (д, J=6,9 Гц, 6 Н). ИК (см-1): 3425, 3220, 2938, 2724, 2635, 2571, 2500, 1640, 1571, 1499, 1416, 1335, 1189, 1008, 761. МС (m/z): 424 [М+Н+]. Пример 2. Получение гидрохлорида N-[(2-азатрицикло[3.1.1.13.7]дец-2-ил)пропил]-4-гидрокси-1 изобутил-2-оксо-1,2-дигидрохинолин-3-карбоксамида. К перемешиваемому раствору соединения формулы (59) (R1=H, R2=изобутил) (141 мг, 0,54 ммоль) в толуоле (5 мл) добавляли карбонат калия (71,3 мг, 0,512 ммоль) и соединение формулы (8) (100,1 мг,0,512 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 3 ч. Легколетучие растворители удаляли при пониженном давлении, и сырой продукт очищали с помощью флеш-хроматографии на силикагеле, и продукт обрабатывали изопропанольным раствором HCl с получением гидрохлорида N-[(2-азатрицикло[3.3.1.13.7]дец-2-ил)пропил]-4-гидрокси-1-изобутил-2-оксо-1,2-дигидрохинолин 3-карбоксамида (159,4 мг). Выход: 68%. 1 7,79 (т, J=8,1 Гц, 1 Н), 7,66 (д, J=8,7 Гц, 1 Н), 7,36 (т, J=7,5 Гц, 1 Н), 4,15 (д, J=6,7 Гц, 2 Н), 3,65-3,58 (м, 2 Н),3,50-3,40 (м, 2 Н), 3,40-3,25 (м, 2 Н), 2,25-2,05 (м, 5 Н), 2,05-1,87 (м, 6 Н), 1,78 (ушир.с, 2 Н), 1,72-1,65 (м,2 Н), 0,90 (д, J=6,6 Гц, 6 Н). ИК (см-1): 3397, 3218, 2950, 2936, 2439, 1642, 1569, 1499, 1413, 1183, 1017, 763, 670. МС (m/z): 438 [М+Н+]. Пример 3. Получение N-[1-(трицикло[3.3.1.13.7]дец-2-ил)пирролидин-3-ил]-4-гидрокси-1-изопропил-2 оксо-1,2-дигидрохинолин-3-карбоксамида. К перемешиваемому раствору соединения формулы (59) (R1=H, R2=изопропил) (108,3 мг, 0,41 ммоль) в сухом диметилформамиде (2,5 мл) добавляли карбонат калия (57 мг, 0,42 ммоль), соединение формулы(53) (100 мг, 0,45 ммоль) и реакционную смесь нагревали до 130-135 С в течение 18 ч. Реакционную смесь охлаждали до 0 С, разбавляли водой и экстрагировали эфиром. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Сырой продукт очищали с помощью флеш-хроматографии на силикагеле с получением N-[1-(трицикло[3.3.1.13.7]дец-2-ил)пирролидин-3-ил]-4-гидрокси-1-изопропил-2-оксо 1,2-дигидрохинолин-3-карбоксамида (54 мг). Выход: 29%. 1 Н-ЯМР (CDCl3):17,16 (с, 1 Н), 10,60 (ушир.с, 1 Н), 8,23 (д, J=7,8 Гц, 1 Н), 7,75-7,50 (м, 2 Н), 7,407,20 (м, 1 Н), 5,80-5,10 (ушир.с, 1 Н), 4,65-4,52 (м, 1 Н), 2,90-2,75 (м, 2 Н), 2,70-2,60 (м, 1 Н), 2,55-2,42 (м,1 Н), 2,40-2,15 (м, 4 Н), 2,0-1,90 (м, 2 Н), 1,90-1,75 (м, 4 Н), 1,75-1,20 (м, 7 Н), 1,64 (д, J=7,0 Гц, 6 Н). ИК (см-1): 3190, 2904, 2848, 2786, 1910, 1639, 1547, 1410, 1323, 1172, 995, 747, 704. МС (m/z): 450 [М+Н+]. Примеры 4-27. Соединения по примерам 4-27 были получены, следуя способам, описанным в примерах 1-3, с некоторыми несущественными изменениями.
МПК / Метки
МПК: C07D 401/12, C07D 471/12, A61K 31/4704, A61P 25/00, C07D 471/10
Метки: соединения, 5-нт4, качестве, 1,2-дигидро-2-оксохинолиновые, рецептора, лигандов
Код ссылки
<a href="https://eas.patents.su/30-20227-12-digidro-2-oksohinolinovye-soedineniya-v-kachestve-ligandov-receptora-5-nt4.html" rel="bookmark" title="База патентов Евразийского Союза">1,2-дигидро-2-оксохинолиновые соединения в качестве лигандов рецептора 5-нт4</a>
Предыдущий патент: Диэлектрическая изоляционная среда
Следующий патент: Конденсированные тиазоло- и оксазолопиримидиноны
Случайный патент: Устройство и способ охлаждения оборудования пищевой промышленности












