Соединения хинуклидина в качестве лигандов никотинового ацетилхолинового рецептора α7
Номер патента: 17628
Опубликовано: 30.01.2013
Авторы: Ивуагву Кристиана И., Олсон Ричард Е., Зуси Ф.Кристофер, Кук II Джеймс Х., Кинг Далтон, Макдональд Ивар М., Мэкор Джон Е., Ван Нэнхуэй
Формула / Реферат
1. Соединение формулы I или его стереоизомер
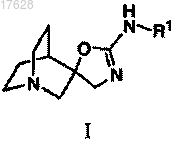
где R1 выбирают из группы, содержащей изоксазолил, пиразолил, оксазолил, тиазолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, пиридинил, пиразинил, пиридазинил, пиримидинил, триазинил, хинолинил, изохинолинил, хиноксалинил, хиназолинил, нафтиридинил, индазолил, индолил, 2-индолонил, бензизоксазолил, бензоизотиазолил, бензоксазолил, бензотиазолил, бензимидазолил, фуропиридинил, тиенопиридинил, тиенопиримидинил, изотиазолопиридинил, тиазолопиридинил, тиазолопиридинолил, тиазолопиразинил, тиазолопиримидинил, триазолопиридинил, триазолопиразинил, пирролотриазинил, 5,6-дигидробензо[h]хиназолинил, 5Н-хромено[4,3-d]пиримидинил, 6,7-дигидро-5Н-циклопента[d]пиримидинил, 5,6,7,8-тетрагидрохиназолинил, 7,8-дигидрохиназолин-5(6Н)-онил и тетрагидробензотиазолил, каждый из которых независимо друг от друга замещен 0-3 заместителями, выбранными из группы, содержащей C1-4алкил, C3-7циклоалкил, C1-4галоалкил, C1-4алкокси, C1-4галоалкокси, С3-7циклоалкокси, C1-4алкилтио, фенокси, бензилокси, гало, гидрокси, циано, C1-4алкилсульфонил, NR2R3, пирролидинонил, метилендиокси, фурил, тиенил, триазолил, пиримидинил, нафтил, C1-4алкиламидо, CONR2R3, пиридил, фенил и бензил, и где пиридил, фенил и бензил замещены независимо друга от друга 0-2 заместителями, выбранными из группы, содержащей галоген, C1-4алкил, C1-4алкокси, C1-4галоалкил, C1-4галоалкокси и NR2R3;
R2 - водород, C1-4алкил, C1-4гидроксиалкил или C1-4аминоалкил;
R3 - водород, C1-4алкил, C1-4гидроксиалкил или C1-4аминоалкил;
или R2 и R3 вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил, пиперидинил, пиперазинил, N-(C1-4алкил)пиперазинил, морфолинил или гомопиперидинил;
или их фармацевтически приемлемая соль.
2. Соединение по п.1, в котором R1 выбирают из группы, содержащей диметилизоксазолил, (метил)(фенил)изоксазолил, метилпиразолил, диметилпиразолил, тиенилпиразолил, метоксифенилпиразолил, тиазолил, бромтиазолил, цианотиазолил, метилтиазолил, диметилтиазолил, (метил)(фенил)тиазолил, изопропилтиазолил, бутилтиазолил, бензилтиазолил, метоксифенилметилтиазолил, фенилтиазолил, хлорфенилтиазолил, метоксифенилтиазолил, (метоксифенил)(метил)тиазолил, пиридинилтиазолил, (фенил)(метил)имидазолил, метилоксадиазолил, этилоксадиазолил, метилтиадиазолил, фторфенилтиадиазолил, фурилтиадиазолил, (диметилкарбоксамидо)(метил)тиазолил, (пирролидинилСО)тиазолил, фенилтриазолил, пиридинил, бромпиридинил, хлорпиридинил, (хлор)(фтор)пиридинил, (хлор)(метил)пиридинил, дихлорпиридинил, фторпиридинил, цианопиридинил, (циано)(метил)пиридинил, (циано)(диметил)пиридинил, метоксипиридинил, (метилпирролидинил)пиридинил, фенилпиридинил, метоксипиридинилпиридинил, пиридазинил, бромпиридазинил, хлорпиридазинил, метилпиридазинил, метоксипиридазинил, метилтиопиридазинил, пирролидинилпиридазинил, пирролидинонилпиридазинил, фенилпиридазинил, пиридинилпиридазинил, метоксипиридинилпиридазинил, пиримидинил, (бром)(изопропил)пиримидинил, (бром)(диметил)пиримидинил, (бром)(циклопропил)пиримидинил, (бром)(метокси)пиримидинил, (бром)(фенил)пиримидинил, (бром)(пиридинил)пиримидинил, хлорпиримидинил, (хлор)(диметил)пиримидинил, (метил)(метокси)пиримидинил, метилпиримидинил, этилпиримидинил, (метил)(фенил)пиримидинил, диметилпиримидинил, бутилпиримидинил, изопропилпиримидинил, циклопропилпиримидинил, метоксипиримидинил, диметоксипиримидинил, изопропоксипиримидинил, циклопентоксипиримидинил, дифторметоксипиримидинил, трифторэтоксипиримидинил, феноксипиримидинил, метилтиопиримидинил, фенилпиримидинил, хлорфенилпиримидинил, метилфенилпиримидинил, метоксифенилпиримидинил, (фенил)(триазолил)пиримидинил, пиридинилпиримидинил, метоксипиридинилпиримидинил, метоксипиримидинилпиримидинил, нафтилпиримидинил, пиразинил, бромпиразинил, (бром)(метокси)пиразинил, хлорпиразинил, метилпиразинил, диметилпиразинил, бутилпиразинил, цианопиразинил, метоксипиразинил, изопропоксипиразинил, трифторметилпиразинил, и фенилпиразинил, и диметилтриазинил;
или его фармацевтически приемлемая соль.
3. Соединение по п.1, в котором R1 выбирают из группы, содержащей диметилпиридиноизоксазолил, бензоксазолил, хлорбензоксазолил, фторфенилбензоксазолил, этилфенилбензоксазолил, диметиламинофенилбензоксазолил, пиридинилбензоксазолил, бензотиазолил, ацетамидобензотиазолил, бромбензотиазолил, хлорбензотиазолил, (хлор)(метил)бензотиазолил, (хлор)(метокси)бензотиазолил, фторбензотиазолил, дифторбензотиазолил, цианобензотиазолил, метилбензотиазолил, диметилбензотиазолил, (метил)(метокси)бензотиазолил, этилбензотиазолил, трифторметилбензотиазолил, гидроксибензотиазолил, метоксибензотиазолил, этоксибензотиазолил, изопропоксибензотиазолил, трифторметоксибензотиазолил, дифторметоксибензотиазолил, диметоксибензотиазолил, морфолинилбензотиазолил, (пирролидинилСО)бензотиазолил, метилсульфонилбензотиазолил, хлортиазолопиридинил, диметилтиазолопиридинил, бензилокситиазолопиридинил, дифторметокситиазолопиридинил, бензотриазолил, индолонил, индазолил, броминдазолил, хлориндазолил, фториндазолил, (метил)(метокси)индазолил, метоксииндазолил, трифторметилиндазолил, трифторметоксииндазолил, дифторметоксииндазолил, бензимидазолил, фторбензимидазолил, метилбензимидазолил, (метил)(метокси)бензимидазолил, метоксибензимидазолил, тетрагидробензотиазолил, фуропиридинил, диметилфуропиримидинил, тиенопиримидинил, изопропилтиенопиримидинил, диметилтиенопиримидинил, хлортриазолопиридинил, метилтриазолопиридинил, трифторметилтриазолопиридинил, метокситриазолопиридинил, триазолопиразинил, бромпирролотриазинил, диметиламинотиазолопиримидинил, тиазолпиразинил, бромтиазолпиразинил, метокситиазолпиразинил, метилтиотиазолпиразинил, метокситиазолопиримидинил, (метил)(метокси)тиазолопиримидинил, хинолинил, бромхинолинил, фторхинолинил, метилхинолинил, (метил)(метокси)хинолинил, изохинолинил, бромизохинолинил, дихлоризохинолинил, метилизохинолинил, диметилизохинолинил, хиноксалинил, хлорхиноксалинил, метилхиноксалинил, метоксихиноксалинил, хиназолинил, бромхиназолинил, нафтиридинил, 5,6-дигидробензо[h]хиназолинил, 5Н-хромено[4,3-d]пиримидинил, 6,7-дигидро-5Н-циклопента[d]пиримидинил, 5,6,7,8-тетрагидрохиназолинил и 7,8-дигидрохиназолин-5(6Н)-онил;
или его фармацевтически приемлемая соль.
4. Соединение по п.1, в котором R1 выбирают из группы, содержащей фенилтиазолил, (хлор)(метил)пиридинил, (бром)(фенил)пиримидинил, метоксипиримидинил, дифторметоксипиримидинил, дифторэтоксипиримидинил, циклопентоксипиримидинил, (метилфенил)пиримидинил, (метоксифенил)пиримидинил, бромпиразинил, хлорпиразинил, метилтиопиразинил, метоксибензотиазолил, этоксибензотиазолил, дифторметоксибензотиазолил, тиазолопиридинолил, трифторметилиндазолил, бензимидазолил, изохинолинил и хиназолинил;
или его фармацевтически приемлемая соль.
5. Стереоизомер соединения по п.1 формулы Ia
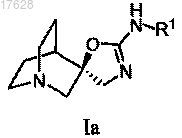
или его фармацевтически приемлемая соль.
6. Соединение по п.5, в котором R1 выбирают из группы, содержащей диметилизоксазолил, (метил)(фенил)изоксазолил, метилпиразолил, диметилпиразолил, тиенилпиразолил, метоксифенилпиразолил, тиазолил, бромтиазолил, цианотиазолил, метилтиазолил, диметилтиазолил, (метил)(фенил)тиазолил, изопропилтиазолил, бутилтиазолил, бензилтиазолил, метоксифенилметилтиазолил, фенилтиазолил, хлорфенилтиазолил, метоксифенилтиазолил, (метоксифенил)(метил)тиазолил, пиридинилтиазолил, (фенил)(метил)имидазолил, метилоксадиазолил, этилоксадиазолил, метилтиадиазолил, фторфенилтиадиазолил, фурилтиадиазолил, (диметилкарбоксамидо)(метил)тиазолил, (пирролидинилСО)тиазолил, фенилтриазолил, пиридинил, бромпиридинил, хлорпиридинил, (хлор)(фтор)пиридинил, (хлор)(метил)пиридинил, дихлорпиридинил, фторпиридинил, цианопиридинил, (циано)(метил)пиридинил, (циано)(диметил)пиридинил, метоксипиридинил, (метилпирролидинил)пиридинил, фенилпиридинил, метоксипиридинилпиридинил, пиридазинил, бромпиридазинил, хлорпиридазинил, метилпиридазинил, метоксипиридазинил, метилтиопиридазинил, пирролидинилпиридазинил, пирролидинонилпиридазинил, фенилпиридазинил, пиридинилпиридазинил, метоксипиридинилпиридазинил, пиримидинил, (бром)(изопропил)пиримидинил, (бром)(диметил)пиримидинил, (бром)(циклопропил)пиримидинил, (бром)(метокси)пиримидинил, (бром)(фенил)пиримидинил, (бром)(пиридинил)пиримидинил, хлорпиримидинил, (хлор)(диметил)пиримидинил, (метил)(метокси)пиримидинил, метилпиримидинил, этилпиримидинил, (метил)(фенил)пиримидинил, диметилпиримидинил, бутилпиримидинил, изопропилпиримидинил, циклопропилпиримидинил, метоксипиримидинил, диметоксипиримидинил, изопропоксипиримидинил, циклопентоксипиримидинил, дифторметоксипиримидинил, трифторэтоксипиримидинил, феноксипиримидинил, метилтиопиримидинил, фенилпиримидинил, хлорфенилпиримидинил, метилфенилпиримидинил, метоксифенилпиримидинил, (фенил)(триазолил)пиримидинил, пиридинилпиримидинил, метоксипиримидинилпиримидинил, метоксипиримидинилпиримидинил, нафтилпиримидинил, пиразинил, бромпиразинил, (бром)(метокси)пиразинил, хлорпиразинил, метилпиразинил, диметилпиразинил, бутилпиразинил, цианопиразинил, метоксипиразинил, изопропоксипиразинил, трифторметилпиразинил и фенилпиразинил и диметилтриазинил;
или его фармацевтически приемлемая соль.
7. Соединение по п.5, в котором R1 выбирают из группы, содержащей диметилпиридиноизоксазолил, бензоксазолил, хлорбензоксазолил, фторфенилбензоксазолил, этилфенилбензоксазолил, диметиламинофенилбензоксазолил, пиридинилбензоксазолил, бензотиазолил, ацетамидобензотиазолил, бромбензотиазолил, хлорбензотиазолил, (хлор)(метил)бензотиазолил, (хлор)(метокси)бензотиазолил, фторбензотиазолил, дифторбензотиазолил, цианобензотиазолил, метилбензотиазолил, диметилбензотиазолил, (метил)(метокси)бензотиазолил, этилбензотиазолил, трифторметилбензотиазолил, гидроксибензотиазолил, метоксибензотиазолил, этоксибензотиазолил, изопропоксибензотиазолил, трифторметоксибензотиазолил, дифторметоксибензотиазолил, диметоксибензотиазолил, морфолинилбензотиазолил, (пирролидинилСО)бензотиазолил, метилсульфонилбензотиазолил, хлортиазолопиридинил, диметилтиазолопиридинил, бензилокситиазолопиридинил, дифторметокситиазолопиридинил, бензотриазолил, индолонил, индазолил, броминдазолил, хлориндазолил, фториндазолил, (метил)(метокси)индазолил, метоксииндазолил, трифторметилиндазолил, трифторметоксииндазолил, дифторметоксииндазолил, бензимидазолил, фторбензимидазолил, метилбензимидазолил, (метил)(метокси)бензимидазолил, метоксибензимидазолил, тетрагидробензотиазолил, фуропиридинил, диметилфуропиримидинил, тиенопиримидинил, изопропилтиенопиримидинил, диметилтиенопиримидинил, хлортриазолопиридинил, метилтриазолопиридинил, трифторметилтриазолопиридинил, метокситриазолопиридинил, триазолопиразинил, бромпирролотриазинил, диметиламинотиазолопиримидинил, тиазолпиразинил, бромтиазолпиразинил, метокситиазолпиразинил, метилтиотиазолпиразинил, метокситиазолопиримидинил, (метил)(метокси)тиазолопиримидинил, хинолинил, бромхинолинил, фторхинолинил, метилхинолинил, (метил)(метокси)хинолинил, изохинолинил, бромизохинолинил, дихлоризохинолинил, метилизохинолинил, диметилизохинолинил, хиноксалинил, хлорхиноксалинил, метилхиноксалинил, метоксихиноксалинил, хиназолинил, бромхиназолинил, нафтиридинил, 5,6-дигидробензо[h]хиназолинил, 5Н-хромено[4,3-d]пиримидинил, 6,7-дигидро-5Н-циклопента[d]пиримидинил, 5,6,7,8-тетрагидрохиназолинил и 7,8-дигидрохиназолин-5(6Н)-онил;
или его фармацевтически приемлемая соль.
8. Соединение по п.5, в котором R1 выбирают из группы, содержащей фенилтиазолил, (хлор)(метил)пиридинил, (бром)(фенил)пиримидинил, метоксипиримидинил, дифторметоксипиримидинил, дифторэтоксипиримидинил, циклопентоксипиримидинил, (метилфенил)пиримидинил, (метоксифенил)пиримидинил, бромпиразинил, хлорпиразинил, метилтиопиразинил, метоксибензотиазолил, этоксибензотиазолил, дифторметоксибензотиазолил, тиазолопиридинолил, трифторметилиндазолил, бензимидазолил, изохинолинил и хиназолинил;
или его фармацевтически приемлемая соль.
9. Соединение по п.5, в котором R1 выбирают из группы, содержащей тиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, бензотиазолил, тиазолопиридинил, индазолил, бензимидазолил, изохинолинил и хиназолинил, каждый из которых независимо друг от друга замещен 0-3 заместителями, выбранными из группы, содержащей C1-4алкил, C3-7циклоалкил, C1-4галоалкил, C1-4алкокси, C1-4галоалкокси, C3-7циклоалкокси, C1-4алкилтио, фенокси, бензилокси, гало, гидрокси, циано, C1-4алкилсульфонил, NR2R3, пирролидинонил, метилендиокси, фурил, тиенил, триазолил, пиримидинил, нафтил, C1-4алкиламидо, CONR2R3, пиридил, фенил и бензил, и где пиридил, фенил и бензил независимо друг от друга замещены 0-2 заместителями, которые выбирают из группы, содержащей галоген, C1-4алкил, C1-4алкокси, C1-4галоалкил и C1-4галоалкокси, NR2R3;
или его фармацевтически приемлемая соль.
10. Соединение по п.9, в котором R1 выбирают из группы, содержащей пиридинил, пиримидинил, пиразинил, тиазолопиридинил и изохинолинил, каждый из которых независимо друг от друга замещен 0-3 заместителями, которые выбирают из группы, содержащей C1-4алкил, C3-7циклоалкил, C1-4галоалкил, C1-4алкокси, C1-4галоалкокси, C3-7циклоалкокси, C1-4алкилтио, фенокси, бензилокси, гало, гидрокси, циано, C1-4алкилсульфонил, NR2R3, пирролидинонил, метилендиокси, фурил, тиенил, триазолил, пиримидинил, нафтил, C1-4алкиламидо, CONR2R3, пиридил, фенил и бензил, и где пиридил, фенил и бензил независимо друг от друга замещены 0-2 заместителями, выбранными из группы, содержащей гало и C1-4алкил, C1-4алкокси,
C1-4галоалкил, C1-4галоалкокси, NR2R3,
или его фармацевтически приемлемая соль.
11. Соединение по п.10, в котором R1 выбирают из группы, содержащей пиридинил и изохинолинил, которые независимо друг от друга замещены 0-3 заместителями, выбранными из группы, содержащей
C1-4алкил, C3-7циклоалкил, C1-4галоалкил, C1-4алкокси, C1-4галоалкокси, C3-7циклоалкокси, C1-4алкилтио, фенокси, бензилокси, гало, гидрокси, циано, C1-4алкилсульфонил, NR2R3, пирролидинонил, метилендиокси, фурил, тиенил, триазолил, пиримидинил, нафтил, C1-4алкиламидо, CONR2R3, пиридил, фенил и бензил, и где пиридил, фенил и бензил независимо друг от друга замещены 0-2 заместителями, выбранными из группы, содержащей галоген, C1-4алкил, C1-4алкокси, C1-4галоалкил, C1-4галоалкокси и NR2R3;
или его фармацевтически приемлемая соль.
12. Соединение, выбранное из группы, содержащей
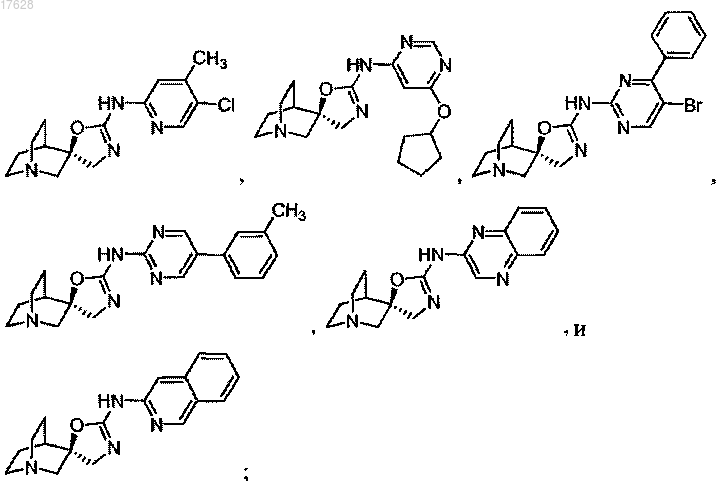
или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
14. Способ лечения шизофрении или болезни Альцгеймера, заключающийся во введении больному терапевтически эффективного количества соединения по п.1.
Текст
СОЕДИНЕНИЯ ХИНУКЛИДИНА В КАЧЕСТВЕ ЛИГАНДОВ НИКОТИНОВОГО АЦЕТИЛХОЛИНОВОГО РЕЦЕПТОРА 7 Изобретение относится к соединениям формулы I, включая их соли, а также композициям и способам применения соединений. Соединения являются лигандами никотинового рецептора 7 и могут использоваться в лечении различных расстройств центральной нервной системы, особенно аффективных и нейродегенеративных расстройств. 017628 Область техники Данное описание в целом относится к соединениям формулы I, включая их соли, а также композициям и применению этих соединений. Эти соединения являются лигандами никотинового рецептора 7 и могут быть полезны при лечении различных заболеваний центральной нервной системы, особенно аффективных расстройств и нейродегенеративных заболеваний. Уровень техники Шизофрения - серьезное психическое заболевание, которым страдает примерно 1% населения. Его прогрессирующее течение ведет к тяжелым нарушениям психических и социальных функций и часто приводит к развитию других заболеваний. Часто отмечается наследственная предрасположенность, при этом важную роль играют генетические факторы и факторы внешней среды. Прямые и непрямые потери, обусловленные этим заболеванием, оцениваются только в США в десятки миллиардов долларов ежегодно. У больных шизофренией повышен риск суицида (примерно 10% на протяжении жизни). У них в 2,5 раза повышена общая смертность, что ведет к 20% снижению продолжительности жизни. Начало заболевания может приводить к появлению каскада факторов нездорового образа жизни и поведению, которые повышают риск различных нарушений и, в итоге, риск смерти. Шизофрения чаще всего начинается в позднем подростковом или молодом возрасте, и на протяжении жизни отмечаются рецидивы. Для этого заболевания характерны три группы симптомов: продуктивные, негативные и когнитивные. Психотические или продуктивные симптомы включают бред, галлюцинации, дезорганизацию мышления и паранойю. Негативные симптомы включают негативный аффект,социальную изоляцию и агедонию. Когнитивные нарушения включают нарушения внимания, ухудшение памяти и нарушения адаптации. Патофизиология шизофрении изучена не полностью, однако большинство специалистов считают ее мультифакториальным заболеванием, когда играют роль биологические,генетические и внешние факторы. Большинство современных схем лечения нацелены на дофаминергическую систему, и благодаря этому факту предполагается, что некоторые аспекты шизофрении обусловлены избытком дофаминергической афферентной импульсации. Эта теория находит дополнительные подтверждения из того факта, что лекарственные средства, которые повышают уровень дофамина, вызывают психозы, схожие с продуктивными симптомами этого заболевания. Также исследования головного мозга умерших больных шизофренией указывают на увеличенное число D2-дофаминовых рецепторов. Несмотря на то, что за последнее десятилетие появились новые антипсихотические средства, известные как атипичные антипсихотики, которые действуют на несколько других рецепторов нейромедиаторов,эти средства также обладают активностью в отношении D2-дофаминовых рецепторов. Также все используемые на сегодняшний день средства имеют серьезные недостатки. Несмотря на то, что продуктивные симптомы обычно удается устранить у большинства больных, эти средства практически не действуют на негативные симптомы и нарушения когнитивной функции, которые встречаются часто и зачастую являются самыми тяжелыми. Кроме того, антипсихотические средства имеют ряд нежелательных и ограничивающих их применение побочных эффектов. Никотин - одно из нескольких средств, которые влияют на когнитивную функцию. Многие шизофреники курят; курильщики среди больных встречаются в 2-4 раза чаще, чем среди населения в целом, а среди больных, госпитализированных в психиатрические стационары, доля курильщиков доходит до 90%. Курение считают формой самолечения. Болезнь Альцгеймера - прогрессирующее нейродегенеративное заболевание, ведущее к утрате всех когнитивных функций. Его частота увеличивается с возрастом, при этом по оценкам некоторой степенью деменции страдает 25-50% людей старше 85 лет. Диагноз болезни Альцгеймера означает, что продолжительность оставшейся жизни снижена вдвое по сравнению со здоровыми взрослыми людьми. Клинически болезнь Альцгеймера проявляется прогрессирующим ухудшением когнитивных функций, снижением способности выполнять повседневные обязанности и нейропсихическими нарушениям или поведенческими расстройствами. На поздних стадиях заболевания ухудшение функции мышц и подвижности могут приводить к невозможности самостоятельно питаться, и, в конце концов, больной становится прикованным к постели. Речь становится сильно дезорганизованной, а затем утрачивается. Больные не могут выполнять даже простые задания без посторонней помощи и требуют постоянного наблюдения. Расходы на уход в специализированных учреждениях могут составлять до 70% расходов, связанных с заболеванием. Таким образом, настоятельно требуются препараты, которые могут улучшать когнитивную функцию и отсрочивать помещение больных в специальные интернаты. Никотиновые-ацетилхолиновые рецепторы (нАц-Р) - это ионные каналы с пентамерными лигандами, которые широко экспрессируются в центральной и периферической нервной системе. Эти каналы относятся к быстрым кальциевым каналам, которые, будучи открытыми, увеличивают внутриклеточную концентрацию иона Са 2+. Несмотря на то, что имеется 12 отдельных рецепторов, в наибольшей степени в головном мозге распространены рецепторы 42 и 7. Комплекс 42 идентифицирован как "высокоаффинный" никотиновый сайт. Гомопентамерный рецептор 7 селективно связывает естественный продукт, -бунгаротоксин, который удалось относительно легко обнаружить и измерить. Рецептор 7 в основном экспрессируется в коре головного мозга, гиппокампе и подкорковой лимбической системе и ча-1 017628 ще всего на пресинаптическом уровне. Обнаружение нАц-Р 7 в областях, участвующих в обучении и формировании памяти, привела к проведению исследований, включающих мышей с выключенными генами и фармакологические вмешательства. Изучали афферентную импульсацию, память и пластичность нейронов. Как показано, соединения, которые селективно связывают рецептор 7, улучшают функции обучения и памяти у здоровых и старых животных, устраняют нарушения памяти, вызванные скополамином, устраняют нарушения афферентной импульсации, вызванные различными препаратами, и проявляют некоторые анксиолитические свойства. Также показано, что рецептор 7 участвует в уменьшении воспаления с участием блуждающего нерва. Как показано в нескольких исследованиях, болезнь Альцгеймера сопровождается снижением числа никотиновых рецепторов в коре головного мозга и гиппокампе. Инъекции никотина или никотинсодержащие пластыри существенно улучшали внимание, память и обучение у больных с болезнью Альцгеймера. В то время как при болезни Альцгеймера имеется прогрессирующая утрата никотиновых рецепторов, 7-нейроны страдают в меньшей степени по сравнению с относительно обильными рецепторами 4. Недавно показано, что введение селективных агонистов никотинового рецептора 7 улучшает когнитивные функции у больных с болезнью Альцгеймера, когда курс лечения длится 8 недель. В следующих ссылках приведены общие обзоры системы никотиновых рецепторов и рецепторов 7 и их лигандов: Picciotto, Zoli, J. Neurobio, (2002) 53:641-655; Brening, et al. Ann. Reports in Med. Chem.(2007) 151:915-929; Romanelli, et al. Chem. Med. Chem. (2007) 2(6):746-767. Описаны лиганды никотинового рецептора 7. См. европейские патенты 452101, 337547, WO 2003/092580, WO 2004/000,469, заявку на патент США 2007004715, и C.J. Swain, et al. J. Med. Chem.(1992) 35: 1019-1031. Настоящее изобретение дает технические преимущества, например, эти соединения являются новыми и эффективными против вируса гепатита С. Кроме того, эти соединения имеют преимущества при использовании в качестве лекарственных средств, например, в отношении одного или нескольких механизмов действия, связывания, эффективности торможения, селективности действия, растворимости,профилей безопасности или биодоступности. Сущность изобретения Настоящее изобретение относится к соединениям формулы I, включая фармацевтически приемлемые соли, а также композиции и методы лечения с использованием этих соединений. Эти соединения могут быть полезны при лечении различных заболеваний центральной нервной системы. Один аспект настоящего изобретения представляет собой соединение формулы I или его стереоизомер где R1 выбирают из группы, содержащей изоксазолил, пиразолил, оксазолил, тиазолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, пиридинил, пиразинил, пиридазинил, пиримидинил, триазинил,хинолинил, изохинолинил, хиноксалинил, хиназолинил, нафтиридинил, индазолил, индолил, 2 индолонил, бензизоксазолил, бензоизотиазолил, бензоксазолил, бензотиазолил, бензимидазолил, фуропиридинил, тиенопиридинил, тиенопиримидинил, изотиазолопиридинил, тиазолопиридинил, тиазолопиридинолил, тиазолопиразинил, тиазолопиримидинил, триазолопиридинил, триазолопиразинил, пирролотриазинил, 5,6-дигидробензо[b]хиназолинил, 5 Н-хромено[4,3-d]пиримидинил, 6,7-дигидро-5 Нцилопента[d]пиримидинил, 5,6,7,8-тетрагидрохиназолинил, 7,8-дигидрохиназолин-5(6 Н)-онил и тетрагидробензотиазолил, и замещен независимо друг от друга замещающими группами 0-3, которые выбирают из группы, содержащей C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C1-4 алкокси, C1-4 алоалкокси C3-7 циклоалкокси, C1-4 алкилтио, фенокси, бензилокси, гало, гидрокси, циано, C1-4 алкилсульфонил, NR2R3,пирролидинонил, метилендиокси, фурил, тиенил, триазолил, пиримидинил, нафтил, C1-4 алкиламидо,CONR2R3, пиридил, фенил и бензил, и где пиридил, фенил и бензил замещены независимо друг от друга замещающими группами 0-2, которые выбирают из группы, содержащей галоген, C1-4 алкил, C1-4 алкокси,C1-4 галоалкил, C1-4 галоалкокси и NR2R3; или их фармацевтически приемлемую соль;R3 - водород, C1-4 алкил, C1-4 гидроксиалкил или C1-4 аминоалкил; или R2 и R3 вместе с атомом азота, к которому они присоединены, - аксетидинил, пирролидинил,пиперидинил, пиперазинил, N-(C1-4 алкил)пиперазинил, морфолинил или гомопиперидинил; или их фармацевтически приемлемую соль. Другой аспект настоящего изобретения относится к стереоизомеру формулы I согласно формуле Ia Другой аспект настоящего изобретения относится к соединению формулы I или Ia, где R1 выбирают из группы, содержащей диметилизоксазолил, (метил)(фенил)изоксазолил, метилпиразолил, диметилпиразолил, тиенилпиразолил, метоксифенилпиразолил, тиазолил, бромтиазолил, цианотиазолил, метилтиазолил, диметилтиазолил, (метил)(фенил)тиазолил, изопропилтиазолил, бутилтиазолил, бензилтиазолил,метоксифенилметилтиазолил, фенилтиазолил, хлорфенилтиазолил, метоксифенилтиазолил, (метоксифенил)(метил)тиазолил, пиридинилтиазолил, (фенил)(метил)имидазолил, метилоксадиазолил, этилоксадиазолил, метилтиадиазолил, фторфенилтиадиазолил, фурилтиадиазолил, (диметилкарбоксамидо)(метил) тиазолил, (пирролидинилСО)тиазолил, фенилтриазолил, пиридинил, бромпиридинил, хлорпиридинил,(хлор)(фтор)пиридинил, (хлор)(метил)пиридинил, дихлорпиридинил, фторпиридинил, цианопиридинил,(циано)(метил)пиридинил, (циано)(диметил)пиридинил, метоксипиридинил, (метилпирролидинил)пиридинил, фенилпиридинил, метоксипиридинилпиридинил, пиридазинил, бромпиридазинил, хлорпиридазинил, метилпиридазинил, метоксипиридазинил, метилтиопиридазинил, пирролидинилпиридазинил, пирролидинонилпиридазинил, фенилпиридазинил, пиридинилпиридазинил, метоксипиридинилпиридазинил,пиримидинил, (бром)(изопропил)пиримидинил, (бром)(диметил)пиримидинил, (бром)(циклопропил) пиримидинил, (бром)(метокси)пиримидинил, (бром)(фенил)пиримидинил, (бром)(пиридинил)пиримидинил, хлорпиримидинил, (хлор)(диметил)пиримидинил, (метил)(метокси)пиримидинил, метилпиримидинил, этилпиримидинил, (метил)(фенил)пиримидинил, диметилпиримидинил, бутилпиримидинил, изопропилпиримидинил, циклопропилпиримидинил, метоксипиримидинил, диметоксипиримидинил, изопропоксипиримидинил, циклопентоксипиримидинил, дифторметоксипиримидинил, трифторэтоксипиримидинил, феноксипиримидинил, метилтиопиримидинил, фенилпиримидинил, хлорфенилпиримидинил, метилфенилпиримидинил, метоксифенилпиримидинил, (фенил)(триазолил)пиримидинил, пиридинилпиримидинил, метоксипиридинилпиримидинил, метоксипиримидинилпиримидинил, нафтилпиримидинил, пиразинил, бромпиразинил, (бром)(метокси)пиразинил, хлорпиразинил, метилпиразинил, диметилпиразинил, бутилпиразинил, цианопиразинил, метоксипиразинил, изопропоксипиразинил, трифторметилпиразинил и фенилпиразинил и диметилтриазинил,или их фармацевтически приемлемой соли. Другой аспект настоящего изобретения относится к соединению формулы I или Ia, где R1 выбирают из группы, содержащей диметилпиридиноизоксазолил, бензоксазолил, хлорбензоксазолил, фторфенилбензоксазолил, этилфенилбензоксазолил, диметиламинофенилбензоксазолил, пиридинилбензоксазолил,бензотиазолил, ацетамидобензотиазолил, бромбензотиазолил, хлорбензотиазолил, (хлор)(метил)бензотиазолил, (хлор)(метокси)бензотиазолил, фторбензотиазолил, дифторбензотиазолил, цианобензотиазолил, метилбензотиазолил, диметилбензотиазолил, (метил)(метокси)бензотиазолил, этилбензотиазолил,трифторметилбензотиазолил, гидроксибензотиазолил, метоксибензотиазолил, этоксибензотиазолил, изопропоксибензотиазолил, трифторметоксибензотиазолил, дифторметоксибензотиазолил, диметоксибензотиазолил, морфолинилбензотиазолил, (пирролидинилСО)бензотиазолил, метилсульфонилбензотиазолил,хлортиазолопиридинил, диметилтиазолопиридинил, бензилокситиазолопиридинил, дифторметокситиазолопиридинил, бензотриазолил, индолоннил, индазолил, броминдазолил, хлориндазолил, фториндазолил, (метил)(метокси)индазолил, метоксииндазолил, трифторметилиндазолил, трифторметоксииндазолил, дифторметоксииндазолил, бензимидазолил, фторбензимидазолил, метилбензимидазолил, (метил)(метокси)бензимидазолил, метоксибензимидазолил, тетрагидробензотиазолил, фуропиридинил, диметилфуропиримидинил, тиенопиримидинил, изопропилтиенопиримидинил, диметилтиенопиримидинил, хлортриазолопиридинил, метилтриазолопиридинил, трифторметилтриазолопиридинил, метокситриазолопиридинил, триазолопиразинил, бромпирролотриазинил, диметиламинотиазолопиримидинил,тиазолпиразинил, бромтиазолпиразинил, метокситиазолпиразинил, метилтиотиазолпиразинил, метокситиазолопиримидинил, (метил)(метокси)тиазолопиримидинил, хинолинил, бромхинолинил, фторхинолинил, метилхинолинил, (метил)(метокси)хинолинил, изохинолинил, бромизохинолинил, дихлоризохинолинил, метилизохинолинил, диметилизохинолинил, хиноксалинил, хлорхиноксалинил, метилхиноксалинил, метоксихиноксалинил, хиназолинил, бромхиназолинил, нафтиридинил, 5,6-дигидробензо[b]хиназолинил, 5 Н-хромено[4,3-d]пиримидинил, 6,7-дигидро-5 Н-цилопента[d]пиримидинил, 5,6,7,8-тетрагидрохиназолинил и 7,8-дигидрохиназолин-5(6 Н)-онил, или их фармацевтически приемлемой соли. Другой аспект настоящего изобретения относится к соединению формулы I или Ia, где R1 выбирают из группы, содержащей фенилтиазолил, (хлор)(метил)пиридинил, (бром)(фенил)пиримидинил, метоксипиримидинил, дифторметоксипиримидинил, дифторэтоксипиримидинил, циклопентоксипиримидинил,(метилфенил)пиримидинил, (метоксифенил)пиримидинил, бромпиразинил, хлорпиразинил, метилтиопиразинил, метоксибензотиазолил, этоксибензотиазолил, дифторметоксибензотиазолил, тиазолопиридинолил, трифторметилиндазолил, бензимидазолил, изохиноинил и хиназолинил, или их фармацевтически-3 017628 приемлемой соли. Другой аспект настоящего изобретения относится к соединению формулы I или Ia, где R1 выбирают из группы, содержащей тиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, бензотиазолил,тиазолопиридинил, индазолил, бензимидазолил, изохиноинил и хиназолинил, и замещен независимо друг от друга замещающими группами 0-3, которые выбирают из группы, содержащей C1-4 алкил С 3-7 циклоалкил, C1-4 галоалкил, C1-4 алкокси, C1-4 галоалкокси С 3-7 циклоалкокси, C1-4 алкилтиофенокси, бензилокси, гало, гидрокси, циано, C1-4 алкилсульфонил, NR2R3, пирролидинонил, метилендиокси, фурил, тиенил, триазолил, пиримидинил, нафтил, C1-4 алкиламидо, CONR2R3, пиридил, фенил и бензил, и где фенил и бензил замещены независимо друг от друга замещающими группами 0-2, которые выбирают из группы, содержащей галоген, C1-4 галоалкокси и NR2R3, или их фармацевтически приемлемой соли. Другой аспект настоящего изобретения относится к соединению формулы I или Ia, где R1 выбирают из группы, содержащей пиридинил, пиримидинил, пиразинил, тиазолопиридинил и изохиноинил, и замещен независимо друг от друга замещающими группами 0-3, которые выбирают из группы, содержащей C1-4 алкил, С 3-7 циклоалкил, C1-4 галоалкил, C1-4 алкокси, C1-4 галоалкокси, C3-7 циклоалкокси, C1-4 алкилтиофенокси, бензилокси, гало, гидрокси, циано, C1-4 алкилсульфонил, NR2R3, пирролидинонил, метилендиокси, фурил, тиенил, триазолил, пиримидинил, нафтил, C1-4 алкиламидо, CONR2R3, пиридил, фенил и бензил, и где пиридил, фенил и бензил замещены независимо друг от друга замещающими группами 0-2,которые выбирают из группы, содержащей галоген, C1-4 алкил, C1-4 алкокси, C1-4 галоалкил, C1-4 галоалкокси и NR2R3 или их фармацевтически приемлемой соли. Другой аспект настоящего изобретения относится к соединению формулы I или Ia, где R1 выбирают из группы, содержащей пиридинил и изохиноинил, и замещен независимо друг от друга замещающими группами 0-3, которые выбирают из группы, содержащей C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C1-4 алкокси, C1-4 галоалкокси, C3-7 циклоалкокси, C1-4 алкилтио, фенокси, бензилокси, гало, гидрокси, циано,C1-4 алкилсульфонил, NR2R3, пирролидинонил, метилендиокси, фурил, тиенил, триазолил, пиримидинил,нафтил, C1-4 алкиламидо, CONR2R3, пиридил, фенил и бензил, и где пиридил, фенил и бензил замещены независимо друг от друга замещающими группами 0-2, которые выбирают из группы, содержащей галоген, C1-4 алкил, C1-4 алкокси, C1-4 галоалкил, C1-4 галоалкокси и NR2R3, или их фармацевтически приемлемой соли. Другой аспект настоящего изобретения относится к соединению, которое выбирают из группы, содержащей или его фармацевтически приемлемой соли. Другой аспект настоящего изобретения относится к соединению формулы I, где R1 выбирают из группы, содержащей тиазол, тиадиазол, изоксазол, оксазол, пиразол, имидазол, пиридин, пиразин, пиридазин, пиримидин, хинолон, изохинолон, хиноксалин, индазол, индол, 2-индолон, бензотиазол, бензимидазол, бензоксазол, бензо(d)изотиазол, бензизоксазол, изотиазол[5,4-b]пиридин, (1,2,4)триазол[1,5 а]пиридине, тиазол[5,4-b]пиридине и тетрагидробензотиазол, где каждая группа может быть замещена одной или двумя замещающими группами, которые выбирают из группы, содержащей C1-4 алкил, C1-4 алкокси, галоген, гидрокси, циано, трифторметил, дифторметил, фторметил, трифторметокси, дифторметокси, C1-4 алкилсульфонил, фурил, морфолино, метилендиокси, пиридил, C1-4 алкилфенил, галофенил,диметиламинофенил, C1-4 алкиламидо, -CONR2R3, где R2 и R3 представляют собой независимо друг от друга водород, C1-4 алкил, гидрокси, аминоС 1-4 алкил, или R2 и R3 вместе с атомом, к которому они присоединены, представляют собой C3-6 циклоалкил, фенил, замещенный фенил, фенилметил, замещенный фенилметил, где вышеуказанный замещенный фенил и замещенный фенилметил замещены независимо друг от друга замещающими группами, которые выбирают из группы, содержащей галоген, C1-4 алкил, C1-4 алкокси, трифторметил и трифторметокси, или его фармацевтически приемлемой соли. В отношении соединения формулы I или Ia диапазон любого варианта вариабельной замещающей-4 017628 группы, включая R1, R2 и R3, можно использовать независимо друг от друга с диапазоном любого другого варианта вариабельной замещающей группы. По существу, настоящее изобретение включает комбинации этих различных аспектов. Если не указано иначе, эти термины употребляются в следующих значениях: "алкил" означает прямую или разветвленную алкильную группу, состоящую из 1-4 атомов углерода, "алкенил" означает прямую или разветвленную алкильную группу, состоящую из 2-4 атомов углерода, по крайней мере с одной двойной связью, "циклоалкил" означает моноциклическую кольцевую систему, состоящую из 3-7 атомов углерода, "галоалкил" или "галоалкокси" включает все галогенированные изомеры от моногало- до пергало. Термины с углеводородной группой (например, алкокси) включают прямые и разветвленные изомеры углеводородной части. Термины в одиночных и множественных скобках предназначены для четкого обозначения соотношения связей для специалиста в данной области техники. Например, такой термин как R)алкил) означает алкильную замещающую группу, дополнительно замещенную замещающей группой R. Настоящее изобретение включает все формы фармацевтически приемлемых солей этих соединений. Фармацевтически приемлемые соли - это те соли, в которых ионы, заряженные с противоположным знаком, существенно не влияют на физиологическую активность или токсичность соединений и их функцию в качестве фармакологических эквивалентов. Эти соли можно получать согласно методикам, общеизвестным в органической химии, с использованием готовых реагентов. Некоторые формы анионных солей включают ацетат, ацистрат, безилат, бромид, хлорид, цитрат, фумарат, глюкуронат, гидробромид, гидрохлорид, гидройодид, йодид, лактат, малеат, мезилат, нитрат, памоат, фосфат, сукцинат, сульфат, тартрат,тозилат и ксинофоат. Некоторые формы катионных солей включают аммоний, алюминий, бензатин, висмут, кальций, холин, диэтиламин, диэтаноламин, литий, магний, меглумин, 4-фенилциклогексиламин,пиперазин, калий, натрий, трометамин и цинк. Некоторые из соединений настоящего изобретения существуют в форме стереоизомеров. Настоящее изобретение включает все стереоизомерные формы соединений, включая энантиомеры и диастереоизомеры. Методики получения и разделения стереоизомеров известны в данной области техники. Настоящее изобретение включает все таутомерные формы этих соединений. Пример таутомерной пары приведен ниже Эти соединения могут быть получены согласно методикам, известным в данной области техники,включая описанные ниже и включая варианты, известные в данной области техники. Некоторые реагенты и промежуточные соединения известны в данной области техники. Другие реагенты и промежуточные соединения можно получить согласно методикам, известным в данной области техники, с использованием общедоступных материалов. Вариабельные группы (например, пронумерованные замещающие группы R) используются для описания процесса синтеза соединений и предназначены только для иллюстрации, как получать эти соединения, и их не следует путать с вариабельными группами, использованными в формуле изобретения или других разделах данного описания. Следующие методики предназначены для иллюстративных целей и не налагают каких-либо ограничений на настоящее изобретение. Некоторые из этих соединений можно получить, используя реакции и методики, описанные в данном разделе. Реакции проводят в растворителях, соответствующих использующимся реагентам и материалам, и они пригодны для осуществляемых превращений. Специалисту в области органического синтеза понятно, что функциональные группы, присутствующие на различных частях молекулы, должны быть совместимы с предложенными реагентами и реакциями. Такие ограничения в отношении замещающих групп, совместимых с условиями реакций, будут очевидны для специалиста в данной области техники, и необходимо использовать другие методики. Сокращения, используемые на схемах, обычно соответствуют понятиям, использующимся в данной области техники. Химические сокращения, использующиеся в данном описании и примерах, определены следующим образом: NaHMDS - бис(триметилсили)амид натрия; ДМФ - N,N-диметилформамид; МеОН метанол; NBS - N-бромсукцинимид; Ar - арил; ТФУК - трифторуксусная кислота; LAH - лития алюмогидрид; ВОС, DMSO - диметилсульфоксид; ч - час, кт - комнатная температура или время удержания (в зависимости от контекста); мин - минуты; EtOAc - этилацетат; ТГФ - тетрагидрофуран; EDTA - этилендиаминтетрауксусная кислота; Et2O - диэтиловый эфир; DMAP - 4-диметиламинопиридин; ДХЭ - 1,2 дихлорэтан; АЦН - ацетонитрил; ДМЭ - 1,2-диметоксиэтан; HOBt - гидрат 1-гидроксибензотриазола; ДИПЭ - диизопропилэтиламин, Nf-CF3(CF2)3SO2 и ТМОФ - триметилортоформат. Сокращения, использующиеся в данном документе, определены следующим образом: 1 - однократно, 2 - двукратно, 3 - трехкратно, С - градус Цельсия, экв. - эквивалент или эквиваленты, г -5 017628 грамм или граммы, мг - миллиграмм или миллиграммы, л - литр или литры, мл - миллилитр или миллилитры, мкл - микролитр или микролитры, N - нормальный, моль - молярный, ммоль - миллимоль или миллимоли, мин - минута или минуты, ч - час или часы, кт - комнатная температура, RT - время удержания, атм - атмосфера, фкд - фунт на квадратный дюйм, конц. - концентрат, нас. или нас-й - насыщенный,ММ - молекулярная масса, тп - точка плавления, иэ - избыток энантиомеров, МС или масс-спектр - массспектрометрия, МС-ИЭР - масс-спектрометрия с ионизацией электрораспылением, ВЭ - высокоэффективный, МСВР - масс-спектрометрия высокого разрешения, ЖХ-МС - жидкостная хроматография-массспектрометрия, ВЭЖХ - жидкостная хроматография высокого давления, ОФ ВЭЖХ - обращенно-фазовая ВЭЖХ, ТСХ или тсх - тонкослойная хроматография, ЯМР - ядерно-магнитная резонансная спектроскопия, 1 Н - протон,- дельта, s - синглет, d - дублет, t - триплет, q - квартет, m - множественный, br - широкий, Гц - Герц и , , R, S, Е и Z - стереохимические обозначения, известные специалисту в данной области техники. Схема 1 Соединения формулы I получают, как проиллюстрировано на схеме реакции 1. Кетон формулы III (3-хинуклидон) известен, имеется в продаже или может быть получен с помощью методик, известных специалисту в данной области техники. Этот кетон можно превратить в соответствующий цианогидрин формулы IV с помощью реакции с цианидом натрия или калия плюс кислота. Соединение формулы IV можно восстановить до соответствующего аминометильного соединения (борановый комплекс) формулы V с помощью реакции с комплексом боран/тетрагидрофуран. Соединение формулы V можно включить в реакцию с гетероарилизотиоцианатами прямо в инертном растворителе с получением тиомочевин формулы VI. Или можно провести реакцию между гетероариламином и тиокарбонилдиимидазолом с получением активного соединения, которое можно использовать без выделения для превращения соединения формулы V в соединение формулы VI, гетероариламин можно получить с помощью методик, известных специалисту в данной области техники. Тиомочевину формулы VI можно циклизировать с использованием, например, диизопропилкарбодиимида с получением оксазолина формулы VII, у которого можно снять защиту кислотой с получением рацемического конечного продукта - соединения формулы I. Соединение формулы I можно превратить в-6 017628 чистые энантиомеры соединений формулы Ia и формулы Ib путем, известным в данной области техники,например с помощью хиральной хроматографии. Схема 2 Или свободную аминогруппу хинуклидина формулы V можно блокировать, например, карбобензилоксихлоридом (CBZ-Cl) с получением соединения формулы VIII, как проиллюстрировано на схеме реакции 2. Рацемическое соединение формулы VIII можно разделить на его энантиомеры, формулы IX и формулы X, с помощью, например, хиральной хроматографии. Либо соединение формулы IX или формулы X и предпочтительно соединение формулы X можно использовать далее, как показано на схеме реакции 2. Борановую группу соединения формулы X можно удалить, например, путем обработки разведенной соляной кислотой, и карбобензилоксигруппу можно удалить, например, путем каталитического гидрирования с получением хирального хинуклидинамина формулы XI. Аналогично схеме реакции 1, можно провести реакцию между аминовой солью формулы XI с изотиоцианатами с получением тиомочевины формулы VIa, которую можно включать в реакцию с диалкилкарбодиимидами или смесью тиомочевин(как в реакции с тиокарбонилдиимидазолом) с получением хирального оксазолинхинуклидина соединения формулы Ia и его таутомера формулы IIa. Схема 2 а Или борановую группу V можно удалить соляной кислотой с получением дигидрохлоридной солиXII, которую можно включить в реакцию в присутствии основания с изотиоцианатом с получением промежуточного соединения - тиомочевины XIII, которую затем можно циклизировать, как на схемах реакции 1-2, с получением соединения I, XII можно также получить с помощью других методик, как описано в патенте США 5137895 (8.11.1992). Схема 3 Кроме того, можно провести реакцию между (гетеро)ароматическими аминами с карбондисульфидом, гидроксидом натрия и метилйодидом с получением промежуточного продукта - диметилкарбони-7 017628 мидодитиоатов XIV. С ними проводят реакцию с дигидрохлоридом XI в присутствии основания для удаления двух молей метантиола и прямого получения желаемых продуктов 1 а. Биологические методикиI) Связывание никотинового-ацетилхолинового рецептора 7. Мембраны готовили для связывания с использованием клеток HEK293, стабильно экспрессирующих никотиновый-ацетилхолиновый рецептор 7 крысы (нАХР 7 крысы). Клетки гомогенизировали в гипотонической литическом буфере при 4 С, состоящем из 10 ммоль Трис (рН 7,4), 5 ммоль EDTA и ингибиторов протеазы, и центрифугировали при 32000 g в течение 20 мин. Осадок промывали однократно в буферном растворе для промывания мембран, состоящем из 50 ммоль Трис (рН 7,4), 1 ммоль EDTA и ингибиторов протеазы, и центрифугировали при 32000 g в течение 20 мин. Этот осадок затем вновь взвешивали в буферном растворе для анализа, состоящем из 50 ммоль KH2PO4 (рН 7,4 при 25 С), 1 ммоль EDTA, 0,005% Triton-X 100 0,1% (v/v) коктейля ингибиторов протеазы Sigma. Порции замораживали на сухом льду с этанолом и хранили при -80 С до дня проведения анализа.II) Са 2+-чувствительный флуоресцентный анализ функции канала никотинового-ацетилхолинового рецептора 7 в клетках млекопитающих ('FLIPR). Резюме: основные соединения исследовали на активность в качестве агонистов ионных каналов подтипов никотиновых-ацетилхолиновых рецепторов 7, 34, 42 и 111, экспрессирующихся в клетках млекопитающих HEK293. Активность и эффективность в качестве агонистов определены по показателям кинетической флуоресценции притока Са 2+ с использованием FLIPR (плашечного ридера изображений флуоресценции) с 384 лунками. Полезность флуоресцентных индикаторов при измерении изменений внутриклеточных концентраций двухвалентных ионов, особенно Са 2+, при открытии лекарственных соединений четко задокументирована (Rudiger, R., et al. H.o.ture Reviews, 2003, 4:579-586; Gonzalez J.E., et als Receptors and Channels. 2002, 8:283-295). В этом анализе клеточные линии HEK, экспрессирующие каналы и помещенные на аналитические плашки с 384 лунками, обрабатывали проникающим через мембраны флуоресцентным Са 2+-индикаторным красителем, чей S10HM-исходящий зеленый сигнал нарастает в ответ на повышение концентрации внутриклеточного Са 2+. Базальную флуоресценцию из клеток отслеживают в режиме реального времени, после чего однократно добавляют исследуемые соединения. Если соединение является агонистом неселективных ионных каналов. Последние открываются и обеспечивают перемещение ионов Са 2+ в клеточную цитоплазму. После чего они связываются с Са 2+индикаторным красителем и дают увеличение выходного сигнала флуоресценции, что фиксирует охлажденная видеокамера CCD. Материалы и методы. Реагенты: ацетометокси(АМ)-эфир Са 2+-индикаторного красителя Fluo-4 получен от компании InVitrogen, (Карлсбад, штат Калифорния). Ацетилхолин и все компоненты буферных растворов закупали у компании Sigma Chemical, Сент-Луис, штат Монтана, G418 и среду Minimal Essential Medium закупали у компании InVitrogen Life Technologies. Карлсбад, штат Калифорния. Сыворотку плода коровы закупали у компании InVitrogen (Карлсбад, штат Калифорния). Клеточная культура: клетки HEK293 культивировали в среде Minimal Essential Medium, содержащей 10% (v/v) сыворотки плода коровы при 37 С в инкубаторе с 5% CO2. Клетки HEK293, стабильно экспрессирующие ионные каналы, выращивали на такой же среде с добавлением 500 мкг/мл G418. Анализ потока Са 2+ в Са 2+-каналах, экспрессирующихся в клетках HEK293: клетки HEK293, экспрессирующие исследуемые ионные каналы, сеяли на плашки с 384 лунками с черными стенками, прозрачным дном и покрытыми поли-D-лизином, с плотностью 20000 клеток/лунка в 20 мкл среды MinimalEssential Medium, содержащей 10% (v/v) сыворотки плода коровы, и инкубировали в течение 2 суток при 29 С в инкубаторе с 5% CO2. До анализа клетки обрабатывали АМ-эфиром Fluo-4. Обработку клеток завершали путем удаления питательной среды и заменяли ее АМ-эфиром красителя, 30 мкг/лунку (5 мкмоль), смешанным с равновесным солевым раствором Хэнкса ( 14175-095), содержащего 20 ммольHEPES, 2,5 ммоль пробеницида, 0,5 ммоль CaCl2, 1 ммоль MgCl2 и 10 мкмоль атропина. Обработку красителем продолжали в течение 90 мин при комнатной температуре. После чего раствор с красителем удаляли и заменяли буфером Хэнкса, 40 мкл/лунку. Обработанные клетки обрабатывали FLIPR384 (Molecular Devices, Саннивейл, штат Калифорния). Краситель Fluo-4 возбуждали аргоновым лазером с длиной волны 488 нм. Эмиссию фильтровали с помощью фильтра с полосой пропускания 54030 нм. Для оценки эффектов исследуемых соединений с помощью анализа потока Са+ исследуемые соединения использовали на готовых аналитических плашках. В отношении клеток, экспрессирующих ионные каналы никотиновых рецепторов, анализ начинали добавлением буфера Хэнкса, 20 мкл/лунку, содержащего исследуемые соединения. В отношении всех анализов данные регистрировали при 1 Гц в течение 10 с (исходные), затем добавляли буферные растворы, содержащие соединения-стимулы, и дальнейшие измерения проводили при 0,33 Гц в течение 3 мин. Анализ данных: статистическую надежность анализов потока Са 2+ через никотиновые рецепторы определяют с помощью пустых растворов и итоговых данных по лункам. Итоговые данные по лункам определяют максимальную активацию каналов для каждой аналитической плашки с соединением (мак-8 017628 симальная эффективная доза ацетилхолина); пустые лунки, которые содержат только аналогичное количество DMSO, определяют нулевую активность каналов. Файлы с необработанными данными по единицам флуоресценции, созданные на ридере плашек FLIPR, автоматически экспортируются и подвергаются обработке с помощью внутренних инструментов для анализа данных. Данные по уменьшению процента активации для каждой концентрации исследуемого соединения подгоняют с помощью программы подгонки MathIQ (ID Business Solutions Limited, Суррей, Великобритания). Данные анализировали путем сопоставления максимальных амплитуд изменений флуоресценции с потоком Са 2+ для заданных условий в отношении исследуемого соединения. Активность (значения EC50) соединений рассчитывают путем усреднения по трем лункам двадцати пунктов CRC. Значения эффективности исследуемых соединений(Ymax) выражают относительно максимальной реакции на ацетилхолин по итоговым данным по всем лункам.III) Количественный анализ Fos. Самцам крыс линии Вистар вводят лекарственное средство (1-1 мкг/кг) или наполнитель (2 мл/кг,подкожно). Через 2 ч после введения крыс быстро обезглавливают, выделяют соответствующие участки головного мозга на льду, взвешивают, замораживают в жидком азоте и хранят при -80 С. Дальнейшую обработку ткани головного мозга для выделения ядер и количественный анализ Fos проводят согласно протоколу, описанному в инструкции к набору для измерения хемилюминесценции, основанному на твердофазном анализе (каталог 89860, набор EZ-detect c-Fos Trans, Pierce Biotechnology Inc., Рокфорд,штат Иллинойс).IV) Тест на нарушения переключения MK-801 у крыс. В этом тесте используется модификация протокола, описанного Stefani с соавт. (Behavioral Neuroscience, 2003, 117: 728-737). Исследуемые соединения изучают на способность устранять нарушения функции, вызванные в тесте MK-801 (0,03 мкг, интраперитонеально, однократное введение). Активность конкретных соединений, описанных в данном документе, исследуют в вышеописанном анализе (II), как отображено в табл. 1. Таблица 1 Активность, определенная по значениям нмоль ЕС 50:= 100 нмоль,=100-1000 нмоль,+ =1000-100000 нмоль,bNT = не исследовали,Н.О. = неактивно (1000000 нмоль). Фармацевтические композиции и способы лечения Соединения формулы I связывают рецептор 7 и могут быть полезны в лечении аффективных расстройств и нейродегенеративных заболеваний. Таким образом, другой аспект настоящего изобретения относится к композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Другой аспект настоящего изобретения относится к применению соединения формулы I в производстве лекарственного средства для лечения аффективных расстройств или нейродегенеративных заболеваний. Другой аспект настоящего изобретения относится к применению соединения формулы I в производстве лекарственного средства для лечения шизофрении или болезни Альцгеймера. Другой аспект настоящего изобретения относится к способу лечения аффективных расстройств или нейродегенеративных заболеваний, заключающемуся во введении терапевтически эффективного количества соединения формулы I. Другой аспект настоящего изобретения относится к способу лечения шизофрении или болезни Альцгеймера, заключающемуся во введении терапевтически эффективного количества соединения формулы I. Другой аспект настоящего изобретения относится к способу лечения шизофрении, заключающемуся во введении терапевтически эффективного количества соединения формулы I. Другой аспект настоящего изобретения относится к способу лечения болезни Альцгеймера, заключающемуся во введении терапевтически эффективного количества соединения формулы I."Больной" означает лицо, пригодное для лечения согласно представлениям специалистов в области аффективных расстройств и нейродегенеративных заболеваний."Лечение", "терапия" и схожие термины используются согласно представлениям специалистов в области аффективных расстройств и нейродегенеративных заболеваний. Соединения настоящего изобретения обычно назначают в виде фармацевтических композиций, содержащих терапевтически эффективное количество соединения или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Фармацевтически приемлемые носители представляют собой традиционно известные носители, обладающие приемлемыми профилями безопасности. К композициям относятся все часто использующиеся твердые и жидкие формы, включая, например, капсулы,таблетки, пастилки и порошки, а также жидкие суспензии, сиропы, эликсиры и растворы. Композиции изготавливают с использованием общеизвестных фармацевтических методик, и, как правило, в композициях используют традиционные наполнители (такие как вяжущие и увлажняющие средства) и наполнители (такие как вода и спирты). См., например, Remington's Pharmaceutical Sciences, Mack PublishingCompany, Easton, PA, 17th edition, 1985. Твердые композиции обычно изготавливают в дозированных формах; предпочтительны композиции, содержащие от 1 до 1000 мг активного ингредиента на одну дозу. Некоторые примеры дозировок 1, 10, 100, 250, 500 и 1000 мг. Как правило, будут присутствовать другие агенты в диапазоне дозировок, схожих с агентами соответствующих классов, применяющихся в клинических условиях. Обычно это составляет 0,25-1000 мг/ед. Жидкие композиции обычно выпускают в разных дозировках. Как правило, жидкую композицию будут выпускать в диапазоне дозировок от 1 до 100 нг/мл. Некоторые примеры дозировок - 1, 10, 25, 50 и 100 мг/мл. Как правило, будут присутствовать другие агенты в диапазоне дозировок, схожих с агентами соответствующих классов, применяющихся в клинических условиях. Обычно это составляет 1-100 мг/мл. В объем настоящего изобретения входят все традиционные способы введения; предпочтительны- 23017628 прием внутрь и парентеральные пути введения. Как правило, схема лечения будет схожа со схемой, согласно которой назначают другие агенты, применяющиеся в клинических условиях. Как правило, суточная доза будет находиться в диапазоне 1-100 мг/кг веса тела в сутки. Как правило, при приеме внутрь требуется большее количество соединения и меньшее при парентеральном введении. Однако конкретную схему применения будет определять врач, исходящий из обоснованного медицинского суждения. Описание конкретных вариантов воплощения изобретения 1 Н-ЯМР-спектры получали с использованием аппарата Брукера при 500, 400 или 300 МГц и химические сдвиги выражали в млн-1 относительно тетраметилсилана ( = 0,0). Все этапы выпаривания проводили при сниженном давлении. Если не указано иначе, анализы с ЖХ/МС проводили на аппаратеShimadzu с использованием колонки для обращенно-фазовой хроматографии Phenomenex-LuH.o. 4,650 мм S10 при скорости потока 4 мл/мин с использованием 0,1% ТФУК в градиенте метанол/вода [0-100% за 3 мин, с 4-минутным временем прогона] и УФ-детектора, установленного на 220 нм, или колонки для обращенно-фазовой хроматографии Gemini C18 4,650 мм, 5 мкм, при скорости потока 5 мл/мин с использованием 10 ммоль ацетата аммония в градиенте ацетонитрил/вода [5-95% за 3 мин, с 4-минутным временем прогона] и УФ-детектором, установленным на 220 нм (масс-спектрометрия отрицательных ионов). Если не указано иначе, очистка могла быть проведена с помощью препаративной колонки С-18 с использованием градиентов метанол/вода, содержащего 0,1% трифтроуксусной кислоты (ТФУК) и системы для высокоэффективной жидкостной препаративной хроматографии на колонке XTERRA 30100 мм S5 при скорости потока 40 мл/мин с 12-минутным градиентом. Пример 1. N-(бензо[d]тиазол-2-ил)-4 Н-1'-азаспиро[оксазол-5,3'-бицикло[2,2,2]октан]-2-амин К бензо[d]тиазол-2-амину (20 г, 133 ммоль) в ацетонитриле (300 мл) добавляли 1,1'тиокарбонилдиимидазол (30,8 г, 173 ммоль). Реакционную смесь перемешивали при 50 С в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры и осадок фильтровали и промывали ацетонитрилом (250 мл). Желтый порошок сушили в вакуумной печи (40 С) в течение 2 ч. Продукт, N(бензо[d]тиазол-2-ил)-1 Н-имидазол-1-карботиамид (28,9 г, 111 ммоль), использовали непосредственно на следующем этапе без какой-либо дополнительной очистки. Этап В. (3-3-Бензо[d]тиазол-2-илтиоуреидо)метил)-3-гидрокси-1-аммонийбицикло[2,2,2]октан-1 ил)тригидроборат(100 мл) добавляли (3-(аминометил)-3-гидрокси-1-аммонийбицикло[2,2,2]октан-1-ил)тригидроборат (6,0 г, 35 ммоль), который синтезировали согласно Swain C.J. с соавт., J. Med. Chem., 35: 1019-1031 (1992). Реакционную смесь перемешивали при 65 С в течение 15 ч. Реакционную смесь охлаждали и концентрировали с получением неочищенного продукта. Этот неочищенный материал очищали с использованием флэш-хроматографии (50-100% этилацетат/гексаны) с получением первого пятна из фракций, выявленного с помощью ТСХ в качестве продукта. Фракции объединяли и концентрировали с получением (3-3 бензо[d]тиазол-2-илтиоуреидо)метил)-3-гидрокси-1-аммонийбицикло[2,2,2]октан-1-ил)тригидробората(10,6 г, 29,1 ммоль, 83% выход) в виде порошка белого цвета с желтоватым или сероватым оттенком. 1 Н ЯМР (500 МГц, DMSO-d6)млн-1 11,88 (s, 1 Н), 10,30 (s, 1 Н), 7,94 (d, J=7,63 Гц, 1 Н), 7,55-7,74 (m,1 Н), 7,37-7,53 (m, J=7,32, 7,32 Гц, 1 Н), 7,16-7,37 (m, J=7,63, 7,63 Гц, 1 Н), 5,39 (s, 1 Н), 3,85 (d, 2 Н), 2,653,08 (m, 6 Н), 1,99-2,22 (m, 1 Н), 1,79-1,97 (m, 2 Н), 1,66-1,79 (m, 1 Н), 1,08-1,63 (m, 4 Н), МС (ЖХ/МС) время удержания = 3,40; [М+Н]+ = 363,1. Этап С. (2-(Бензо[d]тиазол-2-иламино)-4 Н-1'-аммонийспиро[оксазол-5,3'-бицикло[2,2,2]октан]-1'ил)тригидроборат К 3-3-бензо[d]тиазол-2-илтиоуреидо)метил)-3-гидрокси-1-аммонийбицикло[2,2,2]октан-1-ил)тригидроборату (10,6 г, 29,1 ммоль) в N,N-диметилформамиде (100 мл) добавляли N,N'-диизопропилкарбодиимид (11,4 мл, 72,8 ммоль). Реакционную смесь перемешивали при 70 С в течение 4 ч. Реакционную смесь концентрировали с получением неочищенного осадка. Добавляли небольшое количество этилацетата (20 мл) и взвесь обрабатывали ультразвуком. Твердые вещества фильтровали и промывали небольшими порциями этилацетата (210 мл). Твердые вещества сушили в вакуумной печи К (2-(бензо[d]тиазол-2-иламино)-4 Н-1'-аммонийспиро[оксазол-5,3'-бицикло[2,2,2]октан]-1'-ил)тригидроборату (6,6 г, 20,1 ммоль) в ацетоне (9 мл) добавляли 3 М HCl (50,3 мл, 151 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакцию завершали ТСХ (нижнее пятно). Добавляли этилацетат, а затем отделяли водный слой. Водный слой нейтрализовали 1N гидроксидом натрия. Продукт экстрагировали этилацетатом (2150 мл). Органические соединения объединяли, сушили сульфатом магния. Фильтровали и концентрировали в вакууме с получением белого порошка. К этому порошку добавляли небольшое количество этилацетата (20 мл). Твердые вещества обрабатывали ультразвуком и фильтровали с получением рацемической смеси N-(бензо[d]тиазол-2-ил)-4 Н-1'-азаспиро[оксазол-5,3'-бицикло[2,2,2]октан]-2-амина (5,13 г, 16,3 ммоль, 81% выход) в виде белого порошка. 1 Н ЯМР (500 МГц, DMSO-d6)млн-1 9,02 (br, s, 1 Н), 7,79 (d, J=7,02 Гц, 1 Н), 7,62 (d, J=7,63 Гц, 1 Н),7,29-7,38 (m, 1 Н), 7,15-7,22 (m, 1 Н), 3,90 (d, J=10,07 Гц, 1 Н), 3,65 (d, J=10,07 Гц, 1 Н), 2,98-3,10 (m, 2 Н),2,73-2,88 (m, 2 Н), 2,67 (t, J=7,78 Гц, 2 Н), 2,07 (br, s, 1 Н), 1,93 (br, s, 1 Н), 1,42-1,67 (m, 3H), МС (ЖХ/МС) время удержания = 1,15; [М+Н]+ = 315,3. Энантиомеры разделяли на колонке Chiralpak AD-H (325 см, 5 мкм) с подвижной фазой, состоящей из СО 2/(метанола/ацетонитрила/диэтилацетата=70/30/0,1 (v/v/v = 77/23. Длина волны была установлена на 300 нм. Разделенные пики концентрировали в вакууме с получением белых порошков. Первый пик с колонки соответствовал (S)-N-(бензо[d]тиазол-2-ил)-4H-1'-азаспиро[оксазол-5,3'бицикло[2,2,2]октан]-2-амину (1,45 г, 4,61 ммоль, 29,4% выход), (Ia; S-изомер): 1(ЖХ/МС) время удержания = 1,15; [М+Н]+ = 315,3. Оптическое вращение (1,23 мг/мл, DMSO) = +5,20. Второй пик соответствовал (R)-N-(бензо[d]тиазол-2-ил)-4 Н-1'-азаспиро[оксазол-5,3'-бицикло[2,2,2] октан]-2-амину (1,21 г, 3,85 ммоль, 24,5% выход), (Ib; R-изомер): 1 Н ЯМР (500 МГц, DMSO-d6)млн-1 9,02 (br, s, 1H), 7,79 (d, J=7,32 Гц, 1 Н), 7,62 (d, J=7,63 Гц, 1 Н),7,33 (t, J=7,63 Гц, 1 Н), 7,18 (t, J=7,48 Гц, 1 Н), 3,90 (d, J=10,07 Гц, 1 Н), 3,65 (d, J=10,07 Гц, 1 Н), 2,98-3,10 В 500 мл, 3-горлая колба с механической мешалкой, капельная воронка и термометр. Добавляли уксусную кислоту (100 мл) и охлаждали на ледяной бане. В реакционную смесь добавляли тиоцианат калия(40 г, 412 ммоль) и 6-метоксипиридин-3-амин (6,2 г, 49,9 ммоль). Реакционную смесь охлаждали на ледяной солевой бане до тех пор, пока температура реакционной смеси не падала ниже 0 С. Раствор брома(8 мл, 156 ммоль) в уксусной кислоте (30,0 мл) по каплям добавляли на протяжении 2 ч со скоростью,которая поддерживала температуру реакции ниже 0 С. Требовалось механическое перемешивание. После того как добавление завершилось, смесь отставляли перемешиваться и медленно нагреваться до комнатной температуры на протяжении ночи. Затем добавляли воду (30 мл) и смесь нагревали до 85 С на масляной бане. Затем смесь фильтровали в горячем виде. Фильтр с оранжевым осадком возвращали в реакционную колбу и добавляли дополнительно 50 мл уксусной кислоты. Смесь снова нагревали до 85 С, а затем еще один раз фильтровали в горячем виде. Объединенные фильтраты охлаждали на ледяной бане и нейтрализовали до рН 8 концентрированным хлоридом аммония. Получался фиолетовый осадок, который затем собирали путем фильтрования с получением 5 г неочищенного материала. Этот неочищенный материал заново выкристаллизовывали из метанола (40 мл) с получением 5 метокситиазол[5,4-b]пиридин-2-амина (3 г, 16,55 ммоль, 33,1% выход) в виде фиолетовых кристаллов. 1 Н ЯМР (300 МГц, DMSO-d6)млн-1 7,60 (1 Н, d, J=8,42 Гц), 7,41 (2H, s), 6,67 (1 Н, d, J=8,78 Гц), 3,81 5-Метокситиазол[5,4-b]пиридин-2-амин (2,4 г, 13,24 ммоль) делили на два сосуда 520 мл с винтовыми крышками. В каждый сосуд добавляли ацетонитрил (10 мл) и тиокарбонилдиимидазол (600 мг). Все сосуды нагревали при 60 С на протяжении ночи. Реакционные сосуды объединяли и концентрировали с получением продукта - неочищенного N-(5-метокситиазол[5,4-b]пиридин-2-ил)-1 Н-имидазол-1 карботиамида. Неочищенный продукт взвешивали в N,N-диметилформамиде (50 мл) и затем добавляли (3(аминометил)-3-гидрокси-1-аммонийбицикло[2,2,2]октан-1-ил)тригидроборат (2,7 г, 15,88 ммоль). Реакционную смесь нагревали при 70 С в течение 4 ч. ЖХ/МС демонстрировали практически полное превращение. Реакционную смесь охлаждали до комнатной температуры и затем выливали в воду. Продукт экстрагировали сначала толуолом, а затем хлороформом. Органические соединения объединяли, промывали водой и солевым раствором, сушили над сульфатом натрия. Фильтровали и концентрировали в вакууме с получением неочищенного материала. Этот неочищенный материал очищали с использованием флэш-хроматографии (20-100% этилацетатгексан). Фракции продукта собирали и концентрировали в вакууме с получением (3-гидрокси-3-3-(5-метокситиазол[5,4-b]пиридин-2-ил)тиоуреидо)метил)-1 аммонийбицикло[2,2,2]октан-1-ил)тригидробората (1,36 г, 3,46 ммоль, 26,1% выход). 1 Н-ЯМР выявлял молярное отношение 1:0,55 (3-гидрокси-3-3-(5-метокситиазол[5,4-b]пиридин-2-ил)тиоуреидо)метил)-1 аммонийбицикло[2,2,2]октан-1-ил)тригидробората (1,36 г, 3,46 ммоль, 26,1% выход) к 5 метокситиазол[5,4-b]пиридин-2-амину (1,34 г, 1,876 ммоль, 14,17% выход). Смесь использовали непосредственно на следующем этапе без какой-либо дополнительной очистки. МС (ЖХ/МС) время удержания = 3,23; [М+Н]+ = 392,1. Этап С. 2-(5-Метокси-3 а,7 а-дигидротиазол[5,4-b]пиридин-2-иламино)-4 Н-1'-аммонийспиро[оксазол-5,3'-бицикло[2,2,2]октан]-1'-ил)тригидроборат[2,2,2]октан-1-ил)тригидроборату (1,7 г, 3,46 ммоль) в N,N-диметилформамиде (10 мл) добавляли N,N'диизопропилкарбодиимид (1,89 мл, 12,10 ммоль). Реакционную смесь перемешивали при 70 С в течение 2 ч. Смесь охлаждали и затем выливали в воду. Продукт экстрагировали толуолом и хлороформом. Органические слои объединяли, промывали водой и солевым раствором, сушили над сульфатом натрия. Фильтровали и концентрировали в вакууме с получением неочищенного материала. Это твердое вещество растирали в порошок с эфиром. Твердые вещества затем фильтровали и сушили с получением (2-(5- 26017628 метокси-3 а,7 а-дигидротиазол[5,4-b]пиридин-2-иламино)-4 Н-1'-аммонийспиро[оксазол-5,3'-бицикло[2,2,2]октан]-1-ил)тригидроборату (780 мг, 2,17 ммоль) в ацетоне (10 мл) добавляли 3 М HCl (10 мл, 329 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли хлороформ и воду, а затем отделяли водный слой. Водный слой нейтрализовали бикарбонатом натрия. Продукт экстрагировали хлороформом (2). Органические соединения объединяли, сушили над сульфатом натрия. Фильтровали и концентрировали в вакууме с получением рацемической смеси N-(5 метокситиазол[5,4-b]пиридин-2-ил)-4 Н-1'-азаспиро[оксазол-5,3'-бицикло[2,2,2]октан]-2-амина (588 мг,1,70 ммоль, 78% выход) в виде белого порошка. 1 Н ЯМР (500 МГц, DMSO-d6)млн-1 8,90 (1H, br, s), 7,82-7,86 (1H, m), 6,80 (1H, d, J=8,85 Гц), 3,843,89 (4H, m), 3,61 (1H, d, J=10,07 Гц), 3,03 (2H, d, J=5,19 Гц), 2,73-2,86 (2H, m), 2,66 (2H, t, J=7,78 Гц), 2,07(1H, br, s), 1,92 (1H, br, s), 1,45-1,65 (3H, m), MC (ЖХ/МС) время удержания = 1,29; [M+H]+ = 346,1. Энантиомеры разделяли на колонке Chiralpak AD-H (30250 мм, 5 мкм) с подвижной фазой, состоящей из 35% метанола (0,1% ДЭА) в CO2. Длина волны была установлена на 300 нм. Разделенные пики концентрировали в вакууме с получением белых порошков. Первый пик с колонки соответствовал (S)-N-(5-метокситиазол[5,4-b]пиридин-2-ил)-4 Н-1'азаспиро[оксазол-5,3'-бицикло[2,2,2]октан]-2-амину (212 мг, 0,61 ммоль, 36,1% выход), (2 а; S-изомер): 1 Н ЯМР (500 МГц, DMSO-d6)млн-1 8,89 (1 Н, br, s), 7,84 (1 Н, d, J=8,85 Гц), 6,77-6,82 (1 Н, m), 3,84-3,89 (4 Н,m), 3,61 (1 Н, d, J=10,07 Гц), 3,03 (2H, d, J=5,19 Гц), 2,74-2,86 (2H, m), 2,66 (2H, t, J=7,63 Гц), 2,06 (1 Н, br,s), 1,92 (1 Н, br, s), 1,44-1,65 (3H, m), MC (ЖХ/МС) время удержания = 1,47; [М+Н]+ = 346,2. Оптическое вращение (3,57 мг/мл, DMSO) = -2,58. Второй пик соответствовал (R)-N-(5-метокситиазол[5,4-b]пиридин-2-ил)-4 Н-1'-азаспиро[оксазол 5,3'-бицикло[2,2,2]октан]-2-амину (242 мг, 0,70 ммоль, 41,2% выход), (2b; R-изомер): 1H ЯМР (500 МГц,DMSO-d6)млн-1 8,89 (1 Н, br, s), 7,84 (1 Н, d, J=8,85 Гц), 6,79 (1 Н, d, J=8,55 Гц), 3,82-3,90 (4 Н, m), 3,61 В колбу емкостью 250 мл добавляли 2-(трет-бутоксикарбониламино)бензо[d]тиазол-6-карбоновую кислоту (1,0 г, 3,4 ммоль) и пирролидин (0,559 мл, 6,8 ммоль) в тетрагидрофуране (50 мл). К этому раствору добавляли EDC (1,3 г, 6,8 ммоль), 1-гидроксибензотриаксол (1,041 г, 6,8 ммоль), основание Хюнига (2,37 мл, 13,59 ммоль). Реакционную смесь перемешивали при 25 С в течение 1 ч. Затем реакционную смесь выливали в воду и дихлорметан. Воду экстрагировали 3 раза дихлорметаном и органические слои объединяли и концентрировали. Остаток собирали небольшим количеством дихлорметана и осаждали диэтиловым эфиром/гексанами. Колбу помещали в холодильник на 1 ч и фильтровали. Белый осадок собирали с получением трет-бутил-6-(пирролидин-1-карбонил)бензо[d]тиазол-2-илкарбамата (1,09 г, 3,14 ммоль, 92% выход). 1 Н ЯМР (500 МГц, DMSO-d6)млн-1 11,95 (s, 1H), 8,14 (s, 1H), 7,61-7,77 (m, J=8,39, 1,98 Гц, 1 Н),- 27017628 7,46-7,63 (m, 1 Н), 3,39-3,63 (m, 4 Н), 1,74-2,00 (m, 4 Н), 1,45-1,62 (m, 9 Н), МС (ЖХ/МС) время удержания = 3,40; [М+Н]+ = 363,1. Этап В. (2-Аминобензо[d]тиазол-6-ил) (пирролидин-1-ил)метон трет-Бутил 6-(пирролидин-1-карбонил)бензо[d]тиазол-2-илкарбамат (1,09 г, 3,14 ммоль) растворяли в дихлорметане (10 мл) и ТФУК (3 мл, 38,9 ммоль) и реакционную смесь перемешивали при 25 С на протяжении ночи. Реакционную смесь выливали на разделительную воронку и тщательно нейтрализовали бикарбонатом натрия. Жидкость экстрагировали 3-кратно хлороформом и метанолом (4:1). Органические слои концентрировали до твердого осадка белого цвета и растирали в порошок в диэтиловом эфире. Осадок собирали с получением (2-аминобензо[d]тиазол-6-ил)(пирролидин-1-ил)метона (0,497 г, 2,0 ммоль, 64% выход). 1 Н ЯМР (400 МГц, DMSO-d6)млн-1 7,86 (d, J=1,51 Гц, 1 Н), 7,65 (s, 2 Н), 7,35-7,46 (m, 1 Н), 7,26-7,35 2-(5 Н-1'-Азаспиро[оксазол-4,3'-бицикло[2,2,2]октан]-2-иламин)бензо[d]тиазол-6-ил)пирролидин-1 ил)метанон получали согласно стандартным процедурам примера 1 этапов A-D и использованием (2 аминобензо[d]тиазол-6-ил)(пирролидин-1-ил)метона (пример 3, этап В) в качестве исходного материала. 1 К 5-фенилтиазол-2-амину (0,52 г, 2,9 ммоль) в ацетонитриле (6 мл) добавляли 1,1'тиокарбонилдиимидазол (0,68 г, 3,8 ммоль). Реакционную смесь перемешивали при 65 С в течение 2 ч. Осадок фильтровали и промывали ацетонитрилом (220 мл) с получением промежуточного соединения N-(5-фенилтиазол-2-ил)-1 Н-имидазол-1-карботиамида. Этот промежуточный продукт взвешивали в N,Nдиметилформамиде(3-(аминометил)-3-гидрокси-1-аммонийбицикло[2,2,2]октан-1-ил)тригидроборат (0,5 г, 2,9 ммоль). Реакционную смесь перемешивали при 65 С в течение 5 ч. Реакционную смесь концентрировали в вакууме и очищали с использованием хроматографии на силикагеле (30-100% этилацетат/гексан). Фракции продукта собирали и концентрировали в вакууме с получением (3-гидрокси-3-3-(5-фенилтиазол-2-ил)тиоуреидо)метил)-1-аммонийбицикло[2,2,2]октан-1-ил)тригидробората (0,85 г, 2,19 ммоль, 74,4% выход) в виде белого порошка, ЖХ/МС подтверждала наличие продукта с потерей BH3 в данных условиях ЖХ/МС, время удержания 3,26 (М+1-BH3 = 375,33). Этап В. (2-(5-Фенилтиазол-2-иламино)-4 Н-1'-аммонийспиро[оксазол-5,3'-бицикло[2,2,2]октан]-1'ил)тригидроборат К 3-гидрокси-3-3-(5-фенилтиазол-2-ил)тиоуреидо)метил)-1-аммонийбицикло[2,2,2]октан-1-ил) тригидроборату (0,8 г, 2,1 ммоль) в N,N-диметилформамиде (20 мл) добавляли N,N-диизопропилкарбодиимид (1,12 мл, 7,2 ммоль). Реакционную смесь перемешивали при 70 С в течение 4 ч. Реакционную смесь концентрировали в вакууме и очищали с использованием хроматографии на силикагеле (40100% этилацетат/гексан). Объединенные фракции продукта концентрировали в вакууме с получением (2(5-фенилтиазол-2-иламино)-4 Н-1'-аммонийспиро[оксазол-5,3'-бицикло[2,2,2]октан]-1'-ил)тригидробората(0,51 г, 1,44 ммоль, 70% выход) в виде белого порошка. Масса после ЖХ/МС соответствует потере BH3 при данных условиях ЖХ/МС, время удержания 2,46 (М+1-BH3 = 341,36). Этап С. N-(5-Фенилтиазол-2-ил)-4 Н-1'-азаспиро[оксазол-5,3'-бицикло[2,2,2]октан]-2-амин К (2-(5-фенилтиазол-2-иламино)-4 Н-1'-аммонийспиро[оксазол-5,3'-бицикло[2,2,2]октан]-1'-ил)тригидроборату (0,56 г, 1,58 ммоль) в ацетоне (9 мл) добавляли 3 М HCl (3,95 мл, 11,86 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч и затем нейтрализовали 1N гидроксидом натрия. Продукт экстрагировали этилацетатом (220 мл), а затем хлороформом (220 мл). Органические соединения объединяли, сушили сульфатом магния. Фильтровали и концентрировали в вакууме с получением белого порошка. Неочищенный продукт очищали с помощью обращенно-фазовой ВЭЖХ (Phenomenex LuH.o. 30 100 мм; длина волны 220 нм; градиентное время 10 мин; скорость потока 40 мл/мин; растворитель А; 10% метанол - 90%, вода - 10% - 0,1% ТФУК. Растворитель В; 90% метанол - 10% вода 0,1% ТФУК). Фракции объединяли, нейтрализовали 1N гидроксидом натрия и экстрагировали этилацетатом (230 мл) и хлороформом (230 мл). Органические соединения объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением N-(5-фенилтиазол-2-ил)-4 Н-1'азаспиро[оксазол-5,3'-бицикло[2,2,2]октан]-2-амина (0,4 г, 1,175 ммоль, 74,3% выход) в виде белого порошка. 1 Н ЯМР (500 МГц, DMSO-d6)млн-1 8,63 (1 Н, br, s), 7,71 (1 Н, s), 7,52 (2H, d, J=7,32 Гц), 7,37 (2H, t,J=7,78 Гц), 7,25 (1 Н, t, J=7,32 Гц), 3,82 (1 Н, d, J=10,07 Гц), 3,57 (1 Н, d, J=9,77 Гц), 3,02 (2H, d, J=4,27 Гц),2,79 (2H, t, J=7,63 Гц), 2,66 (2H, t, J=7,63 Гц), 2,04 (1 Н, br, s), 1,92-1,97 (1 Н, m), 1,44-1,65 (3 Н, m), МС(ЖХ/МС) время удержания = 1,52; [М+Н]+ = 341,3. Энантиомеры разделяли на колонке Chiralpak AS-H (30250 мм, 5 мкм) с подвижной фазой, состоящей из 30% метанола (0,1% ДЭА) в CO2, и исследовали с помощью УФ-детектора при 300 нм. Разделенные пики концентрировали в вакууме с получением белых порошков. Первый пик с колонки соответствовал 0,4 г, 1,15 ммоль, 32,7% (4 а, S-изомер): 1 Н ЯМР (500 МГц,DMSO-d6)млн-1 8,69 (s, 1H), 7,69-7,87 (m, 1H), 7,52-7,66 (m, J=10,99 Гц, 2 Н), 7,37-7,51 (m, 2 Н), 7,21-7,38(m, 2 Н), 3,52-4,00 (m, 2 Н), 2,98-3,23 (m, 2 Н), 2,78-2,94 (m, 2 Н), 2,64-2,78 (m, 2 Н), 1,88-2,19 (m, J=60,43 Гц,2 Н), 1,40-1,77 (m, 3H), МС (ЖХ/МС) время удержания = 1,77; [М+Н]+ = 341,1. Второй пик соответствовал 0,4 г, 1,15 ммоль, 32,7% (4b, R-изомер): L,M,P, 187-9C, 1H ЯМР (500 МГц, DMSO-d6)млн-1 8,64 (s, 1 Н), 7,62-7,84 (m, 1 Н), 7,44-7,61 (m, 2 Н), 7,33-7,46 (m, 2 Н), 7,18-7,31 (m,1 Н), 3,50-3,99 (m, 2 Н), 2,94-3,14 (m, 2 Н), 2,74-2,91 (m, 2 Н), 2,61-2,72 (m, 2 Н), 2,05 (s, 1 Н), 1,82-2,00 (m,1 Н), 1,34-1,72 (m, 3H), МС (ЖХ/МС) время удержания = 1,78; [М+Н]+ = 341,1. Пример 5. N-(6-Метоксибензо[d]тиазол-2-ил)-4 Н-1'-азаспиро[оксазол-5,3'-бицикло[2,2,2]октан]-2 амин. Этап А. N-(6-Метоксибензо[d]тиазол-2-ил)-Н-имидазол-1-карботиамид К 6-метоксибензо[d]тиазол-2-амину (0,53 г, 2,94 ммоль) в ацетонитриле (20 мл) добавляли 1,1'тиокарбонилдиимидазол (0,681 г, 3,82 ммоль). Реакционную смесь перемешивали при 65 С в течение 24 ч. Осадок фильтровали и промывали ацетонитрилом (220 мл) с получением продукта. Продукт использовали непосредственно на следующем этапе без какой-либо дополнительной очистки. Этап В. (3-Гидрокси-3-3-(6-метоксибензо[d]тиазол-2-ил)тиоуреидо)метил)-1-аммонийбицикло
МПК / Метки
МПК: A61K 31/439, A61P 25/28, C07D 498/20
Метки: рецептора, никотинового, лигандов, хинуклидина, качестве, соединения, alpha;7, ацетилхолинового
Код ссылки
<a href="https://eas.patents.su/30-17628-soedineniya-hinuklidina-v-kachestve-ligandov-nikotinovogo-acetilholinovogo-receptora-alpha7.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения хинуклидина в качестве лигандов никотинового ацетилхолинового рецептора α7</a>
Предыдущий патент: Хинуклидиновые производные в качестве антагонистов мускаринового м3 рецептора
Следующий патент: Гербицидные соединения
Случайный патент: Способ припаивания электронных компонентов












