8-[3-аминопиперидин-1-ил]ксантины, их получение и их применение в качестве ингибиторов dpp – iv
Номер патента: 10854
Опубликовано: 30.12.2008
Авторы: Лангкопф Эльке, Томас Лео, Эккхардт Маттиас, Химмельсбах Франк, Тадайон Мохаммад
Формула / Реферат
1. Соединения общей формулы
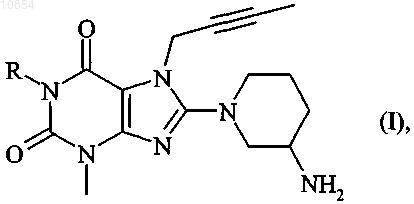
в которой R обозначает
бензильную, 2-фторбензильную, 3-фторбензильную, 4-фторбензильную, 2,6-дифторбензильную, 3,4-дифторбензильную, 2-хлорбензильную, 3-хлорбензильную или 4-хлорбензильную группу,
2-трифторметилбензильную, 3-трифторметилбензильную или 4-трифторметилбензильную группу,
3-трифторметоксибензильную или 4-трифторметоксибензильную группу,
2-цианобензильную, 3-цианобензильную или 4-цианобензильную группу,
2,6-дицианобензильную, 3,4-дицианобензильную, 3,5-дицианобензильную, 2-трифторметил-4-цианобензильную, 3-нитро-4-цианобензильную, 2-циано-3-метоксибензильную, 2-циано-4-метоксибензильную, 2-циано-5-метоксибензильную, 2-циано-4-фторбензильную, 2-циано-5-фторбензильную, 2-циано-6-фторбензильную, 3-циано-4-фторбензильную, 4-циано-3-фторбензильную, 2-фтор-4-цианобензильную, 2-циано-3-хлорбензильную, 2-хлор-4-цианобензильную или 2-циано-4-бромбензильную группу,
2-метоксибензильную, 3-метоксибензильную, 4-метоксибензильную, 2-фтор-3-метоксибензильную, 2-фтор-4-метоксибензильную, 2-фтор-5-метоксибензильную, 3-фтор-4-метоксибензильную, 3,4-диметоксибензильную, 3,5-диметоксибензильную или 3,4-диметокси-6-фторбензильную группу,
(бензо[1,3]диоксол-5-ил)метильную группу,
[(4-цианобензо[1,3]диоксол-5-ил)метильную группу,
2-(3-циклопропилоксифенил)-2-оксоэтильную, 2-(3-циклопропилметоксифенил)-2-оксоэтильную или 2-(3-циклобутилоксифенил)-2-оксоэтильную группу,
2-оксо-2-[2-(пиридин-3-ил)фенил]этильную или 2-оксо-2-[2-(пиридин-4-ил)фенил]этильную группу,
(3-цианонафталин-1-ил)метильную, (1,4-дицианонафталин-2-ил)метильную или (2,4-диметоксинафталин-1-ил)метильную группу,
(фуран-2-ил)метильную, (фуран-3-ил)метильную, (5-бромфуран-2-ил)метильную, (5-метилфуран-2-ил)метильную, (5-цианофуран-2-ил)метильную или (5-метоксикарбонилфуран-2-ил)метильную группу,
(пиридин-2-ил)метильную, (6-фторпиридин-2-ил)метильную или (5-метоксипиридин-2-ил)метильную группу,
(3-цианопиридин-2-ил)метильную, (6-цианопиридин-2-ил)метильную, (5-цианопиридин-2-ил)метильную, (4-цианопиридин-2-ил)метильную, (4-цианопиридин-3-ил)метильную, (3-цианопиридин-4-ил)
метильную, (2-цианопиридин-3-ил)метильную, (2-цианопиридин-4-ил)метильную, (5-цианопиридин-3-ил)метильную, (6-цианопиридин-3-ил)метильную или (5-циано-6-метоксипиридин-2-ил)метильную группу,
(6-фенилпиридин-2-ил)метильную или ([2,2']бипиридинил-6-ил)метильную группу,
(пиримидин-2-ил)метильную, (4-метилпиримидин-2-ил)метильную или (4,6-диметилпиримидин-2-ил)метильную группу,
(2-фенилпиримидин-4-ил)метильную или (4-фенилпиримидин-2-ил)метильную группу,
[(1-метил-1Н-бензотриазол-5-ил)метильную]группу,
(6-фторхинолин-2-ил)метильную, (7-фторхинолин-2-ил)метильную, (2-метилхинолин-4-ил)метильную, (3-цианохинолин-2-ил)метильную, (3-циано-4-метилхинолин-2-ил)метильную, (4-цианохинолин-2-ил)метильную, (5-цианохинолин-2-ил)метильную, (8-цианохинолин-2-ил)метильную, (6-аминохинолин-2-ил)метильную, (8-аминохинолин-2-ил)метильную, (4-метоксихинолин-2-ил)метильную, (6-метоксихинолин-2-ил)метильную, (6,7-диметоксихинолин-2-ил)метильную или (8-цианохинолин-7-ил)метильную группу,
(1-цианоизохинолин-3-ил)метильную, (4-цианоизохинолин-1-ил)метильную, (4-цианоизохинолин-3-ил)метильную или [4-(пиридин-2-ил)изохинолин-1-ил]метильную группу,
(хиназолин-6-ил)метильную, (хиназолин-7-ил)метильную, (2-метилхиназолин-4-ил)метильную, (4,5-диметилхиназолин-2-ил)метильную, (4-этилхиназолин-2-ил)метильную, (4-циклопропилхиназолин-2-ил)метильную, (2-фенилхиназолин-4-ил)метильную, (4-цианохиназолин-2-ил)метильную, (4-фениламинохиназолин-2-ил)метильную или (4-бензиламинохиназолин-2-ил)метильную группу,
(хиноксалин-5-ил)метильную, (хиноксалин-6-ил)метильную или (2,3-диметилхиноксалин-6-ил)метильную группу либо
([1,5]нафтиридин-3-ил)метильную группу,
их таутомеры, энантиомеры, диастереомеры, их смеси и их соли.
2. Соединение общей формулы
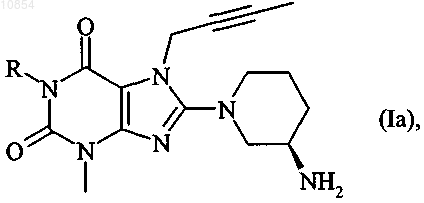
в которой R имеет указанные в п.1 значения,
а также их таутомеры и соли.
3. Соединение общей формулы
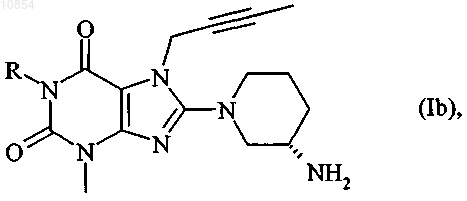
в которой R имеет указанные в п.1 значения,
а также их таутомеры и соли.
4. Соединение общей формулы Ia по п.2, в которой R обозначает (3-цианопиридин-2-ил)метильную группу, а также его соли.
5. Физиологически совместимые соли соединений по любому из пп.1-4 с неорганическими или органическими кислотами.
6. Физиологически совместимые соли соединения формулы Ia по п.4 с неорганическими или органическими кислотами.
7. Лекарственное средство, содержащее соединение по любому из пп.1-4 или физиологически совместимую соль по п.5 или 6 и необязательно один или несколько инертных носителей и/или разбавителей.
8. Лекарственное средство, содержащее соединение формулы Ia по п.4 или физиологически совместимую соль по п.6 и необязательно один или несколько инертных носителей и/или разбавителей.
9. Лекарственное средство, содержащее физиологически совместимую соль по п.6 и необязательно один или несколько инертных носителей и/или разбавителей.
10. Применение соединения по любому из пп.1-6 для получения лекарственного средства, пригодного для лечения сахарного диабета типа I и типа II, артрита, ожирения, отторжения аллотрансплантата и вызванного кальцитонином остеопороза.
11. Способ получения лекарственного средства по п.7, отличающийся тем, что соединение по любому из пп.1-6 нехимическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями.
12. Способ получения лекарственного средства по п.8, отличающийся тем, что соединение формулы Ia по п.4 или физиологически совместимую соль по п.6 нехимическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями.
13. Способ получения лекарственного средства по п.9, отличающийся тем, что физиологически совместимую соль по п.6 нехимическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями.
14. Способ получения соединений общей формулы I по любому из пп.1-6, отличающийся тем, что соединение общей формулы
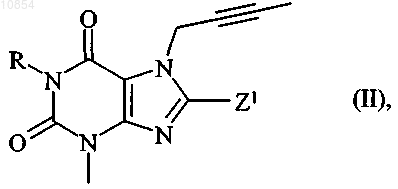
в которой R имеет указанные в п.1 значения, a Z1 обозначает уходящую группу, такую как атом галогена, замещенная гидроксигруппа, меркаптогруппа, сульфинильная группа, сульфонильная группа или сульфонилоксигруппа, подвергают взаимодействию с 3-аминопиперидином, его энантиомерами или его солями и затем при необходимости отщепляют возможно использовавшиеся на время реакции защитные группы, и/или полученные таким путем соединения общей формулы I разделяют на их энантиомеры и/или диастереомеры, и/или полученные соединения формулы I переводят в их соли, прежде всего для их фармацевтического применения переводят в их физиологически совместимые соли с неорганическими или органическими кислотами.
15. Способ получения соединений общей формулы I по любому из пп.1-6, отличающийся тем, что в соединении общей формулы
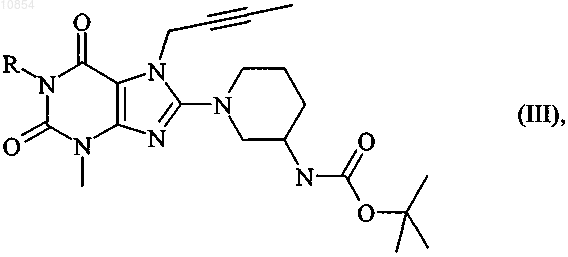
в которой R имеет указанные в п.1 значения, удаляют защитную группу, и/или полученные таким путем соединения общей формулы I разделяют на их энантиомеры и/или диастереомеры, и/или полученные соединения формулы I переводят в их соли, прежде всего для их фармацевтического применения переводят в их физиологически совместимые соли с неорганическими или органическими кислотами.
Текст
010854 Настоящее изобретение относится к новым замещенным ксантинам общей формулы их таутомерам, энантиомерам, диастереомерам, их смесям и их солям, прежде всего их физиологически совместимым солям с неорганическими или органическими кислотами, обладающим ценными фармакологическими свойствами, прежде всего ингибирующим действием на активность такого фермента, как дипептидилпептидаза-IV (DPP-IV), к их получению, их применению для профилактики или лечения заболеваний или состояний, которые взаимосвязаны с повышенной активностью DPP-IV или которые можно предупредить или облегчить за счет уменьшения активности DPP-IV, прежде всего сахарного диабета типа I или типа II, к содержащим соединение общей формулы (I) или его физиологически совместимую соль лекарственным средствам, а также к их получению. Производные ксантинов, обладающие ингибирующим действием на DPP-IV, уже известны из WO 02/068420, WO 02/02560, WO 03/004496, WO 03/024965, WO 04/018468, WO 04/048379, JP 2003300977 и ЕР 1338595. В приведенной выше общей формуле I([1,5]нафтиридин-3-ил)метильную группу. Предпочтительны соединения общей формулы в которой R имеет указанные выше значения, а также их таутомеры и соли. Равным образом предпочтительны соединения общей формулы в которой R имеет указанные выше значения, а также их таутомеры и соли. Соединения общей формулы I получают согласно изобретению известными способами, например описанными ниже способами. а) В этом варианте соединение общей формулы в которой R имеет указанные в начале описания значения, a Z1 обозначает уходящую группу, такую как атом галогена, замещенная гидрокси-, меркапто-, сульфинильная, сульфонильная или сульфонилоксигруппа, например атом хлора или брома, метансульфонильная или метансульфонилоксигруппа, подвергают взаимодействию с 3-аминопиперидином, его энантиомерами или его солями. Описанное выше взаимодействие целесообразно проводить в растворителе, таком как изопропанол,бутанол, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, монометиловый эфир этиленгликоля, диэтиловый эфир этиленгликоля или сульфолан, необязательно в присутствии неорганического основания, например карбоната натрия, карбоната калия или гидроксида калия, третичного органического основания, например триэтиламина, или в присутствии N-этилдиизопропиламина (основания Хюнига), при этом указанные органические основания одновременно могут также служить растворителем, и необязательно в присутствии катализатора, например галогенида щелочного металла или катализатора на основе палладия, при температуре от -20 до +180 С, предпочтительно, однако, при температуре от -10 до +120 С. Вместе с тем, реакцию можно проводить и без растворителя или в избытке 3 аминопиперидина. б) В этом варианте в соединении общей формулы в которой R имеет указанные в начале описания значения, удаляют защитную группу. трет-Бутилоксикарбонильную группу предпочтительно отщеплять обработкой кислотой, такой как трифторуксусная кислота или соляная кислота, либо обработкой бромтриметилсиланом или иодтриметилсиланом, необязательно с использованием растворителя, такого как метиленхлорид, этилацетат, диоксан, метанол, изопропанол или диэтиловый эфир, при температуре от 0 до 80 С. При проведении описанных выше реакций присутствующие при определенных условиях реакцион-2 010854 носпособные группы, такие как амино-, алкиламино- или иминогруппы, можно защищать на время протекания реакции обычными защитными группами и вновь отщеплять их по завершении реакции. В качестве примера защитной группы для амино-, алкиламино- или иминогруппы можно назвать формильную, ацетильную, трифторацетильную, этоксикарбонильную, трет-бутоксикарбонильную, бензилоксикарбонильную, бензильную, метоксибензильную или 2,4-диметоксибензильную группу, а для аминогруппы - дополнительно фталильную группу. При необходимости последующее отщепление используемой защитной группы можно осуществлять, например, гидролитическим путем в водном растворителе, например в воде, изопропаноле/воде,уксусной кислоте/воде, тетрагидрофуране/воде или диоксане/воде, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, либо в присутствии гидроксида щелочного металла, такого как гидроксид натрия или гидроксид калия, или апротонным путем, например в присутствии иодтриметилсилана, при температуре от 0 до 120 С, предпочтительно от 10 до 100 С. Однако бензильную, метоксибензильную или бензилоксикарбонильную группу отщепляют, например, путем гидрогенолиза, в частности под действием водорода в присутствии катализатора, такого как палладий на угле, в приемлемом растворителе, таком как метанол, этанол, этилацетат или ледяная уксусная кислота, необязательно с добавлением кислоты, такой как соляная кислота, при температуре от 0 до 100 С, но предпочтительно при комнатных температурах в пределах от 20 до 60 С, и при давлении водорода от 1 до 7 бар, предпочтительно, однако, от 3 до 5 бар. 2,4-Диметоксибензильную группу предпочтительно, однако, отщеплять в трифторуксусной кислоте в присутствии анизола. трет-Бутилоксикарбонильную группу предпочтительно отщеплять обработкой кислотой, такой как трифторуксусная кислота или соляная кислота, либо обработкой иодтриметилсиланом, необязательно с использованием растворителя, такого как метиленхлорид, диоксан, этилацетат или диэтиловый эфир. Трифторацетильную группу предпочтительно отщеплять обработкой кислотой, такой как соляная кислота, необязательно в присутствии растворителя, такого как уксусная кислота, при температуре от 50 до 120 С, либо обработкой едким натром, необязательно в присутствии растворителя, такого как тетрагидрофуран, при температуре от 0 до 50 С. Фталильную группу предпочтительно отщеплять в присутствии гидразина или первичного амина,такого как метиламин, этиламин, этаноламин или н-бутиламин, в растворителе, таком как метанол, этанол, изопропанол, толуол/вода или диоксан, при температуре от 20 до 50 С. Кроме того, полученные соединения общей формулы I можно разделять, как уже указывалось в начале описания, на их энантиомеры и/или диастереомеры. Так, например, цис-/транс-смеси можно разделять на их отдельные цис- и транс-изомеры, а соединения по меньшей мере с одним оптически активным атомом углерода можно разделять на их энантиомеры. Так, в частности, полученные цис-/транс-смеси можно разделять путем хроматографии на их отдельные цис- и транс-изомеры, полученные соединения общей формулы I, которые образуются в виде рацематов, можно разделять по известным методам (см. Allinger N.L. и Eliel E.L., "Topics in Stereochemistry",т. 6, изд-во Wiley Interscience, 1971) на их оптические антиподы, а соединения общей формулы I по меньшей мере с 2 асимметрическими атомами углерода можно на основании различий их физикохимических свойств разделять по известным методам, например хроматографией и/или фракционированной кристаллизацией, на их диастереомеры, которые при их образовании в рацемической форме в последующем можно разделять, как это описано выше, на энантиомеры. Разделение на энантиомеры предпочтительно осуществлять путем колоночного разделения на хиральных фазах либо путем перекристаллизации из оптически активного растворителя или взаимодействием с образующим с рацемическим соединением соли или производные, такие как сложные эфиры или амиды, оптически активным веществом, прежде всего с кислотами и их активированными производными или спиртами, и разделением полученной в результате смеси диастереомерных солей или производного,например, на основе различий в растворимости, при этом из чистых диастереомерных солей или производных можно высвобождать свободные антиподы воздействием пригодными для этой цели средствами. В качестве примера наиболее часто используемых в вышеуказанных целях оптически активных кислот можно назвать D- и L-формы винной либо дибензоилвинной кислоты, ди-О-n-толилвинной кислоты, яблочной кислоты, миндальной кислоты, камфорсульфоновой кислоты, глутаминовой кислоты, аспарагиновой кислоты или хинной кислоты. Примером оптически активного спирта служит (+)- или (-)-ментол, а в качестве примера оптически активного ацильного фрагмента в амидах можно назвать (+)- или (-)ментилоксикарбонил. Помимо этого полученные соединения формулы I можно переводить в их соли, прежде всего, для фармацевтического применения в их пригодные физиологически совместимые соли с неорганическими или органическими кислотами. В качестве примера пригодных для этой цели кислот можно назвать соляную кислоту, бромисто-водородную кислоту, серную кислоту, метансульфоновую кислоту, фосфорную кислоту, фумаровую кислоту, янтарную кислоту, молочную кислоту, лимонную кислоту, винную кислоту или малеиновую кислоту. Используемые в качестве исходных веществ соединения общих формул II и III либо известны из-3 010854 литературы, либо их получают по известным из литературы методам (см. примеры I-XXV). Предлагаемые в изобретении соединения общей формулы I и их физиологически совместимые соли обладают, как уже указывалось выше, ценными фармакологическими свойствами, прежде всего ингибирующим действием на фермент DPP-IV. Биологические свойства новых соединений исследовали по описанной ниже методике. Способность предлагаемых в изобретении соединений и их соответствующих солей подавлять активность DPP-IV можно продемонстрировать экспериментально с использованием в качестве источникаDPP-IV экстракта человеческих клеток рака толстой кишки линии Сасо-2. Для дифференцировки клеток с целью индуцировать экспрессию DPP-IV использовали метод, описанный у Reiner и др. в статье"Increased expression of intestinal cell line Caco-2", опубликованной в Proc. Natl. Acad. Sci., т. 90, 1993,cc. 5757-5761. Клеточный экстракт получали из солюбилизированных в буфере (10 мМ трис-HCl, 0,15MNaCl, апротинин в количестве, соответствующем 0,04 ед. ингибирования трипсина (ЕИТ), 0,5% NonidetP40, pH 8,0) клеток путем центрифугирования при 35000g в течение 30 мин при 4 С (для удаления клеточного дебриса). Ниже рассмотрена методика проведения опыта по исследованию подавления активности DPP-IV. В черные титрационные микропланшеты вносили 50 мкл раствора субстрата (амидо-4-трифторметилкумарина, конечная концентрация 100 мкМ). Далее с помощью пипетки добавляли 20 мкл буфера для анализа (конечные концентрации: 50 мМ трис-HCl с рН 7,8, 50 мМ NaCl, 1% ДМСО). Реакцию инициировали добавлением 30 мкл солюбилизированного белка из клеток линии Сасо-2 (конечная концентрация 0,14 мкг белка на лунку). Анализируемые тестируемые вещества обычно добавляли в предварительно разведенном в 20 мкл виде, уменьшая в этом случае на соответствующую величину объем используемого буфера для анализа. Реакцию проводили при комнатной температуре при продолжительности инкубации, равной 60 мин. По истечении этого промежутка времени измеряли интенсивность флуоресценции в приборе типа Victor 1420 Multilabel Counter при длине волны возбуждения 405 нм и длине волны испускания 535 нм. "Холостые" значения (соответствуют активности, равной 0%) получали в смесях без белка из клеток линии Сасо-2 (недостающий объем восполняли добавлением соответствующего количества буфера для анализа), а контрольные значения (соответствуют активности, равной 100%) получали в смесях, к которым не добавляли анализируемые вещества. Степень проявляемого каждым из тестируемых веществ действия, выраженную в виде значений ингибирующей концентрации IC50, рассчитывали на основании кривых зависимости эффекта от дозы, каждую из которых строили по 11 экспериментальным точкам. При этом были получены следующие результаты. Предлагаемые в изобретении соединения обладают хорошей переносимостью, поскольку, например, после перорального введения крысам соединения из примера 1(30) в дозе 10 мг/кг не наблюдалось никаких изменений в поведении животных. Предлагаемые в изобретении соединения общей формулы I и их соответствующие фармацевтически приемлемые соли с учетом их способности подавлять активность DPP-IV позволяют влиять на все те состояния или заболевания, на которые можно воздействовать за счет подавления активности DPP-IV. Поэтому можно ожидать, что предлагаемые в изобретении соединения пригодны для профилактики или лечения таких заболеваний или состояний, как сахарный диабет типа 1 и типа 2, преддиабет, снижение толерантности к глюкозе или изменения уровня сахара в крови натощак, диабетические осложнения (например, ретинопатия, нефропатия или невропатия), метаболический ацидоз или кетоз, реактивная гипогликемия, резистентность к инсулину, метаболический синдром, дислипидимии различного генеза, артрит, атеросклероз и родственные заболевания, ожирение, отторжение аллотрансплантата и вызванный кальцитонином остеопороз. Помимо этого предлагаемые в изобретении соединения позволяют предупреждать дегенерацию В-клеток, например апоптоз или некроз панкреатических В-клеток. Предлагаемые в изобретении соединения пригодны далее для улучшения или восстановления функциональной ак-4 010854 тивности панкреатических клеток и наряду с этим для увеличения количества и размера панкреатических В-клеток. Кроме того, исходя из той роли, которую играют глюкагоноподобные пептиды, такие, например, как GLP-1 и GLP-2, и с учетом их связи с ингибированием DPP-IV, ожидается, что предлагаемые в изобретении соединения пригодны помимо прочего для достижения седативного или устраняющего состояние страха эффекта и, кроме того, способны благоприятно влиять на катаболические состояния после хирургических операций или на гормональные стрессовые реакции или позволяют снизить смертность и заболеваемость после инфаркта миокарда. Помимо этого предлагаемые в изобретении соединения пригодны для лечения всех состояний, взаимосвязанных с вышеописанными эффектами и опосредуемых пептидом GLP-1 или GLP-2. Предлагаемые в изобретении соединения равным образом могут использоваться в качестве мочегонных или гипотензивных средств и пригодны для предупреждения и лечения острой почечной недостаточности. Предлагаемые в изобретении соединения могут далее использоваться для лечения воспалительных заболеваний дыхательных путей. Равным образом они пригодны для предупреждения и терапии хронических воспалительных заболеваний кишечника, таких, например, как синдром раздраженного кишечника (СРК), болезнь Крона или язвенный колит, а также для применения при панкреатите. Помимо этого ожидается, что они могут использоваться при любом типе повреждений или нарушений в желудочно-кишечном тракте, в том числе и, например, при колитах и энтеритах. Кроме того, ожидается, что ингибиторы DPP-IV, а, тем самым, и предлагаемые в изобретении соединения могут применяться для лечения бесплодия или для улучшения репродуктивной способности человека или млекопитающих, и прежде всего в том случае, когда бесплодие взаимосвязано с резистентностью к инсулину или с синдромом поликистоза яичников. С другой стороны, эти соединения способны влиять на подвижность сперматозоидов и поэтому могут использоваться в качестве мужских контрацептивов. Такие соединения способны помимо этого положительно влиять на состояния, связанные с дефицитом соматотропных гормонов и проявляющиеся в карликовом росте, а также их целесообразно использовать при всех показаниях, при которых допускается применение соматотропных гормонов. Предлагаемые в изобретении соединения благодаря их ингибирующему действию на DPP-IV пригодны также для лечения различных аутоиммунных заболеваний, таких, например, как ревматоидный артрит, множественный склероз, тиреоидиты, базедова болезнь и другие. Помимо этого они могут использоваться при вирусных заболеваниях, в том числе, например, и при ВИЧ-инфекциях, для стимуляции гемопоэза, при доброкачественной гиперплазии простаты, при гингивитах, а также для лечения нейронных нарушений и нейродегенеративных заболеваний, таких, например, как болезнь Альцгеймера. Предлагаемые в изобретении соединения можно использовать и для терапии опухолей, прежде всего для изменения процесса инвазии опухоли, в том числе и метастазирования. В качестве примера при этом можно назвать применение при Т-клеточных лимфомах, остром лимфобластном лейкозе, клеточном раке щитовидной железы,базалиоме или раке молочной железы. К числу других показаний относятся апоплексический удар, ишемии различного генеза, болезнь Паркинсона и мигрень. Помимо этого к другим показаниям относятся фолликулярный и эпидермолитический гиперкератозы, повышенная пролиферация кератиноцитов, псориаз, энцефаломиелиты, гломерулонефриты, липодистрофии, а также психосоматические, депрессивные и нейропсихические заболевания различного генеза. Предлагаемые в изобретении соединения можно также использовать в сочетании с другими действующими веществами. К подобного рода терапевтическим средствам, которые могут использоваться в комбинации с предлагаемыми в изобретении соединениями, относятся, например, антидиабетические средства, такие как метформин, сульфонилмочевины (например, глибенкламид, толбутамид, глимепирид), натеглинид, репаглинид, тиазолидиндионы (например, росиглитазон, пиоглитазон), агонисты рецептора PPAR (например, GI 262570) и антагонисты рецептора PPAR, модуляторы рецептора PPAR/(например, KRP 297), модуляторы рецептора PPAR//, активаторы AMPK, ингибиторы АСС 1 и АСС 2,ингибиторы DGAT, агонисты SMT3-рецептора, ингибиторы 11-HSD, агонисты или миметики FGF19,ингибиторы -глюкозидазы (например, акарбоза, воглибоза), иные ингибиторы DPP-IV, 2-антагонисты,инсулин и его аналоги, GLP-1 и аналоги GLP-1 (например, эксендин-4) или амилин. Наряду с указанными выше в комбинации с предлагаемыми в изобретении соединениями могут также использоваться ингибиторы SGLT2, такие как Т-1095 или KGT1251 (869682), ингибиторы (белок-тирозин)фосфатазы 1,вещества, влияющие на дерегуляцию продуцирования глюкозы в печени, такие как ингибиторы глюкозо 6-фосфатазы, фруктозо-1,6-бисфосфатазы или гликогенфосфорилазы, антагонисты глюкагонового рецептора и ингибиторы фосфоенолпируваткарбоксикиназы, киназы гликогенсинтазы (протеинкиназы) или пируватдегидрогеназы, средства, понижающие уровень липидов в крови, такие как ингибиторы HMGCoA-редуктазы (например, симвастатин, аторвастатин), фибраты (например, безафибрат, фенофибрат),никотиновая кислота и ее производные, агонисты рецептора PPAR, агонисты рецептора PPAR, ингибиторы АСАТ (например, авасимиб) или ингибиторы всасывания холестерина, такие как эзетимиб, связывающие желчные кислоты вещества, такие как колестирамин, ингибиторы подвздошного транспорта желчных кислот, повышающие уровень альфа-липопротеинов высокой плотности в крови соединения,такие как ингибиторы СЕТР, или регуляторы АВС 1, или же антагонисты LXR, агонисты LXR или регуляторы LXR/, либо действующие вещества для лечения ожирения, такие как сибутрамин, тетрагид-5 010854 ролипстатин, дексфенфлурамин или аксокин, антагонисты рецептора каннбиноида 1, антагонисты рецептора МСН-1, агонисты рецептора МС 4, антагонисты NPY5 либо NPY2 или 3-агонисты, такие как SB418790 или AD-9677, а также агонисты рецептора 5 НТ 2 С. Помимо этого в сочетании с предлагаемыми в изобретении соединениями можно использовать медикаменты, влияющие на повышенное кровяное давление, такие, например, как антагонисты AII или ингибиторы АСЕ, диуретики, -блокаторы, Са-антагонисты и другие или их комбинации. Для достижения соответствующего действия предлагаемые в изобретении соединения целесообразно вводить в организм от 1 до 4 раз в день в дозе, которая при внутривенном введении составляет от 1 до 100 мг, предпочтительно от 1 до 30 мг, а при пероральном введении составляет от 1 до 1000 мг, предпочтительно от 1 до 100 мг. С этой целью предлагаемые в изобретении соединения формулы I, необязательно в сочетании с другими действующими веществами, перерабатывают совместно с одним или несколькими обычными инертными носителями и/или разбавителями, например с кукурузным крахмалом, лактозой,тростниковым сахаром, микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, водой/этанолом, водой/глицерином, водой/сорбитом,водой/полиэтиленгликолем, пропиленгликолем, цетилстеариловым спиртом, карбоксиметилцеллюлозой или жиросодержащими веществами, такими как отвержденный жир, или их приемлемыми смесями, в обычные галеновы формы, такие как таблетки, драже, капсулы, порошки, суспензии или суппозитории. Ниже изобретение проиллюстрировано на примерах. Получение исходных соединений Пример I. 1-[(4-Фениламинохиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. Смесь из 416 мг 3-метил-7-(2-бутин-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина и 456 мг карбоната цезия в 4 мл N,N-диметилформамида перемешивают при 80 С в течение 10 мин,после чего добавляют 324 мг 2-хлорметил-4-фениламинохиназолина и реакционную смесь перемешивают в течение 2 ч при 80 С. Далее вновь добавляют 50 мг карбоната цезия и 50 мг хлорметил-4-фениламинохиназолина и смесь перемешивают еще в течение 1,5 ч при 80 С. После этого отгоняют растворитель и остаток распределяют между водой и этилацетатом. Органическую фазу промывают разбавленной лимонной кислотой, водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Сырой продукт очищают хроматографией на силикагелевой колонке с использованием в качестве элюента смеси этилацетат/петролейный эфир (в соотношении, изменяющемся от 8:2 до 10:0). Выход: 425 мг (65% от теории). Значение Rf: 0,33 (силикагель, этилацетат). Масс-спектр (ESI+): m/z=650 [М+Н]+. Аналогично примеру I получают следующие соединения:(102) 1-[(4-цианобензо[1,3]диоксол-5-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин: значение Rf: 0,80 (силикагель, этилацетат),масс-спектр (ESI+): m/z=576 [М+Н]+. Пример II. 3-Метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. К 15,00 г 3-метил-7-(2-бутин-1-ил)-8-бромксантина и 16,00 г карбоната калия в 100 мл диметилсульфоксида добавляют 11,00 г (R)-3-трет-бутилоксикарбониламинопиперидина и густую светло-бежевую суспензию в течение 4 ч перемешивают механической мешалкой при температуре около 114 С. Затем к реакционной смеси вновь добавляют раствор 900 мг (R)-3-трет-бутилоксикарбониламинопиперидина в 10 мл диметилсульфоксида и перемешивают ее еще в течение 2 ч при 114 С. После охлаждения до комнатной температуры реакционную смесь разбавляют большим количеством воды. Образовавшийся осадок тщательно растирают до полного отсутствия комочков и отделяют вакуум-фильтрацией. Светлое твердое вещество вновь взмучивают в воде, подвергают вакуум-фильтрации, после чего промывают водой и диэтиловым эфиром и сушат в сушильном шкафу с циркуляцией воздуха при 60 С. Выход: 19,73 г (94% от теории). Значение Rf: 0,64 (силикагель, этилацетат). Масс-спектр (ESI+): m/z=417 [М+Н]+. Аналогично примеру II получают следующие соединения:(5) 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(S)-3-(трет-бутилоксикарбониламино) пиперидин-1-ил]ксантин: значение Rf: 0,50 (силикагель, этилацетат),масс-спектр (ESI+): m/z=533 [М+Н]+. Пример III. 3-Метил-7-(2-бутин-1-ил)-8-бромксантин. К 30,17 г 3-метил-8-бромксантина и 27,00 мл основания Хюнига в 370 мл N,N-диметилформамида добавляют 17,06 г 1-бром-2-бутина. Реакционную смесь в течение 2 ч перемешивают при комнатной температуре, после чего вновь добавляют 1 мл 1-бром-2-бутина и перемешивают еще в течение часа при комнатной температуре. Для переработки реакционную смесь разбавляют примерно 300 мл воды. Образовавшийся светлый осадок отделяют вакуум-фильтрацией и затем промывают водой. Осадок на фильтре промывают небольшим количеством этанола и диэтилового эфира и сушат в сушильном шкафу с циркуляцией воздуха при 60 С. Выход: 30,50 г (84% от теории). Значение Rf: 0,24 (силикагель, метиленхлорид/метанол в соотношении 95:5). Масс-спектр (ESI+): m/z=297, 299 [М+Н]+. Пример IV. 2-Хлорметил-4-фениламинохиназолин. Указанное соединение получают взаимодействием 500 мг 4-хлор-2-хлорметилхиназолина с 438 мг анилина в 12 мл метиленхлорида при комнатной температуре. Выход: 518 мг (82% от теории). Значение Rf: 0,60 (силикагель, циклогексан/этилацетат в соотношении 1:1). Масс-спектр (ESI+): m/z=270, 272 [М+Н]+. Аналогично примеру IV получают следующее соединение:(1) 2-хлорметил-4-бензиламинохиназолин: значение Rf: 0,60 (силикагель, циклогексан/этилацетат в соотношении 1:1),масс-спектр (ESI+): m/z=284, 286 [M+H]+. Пример V. 1-Бромметил-4-цианоизохинолин. Указанное соединение получают бромированием 1-метил-4-цианоизохинолина N-бромсукцинимидом в присутствии азо-бис-изобутиронитрила в четыреххлористом углероде при 80 С. Значение Rf: 0,51 (силикагель, метиленхлорид). Масс-спектр (EI): m/z=246, 248 [М]+. Аналогично примеру V получают следующие соединения:(17) 2-бромметил-8-цианохинолин: значение Rf: 0,75 (силикагель, метиленхлорид/метанол в соотношении 99:1),масс-спектр (ESI+): m/z=247, 249 [М+Н]+. Пример VI. 2-Бром-1-(3-циклопропил оксифенил)этанон. Указанное соединение получают бромированием 1-(3-циклопропилоксифенил)этанона трибромидом фенилтриметиламмония в метиленхлориде при кипячении с обратным холодильником. Значение Rf: 0,75 (силикагель, циклогексан/этилацетат в соотношении 3:1). Масс-спектр (ESI+): m/z=255, 257 [М+Н]+. Аналогично примеру VI получают следующие соединения:(2) 2-бром-1-(3-циклобутилоксифенил)этанон: значение Rf: 0,70 (силикагель, циклогексан/этилацетат в соотношении 3:1). Пример VII. 1-(3-Циклопропилоксифенил)этанон. Указанное соединение получают взаимодействием 3-гидроксиацетофенона с бромциклопропаном в присутствии иодида калия и трет-бутилата калия в N,N-диметилформамиде в микроволновой печи при 220 С. Значение Rf: 0,65 (силикагель, циклогексан/этилацетат в соотношении 3:1). Масс-спектр (ESI+): m/z=177 [М+Н]+. Аналогично примеру VII получают следующие соединения:(2) 1-(3-циклобутилоксифенил)этанон: значение Rf: 0,65 (силикагель, циклогексан/этилацетат в соотношении 3:1),масс-спектр (ESI+): m/z=191 [М+Н]+. Пример VIII. 1-Хлорметил-2,4-диметоксинафталин. Указанное соединение получают хлорированием 1-гидроксиметил-2,4-диметоксинафталина тионилхлоридом в метиленхлориде при комнатной температуре. Значение Rf: 0,78 (силикагель, циклогексан/этилацетат в соотношении 1:1). Масс-спектр (ESI+): m/z=236, 238 [M]+. Пример IX. 1-Гидроксиметил-2,4-диметоксинафталин. Указанное соединение получают восстановлением 2,4-диметоксинафталин-1-карбоксальдегида боргидридом натрия в смеси из диоксана и воды (3:1) при комнатной температуре. Значение Rf: 0,48 (силикагель, циклогексан/этилацетат в соотношении 1:1). Пример X. 1-[(6-Аминохинолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. Указанное соединение получают обработкой 1-[(6-нитрохинолин-2-ил)метил]-3-метил-7-(2-бутин 1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина дитионитом натрия в смеси из этанола и воды (5:2) при 55-60 С. Значение Rf: 0,40 (силикагель, метиленхлорид/метанол в соотношении 95:5). Масс-спектр (ESI+): m/z=573 [М+Н]+. Пример XI. 1-Метил-4-(пиридин-2-ил)изохинолин. Указанное соединение получают взаимодействием 4-бром-1-метилизохинолина с триизопропокси 2-пиридинилборонатом лития в присутствии тетракис(трифенилфосфин)палладия, трифенилфосфина,карбоната натрия и иодида меди(I) в 1,4-диоксане при кипячении с обратным холодильником. Значение Rf: 0,22 (силикагель, метиленхлорид/метанол в соотношении 95:5). Масс-спектр (ESI+): m/z=221 [М+Н]+. Пример XII. 1-[(8-Аминохинолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. Указанное соединение получают обработкой 1-[(8-нитрохинолин-2-ил)метил]-3-метил-7-(2-бутин- 14010854 1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина порошковым железом в смеси из ледяной уксусной кислоты, этанола и воды (2:20:5) при кипячении с обратным холодильником. Значение Rf: 0,50 (силикагель, метиленхлорид/метанол в соотношении 95:5). Масс-спектр (ESI+): m/z=573 [М+Н]+. Пример XIII. 1-2-Оксо-2-[2-(пиридин-3-ил)фенил]этил-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(третбутилоксикарбониламино)пиперидин-1-ил]ксантин. Указанное соединение получают взаимодействием 1-[2-оксо-2-(2-бромфенил)этил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина с пиридин-3-бороновой кислотой в присутствии тетракис(трифенилфосфин)палладия, тетра-н-бутил-аммонийбромида и карбоната натрия в смеси из толуола и этанола (1:1) при 105 С. Значение Rf: 0,55 (силикагель, этилацетат). Масс-спектр (ESI+): m/z=612 [М+Н]+. Аналогично примеру XII получают следующее соединение:(1) 1-2-оксо-2-[2-(пиридин-4-ил)фенил]этил-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин (взаимодействие проводят с 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)пиридином): значение Rf: 0,40 (силикагель, этилацетат),масс-спектр (ESI+): m/z=612 [М+Н]+. Пример XIV. 1-[(4-Этилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. Указанное соединение получают обработкой 1-цианометил-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина трет-бутилатом калия в метаноле и последующим взаимодействием образовавшегося иминоэфира с 2-аминопропиофеноном в присутствии ледяной уксусной кислоты. Значение Rf: 0,60 (силикагель, этилацетат). Масс-спектр (ESI+): m/z=587 [M+H]+. Аналогично примеру XIV получают следующее соединение:(1) 1-[(4-циклопропилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин: значение Rf: 0,70 (силикагель, этилацетат),масс-спектр (ESI+): m/z=599 [М+Н]+. Пример XV. 2-Хлорметил-3-циано-4-метилхинолин. Указанное соединение получают взаимодействием 3-циано-2,4-диметил-1-оксихинолина с хлорангидридом бензосульфоновой кислоты в толуоле при 80 С. Значение Rf: 0,55 (силикагель, циклогексан/этилацетат в соотношении 2:1). Масс-спектр (ESI+): m/z=217, 219 [М+Н]+. Пример XVI. 3-Циано-2,4-диметил-1-оксихинолин. Указанное соединение получают обработкой 3-циано-2,4-диметилхинолина водным раствором пероксида водорода (35%-ным) в ледяной уксусной кислоте при 60 С. Значение Rf: 0,35 (силикагель, этилацетат). Масс-спектр (ESI+): m/z=199 [М+Н]+. Пример XVII. 2-Хлорметил-4,5-диметилхиназолин. Указанное соединение получают взаимодействием 1-(2-амино-6-метилфенил)этанона с хлорацетонитрилом в диоксане с подачей хлористого водорода при 30-38 С. Масс-спектр (ESI+): m/z=207, 209 [М+Н]+. Пример XVIII. 1-[(2-Метилхиназолин-4-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. Указанное соединение получают взаимодействием 1-[2-(2-ацетиламинофенил)-2-оксоэтил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина с этанольным аммиаком (6-молярным) и хлоридом аммония в автоклаве при 150 С. Значение Rf: 0,35 (силикагель, этилацетат). Масс-спектр (ESI+): m/z=573 [М+Н]+. Пример XIX. 1-[2-(2-Ацетиламинофенил)-2-оксоэтил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. Указанное соединение получают взаимодействием 1-[2-(2-аминофенил)-2-оксоэтил]-3-метил-7-(2 бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина с ацетилхлоридом в присутствии пиридина в метиленхлориде при комнатной температуре. Значение Rf: 0,79 (силикагель, этилацетат). Масс-спектр (ESI+): m/z=592 [М+Н]+. Пример XX. 1-[2-(2-Аминофенил)-2-оксоэтил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. Указанное соединение получают восстановлением 1-[2-(2-нитрофенил)-2-оксоэтил]-3-метил-7-(2- 15010854 бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина дигидратом хлорида олова(II) в тетрагидрофуране при комнатной температуре. Значение Rf: 0,85 (силикагель, этилацетат). Масс-спектр (ESI+): m/z=550 [М+Н]+. Пример XXI. 1-[(Фуран-3-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. Смесь из 300 мг 3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1 ил]ксантина, 95 мкл фуран-3-илметанола, 302 мг трифенилфосфина и 226 мкл диизопропилазодикарбоксилата в 4 мл тетрагидрофурана перемешивают в течение ночи при комнатной температуре. Для переработки реакционную смесь смешивают с насыщенным раствором карбоната калия и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом магния и концентрируют. Остаток в колбе хроматографируют на силикагелевой колонке с использованием смеси циклогексан/этилацетат (в соотношении, изменяющемся от 1:1 до 3:7). Выход: 330 мг (92% от теории). Масс-спектр (ESI+): m/z=497 [M+H]+. Аналогично примеру XXI получают следующие соединения:(2) 1-[(5-бромфуран-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино) пиперидин-1-ил]ксантин: масс-спектр (ESI+): m/z=575, 577 [М+Н]+. Пример XXII. 1-[(5-Цианофуран-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. Указанное соединение получают взаимодействием 1-[(5-формилфуран-2-ил)метил]-3-метил-7-(2 бутин-1-ил)-8-[(R)-3-(трет-бутилоксикарбонил-амино)пиперидин-1-ил]ксантина с гидроксиламин-О-сульфоновой кислотой и пиридином в толуоле при кипячении с обратным холодильником. Пример XXIII. 5-(Метансульфонилоксиметил)-2-фуранкарбоксальдегид. Указанное соединение получают взаимодействием 5-(гидроксиметил)-2-фуранкарбоксальдегида с хлорангидридом метансульфоновой кислоты в присутствии триэтиламина в метиленхлориде при комнатной температуре. Сырой продукт используют в последующей реакции без дополнительной очистки. Пример XXIV. 2-Хлорметил-3-цианопиридин. Указанное соединение получают из 2-(гидроксиметил)никотинамида его взаимодействием с тионилхлоридом в ацетонитриле с последующей дегидратацией полученного таким путем 2-(хлорметил)никотинамида ангидридом трифторуксусной кислоты в присутствии триэтиламина в метиленхлориде. В другом варианте указанное в заголовке соединение получают также в одну стадию нагреванием 2-(гидроксиметил)никотинамида с оксихлоридом фосфора с обратным холодильником. Значение Rf: 0,85 (силикагель, метиленхлорид/метанол в соотношении 9:1). Масс-спектр (ESI+): m/z=153, 155 [М+Н]+. Пример XXV. 8-Циано-7-метилхинолин. Указанное соединение получают взаимодействием 8-бром-7-метилхинолина с цианидом цинка в присутствии тетракис(трифенилфосфин)палладия в N-метилпирролидиноне в атмосфере защитного газа при 100-105 С. Значение Rf: 0,35 (силикагель, петролейный эфир/этилацетат в соотношении 7:3). Масс-спектр (ESI+): m/z=169 [М+Н]+. Пример XXVI. 2-Метил-8-цианохинолин. Указанное соединение получают взаимодействием 2-метил-8-бромхинолина с цианидом меди(I) вN-метилпирролидиноне в атмосфере защитного газа при 180 С. Значение Rf: 0,40 (силикагель, петролейный эфир/этилацетат в соотношении 7:3). Масс-спектр (ESI+): m/z=169 [М+Н]+. Получение конечных соединений Пример 1. 1-[(4-Фениламинохиназолин-2-ил)метил]-3-метил-7-(2-6 утин-1-ил)-8-(3-аминопиперидин 1-ил)ксантин. Смесь из 400 мг 1-[(4-фениламинохиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина в 10 мл метиленхлорида смешивают с 2 мл изопропанольной соляной кислоты (5-6-молярной) и перемешивают в течение 3 ч при комнатной температуре. Затем реакционную смесь разбавляют метиленхлоридом, смешивают со смесью воды со льдом и подщелачивают 3-молярным раствором карбоната калия. Водную фазу экстрагируют метиленхлоридом. Объединенные экстракты промывают водой, сушат над сульфатом магния и концентрируют. Остаток в колбе размешивают с диэтиловым эфиром, подвергают вакуум-фильтрации, затем промывают диэтиловым эфиром и сушат в вакууме. Выход: 274 мг (81% от теории).(4) 1-[(2-фенилхиназолин-4-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин: значение Rf: 0,45 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=535 [М+Н]+;(7) 1-[2-(3-циклопропилоксифенил)-2-оксоэтил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантин: значение Rf: 0,45 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=491 [M+H]+;(8) 1-[2-(3-циклопропилметоксифенил)-2-оксоэтил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантин: значение Rf: 0,35 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=505 [М+Н]+;(9) 1-[2-(3-циклобутилоксифенил)-2-оксоэтил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантин: значение Rf: 0,40 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=505 [М+Н]+;(21) 1-2-оксо-2-[2-(пиридин-3-ил)фенил]этил-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантин: значение Rf: 0,55 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=512 [М+Н]+;(23) 1-[(4-циклопропилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантин (бутоксикарбонильную (ВОС-) группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,45 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=499 [М+Н]+;(27) 1-[(3-циано-4-метилхинолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,50 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=497 [M+H]+;(28) 1-[(4,5-диметилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил) ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=487 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,50 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=483 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,38 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:1),масс-спектр (ESI+): m/z=473 [М+Н]+;(34) 1-2-оксо-2-[2-(пиридин-4-ил)фенил]этил-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,55 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=512 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,50 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:1),масс-спектр (ESI+): m/z=484 [М+Н]+;(39) 1-(2-цианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,35 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:1),масс-спектр (ESI+): m/z=432 [М+Н]+;(40) 1-(3-цианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,40 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:1),масс-спектр (ESI+): m/z=432 [М+Н]+;(41) 1-(4-цианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,31 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:1),масс-спектр (ESI+): m/z=432 [М+Н]+;(43) 1-бензил-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): температура плавления: 207-209 С,масс-спектр (ESI+): m/z=407 [М+Н]+;(46) 1-(2,6-дицианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=457 [M+H]+;(47) 1-(2-циано-4-бромбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=510, 512 [М+Н]+;(48) 1-(3-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,45 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=425 [М+Н]+;(49) 1-(3,5-диметоксибензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,45 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=467 [М+Н]+;(50) 1-(2-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,45 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=425 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой),масс-спектр (ESI+): m/z=433 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой):(53) 1-(2-циано-3-хлорбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=466, 468 [M+H]+;(54) 1-(4-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=425 [М+Н]+;(55) 1-(4-хлорбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=441, 443 [М+Н]+;(56) 1-(2-циано-4-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=450 [М+Н]+;(57) 1-(3-циано-4-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=450 [М+Н]+;(58) 1-(2-хлор-4-цианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=466, 468 [М+Н]+;(59) 1-[(5-метоксикарбонилфуран-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=455 [М+Н]+;(60) 1-(2-трифторметил-4-цианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=500 [М+Н]+;(61) 1-(3,5-дицианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=457 [М+Н]+;(62) 1-(3-нитро-4-цианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=477 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,50 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=433 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,50 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=462 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,45 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=462 [М+Н]+;(66) 1-(3-метоксибензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,45 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=437 [М+Н]+;(67) 1-(3-трифторметилбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,60 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=475 [М+Н]+;(68) 1-(3,4-диметоксибензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,50 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=467 [М+Н]+;(69) 1-(3-хлорбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,45 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),- 20010854 масс-спектр (ESI+): m/z=441, 443 [М+Н]+;(70) 1-(4-трифторметилбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,45 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=475 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,60 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=433 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,60 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=433 [М+Н]+;(80) 1-[(пиримидин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,60 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=409 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,65 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=423 [М+Н]+;(82) 1-[(4,6-диметилпиримидин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1 ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): температура плавления: 202-204 С,масс-спектр (ESI+): m/z=437 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,45 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=455 [М+Н]+;(85) 1-(3,4-дифторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,45 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=443 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,40 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=483 [М+Н]+;(90) 1-[(фуран-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=397 [М+Н]+;(91)1-(3,4-дицианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=457 [М+Н]+;(92) 1-[(фуран-3-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=397 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=411 [М+Н]+;(94) 1-[(5-бромфуран-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=475, 477 [М+Н]+;(95) 1-(4-циано-2-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=450 [М+Н]+;(96) 1-(2-циано-5-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=450 [М+Н]+;(97) 1-[(5-цианофуран-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=422 [М+Н]+;(98) 1-(2-циано-6-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=450 [М+Н]+;(99) 1-(4-циано-3-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин (ВОСгруппу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=450 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): масс-спектр (ESI+): m/z=483 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): температура плавления: 166 С,масс-спектр (ESI+): m/z=433 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,50 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=483 [М+Н]+;(104) 1-[(1-метил-1 Н-бензотриазол-5-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантин (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,60 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),- 22010854 масс-спектр (ESI+): m/z=462 [М+Н]+;(105) 1-[(3-цианопиридин-4-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантинтрифторуксусная кислота (ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,65 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=433 [М+Н]+;(ВОС-группу отщепляют обработкой трифторуксусной кислотой): значение Rf: 0,60 (готовая пластина для ТСХ с обращенной фазой (фирма Е. Merck), ацетонитрил/ вода/трифторуксусная кислота в соотношении 50:50:1),масс-спектр (ESI+): m/z=433 [М+Н]+;(107) 1-[(4-цианобензо[1,3]диоксол-5-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантин: значение Rf: 0,45 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:0,1),масс-спектр (ESI+): m/z=476 [М+Н]+. Аналогично рассмотренным выше примерам и иным известным из литературы методам можно также получить следующие соединения:(1)1-(2-циано-4-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(2) 1-(2-циано-5-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(3) 1-(2-циано-6-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(4) 1-(3-циано-4-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(5) 1-(3,5-дицианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(6) 1-(3,4-дицианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(7) 1-(3-нитро-4-цианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(8) 1-(2-хлор-4-цианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(9) 1-(2-фтор-4-цианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(10) 1-(2-трифторметил-4-цианобензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(11) 1-[(5-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(12) 1-[(4-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(13) 1-[(4-цианопиридин-3-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(14) 1-[(3-цианопиридин-4-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(15) 1-[(2-цианопиридин-3-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(16) 1-[(2-цианопиридин-4-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(17) 1-[(5-цианопиридин-3-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(18) 1-[(6-цианопиридин-3-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(19) 1-(2-циано-4-метоксибензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(20) 1-(2-циано-5-метоксибензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(21) 1-[([2,2']бипиридинил-6-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(22) 1-[(5-метоксипиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(23) 1-[(6-фторпиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(24) 1-[(5-циано-6-метоксипиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин 1-ил)ксантин,(25) 1-(2-метоксибензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(26) 1-(3-метоксибензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(27) 1-(3-хлорбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(28) 1-(4-трифторметилбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(29) 1-(3-трифторметилбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(30) 1-(2-трифторметилбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(31) 1-(3,4-диметоксибензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(32) 1-(3,4-диметокси-6-фторбензил)-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин,(33) 1-[(бензо[1,3]диоксол-5-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин. Пример 2. Драже с содержанием действующего вещества 75 мг. Состав из расчета на 1 ядро драже:- 23010854 Получение. Действующее вещество смешивают с фосфатом кальция, кукурузным крахмалом, поливинилпирролидоном, гидроксипропилметилцеллюлозой и половиной от указанного количества стеарата магния. Из полученной смеси на таблетировочной машине получают прессованные продукты диаметром примерно 13 мм, которые протирают на соответствующей машине через сито с размером ячеек 1,5 мм и смешивают с остальным количеством стеарата магния. Из этого гранулята на таблетировочной машине прессуют таблетки заданной формы. Масса ядра: 230 мг. Пуансон: диаметр 9 мм, с вогнутой рабочей поверхностью. На полученные таким путем ядра драже наносят пленочное покрытие, состоящее, в основном, из гидроксипропилметилцеллюлозы. Готовые драже с пленочным покрытием полируют пчелиным воском. Масса драже: 245 мг. Пример 3. Таблетки с содержанием действующего вещества 100 мг. Состав из расчета на 1 таблетку: Получение. Действующее вещество смешивают с лактозой и крахмалом и равномерно увлажняют водным раствором поливинилпирролидона. После продавливания влажной массы через сито (с размером ячеек 2,0 мм) и сушки в решетчатом сушильном шкафу при 50 С продукт вновь просеивают через сито (с размером ячеек 1,5 мм) и примешивают смазывающее вещество. Готовую к прессованию смесь перерабатывают в таблетки. Масса таблетки: 220 мг. Диаметр таблетки: 10 мм, двоякоплоская с двусторонней фасеткой и разделительной насечкой с одной стороны. Пример 4. Таблетки с содержанием действующего вещества 150 мг. Состав из расчета на 1 таблетку: Получение. Смесь действующего вещества с лактозой, кукурузным крахмалом и кремниевой кислотой увлажняют 20%-ным водным раствором поливинилпирролидона и продавливают через сито с размером ячеек 1,5 мм. Высушенный при 45 С гранулят еще раз протирают через то же самое сито и смешивают с указанным количеством стеарата магния. Из этой смеси прессуют таблетки. Масса таблетки: 300 мг. Пуансон: диметр 10 мм, с плоской рабочей поверхностью. Пример 5. Твердожелатиновые капсулы с содержанием действующего вещества 150 мг. Состав из расчета на 1 капсулу:- 24010854 Получение. Действующее вещество смешивают со вспомогательными веществами, просеивают через сито с размером ячеек 0,75 мм и смешивают до гомогенности в соответствующем аппарате. Полученную смесь расфасовывают в твердожелатиновые капсулы размера 1. Масса содержимого капсулы: примерно 320 мг. Оболочка капсулы: твердожелатиновая капсула размера 1. Пример 6. Суппозитории с содержанием действующего вещества 150 мг. Состав из расчета на 1 свечу: Получение. После расплавления массы для суппозиториев в ней гомогенно диспергируют действующее вещество и расплавленную массу разливают по предварительно охлажденным формам. Пример 7. Суспензия с содержанием действующего вещества 50 мг. Состав из расчета на 100 мл суспензии: Получение. Дистиллированную воду нагревают до 70 С. Далее в ней при перемешивании растворяют метиловый и пропиловый эфиры n-гидроксибензойной кислоты, а также глицерин и натриевую соль карбоксиметилцеллюлозы. Раствор охлаждают до комнатной температуры, при перемешивании добавляют к нему действующее вещество и диспергируют до гомогенности. После добавления и растворения сахара, раствора сорбита и ароматизатора суспензию для удаления из нее воздуха вакуумируют при перемешивании. В 5 мл суспензии содержание действующего вещества составляет 50 мг. Пример 8. Ампулы с содержанием действующего вещества 10 мг. Состав: Получение. Действующее вещество растворяют в необходимом количестве 0,01 н. HCl, раствору добавлением поваренной соли придают изотоничность, после чего стерилизуют фильтрацией и расфасовывают в 2 миллилитровые ампулы. Пример 9. Ампулы с содержанием действующего вещества 50 мг. Состав: Получение. Действующее вещество растворяют в необходимом количестве 0,01 н. HCl, раствору добавлением- 25010854 поваренной соли придают изотоничность, после чего стерилизуют фильтрацией и расфасовывают в 10 миллилитровые ампулы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы в которой R имеет указанные в п.1 значения,а также их таутомеры и соли. 3. Соединение общей формулы в которой R имеет указанные в п.1 значения,а также их таутомеры и соли. 4. Соединение общей формулы Ia по п.2, в которой R обозначает (3-цианопиридин-2-ил)метильную группу, а также его соли. 5. Физиологически совместимые соли соединений по любому из пп.1-4 с неорганическими или органическими кислотами. 6. Физиологически совместимые соли соединения формулы Ia по п.4 с неорганическими или органическими кислотами. 7. Лекарственное средство, содержащее соединение по любому из пп.1-4 или физиологически совместимую соль по п.5 или 6 и необязательно один или несколько инертных носителей и/или разбавителей. 8. Лекарственное средство, содержащее соединение формулы Ia по п.4 или физиологически совместимую соль по п.6 и необязательно один или несколько инертных носителей и/или разбавителей. 9. Лекарственное средство, содержащее физиологически совместимую соль по п.6 и необязательно один или несколько инертных носителей и/или разбавителей. 10. Применение соединения по любому из пп.1-6 для получения лекарственного средства, пригодного для лечения сахарного диабета типа I и типа II, артрита, ожирения, отторжения аллотрансплантата и вызванного кальцитонином остеопороза. 11. Способ получения лекарственного средства по п.7, отличающийся тем, что соединение по любому из пп.1-6 нехимическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями. 12. Способ получения лекарственного средства по п.8, отличающийся тем, что соединение формулыIa по п.4 или физиологически совместимую соль по п.6 нехимическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями. 13. Способ получения лекарственного средства по п.9, отличающийся тем, что физиологически совместимую соль по п.6 нехимическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями. 14. Способ получения соединений общей формулы I по любому из пп.1-6, отличающийся тем, что соединение общей формулы в которой R имеет указанные в п.1 значения, a Z1 обозначает уходящую группу, такую как атом галогена,замещенная гидроксигруппа, меркаптогруппа, сульфинильная группа, сульфонильная группа или сульфонилоксигруппа, подвергают взаимодействию с 3-аминопиперидином, его энантиомерами или его солями и затем при необходимости отщепляют возможно использовавшиеся на время реакции защитные группы, и/или полученные таким путем соединения общей формулы I разделяют на их энантиомеры и/или диастереомеры, и/или полученные соединения формулы I переводят в их соли, прежде всего для их фармацевтического применения переводят в их физиологически совместимые соли с неорганическими или органическими кислотами. 15. Способ получения соединений общей формулы I по любому из пп.1-6, отличающийся тем, что в соединении общей формулы в которой R имеет указанные в п.1 значения, удаляют защитную группу, и/или полученные таким путем соединения общей формулы I разделяют на их энантиомеры и/или диастереомеры, и/или полученные соединения формулы I переводят в их соли, прежде всего для их фармацевтического применения переводят в их физиологически совместимые соли с неорганическими или органическими кислотами.
МПК / Метки
МПК: C07D 473/04, A61K 31/437, A61P 3/10
Метки: получение, качестве, ингибиторов, применение, 8-[3-аминопиперидин-1-ил]ксантины
Код ссылки
<a href="https://eas.patents.su/29-10854-8-3-aminopiperidin-1-ilksantiny-ih-poluchenie-i-ih-primenenie-v-kachestve-ingibitorov-dpp-iv.html" rel="bookmark" title="База патентов Евразийского Союза">8-[3-аминопиперидин-1-ил]ксантины, их получение и их применение в качестве ингибиторов dpp – iv</a>
Предыдущий патент: Изготовление цинковых химических реактивов из неосновного потока процесса
Следующий патент: Замороженная в виде гранул культура молочнокислых бактерий, применение культуры и способ ее получения
Случайный патент: Способ выделения энантиомерных компонентов из смеси энантиомеров в результате проведения кристаллизации, контролируемой по размеру частиц


































