Бензимидазолы, их получение и их применение в качестве лекарственных средств
Номер патента: 3947
Опубликовано: 30.10.2003
Авторы: Кауффманн Ириз, Припке Хеннинг, Нар Герберт, Хауэль Норберт, Штассен Еан Марие, Риз Уве, Винен Вольфганг
Формула / Реферат
1. Бензимидазолы общей формулы I
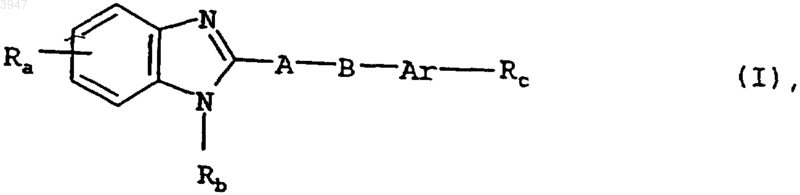
в которой Ar обозначает необязательно замещенную атомом фтора, хлора либо брома, трифторметильной, C1-C3алкильной либо C1-C3алкоксигруппой фениленовую или нафтиленовую группу,
или обозначает необязательно замещенную в углеродном скелете C1-C3алкильной группой тиениленовую, тиазолиленовую, пиридиниленовую, пиримидиниленовую, пиразиниленовую или пиридазиниленовую группу,
A обозначает C1-C3алкиленовую группу,
B обозначает атом кислорода либо серы, метиленовую, карбонильную, сульфинильную или сульфонильную группу, необязательно замещенную C1-C3алкильной группой аминогруппу, в которой алкильный фрагмент может быть одно- либо двузамещенным карбоксигруппой,
Ra обозначает R1-CO-C3-C5циклоалкильную группу, где
R1 представляет собой
- C1-C3алкокси-, амино-, C1-C4алкиламино- либо ди(C1-C4алкил)аминогруппу, в которых соответственно алкильный фрагмент может быть замещен карбоксигруппой,
- 4-7-членную циклоалкиленимино- либо циклоалкенилениминогруппу, которые могут быть замещены одной или двумя C1-C3алкильными группами, при этом один алкильный заместитель одновременно может быть замещен гидрокси-, C1-C3алкокси-, карбокси-, карбокси-C1-C3алкокси-, карбокси-C1-C3алкиламино-, N-(C1-C3алкил)-N-(карбокси-C1-C3алкил)амино-, карбокси-C1-C3алкиламинокарбонильной, N-(C1-C3алкил)-N-(карбокси-C1-C3алкил)аминокарбонильной, карбокси-C1-C3алкиламинокарбониламино-, 1-(C1-C3алкил)-3-(карбокси-C1-C3алкил)аминокарбониламино-, 3-(C1-C3алкил)-3-(карбокси-C1-C3алкил)аминокарбониламино- либо 1,3-ди(C1-C3алкил)-3-(карбокси-C1-C3алкил)аминокарбониламиногруппой,
- замещенную гидроксигруппой 4-7-членную циклоалкилениминогруппу,
- необязательно замещенную C1-C3алкильной группой 5-7-членную циклоалкилениминогруппу, с которой через два смежных атома углерода сконденсировано фенильное кольцо,
- морфолиновую, пиперазиновую, N-(C1-C3алкил)пиперазиновую, пирролиновую, 3,4-дегидропиперидиновую или пиррол-1-ильную группу,
или обозначает R2-CX-C3-C5циклоалкильную группу, где
R2 представляет собой необязательно замещенную C1-C3алкильной группой фенильную, нафтильную либо моноциклическую 5- или 6-членную гетероарильную группу, при этом 6-членная гетероарильная группа содержит один, два или три атома азота, а 5-членная гетероарильная группа содержит необязательно замещенную C1-C3алкильной группой иминогруппу, один атом кислорода либо серы или необязательно замещенную C1-C3алкильной группой иминогруппу и один атом кислорода либо серы или один либо два атома азота и упомянутый выше алкильный заместитель может быть замещен карбокси-, карбокси-C1-C3алкокси-, карбокси-C1-C3алкиламино- либо N-(C1-C3алкил)карбокси-C1-C3алкиламиногруппой, и
X представляет собой атом кислорода, C1-C3алкилимино-, C1-C3алкоксиимино-, C1-C3алкилгидразиновую, ди(C1-C3алкил)гидразиновую, C2-C4алканоилгидразиновую, N-(C1-C3алкил)-C2-C4алканоилгидразиновую или C1-C3алкилиденовую группу, каждая из которых соответственно в алкильном или алканоильном фрагменте либо в алкильном и алканоильном фрагментах может быть замещена карбоксигруппой,
или обозначает замещенную имидазольной либо имидазолоновой группой C1-C3алкильную или C3-C5циклоалкильную группу, где имидазольное кольцо может быть замещено фенильной либо карбоксигруппой и одной или двумя C1-C3алкильными группами либо одной, двумя или тремя C1-C3алкильными группами, при этом заместители могут быть идентичными или разными и один из вышеназванных алкильных заместителей одновременно может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, C2-C4алканоиламино-, C1-C3алкиламино-, N-(C2-C4алканоил)-C1-C3алкиламино- либо ди(C1-C3алкил)аминогруппой, а имидазолоновое кольцо может быть замещено C1-C3алкильной группой, при этом алкильный заместитель может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, C2-C4алканоиламино-, C1-C3алкиламино-, N-(C2-C4алканоил)-C1-C3алкиламино- либо ди(C1-C3алкил)аминогруппой, и дополнительно с вышеуказанными имидазольным и имидазолоновым кольцами через два смежных атома углерода может быть сконденсировано фенильное либо пиридиновое кольцо,
или обозначает имидазолидин-2,4-дион-5-ильную группу, которая может быть замещена одной или двумя C1-C3алкильными группами, при этом одновременно один алкильный заместитель может быть замещен карбоксигруппой,
или обозначает C1-C4алкильную группу, замещенную
- C1-C3алкил-Y1-C1-C3алкильной, HOOC-C1-C3алкил-Y1-C1-C3алкильной, тетразолил-C1-C3алкил-Y2-, R3NR4- или R3NR4-C1-C3алкильной группой и
- необязательно замещенной C1-C3алкильной группой изоксазолидинилкарбонильной группой, пирролинокарбонильной, 3,4-дегидропиперидинокарбонильной, пирролил-1-илкарбонильной, карбокси-, аминокарбонильной, C1-C3алкиламинокарбонильной, ди(C1-C3алкил)аминокарбонильной или 4-7-членной циклоалкилениминокарбонильной группой, при этом в вышеназванных группах циклоалкилениминовый фрагмент замещен одной либо двумя C1-C3алкильными группами и одновременно в каждой из указанных выше C1-C3алкиламинокарбонильных, ди(C1-C3алкил)аминокарбонильных или циклоалкилениминокарбонильных групп один алкильный фрагмент или алкильный заместитель может быть соответственно замещен карбоксигруппой, а остальные атомы водорода C1-C4алкильной группы могут быть полностью либо частично заменены на атомы фтора, где
R3 представляет собой атом водорода или необязательно замещенную карбоксигруппой C1-C3алкильную группу, а
R4 представляет собой атом водорода, C1-C3алкил-Y1-C1-C3алкил-Y2-, карбокси-C1-C3алкил-Y1-C1-C3алкил-Y2-, C1-C3алкил-Y2- или карбокси-C1-C3алкил-Y2-группу или
R3 и R4 вместе с расположенным между ними атомом азота представляют собой необязательно замещенную карбокси-, C1-C3алкильной либо карбокси-C1-C3алкильной группой 4-7-членную циклоалкилениминогруппу, при этом
Y1 представляет собой углерод-углеродную связь, атом кислорода, сульфенильную, сульфинильную, сульфонильную, -NH-, -NH-CO- или -NH-CO-NH-группу, а
Y2 представляхт собой углерод-азотную связь или карбонильную, сульфонильную, имино- либо -NH-CO-группу, причем карбонильная группа в составе -NH-CO-группы соединена с атомом азота R3NR4-группы, а каждая из указанных при расшифровке значений остатков Y1 и Y2 иминогрупп дополнительно может быть замещена соответственно C1-C3алкильной либо карбокси -C1-C3алкильной группой,
или обозначает замещенную R5NR6-группой C1-C3алкильную или C3-C5циклоалкильную группу, где
R5 представляет собой атом водорода, C1-C3алкильную, C5-C7циклоалкильную, фенилкарбонильную, фенилсульфонильную или пиридинильную группу, а
R6 представляет собой C1-C3алкильную, карбокси-C1-C3алкильную или карбокси-C1-C3алкилкарбонильную группу,
или обозначает C1-C3алкильную группу, замещенную C2-C4алканоильной либо C5-C7циклоалканоильной группой, и замещенную атомом хлора, брома либо иода C1-C3алкильную группу,
Rb обозначает атом водорода или C1-C3алкильную группу и
Rc обозначает цианогруппу или необязательно замещенную одной либо двумя C1-C3алкильными группами амидиновую группу, причем указанные при расшифровке значений вышеназванных остатков карбоксигруппы могут быть, кроме того, заменены на группу, переводимую in vivo в карбоксигруппу, либо на отрицательно заряженную в физиологических условиях группу; или
указанные при расшифровке значений вышеназванных остатков амино- и иминогруппы могут быть, кроме того, замещены отщепляемой in vivo группой;
при этом под группой, переводимой in vivo в карбоксигруппу, имеются в виду, например, гидроксиметильная группа, этерифицированная спиртом карбоксигруппа, в которой спиртовой фрагмент представляет собой предпочтительно C1-C6алканол, фенил-C1-C3алканол, C3-C9циклоалканол, при этом C5-C8циклоалканол дополнительно может быть замещен одной либо двумя C1-C3алкильными группами, C5-C8циклоалканол, в котором метиленовая группа в положении 3 или 4 заменена на атом кислорода либо на необязательно замещенную C1-C3алкильной, фенил-C1-C3алкильной, фенил-C1-C3алкоксикарбонильной или C2-C6алканоильной группой иминогруппу, а циклоалканольный фрагмент дополнительно может быть замещен одной либо двумя C1-C3алкильными группами, C4-C7циклоалкенол, C3-C5алкенол, фенил-C3-C5алкенол, C3-C5алкинол или фенил-C3-C5алкинол, при условии, что отсутствует связь между атомом кислорода и атомом углерода, несущим двойную либо тройную связь, C3-C8циклоалкил-C1-C3алканол, бициклоалканол с в общей сложности 8-10 атомами углерода, который в бициклоалкильном фрагменте дополнительно может быть замещен одной либо двумя C1-C3алкильными группами, 1,3-дигидро-3-оксо-1-изобензфуранол или же спирт формулы
Rd-CO-O-(ReCRf)-OH,
где Rd представляет собой C1-C8алкильную, C5-C7циклоалкильную, фенильную либо фенил-C1-C3алкильную группу,
Re представляет собой атом водорода, C1-C3алкильную, C5-C7циклоалкильную либо фенильную группу и
Rf представляет собой атом водорода либо C1-C3алкильную группу;
под отрицательно заряженной в физиологических условиях группой имеются в виду такие группы, как тетразол-5-ильная, фенилкарбониламинокарбонильная, трифторметилкарбониламинокарбонильная, C1-C6алкилсульфониламино-, фенилсульфониламино-, бензилсульфониламино-, трифторметилсульфониламино-, C1-C6алкилсульфониламинокарбонильная, фенилсульфониламинокарбонильная, бензилсульфониламинокарбонильная или перфтор-C1-C6алкилсульфониламинокарбонильная группа, а
под отщепляемой in vivo от имино- или аминогруппы группой имеются в виду, например, гидроксигруппа, ацильная группа, такая как одно- либо двузамещенная атомами фтора, хлора, брома или иода, C1-C3алкильными либо C1-C3алкоксигруппами бензоильная группа, при этом заместители могут быть идентичными или разными, пиридиноильная группа или C1-C16алканоильная группа, такая как формильная, ацетильная, пропионильная, бутаноильная, пентаноильная и гексаноильная группа, 3,3,3-трихлорпропионильная либо аллилоксикарбонильная группа, C1-C16алкоксикарбонильная либо C1-C16алкилкарбонилоксигруппа, в которых атомы водорода полностью или частично могут быть заменены на атомы фтора либо хлора, такие как метоксикарбонильная, этоксикарбонильная, пропоксикарбонильная, изопропоксикарбонильная, бутоксикарбонильная, трет-бутоксикарбонильная, пентоксикарбонильная, гексоксикарбонильная, октилоксикарбонильная, нонилоксикарбонильная, децилоксикарбонильная, ундецилоксикарбонильная, додецилоксикарбонильная, гексадецилоксикарбонильная, метилкарбонилокси-, этилкарбонилокси-, 2,2,2-трихлорэтилкарбонилокси-, пропилкарбонилокси-, изопропилкарбонилокси-, бутилкарбонилокси-, трет-бутилкарбонилокси-, пентилкарбонилокси-, гексилкарбонилокси-, октилкарбонилокси-, нонилкарбонилокси-, децилкарбонилокси-, ундецилкарбонилокси-, додецилкарбонилокси- или гексадецилкарбонилоксигруппа, фенил-C1-C6алкоксикарбонильная группа, такая как бензилоксикарбонильная, фенилэтоксикарбонильная или фенилпропоксикарбонильная группа, 3-аминопропионильная группа, в которой аминогруппа является одно- либо двузамещенной C1-C6алкильными или C3-C7циклоалкильными группами и заместители могут быть идентичными или разными, C1-C3алкилсульфонильная, C2-C4алкоксикарбонильная, C1-C3алкокси-C2-C4алкокси-C2-C4алкоксикарбонильная, Rd-CO-O-(RdCRf)-O-CO-, C1-C6алкил-CO-NH-(RgCRh)-O-CO- или C1-C6алкил-CO-O-(RgCRh)-(RgCRh)-O-CO-группа, в которых Rd-Rf имеют значения, указанные выше, а
Rg и Rh, которые могут быть идентичными или разными, представляют собой атомы водорода или C1-C3алкильные группы;
их таутомеры, их стереоизомеры, их смеси и их соли.
2. Бензимидазолы общей формулы Ia
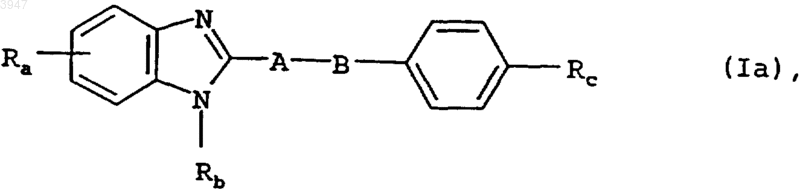
в которой
A обозначает C1-C3алкиленовую группу,
B обозначает атом кислорода либо серы, метиленовую, карбонильную, сульфинильную или сульфонильную группу, необязательно замещенную C1-C3алкильной группой аминогруппу, в которой алкильный фрагмент может быть одно- либо двузамещенным карбоксигруппой,
Ra обозначает R1-CO-C3-C5циклоалкильную группу, где
R1 представляет собой
- C1-C3алкокси-, амино-, C1-C4алкиламино- либо ди(C1-C4алкил)аминогруппу, в которых соответственно алкильный фрагмент может быть замещен карбоксигруппой,
- 4-7-членную циклоалкиленилимино- либо циклоалкенилениминогруппу, которые могут быть замещены одной или двумя C1-C3алкильными группами, при этом офшэ алкильный заместитель одновременно может быть замещен гидрокси-, C1-C3алкокси-, карбокси-, карбокси-C1-C3алкокси-, карбокси-C1-C3алкиламино-, N-(C1-C3алкил)-N-(карбокси-C1-C3алкил)амино-, карбокси-C1-C3алкиламинокарбонильной, N-(C1-C3алкил)-N-(карбокси-C1-C3алкил)аминокарбонильной, карбокси-C1-C3алкиламинокарбониламино-, 1-(C1-C3алкил)-3-(карбокси-C1-C3алкил)аминокарбониламино-, 3-(C1-C3алкил)-3-(карбокси-C1-C3алкил)аминокарбониламино- либо 1,3-ди(C1-C3алкил)-3-(карбокси-C1-C3алкил)аминокарбониламиногруппой,
- замещенную гидроксигруппой 4-7-членную циклоалкилениминогруппу,
- необязательно замещенную C1-C3алкильной группой 5-7-членную циклоалкилениминогруппу, с которой через два смежных атома углерода сконденсировано фенильное кольцо,
- морфолиновую, пиперазиновую, N-(C1-C3алкил)пиперазиновую, пирролиновую, 3,4-дегидропиперидиновую или пиррол-1-ильную группу,
или обозначает R2-CX-C3-C5циклоалкильную группу, где
R2 представляет собой необязательно замещенную C1-C3алкильной группой фенильную, нафтильную либо моноциклическую 5- или 6-членную гетероарильную группу, при этом 6-членная гетероарильная группа содержит один, два или три атома азота, а 5-членная гетероарильная группа содержит необязательно замещенную C1-C3алкильной группой иминогруппу, один атом кислорода либо серы или необязательно замещенную C1-C3алкильной группой иминогруппу и один атом кислорода либо серы или один либо два атома азота и упомянутый выше алкильный заместитель может быть замещен карбокси-, карбокси-C1-C3алкокси-, карбокси-C1-C3алкиламино- либо N-(C1-C3алкил)карбокси-C1-C3алкиламиногруппой, и
X представляет собой атом кислорода, C1-C3алкилимино-, C1-C3алкоксиимино-, C1-C3алкилгидразиновую, ди(C1-C3алкил)гидразиновую, C2-C4алканоилгидразиновую, N-(C1-C3алкил)-C2-C4алканоилгидразиновую или C1-C3алкилиденовую группу, каждая из которых соответственно в алкильном или алканоильном фрагменте либо в алкильном и алканоильном фрагментах может быть замещена карбоксигруппой,
или обозначает замещенную имидазольной либо имидазолоновой группой C1-C3алкильную или C3-C5циклоалкильную группу, где имидазольное кольцо может быть замещено фенильной либо карбоксигруппой и одной или двумя C1-C3алкильными группами либо одной, двумя или тремя C1-C3алкильными группами, при этом заместители могут быть идентичными или разными и один из вышеназванных алкильных заместителей одновременно может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, C2-C4алканоиламино-, C1-C3алкиламино-, N-(C2-C4алканоил)-C1-C3алкиламино- либо ди(C1-C3алкил)аминогруппой, а имидазолоновое кольцо может быть замещено C1-C3алкильной группой, при этом алкильный заместитель может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, C2-C4алканоиламино-, C1-C3алкиламино-, N-(C2-C4алканоил)-C1-C3алкиламино- либо ди(C1-C3алкил)аминогруппой, и дополнительно с вышеуказанными имидазольным и имидазолоновым кольцами через два смежных атома углерода может быть сконденсировано фенильное либо пиридиновое кольцо,
или обозначает имидазолидин-2,4-дион-5-ильную группу, которая может быть замещена одной или двумя C1-C3алкильными группами, при этом одновременно один алкильный заместитель может быть замещен карбоксигруппой,
или обозначает C1-C4алкильную группу, замещенную
- C1-C3алкил-Y1-C1-C3алкильной, HOOC-C1-C3алкил-Y1-C1-C3алкильной, тетразолил-C1-C3алкил-Y2-, R3 NR4- или R3NR4-C1-C3алкильной группой и
- необязательно замещенной C1-C3алкильной группой изоксазолидин-1-илкарбонильной группой, пирролинокарбонильной, 2,3-дегидропиперидинокарбонильной, пирролил-1-илкарбонильной, карбокси-, аминокарбонильной, C1-C3алкиламинокарбонильной, ди(C1-C3алкил)аминокарбонильной или 4-7-членной циклоалкилениминокарбонильной группой, при этом в вышеназванных группах циклоалкилениминовый фрагмент замещен одной либо двумя C1-C3алкильными группами и одновременно в каждой из указанных выше C1-C3алкиламинокарбонильных, ди(C1-C3алкил)аминокарбонильных или циклоалкилениминокарбонильных групп один алкильный фрагмент или алкильный заместитель может быть соответственно замещен карбоксигруппой, а остальные атомы водорода C1-C4алкильной группы могут быть полностью либо частично заменены на атомы фтора, где
R3 представляет собой атом водорода или необязательно замещенную карбоксигруппой C1-C3алкильную группу, а
R4 представляет собой атом водорода, C1-C3алкил-Y1-C1-C3алкил-Y2-, карбокси-C1-C3алкил-Y1-C1-C3алкил-Y2-, C1-C3алкил-Y2- или карбокси-C1-C3алкил-Y2-группу или
R3 и R4 вместе с расположенным между ними атомом азота представляют собой необязательно замещенную карбокси-, C1-C3алкильной либо карбокси-C1-C3алкильной группой 4-7-членную циклоалкилениминогруппу, при этом
Y1 представляет собой углерод-углеродную связь, атом кислорода, сульфенильную, сульфинильную, сульфонильную, -NH-, -NH-CO- или -NH-CO-NH-группу, а
Y2 представляет собой углерод-азотную связь или карбонильную, сульфонильную, имино- либо -NH-CO-группу, причем карбонильная группа в составе -NH-CO-группы соединена с атомом азота R3NR4-группы, а каждая из указанных при расшифровке значений остатков Y1 и Y2 иминогрупп дополнительно может быть замещена соответственно C1-C3алкильной либо карбокси-C1-C3алкильной группой,
или обозначает замещенную R5NR6-группой C1-C3алкильную или C3-C5циклоалкильную группу, где
R5 представляет собой атом водорода, C1-C3алкильную, C5-C7циклоалкильную, фенилкарбонильную, фенилсульфонильную или пиридинильную группу, а
R6 представляет собой C1-C3алкильную, карбокси-C1-C3алкильную или карбокси-C1-C3алкилкарбонильную группу,
или обозначает C1-C3алкильную группу, замещенную C2-C4алканоильной либо C5-C7циклоалканоильной группой и замещенную атомом хлора, брома либо иода C1-C3алкильную группу,
Rb обозначает атом водорода или C1-C3алкильную группу и
Rc обозначает цианогруппу или амидиновую группу, которая может быть замещхэр гидроксигруппой, одной либо двумя C1-C3алкильными группами, одной либо двумя C1-C8алкоксикарбонильными группами, при этом указанные выше при расшифровке значений остатков карбоксигруппы могут быть, кроме того, заменены на группу, переводимую in vivo в карбоксигруппу и охарактеризованную в соответствии с п.1, либо на отрицательно заряженную в физиологических условиях группу, а указанные выше при расшифровке значений остатков амино- и иминогруппы могут быть замещены, кроме того, охарактеризованной в соответствии с п.1 отщепляемой in vivo группой,
их таутомеры, их стереоизомеры и их соли.
3. Бензимидазолы общей формулы Iа по п.2, в которой
A обозначает C1-C3алкиленовую группу,
B обозначает атом кислорода, метиленовую, амино- или N-(C1-C3алкил)аминогруппу, в которой алкильный фрагмент может быть замещен карбоксигруппой,
Ra обозначает замещенную в положении 1 R1-CO-группой C3-C5циклоалкильную группу, где
R1 представляет собой
- C1-C3алкокси-, амино-, C1-C4алкиламино- либо ди(C1-C4алкил)аминогруппу, в каждой из которых соответственно алкильный фрагмент может быть замещен карбоксигруппой,
- 4-7-членную циклоалкилениминогруппу, которая может быть замещена гидроксигруппой либо одной или двумя C1-C3алкильными группами, при этом один алкильный заместитель одновременно может быть замещен гидрокси-, C1-C3алкокси-, карбокси-, карбокси-C1-C3алкокси-, карбокси-C1-C3алкиламино-, N-(C1-C3алкил)-N-(карбокси-C1-C3алкил)амино-, карбокси-C1-C3алкиламинокарбонильной, N-(C1-C3алкил)-N-(карбокси-C1-C3алкил)аминокарбонильной, карбокси-C1-C3алкиламинокарбониламино-, 1-(C1-C3алкил)-3-(карбокси-C1-C3алкил)аминокарбониламино-, 3-(C1-C3алкил)-3-(карбокси-C1-C3алкил)аминокарбониламино- либо 1,3-ди(C1-C3алкил)-3-(карбокси-C1-C3алкил)аминокарбониламиногруппой,
- необязательно замещенную C1-C3алкильной группой 5-7-членную циклоалкилениминогруппу, с которой через два смежных атома углерода сконденсировано фенильное кольцо,
- морфолиновую, пиперазиновую, N-(C1-C3алкил)пиперазиновую, пирролиновую, 3,4-дегидропиперидиновую или пиррол-1-ильную группу,
или обозначает замещенную в положении 1 R2-CX-группой C3-C5циклоалкильную группу, где
R2 представляет собой необязательно замещенную C1-C3алкильной группой фенильную, нафтильную либо моноциклическую 5- или 6-членную гетероарильную группу, при этом 6-членная гетероарильная группа содержит один, два или три атома азота, а 5-членная гетероарильная группа содержит необязательно замещенную C1-C3алкильной группой иминогруппу, один атом кислорода либо серы или необязательно замещенную C1-C3алкильной группой иминогруппу и один атом кислорода либо серы или один либо два атома азота и упомянутый выше алкильный заместитель может быть замещен карбокси-, карбокси-C1-C3алкокси-, карбокси-C1-C3алкиламино- либо N-(C1-C3алкил)карбокси-C1-C3алкиламиногруппой, и
X представляет собой атом кислорода, C1-C3алкилимино-, C1-C3алкоксиимино- или C1-C3алкилиденовую группу, которые соответственно в алкильном либо алкоксифрагменте могут быть замещены карбоксигруппой,
или обозначает замещенную в положении 1 имидазольной либо имидазолоновой группой C1-C3алкильную группу, где
имидазольное кольцо может быть замещено фенильной либо карбоксигруппой и одной или двумя C1-C3алкильными группами либо одной, двумя или тремя C1-C3алкильными группами, при этом заместители могут быть идентичными или разными и один из вышеназванных алкильных заместителей одновременно может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, C2-C4алканоиламино-, C1-C3алкиламино-, N-(C2-C4алканоил)-C1-C3алкиламино- либо ди(C1-C3алкил)аминогруппой, а имидазолоновое кольцо может быть замещено C1-C3алкильной группой, при этом алкильный заместитель может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, C2-C4алканоиламино-, C1-C3алкиламино-, N-(C2-C4алканоил)-C1-C3алкиламино- либо ди(C1-C3алкил)аминогруппой, и дополнительно с вышеуказанными имидазольным и имидазолоновым кольцами через два смежных атома углерода может быть сконденсировано фенильное либо пиридиновое кольцо,
или обозначает имидазолидин-2,4-дион-5-ильную группу, которая может быть замещена одной либо двумя C1-C3алкильными группами, при этом одновременно один алкильный заместитель может быть замещен карбоксигруппой,
или обозначает C1-C4алкильную группу, замещенную в положении 1
- R3NR4- или R3NR4-C1-C3алкильной группой и
- пирролинокарбонильной, 2,3-дегидропиперидинокарбонильной, имидазол-1-илкарбонильной, карбокси-, аминокарбонильной, C1-C3алкиламинокарбонильной, ди(C1-C3алкил)аминокарбонильной, изоксазолидин-1-илкарбонильной или 4-7-членной циклоалкилениминокарбонильной группой, при этом в вышеназванных группах циклоалкилениминовый фрагмент замещен одной либо двумя C1-C3алкильными группами и одновременно в каждой из указанных выше C1-C3алкиламинокарбонильных, ди(C1-C3алкил)аминокарбонильных или циклоалкилениминокарбонильных групп один алкильный фрагмент или алкильный заместитель может быть соответственно замещен карбоксигруппой, а остальные атомы водорода C1-C4алкильной группы могут быть полностью либо частично заменены на атомы фтора, где
R3 представляет собой атом водорода или необязательно замещенную карбоксигруппой C1-C3алкильную группу, а
R4 представляет собой атом водорода, C1-C3алкил-Y2- или карбокси-C1-C3алкил-Y2-группу, или
R3 и R4 вместе с расположенным между ними атомом азота представляют собой необязательно замещенную в положении 1 карбокси-, C1-C3алкильной либо карбокси-C1-C3алкильной группой 4-7-членную циклоалкилениминогруппу, при этом
Y2 представляет собой углерод-азотную связь или карбонильную, имино- либо -NH-CO-группу, причем карбонильная группа в составе -NH-CO-группы соединена с атомом азота R3NR4-группы, а указанная при расшифровке значений остатка Y2 иминогруппа дополнительно может быть замещена C1-C3алкильной либо карбокси-C1-C3алкильной группой,
или обозначает замещенную в положении 1 R5NR6-группой C1-C3алкильную или C3-C5циклоалкильную группу, где
R5 представляет собой атом водорода, C1-C3алкильную, C5-C7циклоалкильную, фенилкарбонильную, фенилсульфонильную или пиридинильную группу, а
R6 представляет собой C1-C3алкильную, карбокси-C1-C3алкильную шыш карбокси-C1-C3алкилкарбонильную группу,
или обозначает C1-C3алкильную группу, замещенную C2-C4алканоильной либо C5-C7циклоалканоильной группой, и замещенную атомом хлора, брома либо иода C1-C3алкильную группу,
Rb обозначает C1-C3алкильную группу и
Rc обозначает необязательно замещенную 2,2,2-трихлорэтоксикарбонильной, C1-C8алкоксикарбонильной, ацетоксиметилоксикарбонильной, бензилоксикарбонильной или бензоильной группой амидиновую группу, при этом бензоильный фрагмент может быть одно- либо двузамещенным атомами фтора, хлора, брома либо иода, C1-C3алкильными или C1-C3алкоксигруппами, и заместители могут быть идентичными либо разными,
их C1-C3алканоловые эфиры, их таутомеры, их стереоизомеры и их соли.
4. Бензимидазолы общей формулы Ia по п.2, в которой
A обозначает метиленовую группу,
B обозначает атом кислорода или аминогруппу,
Ra обозначает замещенную в положении 1 R1-CO-группой циклопропильную группу, где
R1 представляет собой необязательно замещенную метильной либо этильной группой пирролидиновую или пиперидиновую группу, в каждой из которых соответственно метильный либо этильный фрагмент может быть замещен карбокси-, карбокси-C1-C3алкокси-, карбокси-C1-C3алкиламино- или N-(C1-C3алкил)карбокси-C1-C3алкиламиногруппой,
или обозначает замещенную в положении 1 R2-CX-группой циклопропильную группу, где
R2 представляет собой необязательно замещенную C1-C3алкильной группой фенильную, пиридильную или пиразолильную группу, а
X представляет собой атом кислорода, C1-C3алкоксиимино- или C1-C3алкилиденовую группу, замещенные соответственно в алкильном либо алкоксифрагменте карбоксигруппой,
или обозначает замещенную в положении 1 имидазольной группой C1-C2алкильную группу, где имидазольное кольцо может быть замещено фенильной или карбоксигруппой и одной либо двумя C1-C3алкильными группами или одной, двумя либо тремя C1-C3алкильными группами, при этом заместители могут быть идентичными либо разными, а один из вышеназванных алкильных заместителей одновременно может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, C2-C4алканоиламино-, C1-C3алкиламино-, N-(C2-C4алканоил)-C1-C3алкиламино- или ди(C1-C3алкил)аминогруппой, при этом дополнительно с указанными выше имидазольными кольцами через два смежных атома углерода может быть сконденсировано фенильное либо пиридиновое кольцо, или обозначает замещенную в положении 1 бензимидазолон-1-ильной группой C1-C2алкильную группу, при этом имидазолоновое кольцо может быть замещено необязательно замещенной карбоксигруппой метильной либо этильной группой,
или обозначает метильную или этильную группу, замещенную в положении 1
- R3NR4- или R3NR4-C1-C3алкильной группой и
- ди(C1-C3алкил)аминокарбонильной группой, изоксазолидин-1-илкарбонильной группой, необязательно замещенной C1-C3алкильной группой пирролидинокарбонильной либо пиперидинокарбонильной группой, при этом один алкильный фрагмент или алкильный заместитель в указанных выше группах может быть замещен карбоксигруппой, где
R3 представляет собой атом водорода или необязательно замещенную карбоксигруппой C1-C3алкильную группу, а
R4 представляет собой атом водорода, C1-C3алкил-Y2- или карбокси-C1-C3алкил-Y2-группу или
R3 и R4 вместе с расположенным между ними атомом азота представляют собой необязательно замещенную карбоксигруппой 4-7-членную циклоалкилениминогруппу, при этом
Y2 представляет собой углерод-азотную связь, карбонильную группу или необязательно замещенную C1-C3алкильной группой иминогруппу, или обозначает замещенную в положении 1 R5NR6-группой C1-C2алкильную группу, где
R5 представляет собой пиридинильную, фенилкарбонильную или фенилсульфонильную группу, а
R6 представляет собой C1-C3алкильную или карбокси-C1-C3алкильную группу,
или обозначает замещенную в положении 3 атомом хлора н-пропильную группу, замещенную в положении 1 циклопентилкарбонильной группой, или обозначает замещенную в положении 1 циклопентиламиногруппой циклопропильную группу, замещенную у атома азота карбокси-C1-C3алкилкарбонильной группой,
Rb обозначает метильную группу и
Rc обозначает необязательно замещенную C1-C8алкоксикарбонильной, ацетоксиметилоксикарбонильной, 2,2,2-трихлорэтоксикарбонильной, бензилоксикарбонильной либо бензоильной группой амидиновую группу,
их C1-C3алканоловые эфиры, их таутомеры, их стереоизомеры и их соли.
5. Бензимидазолы общей формулы Ia по п.2, в которой
A обозначает метиленовую группу,
B обозначает аминогруппу,
Ra обозначает замещенную в положении 1 R1-CO-группой циклопропильную группу, где
R1 представляет собой необязательно замещенную метильной либо этильной группой пирролидиновую или пиперидиновую группу, в которых соответственно метильный либо этильный фрагмент может быть замещен карбокси-, карбокси-C1-C3алкокси-, карбокси-C1-C3алкиламино- или N-(C1-C3алкил)карбокси-C1-C3алкиламиногруппой,
или обозначает замещенную в положении 1 R2-CX-группой циклопропильную группу, где
R2 представляет собой необязательно замещенную C1-C3алкильной группой фенильную, пиридильную или пиразолильную группу, а
X представляет собой атом кислорода, C1-C3алкоксиимино- или C1-C3алкилиденовую группу, замещенные соответственно в алкильном либо алкоксифрагменте карбоксигруппой,
или обозначает замещенную в положении 1 имидазольной группой C1-C2алкильную группу, где имидазольное кольцо может быть замещено 1-3 метильными группами или замещено двумя метильными группами и одной этильной группой, при этом дополнительно один из вышеуказанных метильных или этильных заместителей одновременно может быть замещен карбоксигруппой,
или обозначает метильную либо этильную группу, замещенную в положении 1
- R3NR4- или R3NR4-CH2-группой и
- ди(C1-C3алкил)аминокарбонильной группой, необязательно замещенной C1-C3алкильной группой пирролидинокарбонильной либо пиперидинокарбонильной группой, при этом соответственно один алкильный фрагмент или алкильный заместитель в составе вышеназванных групп может быть замещен карбоксигруппой, где
R3 представляет собой атом водорода или необязательно замещенную карбоксигруппой C1-C3алкильную группу, а
R4 представляет собой C1-C3алкил-Y2- или карбокси-C1-C3алкил-Y2-группу, при этом
Y2 представляет собой углерод-азотную связь, карбонильную группу или необязательно замещенную C1-C3алкильной группой иминогруппу,
Rb обозначает метильную группу и
Rc обозначает необязательэю замещенную C1-C8алкоксикарбонильной, ацетоксиметилоксикарбонильной, 2,2,2-трихлорэтоксикарбонильной, бензилоксикарбонильной либо бензоильной группой амидиновую группу,
их C1-C3алканоловые эфиры, их таутомеры, их стереоизомеры и их соли.
6. Бензимидазолы общей формулы I по любому из пп.1-5, в которых остаток Ra находится в положении 5, их таутомеры, их стереоизомеры и их соли.
7. Соединения общей формулы Ia из группы, включающей
(а) 2-(4-амидинофениламинометил)-1-метил-5-[1-(пирролидин-1-илкарбонил)циклопропил]бензимидазол,
(б) (E/Z)-2-(4-амидинофениламинометил)-1-метил-5-[1-[(пиридин-2-ил)(карбоксиметилоксиимино)метилен]циклопропил]бензимидазол,
(в) 2-(4-амидинофениламинометил)-1-метил-5-[1-(2-карбоксиэтиламино)-1-(пирролидин-1-илкарбонил)этил]бензимидазол,
(г) 2-(4-амидинофениламинометил)-1-метил-5-[1-[2-(2-карбоксиэтил)пирролидин-1-илкарбонил]циклопропил]бензимидазол,
(д) 2-(4-амидинофениламинометил)-1-метил-5-[2-(2-карбоксиэтил)-4,5-диметилимидазол-1-илметил]бензимидазол,
(е) 2-(4-амидинофениламинометил)-1-метил-5-[1-(карбоксиметиламино)-1-(пирролидин-1-илкарбонил)этил]бензимидазол и
(ж) 2-(4-амидинофениламинометил)-1-метил-5-[1-(N-метилкарбоксиметилкарбониламинометил)-1-метил-1-(пирролидин-1-илкарбонил)этил]бензимидазол,
а также их C1-C3алканоловые эфиры, их N-(C1-C8алкоксикарбонил)-, N-бензилоксикарбонил- и N-бензоиламидины, их таутомеры, их стереоизомеры и их соли.
8. 2-(4-Амидинофениламинометил)-1-метил-5-[1-(карбоксиметиламино)-1-(пирролидин-1-илкарбонил)этил]бензимидазол, его C1-C3алканоловые эфиры и их N-(C1-C8алкоксикарбонил)-, N-бензилоксикарбонил- и N-бензоиламидины, их таутомеры, стереоизомеры и соли.
9. (R)-2-(4-амидинофениламинометил)-1-метил-5-[1-(карбоксиметиламино)-1-(пирролидинокарбонил)этил]бензимидазол, его C1-C3алканоловые эфиры и их N-(C1-C8алкоксикарбонил)-, N-бензилоксикарбонил- и N-бензоиламидины, их таутомеры, стереоизомеры и соли.
10. Физиологически приемлемые соли соединений по любому из пп.1-9, в которых Rc представляет собой одну из указанных в пп.1-9 амидиновых групп.
11. Лекарственные средства, содержащие соединение по любому из пп.1-9, в котором Rc представляет собой одну из указанных в пп.1-9 амидиновых групп, или соль по п.10 наряду с одним либо несколькими инертными носителями и/или разбавителями.
12. Применение соединения по любому из пп.1-9, в котором Rc представляет собой одну из указанных в пп.1-9 амидиновых групп, или соли по п.10 для получения лекарственного средства, обладающего увеличивающим продолжительность тромбинового времени действием, подавляющим тромбин действием и ингибирующим действием по отношению к родственным протеазам серина.
13. Способ получения лекарственного средства по п.11, отличающийся тем, что соединение по любому из пп.1-9, в котором Rc представляет собой одну из указанных в пп.1-9 амидиновых групп, или соль по п.10 нехимическим путем вводят в один либо несколько инертных носителей и/или разбавителей.
14. Способ получения соединений по пп.1-10, отличающийся тем, что для получения соединения общей формулы I, в которой Rc представляет собой цианогруппу, циклизуют соединение общей формулы II
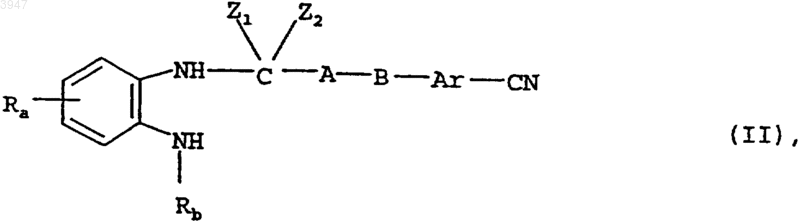
в которой
Ra, Rb, Ar, A и B имеют значения, указанные в пп.1-8,
Z1 и Z2 могут быть идентичными либо разными и обозначают необязательно замещенные алкильными группами с 1-6 атомами углерода амино-, гидрокси- либо меркаптогруппы или
Z1 и Z2 вместе обозначают атом кислорода либо серы, необязательно замещенную алкильной группой с 1-3 атомами углерода иминогруппу, алкилендиокси- либо алкилендитиогруппу соответственно с 2 или 3 атомами углерода;
и при необходимости полученное таким путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3 алкильную группу, в которой по меньшей мере один из остатков R3 или R4 представляет собой атом водорода, переводят затем с помощью соответствующего изоцианата или карбамоилгалогенида в соответствующее карбамидное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе NH2-C1-C3алкильную группу, переводят с помощью соответствующего эфира акриловой кислоты в соответствующее 2-(C1-C3алкоксикарбонил)этильное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой R3 и R4 представляют собой соответственно атом водорода, переводят с помощью соответствующего дигалогеналкана в соответствующее соединение общей формулы I, в которой R3 и R4 вместе с расположенным между ними атомом азота представляют собой соответствующую 4-7-членную циклоалкилениминогруппу, и/или
полученное описанным путем соединение общей формулы I, в которой Ra содержит карбоксигруппу, переводят этерифицированием в соответствующий сложный эфир, и/или
используемую в реакциях для защиты реакционноспособных групп защитную группу отщепляют, и/или
полученное описанным путем соединение общей формулы I разделяют на его стереоизомеры, и/или
полученное описанным путем соединение общей формулы I переводят в его соли, прежде всего в его предназначенные для применения в фармацевтике физиологически приемлемые соли с неорганическими или органическими кислотами либо основаниями.
15. Способ получения соединений по пп.1-10, отличающийся тем, что для получения соединения общей формулы I, в которой Ra обозначает R2-CX'-C3-C5циклоалкиленовую группу, где R2 имеет значения, указанные в пп.1-9, а X' представляет собой одну из указанных для X в пп.1-9 иминогрупп, соединение общей формулы IV
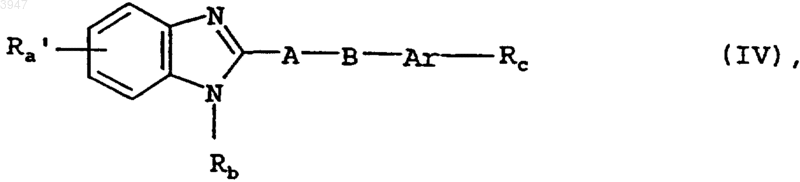
в которой
Rb, Rc, Ar, A и B имеют значения, указанные в пп.1-9, а
Ra' представляет собой R2-CO-C3-C5циклоалкиленовую группу, где R2 имеет значения, указанные в пп.1-9, подвергают взаимодействию с амином общей формулы V
H2X' (V)
в которой X' представляет собой одну из указанных для X в пп.1-9 иминогрупп;
и при необходимости полученное таким путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой по меньшей мере один из остатков R3 или R4 представляет собой атом водорода, переводят затем с помощью соответствующего изоцианата или карбамоилгалогенида в соответствующее карбамидное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе NH2-C1-C3алкильную группу, переводят с помощью соответствующего эфира акриловой кислоты в соответствующее 2-(C1-C3алкоксикарбонил)этильное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой R3 и R4 представляют собой соответственно атом водорода, переводят с помощью соответствующего дигалогеналкана в соответствующее соединение общей формулы I, в которой R3 и R4 вместе с расположенным между ними атомом азота представляют собой соответствующую 4-7-членную циклоалкилениминогруппу, и/или
полученное описанным путем соединение общей формулы I, т которой Rc представляет собой амидиновую группу, переводят с помощью производного галогенуксусной кислоты и последующими гидролизом и декарбоксилированием в соответствующее замещенное одной либо двумя метильными группами амидиновое соединение, и/или
полученное описанным путем соединение общей формулы I, в которой Rc представляет собой гидроксиамидиновую группу, переводят каталитическим гидрированием в соответствующее амидиновое соединение, и/или
полученное описанным путем соединение общей формулы I, в которой Ra содержит карбоксигруппу, переводят этерифицированием в соответствующий сложный эфир, и/или
используемую в реакциях для защиты реакционноспособных групп защитную группу отщепляют, и/или
полученное описанным путем соединение общей формулы I разделяют на его стереоизомеры, и/или
полученное описанным путем соединение общей формулы I переводят в его соли, прежде всего в его предназначенные для применения в фармацевтике физиологически приемлемые соли с неорганическими или органическими кислотами либо основаниями.
16. Способ получения соединений по пп.1-10, отличающийся тем, что для получения соединения общей формулы I, в которой Ra обозначает R2-CX"-C3-C5циклоалкиленовую группу, где R2 имеет значения, указанные в пп.1-9, а X" представляет собой одну из указанных для X в пп.1-9 алкилиденовых групп, соединение общей формулы IV
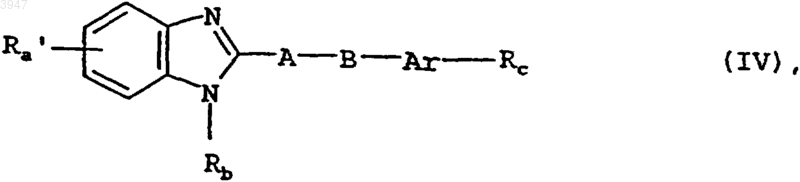
в которой Rb, Rc, Ar, A и B имеют значения, указанные в пп.1-9, а Ra' представляет собой R2-CO-C3-C5циклоалкиленовую группу, где R2 имеет значения, указанные в пп.1-9, подвергают взаимодействию с фосфоном общей формулы VI
Z3-HX" (VI)
в которой X" представляет собой одну из указанных для X в пп.1-9 алкилиденовых групп, а Z3 представляет собой трифенилфосфоновую либо ди(C1-C3алкокси)фосфоновую группу;
и при необходимости полученное таким путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой по меньшей мере один из остатков R3 или R4 представляет собой атом водорода, переводят затем с помощью соответствующего изоцианата или карбамоилгалогенида в соответствующее карбамидное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе NH2-C1-C3алкильную группу, переводят с помощью соответствующего эфира акриловой кислоты в соответствующее 2-(C1-C3алкоксикарбонил)этильное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой R3 и R4 представляют собой соответственно атом водорода, переводят с помощью соответствующего дигалогеналкана в соответствующее соединение общей формулы I, в которой R3 и R4 вместе с расположенным между ними атомом азота представляют собой соответствующую 4-7-членную циклоалкилениминогруппу, и/или
полученное описанным путем соединение общей формулы I, в которой Rc представляет собой амидиновую группу, переводят с помощью производного галогенуксусной кислоты и последующими гидролизом и декарбоксилированием в соответствующее замещенное одной либо двумя метильными группами амидиновое соединение, и/или
полученное описанным путем соединение общей формулы I, в которой Rc представляет собой гидроксиамидиновую группу, переводят каталитическим гидрированием в соответствующее амидиновое соединение, и/или
полученное описанным путем соединение общей формулы I, в которой Ra содержит карбоксигруппу, переводят этерифицированием в соответствующий сложный эфир, и/или
используемую в реакциях для защиты реакционноспособных групп защитную группу отщепляют, и/или
полученное описанным путем соединение общей формулы I разделяют на его стереоизомеры, и/или
полученное описанным путем соединение общей формулы I переводят в его соли, прежде всего в его предназначенные для применения в фармацевтике физиологически приемлемые соли с неорганическими или органическими кислотами либо основаниями.
17. Способ получения соединений по пп.1-10, отличающийся тем, что для получения соединения общей формулы I, в которой Rc представляет собой амидиновую группу, которая может быть замещена одной либо двумя C1-C3алкильными группами, соединение общей формулы VII
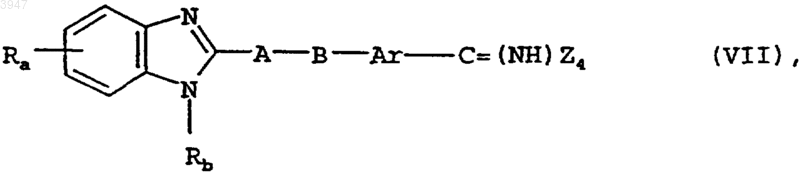
в которой Ra, Rb, Ar, A и B имеют значения, указанные в пп.1-9, а Z4 представляет собой алкокси-, аралкокси-, алкилтио- или аралкилтиогруппу, подвергают взаимодействию с амином общей формулы VIII
H-R7NR8 (VIII)
в которой R7 и R8 могут быть идентичными либо разными и обозначают соответственно атом водорода или C1-C3алкильную группу, либо взаимодействие осуществляют с его солями;
и при необходимости полученное таким путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой по меньшей мере один из остатков R3 или R4 представляет собой атом водорода, переводят затем с помощью соответствующего изоцианата или карбамоилгалогенида в соответствующее карбамидное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе NH2-C1-C3алкильную группу, переводят с помощью соответствующего эфира акриловой кислоты в соответствующее 2-(C1-C3алкоксикарбонил)этильное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой R3 и R4 представляют собой соответственно атом водорода, переводят с помощью соответствующего дигалогеналкана в соответствующее соединение общей формулы I, в которой R3 и R4 вместе с расположенным между ними атомом азота представляют собой соответствующую 4-7-членную циклоалкилениминогруппу, и/или
полученное описанным путем соединение общей формулы I, в которой Ra содержит карбоксигруппу, переводят этерифицированием в соответствующий сложный эфир, и/или
используемую в реакциях для защиты реакционноспособных групп защитную группу отщепляют, и/или
полученное описанным путем соединение общей формулы I разделяют на его стереоизомеры, и/или
полученное описанным путем соединение общей формулы I переводят в его соли, прежде всего в его предназначенные для применения в фармацевтике физиологически приемлемые соли с неорганическими или органическими кислотами либо основаниями.
18. Способ получения соединений по пп.1-10, отличающийся тем, что для получения соединения общей формулы I, в которой Ra представляет собой имидазолидин-2,4-дион-5-ильную группу, которая может быть замещена одной либо двумя C1-C3алкильными группами, при этом одновременно алкильный заместитель может быть замещен карбокси- либо C1-C3алкоксикарбонильной группой, циклизуют соединение общей формулы IX
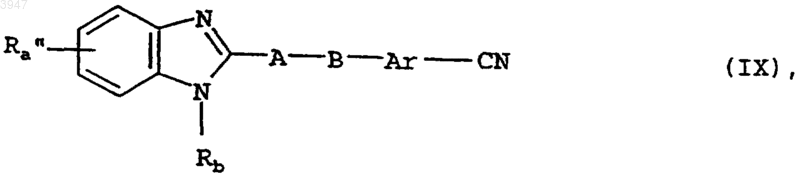
в которой Rb, Ar, A и B имеют значения, указанные в пп.1-8, а Ra" представляет собой аминокарбониламиногруппу, замещенную в положении 3 C1-C3алкоксикарбонил-C1-C3алкильной группой;
и при необходимости полученное описанным путем соединение общей формулы I, содержащее в свюхь составе NH2-C1-C3алкильную группу, переводят с помощью соответствующего эфира акриловой кислоты в соответствующее 2-(C1-C3алкоксикарбонил)этильное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, в которой Ra содержит карбоксигруппу, переводят этерифицированием в соответствующий сложный эфир, и/или
используемую в реакциях для защиты реакционноспособных групп защитную группу отщепляют, и/или
полученное описанным путем соединение общей формулы I разделяют на его стереоизомеры, и/или
полученное описанным путем соединение общей формулы I переводят в его соли, прежде всего в его предназначенные для применения в фармацевтике физиологически приемлемые соли с неорганическими или органическими кислотами либо основаниями.
19. Способ получения соединений по пп.1-10, отличающийся тем, что для получения соединения общей формулы I, в которой Rc представляет собой гидроксиамидиновую группу, нитрил общей формулы X
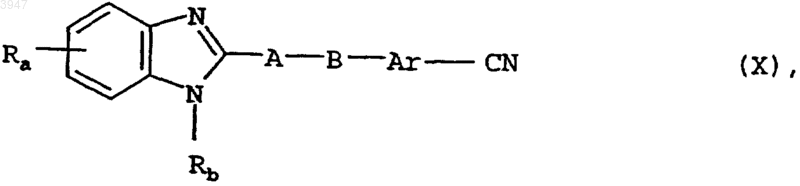
в которой Ra, Rb, Ar, A и B имеют значения, указанные в пп.1-9, подвергают взаимодействию с гидроксиламином либо с его солями;
и при необходимости полученное таким путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой по меньшей мере один из остатков R3 или R4 представляет собой атом водорода, переводят затем с помощью соответствующего изоцианата или карбамоилгалогенида в соответствующее карбамидное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе NH2-C1-C3алкильную группу, переводят с помощью соответствующего эфира акриловой кислоты в соответствующее 2-(C1-C3алкоксикарбонил)этильное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой R3 и R4 представляют собой соответственно атом водорода, переводят с помощью соответствующего дигалогеналкана в соответствующее соединение общей формулы I, в которой R3 и R4 вместе с расположенным между ними атомом азота представляют собой соответствующую 4-7-членную циклоалкилениминогруппу, и/или
полученное описанным путем соединение общей формулы I, в которой Ra содержит карбоксигруппу, переводят этерифицированием в соответствующий сложный эфир, и/или
используемую в реакциях для защиты реакционноспособных групп защитную группу отщепляют, и/или
полученное описанным путем соединение общей формулы I разделяют на его стереоизомеры, и/или
полученное описанным путем соединение общей формулы I переводят в его соли, прежде всего в его предназначенные для применения в фармацевтике физиологически приемлемые соли с неорганическими или органическими кислотами либо основаниями.
20. Способ получения соединений по пп.1-10, отличающийся тем, что для получения соединения общей формулы I, в которой Ra содержит карбоксигруппу, а Rc имеет значения, указанные в пп.1-9, или Ra имеет значения, указанные в пп.1-9, а Rc представляет собой необязательно замещенную гидроксигруппой либо одной или двумя C1-C3алкильными группами амидиновую группу, соединение общей формулы XI
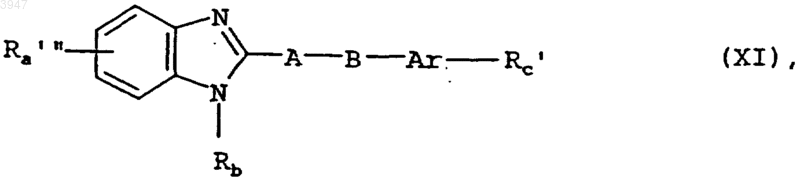
в которой Rb, Ar, A и B имеют значения, указанные в пп.1-9, а Ra"' и Rc' имеют значения, указанные для Ra и Rc в пп.1-9, при условии, что Ra содержит группу, переводимую путем гидролиза, обработки кислотой либо основанием, путем термолиза или гидрогенолиза в карбоксигруппу, а Rc имеет значения, указанные в пп.1-9, или Rc представляет собой группу, переводимую путем гидролиза, обработки кислотой либо основанием, путем термолиза или гидрогенолиза в необязательно замещенную гидроксигруппой либо одной или двумя C1-C3алкильными группами амидиновую группу, а Ra имеет значения, указанные в пп.1-9, переводят путем гидролиза, обработки кислотой либо основанием, путем термолиза или гидрогенолиза в соединение общей формулы I, в которой Ra содержит карбоксигруппу, а Rc имеет значения, указанные в пп.1-9, или Ra имеет значения, указанные в пп.1-9, а Rc представляет собой необязательно замещенную гидроксигруппой либо одной или двумя C1-C3алкильными группами амидиновую группу;
и при необходимости полученное таким путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой по меньшей мере один из остатков R3 или R4 представляет собой атом водорода, переводят затем с помощью соответствующего изоцианата или карбамоилгалогенида в соответствующее карбамидное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе NH2-C1-C3алкильную группу, переводят с помощью соответствующего эфира акриловой кислоты в соответствующее 2-(C1-C3алкоксикарбонил)этильное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой R3 и R4 представляют собой соответственно атом водорода, переводят с помощью соответствующего дигалогеналкана в соответствующее соединение общей формулы I, в которой R3 и R4 вместе с расположенным между ними атомом азота представляют собой соответствующую 4-7-членную циклоалкилениминогруппу, и/или
полученное описанным путем соединение общей формулы I, в которой Rc представляет собой амидиновую группу, переводят с помощью производного галогенуксусной кислоты и последующими гидролизом и декарбоксилированием в соответствующее замещенное одной либо двумя метильными группами амидиновое соединение, и/или
полученное описанным путем соединение общей формулы I, в которой Rc представляет собой гидроксиамидиновую группу, переводят каталитическим гидрированием в соответствующее амидиновое соединение, и/или
полученное описанным путем соединение общей формулы I, в которой Ra содержит карбоксигруппу, переводят этерифицированием в соответствующий сложный эфир, и/или
используемую в реакциях для защиты реакционноспособных групп защитную группу отщепляют, и/или
полученное описанным путем соединение общей формулы I разделяют на его стереоизомеры, и/или
полученное описанным путем соединение общей формулы I переводят в его соли, прежде всего в его предназначенные для применения в фармацевтике физиологически приемлемые соли с неорганическими или органическими кислотами либо основаниями.
21. Способ получения соединений по пп.1-10, отличающийся тем, что для получения соединения общей формулы I, в которой Rc представляет собой амидиновую группу, замещенную одной или двумя C1-C8алкоксикарбонильными группами либо отщепляемым in vivo остатком, соединение общей формулы XII
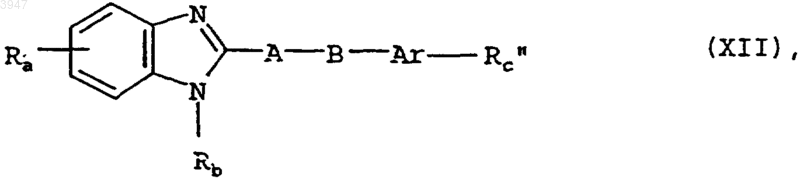
в которой Ra, Rb, Ar, A и B имеют значения, указанные в пп.1-9, а Rc" обозначает амидиновую группу, подвергают взаимодействию с соединением общей формулы XIII
Z5-R9 (XIII)
в которой
R9 представляет собой C1-C8алкоксикарбонильную группу или ацильную группу одного из указанных выше отщепляемых in vivo остатков, а Z5 обозначает нуклеофобэую уходящую группу;
и при необходимости полученное таким путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой по меньшей мере один из остатков R3 или R4 представляет собой атом водорода, переводят затем с помощью соответствующего изоцианата или карбамоилгалогенида в соответствующее карбамидное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе NH2-C1-C3алкильную группу, переводят с помощью соответствующего эфира акриловой кислоты в соответствующее 2-(C1-C3алкоксикарбонил)этильное соединение общей формулы I, и/или
полученное описанным путем соединение общей формулы I, содержащее в своем составе (R3NR4)-C1-C3алкильную группу, в которой R3 и R4 представляют собой соответственно атом водорода, переводят с помощью соответствующего дигалогеналкана в соответствующее соединение общей формулы I, в которой R3 и R4 вместе с расположенным между ними атомом азота представляют собой соответствующую 4-7-членную циклоалкилениминогруппу, и/или
полученное описанным путем соединение общей формулы I, в которой Ra содержит карбоксигруппу, переводят этерифицированием в соответствующий сложный эфир, и/или
используемую в реакциях для защиты реакционноспособных групп защитную группу отщепляют, и/или
полученное описанным путем соединение общей формулы I разделяют на его стереоизомеры, и/или
полученное описанным путем соединение общей формулы I переводят в его соли, прежде всего в его предназначенные для применения в фармацевтике физиологически приемлемые соли с неорганическими или органическими кислотами либо основаниями.
Текст
1 Настоящее изобретение относится к обладающим ценными свойствами бензимидазолам общей формулы к их таутомерам, их стереоизомерам, их смесям,их пролекарственным остаткам, их производным, содержащим вместо карбоксигруппы отрицательно заряженную в физиологических условиях группу, к их солям, прежде всего к их физиологически приемлемым солям с неорганическими или органическими кислотами или основаниями. Соединения приведенной выше общей формулы I, в которых Rc представляет собой цианогруппу, являются ценными промежуточными продуктами для получения других соединений общей формулы I, а соединения вышеприведенной общей формулы I, в которых Rс представляет собой одну из представленных ниже амидиновых групп, а также их таутомеры,их стереоизомеры, их смеси, их пролекарственные остатки, их производные, содержащие вместо карбоксигруппы отрицательно заряженную в физиологических условиях группу, и их соли,прежде всего их физиологически приемлемые соли с неорганическими или органическими кислотами, и их стереоизомеры обладают ценными фармакологическими свойствами, прежде всего антитромботическим действием. Объектом настоящего изобретения в соответствии с этим являются новые соединения вышеприведенной общей формулы I, а также их получение, лекарственные средства, содержащие в своем составе фармакологически эффективные соединения, их получение и применение. В вышеприведенной общей формуле Аr обозначает необязательно замещенную атомом фтора, хлора либо брома, трифторметильной, С 1-С 3 алкильной либо С 1-С 3 алкоксигруппой фениленовую или нафтиленовую группу,или обозначает необязательно замещенную в углеродном скелете С 1-С 3 алкильной группой тиениленовую, тиазолиленовую, пиридиниленовую, пиримидиниленовую, пиразиниленовую или пиридазиниленовую группу,А обозначает С 1-С 3 алкиленовую группу,В обозначает атом кислорода либо серы,метиленовую, карбонильную, сульфинильную или сульфонильную группу, необязательно замещенную С 1-С 3 алкильной группой иминогруппу, в которой алкильный фрагмент может быть однолибо двузамещенной карбоксигруппой,Ra обозначает R1-СО-С 3-С 5 циклоалкильную группу, где- С 1-С 3 алкокси-, амино-, С 1-С 4 алкиламинолибо ди(С 1-С 4 алкил)аминогруппу, в которых соответственно алкильный фрагмент может быть замещен карбоксигруппой,- 4-7-членную циклоалкиленимино- либо циклоалкенилениминогруппу, которые могут быть замещены одной или двумя С 1-С 3 алкильными группами, при этом один алкильный заместитель одновременно может быть замещен гидрокси-, С 1-С 3 алкокси-, карбокси-, карбоксиС 1-С 3 алкокси-, карбокси-С 1-С 3 алкиламино-, N(С 1-С 3 алкил)-N-(карбокси-С 1-С 3 алкил)амино-,карбокси-С 1-С 3 алкиламинокарбонильной,N(С 1-С 3 алкил)-N-(карбокси-С 1-С 3 алкил)аминокарбонильной, карбокси-С 1-С 3 алкиламинокарбониламино-, 1-(С 1-С 3 алкил)-3-(карбокси-С 1-С 3 алкил)аминокарбониламино-, 3-(С 1-С 3 алкил)-3(карбокси-С 1-С 3 алкил)аминокарбониламинолибо 1,3-ди(С 1-С 3 алкил)-3-(карбокси-С 1-С 3 алкил)аминокарбониламиногруппой,- замещенную гидроксигруппой 4-7 членную циклоалкилениминогруппу,- необязательно замещенную С 1-С 3 алкильной группой 5-7-членную циклоалкилениминогруппу, с которой через два смежных атома углерода сконденсировано фенильное кольцо,- морфолиновую, пиперазиновую, N-(С 1-С 3 алкил)пиперазиновую, пирролиновую, 3,4 дегидропиперидиновую или пиррол-1-ильную группу,или обозначает R2-СХ-С 3-С 5 циклоалкильную группу, гдеR2 представляет собой необязательно замещенную С 1-С 3 алкильной группой фенильную,нафтильную либо моноциклическую 5- или 6 членную гетероарильную группу, при этом 6 членная гетероарильная группа содержит один,два или три атома азота, а 5-членная гетероарильная группа содержит необязательно замещенную С 1-С 3 алкильной группой иминогруппу,один атом кислорода либо серы или необязательно замещенную С 1-С 3 алкильной группой иминогруппу и один атом кислорода либо серы или один либо два атома азота и упомянутый выше алкильный заместитель может быть замещен карбокси-, карбокси-С 1-С 3 алкокси-, карбокси-С 1-С 3 алкиламино- либо N-(С 1-С 3 алкил) карбокси-С 1-С 3 алкиламиногруппой, и Х представляет собой атом кислорода, С 1 С 3 алкилимино-, С 1-С 3 алкоксиимино-, С 1-С 3 алкилгидразиновую,ди(С 1-С 3 алкил)гидразиновую, С 2-С 4 алканоилгидразиновую, N-(С 1-С 3 алкил)-С 2-С 4 алканоилгидразиновую или С 1-С 3 алкилиденовую группу, каждая из которых соответственно в алкильном или алканоильном фрагменте либо в алкильном и алканоильном фрагментах может быть замещена карбоксигруппой, или обозначает замещенную имидазольной либо имидазолоновой группой С 1-С 3 алкильную или С 3-С 5 циклоалкильную группу,где 3 имидазольное кольцо может быть замещено фенильной либо карбоксигруппой и одной или двумя С 1-С 3 алкильными группами либо одной, двумя или тремя С 1-С 3 алкильными группами, при этом заместители могут быть идентичными или разными и один из выше названных алкильных заместителей одновременно может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, С 2-С 4 алканоиламино-, С 1-С 3 алкиламино-, N-(С 2-С 4 алканоил)-С 1-С 3 алкиламино- либо ди(С 1-С 3 алкил) аминогруппой, а имидазолоновое кольцо может быть замещено С 1-С 3 алкильной группой, при этом алкильный заместитель может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, С 2-С 4 алканоиламино-, С 1-С 3 алкиламино-,N-(С 2-С 4 алканоил)-С 1-С 3 алкиламинолибо ди(С 1-С 3 алкил)аминогруппой, и дополнительно с вышеуказанными имидазольным и имидазолоновым кольцами через два смежных атома углерода может быть сконденсировано фенильное либо пиридиновое кольцо,или обозначает имидазолидин-2,4-дион-5 ильную группу, которая может быть замещена одной или двумя С 1-С 3 алкильными группами,при этом одновременно один алкильный заместитель может быть замещен карбоксигруппой,или обозначает С 1-С 4 алкильную группу,замещенную- необязательно замещенной С 1-С 3 алкильной группой изоксазолидинилкарбонильной группой, пирролинокарбонильной, 3,4 дегидропиперидинокарбонильной, пирролил-1 илкарбонильной, карбокси-, аминокарбонильной, С 1-С 3 алкиламинокарбонильной, ди(С 1-С 3 алкил)аминокарбонильной или 4-7-членной циклоалкилениминокарбонильной группой, при этом в вышеназванных группах циклоалкилениминовый фрагмент замещен одной либо двумя С 1-С 3 алкильными группами и одновременно в каждой из указанных выше С 1-С 3 алкиламинокарбонильных,ди(С 1-С 3 алкил)аминокарбонильных или циклоалкилениминокарбонильных групп один алкильный фрагмент или алкильный заместитель может быть соответственно замещен карбоксигруппой, а остальные атомы водорода С 1-С 4 алкильной группы могут быть полностью либо частично заменены на атомы фтора, гдеR3 представляет собой атом водорода или необязательно замещенную карбоксигруппой С 1-С 3 алкильную группу, аR4 представляет собой атом водорода, С 1 С 3 алкил-Y1-С 1-С 3 алкил-Y2-, карбокси-С 1-С 3 алкил-Y1-С 1-С 3 алкил-Y2-, С 1-С 3 алкил-Y2- или карбокси-С 1-С 3 алкил-Y2-группу илиR3 и R4 вместе с расположенным между ними атомом азота представляют собой необязательно замещенную карбокси-, С 1-С 3 алкиль 003947Y1 представляет собой углеродуглеродную связь, атом кислорода, сульфенильную, сульфинильную, сульфонильную, -NH-,-NH-CO-или -NH-CO-NH-группу, аY2 представляет собой углерод-азотную связь или карбонильную, сульфонильную, имино- либо -NH-CO-группу, причем карбонильная группа в составе -NH-CO-группы соединена с атомом азота R3NR4-группы, а каждая из указанных при расшифровке значений остатков Y1 и Y2 иминогрупп дополнительно может быть замещена соответственно С 1-С 3 алкильной либо карбокси-С 1-С 3 алкильной группой,или обозначает замещенную R5NR6 группой С 1-С 3 алкильную или С 3-С 5 циклоалкильную группу, гдеR5 представляет собой атом водорода, С 1 С 3 алкильную, С 5-С 7 циклоалкильную, фенилкарбонильную, фенилсульфонильную или пиридинильную группу, аR6 представляет собой С 1-С 3 алкильную,карбокси-С 1-С 3 алкильную или карбокси-С 1-С 3 алкилкарбонильную группу,или обозначает С 1-С 3 алкильную группу,замещенную С 2-С 4 алканоильной либо С 5-С 7 циклоалканоильной группой, и замещенную атомом хлора, брома либо иода С 1-С 3 алкильную группу,Rb обозначает атом водорода или С 1-С 3 алкильную группу иRc обозначает цианогруппу или необязательно замещенную одной либо двумя С 1-С 3 алкильными группами амидиновую группу. Указанные при расшифровке значений вышеназванных остатков карбоксигруппы могут быть, кроме того, заменены на группу, переводимую in vivo в карбоксигруппу, либо на отрицательно заряженную в физиологических условиях группу или указанные при расшифровке значений вышеназванных остатков амино- и иминогруппы могут быть, кроме того, замещены отщепляемой in vivo группой. Такие группы описаны, в частности, в заявке WO 98/46576 и в публикации N.M. Nielson и др., InternationalJournal of Pharmaceutics 39, стр. 75-85 (1987). Под группой, переводимой in vivo в харбоксигруппу, имеются в виду, например, гидроксиметильная группа, этерифицированная спиртом карбоксигруппа, в которой спиртовой фрагмент представляет собой предпочтительно С 1-С 6 алканол, фенил-С 1-С 3 алканол, С 3-С 9 циклоалканол, при этом С 5-С 8 циклоалканол дополнительно может быть замещен одной либо двумя С 1-С 3 алкильными группами, С 5-С 8 циклоалканол, в котором метиленовая группа в положении 3 или 4 заменена на атом кислорода либо на необязательно замещенную С 1-С 3 алкильной,фенил-С 1-С 3 алкильной,фенил-С 1-С 3 алкоксикарбонильной или С 2-С 6 алканоильной группой иминогруппу, а циклоалканольный фрагмент 5 дополнительно может быть замещен одной либо двумя С 1-С 3 алкильными группами, С 4-С 7 циклоалкенол, С 3-С 5 алкенол, фенил-С 3-С 5 алкенол, С 3 С 5 алкинол или фенил-С 3-С 5 алкинол, при условии, что отсутствует связь между атомом кислорода и атомом углерода, несущим двойную либо тройную связь, С 3-С 8 циклоалкил-С 1-С 3 алканол,бициклоалканол с в общей сложности 8-10 атомами углерода, который в бициклоалкильном фрагменте дополнительно может быть замещен одной либо двумя С 1-С 3 алкильными группами,1,3-дигидро-3-оксо-1-изобензфуранол или же спирт формулыRd-СО-О-(ReCRf)-ОН,где Rd представляет собой С 1-С 8 алкильную, С 5 С 7 циклоалкильную, фенильную либо фенил-С 1 С 3 алкильную группу,Rе представляет собой атом водорода, С 1 С 3 алкильную, С 5-С 7 циклоалкильную либо фенильную группу иRf представляет собой атом водорода либо С 1-С 3 алкильную группу; под отрицательно заряженной в физиологических условиях группой имеются в виду такие группы, как тетразол-5-ильная, фенилкарбониламинокарбонильная, трифторметилкарбониламинокарбонильная, С 1-С 6 алкилсульфониламино-, фенилсульфониламино-, бензилсульфониламино-, трифторметилсульфониламино-, С 1 С 6 алкилсульфониламинокарбонильная, фенилсульфониламинокарбонильная, бензилсульфониламинокарбонильная или перфтор-С 1-С 6 алкилсульфониламинокарбонильная группа, а под отщепляемой in vivo от имино- или аминогруппы группой имеются в виду, например, гидроксигруппа, ацильная группа, такая как одно- либо двузамещенная атомами фтора,хлора, брома или иода, С 1-С 3 алкильными либо С 1-С 3 алкоксигруппами бензоильная группа, при этом заместители могут быть идентичными или разными, пиридиноильная группа или С 1 С 16 алканоильная группа, такая как формильная,ацетильная, пропионильная, бутаноильная, пентаноильная и гексаноильная группа, 3,3,3 трихлорпропионильная либо аллилоксикарбонильная группа, С 1-С 16 алкоксикарбонильная либо С 1-С 16 алкилкарбонилоксигруппа, в которых атомы водорода полностью или частично могут быть заменены на атомы фтора либо хлора, такие как метоксикарбонильная, этоксикарбонильная, пропоксикарбонильная, изопропоксикарбонильная, бутоксикарбонильная, третбутоксикарбонильная, пентоксикарбонильная,гексоксикарбонильная, октилоксикарбонильная,нонилоксикарбонильная, децилоксикарбонильная, ундецилоксикарбонильная, додецилоксикарбонильная,гексадецилоксикарбонильная,метилкарбонилокси-, этилкарбонилокси-, 2,2,2 трихлорэтилкарбонилокси-, пропилкарбонилокси-, изопропилкарбонилокси-, бутилкарбонилокси-, трет-бутилкарбонилокси-, пентилкарбонилокси-, гексилкарбонилокси-, октилкарбони 003947 6 локси-, нонилкарбонилокси-, децилкарбонилокси-, ундецилкарбонилокси-, додецилкарбонилокси- или гексадецилкарбонилоксигруппа,фенил-С 1-С 6 алкоксикарбонильная группа, такая как бензилоксикарбонильная, фенилэтоксикарбонильная или фенилпропоксикарбонильная группа, 3-аминопропионильная группа, в которой аминогруппа является одно- либо двузамещенной С 1-С 6 алкильными или С 3-С 7 циклоалкильными группами и заместители могут быть идентичными или разными, С 1-С 3 алкилсульфонильная, С 2-С 4 алкоксикарбонильная, С 1-С 3 алкокси-С 2-С 4 алкокси-С 2-С 4 алкоксикарбонильная,С 1-С 6 алкил-СО-NНRd-CO-О-(RdCRf)-О-CO-,(RgCRh)-О-СО- или С 1-С 6aлкил-CO-О-(RgCRh)(RgCRh)-O-CO-группa, в которых Rd-Rf имеют значения, указанные выше, a Rg и Rh, которые могут быть идентичными или разными, представляют собой атомы водорода или С 1-С 3 алкильные группы. Кроме того, группы, указанные при расшифровке значений вышеназванных насыщенных алкильных и алкоксифрагментов, содержащих более двух атомов углерода, включают также их разветвленные изомеры, как, например, изопропильная, трет-бутильная, изобутильная и т.д. группа. К предпочтительным соединениям относятся такие соединения общей формулы в которой А обозначает С 1-С 3 алкиленовую группу,В обозначает атом кислорода либо серы,метиленовую, карбонильную, сульфинильную или сульфонильную группу, необязательно замещенную С 1-С 3 алкильной группой иминогруппу, в которой алкильный фрагмент может быть одно- либо двузамещенной карбоксигруппой,Rа обозначает R1-СО-С 3-С 5 циклоалкильную группу, где R1 представляет собой- С 1-С 3 алкокси-, амино-, С 1-С 4 алкиламинолибо ди(С 1-С 4 алкил)аминогруппу, в которых соответственно алкильный фрагмент может быть замещен карбоксигруппой,- 4-7-членную циклоалкиленилимино- либо циклоалкенилениминогруппу, которые могут быть замещены одной или двумя C1-С 3 алкильными группами, при этом один алкильный заместитель одновременно может быть замещен гидрокси-, С 1-С 3 алкокси-, карбокси-,карбокси-С 1-С 3 алкокси-,карбокси-С 1-С 3 алкиламино-, N-(С 1-С 3 алкил)-N-(карбокси-С 1-С 3 алкил)амино-, карбокси-C1-С 3 алкиламинокарбонильной, N-(С 1-С 3 алкил)-N-(карбокси-С 1-С 3 алкил)аминокарбонильной, карбокси-С 1-С 3 алкиламинокарбониламино-, 1-(С 1-С 3 алкил)-3-(карбокси-С 1-С 3 алкил)аминокарбониламино-, 3-(С 1-С 3 алкил)-3-(карбокси-С 1-С 3 алкил)аминокарбонил 7 амино- либо 1,3-ди(С 1-С 3 алкил)-3-(карбокси-С 1 С 3 алкил)аминокарбониламиногруппой,- замещенную гидроксигруппой 4-7 членную циклоалкилениминогруппу,- необязательно замещенную С 1-С 3 алкильной группой 5-7-членную циклоалкилениминогруппу, с которой через два смежных атома углерода сконденсировано фенильное кольцо,- морфолиновую, пиперазиновую, N-(С 1-С 3 алкил)пиперазиновую, пирролиновую, 3,4 дегидропиперидиновую или пиррол-1-ильную группу,или обозначаетR2-СХ-С 3-С 5 циклоалкильную группу, где R2 представляет собой необязательно замещенную С 1-С 3 алкильной группой фенильную, нафтильную либо моноциклическую 5- или 6-членную гетероарильную группу, при этом 6-членная гетероарильная группа содержит один, два или три атома азота, а 5 членная гетероарильная группа содержит необязательно замещенную С 1-С 3 алкильной группой иминогруппу, один атом кислорода либо серы или необязательно замещенную С 1-С 3 алкильной группой иминогруппу и один атом кислорода либо серы или один либо два атома азота и упомянутый выше алкильный заместитель может быть замещен карбокси-, карбокси-С 1-С 3 алкокси-, карбокси-С 1-С 3 алкиламино- либо N-(С 1-С 3 алкил)карбокси-С 1-С 3 алкиламиногруппой, и Х представляет собой атом кислорода, С 1-С 3 алкилимино-, С 1-С 3 алкоксиимино-, С 1-С 3 алкилгидразиновую, ди(С 1-С 3 алкил)гидразиновую, С 2-С 4 алканоилгидразиновую, N-(С 1-С 3 алкил)-С 2-С 4 алканоилгидразиновую или С 1-С 3 алкилиденовую группу, каждая из которых соответственно в алкильном или алканоильном фрагменте либо в алкильном и алканоильном фрагментах может быть замещена карбоксигруппой, или обозначает замещенную имидазольной либо имидазолоновой группой С 1-С 3 алкильную или С 3-С 5 циклоалкильную группу, где имидазольное кольцо может быть замещено фенильной либо карбоксигруппой и одной или двумя С 1-С 3 алкильными группами либо одной, двумя или тремя С 1-С 3 алкильными группами, при этом заместители могут быть идентичными или разными и один из вышеназванных алкильных заместителей одновременно может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, С 2-С 4 алканоиламино-, С 1-С 3 алкиламино-, N-(С 2-С 4 алканоил)-С 1-С 3 алкиламинолибо ди(С 1-С 3 алкил)аминогруппой, а имидазолоновое кольцо может быть замещено С 1-С 3 алкильной группой,при этом алкильный заместитель может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, С 2-С 4 алканоиламино-, С 1-С 3 алкиламино-, N-(С 2-С 4 алканоил)-С 1-С 3 алкиламино- либо ди(С 1-С 3 алкил)аминогруппой, и дополнительно с вышеуказанными имидазольным и имидазолоновым кольцами через два смежных 8 атома углерода может быть сконденсировано фенильное либо пиридиновое кольцо,или обозначает имидазолидин-2,4-диoн-5 ильную группу, которая может быть замещена одной или двумя С 1-С 3 алкильными группами,при этом одновременно один алкильный заместитель может быть замещен карбоксигруппой,или обозначает С 1-С 4 алкильную группу, замещенную- необязательно замещенной С 1-С 3 алкильной группой изоксазолидин-1-илкарбонильной группой, пирролинокарбонильной, 3,4-дегидропиперидинокарбонильной, пирролил-1-илкарбонильной, карбокси-, аминокарбонильной, С 1-С 3 алкиламинокарбонильной, ди(С 1-С 3 алкил)аминокарбонильной или 4-7-членной циклоалкилениминокарбонильной группой, при этом в вышеназванных группах циклоалкилениминовый фрагмент замещен одной либо двумя С 1 С 3 алкильными группами и одновременно в каждой из указанных выше С 1-С 3 алкиламинокарбонильных, ди(С 1-С 3 алкил)аминокарбонильных или циклоалкилениминокарбонильных групп один алкильный фрагмент или алкильный заместитель может быть соответственно замещен карбоксигруппой, а остальные атомы водорода С 1-С 4 алкильной группы могут быть полностью либо частично заменены на атомы фтора,где R3 представляет собой атом водорода или необязательно замещенную карбоксигруппой С 1-С 3 алкильную группу, а R4 представляет собой атом водорода, С 1-С 3 алкил-Y1-С 1-С 3 алкилY2-,карбокси-С 1-С 3 алкил-Y1-С 1-С 3 алкил-Y2-,С 1-С 3 алкил-Y2- или карбокси-С 1-С 3 алкил-Y2 группу или R3 и R4 вместе с расположенным между ними атомом азота представляют собой необязательно замещенную карбокси-, С 1-С 3 алкильной либо карбокси-С 1-С 3 алкильной группой 4-7-членную циклоалкилениминогруппу,при этомY1 представляет собой углеродуглеродную связь, атом кислорода, сульфенильную, сульфинильную, сульфонильную, -NH-,-NH-CO-или -NH-CO-NH-группу, аY2 представляет собой углерод-азотную связь или карбонильную, сульфонильную, имино- либо -NH-CO-группу, причем карбонильная группа в составе -NH-CO-группы соединена с атомом азота R3NR4-группы, а каждая из указанных при расшифровке значений остатков Y1 и Y2 иминогрупп дополнительно может быть замещена соответственно С 1-С 3 алкильной либо карбокси-С 1-С 3 алкильной группой,или обозначает замещенную R5NR6 группой С 1-С 3 алкильную или С 3-С 5 циклоалкильную группу, гдеR5 представляет собой атом водорода, С 1 С 3 алкильную, С 5-С 7 циклоалкильную, фенилкар 9 бонильную, фенилсульфонильную или пиридинильную группу, аR6 представляет собой С 1-С 3 алкильную,карбокси-С 1-С 3 алкильную или карбокси-С 1 С 3 алкилкарбонильную группу,или обозначает С 1-С 3 алкильную группу,замещенную С 2-С 4 алканоильной либо С 5-С 7 циклоалканоильной группой, и замещенную атомом хлора, брома либо иода С 1-С 3 алкильную группу, Rb обозначает атом водорода или С 1-С 3 алкильную группу и Rc обозначает цианогруппу или амидиновую группу, которая может быть замещена гидроксигруппой, одной либо двумя С 1-С 3 алкильными группами, одной либо двумя С 1-С 8 алкоксикарбонильными группами,при этом указанные выше при расшифровке значений остатков карбокси-, амино- и иминогруппы могут быть замещены, кроме того,отщепляемой in vivo группой, их таутомеры, их стереоизомеры и их соли. Особенно предпочтительными являются такие соединения вышеприведенной общей формулы Iа, в которых А обозначает С 1-С 3 алкиленовую группу, В обозначает атом кислорода, метиленовую, имино- или N-(С 1-С 3 алкил)иминогруппу, в которой алкильный фрагмент может быть замещен карбоксигруппой, Ra обозначает замещенную в положении 1 R1-СО-группой С 3-С 5 циклоалкильную группу, где- С 1-С 3 алкокси-, амино-, С 1-С 4 алкиламинолибо ди(С 1-С 4 алкил)аминогруппу, в каждой из которых соответственно алкильный фрагмент может быть замещен карбоксигруппой,- 4-7-членную циклоалкилениминогруппу,которая может быть замещена гидроксигруппой либо одной или двумя С 1-С 3 алкильными группами, при этом один алкильный заместитель одновременно может быть замещен гидрокси-,С 1-С 3 алкокси-, карбокси-, карбокси-С 1-С 3 алкокси-, карбокси-С 1-С 3 алкиламино-, N-(С 1-С 3 алкил)-N-(карбокси-С 1-С 3 алкил)амино-, карбоксиС 1-С 3 алкиламинокарбонильной, N-(С 1-С 3 алкил)N-(карбокси-С 1-С 3 алкил)аминокарбонильной,карбокси-С 1-С 3 алкиламинокарбониламино-, 1(С 1-С 3 алкил)-3-(карбокси-С 1-С 3 алкил)аминокарбониламино-,3-(С 1-С 3 алкил)-3-(карбокси-С 1 С 3 алкил)аминокарбониламино- либо 1,3-ди(С 1 С 3 алкил)-3-(карбокси-С 1-С 3 алкил)аминокарбониламиногруппой,- необязательно замещенную С 1-С 3 алкильной группой 5-7-членную циклоалкилениминогруппу, с которой через два смежных атома углерода сконденсировано фенильное кольцо,- морфолиновую, пиперазиновую, N-(С 1-С 3 алкил)пиперазиновую, пирролиновую, 3,4 дегидропиперидиновую или пиррол-1-ильную группу,или обозначает замещенную в положении 1 R2-СХ-группой С 3-С 5 циклоалкильную группу, 003947 10 где R2 представляет собой необязательно замещенную С 1-С 3 алкильной группой фенильную,нафтильную либо моноциклическую 5- или 6 членную гетероарильную группу, при этом 6 членная гетероарильная группа содержит один,два или три атома азота, а 5-членная гетероарильная группа содержит необязательно замещенную С 1-С 3 алкильной группой иминогруппу,один атом кислорода либо серы или необязательно замещенную С 1-С 3 алкильной группой иминогруппу и один атом кислорода либо серы или один либо два атома азота и упомянутый выше алкильный заместитель может быть замещен карбокси-, карбокси-С 1-С 3 алкокси-, карбокси-С 1-С 3 алкиламино- либо N-(С 1-С 3 алкил) карбокси-С 1-С 3 алкиламиногруппой, и Х представляет собой атом кислорода, С 1 С 3 алкилимино-, С 1-С 3 алкоксиимино- или С 1 С 3 алкилиденовую группу, которые соответственно в алкильном либо алкоксифрагменте могут быть замещены карбоксигруппой,или обозначает замещенную в положении 1 имидазольной либо имидазолоновой группой С 1-С 3 алкильную группу, где имидазольное кольцо может быть замещено фенильной либо карбоксигруппой и одной или двумя С 1-С 3 алкильными группами либо одной, двумя или тремя С 1-С 3 алкильными группами, при этом заместители могут быть идентичными или разными и один из вышеназванных алкильных заместителей одновременно может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, С 2-С 4 алканоиламино-, С 1-С 3 алкиламино-, N-(С 2-С 4 алканоил)-С 1-С 3 алкиламино- либо ди(С 1-С 3 алкил) аминогруппой, а имидазолоновое кольцо может быть замещено С 1-С 3 алкильной группой, при этом алкильный заместитель может быть замещен карбоксигруппой или в положении 2 либо 3 амино-,С 2-С 4 алканоиламино-,С 1-С 3 алкиламино-,N-(С 2-С 4 алканоил)-С 1-С 3 алкиламинолибо ди(С 1-С 3 алкил)аминогруппой, и дополнительно с вышеуказанными имидазольным и имидазолоновым кольцами через два смежных атома углерода может быть сконденсировано фенильное либо пиридиновое кольцо,или обозначает имидазолидин-2,4-дион-5 ильную группу, которая может быть замещена одной либо двумя С 1-С 3 алкильными группами,при этом одновременно один алкильный заместитель может быть замещен карбоксигруппой,или обозначает С 1-С 4 алкильную группу,замещенную в положении 1- пирролинокарбонильной, 2,3-дегидропиперидинокарбонильной, имидазол-1-илкарбонильной, карбокси-, аминокарбонильной, С 1 С 3 алкиламинокарбонильной,ди(С 1-С 3 алкил) аминокарбонильной, изоксазолидин-1-илкарбонильной или 4-7-членной циклоалкилениминокарбонильной группой, при этом в вышеназван 11 ных группах циклоалкилениминовый фрагмент замещен одной либо двумя С 1-С 3 алкильными группами и одновременно в каждой из указанных выше С 1-С 3 алкиламинокарбонильных,ди(С 1-С 3 алкил)аминокарбонильных или циклоалкилениминокарбонильных групп один алкильный фрагмент или алкильный заместитель может быть соответственно замещен карбоксигруппой, а остальные атомы водорода С 1 С 4 алкильной группы могут быть полностью либо частично заменены на атомы фтора, гдеR3 представляет собой атом водорода или необязательно замещенную карбоксигруппой С 1-С 3 алкильную группу, аR4 представляет собой атом водорода, С 1 С 3 алкил-Y2 или карбокси-С 1-С 3 алкил-Y2 группу, илиR3 и R4 вместе с расположенным между ними атомом азота представляют собой необязательно замещенную в положении 1 карбокси-,С 1-С 3 алкильной либо карбокси-С 1-С 3 алкильной группой 4-7-членную циклоалкилениминогруппу, при этомY2 представляет собой углерод-азотную связь или карбонильную, имино- либо -NH-COгруппу, причем карбонильная группа в составеR3NR4-группы, а указанная при расшифровке значений остатка Y2 иминогруппа дополнительно может быть замещена С 1-С 3 алкильной либо карбокси-С 1-С 3 алкильной группой,или обозначает замещенную в положении 1 R5NR6-группой С 1-С 3 алкильную или С 3-С 5 циклоалкильную группу, гдеR5 представляет собой атом водорода, С 1 С 3 алкильную, С 5-С 7 циклоалкильную, фенилкарбонильную, фенилсульфонильную или пиридинильную группу, аR6 представляет собой С 1-С 3 алкильную,карбокси-С 1-С 3 алкильную или карбокси-С 1-С 3 алкилкарбонильную группу,или обозначает С 1-С 3 алкильную группу,замещенную С 2-С 4 алканоильной либо С 5-С 7 циклоалканоильной группой, и замещенную атомом хлора, брома либо иода С 1-С 3 алкильную группу,Rb обозначает С 1-С 3 алкильную группу иRc обозначает необязательно замещенную 2,2,2-трихлорэтоксикарбонильной, С 1-С 8 алкоксикарбонильной,ацетоксиметилоксикарбонильной, бензилоксикарбонильной или бензоильной группой амидиновую группу, при этом бензоильный фрагмент может быть одно- либо двузамещенным атомами фтора, хлора, брома либо иода, С 1-С 3 алкильными или С 1-С 3 алкоксигруппами, и заместители могут быть идентичными либо разными, их С 1-С 3 алканоловые эфиры, их таутомеры, их стереоизомеры и их соли. Наиболее предпочтительны такие соединения общей формулы I, в которых А обозначает метиленовую группу, 003947 12 В обозначает атом кислорода или иминогруппу,Ra обозначает замещенную в положении 1R1 представляет собой необязательно замещенную метильной либо этильной группой пирролидиновую или пиперидиновую группу, в каждой из которых соответственно метильный либо этильный фрагмент может быть замещен карбокси-, карбокси-С 1-С 3 алкокси-, карбоксиС 1-С 3 алкиламино- или N-(С 1-С 3 алкил)карбоксиС 1-С 3 алкиламиногруппой,или обозначает замещенную в положении 1 R2-CX-группой циклопропильную группу, гдеR2 представляет собой необязательно замещенную С 1-С 3 алкильной группой фенильную,пиридильную или пиразолильную группу, a Х представляет собой атом кислорода, С 1 С 3 алкоксиимино- или С 1-С 3 алкилиденовую группу, замещенные соответственно в алкильном либо алкоксифрагменте карбоксигруппой,или обозначает замещенную в положении 1 имидазольной группой С 1-С 2 алкильную группу,где имидазольное кольцо может быть замещено фенильной или карбоксигруппой и одной- либо двумя С 1-С 3 алкильными группами или одной,двумя либо тремя С 1-С 3 алкильными группами,при этом заместители могут быть идентичными либо разными, а один из вышеназванных алкильных заместителей одновременно может быть замещен карбоксигруппой или в положении 2 либо 3 амино-, С 2-С 4 алканоиламино-, С 1 С 3 алкиламино-, N-(С 2-С 4 алканоил)-С 1-С 3 алкиламино- или ди(С 1-С 3 алкил)аминогруппой, при этом дополнительно с указанными выше имидазольными кольцами через два смежных атома углерода может быть сконденсировано фенильное либо пиридиновое кольцо, или обозначает замещенную в положении 1 бензимидазолон-1 ильной группой С 1-С 2 алкильную группу, при этом имидазолоновое кольцо может быть замещено необязательно замещнной карбоксигруппой метильной либо этильной группой,или обозначает метильную или этильную группу, замещенную в положении 1- R3NR4- или R3NR4-С 1-С 3 алкильной группой и ди(С 1-С 3 залкил)аминокарбонильной группой,изоксазолидин-1-илкарбонильной группой, необязательно замещенной С 1-С 3 алкильной группой пирролидинокарбонильной либо пиперидинокарбонильной группой, при этом один алкильный фрагмент или алкильный заместитель в указанных выше группах может быть замещен карбоксигруппой, гдеR3 представляет собой атом водорода или необязательно замещенную карбоксигруппой С 1-С 3 алкильную группу, аR4 представляет собой атом водорода, С 1 С 3 алкил-Y2 или карбокси-С 1-С 3 алкил-Y2 группу илиR3 и R4 вместе с расположенным между ними атомом азота представляют собой необязательно замещенную карбоксигруппой 4-7 членную циклоалкилениминогруппу, при этомY2 представляет собой углерод-азотную связь, карбонильную группу или необязательно замещенную С 1-С 3 алкильной группой иминогруппу, или обозначает замещенную в положении 1 R5NR6-группой С 1-С 2 алкильную группу,гдеR6 представляет собой С 1-С 3 алкильную или карбокси-С 1-С 3 алкильную группу,или обозначает замещенную в положении 3 атомом хлора н-пропильную группу, замещенную в положении 1 циклопентилкарбонильной группой, или обозначает замещенную в положении 1 циклопентиламиногруппой циклопропильную группу, замещенную у атома азота карбокси-С 1-С 3 алкилкарбонильной группой,Rb обозначает метильную группу иRc обозначает необязательно замещенную С 1-С 8 алкоксикарбонильной, ацетоксиметилоксикарбонильной,2,2,2-трихлорэтоксикарбонильной, бензилоксикарбонильной либо бензоильной группой амидиновую группу. Предпочтительны в первую очередь такие соединения общей формулы Iа, в которых А обозначает метиленовую группу,В обозначает иминогруппу,Ra обозначает замещенную в положении 1R1 представляет собой необязательно замещенную метильной либо этильной группой пирролидиновую или пиперидиновую группу, в которых соответственно метильный либо этильный фрагмент может быть замещен карбокси-,карбокси-С 1-С 3 алкокси-, карбокси-С 1-С 3 алкиламино- или N-(С 1-С 3 алкил)карбокси-С 1-С 3 алкиламиногруппой,или обозначает замещенную в положении 1 R2-СХ-группой циклопропильную группу, гдеR2 представляет собой необязательно замещенную С 1-С 3 алкильной группой фенильную,пиридильную или пиразолильную группу, а Х представляет собой атом кислорода, С 1 С 3 алкоксиимино- или С 1-С 3 алкилиденовую группу, замещенные соответственно в алкильном либо алкоксифрагменте карбоксигруппой,или обозначает замещенную в положении 1 имидазольной группой С 1-С 2 алкильную группу,где имидазольное кольцо может быть замещено 1-3 метильными группами или замещено двумя метильными группами и одной этильной группой, при этом дополнительно один из вышеуказанных метильных или этильных заместителей одновременно может быть замещен карбоксигруппой,или обозначает метильную либо этильную группу, замещенную в положении 1- ди(С 1-С 3 алкил)аминокарбонильной группой, необязательно замещенной С 1-С 3 алкильной группой пирролидинокарбонильной либо пиперидинокарбонильной группой, при этом соответственно один алкильный фрагмент или алкильный заместитель в составе вышеназванных групп может быть замещен карбоксигруппой,где R3 представляет собой атом водорода или необязательно замещенную карбоксигруппой С 1-С 3 алкильную группу, а R4 представляет собой С 1-С 3 алкил-Y2- или карбокси-С 1-С 3 алкилY2-группу, при этомY2 представляет собой углерод-азотную связь, карбонильную группу или необязательно замещенную С 1-С 3 алкильной группой иминогруппу,Rb обозначает метильную группу иRc обозначает необязательно замещенную С 1-С 8 алкоксикарбонильной, ацетоксиметилоксикарбонильной,2,2,2-трихлорэтоксикарбонильной, бензилоксикарбонильной либо бензоильной группой амидиновую группу,при этом предпочтительными являются прежде всего те из вышеуказанных соединений общей формулы I, в которых Ra находится в положении 5, их С 1-С 3 алканоловые эфиры, их таутомеры, их стереоизомеры и их соли. В качестве примеров наиболее предпочтительных соединений можно назвать следующие соединения из группы, включающей(ж) 2-(4-амидинофениламинометил)-1 метил-5-[1-(N-метилкарбоксиметилкарбониламинометил)-1-метил-1-(пирролидин-1-илкарбонил)этил]бензимидазол,а также их С 1-С 3 алканоловые эфиры, их N(С 1-С 8 алкоксикарбонил)-, N-бензилоксикарбонил- и N-бензоиламидины, их таутомеры, их стереоизомеры и их соли. Согласно изобретению соединения общей формулы I получают по известным способам,например по следующим способам. 15 а) Для получения соединения общей формулы I, в которой Rc представляет собой цианогруппу, циклизуют образующееся при определенных условиях в реакционной смеси соединение общей формулы IIRa, Rb, Ar, А и В имеют значения, указанные выше,Z1 и Z2 могут быть идентичными либо разными и обозначают необязательно замещенные алкильными группами с 1-6 атомами углерода амино-, гидрокси- либо меркаптогруппы илиZ1 и Z2 вместе обозначают атом кислорода либо серы, необязательно замещенную алкильной группой с 1-3 атомами углерода иминогруппу, алкилендиокси- либо алкилендитиогруппу соответственно с 2 или 3 атомами углерода. Циклизацию целесообразно осуществлять в растворителе либо в смеси растворителей, таких как этанол, изопропанол, ледяная уксусная кислота, бензол, хлорбензол, толуол, ксилол,гликоль, монометиловый эфир гликоля, диметиловый эфир диэтиленгликоля, сульфолан, диметилформамид, тетралин или с использованием избытка ацилирующего агента, применяемого для получения соединения общей формулы II,например, в соответствующем нитриле, ангидриде, галогенангидриде кислоты, сложном эфире или амиде, например при температурах в интервале от 0 до 250 С, предпочтительно, однако,при температуре кипения реакционной смеси,необязательно в присутствии агента конденсации, такого как оксихлорид фосфора, тионилхлорид, сульфурилхлорид, серная кислота, птолуолсульфокислота,метансульфокислота,соляная кислота, фосфорная кислота, полифосфорная кислота, уксусная кислота, ангидрид уксусной кислоты, N,N-дициклогексилкарбодиимид, или необязательно в присутствии основания, такого как этилат калия либо третбутилат калия. Циклизацию, однако, можно проводить и без растворителя и/или агента конденсации. Особенно предпочтительно осуществлять реакцию таким образом, чтобы получить соединение общей формулы II в реакционной смеси восстановлением соответствующего о-нитросоединения, необязательно в присутствии карбоновой кислоты общей формулы III(III),в которой Аr, А и В имеют указанные выше значения, и ацилированием образующегося при определенных условиях в реакционной смеси аминосоединения. б) Для получения соединения общей формулы I, в которой Ra обозначает R2-СХ'-С 3 003947 16 С 5 циклоалкиленовую группу, где R2 имеет значения, указанные выше, а X' представляет собой одну из вышеуказанных для Х иминогрупп, соединение общей формулы IVR2-СО-С 3-С 5 циклоалкиленовую группу, где R2 имеет значения, указанные выше, подвергают взаимодействию с амином общей формулы V Н 2 Х'(V) в которой X' представляет собой одну из вышеуказанных для Х иминогрупп. Реакцию целесообразно проводить в растворителе, таком как метанол/толуол, этанол,изопропанол или ксилол, и предпочтительно в присутствии обезвоживающего агента, такого как молекулярное сито, сульфат натрия или хлорид кальция, необязательно в присутствии основания, такого как триэтиламин, при температурах в интервале от 50 до 100 С, предпочтительно при температуре кипения реакционной смеси. в) Для получения соединения общей формулы I, в которой Ra обозначает R2-СХ"-С 3 С 5 циклоалкиленовую группу, где R2 имеет значения, указанные выше, а X" представляет собой одну из указанных выше для Х алкилиденовых групп, соединение общей формулы IV(VI) в которой X" представляет собой одну из указанных выше для Х алкилиденовых групп, aZ3 представляет собой трифенилфосфоновую либо ди(С 1-С 3 алкокси)фосфоновую группу, такую как триэтоксифосфоновая группа. Реакцию предпочтительно проводить в атмосфере защитного газа в растворителе, таком как тетрагидрофуран, диметилформамид, диоксан, диэтиловый эфир или диметилсульфоксид,в присутствии основания, такого как третбутилат калия, метилат натрия или гидрид натрия, при температурах в интервале от -25 до 50 С, предпочтительно в интервале от -15 С до комнатной температуры. г) Для получения соединения общей формулы I, в которой Rс представляет собой амидиновую группу, которая может быть замещена одной либо двумя С 1-С 3 алкильными группами,образующееся при определенных условиях в 17 реакционной смеси соединение общей формулы в которой Ra, Rb, Аr, А и В имеют указанные выше значения, а Z4 представляет собой алкокси- либо аралкоксигруппу, такую как метокси-, этокси-, н-пропокси-, изопропокси- или бензилоксигруппа, или представляет собой алкилтио- либо аралкилтиогруппу, такую как метилтио-, этилтио-, н-пропилтио- или бензилтиогруппа, подвергают взаимодействию с амином общей формулы VIII(VIII),в которой R7 и R8 могут быть идентичными либо разными и обозначают соответственно атом водорода или С 1-С 3 алкильную группу, либо осуществляют взаимодействие с его солями. Эту реакцию целесообразно проводить в растворителе, таком как метанол, этанол, нпропанол, тетрагидрофуран или диоксан, при температурах в интервале от 0 до 150 С, предпочтительно при температурах в интервале от 0 до 80 С, осуществляя при этом взаимодействие с указанным выше амином общей формулы VIII либо с соответствующей кислотно-аддитивной солью, такой как карбонат аммония или ацетат аммония. Соединение общей формулы VII получают, например, взаимодействием соответствующего цианосоединения с соответствующим спиртом, таким как метанол, этанол, нпропанол, изопропанол или бензиловый спирт, в присутствии кислоты, такой как соляная кислота, либо взаимодействием соответствующего амида с солью триалкилоксония, такой как тетрафторборат триэтилоксония, в растворителе,таком как метиленхлорид, тетрагидрофуран или диоксан, при температурах в интервале от 0 до 50 С, предпочтительно, однако, при 20 С, либо взаимодействием соответствующего нитрила с сероводородом, предпочтительно в растворителе, таком как пиридин или диметилформамид, и в присутствии основания, такого как триэтиламин, и последующим алкилированием образовавшегося тиоамида соответствующим алкилили аралкилгалогенидом. д) Для получения соединения общей формулы I, в которой Ra представляет собой имидазолидин-2,4-дион-5-ильную группу, которая может быть замещена одной либо двумя С 1-С 3 алкильными группами, при этом одновременно алкильный заместитель может быть замещен карбокси- либо С 1-С 3 алкоксикарбонильной группой, циклизуют образующееся при определенных условиях в реакционной смеси соединение общей формулы IX 18 в которой Rb, Ar, А и В имеют значения,указанные выше, a Ra" представляет собой аминокарбониламиногруппу, замещенную в положении 3 С 1-С 3 алкоксикарбонил-С 1-С 3 алкильной группой. Эту реакцию целесообразно проводить в растворителе, таком как метанол, этанол, нпропанол, изопропанол или бензиловый спирт, в присутствии кислоты, такой как соляная кислота, при температурах в интервале от 0 до 50 С,предпочтительно, однако, при 20 С. е) Для получения соединения общей формулы I, в которой Rc представляет собой гидроксиамидиновую группу, нитрил общей формулы Х в которой Ra, Rb, Аr, А и В имеют указанные выше значения, подвергают взаимодействию с гидроксиламином либо его солями. Эту реакцию целесообразно проводить в растворителе, таком как метанол, этанол, нпропанол, вода, метанол/вода, тетрагидрофуран,тетрагидрофуран/вода, диоксан или диоксан/вода, при температурах в интервале от 0 до 150 С, предпочтительно в интервале от 0 до 80 С. ж) Для получения соединения общей формулы I, в которой Ra содержит карбоксигруппу,a Rc имеет значения, указанные выше, или Ra имеет значения, указанные выше, a Rc представляет собой необязательно замещенную гидроксигруппой либо одной или двумя С 1-С 3 алкильными группами амидиновую группу, соединение общей формулы XI в которой Rb, Ar, А и В имеют значения,указанные выше, а Ra"' и Rc' имеют значения,указанные выше для Ra и Rc соответственно, при условии, что Ra содержит группу, переводимую путем гидролиза, обработки кислотой либо основанием, путем термолиза или гидрогенолиза в карбоксигруппу, a Rc имеет значения, указанные выше, или Rc представляет собой группу, переводимую путем гидролиза, обработки кислотой либо основанием, путем термолиза или гидрогенолиза в необязательно замещенную гидроксигруппой либо одной или двумя С 1 С 3 алкильными группами амидиновую группу, aRa имеет значения, указанные выше, переводят путем гидролиза, обработки кислотой либо основанием, путем термолиза или гидрогенолиза в соединение общей формулы I, в которой Ra содержит карбоксигруппу, a Rc имеет значения,указанные выше, или Ra имеет значения, указанные выше, a Rc представляет собой необязательно замещенную гидроксигруппой либо од 19 ной или двумя С 1-С 3 алкильными группами амидиновую группу. В качестве группы, переводимой в карбоксигруппу, могут рассматриваться среди прочих защищенная защитной группой карбоксильная группа, в том числе ее функциональные производные, например ее незамещенные или замещенные амиды, сложные эфиры, тиоэфиры,триметилсилиловые эфиры, ортоэфиры либо иминоэфиры, которые целесообразно переводить в карбоксильную группу путем гидролиза,ее сложные эфиры с третичными спиртами, например трет-бутиловый эфир, которые целесообразно переводить в карбоксильную группу путем обработки кислотой либо путем термолиза, и ее сложные эфиры с аралканолами, например бензиловый эфир, которые целесообразно переводить в карбоксильную группу путем гидрогенолиза. Гидролиз целесообразно осуществлять либо в присутствии кислоты, такой как соляная кислота, серная кислота, фосфорная кислота,уксусная кислота, трихлоруксусная кислота,трифторуксусная кислота, или их смесей, либо в присутствии основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в соответствующем растворителе, таком как вода,вода/метанол, вода/этанол, вода/изопропанол,метанол, этанол, вода/тетрагидрофуран или вода/диоксан, при температурах в интервале от -10 до 120 С, например при температурах в интервале от комнатной температуры до температуры кипения реакционной смеси. Если соединение формулы XI содержит,например,трет-бутильную или третбутилоксикарбонильную группу, то эти группы можно отщеплять также путем обработки кислотой, такой как трифторуксусная кислота,муравьиная кислота, п-толуолсульфокислота,серная кислота, соляная кислота, фосфорная кислота или полифосфорная кислота, необязательно в инертном растворителе, таком как метиленхлорид, хлороформ, бензол, толуол, диэтиловый эфир, тетрагидрофуран или диоксан,предпочтительно при температурах в интервале от -10 до 120 С, например при температурах в интервале от 0 до 60 С, или же путем термообработки, необязательно в инертном растворителе, таком как метиленхлорид, хлороформ, бензол, толуол, тетрагидрофуран или диоксан, и предпочтительно в присутствии каталитического количества кислоты, такой как птолуолсульфокислота, серная кислота, фосфорная кислота или полифосфорная кислота, предпочтительно при температуре кипения используемого растворителя, например при температурах в интервале от 40 до 120 С. Если соединение формулы XI содержит,например, бензилокси- или бензилоксикарбонильную группу, то эти группы можно также отщеплять путем гидрогенолиза в присутствии 20 катализатора гидрирования, такого как палладий на угле, в соответствующем растворителе,таком как метанол, этанол, этанол/вода, ледяная уксусная кислота, этиловый эфир уксусной кислоты, диоксан или диметилформамид, предпочтительно при температурах в интервале от 0 до 50 С, например при комнатной температуре,и при давлении водорода 1-5 бар. з) Для получения соединения общей формулы I, в которой Rc представляет собой амидиновую группу, замещенную одной или двумя С 1-С 8 алкоксикарбонильными группами либо отщепляемым in vivo остатком, соединение общей формулы XII в которой Ra, Rb, Аr, А и В имеют значения, указанные выше, a Rc" обозначает амидиновую группу, подвергают взаимодействию с соединением общей формулы XIII(XIII) в которой R9 представляет собой С 1 С 8 алкоксикарбонильную группу или ацильную группу одного из указанных выше отщепляемыхin vivo остатков, a Z5 обозначает нуклеофобную уходящую группу, такую как атом галогена,например атом хлора, брома либо иода, или обозначает п-нитрофенильную группу. Эту реакцию целесообразно проводить в растворителе, таком как метанол, этанол, метиленхлорид, тетрагидрофуран, толуол, диоксан,диметилсульфоксид или диметилформамид,необязательно в присутствии неорганического либо третичного органического основания,предпочтительно при температурах в интервале от 20 С до температуры кипения используемого растворителя. Взаимодействие с соединением общей формулы XIII, в которой Z5 представляет собой нуклеофобную уходящую группу, предпочтительно проводить в растворителе, таком как метиленхлорид, ацетонитрил, тетрагидрофуран,толуол, ацетон/вода, диметилформамид или диметилсульфоксид, необязательно в присутствии основания, такого как гидрид натрия, карбонат калия,трет-бутилат калия илиNэтилдиизопропиламин, при температурах в интервале от 0 до 60 С. Если согласно изобретению получают соединение общей формулы I, содержащее в своем составе (R3NR4)-С 1-С 3 алкильную группу, в которой, по меньшей мере, один из остатков R3 или R4 представляет собой атом водорода, то его можно переводить затем с помощью соответствующего изоцианата или карбамоилгалогенида в соответствующее карбамидное соединение общей формулы I и/или если получают соединение общей формулы I, содержащее в своем составе NН 2-С 1 С 3 алкильную группу, то его можно затем пере 21 водить с помощью соответствующего эфира акриловой кислоты в соответствующее 2-(С 1 С 3 алкоксикарбонил)этильное соединение общей формулы I и/или если получают соединение общей формулы I, содержащее в своем составе (R3NR4)-С 1 С 3 алкильную группу, в которой R3 и R4 представляют собой соответственно атом водорода,то его можно затем переводить с помощью соответствующего дигалогеналкана в соответствующее соединение общей формулы I, в которой R3 и R4 вместе с расположенным между ними атомом азота представляют собой соответствующую 4-7-членную циклоалкилениминогруппу, и/или если получают соединение общей формулы I, в которой Rс представляет собой амидиновую группу, то его можно затем переводить с помощью производного галогенуксусной кислоты и последующими гидролизом и декарбоксилированием в соответствующее замещенное одной либо двумя метильными группами амидиновое соединение, и/или если получают соединение общей формулы I, в которой Rс представляет собой гидроксиамидиновую группу, то его можно затем переводить путем каталитического гидрирования в соответствующее амидиновое соединение,и/или если получают соединение общей формулы I, в которой Rа содержит карбоксигруппу, то его можно затем переводить этерифицированием в соответствующий сложный эфир. Указанный выше последующий процесс получения соответствующего карбамидного соединения общей формулы I целесообразно осуществлять с использованием соответствующего изоцианата или карбамоилхлорида, предпочтительно в растворителе, таком как диметилформамид, и необязательно в присутствии третичного органического основания, такого как триэтиламин, при температурах в интервале от 0 до 50 С, предпочтительно при комнатной температуре. Указанный выше последующий процесс получения соответствующего 2-(С 1-С 3 алкоксикарбонил)этильного соединения целесообразно осуществлять с использованием соответствующего эфира акриловой кислоты, предпочтительно в растворителе, таком как метанол, этанол или изопропанол, при температурах в интервале от 50 до 100 С, предпочтительно при температуре кипения реакционной смеси. Указанный выше последующий процесс получения соответствующего 4-7-членного циклоалкилениминосоединения общей формулы I целесообразно осуществлять с использованием соответствующего дигалогеналкана, предпочтительно в растворителе, таком как метанол, этанол или изопропанол, в присутствии основания,такого как карбонат натрия, при температурах в 22 интервале от 50 до 100 С, предпочтительно при температуре кипения реакционной смеси. Указанное выше последующее алкилирование целесообразно осуществлять в растворителе, таком как метиленхлорид, тетрагидрофуран, диоксан, диметилсульфоксид, диметилформамид или ацетон, необязательно в присутствии ускорителя реакции, такого как иодид натрия или калия, и предпочтительно в присутствии основания, такого как карбонат натрия или карбонат калия, либо в присутствии третичного органического основания, такого как Nэтилдиизопропиламин или N-метилморфолин,которые одновременного могут служить и растворителями, либо необязательно в присутствии карбоната серебра или оксида серебра, при температурах в интервале от -30 до 100 С, предпочтительно, однако, при температурах в интервале от -10 до 80 С. Указанный выше последующий гидролиз целесообразно осуществлять либо в присутствии кислоты, такой как соляная кислота, серная кислота, фосфорная кислота, уксусная кислота,трихлоруксусная кислота, трифторуксусная кислота, или их смесей, либо в присутствии основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в соответствующем растворителе, таком как вода, вода/метанол, вода/этанол, вода/изопропанол, метанол, этанол, вода/тетрагидрофуран или вода/диоксан, а последующее декарбоксилирование осуществлять в присутствии кислоты из числа вышеназванных, при температурах в интервале от -10 до 120 С, например при температурах в интервале от комнатной температуры до температуры кипения реакционной смеси. Последующую этерификацию целесообразно осуществлять с использованием соответствующего спирта, предпочтительно в растворителе либо в смеси растворителей, таких как метиленхлорид, бензол, толуол, хлорбензол,тетрагидрофуран, бензол/тетрагидрофуран или диоксан, предпочтительно, однако, применяя избыток используемого спирта, необязательно в присутствии кислоты, такой как соляная кислота, или же в присутствии обезвоживающего агента, например в присутствии изобутилового эфира хлормуравьиной кислоты, тионилхлорида, триметилхлорсилана, соляной кислоты, серной кислоты,метансульфокислоты,птолуолсульфокислоты, трихлорида фосфора,пентоксида фосфора,N,N'-дициклогексилкарбодиимида,N,N'-дициклогексилкарбодиимида/N-гидроксисукцинимида, N,N'-карбонилдиимидазола либо N,N'-тионилдиимидазола,трифенилфосфина/тетрахлорметана или трифенилфосфина/диэтилового эфира азодикарбоновой кислоты, необязательно в присутствии основания, такого как карбонат калия, Nэтилдиизопропиламин или N,N-диметиламинопиридин, предпочтительно при температурах в интервале от 0 до 150 С, более предпочти 23 тельно при температурах в интервале от 0 до 80 С, или же этерификацию осуществлять с использованием соответствующего галогенида в растворителе, таком как метиленхлорид, тетрагидрофуран, диоксан, диметилсульфоксид, диметилформамид или ацетон, необязательно в присутствии ускорителя реакции, такого как иодид натрия или калия, и предпочтительно в присутствии основания, такого как карбонат натрия или карбонат калия, либо в присутствии третичного органического основания, такого какN-метилморфолин, которые одновременно могут служить и растворителями, либо необязательно в присутствии карбоната серебра или оксида серебра при температурах в интервале от -30 до 100 С, предпочтительно, однако, при температурах в интервале от -10 до 80 С. В описанных выше реакциях в ходе их проведения для необязательно имеющихся реакционноспособных групп, таких как гидрокси-,карбокси-, амино-, алкиламино- или иминогруппы, можно предусмотреть обычные защитные группы и по завершении реакции снова их отщеплять. В качестве защитной группы для гидроксигруппы может использоваться, например,триметилсилильная, ацетильная, бензоильная,трет-бутильная, тритильная, бензильная или тетрагидропиранильная группа,в качестве защитной группы для карбоксильной группы - триметилсилильная, метильная, этильная, трет-бутильная, бензильная или тетрагидропиранильная группа, а в качестве защитной группы для амино-,алкиламино- или иминогруппы -ацетильная,трифторацетильная, бензоильная, этоксикарбонильная, трет-бутоксикарбонильная, бензилоксикарбонильная, бензильная, метоксибензильная или 2,4-диметоксибензильная группа, а для аминогруппы, помимо названных, можно использовать и фталильную группу. В случае использования защитных групп их последующее отщепление можно осуществлять, например, гидролитическим путем в водном растворителе, например в воде, изопропаноле/воде, тетрагидрофуране/воде или диоксане/воде, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, либо в присутствии основания щелочного металла, такого как гидроксид лития,гидроксид натрия или гидроксид калия, или же отщеплением группы простого эфира, например, в присутствии иодтриметилсилана, при температурах в интервале от 0 до 100 С, предпочтительно при температурах в интервале от 10 до 50 С. В отличие от вышеописанного бензильную, метоксибензильную или бензилоксикарбонильную группу отщепляют, например, путем гидрогенолиза с помощью, например, водорода,в присутствии катализатора, такого как палла 003947 24 дий на угле, в растворителе, таком как метанол,этанол, этиловый эфир уксусной кислоты, диметилформамид, диметилформамид/ацетон или ледяная уксусная кислота, необязательно с добавлением кислоты, такой как соляная кислота,при температурах в интервале от 0 до 50 С,предпочтительно, однако, при комнатной температуре, и при давлении водорода в пределах от 1 до 7 бар, предпочтительно, однако, в пределах от 3 до 5 бар. Отщепление метоксибензильной группы можно осуществлять также в присутствии окислителя, такого как аммонийнитрат церия (IV), в растворителе, таком как метиленхлорид, ацетонитрил или ацетонитрил/вода, при температурах в интервале от 0 до 50 С, предпочтительно, однако, при комнатной температуре. Отщепление же 2,4-диметоксибензильной группы предпочтительно осуществлять в трифторуксусной кислоте в присутствии анизола. Отщепление трет-бутильной или третбутилоксикарбонильной группы предпочтительно осуществлять путем обработки кислотой,такой как трифторуксусная кислота или соляная кислота, необязательно с использованием растворителя, такого как метиленхлорид, диоксан или простой эфир. Отщепление фталильной группы предпочтительно осуществлять в присутствии гидразина или первичного амина, такого как метиламин,этиламин или н-бутиламин, в растворителе, таком как метанол, этанол, изопропанол, толуол/вода или диоксан, при температурах в интервале от 20 до 50 С. Отщепление аллилоксикарбонильной группы осуществляют путем обработки каталитическим количеством тетракис(трифенилфосфин)палладия (0), предпочтительно в растворителе, таком как тетрагидрофуран, и предпочтительно в присутствии избытка основания, такого как морфолин или 1,3-димедон, при температурах в интервале от 0 до 100 С, предпочтительно при комнатной температуре и в атмосфере инертного газа, либо путем обработки каталитическим количеством хлорида трис (трифенилфосфин)родия (I) в растворителе, таком как водный этанол, и необязательно в присутствии основания,такого как 1,4-диазабицикло[2,2,2]октан, при температурах в интервале от 20 до 70 С. Применяемые в качестве исходных веществ соединения общих формул II-XIII, частично известные из литературных источников,получают по способам, известным из соответствующих публикаций, более подробно получение указанных соединений описано в представленных примерах. Химия соединений общей формулы III описана, например, у Jack Robinson в Journ.Chem. Soc. 1941. 744, химия бензимидазолов описана у Katritzky и Rees в Comprehensive Heterocyclic Chemistry, Oxford, изд-во PergamonPress, 1984, у Schaumann в Hetarene III, Methoden der organischen Chemie (Houben-Weyl), 4-oe издание, изд-во Verlag Тhiemе, Штуттгарт, 1993. Так, например, соединение общей формулы II получают путем ацилрования соответствующего о-диаминосоединения с помощью соответствующего реакционноспособного производного соединения общей формулы III, соединение общих формул IV, VII, IX, X, XI и XII получают путем циклизации соответствующего замещенного соединения согласно варианту а) и при необходимости последующим восстановлением содержащейся в фенильном фрагменте нитрогруппы, а также последующим ацилированием, амидированием и/или галогенированием. Кроме того, полученные соединения общей формулы I можно разделять на их энантиомеры и/или диастереомеры. Так, например, полученные соединения общей формулы I, образующиеся в форме рацематов, можно разделять по известным методам (см. Allinger N.L. и ElielWiley Interscience, 1971) на их оптические антиподы, а соединения общей формулы I с по меньшей мере 2 асимметричными атомами углерода благодаря их физико-химическим различиям можно разделять по известным методам,например посредством хроматографии и/или путем фракционированной кристаллизации на их диастереомеры, которые затем в случае их образования в рацемической форме можно разделять, как указано выше, на энантиомеры. Разделение на энантиомеры предпочтительно осуществлять на колонках на хиральных фазах либо путем перекристаллизации из оптически активного растворителя, либо взаимодействием с оптически активной субстанцией, образующей с рацемическим соединением соли или производные, как, например, сложные эфиры или амиды, прежде всего с кислотами и их активированными производными или спиртами,разделяя затем полученную таким образом диастереоизомерную солевую смесь или производное, например, исходя из различной степени их растворимости, при этом из чистых диастереомерных солей или производных под действием соответствующих агентов могут высвобождаться свободные антиподы. Наиболее часто используемыми, оптически активными кислотами являются, в частности, D- и L-формы винной кислоты либо дибензоилвинной кислоты, ди-отолилвинной кислоты, яблочной кислоты, миндальной кислоты, камфорной сульфокислоты,глутаминовой кислоты, аспарагиновой кислоты или хинной кислоты. В качестве оптически активного спирта приемлем, например, (+)- или(-)-ментол, а в качестве оптически активной ацильной группы в амидах -, например, (+)- или(-)-ментилоксикарбонильная группа. Далее, полученные соединения общей формулы I можно переводить в их соли, прежде 26 всего в физиологически приемлемые соли с неорганическими или органическими кислотами,предназначенные для применения в фармацевтике. В качестве таких кислот для этих целей могут рассматриваться среди прочих соляная кислота, бромисто-водородная кислота, серная кислота, метансульфокислота, фосфорная кислота, фумаровая кислота, янтарная кислота,молочная кислота, лимонная кислота, винная или малеиновая кислота. Кроме того, полученные описанным выше путем новые соединения общей формулы I в случае наличия в их структуре карбоксигруппы при необходимости можно переводить затем в их соли с неорганическими или органическими основаниями, прежде всего в физиологически приемлемые соли, предназначенные для применения в фармацевтике. В качестве таких оснований для этих целей могут рассматриваться среди прочих гидроксид натрия, гидроксид калия, циклогексиламин, этаноламин, диэтаноламин и триэтаноламин. Как уже указывалось выше, новые соединения общей формулы I и их соли обладают ценными свойствами. Так, в частности, соединения общей формулы I, в которых Rc представляет собой цианогруппу, являются ценными промежуточными продуктами для получения остальных соединении общей формулы I, а соединения общей формулы I, в которых Rc представляет собой одну из названных выше амидиновых групп, равно как и их таутомеры, их стереоизомеры и их физиологически приемлемые соли обладают ценными фармакологическими свойствами, прежде всего антитромботическим эффектом, основанном предпочтительно на воздействии на тромбин или фактор Ха, например на подавлении тромбина или фактора Ха, на действии, увеличивающем продолжительность аЧТВ (активированное частичное тромбопластиновое время) и на подавлении родственных сериновых протеаз, таких, например, как трипсин, урокиназа, фактор VIIa, фактор IX, факторXI и фактор XII. Представленные ниже соединения из группы, включающей А=гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-(пирролидин-1-илкарбонил)циклопропил]бензимидазола,Б=гидрохлорид (Е/Z)-2-(4-амидинофениламинометил)-1-метил-5-[1-[(пиридин-2-ил)(карбоксиметилоксиимино)метилен]циклопропил]бензимидазола,В=гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-(2-карбоксиэтиламино)-1(пирролидин-1-илкарбонил)этил]бензимидазола,Г=гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-[2-(2-карбоксиэтил)пирролидин-1-илкарбонил]циклопропил]бензимидазола, 27 Д=гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[2-(2-карбоксиэтил)-4,5 диметилимидазол-1-илметил]бензимидазола,Е=гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-(карбоксиметиламино)-1(пирролидин-1-илкарбонил)этил]бензимидазола и Ж=дигидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-(N-метилкарбоксиметилкарбониламинометил)-1-метил-1-(пирролидин 1-илкарбонил)этил]бензимидазола,исследовали на их влияние на увеличение продолжительности аЧТВ следующим образом. Материал: плазма, из нитратной крови человека,ЧТВ-реагент, фирма Boehringer MannheimDesaga, Wiesloch. Проведение исследований: продолжительность аЧТВ определяли с помощью коагулометра типа Biomatic B10 фирмы Desaga. Тестируемую субстанцию помещали совместно с 0,1 мл плазмы из нитратной крови человека и 0,1 мл ЧТВ-реагента в соответствующие сосуды согласно инструкциям изготовителя. Смесь инкубировали в течение 3 мин при 37 С. Добавлением 0,1 мл раствора кальция инициировали реакцию свертывания. В зависимости от особенностей используемого измерительного прибора после введения раствора кальция определяли время, потребовавшееся для завершения свертывания смеси. В качестве контроля использовали смеси, к которым добавляли ДБА-буфер. Эффективную концентрацию соответствующей субстанции, при которой аЧТВ удваивалось по сравнению с контролем, определяли по кривой зависимости эффекта от дозы. В нижеследующей таблице представлены полученные показатели: Соединение аЧТВ (ED200 в мкм) А 0,12 Б 0,42 В 0,31 Г 0,29 Д 0,29 Е 0,20 Ж 0,17 Получаемые согласно изобретению соединения отличаются хорошей совместимостью,что подтверждает отсутствие каких-либо токсических побочных действий при их использовании в терапевтических дозах. Благодаря их фармакологическим свойствам новые соединения и их физиологически 28 приемлемые соли могут применяться для предупреждения и лечения венозных и артериальных тромботических заболеваний, например,для лечения тромбофлебита глубоких вен нижних конечностей, для предупреждения повторной окклюзии после операций шунтирования или ангиопластики (РТ(С)А), а также окклюзии при периферических артериальных заболеваниях, таких как легочная эмболия, распространенного внутрисосудистого свертывания, для профилактики тромбоза коронарных сосудов, для профилактики инсульта и предупреждения окклюзии шунта. Помимо этого, предлагаемые в изобретении соединения могут применяться в качестве дополнительных антитромботических средств при лечении тромболитических заболеваний, например, предполагающем применение препаратов rt-PA или стрептокиназы, для предупреждения длительного рестеноза после ангиопластики, для предупреждения метастазирования и роста зависящих от коагуляции опухолей и зависящих от содержания фибрина воспалительных процессов, например при лечении фиброзиса легочной артерии. Дозировка, необходимая для достижения соответствующего эффекта, составляет при внутривенном введении от 0,1 до 30 мг/кг, более предпочтительно от 0,3 до 10 мг/кг, а при оральном введении она составляет от 0,1 до 50 мг/кг, предпочтительно от 0,3 до 30 мг/кг, соответственно из расчета на 1-4 приема в день. С этой целью полученные согласно изобретению соединения формулы I, необязательно в сочетании с другими активными веществами, совместно с одним либо несколькими обычными инертными носителями и/или разбавителями,например с кукурузным крахмалом, молочным сахаром, тростниковым сахаром, микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, водой/этанолом, водой/ глицерином, водой/сорбитом, водой/полиэтиленгликолем, пропиленгликолем, цетилстеариловым спиртом, карбоксиметилцеллюлозой или жирными субстанциями, такими как отвержденный жир, либо их соответствующими смесями перерабатывают в обычные галеновы формы, такие как таблетки, драже, капсулы,порошки, суспензии или свечи. Ниже изобретение более подробно поясняется на примерах. Пример 1. Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-(пирролидин-1 илкарбонил)циклопропил]бензимидазола. а) 1-(4-Xлор-3-нитрофенил)-1-циклопропанкарбоновая кислота. К 350 мл дымящей азотной кислоты порциями добавляют при -25 С 50,0 г (0,21 моля) 1(4-хлорфенил)-1-циклопропанкарбоновой кислоты. Раствор перемешивают в течение 15 мин при -25 С, после чего сливают на ледяную воду. 29 Выпавший продукт удаляют вакуумфильтрацией, промывают водой и сушат. Выход: 58,5 г (95% от теории).Rf-значение: 0,45 (силикагель; метиленхлорид/метанол в соотношении 9,5:0,5). б) 1-(4-Метиламино-3-нитрофенил)-1 циклопропанкарбоновая кислота. 20,0 г (0,083 моля) 1-(4-хлор-3-нитрофенил)-1-циклопропанкарбоновой кислоты и 100 мл раствора метиламина (40%-ного в Н 2 О) нагревают в автоклаве в течение 5 ч при 80 С. Содержимое сосуда упаривают досуха, растворяют в воде и подкисляют ледяной уксусной кислотой. Выпавший в осадок продукт отфильтровывают вакуум-фильтрацией, промывают водой и сушат. Выход: 16,9 г (93% от теории),Rf-значение: 0,58 (силикагель; метиленхлорид/метанол в соотношении 9:1). в) 4-[1-(Пирролидин-1-илкарбонил)циклопропил]-2-нитро-N-метиланилин. 2,4 г (0,01 моля) 1-(4-метиламино-3-нитрофенил)-1-циклопропанкарбоновой кислоты растворяют в 50 мл диметилформамида и после добавления 3,2 г (0,01 моля) тетрафторобората(0,01 моля) N-метилморфолина перемешивают в течение 20 ч при комнатной температуре. Затем растворитель отгоняют и остаток хроматографируют на силикагеле, элюируя при этом метиленхлоридом. Требуемые фракции упаривают,растирают с простым эфиром, отфильтровывают вакуум-фильтрацией и сушат. Выход: 1,8 г (61% от теории).Rd-значение: 0,51 (силикагель; метиленхлорид/метанол в соотношении 9:1). г) 4-[1-(Пирролидин-1-илкарбонил)циклопропил]-2-aминo-N-метиланилин. 1,8 г (6,2 ммоля) 4-[1-(пирролидин-1 илкарбонил)циклопропил]-2-нитро-N-метиланилина растворяют в 40 мл метанола и 40 мл метиленхлорида и после добавления 0,4 г палладия на активированном угле (10%-ного) гидрируют в течение 4 ч при комнатной температуре. Затем отфильтровывают от катализатора и упаривают. Выход: 1,6 г (100% от теории).Rf-значение: 0,26 (силикагель; метиленхлорид/метанол в соотношении 9:1). д) 4-[1-(Пирролидин-1-илкарбонил)циклопропил]-2-(4-цианофенил)аминометилкарбониламино-N-метиланилин. Получение аналогично примеру 1 в из 4-[1(пирролидин-1-илкарбонил)циклопропил]-2 амино-N-метиланилина, тетрафторобората O(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, 4-цианофенилглицина и триэтиламина в диметилформамиде. Выход: 66% от теории. 30 е) 2-(4-Цианофениламинометил)-1-метил 5-[1-(пирролидин-1-илкарбонил)циклопропил] бензимидазол. 1,7 г (0,004 моля) 4-[1-(пирролидин-1 илкарбонил)циклопропил]-2-(4-цианофенил) аминометилкарбониламино-N-метиланилина в 7 мл ледяной уксусной кислоты нагревают в течение 2 ч с обратным холодильником. Затем растворитель отгоняют, остаток растворяют в воде и экстрагируют метиленхлоридом. Органическую фазу сушат, упаривают и в завершение хроматографируют на силикагеле, элюируя при этом метиленхлоридом +2-3% метанола. Выход: 1,0 г (62% от теории).Rf-значение: 0,49 (силикагель; метиленхлорид/метанол в соотношении 9:1). ж) Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-(пирролидин-1-илкарбонил)циклопропил]бензимидазола. 1,0 г (2,5 ммоля) 2-(4-цианофениламинометил)-1-метил-5-[1-(пирролидин-1-илкарбонил)циклопропил]бензимидазола растворяют в 50 мл насыщенного раствора соляной кислоты в этаноле и перемешивают в течение 5 ч при комнатной температуре. Затем растворитель отгоняют, остаток растворяют в 50 мл абсолютного этанола и смешивают с 2,3 г (25 ммолей) карбоната аммония. После выдержки в течение 60 ч при комнатной температуре упаривают досуха. Остаток хроматографируют на силикагеле,элюируя при этом метиленхлоридом/метанолом в соотношении 7:1. Выход: 700 мг (62% от теории).C29H36N6O4HCl (532,66/569,11),масс-спектр: (М+Н)+=533,(М+2 Н)=267. Пример 2. Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-(1-циклопентилкарбонил-3-хлор-н-пропил)бензимидазола. а) 4-[1-(Циклопентилкарбонил)циклопропил]хлорбензол. 2,4 г (0,1 моля) магниевой стружки суспендируют в 10 мл простого эфира. После добавления на кончике шпателя иода медленно добавляют по каплям 14,9 г (0,1 моля) бромпиклопентана в 40 мл простого эфира, инициируя при этом реакцию начальным легким нагреванием суспензии. По завершении процесса до 003947 32 бавления нагревание продолжают еще в течение 30 мин с обратным холодильником. Затем добавляют раствор из 14,0 г (0,08 моля) 1-(4 хлорфенил)-1-циклопропанкарбонитрила в 75 мл простого эфира и продолжают нагревание еще в течение 3 ч с обратным холодильником. После этого реакционный раствор сливают на ледяную воду, значение рН с помощью соляной кислоты устанавливают на 3 и экстрагируют простым эфиром. Органические экстракты сушат и упаривают. Остаток хроматографируют на силикагеле и элюируют петролейным эфиром/уксусным эфиром в соотношении 19:1 и 15:1. Выход: 3,0 г (12% от теории).Rf-значение: 0,58 (силикагель; петролейный эфир/уксусный эфир в соотношении 4:1). б) 4-[1-(Циклопентилкарбонил)циклопропил]-2-нитрохлорбензол. Получение аналогично примеру 1 а из 4-[1(циклопентилкарбонил)циклопропил]хлорбензола и дымящей азотной кислоты. Выход: 87% от теории.Rf-значение: 0,60 (силикагель; петролейный эфир/уксусный эфир в соотношении 9:1). в) 4-[1-(Циклопентилкарбонил)циклопропил]-2-нитро-N-метиланилин. Получение аналогично примеру 1 б из 4-[1(циклопентилкарбонил)циклопропил]-2-нитрохлорбензола и водного раствора метиламина. Выход: 18% от теории,Rf-значение: 0,54 (силикагель; метиленхлорид/этанол в соотношении 19:1). г) 4-[1-(Циклопентилкарбонил)циклопропил]-2-амино-N-метиланилин. 2,3 г (7,9 ммоля) 4-[1-(циклопентилкарбонил)циклопропил]-2-нитро-N-метиланилина растворяют в 125 мл уксусного эфира и 25 мл этанола и после добавления 1,0 г никеля Ренея гидрируют в течение 1,5 ч при комнатной температуре. Затем отфильтровывают от катализатора и упаривают. Выход: 2,0 г (98% от теории).Rf-значение: 0,15 (силикагель; метиленхлорид/этанол в соотношении 19:1). д) 4-[1-(Циклопентилкарбонил)циклопропил]-2-(4-цианофениламинометилкарбониламино)-N-метиланилин. Получение аналогично примеру 1 в из 4-[1(циклопентилкарбонил)циклопропил]-2-аминоN-метиланилина, тетрафторобората O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, 4 цианофенилглицина и триэтиламина в диметилформамиде. Выход: 96% от теории.Rf-значение: 0,54 (силикагель; метиленхлорид/этанол в соотношении 19:1). е) 2-(4-Цианофениламинометил)-1-метил 5-[1-(циклопентилкарбонил)циклопропил]бензимидазол. Получение аналогично примеру 1 е из 4- [1(циклопентилкарбонил)циклопропил]-2-(4 33 цианофениламинометилкарбониламино)-Nметиланилина в ледяной уксусной кислоте. Выход: 53% от теории.Rf-значение: 0,46 (силикагель; метиленхлорид/этанол в соотношении 19:1). ж) Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-(1-циклопентилкарбонил-3-хлор-н-пропил)бензимидазола. Получение аналогично примеру 1 ж из 2-(4 цианофениламинометил)-1-метил-5-(1-циклопентилкарбонил-3-хлор-н-пропил)бензимидазола и соляной кислоты/карбоната аммония в этаноле. Выход: 61% от теории. С 25 Н 30 СlN5 ОНСl (452,00/488,56),масс-спектр: (M+H)+=452/4 (Сl). Пример 3. Гидрохлорид (Е/Z)-2-(4-амидинофениламинометил)-1-метил-5-[1-[(пиридин-3 ил)(этоксикарбонилметилоксиимино)метилен] циклопропил]бензимидазола. а) 1-[(Пиридин-3-ил)карбонил]циклопропилбензол. К 100 мл бутиллития (1,6 М в гексане) при температуре в интервале от -40 до -50 С по каплям добавляют раствор из 21,4 г (0,135 моля) 3 бромпиридина в 125 мл простого эфира, после чего перемешивают еще в течение 20 мин при-40 С. Затем охлаждают до -60 С и по каплям добавляют раствор из 20,1 г (0,14 моля) 1 фенилциклопропанкарбонитрила в 125 мл простого эфира. По завершении процесса добавления реакционную смесь нагревают до комнатной температуры и перемешивают в течение 5 ч. Далее к суспензии примешивают 20%-ную соляную кислоту и в течение 30 мин нагревают до 100 С. После охлаждения значение рН с помощью 20%-ного едкого натра устанавливают на 8 и экстрагируют уксусным эфиром. Объединенные органические экстракты сушат и упаривают. Остаток хроматографируют на оксиде алюминия, элюируя при этом петролейным эфиром/уксусным эфиром в соотношении 9:1. Выход: 14,0 г (46% от теории).Rf-значение: 0,27 (оксид алюминия; петролейный эфир/уксусный эфир в соотношении 9:1). б) 4-[1-[(Пиридин-3-ил)карбонил]циклопропил]нитробензол. Получение аналогично примеру 1 а из 1[(пиридин-3-ил)карбонил]циклопропилбензола и дымящей азотной кислоты. Выход: 53,7% от теории.Rf-значение: 0,29 (оксид алюминия; петролейный эфир/уксусный эфир в соотношении 4:1). в) 4-[1-[(Пиридин-3-ил)карбонил]циклопропил]анилин. Получение аналогично примеру 2 г из 4-[1[(пиридин-3-ил)карбонил]циклопропил]нитробензола в присутствии никеля Ренея в уксусном эфире/этаноле.(силикагель; метиленхлорид/ этанол в соотношении 19:1). г) 4-[1-[(Пиридин-3-ил)карбонил]циклопропил]трифторацетиланилин. 8,0 г (33,5 ммоля) 4-[1-[(пиридин-3 ил)карбонил]циклопропил]анилина растворяют в 100 мл хлорбензола и после добавления 15 мл ангидрида трифторуксусной кислоты перемешивают в течение 2 ч при 110 С. Затем растворитель отгоняют, остаток тщательно размешивают с петролейным эфиром/простым эфиромRf-значение: 0,54 (силикагель; метиленхлорид/этанол в соотношении 19:1). д) 4-[1-[(Пиридин-3-ил)карбонил]циклопропил]-2-нитротрифторацетиланилин. 13 мл концентрированной серной кислоты и 16 мл 65%-ной азотной кислоты при -5 С порциями смешивают с 1,7 г (5 ммолей) 4-[1[(пиридин-3-ил)карбонил]циклопропил]трифторацетиланилина. Затем без охлаждения перемешивают еще в течение 30 мин, сливают на ледяную воду и экстрагируют уксусным эфиром. Органические экстракты сушат и упаривают. Остаток хроматографируют на силикагеле и элюируют метиленхлоридом/этанолом в соотношении 50:1 и 25:1. Требуемые фракции упаривают, растирают с простым эфиром и петролейным эфиром, отфильтровывают вакуумфильтрацией и сушат. Выход: 1,2 г (75% от теории).Rf-значение: 0,70 (силикагель; метиленхлорид/этанол в соотношении 19:1). е) 4-[1-[(Пиридин-3-ил)карбонил]циклопропил]-2-нитро-N-трифторацетил-N-метиланилин. 1,15 г (3,0 ммоля) 4-[1-[(пиридин-3-ил) карбонил]циклопропил]-2-нитротрифторацетиланилина растворяют в 50 мл ацетона и после добавления 2,0 г карбоната калия и 0,8 мл метилиодида нагревают в течение 2 ч с обратным холодильником. Нерастворимый материал отфильтровывают и раствор концентрируют. Остаток хроматографируют на силикагеле, элюируя при этом петролейным эфиром/уксусным эфиром в соотношении 1:1 и 1:4. Выход: 0,88 г (75% от теории).Rf-значение: 0,38 (силикагель; петролейный эфир/уксусный эфир в соотношении 1:1). ж) 4-[1-[(Пиридин-3-ил)карбонил]циклопропил]-2-нитро-N-метиланилин. 7,4 г (18,8 ммоля) 4-[1-[(пиридин-3-ил) карбонил]циклопропил]-2-нитро-N-трифторацетил-N-метиланилина перемешивают в 200 мл 20%-ного едкого кали в течение 1 ч при 30 С. Затем разбавляют изопропанолом, органическую фазу отделяют, смешивают с 10,0 г оксида алюминия и упаривают досуха. Остаток хроматографируют на оксиде алюминия, элюируя приRf-значение: 0,50 (силикагель; петролейный эфир/уксусный эфир в соотношении 1:1). з) 4-[1-[(Пиридин-3-ил)карбонил]циклопропил]-2-амино-N-метиланилин. Получение аналогично примеру 2 г из 4-[1[(пиридин-3-ил)карбонил]циклопропил]-2-нитро-N-метиланилина и никеля Ренея в уксусном эфире/этаноле. Выход: 98% от теории.Rf-значение: 0,51 (силикагель; метиленхлорид/этанол в соотношении 19:1). и) 4-[1-[(пиридин-1-ил)карбонил]циклопропил]-2-(4-цианофенил)аминометилкарбониламино-N-метиланилин. Получение аналогично примеру 1 в из 4-[1[(пиридин-3-ил)карбонил]циклопропил]-2-амино-N-метиланилина,тетрафтороборатаRf-значение: 0,48 (силикагель; метиленхлорид/этанол в соотношении 19:1). к) 2-(4-Цианофениламинометил)-1-метил 5-[1-[(пиридин-3-ил)карбонил]циклопропил] бензимидазол. Получение аналогично примеру 1 е из 4(пиридин-3-илкарбонил)циклопропил-2-(4-цианофенил)аминометилкарбониламино-Nметиланилина в ледяной уксусной кислоте. Выход: 76% от теории.Rf-значение: 0,52 (силикагель; метиленхлорид/этанол в соотношении 19:1). л) (Е/Z)-2-(4-Цианофениламинометил)-1 метил-5-[1-[(пиридин-3-ил)(карбоксиметилоксиимино)метилен]циклопропил]бензимидазол. 1,6 г (4,0 ммоля) 2-(4-цианофениламинометил)-1-метил-5-[1-[(пиридин-3-ил)карбонил] циклопропил]бензимидазола, 3,0 г (12 ммолей) полугидрата карбоксиметоксиламина, 0,84 мл триэтиламина, 12 г молекулярного сита 3 и 12 г молекулярного сита 4 нагревают с обратным холодильником в течение 12 ч в 80 мл метанола и 40 мл толуола. Затем отфильтровывают от молекулярного сита и упаривают. Остаток тщательно размешивают с водой, отфильтровывают вакуум-фильтрацией и сушат. Сырой продукт хроматографируют на силикагеле, элюируя при этом метиленхлоридом/этанолом/ледяной уксусной кислотой в соотношении 25:1:0 и 8:2: 0,2. Выход: 0,9 г (48% от теории). 36 Получение аналогично примеру 1 ж из 37 150 мг гидрохлорида (Е/Z)-2-(4-амидинофениламинометил)-1-метил-5-[1-[(пиридин-2 ил)(этоксикарбонилметилоксиимино)метилен] циклопропил]бензимидазола и 2,5 мл 2 н. едкого натра перемешивают в 10 мл этанола в течение 5 ч при комнатной температуре. Затем спирт отгоняют и значение рН остатка устанавливают с помощью соляной кислоты на 5. Кристаллический продукт отфильтровывают вакуумфильтрацией, промывают водой и сушат. Выход: 46% от теории.Rf-значение: 0,57 (обращенная фаза RP 18; метанол/5%-ный раствор хлорида натрия в соотношении 3:2). С 28 Н 34N6O3 НСl (502,62/539,08),масс-спектр: (М+Н)+=503, (М+Na)+=525.Rf-значение: 0,73 (обращенная фаза RР 8; метанол/5%-ный раствор хлорида натрия в соотношении 1:2).Rf-значение: 0,70 (обращенная фаза RP 8; метанол/5%-ный раствор хлорида натрия в соотношении 1:2). С 25 Н 30N6O5 НСl (494,55/531,05),масс-спектр: (М+Н)+=495, (2 М+Н)+=989.Rf-значение: 0,70 (обращенная фаза RP 8; метанол/5%-ный раствор хлорида натрия в соотношении 6:4).Rf-значение: 0,45 (обращенная фаза RP 8; метанол/5%-ный раствор хлорида натрия в соотношении 6:4).(0,12 моля) цианата калия перемешивают в 150 мл воды и 150 мл метанола в течение 18 ч при 55 С. Затем растворитель отгоняют, остаток растворяют в воде и экстрагируют уксусным эфиром. Объединенные органические экстракты сушат и упаривают. Выход: 8,6 г (38% от теории),tпл. 215C. б) 5-(4-Хлор-3-нитрофенил)имидазолидин 2,4-дион. Получение аналогично примеру 1 а из 5-(4 хлорфенил)имидазолидин-2,4-диона и дымящей азотной кислоты. Выход: 52% от теории, Rf-значение: 0,63(силикагель; метиленхлорид/метанол в соотношении 9:1). в) Гидрохлорид 4-хлор-3-нитрофенилаланина. 560 мг (2,2 моля) 5-(4-хлор-3-нитрофенил) имидазолидин-2,4-диона нагревают с обратным холодильником в 20 мл полуконцентрированной соляной кислоты в течение 24 ч. Затем растворитель отгоняют, остаток растворяют в воде,отфильтровывают от нерастворимых компонентов и упаривают. Остаток трижды растворяют в этаноле, упаривают досуха, растирают с простым эфиром, отфильтровывают вакуумфильтрацией и сушат. Выход: 380 мг (65% от теории),tпл. 186 С. г) 4-Xлор-3-нитро-N-тpет-бутилоксикарбонилфенилаланин. 5,7 г (17,8 ммоля) гидрохлорида 4-хлор-3 нитрофенилаланина растворяют в 50 мл диокса 41 на и 25 мл воды и после добавления 5,5 мл (39,1 ммоля) триэтиламина и 4,8 г (21,3 ммоля) дитрет-бутилдикарбоната перемешивают в течение 18 ч при комнатной температуре. Затем примешивают 0,5 М раствор гидросульфата калия и экстрагируют уксусным эфиром. Объединенные органические экстракты сушат и упаривают. Выход: 6,3 г (100% от теории).Rf-значение: 0,20 (силикагель; метиленхлорид/метанол в соотношении 9:1). д) 2-(4-Xлор-3-нитрофенил)-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)этанон. Получение аналогично примеру 1 в из 4 хлор-3-нитро-N-трет-бутилоксикарбонилфенилаланина, тетрафторобората O-(бензотриазол)N,N,N',N'-тетраметилурония, пирролидина и Nэтилдиизопропиламина в тетрагидрофуране. Выход: 68% от теории,tпл. 203 С. е) 2-(4-Метиламино-3-нитрофенил)-2-третбутилоксикарбониламино-1-(пирролидин-1 ил)этанон. Получение аналогично примеру 16 из 2-(4 хлор-3-нитрофенил)-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)этанона и раствора метиламина. Выход: 76% от теории.Rf-значение; 0,33 (силикагель; циклогексан/уксусный эфир в соотношении 1:1). ж) 2-(4-Метиламино-3-аминофенил)-2 трет-бутилоксикарбониламино-1-(пирролидин 1-ил)этанон. Получение аналогично примеру 1 г из 2-(4 метиламино-3-нитрофенил)-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)этанона и палладия на активированном угле в метиленхлориде/этаноле. Выход: 100% от теории.Rf-значение: 0,12 (силикагель; циклогексан/уксусный эфир в соотношении 1:1). з) 2-[4-Метиламино-3-(4-цианофениламинометилкарбониламино)фенил]-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)этанон. Получение аналогично примеру 1 в из 2-(4 метиламино-3-аминофенил)-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)этанона,тетрафторобората О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, 4-цианофенилглицина и триэтиламина в тетрагидрофуране. Выход: 100% от теории,Rf-значение: 0,50 (силикагель; метиленхлорид/метанол в соотношении 9:1). и) 2-(4-Цианофениламинометил)-1-метил 5-[1-(пирролидин-1-илкарбонил)аминометил] бензимидазол. Получение аналогично примеру 1 е из 2-[4 метиламино-3-(4-цианофениламинометилкарбониламино)фенил]-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)этанона в ледяной уксусной кислоте. 42 Выход: 30% от теории,Rf-значение: 0,19 (силикагель; метиленхлорид/метанол в соотношении 9,5:0,5). к) Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-(пирролидин-1-илкарбонил)аминометил]бензимидазола. Получение аналогично примеру 1 ж из 2-(4 цианофениламинометил)-1-метил-5-[1-(пирролидин-1-илкарбонил)аминометил] бензимидазола и соляной кислоты/карбоната аммония в этаноле. Выход: 27% от теории,С 22H27N7OНСl (405,50/441,96),масс-спектр: (М+Н)+=406. Аналогично примеру 5 получают следующие соединения: 43 Пример 6. Гидрохлорид 2-(4-амидинoфениламинометил)-1-метил-5-[1-[N-(2-этоксикарбонилэтил)амино]-1-(пирролидин-1-илкарбонил)этил]бензимидазола. а) 5-(4-Хлор-3-нитрофенил)-5-метилимидазолидин-2,4-дион. К 50 мл дымящей азотной кислоты при температуре в интервале от -25 до -35 С добавляют порциями 10,0 г (4,45 ммоля) 5-(4 хлорфенил)-5-метилимидазолидин-2,4-диона. По истечении 45 мин выдержки при температуре в интервале от -25 до -20 С реакционную смесь сливают на ледяную воду. Кристаллический продукт отфильтровывают вакуумфильтрацией, промывают водой и сушат. Выход: 10,5 г (100% от теории).(0,044 моля) 5-(4-хлор-3 нитрофенил)-5-метилимидазолидин-2,4-диона нагревают с обратным холодильником в 200 мл диоксана и 700 мл 6 н. соляной кислоты в течение 5 дней. Затем раствор упаривают, остаток растворяют в воде и экстрагируют уксусным эфиром. Водную фазу упаривают, смешивают с толуолом, после чего упаривают досуха. Остаток растирают с простым эфиром, отфильтровывают вакуум-фильтрацией и сушат. Выход: 6,8 г (63% от теории),Rf-значение: 0,24 (обращенная фаза RP 8; 5%-ный раствор поваренной соли/метанол в соотношении 1:1). в) 2-трет-Бутилоксикарбониламино-2-(4 хлор-3-нитрофенил)пропионовая кислота. Получение аналогично примеру 5 г из 2 амино-2-(4-хлор-3-нитрофенил)пропионовой кислоты, ди-трет-бутилдикарбоната пироугольной кислоты и триэтиламина в диоксане. Выход: 9,6 г (100% от теории).Rf-значение: 0,31 (обращенная фаза RP 8; 5%-ный раствор поваренной соли/метанол в соотношении 1:2). г) 2-(4-Xлор-3-нитрофенил)-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)пропанон. Получение аналогично примеру 1 в из 2 трет-бутилоксикарбониламино-2-(4-хлор-3-нитрофенил)пропионовой кислоты, тетрафторобората O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, пирролидина и N-метилморфолина в диметилформамиде. Выход: 94% от теории,Rf-значение: 0,11 (силикагель; циклогексан/уксусный эфир в соотношении 1:1). д) 2-(4-Метиламино-3-нитрофенил)-2-третбутилоксикарбониламино-1-(пирролидин-1-ил) пропанон. Получение аналогично примеру 1 б из 2-(4 хлор-3-нитрофенил)-2-трет-бутилоксикарбонил 003947Rf-значение: 0,79 (силикагель; уксусный эфир/этанол в соотношении 9:1). е) 2-(4-Метиламино-3-аминофенил)-2-третбутилоксикарбониламино-1-(пирролидин-1-ил) пропанон. Получение аналогично примеру 1 г из 2-(4 метиламино-3-нитрофенил)-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)пропанона и палладия на активированном углеводороде в метаноле. Выход: 100% от теории,Rf-значение: 0,63 (силикагель; уксусный эфир/этанол в соотношении 9:1). ж) 2-[4-Метиламино-3-(4-цианофениламинометилкарбониламино)фенил]-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)пропанон. Получение согласно примеру 1 в из 2-(4 метиламино-3-аминофенил)-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)пропанона,тетрафторобората О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, 4-цианофенилглицина и N-метилморфолина в диметилформамиде. Выход: 37% от теории.Rf-значение: 0,47 (силикагель; уксусный эфир). з) 2-(4-Цианофениламинометил)-1-метил 5-[1-(N-трет-бутилоксикарбониламино)-1-(пирролидин-1-илкарбонил)этил]бензимидазол. Получение аналогично примеру 1 е из 2-[4 метиламино-3-(4-цианофениламинометилкарбониламино)фенил]-2-трет-бутилоксикарбониламино-1-(пирролидин-1-ил)пропанона и ледяной уксусной кислоты. Выход: 60% от теории.Rf-значение: 0,37 (силикагель; уксусный эфир). и) 2-(4-Цианофениламинометил)-1-метил 5-[1-амино-1-(пирролидин-1-илкарбонил)этил] бензимидазол. 1,3 г (2,3 ммоля) 2-(4-цианофениламинометил)-1-метил-5-[1-(N-трет-бутилоксикарбониламино)-1-(пирролидин-1-илкарбонил) этил]бензимидазола растворяют в 20 мл диоксана и после добавления 40 мл полуконцентрированной соляной кислоты перемешивают в течение 2 ч при комнатной температуре. Затем раствор смешивают со льдом, подщелачивают аммиаком и экстрагируют уксусным эфиром. Объединенные органические экстракты сушат и упаривают. Выход: 0,9 г (98% от теории). 45 10 мл этанола и после добавления 0,3 мл (2,7 ммоля) этилового эфира акриловой кислоты перемешивают в течение 24 ч при 95 С. Затем растворитель отгоняют, остаток хроматографируют на силикагеле, элюируя при этом метиленхлоридом/этанолом в соотношении 20:1 и 4:1. Выход: 0,16 г (31% от теории).Rf-значение: 0,26 (силикагель; уксусный эфир/этанол в соотношении 9:1). л) Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-[N-(2-этоксикарбонилэтил)амино]-1-(пирролидин-1-илкарбонил)этил] бензимидазола. Получение аналогично примеру 1 ж из 2-(4 цианофениламинометил)-1-метил-5-[1-[N-(2 этоксикарбонилэтил)амино]-1-(пирролидин-1 илкарбонил)этил]бензимидазола и соляной кислоты/карбоната аммония в этаноле. Выход: 96% от теории. С 28 Н 37N7O3 НСl (519,65/556,11),масс-спектр: (М+Н)+=520,(M+Na)+=542. Аналогично примеру 6 получают следующие соединения.Rf-значение: 0,50 (обращенная фаза RP 8; метанол/5%-ный раствор поваренной соли в соотношении 3:2). С 26 Н 33N7O4 НСl (507,60/544,05),масс-спектр: (М+Н)+=508.Rf-значение: 0,70 (обращенная фаза RP 8; метанол/5%-ный раствор поваренной соли в соотношении 3:2).Rf-значение: 0,40 (обращенная фаза RP 8; метанол/5%-ный раствор поваренной соли в соотношении 3:2).Rf-значение: 0,60 (обращенная фаза RP 8; метанол/5%-ный раствор поваренной соли в соотношении 3:2).Rf-значение: 0,60 (обращенная фаза RP 8; метанол/5%-ный раствор поваренной соли в соотношении 3:2).Rf-значение: 0,50 (обращенная фаза RP 8; метанол/5%-ный раствор поваренной соли в соотношении 1:1).C29H39N7O32HCl (533,68/606,58),масс-спектр: (М+Н)+=534. Пример 7. Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-[N-циклопентил-N-(3-этоксикарбонилпропионил)амино] циклопропил]бензимидазола. а) 4-1-трет-Бутилоксикарбониламино) циклопропил)-2-нитро-N-метиланилин. 15,0 г (63,5 ммоля) 4-1-карбокси)циклопропил)-2-нитро-N-метиланилина и 17,6 мл (127 ммолей) триэтиламина растворяют в 250 мл дихлорметана и при 0 С примешивают 8,3 г (76 ммолей) этилового эфира хлормуравьиной кислоты. По истечении 1 ч выдерживания при комнатной температуре добавляют 0,75 г бромида тетрабутиламмония. Затем по каплям добавляют раствор из 6,3 г (96 ммолей) азида натрия в 20 мл воды. По истечении 1 ч при 0 С раствор разбавляют водой и экстрагируют уксусным эфиром. Органические экстракты сушат и упаривают. Остаток растворяют в 200 мл третбутанола и в течение 2 ч нагревают с обратным холодильником. После этого растворитель выпаривают, остаток хроматографируют на силикагеле и элюируют метиленхлоридом. Выход: 15,5 г (77% от теории).Rf-значение: 0,83 (силикагель; метиленхлорид/метанол в соотношении 9,5:0,5). б) Гидрохлорид [(1-амино)циклопропил]2-нитро-N-метиланилина. 15,5 г (0,05 моля) 4-1-трет-бутилоксикарбониламино)циклопропил)-2-нитро-N-метиланилина растворяют в 50 мл этанола и 50 мл соляной кислоты в этаноле и в течение 7 ч перемешивают при комнатной температуре. Затем растворитель отгоняют, остаток растирают с простым эфиром, отфильтровывают вакуумфильтрацией и сушат. Выход: 98% от теории.Rf-значение: 0,44 (силикагель; метиленхлорид/метанол в соотношении 9,5:0,5). в) 4-[N-(1-циклопентиламино)циклопропил]-2-нитро-N-метиланилин. 12,0 г (0,05 моля) гидрохлорида 4-[(1 амино)циклопропил]-2-нитро-N-метиланилина растворяют в 500 мл тетрагидрофурана и после добавления 4,1 г (0,05 моля) циклопентанона и 3,2 мл ледяной уксусной кислоты порциями смешивают в атмосфере азота с 13,6 г (0,064 моля) триацетоксиборогидрида натрия. По ис 49 течении 16 ч выдерживания при комнатной температуре разбавляют раствором гидрокарбоната натрия и экстрагируют уксусным эфиром. Органические экстракты сушат и упаривают. Остаток хроматографируют на силикагеле и элюируют уксусным эфиром/циклогексаном в соотношении 1:1. Выход: 10,8 г (80% от теории).Rf-значение: 0,56 (силикагель; метиленхлорид/метанол в соотношении 9,5:0,5). г) 4-[1-(N-(3-этоксикарбонилпропионил)N-циклопентиламино)циклопропил]-2-нитро-Nметиланилин. 1,0 г (3,6 ммоля) 4-[(1-циклопентиламино) циклопропил]-2-нитро-N-метиланилина растворяют в 30 мл тетрагидрофурана и после добавления 0,45 г (4,4 ммоля) триэтиламина примешивают 0,65 г (4,4 ммоля) хлорангидрида моноэтилового эфира янтарной кислоты и в течение 4 ч перемешивают при комнатной температуре. После этого разбавляют уксусным эфиром и раствором гидрокарбоната натрия, органические экстракты сушат и упаривают. Остаток хроматографируют на силикагеле, элюируя при этом уксусным эфиром/циклогексаном в соотношении 1:1. Выход: 1,3 г (90% от теории).Rf-значение: 0,46 (силикагель; уксусный эфир/циклогексан в соотношении 1:1). д) 4-[1-(N-(3-этоксикарбонилпропионил)N-циклопентиламино)циклопропил]-2-амино-Nметиланилин. Получение аналогично примеру 1 г из 4-[1(N-(3-этоксикарбонилпропионил)-N-циклопентиламино)циклопропил]-2-нитро-N-метиланилина и палладия на активированном угле/водорода в метиленхлориде/этаноле. Выход: 100% от теории.Rf-значение: 0,18 (силикагель; уксусный эфир/циклогексан в соотношении 1:1). е) 4-[1-(N-(3-Этоксикарбонилпропионил)N-циклопентиламино)циклопропил]-2-(4-цианофенил)аминометилкарбониламино-N-метиланилин. Получение аналогично примеру 1 в из 4-[1(N-(3-этоксикарбонилпропионил)-N-циклопентиламино)циклопропил]-2-амино-N-метиланилина, тетрафторобората O-(бензотриазол-1-ил)N,N,N',N'-тетраметилурония, 4-цианофенилглицина и триэтиламина в диметилформамиде. Выход: 96% от теории.Rf-значение: 0,54 (силикагель; метиленхлорид/метанол в соотношении 9,5:0,5). ж) 2-(4-Цианофениламинометил)-1-метил 5-[1-[N-циклопентил-N-(3-этоксикарбонилпpопионил)аминo]циклопропил]бензимидазол. Получение аналогично примеру 1 е из 4-[1(N-(3-этоксикарбонилпропионил)-N-циклопентиламино)циклопропил]-2-(4-цианофенил)аминометилкарбониламино-N-метиланилина в ледяной уксусной кислоте. Выход: 52% от теории.Rf-значение: 0,81 (силикагель; метиленхлорид/метанол в соотношении 9:1). з) Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-[N-циклопентил-N-(3 этоксикарбонилпропионил)амино]циклопропил] бензимидазола. Получение аналогично примеру 1 ж из 2-(4 цианофениламинометил)-1-метил-5-[1-[N-циклопентил-N-(3-этоксикарбонилпропионил)амино]циклопропил]бензимидазола и соляной кислоты/карбоната аммония в этаноле. Выход: 36% от теории. С 30 Н 38N6 О 3 НСl (530,68/567,14),масс-спектр: (M+H)+=531. Пример 8. Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-(5-метил-3-этоксикарбонилметилимидазолин-2,4-дион-5-ил) бензимидазола. а) 2-(4-Цианофениламинометил)-1-метил 5-[1-(этоксикарбонилметиламинокарбониламино)-1-(пирролидин-1-илкарбонил)этил]бензимидазол. 1,0 г (2,5 ммоля) 2-(4-цианофениламинометил)-1-метил-5-[1-амино-1-(пирролидин-1 илкарбонил)этил]бензимидазола растворяют в 10 мл диметилформамида и после добавления 0,9 мл (7,9 ммоля) этилового эфира изоцианатоуксусной кислоты перемешивают в течение 45 мин при комнатной температуре. Затем раствор сливают на ледяную воду, кристаллический продукт отфильтровывают вакуум-фильтрацией и сушат. Остаток хроматографируют на силикагеле, элюируя при этом метиленхлоридом/этанолом/аммиаком в соотношении 20:1:0,01 и 10:1:0,01.Rf-значение: 0,77 (силикагель; метиленхлорид/этанол/аммиак в соотношении 9:1:0,01). б) Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-(5-метил-3-этоксикарбонилметилимидазолин-2,4-дион-5-ил)бензимидазола. Получение аналогично примеру 1 ж из 2-(4 цианофениламинометил)-1-метил-5-[1-(этоксикарбонилметиламинокарбониламино)-1-(пирролидин-1-илкарбонил)этил]бензимидазола и соляной кислоты/карбоната аммония в этаноле. Выход: 68% от теории.C24H27N7O4HCl (477,52/513,99),масс-спектр: (М+Н)+=478. Пример 9. Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[N-(2-пиридил)N-(2-этоксикарбонилэтил)аминометил]бензимидазола. а) 4-(2-трет-Бутилоксикарбонилэтил)-2(пиридиламинометил)-2-нитрохлорбензол. 13,4 г (0,053 моля) 4-хлор-3-нитробензилбромида и 11,8 г (0,053 моля) 2-третбутилоксикарбонилэтиламинопиридина перемешивают в 80 мл N-этилдиизопропиламина в течение 3 ч при 90 С. Затем раствор упаривают,остаток хроматографируют на силикагеле, 51 элюируя при этом петролейным эфиром/уксусным эфиром в соотношении 8:2 и 7:3. Выход: 8,2 г (40% от теории).Rf-значение: 0,64 (силикагель; петролейный эфир/уксусный эфир в соотношении 8:2). б) 4-(2-трет-Бутилоксикарбонилэтил)-2(пиридиламинометил)-2-нитро-N-метиланилин. Получение аналогично примеру 1 б из 4-(2 трет-бутилоксикарбонилэтил)-2-(пиридиламинометил)-2-нитрохлорбензола и раствора метиламина. Выход: 20% от теории.Rf-значение: 0,65 (силикагель; метиленхлорид/этанол в соотношении 9:1). в) 4-(2-третбутилоксикарбонилэтил)-2-(пиридиламинометил)-2-амино-N-метиланилин. 1,6 г (4 ммоля) 4-(2-трет-Бутилоксикарбонилэтил)-2-(пиридиламинометил)-2 нитро-N-метиланилина растворяют в 200 мл метанола и после добавления 2 г никеля Ренея примешивают 1 мл гидразингидрата. Затем раствор перемешивают в течение 30 мин при комнатной температуре и упаривают. Остаток хроматографируют на силикагеле и элюируют метиленхлоридом/этанолом в соотношении 95:5. Выход: 1,2 г (82% от теории).Rf-значение: 0,33 (силикагель; метиленхлорид/этанол в соотношении 9:1). г) 2-(4-Цианофениламинометил)-1-метил 5-[N-(2-пиридил)-N-(2-этоксикарбонилэтил) аминометил]бензимидазол. Получение аналогично примеру 1 в из 4-(2 трет-бутилоксикарбонилэтил)-2-(пиридиламинометил)-2-амино-N-метиланилина, тетрафторобората O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, 4-цианофенилглицина в тетрагидрофуране и ледяной уксусной кислоты. Выход: 72% от теории.Rf-значение: 0,36 (силикагель; метиленхлорид/этанол в соотношении 9:1). д) Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[N-(2-пиридил)-N-(2-этоксикарбонилэтил)аминометил]бензимидазола. Получение аналогично примеру 1 ж из 4[(5-(2-трет-бутилоксикарбонилэтил)-2-пиридинаминометил-1-метилбензимидазол-2-ил)метиламино]бензонитрила и соляной кислоты/карбоната аммония в этаноле. Выход: 59% от теории.(2) Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-(N-метилфенилкарбониламинометил)бензимидазола. Выход: 42% от теории,C25H26N6OHCl (426,53/462,96),масс-спектр: (М+Н)+=427. Пример 10. Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[(2-метилбензимидазол-1-ил)метил]бензимидазола. а) 1-(4-Xлор-3-нитробензил)-2-метилбензимидазол. Получение аналогично примеру 9 а из 2 метилбензимидазола и 4-хлор-3-нитробензилхлорида в диметилсульфоксиде. Выход: 78% от теории. С 15 Н 12 СlN3 О 2 (301,7),масс-спектр: М+=301/303. б) 1-(4-Метиламино-3-нитробензил)-2 метилбензимидазол. Получение аналогично примеру 1 б из 1-(4 хлор-3-нитробензил)-2-метилбензимидазола и метиламина. Выход: 96% от теории.Rf-значение: 0,56 (силикагель; метиленхлорид/этанол в соотношении 19:1). в) 1-(4-Метиламино-3-аминобензил)-2 метилбензимидазол. Получение аналогично примеру 1 в из 1-(4 метиламино-3-нитробензил)-2-метилбензимидазола и водорода/никеля Ренея. Выход: 100% от теории.Rf-значение: 0,34 (силикагель; метиленхлорид/этанол в соотношении 19:1). г) 2-(4-Цианофениламинометил)-1-метил 5-[(2-метилбензимидазол-1-ил)метил]бензимидазол. Смесь из 1,94 г (11,0 ммолей) N-(4-цианофенил)глицина и 1,78 г (11,0 ммолей) карбонилдиимидазола нагревают с обратным холодильником в 80 мл абсолютного тетрагидрофурана в течение 15 мин. После добавления 2,7 г (10,46 ммоля) 1-(4-метиламино-3-аминобензил)-2 метилбензимидазола смесь нагревают с обратным холодильником еще в течение 16 ч. Затем раствор упаривают досуха, остаток смешивают с 80 мл ледяной уксусной кислоты и в течение 1 ч нагревают с обратным холодильником. После этого вновь упаривают досуха, полученный в результате остаток смешивают с 50 мл воды и подщелачивают концентрированным аммиаком(приблизительно рН 10). Выпавший при этом в осадок кристаллический продукт отфильтровывают вакуум-фильтрацией, промывают небольшим количеством воды и сушат. Выход: 4,1 г (96% от теории). 53 Получение аналогично примеру 1 ж из 2-(4 цианофениламинометил)-1-метил-5-[(2-метилбензимидазол-1-ил)метил]бензимидазола и соляной кислоты/карбоната аммония. Выход: 59% от теории. С 25 Н 25N7 НСl (423,5/459,9),масс-спектр: (М+Н)+=424,(М+2 Н)2+=217,7. Аналогично примеру 10 получают следующие соединения.(5,5 ммоля) трет-бутилового эфира 2,4 диброммасляной кислоты растворяют в 5 мл этанола, примешивают 0,2 г (1,86 ммоля) карбоната натрия и перемешивают в атмосфере азота в течение 30 ч при 55 С. После охлаждения отфильтровывают от белого осадка и промывают этанолом. Фильтрат упаривают и остаток хроматографируют на силикагеле, используя в качестве элюентов уксусный эфир и уксусный эфир/этанол/аммиак в соотношении 20:1:0,01. Требуемые фракции объединяют и упаривают. Выход: 0,44 г (44% от теории) в виде смеси диастереомеров.C31H38N6 О 3 (542,69),масс-спектр: (М+Н)+=543. 6) Гидрохлорид 2-(4-амидинофениламинометил)-1-метил-5-[1-(2-этоксикарбонилазетидин-1-ил)-1-(пирролидин-1-илкарбонил) этил]бензимидазола (смесь диастереомеров). Получение аналогично примеру 1 ж из 2-(4 цианофениламинометил)-1-метил-5-[1-(2-третбутилоксикарбонилазетидин-1-ил)-1-(пирролидин-1-илкарбонил)этил]бензимидазола и соляной кислоты/карбоната аммония в этаноле. Выход: 12% от теории.C29H37N7 О 3HCl (531,66/568,12),масс-спектр: (М+Н)+=532,(М+Н+НСl)2+=568/70 (Cl). Пример 12. Гидрохлорид (Е/Z)-2-(4 амидинофениламинометил)-1-метил-5-[1-[(пиридин-3-ил)-(этоксикарбонилметилиден)метилен]циклопропил]бензимидазола. а) (Е/Z)-2-(4-цианофениламинометил)-1 метил-5-[1-[(пиридин-3-ил)-(этоксикарбонилметилиден)метилен]циклопропил]бензимидазол. 897 мг (4,0 ммоля) триэтилового эфира фосфоноуксусной кислоты растворяют в атмосфере аргона в 30 мл тетрагидрофурана, после чего при -15 С добавляют 449 мг (4,0 ммоля) трет-бутилата калия. По истечении 30 мин порциями добавляют 815 мг (2 ммоля) 2-(4 цианофениламинометил)-1-метил-5-[1-(пиридин-3-илкарбонил)циклопропил]бензимидазола и в течение ночи перемешивают при комнатной температуре. После этого раствор в течение 6 ч нагревают с обратным холодильником и концентрируют. Остаток смешивают с раствором хлорида натрия и трижды экстрагируют уксусным эфиром. Объединенные органические фазы сушат над сульфатом натрия и концентрируют. Остаток растворяют в дихлорметане и хроматографируют на силикагеле, используя при этом в качестве элюента дихлорметан с 5% этанола. В завершение требуемые фракции концентриру 003947(Е/Z)-2-(4-амидинофениламинометил)-1-метил-5-[1-[(пиридин-3 ил)-(этоксикарбонилметилиден)метилен]циклопропил]бензимидазола. Получение аналогично примеру 1 ж из(E/Z)-2-(4-амидинофениламинометил)-1-метил-5-[1-[(пиридин-2-ил)(этоксикарбонилметилиден)метилен]циклопропил] бензимидазола. Выход: 72% от теории. С 29 Н 30N6O2 НСl (494,60/531,05),масс-спектр: (М+Н)+=495. Пример 13. Гидрохлорид 2-(4 амидинофениламинoмeтил)-1-метил-5-[1-(2 карбоксиазетидин-1-ил)-1-(пирролидин-1 илкарбонил)этил]бензимидазола (смесь диастеpеомеров). 200 мг (0,35 ммоля) гидрохлорида 2-(4 амидинофениламинометил)-1-метил-5-[1-(2 этоксикарбонилазетидин-1-ил)(пирролидин-1 илкарбонил)этил]бензимидазола растворяют в 30 мл 6 н. соляной кислоты и в течение 13 ч перемешивают при комнатной температуре. Затем реакционную смесь упаривают, добавляя при этом толуол, остаток растирают с ацетоном/простым эфиром, отфильтровывают вакуум-фильтрацией, промывают простым эфиром и сушат. Выход: 200 мг (100% от теории, с содержанием хлорида аммония),C27H33N7O3HCl (503,62/540,07),масс-спектр: (М+Н)+=504. Аналогично примеру 13 получают следующие соединения:Rf-значение: 0,55 (обращенная фаза RP 8; метанол/5%-ный раствор поваренной соли в соотношении 1:1).Rf-значение: 0,54 (обращенная фаза RP 8; метанол/5%-ный раствор поваренной соли в соотношении 1:1).C25H33N7O32HCl (479,59/552,59),масс-спектр: (М+Н)+=480. Пример 14. 2-[4-(N-гексилоксикарбониламидино)фениламинометил]-1-метил-5-[1-(2 этоксикарбонилэтиламино)-1-(диметиламинокарбонил)этил]бензимидазол. 1,5 г (2,8 ммоля) гидрохлорида 2-(4 амидинофениламинометил)-1-метил-5-[1-(2 этоксикарбонилэтиламино)-1-(диметиламинокарбонил)этил]бензимидазола растворяют в 14 мл воды и 55 мл тетрагидрофурана, к раствору примешивают 2,0 г карбоната калия и 1,0 мл (6 ммолей) гексилового эфира хлормуравьиной кислоты и в течение 4 ч перемешивают при комнатной температуре. После удаления под вакуумом растворителя остаток смешивают с раствором поваренной соли и трижды экстрагируют метиленхлоридом, объединенные органические фазы промывают небольшим количеством воды, сушат над сульфатом магния и упаривают. Сырой продукт очищают на силикагеле,используя при этом в качестве элюентов метиленхлорид и 2-7,5% этанола. Однородные фракции объединяют, упаривают, растворяют в небольшом количестве уксусного эфира и смешивают с петролейным эфиром. Образовавшийся твердый продукт отфильтровывают вакуум 003947 58 фильтрацией, промывают петролейным эфиром и сушат. Выход: 0,8 г (43% от теории).-78 С по каплям добавляют 35 мл 1,6-молярного раствора н-бутиллития в гексане (61 ммоль). Затем при той же температуре -78 С по каплям добавляют раствор из 10,0 г (50 ммолей) метилового эфира 2-(4-хлорфенил)пропионовой кислоты в 30 мл тетрагидрофурана. После этого через реакционную смесь при -20 С пропускают в течение 30 мин газообразный формальдегид. После добавления 5%-ной лимонной кислоты и ледяной уксусной кислоты экстрагируют уксусным эфиром. Органические фазы промывают 1 н. серной кислотой, водой, насыщенным раствором бикарбоната натрия и раствором поваренной соли и сушат над сульфатом магния. Сырой продукт очищают на силикагеле, используя при этом в качестве элюента циклогексан/уксусный эфир в соотношении 19:1, 9:1,4:1,1:1 и 0:1. Однородные фракции объединяют и упаривают. Выход: 9,7 г (84% от теории) желтого масла.Rf-значение: 0,25 (силикагель; петролейный эфир/уксусный эфир в соотношении 4:1). б) 2-(4-Xлорфенил)-3-гидрокси-2-метилпропионовая кислота. Получение аналогично примеру 4 из метилового эфира 2-(4-хлорфенил)-3-гидрокси-2 метилпропионовой кислоты и едкого натра в этаноле. Выход: 83% от теории.Rf- значение: 0,55 (силикагель; уксусный эфир/циклогексан в соотношении 2:1+ледяная уксусная кислота). в) 2-(4-Хлор-3-нитрофенил)-2-метил-3 нитрооксипропионовая кислота. Получение аналогично примеру 1 а из 2-(4 хлорфенил)-3-гидрокси-2-метилпропионовой кислоты и азотной кислоты. Выход: 90% от теории.tпл. 129-132 С,С 10 Н 9 СlN2O7 (304,64). г) 2-(4-Xлоp-3-нитрофенил)-2-метил-3 гидроксипропионовая кислота. Получение аналогично примеру 6 из 2-(4 хлор-3-нитрофенил)-3-нитроокси-2 59 метилпропионовой кислоты и 6 н. соляной кислоты в диоксане. Выход: 98% от теории.C10H10ClNO5 (259,65),масс-спектр: (М-Н)-=258/60 (Cl),(2 М-Н)-=517,9 (Сl2). д) 2- [4-(N-бензилметиламино)-3-нитрофенил]-2-метил-3-гидроксилропионовая кислота. Получение аналогично примеру 1 б из 2-(4 хлор-3-нитрофенил)-3-гидрокси-2-метилпропионовой кислоты и N-метилбензиламина. Выход: 81% от теории,С 18 Н 20ClN2 О 5 (344,37),масс-спектр: М+=344. е) 2-[4-(N-бензилметиламино)-3-нитрофенил]-2-метил-3-гидрокси-1-пирролидин-1-илпропан-1-он. Получение аналогично примеру 1 в из 2-[4(N-бензилметиламино)-3-нитрофенил]-3-гидрокси-2-метилпропионовой кислоты иC22H27N3O4 (397,48),масс-спектр: М+=398,(M+Na)+=420. ж) 2-[4-(N-бензилметиламино)-3-нитрофенил]-2-метил-3-метансульфонилокси-1-пирролидин-1-илпропан-1-он. Раствор из 1,2 г (3,0 ммоля) 2-[4-(Nбензилметиламино)-3-нитрофенил]-2-метил-3 гидрокси-1-пирролидин-1-илпропан-1-она в 20 мл тетрагидрофурана смешивают при комнатной температуре с 1,3 мл (9,3 ммолей) триэтиламина. Затем при 2-5 С по каплям добавляют 0,27 мл (3,5 ммоля) метансульфонилхлорида. По истечении 2 ч выдерживания при комнатной температуре образовавшийся осадок отфильтровывают вакуум-фильтрацией и фильтрат упаривают. Сырой продукт используют без очистки в последующей реакции. Выход: 1,4 г (98% от теории). з) 2-[4-(N-бензилметиламино)-3-нитрофенил]-2-метил-3-метиламино-1-пирролидин-1 илпропан-1-он. К раствору из 1,4 г (2,9 ммоля) 2-[4-(Nбензилметиламино)-3-нитрофенил]-2-метил-3 метансульфонилокси-1-пирролидин-1-илпропан-1-она в 10 мл диметилформамида примешивают 20 мл 40%-ного водного раствора метиламина и в течение 70 мин нагревают до 100 С. После охлаждения реакционную смесь смешивают с ледяной водой и экстрагируют уксусным эфиром. Органические фазы промывают водой и раствором поваренной соли, сушат над сульфатом магния и упаривают. Сырой продукт очищают на силикагеле, используя при этом в качестве элюента уксусный эфир/этанол в соотношении 10:1, 9:1, 4:1 плюс 1% концентрированного аммиака. Однородные фракции объединяют и упаривают. Выход: 740 мг (61% от теории).Rf-значение: 0,45 (силикагель; метиленхлорид/этанол в соотношении 9:1 плюс 1% концентрированного аммиака). и) 2-[4-(Бензилметиламино)-3-нитрофенил]-2-метил-3-(N-метоксикарбонилметилкарбонилметиламино)-1-пирролидин-1-илпропан-1 он. Получение аналогично примеру 7 г из 2-[4(N-бензилметиламино)-3-нитрофенил]-2-метил 3-метиламино-1-пирролидин-1-илпропан-1-она и хлорангидрида метилового эфира малоновой кислоты. Выход: 84% от теории.C27H34N4O6 (510,60),масс-спектр: (М-Н)-=509,(M+Na)+=533. к) 2-(4-Метиламино-3-аминофенил)-2 метил-3-(N-метоксикарбонилметилкарбонилметиламино)-1-пирролидин-1-илпропан-1-он. Получение аналогично примеру 1 г из 2- [4(бензилметиламино)-3-нитрофенил]-2-метил-3(N-метоксикарбонилметилкарбонилметиламино)-1-пирролидин-1-илпропан-1-она и водорода/ палладия на активированном угле. Выход: 100% от теории.Rf-значение: 0,40 (силикагель; уксусный эфир/этанол в соотношении 9:1+1% концентрированного аммиака). С 20 Н 30N4O4 (390,49),масс-спектр: М+=390. л) 4-[2-(3-(N-метоксикарбонилметилкарбонилметиламино-2-метил-1-пирролидин-1 илпропан-1-он-2-ил]-2-(4-цианофенил)аминометилкарбониламино-N-метиланилин. Получение аналогично примеру 1 д из 2-(4 метиламино-3-аминофенил)-2-метил-3-(N-метоксикарбонилметилкарбонилметиламино)-1 пирролидин-1-илпропан-1-она и тетрафторобората O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, 4-цианофенилглицина и триэтиламина в диметилформамиде. Выход: 95% от теории.Rf-значение: 0,35 (силикагель; уксусный эфир/этанол в соотношении 9:1 плюс 1% концентрированного аммиака). м) 2-(4-Цианофениламинометил)-1-метил 5-[1-(N-этоксикарбонилметилкарбонилметиламино)-2-(пирролидинокарбонил)проп-2-ил] бензимидазол. Получение аналогично примеру 1 е из 4-[2(3-(N-метоксикарбонилметилкарбонилметиламино-2-метил-1-пирролидин-1-илпропан-1 он-2-ил]-2-(4-циaнoфeнил)aминoмeтилкapбoнилaминo-N-мeтилaнилинa в ледяной уксусной кислоте. Выход: 47% от теории.
МПК / Метки
МПК: A61K 31/415, C07D 235/14
Метки: лекарственных, качестве, применение, средств, получение, бензимидазолы
Код ссылки
<a href="https://eas.patents.su/30-3947-benzimidazoly-ih-poluchenie-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Бензимидазолы, их получение и их применение в качестве лекарственных средств</a>
Предыдущий патент: Бицикло [2.2.1] гептаны и родственные соединения
Следующий патент: Способ получения производных бифенил-2-карбоновой кислоты
Случайный патент: Композиции и способы для дифференциальной регуляции ненасыщенности жирных кислот в мембранных липидах и масле семян












