6-замещенные пиримидины, ингибирующие вич
Номер патента: 20772
Опубликовано: 30.01.2015
Формула / Реферат
1. Соединение формулы
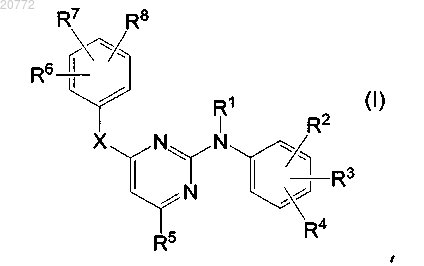
его фармацевтически приемлемая аддитивная соль, фармацевтически приемлемый сольват или стереохимически изомерная форма, где
R1 представляет собой водород;
R2 и R3 независимо представляют собой водород;
R6 и R7 независимо представляют собой C1-6алкил;
R4 представляет собой циано;
R8 представляет собой C2-6алкенил, замещенный циано;
R5 представляет собой пиридил, -C(=O)NR5aR5b; -CH(OR5c)R5d; -CH2-NR5eR5f; -CH=NOR5a; -CH2-O-C2-6алкенил; -CH2-O-P(=O) (OR5g)2; -CH2-O-C(=O)-NH2; -C(=O)-R5d;
каждый R5a независимо представляет собой водород или C1-6алкил;
R5b представляет собой C1-6алкилокси или C1-6алкил, замещенный гидрокси, C1-6алкилокси, галогеном, циано, Het;
R5c представляет собой водород, C1-6алкил, Het;
каждый R5d независимо представляет собой арил или Het;
R5e представляет собой водород или C1-6алкил;
R5f представляет собой C1-6алкилокси; C2-6алкенил или C1-6алкил, замещенный радикалом, выбранным из гидрокси, C1-6алкилокси, циано, амино, моно- и ди-C1-6алкиламино, C1-6алкилкарбониламино, арила, Het, диоксоланила, тетрагидрофуранила, пирролидинила, пиперидинила, морфолинила, пиперазинила и C3-7циклоалкила; где указанный диоксоланил может быть необязательно замещен одним или двумя C1-6алкильными радикалами; и,
где указанный пиперазинил может быть необязательно замещен C1-6алкилом, C1-6алкилкарбонилом или C1-6алкилоксикарбонилом;
R5e и R5f, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидинил; имидазолил; пиперидинил; морфолинил; пиперазинил; или пиперазинил, необязательно замещенный C1-6алкилом, C1-6алкилоксикарбонилом или C1-6алкилкарбонилом;
каждый R5g независимо представляет собой C1-6алкил;
X представляет собой -NR1-;
каждый Het независимо представляет собой пиридил, тиенил, фуранил, тиазолил; где каждый необязательно может быть замещен одним или двумя заместителями, каждый независимо выбранный из C1-6алкила, галогена, гидрокси, циано, C1-6алкилокси, C2-6алкенила, замещенного галогеном, гидрокси или циано;
каждый арил независимо представляет собой фенил или фенил, замещенный C1-6алкилокси или аминосульфонилом.
2. Соединение по п.1, где соединение формулы (I) представлено формулой
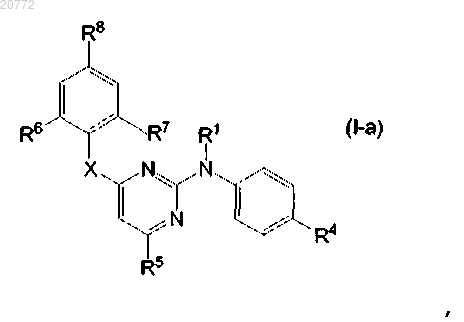
где R1, R4, R5, R6, R7 и R8 имеют значения, определенные в п.1.
3. Соединение по п.1, где R8 представляет собой радикал -CH=CH-CN.
4. Соединение по любому из пп.1-3, где
R5 представляет собой пиридил; или
R5 представляет собой -C(=O)NR5aR5b; где R5a независимо представляет собой водород или C1-6алкил;
R5b представляет собой C1-6алкилокси или C1-6алкил, замещенный C1-6алкилокси, галогеном, циано, пиридилом, фуранилом;
-CH(OR5c)R5d; где R5c представляет собой водород и R5d представляет собой арил;
-CH2-NR5eR5f;
R5e представляет собой водород или C1-6алкил;
R5f представляет собой C1-6алкилокси; C2-6алкенил или C1-6алкил, замещенный гидрокси, C1-6алкилокси, циано, амино, моно- или ди-C1-6алкиламино, C1-6алкилкарбониламино, арилом, пиридилом, тиенилом, фуранилом, диоксоланилом, необязательно замещенным двумя C1-6алкильными радикалами, тетрагидрофуранилом, морфолинилом, C3-7циклоалкилом; или
R5e и R5f, взятые вместе с атомом азота, к которому они присоединены, образуют имидазолил; морфолинил; пиперазинил или пиперазинил, необязательно замещенный C1-6алкилом;
-CH=NOR5a; где R5a представляет собой C1-6алкил;
-CH2-O-C2-6алкенил;
-CH2-O-P(=О)(OR5g)2; каждый R5g представляет собой C1-6алкил;
-CH2-O-C(=O)-NH2;
-C(=O)-R5d; где R5d представляет собой тиазолил.
5. Соединение по любому из пп.1-4, где каждый арил независимо представляет собой фенил или фенил, замещенный C1-6алкилокси.
6. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения формулы (I) по любому из пп.1-5, и фармацевтически премлемый носитель или разбавитель, и обладающая свойствами ингибирования репликации ВИЧ (вируса иммунодефицита человека).
Текст
Ингибиторы репликации ВИЧ формулы (I). R1 представляет собой водород; R2 и R3 представляют собой водород; R6 и R7 независимо представляют собой C1-6 алкил; R4 представляет собой циано; R8 представляет собой C2-6 алкенил, замещенный циано; R5 представляет собой пиридил, C(=O)NR5aR5b; -CH(OR5c)R5d; -CH2-NR5eR5f; -CH=NOR5a; -CH2-O-C2-6 алкенил; -CH2-O-Р(=О)(OR5g)2;-CH2-O-C(=O)-NH2; -C(=O)-R5d; X представляет собой -NR1-; фармацевтические композиции,содержащие эти соединения в качестве активного компонента, и способы получения указанных соединений и композиций. Гийемон Жером Эмиль Жорж, Мордан Селин Изабелль (FR) Медведев В.Н. (RU) Изобретение относится к производным пиримидина, обладающим ингибирующими репликацию ВИЧ (вирус иммунодефицита человека) свойствами, их получению и фармацевтическим композициям,включающим эти соединения. Изначально, лечение ВИЧ инфекции заключалось в монотерапии с помощью нуклеозидных производных и, несмотря на успешное подавление репликации вируса, эти лекарственные средства быстро теряли свою эффективность из-за появления стойких к лекарственному средству штаммов. Стало ясно,что высокая частота мутаций, объединенная с быстрой репликацией, сделала ВИЧ особенно затруднительной целью для антивирусной терапии. Введение комбинированной терапии двух или более антиВИЧ агентов улучшило терапевтический результат. Существенные успехи были сделаны введениемHAART (высокоактивная антиретровирусная терапия), которая привела к сильному и длительному подавлению вируса. HAART, обычно, включает комбинации нуклеозидных или нуклеотидных ингибиторов обратной транскриптазы (NRTIs или NtRTIs, соответственно) с ненуклеозидным ингибитором обратной транскриптазы (NNRTI) или ингибитором протеазы (PI). Текущие рекомендации для антиретровирусной терапии рекомендуют такой тройной режим комбинированной терапии даже для первичного лечения. Эти мультилекарственные терапии, однако, не полностью устраняют ВИЧ, и длительное лечение обычно приводит к мультилекарственной резистентности. Также было показано, что устойчивый вирус переносится на недавно инфицированных индивидуумов, приводя к строго ограниченным вариантам терапии для этих не подвергавшимся действию лекарственного средства пациентам. Следовательно, существует продолжающаяся потребность в новой комбинации активных компонентов, которые являются эффективными в отношении ВИЧ. Новые типы анти-ВИЧ эффективных активных компонентов, различающиеся по химической структуре и профилю активности, являются полезными в новых типах комбинированной терапии. Обнаружение таких активных компонентов, следовательно, является весьма желаемой целью для достижения. Настоящее изобретение нацелено на обеспечение особого нового ряда производных пиримидина,обладающих ингибирующими репликацию ВИЧ свойствами. В WO 99/50250, WO 00/27825, WO 01/85700 и WO 06/035067 раскрыты определенные классы замещенных аминопиримидинов, обладающих ингибирующими репликацию ВИЧ свойствами. Соединения по настоящему изобретению отличаются от соединений из уровня техники по структуре, фармакологической активности и/или фармакологической эффективности. Было обнаружено, что введение определенных заместителей в 6-положение пиримидиновой группы приводит к соединениям,не только действующим благоприятно, исходя из своей способности ингибировать репликацию вируса иммунодефицита человека (ВИЧ), но также благодаря своей улучшенной способности ингибировать репликацию мутантных штаммов, в особенности, штаммов, которые показывают устойчивость к известным лекарственным средствам NNRTI, причем эти штаммы называются штаммами ВИЧ, устойчивыми к лекарственному средству или мультилекарственному средству. Таким образом, в одном аспекте, настоящее изобретение относится к соединениям формулы его фармацевтически приемлемым аддитивным солям, фармацевтически приемлемым сольватам, и стереохимически изомерным формам, гдеR6 и R7 независимо представляют собой C1-6 алкил;R5 представляет собой пиридил, -C(=O)NR5aR5b; -CH(OR5c)R5d; -CH2-NR5eR5f; -CH=NOR5a; -CH2-OC2-6 алкенил; -CH2-O-P(=О) (OR5g)2; -CH2-O-C(=O)-NH2; -C(=O)-R5d; каждый R5a независимо представляет собой водород или C1-6 алкил;R5c представляет собой водород, C1-6 алкил, Het; каждый R5d независимо представляет собой арил или Het;R5e представляет собой водород или C1-6 алкил;R5f представляет собой C1-6 алкилокси; C2-6 алкенил; или C1-6 алкил, замещенный радикалом, выбранным из гидрокси, C1-6 алкилокси, циано, амино, моно- и ди-C1-6 алкиламино, C1-6 алкилкарбониламино,арила, Het, диоксоланила, тетрагидрофуранила, пирролидинила, пиперидинила, морфолинила, пиперазинила и C3-7 циклоалкила, где указанный диоксоланил может быть необязательно замещен одним или двумя C1-6 алкильными радикалами; и, где указанный пиперазинил может быть необязательно замещенC1-6 алкилом, C1-6 алкилоксикарбонилом или C1-6 алкилкарбонилом; каждый R5g независимо представляет собой C1-6 алкил;X представляет собой -NR1-; каждый Het независимо представляет собой пиридил, тиенил, фуранил, тиазолил; где каждый необязательно может быть замещен одним или двумя заместителями, каждый независимо выбранный изC1-6 алкила, галогена, гидрокси, циано, C1-6 алкилокси, C2-6 алкенила замещенного галогеном, гидрокси или циано; каждый арил независимо представляет собой фенил или фенил, замещенный C1-6 алкилокси или аминосульфонилом. Используемый до этого и далее C1-4 алкил в качестве группы или части группы определяет радикалы насыщенных углеводородов с прямой или разветвленной цепью, содержащих от 1 до 4 атомов углерода,таких как метил, этил, 1-пропил, 2-пропил, 1 -бутил, 2-бутил, 2-метилпропил, третбутил; C1-6 алкил в качестве группы или части группы определяет радикалы насыщенных углеводородов с прямой или разветвленной цепью, содержащих от 1 до 6 атомов углерода, таких как группы, определенные для C1-4 алкила и 1-пентила, 2-пентила, 1-гексила, 2-гексила, 3-гексила, 2-метилбутила, 3-метилпентила и подобные;C1-2 алкил определяет метил или этил; C3-7 циклоалкил является общим с циклопропилом, циклобутилом,циклопентилом, циклогексилом и циклогептилом. Предпочтительными среди C1-6 алкила являются C1-4 алкил или C1-2 алкил. Предпочтительными среди C3-7 циклоалкила являются циклопентил или циклогексил. Термин "C2-6 алкенил" в качестве группы или части группы определяет радикалы углеводородов с прямой или разветвленной цепью, имеющих насыщенные углерод-углеродные связи и, по меньшей мере,одну двойную связь, и содержащих от 2 до 6 атомов углерода, таких как, например, этенил (или винил),1-пропенил, 2-пропенил (или аллил), 1-бутенил, 2-бутенил, 3-бутенил, 2-метил- 2-пропенил, 1-пентенил,2-пентенил, 3-пентенил, 2 метил- 1-бутенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 2-метил-2 пентенил, 1,2-диметил- 1-бутенил и подобные. Предпочтительными являются C2-6 алкенилы, имеющие одну двойную связь. Среди C2-6 алкенильных радикалов представляют интерес C2-4 алкенильные радикалы. Термин "C3-6 алкенил" является таким же, как и C2-6 алкенил, но ограничен до ненасыщенных углеводородных радикалов, содержащих от 3 до 6 атомов углерода. В примерах, где C3-6 алкенил связан с гетероатомом, атом углерода, связанный с гетероатомом по предпочтению является насыщенным. Термин "C2-6 алкинил" в качестве группы или части группы определяет радикалы углеводородов с прямой или разветвленной цепью, имеющих насыщенные углерод-углеродные связи и, по меньшей мере,одну тройную связь, и содержащих от 2 до 6 атомов углерода, таких как, например, этинил, 1-пропинил,2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 2-метил-2-пропинил, 2-пентинил, 3-пентинил, 2-гексинил,3-гексинил, 4-гексинил, 2-метил-2-бутинил, 2-метил-2-пентинил и подобные. Предпочтительными являются C2-6 алкинилы, содержащие одну тройную связь. Среди C26 алкинильных радикалов интерес представляют С 2-4 алкинильные радикалы. Термин "C3-6 алкинил" является таким же, как и C2-6 алкинил, но ограничен до ненасыщенных углеводородных радикалов, содержащих от 3 до 6 атомов углерода. В примерах, где C3-6 алкинил связан с гетероатомом, атом углерода, связанный с гетероатомом по предпочтению является насыщенным. Используемый в настоящем описании ранее, термин (=O) относится к карбонильной группе, когда присоединен к атому углерода, сульфоксидной группе, когда присоединен к атому серы, и сульфонильную группу, когда два из указанных терминов присоединены к атому серы. Термины карбоксил, карбокси или гидроксикарбонил относятся к группе -COOH. Термин "галоген" является общим с фтором, хлором, бромом или иодом. Термин "полигалогенС 1-6 алкил" в качестве группы или части группы, например, в полигалогенС 1-6 алкокси, определен, как моно- или полигалоген замещенный C1-6 алкил, в особенности C1-6 алкил, замещенный вплоть до одним, двумя, тремя, четырьмя, пятью, шестью или более атомами галогена, такой как метил или этил с одним или более атомами фтора, например, дифторметил, трифторметил, трифторэтил. Предпочтительным является трифторметил. Также включены перфторС 1-6 алкильные группы, которые представляют собой C1-6 алкильные группы, где все водородные атомы заменены на атомы фтора, например, пентафторэтил. В случае, когда более чем один атом галогена присоединен к алкильной группе в пределах определения полигалогенС 1-6 алкила, атомы галогена могут быть одинаковыми или разными. Любые гетероциклы, упомянутые в определениях Het, могут включать любой изомер, такой как,например, для группы тиадиазола, которая может быть 1,2,4-тиадиазолом, 1,3,4-тиадиазолом. Группа Het может быть тиазолилом, который, предпочтительно, представляют собой 1,3-тиазолил. В одном варианте осуществления каждый Het независимо представляет собой пиридил, тиенил, фуранил, или тиазолил. Во всех случаях, когда радикал появляется в определении соединения формулы (I) или в любой из подгрупп, определенных в настоящем описании, указанный радикал независимо является таким же, как он определен выше в определении соединений формул (I) или в более ограниченных определениях как определено в настоящем описании далее. Следует также отметить, что положения радикала на любой группе молекулы, использованной в определениях, могут быть, где угодно на такой группе при условии, что она химически стабильна. Например, пиридин включает 2-пиридин, 3-пиридин и 4-пиридин; пентил включает 1-пентил, 2-пентил и 3 пентил. Когда любая переменная (например, галоген, C1-6 алкил, арил, Het и т.д.) появляется более, чем один раз в любой группе, каждое определение является независимым. Любые ограниченные определения радикалов, определенные в настоящем описании, подразумеваются подходящими для группы соединения формулы (I) так же, как и для любой подгруппы, определенной или упомянутой в настоящем описании. Линии, нарисованные от заместителей в кольцевые системы, указывают, что связь может быть присоединена к любым подходящим кольцевым атомам. Фармацевтически приемлемые формы аддитивной соли, которые соединения по настоящему изобретению способны образовывать, могут удобным образом быть получены, используя соответсвующие кислоты, такие как, например, неорганические кислоты, такие как галогеноводородные кислоты, например, хлористо-водородная или бромисто-водородная кислота, серная, гемисерная, азотная, фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, аспарагиновая, додецилсерная, гептановая, гексановая, никотиновая, пропановая, кидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, памино-салициловая, памовая и подобные кислоты. И наоборот, указанные формы кислотно-аддитивной соли могут быть превращены в форму свободного основания с помощью обрабтки соответсвующим основанием. Соединения формулы (I), содержащие протоны кислоты, могут быть превращены в их фармацевтически приемлемые металлические или аминные формы аддитивной соли с помощью обрабтки соответсвующими органическими и неорганическими основаниями. Соответствующие формы основной соли включают, например, соли аммония, соли щелочного и щелочно-земельного металла, например, соли лития, натрия, калия, магния, кальция и подобные, соли с органическими основаниями, например, соли первичных, вторичных и третичных алифатических и ароматических аминов, такие как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин, N-метилD-глюкамин, 2-амино-2-(гидроксиметил), 3-пропандиол, гидрабамин, и соли с аминокислотами, такие как, например, аргинин, лизин и подобные. И наоборот, солевая форма может быть превращена с помощью обработки кислотой в форму свободной кислоты. Термин "фармацевтически приемлемый сольват" означает, что он включает гидраты и аддитивные формы растворителя, которые соединения формулы (I), включая его стереоизомерные формы, может образовывать. Примерами таких сольватов являются, например, гидраты, алкоголяты, такие как метаноляты, этаноляты, изопропаноляты, н-пропаноляты и подобные. Соединения формулы (I) могут содержать один или более хиральных центров и могут существовать в виде стереохимически изомерных форм. Особый интерес представляют те соединения формулы (I),которые являются стереохимически чистыми. Термин "стереохимически изомерные формы", используемый в настоящем описании, определяет все возможные стереоизомерные формы, которыми соединения формулы (I) и их аддитивные соли могут обладать. Если ранее не упоминалось или не указывалось, химическое название соединения обозначает смесь всех возможных стереохимически изомерных форм,причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры так же, как и каждую из индивидуальных изомерных форм формулы (I), фармацевтически приемлемые соли или фармацевтически приемлемые сольваты, по существу, свободные, т.е. связанные с менее чем 10%, предпочтительно менее чем 5%, в особенности менее чем 2% и наиболее предпочтительно менее чем 1% другого изомера. Таким образом, когда соединение формулы (I) определено, например, как (Е),это означает, что соединение представляет собой по существу свободно от (Z) изомера, в особенности,стереогенные центры могут иметь R- или S-конфигурацию; заместители на бивалентных циклических(частично) насыщенных радикалах могут иметь или цис- или трансконфигурацию. Соединения, имеющие двойные связи, могут иметь Е (entgegen) или Z (zusammen)-стереохимию при указанной двойной связи. Термины цис, транс, R, S, Е и Z хорошо известны специалисту в данной области техники. Некоторые соединения формулы (I) могут также существовать в своей таутомерной форме. Такие формы, несмотря на то что явно не указаны в формуле выше, подразумеваются включенными в объем настоящего изобретения. Также подразумевается, что настоящее изобретение включает любые изотопы атомов, присутствующих в соединениях по настоящему изобретению. Например, изотопы водорода включают тритий и дейтерий и изотопы углерода включают С-13 и С-14. Во всех случаях, когда используются в настоящем описании выше или в настоящем описании далее, термины "соединения формулы (I)", "настоящие соединения", "соединения по настоящему изобретению" или любые эквивалентные термины, и подобное, термины "подгруппы соединений формулы (I)","подгруппы настоящих соединений", "подгруппы соединений по настоящему изобретению" или любые эквивалентные термины, означает то, что они включают соединения общей формулы (I) или подгруппы соединений общей формулы (I), так же, как и их соли, сольваты и стереизомеры. Во всех случаях, когда сделано упоминание в настоящем описании ранее или в настоящем описании далее о том, что заместители могут быть выбраны каждый независимо из перечня определений, таких как, например, для R1 и R5d, причем подразумеваются включенными любые возможные комбинации,которые являются химически возможными или которые приводят к молекулам такой химической стабильности, которую они могут проявлять в стандартных фармацевтических методиках. Один вариант осуществления настоящего изобретения относится к соединениям формулы их фармацевтически приемлемым аддитивным солям или стереохимически изомерным формам, гдеX, R1, R4, R5, R6, R7, и R8 такие, как определено выше или в настоящем описании далее. В одном варианте осуществления, R8 в соединениях формулы (I) или (I-а) представляет собой C2-6 алкенил, замещенный циано. В другом варианте осуществления, R8 в соединениях формулы (I) или (I-а) представляет собой С 2 алкенил, замещенный циано; где циано, в особенности, замещен по атому углерода, который не связан с фенильной группой. В последнем случае, R8 может быть представлен радикалом-A-CN, где А представляет собой -CH=CH-. Конкретные подгруппы соединений формулы (I) или (I-а) или любая подгруппа соединения формулы (I) или (I-а) определены в настоящем описании, где R8 представляет собой -CH=CH-CN. Особый интерес представляют собой те соединения формулы (I), как определено в настоящем описании, или любые их подгруппы, где R8 представляет собой -CH=CH-, замещенный любыми заместителями C2-6 алкенила, определенные выше в отношении определения R8, или где R8 в особенности представляет собой -CH=CH-CN и где заместители на группе -CH=CH- находятся в Е-конфигурации (т.е. так называемые Е'-изомеры). Особый интерес представляют те соединения формулы (I), как определено в настоящем описании, или любые их подгруппы, где R8 представляет собой (Е) -CH=CH-CN. Вариантами осуществления настоящего изобретения являются те соединения формулы (I) или любые подгруппы соединения формулы (I), где R1 представляет собой водород. Дополнительными вариантами осуществления настоящего изобретения являются те соединения формулы (I) или любые подгруппы соединения формулы (I), гдеR6 и R7 независимо представляют собой C1-6 алкил. Вариантами осуществления настоящего изобретения являются те соединения формулы (I) или любые подгруппы соединения формулы (I), где(a) R4 представляет собой циано; R8 представляет собой С 2-6 алкенил, замещенный циано. Вариантами осуществления настоящего изобретения являются те соединения формулы (I) или любые подгруппы соединения формулы (I), гдеR5 представляет собой пиридил; или R5 представляет собой -CONR5aR5b; где R5a независимо представляет собой водород или C1-6 алкил;-CH(OR5c)R5d; где R5c представляет собой водород, и R5d представляет собой арил; -CH2-NR5eR5f; R5e представляет собой водород или C1-6 алкил; гдеR5f представляет собой C1-6 алкилокси; C2-6 алкенил; или C1-6 алкил, замещенный гидрокси, C1-6 алкилокси, циано, амино, моно-или ди-C1-6 алкиламино, C1-6 алкилкарбонил- амино, арилом, пиридилом, тиенилом, фуранилом, тетрагидрофуранилом, морфолинилом, C3-7 циклоалкилом или диоксоланилом, необязательно замещенный двумя C1-6 алкильными радикалами; или-CH2-O-P(=O)(OR5g)2; где каждый R5g независимо представляет собой C1-6 алкил;-C(=O)-R5d; где R5d представляет собой пиридил, тиенил, фуранил, тиазолил; или где R5d представляет собой тиазолил. Вариантами осуществления настоящего изобретения являются те соединения формулы (I) или любые подгруппы соединения формулы (I), где(a) каждый Het независимо представляет собой пиридил, тиенил, фуранил, тиазолил; где каждый необязательно может быть замещен одним или двумя заместителями, каждый независимо выбранный из(b) каждый Het независимо представляет собой пиридил, тиенил, фуранил, тиазолил; где каждый необязательно может быть замещен C1-6 алкилом, галогеном; или(c) каждый Het независимо представляет собой пиридил, тиенил, фуранил, тиазолил; или(d) каждый Het независимо представляет собой пиридил, тиенил, фуранил. Вариантами осуществления настоящего изобретения являются те соединения формулы (I) или любые подгруппы соединения формулы (I), где каждый арил независимо представляет собой фенил или фенил, замещенный C1-6 алкилокси и аминосульфонилом. Конкретными подгруппами соединений формулы (I) или (I-а) явялются те, где одно, несколько или все следующие ограничения применимы:R5 представляет собой пиридил; или R5 представляет собой -CONR5aR5b; где R5a независимо представляет собой водород или C1-6 алкил;-CH2-NR5eR5f; R5e представляет собой водород или C1-6 алкил;R5f представляет собой C1-6 алкилокси; C2-6 алкенил; или C1-6 алкил, замещенный гидрокси, C1-6 алкилокси, циано, амино, моно- или ди-C1-6 алкиламино, C1-6 алкил- карбониламино, арилом, пиридилом, тиенилом, фуранилом, диоксоланилом, необязательно замещенный двумя C1-6 алкильными радикалами, тетрагидрофуранилом, морфолинилом, C3-7 циклоалкилом; или-CH2-O-Р(=O)(OR5g)2; каждый R5g независимо представляет собой C1-6 алкил;-C(=O)-R5d; где R5d тиазолил; каждый арил независимо представляет собой фенил или фенил, замещенный C1-6 алкилоксиаминосульфонилом. Соединения формулы (I) могут быть получены с помощью взаимодействия промежуточного соединения формулы (II), где W представляет подходящую уходящую группу, такую как, например, галоген,например, хлор, бром или тозил, мезил или похожую группу, с промежуточным соединением формулы Реакцию (II) с (III) обычно проводят в присутствии подходящего растворителя. Подходящими растворителями являются, например, спирт, такой как, например, этанол, 2-пропанол; диполярный апротонный растворитель, такой как ацетонитрил, N,N-диметилформамид, N,N-диметил-ацетамид, 1-метил-2 пирролидинон; простой эфир, такой как тетрагидрофуран, 1,4-диоксан, пропиленгликоль монометиловый эфир. Реакцию можно проводить при кислотных условиях, полученных путем добавления количеств подходящей кислоты, такой как, например, камфорсульфоновая кислота, или используя кислотные растворители, например, хлористоводородная кислота, растворенная в алканоле, таком как 1- или 2 пропаноле. Соединения формулы (I) могут также быть получены путем формирования X мостика с помощью взаимодействия или (IV-a) с (V-a) или (IV-b) с (V-b), как описано в следующей схеме. В этой реакционной схеме W представляет соответствующую уходящую группу, которая, в особенности, является такой, как определено выше. Уходящая группа W в (V-a) может также быть введена insitu, например, путем превращения соответствующей гидрокси функции в уходящую группу, например,при помощи POCl3. X1 представляет собой -NR1-. Где X1 представляет собой NR1, реакции выше предпочтительно проводят в присутствии третичного аминного основания, например, триэтиламина. В этой реакционной схеме W представляет соответствующую уходящую группу, которая, в особенности, является такой, как определено выше. Уходящая группа W в (V-a) может также быть введена in situ, например, путем превращения соответствующей гидрокси функции в уходящую группу, например, при помощи POCl3. Где X представляет собой NR1, реакции выше предпочтительно проводят в присутствии основания, например, триэтиламина. Соединения формулы (I), где R5 представляет собой пиридил, причем указанные соединения представлены формулой (I-а), могут быть получены с помощью реакции Сузуки, т.е. с помощью взаимодействия 6-галогенпиримидинового производного (VI) с пиридилборной кислотой Het-B(OH)2 или сложным эфиром борной кислоты (в особенности, алкилсложным эфиром, таким как сложный метиловый или этиловый эфир) в присутствии палладиевого катализатора, в особенности, Pd(PPh3)4.W1 представляет собой галоген (I, Br или Cl) или псевдогалогеновую группу (трифлат). Соединения формулы (I), где R5 представляет собой группу -CONR5aR5b, причем указанные соединения представлены формулой (I-b), могут быть получены путем взаимодействия карбоновой кислоты или ее активной формы (VII) с амином (VIII), в реакции образования амидной связи. Реакция образования амидной связи может быть проведена путем взаимодействия исходных веществ в присутствии сшивающего агента или путем превращения карбоксильной функции в (VII) в активную форму, такую как активный сложный эфир или галогениды карбоновой кислоты, в особенности,хлориды или бромиды кислоты, азиды, смешанный ангидрид угольно-карбоновой кислоты (например, с помощью реакции с изобутилхлорформатом), активные сложные эфиры (п-нитрофенил сложный эфир,пентахлорфенилсложный эфир, N-гидроксиянтарный имидоэфир). Амины (VIII) могут также реагировать со сложными эфирами низших алкилов карбоновой кислоты, в особенности, метиловыми или этиловыми сложными эфирами. Примеры сшивающих агентов включают карбодиимиды (дициклогексилкарбодиимид, диизопропилкарбодиимид или растворимый в воде карбодиимид, такой как N-этил-N'-[(3 диметиламино)пропил] карбодиимид) или карбонилдиимидазолы. Некоторые из этих методов могут быть улучшены путем добавления подходящих катализаторов, например, в карбодиимид способе путем добавления 1-гидроксибензотриазола или 4-диметиламинопиридина (4-DMAP). Реакции формирования амидной связи предпочтительно проводят в инертном растворителе, таком как галогенированные углеводороды, например, дихлорметан, хлороформ, диполярные апротонные растворители, такие как ацетонитрил, диметилформамид, диметилацетамид, простые эфиры, такие как тетрагидрофуран. Во многих примерах реакции сочетания проводят в присутствии подходящего основания,таком как третичный амин, например, триэтиламин, диизопропилэтиламин (DIPEA), N-метилморфолин,N-метилпирролидин или 4-DMAP. Соединения формулы (I), где R5 представляет собой CH2NR56R5f, причем указанные соединения представлены формулой (I-е), могут быть получены с помощью реакции восстановительного аминирования, начиная с альдегидов (IX). Восстановительное аминирование может быть проведено с помощью водорода в присутствии катализатора на основе благородного металла, такого как Pt или Pd, или с помощью цианоборгидрида. Эти соединения могут также быть получены с помощью реакции Nалкилирования, начиная с промежуточных соединений (X), где W определен выше и, в особенности,представляет собой хлор или бром. Соединения формулы (I-d), которые являются соединениями формулы (I), где R5 представляет собой -C(=O)-R5d, могут быть получены с помощью взаимодействия промежуточного соединения (XI) с Соединения (I-d) могут быть восстановлены до соответствующих спиртов (I-e), например, с помощью NaBH4 в спирт, такой как метанол. Соединения формулы (I-g), которые представляют собой соединения формулы (I), где R5 представляет собой -CH(OR5c)R5d, могут быть получены с помощью взаимодействия пиримидина формулы (XII) с органо-металлическим соединением (M-R5d). Полученные таким образом соединения формулы (I-f) могут быть превращены в соответствующие соединения формулы (I-g), которые представляют собой соединения формулы (I), где R5c отличен от водорода. Группа R5c может быть введена с помощью реакции формирования простого эфира, такой как реакция О-алкилирования с реагентом W1-R5c, где W1 представляет собой уходящую группу, такую как галоген, в особенности, хлор, бром или иод, или сульфатная или азидная группа. M в M-R5d представляет собой металл, такой как щелочной металл, в особенности,Li, Na или K, или производное магния, такое как реактив типа Гриньяра (M-R5d представляет собой галоген-Mg-R5d). Эти реакции, обычно, проводят в реакционно-инертном растворителе, таком как простой эфир (ТГФ, диэтиловый эфир, диоксан) или галогенированные углеводороды (CH2Cl2, CHCl3).-7 020772 Соединения формулы (I-h), которые представляют собой соединения формулы (I), где R5 представляет собой -CH2-OQ, где Q представляет собой -Р(=O) (OR5h)2 или C2-6 алкенил, могут быть получены путем взаимодействия (XII) с диалкилхлорфосфатом (XIII). Эту реакцию проводят в реакционно-инертном растворителе, например, ТГФ, в присутствии основания, например, алканолата щелочного металла, например, K-OtBu. Подобным образом, промежуточные соединения (XII) могут взаимодействовать с хлорсульфонилизоцианатом до получения соединений формулы (I-i). Эта реакция может быть проведена в реакционноинертном растворителе, например ТГФ, с последующим гидролизом. Некоторые промежуточные соединения и исходные вещества представляют собой известные соединения и могут быть коммерчески доступными или могут быть получены в соответствии с методиками, известными из уровня техники. Промежуточные соединения формулы (II) могут быть получены путем взаимодействия промежуточного соединения формулы (XIII), где каждый W как определено в настоящем описании выше, с промежуточным соединением формулы (XIV) в подходящем растворителе, таком как, например, тетрагидрофуран, обычно в присутствии подходящего основания, такого как, например, Na2CO3. X1 в следующих схемах представляет -NR1-, -O- или -S-. Промежуточные соединения (V-a) и (V-b) могут быть получены следующим образом: Промежуточные соединения формулы (VII), (XI) и (XII) могут быть получены следующим образом: На первой стадии, арилгуанидин конденсируют с 4-метоксиацетоуксусной кислотой. Полученный таким образом гидроксипиримидин превращают в соответствующий галогенопиримидин, используя галогенирующий агент, такой как POCl3. Галогеногруппу замещают производным анилина с получением метоксиметильного производного (XI). Последний деметилируют с получением метилспирта (XII), который окисляют до (VII). Окисление (XII) с помощью мягкого окислителя, такого как MnO2, в реакционно-инертном растворителе, таком как ацетон или дихлорметан, приводит к промежуточным соединениям (IX). Галогенирование (XII), такое, как взаимодействие с сульфонилхлоридом в реакционно-инертном растворителе, таком как ТГФ или дихлорметан, приводит к промежуточным соединениям (X). Соединения формулы (I) могут дополнительно быть приготовлены путем превращения соединения формулы (I) друг в друга в соответствии с известными из уровня техники реакциями трансформации групп. Соединения формулы (I), где R2, R3, R6 или R7 представляет собой водород, могут быть превращены в соединения формулы (I), где R2, R3, R6 или R7 представляет собой галоген, путем взаимодействия с подходящим агентом, вводящим галоген, таким как, например, N-хлор- или N-бромсукцинимид, в подходящем растворителе, например, уксусной кислоте. Соединения формулы (I), где R1 представляет C1-6 алкилоксикарбонил, могут быть превращены в соединения формулы (I), где R1 представляет водород,путем взаимодействия с подходящим основанием, таком как, например, натрия гидроксид или метоксид. Где R1 представляет собой третбутилоксикарбонил, соответствующие соединения, где R1 представляет собой водород, могут быть получены путем обработки трифторуксусной кислотой. Некоторые из соединений формулы (I) и некоторые из промежуточных соединений в настоящем изобретении могут содержать асимметричный атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений могут быть получены благодаря применению методик, известных из уровня техники. Например, диастереоизомеры могут быть отделены с помощью физических методов, таких как селективная кристаллизация или хроматографические методики, например, распределение в противотоке, жидкостная хроматография и подобные методы. Энантиомеры могут быть получены из рацемических смесей, путем сначала превращения указанных рацемических смесей с подходящими разделяющими агентами, такими как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем физического разделения указанных смесей диастереомерных солей или соединений путем, например, селективной кристаллизации или хроматографическими методиками, например, жидкостной хроматографией и подобными методами; и, наконец, превращения указанных отделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы могут также быть получены из чистых стереохимически изомерных форм соответсвующих промежуточных соединений и исходных веществ, при условии, что промежуточные реакции протекают стереоспецифически. Альтернативный метод разделения энантиомерных форм соединения формулы (I) и промежуточных соединений включает жидкостную хроматографию, в особенности, жидкостную хроматографию,использующую хиральную стационарную фазу. Соединения формулы (I) показывают антиретровирусные свойства (свойства, ингибирующие обратную транскриптазу), в особенности, в отношении вируса иммунодефицита человека (ВИЧ), этиологического агента синдрома приобретенного иммунодефицита (СПИД) у людей. Вирус ВИЧ предпочтительно инфицирует человеческие Т-4 клетки и разрушает их или изменяет их нормальные функции, особенно согласованные действия иммунной системы. Как результат, инфицированный пациент имеет постоянно уменьшающееся число Т-4 клеток, которые, более того, ведут себя ненормально. Следовательно,иммунологическая защитная система не способна бороться с инфекциями и новообразованиями, и ВИЧ инфицированный пациент обычно умирает от оппортунистических инфекций, таких как пневмония или от рака. Другие условия, связанные с ВИЧ инфекцией, включают тромбоцитопению, Саркому Калоши и инфекции центральной нервной системы, характеризующиеся прогрессивным демиелированием, приводя к слабоумию и симптомам, таким как, прогрессивным дизартрия, нарушение координации движений и потеря ориентации. ВИЧ инфекции дополнительно также связаны с периферической нейропатией, прогрессивной генерализованной лимфаденопатией (PGL) и СПИД-ассоциированным комплексом (ARC). Настоящие соединения также показывают активность в отношении штаммов ВИЧ, устойчивых к лекарственному средству или мультилекарственному средству, в особенности, штаммов ВИЧ, устойчивых к мультилекарственному средству, более конкретно, настоящие соединения показывают активность в отношении ВИЧ штаммов, которые обладают приобретенной устойчивостью к одному или более известным из уровня техники ненуклеозидным ингибиторам обратной транскриптазы, в особенности, те,которые были одобрены для терапии, такой как эфавиренз, делавирдин и невирапин. Благодаря своим антиретровирусным свойствам, особенно своим анти-ВИЧ свойствам, особенно своим анти-ВИЧ-1-активности, соединения формулы (I), их фармацевтически приемлемые аддитивные соли, фармацевтически приемлемые сольваты или возможные стереоизомерные формы, являются полезными при лечении индивидуумов, инфицированных ВИЧ, и для профилактики этих инфекций. В общем случае, соединения по настоящему изобретению могут быть полезными в лечении теплокровных живот-9 020772 ных, инфицированных вирусами, чье существование опосредовано или зависит от ферментной обратной транскриптазы. Состояния, которые могут быть предупреждены или вылечены с помощью соединений по настоящему изобретению, особенно состояния, связанные с ВИЧ и другими патогенными ретровирусами, включают СПИД, СПИД-ассоциированный комплекс (ARC), прогрессивную генерализованную лимфаденопатию (PGL), также, как и хронические заболевания центральной нервной системы, вызванные ретровирусами, такими как, например, ВИЧ-опосредованное слабоумие и рассеянный склероз. Соединения по настоящему изобретению или любые их подгруппы можно, следовательно, использовать в качестве лекарственных средств в отношении вышеупомянутых состояний. Указанное применение в качестве лекарственного средства или способа лечения включает введение ВИЧ-инфицированным пациентам количества, эффективного для борьбы с состояниями, связанными с ВИЧ и другими патогенными ретровирусами, особенно ВИЧ-1. В особенности, соединения формулы (I) могут быть использованы в получении лекарственного средства для лечения или профилактики ВИЧ инфекций. В дополнительном аспекте настоящее изобретение предоставляет способ лечения теплокровных животных, включая людей, страдающих от вирусных инфекций, или способ профилактики теплокровных животных, включая людей, страдающих от вирусных инфекций, особенно ВИЧ инфекций. Указанный способ включает введение, предпочтительно, пероральное введение, эффективного количества соединения формулы (I), их фармацевтически приемлемой аддитивной соли, фармацевтически приемлемого сольвата или их возможной стереоизомерной формы теплокровным животным, включая людей. Настоящее изобретение также предоставляет композиции для лечения вирусных инфекций, включающие терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или разбавитель. Соединения по настоящему изобретению или любые их подгруппы могут быть представлены в разных фармацевтических формах для целейвведения. В качестве соответсвующих композиций могут быть указаны все композиции, обычно используемые для систематически вводимых лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению, эффективное количество конкретного соединения, необязательно в аддитивной солевой форме, в качестве активного компонента объединяют в тщательно перемешанной примеси с фармацевтически приемлемым носителем, который может принимать большое разнообразие форм, в зависимости от формы получения, необходимой для введения. Эти фармацевтические композиции желаемы в единичной лекарственной форме, подходящей особенно для введение перорально, ректально, подкожно или для парентерального введения. Например,при получении композиций в пероральной лекарственной форме, любая обычная фармацевтическая среда может быть использована, такая как, например, вода, гликоли, масла, спирты и подобные в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазки, связывающие вещества,расщепляющие агенты и подобные в случае порошков, пилюль, капсул и таблеток. Благодаря своей простоте при введении, таблетки и капсулы представляют наиболее преимущественные пероральные единичные лекарственные формы, в случае которых очевидно используют твердые фармацевтические носители. Для парентеральных композиций носитель будет обычно включать стерильную воду, по меньшей мере, в большей части, хотя могут быть включены другие компоненты, например, чтобы достичь растворимости. Могут быть получены, например, растворы для введения, где носитель включает раствор хлорида натрия, раствор глюкозы или смесь раствора хлорида натрия и раствора глюкозы. Могут также быть приготовлены суспензии для введения, в случае которых соответствующие жидкие носители, суспендирующие агенты и подобные могут быть использованы. Также включены препараты твердой формы, которые могут быть превращены, за короткое время до применения, в препараты жидкой формы. В композициях, подходящих для подкожного введения, носитель необязательно включает агент, увеличивающий проникновение, и/или подходящий смачивающий агент, необязательно объединенный с подходящими добавками любой природы в минорных пропорциях, причем добавки не оказывают значительного вредного воздействия на кожу. Указанные добавки могут облегчать введение на кожу и/или могут быть полезными для получения необходимых композиций. Эти композиции могут быть введены разными путями, например, в виде трансдермального пластыря, местно, в качестве мази. Соединения по настоящему изобретению могут также быть введены через вдыхание или вдуванием при помощи методов и составов, используемых в уровне техники для введения этим путем. Таким образом, в общем случае, соединения по настоящему изобретению могут быть введены в легкие в форме раствора, суспензии или сухого порошка. Любая система, разработанная для доставки растворов, суспензий или сухих порошков посредством перорального или назального вдыхания или вдувания, подходит для введения настоящих соединений. Особенно предпочтительно получать вышеупомянутые фармацевтические композиции в единичной лекарственной форме для простоты введения и однородности дозы. Единичная лекарственная форма,используемая в настоящем описании, относится к физически дискретным единицам, подходящим в качестве единичных доз, причем каждая единица содержит заранее определенное количество активного компонента, рассчитанного для получения необходимого терапевтического воздействия совместно с желаемым фармацевтическим носителем. Примерами таких единичных лекарственных форм являются таблет- 10020772 ки (включая делимые или покрытые таблетки), капсулы, пилюли, пакеты для порошкообразного продукта, облатки, суппозитории, растворы для введения или суспензии и подобные, и их отдельные кратные единицы. Специалисты в лечении ВИЧ-инфекции смогут определить эффективное ежедневное количество из результатов теста, представленных здесь. В общем случае, предполагается, что эффективным ежедневным количеством будет от 0,01 мг/кг до 50 мг/кг по весу тела, более предпочтительно, от 0,1 мг/кг до 10 мг/кг по весу тела. Может быть подходящим вводить желаемую дозу в виде двух, трех, четырех или более небольших доз с соответсвующими интервалами в течение дня. Указанные небольшие дозы могут быть представлены в виде единичных лекарственных форм, например, содержащих 1 до 1000 мг, и в особенности от 5 до 200 мг активного компонента на единичную лекарственную форму. Точная доза и частота введения зависят от конкретного используемого соединения формулы (I),конкретного состояния, подвергающегося лечению, тяжести состояния, подвергающегося лечению, возраста, веса и общего физического состояния конкретного пациента так же, как и другого лекарственного лечения, которое индивидуум может проходить, как хорошо известно специалистам в данной области техники. Более того, очевидно, что указанное эффективное ежедневное количество может быть понижено или повышено в зависимости от ответа пациента на лечение и/или в зависимости от оценки врача назначающего соединения текущего изобретения. Эффективные ежедневные диапазоны количеств, упомянутые в настоящем описании выше, являются, следовательно, только рекомендациями и не подразумевают ограничения объема или применения изобретения до любой степени. Настоящие соединения формулы (I) могут быть использованы сами по себе или в комбинации с другими терапевтическими агентами, такими как противовирусные препараты, антибиотики, иммуномодуляторы или вакцины для лечения вирусных инфекций. Они могут также быть использованы сами по себе или в комбинации с другими профилактическими агентами для предупреждения вирусных инфекций. Настоящие соединения могут быть использованы в вакцинах и способах защиты индивидуумов от вирусных инфекций на протяжении расширенного периода времени. Соединения могут быть использованы в таких вакцинах или сами по себе или вместе с другими соединениями по настоящему изобретению или вместе с другими противовирусными агентами способом, согласующимся с обычным использованием ингибиторов обратной транскриптазы в вакцинах. Таким образом, настоящие соединения могут быть объединены с фармацевтически приемлемыми адъювантами, обычно используемыми в вакцинах, и введены в профилактически эффективных количествах для защиты индивидуумов на протяжении расширенного периода времени от ВИЧ-инфекции. Также комбинация одного или более дополнительных антиретровирусных соединений и соединения формулы (I) может быть использована в качестве лекарственного средства. Таким образом, настоящее изобретение также относится к продукту, содержащему (a) соединение формулы (I), и (b) одно или более дополнительных антиретровирусных соединений, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в анти-ВИЧ лечении. Разные лекарственные средства могут быть объединены в однократном препарате вместе с фармацевтически приемлемыми носителями. Указанные другие антиретровирусные соединения могут быть любыми известными антиретровирусными соединениями, такими как сурамин, пентамидин, тимопентин, кастаноспермин,декстран (сульфат декстрана), фоскарнет натрий (тринатрия фосфоноформат); нуклеозидные ингибиторы обратной транскриптазы (NRTIs), например, зидовудин (AZT), диданозин (ddl), зальцитабин (ddC), ламивудин (3 ТС), ставудин (d4T), эмтрицитабин (FTC), абакавир (ABC), амдоксовир (DAPD), эльвуцитабин (ACN- 126,443), AVX 754 -)-dOTC), фозивудин тидоксил (FZT), фосфазид, HDP-990003, KP-1461,MIV-210, рацивир (PSI-5004), UC-781 и подобные; ненуклеозидные ингибиторы обратной транскриптазы(NNRTIs), такие как делавирдин (DLV), эфавиренз (EFV), невирапин (NVP), дапивирин (ТМС 120), этравирин (ТМС 125), рилпивирин (ТМС 278), DPC-082, (+)-каланолид A, BILR-355, и подобные; нуклеотидные ингибитоы обратной транскриптазы (NtRTIs), например, тенофовир R)-РМРА) и тенофовир дизопроксил фумарат (TDF), и подобные; нуклеотид-конкурирующие ингибиторы обратной транскриптазы(PNU-140690), AG-1859, AG-1776, Ro-0334649 и подобные; ингибиторы слияния, которые включают ингибиторы сплавления (например, энфувиртид (Т-20, ингибиторы связывания и ингибиторы сорецептора, последние включают антагонисты CCR5 (например, анкриврок, CCR5mAb004, маравирок (UK427,857), PRO-140, TAK-220, TAK-652, викривирок (SCH-D, SCH-417,690 и антагонисты CXR4 (например, AMD-070, KRH-27315), примерами ингибиторов слияния являются PRO-542, TNX-355, BMS488,043, BlockAide/CR, FP 21399, hNMO1, нонакин, VGV-1; ингибитор созревания, например, представляет собой РА-457; ингибиторы вирусных интеграз, например, ральтегравир (MK-0518), эльвитегравир (JTK-303, GS-9137), BMS-538,158; рибозимы; иммуномодуляторы; моноклональные антитела; генная терапия; вакцины; малые интерферирующие РНК; антисмысловые РНК; бактерицидные вещества; инги- 11020772 биторы "цинковых пальцев". Комбинация может давать синергитический эффект, при помощи которого вирусная инфицирующая способность и связанные с ней симптомы могут быть предупреждены, существенно уменьшены или полностью устранены. Соединения по настоящему изобретению могут также быть введены в комбинации с иммуномодуляторами (например, бропиримин, анти-антитело к человеческому альфа интерферону, ИЛ-2, метионин энкефалин, интерферон альфа, и налтрексон), с антибиотиками (например, пентамидин изотиорат), цитокинами (например, Th2), модуляторами цитокинов, хемокинами или модуляторами хемокинов, хемокиновыми рецепторами (например, CCR5, CXCR4), модуляторами хемокиновых рецепторов или гормонами (например, гормон роста) для улучшения, борьбы или устранения ВИЧ-инфекции и ее симптомов. Такая комбинированная терапия в разных составах может быть введена одновременно, последовательно или независимо друг от друга. Альтернативно, такая комбинация может быть введена в виде единичного состава, в результате чего активные компоненты высвобождаются из состава одновременно или раздельно. Соединения по настоящему изобретению могут также быть введены в комбинации с модуляторами метаболизации, следуя применению лекарственного средства на индивидууме. Эти модуляторы включают соединения, которые препятствуют метаболизации на цитохромах, таких как цитохром P450. Известно, что несколько изоферментов существует в цитохроме P450, один из которых представляет собой цитохром P450 3 А 4. Ритонавир представляет собой пример модулятора метаболизации через цитохромP450. Такая комбинированная терапия в разных составах может быть введена одновременно, последовательно или независимо друг от друга. Альтернативно, такая комбинация может быть введена в виде единичного состава, при помощи которого активные компоненты высвобождаются из состава одновременно или раздельно. Такой модулятор может быть введен в том же или другом соотношении в качестве соединения по настоящему изобретению. Предпочтительно, весовое соотношение такого модулятора по отношению к соединению по настоящему изобретению (модулятор: соединение по настоящему изобретению) составляет 1:1 или ниже, более предпочтительно соотношение составляет 1:3 или ниже, подходящим соотношением является 1:10 или ниже, более подходящим соотношением является 1:30 или ниже. Несмотря на то что настоящее изобретение направлено на применение настоящих соединений для предупреждения или лечения ВИЧ инфекций, настоящие соединения могут также быть использованы в качестве ингибирующих агентов для других вирусов, которые зависят от обратных транскриптаз для размножения. Следующие примеры подразумеваются для иллюстрации настоящего изобретения и не для ограничения его объема. Пример 1 Смесь 4-цианоанилина (0,420 моль) в 2-метоксиэтиловом эфире (250 мл) перемешивали при 100C в течение 30 мин. Затем смесь цианамида (0,630 моль) в воде (30 мл) добавляли порциями в течение 45 мин. После перемешивания 24 ч при 100C цианамид (0,210 моль) добавляли снова. Смесь затем перемешивали при 100C еще 48 ч и затем упаривали досуха. Остаток кристаллизовали из ацетона, получая 70,5 г промежуточного соединения А (выход 85%, точка плавления: 225C). К раствору А (0,0102 моль) в этаноле (25 мл) добавляли этоксид натрия (21%) (0,0153 моль, 1,5 экв.), затем диэтиловый эфир малоновой кислоты (0,0102 моль, 1 экв.). Конечную смесь перемешивали при кипячении с обратным холодильником в течение 6 ч и затем давали остыть до комнатной температуры. Добавляли воду и смесь подкисляли уксусной кислотой (до pH 6). Полученный осадок фильтровали с получением 1,5 г желаемого соединения В (выход 57%). Смесь В (0,0056 моль) и оксихлорид фосфора (10 мл) перемешивали при кипячении с обратным холодильником в течение 30 мин. После охлаждения оксихлорид фосфора упаривали. Добавляли воду иK2CO3 10%, и смесь экстрагировали CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали, и растворитель упаривали с получением 1,51 г С (выход 97%). 3-(4-Амино-3,5-диметилфенил)-акрилонитрил (0,00754 моль) и дихлорпиримидин С (0,00754 моль) смешивали и нагревали до слияния. Смесь выливали в воду и K2CO3 10% и экстрагировали CH2Cl2 и метанолом. Органический слой сушили над сульфатом магния, фильтровали, и растворитель упаривали. Остаток очищали на колоночной хроматографии с силикагелем (35-70 мкм; элюент: CH2Cl2/метанол 99,5:0,5). Фракции с желаемым соединением собирали, и растворитель упаривали с получением 0,4 г промежуточного соединения D с 72% чистотой (выход 9%). Смесь промежуточного соединения D (0,0003 моль), трифенилфосфина палладия (0,00006 моль),K2CO3 2 М (0,001 моль) и пиридил-3-бороновая кислота (0,0009 моль) в диметоксиэтане (ДМЭ; 5 мл) и метанол (1 мл) перемешивали при кипячении с обратным холодильником всю ночь. После охлаждения,смесь фильтровали через целит, и фильтрат выливали в воду и экстрагировали CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали и растворитель упаривали. Остаток очищали на колоночной хроматографии с силикагелем (Kromasil 5 мкм; элюент: CH2Cl2 100 до CH2Cl2/метанол 99:1). Чистые фракции собирали, и растворитель упаривали с получением 0,042 г чистого продукта соединения 1 К раствору промежуточного соединения А (0,0102 моль), полученного как в примере 1, в этаноле(25 мл) добавляли этоксид натрия (21%) (0,0153 моль, 1,5 экв.), затем метил 4-метоксиацетоацетат(0,0102 моль, 1 экв.). Конечную смесь перемешивали при кипячении с обратным холодильником в течение 6 ч и затем давали остыть до комнатной температуры. Добавляли воду и смесь подкисляли уксусной кислотой (до pH 6). Полученный осадок фильтровали с получением 1,5 г промежуточного соединения E(57% выход). Смесь E (0,0056 моль) и оксихлорид фосфора (10 мл) перемешивали при кипячении с обратным холодильником в течение 30 мин. После охлаждения оксихлорид фосфора упаривали. Добавляли воду иK2CO3 10%, и смесь экстрагировали CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали, и растворитель упаривали с получением 1,51 г F (выход 97%). Смесь промежуточного соединения F (0,00182 моль) и 3-(4-амино-3,5-диметилфенил)- акрилонитрил (0,00182 моль) нагревали до слияния в течение 5 мин, затем выливали в смесь воды и K2CO3 10%. Конечную смесь экстрагировали CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали, и растворитель упаривали. Остаток очищали на колоночной хроматографии с силикагелем (35-70 мкм; элюент: CH2Cl2/метанол 97:3). Чистые фракции собирали, и растворитель упаривали с получением 0,34 г промежуточного соединения G (46% выход, точка плавления: 115C). Трибромид брома 1M в CH2Cl2 (0,00456 моль) добавляли по каплям к раствору метокси производного G (0,000828 моль) в CH2Cl2 (15 мл) при -78C. Раствор перемешивали при -78C в течение 20 мин и при 0C в течение 3 ч. Добавляли лед, и смесь экстрагировали CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали, и растворитель упаривали. Остаток кристаллизовали из CH2Cl2, давая 0,22 г промежуточного соединения H (67% выход, точка плавления: 232C). Гидрид натрия (60% в масле, 0,0006 моль, 1,2 экв.) добавляли к охлажденной с помощью льда смеси производного метилового спирта H (0,0005 моль) и аллилбромида (0,0006 моль, 1,2 экв.) в тетрагидрофуране (ТТФ; 5 мл). После 30 мин при 0C смесь нагревали вплоть до комнатной температуры и перемешивали в течение 42 ч. Добавляли воду, и смесь экстрагировали CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали, и растворитель упаривали. Остаток очищали на колоночной хроматографии с силикагелем (5 мкм, элюент: CH2Cl2/метанол/NH4OH 99:1 :0,1 до 90:10:1) с получением 0,074 г чистого соединения 2 (34% выход, точка плавления: 111C). Оксид марганца (0,0345 моль) добавляли к раствору промежуточного соединения H (0,00343 моль) в CH2Cl2 (70 мл) и ТГФ (20 мл) и смесь перемешивали при комнатной температуре в течение 5 ч, затем фильтровали через целит. Целит промывали с помощью CH2Cl2/метанол и фильтрат упаривали. Остаток кристаллизовали из CH2Cl2 и нескольких капель метанола. Осадок предоставлял кислотное производное J(0,63 г, 45% выход). Фильтрат упаривали, и остаток представлял альдегид I (0,55 г, 46% выход). Эти два соединения вовлекали в следующие стадии без дополнительной очистки. К раствору альдегидного производного I (0,000481 моль) в ТГФ (10 мл), охлажденного до -78C,добавляли 2-метоксифенил магния бромид (0,00168 моль, 3,5 экв.). Конечную смесь перемешивали 2 ч при -78C, затем давали нагреться вплоть до комнатной температуры и перемешивали в течение 18 ч.NH4Cl 10% выливали в смесь и проводили экстракцию с помощью CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали и растворитель упаривали. Остаток очищали на колоночной хроматографии с силикагелем (Kromasil 5 мкм; элюент: CH2Cl2/метанол 100:0 до 96:4). Чистые фракции собирали и растворитель упаривали, получая 0,026 г соединения 3 (11% выход). Пример 5 1-гидроксибензотриазол (0,000366 моль, 1,5 экв.) добавляли к смеси кислоты J (0,000244 моль) в ТГФ (3 мл). Дихлорметан (3 мл) и 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (0,000366 моль, 1,5 экв.) добавляли последовательно к смеси. К этому раствору добавляли 2-этоксиэтиламин(0,000366 моль, 1,5 экв.), затем триэтиламин (0,000488 моль, 2 экв.). Смесь перемешивали при комнатной температуре в течение 24 ч, затем выливали в воду и K2CO3 10% и экстрагировали 90:10 смесьюCH2Cl2/метанол. Органический слой сушили над сульфатом магния, фильтровали и растворитель упаривали. Остаток очищали на колоночной хроматографии с силикагелем (Kromasil 5 мкм; элюент: 1-Гидроксибензотриазол (0,0009 моль, 1,5 экв.) добавляли к смеси кислоты J (0,0006 моль) в ТГФ (3 мл). Дихлорметан (3 мл) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (0,0009 моль,1,5 экв.) добавляли последовательно к смеси. К этому раствору добавляли N,О-диметилгидроксиламина гидрохлорид (0,0009 моль, 1,5 экв.), затем триэтиламин (0,0009 моль, 1,5 экв.). Смесь перемешивали при комнатной температуре в течение 36 ч, затем выливали в воду и K2CO3 10%, и экстрагировали 90:10 смесью CH2Cl2/ТГФ. Органический слой сушили над сульфатом магния, фильтровали и растворитель упаривали. Полученное промежуточное соединение К затем вовлекали в следующие стадии без дополнительной очистки. К раствору тиазола (0,003 моль, 5 экв.) в ТГФ (2,5 мл) при -78C добавляли по каплям н-бутиллитий(0,003 моль, 5 экв.); конечную смесь перемешивали при -78C в течение 25 мин до добавления по каплям раствора промежуточного соединения К (0,0006 моль) в ТГФ (6 мл). Конечной смеси позволяли нагреться вплоть до комнатной температуры и перемешивание продолжали всю ночь. 10% NH4Cl добавляли к смеси и ее экстрагировали затем CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали и растворитель упаривали. Остаток очищали на колоночной хроматографии с силикагелем (3,5 мкм; элюент: CH2Cl2/метанол/ NH4OH 100:0:0 до 96:4:0,4), давая 0,017 г соединения 10 (6% выход). К охлажденному с помощью льда раствору соединения 10 (0,0013 моль) в метаноле (5 мл) добавляли натрия боргидрид (0,0007 моль, 0,55 экв.); конечную смесь перемешивали при 0C в течение 2,5 ч. 10% NH4Cl добавляли к смеси, экстрагированной затем с CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали и растворитель упаривали. Остаток очищали на колоночной хроматографии с силикагелем (3,5 мкм; элюент: К охлажденному с помощью льда раствору производного метилового спирта H (0,004 моль) вCH2Cl2 (16 мл) добавляли по каплям тионилхлорид (8,5 мл). Смесь перемешивали при 5C в течение 2 ч. Растворитель упаривали с получением желтого порошка, затем сушили под вакуумом при 60C с получением 1,65 г промежуточного соединения M, использованного без дополнительной очистки в следующих стадиях (99% выход). Способ A К раствору промежуточного соединения M (0,0006 моль) в ТГФ (5 мл) добавляли нитрат серебра(0,0072 моль, 1,2 зкв.) после 5 мин перемешивания с 1-метилпиперазином (0,0072 моль, 1,2 экв.). Все перемешивали при 40C всю ночь. Затем добавляли воду, и смесь фильтровали через подушку из целита и промывали с помощью CH2Cl2. Остаток экстрагировали CH2Cl2 и объединенные органические слои промывали с помощью 10% NH4Cl раствора, сушили над MgSO4 и фильтровали. Растворитель упаривали и конечную смесь (0,345 г) очищали на колоночной хроматографии (5 мкм, элюент: Смесь промежуточного соединения М (0,0005 моль), 2-метоксиэтиламина (0,001 моль, 2 экв.) и карбоната калия (0,002 моль, 4 экв.) в ацетонитриле (5 мл) нагревали до 80C в течение 20 ч. Добавляли воду и смесь экстрагировали CH2Cl2. Объединенные органические слои сушили над MgSO4, фильтровали и упаривали. Остаток (0,24 г) очищали на колоночной хроматографии (10 мкм, элюент: CH2Cl2/метанол/NH4OH 97:23:0,1 до 96:4:0,5),давая 0,080 г чистого соединения 15 (35% выход). Способ C Две капли уксусной кислоты добавляли при комнатной температуре к смеси натрия цианоборгидрида (0,00152 моль), альдегида I (0,000508 моль), и 3-(аминометил)пиридина (0,000761 моль) в ТГФ (10 мл). Смесь перемешивали при комнатной температуре в течение 4 ч. Смесь выливали в воду и K2CO3 10% и экстрагировали CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали и растворитель упаривали. Остаток очищали на колоночной хроматографии с силикагелем (Kroraasil 5 мкм; элюент: CH2Cl2/метанол/NH4OH 99:1:0,05 до 95:5:0,25). Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из диэтилового эфира с получением 0,063 г чистого соединения 27 (26% К охлажденной с помощью льда смеси третбутоксида калия (0,000416 моль) в ТГФ, добавляли производное метилового спирта H (0,000378 моль), затем диэтилхлорфосфат (0,000416 моль). Смесь перемешивали при комнатной температуре в течение 1 ч и затем выливали в воду и экстрагировали CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали и растворитель упаривали. Остаток очищали на колоночной хроматографии с силикагелем (35-70 мкм; элюент: CH2Cl2/метанол 98:2), получая 0,051 г соединения 32 (25% выход, точка плавления: 217C). Производное метилового спирта H (0,000252 моль) в ТГФ (3 мл) добавляли к смеси хлорсульфонилизоцианата (0,000416 моль) в ТГФ (2 мл) при -78C. Смеси позволяли нагреться вплоть до комнатной температуры и затем перемешивали при комнатной температуре в течение 1 ч. Добавляли воду и смесь перемешивали при 70C всю ночь, затем выливали в воду и K2CO3 10%. Смесь экстрагировали CH2Cl2. Органический слой сушили над сульфатом магния, фильтровали и растворитель упаривали. Остаток сначала кристаллизовали из диэтилового эфира, затем из ацетона, получая 0,017 г соединения 33 (15% выход, точка плавления 250C). Пример 9 Смесь альдегида I (0,000330 моль) и гидроксиламин гидрохлорида (0,000494 моль) в пиридине (4 мл) перемешивали при комнатной температуре в течение 20 ч, затем выливали в воду. Осадок отфильтровывали, промывали водой и CH3CN и сушили с получением 0,060 г соединения 34 (44% выход, точка плавления: 220C). Антивирусная характеристика Соединения по настоящему изобретению тестировали на их эффективность в отношении вируса дикого типа и клинически выделенных ВИЧ штаммов, содержащих одну или более мутаций, связанных с устойчивостью к ингибиторам обратной транскриптазы. Антивирусную активность оценивали, используя клеточный анализ, проведенный в соответствии со следующей методикой. Человеческую линию Т-клеток МТ 4 сконструировали с зеленым флуоресцентным белком (GFP) и промотером, специфичным к ВИЧ, ВИЧ-1 длинным терминальным повтором (LTR). Эта клеточная линия, обозначенная МТ 4 LTR-EGFP, может быть использована для in vitro оценки анти-ВИЧ активности исследовательских соединений. В инфицированных ВИЧ-1 клетках продуцируется белок Tat, который активирует LTR промотор и, наконец, приводит к стимуляции продуцирования репортера GFP, позволяя измерить продолжающуюся ВИЧ-инфекцию флуорометрически. Аналогичным образом, МТ 4 клетки сконструировали с GFP и конститутивным промотором цитомегаловируса (CMV). Эту клеточную линию обозначили МТ 4 CMV-EGFP, и она может быть использована для in vitro оценки цитотоксичности исследовательских соединений. В этой клеточной линии уровни GFP сравнимы с уровнями инфицированных МТ 4 LTR-EGFP клеток. Цитотоксичные исследовательские соединения понижают GFP уровни mock-инфицированных МТ 4 CMV-EGFP клеток. Могут быть определены значения эффективной концентрации, такие как 50% эффективной концентрации (EC50), и обычно их выражают в мкм. Значение EC50 определено, как концентрация тестируемо- 18020772 го соединения, которая понижает флуоресценцию ВИЧ-инфицированных клеток на 50%. 50% цитотоксичная концентрация (CC50 в мкм) определена, как концентрация тестируемого соединения, которая понижает флуоресценцию mock-инфицированных клеток на 50%. Соотношение CC50 к EC50 определено, как индекс селективности (SI), и является указанием селективности анти-ВИЧ активности ингибитора. Первичную регистрацию ВИЧ-1 инфекции и цитотоксичности выполняли, используя сканирующий микроскоп. Анализ изображения обеспечивает очень чувствительное определение вирусной инфекции. Измерения проводили до некроза клетки, который обычно происходит спустя примерно пять дней после инфицирования, в особенности измерения проводили спустя три дня после инфицирования. Колонки IIIB, L100I, и т.д. в таблице перечня значений pEC50 (-log EC50) в отношении разных штаммов IIIB, L100I, и т.д.; pSI перечисляет значения -log SI. Штамм IIIB представляет собой штамм ВИЧ дикого типа."MDR" относится к штамму, который содержит мутации L100I, K103N, Y181C, E138G, V179I,L2214F, V278V/I и A327A/V в обратной транскриптазе ВИЧ. его фармацевтически приемлемая аддитивная соль, фармацевтически приемлемый сольват или стереохимически изомерная форма, гдеR2 и R3 независимо представляют собой водород;R6 и R7 независимо представляют собой C1-6 алкил;R5 представляет собой пиридил, -C(=O)NR5aR5b; -CH(OR5c)R5d; -CH2-NR5eR5f; -CH=NOR5a; -CH2-OC2-6 алкенил; -CH2-O-P(=O) (OR5g)2; -CH2-O-C(=O)-NH2; -C(=O)-R5d; каждый R5a независимо представляет собой водород или C1-6 алкил;R5c представляет собой водород, C1-6 алкил, Het; каждый R5d независимо представляет собой арил или Het;R5e представляет собой водород или C1-6 алкил;R5f представляет собой C1-6 алкилокси; C2-6 алкенил или C1-6 алкил, замещенный радикалом, выбранным из гидрокси, C1-6 алкилокси, циано, амино, моно- и ди-C1-6 алкиламино, C1-6 алкилкарбониламино,арила, Het, диоксоланила, тетрагидрофуранила, пирролидинила, пиперидинила, морфолинила, пиперазинила и C3-7 циклоалкила; где указанный диоксоланил может быть необязательно замещен одним или двумя C1-6 алкильными радикалами; и,где указанный пиперазинил может быть необязательно замещен C1-6 алкилом, C1-6 алкилкарбонилом или C1-6 алкилоксикарбонилом;R5e и R5f, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидинил; имидазолил; пиперидинил; морфолинил; пиперазинил или пиперазинил, необязательно замещенный C1-6 алкилом, C1-6 алкилоксикарбонилом или C1-6 алкилкарбонилом; каждый R5g независимо представляет собой C1-6 алкил;X представляет собой -NR1-; каждый Het независимо представляет собой пиридил, тиенил, фуранил, тиазолил; где каждый необязательно может быть замещен одним или двумя заместителями, каждый независимо выбранный изC1-6 алкила, галогена, гидрокси, циано, C1-6 алкилокси, C2-6 алкенила, замещенного галогеном, гидрокси или циано; каждый арил независимо представляет собой фенил или фенил, замещенный C1-6 алкилокси или аминосульфонилом. 2. Соединение по п.1, где соединение формулы (I) представлено формулой где R1, R4, R5, R6, R7 и R8 имеют значения, определенные в п.1. 3. Соединение по п.1, где R8 представляет собой радикал -CH=CH-CN. 4. Соединение по любому из пп.1-3, гдеR5 представляет собой -C(=O)NR5aR5b; где R5a независимо представляет собой водород или C1-6 алкил;-CH(OR5c)R5d; где R5c представляет собой водород и R5d представляет собой арил;R5e представляет собой водород или C1-6 алкил;R5f представляет собой C1-6 алкилокси; C2-6 алкенил или C1-6 алкил, замещенный гидрокси, C1-6 алкилокси, циано, амино, моно- или ди-C1-6 алкиламино, C1-6 алкилкарбониламино, арилом, пиридилом, тиенилом, фуранилом, диоксоланилом, необязательно замещенным двумя C1-6 алкильными радикалами, тетрагидрофуранилом, морфолинилом, C3-7 циклоалкилом; или 5. Соединение по любому из пп.1-4, где каждый арил независимо представляет собой фенил или фенил, замещенный C1-6 алкилокси. 6. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения формулы (I) по любому из пп.1-5, и фармацевтически премлемый носитель или разбавитель, и обладающая свойствами ингибирования репликации ВИЧ (вируса иммунодефицита человека).
МПК / Метки
МПК: C07D 401/04, C07D 401/12, A61K 31/506, C07D 403/06, C07D 405/12, C07D 409/12, A61K 31/505, C07D 239/48, A61P 31/18, C07D 417/06
Метки: 6-замещенные, вич, ингибирующие, пиримидины
Код ссылки
<a href="https://eas.patents.su/22-20772-6-zameshhennye-pirimidiny-ingibiruyushhie-vich.html" rel="bookmark" title="База патентов Евразийского Союза">6-замещенные пиримидины, ингибирующие вич</a>
Предыдущий патент: Гербицидно активные бициклические 1,3-дионы
Следующий патент: Производные тиенопиридона в качестве активаторов амр-активированной протеинкиназы (амрк)
Случайный патент: Способ нейтронного измерения для определения пористости формации вокруг ствола скважины












