Вич-ингибирующие 5,6-замещенные пиримидины
Номер патента: 20749
Опубликовано: 30.01.2015
Авторы: Гийемон Жером Эмиль Жорж, Шмитт Бенуа Антуан, Мордан Селин Изабелль
Формула / Реферат
1. Соединение формулы
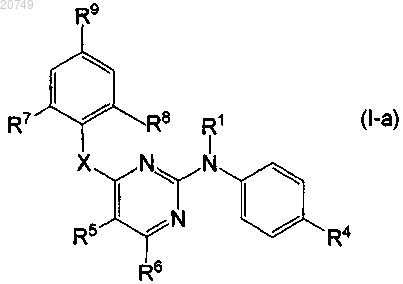
его фармацевтически приемлемая аддитивная соль, фармацевтически приемлемый сольват или стереохимически изомерная форма, где
каждый R1 независимо означает атом водорода; арил; формил; C1-6алкилкарбонил; С1-6алкил; С1-6алкилоксикарбонил;
R2 и R3 независимо означают атом водорода; гидрокси; атом галогена; С3-7циклоалкил; C1-6алкилокси; карбоксил; C1-6алкилоксикарбонил; циано; нитро; амино; моно- или ди(C1-6алкил)амино; полигалогенС1-6алкил; полигалогенС1-6алкилокси; C(=O)R10; C1-6алкил, необязательно замещенный атомом галогена, цианогруппой или -C(=O)R10; C2-6алкенил, необязательно замещенный атомом галогена, цианогруппой или
-С(=O)R10; C2-6алкинил, необязательно замещенный атомом галогена, цианогруппой или -C(=O)R10;
R7 и R8 независимо означают C1-6алкил;
R4 означает циано;
R9 означает C1-6алкил, C2-6алкенил или C2-6алкинил, каждый из которых замещен цианогруппой;
R5 означает C2-6алкенил или C2-6алкинил, оба замещенные цианогруппой, аминокарбонильной, моно- или ди(C1-6алкил)аминокарбонильной, арильной, пиридильной, тиенильной, фуранильной или одной или двумя C1-6алкилоксигруппами; или
R5 означает Het; -С(=O)NR5aR5b или -СН(OR5c)R5d;
где R5a означает C1-6алкилокси; C2-6алкенил; С3-7циклоалкил или C1-6алкил, замещенный гидрокси, амино, моно- или ди(С1-6алкил)амино, C1-6алкилкарбониламиногруппой, атомом галогена, циано, арильной, пиридильной, тиенильной, фуранильной, тетрагидрофуранильной, пирролидинильной, пиперидинильной, морфолинильной, пиперазинильной группой, пиперазинильной группой, необязательно замещенной C1-6алкилом, C1-6алкилкарбонилом или гидроксиС1-6алкилом; или
R5a означает C1-6алкил, замещенный одной или двумя С1-6алкилоксигруппами;
R5b означает атом водорода или C1-6алкил; или
R5a и R5b вместе с атомом азота, к которому они присоединены, образуют пирролидинил; пиперидинил, необязательно замещенный аминокарбонилом, гидрокси или C1-6алкилоксигруппой; морфолинил; пиперазинил; пиперазинил, необязательно замещенный C1-6алкилом, C1-6алкилкарбонилом или гидрокси-С1-6алкилом;
R5c означает атом водорода;
R5d означает C1-6алкил, С2-6алкенил, С2-6алкинил, арил или Het;
R6 означает С1-6алкоксиС1-6алкил;
каждый R10 независимо означает C1-6алкил, амино, моно- или ди(C1-6алкил)амино или полигалогенС1-6алкил;
X означает -NR1-, -O-;
каждый r независимо равен 1 или 2;
каждый Het независимо означает пиридил, тиенил, фуранил, тиазолил;
каждый арил независимо означает фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из C1-6алкила, C1-6алкилокси, аминосульфонила или полигалогенС1-6алкилокси.
2. Соединение по п.1, где R2 и R3 независимо означают атом водорода; атом галогена; C1-6алкил; цианогруппу.
3. Соединение по п.1, где R9 означает радикал -CH2-CH2-CN, -CH=CH-CN или -CºC-CN.
4. Соединение по п.3, где R9 означает радикал (Е)-CH=CH-CN.
5. Соединение по любому из пп.1-4, где R1 означает атом водорода.
6. Соединение по любому из пп.1-5, где R5 означает группу Het; -C(=O)NR5aR5b; -CH(OR5c)R5d; где
R5a означает C1-6алкилокси; C2-6алкенил; С3-7циклоалкил или С1-6алкил, замещенный моно- или ди(С1-6алкил)амино, C1-6алкилкарбониламино, циано, арилом, пиридилом, тиенилом, тетрагидрофуранилом, морфолинилом, пиперазинилом, пиперазинилом, необязательно замещенным C1-6алкилом или гидроксиС1-6алкилом; или R5a означает C1-6алкил, замещенный одним или двумя C1-6алкилоксигруппами;
R5b означает атом водорода или C1-6алкил; или
R5a и R5b вместе с атомом азота, к которому они присоединены, образуют пиперидинил, необязательно замещенный аминокарбонилом или гидроксигруппой; пиперазинил, необязательно замещенный C1-6алкилом или гидроксиС1-6алкилом;
R5c означает атом водорода;
R5d означает C1-6алкил, С2-6алкенил, арил, пиридил или тиазолил.
7. Соединение по любому из пп.1-6, где X означает -NH-.
8. Фармацевтическая композиция для лечения ВИЧ-инфекций, содержащая эффективное количество соединения формулы (I-а) по любому из пп.1-6 и носитель.
Текст
Настоящее изобретение относится к соединениям формулы (I-а). Изобретение также относится к фармацевтическим композициям для лечения ВИЧ-инфекций, содержащим эффективное количество указанного соединения в качестве активного ингредиента. Гийемон Жером Эмиль Жорж, Мордан Селин Изабелль (FR), Шмитт Бенуа Антуан (BE) Медведев В.Н. (RU) Настоящее изобретение относится к 5,6-замещенным производным пиримидинов, обладающим способностью ингибировать репликацию ВИЧ (вируса иммунодефицита человека), к их получению и фармацевтическим композициям, содержащим указанные соединения. Вначале лечение ВИЧ-инфекции представляло собой монотерапию, в которой использовали нуклеозидные производные, однако, несмотря на то, что указанные лекарственные средства успешно подавляли репликацию вируса, они быстро теряли свою эффективность вследствие появления устойчивых к лекарствам штаммов. Стало понятно, что высокая скорость мутации в сочетании с быстрой репликацией делают ВИЧ особенно сложной целью для антивирусной терапии. Введение комбинированной терапии с использованием двух или нескольких средств против ВИЧ улучшило терапевтический результат. Значительный прогресс был достигнут с разработкой HAART (высокоактивная антиретровирусная терапия),которая привела к мощному и длительному подавлению вируса. Как правило, HAART включает комбинацию нуклеозидных или нуклеотидных ингибиторов обратной транскриптазы (NRTI или NtRTI, соответственно) с ненуклеозидным ингибитором обратной транскриптазы (NNRTI) или ингибитором протеазы (PI). Современные методические руководства для антиретровирусной терапии рекомендуют подобную тройную комбинированную терапию в качестве схемы лечения даже в начальной стадии заболевания. Тем не менее, указанные терапии с использованием множества лекарственных средств не устраняют ВИЧ полностью, и длительное лечение обычно приводит к множественной лекарственной устойчивости. Было также показано, что устойчивый вирус передается вновь инфицированным индивидуумам, что приводит к существенному ограничению возможностей терапии для указанных пациентов, которые не получали ранее лекарственных препаратов. Таким образом, сохраняется потребность в новых комбинациях средств, которые эффективны против ВИЧ. Новые типы эффективных против ВИЧ-активных ингредиентов, различающихся по химической структуре и профилю активности, могут найти применение в новых типах комбинированной терапии. Таким образом, поиск подобных активных ингредиентов является задачей, которую чрезвычайно важно решить. Настоящее изобретение направлено на разработку совершенно новой серии пиримидиновых производных, обладающих способностью ингибировать репликацию ВИЧ. В WO 99/50250, WO 00/27825, WO 01/85700 и WO 06/035067 раскрыты некоторые классы замещенных аминопиримидинов, обладающих способностью ингибировать репликацию ВИЧ. Соединения по настоящему изобретению отличаются от известных из предшествующего уровня соединений своей структурой, фармакологической активностью и/или фармакологической эффективностью. Было обнаружено, что введение определенных заместителей в положение 5 и 6 определенным образом замещенных пиримидинов приводит к соединениям, которые оказывают благотворное действие не только благодаря своей способности ингибировать репликацию вируса иммунодефицита человека.(ВИЧ), но и благодаря своей повышенной способности ингибировать репликацию мутантных штаммов, в частности штаммов, которые приобрели устойчивость к одному или нескольким известным NNRTI лекарственным средствам, т.е. штаммам, которые называют штаммами ВИЧ, обладающими устойчивостью к лекарственным средствам или обладающими множественной лекарственной устойчивостью. Таким образом, настоящее изобретение касается соединений формулы их фармацевтически приемлемых аддитивных солей, фармацевтически приемлемых сольватов и стереохимически изомерных форм, где каждый R1 независимо означает атом водорода; арил; формил; C1-6 алкилкарбонил; C1-6 алкил; C1-6 алкилоксикарбонил;R2 и R3 независимо означают атом водорода; гидрокси; атом галогена; С 3-7 циклоалкил; C1-6 алкилокси; карбоксил; С 1-6 алкилоксикарбонил; циано; нитро; амино; моно- или ди(С 1-6 алкил)амино; полигалогенС 1-6 алкил; полигалогенС 1-6 алкилокси; C(=O)R10; C1-6 алкил, необязательно замещенный атомом галогена, цианогруппой или -C(=O)R10; С 2-6 алкенил, необязательно замещенный атомом галогена, цианогруппой или -C(=O)R10; С 2-6 алкинил, необязательно замещенный атомом галогена, цианогруппой илиR9 означает C1-6 алкил, C2-6 алкенил или C2-6 алкинил, каждый из которых замещен цианогруппой; но- или ди(С 1-6 алкил)аминокарбонильной, арильной, пиридильной, тиенильной, фуранильной или одной или двумя С 1-6 алкилоксигруппами; илиR5 означает Het; -С(=O)NR5aR5b или -СН(OR5c)R5d; где R5a означает C1-6 алкилокси; С 2-6 алкенил; С 3-7 циклоалкил или C1-6 алкил, замещенный гидрокси,амино, моно- или ди(С 1-6 алкил)амино, C1-6 алкилкарбониламиногруппой, атомом галогена, циано, арильной, пиридильной, тиенильной, фуранильной, тетрагидрофуранильной, пирролидинильной, пиперидинильной, морфолинильной, пиперазинильной группой, пиперазинильной группой, необязательно замещенной C1-6 алкилом, C1-6 алкилкарбонилом или гидроксиС 1-6 алкилом; илиR5a означает С 1-6 алкил, замещенный одной или двумя C1-6 алкилоксигруппами;R5b означает атом водорода или C1-6 алкил; илиR5a и R5b вместе с атомом азота, к которому они присоединены, образуют пирролидинил; пиперидинил, необязательно замещенный аминокарбонилом, гидрокси или C1-6 алкилоксигруппой; морфолинил; пиперазинил; пиперазинил, необязательно замещенный C1-6 алкилом, C1-6 алкилкарбонилом или гидроксиС 1-6 алкилом;X означает -NR1-, -О-; каждый r независимо равен 1 или 2; каждый Het независимо означает пиридил, тиенил, фуранил, тиазолил; каждый арил независимо означает фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из C1-6 алкила, C1-6 алкилокси, аминосульфонила,или полигалогенС 1-6 алкилокси. Как использовано выше или будет использовано ниже в настоящем описании, C1-6 алкил как группа или часть группы означает насыщенные углеводородные радикалы с прямой или разветвленной цепью,содержащие от 1 до 6 атомов углерода, такие как группа, определение которой дано для C1-4 алкила, и 1 пентил, 2-пентил, 1-гексил, 2-гексил, 3-гексил, 2-метилбутил, 3-метилпентил и т.п.; С 3-7 циклоалкил является общим термином для циклопропила, циклобутила, циклопентила, циклогексила и циклогептила. Предпочтительными из C1-6 алкилов являются C1-4 алкил или C1-2 алкил. Предпочтительными среди С 3-7 циклоалкилов являются циклопентил или циклогексил. Термин "C2-6 алкенил" как группа или часть группы определяет углеводородные радикалы с прямой или разветвленной цепью, имеющие насыщенные углерод-углеродные связи и по меньшей мере одну двойную связь и содержащие от 2 до 6 атомов углерода, такие как, например, этенил (или винил), 1 пропенил, 2-пропенил (или аллил), 1-бутенил, 2-бутенил, 3-бутенил, 2-метил-2-пропенил, 1-пентенил, 2 пентенил, 3-пентенил, 2-метил-1-бутенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 2-метил-2 пентенил, 1,2-диметил-1-бутенил и т.п. Предпочтительными являются С 2-6 алкенилы, содержащие одну двойную связь. Среди С 2-6 алкенильных радикалов интерес представляют С 2-4 алкенильные радикалы. Термин "С 3-6 алкенил" означает С 2-6 алкенил, ограниченный ненасыщенными углеводородными радикалами, содержащими от 3 до 6 атомов углерода. В том случае, когда С 3-6 алкенил соединен с гетероатомом, то атом углерода, связанный с гетероатомом, предпочтительно является насыщенным. Это, в частности, справедливо для С 3-6 алкенила, замещенного гидроксигруппой, где гидроксигруппа предпочтительно не связана с атомом углерода при двойной связи. Термин "С 2-6 алкинил" как группа или часть группы определяет углеводородные радикалы с прямой или разветвленной цепью, имеющие насыщенные углерод-углеродные связи и по меньшей мере одну тройную связь и содержащие от 2 до 6 атомов углерода, такие как, например, этинил, 1-пропинил, 2 пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 2-метил-2-пропинил, 1-пентинил, 2-пентинил, 3-пентинил,2-гексинил, 3-гексинил, 4-гексинил, 2-метил-2-бутинил, 2-метил-2-пентинил и т.п. Предпочтительными являются С 2-6 алкинилы, содержащие одну тройную связь. Среди С 2-6 алкинильных радикалов интерес представляют С 2-4 алкинильные радикалы. Термин "С 3-6 алкинил" означает С 2-6 алкинил, ограниченный ненасыщенными углеводородными радикалами, содержащими по меньшей мере одну тройную связь и от 3 до 6 атомов углерода. В том случае, когда С 3-6 алкинил соединен с гетероатомом, то атом углерода, связанный с гетероатомом, предпочтительно является насыщенным. Это, в частности, справедливо для С 3-6 алкинила, замещенного гидроксигруппой, где гидроксигруппа предпочтительно не связана с атомом углерода при тройной связи. Как использовано в настоящем описании, термин (=O) относится к карбонильному фрагменту, если он присоединен к атому углерода, сульфоксидному фрагменту, если он присоединен к атому серы, и сульфонильному фрагменту, если два таких члена присоединены к атому серы. Термин карбоксил, карбокси или гидроксикарбонил относится к группе -СООН. Термин "галоген" является общим термином для фтора, хлора, брома или йода. Термин "полигалогенС 1-6 алкил" как группа или часть группы, например, в полигалогенС 1-6 алкокси,означает моно- или полигалогенсодержащий С 1-6 алкил, замещенный вплоть до одного, двух, трех, четырех, пяти, шести или более атомами галогена, такой как метил или этил с одной или несколькими атомами фтора, например дифторметил, трифторметил, трифторэтил. Предпочтительным является трифторметил. Включены также перфторС 1-6 алкильные группы, представляющие собой С 1-6 алкильные группы, в которых все атомы водорода замещены атомами фтора, например пентафторэтил. В том случае, если к алкильной группе, подпадающей под определение полигалогенС 1-6 алкила, присоединено несколько атомов галогена, то атомы галогена могут быть одинаковыми или различными. Следует понимать, что любой из приведенных в определении Het гетероциклов включает любой изомер, такой как, например, тиадиазол, который может быть 1,2,4-тиадиазолом, 1,3,4-тиадиазолом или 1,2,3-тиадиазолом. Группа Het может быть тиазолилом, который преимущественно представляет собой 1,3-1,3-тиазолил. Любой из пирролидинила, пиперидинила, морфолинила, пиперазинила, в частности пиперазинил,присоединен к остальной части молекулы посредством своего атома азота. Любой пиперазинил, замещенный, например, С 1-6 алкилом, C1-6 алкилкарбонилом или гидроксиС 1-6 алкилом, предпочтительно замещен по атому азота, посредством которого пиперазин не присоединен к остальной части молекулы (во многих случаях атом азота 4). В одном варианте осуществления каждый Het независимо означает пиридил, тиенил, фуранил или тиазолил. Всякий раз, когда радикал появляется в определении соединений формулы (I-а) или в любой из подгрупп, для которых дано определение в настоящем описании, указанный радикал независимо является таким, как указано выше в определении для соединений формулы (I-а) или в более конкретных определениях, приведенных в настоящем описании. Следует также отметить, что положение радикала в любом фрагменте молекулы, который используют в определениях, может быть любым в подобном фрагменте, при условии, что он является химически стабильным. Например, пиридин включает 2-пиридин, 3-пиридин и 4-пиридин; пентил включает 1 пентил, 2-пентил и 3-пентил. В том случае, когда любая переменная (например, атом галогена, С 1-6 алкил, арил, Het и т.п.) встречается в любом фрагменте несколько раз, то каждое определение является независимым. Следует понимать, что любые ограниченные определения радикалов, указанных в настоящем определении, применимы для группы соединений формулы (I-а), а также к любой подгруппе, которая определена или указана в настоящем описании. Линии, которые ведут от заместителей в сторону кольцевой системы, указывают на то, что данная связь может быть образована с любым из подходящих атомов кольца. Фармацевтически приемлемые кислотно-аддитивные солевые формы, которые способны образовывать соединения по настоящему изобретению, легко могут быть получены при использовании подходящих кислот, таких как, например, неорганические кислоты, такие как галогеноводородные кислоты, в частности хлористо-водородная или бромисто-водородная кислота, серная, гемисерная, азотная, фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, аспарагиновая,додецилсерная, гептановая, гексановая, никотиновая, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, паминосалициловая, памовая и подобные кислоты. Соответственно, указанные кислотно-аддитивные солевые формы могут быть преобразованы в форму свободного основания обработкой подходящим основанием. Соединения формулы (I-а), содержащие кислые атомы водорода, могут быть преобразованы в их фармацевтически приемлемые соли металлов или аддитивные соли аминов обработкой подходящими органическими и неорганическими основаниями. Подходящие солевые формы оснований представляют собой, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, в частности соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, в частности соли первичных, вторичных и третичных алифатических и ароматических аминов, таких как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, соли бензатина, Nметил-D-глюкамина, 2-амино-2-(гидроксиметил)-1,3-пропандиола, гидрабамина и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Соответственно, солевая форма может быть преобразована в свободную кислотную форму обработкой кислотой. Термин "фармацевтически приемлемый сольват" означает гидраты и формы присоединения растворителя, включая их стереоизомерные формы, которые могут образовывать соединения формулы (I-а). Примерами подобных сольватов являются, например, гидраты, алкоголяты, такие как метаноляты, этаноляты, изопропаноляты, н-пропаноляты и т.п. Соединения формулы (I-а) могут содержать один или несколько хиральных центров и могут суще-3 020749 ствовать в стереохимически изомерных формах. Особый интерес представляют такие соединения формулы (I-а), которые являются стереохимически чистыми. Термин "стереохимически изомерные формы" в настоящем описании означает все возможныестереохимические формы соединений формулы (I-а), их фармацевтически приемлемые аддитивные соли и их фармацевтически приемлемые сольваты. Если специально не оговорено или не указано иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, при этом указанные смеси включают все диастереомеры и энантиомеры базовой молекулярной структуры, а также каждую из индивидуальных изомерных форм формулы (I-а), ее фармацевтически приемлемые аддитивные соли и ее фармацевтически приемлемые сольваты в практически чистой форме, т.е. она содержит менее чем 10%, предпочтительно содержит менее чем 5%, в частности, содержит менее чем 2% и наиболее предпочтительно содержит менее чем 1% других изомеров. Таким образом, когда соединение формулы (I-а) обозначено как (Е), то это означает,что указанное соединение практически не содержит Z-изомер. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители при двухвалентных циклических (частично) насыщенных радикалах могут иметь как цис-, так и транс-конфигурацию. Соединения, имеющие двойные связи, могут иметь стереохимию Е (против) или Z (вместе) при указанной двойной связи. Термины цис, транс, R, S, Е и Z хорошо известны специалистам в данной области. Некоторые соединения формулы (I-а) могут также существовать в таутомерной форме. Следует понимать, что такие формы, хотя они не указаны подробно в вышеприведенной формуле, включены в объем настоящего изобретения. Следует также понимать, что настоящее изобретение включает любые изотопы атомов, присутствующих в соединениях по настоящему изобретению. Например, изотопы водорода включают тритий и дейтерий, и изотопы углерода включают изотопы С-13 и С-14. Следует понимать, что всякий раз, когда они используются в настоящем описании, термины "соединения формулы (I-а)", "настоящие соединения", "соединения по настоящему изобретению" или любые эквивалентные термины и, аналогично, термины "подгруппы соединений формулы (I-а)", "подгруппы настоящих соединений", "подгруппы соединений по настоящему изобретению" или любые эквивалентные термины включают соединения общей формулы (I-а) или подгруппы соединений общей формулы (I-а), а также их соли, сольваты и стереоизомеры. Всякий раз, когда в настоящем описании указано, что каждый из заместителей может быть независимо выбран из списка определений, как, например, для R1 и R5d, то следует понимать, что в них включены любые возможные комбинации, которые химически возможны или которые приводят к молекулам такой химической стабильности, что они могут подвергаться обработке с использованием обычных фармацевтических способов. В предпочтительном варианте осуществления R2 и R3 независимо означают атом водорода; атом галогена; С 1-6 алкил; цианогруппу. В предпочтительном варианте осуществления R9 в соединениях формулы (I-а) означает -CH2-CH2CN или -CH=CH-CN, или R9 означает -CH=CH-CN. Особый интерес представляют такие указанные в настоящем описании соединения формулы (I-а),где R9 означает -CH=CH-CN и где заместители у фрагмента -СН=СН- находятся в Е-конфигурации (т.е. представляют собой так называемые Е-изомеры). Особый интерес представляют такие указанные в настоящем описании соединения формулы (I-а), где R9 означает (Е)-CH=CH-CN. Вариантами осуществления настоящего изобретения являются такие соединения формулы (I-а), гдеR1 означает атом водорода. Другими вариантами осуществления настоящего изобретения являются такие соединения формулыR5a означает С 1-6 алкилокси; С 2-6 алкенил; С 3-7 циклоалкил или С 2-6 алкил, замещенный моно- или ди(С 1-6 алкил)амино, C1-6 алкилкарбониламино, циано, арилом, пиридилом, тиенилом, тетрагидрофуранилом, морфолинилом, пиперазинилом, пиперазинилом, необязательно замещенным С 1-6 алкилом или гидроксиС 1-6 алкилом; или R5a означает С 1-6 алкил, замещенный одним или двумя С 1-6 алкилоксигруппами;R5b означает атом водорода или С 1-6 алкил; илиR5a и R5b вместе с атомом азота, к которому они присоединены, образуют пиперидинил, необязательно замещенный аминокарбонилом или гидроксигруппой; пиперазинил, необязательно замещенный С 1-6 алкилом или гидроксиС 1-6 алкилом;R5d означает С 1-6 алкил, С 2-6 алкенил, арил, пиридил или тиазолил. Вариантами осуществления настоящего изобретения являются такие соединения формулы (I-а), гдеX означает -NH-. Соединения формулы (I-а) можно получить путем образования мостиковой связи X либо путем взаимодействия соединения (IV-a) и соединения (V-a) или взаимодействия соединения (IV-b) и соединения(V-b), как показано на следующей схеме. На данной схеме реакции W означает подходящую уходящую группу, которая определена выше. Уходящую группу W в соединении (V-a) можно ввести in situ, в частности, преобразовывая соответствующую функциональную гидроксигруппу в уходящую группу, например, с помощью POCl3. X1 означает-NR1-, -О-. В том случае, когда X1 означает -NR1-, вышеуказанные реакции преимущественно проводят в присутствии третичного аминного основания, в частности триэтиламина. В том случае, когда X1 означает О, вышеуказанные реакции проводят в присутствии основания, такого как, например, K2CO3 или третбутоксид калия (KOt-Bu). Некоторые промежуточные соединения и исходные вещества являются известными соединениями и коммерчески доступны или могут быть получены в соответствии с известными в данной области способами. Промежуточные соединения (V-a) и (V-b) могут быть получены следующим образом:X1 в соединении (XVI) преимущественно защищена, в частности, в том случае, когда X1 означает амин, с помощью ацетильной, бутоксикарбонильной или бензильной группы, и в том случае, когда X1 означает О, с помощью метильной, бензильной или трет-бутильной группы. После реакции с соединением (XVI) защитную группу удаляют и получают соединение (V-b). Взаимодействие соединения (XV) или соединения (XVII) с соединением (XVI) проводят в инертном по отношению к реакции растворителе, обычно в присутствии основания. Соединения формулы (I-а), где R1 означает C1-6 алкилоксикарбонил, могут быть преобразованы в соединение формулы (I-а), где R1 означает атом водорода, взаимодействием с подходящим основанием,таким как, например, гидроксид или метоксид натрия. В том случае, когда R1 означает третбутоксикарбонил, соответствующие соединения, где R1 означает атом водорода, можно получить обработкой трифторуксусной кислотой. Некоторые из соединений формулы (I-а) и некоторые из промежуточных соединений по настоящему изобретению могут содержать асимметричный атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений могут быть получены с помощью известных в данной области способов. Например, диастереоизомеры могут быть разделены физическими методами, такими как избирательная кристаллизация, или хроматографическими методами, например противоточное распространение, жидкостная хроматография и аналогичные методы. Энантиомеры можно получить из рацемических смесей, преобразуя сначала указанные рацемические смеси с помощью подходящих расщепляющих агентов, таких как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем физически разделяют указанные смеси диастереомерных солей или соединений с помощью, например, избирательной кристаллизации или хроматографическими методами, например, жидкостной хроматографией и аналогичными методами; и, наконец, преобразовывают указанные разделенные диастереомерные соли или соединения в соответствующие энантиомеры. Чистые стереохимически изомерные формы также могут быть получены из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных веществ, при условии, что происходящие реакции протекают стереоспецифично. Альтернативный способ разделения энантиомерных форм соединений формулы (I-а) и промежуточных соединений включает жидкостную хроматографию, в частности, жидкостную хроматографию с использованием хиральной неподвижной фазы. Некоторые промежуточные соединения и исходные вещества являются известными соединениями и коммерчески доступны или могут быть получены в соответствии с известными в данной области способами. Соединения формулы (I-а) обладают антиретровирусными свойствами (ингибирующим действием по отношению к обратной транскриптазе), в частности, против ВИЧ, который является этиологическим агентом синдрома приобретенного иммунодефицита (СПИД) у людей. Вирус ВИЧ преимущественно заражает Т-4 клетки человека и разрушает их или изменяет их нормальную функцию, в особенности координирующую функцию иммунной системы. В результате у зараженного пациента постоянно уменьшается количество Т-4 клеток, которые, кроме этого, ведут себя аномально. Как следствие, иммунная защитная система не способна противостоять инфекциям и неоплазмам, и ВИЧ-инфицированный субъект обычно умирает от условно-патогенных инфекций, таких как пневмония или раковые образования. Другие условия, связанные с ВИЧ инфекцией, включают тромбоцитопению, саркому Капоши и инфекцию центральной нервной системы, которая характеризуется прогрессирующей демиелинизацией, приводящей к слабоумию и к таким симптомам, как прогрессирующая дисартрия, атаксия и дезориентировка. ВИЧ инфекция также связана с периферической невропатией, прогрессирующей генерализованной лимфаденопатией (PGL) и СПИД-ассоциированным комплексом (ARC). Соединения по настоящему изобретению обладают также активностью в отношении обладающих лекарственной устойчивостью и обладающих множественной лекарственной устойчивостью штаммам ВИЧ, в частности, обладающим множественной лекарственной устойчивостью штаммам ВИЧ; в частности, соединения по настоящему изобретению обладают активностью против штаммов ВИЧ, которые приобрели устойчивость к одному или нескольким известным в данной области ненуклеозидным ингибиторам обратной транскриптазы, в частности, к таким ненуклеозидным ингибиторам обратной транскриптазы, которые одобрены для лечения, таким как эфавиренз, делавирдин и невирапин. Благодаря их антиретровирусным свойствам, в частности их анти-ВИЧ свойствам, соединения формулы (I-а), их фармацевтически приемлемые аддитивные соли и их стереохимически изомерные формы пригодны при лечении ВИЧ-инфицированных индивидов и профилактике указанных инфекций. Соединения по настоящему изобретению могут также найти применение для лечения теплокровных животных, инфицированных вирусами, существование которых опосредуется или зависит от фермента обратной транскриптазы. Состояния, которые можно предотвратить или лечить с помощью соединений по настоящему изобретению, в частности, состояний, связанных с ВИЧ и другими патогенными ретровирусами, включают СПИД, СПИД-ассоциированный комплекс (ARC), прогрессирующую генерализованную лимфаденопатию (PGL), а также хронические заболевания центральной нервной системы, вызванные ретровирусами, такие как, например, ВИЧ-опосредованное слабоумие и рассеянный склероз. Соединения по настоящему изобретению и любые их подгруппы могут, таким образом, применяться в качестве лекарственных средств против указанных выше состояний. Указанное применение в качестве лекарственных средств или способы лечения включают введение ВИЧ-инфицированным субъектам количества лекарственного средства, эффективного для борьбы с состояниями, связанными с ВИЧ и другими патогенными ретровирусами, особенно с ВИЧ-1. В частности, соединения формулы (I-а) могут применяться при производстве лекарственных средств для лечения или предупреждения ВИЧ-инфекций. В соответствии с другим аспектом настоящего изобретения, предлагается способ лечения теплокровных животных, включая людей, пораженных вирусными инфекциями, или способ предотвращения поражения теплокровных животных, включая людей, вирусными инфекциями, особенно ВИЧинфекциями. Указанный способ включает введение, предпочтительно, пероральное введение эффективного количества соединения формулы (I-а), его фармацевтически приемлемой аддитивной соли, его фармацевтически приемлемого сольвата или его возможной стереоизомерной формы теплокровным животным, включая людей. В настоящем изобретении предлагаются также композиции для лечения вирусных инфекций, которые содержат эффективное количество соединения формулы (I-а) и фармацевтически приемлемый носитель или разбавитель. Соединения по настоящему изобретению или любую их подгруппу можно получить для введения в виде различных фармацевтических форм. В качестве подходящих композиций можно привести все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения,необязательно в форме аддитивной соли, в качестве активного ингредиента тщательно смешивают с фармацевтически приемлемым носителем, при этом носитель имеет весьма разнообразные формы в зависимости от требуемой для введения формы препарата. Желательно, чтобы указанные фармацевтиче-6 020749 ские формы представляли собой единичную дозированную форму, пригодную, в частности, для перорального введения, ректального, подкожного введения или для парентеральной инъекции. Например, при изготовлении композиций в виде пероральной дозированной формы могут использоваться любые обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, лубриканты, связующие вещества, разрыхлители и т.п., в случае порошков, пилюль, капсул и таблеток. Благодаря легкости их введения таблетки и капсулы являются наиболее удобными пероральными единичными дозированными формами, и в этом случае, очевидно, используются твердые фармацевтические носители. Для парентеральных композиций носители, по меньшей мере, в значительной степени, обычно представляют собой стерильную воду, хотя могут быть включены другие ингредиенты, например вещества, улучшающие растворимость. Могут быть приготовлены, например, растворы для инъекций, в которых носителем является солевой раствор,раствор глюкозы или смесь солевого раствора и раствора глюкозы. Могут быть также приготовлены суспензии для инъекций, и в этом случае могут использоваться соответствующие жидкие носители, суспендирующие средства и т.п. Также включены препараты в твердой форме, которые непосредственно перед применением можно преобразовать в препараты в жидкой форме. В композициях, подходящих для подкожного введения, носитель необязательно включает усиливающее проникновение средство и/или подходящее смачивающее вещество, необязательно в комбинации с небольшими количествами подходящих добавок любых химических соединений, при этом указанные добавки не оказывают значительного вредного воздействия на кожу. Указанные добавки могут облегчить нанесение композиций на кожу и/или могут быть полезными при приготовлении требуемых композиций. Указанные композиции можно вводить различными способами, например, в виде чрескожного пластыря, в виде точечного пластыря, в виде мази. Соединения по настоящему изобретению можно также вводить путем ингаляции или инсуффляции с помощью способов и составов, которые используются в данной области для введения лекарственных препаратов указанным путем. Таким образом, в общем случае, соединения по настоящему изобретению можно вводить в легкие в форме раствора, суспензии или в виде сухого порошка. Для введения соединений по настоящему изобретению подходит любое устройство, разработанное для доставки растворов,суспензий или сухих порошков посредством пероральной или назальной ингаляции или посредством инсуффляции. С точки зрения простоты введения и однородности дозировки наиболее удобно составлять вышеуказанные фармацевтические композиции в виде единичной дозированной формы. Единичная дозированная форма в настоящем описании означает физически дискретную единицу, подходящую для единичных дозировок, при этом каждая единица содержит определенное количество активного ингредиента,которое по расчету способно оказать желаемое терапевтическое действие, в комбинации с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки(включая таблетки с насечками или таблетки, покрытые оболочкой), капсулы, пилюли, пакетики с порошком, облатки, суппозитории, растворы или суспензии для инъекций и т.п., и их разделенные отдельные части. Специалисты в области лечения ВИЧ-инфекции смогут определить эффективное суточное количество из результатов испытаний, приведенных в настоящем описании. В общем случае предполагается,что эффективное суточное количество составляет от 0,01 до 50 мг/кг массы тела, более предпочтительно от 0,1 до 10 мг/кг массы тела. Может быть удобным вводить требуемую дозу в виде двух, трех, четырех или большего количества субдоз через определенные интервалы в течение суток. Указанные субдозы можно приготовить в виде единичных дозированных форм, содержащих, например, от 1 до 1000 мг и, в частности, от 5 до 200 мг активного ингредиента на единичную дозированную форму. Точная дозировка и частота введения зависят от конкретного используемого соединения формулы(I-а), конкретного состояния, лечение которого проводят, тяжести состояния, лечение которого проводят,возраста, массы и общего физического состояния конкретного пациента, а также от другого лечения, которое может получать индивидуум, что хорошо известно специалистам в данной области. Кроме того,очевидно, что указанное эффективное суточное количество может быть уменьшено или увеличено в зависимости от ответной реакции субъекта, которого подвергают лечению, и/или в зависимости от оценки врача, который предписывает соединения по настоящему изобретению. Поэтому вышеуказанные эффективные суточные количества приведены в данном описании только для справки, и следует понимать, что они каким-либо образом не ограничивают объем или применение настоящего изобретения. Соединения формулы (I-а) по настоящему изобретению могут использоваться самостоятельно или в комбинации с другими терапевтическими средствами, такими как антивирусные препараты, антибиотики, иммуномодуляторы или вакцины для лечения вирусных инфекций. Они могут также использоваться самостоятельно или в комбинации с другими профилактическими средствами для предотвращения вирусных инфекций. Соединения по настоящему изобретению могут использоваться в вакцинах и способах защиты индивидуумов против вирусных инфекций в течение длительного периода времени. Указанные соединения могут использоваться в подобных вакцинах как индивидуально, так и вместе с другими со-7 020749 единениями по настоящему изобретению или вместе с другими антивирусными средствами в соответствии со способами, которые совместимы с обычными способами применения ингибиторов обратной транскриптазы в вакцинах. Таким образом, соединения по настоящему изобретению можно комбинировать с фармацевтически приемлемыми вспомогательными средствами, которые обычно используются в вакцинах и которые вводят в профилактически эффективном количестве, с целью защитить индивидуума от ВИЧ инфекции в течение длительного времени. Также при лечении может использоваться комбинация одного или нескольких дополнительных антиретровирусных соединений и соединений формулы (I-а). Таким образом, настоящее изобретение относится также к продукту, содержащему (а) соединение формулы (I-а) и (b) одно или несколько дополнительных антиретровирусных соединений в виде комбинированного препарата для одновременного, раздельного или последовательного применения при проведении анти-ВИЧ лечения. Различные лекарственные средства можно объединять в одном препарате вместе с фармацевтически приемлемыми носителями. Указанные другие антиретровирусные соединения могут быть любыми известными антиретровирусными соединениями, такими как сурамин, пентамидин, тимопентин, кастаноспермин, декстран(сульфат декстрана), фоскарнет-натрий (тринатрий фосфоноформиат); нуклеозидные ингибиторы обратной транскриптазы (NRTI), например зидовудин (AZT), диданосин (ddl), зальцитабин (ddC), ламивудин(ЗТС), ставудин (d4T), эмтрицитабин (FTC), абакавир (ABC), амдоксовир (DAPD), элвуцитабин (АСН 126443), AVX 754 -)-dOTC), фоцивудин тидоксил (FZT), фосфазид, HDP-990003, КР-1461, MIV-210,рацивир (PSI-5004), UC-781 и т.п.; ненуклеозидные ингибиторы обратной транскриптазы (NNRTI), такие как делавирдин (DLV), эфавиренц (EFV), невирапин (NVP), дапивирин (ТМС 120), этравирин (ТМС 125),рилпивирин (ТМС 278), DPC-082, (+)-каланолид A, BILR-355 и т.п.; нуклеотидные ингибиторы обратной транскриптазы (NtRTI), например, тенофовир R)-РМРА) и тенофовир дизопроксил фумарат (TDF) и т.п.; нуклеотид-конкурентные ингибиторы обратной транскриптазы (NcRTI), например, NcRTI-I и т.п.; ингибиторы транс-активирующих белков, такие как ТАТ-ингибиторы, в частности RO-5-3335, BI-201 и т.п.; REV ингибиторы; ингибиторы протеазы, например ритонавир (RTV), саквинавир (SQV), лопинавир(АВТ-378 или LPV), индинавир (IDV), ампренавир (VX-478), ТМС 126, нелфинавир (AG-1343), атазанавир (BMS 232632), дарунавир (ТМС 114), фосампренавир (GW433908 или VX-175), бреканавир (GW640385, VX-385), P-1946, PL-337, PL-100, типранавир (PNU-140690), AG-1859, AG-1776, Ro-0334649 и т.п.; ингибиторы проникновения, которые включают ингибиторы слияния (например, энфувиртид (Т 20, ингибиторы присоединения и ингибиторы совместного рецептора, при этом последние включают антагонисты CCR5 (например, анкривирок, CCR5mAb004, маравирок (UK-427857), PRO-140, TAK-220,TAK-652, викривирок (SCH-D, SCH-417690 и антагонистов CXR4 (например, AMD-070, KRH-27315),примерами ингибиторов проникновения являются PRO-542, TNX-355, BMS-488043, BlockAide/CR,FP21399, hNMOl, нонакин, VGV-1; ингибитор созревания, например, РА-457; ингибиторы вирусной интегразы, например, ралтегравир (MK-0518), элвитегравир (JTK-303, GS-9137), BMS-538158; рибозимы; иммуномодуляторы; моноклональные антитела; генную терапию; вакцины; siRNA; антисмысловые РНК; микробициды; ингибиторы цинксодержащей кольцеобразной области в ДНК. Комбинации могут давать синергический эффект, при этом вирусная инфекция и связанные с ней симптомы могут предотвращаться, существенно уменьшаться или полностью устраняться. Соединения по настоящему изобретению можно также вводить в комбинации с иммуномодуляторами (такими как, например, бропиримин, антитело против альфа-интерферона человека, IL-2, метионин энкефалин, интерферон альфа, налтрексон), с антибиотиками (такими как, например, пентамидин изотиорат), цитокинами (например, с Th2), модуляторами цитокинов, хемокинами или модуляторами хемокинов, рецепторами хемокинов (такими как, например, CCR5, CXCR4), модуляторами рецепторов хемокинов или гормонами (например, с гормоном роста), с целью ослабить, лечить или устранять ВИЧ инфекцию и ее симптомы. Указанные комбинированные терапии с использованием различных препаратов могут вводиться одновременно, последовательно или независимо друг от друга. Альтернативно, подобные комбинации можно вводить в виде одного препарата, при этом активные ингредиенты высвобождаются из препарата одновременно или раздельно. Соединения по настоящему изобретению можно также вводить в комбинации с модуляторами метаболизма после применения лекарственного средства для индивидуума. Указанные модуляторы включают соединения, которые мешают метаболизму в цитохромах, таких как цитохрома Р 450. Известно, что существует несколько коферментов цитохромы Р 450, одной из которых является цитохромома Р 450 3 А 4. Ритонавир является примером модулятора метаболизма посредством цитохромы Р 450. Подобные комбинированные терапии в виде различных препаратов могут вводиться одновременно, последовательно или независимо друг от друга. Альтернативно, подобная комбинация может вводиться в виде одного препарата, при этом активные ингредиенты высвобождаются из препарата одновременно или раздельно. Подобные модуляторы могут вводиться в том же самом или в различном соотношении с соединениями по настоящему изобретению. Массовое отношение подобного модулятора к соединениям по настоящему изобретению (модулятор:соединение по настоящему изобретению), преимущественно составляет 1:1 или меньше, предпочтительно составляет 1:3 или меньше, более предпочтительно составляет 1:10 или меньше и наиболее предпочтительно составляет 1:30 или меньше. Хотя в настоящем изобретении основное внимание уделено использованию соединений по настоящему изобретению для предупреждения или лечения ВИЧ-инфекций, соединения по настоящему изобретению могут также использоваться в качестве ингибирующих средств для других вирусов, мультипликация которых зависит от обратных транскриптаз. Следующие примеры предназначены для иллюстрации настоящего изобретения и не ограничивают его объем. Пример 1. Смесь 4-цианоанилина (0,420 моль) в 2-метоксиэтиловом эфире (250 мл) перемешивают при 100 С в течение 30 мин. Затем порциями в течение 45 мин добавляют смесь цианамида (0,630 моль) в воде (30 мл). Смесь перемешивают при 100 С еще в течение 45 мин и снова добавляют цианамид (0,210 моль). Смесь затем перемешивают при 100 С в течение 48 ч, затем упаривают досуха. Остаток перекристаллизовывают из ацетона с получением 70,5 г соединения А (выход 85%, т.пл. 225 С). К раствору промежуточного соединения А (0,0102 моль), полученного по примеру 1, в этаноле (25 мл) добавляют этоксид натрия (21%) (0,0153 моль, 1,5 экв.), с последующим добавлением метил 4 метоксиацетоацетата (0,0102 моль, 1 экв.). Полученную смесь перемешивают при кипячении с обратным холодильником в течение 6 ч и затем охлаждают до комнатной температуры. Добавляют воду и смесь подкисляют уксусной кислотой (до рН=6). Образовавшийсяосадок отфильтровывают, с получением 1,5 г промежуточного соединения В (выход 57%). Смесь соединения В (0,0056 моль) и оксихлорида фосфора (10 мл) перемешивают при кипячении с обратным холодильником в течение 30 мин. Охлаждают и оксихлорид фосфора отгоняют. Добавляют воду и 10%-ный K2CO3 и смесь экстрагируют CH2Cl2. Органический слой сушат над сульфатом магния,фильтруют и растворитель упаривают, получая 1,51 г соединения С (выход 97%). Смесь промежуточного соединения С(0,00182 моль) и 3-(4-амино-3,5-диметилфенил)акрилонитрила (0,00182 моль) нагревают до температуры конденсации в течение 5 мин, затем выливают в воду и 10%-ный раствор K2CO3. Полученную смесь экстрагируют CH2Cl2. Органический слой сушат над сульфатом магния, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (35-70 мкм; элюент: CH2Cl2/метанол 97:3). Очищенные фракции собирают и растворитель упаривают, получая 0,34 г промежуточного соединения D (выход 46%, т.пл. 115 С). К раствору промежуточного соединения D (15,3 г, 37,2 ммоль) в метаноле (500 мл) и воды (75 мл) добавляют СаСО 3 (44,7 ммоль, 1,2 экв.) и затем по каплям добавляют хлорид йода (74,5 ммоль, 2 экв.). Полученную смесь перемешивают при комнатной температуре в течение 72 ч. Добавляют насыщенный раствор Na2S2O3 и смесь перемешивают в течение 30 мин. Метанол упаривают и полученную смесь экстрагируют этилацетатом. Органические слои объединяют, сушат над MgSO4 и фильтруют. Растворитель упаривают и полученную смесь Е используют без очистки в следующей реакции (20,6 г, выход 100%). К раствору промежуточного соединения Е (0,25 г, 0,37 ммоль) в смеси 5:1 1,2 диметоксиэтан/метанол (18 мл) последовательно добавляют 4-метокси-3-пиридинилбороновую кислоту(1,4 ммоль, 3 экв.), тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) (0,094 ммоль, 0,2 экв.) и 2 н раствор K2CO3 (2,4 ммоль, 5 экв.). Полученную смесь оставляют в течение ночи перемешиваться при кипячении с обратным холодильником. Добавляют 10%-ный раствор K2CO3, смесь фильтруют через рыхлый слой целлита и промывают CH2Cl2. Остаток экстрагируют смесью CH2Cl2/тетрагидрофуран. Органические слои объединяют, сушат над MgSO4 и фильтруют. Растворитель упаривают и полученную смесь очищают колоночной хроматографией (5 мкм; элюент: CH2Cl2/метанол/NH4OH от 99:1:0,1 до 95:5:0,5), с получением 0,151 г соединения 1 (выход 62%, т.пл. 120 С). В приведенной ниже и последующих таблицах связь, отмеченная значком означает связь, посредством которой радикал связывается с остальной молекулой. Me и Et относятся к метилу и этилу соответственно. Таблица 1 К раствору промежуточного соединения Е (14 г, 0,026 моль) в этаноле (100 мл) добавляют бис(трифенилфосфин)палладий(II)хлорид (PdCl2(PPh3)2) (0,00522 моль, 0,2 экв.) и триэтиламин (0,0112 моль, 4,3 экв.). Полученную смесь в течение 48 ч нагревают при 110 С в атмосфере монооксида углерода при давлении 25 бар (2,5 МПа). Затем смесь фильтруют через рыхлый слой целлита и промывают тетрагидрофураном. После упаривания растворителя полученную смесь очищают колоночной хроматографией (20-45 мкм; элюент: CH2Cl2/метанол 99:1), с получением 10,65 г промежуточного соединения F (выход 85%, т.пл. 156 С). К раствору соединения F (5,4 г, 0,0112 моль) в смеси тетрагидрофуран/H2O (50 мл/15 мл) добавляют моногидрат LiOH (0,0559 моль, 5 экв.). Полученную смесь оставляют перемешиваться в течение ночи при комнатной температуре. Затем тетрагидрофуран упаривают, добавляют воду и смесь подкисляют до рН 1 3 н раствором HCl. Осадок затем отфильтровывают и сушат в вакууме, получая 4,55 г промежуточного соединения G (выход 89%, т.пл. 220 С), которое используют на следующей стадии без дальнейшей очистки. К раствору промежуточного соединения G (0,15 г, 0,33 ммоль) в смеси 1:1 тетрагидрофуран/СН 2 С 12(0,5 ммоль, 1,5 экв.), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI) (0,5 ммоль),1,5 экв.) и триэтиламин (0,5 ммоль, 1,5 экв.). Полученную смесь оставляют перемешиваться в течение ночи при комнатной температуре. К смеси добавляют 10%-ный раствор K2CO3 и остаток экстрагируют получают соединения, приведенные в табл. 4. Исходные соединения указанной выше формулы J получают, следуя методике, аналогично приведенной в примере 1, однако при осуществлении преобразования из С в D производное анилина заменяют соответствующим фенолом. Таблица 4 Смесь промежуточного соединения Е (0,00372 моль), ацетата палладия (0,000746 моль, 0,2 экв.),формиата натрия (0,0111 моль, 3 экв.) и некоторое количество MgSO4 в диметилформамиде оставляют перемешиваться в течение ночи при 100 С в атмосфере монооксида углерода при давлении 30 бар (3 МПа). Смесь выливают в воду. Осадок отфильтровывают и сушат. Неочищенный продукт очищают хроматографией на силикагеле (элюент: CH2Cl2/метанол/NH4OH 99/1/0,1; 15-40 мкМ). Чистые фракции собирают и растворитель упаривают. Выход 0,410 г (25%) промежуточного соединения L. Способ А. К смеси промежуточного соединения L (0,0008 моль) в 15 мл тетрагидрофурана в атмосфере азота при -78 С добавляют метилмагнийхлорид (0,00279 моль, 3,5 экв.). Смесь перемешивают при -78 С в течение 2 ч и затем оставляют перемешиваться в течение ночи при комнатной температуре. Реакционную смесь выливают в 10%-ный раствор NH4Cl и экстрагируют CH2Cl2. Органический слой сушат надMgSO4, фильтруют и растворитель упаривают. Неочищенный продукт очищают хроматографией на силикагеле (элюент: CH2Cl2/метанол/NH4OH; от 99:1:0,1 до 95:5:0,5). Чистые фракции собирают и растворитель упаривают. Выход 0,045 г (12%, 213 С) соединения 37. Способ В. В атмосфере азота при -78 С по каплям добавляют н-бутиллитий (1,14 мл, 3,5 экв.) к раствору тиазола (0,00159 моль, 3,5 экв.) в 10 мл тетрагидрофурана. Полученную смесь перемешивают при -78 С в течение одного часа. Затем по каплям добавляют раствор промежуточного соединения L в 5 мл тетрагидрофурана, смесь перемешивают при -78 С в течение двух часов и затем оставляют в течение ночи перемешиваться при комнатной температуре. Реакционную смесь выливают в 10%-ный раствор NH4Cl и экстрагируют смесью CH2Cl2/тетрагидрофуран/метанол. Органический слой сушат над MgSO4, фильтруют и растворитель упаривают. Неочищенный продукт очищают хроматографией на силикагеле (элюент: CH2Cl2/метанол/NH4OH; от 98:2:0,2 до 92:8:0,8). Чистые фракции собирают и растворитель упаривают. Выход 0,073 г (30%, 134 С) соединения 38. Таблица 5PdCl2(PPh3)2 (0,19 ммоль, 0,2 экв.). Полученную смесь оставляют перемешиваться в течение ночи при 110 С. Добавляют водный раствор KF, смесь перемешивают в течение 15 мин, затем фильтруют через рыхлый слой целита и промывают CH2Cl2. Остаток экстрагируют в CH2Cl2. Органические слои объединяют, промывают водой, затем сушат над MgSO4 и фильтруют. Растворитель упаривают и остаток очищают колоночной хроматографией (Kromasil 5 мкм, 25030 мкм, элюент: CH2Cl2/метанол 98:2), получая 0,089 г чистого продукта 46 (выход 20%, т.пл. 102 С). Способ В. К раствору соединения Е (0,27 г, 0,52 ммоль) в смеси 5:1 диметиловый эфир/метанол (19 мл) последовательно добавляют (Е)-3-метоксипропенбороновую кислоту (1,5 ммоль, 3 экв.), Pd(PPh3)4 (0,11 ммоль,0,2 экв.) и 2 н раствор K2CO3 (2,5 ммоль, 5 экв.). Полученную смесь перемешивают в течение ночи при кипячении с обратным холодильником. Добавляют 10%-ный раствор K2CO3, смесь фильтруют через рыхлый слой целита и промывают CH2Cl2. Остаток экстрагируют смесью CH2Cl2/тетрагидрофуран. Органические слои объединяют, сушат над MgSO4 и фильтруют. Растворитель упаривают и остаток очищают колоночной хроматографией (10 мкм, элюент: CH2Cl2/метанол 99:1), получая 0,079 г чистого продукта 39 (выход 33%). Способ С. К раствору соединения Е (1 г, 1,9 ммоль) в диметилформамиде (30 мл) последовательно добавляют 3-этинилпиридин (5,7 ммоль, 3 экв.), PdCl2(PPh3)2 (0,19 ммоль, 0,1 экв.), CuI (3,8 ммоль, 2 экв.) и триэтиламин (5,7 ммоль, 3 экв.). Полученную смесь перемешивают в течение ночи при кипячении с обратным холодильником. Добавляют 10%-ный раствор K2CO3, смесь фильтруют через рыхлый слой целита и промывают CH2Cl2. Остаток экстрагируют смесью CH2Cl2/тетрагидрофуран. Органические слои объединяют, сушат над MgSO4 и фильтруют. Растворитель упаривают и остаток очищают колоночной хроматографией (10 мкм, элюент: CH2Cl2/метанол/KH4OH 98:2:0,2), получая 0,29 г чистого продукта 48 (выход 30%, т.пл. 210 С).(P(оТо 1)3) (0,24 ммоль, 0,5 экв.) и триэтиламин (2,8 ммоль, 6 экв.). Полученную смесь при перемешивании нагревают в течение ночи до 115 С, затем фильтруют через рыхлый слой целита и промывают водой. Остаток экстрагируют CH2Cl2. Органические слои объединяют, сушат над MgSO4 и фильтруют. Растворитель упаривают и остаток очищают колоночной хроматографией (3,5 мкм, элюент:(0,075 ммоль, 0,05 экв.) и ацетат калия (4,5 ммоль, 3 экв.). Полученную смесь при перемешивании оставляют в течение ночи нагреваться при 85 С. Затем добавляют раствор 3-бром-2-метилакрилонитрила (3,0 ммоль, 2 экв.), PdCl2dppf (0,075 ммоль, 0,05 экв.) и K2CO3 (7,5 ммоль, 3 экв.) в диметилформамиде (5 мл) и полученную смесь перемешивают при 115 С в течение 24 ч. После охлаждения полученную смесь фильтруют через рыхлый слой целита и промывают водой. Остаток экстрагируют CH2Cl2. Органические слои объединяют, сушат над MgSO4 и фильтруют. Растворитель упаривают и полученную смесь очищают колоночной хроматографией (3,5 мкм, элюент: CH2Cl2/метанол от 100:0 до 98:2; затем 5 мкм, элюент: Спектр антивирусной активности Соединения по настоящему изобретению испытывали на их эффективность против вируса дикого типа и выделенных в клинических условиях штаммов ВИЧ, имеющих одну или несколько мутаций, связанных с устойчивостью к ингибиторам обратной транскриптазы. Антивирусную активность оценивали с помощью клеточного анализа, который проводили в соответствии со следующей методикой. Конструируют клеточную линию МТ-4 Т-клеток человека с зеленым флуоресцентным белком(GFP) и ВИЧ-специфическим промотором, длинным концевым повтором (LTR) ВИЧ-1. Указанную клеточную линию, которую обозначают как МТ 4 LTR-EGFP, можно использовать для in vitro оценки антиВИЧ активности исследуемых соединений. В клетках, инфицированных ВИЧ-1, продуцируется белокTat, который активирует промотор LTR и, в конечном счете, приводит к активации продукции репортерной группы GFP, что позволяет измерить существующую ВИЧ-инфекцию флуорометрически. Аналогично конструируют клетки MT4 с GFP и общим промотором цитомегаловируса (CMV). Указанную клеточную линию обозначают как МТ 4 CMV-EGFP и ее можно использовать для in vitro оценки цитотоксичности исследуемых соединений. В указанной клеточной линии уровни GFP сопоставимы с уровнем GFP в клетках, инфицированных МТ 4 LTR-EGFP. Цитотоксичные исследуемые соединения снижают уровни GFP в клетках, ложно-инфицированных МТ 4 CMV-EGFP. Можно установить эффективные значения концентрации, такие как 50%-ная эффективная концентрация (EC50), которые, как правило, выражают в мкМ. Значение EC50 определяют как концентрацию тестируемого соединения, которая на 50% снижает флуоресценцию ВИЧ-инфицированных клеток. 50%ную цитотоксическую концентрацию (CC50 в мкМ) определяют как концентрацию тестируемого соединения, которая на 50% снижает флуоресценцию ложно-инфицированных клеток. Отношение СС 50 кEC50 определяют как индекс селективности (SI), и он является показателем избирательности анти-ВИЧ активности ингибитора. Окончательный контроль инфекции и цитотоксичности ВИЧ-1 проводят с помощью сканирующего микроскопа. Анализ изображения дает возможность провести очень чувствительное определение вирусной инфекции. Измерения проводят перед некрозом клеток, который обычно наступает приблизительно через пять дней после инфекции, в частности измерения проводят через три дня после инфекции. В столбцах IIIB, L100I и т.д. в таблице приведены значения рЕС 50 (-log EC50) против различных вирусных штаммов IIIB, L100I и т.д.; в pSi приведены значения -log SI. Штамм IIIB является штаммом ВИЧ дикого типа."MDR" относится к штамму, который содержит мутации L100I, K103N, Y181C, E138G, V179I,L2214F, V278V/I и A327A/V в обратной транскриптазе ВИЧ. его фармацевтически приемлемая аддитивная соль, фармацевтически приемлемый сольват или стереохимически изомерная форма, где каждый R1 независимо означает атом водорода; арил; формил; C1-6 алкилкарбонил; С 1-6 алкил; С 16 алкилоксикарбонил;R2 и R3 независимо означают атом водорода; гидрокси; атом галогена; С 3-7 циклоалкил; C16 алкилокси; карбоксил; C1-6 алкилоксикарбонил; циано; нитро; амино; моно- или ди(C1-6 алкил)амино; полигалогенС 1-6 алкил; полигалогенС 1-6 алкилокси; -C(=O)R10; C1-6 алкил, необязательно замещенный атомом галогена, цианогруппой или -C(=O)R10; C2-6 алкенил, необязательно замещенный атомом галогена, цианогруппой или -С(=O)R10; C2-6 алкинил, необязательно замещенный атомом галогена, цианогруппой или C(=O)R10;R9 означает C1-6 алкил, C2-6 алкенил или C2-6 алкинил, каждый из которых замещен цианогруппой;R5 означает C2-6 алкенил или C2-6 алкинил, оба замещенные цианогруппой, аминокарбонильной, моно- или ди(C1-6 алкил)аминокарбонильной, арильной, пиридильной, тиенильной, фуранильной или одной или двумя C1-6 алкилоксигруппами; илиR5 означает Het; -С(=O)NR5aR5b или -СН(OR5c)R5d; где R5a означает C1-6 алкилокси; C2-6 алкенил; С 3-7 циклоалкил или C1-6 алкил, замещенный гидрокси,амино, моно- или ди(С 1-6 алкил)амино, C1-6 алкилкарбониламиногруппой, атомом галогена, циано, арильной, пиридильной, тиенильной, фуранильной, тетрагидрофуранильной, пирролидинильной, пиперидинильной, морфолинильной, пиперазинильной группой, пиперазинильной группой, необязательно замещенной C1-6 алкилом, C1-6 алкилкарбонилом или гидроксиС 1-6 алкилом; илиR5a означает C1-6 алкил, замещенный одной или двумя С 1-6 алкилоксигруппами;R5b означает атом водорода или C1-6 алкил; илиR5a и R5b вместе с атомом азота, к которому они присоединены, образуют пирролидинил; пиперидинил, необязательно замещенный аминокарбонилом, гидрокси или C1-6 алкилоксигруппой; морфолинил; пиперазинил; пиперазинил, необязательно замещенный C1-6 алкилом, C1-6 алкилкарбонилом или гидроксиС 1-6 алкилом;X означает -NR1-, -O-; каждый r независимо равен 1 или 2; каждый Het независимо означает пиридил, тиенил, фуранил, тиазолил; каждый арил независимо означает фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из C1-6 алкила, C1-6 алкилокси, аминосульфонила или полигалогенС 1-6 алкилокси. 2. Соединение по п.1, где R2 и R3 независимо означают атом водорода; атом галогена; C1-6 алкил; цианогруппу. 3. Соединение по п.1, где R9 означает радикал -CH2-CH2-CN, -CH=CH-CN или -CC-CN. 4. Соединение по п.3, где R9 означает радикал (Е)-CH=CH-CN. 5. Соединение по любому из пп.1-4, где R1 означает атом водорода. 6. Соединение по любому из пп.1-5, где R5 означает группу Het; -C(=O)NR5aR5b; -CH(OR5c)R5d; гдеR5a означает C1-6 алкилокси; C2-6 алкенил; С 3-7 циклоалкил или С 1-6 алкил, замещенный моно- или ди(С 1-6 алкил)амино, C1-6 алкилкарбониламино, циано, арилом, пиридилом, тиенилом, тетрагидрофуранилом, морфолинилом, пиперазинилом, пиперазинилом, необязательно замещенным C1-6 алкилом или гидроксиС 1-6 алкилом; или R5a означает C1-6 алкил, замещенный одним или двумя C1-6 алкилоксигруппами;R5b означает атом водорода или C1-6 алкил; илиR5a и R5b вместе с атомом азота, к которому они присоединены, образуют пиперидинил, необязательно замещенный аминокарбонилом или гидроксигруппой; пиперазинил, необязательно замещенныйC1-6 алкилом или гидроксиС 1-6 алкилом;R5d означает C1-6 алкил, С 2-6 алкенил, арил, пиридил или тиазолил. 7. Соединение по любому из пп.1-6, где X означает -NH-. 8. Фармацевтическая композиция для лечения ВИЧ-инфекций, содержащая эффективное количество соединения формулы (I-а) по любому из пп.1-6 и носитель.
МПК / Метки
МПК: C07D 401/04, A61K 31/506, A61K 31/505, C07D 417/06, C07D 401/06, A61P 31/18, C07D 401/12, C07D 405/04, C07D 409/12, C07D 405/12, C07D 409/04, C07D 239/48
Метки: 5,6-замещенные, пиримидины, вич-ингибирующие
Код ссылки
<a href="https://eas.patents.su/21-20749-vich-ingibiruyushhie-56-zameshhennye-pirimidiny.html" rel="bookmark" title="База патентов Евразийского Союза">Вич-ингибирующие 5,6-замещенные пиримидины</a>
Предыдущий патент: Способ и устройство для изготовления гнутого элемента
Следующий патент: Подавление неприятного запаха косметических продуктов
Случайный патент: Способ приготовления солей щелочных металлов












