Гербицидно активные бициклические 1,3-дионы
Номер патента: 20771
Опубликовано: 30.01.2015
Авторы: Даулин Алан Джон, Говенкар Мангала, Хостон Маттью Брайан, Чаллинор Ли, Скатт Джеймс Николас, Матьюс Кристофер Джон
Формула / Реферат
1. Соединения формулы I
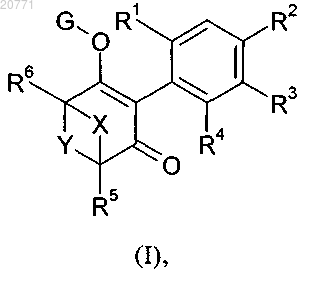
в которой R1 обозначает метил, этил, н-пропил, циклопропил, галогенметил, галоген, этинил, метоксигруппу, этоксигруппу или галогенметоксигруппу;
R2 и R3 независимо обозначают водород; фенил или фенил, содержащий в качестве заместителей C1-С2-алкил, С1-С2-галогеналкил, С1-С2-алкоксигруппу, С1-С2-галогеналкоксигруппу, фтор, хлор, бром или цианогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей C1-С2-алкил, C1-С2-галогеналкил, С1-С2-алкоксигруппу,С1-С2-галогеналкоксигруппу, фтор, хлор, бром или цианогруппу;
где по меньшей мере один из R2 и R3 обозначает необязательно замещенный фенил или необязательно замещенный гетероарил;
R4 обозначает водород, метил, этил, н-пропил, галогенметил, галоген, этинил, метоксигруппу, этоксигруппу или галогенметоксигруппу;
R5 обозначает водород, С1-С4-алкил, С1-С4-алкоксигруппу или С1-С4-алкокси-С1-С4-алкил;
R6 обозначает водород или метил;
X обозначает необязательно замещенный C1-С3-алкилен; и
Y обозначает необязательно замещенный C1-С3-алкилен или необязательно замещенный С2-С3-алкенилен;
где C1-С3-алкиленовые и С2-С3-алкениленовые группы X и Y являются незамещенными или один или два раза замещены С1-С4-алкилом, С1-С4-алкоксигруппой, С1-С4-алкокси-С1-С4-алкилом, галогеном или гидроксигруппой; и
G обозначает водород, щелочной металл, щелочно-земельный металл, сульфоний, аммоний или маскирующую группу;
и где если G обозначает маскирующую группу, то G обозначает C(Xa)-Ra, C(Xb)-Xc-Rb, -SO2-Re или
-P(Xe)(Rf)-Rg;
где Ха, Xb, Xc и Xe независимо друг от друга обозначают кислород или серу; и где
Ra обозначает C1-C18-алкил, С2-С18-алкенил, С2-С18-алкинил, С3-С7-циклоалкил-С1-С5-алкил, С1-С5-алкокси-С1-С5-алкил, С3-С5-алкенилокси-С1-С5-алкил, С3-С5-алкинилокси-С1-С5-алкил, фенил-С1-С5-алкил (где фенил необязательно может содержать в качестве заместителей C1-С3-алкил, С1-С3-галогеналкил, C1-С3-алкоксигруппу, C1-С3-галогеналкоксигруппу, С1-С3-алкилтиогруппу, C1-С3-алкилсульфинил, C1-С3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), гетероарил-С1-С5-алкил (где гетероарил необязательно может содержать в качестве заместителей C1-С3-алкил, С1-С3-галогеналкил, C1-С3-алкоксигруппу, C1-С3-галогеналкоксигруппу, С1-С3-алкилтиогруппу, C1-С3-алкилсульфинил, C1-С3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), С3-С8-циклоалкил; фенил или фенил, содержащий в качестве заместителей C1-С3-алкил, C1-С3-галогеналкил, С1-С3-алкоксигруппу, C1-С3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей C1-С3-алкил, C1-С3-галогеналкил, C1-С3-алкоксигруппу, С1-С3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу;
Rb обозначает C1-C18-алкил, С3-С18-алкенил, С3-С18-алкинил, С3-С7-циклоалкил-С1-С5-алкил, С1-С5-алкокси-С1-С5-алкил, С3-С5-алкенилокси-С1-С5-алкил, С3-С5-алкинилокси-С1-С5-алкил, фенил-С1-С5-алкил (где фенил необязательно может содержать в качестве заместителей C1-С3-алкил, C1-С3-галогеналкил, C1-С3-алкоксигруппу, C1-С3-галогеналкоксигруппу, C1-С3-алкилтиогруппу, C1-С3-алкилсульфинил, C1-С3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), гетероарил-С1-С5-алкил (где гетероарил необязательно может содержать в качестве заместителей C1-С3-алкил, С1-С3-галогеналкил, C1-С3-алкоксигруппу, C1-С3-галогеналкоксигруппу, С1-С3-алкилтиогруппу, C1-С3-алкилсульфинил, C1-С3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), С3-С8-циклоалкил; фенил или фенил, содержащий в качестве заместителей C1-С3-алкил, C1-С3-галогеналкил, С1-С3-алкоксигруппу, C1-С3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей C1-С3-алкил, C1-С3-галогеналкил, C1-С3-алкоксигруппу, С1-С3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу;
Re обозначает C1-С10-алкил, С3-С8-циклоалкил; или фенил или фенил, содержащий в качестве заместителей C1-С3-алкил, C1-С3-галогеналкил, С1-С3-алкоксигруппу, C1-С3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; и
Rf и Rg, каждый независимо друг от друга, обозначают C1-С10-алкил, С3-С8-циклоалкил; или фенил или фенил, содержащий в качестве заместителей C1-С3-алкил, C1-С3-галогеналкил, C1-С3-алкоксигруппу, C1-С3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу;
и где термин "гетероарил" означает тиенил, фурил, пирролил, изоксазолил, оксазолил, изотиазолил, тиазолил, пиразолил, имидазолил, триазолил, тетразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, оксадиазолил или тиадиазолил и, если это является подходящим, их N-оксиды и соли;
при условии, что для R2 и R3 термин "гетероарил" означает тиенил, пиридил, пиримидинил, пиразолил или тиазолил.
2. Соединения по п.1, в которых R1 обозначает метил, этил, галоген, галогенметил, этинил или галогенметоксигруппу.
3. Соединения по п.2, в которых R1 обозначает метил или этил.
4. Соединения по п.3, в которых R1 обозначает этил.
5. Соединения по п.2, в которых R1 обозначает -OCHF2 или -OCF3.
6. Соединения по пп.1, 2, 3 или 4, в которых R2 обозначает фенил или фенил, содержащий в качестве заместителей C1-С2-алкил, С1-С2-алкоксигруппу, С1-С2-галогеналкил, С1-С2-галогеналкоксигруппу, фтор, хлор, бром или цианогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей C1-С2-алкил, C1-С2-алкоксигруппу, С1-С2-галогеналкил, C1-С2-галогеналкоксигруппу, фтор, хлор, бром или цианогруппу; и R3 обозначает водород.
7. Соединения по пп.1, 2, 3 или 4, в которых R2 обозначает водород и R3 обозначает фенил или фенил, содержащий в качестве заместителей C1-С2-алкил, С1-С2-алкоксигруппу, C1-С2-галогеналкил, С1-С2-галогеналкоксигруппу, фтор, хлор, бром или цианогруппу.
8. Соединения по любому из пп.1-4, или 6, или 7, в которых R4 обозначает водород, метил, этил или этинил.
9. Соединения по п.8, в которых R4 обозначает водород, метил или этил.
10. Соединения по любому из пп.1-4 или 6-9, в которых R5 обозначает водород или метил.
11. Соединения по любому из пп.1-4 или 6-10, в которых R6 обозначает водород.
12. Соединения по любому из пп.1-4 или 6-11, в которых X обозначает необязательно замещенный С1-С2-алкилен.
13. Соединения по п.12, в которых X обозначает метилен, этилен, метилен, содержащий в качестве заместителей C1-С3-алкил, C1-С3-алкоксигруппу или C1-С3-алкокси-С1-С3-алкил, или этилен, содержащий в качестве заместителей С1-С3-алкил, C1-С3-алкоксигруппу или С1-С3-алкокси-С1-С3-алкил.
14. Соединения по п.13, в которых X обозначает метилен или этилен.
15. Соединения по любому из пп.1-4 или 6-14, в которых Y обозначает необязательно замещенный C1-С2-алкилен или необязательно замещенный С2-алкенилен.
16. Соединения по п.15, в которых Y обозначает С1-С2-алкилен или C1-C2-алкилен, содержащий в качестве заместителей галоген, гидроксигруппу, C1-С3-алкил, C1-С3-алкоксигруппу или C1-С3-алкокси-С1-С3-алкил; или С2-алкенилен или С2-алкенилен, содержащий в качестве заместителей галоген, гидроксигруппу, C1-С3-алкил, C1-С3-алкоксигруппу или С1-С3-алкокси-С1-С3-алкил.
17. Соединения по п.16, в которых Y обозначает этилен или этенилен.
18. Соединения по п.1, в которых R1 обозначает метил или этил, R2 обозначает водород, R3 обозначает фенил или фенил, содержащий в качестве заместителей C1-С2-алкил, C1-С2-алкоксигруппу, С1-С2-галогеналкил, C1-С2-галогеналкоксигруппу, фтор, хлор, бром или цианогруппу, R4 обозначает водород, R5 обозначает водород, R6 обозначает водород, X обозначает метилен, Y обозначает этилен и G обозначает водород.
19. Соединения по любому из пп.1-4 или 6-17, в которых если G представляет собой маскирующую группу, то G представляет собой группу -C(Xa)-Ra или -C(Xb)-Xc-Rb и значения Ха, Ra, Xb, Xe и Rb являются такими, как определено в п.1.
20. Соединения по любому из пп.1-4 или 6-17, в которых G обозначает водород.
21. Способ получения соединения формулы I по п.1, в которой G обозначает водород, который включает реакцию соединения формулы (J)
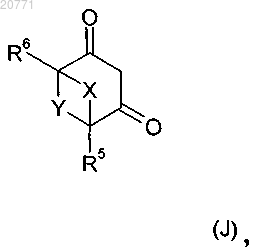
в которой значения X, Y, R5 и R6 являются такими, как определено в п.1, с соединением формулы (М)
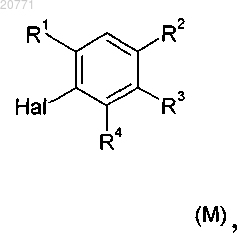
в которой значения R1, R2, R3 и R4 являются такими, как определено в п.1, и Hal обозначает хлор, бром или йод, в присутствии катализатора, лиганда, основания и растворителя.
22. Способ получения соединения формулы I по п.1, который включает реакцию соединения формулы (Т)

в которой Hal обозначает хлор, бром или йод и значения X, Y, R1, R3, R4, R5, R6 и G являются такими, как определено в п.1, с соединением формулы R2-В(ОН)2 или его сложным эфиром или солью, где R2 обозначает необязательно замещенный фенил или необязательно замещенный гетероарил, в присутствии катализатора, лиганда, основания и растворителя.
23. Способ получения соединения формулы I по п.1, который включает реакцию соединения формулы (T1)
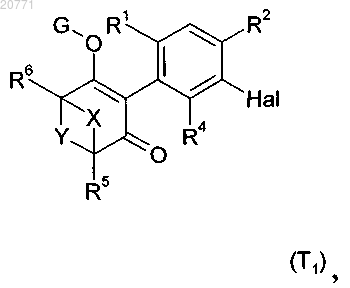
в которой Hal обозначает хлор, бром или йод и значения X, Y, R1 , R2, R4, R5, R6 и G являются такими, как определено в п.1, с соединением формулы R3-В(ОН)2 или его сложным эфиром или солью, где R3 обозначает необязательно замещенный фенил или необязательно замещенный гетероарил, в присутствии катализатора, лиганда, основания и растворителя.
24. Способ получения соединения формулы I по п.1, который включает реакцию соединения формулы (Y)
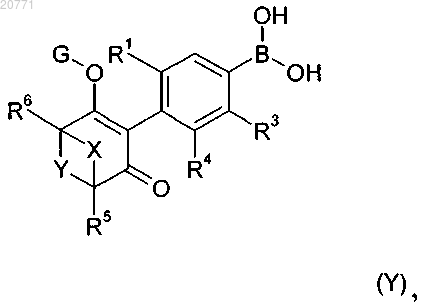
в которой значения R1, R3, R4, R5, R6 и X, Y и G являются такими, как определено в п.1, или его сложного эфира или соли, с соединением формулы R2-Hal, где R2 обозначает необязательно замещенный фенил или необязательно замещенный гетероарил и Hal обозначает хлор, бром или йод, в присутствии катализатора, лиганда, основания и растворителя.
25. Способ получения соединения формулы I по п.1, который включает реакцию соединения формулы (Y1)
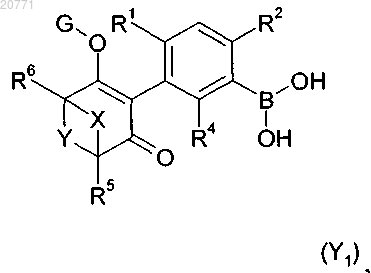
в которой значения R1, R2, R4, R5, R6 и X, Y и G являются такими, как определено в п.1, или его сложного эфира или соли, с арил- или гетероарилгалогенидом формулы R3-Hal, где значения R3 определены в п.1, и Hal обозначает хлор, бром или йод, в присутствии катализатора, лиганда, основания и растворителя.
26. Способ борьбы с сорняками в культурах полезных растений, который включает нанесение гербицидно эффективного количества соединения формулы I по любому из пп.1-20 или композиции, содержащей такое соединение, на растения или на место их произрастания.
27. Способ по п.26, который включает нанесение гербицидно эффективного количества композиции, содержащей соединение формулы I, на растения или на место их произрастания, и где культуры полезных растений представляют собой злаки, хлопок, сою, сахарную свеклу, сахарный тростник, рапс, кукурузу или рис.
28. Гербицидная композиция, содержащая гербицидно эффективное количество соединения формулы I по любому из пп.1-20 и вспомогательные вещества для приготовления композиций.
29. Композиция по п.28, которая в дополнение к соединению формулы I содержит дополнительный гербицид в качестве компонента смеси.
30. Композиция по п.28, которая в дополнение к соединению формулы I содержит антидот.
31. Композиция по п.28, которая в дополнение к соединению формулы I содержит дополнительный гербицид в качестве компонента смеси и антидот.
Текст
ГЕРБИЦИДНО АКТИВНЫЕ БИЦИКЛИЧЕСКИЕ 1,3-ДИОНЫ Изобретение относится к бициклическим дионам формулы (I) и их производным, которые пригодны для применения в качестве гербицидов. Матьюс Кристофер Джон, Хостон Маттью Брайан, Даулин Алан Джон, Скатт Джеймс Николас (GB),Говенкар Мангала (IN), Чаллинор Ли Изобретение относится к новым гербицидно активным циклическим дионам и их производным, к способам их получения, к композициям, содержащим эти соединения, и к их применению для борьбы с сорняками, предпочтительно - в культурах полезных растений или для подавления роста растений. Циклические дионы, обладающие гербицидной активностью, описаны, например, в US 4175135 иUS 4209532. Согласно изобретению обнаружены новые бициклические дионы и их производные, обладающие гербицидной активностью и способностью подавлять рост. Поэтому настоящее изобретение относится к соединениям формулы IR2 и R3 независимо обозначают водород; фенил или фенил, содержащий в качестве заместителей С 1-С 2-алкил, С 1-С 2-галогеналкил, С 1-С 2-алкоксигруппу, С 1-С 2-галогеналкоксигруппу, фтор, хлор, бром или цианогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей С 1-С 2-алкил, C1 С 2-галогеналкил, С 1-С 2-алкоксигруппу,С 1-С 2-галогеналкоксигруппу, фтор, хлор, бром или цианогруппу; где по меньшей мере один из R2 и R3 обозначает необязательно замещенный фенил или необязательно замещенный гетероарил;R6 обозначает водород или метил;X обозначает необязательно замещенный C1-С 3-алкилен; иY обозначает необязательно замещенный C1-С 3-алкилен или необязательно замещенный С 2-С 3 алкенилен; где C1-С 3-алкиленовые и С 2-С 3-алкениленовые группы X и Y являются незамещенными или один или два раза замещены С 1-С 4-алкилом, С 1-С 4-алкоксигруппой, С 1-С 4-алкокси-С 1-С 4-алкилом, галогеном или гидроксигруппой; иG обозначает водород, щелочной металл, щелочно-земельный металл, сульфоний, аммоний или маскирующую группу, как указано в этой заявке,и где термин "гетероарил" означает тиенил, фурил, пирролил, изоксазолил, оксазолил, изотиазолил,тиазолил, пиразолил, имидазолил, триазолил, тетразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, оксадиазолил или тиадиазолил и, если это является подходящим, их N-оксиды и соли; при условии, что для R2 и R3 термин "гетероарил" означает тиенил, пиридил, пиримидинил, пиразолил или тиазолил. В определениях заместителей соединений формулы I алкильные радикалы и алкильные фрагменты алкоксигруппы, алкилсульфонила и т. п., содержащие от 1 до 6 атомов углерода предпочтительно представляют собой метил, этил, а также пропил, бутил, пентил и гексил в виде своих линейных и разветвленных изомеров. Алкенильные и алкинильные радикалы, содержащие от 2 до 6 атомов углерода, могут быть линейными или разветвленными и могут содержать более 1 двойной или тройной связи. Примерами являются винил, аллил, пропаргил, бутенил, бутинил, пентенил и пентинил. Подходящие циклоалкильные группы содержат от 3 до 6 атомов углерода и представляют собой,например, циклопропил, циклобутил, циклопентил и циклогексил. Циклопропил, циклопентил и циклогексил являются предпочтительными. Предпочтительными галогенами являются фтор, хлор и бром. Замещенные C1-С 3-алкиленовые и замещенные С 2-С 3-алкениленовые фрагменты представляют собой насыщенные и ненасыщенные углеродные цепи, которые могут содержать один или больше, чем один заместитель, такой как C1-С 4-алкил, С 1-С 4-алкоксигруппа, галоген или гидроксигруппа. Примерами гетероарилов являются тиенил, фурил, пирролил, изоксазолил, оксазолил, изотиазолил,тиазолил, пиразолил, имидазолил, триазолил, тетразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, оксадиазолил и тиадиазолил и, если это является подходящим, их N-оксиды и соли. Эти гетероарилы, а также фенильные кольца могут содержать один или большее количество заместителей, где заместители выбраны из группы, включающей C1-С 3-алкил, C1-С 3-галогеналкил, C1-С 3 алкоксигруппу, С 1-С 3-галогеналкоксигруппу, C1-С 3-алкилтиогруппу, C1-С 3-алкилсульфинил, С 1-С 3 алкилсульфонил, галоген, цианогруппу или нитрогруппу. Группа G обозначает водород, катион щелочного металла, такого как натрий или калий, катион щелочно-земельного металла, такого как кальций, сульфониевый катион (предпочтительно -S(С 1-С 6 алкил 3)+) или аммониевый катион (предпочтительно -NH4 +или -N(С 1-С 6-алкил)4+), или маскирующую группу, как указано в этой заявке. Маскирующая группа G обозначает C(Xa)-Ra, C(Xb)-Xc-Rb, -SO2-Re или -P(Xe)(Rf)-Rg; где Ха, Xb , Xc и Xe независимо друг от друга обозначают кислород или серу; и гдеRa обозначает C1-C18-алкил, С 2-С 18-алкенил, С 2-С 18-алкинил, С 3-С 7-циклоалкил-С 1-С 5-алкил, С 1-С 5 алкокси-С 1-С 5-алкил, С 3-С 5-алкенилокси-С 1-С 5-алкил, С 3-С 5-алкинилокси-С 1-С 5-алкил, фенил-С 1-С 3 алкил (где фенил необязательно может содержать в качестве заместителей C1-С 3-алкил, С 1-С 3 галогеналкил, C1-С 3-алкоксигруппу, C1-С 3-галогеналкоксигруппу, С 1-С 3-алкилтиогруппу, C1-С 3 алкилсульфинил, C1-С 3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), гетероарил-С 1-С 5 алкил, (где гетероарил необязательно может содержать в качестве заместителей C1-С 3-алкил, С 1-С 3 галогеналкил, C1-С 3-алкоксигруппу, C1-С 3-галогеналкоксигруппу, С 1-С 3-алкилтиогруппу, C1-С 3 алкилсульфинил, C1-С 3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), С 3-С 8-циклоалкил; фенил или фенил, содержащий в качестве заместителей C1-С 3-алкил, C1-С 3-галогеналкил, С 1-С 3 алкоксигруппу, C1-С 3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей C1-С 3-алкил, C1-С 3-галогеналкил, C1-С 3-алкоксигруппу,C1-С 3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу;Rb обозначает С 1-С 18-алкил, С 3-С 18-алкенил, С 3-С 18-алкинил, С 3-С 7-циклоалкил-С 1-С 5-алкил, С 1-С 5 алкокси-С 1-С 5-алкил, С 3-С 5-алкенилокси-С 1-С 5-алкил, С 3-С 5-алкинилокси-С 1-С 5-алкил, фенил-С 1-С 5 алкил (где фенил необязательно может содержать в качестве заместителей C1-С 3-алкил, C1-С 3 галогеналкил, C1-С 3-алкоксигруппу, C1-С 3-галогеналкоксигруппу, С 1-С 3-алкилтиогруппу, C1-С 3 алкилсульфинил, C1-С 3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), гетероарил-С 1-С 5 алкил, (где гетероарил необязательно может содержать в качестве заместителей C1-С 3-алкил, С 1-С 3 галогеналкил, C1-С 3-алкоксигруппу, C1-С 3-галогеналкоксигруппу, C1-С 3-алкилтиогруппу, C1-С 3 алкилсульфинил, C1-С 3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), С 3-С 8-циклоалкил; фенил или фенил, содержащий в качестве заместителей C1-С 3-алкил, C1-С 3-галогеналкил, С 1-С 3 алкоксигруппу, C1-С 3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей C1-С 3-алкил, C1-С 3-галогеналкил, C1-С 3-алкоксигруппу,С 1-С 3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу;Re обозначает C1-С 10-алкил, С 3-С 8-циклоалкил; или фенил или фенил, содержащий в качестве заместителей C1-С 3-алкил, C1-С 3-галогеналкил, С 1-С 3-алкоксигруппу, C1-С 3-галогеналкоксигруппу, галоген,цианогруппу или нитрогруппу; иRf и Rg, каждый независимо, друг от друга обозначает C1-С 10-алкил, С 3-C8-циклоалкил; или фенил или фенил, содержащий в качестве заместителей С 1-С 3-алкил, C1-С 3-галогеналкил, C1-С 3-алкоксигруппу,C1-С 3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу. Предпочтительно, если маскирующая группа G представляет собой группу -C(Xa)-Ra или -C(Xb)-XcbR и значения Ха, Ra, Xb, Xe и Rb являются такими, как определено выше. Предпочтительно, если G обозначает водород, щелочной металл или щелочно-земельный металл,причем водород является особенно предпочтительным. Маскирующие группы G выбраны так, чтобы их можно было удалить с помощью биохимического,химического или физического процесса с получением соединений формулы I, в которой G обозначает Н,до, во время или после нанесения на обрабатываемый участок или растения. Примеры этих процессов включают ферментативное расщепление, химический гидролиз и фотолиз. Соединения, содержащие такие маскирующие группы G, могут обеспечивать определенные преимущества, такие как улучшенное проникновение в кутикулу обрабатываемых растений, улучшенная переносимость культурами, улучшенная совместимость или стабильность в готовых смесях, содержащих другие гербициды, антидоты гербицидов, регуляторы роста растений, фунгициды или инсектициды, или уменьшенное выщелачивание в почвах. В предпочтительной группе соединений формулы I R1 обозначает метил, этил, галоген, галогенметил, этинил или галогенметоксигруппу. Более предпочтительно, если R1 обозначает метил или этил, еще более предпочтительно этил. Также предпочтительно, если R1 обозначает -OCHF2 или -CF3. Как указано выше R2 и R3 независимо обозначают водород, фенил или фенил, содержащий в качестве заместителей C1-С 2-алкил, С 1-С 2-галогеналкил, C1-С 2-алкоксигруппу, С 1-С 2-галогеналкоксигруппу,фтор, хлор, бром или цианогруппу, гетероарил или гетероарил, содержащий в качестве заместителей C1 С 2-алкил, С 1-С 2-галогеналкил, C1-С 2-алкоксигруппу, C1-С 2-галогеналкоксигруппу, фтор, хлор, бром или цианогруппу. Предпочтительными гетероарилами являются тиенил, пиридил, пиримидинил, пиразолил и тиазолил. Особенно предпочтительно, если R2 обозначает водород и R3 обозначает фенил или фенил, содержащий в качестве заместителей C1-С 2-алкил, С 1-С 2-галогеналкил, C1-С 2-алкоксигруппу, С 1-С 2-2 020771 галогеналкоксигруппу, фтор, хлор, бром или цианогруппу. Предпочтительно, если R4 обозначает водород, метил, этил, или этинил и более предпочтительно,если R4 обозначает водород, метил или этил. Предпочтительно, если R5 обозначает водород или метил, еще более предпочтительно - водород. Предпочтительно, если R6 обозначает водород. Предпочтительно, если X обозначает необязательно замещенный С 1-С 2-алкилен. Более предпочтительно, если X обозначает метилен, этилен, метилен, содержащий в качестве заместителей C1-С 3-алкил, C1-С 3-алкоксигруппу или C1- С 3-алкокси-С 1-С 3-алкил или этилен, содержащий в качестве заместителей C1-С 3-алкил, C1-С 3-алкоксигруппу или С 1-С 3-алкокси-С 1-С 3-алкил. Наиболее предпочтительно, если X обозначает метилен или этилен. Предпочтительно, если Y обозначает необязательно замещенный С 1-С 2-алкилен или необязательно замещенный С 2-алкенилен. Более предпочтительно, если Y обозначает С 1-С 2-алкилен или С 1-С 2-алкилен, содержащий в качестве заместителей галоген, гидроксигруппу, С 1-С 3-алкил, C1-С 3-алкоксигруппу или С 1-С 3-алкокси-С 1-С 3 алкил, С 2-алкенилен или С 2-алкенилен, содержащий в качестве заместителей галоген, гидроксигруппу,C1-С 3-алкил, C1-С 3-алкоксигруппу или С 1-С 3-алкокси-С 1-С 3-алкил, более предпочтительно этилен или этенилен. В особенно предпочтительной группе соединений формулы I R1 обозначает метил или этил.R2 обозначает водород, R обозначает фенил или фенил, содержащий в качестве заместителей С 1-С 2 алкил, С 1-С 2-алкоксигруппу, С 1-С 2-галогеналкил, C1-С 2-галогеналкоксигруппу, фтор, хлор, бром или цианогруппу, R обозначает водород, R5 обозначает водород, R6 обозначает водород, X обозначает метилен,Y обозначает этилен и G обозначает водород. Настоящее изобретение также относится к солям, которые могут образовывать соединения формулы I с аминами, основаниями щелочных металлов и щелочно-земельных металлов или четвертичными аммониевыми основаниями. Из гидроксидов щелочных металлов и щелочно-земельных металлов в качестве солеобразователей можно особо отметить гидроксиды лития, натрия, калия, магния и кальция, а в особенности гидроксиды натрия и калия. Соединения формулы I, предлагаемые в настоящем изобретении, также включают гидраты, которые могут образоваться при получении соли. Примеры аминов, пригодных для образования аммониевых солей, включают аммиак, а также первичные, вторичные и третичные C1-C18-алкиламины, С 1-С 4-гидроксиалкиламины и С 2-С 4 алкоксиалкиламины, например, метиламин, этиламин, н-пропиламин, изопропиламин, четыре изомера бутиламина, н-амиламин, изоамиламин, гексиламин, гептиламин, октиламин, нониламин, дециламин,пентадециламин, гексадециламин, гептадециламин, октадециламин, метилэтиламин, метилизопропиламин, метилгексиламин, метилнониламин, метилпентадециламин, метилоктадециламин, этилбутиламин,этилгептиламин, этилоктиламин, гексилгептиламин, гексилоктиламин, диметиламин, диэтиламин, ди-нпропиламин, диизопропиламин, ди-н-бутиламин, ди-н-амиламин, диизоамиламин, дигексиламин, дигептиламин, диоктиламин, этаноламин, н-пропаноламин, изопропаноламин, N,N-диэтаноламин, N-этилпропаноламин, N-бутилэтаноламин, аллиламин, н-бут-2-ениламин, н-пент-2-ениламин, 2,3-диметилбут 2-ениламин, дибут-2-ениламин, н-гекс-2-ениламин, пропилендиамин, триметиламин, триэтиламин, трин-пропиламин, триизопропиламин, три-н-бутиламин, триизобутиламин, три-втор-бутиламин, три-намиламин, метоксиэтиламин и этоксиэтиламин; гетероциклические амины, например, пиридин, хинолин,изохинолин, морфолин, пиперидин, пирролидин, индолин, хинуклидин и азепин; первичные ариламины,например, анилины, метоксианилины, этоксианилины, о-, м- и п-толуидины, фенилендиамины, бензидины, нафтиламины и о-, м- и п-хлоранилины; но предпочтительно триэтиламин, изопропиламин и диизопропиламин. Предпочтительные четвертичные аммониевые основания, пригодные для образования солей, соответствуют, например, формуле [N(RaRbRcRd)]OH, в которой Ra, Rb, Rc и Rd все независимо друг от друга обозначают С 1-С 4-алкил. Другие походящие тетраалкиламмониевые основания с другими анионами можно получить, например, по реакциям обмена анионов. В зависимости от природы заместителей соединения формулы I могут находиться в разных изомерных формах. Если G обозначает водород, то, например, соединения формулы I могут находиться в разных таутомерных формах. Настоящее изобретение включает все такие изомеры и таутомеры и их смеси во всех соотношениях. Кроме того, если заместители содержат двойные связи, то могут существовать цис- и транс-изомеры. Эти изомеры также входят в число заявленных соединений формулы I. Соединение формулы I, в которой G C(Xa)-Ra, C(Xb)-Xc-Rb, -SO2-Re или -P(Xe)(Rf)-Rg где Ха, Xb, Xc,-3 020771Xe, Ra, Rb, Re, Rf и Rg являются такими, как определено выше, можно получить путем обработки соединения формулы (А), которое является соединением формулы I, в которой G обозначает Н, реагентом G-Z,где G-Z представляет собой алкилирующий реагент, такой как алкилгалогенид (определение алкилгалогенидов включает простые C1-C8-алкилгалогениды, такие как метилйодид и этилйодид, замещенные алкилгалогениды, такие как хлорметилалкиловые простые эфиры, Cl-CH2-Xf-Rh, где Xf обозначает кислород, и хлорметилалкилсульфиды Cl-CH2-Xf -Rh, где Xf обозначает серу), C1-C8-алкилсульфонат или ди(С 1-С 8-алкил)сульфат, или С 3-С 8-алкенилгалогенидом, или С 3-С 8-алкинилгалогенидом, или ацилирующим реагентом, таким как карбоновая кислота, HO-C(Xa)Ra, где Ха обозначает кислород, хлорангидрид кислоты, Cl-C(Xa)Ra, где Ха обозначает кислород, или ангидрид кислоты, [RaC(Xa)]2O, где Ха обозначает кислород, или изоцианат, RcN=C=O, или карбамоилхлорид, Cl-C(Xd)-N(Rc)-Rd (где Xd обозначает кислород и при условии, что ни Rc, ни Rd не обозначает водород), или тиокарбамоил (Xd)-N(Rc)-Rd (гдеXd обозначает серу и при условии, что ни Rc, ни Rd не обозначает водород) или хлорформиат, Cl-C(Xb)Xc-Rb, (где Xb и Xc обозначают кислород), или хлортиоформиат С 1-С(Х)-Xc-Rb (где Xb обозначает кислород и Xc обозначает серу), или хлордитиоформиат Cl-C(Xb)-Xc-Rb, (где Xb и Xc обозначают серу), или изотиоцианат, RcN=C=S, или путем последовательной обработки дисульфидом углерода и алкилирующим реагентом, или фосфорилирующим реагентом, таким как фосфорилхлорид, Cl-P(Xe)(Rf)-Rg или сульфонилирующим реагентом, таким как сульфонилхлорид C1-SO2-Re, предпочтительно - в присутствии по меньшей мере одного эквивалента основания. Специалисты в данной области техники должны понимать,что в некоторых случаях, например, когда R5 отличается от R6, эти реакции в дополнение к соединению формулы I могут дать второе соединение формулы IA. Настоящее изобретение включает соединение формулы I и соединение формулы IA вместе со смесями этих соединений в любом соотношении. О-Алкилирование циклических 1,3-дионов известно; подходящие методики описаны, например, в публикации Т. Wheeler, US 4436. Альтернативные методики описаны в публикациях М. Pizzorno and S.al., Chem. Letters, 2006, 35, (No 1) 16, и Р. Zubaidha et al., Tetrahedron Lett., (2004), 45, 7187. О-Ацилирование циклических 1,3-дионов можно провести по методикам, аналогичным описанным,например, в публикации R. Haines, US 4175135 и Т. Wheeler, US 4422870, US 4659372 и US 4436. Обычно дионы формулы (А) можно обработать ацилирующим реагентом в присутствии по меньшей мере одного эквивалента подходящего основания и необязательно в присутствии подходящего растворителя. Основание может быть неорганическим, таким как карбонат или гидроксид щелочного металла или гидрид металла, или органическим основанием, таким как третичный амин или алкоксид металла. Примеры подходящих неорганических оснований включают карбонат натрия, гидроксид натрия или калия, гидрид натрия и подходящие органические основания включают триалкиламины, такие как триметиламин и триэтиламин, пиридины или другие амины, такие как 1,4-диазабицикло[2.2.2]-октан и 1,8-диазабицикло[5.4.0]ундец-7-ен. Предпочтительные основания включают триэтиламин и пиридин. Подходящие для этой реакции растворители выбирают так, чтобы они были совместимы с реагентами и они включают простые эфиры, такие как тетрагидрофуран и 1,2-диметоксиэтан и галогенированные растворители, такие как дихлорметан и хлороформ. Некоторые основания, такие как пиридин и триэтиламин, можно с успехом использовать в качестве и основания, и растворителя. В случаях, когда ацилирующим реагентом является карбоновая кислота, ацилирование предпочтительно проводить в присутствии известного реагента сочетания, такого как 2-хлор-1-метилпиридиниййодид, N,N'-дициклогексилкарбодиимид, 1-(3 диметиламинопропил)-3-этилкарбодиимид и N,N'-карбодиимидазол, и необязательно в присутствии основания, такого как триэтиламин или пиридин в подходящем растворителе, таком как тетрагидрофуран,дихлорметан или ацетонитрил. Подходящие методики описаны, например, в публикациях W. Zhang и G.Pugh, Tetrahedron Lett., (1999), 40 (43), 7595-7598 и Т. Isobe and Т. Ishikawa, J. Org. Chem., (1999), 64(19),6984. Фосфорилирование циклических 1,3-дионов можно провести с использованием фосфорилгалогенида или тиофосфорилгалогенида и основания по методикам, аналогичным описанным в публикации L.Hodakowski, US 4409153. Сульфонилирование соединения формулы (А) можно провести с использованием алкил- или арилсульфонилгалогенида, предпочтительно - в присутствии по меньшей мере одного эквивалента основания,например, по методике, описанной в публикации С. Kowalski and К. Fields, J. Org. Chem., (1981), 46, 197201. Соединения формулы (А) можно получить путем циклизации соединения формулы (В), предпочти-4 020771 тельно в присутствии кислоты или основания, и необязательно в присутствии подходящего растворителя, по методикам, аналогичным описанным в публикации Т. Wheeler, US 4209532. Соединения формулы(В), в которой R обозначает водород, можно циклизовать в кислой среде, предпочтительно в присутствии сильной кислоты, такой как серная кислота, полифосфорная кислота или реагент Итона, необязательно в присутствии подходящего растворителя, такого как уксусная кислота, толуол или дихлорметан. Соединения формулы (В), в которой R обозначает алкил (предпочтительно - метил или этил), можно циклизовать в щелочной среде, предпочтительно в присутствии по меньшей мере одного эквивалента сильного основания, такого как трет-бутоксид калия, диизопропиламид лития, бис(триметилсилил) амид натрия или гидрид натрия, и в растворителе, таком как тетрагидрофуран, толуол, диметилсульфоксид или N,N-диметилформамид. Соединения формулы (В), в которой R обозначает Н, можно получить омылением соединений формулы (С), в которой R' обозначает алкил (предпочтительно метил или этил) при стандартных условиях с последующим подкислением реакционной смеси для проведения декарбоксилирования по методикам,аналогичным описанным, например, в публикации Т. Wheeler, US4209532: Соединения формулы (В), в которой R обозначает Н, можно этерифицировать в соединения формулы (В), в которой R обозначает алкил, при стандартных условиях. Соединения формулы (С), в которой R обозначает алкил, можно получить путем обработки соединений формулы (D) подходящим хлорангидридом карбоновой кислоты формулы (Е), в которой R обозначает алкил, в щелочной среде. Подходящие основания включают трет-бутоксид калия,бис(триметилсилил)амид натрия и диизопропиламид лития и реакцию предпочтительно проводят в подходящем растворителе (таком как тетрагидрофуран или толуол) при температуре от -80 до 30 С: Альтернативно, соединения формулы (С), в которой R обозначает Н, можно получить путем обработки соединения формулы (D) подходящим основанием (таким как трет-бутоксид калия, бис(триметилсилил)амид натрия и диизопропиламид лития) в подходящем растворителе (таком как тетрагидрофуран или толуол) при подходящей температуре (от -80 до 30 С) и введения полученного анилина в реакцию с подходящим ангидридом формулы (F):Chem., (1974), Vol. 39, No. 12, 1607-1612; J. Baldwin and M. Lusch, J. Org. Chem., (1979), Vol. 44, No. 12,1923-1927; R. Carlson and K. May, Tetrahedron Lett., (1975), Vol. 16, No. 11, 947-950; A. Borner et al., Tetrahedron Asymmetry (2002), 13, 1615-1620) или их можно получить по аналогичным методикам из имеющихся в продаже исходных веществ. По методикам, аналогичным описанным выше, и с использованием в качестве исходного вещества галогенированных эфиров фенилуксусной кислоты формулы (G) (в которой Hal обозначает хлор, бром или йод), можно получить соединение формулы (Н). Соединения формулы (Н) представляют собой соединения формулы (А), в которой R1 обозначает хлор, бром или йод. В свою очередь, соединения формулы (Н) можно превратить в дополнительные соединения формулы (А) по реакции с подходящими компонентами сочетания при условиях, описанных в литературе для реакций Судзуки-Мияура, Сонога-5 020771 Например, соединение формулы (Н) можно обработать алкил- или алкенилбороновой кислотой, R1B(OH)2, ее боронатным эфиром, R1-B(OR")2 (предпочтительно эфиром, в котором фрагмент -B(OR")2 означает циклический боронатный эфир, полученный из 1,2- или 1,3-алкандиола, такого как пинакон, 2,2 диметил-1,3-пропандиол или 2-метил-2,4-пентандиол), или алкил-, алкенил- или алкинилтрифторборатом металла (предпочтительно калия), R1-BF3-M+ в присутствии подходящего палладиевого катализатора,подходящего лиганда и подходящего основания в присутствии подходящего растворителя при условиях проведения реакции Судзуки-Мияура (см., например, I. Kondolff, H. Doucet and M, Santelli, Tetrahedron,(2004), 60, 3813-3818; F. Bellina, A. Carpita и R. Rossi, Synthesis (2004), 15, 2419-2440; G. Molander and C-S Альтернативно, соединение формулы (А), в которой R обозначает этинил, можно получить из соединения формулы (Н) путем обработки ацетиленом или триметилсилилацетиленом, в присутствии подходящего палладиевого катализатора, подходящего лиганда, и подходящего основания, необязательно в присутствии подходящего содержащего медь сокатализатора и подходящего растворителя, как это описано, например, в публикациях К. Sonogashira, J. Organomet. Chem., (2002), 653, 46-49 и N. Leadbeater and В. Tominack, Tetrahedron Lett., (2003), 8653-8656. Специалисты в данной области техники должны понимать, что для реакции с участием триметилсилилацетилена потребуется проведение дополнительной стадии гидролиза при известных условиях (см., например, S. Courts et al., Tetrahedron Lett., (1994), Vol. 35,No. 29, 5109-5112; С Hutton et al, Tetrahedron Lett., (2004), 45, 6657-6660). Соединение формулы (А), в которой R1 обозначает этинил, можно восстановить в соединение фор-6 020771 мулы (А), в которой R1 обозначает этил, при стандартных условиях (например, путем каталитического гидрирования). В другой методике получения соединения формулы (А), в которой R1 обозначает алкенил или алкинил, соединение формулы (Н) можно ввести в реакцию сочетания с алкенил- или алкинилстаннаном при условиях, описанных в литературе для проведения реакции Стилле (обзор по реакции Стилле см. в публикации V. Farina, V. Krishnamurthy and W.Scott, Org. React., (1997), 50, 1-652). Предпочтительно, если алкенил- или алкинилстаннан представляет собой трибутилстаннан, (Bu3Sn-R1), и реакцию проводят в присутствии подходящего палладиевого катализатора, подходящего лиганда, и необязательно в присутствии содержащего медь сокатализатора и добавки, как это описано, например, в публикации S. Мее, V. Как и выше, соединение формулы (А), в которой R1 обозначает алкенил или алкинил, можно восстановить в соединение формулы (А), в которой R1 обозначает алкил, при известных условиях (например, путем каталитического гидрирования). Специалисты в данной области техники должны понимать, что указанные выше реакции перекрестного сочетания также можно проводить при условиях, аналогичных использованным для получения соединения формулы I; последующая циклизация при условиях, ранее описанных для соединения формулы (В), также даст соединения формулы (А). Кроме того, специалисты в данной области техники также должны понимать, что дополнительные соединения формулы (А) можно получить из промежуточных продуктов Ga, Gb и Gc при аналогичных условиях с использованием подходящих реагентов. Например, соединения формулы (Gb) можно превратить в соединения формулы (D), в которой R3 обозначает необязательно замещенный арил или необязательно замещенный гетероарил, по реакции с подходящей арил- или гетероарилбороновой кислотой, R3-B(OH)2, или ее подходящим эфиром, или с арил- или гетероарилтрифторборатом металла (предпочтительно калия), в присутствии подходящего палладиевого катализатора при известных условиях проведения реакции Судзуки-Мияура (см., например, S-D Cho et al., Tetrahedron, (2007), 63, 1345-1352; M. Lysen and К. Kohler, Synthesis, (2006), 4, 692698; G. Zhang, Synthesis, (2005), 4, 537-542; F. Bellina, A. Carpita и R. Rossi, Synthesis (2004), 15, 24192440; S. Walker, T. Barder, J. Martinelli and S. Buchwald, Angew. Chem. Int. Ed., (2004), 43, 1871-1876; Y.Wang and D. Sauer, Org. Lett., (2004), 6 (16), 2793-2796; T. Barder and S. Buchwald, Org. Lett., (2004), 6 (16),2649-2652; A. Bouillon et al., Tetrahedron, (2003), 59, 10043-10049; A. Littke и G. Fu, Angew. Chem. Int. Ed.,(2002), 41, 4176-4211; F. Lieb et al., WO99/48869). Эти соединения формулы (D) можно превратить в соединения формулы (А) по описанной ранее методике. По другой методике соединение формулы (А) можно получить по реакции соединения формулы (J) с трикарбоксилатом фенилсвинца, предпочтительно фенилилтриацетатом свинца формулы (K), в присутствии подходящего лиганда (например, 4-диметиламинопиридина, пиридина, имидазола, бипиридина или 1,10-фенантролина, и предпочтительно использовать 1-10 экв. 4-диметиламинопиридина в пересчете на соединение (J в подходящем растворителе (например, хлороформе, дихлорметане или толуоле,предпочтительно - хлороформе и необязательно в присутствии сорастворителя, такого как толуол) при температуре от 25 до 100 С (предпочтительно 60-90 С). Аналогичные реакции описаны в литературе Соединения формулы (J) являются известными соединениями или их можно получить по методи-7 020771Beaudegnies, С. Luethy, A. Edmunds, J. Schaetzer and S. Wendeborn, WO 2005/123667; J-C. Beloeil, J-Y. Lallemand, T. Prange, Tetrahedron, (1986), Vol. 42. No. 13, 3491-3502; H. Favre et al, Can. J. Chem. (1956), 34 1329-39). Соединение формулы (К) можно получить из соединения формулы (L) путем обработки тетраацетатом свинца в подходящем растворителе (например, хлороформе) при температуре от 25 до 100 С (предпочтительно - 25-50 С), необязательно в присутствии катализатора, такого как диацетат ртути, по методикам, описанным в литературе (например, см., K. Shimi, G. Boyer, J-P. Finet and J-P. Galy, Letters in Organic Chemistry, (2005), 2, 407-409; J. Morgan and J. Pinhey, J. Chem. Soc. Perkin Trans. 1, (1990), 3, 715720). Арилбороновую кислоту формулы (L) или ее эфир можно получить из арилгалогенида формулы(М), в которой Hal обозначает Br или I, по известным методикам (см., например, М. Murata et al, Synthesis, (2007), 3, 351-354; Т. Ishiyama, M. Murata and N. Miyaura, J. Org. Chem., (1995), 60, 7508-7510; W.J.Thompson and J. Gaudino, J. Org. Chem, (1984), 49, 5237 и R.T. Hawkins et al., J. Am. Chem. Soc, (1960), 82,3053). Например, фенилгалогенид формулы (М) можно обработать алкиллитием или алкилмагнийгалогенидом при низкой температуре и полученный арилмагниевый или ариллитиевый реагент ввести в реакцию с триалкилборатом и получить арилдиалкилборонат, который можно гидролизовать в кислой среде и получить искомую арилбороновую кислоту формулы (L) в кислой среде или при других известных условиях: Фенилгалогенид формулы (М) можно получить из анилина формулы (N) по известным методикам,например, по реакции Зандмайера, через соответствующую диазониевую соль (см., например, J. March,Advanced Organic Chemistry, 3rd Edition, John Wiley and Sons, pages 647-648 цитированную в ней литературу. Дополнительные примеры также см. в публикациях W. Denney et al., J. Med. Chem., (1991), 34, 217222; P. Knochel et al., Synthesis, (2007), No. 1, 81-84). Альтернативно, анилин формулы (N) можно диазотировать, диазониевую соль обработать борилирующим реагентом, таким как бис(пинаколято)дибор при условиях, описанных, например, в публикации D. Willis и R. Strongin, Tetrahedron Lett., (2000), 41, 86838686, и полученный боронатный эфир гидролизовать, как описано выше, и получить дополнительную арилбороновую кислоту формулы (L). Анилины формулы (N) являются известными соединениями или их можно получить по известным методикам из известных соединений. По другой методике соединение формулы (А) можно получить из соединения формулы (О) по реакции с фенилбороновой кислотой формулы (L) в присутствии подходящего палладиевого катализатора и основания, предпочтительно - в подходящем растворителе. Подходящими палладиевыми катализаторами обычно являются комплексы палладия(II) или палладия(0), например, дигалогениды палладия(II),ацетат палладия(II), сульфат палладия(II), бис(трифенилфосфин)палладий(II)дихлорид, бис(трициклопентилфосфин)палладий(II)дихлорид, бис(трициклогексилфосфин)палладий(II)дихлорид, бис(дибензилиденацетон)палладий(0) или тетракис(трифенилфосфин)палладий(0). Палладиевый катализатор также можно получить "in situ" из соединений палладия(II) или палладия(0) путем образования комплексов с необходимыми лигандами, путем, например, объединения соли палладия(II), с которой необходимо образовать комплекс, например, дихлорида палладия(II) (PdCl2) или ацетата палладия(II) (Pd(OAc)2), вместе с необходимым лигандом, например, трифенилфосфином (PPh3), трициклопентилфосфином или трициклогексилфосфином и выбранным растворителем, с соединением формулы (О), соединением формулы (L) и основанием. Подходящими также являются бидентатные лиганды, например, 1,1'-бис(дифенилфосфино)ферроцен или 1,2-бис(дифенилфосфино)этан. При нагревании реакционной среды "in situ" образуется комплекс палладия(II) или комплекс палладия(0), необходимый для реакции сочетания С-С и затем инициируется реакция сочетания С-С. Палладиевые катализаторы используют в количествах от 0,001 до 50 мол.%, предпочтительно - в количествах от 0,1 до 15 мол.% в пересчете на соединение формулы (О). Более предпочтительно, если источником палладия является ацетат палладия, основанием является гидроксид лития и растворителем является смесь 1,2-диметоксиэтана и воды в соотношении от 4:1 до 1:4. Реакцию также можно провести в присутствии других добавок, таких как тетралкиламмониевые соли, например, тетрабутиламмонийбромид: Соединение формулы (О) можно получить из соединения формулы (J) путем обработки (диацетокси)йодбензолом по методикам, описанным в публикациях K. Schank and С. Lick, Synthesis, (1983), 392,или Z Yang et al, Org. Lett, (2002), 4 (no 19), 3333: По другой методике соединение формулы (А) можно получить из соединения формулы I, в которойG обозначает С 1-С 4-алкил, путем гидролиза, предпочтительно в присутствии кислотного катализатора,такого как хлористо-водородная кислота, и необязательно в присутствии подходящего растворителя, такого как тетрагидрофуран. Соединение формулы I, в которой G обозначает С 1-С 4-алкил, можно получить по реакции соединения формулы (Р), в которой Hal обозначает галоген (предпочтительно бром или йод),с фенилбороновой кислотой (L) в присутствии подходящего палладиевого катализатора (например,0,001-50% ацетата палладия(II) в пересчете на соединение (Р и основания (например, от 1 до 10 экв. фосфата калия в пересчете на соединение (Р и предпочтительно - в присутствии подходящего лиганда(Р, и в подходящем растворителе (например, толуоле), предпочтительно - при температуре от 25 до 200 С. Аналогичные реакции сочетания известны из литературы (см. например, Y. Song, В. Kim and J.-N. Соединение формулы (Р), в которой G обозначает С 1-С 4-алкил, можно путем галогенирования соединения формулы (J), путем галогенирования соединения формулы (J) с последующим алкилированием полученного галогенида формулы (Q) С 1-С 4-алкилгалогенидом или три-С 1-С 4-алкилортоформиатом при известных условиях, например, по методикам, описанным в публикациях R. Shepherd and A. White (J.Chem. Soc. Perkin Trans. 1 (1987), 2153) и Y.-L. Lin et al. (Bioorg. Med. Chem. 10 (2002) 685-690). Альтернативно, соединение формулы (Р) можно получить путем алкилирования соединения формулы (J) С 1-С 4 алкилгалогенидом или три-C1-C4-алкилортоформиатом и галогенирования полученного енона формулы(R) при известных условиях (см. например, Y. Song, В. Kim and J.-N. Heo, Tetrahedron Letters (2005),46(36), 5987-5990). По другой методике соединение формулы (А) можно получить по реакции соединения формулы (J) с соединением формулы (М) в присутствии подходящего палладиевого катализатора, основания, предпочтительно - в присутствии подходящего лиганда и в подходящем растворителе и необязательно с помощью микроволнового излучения. Подходящими палладиевыми катализаторами обычно являются комплексы палладия(II) или палладия(0), например, дигалогениды палладия(II), ацетат палладия(II), сульфат палладия(II), бис(трифенилфосфин)палладий(II)дихлорид, бис(трициклопентилфосфин)палладий(II) дихлорид, бис(трициклогексилфосфин)палладий(II)дихлорид, бис(дибензилиденацетон)палладий(0) или тетракис(трифенилфосфин)палладий(0). Подходящие основания включают карбонаты, фосфаты, алкоксиды и амиды щелочных металлов. Подходящие лиганды включают фосфины, например, 2,2'-бис(ди-птолилфосфино)-1,1'-бинафтил, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 1,1'-бис(ди-о-толилфосфино) ферроцен, Xantphos, (2-ди-трет-бутилфосфино)-2'-метилбифенил, (2-дициклогексилфосфино)-2'-метилбифенил, (2-дициклогексилфосфино)-2' ,4',6'-триизопропилбифенил и т. п. Подходящие растворители включают тетрагидрофуран, 1,4-диоксан и 1,2-диметоксиэтан. Палладиевые катализаторы используют в количествах от 0,001 до 50 мол.%, предпочтительно в количествах от 0,1 до 15 мол.%, предпочтительно в количествах от 0,1 до 15 мол.% в пересчете на соединение формулы (J). Лиганды предпочтительно используют в отношениях от 1:1 до 2:1 к количеству палладиевого катализатора. Предпочтительно использовать от 1 до 5 экв. основания (в пересчете на соединение формулы (J, более предпочтительно использовать 2 или 3 экв. Еще более предпочтительно, если источником палладия является ацетат палладия(II) или бис(дибензилиденацетон)палладий(0) (предпочтительно - ацетат палладия(II), лигандом является (2 дициклогексилфосфино)-2',4',6'-триизопропилбифенил, основанием является фосфат калия и растворителем является 1,2-диметоксиэтан. Аналогичные условия описаны в литературе для проведения арилирования карбоциклических 1,3 дионов (см. например, J. Fox, X. Huang, A. Chieffi, S. Buchwald, J. Am. Chem. Soc. (2000), 122, 1360-1370;B. Hong et al. WO 2005/000233). Альтернативно, соединение формулы (А) можно получить по реакции соединения формулы (J) с соединением формулы (М) в присутствии подходящего содержащего медь(I) катализатора (например,0,001-50% йодида меди(I) в пересчете на соединение (J и основания (например, от 1 до 10 экв. карбоната цезия в пересчете на соединение (J и предпочтительно - в присутствии подходящего лиганда (например, 0,001-50% L-пролина в пересчете на соединение (J и в подходящем растворителе (например, диметилсульфоксиде), предпочтительно - при температуре от 25 до 200 С. Аналогичные реакции сочетания известны из литературы (см. например, Y. Jiang, N. Wu, H. Wu, M. He, Synlett, (2005), 18, 2731-2734). По другой методике соединение формулы I можно получить по реакции соединения формулы (Т) с фенил- или гетероарилбороновой кислотой формулы.R2-B(OH)2 или ее подходящим производным, таким как трифторборат металла (предпочтительно калия) или эфир (такой как полученный из 1,2- или 1,3-алкандиола, например, пинакона, 2,2-диметил 1,3-пропандиола или 2-метил-2,4-пентандиола) при условиях проведения реакции Судзуки-Мияура. Соединение формулы (Т), в которой G обозначает Н, можно получить по реакции соединения формулы(J) с трикарбоксилатом фенилсвинца, предпочтительно - фенилилтриацетатом свинца формулы (S), в которойHal обозначает хлор или бром, в присутствии подходящего лиганда (например, 4-диметиламинопиридина,пиридина, имидазола, бипиридина или 1,10-фенантролина, и предпочтительно использовать 1-10 экв. 4 диметиламинопиридина в пересчете на соединение (S в подходящем растворителе (например, хлороформе,дихлорметане или толуоле, предпочтительно - хлороформе и необязательно в присутствии сорастворителя,такого как толуол) при температуре от 25 до 100 С (предпочтительно 60-90 С). Соединение формулы (S) можно получить из фенилбороновой кислоты формулы (U) при условиях,аналогичных использованным для получения соединения формулы (K) из соединения формулы (L). Соединение формулы (U) можно получить из фенилйодида формулы (V) по известным методикам. Борилирование фенилйодида формулы (V) можно провести при различных известных условиях (см., например, W. Zhu and D. Ma, Org. Lett., (2006), Vol. 6, No. 2 (261-263); M. Murata et al., Synthesis, 2007, No. 3, 351-354; K-T Wong et al, J. Org. Chem., (2002) 67, 1041-1044); гидролиз полученного фенилбората в фенилбороновую кислоту формулы (U) также известен (см., например, S. Coutts et al., Tetrahedron Lett.,(1994), Vol. 35, No. 29, 5109-5112; С Hutton et al., Tetrahedron Lett, (2004), 45, 6657-6660). Фенилйодид формулы (V) можно получить из анилина формулы (W) при различных условиях проведения реакции Альтернативно соединение формулы (U) можно получить из анилина формулы (W) путем диазотирования с образованием фенилдиазониевой соли формулы (X) с последующим борилированием полученной диазониевой соли по методикам, описанным, например, в публикации D. Willis и R. Strongin,(Tetrahedron Lett., (2000), 41, 8683-8686) и полученный боронатный эфир можно превратить в бороновую кислоту формулы (U), как это описано выше. По другой методике соединение формулы I можно получить по реакции соединения формулы (T1) с фенил- или гетероарилбороновой кислотой формулы R3-В(ОН)2 или ее подходящим производным, таким как трифторборат металла (предпочтительно калия) или эфир (такой как полученный из 1,2- или 1,3 алкандиола, например, пинакона, 2,2-диметил-1,3-пропандиола или 2-метил-2,4-пентандиола) при условиях проведения реакции Судзуки-Мияура. Соединение формулы (T1), в которой G обозначает Н, можно получить из соединения формулы (W1) по методикам, аналогичным использованным для получения соединения формулы (Т) из соединения формулы (W): Анилины формулы (W) и формулы (W1) являются известными соединениями или их можно получить по известным методикам из известных соединений. Соединения формул (Т) и (T1) разработаны специально для синтеза соединений формулы I. По другой методике соединение формулы I можно получить из фенилбороновой кислоты формулы(Y) или ее подходящего эфира или соли путем перекрестного сочетания с фенил- или гетероарилгалогенидом, R2-Hal, где Hal предпочтительно обозначает хлор, бром или йод, при условиях проведения реакции Судзуки-Мияура. Соединение формулы (Y) можно получить из соединения формулы (Т) путем обработки по меньшей мере двумя эквивалентами подходящего металлирующего реагента, такого как алкиллитий или алкилмагнийгалогенид, в растворителе, таком как тетрагидрофуран или диэтиловый эфир, или путем обработки по меньшей мере одним эквивалентом подходящего основания (такого как гидрид натрия) с последующей обработкой полученного аниона по меньшей мере одним эквивалентом подходящего металлирующего реагента в растворителе, таком как тетрагидрофуран или диэтиловый эфир, и реакции полученных металлоорганических соединений с подходящим борилирующим реагентом, таким как триметилборат, с получением фенилбороната формулы (Z), в которой R"' обозначает алкильную группу, предпочтительно метил. Фенилборонат формулы (Z) можно гидролизовать в кислой среде и получить фенилбороновую кислоту формулы (Y). Альтернативно соединение формулы (Т) можно ввести в реакцию с борилирующим реагентом H-B(OR")2 или (R"O)2B-B(OR")2 при известных условиях (см., например, М.D. Ma, Org. Lett., (2006), 8 (2), 261) и получить соединение формулы (Z). Подходящие борилирующие реагенты включают бис(пинаколято)дибор, бис(неопентилгликолято)дибор, бис(гексиленгликолято)дибор и 4,4,5,5-тетраметил-1,3,2-диоксаборолан. Соединение формулы (Z), в которой фрагмент -B(OR")2 представляет собой циклический боронатный эфир, можно ввести в реакцию сочетания с фенил- или гетероарилгалогенидом R3-Hal при условиях проведения реакции Судзуки-Мияура. Альтернативно, соединение формулы I можно получить из фенилбороновой кислоты формулы (Y1) или ее подходящего эфира или соли путем перекрестного сочетания с фенил- или гетероарилгалогенидом, R2-Hal, где Hal предпочтительно обозначает хлор, бром или йод, при условиях проведения реакции Судзуки-Мияура. Соединение формулы (Y1) можно получить из соединения формулы (T1) по методикам, аналогичным использованным для получения соединения формулы (Y) из соединения формулы (Т). Соединения формул (Y) и (Y1) разработаны специально для синтеза соединений формулы I. Соединения формулы I, предлагаемые в настоящем изобретении, можно использовать в качестве гербицидов в неизмененном виде, т. е. в том виде, в котором они получены при синтезе, но обычно их различным образом включают в гербицидные композиции с использованием вспомогательных веществ,таких как носители, растворители и поверхностно-активные вещества. Композиции могут находится в различных формах, например, в виде порошков для опудривания, гелей, смачивающихся порошков, диспергирующихся в воде гранул, диспергирующихся в воде таблеток, шипучих прессованных таблеток,эмульгирующихся концентратов, микроэмульгирующихся концентратов, эмульсий масло-в-воде, текучих масел, водных дисперсий, масляных дисперсий, суспоэмульсий, суспензий капсул, эмульгирующихся гранул, растворимых жидкостей, растворимых в воде концентратов (с водой или смешивающимся с водой органическим растворителем в качестве носителя), пропитанных полимерных пленок или в других формах, описанных, например, в руководстве Manual on Development and Use of FAO Specifications forPlant Protection Products, 5th Edition, 1999. Такие композиции можно использовать непосредственно или можно разбавить перед использованием. Разбавление можно провести, например, водой, жидкими удобрениями, питательными микровеществами, биологическими организмами, маслом или растворителями. Композиции можно получить, например, путем смешивания активного ингредиента со вспомогательными веществами для приготовления композиций и получить композиции в виде тонкоизмельченных твердых веществ, гранул, растворов, дисперсий или эмульсий. Активные ингредиенты также можно смешать с другими вспомогательными веществами, такими как тонкоизмельченные твердые вещества,минеральные масла, растительные масла, модифицированные растительные масла, органические растворители, вода, поверхностно-активные вещества или их комбинации. Активные ингредиенты также могут содержаться в очень мелких микрокапсулах, состоящих из полимера. Микрокапсулы содержат активные ингредиенты в пористом носителе. Это обеспечивает выделение активных ингредиентов в окружающую среду в регулируемом количестве (например, медленное выделение). Микрокапсулы обычно обладают диаметром, равным от 0,1 до 500 мкм. Они содержат активные ингредиенты в количество, составляющем примерно от 25 до 95 мас.% в пересчете на массу капсулы. Активные ингредиенты могут содержаться в виде сплошного твердого вещества, в виде мелких частиц в твердой или жидкой дисперсии или в виде соответствующего раствора. Капсулирующие мембраны включают, например, натуральные и синтетические камеди, целлюлозу, сополимеры стирола с бутадиеном, полиакрилонитрил, полиакрилат, сложный полиэфир, полиамиды, полимочевины, полиуретан или химически модифицированные полимеры и ксантаты крахмала или другие полимеры, известные в этом контексте специалисту в данной области техники. Альтернативно, можно получить очень мелкие микрокапсулы, в которых активный ингредиент содержится в виде тонкоизмельченных твердых частиц в твердой матрице основного вещества, но в этом случае микрокапсулы не капсулированы. Вспомогательные вещества, которые пригодны для получения композиций, предлагаемых в настоящем изобретении, сами по себе известны. В качестве жидких носителей можно использовать: воду,толуол, ксилол, петролейный эфир, растительные масла, ацетон, метилэтилкетон, циклогексанон, ангидриды кислот, ацетонитрил, ацетофенон, амилацетат, 2-бутанон, бутиленкарбонаты, хлорбензол, циклогексан, циклогексанол, алкиловые эфиры уксусной кислоты, диацетоновый спирт, 1,2-дихлорпропан,диэтаноламин, п-диэтилбензол, диэтиленгликоль, диэтиленгликольабиетат, бутиловый эфир диэтиленгликоля, этиловый эфир диэтиленгликоля, метиловый эфир диэтиленгликоля, N,N-диметилформамид,диметилсульфоксид, 1,4-диоксан, дипропиленгликоль, метиловый эфир дипропиленгликоля, дипропиленгликольдибензоат, дипроксит, алкилпирролидон, этилацетат, 2-этилгексанол, этиленкарбонат, 1,1,1 трихлорэтан, 2-гептанон, альфа-пинен, d-лимонен, этиллактат, этиленгликоль, бутиловый эфир этиленг- 13020771 ликоля, метиловый эфир этиленгликоля, гамма-бутиролактон, глицерин, глицеринацетат, глицериндиацетат, глицеринтриацетат, гексадекан, гексиленгликоль, изоамилацетат, изоборнилацетат, изооктан,изофорон, изопропилбензол, изопропилмиристат, молочную кислоту, лауриламин, мезитилоксид, метоксипропанол, метилизоамилкетон, метилизобутилкетон, метиллаурат, метилоктаноат, метилолеат, метиленхлорид, м-ксилол, н-гексан, н-октиламин, октадекановую кислоту, актиламинацетат, олеиновую кислоту, олеиламин, о-ксилол, фенол, полиэтиленгликоль (ПЭГ 400), пропионовую кислоту, пропиллактат,пропиленкарбонат, пропиленгликоль, метиловый эфир пропиленгликоля, п-ксилол, толуол, триэтилфосфат, триэтиленгликоль, ксилолсульфоновую кислоту, парафин, минеральное масло, трихлорэтилен, перхлорэтилен, этилацетат, амилацетат, бутилацетат, метиловый эфир пропиленгликоля, метиловый эфир диэтиленгликоля, метанол, этанол, изопропанол и спирты, обладающие большей молекулярной массой,такие как амиловый спирт, тетрагидрофурфуриловый спирт, гексанол, октанол, этиленгликоль, пропиленгликоль, глицерин, N-метил-2-пирролидинон и т. п. Для разбавления концентратов в качестве носителя обычно выбирают воду. Подходящими твердыми носителями обычно являются, например, тальк, диоксид титана, пирофиллитовая глина, диоксид кремния, аттапульгитовая глина, кизельгур, известняк,карбонат кальция, бентонит, монтмориллонит кальция, шелуха семян хлопка, пшеничная мука, соевая мука, пемза, древесная мука, размолотая скорлупа грецких орехов, лигнин и аналогичные вещества, такие как описанные, например, в CFR 180.1001 (с)(d). Большое количество поверхностно-активных веществ с успехом можно использовать и в твердых, и в жидких композициях, в особенности в таких, которые перед применением можно разбавить носителем. Поверхностно-активные вещества могут быть анионогенными, катионогенными, неионогенными или полимерными и их можно использовать в качестве эмульгирующих агентов, смачивающих или суспендирующих агентов или для других целей. Типичные поверхностно-активные вещества включают, например, соли алкилсульфатов, такие как диэтаноламмонийлаурилсульфат; соли алкиларилсульфонатов,такие как додецилбензолсульфонат кальция; продукты присоединения алкилфенолов к алкиленоксидам,такие как нонилфенолэтоксилат; продукты присоединения спиртов к алкиленоксидам, такие как этоксилат тридецилового спирта; мыла, такие как стеарат натрия; соли алкилнафталинсульфонатов, такие как дибутилнафталинсульфонат натрия; диалкиловые эфиры сульфосукцинатных солей, такие как ди(2 этилгексил)сульфосукцинат натрия; сложные эфиры сорбита, такие как сорбитолеат; четвертичные амины, такие как лаурилтриметиламмонийхлорид, сложные эфиры полиэтиленгликоля и жирных кислот,такие как полиэтиленгликольстеарат; блок-сополимеры этиленоксида с пропиленоксидом; и соли монои диалкилфосфатов; а также другие вещества, описанные, например, в публикации "McCutcheon's Detergents and Emulsiflers Annual" MC Publishing Corp., Ridgewood New Jersey, 1981. Другие вспомогательные вещества, которые обычно можно использовать в пестицидных композициях, включают ингибиторы кристаллизации, вещества, модифицирующие вязкость, суспендирующие агенты, красители, антиоксиданты, вспенивающие агенты, поглощающие свет агенты, вспомогательные вещества, способствующие смешиванию, противовспенивающие вещества, комплексообразователи, нейтрализующие или меняющие рН вещества и буферы, ингибиторы коррозии, отдушки, смачивающие агенты, вещества, улучшающие абсорбцию, питательные микроэлементы, пластификаторы, вещества,придающие скользкость, смазывающие вещества, диспергирующие вещества, загущающие агенты, антифризные агенты, микробицидные агенты, а также жидкие и твердые удобрения. Композиции также могут содержать дополнительные активные вещества, например, другие гербициды, вещества, антидоты гербицидов, регуляторы роста растений, фунгициды или инсектициды. Композиции, предлагаемые в настоящем изобретении, могут дополнительно включать добавки,включающие масла растительного или животного происхождения, минеральное масло, алкиловые эфиры таких масел или смеси такхи масел и производных масел. Количество добавки масла, использующееся в композициях, предлагаемых в настоящем изобретении, обычно составляет от 0,01 до 10% в пересчете на смесь для опрыскивания. Например, добавку масла можно прибавить в бак для опрыскивания в необходимой концентрации после приготовления смеси для опрыскивания. Предпочтительные прибавляемые масла включают минеральные масла и масла растительного происхождения, например, рапсовое масло,оливковое масло или подсолнечное масло, эмульгированное растительное масло, такое как AMIGO(Rhone-Poulenc Canada Inc.), алкиловые эфиры масел растительного происхождения, например, метилпроизводные, или масло животного происхождения, такое как рыбий жир или говяжий жир. Предпочтительная добавка, например, содержит в качестве активных компонентов в основном 80% алкиловых эфиров рыбьего жира и 15 мас.% метилированного рапсового масла и 5 мас.% обычных эмульгаторов и веществ, изменяющих рН. Особенно предпочтительные добавки масла включают алкиловые эфиры С 8-С 22 жирных кислот, метилпроизводные С 12-С 18-жирных кислот, например, особенно предпочтительными являются метиловые эфиры лауриновой кислоты, пальмитиновой кислоты и олеиновой кислоты. Эти сложные эфиры известны, как метиллаурат (CAS-111-82-0), метилпальмитат (CAS-112-39-0) и метилолеат (CAS-112-62-9). Предпочтительным метилпроизводным жирной кислоты является Emery 2230 и 2231 (Cognis GmbH). Эти и другие добавки масла также описаны в публикации Compendium of HerbicideAdjuvants, 5th Edition, Southern Illinois University, 2000. Другой предпочтительной добавкой являетсяAdigor (Syngenta AG), которая представляет собой вспомогательное вещество на основе метилирован- 14020771 ного рапсового масла. Внесение и воздействие добавок масла можно дополнительно улучшить путем их комбинирования с поверхностно-активными веществами, такими как неионогенные, анионогенные или катионогенные поверхностно-активные вещества. Примеры подходящих анионогенных, неионогенных и катионогенных поверхностно-активных веществ приведены на стр. 7 и 8 в WO 97/34485. Предпочтительными поверхностно-активными веществами являются анионогенные поверхностно-активные вещества типа додецилбензолсульфоната, в особенности их кальциевые соли, а также неионогенные поверхностно-активные вещества типа этоксилатов жирных спиртов. Особое предпочтение отдается этоксилированным С 12-С 22 жирным спиртам, обладающим степенью этоксилирования, составляющей от 5 до 40. Примерами имеющихся в продаже поверхностно-активных веществ являются вещества типа Genapol (Clariant AG). Также предпочтительными являются силиконовые поверхностно-активные вещества, в особенности модифицированные полиалкилоксидом гептаметилтрисилоксаны, которые имеются в продаже, например, под названием Silwet L-77, а также перфорированные поверхностно-активные вещества. Концентрация поверхностно-активных веществ в пересчете на всю добавку обычно составляет от 1 до 30 мас.%. Примерами добавок масел, которые состоят из смеси масел или минеральных масел или их производных с поверхностно-активными веществами, являются Edenor ME SU, Turbocharge (Syngenta AG, CH) и Actipron(BP Oil UK Limited, GB). Указанные поверхностно-активные вещества также можно использовать в композициях по отдельности, т. е. без добавки масла. Прибавление органического растворителя к смеси добавка масла/поверхностно-активное вещество также может привести к дополнительному усилению воздействия. Подходящими растворителями являются, например, Solvesso(ESSO) и Aromatic Solvent (Exxon Corporation). Концентрация таких растворителей может составлять от 10 до 80 мас.% в пересчете на полную массу. Такие добавки масла, которые содержатся в смеси с растворителями, описаны, например, в US-A-4834908. Описанные в нем имеющиеся в продаже добавки масла, известны под названием MERGE (BASF Corporation). Другой добавкой масла, которая предпочтительна для настоящего изобретения, является SCORE (Syngenta Crop Protection Canada). В дополнение к добавкам масла, перечисленным выше, для усиления воздействия композиций,предлагаемых в настоящем изобретении, в смесь для опрыскивания также можно прибавлять композиции алкилпирролидонов (например, Agrimax). Для этой цели также можно использовать композиции синтетических латексов, такие как, например, полиакриламиды, поливинилы и поли-1-п-ментен (например, Bond, Courier или Emerald). В качестве усиливающих воздействие агентов со смесью для опрыскивания также можно смешать растворы, содержащие пропионовую кислоту, например, EurogkemPen-e-trate. Гербицидные композиции обычно содержат от 0,1 до 99 мас.%, предпочтительно от 0,1 до 95 мас.%, соединения формулы I и от 1 до 99,9 мас.% вспомогательного вещества композиции, которое предпочтительно содержит от 0 до 25 мас.% поверхностно-активного вещества. В то время как имеющиеся в продаже продукты предпочтительно готовят в виде концентратов, конечный потребитель обычно использует разбавленные композиции. Нормы расхода соединений формулы I могут меняться в широких пределах и зависят от характера почвы, методики внесения (до- или послевсходовое; протравливание семян; внесение в борозды для семян; внесение без обработки почвы и т. п.), возделываемого растения, сорняка или травянистого растения, с которыми необходимо бороться, преобладающих климатических условий и других факторов, зависящих от методики внесения, времени внесения и обрабатываемой культуры. Соединения формулы I,предлагаемые в настоящем изобретении, обычно вносят в дозе, составляющей от 1 до 4000 г/га, предпочтительно - от 5 до 1000 г/га. Предпочтительные композиции преимущественно обладают следующими составами: (% = мас.%): Эмульгирующиеся концентраты: активный ингредиент: от 1 до 95%, предпочтительно от 60 до 90%; поверхностно-активное вещество: от 1 до 30%, предпочтительно от 5 до 20%; жидкий носитель: от 1 до 80%, предпочтительно от 1 до 35%. Дусты: активный ингредиент: от 0,1 до 10%, предпочтительно от 0,1 до 5%; твердый носитель: от 99,9 до 90 %, предпочтительно от 99,9 до 99%. Концентраты суспензий: активный ингредиент: от 5 до 75 %, предпочтительно от 10 до 50%; вода: от 94 до 24 %, предпочтительно от 88 до 30%; поверхностно-активное вещество: от 1 до 40 %, предпочтительно от 2 до 30%. Смачивающиеся порошки: активный ингредиент: от 0,5 до 90%, предпочтительно от 1 до 80%; поверхностно-активное вещество: от 0,5 до 20 %, предпочтительно от 1 до 15%; твердый носитель: от 5 до 95 %, предпочтительно от 15 до 90%. Гранулы: активный ингредиент: от 0,1 до 30%, предпочтительно от 0,5 до 15%; твердый носитель: от 99,9 до 70%, предпочтительно от 97 до 85%. Приведенные ниже примеры дополнительно иллюстрируют, но не ограничивают настоящее изобретение. Эмульсии любой необходимой концентрации можно получить из таких концентратов путем разбавления водой. Молекулярная масса. Растворы пригодны для применения в виде микрокапелек. Активный ингредиент тщательно смешивают со вспомогательными веществами и смесь тщательно размалывают на подходящей мельнице и получают смачивающиеся порошки, которые можно разбавить водой и получить суспензии любой необходимой концентрации. Активный ингредиент растворяют в метиленхлориде и наносят на носитель путем разбрызгивания,а затем растворитель выпаривают в вакууме. В смесителе тонкоразмолотый активный ингредиент равномерно наносят на носитель, смоченный полиэтиленгликолем. Таким образом получают не образующие пыли гранулы с покрытием. Активный ингредиент смешивают со вспомогательными веществами и смесь увлажняют водой. Смесь экструдируют и затем сушат в потоке воздуха. Готовые к применению дусты получают смешиванием активного ингредиента с носителями и размолом смеси на подходящей мельнице. Тонкоразмолотый активный ингредиент тщательно смешивают со вспомогательными веществами с получением концентрата суспензии, из которых путем разбавления водой можно получить суспензии любой необходимой концентрации. Настоящее изобретение также относится к способу селективной борьбы с травянистыми растениями и сорняками в культурах полезных растений, который включает обработку полезных растений или места их выращивания, или места их произрастания соединением формулы I. Культуры полезных растений, для которых можно применять композиции, предлагаемые в настоящем изобретении, включают злаки, хлопок, сою, сахарную свеклу, сахарный тростник, плантационные культуры, рапс, кукурузу и рис, и их используют для неселективной борьбы с сорняками. Термин "культуры" следует понимать и как включающий культуры, которым придана стойкость к гербицидам или классам гербицидов (например, к ингибиторам АЛС (ацетолактатсинтаза), ГС (глутаминсинтетаза),ЕПШФС (5-енолпирувилшикимат-3-фосфатсинтаза), ПФО (полифенолоксидаза), ACCase (ацетил-СоАкарбоксилаза) и ГФПД (4-гидроксифенилпируватдиоксигеназа с помощью обычных методик селекции или генной инженерии. Примером культуры, которой с помощью обычных методик селекции придана стойкость, например, к имидазолинонам, таким как имазамокс, является сурепица Clearfield (канола). Примерами культур, которым с помощью методик генной инженерии придана стойкость к гербицидам,являются сорта кукурузы, стойкие, например, к глифозату или глуфозинату, которые имеются в продаже под торговыми названиями RoundupReadyи LibertyLink соответственно. Сорняками, с которым проводят борьбу, могут быть однодольные и двудольные сорняки, такие как,например, Stellaria, Nasturtium, Agrostis, Digitaria, Avena, Setaria, Sinapis, Lolium, Solarium, Echinochloa,Scirpus, Monochoria, Sagittaria, Bromus, Alopecurus, Sorghum, Rottboellia, Cyperus, Abutilon, Sida,Xanthium, Amaranthus, Chenopodium, Ipomoea, Chrysanthemum, Galium, Viola и Veronica. Под культурами также следует понимать такие, у которых методами генной инженерии была выработана стойкость к насекомым-вредителями и в качестве примера которых можно назвать Bt-кукурузу(стойкую по отношению к кукурузному мотыльку), Bt-хлопчатник (устойчивый к хлопковому долгоносику), а также различные сорта Bt-картофеля (устойчивого к колорадскому жуку). Примерами Btкукурузы являются гибриды кукурузы Bt-176 сорта NK (Syngenta Seeds). Токсин Bt представляет собой белок, вырабатываемый в естественных условиях почвенными бактериями Bacillus thuringiensis. Примеры токсинов и трансгенных растений, способных синтезировать подобные токсины, описаны в ЕР-А 451878, ЕР-А-374753, WO 93/07278, WO 95/34656, WO 03/052073 и ЕР-А-427529. Примерами трансгенных растений, которые содержат один или большее количество генов, которые кодируют стойкость к инсектицидам и вырабатывают один или большее количество токсинов, являются KnockOut(кукуруза), Yield Gard (кукуруза), NuCOTIN33B (хлопок), Bollgard (хлопок), NewLeaf(картофель), NatureGardи Protexcta . Культурные растения и их семенной материал может быть стойким по отношению к гербицидам и одновременно также к поеданию насекомыми (совмещенные трансгенные характеристики). Семена могут, например, обладать способностью вырабатывать обладающий инсектицидной активностью белок Cry3 и одновременно являться стойкими по отношению к глифозату. Термин "культуры" следует понимать, как включающий и культуры, полученные по обычным методикам селекции или генной инженерии, которые обладают дополнительными характеристиками (например, улучшенными вкусом, стабильностью при хранении, содержанием питательных веществ). Под посевными площадями следует понимать участки, на которых уже растут культурные растения, а также участки, предназначенные для выращивания этих культурных растений. Соединения формулы I, предлагаемые в настоящем изобретении, также можно использовать в комбинации с другими гербицидами. Приведенные ниже смеси, содержащие соединение формулы I, являются особенно важными. Предпочтительно, если в этих смесях соединение формулы I является одним из соединений, приведенных ниже в табл. 1-35: соединение формулы I + ацетохлор, соединение формулы I + ацифлюорфен, соединение формулы II + тебутам, соединение формулы I + тебутиурон, соединение формулы I + тефурилтрион, соединение формулы I + темботрион, соединение формулы I + тепралоксидим, соединение формулы I + тербацил,соединение формулы I + тербуметон, соединение формулы I + тербутилазин, соединение формулы I + тербутрин, соединение формулы I + тенилхлор, соединение формулы I + тиазафлурон, соединение формулы I + тиазопир, соединение формулы I + тифенсульфурон, соединение формулы I + тиенкарбазон,соединение формулы I + тифенсульфурон-метил, соединение формулы I + тиобенкарб, соединение формулы I + тиокарбазил, соединение формулы I + топрамезон, соединение формулы I + тралкоксидим, соединение формулы I + триаллат, соединение формулы I + триасульфурон, соединение формулы I + триазифлам, соединение формулы I + трибенурон, соединение формулы I + трибенурон-метил, соединение формулы I + трикамба, соединение формулы I + триклопир, соединение формулы I + триэтазин, соединение формулы I + трифлоксисульфурон, соединение формулы I + трифлоксисульфуроннатрий, соединение формулы I + трифлуралин, соединение формулы I + трифлусульфурон, соединение формулы I + трифлусульфурон-метил, соединение формулы I + тригидрокситриазин, соединение формулы I + тринексапак-этил, соединение формулы I + тритосульфурон, соединение формулы I + этиловый эфир [3-[2 хлор-4-фтор-5-(1-метил-6-трифторметил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-3-ил)фенокси]-2 пиридилокси]уксусной кислоты (регистрационныйCAS 353292-31-6), соединение формулы 1 + 4 гидрокси-3-2-[(2-метоксиэтокси)метил]-6-(трифторметил)-3-пиридинил]карбонил]-бицикло[3.2.1]окт-3 ен-2-он (регистрационныйCAS 352010-68-5), и соединение формулы I + 4-гидрокси-3-2-(3 метоксипропил)-6-(дифторметил)-3-пиридинил]карбонил]бицикло[3.2.1]окт-3-ен-2-он. Компоненты для смешивания с соединением формулы I также могут представлять собой сложные эфиры или соли, указанные, например, в публикации The Pesticide Manual, Twelfth Edition, British CropProtection Council, 2000. Соотношение смешивания соединения формулы I с компонентом для смешивания предпочтительно составляет от 1: 100 до 1000:1. Смеси можно с успехом использовать в указанных выше композициях (и в этом случае "активный ингредиент" означает соответствующую смесь соединения формулы I с компонентом для смешивания). Соединения формулы I, предлагаемые в настоящем изобретении, также можно использовать в комбинации с антидотами. Предпочтительно, если в этих смесях соединение формулы I является одним из соединений, приведенных ниже в таблицах 1-35. Приведенные ниже смеси, содержащие антидоты, являются особенно важными: соединение формулы I + клохинтоцет-мексил, соединение формулы I + клохинтоцетовая кислота и ее соли, соединение формулы I + фенхлоразол-этил, соединение формулы I + фенхлоразоловая кислота и ее соли, соединение формулы I + мефенпир-диэтил, соединение формулы I + мефенпира дикислота, соединение формулы I + изоксадифен-этил, соединение формулы I + изоксадифеновая кислота, соединение формулы I + фурилазол, соединение формулы I + R-изомер фурилазола, соединение формулы I + беноксакор, соединение формулы I + дихлормид, соединение формулы I + AD-67, соединение формулы I + оксабетринил, соединение формулы I + циометринил, соединение формулы I + Z-изомер циометринила,соединение формулы I + фенклорим, соединение формулы I + ципросульфамид, соединение формулы I + нафтойный ангидрид, соединение формулы I + флуразол, соединение формулы I + N-(2 метоксибензоил)-4-[(метиламинокарбонил)амино]-бензолсульфонамид, соединение формулы I + CL 304,415, соединение формулы I + дициклонон, соединение формулы I + флуксофеним, соединение формулы I + DKA-24, соединение формулы I + R-29148 и соединение формулы I + PPG-1292. Антидотный эффект также можно обнаружить для смесей соединение формулы I + димрон, соединение формулы I + МСРА, соединение формулы I + мекопроп и соединение формулы I + мекопроп-Р. Указанные выше антидоты и гербициды описаны, например, в публикации Pesticide Manual, TwelfthWO09211761 и N-метоксибензоил)-4-[(метиламинокарбонил)амино]бензолсульфонамид описан в ЕР 365484. Норма расхода антидота по сравнению с гербицидом в значительной степени зависит от методики внесения. В случае обработки в поле обычно вносят от 0,001 до 5,0 кг антидота/га, предпочтительно - от 0,001 до 0,5 кг антидота/га, и обычно от 0,001 до 2 кг гербицида/га, но предпочтительно вносят от 0,005 до 1 кг/га. Гербицидные композиции, предлагаемые в настоящем изобретении, пригодны для всех методик внесения, обычно применяющихся в сельском хозяйстве, таких как, например, довсходовое внесение,послевсходовое внесение и протравливание семян. В зависимости от назначения антидоты можно использовать для предварительной обработки семенного материала культурного растения (протравливание семян или черенков) или вносить в почву до или после высевания, с последующим внесением не являющегося антидотом соединения формулы I, необязательно в комбинации со вспомогательным гербицидом. Однако их также можно вносить по отдельности или вместе с гербицидом до или после появления всходов растений. Поэтому обработку растений или семенного материала антидотом, в принципе, можно проводить независимо от времени внесения гербицида. Обработка растения путем одновременного внесения гербицида и антидота (например, в виде баковой смеси) обычно является предпочтительной. Норма расхода антидота по сравнению с гербицидом в значительной степени зависит от методики внесения. В случае обработки в поле обычно вносят от 0,001 до 5,0 кг антидота/га, предпочтительно - от 0,001 до 0,5 кг антидота/га. В случае протравливания семян обычно вносят от 0,001 до 10 г антидота/кг семян,предпочтительно - от 0,05 до 2 г антидота/кг семян. Если антидот используют в жидком виде при замачивании семян незадолго до высевания, то предпочтительно - использовать растворы антидота, которые содержат активный ингредиент в концентрации, равной от 1 до 10000 ч./млн, предпочтительно от 100 до 1000 ч./млн. Смеси можно с успехом использовать в указанных выше композициях (и в этом случае "активный ингредиент" означает соответствующую смесь соединения формулы I с компонентом для смешивания). Приведенные ниже примеры дополнительно иллюстрируют, но не ограничивают настоящее изобретение. Примеры получения соединений: Пример 1. Получение 3-(4'-хлор-4-метилбифен-3-ил)бицикло[3.2.1]октан-2,4-диона моль). После перемешивания реакционной смеси при 20 С в течение 15 мин к смеси добавляют 20% водный раствор карбоната натрия (300 мл) и полученную смесь кипятят с обратным холодильником в течение 24 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют водой (600 мл) и экстрагируют этилацетатом. Объединенные органические экстракты сушат над безводным сульфатом натрия, фильтруют и фильтрат выпаривают в вакууме. Затем остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя 7% раствором этилацетата в гексане, и получают 3-амино-4'хлор-4-метилбифенил (21,0 г). Стадия 2. Получение 3-бром-4'-хлор-4-метилбифенила К суспензии 3-амино-4'-хлор-4-метилбифенила (21 г, 0,09 моль) в воде (80 мл) по каплям добавляют бромистоводородную кислоту (48 мас.% в воде, 120 мл) и смесь перемешивают до растворения твердого вещества. Смесь охлаждают до -5 С и по каплям добавляют раствор нитрита натрия (10,12 г, 0,14 моль) в воде (50 мл), поддерживая температуру равной 0-5 С. Реакционную смесь перемешивают в течение 1 ч,затем при 0 С добавляют предварительно охлажденный раствор бромида меди (I) (17,9 г, 0,12 моль) в бромистоводородной кислоте (48 мас.% в воде, 120 мл). Реакционную смесь перемешивают и ей в течение ночи дают нагреться до комнатной температуры. Смесь экстрагируют этилацетатом и органические экстракты объединяют, сушат над безводным сульфатом натрия, фильтруют и фильтрат концентрируют в вакууме. Затем остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя 2% раствором этилацетата в гексане, и получают 3-бром-4'-хлор-4-метилбифенил (15,0 г). Стадия 3. Получение 4'-хлор-4-метилбифен-3-илбороновой кислоты 3-Бром-4'-хлор-4-метилбифенил (5,0 г, 0,02 моль) растворяют в безводном тетрагидрофуране (125 мл) и смесь охлаждают до -78 С. В течение 30 мин по каплям добавляют н-бутиллитий (1,33 М раствор в гексанах, 17,3 мл), поддерживая температуру равной примерно -78 С. Реакционную смесь перемешивают при -78 С в течение 1,5 ч, затем по каплям добавляют триметилборат (2,58 г, 0,024 моль) и реакционную смесь перемешивают в течение 3,5 ч, позволяя ей нагреться до 0 С. Затем по каплям добавляют 2 н. водный раствор хлористо-водородной кислоты (50 мл) и после завершения добавления смесь перемешивают в течение2 ч. Смесь концентрируют в вакууме для удаления большей части тетрагидрофурана, затем разбавляют водой (80 мл) и экстрагируют диэтиловым эфиром. Органические экстракты объединяют, сушат над безводным сульфатом натрия, фильтруют и фильтрат выпаривают в вакууме. Затем остаток очищают с помощью колоночной флэш-хроматографии на силикагеле, элюируя 7% раствором этилацетата в гексане, и получают 4'-хлор-4-метилбифен-3-илбороновую кислоту (2,5 г). Стадия 4. Получение 3-(4'-хлор-4-метилбифен-3-ил)бицикло[3.2.1]октан-2,4-диона. Стадия 4 а: (Диацетокси)йодбензол (1,17 г, 3,62 ммоль) и карбонат натрия (0,384 г, 3,62 ммоль) суспендируют в воде (10 мл) и смесь перемешивают при комнатной температуре в течение 15 мин. В течение 2 мин по каплям добавляют раствор бицикло[3.2.1]октан-2,4-диона (0,500 г, 3,62 ммоль), полученного по методике, описанной в публикации R. Beaudegnies et al., WO2005/123667, и карбонат натрия (0,384 г, 3,62 ммоль) в воде (10 мл) и после завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 2,5 ч. Реакционную смесь выливают в делительную воронку и экстрагируют хлороформом (320 мл). Органические экстракты объединяют, сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают в вакууме и получают йодонийилид (1,19 г) в виде белого твердого вещества. Стадия 4b: Смесь йодонийилида (0,600 г, 1,76 ммоль), полученного на стадии 4 а, 5-(4-хлорфенил)2-метилфенилбороновой кислоты (0,522 г, 2,12 ммоль), ацетата палладия (II) (0,020 г, 0,09 ммоль), тетран-бутиламмонийбромида (0,283 г, 0,88 ммоль) и моногидрата гидроксида лития (0,222 г, 5,28 ммоль) в атмосфере аргона перемешивают в смеси 1,2-диметоксиэтана (12 мл) и воды (3 мл). Реакционную смесь нагревают до 50 С, выдерживают при 50 С в течение 2 ч и затем ей дают охладиться до комнатной температуры. Реакционную смесь фильтруют через диатомовую землю, промывают 2 М водным раствором хлористо-водородной кислоты (40 мл) и этилацетатом (20 мл), затем фильтрат выливают в делительную воронку и органическую фазу собирают. Водную фазу экстрагируют этилацетатом (2 20 мл) и органические экстракты объединяют, сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают в вакууме. Остаток частично очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетата и гексана (градиентный режим, от 100% гексана до смеси 70% этилацетат/30% гексан), и получают частично очищенный образец искомого продукта. Дополнительную очистку проводят путем растворения продукта в этилацетате (20 мл) и экстракцией 0,5 М водным раствором карбоната калия (220 мл). Водные экстракты собирают, подкисляют до рН 2 путем добавления хлористоводородной кислоты и продукт экстрагируют этилацетатом (220 мл). Органические экстракты объединяют, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении и получают 3-(4'-хлор-4-метилбифен-3-ил)бицикло[3.2.1]октан-2,4-дион. Пример 2. Получение 3-(4'-хлор-4-этилбифен-3-ил)бицикло[3.2.1]октан-2,4-диона К охлажденному (баня со льдом) раствору 4-этиланилина (20 г, 0,16 моль) в концентрированной серной кислоте (100 мл) порциями добавляют нитрат аммония (39,6 г, 0,49 моль), поддерживая температуру равной от -10 до 0 С путем внешнего охлаждения. Реакционную смесь перемешивают в течение 2 ч,затем выливают на дробленый лед и осадок собирают фильтрованием. Твердое вещество переносят в воду, раствор нейтрализуют путем добавления разбавленного водного раствора гидроксида натрия и экстрагируют этилацетатом. Органические экстракты объединяют, сушат над безводным сульфатом натрия,фильтруют и фильтрат выпаривают в вакууме и получают 4-этил-3-нитроанилин (20 г). Стадия 2. Получение 4-бром-1-этил-2-нитробензола К суспензии 4-этил-3-нитроанилина (20 г, 0,12 моль) в воде (80 мл) по каплям добавляют бромистоводородную кислоту (48 мас.% в воде, 240 мл) и смесь перемешивают до растворения твердого вещества. Смесь охлаждают до -5 С и по каплям добавляют раствор нитрита натрия (19,8 г, 0,28 моль) в воде (100 мл), поддерживая температуру равной 0-5 С. После завершения добавления охлаждающую баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Смесь при 0 С по каплям добавляют к предварительно охлажденному раствору бромида меди (I) (22,4 г, 0,16 моль) в бромистоводородной кислоте (48 мас.% в воде). Реакционную смесь перемешивают и ей в течение 3 ч дают нагреться до комнатной температуры. Смесь экстрагируют диэтиловым эфиром и органические экстракты объединяют, сушат над безводным сульфатом натрия, фильтруют и фильтрат концентрируют в вакууме. Затем остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя гексаном,и получают 4-бром-1-этил-2-нитробензол (18 г). Стадия 3. Получение 4'-хлор-4-этил-3-нитробифенила К 4-бром-1-этил-2-нитробензолу (20,0 г, 0,087 моль) в 150 мл 1,2-диметоксиэтана при комнатной температуре добавляют 4-хлорфенилбороновую кислоту (14,98 г, 0,096 моль) и тетракис(трифенилфосфин)палладий(0) (2,0 г, 0,00174 моль) и через смесь пропускают азот. После перемешивания при 20 С в течение 10 мин добавляют раствор карбоната натрия (73,8 г, 0,696 моль) в воде (350 мл) и смесь кипятят с обратным холодильником в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют через диатомовую землю, промывая с помощью 200 мл этилацетата. Смесь выливают в делительную воронку и две фазы разделяют. Водную фазу экстрагируют этилацетатом. Органические экстракты объединяют, сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают в вакууме и получают 4'-хлор-4-этил-3-нитробифенил (23,84 г) в виде коричневого масла, которое используют на следующей стадии без дополнительной очистки. Стадия 4. Получение 3-амино-4'-хлор-4-этилбифенила 4'-Хлор-4-этил-3-нитробифенил (22,6 г, 0,086 моль) суспендируют в метаноле (250 мл) и реакционную смесь перемешивают при комнатной температуре. Добавляют дистиллированную воду (100 мл),затем цинковую пыль (39,0 г, 0,60 моль) и хлорид аммония (13,8 г, 0,26 моль) и смесь кипятят с обрат- 23020771 ным холодильником в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют через диатомовую землю и фильтрат выпаривают в вакууме для удаления большей части метанола. Остаток подвергают распределению между этилацетатом (200 мл) и водой и водную фазу повторно экстрагируют этилацетатом (200 мл). Органические экстракты объединяют, промывают водой и рассолом,сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают в вакууме и получают 3 амино-4'-хлор-4-этилбифенил (15,0 г) в виде бесцветного твердого вещества. Продукт непосредственно используют на стадии 5 без дополнительной очистки. Стадия 5. Получение 3-бром-4'-хлор-4-этилбифенила Стадия 5 а. 3-Амино-4'-хлор-4-этилбифенил (60,0 г, 0,26 моль) порциями добавляют к смеси бромисто-водородной кислоты (48 мас.% в воде, 350 мл) и воды (250 мл) и после завершения добавления смесь нагревают до 40 С и перемешивают в течение 20 мин, затем смесь охлаждают до 5 С в бане со льдом. В течение 45 мин по каплям добавляют раствор нитрита натрия (20,65 г, 0,30 моль) в воде (100 мл) и после завершения добавления смесь перемешивают при 5 С в течение еще 45 мин. Стадия 5b. Тем временем бромисто-водородную кислоту (48 мас.% в воде, 400 мл) нагревают и перемешивают при 70 С и к ней одной порцией добавляют пентагидрат сульфата меди (74,75 г, 0,30 моль) и смесь перемешивают при 70 С в течение 2 мин и получают темно-пурпурный раствор, затем одной порцией добавляют порошкообразную медь (26,44 г, 0,42 моль) и получают розовую суспензию. Стадия 5 с. Смесь, содержащую соль диазония (получена на стадии 5 а), в течение 70 мин при перемешивании при 70 С порциями добавляют к смеси, полученной на стадии 5b (в промежутках между добавлениями порций смесь, содержащую соль диазония, держат холодной в бане со льдом). После завершения добавления смесь перемешивают при 70 С в течение еще 30 мин и затем ей дают охладиться до комнатной температуры и экстрагируют этилацетатом (3 500 мл). Органические экстракты объединяют,промывают водой и рассолом, сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают в вакууме. Очистка с помощью колоночной хроматографии на силикагеле дает 3-бром-4'-хлор-4 этилбифенил (52,1 г) в виде желтого масла Стадия 6. Получение 3-(4'-хлор-4-этилбифен-3-ил)бицикло[3.2.1]октан-2,4-диона В сосуд для микроволновой печи, содержащий бицикло[3.2.1]октан-2,4-дион (0,112 г, 0,812 ммоль),ацетат палладия (II) (7,6 мг, 0,034 ммоль), 2-дициклогексилфосфино-2',4',6'-три-изопропил-1,1'-бифенил(24,2 мг, 0,051 ммоль) и тонкоизмельченный фосфат калия (0,316 г, 1,49 ммоль), добавляют дегазированный диметоксиэтан (2 мл) и затем 3-бром-4'-хлор-4-этилбифенил (0,200 г, 0,667 ммоль). Затем реакционную смесь нагревают с помощью микроволнового излучения при 160 С в течение 60 мин, затем охлаждают до комнатной температуры и промывают 2 М раствором хлористо-водородной кислоты (2 мл) и экстрагируют этилацетатом (33 мл). Органическую фазу сушат над сульфатом магния, фильтруют и фильтрат концентрируют в вакууме. Неочищенную смесь очищают с помощью колоночной флэшхроматографии на силикагеле (элюент: смесь от 30 до 100% этилацетат/гексан) и получают 3-(4'-хлор-4 этилбифен-3-ил)бицикло[3.2.1]октан-2,4-дион. Пример 3. Получение 3-(4'-хлор-4-этилбифен-3-ил)бицикло[3.2.1]окт-6-ен-2,4-диона 3-Бром-4'-хлор-4-этилбифенил (10 г, 0,03 моль) растворяют в тетрагидрофуране (250 мл) и смесь охлаждают до -78 С. В течение 30 мин по каплям добавляют н-бутиллитий (1,33 М раствор в гексанах,34,6 мл), поддерживая температуру равной примерно -78 С. Реакционную смесь перемешивают в течение 1,5 ч, затем по каплям добавляют триметилборат (4,9 г, 0,05 моль) и реакционную смесь перемешивают в течение 2 ч. По каплям добавляют 2 н. водный раствор хлористо-водородной кислоты (100 мл) и после завершения добавления смесь перемешивают в течение 2 ч. Смесь концентрируют для удаления большей части тетрагидрофурана, затем разбавляют водой и экстрагируют диэтиловым эфиром. Органи- 24020771 ческие экстракты промывают водой и рассолом, объединяют, сушат над безводным сульфатом натрия,фильтруют и фильтрат выпаривают в вакууме. Затем остаток очищают с помощью колоночной флэшхроматографии на силикагеле, элюируя 7% раствором этилацетата в гексане, и получают 4'-хлор-4 этилбифен-3-илбороновую кислоту (5,4 г). Стадия 2. Получение 4'-хлор-4-этилбифен-3-илтриацетата свинца Стадия 2 а. К смеси тетраацетата свинца (2,15 г, 4,85 ммоль) и диацетата ртути (II) (0,15 г, 0,47 ммоль), тщательно продутой азотом, добавляют безводный хлороформ (6 мл). Эту смесь нагревают до 40 С и одной порцией добавляют 4'-хлор-4-этилбифен-3-илбороновую кислоту (1,17 г, 4,50 ммоль) и суспензию нагревают при этой же температуре в течение 5 ч. Затем смесь охлаждают до комнатной температуры, концентрируют до небольшого объема и растирают с гексанами и фильтруют и получают неочищенный 4'-хлор-4-этилбифен-3-илтриацетат свинца (2,70 г). Стадия 2b. Неочищенный 4'-хлор-4-этилбифен-3-илтриацетат свинца (1,50 г) растворяют в безводном хлороформе (20 мл), к смеси добавляют порошкообразный безводный карбонат калия (0,58 г, 4,16 ммоль) и затем интенсивно перемешивают в течение 5 мин. Твердые вещества удаляют фильтрованием и органический раствор концентрируют и получают чистый 4'-хлор-4-этилбифен-3-илтриацетат свинцаBeaudegnies et al., WO 2005/123667) и 4-диметиламинопиридин (0,36 г, 2,86 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 5 мин. Затем добавляют толуол (1 мл) и смесь перемешивают при 80 С (предварительно нагретая масляная баня) в течение 2 ч. Реакционной смеси дают охладиться до комнатной температуры, реакцию останавливают 2 М раствором хлористо-водородной кислоты и неорганический осадок удаляют фильтрованием. Органическую фазу отделяют и затем водную фазу промывают дихлорметаном (2) и фазы повторно разделяют. Все органические фазы объединяют, затем выпаривают при пониженном давлении и получают коричневое смолообразное вещество. Этот продукт очищают сначала с помощью препаративной ВЭЖХ (высокоэффективная жидкостная хроматография) с обращенной фазой, затем также с помощью колоночной флэш-хроматографии на силикагеле (элюент: смесь от 20 до 100% этилацетат/гексан) и получают 3-(4'-хлор-4-этилбифен-3 ил)бицикло[3.2.1]окт-6-ен-2,4-дион. Пример 4. Получение 3-(4-метил-3',4'-дифторбифен-3-ил)бицикло[3.2.1]октан-2,4-диона К смеси тетраацетата свинца (2,15 г, 4,85 ммоль) и диацетата ртути (II) (0,15 г, 0,47 ммоль), тщательно продутой азотом, добавляют безводный хлороформ (6 мл). Эту смесь нагревают до 40 С и одной порцией добавляют 5-хлор-2-метилфенилбороновую кислоту (0,76 г, 4,46 ммоль) и суспензию нагревают при этой же температуре в течение 5 ч. После охлаждения до комнатной температуры смесь концентрируют до небольшого объема и растирают с гексанами и фильтруют и получают неочищенный 5-хлор-2 метилфенилтриацетат свинца (2,27 г). Стадия 2. Получение 3-(5-хлор-2-метилфенил)бицикло[3.2.1]октан-2,4-диона К раствору 5-хлор-2-метилфенилтриацетата свинца (0,41 г, 0,80 ммоль) в хлороформе (4 мл) добавляют бицикло[3.2.1]октан-2,4-дион (0,10 г, 0,72 ммоль) и 4-диметиламинопиридин (0,46 г, 3,62 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 5 мин. Затем добавляют толуол(1 мл) и смесь перемешивают при 80 С (предварительно нагретая масляная баня) в течение 1 ч. Реакци- 25020771 онной смеси дают охладиться до комнатной температуры, реакцию останавливают 1 М раствором хлористо-водородной кислоты и органическую фазу отделяют. Затем водную фазу промывают дихлорметаном(х 2) и фазы повторно разделяют. Все органические фазы объединяют, затем выпаривают при пониженном давлении и получают неочищенное масло. Очистка с помощью препаративной ВЭЖХ с обращенной фазой дает 3-(5-хлор-2-метилфенил)бицикло[3.2.1]октан-2,4-дион (0,063 г, 33%) в виде бесцветного смолообразного вещества. Стадия 3. Получение 3-(3',4'-дифтор-4-метилбифен-3-ил)бицикло[3.2.1]октан-2,4-диона В сосуд для микроволновой печи добавляют 3-(5-хлор-2-метилфенил)бицикло[3.2.1]октан-2,4-дион(1,7 мг, 0,008 ммоль), S-phos-3'-сульфонат натрия (7,8 мг, 0,015 ммоль) и фосфат калия (0,404 г, 1,90 ммоль). Затем добавляют дегазированную воду (0,8 мл) (смывая все твердые вещества со стенок сосуда),затем сосуд продувают азотом и смесь перемешивают при комнатной температуре в течение 5 мин. Затем смесь нагревают с помощью микроволнового излучения при 160 С в течение 15 мин, охлаждают до комнатной температуры и подвергают распределению между 2 М раствором хлористо-водородной кислоты и дихлорметаном. Органический слой отделяют, концентрируют в вакууме, затем очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают 3-(3',4'-дифтор-4-метилбифен-3 ил)бицикло[3.2.1]октан-2,4-дион. Пример 5. Получение 3-(2',4'-дихлор-4-этилбифен-3-ил)бицикло[3.2.1]октан-2,4-диона К раствору 2-этил-5-бромнитробензола (9,71 г, 230 ммолей) в этаноле (125 мл) добавляют дигидрат хлорида олова(II) (35,72 г, 225,71 ммоль), затем нагревают при 70 С в течение 2 ч. После охлаждения до комнатной температуры раствор выливают на дробленый лед (1 л) и затем разбавляют этилацетатом (200 мл). Осторожно добавляют твердый карбонат натрия до установления рН 7, затем вязкую смесь фильтруют через диатомовую землю (дополнительно промывают смесью этилацетат/водный раствор карбоната натрия) и фазы разделяют. После дополнительной экстракции водной фазы все органические фазы объединяют, сушат над безводным сульфатом магния и затем концентрируют в вакууме. Неочищенное масло очищают с помощью колоночной флэш-хроматографии на силикагеле (гексан/этилацетат в соотношении 8:2) и получают 5-бром-2-этиланилин (7,89 г) в виде коричневого масла. Стадия 2. Получение 4-бром-1-этил-2-йодбензола К смеси 5-бром-2-этиланилина (3,39 г, 200 ммолей) в дистиллированной воде (110 мл) при перемешивании добавляют концентрированную серную кислоту (5,60 мл), затем смесь недолго кипятят с обратным холодильником до растворения. Смеси дают охладиться до комнатной температуры и получают мелкокристаллический осадок, который затем охлаждают примерно до 0 С в бане со смесью лед/соль. К этой взвеси в течение 15 мин по каплям добавляют водный раствор нитрита натрия (1,17 г, 16,94 ммоль) в дистиллированной воде (10 мл), поддерживая температуру ниже 5 С и затем дополнительно перемешивают в течение 30 мин. После этого реакционную смесь фильтруют и затем ее при комнатной температуре по каплям добавляют ко второму водному раствору йодида калия (8,44 г, 50,83 ммоль) в дистиллированной воде (45 мл). После завершения добавления раствор недолго нагревают при 80 С и затем повторно дают охладиться до комнатной температуры. Реакционную смесь экстрагируют этилацетатом(3 50 мл) и органическую фазу промывают 1 М водным раствором хлористо-водородной кислоты (30 мл) и водным раствором тиосульфата натрия (230 мл). После сушки над безводным сульфатом магния и концентрирования в вакууме получают 4-бром-1-этил-2-йодбензол (4,90 г) в виде оранжевой жидкости. Стадия 3. Получение 5-бром-2-этилфенилбороновой кислоты мл) при -78 С по каплям добавляют раствор изопропилмагнийхлорида (16,90 мл, 33,80 ммоль, 2 М раствор в тетрагидрофуране), поддерживая температуру ниже -60 С. После перемешивания в течение 20 мин реакционной смеси медленно дают нагреться до комнатной температуры и затем дополнительно перемешивают в течение 1 ч. Раствор повторно охлаждают до -78 С и по каплям добавляют триметилборат (7,18 мл, 64,32 ммоль), затем смеси повторно дают нагреться до комнатной температуры и затем ее перемешивают в течение 2 ч. Добавляют разбавленный водный раствор хлористо-водородной кислоты(30 мл) и неочищенный продукт экстрагируют этилацетатом (100 мл). Водную фазу промывают этилацетатом (2 100 мл) и все органические фазы объединяют, сушат над безводным сульфатом магния, затем концентрируют в вакууме и получают светло-коричневое твердое вещество, которое растирают с гексанами, и получают 5-бром-2-этилфенилбороновую кислоту (6,46 г) в виде кремового порошкообразного вещества. Стадия 4. Получение 5-бром-2-этилфенилтриацетата свинца К смеси тетраацетата свинца (13,7 г, 31,00 ммоль) и диацетата ртути (II) (0,47 г, 1,50 ммоль), тщательно продутой азотом, добавляют безводный хлороформ (42 мл). Эту смесь нагревают 40 С и одной порцией добавляют 5-бром-2-этилфенилбороновую кислоту (6,50 г, 28,00 ммоль) и суспензию нагревают при этой же температуре в течение 5 ч. Затем смеси дают охладиться до комнатной температуры, затем ее охлаждают до 0 С, затем добавляют порошкообразный безводный карбонат калия (3,22 г), интенсивно перемешивают в течение 5 мин и фильтруют. Фильтрат концентрируют до объема, равного 1/2 исходного, затем добавляют гексаны, чтобы вызвать выпадение осадка. Затем смесь концентрируют, растворитель декантируют и твердое вещество промывают гексанами и получают 5-бром-2-этилфенилтриацетат свинца (10,69 г) в виде твердого вещества песочного цвета. Стадия 5. Получение 3-(5-бром-2-этилфенил)бицикло[3.2.1]октан-2,4-диона К раствору 5-бром-2-этилфенилтриацетата свинца (16,34 г, 28,80 ммоль) в хлороформе (160 мл) добавляют бицикло[3.2.1]октан-2,4-дион (3,61 г, 26,10 ммоль) и 4-диметиламинопиридин (16,63 г, 131 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 5 мин. Затем добавляют толуол (40 мл) и смесь перемешивают при 80 С (предварительно нагретая масляная баня) в течение 1 ч. Реакционной смеси дают охладиться до комнатной температуры, реакцию останавливают 1 М раствором хлористо-водородной кислоты и органическую фазу отделяют. Затем водную фазу промывают дихлорметаном (2) и фазы повторно разделяют. Все органические фазы объединяют, затем выпаривают при пониженном давлении и получают неочищенное масло, которое очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент: смесь от 30 до 50% этилацетат/изогексан, затем смесь 10% метанол/дихлорметан). Затем полученное смолообразное вещество перекристаллизовывают из смеси дихлорметан/гексан и получают 3-(5-бром-2-этилфенил)бицикло[3.2.1]октан-2,4-дион (4,62 г, 55%) в виде кремового твердого вещества. Стадия 6. Получение 3-(2',4'-дихлор-4-этилбифен-3-ил)бицикло[3.2.1]октан-2,4-диона В сосуд для микроволновой печи добавляют 3-(5-бром-2-этилфенил)бицикло[3.2.1]октан-2,4-дион(0,200 г, 0,623 ммоль), 2,4-дихлорфенилбороновую кислоту (0,167 г, 0,87 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,040 г, 0,05 ммоль) и фторид цезия (0,284 г, 1,87 ммоль). Затем добавляют дегазированный диметоксиэтан (смывая все твердые вещества со стенок сосуда), затем сосуд продувают азотом и смесь перемешивают при комнатной температуре в течение 5 мин. Смесь нагревают с помощью микроволнового излучения при 160 С в течение 15 мин, охлаждают до комнатной температуры и подвергают распределению между 2 М раствором хлористо-водородной кислоты и дихлорметаном. После отделения органического слоя водную фазу повторно промывают дихлорметаном, затем органические фракции объединяют и концентрируют в вакууме и получают неочищенное смолообразное вещество. Этот неочищенный продукт очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент: смесь от 30 до 100% этилацетат/изогексан) и получают 3-(2',4'-дихлор-4-этилбифен-3 ил)бицикло[3.2.1]октан-2,4-дион. Пример 6. Получение 3-(4'-хлор-4-этил-3'-метилбифен-3-ил)бицикло[3.2.1]октан-2,4-диона В сосуд для микроволновой печи добавляют ацетат палладия (II) (3,7 мг, 0,016 ммоль), тринатрийтрис(3-сульфофенил)фосфин (23 мг, 0,041 ммоль), 4-хлор-3-метилфенилбороновую кислоту (0,167 г, 0,97 ммоль), 3-(5-бром-2-этилфенил)-бицикло[3.2.1]октан-2,4-дион (0,209 г, 0,65 ммоль) и фосфат калия(0,691 г, 3,26 ммоль). Затем добавляют дегазированный раствор смеси ацетонитрил/дистиллированная вода (1,6 мл, в соотношении 1:1) (смывая все твердые вещества со стенок сосуда), затем перемешивают в течение 5 мин и продувают азотом. Затем смесь нагревают с помощью микроволнового излучения при 160 С в течение 15 мин. После охлаждения до комнатной температуры реакционную смесь разбавляютN,N-диметилформамидом (1 мл), затем подвергают распределению между 2 М водным раствором хлористо-водородной кислоты и дихлорметаном. После отделения органической фазы водную фазу повторно промывают дихлорметаном, затем органические фракции объединяют и концентрируют в вакууме и получают неочищенное смолообразное вещество. Затем этот неочищенный продукт очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают 3-(4'-хлор-4-этил-3'-метилбифен-3-ил)бицикло В сосуд для микроволновой печи добавляют 3-(5-бром-2-этилфенил)бицикло[3.2.1]октан-2,4-дион(1,00 г, 3,11 ммоль), йодид натрия (0,93 г, 6,23 ммоль), гексаметилдисилазан (0,45 г, 3,11 ммоль), йодид меди (I) (0,03, 0,15 ммоль), транс-N,N'-диметилциклогексан-1,2-диамин (0,044 г, 0,31 ммоль) и затем дегазированный диоксан (5 мл). Смесь продувают азотом и затем нагревают с помощью микроволнового излучения при 180 С в течение 1 ч. Смесь охлаждают до комнатной температуры, реакцию останавливают 2 М раствором хлористо-водородной кислоты и смесь экстрагируют дихлорметаном (2). Органические фракции объединяют, промывают насыщенным водным раствором метабисульфита натрия, сушат над сульфатом магния и затем фильтруют. Фильтрат концентрируют в вакууме, затем очищают с помощью колоночной флэш-хроматографии (элюент: смесь от 20 до 100% этилацетат/гексан) и получают 3(2-этил-5-йодфенил)бицикло[3.2.1]-октан-2,4-дион (1,14 г, 100%) в виде белого твердого вещества. Стадия 2. Получение 3-(2,4-диоксобицикло[3.2.1]окт-3-ил)-4-этилфенилбороновой кислоты К раствору 3-(2-этил-5-йодфенил)бицикло[3.2.1]октан-2,4-диона (0,65 г, 1,77 ммоль) в безводном тетрагидрофуране (15 мл) при -10 С в течение 10 мин по каплям добавляют комплекс изопропилмагнийхлорида с хлоридом лития (10,6 мл, 10,6 ммоль, 1 М раствор в тетрагидрофуране). Реакционную смесь перемешивают при этой же температуре в течение 1,5 ч, затем охлаждают до -78 С, затем по каплям добавляют триметилборат (1,39 мл, 12,4 ммоль), поддерживая температуру ниже -60 С. После повторного охлаждения до -78 С смесь перемешивают в течение 5 мин и затем дополнительно при комнатной температуре в течение 1 ч. Реакцию останавливают 2 М раствором хлористо-водородной кислоты и смесь экстрагируют этилацетатом (3). Все органические фракции объединяют, сушат над сульфатом магния,фильтруют и фильтрат концентрируют в вакууме и получают оранжевое смолообразное вещество. Этот неочищенный продукт растворяют в минимальном количестве дихлорметана, затем осаждают из изогексана и получают 3-(2,4-диоксобицикло[3.2.1]окт-3-ил)-4-этилфенилбороновую кислоту (0,46 г, 90%) в виде кремового твердого вещества. Стадия 3. Получение 3-[5-(5-хлорпиридин-2-ил)-2-этилфенил]бицикло[3.2.1]октан-2,4-диона В сосуд для микроволновой печи, содержащий 3-(2,4-диоксобицикло[3.2.1]окт-3-ил)-4-этилфенил- 28020771 бороновую кислоту (0,15 г, 0,52 ммоль) и фосфат калия (0,667 г, 3,15 ммоль), добавляют 2-бром-5 хлорпиридин (0,121 г, 0,63 ммоль), ацетат палладия (II) (4,0 мг, 0,016 ммоль) и тринатрий-трис(3 сульфофенил)фосфин (21 мг, 0,038 ммоль). Затем добавляют дегазированную смесь растворителей вода/ацетонитрил (1,6 мл, в соотношении 2:1), затем смесь продувают азотом, затем перемешивают при температуре окружающей среды в течение 5 мин и затем нагревают с помощью микроволнового излучения при 160 С в течение 15 мин. После охлаждения до комнатной температуры смесь подвергают распределению между 2 М раствором хлористо-водородной кислоты и дихлорметаном и органическую фазу отделяют. Затем водную фазу экстрагируют дихлорметаном и все органические фракции объединяют и затем выпаривают. Остаток очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают 3-[5-(5-хлорпиридин-2-ил)-2-этилфенил]бицикло[3.2.1]октан-2,4-дион. Пример 8. Получение 3-[2-этил-5-(4-метилтиазол-2-ил)фенил]бицикло[3.2.1]октан-2,4-диона В сцинтилляционный сосуд добавляют 3-(5-бром-2-этилфенил)бицикло[3.2.1]октан-2,4-дион (200 мг, 0,62 ммоль), 4-метилтиазол (74 мг, 0,75 ммоль), карбонат серебра (860 мг, 3,1 ммоль), трифенилфосфин (16,3 мг, 62,2 мкмоль) и [1,1-бис(дифенилфосфино)ферроцен]палладий(II)хлорид (26 мг, 31,1 мкмоль) и смесь встряхивают в дегазированной смеси растворителей ацетонитрил:вода 1:1 (1,5 мл) при 65 С в течение 22 ч. Смесь концентрируют при пониженном давлении, переносят в ДМСО (диметилсульфоксид) (1,5 мл), фильтруют и очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают 3-[2-этил-5-(4-метил-тиазол-2-ил)фенил]бицикло[3.2.1]октан-2,4-дион. Пример 9. Получение 3-[2-этил-5-(1-оксипиридин-2-ил)фенил]бицикло[3.2.1]октан-2,4-диона В сцинтилляционный сосуд добавляют 3-(5-бром-2-этилфенил)бицикло[3.2.1]октан-2,4-дион (100 мг, 0,31 ммоль), пиридин-N-оксид (118 мг, 1,25 ммоль), ацетат палладия(II) (3,5 мг, 15,5 мкмоль), карбонат калия (86 мг, 0,62 ммоль) и три-трет-бутилфосфонийтетрафторборат (13,5 мг, 46 мкмолей) и смесь встряхивают в дегазированном толуоле при 110 С в течение 22 ч. Смесь концентрируют при пониженном давлении, переносят в ДМСО (1,5 мл), фильтруют и очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают 3-[2-этил-5-(1-оксипиридин-2-ил)фенил]бицикло[3.2.1]октан-2,4-дион. Пример 10. Получение 3-[2-этил-5-(4-метилпиразол-1-ил)фенил]бицикло[3.2.1]октан-2,4-диона В сосуде для микроволновой печи объединяют 3-(5-бром-2-этилфенил)бицикло[3.2.1]октан-2,4 дион (100 мг, 0,31 ммоль), 4-метилпиразол (38 мг, 0,46 ммоль), фосфат калия (264 мг, 1,24 ммоль), Lпролин (36 мг, 0,31 ммоль) и йодид меди (I) (60 мг, 0,31 ммоль), смесь суспендируют в ДМСО и нагревают с помощью микроволнового излучения при 160 С в течение 45 мин. Смесь фильтруют и очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают 3-[2-этил-5-(4-метилпиразол-1 ил)фенил]бицикло-[3.2.1]октан-2,4-дион. Пример 11. Получение 3-[5-(4-хлоримидазол-1-ил)-2-этилфенил]бицикло[3.2.1]октан-2,4-диона и 3[5-(5-хлоримидазол-1-ил)-2-этилфенил]бицикло[3.2.1]октан-2,4-диона В сосуде для микроволновой печи объединяют 3-(5-бром-2-этилфенил)бицикло[3.2.1]октан-2,4 дион (100 мг, 0,31 ммоль), 4-хлоримидазол (47 мг, 0,46 ммоль), фосфат калия (264 мг, 1,24 ммоль), Lпролин (36 мг, 0,31 ммоль) и йодид меди (I) (60 мг, 0,31 ммоль), смесь суспендируют в ДМСО и нагревают с помощью микроволнового излучения при 160 С в течение 45 мин. Смесь фильтруют и очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают смесь 3-[5-(4-хлоримидазол-1-ил)-2 этилфенил]бицикло[3.2.1]октан-2,4-диона и 3-[5-(5-хлоримидазол-1-ил)-2-этилфенил]бицикло[3.2.1] октан-2,4-диона. Пример 12. Получение 3-(2'-фтор-4,4'-дихлорбифен-3-ил)бицикло[3.2.1]октан-2,4-диона
МПК / Метки
МПК: C07C 49/747, A01N 35/06
Метки: бициклические, гербицидно, 1,3-дионы, активные
Код ссылки
<a href="https://eas.patents.su/30-20771-gerbicidno-aktivnye-biciklicheskie-13-diony.html" rel="bookmark" title="База патентов Евразийского Союза">Гербицидно активные бициклические 1,3-дионы</a>
Предыдущий патент: Регуляция роста растений
Следующий патент: 6-замещенные пиримидины, ингибирующие вич
Случайный патент: Состав для лечения вич-инфекции и способ лечения












