Ингибирующие mtp арилпиперидины или пиперазины, замещенные 5-членными гетероциклами
Номер патента: 9455
Опубликовано: 28.12.2007
Авторы: Линдерс Йоаннес Теодорус Мария, Вьейевуа Марсель, Яроскова Либуше, Ван Дер Векен Луи Йозеф Элизабет, Рувенс Петер Вальтер Мария, Мерпул Ливен, Бакс Лео Якобус Йозеф
Формула / Реферат
1. Соединение формулы (I)
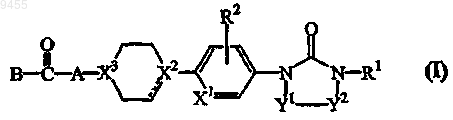
его N-оксиды, фармацевтически приемлемые кислотно-аддитивные соли и стереохимически изомерные формы,
где пунктирная линия представляет необязательную связь, и она отсутствует, когда X2 представляет атом азота;
радикал -Y1-Y2- представляет радикал формулы
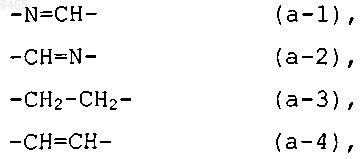
где в двухвалентных радикалах формулы (а-1) или (а-2) атом водорода может быть необязательно заменен C1-6алкилом или фенилом; или в двухвалентных радикалах формулы (а-3) или (а-4) один или два атома водорода могут быть необязательно заменены C1-6алкилом или фенилом;
X1 представляет атом углерода или азота;
по меньшей мере один из X2 или X3 представляет атом азота и другой X2 или X3 представляет СН или атом углерода, когда пунктирная линия представляет связь, или оба X2 и X3 представляют атом азота;
R1 представляет C1-6алкил;
арил1;
C1-6алкил, замещенный гидрокси, C3-6циклоалкилом, арилом1 или нафталинилом;
C3-6циклоалкил;
C3-6циклоалкенил;
C3-6алкенил;
C3-6алкенил, замещенный арилом1;
C3-6алкинил;
C3-6алкинил, замещенный арилом1;
C1-4алкилоксиС1-4алкандиил, необязательно замещенный арилом1;
или когда -Y1-Y2- представляет радикал формулы (а-1), то R1 может быть взят вместе с Y2 с образованием радикала формулы -СН=СН-СН=СН-, в котором каждый атом водорода может быть необязательно заменен заместителем, независимо выбранным из С1-4алкила, С1-4алкилокси, полигалогенС1-4алкила, атома галогена, циано, трифторметила или арила1;
где арил1 представляет фенил; или фенил, замещенный 1-5 заместителями, каждый из которых независимо выбран из С1-4алкила, C1-4алкилокси, полигалогенС1-4алкила, атома галогена, циано или трифторметила;
R2 представляет атом водорода, С1-4алкил или атом галогена;
А представляет C1-6алкандиил;
C1-6алкандиил, замещенный одной или двумя группами, выбранными из арила2, гетероарила1 и
С3-8циклоалкила; или если X3 представляет СН, то указанный радикал А может также представлять NH, необязательно замещенный арилом2, гетероарилом1 или C3-8циклоалкилом;
где арил2 является фенилом; или фенилом, замещенным 1-5 заместителями, каждый из которых независимо выбран из С1-4алкила, С1-4алкилокси, атома галогена, циано или трифторметила;
гетероарил1 является фуранилом, тиенилом, пиридинилом, пиразинилом, пиримидинилом или пиридазинилом; и
указанный гетероарил1 необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из С1-4алкила, С1-4алкилокси, атома галогена, циано или трифторметила;
В представляет NR3R4; или OR9;
где каждый R3 и R4 независимо выбран из атома водорода,
C1-8алкила,
С1-8алкила, замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из гидрокси, атома галогена, циано, С1-4алкилокси, С1-4алкилоксикарбонила,
С3-8циклоалкила, полигалогенС1-4алкила, NR5R6, CONR7R8, арила3, полициклического арила или гетероарила2; С3-8циклоалкила; C3-8циклоалкенила; С3-8алкенила; C3-8алкинила; арила3; полициклического арила; гетероарила2; или
R3 или R4, объединенные вместе с атомом азота, связанным с R3 или R4, могут образовать циклы азетидинила, пирролидинила, пиперидинила, морфолинила, азепанила или азоканила, где каждый из данных циклов может быть необязательно замещен С1-4алкилоксикарбонилом, С1-4алкилоксикарбонилС1-4 алкилом, карбониламино, С1-4алкилкарбониламино, CONR7R8 или С1-4алкилCONR7R8;
где R5 представляет атом водорода, С1-4алкил, арил3, полициклический арил или гетероарил2;
R6 представляет атом водорода или C1-4алкил;
R7 представляет атом водорода, C1-4алкил или фенил;
R8 представляет атом водорода, C1-4алкил или фенил; или
R9 представляет C1-6алкил или С1-6алкил, замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из гидрокси, атома галогена, циано, C1-4алкилокси, C1-4алкилоксикарбонила, С3-8циклоалкила, С3-8циклоалкенила, трифторметила, NR5R6, CONR7R8, арила3, полициклического арила или гетероарила2;
где арил3 является фенилом;
фенилом, замещенным 1-5 заместителями, каждый из которых независимо выбран из C1-4алкила,
C1-4алкилокси, атома галогена, гидрокси, трифторметила, циано, C1-4алкилоксикарбонила, С1-4алкилоксикарбонилC1-4алкила, метилсульфониламино, метилсульфонила, NR5R6, С1-4алкилNR5R6, CONR7R8 или C1-4алкилCONR7R8;
полициклический арил является нафталинилом, инданилом, флуоренилом или 1,2,3,4-тетрагидронафталинилом и указанный полициклический арил необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из C1-6алкила, С1-6алкилокси, фенила, атома галогена, циано, С1-4алкилкарбонила, С1-4алкилоксикарбонила, С1-4алкилоксикарбонилС1-4алкила, NR5R6, С1-4 алкил NR5R6, CONR7R8, C1-4алкилCONR7R8 или С1-4алкилоксикарбониламино, и гетероарил2 является пиридинилом; пиразинилом; пиримидинилом; пиридазинилом; триазинилом; триазолилом; имидазолилом; пиразолилом; тиазолилом; изотиазолилом; оксазолилом; пирролилом; фуранилом; тиенилом; хинолинилом; изохинолинилом; 1,2,3,4-тетрагидроизохинолинилом; бензотиазолилом; бензо[1,3]диоксолилом; 2,3-дигидробензо[1,4]диоксинилом; индолилом; 2,3-дигидро-1Н-индолилом; 1Н-бензоимидазолилом; и указанный гетероарил2 необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из С1-6алкила, C1-6алкилокси, фенила, атома галогена, циано, С1-4 алкилкарбонила, С1-4алкилоксикарбонила, С1-4алкилоксикарбонилС1-4алкила, NR5R6, С1-4алкилNR5R6, CONR7R8 или С1-4алкилCONR7R8.
2. Соединение по п.1, в котором X2 представляет атом азота и X3 представляет СН.
3. Соединение по п.1, в котором X2 представляет СН и X3 представляет атом азота.
4. Соединение по п.1, в котором X2 и X3 оба представляют атом азота.
5. Соединение по любому из пп.1-4, в котором радикал А представляет С1-6алкандиил, замещенный арилом2.
6. Соединение по любому из пп.1-4, в котором радикал В представляет OR9, где R9 является С1-6 алкилом или NR3R4, где R3 представляет атом водорода.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-6.
8. Способ получения фармацевтической композиции по п.7, в котором терапевтически активное количество соединения по любому из пп.1-6 однородно смешивают с фармацевтически приемлемым носителем.
9. Применение соединения по любому из пп.1-6 в качестве лекарственного средства.
10. Способ получения соединения формулы (I), в котором:
а) промежуточное соединение формулы (II), где Y1, Y2 и R1 имеют значения, определенные в п.1, подвергают взаимодействию с промежуточным соединением формулы (III), в которой X1, X2, X3, R2, А и В имеют значения, определенные в п.1, и Q выбран из атомов брома, йода и трифторметилсульфоната, в реакционно-инертном растворителе и необязательно в присутствии по меньшей мере одного конденсирующего реагента на основе переходного металла и/или по меньшей мере одного подходящего катализатора, такого как палладий, связанный с трифенилфосфином или трифениларсином
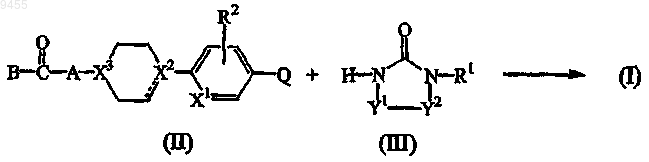
b) соединения формулы (I) превращают друг в друга известными в данной области реакциями превращения или, если желательно, соединение формулы (I) превращают в фармацевтически приемлемую кислотно-аддитивную соль, или, наоборот, кислотно-аддитивную соль соединения формулы (I) превращают в свободное основание с использованием основания; и, если желательно, получают его стереохимически изомерные формы.
11. Соединение формулы (IX)

его N-оксиды, фармацевтически приемлемые кислотно-аддитивные соли и стереохимически изомерные формы, где R1, R2, X1, X2, X3, Y1, Y2 и А имеют значения, определенные в п.1.
Текст
009455 Настоящее изобретение относится к новым арилпиперидиновым или пиперазиновым соединениям,замещенным определенными 5-членными гетероциклами, обладающим ингибирующей активностью в отношении секреции апоВ/МТР и сопутствующей активностью по снижению уровня липидов. Кроме того, изобретение относится к способам получения таких соединений, фармацевтическим композициям,содержащим указанные соединения, а также применению указанных соединений в качестве лекарственного средства для лечения атеросклероза, панкреатита, ожирения, гипертриглицеридемии, гиперхолестеринемии, гиперлипидемии, диабета или диабета типа II. Ожирение является причиной множества серьезных проблем для здоровья, подобных развитию диабета и заболевания сердца у взрослых. Кроме того, снижение массы тела является навязчивой идеей у возрастающей части населения. В настоящее время широко признается причинно-следственная связь между гиперхолестеринемией,особенно связанной с повышенными концентрациями в плазме крови липопротеинов низкой плотности(далее обозначаются LDL) и липопротеинов очень низкой плотности (далее обозначаются VLDL), и преждевременным развитием атеросклероза и/или сердечно-сосудистого заболевания. Однако в настоящее время имеется ограниченное число лекарственных препаратов для лечения гиперлипидемии. Средства, в основном применяемые для лечения гиперлипидемии, включают полимеры для связывания желчных кислот, такие как холестирамин и холестипол, производные фибровой кислоты, такие как безафибрат, клофибрат, фенофибрат, ципрофибрат и гемфиброзил, никотиновую кислоту и ингибиторы синтеза холестерина, такие как ингибиторы HMG-ко-энзим-А-редуктазы. Тем не менее, остается потребность в новых средствах для снижения уровня липидов с повышенной эффективностью и/или действующих посредством других механизмов по сравнению с упомянутыми выше средствами. Липопротеины плазмы крови представляют собой водорастворимые комплексы высокой молекулярной массы, образованные из липидов (холестерина, триглицеридов, фосфолипидов) и аполипопротеинов. Определяют пять основных групп липопротеинов, которые различаются по пропорциональному количеству липидов и типу аполипопротеина, которые все происходят из печени и/или кишечника, по их плотности (определяемой ультрацентрифугированием). Они включают LDL, VLDL, липопротеины промежуточной плотности (далее обозначаются IDL), липопротеины высокой плотности (далее обозначаются HDL) и хиломикроны. Установлено десять основных аполипопротеинов в плазме крови человека.VLDL, которые образуются печенью и содержат аполипопротеин В (далее обозначается Аро-В), превращаются в LDL, которые транспортируют 60-70% от общего количества холестерина в сыворотке крови. Кроме того, Аро-В является основным протеиновым компонентом LDL. Повышенный уровень LDLхолестерина в сыворотке крови в результате избыточного синтеза или пониженного метаболизма связан с возникновением атеросклероза. Напротив, липопротеины высокой плотности (далее обозначаютсяHDL), которые содержат аполипопротеин А 1, обладают защитным действием и обратным образом коррелируют с риском развития заболевания коронарных сосудов сердца. Таким образом, соотношениеHDL/LDL представляет удобный способ оценки атерогенного потенциала липидного профиля плазмы крови у индивидуума. Две изоформы аполипопротеина (апо) В, апо В-48 и апо В-100 являются важными белками в метаболизме липопротеинов у человека. Апо В-48 имеет размер, составляющий 48% от апо В-100 при анализе в додецилсульфат натрийполиакриламидных гелях, синтезируется в кишечнике человека. Апо В-48 необходим для сборки хиломикронов и, следовательно, играет необходимую роль во всасывании жиров пищи в кишечнике. Апо В-100, который образуется у людей в печени, необходим для синтеза и секрецииVLDL. LDL, которые содержат примерно 2/3 холестерина плазмы крови человека, представляют собой продукты метаболизма VLDL. Фактически апо В-100 представляет только один белковый компонентLDL. Признается, что повышенные концентрации апо В-100 и LDL-холестерина в плазме крови являются факторами риска для развития атеросклеротического заболевания коронарных сосудов. Большое количество наследственных и приобретенных заболеваний может привести к гиперлипидемии. Их можно подразделить на первичные и вторичные гиперлипидемические состояния. Наиболее частыми причинами вторичных гиперлипидемий являются сахарный диабет, злоупотребление алкоголем, лекарственными препаратами, гипотиреоидизм, хроническая почечная недостаточность, нефротический синдром, холестаз и булимия. Первичные гиперлипидемии также подразделяются на обычную гиперхолестеринемию, семейную комбинированную гиперлипидемию, семейную гиперхолестеринемию,остаточную гиперлипидемию, синдром хиломикронемии и семейную гипертриглицеридемию. Известно, что микросомальный белок переноса триглицеридов (далее обозначается МТР) катализирует транспорт триглицеридов и холестерилового эфира в предпочтении по сравнению с фосфолипидами, такими как фосфатидилхолин. D. Sharp et al., Nature (1993) 365: 65 было показано, что нарушение,вызывающее абеталипопротеинемию, связано с геном МТР. Это указывает на то, что МТР необходим для синтеза апо В-содержащих липопротеинов, таких как VLDL, предшественников LDL. Следовательно, это означает, что ингибитор МТР будет ингибировать синтез VLDL и LDL, тем самым снижая уровниVLDL, LDL, холестерина и триглицеридов у людей. Ингибиторы МТР раскрыты в WO-00/32582, WO-01/96327 и WO-02/20501. Настоящее изобретение основано на неожиданном открытии того, что группа новых арилпипери-1 009455 динов или пиперазинов, замещенных определенными 5-членными гетероциклами, обладает способностью ингибировать секрецию апо В/МТР. Данные соединения формулы (I) могут функционировать системно и/или в качестве избирательных ингибиторов МТР, т.е. они способны избирательно блокировать МТР на уровне стенки кишечника у млекопитающих. Настоящее изобретение относится к семейству новых соединений формулы (I) их N-оксидам, фармацевтически приемлемым кислотно-аддитивным солям и стереохимически изомерным формам, в которой пунктирная линия представляет необязательную связь, и она отсутствует, когда X2 представляет атом азота; радикал -Y1-Y2- представляет радикал формулы где в двухвалентных радикалах формулы (а-1) или (а-2) атом водорода может быть необязательно заменен С 1-6 алкилом или фенилом; или в двухвалентных радикалах формулы (а-3) или (а-4) один или два атома водорода могут быть необязательно заменены С 1-6 алкилом или фенилом;X1 представляет атом углерода или азота; по меньшей мере один из X2 или X3 представляет атом азота, и другой X2 или X3 представляет CH или атом углерода, когда пунктирная линия представляет связь, или оба X2 и X3 представляют атом азота;C3-6 алкинил; C3-6 алкинил, замещенный арилом 1; С 1-4 алкилоксиС 1-4 алкандиил, необязательно замещенный арилом 1; или когда -Y1-Y2- представляет радикал формулы (а-1), то тогда R1 может быть взят вместе с Y2 с образованием радикала формулы -СН=СН-СН=СН-, в котором каждый атом водорода может быть необязательно заменен заместителем, независимо выбранным из С 1-4 алкила, С 1-4 алкилокси, полигалогенС 1-4 алкила,атома галогена, циано, трифторметила или арила 1; где арил 1 представляет фенил; или фенил, замещенный одним или пятью заместителями, каждый из которых независимо выбран из С 1-4 алкила, С 1-4 алкилокси,полигалогенС 1-4 алкила, атома галогена, циано, трифторметила; R2 представляет атом водорода, С 1-4 алкил или атом галогена; А представляет C1-6 алкандиил; C1-6 алкандиил, замещенный одной или двумя группами, выбранными из арила 2, гетероарила 1 и C3-8 циклоалкила; или если X3 представляет СН, то указанный радикал А может также представлять NH, необязательно замещенный арилом 2, гетероарилом 1 или C3-8 циклоалкилом; где арил является фенилом; или фенилом, замещенным 1-5 заместителями, каждый из которых независимо выбран из С 1-4 алкила, С 1-4 алкилокси, атома галогена, циано или трифторметила; гетероарил 1 является фуранилом, тиенилом, пиридинилом, пиразинилом, пиримидинилом или пиридазинилом; и указанный гетероарил 1 необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из С 1-4 алкила, С 1-4 алкилокси, атома галогена, циано или трифторметила; В представляет NR3R4; или OR9; где каждый R3 и R4 независимо выбран из атома водорода, C18 алкила, C1-8 алкила, замещенного одним, двумя или тремя заместителями, каждый из которых независимо друг от друга выбран из гидрокси, атома галогена, циано, С 1-4 алкилокси, С 1-4 алкилоксикарбонила,С 3-8 циклоалкила, полигалогенС 1-4 алкила, NR5R6, CONR7R8, арила 3, полициклического арила или гетероарила 2; С 3-8 циклоалкила; С 3-8 циклоалкенила; С 3-8 алкенила; С 3-8 алкинила; арила 3; полициклического арила; гетероарила 2; илиR3 или R4, объединенные вместе с атомом азота, связанным с R3 или R4, могут образовать циклы азетидинила, пирролидинила, пиперидинила, морфолинила, азепанила или азоканила, где каждый из данных циклов может быть необязательно замещен С 1-4 алкилоксикарбонилом, С 1-4 алкилоксикарбонил С 1-4 алкилом, карбониламино, С 1-4 алкилкарбониламино, CONR7R8 или С 1-4 алкилCONR7R8; гдеR5 представляет атом водорода, С 1-4 алкил, арил 3, полициклический арил или гетероарил 2;R6 представляет атом водорода или С 1-4 алкил;R9 представляет C1-6 алкил или С 1-6 алкил, замещенный одним, двумя или тремя заместителями, каждый из которых независимо друг от друга выбран из гидрокси, атома галогена, циано, С 1-4 алкилокси,-2 009455 С 1-4 алкилоксикарбонила, С 3-8 циклоалкила, С 3-8 циклоалкенила, трифторметила, NR5R6, CONR7R8, арила 3,полициклического арила или гетероарила 2; где арил 3 является фенилом; фенилом, замещенным от одного до пяти заместителями, каждый из которых независимо выбран из С 1-4 алкила, С 1-4 алкилокси, атома галогена, гидрокси, трифторметила, циано, С 1-4 алкилоксикарбонила, С 1-4 алкилоксикарбонилС 1-4 алкила, метилсульфониламино, метилсульфонила, NR5R6, С 1-4 алкилNR5R6, CONR7R8 или С 1-4 алкилCONR7R8; полициклический арил является нафталинилом, инданилом, флуоренилом или 1,2,3,4-тетрагидронафталинилом, и указанный полициклический арил необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из C1-6 алкила, C1-6 алкилокси, фенила, атома галогена, циано, С 1-4 алкилкарбонила, С 1-4 алкилоксикарбонила, С 1-4 алкилоксикарбонилС 1-4 алкила, NR5R6, С 1-4 алкилNR5R6, CONR7R8, С 1-4 алкилCONR7R8 или С 1-4 алкилоксикарбониламино, и гетероарил 2 является пиридинилом; пиразинилом; пиримидинилом; пиридазинилом; триазинилом; триазолилом; имидазолилом; пиразолилом; тиазолилом; изотиазолилом; оксазолилом; пирролилом; фуранилом; тиенилом; хинолинилом; изохинолинилом; 1,2,3,4-тетрагидроизохинолинилом; бензотиазолилом; бензо[1,3]диоксолилом; 2,3-дигидробензо[1,4]диоксинилом; индолилом; 2,3-дигидро-1 Н-индолилом; 1 Н-бензоимидазолилом; и указанный гетероарил 2 необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из C1-6 алкила, С 1-6 алкилокси, фенила, атома галогена,циано, С 1-4 алкилкарбонила, С 1-4 алкилоксикарбонила, С 1-4 алкилоксикарбонилС 1-4 алкила, NR5R6, С 1-4 алкилNR5R6, CONR7R8 или С 1-4 алкилCONR7R8. В том смысле, в котором они используются в последующих определениях,атом галогена представляет атом фтора, хлора, брома и йода; С 1-4 алкил относится к насыщенным углеводородным радикалам с линейной или разветвленной цепью, содержащим от 1 до 4 атомов углерода, например, таким как метил, этил, пропил, бутил, 1 метилэтил, 2-метилпропил и тому подобное;C1-6 алкил включает С 1-4 алкил и его более высшие гомологи, содержащие 5 или 6 атомов углерода,например, такие как 2-метилбутил, пентил, гексил и тому подобное;C1-8 алкил включает C1-6 алкил и его более высшие гомологи, содержащие от 7 до 8 атомов углерода,например, такие как гептил, этилгексил, октил и тому подобное; полигалогенС 1-4 алкил определяется как полигалогензамещенный С 1-4 алкил, в частности С 1-4 алкилC3-6 циклоалкенил в общем относится к циклопропенилу, циклобутенилу, циклопентенилу и циклогексенилу; С 3-8 циклоалкенил в общем относится к циклопропенилу, циклобутенилу, циклопентенилу, циклогексенилу, циклогептенилу и циклооктенилу; С 1-4 алкандиил определяет двухвалентные углеводородные радикалы с линейной и разветвленной цепью, содержащие от 1 до 4 атомов углерода, например, такие как метандиил, 1,2-этандиил, 1,3 пропандиил и 1,4-бутандиил;C1-6 алкандиил определяет двухвалентные углеводородные радикалы с линейной и разветвленной цепью, содержащие от 1 до 6 атомов углерода, например, такие как метандиил, 1,2-этандиил, 1,3 пропандиил, 1,4-бутандиил, 1,5-пентандиил, 1,6-гександиил и их разветвленные изомеры;C3-6 алкенил определяет углеводородные радикалы с линейной и разветвленной цепью, содержащие одну двойную связь и содержащие от 3 до 6 атомов углерода, например, такие как 2-пропенил, 3 бутенил, 2-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил, 3-гексенил, 2-гексенил и тому подобное; С 3-8 алкенил предназначен для включения C3-6 алкенила и его более высших гомологов, содержащих 7 или 8 атомов углерода, например, таких как 2-пентенил, 2-октенил и тому подобное;C3-6 алкинил определяет углеводородные радикалы с линейной и разветвленной цепью, содержащие одну тройную связь и содержащие от 3 до 6 атомов углерода, например, такие как 2-пропинил, 3 бутинил, 2-бутинил, 2-пентинил, 3-пентинил, 3-метил-2-бутинил, 3-гексинил, 2-гексинил и тому подобное;C3-8 алкинил предназначен для включения C3-6 алкинила и его более высших гомологов, содержащих 7 или 8 атомов углерода, например, таких как 2-пентинил, 2-октинил и тому подобное. Термин стереохимически изомерные формы, в том смысле, в котором он использовался выше,определяет все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не упомянуто или не указано иначе, то химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, где указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Конкретнее, стереогенные центры могут иметь R- или Sконфигурацию; заместители в двухвалентных циклических (частично) насыщенных радикалах могут иметь цис- или транс-конфигурацию. Соединения, содержащие двойные связи, могут иметь Е- или Zстереохимию в указанной двойной связи. Предполагается, что стереохимически изомерные формы со-3 009455 единений формулы (I) очевидно включаются в объем данного изобретения. Абсолютную стереохимическую конфигурацию соединений формулы (I) и промежуточных соединений, используемых при их получении, могут легко определить специалисты в данной области с использованием хорошо известных методов, например, таких как дифракция рентгеновских лучей. Кроме того, некоторые соединения формулы (I) и некоторые промежуточные соединения, используемые при их получении, могут проявлять полиморфизм. Очевидно, понятно, что настоящее изобретение включает любые полиморфные формы, обладающие свойствами, пригодными для лечения состояний, указанных выше. Фармацевтически приемлемые кислотно-аддитивные соли, упомянутые выше, включают терапевтически активные нетоксичные аддитивные соли с кислотами, которые способны образовать соединения формулы (I). Данные фармацевтически приемлемые соли кислоты соответственно получают обработкой основания такой подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например соляная кислота или бромисто-водородная кислота, серная, азотная, фосфорная и подобные кислоты; или органические кислоты, например, такие как уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая кислота), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты. С другой стороны, указанные соли можно превратить обработкой подходящим основанием в свободное основание. Некоторые соединения формулы (I) могут также находиться в их таутомерных формах. Предполагается, что такие формы, хотя и не точно указанные в выше представленных формулах, включаются в объем настоящего изобретения. Например, когда ароматическое гетероциклическое кольцо замещено гидроксигруппой, то кетоформа может представлять наиболее распространенный таутомер. В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы(I), в которых арил 3, полициклический арил и гетероарил 2 определяются следующим образом: арил является фенилом; фенилом, замещенным от одного до пяти заместителями, каждый из которых независимо выбран из C1-4 алкила, C1-4 алкилокси, атома галогена, гидрокси, трифторметила, циано,C1-4 алкилоксикарбонила, С 1-4 алкилоксикарбонилC1-4 алкила, метилсульфониламино, NR5R, C1-4 алкилNR5R6, CONR7R8 или С 1-4 алкилCONR7R8, и полициклический арил является нафталинилом, инданилом, флуоренилом или 1,2,3,4 тетрагидронафталинилом, и указанный полициклический арил необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из C1-6 алкила, C1-6 алкилокси, фенила, атома галогена, циано, С 1-4 алкилкарбонила, С 1-4 алкилоксикарбонила, С 1-4 алкилоксикарбонилС 1-4 алкила, NR5R6, С 1-4 алкилNR5R6, CONR7R8 или С 1-4 алкилCONR7R8; и гетероарил 2 является пиридинилом; пиразинилом; пиримидинилом; пиридазинилом; триазинилом; триазолилом; имидазолилом; пиразолилом; тиазолилом; изотиазолилом; оксазолилом; пирролилом; фуранилом; тиенилом; хинолинилом; изохинолинилом; бензо[1,3]диоксолилом; 2,3-дигидробензо[1,4]диоксинилом; индолилом; 2,3-дигидро-1 Н-индолилом; 1 Н-бензоимидазолилом; и указанный гетероарил 2 необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из С 1-6 алкила, C1-6 алкилокси, фенила, атома галогена, циано, С 1-4 алкилкарбонила, С 1-4 алкилоксикарбонила, С 1-4 алкилоксикарбонилС 1-4 алкила, NR5R6, С 1-4 алкилNR5R6, CONR7R8 или С 1-4 алкилCONR7R8. В другом варианте осуществления настоящее изобретение относится к таким соединениям формулы (I), в которых пунктирная линия представляет необязательную связь, и она отсутствует, когда X2 представляет атом азота; радикал -Y1-Y2- представляет радикал формулы где в двухвалентных радикалах формулы (а-1) или (а-2) атом водорода может быть необязательно замещен C1-6 алкилом или фенилом;X1 представляет атом углерода или азота;R1 представляет С 1-6 алкил; арил 1; C1-6 алкил, замещенный гидрокси, C3-6 циклоалкилом, арилом 1 или нафталинилом; C3-6 алкенил; C3-6 алкенил, замещенный арилом 1; С 1-4 алкилоксиС 1-4 алкандиил, необязательно замещенный арилом 1;-4 009455 или когда -Y1-Y2- представляет радикал формулы (а-1), то R1 может быть взят вместе с Y2 с образованием радикала формулы -СН=СН-СН=СН-, в котором каждый атом водорода может быть необязательно замещен заместителем, независимо выбранным из С 1-4 алкила, С 1-4 алкилокси, трифторметила или арила 1; где арил 1 представляет фенил; или фенил, замещенный одним или двумя заместителями, каждый из которых независимо выбран из С 1-4 алкила, С 1-4 алкилокси, атома галогена, или трифторметила;R2 представляет атом водорода, С 1-4 алкил или атом галогена; А представляет С 1-6 алкандиил; C1-6 алкандиил, замещенный одной или двумя группами, выбранными из арила 2 и гетероарила 1; где арил 2 является фенилом; или фенилом, замещенным одним или двумя заместителями, каждый из которых независимо выбран из С 1-4 алкила и атома галогена; гетероарил 1 является тиенилом или пиридинилом; В представляет NR3R4; или OR9; где каждый R3 и R4 независимо выбран из атома водорода, C1-8 алкила, C1-8 алкила, замещенного одним или двумя заместителями, каждый из которых независимо друг от друга выбран из гидрокси, циано, С 1-4 алкилокси, С 1-4 алкилоксикарбонила, полигалогенС 1-4 алкила, NR5R6,арила 3, полициклического арила или гетероарила 2; С 3-8 циклоалкила; С 3-8 алкенила; арила 3; полициклического арила; гетероарила 2; илиR3 или R4, объединенные вместе с атомом азота, связанным с R3 или R4, могут образовать пиперидиниловый цикл, необязательно замещенный С 1-4 алкилоксикарбонилом; гдеR5 представляет атом водорода, С 1-4 алкил или арил 3;R6 представляет атом водорода или С 1-4 алкил;R9 представляет C1-6 алкил; где арил 3 является фенилом; фенилом, замещенным от одного до трех заместителей, каждый из которых независимо выбран из C1-4 алкила, C1-4 алкилокси, атома галогена, гидрокси, трифторметила, C1-4 алкилоксикарбонила, метилсульфонила или NR5R6; полициклический арил является нафталинилом, инданилом или флуоренилом, и указанный полициклический арил необязательно замещен одним заместителем, независимо выбранным из С 1-4 алкилоксикарбониламина, и гетероарил 2 является пиридинилом; тиазолилом; фуранилом; хинолинилом; 1,2,3,4-тетрагидроизохинолинилом; бензотиазолилом; бензо[1,3]диоксолилом; 2,3-дигидробензо[1,4]-диоксинилом; индолилом; 2,3-дигидро-1 Н-индолилом; 1 Н-бензоимидазолилом; и указанный гетероарил 2 необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из С 1-6 алкила, фенила,C1-4 алкилкарбонила, C1-4 алкилоксикарбонила или C1-4 алкилоксикарбонилC1-4 алкила. Интересными соединениями формулы (I) являются такие соединения формулы (I), для которых применяется одно или более из следующих ограничений:b) пунктирная линия представляет связь, и X2 является атомом углерода;c) R1 представляет С 1-6 алкил или арил 1, или C1-6 алкил, замещенный арилом 1;g) В представляет NR3R4, где каждый R3 и R4 независимо выбран из атома водорода, C1-8 алкила, C1-8 алкила, замещенного одним, двумя или тремя заместителями, выбранными из C1-4 алкилоксикарбонила,арила 3, полициклического арила или гетероарила 2. Первой конкретной группой соединений являются такие соединения формулы (I), в которых X2 представляет атом азота, и X3 представляет СН. Второй конкретной группой соединений являются такие соединения формулы (I), в которых X2 представляет СН, и X3 представляет атом азота. Третьей конкретной группой соединений являются такие соединения формулы (I), в которых оба X2 3 и X представляют атом азота. Четвертой конкретной группой соединений являются такие соединения формулы (I), в которых пунктирная линия представляет связь, X2 представляет атом углерода, и X3 представляет атом азота. Пятой конкретной группой соединений являются такие соединения формулы (I), в которых X1 представляет атом углерода. Шестой конкретной группой соединений являются такие соединения формулы (I), в которых X1 представляет атом азота. Седьмой конкретной группой соединений являются такие соединения формулы (I), в которых радикал А представляет C1-6 алкандиил, замещенный арилом 2. Восьмой конкретной группой соединений являются такие соединения формулы (I), в которых радикал В представляет C1-6 алкилокси. Девятой конкретной группой соединений являются такие соединения формулы (I), в которых радикал В представляет NR3R4, где R3 представляет атом водорода. Десятой конкретной группой соединений являются такие соединения формулы (I), в которых радикал А представляет -С(СН 3)2- или -С(СН 3)(С 6 Н 5)- или -С(С 6 Н 5)2)-, в частности радикал А представляет-С(СН 3) (С 6 Н 5)-. Предпочтительными соединениями формулы (I) являются соединения (187), (192), (196), (204),(223), (224), (227), (228), (271), (272), (278)-(295), (298)-(302), (314), (343)-(346), (361) и (362), представленные в табл. 1. В основном соединения формулы (I) можно получить взаимодействием промежуточного соединения формулы (III) с промежуточным соединением формулы (II), в которой Q выбран из атома брома, йода, трифторметилсульфоната, В(ОН)2, алкилборонатов и их циклических аналогов по меньшей мере в одном реакционно-инертном растворителе и необязательно в присутствии по меньшей мере одного конденсирующего реагента на основе переходного металла и/или по меньшей мере одного подходящего катализатора, такого как палладий, связанный с трифенилфосфином, трифениларсином и тому подобное. Более подробную информацию по данным условиям реакции Бухвальда можно найти ниже. Соединения формулы (I-а), определенные как соединения формулы (I), в которых X2 представляет атом азота, можно в основном получить взаимодействием промежуточного соединения формулы (V), в которой Z выбран из атома галогена, В(ОН)2, алкилборонатов и их циклических аналогов, с промежуточным соединением формулы (IV) по меньшей мере в одном реакционно-инертном растворителе и необязательно в присутствии по меньшей мере одного конденсирующего реагента на основе переходного металла и/или по меньшей мере одного подходящего лиганда, где указанный способ дополнительно необязательно включает превращение соединения формулы (I) в его кислотно-аддитивную соль, и/или получение его стереохимически изомерных форм. Данный тип реакции известен в данной области как реакция Бухвальда, применимые конденсирующие реагенты на основе металла и/или подходящие лиганды,например соединения палладия, такие как палладий тетра(трифенилфосфин), трис(дибензилиденацетон)дипалладий, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил и подобные, можно найти в Tetrahedron Letters (1996) 37(40) 7181-7184 и J. Am. Chem. Soc. (1996) 118: 7216. Если Z представляет В(ОН)2,алкилборонат или его циклический аналог, то следует использовать ацетат меди или алканоат меди в качестве конденсирующего реагента согласно описанному в Tetrahedron Letters (1998) 39: 2933-6. В альтернативном способе получения соединений формулы (I-а) используются промежуточные соединения формулы (IV), в которой X3 представляет атом азота и в которой группа В-(С=O)-А- замещена атомом водорода или подходящей защитной группой, такой как, например, бензил или третбутоксикарбонил. Указанную защитную группу удаляют после проведения реакции Бухвальда с последующим проведением реакции N-алкилирования с промежуточным соединением (VI). Соединения формулы (I-b), определенные как соединения формулы (I), в которой X3 представляет атом азота, можно в основном получить N-алкилированием промежуточного соединения формулы (VII) с промежуточным соединением формулы (VI), в которой W представляет соответствующую уходящую группу, например, такую как атом галогена, например атом фтора, хлора, брома, йода, или в некоторых случаях W может также представлять сульфонилокси, например метансульфонилокси, трифторметансульфонилокси, бензолсульфонилокси и подобные реакционноспособные уходящие группы. Реакцию можно проводить в реакционно-инертном растворителе, например, таком как ацетонитрил, 2-пентанол,изобутанол, диметилацетамид или ДМФА, и необязательно в присутствии подходящего основания, например, такого как карбонат натрия, карбонат калия, N-метилпирролидон или триэтиламин. Перемешивание может повысить скорость реакции. Реакцию можно соответственно проводить при температуре в пределах от комнатной температуры до температуры кипения реакционной смеси. Соединения формулы (1-c), определенные как соединения формулы (I), в которой радикал В представляет NR3R4, можно в основном получить взаимодействием промежуточного соединения формулы(VIII) с промежуточным соединением формулы (IX) по меньшей мере в одном реакционно-инертном-6 009455 растворителе и необязательно в присутствии по меньшей мере одного подходящего конденсирующего реагента и/или подходящего основания, где указанный способ дополнительно необязательно включает превращение соединения формулы (I) в его аддитивную соль, и/или получение его стереохимически изомерных форм. Может быть удобным активировать карбоновую кислоту формулы (IX) добавлением эффективного количества промотора реакции. Неограничивающие примеры таких промоторов реакции включают карбонилдиимидазолы, диимиды, такие как N,N'-дициклогексилкарбодиимид или 1-(3-диметиламинопропил)-3-этилкарбодиимид и их функциональные производные. В случае применения хирально чистого реагента формулы (VIII) можно провести быстрое и без энантиомеризации взаимодействие промежуточного соединения формулы (VIII) с указанным промежуточным соединением формулы (IX) при дополнительном присутствии эффективного количества соединения, такого как гидроксибензотриазол, бензотриазолилокситрис(диметиламино)фосфоний гексафторфосфат, тетрапирролидинофосфоний гексафторфосфат, бромтрипирролидинофосфоний гексафторфосфат, или их функционального производного, как раскрыто D. Hudson, J. Org. Chem. (1988), 53: 617. Соединения формулы (I-d), определенные как соединения формулы (I), в которой радикал В представляет OR9, можно в основном получить взаимодействием промежуточного соединения формулы (X) с промежуточным соединением формулы (IX) по меньшей мере в одном реакционно-инертном растворителе и необязательно в присутствии по меньшей мере одного подходящего конденсирующего реагента и/или подходящего основания, где указанный способ дополнительно необязательно включает превращение соединения формулы (I) в его аддитивную соль, и/или получение его стереохимически изомерных форм. Может быть удобным активировать карбоновую кислоту формулы (IX) добавлением эффективного количества промотора реакции. Неограничивающие примеры таких промоторов реакции включают карбонилдиимидазол, диимиды, такие как N,N'-дициклогексилкарбодиимид или 1-(3-диметиламинопропил)3-этилкарбодиимид, и их функциональные производные. Соединения формулы (1-е), определенные как соединения формулы (I), в которой пунктирная линия означает связь, и X2 представляет атом углерода, можно в основном получить взаимодействием промежуточного соединения формулы (XI) с промежуточным соединением формулы (XII), в которой один из L и Q выбран из атома брома, йода и трифторметилсульфоната, и другой из L и Q выбран из три(С 1-4 алкил)олова, B(OH)2, алкилборонатов и их циклических аналогов по меньшей мере в одном реакционно-инертном растворителе и необязательно в присутствии по меньшей мере одного конденсирующего реагента на основе переходного металла и/или по меньшей мере одного подходящего катализатора, такого как палладий, связанный с трифенилфосфином, трифениларсином, и тому подобное. Данный тип реакции известен в данной области как реакция Стиле или реакция Сузуки. В альтернативном способе получения соединений формулы (I-d) используются промежуточные соединения формулы (XI), в которой X3 представляет атом азота и в которой группа В-(С=O)-А- замещена подходящей защитной группой, например, такой как бензил или трет-бутоксикарбонил. Указанную защитную группу удаляют после проведения реакции сочетания с последующим проведением реакции Nалкилирования с промежуточным соединением (VI). Исходные вещества и некоторые промежуточные соединения являются известными соединениями и промышленно доступными, или их можно получить обычными способами, известными в данной области. Соединения формулы (IX-а), определенные как промежуточные соединения формулы (IX), в которой X3 представляет атом азота, можно получить, как представлено ниже. Промежуточное соединение формулы (XIII) подвергают взаимодействию с промежуточным соединением формулы (V) в условиях-7 009455 реакции Бухвальда и полученное промежуточное соединение формулы (XIV) затем превращают в промежуточное соединение формулы (IX-а) с использованием известного в данной области гидролиза, катализируемого кислотой или основанием. Промежуточные соединения формулы (VII) можно получить взаимодействием промежуточного соединения формулы (III) с промежуточным соединением формулы (XV), в которой PG представляет защитную группу, такую как бензил или трет-бутоксикарбонил, и Q выбран из атомов брома, йода и трифторметилсульфоната по меньшей мере в одном реакционно-инертном растворителе и необязательно в присутствии по меньшей мере одного конденсирующего реагента на основе переходного металла и/или по меньшей мере одного подходящего катализатора, такого как палладий, связанный с трифенилфосфином, трифениларсином, и тому подобное; с последующим удалением защитной группы. Промежуточные соединения формулы (VII-а), определенные как промежуточные соединения формулы (VII), в которой -Y1-Y2- представляет -CH=N-, и R1 является атомом водорода, можно получить,как схематично представлено ниже. PG представляет защитную группу, например, такую как бензил или трет-бутоксикарбонил, которую удаляют на конечной стадии. Промежуточные соединения формулы (VII-b), определенные как промежуточные соединения формулы (VII), в которой -Y1-Y2- представляет -CH=N-, где атом водорода замещен C1-6 алкилом или фенилом, и R1 является атомом водорода, можно получить, как схематично представлено ниже. PG представляет защитную группу, например, такую как бензил или трет-бутоксикарбонил, которую удаляют на конечной стадии. Промежуточные соединения формулы (VII-c), определенные как промежуточные соединения формулы (VII), в которой -Y1-Y2- представляет -CH=N-, где атом водорода замещен C1-6 алкилом или фени-8 009455 лом, можно получить, как схематично представлено ниже. PG представляет защитную группу, например,такую как бензил или трет-бутоксикарбонил, которую удаляют на конечной стадии. Другие промежуточные соединения формулы (VII) можно получить, как схематично представлено ниже. PG представляет защитную группу, например, такую как бензил или трет-бутоксикарбонил, которую удаляют на конечной стадии. Промежуточные соединения формулы (IV-a), определенные как соединения формулы (IV), в которой X3 представляет атом азота, можно получить N-алкилированием пиперазина путем взаимодействия промежуточного соединения формулы (VI) с пиперазином. Реакцию можно проводить в реакционноинертном растворителе, например, таком как ацетонитрил, и необязательно в присутствии подходящего основания, например, такого как карбонат натрия, карбонат калия или триэтиламин. Перемешивание может повысить скорость реакции. Реакцию можно соответственно проводить при температуре в пределах примерно от комнатной температуры до температуры кипения реакционной смеси. Промежуточные соединения формулы (V), определенные как промежуточные соединения формулы(V), в которой Z представляет атом галогена, можно получить взаимодействием промежуточного соединения формулы (III) с промежуточным соединением формулы (XVI), в которой Q выбран из атома брома, йода и трифторметилсульфоната по меньшей мере в одном реакционно-инертном растворителе и необязательно в присутствии по меньшей мере одного конденсирующего реагента на основе переходного металла и/или по меньшей мере одного подходящего катализатора, такого как палладий, связанный с трифенилфосфином, трифениларсином. Соединения формулы (I), полученные способами, описанными выше, можно синтезировать в виде рацемических смесей энантиомеров, которые можно отделить друг от друга, следуя известным в данной области методам разделения. Данные соединения формулы (I), полученные в рацемической форме, можно превратить в соответствующие диастереомерные соли при взаимодействии с подходящей хиральной кислотой. Затем указанные диастереомерные соли разделяют, например, селективной или фракционированной кристаллизацией и энантиомеры выделяют щелочью. Альтернативный способ разделения энантиомеров соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные стереохимически чистые изомеры можно также получить из соответствующих стереохимически чистых изомеров соответствующих исходных соединений, при условии, что реакция протекает стереоспецифически. Предпочтительно, если желаемым является конкретный стереоизомер, то указанное соединение следует синтезировать стереоспецифическими способами получения. В данных способах преимущественно будут использоваться энантиомерно чистые исходные вещества. Соединения формулы (I), их N-оксиды, фармацевтически приемлемые соли и стереоизомеры обладают положительным влиянием на секрецию апоВ и ингибирующей активностью в отношении МТР, и-9 009455 сопутствующей активностью по снижению уровня липидов. Следовательно, настоящие соединения формулы (I) являются пригодными в качестве лекарственного средства особенно в способе лечения пациентов, страдающих гиперлипидемией, ожирением, атеросклерозом или диабетом типа II. Следовательно,настоящие соединения можно использовать для производства лекарственного средства для лечения нарушений, вызванных избытком липопротеинов очень низкой плотности (VLDL) или липопротеинов низкой плотности (LDL), и особенно нарушений, вызванных холестерином, связанным с указанными VLDL и LDL. В частности, настоящие соединения можно использовать для производства лекарственного средства для лечения гиперлипидемии, ожирения, атеросклероза или диабета типа II. Оказалось, что основной механизм действия соединений формулы (I) включает ингибирование активности МТР (микросомального белка переноса триглицеридов) в гепатоцитах и эпителиальных клетках кишечника, приводя соответственно к снижению уровня VLDL и продукции хиломикронов. Это новый и инновационный подход к лечению гиперлипидемии, и полагают, что он приводит к снижению уровня LDL-холестерина и триглицеридов посредством уменьшения продукции VLDL и продукции хиломикронов в кишечнике. Большое количество наследственных и приобретенных заболеваний может привести к развитию гиперлипидемии. Их можно подразделить на первичные и вторичные гиперлипидемические состояния. Наиболее частыми причинами вторичных гиперлипидемий являются сахарный диабет, злоупотребление алкоголем, лекарственными препаратами, гипотиреоидизм, хроническая почечная недостаточность, нефротический синдром, холестаз и булимия. Первичными гиперлипидемиями, как правило, являются обычная гиперхолестеринемия, семейная комбинированная гиперлипидемия, семейная гиперхолестеринемия, остаточная гиперлипидемия, синдром хиломикронемии, семейная гипертриглицеридемия. Настоящие соединения можно также использовать для профилактики или лечения пациентов, страдающих ожирением или атеросклерозом, особенно атеросклерозом коронарных сосудов и более общих заболеваний, которые связаны с атеросклерозом, таких как ишемическое заболевание сердца, заболевание периферических сосудов, заболевание сосудов мозга. Настоящие соединения могут привести к регрессии атеросклероза и подавить клинические последствия атеросклероза, особенно в отношении заболеваемости и смертности. В свете применимости соединений формулы (I) следует, что настоящее изобретение также обеспечивает способ лечения теплокровных животных, включая людей (в целом называемых здесь пациентами), страдающими нарушениями, вызванными избытком липопротеинов очень низкой плотности(VLDL) или липопротеинов низкой плотности (LDL), и особенно нарушений, вызванных холестерином,связанным с указанными VLDL и LDL. Следовательно, обеспечивается способ лечения пациентов, страдающих, например, такими состояниями, как гиперлипидемия, ожирение, атеросклероз или диабет типаII. Аро В-48, синтезированный в кишечнике, необходим для сборки хиломикронов и, следовательно,обладает важной ролью во всасывании жиров пищи в кишечнике. Настоящее изобретение обеспечивает соединения, которые действуют в качестве избирательных ингибиторов МТР на уровне стенки кишечника. Дополнительно настоящее изобретение обеспечивает фармацевтические композиции, содержащие по меньшей мере один фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (I). Для получения фармацевтических композиций по данному изобретению эффективное количество конкретного соединения в виде основания или кислотно-аддитивной соли в качестве активного ингредиента объединяют в однородной смеси по меньшей мере с одним фармацевтически приемлемым носителем, где носитель может иметь широкое разнообразие форм в зависимости от формы средства, желаемой для введения. Желательно, чтобы данные фармацевтические композиции находились в разовой лекарственной форме, подходящей предпочтительно для перорального введения, ректального введения, чрескожного введения или парентеральной инъекции. Например, при получении композиций в препаративной форме для перорального введения можно использовать любые обычные жидкие фармацевтические носители, например, такие как вода, гликоли,масла, спирты и тому подобное, в случае жидких препаративных форм для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые фармацевтические носители, такие как крахмалы, сахара, каолин, скользящие вещества, связующие вещества, разрыхлители и тому подобное в случае порошков, пилюль, капсул и таблеток. В результате простого введения таблетки и капсулы представляют собой наиболее преимущественные лекарственные формы для перорального введения, где в таком случае обязательно применяют твердые фармацевтические носители. Для инъекционных композиций для парентерального введения фармацевтический носитель в основном будет включать стерильную воду,хотя можно включать другие ингредиенты для повышения растворимости активного вещества. Например, инъекционные растворы можно получить с использованием фармацевтического носителя, содержащего раствор соли, раствор глюкозы или смесь обоих. Также можно приготовить инъекционные суспензии с использованием соответствующих жидких носителей, суспендирующих веществ и тому подобное. В композициях, подходящих для перкутанного введения, фармацевтический носитель может необяза- 10009455 тельно включать средство для усиления проникновения и/или подходящее смачивающее вещество, необязательно в смеси с небольшими количествами подходящих добавок, которые не оказывают существенного раздражающего действия на кожу. Указанные добавки можно выбрать для улучшения введения активного ингредиента на кожу, и/или которые могут быть полезными при приготовлении желаемых композиций. Данные композиции для местного применения можно вводить различными путями, например, в виде трансдермального пластыря, наклейки или мази. Аддитивные соли соединений формулы (I) за счет их повышенной растворимости в воде по сравнению с соответствующим основанием объективно являются более подходящими при получении водных композиций. Является особенно преимущественным формулировать фармацевтические композиции по изобретению в разовые лекарственные формы для простоты введения и однородности дозировки. Термин разовая лекарственная форма, в том смысле, в котором он здесь используется, относится к физически дискретным единицам, подходящим в качестве разовых доз, где каждая единица содержит заранее определенное количество активного ингредиента, рассчитанного для получения желаемого терапевтического эффекта, в смеси с необходимым фармацевтическим носителем. Примерами таких разовых лекарственных форм являются таблетки (включая таблетки с риской или покрытые оболочкой таблетки), капсулы,пилюли, пакеты с порошком, облатки, инъекционные растворы или суспензии, количество препарата объемом чайной ложки, количество препарата объемом столовой ложки и тому подобное, и их разделенные количества. Для перорального введения фармацевтические композиции по настоящему изобретению могут иметь форму твердых лекарственных форм, например таблеток (как для проглатывания, так и разжевывания), капсул или мягких капсул, полученных обычными способами с фармацевтически приемлемыми наполнителями и носителями, такими как связующие вещества (например, предварительно желатинированный кукурузный крахмал, поливинилпирролидон, гидроксипропилметилцеллюлоза и тому подобное),наполнители (например, лактоза, микрокристаллическая целлюлоза, фосфат кальция и тому подобное),смазывающие вещества (например, стеарат магния, тальк, диоксид кремния и тому подобное), разрыхлители (например, картофельный крахмал, крахмал натрия гликоллата), смачивающие вещества (например,лаурилсульфат натрия) и тому подобное. Такие таблетки можно также покрыть оболочками способами,хорошо известными в данной области. Жидкие препаративные формы для перорального введения могут иметь форму, например, растворов, сиропов или суспензий, или их можно формулировать в виде сухого продукта для смешивания с водой и/или другим подходящим жидким носителем перед применением. Такие жидкие препаративные формы можно приготовить обычными способами, необязательно с другими фармацевтически приемлемыми добавками, такими как суспендирующие вещества (например, сироп сорбита, метилцеллюлоза,гидроксипропилметилцеллюлоза или гидрогенизированные пищевые жиры), эмульгаторы (например,лецитин или аравийская камедь), неводные носители (например, миндальное масло, жирные эфиры или этиловый спирт), подсластители, вкусовые вещества, маскирующие вещества и консерванты (например,метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подсластители, пригодные в фармацевтических композициях по изобретению, предпочтительно включают по меньшей мере один интенсивный подсластитель, такой как аспартам, ацесульфам калия, цикламат натрия, алитам, подсластитель дигидрохалькон, монеллин, стевиозид, сукралоза (4,1',6'-трихлор-4,1',6'-тридезоксигалактосахароза) или предпочтительно сахарин, сахарин натрия или кальция, и, необязательно, по меньшей мере один объемный подсластитель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, солод, глюкоза, гидрогенизированный глюкозный сироп,ксилит, карамель или мед. Обычно интенсивные подсластители применяют в низких концентрациях. Например, в случае сахарина натрия указанная концентрация может находиться в пределах примерно от 0,04 до 0,1% (мас./об.) от конечной композиции. Объемный подсластитель можно использовать в более высоких концентрациях в пределах примерно от 10 до примерно 35%, предпочтительно примерно от 10 до 15% (мас./об.). Фармацевтически приемлемые вкусовые вещества, которые маскируют горький вкус ингредиентов в композициях с низкими дозами, предпочтительно представляют фруктовые вкусовые вещества, такие как со вкусом и запахом вишни, малины, черной смородины или клубники. Очень хорошие результаты может иметь смешение двух вкусовых веществ. В композициях с высокими дозами могут быть необходимыми более сильные фармацевтически приемлемые вкусовые вещества, такие как Caramel Chocolate,Mint Cool, Fantasy и тому подобное. Каждое вкусовое вещество может находиться в конечной композиции в концентрации в пределах примерно от 0,05 до 1% (мас./об.). Преимущественно применяют комбинации указанных сильных вкусовых веществ. Предпочтительно используют вкусовое вещество, которое не претерпевает какого-либо изменения или потери вкуса, и/или цвета в условиях композиции. Соединения формулы (I) можно формулировать для парентерального введения, обычно внутривенной, внутримышечной или подкожной инъекцией, например болюс-инъекцией или длительной внутривенной инфузией. Композиции для инъекции могут находиться в разовой лекарственной форме, например в ампулах или контейнерах для множества доз, включающих добавленный консервант. Они могут находиться в таких формах, как суспензии, растворы или эмульсии в масляных или водных носителях, и- 11009455 могут содержать формообразующие агенты, такие как изотонирующие, суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно активный ингредиент может находиться в виде порошка для смешения с подходящим носителем, например стерильной непирогенной водой, перед применением. Соединения формулы (I) можно также формулировать в композиции для ректального применения в виде суппозиториев или удерживающих клизм, например, содержащих обычные основы для суппозиториев, такие как какао-масло и/или другие глицериды. Соединения формулы (I) можно также использовать в комбинации с другими фармацевтическими средствами, в частности, фармацевтические композиции по настоящему изобретению могут дополнительно содержать по меньшей мере одно дополнительное средство для снижения уровня липидов, приводя, таким образом, к так называемой комбинированной терапии для снижения уровня липидов. Указанное дополнительное средство для снижения уровня липидов может представлять собой, например,известный препарат, обычно применяемый для контроля гиперлипидемии, такой как полимер для связывания желчных кислот, производное фибриковой кислоты или никотиновой кислоты, как уже упоминалось в разделе изобретения уровень техники. Подходящие дополнительные средства для снижения уровня липидов включают другие ингибиторы биосинтеза холестерина и ингибиторы всасывания холестерина, особенно ингибиторы HMG-CoA-редуктазы и ингибиторы HMG-CoA-синтазы, ингибиторы гена экспрессии HMG-CoA-редуктазы, ингибиторы СЕТР, ингибиторы АСАТ, ингибиторы скваленсинтетазы,антагонисты СВ-1, ингибиторы всасывания холестерина, такие как эзетимиб и тому подобное. Любой ингибитор HMG-CoA-редуктазы можно использовать в качестве второго соединения в аспекте комбинированной терапии данного изобретения. Термин ингибитор HMG-CoA-редуктазы, в том смысле, в котором он здесь используется, если не указано иначе, относится к соединению, которое ингибирует биотрансформацию гидроксиметилглутарил-коэнзима А в мевалоновую кислоту, катализируемую ферментом HMG-CoA-редуктазой. Такими ингибиторами HMG-CoA-редуктазы являются, например, ловастатин, симвастатин, флувастатин, правастатин, ривастатин и аторвастатин. Любой ингибитор HMG-CoA-синтазы можно использовать в качестве второго соединения в аспекте комбинированной терапии данного изобретения. Термин ингибитор HMG-CoA-синтазы, в том смысле,в котором он здесь используется, если не указано иначе, относится к соединению, которое ингибирует биосинтез гидроксиметилглутарил-коэнзима А из ацетил-коэнзима А и ацетоацетил-коэнзима А, катализируемый ферментом HMG-CoA-синтазой. Любой ингибитор гена экспрессии HMG-CoA-редуктазы можно использовать в качестве второго соединения в аспекте комбинированной терапии данного изобретения. Данные средства могут быть ингибиторами транскрипции HMG-CoA-редуктазы, которые блокируют транскрипцию ДНК, или ингибиторами трансляции, которые предупреждают трансляцию мРНК, кодирующей HMG-CoA-редуктазы, в белок. Такие ингибиторы могут оказывать влияние на транскрипцию или трансляцию непосредственно или могут биотрансформироваться в соединения, обладающие вышеуказанными свойствами, под действием одного или более ферментов в каскаде биосинтеза холестерина, или могут привести к накоплению метаболита, обладающего вышеуказанной активностью. Любой ингибитор СЕТР можно использовать в качестве второго соединения в аспекте комбинированной терапии данного изобретения. Термин ингибитор СЕТР, в том смысле, в котором он здесь используется, если не указано иначе, относится к соединению, которое ингибирует транспортный белок холестерилового эфира (СЕТР), опосредуемого транспорт различных холестериловых эфиров и триглицеридов от HDL в LDL и VLDL. Любой ингибитор АСАТ можно использовать в качестве второго соединения в аспекте комбинированной терапии данного изобретения. Термин ингибитор АСАТ, в том смысле, в котором он здесь используется, если не указано иначе, относится к соединению, которое ингибирует внутриклеточную этерификацию холестерина пищи, осуществляемую под действием фермента ацил-СоА:холестеринацилтрансферазы. Любой ингибитор скваленсинтетазы можно использовать в качестве второго соединения в аспекте комбинированной терапии данного изобретения. Термин ингибитор скваленсинтетазы, в том смысле, в котором он здесь используется, если не указано иначе, относится к соединению, которое ингибирует конденсацию двух молекул фарнезилпирофосфата с образованием сквалена, катализируемую ферментом скваленсинтетазой. Очевидно, специалисты в области лечения гиперлипидемии легко определят терапевтически эффективное количество соединения формулы (I) на основе результатов тестов, представленных ниже. В основном полагается, что терапевтически эффективная доза будет находиться в пределах примерно от 0,001 до примерно 50 мг/кг массы тела, более предпочтительно примерно от 0,01 до примерно 5 мг/кг массы тела пациента, который подвергается лечению. Может быть удобным вводить терапевтически эффективную дозу в виде двух или более субдоз с соответствующими интервалами в течение суток. Указанные субдозы можно формулировать в виде разовых лекарственных доз, например, каждая содержащая примерно от 0,1 до примерно 350 мг, более предпочтительно примерно от 1 до примерно 200 мг активного ингредиента на разовую лекарственную форму.- 12009455 Точная дозировка и частота введения зависит от конкретного используемого соединения формулы(I), конкретного состояния, которое подвергается лечению, тяжести состояния, которое подвергается лечению, возраста, массы и общего физического состояния конкретного пациента, а также другого лечения(включая вышеупомянутые дополнительные средства для снижения уровня липидов), которому может подвергаться пациент, как это хорошо известно специалистам в данной области. Кроме того, указанное эффективное суточное количество может быть снижено или повышено в зависимости от ответной реакции пациента, подвергающегося лечению, и/или в зависимости от оценки врача, назначающего соединения по настоящему изобретению. Следовательно, пределы эффективных суточных количеств, указанные выше, представляют собой только указания. Экспериментальный раздел В методиках, описанных здесь ниже, используются следующие сокращения: DMSO означает диметилсульфоксид; THF означает тетрагидрофуран; DCM означает дихлорметан; DIPE означает диизопропиловый эфир; DMF означает N,N-диметилформамид; TFFH означает тетраметилфторформамидиния гексафторфосфат; NMP означает N-метил-2-пирролидон; DIPEA означает диизопропилэтиламин; TFA означает трифторуксусная кислота; TIS означает триизопропилсилан и BINAP означает 2,2'-бис(дифенилфосфино)-1,1'-бинафтил. РуВОР означает комплексExtrelut представляет продукт Merck KgaA (Darmstadt, Германия) и является короткой колонкой,содержащей диатомовую землю. Метилизоцианат-полистирольный полимер (Novabiochem 01-64-0169); 4-бензилоксибензальдегидполистирольный полимер (Novabiochem 01-64-0182); 2-(3,5-диметокси-4-формилфенокси)этоксиметилполистирольный полимер (Novabiochem 01-64-0261); -1-глицерол-полистирольный полимер (Novabiochem 01-64-0408) и N-гидроксибензотриазол-6-карбоксамидометил-полистирольный полимер (Novabiochem 01-64-0425) можно получить от Calbiochem-Novabiochem AG, Weidenmattweg 4, СН-4448 Lufelfingen, Швейцария). Примеры А. Синтез промежуточных соединений. Пример А.1.a) Получение промежуточного соединения (1). 4-Бромфенилгидразин гидрохлорид (1:1) (0,11 моль) превращали в свободное основание с использованием смеси CH2Cl2/H2O/Na2CO3. Добавляли этил N-этоксикарбонилацетимидат (0,13 моль) и 4 диметиламинопиридин (2 г) в триэтиламине (22 мл) и ксилоле (200 мл). Смесь перемешивали и кипятили с обратным холодильником в течение ночи и затем перемешивали при комнатной температуре в течение выходных дней, фильтровали и высушивали с получением 16 г промежуточного соединения (1). промежуточного соединения (2).b) Получение Смесь промежуточного соединения (1) (0,063 моль) и гидроокись калия (0,69 моль) в ДМФА (300 мл) перемешивали в течение 20 мин. Добавляли 2-бромпропан (0,126 моль). Смесь перемешивали при 60 С в течение ночи. Растворитель выпаривали. Остаток растворяли в DCM и промывали водой. Органический слой высушивали, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2). Собирали очищенные фракции и растворитель выпаривали с получением 7 г промежуточного соединения (2). Пример A.2. промежуточного соединения (3). а) Получение Смесь N,N-диметил-N'-(4-нитрофенил)метангидразонамида (0,17 моль), 2-изоцианатопропана (23 г) и N,N-диметил-4-пиридинамина (2 г) в дихлорметане (200 мл) перемешивали и кипятили с обратным холодильником в течение ночи. Добавляли 2-изоцианатопропан (20 г) и реакционную смесь перемешивали и кипятили с обратным холодильником в течение 2 ч. Растворитель выпаривали. Остаток перемешивали и кипятили с обратным холодильником в течение 2 ч в ксилоле (300 мл). Смесь охлаждали и полученный осадок отфильтровывали и перекристаллизовывали из толуола. Осадок отфильтровывали и высушивали с получением 29 г промежуточного соединения (3). промежуточного соединения (4).b) Получение Смесь промежуточного соединения (3) (0,11 моль) в метаноле (500 мл) гидрировали с использованием палладия на угле (10%, 4 г) в качестве катализатора в присутствии раствора тиофена (2 мл). После- 13009455 поглощения водорода (3 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток кристаллизовали из смеси MIK/DIPE с получением 18 г промежуточного соединения (4) (т. пл. 132,5 С). Пример А.3. промежуточного соединения (5). а) Получение Смесь 4-бромбензоламина (0,2 моль) и этилового эфира (1-этоксиэтилиден)гидразинкарбоновой кислоты (0,4 моль) перемешивали на масляной бане при 130-140 С в атмосфере азота в течение 4 ч, затем реакционную смесь охлаждали и растирали с диэтиловым эфиром (150 мл). Полученные твердые частицы отфильтровывали и высушивали с получением 21,5 г сырого продукта. Часть (3,5 г) сырого продукта кристаллизовали из 2-пропанола, затем собирали полученный продукт и высушивали в течение 18 ч при 50 С с получением 2,60 г промежуточного соединения (5) (т. пл. 88-90 С).b) Получение промежуточного соединения (6). Смесь промежуточного соединения (5) (0,01 моль), 2-бромбутана (0,02 моль) и гидроокиси калия(0,02 моль) в ДМФА (50 мл) подвергали взаимодействию в течение 2 ч при 120 С. Реакционную смесь охлаждали и выливали в ледяную воду (500 мл). Полученный осадок отфильтровывали и высушивали с получением 2,20 г сырого продукта, который очищали колоночной флэш-хроматографией на силикагеле(элюент 1: CH2Cl2; элюент 2: CH2Cl2/10% NH4OH/CH3OH) 99/1). Собирали фракции очищенного продукта и растворитель выпаривали с получением 1,56 г промежуточного соединения (6) (т. пл. 168-170 С). Пример А.4. Получение промежуточного соединения (7). Триэтиламин (0,040 моль) добавляли к суспензии 2,4-дигидро-4,5-дифенил-3 Н-1,2,4-триазол-3-она(0,013 моль), 4-бромфенилбороновой кислоты (0,026 моль) и ацетата меди(II) (0,0209 моль) в DCM (150 мл в атмосфере N2). Добавляли молекулярные сита (3 г). Смесь перемешивали при комнатной температуре в течение выходных дней, затем фильтровали через дикалит, промывали 10% раствором NH4OH(150 мл), дважды промывали водой (100 мл) и промывали насыщенным раствором NaCl. Полученный осадок отфильтровали через дикалит и фильтрат упаривали. Остаток растирали с метанолом. Осадок отфильтровывали и высушивали с получением 1,8 г промежуточного соединения (7). Пример А.5. промежуточного соединения (8). Получение 2-Бромпропан (0,03 моль) добавляли при комнатной температуре к перемешиваемому раствору 4(п-бромфенил)-5-фенил-4 Н-1,2,4-триазол-3-ола (0,01 моль) и гидроокиси калия (0,011 моль) в ДМФА (40 мл). Смесь перемешивали при 60 С в течение 16 ч и затем перемешивали при 70 С в течение 6 ч. Смесь выливали в холодную воду (200 мл). Полученный осадок отфильтровывали, промывали водой и DIPE и высушивали в вакууме. Фильтрат экстрагировали дважды DIPE (2 раза по 75 мл). Объединенный органический слой высушивали, фильтровали и растворитель выпаривали. Остаток растирали с метанолом. Осадок отфильтровывали и высушивали с получением промежуточного соединения (8). Пример А.6. Получение промежуточного соединения (9). Раствор этилового эфира N-(4-бромфенил)бензолкарбогидразоновой кислоты (0,00063 моль) в ТГФ(3 мл) охлаждали до -40 С. Добавляли по каплям гексаметилдисилазан лития (1 М раствор в ТГФ) (0,0007 моль). Смесь перемешивали при -40 С в течение 30 мин. Добавляли смесь изопропилизоцианата (0,001 моль) в ТГФ (2 мл). Смесь перемешивали в течение 3 ч, при этом снижая температуру до комнатной температуры, затем перемешивали при комнатной температуре в течение 1 ч и выливали в воду и HCl (1 н. раствор). Органический слой отделяли, разбавляли DCM, промывали водой и насыщенным растворомNaCl, высушивали, фильтровали и затем выпаривали растворитель. Данную фракцию растирали с DIPE. Осадок отфильтровывали и высушивали. Остаток очищали колоночной хроматографией на силикагеле (элюент: смесь СН 2Cl2/гексан 10/1). Собирали очищенные фракции и растворитель выпаривали с получением 0,065 г промежуточного соединения (9).- 14009455 Пример А.7. промежуточного соединения (10). а) Получение Смесь 4-(4-бромфенил)-2,4-дигидро-3H-1,2,4-триазол-3-она (0,062 моль) и гидроокиси калия (0,07 моль) в ДМФА (200 мл) перемешивали в течение 15 мин. Добавляли 2-бромпропан (0,2 моль) и реакционную смесь перемешивали в течение ночи при 60 С. Реакционную смесь охлаждали, выливали в воду,затем перемешивали в течение 1 ч. Реакционную смесь фильтровали. Осадок растворяли в DCM. Органический раствор промывали, высушивали, фильтровали и растворитель выпаривали. Осадок растирали с DIPE, отфильтровывали и высушивали с получением 11,2 г промежуточного соединения (10).b) Получение промежуточного соединения (11). Смесь промежуточного соединения (10) (0,001 моль), комплекса Pd2(дибензилиденацетон)3(0,0000025 моль), BINAP (0,000005 моль) и пивалата натрия (0,00116 моль) в толуоле (4 мл) перемешивали в атмосфере Ar в течение 5 мин. Добавляли смесь этилового эфира 1-пиперазинкарбоновой кислоты(0,00116 моль) в толуоле (1 мл). Смесь перемешивали при 100 С в течение 16 ч, упаривали и очищали ВЭЖХ (элюент: (0,5% NH4OAc в H2O/CH3CN 90/10)/CH3CN 85/15, 10/90 и 0/100; колонка: Hyperprep C18 8 мкм). Собирали очищенные фракции и выпаривали растворитель с получением 0,076 г промежуточного соединения (11). промежуточного соединения (12). с) Получение Смесь промежуточного соединения (11) (0,05 моль) и бисульфита натрия (3 г) в растворе бромистоводородной кислоты в воде (48% раствор) (125 мл) перемешивали и кипятили с обратным холодильником в течение 5 ч. Смесь охлаждали и выпаривали. Остаток растворяли в DCM и нейтрализовалиNH4OH. Органический слой высушивали, фильтровали и выпаривали. Остаток кристаллизовали из этилацетата. Осадок отфильтровывали и высушивали в вакууме при 75 С с получением 12,9 г промежуточного соединения (12) (т. пл. 125,3 С). Пример А.8. Получение промежуточного соединения (13). Смесь промежуточного соединения (4) (0,17 моль) и 2-хлор-N-(2-хлорэтил)этанамина гидрохлорида(0,35 моль) в 2-бутаноле (400 мл) перемешивали и кипятили с обратным холодильником. Добавляли карбонат калия (715 г) каждый час и смесь перемешивали и кипятили с обратным холодильником в течение ночи. Смесь охлаждали и фильтровали. Осадок растворяли в воде и экстрагировали DCM. Органический слой выпаривали и остаток перемешивали в DIPE. Осадок отфильтровывали и высушивали в вакууме при 65 С с получением 29 г промежуточного соединения (13) (т. пл. 130,2 С). Пример А.9. промежуточного соединения (14). Получение Суспензию промежуточного соединения (7) (0,010 моль), комплекса Pd2(дибензилиденацетон)3(0,0002 моль), BINAP (0,0004 моль) и бутилата натрия (0,025 моль) в безводном толуоле (100 мл) перемешивали при комнатной температуре в течение 15 мин. Добавляли пиперазин (0,050 моль). Смесь перемешивали при 110 С в течение 16 ч, фильтровали через дикалит и фильтрат три раза промывали водой, промывали концентрированным раствором соли,высушивали, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: смесь CH2Cl2/CH3OH/NH3 90/10/1). Собирали очищенные фракции и растворитель выпаривали. Остаток растирали с метанолом, отфильтровывали и высушивали с получением 1,1 г промежуточного соединения (14). Промежуточные соединения (15), (16) и (17) получали аналогичным способом. промежуточное соединение (17) Пример А.10. Получение промежуточного соединения (18). Пиперазин (0,2 моль) в ДМФА (15 мл) перемешивали до полного растворения. Добавляли по каплям метил 2-бромфенилацетат (0,043 моль). Смесь перемешивали в течение ночи. Растворитель выпаривали. Остаток растворяли в DCM и промывали водой. Органический слой высушивали, фильтровали и растворитель выпаривали с получением 10 г промежуточного соединения (18). Пример А.11. Получение промежуточного соединения (19). Тионилхлорид (81 мл) добавляли к перемешиваемому раствору 2-бром-2-фенилуксусной кислоты(0,54 моль) в сухом хлороформе (450 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 2,5 ч. Смесь упаривали и остаток растворяли в тетрагидрофуране (200 мл) и полученный раствор медленно добавляли в перемешиваемый раствор 1 Н-2,3-дигидроинден-5-амина (0,42 моль) и триэтиламина (80 мл) в тетрагидрофуране (300 мл), охлажденный ледяной водой в течение 15 мин. Реакционную смесь перемешивали в течение ночи и экстрагировали из воды (100 мл) DCM (3 раза по 250 мл). Экстракты объединяли, промывали разбавленным раствором HCl и насыщенным раствором соли, затем смесь высушивали и фильтровали. Остаток кристаллизовали 2 раза из этилацетата (250 мл) и затем собирали продукт с получением 65,0 г промежуточного соединения (19) (т. пл. 112-114 С). Пример А.12. промежуточного соединения (20). Получение Хлорфенилацетилхлорид (0,0015 моль) добавляли к раствору метилового эфира 5-амино-2 метилбензойной кислоты гидрохлорида (0,0010 моль) и триэтиламина (0,0030 моль) в DCM (25 мл) и реакционную смесь перемешивали в течение 70 ч при 20 С, затем добавляли воду (5 мл) и смесь перемешивали в течение 3 ч при 20 С. Органический слой отделяли и растворитель выпаривали. Сырой остаток очищали высокоэффективной жидкостной хроматографией. Собирали фракции продукта и растворитель выпаривали. Остаток растворяли в DCM (20 мл) и промывали водным раствором карбоната натрия,затем органический слой отделяли и растворитель выпаривали с получением 0,160 г промежуточного соединения (20). Пример А.13. а) Получение промежуточного соединения (21). Смесь этилового эфира 4-[5-(1,5-дигидро-5-оксо-4 Н-1,2,4-триазол-4-ил)-2-пиридинил]-1-пиперазинкарбоновой кислоты (0,005 моль), 2-йодпропана (0,0066 моль) и гидроокиси калия (0,0062 моль) в ДМФА (50 мл) перемешивали при 50 С в течение ночи. Смесь охлаждали, выливали в воду и водный слой экстрагировали DCM. Органический слой промывали, высушивали, фильтровали и выпаривали (остаток 1). Реакцию вновь начинали с этилового эфира 4-[5-(1, 5-дигидро-5-оксо-4 Н-1,2,4-триазол-4-ил)-2 пиридинил]-1-пиперазинкарбоновой кислоты (0,0144 моль) и по той же методике с получением остатка(2). Остаток (1) и (2) объединяли и очищали колоночной хроматографией на силикагеле (элюент: смесьCH2Cl2/CH3OH/NH3 99,5/0,5). Собирали очищенные фракции и упаривали. Остаток кристаллизовали из изопропанола с получением 0,5 г промежуточного соединения (21) (т. пл. 157,4 С).b) Получение промежуточного соединения (22). Смесь промежуточного соединения (21) (0,056 моль) в растворе бромисто-водородной кислоты в воде (48%) (250 мл) перемешивали и кипятили с обратным холодильником в течение 5 ч. Смесь упаривали, добавляли лед и DCM к остатку и водный слой подщелачивали концентрированным растворомNH4OH. Органический слой отделяли, высушивали, фильтровали и растворитель выпаривали. Остаток кристаллизовали из DIPE. Осадок отфильтровывали и высушивали с получением 9 г промежуточного соединения (22). Аналогичным способом получали промежуточное соединение (23), начиная с этилового эфира 4-[4(1,5-дигидро-5-оксо-4 Н-1,2,4-триазол-4-ил)фенил]-1-пиперазинкарбоновой кислоты. промежуточного соединения (24). а) Получение Дисперсию гидрида натрия в минеральном масле (60%) (0,011 моль) перемешивали в сухом ДМФА(50 мл). Добавляли этиловый эфир 4-[4-(1,5-дигидро-5-оксо-4 Н-1,2,4-триазол-4-ил)фенил]-1-пиперазинкарбоновой кислоты (0,01 моль) и затем вносили еще дополнительное количество ДМФА для облегчения перемешивания. Добавляли 1-хлор-1-(4-фторфенил)этан (0,015 моль) и реакционную смесь нагревали в течение ночи при 70 С. Органический растворитель выпаривали и концентрат перемешивали в воде, экстрагировали DCM, затем высушивали. Сырое вещество очищали флэш-хроматографией (элюент: этилацетат/гексан 1/2). Собирали фракции продукта и растворитель выпаривали с получением 2,6 г промежуточного соединения (24) (т. пл. 140-141 С).b) Получение промежуточного соединения (25). Смесь промежуточного соединения (24) (0,0056 моль) и гидроокиси калия (0,011 моль) в 2 метоксиэтаноле (20 мл) перемешивали и кипятили с обратным холодильником в течение ночи, затем растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: метанол). Собирали фракции продукта и растворитель выпаривали с получением 1,3 г промежуточного соединения (25) (т. пл. 199-201 С). Пример А.15. промежуточного соединения (26). а) Получение Смесь этилового эфира 1-пиперазинкарбоновой кислоты (0,16 моль), 3-хлор-4-фторнитробензола(0,14 моль) и карбоната натрия (0,2 моль) в ДМФА (200 мл) перемешивали в течение ночи при комнатной температуре. Смесь фильтровали и фильтрат упаривали. Остаток кристаллизовали из DIPE. Осадок отфильтровывали и высушивали с получением 41,8 г промежуточного соединения (26). промежуточного соединения (27).b) Получение Смесь промежуточного соединения (26) (0,13 моль) и триэтиламина (15 г) в метаноле (500 мл) гидрировали в течение ночи при 50 С с использованием палладия на активированном угле (10%, 3 г) в качестве катализатора в присутствии раствора тиофена в метаноле (4%, 3 мл). После поглощения водорода (3 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток растирали с DIPE. Осадок отфильтровывали и высушивали с получением 27,3 г промежуточного соединения (27). с) Получение промежуточного соединения (28). Реакцию проводили в атмосфере N2. Смесь промежуточного соединения (27) (0,096 моль) и этил[(диметиламино)метилен]гидразинкарбоксилата (0,29 моль) в сульфолане (50 мл) перемешивали в течение 1 ч при 180 С, затем охлаждали, выливали в воду, перемешивали в течение 1 ч и декантировали.d) Получение Смесь промежуточного соединения (28) (0,025 моль) и 2-бромпропана (0,050 моль) в ДМФА (50 мл) перемешивали при комнатной температуре и добавляли гидроокись калия (80% раствор) (0,050 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 6 ч, затем охлаждали. Смесь разбавляли водой, воду декантировали и добавляли новую порцию воды. Смесь экстрагировали DCM (4 раза по 100 мл) и экстракты высушивали и концентрировали. Остаточное масло очищали колоночной флэш-хроматографией (элюент: смесь EtOAc/гексан 1/2). Собирали фракции продукта и растворитель выпаривали. Остаток кристаллизовали из диэтилового эфира и собирали полученный осадок с получением 8,63 г промежуточного соединения (29) (т. пл. 108-110 С). промежуточного соединения (30). е) Получение Смесь промежуточного соединения (29) (0,01 моль) и бисульфита натрия (0,009 моль) в бромистоводородной кислоте (48% раствор) (40 мл) перемешивали и кипятили с обратным холодильником в течение 5 ч. Затем реакционную смесь охлаждали и растворитель выпаривали. Остаток растворяли в DCM и нейтрализовали NH4OH. Органический слой отделяли, высушивали, фильтровали и растворитель выпаривали. Остаток кристаллизовали из этилацетата, затем полученный осадок отфильтровывали и высушивали с получением 4,3 г промежуточного соединения (30) (т. пл. 152-153 С). Аналогичным способом получали промежуточное соединение (31), начиная с 1,2-дифтор-4 нитробензола и этил N-пиперазинкарбоксилата. промежуточного соединения (32). а) Получение Фенилхлорформиат (0,33 моль) добавляли по каплям к смеси 4-[1-(фенилметил)-1-пиперазинил]бензоламина (0,3 моль) в DMA (300 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь выливали в воду, затем полученный осадок отфильтровывали и высушивали с получением 118 г промежуточного соединения (32) (т. пл. 160 С).b) Получение промежуточного соединения (33). Смесь промежуточного соединения (32) (0,15 моль) и гидразина гидрата (1:1) (0,62 моль) в 1,4 диоксане (300 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду, осадок отфильтровывали и высушивали с получением 35 г промежуточного соединения (33). промежуточного соединения (34). с) Получение Смесь промежуточного соединения (33) (0,107 моль) и метанимидамида моноацетата (0,55 моль) в 1-бутаноле (300 мл) перемешивали и кипятили с обратным холодильником в течение 4 ч. Смесь охлаждали и продукт кристаллизовали. Осадок отфильтровывали, промывали этилацетатом на фильтре и высушивали с получением 23,5 г промежуточного соединения (34).d) Получение промежуточного соединения (35). Смесь промежуточного соединения (34) (0,178 моль), 2-бромбутана (0,36 моль) и гидроокиси натрия (0,36 моль) в ДМФА (250 мл) перемешивали при 80 С в атмосфере азота в течение ночи. Добавляли гидроокись натрия (3 г) и 2-бромбутан (10 г). Смесь перемешивали при 100 С в течение 2 ч, затем охлаждали и выливали в воду. Осадок отфильтровывали и высушивали. Остаток кристаллизовали из 2 пропанола с получением 40 г промежуточного соединения (35). промежуточного соединения (36). е) Получение Смесь промежуточного соединения (35) (0,03 моль) в метаноле (250 мл) гидрировали при атмосферном давлении с использованием палладия на активированном угле (10%) (3 г) в качестве катализатора. После поглощения водорода (1 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток растворяли в метаноле и превращали в гидрохлорид (1:1) с использованием смеси НСl/2-пропанол. Растворитель выпаривали. Твердый остаток перемешивали в 2-пропаноне, отфильтровывали и высушивали с получением 11,5 г промежуточного соединения (36). Аналогичным способом получали промежуточное соединение (37), начиная с 4-[1-(фенилметил)4 пиперидинил]бензоламина. а) Получение промежуточного соединения (38). Смесь 1-(фенилметил)пиперазина (0,32 моль), 4-фтор-2-метилнитробензола (0,32 моль) и карбоната натрия (1,27 моль) в ДМФА (35 мл) нагревали до 60 С и затем перемешивали в течение ночи. Реакционную смесь выливали в воду. Полученный осадок отфильтровывали и высушивали с получением 78,64 г промежуточного соединения (38).b) Получение промежуточного соединения (39). Смесь промежуточного соединения (38) (0,08 моль) в этаноле (250 мл) гидрировали водородом (50 бар=5,0 МПа) при 40 С в течение 90 мин с использованием палладия на угле (5%, 0,8 г) в качестве катализатора в присутствии раствора тиофена в этаноле (0,6 мл). После поглощения водорода (3 экв.) реакционную смесь фильтровали через дикалит и фильтрат упаривали. Остаток растирали с DCM и затем полученный осадок отфильтровывали с получением 20 г промежуточного соединения (39). с) Получение промежуточного соединения (40). Фениловый эфир карбонохлоридиновой кислоты (0,048 моль) добавляли по каплям при температуре ниже 5 С к суспензии промежуточного соединения (39) (0,048 моль) и карбоната натрия (0,068 моль) вDCM (40 мл) и реакционную смесь перемешивали в течение 3 ч при температуре в пределах от 3 до 5 С. Добавляли воду (60 мл) и слои разделяли. Продукт экстрагировали DCM (2 раза по 140 мл). Органические слои объединяли, промывали водой (125 мл), высушивали и выпаривали. Остаток очищали колоночной хроматографией (элюент: смесь этилацетат/гексан 1/2). Собирали две фракции продукта и растворитель выпаривали с получением 4,42 г промежуточного соединения (40) (т. пл. 106-108 С).d) Получение промежуточного соединения (41). Смесь промежуточного соединения (40) (0,042 моль), N-(2,2-диметоксиэтил)-2-пропанамина (0,063 моль), триэтиламина (0,042 моль) и N,N-диметил-4-пиридинамина (0,042 моль) в 1,4-диоксане (200 мл) перемешивали и кипятили с обратным холодильником в течение 2 ч. Реакционную смесь выдерживали в течение ночи. Добавляли воду (200 мл) и смесь перемешивали в течение 1 ч с последующей экстракциейDCM (3 раза по 100 мл). Органические слои объединяли, промывали водой (200 мл), высушивали и упаривали. Добавляли муравьиную кислоту (25 мл) и полученную смесь перемешивали и кипятили с обратным холодильником в течение 2 ч, затем выпаривали и экстрагировали из водного раствора NaHCO3 (300 мл) DCM (3 раза по 80 мл). Экстракты объединяли, высушивали и упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат). Собирали две фракции продукта и растворитель выпаривали с получением 7,97 г промежуточного соединения (41) (т. пл. 135-137 С). е) Получение промежуточного соединения (42). Смесь промежуточного соединения (41) (0,0072 моль) в уксусной кислоте (40 мл) гидрировали в те- 19009455 чение 6 ч под давлением 10 бар (1,0 МПа) с использованием палладия на угле (10%, 0,4 г) в качестве катализатора. После поглощения водорода реакционную смесь фильтровали через целит. Слой целита промывали этанолом и фильтрат упаривали. Остаток экстрагировали из NaOH (2 н. раствор, 70 мл) DCM (2 раза по 75 мл). Затем экстракты объединяли, высушивали и упаривали. Остаток очищали колоночной хроматографией (элюент: смесь CH2Cl2/CH3OH 99/1). Собирали две фракции продукта и растворитель выпаривали. Обе фракции полностью дебензилировали (но только частично восстанавливали) и объединяли с получением остатка (I). Остаток (I) подвергали второй раз той же реакции с получением 0,81 г промежуточного соединения (42). Пример А.18. Получение промежуточного соединения (43). Смесь 1-хлорэтилхлорформиата (0,017 моль) в сухом дихлорметане (10 мл) добавляли по каплям к перемешиваемому раствору промежуточного соединения (41) (0,013 моль) в сухом DCM (50 мл) при 0 С. Реакционную смесь перемешивали в течение 24 ч и упаривали. К остатку добавляли метанол (75 мл) и смесь перемешивали и кипятили с обратным холодильником в течение 1 ч. Смесь упаривали, добавляли диэтиловый эфир (80 мл) и отфильтровывали твердые мелкие частицы с получением 4,53 г промежуточного соединения (43) (т. пл. 232-234 С). Пример А.19. промежуточного соединения (44). а) Получение Метил 2-[(диметиламино)метилен]гидразинкарбоксилат добавляли к перемешиваемому раствору промежуточного соединения (39) (0,025 моль) в 1,3-диметил-2-имидазолидиноне (15 мл) при 160 С. Реакционную смесь выдерживали при 160 С в течение 1 ч (некоторое количество СН 3 ОН выпаривалось). Добавляли остальную часть метил 2-[(диметиламино)метилен]гидразинкарбоксилата (сколько понадобится) и смесь выдерживали при 160 С. Полученную смесь охлаждали до комнатной температуры и экстрагировали из воды (100 мл) диэтиловым эфиром (3 раза по 150 мл). Слой диэтилового эфира выпаривали досуха и остаток фильтровали, затем промывали диэтиловым эфиром (2 раза по 50 мл) с получением 3,56 г промежуточного соединения (44) (т. пл. 124,5-126,5 С).b) Получение промежуточного соединения (45). Смесь промежуточного соединения (44) (0,010 моль), 2-бромпропана (0,020 моль) и гидроокиси калия (0,012 моль) в ДМФА (25 мл) перемешивали в течение 42 ч при комнатной температуре и затем добавляли воду (200 мл). Полученные твердые частицы отфильтровывали и промывали водой (3 раза по 60 мл) с получением 3,39 г промежуточного соединения (45) (т. пл. 145,5-146,5 С). с) Получение промежуточного соединения (46). Смесь 1-хлорэтилхлорформиата (0,011 моль) в дихлорметане (10 мл) добавляли по каплям к перемешиваемому раствору промежуточного соединения (45) (0,0082 моль) в DCM (30 мл, сухой) при 0 С,затем реакционную смесь перемешивали при 0 С в течение 2 ч и выпаривали. Добавляли метанол (50 мл) и полученную смесь перемешивали и кипятили с обратным холодильником в течение 1 ч. Смесь упаривали и растирали с эфиром. Остаток растворяли в метаноле (50 мл) и раствор экстрагировали из насыщенного раствора NaHCO3 DCM (3 раза по 100 мл). Экстракты объединяли, высушивали и упаривали. Остаток очищали колоночной хроматографией (элюент: смесь CH2Cl2/CH3OH 9/1). Собирали фракции продукта и растворитель выпаривали с получением 1,6 г промежуточного соединения (46) (т. пл. 140142 С). Пример А.20. а) Получение промежуточного соединения (47). Смесь промежуточного соединения (74) (0,073 моль), N-(2,2-диметсксиэтил)-2-пропанамина (0,116 моль), N,N-диметил-4-пиридинамина (0,073 моль) и триэтиламина (0,073 моль) в 1,4-диоксане (360 мл) перемешивали и кипятили с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры. Добавляли воду (360 мл). Смесь перемешивали в течение 15 мин и экстрагировали DCM (3 раза по 200 мл). Органические экстракты объединяли, высушивали и упаривали. Остаток перемешивали и кипятили с обратным холодильником в муравьиной кислоте (290 мл) в течение 2 ч, затем смесь охлаждали и растворитель выпаривали с получением 67 г продукта. Полученный остаток рас- 20009455 творяли в DCM, промывали насыщенным раствором NaHCO3, высушивали и выпаривали. Данный остаток промывали NaHCO3 и очищали колоночной флэш-хроматографией с получением промежуточного соединения (47). промежуточного соединения (48).b) Получение Смесь 1-хлорэтилхлорформиата (0,0034 6 моль) в сухом DCM (3 мл) добавляли по каплям к перемешиваемому раствору промежуточного соединения (47) (0,00266 моль) в сухом DCM (10 мл) при 0 С. Реакционную смесь перемешивали в течение 1 ч при 0 С. Растворитель выпаривали и остаток растворяли в метаноле (20 мл). Раствор перемешивали и кипятили с обратным холодильником в течение 1 ч, затем смесь охлаждали до комнатной температуры и растворитель выпарили. Остаток растирали с диэтиловым эфиром (20 мл) и собирали полученный продукт с получением 0,55 г промежуточного соединения(48) (т. пл. 196-198 С). Пример А.21. промежуточного соединения (49). Получение Смесь промежуточного соединения (47) (0,053 моль) в уксусной кислоте (200 мл) гидрировали в течение 6 ч при 30 С в атмосфере водорода (2 бар=0,2 МПа) с использованием палладия на угле (10%, 2 г) в качестве катализатора, затем реакционную смесь нагревали в атмосфере водорода при 30 С еще в течение 7 ч и перемешивали в течение ночи при комнатной температуре. После поглощения водорода (2 экв.) смесь фильтровали через целит и упаривали. Остаток экстрагировали из NaOH (2 н. раствор, 200 мл)DCM (2 раза по 250 мл), затем экстракты объединяли, высушивали и выпаривали с получением 14,4 г промежуточного соединения (49) (т. пл. 159-161 С). Пример А.22. а) Получение промежуточного соединения (50). Смесь этилового эфира 4-[4-(1,5-дигидро-3-метил-5-оксо-4 Н-1,2,4-триазол-4-ил)фенил]-1 пиперазинкарбоновой кислоты (0,0078 моль), 2-бромпропана (0,023 моль) и карбоната натрия (0,023 моль) в ДМФА (250 мл) перемешивали при 80 С в течение ночи. Добавляли гидроокись калия (1,4 г). Смесь перемешивали в течение 5 мин. Вновь добавляли 2-бромпропан (0,023 моль). Смесь перемешивали при 80 С в течение ночи. Растворитель выпаривали. Остаток растворяли в DCM, промывали водой,высушивали, фильтровали и растворитель выпаривали. К остатку добавляли гидроокись калия (1,4 г), 2 бромпропан (3 г) и ДМФА (250 мл). Смесь перемешивали при 80 С в течение 5 ч. Растворитель выпаривали. Остаток растворяли в DCM, промывали, высушивали, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: смесь СН 2Cl2/СН 3 ОН 99/1). Собирали очищенные фракции и растворитель выпаривали с получением 2,1 г промежуточного соединенияb) Получение промежуточного соединения (51). Смесь промежуточного соединения (50) (0,0053 моль) и гидроокиси калия (3 г) в 2-пропаноле (50 мл) перемешивали и кипятили с обратным холодильником в течение ночи, перемешивали при комнатной температуре в течение выходных дней и затем кипятили с обратным холодильником в течение ночи. Растворитель выпаривали. Остаток растворяли в DCM, промывали, высушивали, фильтровали и растворитель выпаривали с получением 1,6 г промежуточного соединения (51). Пример А.23. промежуточного соединения (52). а) Получение Смесь этилового эфира 4-[4-(1,5-дигидро-5-оксо-4 Н-1,2,4-триазол-4-ил)фенил]-1-пиперазинкарбоновой кислоты (0,016 моль), диметилсульфата (0,02 моль) и гидроокиси калия (0,02 моль) в ДМФА[100 мл) перемешивали при комнатной температуре в течение 2 ч. Смесь фильтровали, фильтрат выливали в воду (400 мл), кристаллизовали и перемешивали в течение 10 мин. Осадок отфильтровывали, растворяли в DCM и очищали колоночной хроматографией на силикагеле (элюент: смесь СН 2Cl2/CH3OH 99/1). Собирали очищенные фракции и упаривали. Остаток кристаллизовали из этилацетата с получением 2,5 г промежуточного соединения (52) (т. пл. 169,7 С).b) Получение промежуточного соединения (53). Смесь промежуточного соединения (52) (0,076 моль) в смеси бромисто-водородной кислоты в воде(48% раствор) (250 мл) перемешивали и кипятили с обратным холодильником в течение 5 ч. Растворитель выпаривали. Добавляли лед и DCM. Смесь подщелачивали концентрированным раствором NH4OH и разделяли на слои. Органический слой высушивали, фильтровали и растворитель выпаривали. Остаток кристаллизовали из DIPE. Осадок отфильтровывали и высушивали с получением 18 г промежуточного соединения (53). Пример А.24. промежуточного соединения (54). Получение(+)-(R)метилбензолметанамин (0,1 моль) перемешивали в ТГФ (200 мл) при комнатной температуре, затем добавляли диметоксиацетальдегид (0,2 моль), 45% раствор в 2-метокси-2-метилпропане с последующим добавлением изопропилата титана(IV) (0,11 моль). Смесь подвергали взаимодействию в течение 2 ч при комнатной температуре и добавляли метанол (80 мл), затем добавляли порциями тетрагидроборат натрия (0,2 моль) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Добавляли воду (80 мл) и затем полученный осадок отфильтровывали через дикалит и промывали 3 раза ТГФ. Фильтрат упаривали до удаления ТГФ и метанола и остаток экстрагировали DCM. Отделяли органический слой, высушивали, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: смесь CH2Cl2/CH3OH 100/0, 98/2). Собирали фракции продукта и растворитель выпаривали с получением 17 г промежуточного соединения (54). Пример А.25. Получение промежуточного соединения (55).Mn-триацетоксиборогидридный полимер (полистирол-связанный-CH2-N+Et3-B-H(Оас)3 полимер производства Argonaut (New Road, Hengoed, Mid Glamorgan CF82 8AU, Великобритания), продукт под кодом 800414) (0,500 г) добавляли к раствору (R)метил-4-(трифторметил)бензолметанамина (0,00082 моль) и диметоксиацетальдегида (0,0010 моль) в ТГФ (5 мл) и реакционную смесь встряхивали в течение 30 мин при 100 С, затем смесь охлаждали до комнатной температуры и встряхивали в течение 24 ч при комнатной температуре. Добавляли дополнительное количество диметоксиацетальдегида (0,0010 моль) и дополнительное количество триацетоксиборогидридного полимера Argonaut 800414 (0,250 г) и полученную смесь встряхивали в течение 24 ч при комнатной температуре. Добавляли силикагель с функциональной 2-(4-толуолсульфонилгидразино)этильной группой (производства Sigma-Aldrich Corporation с кодом Aldrich 55,259-3) (0,200 г, 1 ммоль/г) и затем добавляли 4-бензилоксибензальдегидполистироловый полимер Novabiochem 01-64-0182 (0,300 г). Реакционную смесь встряхивали в течение 24 ч и добавляли Novabiochem 01-64-0182 (0,300 г). Смесь встряхивали в течение 24 ч, фильтровали,промывали DCM (5 мл) и фильтрат упаривали с получением 0,181 г промежуточного соединения (55). Пример А.26. Получение промежуточного соединения (56). Смесь (R)-этил(гидрокси)(фенил)ацетата (0,139 моль), 1,2-лутидина (21 г) и N,N-диметил-4 пиридинамина (1 г) перемешивали в DCM (200 мл) и смесь охлаждали на ледяной бане, затем добавляли по каплям смесь 4-хлорбензолсульфонилхлорида (0,153 моль) в DCM (50 мл) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли триэтиламин (сколько понадобится)(экзотермическая реакция) и смесь перемешивали в течение 2 ч при комнатной температуре. Полученную смесь промывали разбавленной HCl, высушивали и растворитель выпаривали. Остаток дополнительно кристаллизовали из гексана с небольшим количеством DIPE и собирали полученный осадок с получением 20,1 г промежуточного соединения (56) (т. пл. 46,3-48,8 С). Пример А.27. Получение промежуточного соединения (57). Тионилхлорид (1 моль) добавляли к смеси дигидро-3-фенил-2(3H)-фуранона (0,4 моль) и хлорида цинка (5 г) и затем реакционную смесь перемешивали и кипятили с обратным холодильником в течение ночи. Полимеризованный продукт растворяли в CHCl3 и растворитель выпаривали. Остаток выпаривали и собирали продукт с получением 7 г 4-хлор-2-фенилбутирилхлорида. Полученный 4-хлор-2 фенилбутирилхлорид добавляли по каплям при температуре ниже 10 С к раствору дипропиламина (1 моль) в DCM (500 мл) и реакционную смесь перемешивали в течение ночи. Смесь промывали водой, вы- 22009455 сушивали и растворитель выпаривали с получением 75 г промежуточного соединения (57). Пример А.28. промежуточного соединения (58). Получение Триэтиламин (0,040 моль) и хлорфенилацетилхлорид (0,0333 моль) добавляли по каплям при перемешивании к смеси этилового эфира 2-аминобензойной кислоты (0,0333 моль) в ТГФ (50 мл) и реакционную смесь перемешивали в течение 15 мин, затем органический растворитель удаляли и остаток переводили в смесь CH2Cl2/H2O (25/50). Органический слой отделяли и водный слой экстрагировали DCM(0,024 моль) и карбоната натрия (0,036 моль) в сухом ДМФА (25 мл) перемешивали в течение ночи при комнатной температуре и затем органический растворитель (ДМФА) выпаривали. Остаток перемешивали в воде и экстрагировали DCM. Органический слой отделяли и высушивали, затем растворитель выпаривали и остаток перемешивали в гексане. Наконец, собирали желаемый продукт с получением промежуточного соединения (59) (т. пл. 101-104 С).b) Получение Смесь промежуточного соединения (59) (0,01 моль) в циклогексене (5 мл) и этаноле (25 мл) гидрировали в течение 36 ч с использованием палладия на угле (10%, 0,12 г) в качестве катализатора. После поглощения водорода (3 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток очищали колоночной флэш-хроматографией (элюент: смесь этилацетат/гексан 1/4, 1/1). Собирали фракции продукта и растворитель выпаривали с получением промежуточного соединения (60). Пример А.30. а) Получение промежуточного соединения (61) и промежуточного соединения (62). Промежуточное соединение (60) (0,088 моль) отделяли и очищали хиральной высокоэффективной жидкостной хроматографией (колонка Prochrom D.A.C.; 500 г Chiralcel OJ 20 мкм; элюент: этанол (изократический режим. Собирали две фракции продукта и после выпаривания растворителя превращали его в аддитивную соль гидрохлорид (1:2) с использованием смеси HCl/2-пропанола с получением 13,7 г промежуточного соединения (61) (т. пл. 214,5-214,6 С;b) Получение промежуточного соединения (63). 4-Нитрофенилхлорформиат перемешивали в DCM (100 мл) и смесь охлаждали на бане со льдом и солью. Затем добавляли промежуточное соединение (61) с последующим добавлением насыщенного раствора бикарбоната натрия (100 мл). Реакционную смесь перемешивали и охлаждали в течение 1 ч, затем перемешивали в течение 1 ч при комнатной температуре. Органический слой отделяли, высушивали и растворитель выпаривали. Остаток растирали со смесью диэтиловый эфир/DIPE (50/50), фильтровали и собирали желаемый продукт с получением 1,76 г промежуточного соединения (63). Аналогичным способом получали промежуточное соединение (64), начиная с промежуточного соединения (62). промежуточного соединения (65). а) Получение Смесь промежуточного соединения (40) (0,029 моль), (R)-N-(2,2-диметоксиэтил)бензолметанамина(0,029 моль) и N,N-диметил-4-пиридинамина (0,029 моль) в диоксане перемешивали и кипятили с обратным холодильником в течение 24 ч, затем реакционную смесь охлаждали, выливали в воду и экстрагировали DCM. Экстракт промывали водой и растворитель выпаривали. Маслянистый остаток обрабатывали смесью трифторуксусной кислоты и метанола (1:1) и нагревали при 60 С в течение 4 ч, затем полученную смесь охлаждали и фильтровали. Остаток переводили в DCM, промывали водой и карбонатом натрия, и высушивали с получением промежуточного соединения (65).b) Получение промежуточного соединения (66). Раствор промежуточного соединения (65) (0,015 моль) в сухом DCM перемешивали при 0 С и добавляли по каплям смесь 1-хлорэтилхлорформиата (0,0195 моль) в DCM, затем реакционную смесь перемешивали при 0 С в течение 1 ч и растворитель выпаривали. Остаток растворяли в метаноле (140 мл) и полученный раствор нагревали при температуре кипения в течение 1 ч. Смесь охлаждали до комнатной температуры и выпаривали досуха, затем остаток растирали с эфиром и собирали полученный продукт с получением промежуточного соединения (66). Пример А.32. а) Получение промежуточного соединения (67). Фенилхлорформиат (0,33 моль) добавляли по каплям к охлажденной на льду смеси 4-[1(фенилметил)-4-пиперидинил]бензоламина (0,33 моль) в DMA (500 мл) и смесь перемешивали в течение 1 ч. Смесь выливали в воду, осадок отфильтровывали и высушивали с получением 128 г промежуточного соединения (67).b) Получение промежуточного соединения (68). Смесь промежуточного соединения (67) (0,33 моль) и гидразина моногидрата (1,6 моль) в 1,4 диоксане (1 л) перемешивали при комнатной температуре в течение 48 ч и затем при 60 С в течение ночи. Смесь выливали в воду. Осадок отфильтровывали и кристаллизовали из 1-бутанола с получением 61 г промежуточного соединения (68). промежуточного соединения (69). с) Получение Смесь промежуточного соединения (68) (0,12 моль) и метанимидамида моноацетата (0,5 моль) в 1 бутаноле (250 мл) перемешивали и кипятили с обратным холодильником в течение 48 ч. Смесь охлаждали, добавляли DIPE и кристаллизовали. Осадок отфильтровывали и высушивали. Остаток очищали колоночной хроматографией на силикагеле (элюент: смесь CH2Cl2/CH3OH 98/2). Собирали очищенные фракции и упаривали. Остаток растирали с DIPE с получением 18,7 г промежуточного соединения (69). промежуточного соединения (71). Промежуточное соединение (69) (0,04 моль) перемешивали в ДМФА (200 мл) при комнатной температуре и затем добавляли гидрид натрия (60%) (0,04 моль) и смесь перемешивали в течение 1 ч при комнатной температуре. Смесь нагревали при 70 С и через 30 мин добавляли 1-(1-хлорэтил)-2 фторбензол (0,062 моль). Реакционную смесь перемешивали в течение 20 ч при 70 С и затем добавляли воду (500 мл) и DIPE (50 мл). Полученную смесь перемешивали в течение 1 ч при комнатной температуре и продукт отфильтровывали, затем очищали жидкостной хроматографией на силикагеле (элюент: смесь CH2Cl2/CH3OH 99/1). Собирали фракции продукта и растворитель выпаривали с получением 13 г продукта, который разделяли на его энантиомеры жидкостной хроматографией на хиральной AD- 24009455 колонке (элюент: смесь CH3OH/CH3CN 65/35). Собирали две фракции продукта и растворитель выпаривали. Каждый остаток растирали с DIPE и желаемые продукты отфильтровывали с получением 5,1 г промежуточного соединения (70) и 5,1 г промежуточного соединения (71). е) Получение промежуточного соединения (72). Смесь промежуточного соединения (70) (0,011 моль) в метаноле (100 мл) гидрировали при комнатной температуре в течение 24 ч с использованием палладия на угле (1 г) в качестве катализатора. Добавляли дополнительное количество водорода и палладия на угле (10%) (каталитическое количество) и смесь дополнительно гидрировали в течение 24 ч. После поглощения водорода (1 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток растирали с DIPE и желаемый продукт отфильтровывали с получением 3,3 г промежуточного соединения (72). Аналогичным способом получали промежуточное соединение (73), начиная с промежуточного соединения (71). а) Получение промежуточного соединения (74). Фенилхлорформиат (0,33 моль) добавляли по каплям к смеси 4-[4-(фенилметил)-1 пиперазинил]бензоламина (0,3 моль) в DMA (300 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь выливали в воду, затем полученный осадок отфильтровывали и высушивали с получением 118 г промежуточного соединения (74) (т. пл. 160,0 С).b) Получение промежуточного соединения (75). Смесь промежуточного соединения (74) (0,15 моль) и гидразина моногидрата (0,62 моль) в 1,4 диоксане (300 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду, осадок отфильтровывали и высушивали с получением 35 г промежуточного соединения (75). с) Получение промежуточного соединения (76). Смесь промежуточного соединения (75) (0,107 моль) и метанимидамида моноацетата (0,55 моль) в 1-бутаноле (300 мл) перемешивали и кипятили с обратным холодильником в течение 4 ч. Смесь охлаждали и продукт кристаллизовали. Осадок отфильтровывали, промывали этилацетатом на фильтре и высушивали с получением 23,5 г промежуточного соединения (76).d) Получение промежуточного соединения (77). Промежуточное соединение (76) (0,30 моль) и 1-(1-хлорэтил)-2-фторбензола (0,38 моль) добавляли к раствору гидроокиси калия (0,38 моль) в ДМФА (500 мл) и затем реакционную смесь перемешивали в течение 6 ч при 60 С и охлаждали. Смесь выливали в воду и экстрагировали DCM. Органический слой отделяли, высушивали и фильтровали на фильтре Bchi. Фильтрат упаривали и остаток очищали колоночной хроматографией на силикагеле. Собирали фракции продукта и растворитель выпаривали с получением 3 г промежуточного соединения (77). е) Получение промежуточного соединения (78). Раствор промежуточного соединения (77) (0,06 моль) в DCM перемешивали при 0 С и затем добавляли по каплям смесь 1-хлорэтилхлорформиата (0,077 моль) в DCM. Реакционную смесь перемешивали в течение 1 ч при 0 С и добавляли дополнительное количество 1-хлорэтилхлорформиата (2 мл). Смесь перемешивали в течение ночи и вновь добавляли дополнительное количество 1-хлорэтилхлорформиата (2- 25009455 мл). Полученную смесь перемешивали в течение 48 ч при комнатной температуре и концентрировали,затем полученный остаток растворяли в метаноле (540 мл). Раствор перемешивали и кипятили с обратным холодильником в течение 1 ч, затем охлаждали до комнатной температуры и выпаривали. Остаток растирали с диэтиловым эфиром и собирали желаемый продукт с получением 21 г промежуточного соединения (78) (т. пл. 190-192 С). Пример А.34. промежуточного соединения (79). а) Получение Промежуточное соединение (44) (0,039 моль) и 1-хлор-1-фенилэтан (0,049 моль) добавляли к раствору гидроокиси калия (2,7 г) в ДМФА (100 мл) и затем реакционную смесь перемешивали в течение ночи при 60 С. Смесь выливали в воду и фильтровали. Продукт экстрагировали DCM, высушивали и фильтровали на фильтре Bchi. Остаток на фильтре очищали колоночной хроматографией (элюент: смесь гексан/этилацетат 90/1060/40. Собирали фракции продукта и растворитель выпаривали с получением 7,5 г промежуточного соединения (79) (т. пл. 80-82 С).b) Получение промежуточного соединения (80). Смесь 1-хлорэтилхлорформиата (0,022 моль) в DCM добавляли по каплям к смеси промежуточного соединения (79) (0,017 моль) в DCM при 0 С и затем реакционную смесь перемешивали в течение 1 ч при 0 С. Растворитель выпаривали и полученный продукт растворяли в метаноле (150 мл). Раствор перемешивали и кипятили с обратным холодильником в течение 1 ч, затем охлаждали до комнатной температуры и упаривали. Сухой остаток перемешивали в эфире, фильтровали и высушивали с получением промежуточного соединения (80). Пример А.35.a) Получение промежуточного соединения (81). Смесь -фенил-4-пиперидинацетонитрила моногидрохлорида (0,038 моль) в бромисто-водородной кислоте (100 мл) перемешивали и кипятили с обратным холодильником в течение 5 ч. Растворитель выпаривали. К остатку дважды добавляли 2-пропанол и растворитель выпаривали. Остаток растирали с 2 пропанолом и DIPE. Осадок отфильтровывали и высушивали с получением 8,6 г промежуточного соединения (81), выделенного в виде гидробромида.b) Получение промежуточного соединения (82). Диоксан (150 мл) добавляли к раствору промежуточного соединения (81) (0,028 моль) и карбоната натрия (0,06 моль) в воде (100 мл). Смесь охлаждали на льду. Добавляли 9-флуоренилметилхлорформиат(0,03 моль). Смесь охлаждали до комнатной температуры и затем перемешивали в течение 2 ч. Добавляли воду (500 мл). Смесь экстрагировали 3 раза DIPE (200 мл). Водный слой подкисляли 1 н. растворомHCl и экстрагировали DCM. Объединенный органический слой высушивали, фильтровали и растворитель выпаривали. Остаток растирали с DIPE. Осадок отфильтровывали и высушивали на воздухе с получением 5,2 г промежуточного соединения (82). Пример А.36. а) Получение промежуточного соединения (83). Смесь 1-(4-нитрофенил)фенил-4-пиперидинуксусной кислоты (0,01469 моль) и концентрированной серной кислоты (каталитическое количество) в этаноле (сухой, 50 мл) нагревали при температуре кипения в течение 4 5 ч и реакционной смеси давали охладиться. Собирали полученный осадок и растворяли в хлороформе, к которому добавляли водный раствор NaHCO3. Органический слой отделяли, высушивали, фильтровали и растворитель выпаривали. Остаточное масло растирали с гексаном с получением 1,92 г промежуточного соединения (83) (т. пл. 93-97 С).b) Получение Смесь промежуточного соединения (83) (0,1 моль) в метаноле (400 мл) гидрировали при 50 С в течение 18 ч с использованием палладия на угле (10%, 0,6 г) в качестве катализатора. После поглощения водорода (3 экв.) катализатор отфильтровывали на целите и слой целита промывали метанолом (50 мл). Фильтрат упаривали и затем упаривали вместе с толуолом (15 мл). Остаток затвердевал при комнатной температуре через двое суток с получением промежуточного соединения (84) (т. пл. 20,5-21,5 С). Пример А.37. а) Получение промежуточного соединения (85). Смесь 4-(4-нитрофенил)пиперидина (0,1455 моль), этилового эфира -бромбензолуксусной кислоты (0,1455 моль) и Na2CO3 (15,4 г) в ДМФА (220 мл) перемешивали в течение ночи, затем реакционную смесь выливали в холодную воду (500 мл) и три раза экстрагировали эфиром. Органические слои объединяли, промывали насыщенным раствором соли, высушивали и растворитель выпаривали. Остаточное масло растирали с этанолом и суспензию выдерживали в течение ночи при 5 С. Полученное твердое вещество отфильтровывали и высушивали с получением промежуточного соединения (72-а). Фильтрат упаривали и остаточное масло очищали колоночной хроматографией на силикагеле (элюент: смесь этилацетат/гексан 50:50). Собирали фракции продукта и растворитель выпаривали. Маслянистый остаток затвердевал при комнатной температуре, и его растирали с небольшим количеством этанола, отфильтровали и высушивали с получением дополнительных 9 г промежуточного соединения (85) (т. пл. 102104 С).b) Получение промежуточного соединения (86). Смесь промежуточного соединения (85) (0,0841 моль) в ТГФ (сухой, 300 мл) гидрировали в автоклаве под давлением 40 бар с использованием палладия на угле (10%, 3 г) в качестве катализатора. После поглощения водорода (3 экв.) реакционную смесь фильтровали, и твердое вещество промывали ТГФ (300 мл). Растворитель фильтратов выпаривали и сырой остаток перемешивали в эфире (300 мл), затем фильтровали и промывали эфиром (100 мл). Собирали желаемый продукт и высушивали с получением 22 г промежуточного соединения (86) (т. пл. 132-135 С). Пример А.38. Получение промежуточного соединения (87). Суспензию промежуточного соединения (84) (0,0030 моль) и карбоната калия (0,580 г) в DCM (15 мл) перемешивали и охлаждали, затем добавляли по каплям фенилхлорформиат (0,0030 моль) и реакционную смесь перемешивали в течение ночи. Органический слой отделяли и промывали водой (310 мл),затем высушивали и концентрировали с получением 1,22 г промежуточного соединения (87). Аналогичным способом получали промежуточное соединение (88), начиная с промежуточного соединения (86). промежуточное соединение (88) Пример А.39. промежуточного соединения (89). а) Получение Смесь метилового эфира 4-пиперидинуксусной кислоты гидрохлорида (0,019 моль), 1-фтор-4 нитробензола (0,022 моль) и карбоната натрия (0,044 моль) в ДМФА (100 мл) перемешивали при комнатной температуре в течение 20 ч, затем добавляли воду и DIPE и реакционную смесь перемешивали в течение 1 ч. Продукт отфильтровывали, промывали водой и DIPE и, наконец, высушивали с получением 2,1 г промежуточного соединения (89).b) Получение Смесь промежуточного соединения (89) (0,0075 моль) в ТГФ (50 мл) гидрировали при комнатной температуре с использованием палладия на угле (0,5 г) в качестве катализатора в присутствии раствора тиофена (0,5 мл). После поглощения водорода (3 экв.) катализатор отфильтровывали и к фильтрату добавляли смесь 2-пропанол/HCl (3 мл). Добавляли этанол и DCM, и полученный раствор упаривали. Остаток растирали со смесью этанол/DIPE (50/50), затем желаемый продукт отфильтровывали и высушивали с получением 1,8 г промежуточного соединения (90), выделенного в виде гидрохлорида. промежуточного соединения (91). с) Получение Фенилхлорформиат (0,006 моль) перемешивали в DCM (100 мл) при комнатной температуре и добавляли промежуточное соединение (90) (0,0056 моль) с последующим добавлением бикарбоната натрия(50 мл). Реакционную смесь перемешивали в течение 4 ч и слои разделяли, затем органический слой высушивали и растворитель выпаривали. Остаток растирали с DIPE и желаемый продукт отфильтровывали с получением 2,06 г промежуточного соединения (91).d) Получение промежуточного соединения (92). Смесь промежуточного соединения (91) (0,00027 моль), -N-(2,2-диметоксиэтил)метилбензолметанамина (0,0005 моль) и N,N-диметил-4-пиридинамина (0,00027 моль) встряхивали и нагревали в течение выходных дней при 96 С, и растворитель выпаривали в атмосфере азота. Добавляли DCM (5 мл) с последующим добавлением метилизоцианат-полистиролового полимера Novabiochem 01-64-0169(0,200 г), и реакционную смесь встряхивали в течение 4 ч, фильтровали и растворитель выпаривали с получением промежуточного соединения (92). Пример А.40. Получение промежуточного соединения (93). Смесь соединения (36) (0,02 моль) в соляной кислоте (36%, 50 мл) перемешивали и кипятили с обратным холодильником в течение 4 ч и затем перемешивали при комнатной температуре в течение ночи. Осадок отфильтровывали. Остаток растирали с DIPE. Осадок отфильтровывали и высушивали с получением 5,5 г промежуточного соединения (93), выделенного в виде гидрохлорида. Аналогичным способом получали промежуточное соединение (94) - промежуточное соединение Получение промежуточного соединения (130). Смесь 2-(3,5-диметокси-4-формилфенокси)этоксиметил-полистиролового полимера Novabiochem 01-64-0261 (0,00244 г), 2,3-дигидро-1 Н-инден-5-амина (0,0116 моль) и изопропилата титана (IV) (0,0116 моль) в DCM (70 мл) встряхивали в течение 1 ч при комнатной температуре, затем добавлялиNaBH(OAc)3 (0,0116 моль) и реакционную смесь встряхивали в течение выходных дней при комнатной температуре. Смесь фильтровали и продукт промывали 3[3 раза метанолом и 3 раза DCM] с получением промежуточного соединения (130). Пример А.42. промежуточного соединения (131). Получение Тионилхлорид (0,0027 моль) добавляли к смеси промежуточного соединения (130) (0,000175 моль) в DCM (1 мл) и полученную смесь доводили до температуры кипения, затем смесь высушивали продуванием азота при 50 С. Добавляли дополнительное количество DCM (2 раза по 1 мл), и смесь снова высушивали продуванием, и полученный остаток растворяли в DCM (1 мл) и добавляли к смеси промежуточного соединения (82) (0,000039 моль) и 2,6-лутидина (0,00035 моль) в DCM (1 мл). Реакционную смесь встряхивали в течение 20 ч при комнатной температуре и фильтровали. Остаток промывали 3[3 разаDCM и 3 раза метанолом] и вновь 3 раза DCM, затем один раз ДМФА. Добавляли 20% смесь пиперидина в ДМФА (4 мл) и смесь встряхивали в течение 2,5 ч, затем продукт отфильтровывали и промывали 3[3 раза DCM и 3 раза метанолом] с получением промежуточного соединения (131). Аналогичным способом получали промежуточное соединение (132) и промежуточное соединение(133) взаимодействием промежуточного соединения (130) с эфиром 1-[(9 Н-флуорен-9-илметокси)карбонил]-4-пиперидинуксусной кислоты или 1-(9 Н-флуорен-9-илметил)-1,4-пиперидиндикарбоновой кислоты. Пример А.43. промежуточного соединения (134). Получение Смесь 2-бром-1,1-диэтоксиэтана (0,0012 моль) в сухом DCM (1 мл) добавляли к смеси -1 глицерол-полистиролового полимера Novabiochem 01-64-0408 (0,00012 моль) в сухом DCM (2 мл), затем добавляли смесь D,L-10-камфорсульфоновой кислоты (0,00012 моль) в сухом DCM (1 мл) и реакционную смесь встряхивали в течение 20 ч при комнатной температуре. Желаемый продукт отфильтровывали, промывали 2[3 раза DCM и 3 раза ДМФА] и, наконец, вновь 6 раз DCM с получением промежуточного соединения (134).
МПК / Метки
МПК: C07D 249/08, A61P 19/00, C07D 401/04, C07D 413/12, C07D 417/10, C07D 233/54, C07D 401/10, C07D 403/10
Метки: 5-членными, ингибирующие, гетероциклами, арилпиперидины, замещенные, пиперазины
Код ссылки
<a href="https://eas.patents.su/30-9455-ingibiruyushhie-mtp-arilpiperidiny-ili-piperaziny-zameshhennye-5-chlennymi-geterociklami.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибирующие mtp арилпиперидины или пиперазины, замещенные 5-членными гетероциклами</a>












