Гетероциклические, тетрациклические производные гидрофурана в качестве ингибиторов 5нт2 в терапии расстройств цнс
Номер патента: 13595
Опубликовано: 30.06.2010
Авторы: Мегенс Антониус Адрианус Хендрикус Петрус, Сид-Нуньес Хосе Мария, Трабанко-Суарес Андрес Авелино
Формула / Реферат
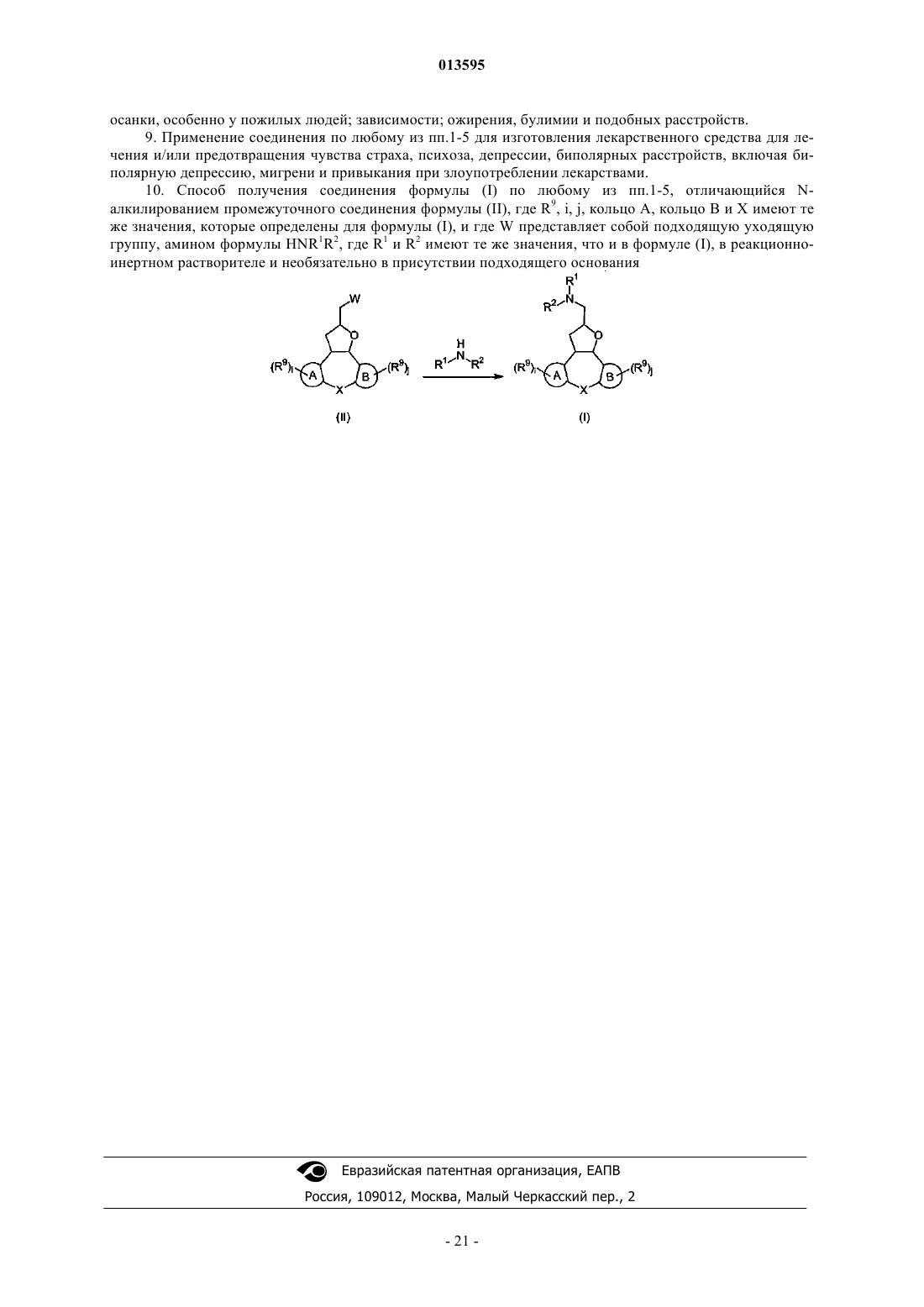
1. Соединение формулы (I)
его N-оксидная форма, фармацевтически приемлемая аддитивная соль или его стереохимически изомерная форма, где
n представляет собой целое число, равное 1;
i, j представляют собой целые числа, независимо друг от друга равные 0 или 1;
r равно 0;
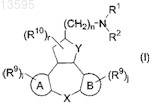
каждый из R1 и R2независимо друг от друга представляет собой водород или алкил, или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, могут образовывать радикал следующей формулы:
где р представляет собой целое число, равное 0 или 1;
q представляет собой целое число, равное 1;
m представляет собой целое число, равное 1 или 2;
каждый R3независимо друг от друга выбран из группы гидрокси, алкила, моно- или диалкиламино, или
два R3-радикала могут образовывать вместе двухвалентный радикал
-O-CR5R5-CR5R5-O- (b-3)
где R5представляет собой водород;
R4 представляет собой алкил;
А и В представляют собой, каждый независимо друг от друга, радикал арила или гетероарила, конденсированный с центральным кольцом и выбранный из группы тиенила и пиридинила, при условии, что по меньшей мере один из А и В является одним из вышеперечисленных радикалов гетероарила;
каждый из R9 независимо друг от друга выбран из группы алкила и алкилоксикарбонила;
Y представляет собой О;
X представляет собой CR6R7, S или NR8, где
R6 и R7, каждый, представляют собой водород;
R8 представляет собой арилалкил;
арил представляет собой фенил или нафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, выбранными из группы галогена, нитро, циано, гидрокси, алкилокси или алкила;
алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 10 атомов углерода, циклический насыщенный углеводородный радикал, имеющий от 3 до 8 атомов углерода, или насыщенный углеводородный радикал, содержащий прямой или разветвленный фрагмент, имеющий от 1 до 10 атомов углерода, и циклический фрагмент, имеющий от 3 до 8 атомов углерода; каждый радикал необязательно замещен одним или более гидроксирадикалами; и
галоген представляет собой фтор, хлор, бром и йод.
2. Соединение по п.1, отличающееся тем, что А представляет собой арил и В представляет собой тиенил, где S находится в положении 9 или 11.
3. Соединение по п.2, отличающееся тем, что X представляет собой S.
4. Соединение по п.1, отличающееся тем, что
i равно 0;
j представляет собой целое число, равное 0 или 1;
R1 и R2представляют собой, каждый независимо друг от друга, водород, метил, этил или гидроксиэтил;
А представляет собой фенил;
В представляет собой тиенил или пиридинил;
R9 представляет собой водород, гидроксиметил, метоксикарбонил или этоксикарбонил;
X представляет собой СН2, S или N-бензил.
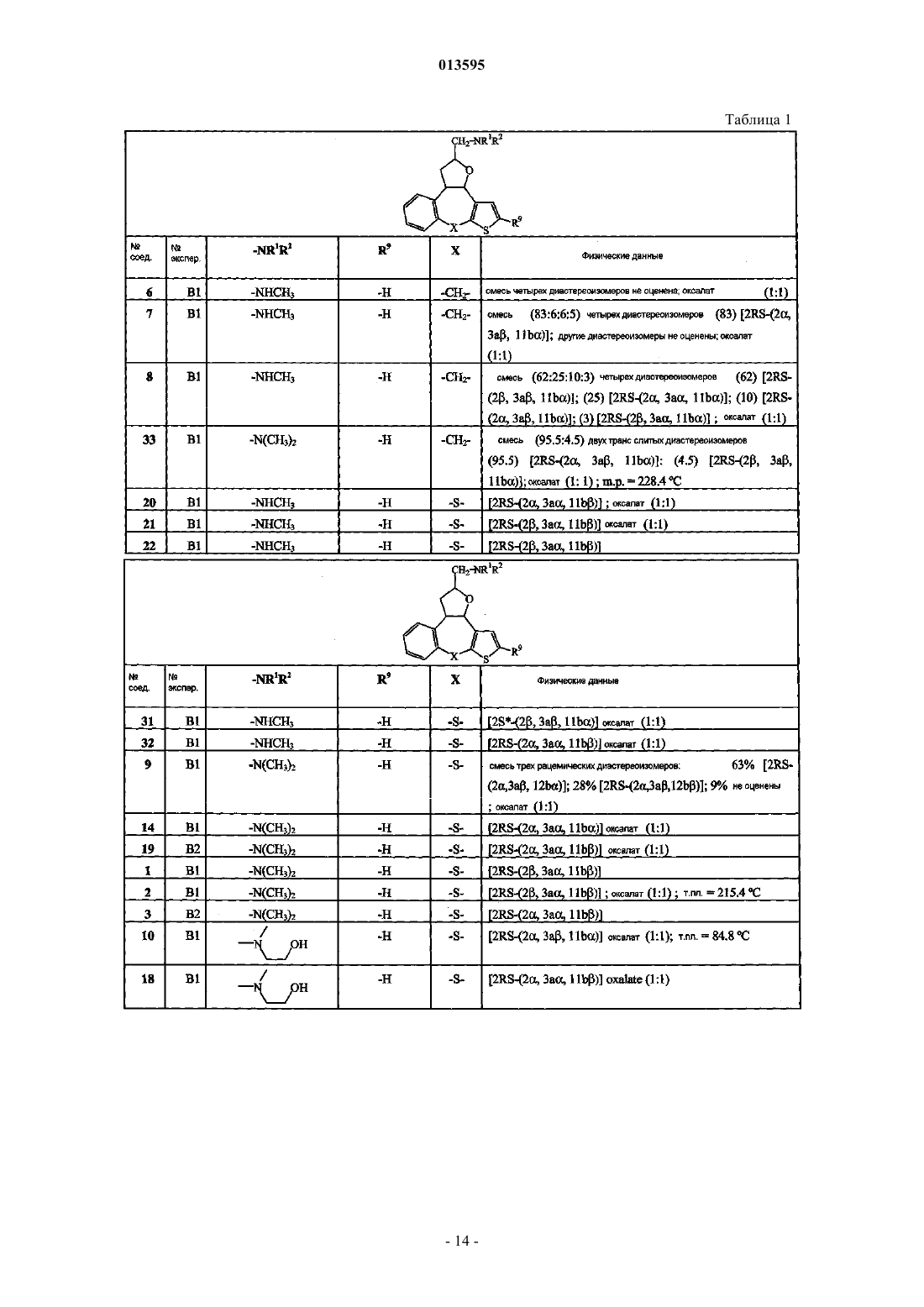
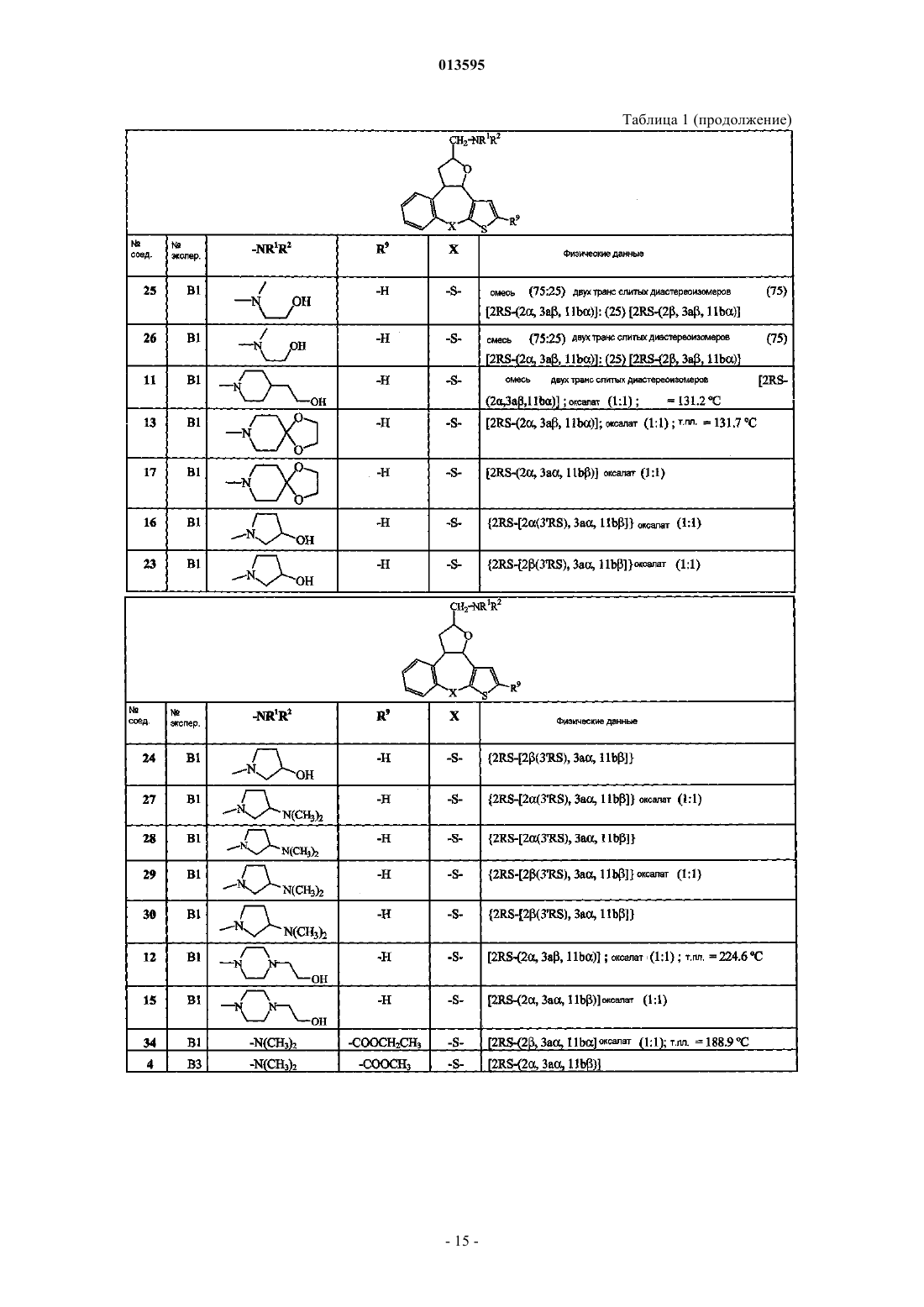
5. Соединение по п.1, выбранное из группы, включающей
3,3а,8,11b-тетрагидро-N-метил-2Н-бензо[3,4]тиено[2',3':6,7]циклогепта[1,2-b]фуран-2-метанамин;
3,3а,8,11b-тетрагидро-N,N-диметил-2Н-бензо[3,4]тиено[2',3':6,7]циклогепта[1,2-b]фуран-2-метанамин;
2,3,3а,11b-тетрагидро-N-метилтиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-метанамин;
2,3,3а,11b-тетрагидро-N,N-диметилтиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-метанамин;
2-[[[метил(2,3,3а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]амино]этанол;
1-[[(2,3,3а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-4-пиперидинэтанол;
8-[[(2,3,3а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-1,4-диокса-8-азаспиро[4.5]декан;
1-[[(2,3,3а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-3-пирролидинол;
N,N-диметил-1-[[(2,3,3а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-3-пирролидинамин;
4-[[(2,3,3а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-1-пиперазинэтанол;
этиловый эфир 2-[(диметиламино)метил]-2,3,3а,11b-тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-10-карбоновой кислоты;
метиловый эфир 2-[(диметиламино)метил]-2,3,3а,11b-тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-10-карбоновой кислоты;
2-[(диметиламино)метил]-2,3,3а,11b-тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-10-метанол;
3,3а,8,11b-тетрагидро-N,N-диметил-2Н-бензо[3,4]тиено[3',2':6,7]циклогепта[1,2-b]фуран-2-метанамин и
3,3а,8,12b-тетрагидро-N-метил-8-(фенилметил)-2Н-фуро[2,3-d]пиридо[2,3-b][1]бензазепин-2-метанамин;
или его N-оксидная форма, фармацевтически приемлемая аддитивная соль или его стереохимически изомерная форма.
6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель или растворитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-5.
7. Применение соединения по любому из пп.1-5 для изготовления лекарственного средства для предотвращения и/или лечения состояний, опосредованных 5HT2-рецептором, в частности 5HT2A- и 5HT2C-рецептором и D2-рецептором, а также ингибированием обратного захвата норэпинефрина.
8. Применение соединения по любому из пп.1-5 для изготовления лекарственного средства для лечения и/или предупреждения расстройств центральной нервной системы, подобных чувству страха; депрессии и умеренной депрессии; биполярных расстройств; расстройств сна и сексуальных нарушений; психозов; пограничных психозов; шизофрении; мигрени; изменений личности; расстройств, связанных с навязчивым неврозом; социальных фобий; приступов паники; расстройств внимания, органических психических нарушений; психических расстройств у детей; агрессии; расстройств памяти и нарушений осанки, особенно у пожилых людей; зависимости; ожирения, булимии и подобных расстройств.
9. Применение соединения по любому из пп.1-5 для изготовления лекарственного средства для лечения и/или предотвращения чувства страха, психоза, депрессии, биполярных расстройств, включая биполярную депрессию, мигрени и привыкания при злоупотреблении лекарствами.
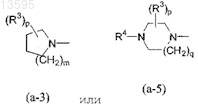
10. Способ получения соединения формулы (I) по любому из пп.1-5, отличающийся N-алкилированием промежуточного соединения формулы (II), где R9, i, j, кольцо А, кольцо В и X имеют те же значения, которые определены для формулы (I), и где W представляет собой подходящую уходящую группу, амином формулы HNR1R2, где R1и R2 имеют те же значения, что и в формуле (I), в реакционно-инертном растворителе и необязательно в присутствии подходящего основания
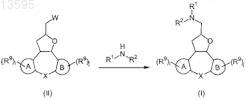
Текст
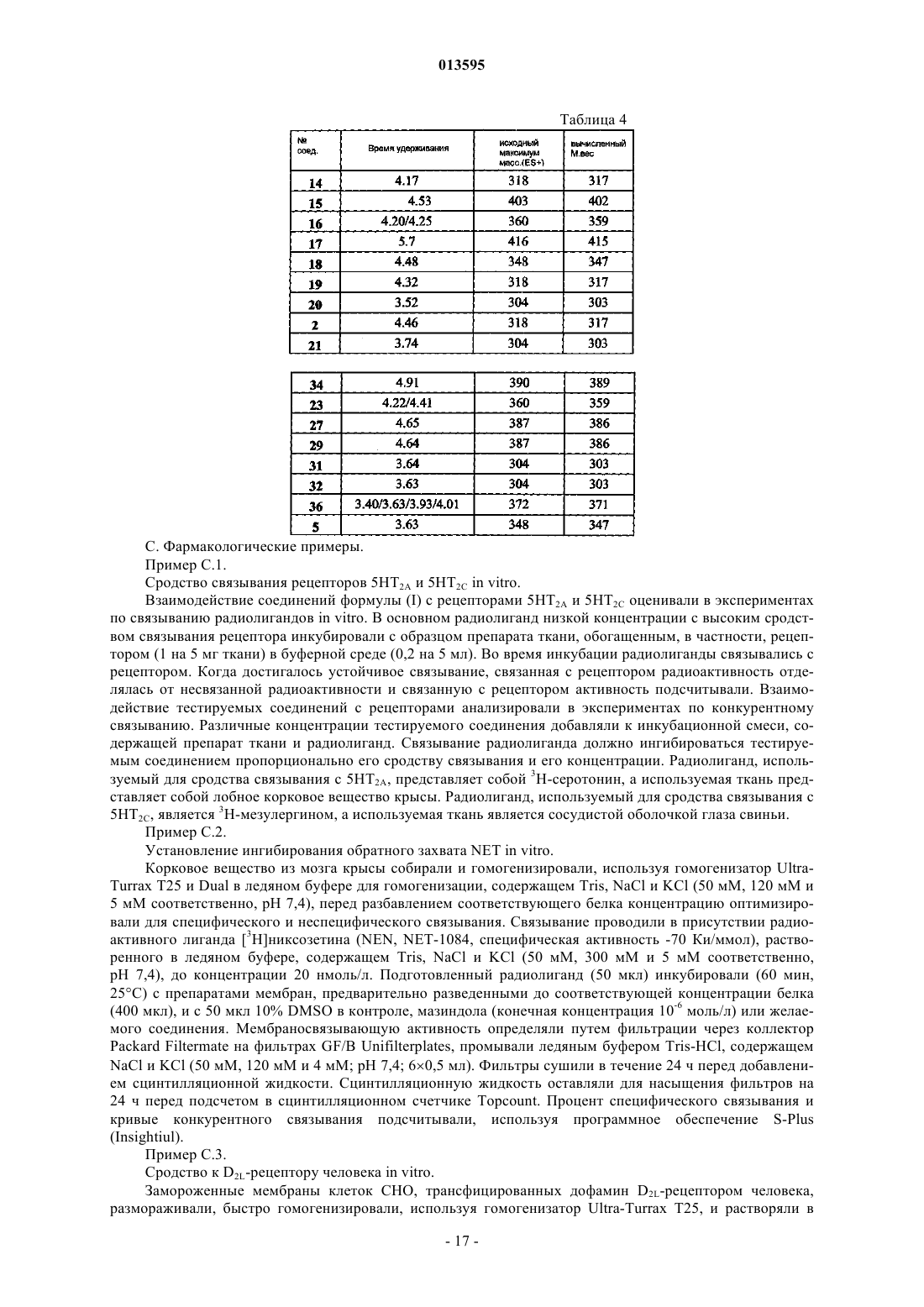
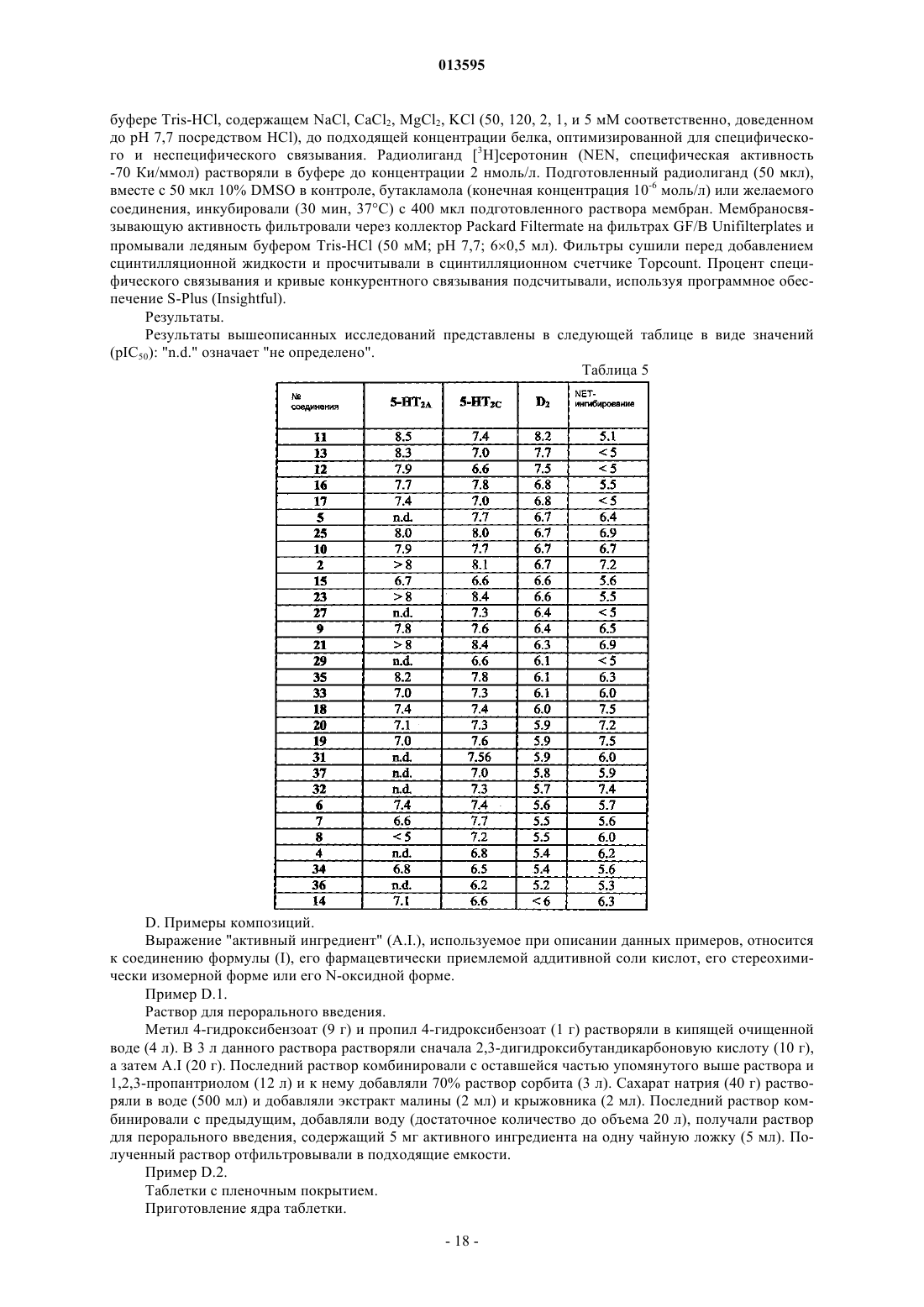
013595 Область изобретения Настоящее изобретение касается новых замещенных гетероциклических, тетрациклических производных тетрагидрофурана, имеющих сродство в отношении рецепторов серотонина, в частности 5HT2Aи 5HT2C-рецепторов, и рецепторов дофамина, в частности D2-рецепторов дофамина, наделенных также свойствами ингибиторов обратного захвата норэпинефрина, фармацевтических композиций, содержащих соединения согласно изобретению, их применения в качестве лекарственного средства, в частности, для профилактики и/или лечения ряда психиатрических и нейрологических расстройств, в частности определенных психотических, сердечно-сосудистых и гастрокинетических расстройств, и способов их получения. Предшествующий уровень техники В Международной заявке на патент WO 97/38991, опубликованной 23 октября 1997 г. (Janssen Pharmaceutica N.V.), описаны замещенные тетрациклические производные тетрагидрофурана, которые могут быть использованы в качестве терапевтических агентов при лечении или предотвращении нарушений ЦНС, сердечно-сосудистых расстройств или желудочно-кишечных расстройств. В частности, эти соединения обладают сродством к 5HT2-рецепторам серотонина, конкретно к 5HT2A- и 5HT2C-рецепторам. В Международной заявке на патент WO 99/19317, опубликованной 22 апреля 1999 г. (Janssen Pharmaceutica N.V.), описаны замещенные тетрациклические производные тетрагидрофурана со специфическим характером замещения галогена в дибензоазепиновом, дибензооксипиновом, дибензотиепиновом или дибензосуберановом кольце. Соединения пригодны для лечения или профилактики нарушений ЦНС,сердечно-сосудистых расстройств или желудочно-кишечных расстройств, и показано более быстрое начало их действия по сравнению с соединениями, описанными в Международной заявке на патентWO 97/38991. В обеих Международных заявках и в WO 03/048146, опубликованной 12 июня 2003 г. (JanssenPharmaceutica N.V.), и в WO 03/048147, опубликованной 12 июня 2003 г. (Janssen Pharmaceutica N.V.),описаны способы получения каждого из 4 диастереомеров цис-, соответственно, транс-слитых 3,3 а,8,12bтетрагидро-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b]фурановых производных в стереохимически чистом виде из одного энантиомерно чистого предшественника. В Международной заявке WO 03/040122, опубликованной 15 мая 2003 г. (Janssen PharmaceuticaN.V.), описаны соли миндальной кислоты соединений согласно WO 97/38991 и WO 99/19317. Неожиданно было обнаружено, что указанные соли более стабильны при повышенной температуре и относительной влажности, чем соединения, описанные в WO 97/38991 и WO 99/19317. Далее следует отметить WO 97/39001, опубликованную 23 октября 1997 г. (Janssen PharmaceuticaN.V.), в которой описаны гетероциклические тетрациклические производные изоксазолидина и которая обладает сродством к 5HT2-рецепторам. Описание изобретения Целью настоящего изобретения является получение новых гетероциклических аналогов тетрациклических производных тетрагидрофурана, описанных в WO 97/38991 и WO 99/19317, которые обнаруживают неожиданные преимущества по сравнению с последними соединениями в отношении большего сродства к 5HT2A- и 5HT2C-рецепторам и переносчикам обратного захвата норэпинефрина. Неожиданно соединения согласно изобретению также проявляли от высокой до умеренной активности дофамина D2, что вызывает интерес к этим соединениям в плане возможности лечения дофаминрегулируемых состояний, в частности шизофрении. На предшествующем уровне техники не было информации о соединениях, проявляющих указанную активность дофамина D2, и ни в одном из документов предшествующего уровня техники не указано, как ввести указанную активность в молекулу, которая имеет сродство к 5HT2A- и 5HT2C-рецепторам, при этом сохраняя ее сродство к 5HT2A- и 5HT2Cрецепторам. Эта задача достигается с помощью представленных здесь новых соединений формулы (I) их N-оксидной формы, их фармацевтически приемлемой аддитивной соли или их стереохимически изомерной формы, гдеn представляет собой целое число, равное 1;i, j представляют собой целые числа, независимо друг от друга равные 0 или 1;r равно 0; каждый из R1 и R2 независимо друг от друга представляет собой водород или алкил, или R1 и R2,взятые вместе с атомом азота, к которому они присоединены, могут образовывать радикал следующей где р представляет собой целое число, равное 0 или 1;q представляет собой целое число, равное 1;m представляет собой целое число, равное 1 или 2; каждый R3 независимо друг от друга выбран из группы гидрокси, алкила, моно- или диалкиламино,или два R3-радикала могут образовывать вместе двухвалентный радикалR4 представляет собой алкил; А и В представляют собой, каждый независимо друг от друга, радикал арила или гетероарила, конденсированный с центральным кольцом и выбранный из группы тиенила и пиридинила; при условии, что по меньшей мере один из А и В является одним из вышеперечисленных радикалов гетероарила; каждый из R9 независимо друг от друга выбран из группы алкила и алкилоксикарбонила;R8 представляет собой арилалкил; арил представляет собой фенил или нафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, выбранными из группы галогена, нитро, циано, гидрокси, алкилокси или алкила; алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал,имеющий от 1 до 10 атомов углерода, циклический насыщенный углеводородный радикал, имеющий от 3 до 8 атомов углерода, или насыщенный углеводородный радикал, содержащий прямой или разветвленный фрагмент, имеющий от 1 до 10 атомов углерода, и циклический фрагмент, имеющий от 3 до 8 атомов углерода; каждый радикал необязательно замещен одним или более гидроксирадикалами; и галоген представляет собой фтор, хлор, бром и йод. Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или растворитель и в качестве активного ингредиента терапевтически активное количество соединения согласно изобретению. Изобретение также относится к применению соединения согласно изобретению для получения лекарственного средства для предупреждения и/или лечения состояний, опосредованных 5HT2- и D2 рецептором, а также ингибированием обратного захвата норэпинефрина. В частности, изобретение относится к применению соединения согласно изобретению для изготовления лекарственного средства для лечения и/или предупреждения расстройств центральной нервной системы, подобных чувству страха, депрессии и умеренной депрессии, биполярных расстройств, расстройств сна и сексуальных нарушений, психозов, пограничных психозов, шизофрении, мигрени, изменения личности или расстройств, связанных с навязчивым неврозом, социальных фобий или приступов паники, органических психических нарушений, психических нарушений у детей, агрессии, расстройств памяти и нарушений осанки у пожилых людей, зависимости, ожирения, булимии и подобных расстройств. Более конкретно, изобретение относится к применению соединения согласно изобретению для изготовления лекарственного средства для лечения и/или предупреждения чувства страха, депрессии, психоза, шизофрении, мигрени и привыкания при злоупотреблении лекарствами. Кроме того, изобретение относится к способу получения соединения формулы (I) по изобретению,отличающемуся N-алкилированием промежуточного соединения формулы (II), где R9, i, j, кольцо А,кольцо В и X имеют те же значения, которые определены для формулы (I), и где W представляет собой подходящую уходящую группу, амином формулы HNR1R2, где R1 и R2 имеют те же значения, что и в формуле (I), в реакционно-инертном растворителе и необязательно в присутствии подходящего основания. Подробное описание изобретения В предпочтительном воплощении изобретение относится к соединению общей формулы (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме и его N-оксидной форме, где А представляет собой арил и В представляет собой тиенил, где S находится в положении 9 или 11. В следующем предпочтительном воплощении изобретение относится к соединению общей формулы (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме и его N-оксидной форме, где X представляет собой S. В еще одном предпочтительном воплощении изобретение относится к соединению общей формулы(I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме и его N-оксидной форме, где i равно 0; j представляет собой целое число, равное 0 или 1; R1 и R2 представляют собой, каждый независимо друг от друга, водород, метил, этил или гидроксиэтил; А представляет собой фенил; В представляет собой тиенил или пиридинил; R9 представляет собой водород, гидроксиметил, метоксикарбонил или этоксикарбонил; X представляет собой СН 2, S или Nбензил. В наиболее предпочтительном воплощении изобретение относится к соединению общей формулы(I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме и его N-оксидной форме, где соединение выбрано из группы, включающей 3,3 а,8,11b-тетрагидро-N-метил-2 Н-бензо[3,4]тиено[2',3':6,7]циклогепта[1,2-b]фуран-2-метанамин; 3,3 а,8,11b-тетрагидро-N,N-диметил-2 Н-бензо[3,4]тиено[2',3':6,7]циклогепта[1,2-b]фуран-2 метанамин; 2,3,3 а,11b-тетрагидро-N-метилтиено[2,3':2,3][1]бензотиепино[4,5-b]фуран-2-метанамин; 2,3,3 а,11b-тетрагидро-N,N-диметилтиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-метанамин; 2-метил(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2 ил]метил]амино]этанол; 1-(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-4 пиперидинэтанол; 8-(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-1,4-диокса-8 азаспиро[4.5]декан; 1-(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-3-пирролидинол;N,N-диметил-1-(2,3,3 а,11b)-тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-3 пирролидинамин; 4-(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-1 пиперазинэтанол; этиловый эфир 2-[(диметиламино)метил]-2,3,3 а,11b-тетрагидротиено[2',3':2,3][1]бензотиепино[4,5b]фуран-10-карбоновой кислоты; метиловый эфир 2-[(диметиламино)метил]-2,3,3 а,11b-тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-10-карбоновой кислоты; 2-[(диметиламино)метил]-2,3,3 а,11b-тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-10 метанол; 3,3 а,8,11b-тетрагидро-N,N-диметил-2 Н-бензо[3,4]тиено[3',2':6,7]циклогепта[1,2-b]фуран-2 метанамин и 3,3 а,8,12b-тетрагидро-N-метил-8-(фенилметил)-2 Н-фуро[2,3-d]пиридо[2,3-b][1]бензазепин-2 метанамин. В рамках данного изобретения алкил определяется как одновалентный прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 10 атомов углерода, например метил, этил,пропил, бутил, 1-метилпропил, 1,1-диметилэтил, пентил, гексил; алкил, кроме того, определяется как одновалентный циклический насыщенный углеводородный радикал, имеющий от 3 до 8 атомов углерода, например, циклопропил, метилциклопропил, циклобутил, циклопентил и циклогексил. Согласно определению, алкил также включает в себя алкильный радикал, в котором один или более атомов углерода необязательно замещены одним или более гидроксирадикалами, например гидроксиалкил, в частности гидроксиметил и гидроксиэтил.-3 013595 Здесь галоген относится к фтору, хлору, брому и йоду. В рамках данного изобретения выражение "соединения согласно изобретению" означает соединение общей формулы (I), его фармацевтически приемлемую аддитивную соль кислоты или основания, его стереохимически изомерные формы и его N-оксидную форму. В рамках данного изобретения элемент, в частности, когда он упоминается в связи с соединением формулы (I), содержит все изотопы и смеси изотопов данного элемента либо природного происхождения, либо полученных синтетическим путем, либо содержащихся в природе в избыточном количестве или в форме, обогащенной изотопами. В частности, когда упоминается водород, подразумеваются 1 Н, 2 Н,3 Н и их смеси; когда упоминается углерод, подразумеваются 11 С, 12 С, 13 С, 14 С и их смеси; когда упоминается азот, подразумеваются 13N, 14N, 15N и их смеси; когда упоминается кислород, подразумеваются 14 О,15 О, 16 О, 17 О, 18 О и их смеси; и когда упоминается фтор, подразумеваются 18F, 19F и их смеси. Следовательно, соединения согласно изобретению содержат также соединения с одним или более изотопами одного или более элементов и их смеси, включая радиоактивные соединения, называемые также соединениями, меченными радиоактивными изотопами, где один или более нерадиоактивных атомов замещены одним из его радиоактивных изотопов. Под термином "соединение, меченное радиоактивными изотопами", подразумевается любое соединение формулы (I), его N-оксидная форма, фармацевтически приемлемая аддитивная соль или стереометрически изомерная форма, которые содержат по меньшей мере один радиоактивный атом. Например, соединения могут быть мечены позитронными или радиоактивными изотопами с гамма-излучением. В технологии связывания радиолиганда (анализ мембранных рецепторов) для замещения выбирали 3 Н-атом или 125I-атом. Для визуализации в большинстве случаев использовали радиоактивные изотопы, излучающие позитроны (PET), 11C, 18F, 15O и 13N, все из которых были получены на ускорителе и которые имеют период полураспада соответственно 20, 100, 2 и 10 мин. В связи с коротким периодом полураспада указанных изотопов они являются единственно возможными для использования в таком устройстве, которое имеет ускоритель на месте их образования,таким образом, ограничивая их применение. Наиболее широко используемыми из них являются 18F,99mTc, 201Tl и 123I. Обращение с этими радиоактивными изотопами, их получение, выделение и включение в молекулу известны специалисту в данной области. В частности, радиоактивный атом выбирают из группы водорода, углерода, азота, серы, кислорода и галогена. Предпочтительно радиоактивный атом выбирается из группы водорода, углерода и галогена. В частности, радиоактивный изотоп выбирают из группы 3 Н, 11C, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br,77Br и 82Br. Предпочтительно радиоактивный изотоп выбирают из группы 3 Н, 11 С и 18F. Фармацевтически приемлемые соли определяются как содержащие терапевтически активные нетоксические формы аддитивных солей кислоты, которые могут образовывать соединения формулы (I). Указанные соли могут быть получены посредством обработки основной формы соединений формулы (I) соответствующими кислотами, например неорганическими кислотами, например галогеноводородной кислотой, в частности соляной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой, пропионовой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, паратолуолсульфоновой кислотой, цикламовой кислотой, салициловой кислотой, парааминосалициловой кислотой, памовой кислотой и миндальной кислотой. Наоборот, указанные формы аддитивной соли кислоты могут быть превращены в форму свободного основания посредством обработки соответствующим основанием. Соединения формулы (I), содержащие кислотные протоны, также могут быть превращены в формы их терапевтически активных нетоксических аддитивных солей металла или амина посредством обработки соответствующими органическими и неорганическими основаниями. Формы соответствующих солей основания содержат, например, соли аммония, соли щелочных и щелочно-земельных металлов, в частности соли лития, натрия, калия, магния и кальция, соли органических оснований, например бензатин, Nметил-D-глюкамин, соли оксиамина и соли аминокислот, например аргинина и лизина. Наоборот, формы указанных солей могут быть превращены в свободные формы посредством обработки соответствующей кислотой. Четвертичные соли аммония соединений формулы (I) определяют указанные соединения, которые способны образовываться посредством взаимодействия между основным азотом соединения формулы (I) и соответствующим четвертичным агентом, таким, например, как необязательно замещенный галогеналкил, галогенарил или галогенарилалкил, в частности метилйодид и бензилйодид. Другие реагенты с легко уходящими группами могут также быть использованы, например, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-р-толуолсульфонаты. Соль четвертичного аммония имеет положительно заряженный азот. Фармацевтически приемлемые противоионы включают в себя ионы хлора, брома, йода, трифторацетата и ацетата. Термин "аддитивная соль", используемый в рамках настоящего изобретения, также включает в себя-4 013595 сольваты, которые способны образовывать соединения формулы (I), а также их соли. Такими сольватами являются, например, гидраты и алкоголяты. Под N-оксидными формами соединений формулы (I) подразумеваются такие соединения формулы(I), в которых один или несколько атомов азота окислены до так называемого N-оксида, в частности таких N-оксидов, где один или более третичных атомов азота (например, радикал пиперазинила или пиперидинила) являются N-окисленными. Такие N-оксиды могут быть легко получены специалистом в данной области без какого-либо изобретательства, и они являются очевидной альтернативой соединений согласно формуле (I), так как данные соединения являются метаболитами, которые образуются посредством окисления в организме человека при их поглощении. Известно, что, как правило, окисление в норме является первым этапом метаболизма лекарственного средства (Textbook of Organic Medicinal и Pharmaceutical Chemistry, 1977, pages 70-75). Известно также, что, как правило, разновидность метаболита соединения также может быть введена в организм человека вместо соединения как такового, по большей части с теми же эффектами. Соединения согласно изобретению могут иметь по меньшей мере один окисляемый азот (т.е. фрагмент третичных аминов в случаях R1 и R2 не является Н). В таком случае существует высокая вероятность того, что N-оксиды образуются в процессе метаболизма у человека. Соединения формулы (I) могут быть превращены в соответствующие N-оксидные формы нижеследующими известными в данной области способами превращения трехвалентного азота в его N-оксидную форму. Указанная реакция N-окисления обычно может быть проведена посредством взаимодействия стартового материала формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают в себя, например, перекись водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать в себя пероксикислоты, такие, например, как бензолпероксикарбоновая кислота или галогензамещенная бензолпероксикарбоновая кислота, например 3 хлорбензолпероксикарбоновая кислота, пероксиалкановая кислота, например пероксиуксусная кислота,алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются,например, вода, низшие спирты, например этанол и пр., углеводороды, например толуол, кетоны, например 2-бутанон, галогенизированные углеводороды, например дихлорметан, и смеси таких растворителей. Термин "стереохимически изомерные формы", используемый выше в данном документе, определяет все возможные изомерные формы, которые могут принимать соединения формулы (I). Если не указано иначе, химическое название соединений означает смесь всех возможных стереохимически изомерных форм, указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; заместители двухвалентных циклических (частично) насыщенных радикалов могут иметь или цис-, или транс-конфигурацию. Соединения, содержащие двойные связи, могут иметь Е- или Z-стереохимию на месте указанной двойной связи. Стереохимически изомерные формы соединений формулы (I) считаются включенными в объем настоящего изобретения. Согласно номенклатурному соглашению CAS, когда в молекуле присутствуют два стереогенных центра известной абсолютной конфигурации, младшему заместителю хирального центра приписывается символ R или S (на основе правила последовательности Кана-Ингольда-Прелог), центр отсчета. Каждый из R и S означает оптически чистый стереогенный центр с неопределенной абсолютной конфигурацией. Если используются и " ": положение старшего заместителя при асимметричном атоме углерода в циклической системе, имеющей наименьший номер в кольце, является неизменно произвольным в положении средней плоскости, определяемой системой колец. Положение старшего заместителя на другом асимметричном атоме углерода в системе колец (атом водорода в соединениях формулы (I относительно положения старшего заместителя от атома отсчета обозначают 42, если он находится на той же стороне средней плоскости, определяемой системой колец, или , если он находится на другой стороне средней плоскости, определяемой системой колец. Соединения формулы (I) имеют по меньшей мере один асимметричный центр на атоме углерода в пятичленном кольце, прикрепленный к алкиламино-стороне цепи. Указанный асимметричный центр и любой другой асимметричный центр, который может присутствовать (например, определенные Хгруппы), обозначаются посредством символов R и S. Фармакология Соединения общей формулы (I) согласно изобретению, их фармацевтически приемлемые аддитивные соли кислот или оснований, их стереохимические изомерные формы и их N-оксидные формы обладают сродством к 5HT2-рецепторам, в частности к 5HT2A- и 5HT2C-рецепторам (номенклатура, как описано у D. Hoyer в "Serotonin (5HT) in neurologic и psychiatric disorders", под редакцией M.D. Ferrari и опубликованной в 1994 Boerhaave Commission of the University of Leiden), и сродством к D2-рецептору, а также проявляют ингибиторную активность в отношении обратного захвата ноэпинефрина. Свойства антагониста серотонина соединений согласно изобретению можно продемонстрировать с помощью эффекта ингибирования ими "5-гидрокситриптофанового теста на крысах", который описан в Drug Dev.Res., 13, 237-244 (1988). Соединения общей формулы (I) согласно изобретению, их фармацевтически приемлемые аддитивные соли кислот или оснований, их стереохимические изомерные формы и их N-оксидные формы также обладают благоприятными физико-химическими свойствами. Например, они являются химически стабильными соединениями. Ввиду их способности блокировать 5HT2-рецепторы, и, в частности, блокировать 5HT2A- и 5HT2Cрецепторы, а также D2-рецептор, а также их воздействие на ингибиторную активность обратного захвата норэпинефрина, соединения общей формулы (I) согласно изобретению, их фармацевтически приемлемые аддитивные соли кислот или оснований, их стереохимически изомерные формы и их N-оксидные формы применимы в качестве лекарственного средства, в частности, для профилактики и терапевтического курса лечения состояний, опосредованных указанными рецепторами. Следовательно, изобретение относится к применению соединения общей формулы (I), его фармацевтически приемлемых аддитивных солей кислот или оснований, его стереохимически изомерных форм и его N-оксидных формам в качестве лекарственного средства. Изобретение также относится к применению соединения общей формулы (I), его фармацевтически приемлемых аддитивных солей кислот или оснований, их стереохимически изомерных форм и их Nоксидных форм для производства лекарственного средства для предотвращения и/или лечения состояний, опосредованных 5HT2-рецептором, в частности 5HT2A- и 5HT2C-рецептором и D2-рецептором, а также ингибирования обратного захвата норэпинефрина. Ввиду указанных фармакологических и физико-химических свойств соединения общей формулы(I), их фармацевтически приемлемые аддитивные соли кислот или оснований, их стереохимические изомерные формы и их N-оксидные формы пригодны в качестве терапевтических агентов для лечения и/или предотвращения расстройств центральной нервной системы, таких как чувство страха; депрессии и умеренной степени депрессии; биполярных расстройств, включая биполярную манию и депрессию; нарушения сна и сексуальные расстройства; психозы; пограничные психозы; шизофрения; мигрени; изменения личности; навязчивые неврозы; социальные фобии; приступы паники; расстройств внимания, включая синдром дефицита внимания и гиперактивности (ADHD); органические психические нарушения; психические расстройства у детей, таких как ADHD; агрессия; расстройства памяти и нарушения осанки, особенно у пожилых людей; вредные привычки; ожирение; булимия и подобные расстройства. В частности, соединения согласно изобретению могут применяться в качестве средства, подавляющего патологический страх, в качестве антидепрессантов, нейролептиков, антишизофренических агентов, агентов против мигрени и в качестве агентов, позволяющих аннулировать свойства лекарственных средств, вызывающих привыкание при злоупотреблении ими. Соединения согласно изобретению, в частности соединения общей формулы (I), их фармацевтически приемлемые аддитивные соли кислот или оснований, их стереохимические изомерные формы и ихN-оксидные формы могут быть использованы также в качестве терапевтических агентов при лечении нарушений моторики. Применение соединений согласно изобретению может быть успешным в сочетании с классическими терапевтическими агентами, обычно используемыми для лечения таких расстройств. Соединения согласно изобретению, в частности соединения общей формулы (I), их фармацевтически приемлемые аддитивные соли кислот или оснований, их стереохимические изомерные формы и ихN-оксидные формы могут быть полезны также в лечении или предотвращении поражения нервной системы, вызванного травмой, параличом, нейродегенеративными заболеваниями, когнитивными расстройствами, такими как слабоумие и болезнь Альцгеймера, и пр.; сердечно-сосудистых заболеваний, таких как высокое кровяное давление, тромбоз, инсульт и пр.; и расстройств желудочно-кишечного тракта,таких как дисфункция сократительной способности желудочно-кишечной системы и пр. Принимая во внимание отмеченные выше применения, следует указать, что согласно настоящему изобретению представляется способ лечения теплокровных животных, страдающих от подобных заболеваний, при этом указанный способ, включающий в себя системное введение терапевтического количества соединений согласно изобретению, в частности соединений общей формулы (I), их фармацевтически приемлемых аддитивных солей кислот или оснований, их стереохимически изомерных форм и их Nоксидных форм эффективен для лечения вышеописанных расстройств, в частности для лечения чувства страха, психозов, депрессий, биполярных расстройств, включая биполярную депрессию, мигрень и зависимости от лекарственных средств, вызывающих привыкание при злоупотреблении ими. Настоящее изобретение, таким образом, относится также к применению соединений согласно изобретению, в частности, с соединений общей формулы (I), их фармацевтически приемлемых аддитивных солей кислот или оснований, их стереохимически изомерных форм и их N-оксидных форм в качестве лекарственного средства, в частности соединение формулы (I) может быть использовано для производства лекарственного средства для лечения чувства страха, психозов, депрессий, биполярных расстройств,включая биполярную депрессию, мигрень и зависимости от лекарственных средств, вызывающих привыкание при злоупотреблении ими. Специалист в области лечения подобных заболеваний может определить терапевтически эффектив-6 013595 ное суточное количество лекарственного средства по результатам теста, который представлен в дальнейшем описании. Эффективное терапевтическое суточное количество лекарственного средства должно приблизительно составлять от 0,01 до приблизительно 10 мг/кг веса тела, более предпочтительно приблизительно от 0,05 до приблизительно 1 мг/кг веса тела. Изобретение также относится к фармацевтической композиции, включающей фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения согласно изобретению, в частности соединения общей формулы (I), его фармацевтически приемлемые аддитивные соли кислот или оснований, их стереохимически изомерные формы и их Nоксидную форму. Соединения согласно изобретению, в частности соединения общей формулы (I), их фармацевтически приемлемые аддитивные соли кислот или оснований, их стереохимически изомерные формы, и их Nоксидная форма или их любая подгруппа или комбинация могут быть составлены в композицию в различных фармацевтических формах, предназначенных для введения. В качестве подходящих композиций могут быть приведены все композиции, обычно используемые для системного введения лекарственных средств. Для приготовления фармацевтических композиций согласно изобретению эффективное количество конкретного соединения, необязательно в виде его аддитивной соли в качестве активного ингредиента, комбинируют при тщательном перемешивании с фармацевтически приемлемым носителем, где указанный носитель может представлять собой одну из многообразных форм в зависимости от формы препарата, требуемой для введения. Указанные фармацевтические композиции должны быть составлены в унитарную лекарственную форму, подходящую, в частности, для перорального, ректального, чрескожного введения, введения посредством парентеральной инъекции или путем ингаляции. Например, для приготовлении композиций в пероральной лекарственной форме может быть использована любая из обычных фармацевтических сред, такая, например, как вода, гликоли, масла, спирты и пр., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазывающие материалы, связующие вещества, разрыхлители и пр. в случае порошков, пилюль, капсул и таблеток. Таблетки и капсулы представляют собой наиболее удобные пероральные лекарственные формы, поскольку они наиболее удобны для приема, и в этом случае, безусловно, используются твердые фармацевтические носители. Для парентеральных композиций носитель, как правило, будет в основном содержать помимо прочих ингредиентов стерильную воду, например, для повышения растворимости. Например, могут быть получены растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть получены также инъецируемые суспензии, в этом случае используют подходящие жидкие носители, суспендирующие агенты и пр. Используют также твердые формы препаратов, которые предназначены для того, чтобы незадолго до использования их превращали в жидкую форму препаратов. В композициях, подходящих для чрескожного введения, носитель необязательно содержит усиливающий проникновение агент и/или подходящий смачивающий агент, необязательно в сочетании с подходящими добавками любой природы в минорном соотношении, чтобы эти добавки не оказывали заметного вредного воздействия на кожу. Указанные добавки облегчают введение через кожу и/или могут быть полезны при получении требуемых композиций. Указанные композиции могут быть введены различными путями, например в виде трансдермального пластыря, местно или в виде мази. Особенно предпочтительны указанные выше фармацевтические композиции в единичной лекарственной форме для облегчения введения и унификации дозировки. Здесь единичная лекарственная форма относится к физически дискретным единицам, пригодным в качестве одноразовых дозировок, причем каждая единица содержит предопределенное количество активного ингредиента, рассчитанного так, чтобы производить желаемый терапевтический эффект, в сочетании с соответствующим фармацевтическим носителем. Примерами таких единичных лекарственных форм являются таблетки (включая таблетки с насечкой или покрытые оболочкой таблетки), капсулы, пилюли, порошковые пакеты, брикеты, суппозитории, растворы для инъекций или суспензии и пр., а также раздельные упаковки, содержащие определенное количество единичных лекарственных форм. Так как соединения согласно изобретению являются сильнодействующими перорально вводимыми соединениями, фармацевтические композиции, содержащие указанные соединения и предназначенные для введения пероральным способом, имеют особые преимущества. Для того чтобы увеличить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях, может оказаться полезным использование -, - или -циклодекстрины или их производные, в частности гидроксиалкилзамещенные циклодекстрины, например 2-гидроксипропил-циклодекстрин. Вспомогательные растворители, такие как спирты, также могут улучшать растворимость и/или стабильность соединений согласно изобретению в фармацевтических композициях. Получение соединений. Соединения согласно изобретению в общем могут быть получены путем осуществления последовательных стадий, каждая из которых известна специалистам в данной области.-7 013595 Соединения формулы (I), которые получают описанными ниже способами, могут быть синтезированы в виде рацемических смесей энантиомеров, которые могут быть отделены один от другого следующими известными в данной области способами разделения. Рацемические соединения формулы (I) могут быть превращены в соответствующие формы диастереомерной соли посредством взаимодействия с соответствующей хиральной кислотой. Указанные формы диастереомерной соли впоследствии разделяли, например, посредством селективной или фракционной кристаллизации и энантиомеры высвобождали из них с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает в себя жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные очищенные стереохимически изомерные формы могут быть получены также и из соответствующих чистых стереохимически изомерных форм подходящих стартовых материалов, при условии, что реакция протекает стереоспецифически. Если требуется специфический стереоизомер, предпочтительно, чтобы указанное соединение было синтезировано стереоспецифическими способами получения. В указанных способах будут преимущественно использованы энантиомерно чистые стартовые материалы. Соответствующие схемы получения соединений согласно изобретению включают в себя следующее: Схема А Стадия 1. Взаимодействие промежуточного соединения формулы (V) с реагентом формулы (VI). Эту реакцию можно осуществить каким-нибудь из способов, известных в данной области для алкилирования кетонов в -положении в кислых или основных условиях реакции (например, реакция может быть проведена в органическом растворителе, таком как тетрагидрофуран, с основанием, таким, например, как гидрид натрия или N,N-диизопропиламин лития и с использованием аллилбромида в качестве алкилирующего агента), и в результате получить промежуточное соединение формулы (IV), где R9, i, j, кольцо А, кольцо В и X все имеют значения, которые описаны выше для конечного соединения формулы (I). Для соединения формулы (VI) М представляет собой подходящую группу для реакции алкилирования,такую, например, как галоген, гидрокси или ацетокси. Стадия 2. Восстановление соединения формулы (IV), например, боргидридом натрия в органическом растворителе, таком как тетрагидрофуран или метанол, обычно при комнатной температуре с получением на выходе соединения формулы (III). Стадия 3. Взаимодействие промежуточного соединения формулы (III) с циклизующим агентом, таким, например, как йод вместе с гидрокарбонатом натрия, в органическом растворителе, таком, например, как ацетонитрил или дихлорметан, с получением промежуточного соединения формулы (II), которое является новым соединением, где W представляет собой подходящую уходящую группу, предпочтительно, галоген, алкил- или арилсульфонилокси, в частности 4-(метилфенил)сульфонилокси или йод. Стадия 4. N-алкилирование промежуточного соединения формулы (II) амином формулы HNR1R2,где R1 и R2 определяются так, как в формуле (I), посредством любого известного в данной области способа, приводит к конечному соединению формулы (I), которое является новым соединением. Например,указанное N-алкилирование можно легко провести так, как описано в Международной заявкеWO 97/38991, в реакционно-инертном растворе, таком, например, как метанол, метилизобутилкетон,N,N-диметилформамид или диметилсульфоксид, и, необязательно, в присутствии подходящего основания. Перемешивание и повышенная температура, например температура флегмы, могут увеличить скорость реакции. Обычными условиями реакции являются 8 ч при 130 С. С другой стороны, указанное N-алкилирование также можно провести, используя способ, описанный Monkovic и др. (J. Med. Chem. (1973), 16(4), p. 403-407), с применением реакционного герметичного сосуда.-8 013595 Альтернативно, указанное N-алкилирование можно произвести также посредством нагревания до высокой температуры, например 120 С, промежуточного соединения формулы (II), амина формулыNHR1R2 и основания, например оксида кальция, в органическом растворителе, таком как THF, в герметичном реакционном сосуде. Соединения формулы (I) также могут быть превращены друг в друга в результате следующих известных в данной области реакций трансформации. Например,a) соединение формулы (I), где R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют радикал формулы (b), может быть превращено в соответствующий первичный амин путем обработки гидразином или водной щелочью;b) соединение формулы (I), где R1 и R2 представляют собой трифторметилкарбонил, может быть превращено в соответствующий первичный или вторичный амин путем гидролиза водной щелочью;c) соединение формулы (I), где R1 и R2 представляют собой C1-6 алкил, замещенный C1-6 алкилкарбонилокси, может быть гидролизовано в соединение формулы (I), где R1 или R2 представляют собойd) соединение формулы (I), где R1 и R2 оба представляют собой водород, может быть моно- или диN-алкилировано до соответствующей формы амина;e) соединение формулы (I), где R1 и R2 оба представляют собой водород либо R1 или R2 представляет собой водород, может быть N-ацилировано до соответствующего амида;f) соединение формулы (I), содержащее C1-6 алкилоксикарбонильную группу, может быть гидролизовано до соответствующей карбоновой кислоты;g) соединение формулы (I), в котором R9 представляет собой водород, т.е. i и/или j равны 0, может быть превращено в соответствующее соединение алкилоксикарбонила посредством обработки подходящим ацилирующим агентом, например, подходящим алкилоксикарбонилхлоридом, в присутствии бутиллития в гексане, с использованием органического растворителя, такого как тетрагидрофуран; илиh) соединение формулы (I), в котором R9 представляет собой алкилоксикарбонил, может быть превращено в соответствующее соединение гидроксиметила посредством восстановления, например,LiAlH4, например, в органическом растворителе, таком как тетрагидрофуран. Каждое промежуточное соединение из упомянутых выше в данном документе можно приобрести или получить нижеследующими известными в данной области способами. Например, промежуточные соединения формулы (II) могут быть получены согласно способу, описанному Monkovic и др. (J. Med.Chem. (1973), 16(4), p. 403-407). Промежуточные соединения формулы (V), в которых X представляет собой СН 2, А представляет собой фенильную группу и В представляет собой тиенильную группу, представленную формулой (V-a) ниже, можно приобрести или получить нижеследующими известными в данной области способами. Например, промежуточные соединения формулы (V-a) могут быть получены согласно способу, описанному Промежуточные соединения формулы (V), в которых X представляет собой S, А представляет собой фенильную группу и В представляет собой тиенильную группу, представленную формулой (V-b) ниже, могут быть получены посредством восстановления промежуточного соединения формулы (VI) подходящим восстанавливающим агентом, таким как гидрид алюминия в органическом растворителе,таком, например, как тетрагидрофуран. Схема В Промежуточное соединение формулы (VI) можно получить с помощью способов, описанныхMichal Majchrzak (Journal of Heterocyclic Chemistry 1985, 22(5), 1203-4; Journal of Heterocyclic Chemistry 1985, 22(5), 1205-6) и в патентных публикациях DE2625642 и PL158223. Промежуточные соединения формулы (V), в которых X представляет собой S, А представляет собой фенильную группу и В представляет собой тиенильную группу, представленную формулой (V-c) ниже, можно приобрести или получить нижеследующими известными в данной области способами. Например, промежуточные соединения формулы (V-c) могут быть получены согласно способам, описанным в патентных публикациях Промежуточные соединения формулы (V), в которых X представляет собой NR8, А представляет собой фенильную группу и В представляет собой пиридинильную группу, представленную формулой(V-d) ниже, могут быть получены согласно последовательным реакциям, показанным на схеме С. Схема С Стадия 1. Реакция соединения формулы (VII) с соединением формулы (VIII) при высокой температуре, такой, например, как 200 С, даст промежуточное соединение формулы (IX), где R1, R2, R9, i, j имеют значения, описанные выше для конечного соединения формулы (I). Стадия 2. Реакция соединения формулы (IX) с соединением формулы (X) в присутствии основания,такого, например, как гидрид натрия, в органическом растворителе, таком, например, как N,Nдиметилформамид. Альтернативно, реакцию можно провести любым известным в данной области способом для алкилирования анилиновых производных. Для соединения формулы (X) X представляет собой подходящую группу для реакции алкилирования, такую, например, как галоген, гидрокси или ацетокси,и R8 имеет значение, которое описано выше для конечного соединения формулы (I). Стадия 3. Циклизация промежуточного соединения формулы (XI) дает соединение формулы (V-d),где R8, R9, i, j имеют значения, которые описаны выше для конечного соединения формулы (I). Реакция циклизации может быть выполнена посредством известных в данной области способов, таких как способ, описанный Lohse и др. (Tetrahedron Letters, 2001, 42, 385-389). Чистые стереохимически изомерные формы соединений формулы (I) могут быть получены с применением способов, известных в данной области. Диастереомеры могут быть разделены физическими методами, такими как селективная кристаллизация, и хроматографически, например, путем противоточного распределения, жидкостной хроматографии и пр. Соединения формулы (I), получаемые описанными выше в данном документе способами, обычно представляют собой рацемические смеси энантиомеров, которые могут быть отделены один от другого нижеследующими известными в данной области способами разделения. Рацемические соединения формулы (I), которые в достаточной степени являются основными или кислотными, могут быть превращены в соответствующие формы диастереомерной соли в результате реакции с подходящей хиральной кислотой, соответственно, с подходящим хиральным основанием. Указанные формы диастереомерной соли последовательно разделяли, например, с помощью селективной или фракционной кристаллизации, и энантиомеры высвобождали из них щелочью или кислотой. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает в себя жидкостную хроматографию с применением хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы также могут быть получены из соответствующих чистых стереохимически изомерных форм подходящих стартовых материалов при условии, что реакция протекает стереоспецифически. Предпочтительно, если требуется специфический стереоизомер, предпочтительно, чтобы указанное соединение было синтезировано стереоспецифическими способами получения. В таких способах будут с успехом применяться энантиомерно чистые стартовые материалы. Нижеследующие примеры предназначены для иллюстрации, но не ограничивая объема настоящего изобретения.- 10013595 Экспериментальная часть Ниже в настоящем документе "DCM" определяется как дихлорметан; "THF" определяется как тетрагидрофуран; "BuLi" определяется как н-бутиллитий; "EtOAc" определяется как этилацетат и "МеОН" определяется как метанол. А. Получение промежуточных соединений. Пример А 1. а) Получение промежуточного соединения 1 Рацемическая смесь Взаимодействие в атмосфере N2: раствор тиено[2,3-b][1]бензотиепин-4(5 Н)-он (0,03998 моль) в безводном THF (750 мл) охлаждали до 0 С, и затем порциями добавляли 60% гидрид натрия в минеральном масле (0,040 моль). Реакционную смесь встряхивали в течение 45 мин при 0 С, затем при комнатной температуре в течение 1 ч. После охлаждения до 0 С покапельно добавляли смесь 3-бром-1-пропена(0,40 моль) в обезвоженном THF (250 мл) и полученную смесь охлаждали при комнатной температуре в течение ночи. Добавляли воду и выпаривали органический раствор. Водный концентрат экстрагировали два раза DCM; органические слои объединяли, сушили (Na2SO4), раствор выпаривали (вакуум), получая на выходе 10,22 г промежуточного соединения 1.b) Получение промежуточного соединения 2 Рацемическая смесь цис/транс-диастереоизомеров 90/10 Раствор промежуточного соединения 1 (0,03744 моль) в THF (200 мл) охлаждали до 0 С и порциями добавляли тетрагидроборат натрия (0,045 моль). Через 10 мин покапельно добавляли МеОН (100 мл),реакционную смесь нагревали до комнатной температуры и затем встряхивали в течение ночи. Смесь охлаждали насыщенным водным раствором хлорида аммония и органический раствор выпаривали (вакуум). Водный концентрат дважды экстрагировали DCM; органические слои объединяли, промывали соляным раствором и водой и затем сушили (Na2SO4). Растворитель выпаривали (вакуум), осадок очищали с помощью хроматографии на короткой открытой колонке. Фракции с продуктом собирали и раствор выпаривали, получая (смесь изомеров: цис/транс 90/10) промежуточное соединение 2. с) Получение промежуточного соединения 3 Рацемическая смесь Раствор трифенилфосфина (0,073 моль) в THF (достаточное количество) встряхивали в N2 при 0 С,добавляли бис-(1-метилэтил)диазендикарбоксилат (0,071 моль) и полученную суспензию встряхивали в течение 0,5 ч. Раствор промежуточного соединения 2 (0,036 моль) и 4-нитробензойную кислоту (0,073 моль) в THF (достаточное количество) добавляли покапельно, реакционную смесь постепенно нагревали до комнатной температуры и встряхивали в течение 16 ч. Растворитель выпаривали и осадок растворяли в DCM, промывали водой и соляным раствором, затем сушили (Na2SO4). Растворитель выпаривали и осадок очищали с помощью препаративной высокоэффективной жидкостной хроматографии (элюат:EtOAc/гептан 2/8). Чистые фракции собирали и растворитель выпаривали, получая промежуточное соединение 3.d) Получение промежуточного соединения 4 Рацемическая смесь Смесь промежуточного соединения 3 (0,018 моль) встряхивали в THF (200 мл) при 0 С и затем покапельно добавляли смесь гидроксида лития (0,020 моль) в воде (50 мл). Реакционную смесь доводили до комнатной температуры в течение 16 ч и органический растворитель выпаривали. Водный концентрат промывали DCM; органический слой отделяли, сушили (Na2SO4) и растворитель выпаривали при пониженном давлении, получая в результате 5,43 г промежуточного соединения 4. е) Получение промежуточных соединений 5 и 6 промежуточное соединение 5 [2RS-(2,3 а,11b)] промежуточное соединение 6 [2RS-(2,3 а,11b)] бис-(Пиридин)йодоний тетрафторборат (0,0186 моль) добавляли порциями к смеси промежуточного соединения 4 (0,0169 моль) в DCM (достаточное количество) при комнатной температуре в атмосфере N2 и полученный раствор встряхивали в течение 1 ч, затем добавляли водный раствор тиосульфата натрия. Органический слой отделяли, сушили (Na2SO4) и растворитель выпаривали при пониженном давлении. Осадок очищали с помощью препаративной жидкостной хроматографии высокого разрешения. Фракции с продуктом собирали и растворитель выпаривали, получая 2,5 г промежуточного соединения 5 и 2,1 г промежуточного соединения 6. В. Получение конечных соединений. Пример В 1. Получение конечного соединения 1 (свободное основание) и 2 Смесь промежуточного соединения 5 (0,00127 моль), диметиламина (0,020 моль, 2 М в THF) и оксида кальция (0,100 г) в THF (10 мл) нагревали при 120 С (температура масляной бани) в корпусе реактора Парра в течение 8 ч и затем реакционную смесь охлаждали до комнатной температуры. Сухие вещества отфильтровывали и органический растворитель выпаривали. Полученный таким образом осадок очищали в коллекторе (вакуум), используя Sep-Pak картридж диоксида кремния (элюат: смесиDCM/(МеОН/NH3. Продукт фракций собирали и растворитель выпаривали до получения соединения 1,а именно свободного основания соединения 2. Осадок превращали в соль щавелевой кислоты посредством обработки щавелевой кислотой в диэтиловом эфире. Получающийся осадок отфильтровывали, промывали холодным диэтилэфиром и сушили, получая на выходе конечное соединение 2 (смесь диастереоизомеров 80/20). Пример В 2. Получение соединения 3 Смесь промежуточного соединения 6 (0,00145 моль), диметиламина 2 М в THF (0,020 моль) и окси- 12013595 да кальция (0,200 г) в THF (20 мл) нагревали в корпусе реактора Парра в течение 10 ч при 120 С (температура масляной бани), затем реакционную смесь охлаждали до комнатной температуры и сухие вещества отфильтровывали. Органический растворитель выпаривали и полученный таким образом осадок, взятый в DCM, промывали насыщенным водным раствором NaHCO3. Органический слой отделяли, сушили(Na2SO4), отфильтровывали и растворитель выпаривали. Остаточное масло очищали в коллекторе (вакуум), используя Sep-Pak картридж диоксида кремния (элюат: DCM/(МеОН/NH3. Продукт фракций собирали и растворитель выпаривали, получая на выходе конечное соединение 3. Пример В 3. Получение конечного соединения 4 Реакцию проводили в атмосфере N2: раствор конечного соединения 3 (0,00104 моль) в безводномTHF (15 мл) охлаждали до -78 С, и затем покапельно добавляли 1,6 М BuLi в гексане (0,0011 моль). Реакционную смесь встряхивали при -78 С в течение 35 мин, и добавляли диметилкарбонат (0,003 моль). Полученную смесь охлаждали до комнатной температуры в течение 1 ч, добавляли воду и органический слой выпаривали. Полученный таким образом осадок, взятый в DCM, промывали насыщенным водным раствором NaHCO3. Органический слой отделяли, сушили (Na2SO4), отфильтровывали и растворитель выпаривали. Полученный осадок очищали в коллекторе (вакуум), используя Sep-Pak картридж диоксида кремния. Продукт фракций собирали и растворитель выпаривали. Осадок затем очищали с помощью жидкостной хроматографии высокого разрешения. Продукт фракций собирали и растворитель выпаривали, получая на выходе конечное соединение 4. Пример B4. Получение конечного соединения 5 Смесь конечного соединения 4 (0,0004 моль) в THF (достаточное количество) встряхивали при комнатной температуре в атмосфере N2 и добавляли тетрагидроалюминат лития (0,00044 моль), затем реакционную смесь встряхивали в течение 2 ч и добавляли насыщенный водный раствор хлорида аммония. Органический слой отделяли, сушили (MgSO4), отфильтровывали и растворитель выпаривали. Осадок очищали с помощью хроматографии на короткой открытой колонке с силикагелем (элюат:DCM/MeOH 97/3). Продукт фракций собирали и растворитель выпаривали, получая на выходе 0,153 г конечного соединения 5. Физические данные соединений, полученных в примерах, представлены в следующих табл. 1-3. Данные LCMS, показанные в табл. 4, получены с помощью следующего способа. Градиент ВЭЖХ создавали с помощью HP 1100 от Agilent, с нагревателем колонки до 40 С. Поток от колонки проходит через фотодиодную установку-детектор (PDA) и затем разделяется на детектор рассеянного света (ELSD) и на масс-спектрометр Waters-Micromass Time of Flight (ToF) с источником электрораспылительной ионизации, приводимым в действие одновременно в положительном и отрицательном режиме ионизации. Обращенно-фазовую ВЭЖХ проводили на XDB-C18-картридже (3,5 мкм, 4,630 мм) от Agilent, со скоростью потока 1 мл/мин. Три мобильные фазы (мобильная фаза А: 0,5 г/л раствора аммония ацетата,мобильная фаза В: ацетонитрил; мобильная фаза С: метанол) подавали для протекания градиента в режиме от 80% А, 10% В, 10% С до 50% В и 50% С за 6,0 мин, до 100% В от 6,5 мин, удерживание до 7,0 мин и перекалибровка с 80% А, 10% В и 10% С до 7,6 мин, которая удерживалась до 9,0 мин. Использовали 5 мкл объем для инжекции. Масс-спектры высокого разрешения получали при сканировании от 100 до 750 за 1 с, со временем удерживания в 1 с. Напряжение на капилляре составляло 3 кВ, источник температуры поддерживали при 140 С. В качестве газа-рапылителя использовали азот. Коническое напряжение составляло 30 В для обоих режимов ионизации - и положительного, и отрицательного. Лейцин-энкефалин служил эталоном, используемым для распыления пучка. Сбор данных проводили на информационной системе WatersMicromass MassLynx-Openlynx. Все исходные максимумы масс соответствуют свободному основанию С. Фармакологические примеры. Пример С.1. Сродство связывания рецепторов 5HT2A и 5HT2C in vitro. Взаимодействие соединений формулы (I) с рецепторами 5HT2A и 5HT2C оценивали в экспериментах по связыванию радиолигандов in vitro. В основном радиолиганд низкой концентрации с высоким сродством связывания рецептора инкубировали с образцом препарата ткани, обогащенным, в частности, рецептором (1 на 5 мг ткани) в буферной среде (0,2 на 5 мл). Во время инкубации радиолиганды связывались с рецептором. Когда достигалось устойчивое связывание, связанная с рецептором радиоактивность отделялась от несвязанной радиоактивности и связанную с рецептором активность подсчитывали. Взаимодействие тестируемых соединений с рецепторами анализировали в экспериментах по конкурентному связыванию. Различные концентрации тестируемого соединения добавляли к инкубационной смеси, содержащей препарат ткани и радиолиганд. Связывание радиолиганда должно ингибироваться тестируемым соединением пропорционально его сродству связывания и его концентрации. Радиолиганд, используемый для сродства связывания с 5HT2A, представляет собой 3 Н-серотонин, а используемая ткань представляет собой лобное корковое вещество крысы. Радиолиганд, используемый для сродства связывания с 5HT2C, является 3 Н-мезулергином, а используемая ткань является сосудистой оболочкой глаза свиньи. Пример С.2. Установление ингибирования обратного захвата NET in vitro. Корковое вещество из мозга крысы собирали и гомогенизировали, используя гомогенизатор UltraTurrax T25 и Dual в ледяном буфере для гомогенизации, содержащем Tris, NaCl и KCl (50 мМ, 120 мМ и 5 мМ соответственно, рН 7,4), перед разбавлением соответствующего белка концентрацию оптимизировали для специфического и неспецифического связывания. Связывание проводили в присутствии радиоактивного лиганда [3 Н]никсозетина (NEN, NET-1084, специфическая активность -70 Ки/ммол), растворенного в ледяном буфере, содержащем Tris, NaCl и KCl (50 мМ, 300 мМ и 5 мМ соответственно,рН 7,4), до концентрации 20 нмоль/л. Подготовленный радиолиганд (50 мкл) инкубировали (60 мин,25 С) с препаратами мембран, предварительно разведенными до соответствующей концентрации белка(400 мкл), и с 50 мкл 10% DMSO в контроле, мазиндола (конечная концентрация 10-6 моль/л) или желаемого соединения. Мембраносвязывающую активность определяли путем фильтрации через коллекторPackard Filtermate на фильтрах GF/B Unifilterplates, промывали ледяным буфером Tris-HCl, содержащемNaCl и KCl (50 мМ, 120 мМ и 4 мМ; рН 7,4; 60,5 мл). Фильтры сушили в течение 24 ч перед добавлением сцинтилляционной жидкости. Сцинтилляционную жидкость оставляли для насыщения фильтров на 24 ч перед подсчетом в сцинтилляционном счетчике Topcount. Процент специфического связывания и кривые конкурентного связывания подсчитывали, используя программное обеспечение S-Plus(Insightiul). Пример С.3. Сродство к D2L-рецептору человека in vitro. Замороженные мембраны клеток СНО, трансфицированных дофамин D2L-рецептором человека,размораживали, быстро гомогенизировали, используя гомогенизатор Ultra-Turrax Т 25, и растворяли в- 17013595 буфере Tris-HCl, содержащем NaCl, CaCl2, MgCl2, KCl (50, 120, 2, 1, и 5 мМ соответственно, доведенном до рН 7,7 посредством HCl), до подходящей концентрации белка, оптимизированной для специфического и неспецифического связывания. Радиолиганд [3 Н]серотонин (NEN, специфическая активность-70 Ки/ммол) растворяли в буфере до концентрации 2 нмоль/л. Подготовленный радиолиганд (50 мкл),вместе с 50 мкл 10% DMSO в контроле, бутакламола (конечная концентрация 10-6 моль/л) или желаемого соединения, инкубировали (30 мин, 37 С) с 400 мкл подготовленного раствора мембран. Мембраносвязывающую активность фильтровали через коллектор Packard Filtermate на фильтрах GF/B Unifilterplates и промывали ледяным буфером Tris-HCl (50 мМ; рН 7,7; 60,5 мл). Фильтры сушили перед добавлением сцинтилляционной жидкости и просчитывали в сцинтилляционном счетчике Topcount. Процент специфического связывания и кривые конкурентного связывания подсчитывали, используя программное обеспечение S-Plus (Insightful). Результаты. Результаты вышеописанных исследований представлены в следующей таблице в виде значенийD. Примеры композиций. Выражение "активный ингредиент" (A.I.), используемое при описании данных примеров, относится к соединению формулы (I), его фармацевтически приемлемой аддитивной соли кислот, его стереохимически изомерной форме или его N-оксидной форме. Пример D.1. Раствор для перорального введения. Метил 4-гидроксибензоат (9 г) и пропил 4-гидроксибензоат (1 г) растворяли в кипящей очищенной воде (4 л). В 3 л данного раствора растворяли сначала 2,3-дигидроксибутандикарбоновую кислоту (10 г),а затем A.I (20 г). Последний раствор комбинировали с оставшейся частью упомянутого выше раствора и 1,2,3-пропантриолом (12 л) и к нему добавляли 70% раствор сорбита (3 л). Сахарат натрия (40 г) растворяли в воде (500 мл) и добавляли экстракт малины (2 мл) и крыжовника (2 мл). Последний раствор комбинировали с предыдущим, добавляли воду (достаточное количество до объема 20 л), получали раствор для перорального введения, содержащий 5 мг активного ингредиента на одну чайную ложку (5 мл). Полученный раствор отфильтровывали в подходящие емкости. Пример D.2. Таблетки с пленочным покрытием. Приготовление ядра таблетки.- 18013595 Смесь A.I. (100 г), лактозы (570 г) и крахмала (200 г) хорошо перемешивали, затем увлажняли раствором додецилсульфата натрия (5 г) и поливинилпирролидона (10 г) в воде (200 мл). Влажную порошковую смесь просеивали, сушили и просеивали снова. Затем добавляли микрокристаллическую целлюлозу (100 г) и гидрогенизированное растительное масло (15 г). Все хорошо перемешивали и спрессовывали в таблетки, получая 10000 таблеток, каждая из которых содержала по 10 мг активного ингредиента. Покрытие таблеток. К раствору метилцеллюлозы (10 г) в денатурированном этаноле (75 мл) добавляли раствор этилцеллюлозы (5 г) в дихлорметане (150 мл). Затем добавляли дихлорметан (75 мл) и 1,2,3-пролантриол(2,5 мл). Полиэтиленгликоль (10 г) расплавляли и растворяли в дихлорметане (75 мл). Последний раствор добавляли к предыдущему и затем добавляли октадеканоат магния (2,5 г), поливинилпирролидон (5 г) и концентрированную цветную суспензию (30 мл), все гомогенизировали. Ядра таблеток покрывали полученной таким образом смесью в устройстве для нанесения покрытия. Пример D.3. Раствор для инъекций. Метил 4-гидроксибензоат (1,8 г) и пропил 4-гидроксибензоат (0,2 г) растворяли в кипящей воде(500 мл) для инъекций. После охлаждения приблизительно до 50 С при непрерывном помешивании добавляли молочную кислоту (4 г), пропиленгликоль (0,05 г) и A.I. (4 г). Раствор охлаждали до комнатной температуры и дополняли количеством воды для инъекций, достаточным для доведения до 1000 мл, данный раствор содержит 4 мг/мл A.I. Раствор стерилизовали посредством фильтрации и наполняли стерильные емкости. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) его N-оксидная форма, фармацевтически приемлемая аддитивная соль или его стереохимически изомерная форма, гдеn представляет собой целое число, равное 1;i, j представляют собой целые числа, независимо друг от друга равные 0 или 1;r равно 0; каждый из R1 и R2 независимо друг от друга представляет собой водород или алкил, или R1 и R2,взятые вместе с атомом азота, к которому они присоединены, могут образовывать радикал следующей формулы: где р представляет собой целое число, равное 0 или 1;q представляет собой целое число, равное 1;m представляет собой целое число, равное 1 или 2; каждый R3 независимо друг от друга выбран из группы гидрокси, алкила, моно- или диалкиламино,или два R3-радикала могут образовывать вместе двухвалентный радикалR4 представляет собой алкил; А и В представляют собой, каждый независимо друг от друга, радикал арила или гетероарила, конденсированный с центральным кольцом и выбранный из группы тиенила и пиридинила, при условии, что по меньшей мере один из А и В является одним из вышеперечисленных радикалов гетероарила; каждый из R9 независимо друг от друга выбран из группы алкила и алкилоксикарбонила;R8 представляет собой арилалкил; арил представляет собой фенил или нафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, выбранными из группы галогена, нитро, циано, гидрокси, алкилокси или алкила; алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал,имеющий от 1 до 10 атомов углерода, циклический насыщенный углеводородный радикал, имеющий от 3 до 8 атомов углерода, или насыщенный углеводородный радикал, содержащий прямой или разветвленный фрагмент, имеющий от 1 до 10 атомов углерода, и циклический фрагмент, имеющий от 3 до 8 атомов углерода; каждый радикал необязательно замещен одним или более гидроксирадикалами; и галоген представляет собой фтор, хлор, бром и йод. 2. Соединение по п.1, отличающееся тем, что А представляет собой арил и В представляет собой тиенил, где S находится в положении 9 или 11. 3. Соединение по п.2, отличающееся тем, что X представляет собой S. 4. Соединение по п.1, отличающееся тем, чтоj представляет собой целое число, равное 0 или 1;R1 и R2 представляют собой, каждый независимо друг от друга, водород, метил, этил или гидроксиэтил; А представляет собой фенил; В представляет собой тиенил или пиридинил;X представляет собой СН 2, S или N-бензил. 5. Соединение по п.1, выбранное из группы, включающей 3,3 а,8,11b-тетрагидро-N-метил-2 Н-бензо[3,4]тиено[2',3':6,7]циклогепта[1,2-b]фуран-2-метанамин; 3,3 а,8,11b-тетрагидро-N,N-диметил-2 Н-бензо[3,4]тиено[2',3':6,7]циклогепта[1,2-b]фуран-2 метанамин; 2,3,3 а,11b-тетрагидро-N-метилтиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-метанамин; 2,3,3 а,11b-тетрагидро-N,N-диметилтиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-метанамин; 2-метил(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2 ил]метил]амино]этанол; 1-(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-4 пиперидинэтанол; 8-(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-1,4-диокса-8 азаспиро[4.5]декан; 1-(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-3-пирролидинол;N,N-диметил-1-(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-3 пирролидинамин; 4-(2,3,3 а,11b)тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-2-ил]метил]-1 пиперазинэтанол; этиловый эфир 2-[(диметиламино)метил]-2,3,3 а,11b-тетрагидротиено[2',3':2,3][1]бензотиепино[4,5b]фуран-10-карбоновой кислоты; метиловый эфир 2-[(диметиламино)метил]-2,3,3 а,11b-тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-10-карбоновой кислоты; 2-[(диметиламино)метил]-2,3,3 а,11b-тетрагидротиено[2',3':2,3][1]бензотиепино[4,5-b]фуран-10 метанол; 3,3 а,8,11b-тетрагидро-N,N-диметил-2 Н-бензо[3,4]тиено[3',2':6,7]циклогепта[1,2-b]фуран-2 метанамин и 3,3 а,8,12b-тетрагидро-N-метил-8-(фенилметил)-2 Н-фуро[2,3-d]пиридо[2,3-b][1]бензазепин-2 метанамин; или его N-оксидная форма, фармацевтически приемлемая аддитивная соль или его стереохимически изомерная форма. 6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель или растворитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-5. 7. Применение соединения по любому из пп.1-5 для изготовления лекарственного средства для предотвращения и/или лечения состояний, опосредованных 5HT2-рецептором, в частности 5HT2A- и 5HT2Cрецептором и D2-рецептором, а также ингибированием обратного захвата норэпинефрина. 8. Применение соединения по любому из пп.1-5 для изготовления лекарственного средства для лечения и/или предупреждения расстройств центральной нервной системы, подобных чувству страха; депрессии и умеренной депрессии; биполярных расстройств; расстройств сна и сексуальных нарушений; психозов; пограничных психозов; шизофрении; мигрени; изменений личности; расстройств, связанных с навязчивым неврозом; социальных фобий; приступов паники; расстройств внимания, органических психических нарушений; психических расстройств у детей; агрессии; расстройств памяти и нарушений- 20013595 осанки, особенно у пожилых людей; зависимости; ожирения, булимии и подобных расстройств. 9. Применение соединения по любому из пп.1-5 для изготовления лекарственного средства для лечения и/или предотвращения чувства страха, психоза, депрессии, биполярных расстройств, включая биполярную депрессию, мигрени и привыкания при злоупотреблении лекарствами. 10. Способ получения соединения формулы (I) по любому из пп.1-5, отличающийся Nалкилированием промежуточного соединения формулы (II), где R9, i, j, кольцо А, кольцо В и X имеют те же значения, которые определены для формулы (I), и где W представляет собой подходящую уходящую группу, амином формулы HNR1R2, где R1 и R2 имеют те же значения, что и в формуле (I), в реакционноинертном растворителе и необязательно в присутствии подходящего основания
МПК / Метки
МПК: A61P 25/30, A61K 31/381, A61K 31/55, A61P 3/04, C07D 495/04, A61P 25/24, A61P 25/22, A61K 31/38, C07D 491/14, A61P 25/18, C07D 495/14
Метки: гидрофурана, ингибиторов, производные, качестве, терапии, тетрациклические, цнс, расстройств, гетероциклические, 5нт2
Код ссылки
<a href="https://eas.patents.su/22-13595-geterociklicheskie-tetraciklicheskie-proizvodnye-gidrofurana-v-kachestve-ingibitorov-5nt2-v-terapii-rasstrojjstv-cns.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклические, тетрациклические производные гидрофурана в качестве ингибиторов 5нт2 в терапии расстройств цнс</a>
Предыдущий патент: 3,5-дизамещенные и 3,5,7-тризамещенные 3h-оксазоло- и 3h-тиазоло[4,5-d] пиримидин-2-оны и их пролекарства
Следующий патент: Фармацевтическая система доставки, содержащая окаперидон
Случайный патент: Сканирующий струйный нанолитограф и способ его работы