3,5-дизамещенные и 3,5,7-тризамещенные 3h-оксазоло- и 3h-тиазоло[4,5-d] пиримидин-2-оны и их пролекарства
Номер патента: 13594
Опубликовано: 30.06.2010
Авторы: Сян Алан Синь, Леннокс Джозеф Р., Хейли Грегори Дж., Веббер Стефен И., Руден Эрик Дж.
Формула / Реферат
1. Соединение формулы I
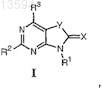
где X представляет собой атом кислорода или атом серы;
Y представляет собой атом кислорода или атом серы;
R1 представляет собой атом водорода, алкил, арил, циклоалкил или гетероциклил;
R2 представляет собой NH2, -NHC(O)R4, -NHR5, -N=CHNR6R7;
R3 представляет собой атом водорода или OR8;
R4 представляет собой -C1-C7-алкил или -О(C1-C7-алкил);
R5 представляет собой -C1-C7-алкил;
R6 и R7независимо представляют собой -C1-C7-алкил или вместе с атомом азота образуют 5- или 6-членное гетероциклическое кольцо;
R8 представляет собой -CHR9R10;
R9 представляет собой атом водорода, -C1-C7-алкил, циклоалкил, арил, гетероциклил, -NR11R12 или OR5;
R10 представляет собой -C1-C7-алкил, циклоалкил, арил, гетероциклил, -NR11R12 или OR5;
R11 и R12 независимо представляют собой атом водорода, -C1-C7-алкил или -C(O)R4;
где если X представляет собой атом кислорода, Y представляет собой атом серы и R3представляет собой атом водорода, Cl, Br или OR8, то R1 не является атомом водорода или b-D-рибозой или ее эфирами,
где вышеупомянутый алкильный, арильный, циклоалкильный или гетероциклильный фрагменты являются необязательно замещенными 1-4 заместителями, выбранными из атома водорода, алкиламина, амино, арила, циклоалкила, гетероциклила, C1-C6-алкила, C1-C6-галогеналкила, C1-C6-гидроксиалкила, C1-C6-алкокси, C1-C6-алкиламина, C1-C6-диалкиламина, C2-C6-алкенила или C2-C6-алкинила, где каждая из упомянутых групп может быть замещена одним или несколькими гетероатомами, карбоксилом, циано, атомом галогена, гидрокси, меркапто, нитро, тиоалкилом, -N=N-NH2, -C(O)2-(C1-C6-алкилом), -C(O)2-(арилом), -C(O)2-(циклоалкилом), -C(O)2-(гетероциклилом), -О-(C1-C6-галогеналкилом), -О-(C1-C6-алкил)арилом, -О-(C1-C6-алкил)циклоалкилом, -О-(C1-C6-алкил)гетероциклилом, -О-(C1-C6-алкил)амино, -О-(C1-C6-алкил)алкиламино, -О-(C1-C6-алкил)диалкиламино, -О-(C1-C6-алкил)-C(O)-амино, -О-(C1-C6-алкил)-C(O)-алкиламино, -О-(C1-C6-алкил)-S(О)2-амино, -О-(C1-C6-алкил)-S(О)2-алкиламино, -О-(C1-C6-алкил)-S(О)2-диалкиламино, -О-(C1-C6-алкил)-C(O)-диалкиламино, -О-арилом, -О-гетероциклилом, -NHC(О)-(C1-C6-алкилом), -NHC(О)-(C1-C6-алкенилом), -NHC(О)-(арилом), -NHC(О)-(циклоалкилом), -NHC(О)-(гетероциклилом), -NHC(О)-(C1-C6-алкил)арилом, -NHC(О)-(C1-C6-алкил)циклоалкилом, -NHC(О)-(C1-C6-алкил)гетероциклилом, -NHC(О)-(C1-C6-алкил)амино, -NHC(O)-(C1-C6-алкил)алкиламино, -NHC(О)-(C1-C6-алкил)диалкиламино, -NHC(О)-(C1-C6-алкил)C(O)амино, -NHC(О)-(C1-C6-алкил)-C(O)-алкиламино,
-NHC(О)-(C1-C6-алкил)-C(O)-диалкиламино, -NHC(О)-(C1-C6-алкил)-N(Н)-(C1-C6-алкил)C(O)2-(C1-C6-алкилом), -NH-(C1-C6-алкил)-C(O)-амино, -NH-(C1-C6-алкил)-C(O)-алкиламино, -NH-(C1-C6-алкил)-C(O)-диалкиламино, -NHC(О)-(C1-C6-алкил)S(О)2(C1-C6-алкилом), -NHC(О)-(C1-C6-алкил)-S-(гетероциклилом),
-NHS(О)2-(C1-C6-алкилом), -NHS(О)2-(арилом), -NH-(C1-C6-алкил)-S(О)2-амино, -NH-(C1-C6-алкил)-S(О)2-алкиламино, -NH-(C1-C6-алкил)-S(О)2-диалкиламино, -NHS(О)2-(циклоалкилом), -NHS(О)2-(гетероциклилом), -NHS(О)-(C1-C6-алкилом), -NHS(O)-(арилом), -NHS(О)-(циклоалкилом), -NHS(О)-(гетероциклилом), -NHS(C1-C6-алкилом), -NHS(арилом), -NHS-(циклоалкилом) и -NH-S-(гетероциклилом),
где каждый из вышеупомянутых заместителей может быть, кроме того, необязательно замещен 1-5 заместителями, выбранными из амино, C1-C6-алкиламино, C1-C6-диалкиламино, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкенила, C1-C6-гидроксила и C1-C6-гидроксиалкила,
где каждый необязательно замещен циано, атомом галогена и нитрогруппой;
или его фармацевтически приемлемая соль.
2. Соединение или фармацевтически приемлемая соль по п.1, в котором R2представляет собой NH2.
3. Соединение или фармацевтически приемлемая соль по п.2, в котором R3представляет собой атом водорода.
4. Соединение или фармацевтически приемлемая соль по п.3, в котором X представляет собой атом кислорода и Y представляет собой атом серы.
5. Соединение или фармацевтически приемлемая соль по п.4, в котором R1является выбранным из

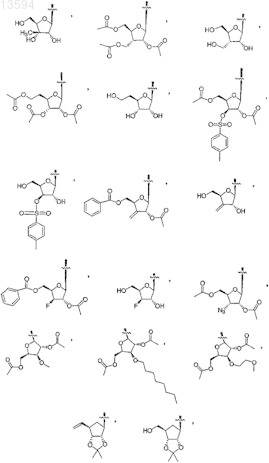
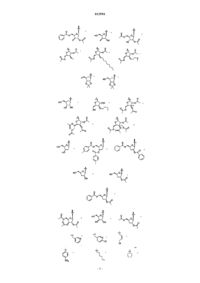
6. Соединение или фармацевтически приемлемая соль по п.1, выбранные из
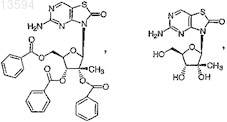
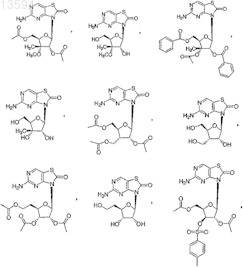
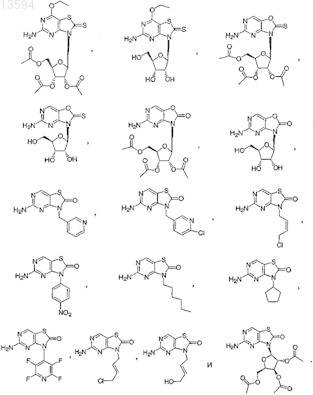
7. Соединение, выбранное из
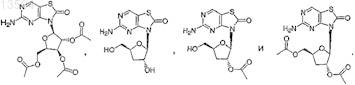
или его фармацевтически приемлемая соль.
8. Соединение по п.7, где соединение представлено формулой
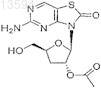
или его фармацевтически приемлемая соль.
9. Соединение формулы II
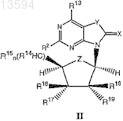
где X представляет собой атом кислорода или атом серы;
Y представляет собой атом кислорода или атом серы;
Z представляет собой атом кислорода или CH2;
R2 представляет собой -NH2, -NHC(O)R4, -NHR5, -N=CHNR6R7;
R4 представляет собой -C1-C7-алкил или -О(C1-C7-алкил);
R5 представляет собой -C1-C7-алкил;
R6 и R7независимо представляют собой -C1-C7-алкил или вместе с атомом азота образуют 5- или 6-членное гетероциклическое кольцо;
R13 представляет собой ОН или SH;
R14 представляет собой атом водорода, -CH2OH или -CH2-O-С(O)-C1-18-алкил;
R15 представляет собой ОН, алкенил, -OC(O)-C1-18-алкил, -OC(O)-арил или -OC(O) -гетероциклил;
R16, R17, R18 и R19 независимо представляют собой атом водорода, атом галогена, N3, алкил, -(CH2)mOR20,
-(CH2)m-OC(О)-C1-18-алкил, -ОС(O)-арил, -OS(O)2-арил или
R16 и R17 представляют собой алкенил или
R17 и R19, объединенные вместе, образуют диоксолановый цикл;
R20 представляет собой атом водорода или алкил;
m равно 0 или 1;
n равно 1 или 2;
где если R2 представляет собой NH2, то одно из нижеследующих должно присутствовать:
Z представляет собой CH2, или
n равно 2, или
m равно 1;
по меньшей мере один из R16, R17, R18 и R19 представляет собой атом галогена, N3, алкил или -(CH2)mOR20, где m равно 1, и при условии, что если R17 представляет собой N3, то R18 и R19 не являются атомами водорода, и если R17 представляет собой ОН и R16 и R19 представляют собой атомы водорода, то R18 не является F; или
R16 и R17 представляют собой алкенил,
где вышеупомянутый алкильный, арильный, циклоалкильный или гетероциклильный фрагменты являются необязательно замещенными 1-4 заместителями, выбранными из атома водорода, алкиламина, амино, арила, циклоалкила, гетероциклила, C1-C6-алкила, C1-C6-галогеналкила, C1-C6-гидроксиалкила, C1-C6-алкокси, C1-C6-алкиламина, C1-C6-диалкиламина, C2-C6-алкенила или C2-C6-алкинила,
где каждая из упомянутых групп может быть замещена одним или несколькими гетероатомами, карбоксилом, циано, атомом галогена, гидрокси, меркапто, нитро, тиоалкилом, -N=N-NH2, -C(O)2-(C1-C6-алкилом), -C(O)2-(арилом), -C(O)2-(циклоалкилом), -C(O)2-(гетероциклилом), -О-(C1-C6-галогеналкилом),
-О-(C1-C6-алкил)арилом, -О-(C1-C6-алкил)циклоалкилом, -О-(C1-C6-алкил)гетероциклилом, -О-(C1-C6-алкил)амино, -О-(C1-C6-алкил)алкиламино, -О-(C1-C6-алкил)диалкиламино, -О-(C1-C6-алкил)-C(O)-амино,
-О-(C1-C6-алкил)-C(O)-алкиламино, -О-(C1-C6-алкил)-S(О)2-амино, -О-(C1-C6-алкил)-S(О)2-алкиламино, -О-(C1-C6-алкил)-S(О)2-диалкиламино, -О-(C1-C6-алкил)-C(O)-диалкиламино, -О-арилом, -О-гетероциклилом,
-NHC(О)-(C1-C6-алкилом), -NHC(О)-(C1-C6-алкенилом), -NHC(О)-(арилом), -NHC(О)-(циклоалкилом),
-NHC(О)-(гетероциклилом), -NHC(О)-(C1-C6-алкил)арилом, -NHC(О)-(C1-C6-алкил)циклоалкилом, -NHC(О)-(C1-C6-алкил)гетероциклилом, -NHC(О)-(C1-C6-алкил)амино, -NHC(О)-(C1-C6-алкил)алкиламино, -NHC(О)-(C1-C6-алкил)диалкиламино, -NHC(O)-(C1-C6-алкил)С(O)амино, -NHC(О)-(C1-C6-алкил)-C(O)-алкиламино,
-NHC(О)-(C1-C6-алкил)-C(O)-диалкиламино, -NHC(О)-(C1-C6-алкил)-N(Н)-(C1-C6-алкил)-C(O)2-(C1-C6-алкилом), -NH-(C1-C6-алкил)-C(O)-амино, -NH-(C1-C6-алкил)-C(O)-алкиламино, -NH-(C1-C6-алкил)-C(O)-диалкиламино, -NHC(О)-(C1-C6-алкил)-S(О)2-C1-C6-алкилом), -NHC(О)-(C1-C6-алкил)-S-(гетероциклилом),
-NHS(О)2-(C1-C6-алкилом), -NHS(О)2-(арилом), -NH-(C1-C6-алкил)-S(О)2-амино, -NH-(C1-C6-алкил)-S(О)2-алкиламино, -NH-(C1-C6-алкил)-S(О)2-диалкиламино, -NHS(О)2-(циклоалкилом), -NHS(О)2-(гетероциклилом), -NHS(О)-(C1-C6-алкилом), -NHS(O)-(арилом), -NHS(О)-(циклоалкилом), -NHS(О)-(гетероциклилом), -NHS-(C1-C6-алкилом), -NHS-(арилом), -NHS-(циклоалкилом) и -NH-S-(гетероциклилом),
где каждый из вышеупомянутых заместителей может быть далее необязательно замещен 1-5 заместителями, выбранными из амино, C1-C6-алкиламино, C1-C6-диалкиламино, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкенила, C1-C6-гидроксила и C1-C6-гидроксиалкила,
где каждый необязательно замещен циано, атомом галогена и нитрогруппой;
либо его фармацевтически приемлемая соль или таутомер.
10. Соединение или его фармацевтически приемлемая соль или таутомер по п.9, в котором R2 представляет собой NH2.
11. Соединение или его фармацевтически приемлемая соль или таутомер по п.10, в котором R13 представляет собой ОН.
12. Соединение или его фармацевтически приемлемая соль или таутомер по п.11, в котором X представляет собой атом кислорода и Y представляет собой атом серы.
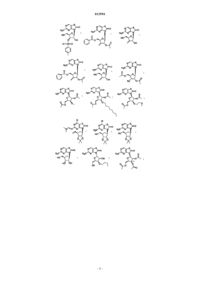
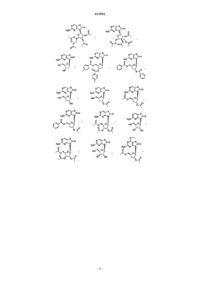
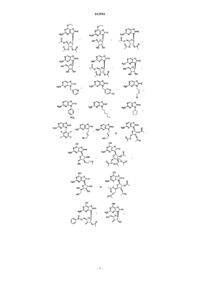
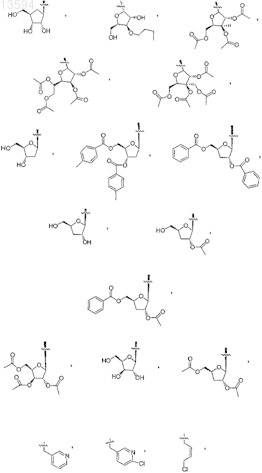
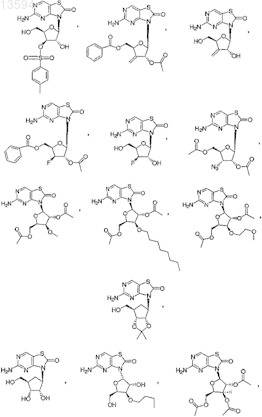
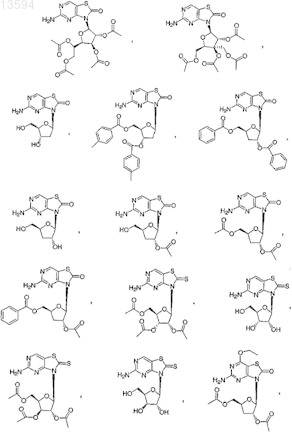
13. Соединение, выбранное из
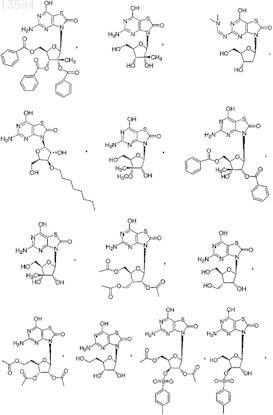
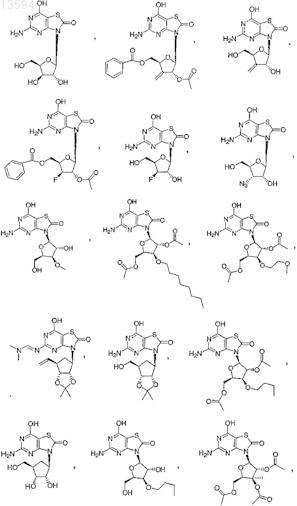
либо его фармацевтически приемлемая соль или таутомер.
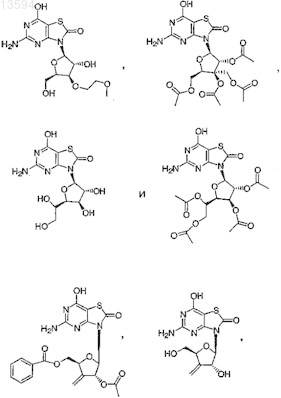
14. Соединение, выбранное из
либо его фармацевтически приемлемая соль или таутомер.
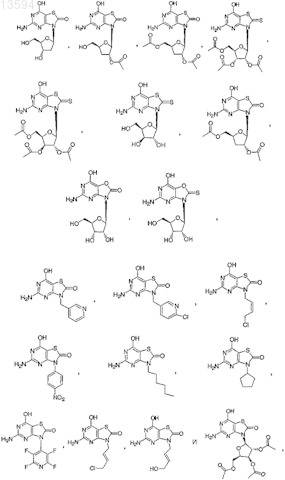
15. Соединение, выбранное из
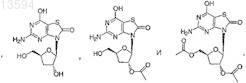
либо его фармацевтически приемлемая соль или таутомер.
16. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение по любому из пп.1-15 либо его фармацевтически приемлемую соль или таутомер.
17. Способ модулирования иммунных цитокиновых активностей у пациента, включающий введение пациенту терапевтически или профилактически эффективного количества соединения по любому из пп.1-15 либо его фармацевтически приемлемой соли или таутомера.
18. Способ лечения вирусной инфекции гепатита С у пациента, включающий введение пациенту терапевтически или профилактически эффективного количества соединения по любому из пп.1-15 либо его фармацевтически приемлемой соли или таутомера.
19. Способ лечения рака у пациента, включающий введение пациенту терапевтически эффективного количества соединения по любому из пп.1-15 либо его фармацевтически приемлемой соли или таутомера.
20. Способ по п.19, где рак выбирают из группы, состоящей из рака толстой кишки, мочевого пузыря, легких, простаты, желудка, карциномы поджелудочной железы, лимфобластомной лейкемии и миелоидной лейкемии.
Текст
013594 Изобретение относится к соединениям 3,5-дизамещенных и 3,5,7-тризамещенных- 3H-оксазоло- и 3H-тиазоло[4,5-d]пиримидин-2-онов и их пролекарствам, которые имеют иммуномодуляторную активность. Изобретение также относится к терапевтическому или профилактическому применению таких соединений и содержащих их фармацевтических композиций и к способам лечения описанных здесь болезней и расстройств путем назначения эффективных количеств таких соединений и пролекарств. В последние десятилетия были предприняты значительные усилия, направленные на выявление возможных терапевтических применений аналогов гуанина и их нуклеозидов. Ряд нуклеозидных аналогов продается в настоящее время в качестве антивирусных лекарств, включая ингибиторы HIV-обратной траскриптазы, такие как AZT, ddI, ddC, d4T, 3TC и аналог гуанозинового нуклеозида абакавир. Не будучи связанными определенной теорией, аналоги нуклеозидов могут предоставлять преимущества путем прямого ингибирования патогенного микроорганизма или опухоли, путем стимуляции иммунных функций организма-хозяина или некой комбинации этих или других механизмов. Один из изученных аналогов гуанозина с выявленной иммуномодуляторной активностью представляет собой 5-амино-3-(-D-рибофуранозилтиазоло[4,5-d]пиримидин-2,7(3H,6 Н)дион (7-тиа-8 оксогуанозин). Например, определенные пиримидо[4,5-d]пиримидиновые нуклеозиды впервые описаны в патенте США 5041542 от Robins et al. как являющиеся эффективными при лечении L1210 наBDFl-мыши. Кроме того, 3D-рибофуранозилтиазоло[4,5-d]пиримидины, обнаруживающие значительную иммунную активность, включая пролиферацию клеток селезенки мышей и активность in vivo к вирусу лихорадки леса Симлики (Semliki), впервые были описаны в патентах США 5041426 и 4880784 от Robins et al. Ряд публикаций также описывают негликозидные производные тиазоло[4,5d]пиримидинового фрагмента. См., например, патенты США 5994321 и 5446045; Revankar et al., J.,Het. Chem., 30, 1341-49 (1993); Lewis et al., J. Het. Chem., 32, 547-56 (1995). Настоящее изобретение описывает новые соединения 3,5-дизамещенных и 3,5,7-тризамещенных 3H-оксазоло- и 3H-тиазоло[4,5-d]пиримидин-2-онов, фармацевтически приемлемые соли, которые могут быть применены в качестве иммуномодуляторов. В целом изобретение относится к пролекарствам, которые представляют собой соединения 3,5-дизамещенных и 3,5,7-тризамещенных 3H-оксазоло- и 3H-тиазоло[4,5-d]пиримидин-2-онов формулы I где X представляет собой атом кислорода или атом серы;Y представляет собой атом кислорода или атом серы;R1 представляет собой атом водорода, алкил, арил, циклоалкил или гетероциклил;R3 представляет собой атом водорода, Cl, Br или OR8;R6 и R7 независимо представляют собой -C1-C7-алкил или вместе с атомом азота образуют 5- или 6 членное гетероциклическое кольцо;R9 представляет собой атом водорода, -C1-C7-алкил, циклоалкил, арил, гетероциклил, -NR11R12 или 5R11 и R12 независимо представляют собой атом водорода, -C1-C7-алкил или -C(O)R4; где если X представляет собой атом кислорода, Y представляет собой атом серы и R3 представляет собой атом водорода, Cl, Br или OR8, то R1 не является атомом водорода или -D-рибозой или ее эфирами,где вышеупомянутый алкильный, арильный, циклоалкильный или гетероциклильный фрагменты являются необязательно замещенными 1-4 заместителями, выбранными из атома водорода, алкиламина,амино, арила, циклоалкила, гетероциклила, C1-C6-алкила, C1-C6-галогеналкила, C1-C6-гидроксиалкила,C1-C6-алкокси, C1-C6-алкиламина, C1-C6-диалкиламина, C2-C6-алкенила или C2-C6-алкинила,где каждая из упомянутых групп может быть замещена одним или несколькими гетероатомами,карбоксилом, циано, атомом галогена, гидрокси, меркапто, нитро, тиоалкилом, -N=N-NH2, -C(O)2-(C1-C6 алкилом), -C(O)2-(арилом), -C(O)2-(циклоалкилом), -C(O)2-(гетероциклилом), -О-(C1-C6-галогеналкилом),-О-(C1-C6-алкил)арилом, -О-(C1-C6-алкил)циклоалкилом, -О-(C1-C6-алкил)гетероциклилом, -O-(C1-C6 алкил)амино, -О-(C1-C6-алкил)алкиламино, -О-(C1-C6-алкил)диалкиламино, -О-(C1-C6-алкил)-C(O)-амино,-О-(C1-C6-алкил)-C(O)-алкиламино, -О-(C1-C6-алкил)-S(О)2-амино, -О-(C1-C6-алкил)-S(О)2-алкиламино,-О-(C1-C6-алкил)-S(О)2-диалкиламино, О-(C1-C6-алкил)-C(O)-диалкиламино, -O-арилом, -О-гетероциклилом, -NHC(O)-(C1-C6-алкилом), -NHC(О)-(C1-C6-алкенилом), -NHC(O)-(арилом), -NHC(О)-(циклоалкилом), -NHC(О)-(гетероциклилом), -NHC(О)-(C1-C6-алкил)арилом, -NHC(О)-(C1-C6-алкил)цикло-1 013594 алкилом, -NHC(О)-(C1-C6-алкил)гетероциклилом, -NHC(О)-(C1-C6-алкил)амино, NHC(О)-(C1-C6-алкил)алкиламино, -NHC(О)-(C1-C6-алкил)диалкиламино, -NHC(О)-(C1-C6-алкил)-C(O)-амино, -NHC(О)-(C1-C6 алкил)-C(O)-алкиламино, -NHC(О)-(C1-C6-алкил)-C(O)-диалкиламино, -NHC(О)-(C1-C6-алкил)-N(Н)-(C1C6-алкил)-C(O)2-(C1-C6-алкилом), -NH-(C1-C6-алкил)-C(O)-амино, -NH-(C1-C6-алкил)-C(O)-алкиламино,-NH-(C1-C6-алкил)-С(О)-диалкиламино, -NHC(О)-(C1-C6-алкил)-S(О)2-(C1-C6-алкилом), -NHC(О)-(C1-C6 алкил)-S-(гетероциклилом), -NHS(О)2-(C1-C6-алкилом), -NHS(О)2-(арилом), -NH-(C1-C6-алкил)-S(О)2 амино, -NH-(C1-C6-алкил)-S(О)2-алкиламино, -NH-(C1-C6-алкил)-S(О)2-диалкиламино, -NHS(О)2-(циклоалкилом), -NHS(О)2-(гетероциклилом), -NHS(О)-(C1-C6-алкилом), -NHS(О)-(арилом), -NHS(О)-(циклоалкилом), -NHS(О)-(гетероциклилом), -NHS-(C1-C6-алкилом), -NHS-(арилом), -NHS-(циклоалкилом) и-NH-S-(гетероциклилом),где каждый из вышеупомянутых заместителей может быть, кроме того, необязательно замещен 1-5 заместителями, выбранными из амино, C1-C6-алкиламино, C1-C6-диалкиламино, C1-C6-алкила,C1-C6-алкокси, C1-C6-алкенила, C1-C6-гидроксила и C1-C6-гидроксиалкила,где каждый необязательно замещен циано, атомом галогена и нитрогруппой; или их фармацевтически приемлемые соли. В одном варианте осуществления изобретение относится к соединениям формулы I, гдеR2 представляет собой NH2. В другом варианте осуществления изобретение относится к соединениям формулы I, гдеR3 представляет собой атом водорода. В другом варианте осуществления изобретение относится к соединениям формулы I, гдеX представляет собой атом кислорода и Y представляет собой атом серы. В другом варианте осуществления изобретение относится к соединениям формулы I, где В другом варианте осуществления изобретение относится к соединениям формулы I, выбранным из-7 013594 В следующем общем аспекте изобретение относится к соединениям 3,5-дизамещенных и 3,5,7-тризамещенных 3H-оксазоло- и 3H-тиазоло[4,5-d]пиримидин-2-онов формулы II где X представляет собой атом кислорода или атом серы;Y представляет собой атом кислорода или атом серы;Z представляет собой атом кислорода или CH2;R6 и R7 независимо представляют собой -C1-C7-алкил или вместе с атомом азота образуют 5- или 6 членное гетероциклическое кольцо;R13 представляет собой ОН или SH;R14 представляет собой атом водорода, -CH2OH или -CH2-O-С(O)-C1-18-алкил;R16, R17, R18 и R19 независимо представляют собой атом водорода, атом галогена, N3, алкил,-(CH2)mOR20, -(CH2)mOC(O)-C1-18-алкил, -ОС(O)-арил, -OS(O)2-арил; илиR20 представляет собой атом водорода или алкил;n равно 1 или 2; где если R2 представляет собой NH2, то должно выполняться одно из нижеследующих:n=2 или m=1; по меньшей мере один из R16, R17, R18 и R19 представляет собой атом галогена, N3, алкил или-(CH2)mOR20, где m равно 1, и при условии, что R17 представляет собой N3, то R18 и R19 не являются атомами водорода; и где если R17 представляет собой ОН и R16 и R19 представляют собой атомы водорода, то R18 не является F; илиR16 и R17 представляют собой алкенил,где вышеупомянутый алкильный, арильный, циклоалкильный или гетероциклильный фрагменты необязательно замещены 1-4 заместителями, выбранными из атома водорода, алканоила,алкиламина, амино, арила, циклоалкила, гетероциклила, азидо, C1-C6-алкила, C1-C6-галогеналкила,C1-C6-гидроксиалкила, C1-C6-алкокси, C1-C6-алкиламина, C1-C6-диалкиламина, C2-C6-алкенила илиC2-C6-алкинила,где каждая из упомянутых групп может быть замещена одним или несколькими гетероатомами,карбоксилом, циано, атомом галогена, гидрокси, меркапто, нитро, тиоалкилом, -N=N-NH2, -C(O)2-(C1-C6 алкилом), -C(O)2-(арилом), -C(O)2-(циклоалкилом), -C(O)2-(гетероциклилом), -О-(C1-C6-галогеналкилом),-О-(C1-C6-алкил)арилом, -О-(C1-C6-алкил)циклоалкилом, -О-(C1-C6-алкил)гетероциклилом, -O-(C1-C6 алкил)амино, -О-(C1-C6-алкил)алкиламино, -О-(C1-C6-алкил)диалкиламино, -О-(C1-C6-алкил)-C(O)-амино,-О-(C1-C6-алкил)-C(O)-алкиламино, -О-(C1-C6-алкил)-S(О)2-амино, -О-(C1-C6-алкил)-S(О)2-алкиламино,-О-(C1-C6-алкил)-S(О)2-диалкиламино, -О-(C1-C6-алкил)-C(O)-диалкиламино, -О-арилом, -О-гетероциклилом,-NHC(O)-(C1-C6-алкилом), -NHC(О)-(C1-C6-алкенилом), -NHC(O)-(арилом), -NHC(О)-(циклоалкилом),-NHC(О)-(гетероциклилом), -NHC(О)-(C1-C6-алкил)арилом, -NHC(О)-(C1-C6-алкил)циклоалкилом, NHC(О)(C1-C6-алкил)гетероциклилом, -NHC(О)-(C1-C6-алкил)амино, NHC(О)-(C1-C6-алкил)алкиламино, -NHC(О)(C1-C6-алкил)диалкиламино, -NHC(О)-(C1-C6-алкил)-C(O)-амино, -NHC(О)-(C1-C6-алкил)-C(O)-алкиламино,-NHC(О)-(C1-C6-алкил)-C(O)-диалкиламино,-NHC(О)-(C1-C6-алкил)-N(Н)-(C1-C6-алкил)-C(O)2-(C1-C6 алкилом), -NH-(C1-C6-алкил)-C(O)-амино, -NH-(C1-C6-алкил)-C(O)-алкиламино, -NH-(C1-C6-алкил)-C(O)диалкиламино, -NHC(О)-(C1-C6-алкил)-S(О)2-(C1-C6-алкилом), -NHC(О)-(C1-C6-алкил)-S-(гетероциклилом),-NHS(О)2-(C1-C6-алкилом), -NHS(О)2-(арилом), -NH-(C1-C6-алкил)-S(О)2-амино, NH-(C1-C6-алкил)-S(О)2 алкиламино, -NH-(C1-C6-алкил)-S(О)2-диалкиламино, -NHS(О)2-(циклоалкилом), -NHS(О)2-(гетероциклилом),-NHS(О)-(C1-C6-алкилом), -NHS(О)-(арилом), -NHS(О)-(циклоалкилом), -NHS(О)-(гетероциклилом), -NHS(C1-C6-алкилом), -NHS-(арилом), -NHS(циклоалкилом) и -NH-S-(гетероциклилом),-8 013594 где каждый из вышеупомянутых заместителей может быть далее необязательно замещен 1-5 заместителями, выбранными из амино, C1-C6-алкиламино, C1-C6-диалкиламино, C1-C6-алкила, C1-C6-алкокси,C1-C6-алкенила, C1-C6-гидроксила и C1-C6-гидроксиалкила,где каждый необязательно замещен циано, атомом галогена и нитрогруппой; или к их фармацевтически приемлемым солям, гидратам или стереоизомерам. В следующем варианте осуществления изобретение относится к соединениям формулы II, гдеR2 представляет собой NH2. В следующем варианте осуществления изобретение относится к соединениям формулы II, гдеR13 представляет собой ОН. В следующем варианте осуществления изобретение относится к соединениям формулы II, гдеX представляет собой атом кислорода и Y представляет собой атом серы. В следующем варианте осуществления изобретение относится к соединениям формулы II, выбранным из- 10013594 В следующем общем аспекте изобретение относится к соединениям 3,5-дизамещенных и 3,5,7-тризамещенных 3H-оксазоло- и 3H-тиазоло[4,5-d]пиримидин-2-онов, выбранным из Также описаны оптимальные способы получения соединений по изобретению. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть применены как усилители иммунной системы и имеют определенные свойства по отношению к иммунной системе, включая модуляцию, митогенность, усиление и/или потенцирование; или они являются промежуточными соединениями для соединений, которые имеют эти свойств. Соединения, для которых предполагается наличие эффектов, по меньшей мере, на природные клетки-киллеры, макрофаги, дендритные или лимфоцитные клетки иммунной системы хозяина. Благодаря этим свойствам они могут быть применены как антивирусные и антиопухолевые агенты или как промежуточные соединения для антивирусных и антиопухолевых агентов. Они могут быть применены для лечения инфицированного индивидуума путем применения в качестве активных компонентов приемлемых фармацевтических композиций. В одном аспекте изобретения пролекарства формулы I, соединения формулы II и другие соединения по изобретению применяются для лечения всего диапазона вирусных заболеваний у млекопитающих,включая людей, путем назначения млекопитающему терапевтически эффективного количества соединений. Вирусные заболевания, которые, как предполагается, излечиваются соединениями по изобретению,включают острые и хронические инфекции, вызываемые как РНК- и ДНК-вирусами. Без ограничения любым образом диапазона вирусных инфекций, которые могут излечиваться, пролекарства формулы I,соединения формулы II и другие соединения по изобретению особенно применимы при лечении инфекций, вызываемых аденовирусом, цитомегаловирусом, вирусом гепатита A (HAV), вирусом гепатита В(HBV), флавивирусами, включая вирус желтой лихорадки и вирус гепатита С (HCV), простым герпесом 1- и 2-го типов, опоясывающим герпесом, человеческим вирусом герпеса 6, вирусом иммунодефицита человека (HIV), вирусом папиломы человека (HPV), вирусом инфлюэнцы А, вирусом инфлюэнцы В, корью, вирусом параинфлюэнцы, вирусом полимиелита, поксвирусом (включая оспу и вирус обезьяньей оспы), риновирусом, респираторно-синцитиальным вирусом (RSV), множественными семействами вирусов, которые вызывают геморрагические лихорадки, включая аренавирусы (LCM, вирус Джанина (Junin),вирус Мачупа (Machup), вирус Гуанарито (Guanarito) и Ласса-лихорадку, буньявирусы (вирусы Ханта(Hanta) и лихорадка Рифт-Валли) и филовирусы (вирус Эбола и Марбурга (Marburg, серией вирусных энцефалитов, включая вирус энцефалита Западного Нила, вирусом Лакросса (LaCrosse), вирусом калифорнийского энцефалита, вирусом венесуэльского конского энцефалита, вирусом восточного конского энцефалита, вирусом западного конского энцефалита, вирусом японского энцефалита, лесным вирусом Кусанура (Kysanur) и клещевыми вирусами, такими как вирус конго-крымской геморрагической лихорадки. В следующем аспекте изобретения пролекарства формулы I, соединения формулы II и другие соединения по изобретению применяются для лечения бактериальных, грибковых и протозойных инфекций у млекопитающих путем назначения млекопитающему терапевтически эффективного количества соединений. Полный диапазон патогенных микроорганизмов, которые, как предполагается, чувствительны к лечению соединениями по настоящему изобретению, включает без ограничения те организмы, которые являются устойчивыми к антибиотикам. Способность соединений к активации многочисленных компонентов иммунной системы обходит механизмы устойчивости, обычно наблюдаемые как уменьшающие восприимчивость к антибиотикам, и, таким образом, лечение пролекарствами формулы I, соединениями формулы II и другими соединениями по изобретению инфекций у млекопитающего, вызываемых такими устойчивыми микроорганизмами, является характерным применением настоящего изобретения. В следующем аспекте изобретения пролекарства формулы I, соединения формулы II и другие соединения по изобретению применяются для лечения опухолей у млекопитающих путем назначения млекопитающему терапевтически эффективного количества соединений. Опухоли или рак, предполагаемые быть излечиваемыми, включают, без ограничения, те, что вызываются вирусом, и эффект может включать в себя торможение превращения инфицированных вирусом клеток в неопластическое состояние,торможение распространения вирусов из трансформированных клеток в другие нормальные клетки,и/или остановку роста трансформированных вирусом клеток. Соединения по изобретению, как ожидается, могут быть применены против широкого спектра опухолей, включая, без ограничения, карциномы,саркомы и лейкемии. Включенными в такой класс являются карциномы груди, толстой кишки, мочевого пузыря, легкого, простаты, желудка и панкреатической железы и лимфобластомная и миелоидная лейкемии. В следующем аспекте изобретения способ лечения млекопитающего включает назначение терапевтически и/или профилактически эффективного количества фармацевтического препарата, содержащего соединение по изобретению. В этом аспекте эффект может относиться к модуляции некоторой части иммунной системы млекопитающего, особенно модуляции цитокиновых активностей Th1 и Th2, включая без ограничения семейство интерлейкинов, например от IL-1 до IL-12, и других цитокинов, таких какTNF-, и интерферонов, включая альфа-интерферон, бета-интерферон и гамма-интерферон, и их следующие по каскаду эффекторы. Когда имеет место модуляция Th1 и Th2 цитокинов, предполагается, что модуляция может включать стимуляцию как Th1, так и Th2, подавление как Th1, так и Th2, стимуляцию или Th1, или Th2 и подавление других или бимодальную модуляцию, в которой один эффект на Th1/Th2 уровни (такой как общее подавление) имеет место при высокий концентрации, в то время как другой эффект (такой как стимуляция или Th1, или Th2 и подавление других) имеет место при более низкой концентрации. В следующем аспекте изобретения фармацевтические композиции, содержащие пролекарство формулы I, соединение формулы II или другое соединение по изобретению, назначали в терапевтически эффективной дозе млекопитающему, которое получало антиинфекционные лекарства, не включенные в соединения по изобретению. В предпочтительном аспекте этого изобретения фармацевтические композиции, содержащие пролекарство формулы I, соединение формулы II или другое соединение по изобретению, назначали в терапевтически эффективной дозе с антиинфекционным лекарством(ами), которые действуют прямо на инфицирующий агент для торможения роста или уничтожения инфицирующего агента. В следующем аспекте изобретение включает способ лечения или предотвращения инфекции вируса гепатита С у млекопитающего, предпочтительно у человека, имеющего такую необходимость. В следующем аспекте изобретение включает способ лечения или предотвращения инфекции вируса гепатита С у пациента, имеющего такую необходимость, включающий введение пациенту терапевтически или профилактически эффективного количества пролекарства формулы I, соединения формулы II или другого соединения по изобретению и фармацевтически приемлемого наполнителя, носителя или переносчика.- 12013594 В следующем аспекте изобретение включает способ лечения или предотвращения инфекции вируса гепатита С у пациента, имеющего такую необходимость, включающий введение пациенту терапевтически или профилактически эффективного количества соединения пролекарства формулы I, соединения формулы II или другого соединения по изобретению и дополнительного терапевтического агента, предпочтительно дополнительного антивирусного агента или противоопухолевого агента, который соответствует предполагаемому применению. В предпочтительном аспекте изобретения фармацевтическая композиция, включающая терапевтически эффективное количество пролекарства формулы I, предоставляет улучшенную пероральную доступность и назначается в качестве иммуномодулятора. В другом предпочтительном аспекте изобретения фармацевтическая композиция, включающая терапевтически эффективное количество пролекарства формулы I по изобретению, обеспечивает маскировку активной структуры агента, проникновение через покрывающую желудок лимфоидную ткань, таким образом минимизирует активацию этой ткани и делает возможным улучшенную пероральную переносимость. Фиг. 1 представляет график IFN- (пг/мл), индуцируемого в человеческих РВМС-клетках соединением 134 относительно IFN- (пг/мл), индуцируемого идентичной концентрацией изаторибина. Фиг. 2 представляет график IFN- (пг/мл), индуцируемого в человеческих РВМС-клетках соединением 122 относительно IFN- (пг/мл), индуцируемого идентичной концентрацией изаторибина. Если следующие термины применяются в этом описании, то они применяются, как определено ниже. Термины "включающий" и "включая" применяются здесь в их широком, не ограничивающем смысле. Термин "пиримидин" относится к азотным моноциклическим гетероциклам. Термин "алкил", применяемый здесь, пока не указано иное, включает насыщенные одновалентные углеводородные радикалы, имеющие линейные, разветвленные или циклические фрагменты (включая конденсированные и мостиковые бициклические и спироциклические фрагменты) или комбинации вышеупомянутых фрагментов. Алкильная группа, имеющая циклические фрагменты, должна иметь по меньшей мере три атома углерода. Термин "алкенил", применяемый здесь, пока не указано иное, включает алкильные фрагменты,имеющие по меньшей мере одну углерод-углеродную двойную связь, где алкил определен выше, включая Е- и Z-изомеры упомянутого алкенильного фрагмента. Применяемый здесь термин "алкинил", пока не указано иное, включает алкильные фрагменты,имеющие по меньшей мере одну углерод-углеродную тройную связь, где алкил определен выше. Применяемый здесь термин "алкокси", пока не указано иное, включает О-алкильные группы, где алкил определен выше. Термин "Me" обозначает метил, "Et" обозначает этил, "Ас" обозначает ацетил, "Bz" обозначает бензоил и "Tol" обозначает толуоил. Термин "циклоалкил", применяемый здесь, пока не указано иное, относится к неароматическому,насыщенному или частично насыщенному, моноциклическому или конденсированному, спиро- или неконденсированному бициклическому или трициклическому углеводороду, описываемому здесь как содержащий всего от 3 до 10 атомов углерода, предпочтительно 5-8 кольцевых атомов углерода. Типичные циклоалкилы включают моноциклические кольца, имеющие 3-7, предпочтительно 3-6 атомов углерода,такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и подобные. Иллюстративные примеры циклоалкила являются произведенными от, без ограничения, нижеследующих: Термин "арил", применяемый здесь, пока не указано иное, включает органический радикал, произведенный от ароматического углеводорода путем удаления одного водорода, такой как фенил или нафтил. Термин "гетероциклил" или "гетероциклический", применяемый здесь, пока не указано иное, включает ароматические (например, гетероарил) и неароматические гетероциклические группы, содержащие от 1 до 4 гетероатомов, где каждый является выбранным из О, S и N и где каждая гетероциклическая группа имеет 4-10 атомов в ее циклической системе, с условием, что цикл упомянутой группы не содержит два соседних атома кислорода или серы. Неароматические гетероциклические группы включают группы, имеющие только 4 атома в их циклической системе, но ароматические гетероциклические группы должны иметь по меньшей мере 5 атомов в их циклической системе. Гетероциклические группы- 13013594 включают бензоконденсированные циклические системы. Примером 4-членной гетероциклической группы является азетидинил (произведенный от азетидина). Примером 5-членной гетероциклической группы является тиазолил и примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил,2-пирролинил, 3-пирролинил, индолинил, 2 Н-пиранил, 4 Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил,имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, 3H-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил,изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил,оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил,хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Где это возможно, вышеупомянутые группы, как и произведенные от групп, перечисленных выше, могут быть С-присоединенными или(N-присоединенным) или пиррол-3-илом (С-присоединенным). Далее, группа, произведенная от имидазола, может быть имидазол-1-илом (N-присоединенным) или имидазол-3-илом (С-присоединенным). 4-10-звенный гетероцикл может быть необязательно замещен при любом циклическом атоме(ах) углерода, серы или азота одной или двумя оксогруппами, считая на цикл. Примером гетероциклической группы, где 2 циклических атома углерода замещены оксофрагментами, является 1,1-диоксотиоморфолинил. Другие иллюстративные примеры 4-10-звенных гетероциклов являются произведенными от, без ограничения, нижеследующих: Термин "иммуномодулятор" относится к природным или синтетическим продуктам, способным модифицировать нормальную или отклоняющуюся от нормы иммунную систему через стимуляцию или подавление. Термин "предотвращение" здесь относится к способности соединения или композиции по изобретению к предотвращению болезни, идентифицированной у пациентов, уже диагностированных как имеющих заболевание или находящихся в зоне риска развития такого заболевания. Термин также включает предотвращение дальнейшей прогрессии болезни пациентов, которые уже страдают или имеют симптомы такой болезни.- 14013594 Термин "пациент" или "субъект" обозначает животное (например, корову, лошадь, овцу, свинью,курицу, индюка, перепелку, кошку, собаку, мышь, крысу, кролика, морскую свинку и т.д.) или млекопитающее, включая химерных и трансгенных животных и млекопитающих. При лечении или профилактикеHCV-инфекции термин "пациент" или "субъект" предпочтительно обозначает обезьяну или человека,наиболее предпочтительно человека, в специфическом варианте осуществления пациент или субъект является инфицированным или пораженным вирусом гепатита С. В определенных вариантах осуществления пациент представляет собой младенца человека (возраст 0-2), ребенка (возраст 2-17), подростка(возраст 12-17), взрослого (возраст 18 и более) или старика (возраст 70 и более). Кроме того, пациент включает иммунодефицитных пациентов, таких как HIV-положительные пациенты, раковые пациенты,пациенты, проходящие иммунотерапию или химиотерапию. В конкретном варианте осуществления пациент представляет собой здорового индивидуума, т.е. не обнаруживающего симптомов других вирусных инфекций. Термин "терапевтически эффективное количество" относится к количеству соединения по изобретению, достаточному для предоставления преимущества при лечении или предотвращении вирусного заболевания, для задержки или минимизирования симптомов, ассоциированных с вирусной инфекцией или индуцированных вирусом болезнью, или для исцеления или искоренения болезни или инфекции или их причины. В частности, терапевтически эффективное количество обозначает количество, достаточное для предоставления терапевтического преимущества in vivo. Применяемый в отношении к количеству соединения по изобретению термин "предпочтительно" включает нетоксичное количество, которое улучшает общую терапию, уменьшает или избегает симптомов или причин болезни, или увеличивает терапевтическую эффективность, или синергически действует с другим терапевтическим агентом. Термин "профилактически эффективное количество" относится к количеству соединения по изобретению или другому активному компоненту, достаточному для получения результата предотвращения инфекции, рецидива или распространения вирусной инфекции. Профилактически эффективное количество может относиться к количеству, достаточному для предотвращения начальной инфекции, или рецидива, или распространения инфекции или болезни, ассоциированной с инфекцией. Примененный в отношении количества соединения по изобретению термин "предпочтительно" включает нетоксичное количество, которое улучшает общую картину профилактики, или усиливает профилактическую эффективность, или действует синергически с другим профилактическим или терапевтическим агентом. Термин "в комбинации" относится к применению более чем одного профилактического и/или терапевтического агентов одновременно или последовательно и таким образом, что их соответствующие эффекты суммируются или являются синергическими. Термин "лечение" относится к следующему:(i) предотвращение болезни, расстройства или состояния от появления в животном, которое может быть предрасположено к болезни, расстройству и/или состоянию, но еще не может быть диагностировано как имеющее его;(iii) исцеление от болезни, расстройства или состояния, т.е. достижение ослабления болезни, расстройства и/или состояния. Термины и указывают на специфическую стереохимическую конфигурацию заместителя при асимметрическом атоме углерода в химической структуре, как изображено. Соединения по изобретению могут проявлять явление таутомерии. В то время как нарисованные формулы не могут точно обозначать все возможные таутомерные формы, понятно, что они предназначены представлять любую таутомерную форму изображенного соединения и не являются ограниченными единственно только специфической формой соединения, изображенной приведенными формулами. Например, понятно, что для формулы II, не взирая на то, показан или нет любой из двух заместителей в его енольной или кетонной форме, они изображают то же соединение (как изображено в примере ниже) Некоторые из соединений по изобретению могут существовать как отдельные стереоизомеры (т.е.,по существу, свободные от других стереоизомеров), рацематы и/или смеси энантиомеров и/или диастереомеров. Все такие отдельные стереоизомеры, рацематы и их смеси предназначены находиться в пределах объема настоящего изобретения. Предпочтительно соединения по изобретению, которые являются оптически активными, применяются в оптически чистой форме. Как в целом понятно специалистам в данной области, оптически чистое соединение, имеющее один хиральный центр (т.е. один асмметрический атом углерода), является соединением, которое образовано,по существу, одним из двух возможных энантиомеров (т.е. является энантиомерно чистым), и оптически чистое соединение, имеющее более чем один хиральный центр, представляет собой соединение, которое- 15013594 является как диастереомерно чистым, так и энантиомерно чистым. Предпочтительно соединения по настоящему изобретению применяются в форме, которая является по меньшей мере на 90% оптически чистой, т.е. в форме, которая содержит по меньшей мере 90% отдельного изомера (80% энантиомерного избытка ("е.е.") или диастереомерного избытка ("d.e.", более предпочтительно по меньшей мере 95% (90% е.е. или d.e.), даже более предпочтительно по меньшей мере 97,5% (95% е.е. или d.e.) и наиболее предпочтительно по меньшей мере 99% (98% е.е. или d.e.). Кроме того, пролекарства формулы I, соединения формулы II и другие соединения по изобретению предназначены включать сольватированные, а равно и несольватированные формы идентифицированных структур. Например, формула I включает соединения указанной структуры как в гидратированной, так и негидратированной формах. Другие примеры сольватов включают структуры в комбинации с изопропанолом, этанолом, метанолом, ДМСО, этилацетатом, уксусной кислотой или этаноламином. В добавление к пролекарствам формулы I, соединениям формулы II и другим соединениям по изобретению изобретение включает фармацевтически активные метаболиты и фармацевтически приемлемые соли таких соединений и метаболитов."Фармацевтически приемлемое пролекарство" представляет собой соединение, которое может быть преобразовано в физиологических условиях или путем сольволиза в определенное соединение или в фармацевтически приемлемую соль такого соединения перед проявлением им фармакологического эффекта(ов). Типично, пролекарство рецептурируется с целью(ями) улучшенной химической стабильности,улучшенного приема и согласия пациента, улучшенной биодоступности, увеличенной продолжительности действия, улучшенной селективности к органу, улучшенной рецептуры (например, повышенной растворимости в воде) и/или уменьшенных побочных эффектов (например, токсичности). Пролекарство может быть легко получено с применением способов, известных в технике, таких как те, что описаны вal., eds., Harwood Academic Publishers, 1991); Dear et al., J. Chromatogr. B, 748, 281-293 (2000); Spraul et al.,J. PharmaceuticalBiomedical Analysis, 10, 601-605 (1992) и Prox et al., Xenobiol, 3, 103-112 (1992). Термин "фармацевтически активный метаболит" предназначен обозначать фармакологически активный продукт, получаемый путем метаболизма в организме определенного соединения или его соли. После введения в организм большинство лекарств являются субстратами для химических реакций, которые могут изменить их физические свойства и биологические эффекты. Эти метаболические конверсии,которые обычно воздействуют на полярность соединений по изобретению, изменяют путь, по которому лекарства распределяются и выводятся из организма. Однако в некоторых случаях метаболизм лекарства требуется для терапевтического эффекта. Например, антираковые лекарства группы антиметаболитов должны конвертироваться в их активные формы после того, как они транспортированы в раковую клетку. Так как большинство лекарств претерпевает метаболическое превращение некоторого вида, биохимические реакции, которые играют роль в метаболизме лекарства, могут быть многочисленными и различными. Главным местом метаболизма лекарства является печень, хотя другие ткани также могут принимать участие. Специфическим признаком многих этих превращений является то, что метаболические продукты,или "метаболиты," являются более полярными, чем исходные лекарства, хотя полярное лекарство иногда дает менее полярный продукт. Вещества с высокими коэффициентами липид/водного распределения,которые легко проходят сквозь мембраны, также быстро диффундируют обратно из мочи в почечных канальцах через клетки почечных канальцев в плазму. Таким образом, такие вещества имеют тенденцию иметь низкий почечный клиренс и продолжительное сохранение в теле. Если лекарство метаболизируется в более полярное соединение, вещество с более низким коэффициентом распределения, его почечная реабсорбция будет значительно уменьшена. Кроме того, специфические секреторные механизмы для анионов и катионов в проксимальных почечных канальцах и в паренхимных клетках печени воздействуют на высокополярные вещества. В качестве специфического примера фенацетин (ацетофенетидин) и ацетанилид являются оба мягкими аналтезирующими и антипиретическими агентами, но трансформируются в пределах тела в более полярный и более эффективный метаболит, парагидроксиацетанилид (ацетаминофен), который сегодня широко применяется. Когда доза ацетанилида вводится индивидууму, последующие метаболиты имеют максимум и разлагаются в плазме последовательно. В течение 1-го часа ацетанилид является основным плазменным компонентом. В течение 2-го часа, по мере того как уровень ацетанилида падает, концентрация метаболического ацетаминофена достигает пика. В конце концов после нескольких часов основным плазменным компонентом является следующий метаболит, который является инертным и может быть выведен из тела. Таким образом, плазменные концентрации одного или нескольких метаболитов,также как самого лекарства, могут быть фармакологически важными.- 16013594 Термин "фармацевтически приемлемая соль" предназначен обозначать соль, которая сохраняет биологическую эффективность свободных кислот и оснований определенного соединения и которая не является биологически или иначе нежелательной. Соединение по изобретению может обладать достаточно кислотной, достаточно основной или обеими функциональными группами и поэтому реагировать с любым из ряда неорганических или органических оснований и неорганических и органических кислот с образованием фармацевтически приемлемой соли. Типичные фармацевтически приемлемые соли включают те соли, что получены реакцией соединений по настоящему изобретению с минеральной или органической кислотой или неорганическим основанием, такие как соли, включающие сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрогенфосфаты, дигидрогенфосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, йодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себакаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты,метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, -гидроксибутираты,гликолаты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2 сульфонаты и манделаты. Если соединение по изобретению представляет собой основание, желательная фармацевтически приемлемая соль может быть получена любым приемлемым способом, доступным в технике, например обработкой свободного основания неорганической кислотой, такой как соляная, бромисто-водородная,серная, азотная, фосфорная кислота и подобные, или органической кислотой, такой как уксусная, малеиновая, янтарная, миндальная, фумаровая, малоновая, пировиноградная, щавелевая, гликолевая, салициловая кислота, пиранозидильной кислотой, такой как глюкуроновая кислота или галактуроновая кислота,альфа-гидроксизамещенной кислотой, такой как лимонная кислота или винная кислота, аминокислотой,такой как аспаргиновая кислота или глутаминовая кислота, ароматической кислотой, такой как бензойная кислота или коричная кислота, сульфоновой кислотой, такой как паратолуолсульфоновая кислота или этансульфоновая кислота, или подобными. Если соединение по изобретению представляет собой кислоту, желательная фармацевтически приемлемая соль может быть получена любым пригодным способом, например обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочно-земельного металла или подобными. Иллюстративные примеры приемлемых солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов, и циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганических солей, полученных из натрия,кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития. В случае реагентов, которые являются твердыми, специалистам в данной области будет понятно,что соединения и соли по изобретению могут существовать в различных кристаллических или полиморфных формах, все из которых предназначаются для включения в объем настоящего изобретения и представленных формул. Способы лечения и профилактики вирусных инфекций гепатита С Настоящее изобретение представляет способы лечения или профилактики вирусной инфекции гепатита С у пациента, имеющего такую необходимость. Далее настоящее изобретение представляет способы для введения терапевтически эффективного количества пролекарства формулы I, соединения формулы II или другого соединения по изобретению или комбинации таких соединений в кровоток пациента при лечении и/или профилактике вирусных инфекций гепатита С. Диапазон профилактической или терапевтической дозы пролекарства формулы I, соединения формулы II или другого соединения по изобретению или его фармацевтически приемлемой соли, сольвата,или гидрата при лечении острого или хронического заболевания или профилактике инфекции будет варьировать, однако в зависимости от природы и тяжести инфекции и пути, по которому назначается активный компонент. Доза, и в некоторых случаях частота дозы, будет также варьировать согласно излечиваемой инфекции, возраста, массы тела и реакции индивидуального пациента. Пригодные режимы дозировки могут быть легко выбраны специалистами в данной области при должном обсуждении таких факторов. Способы по настоящему изобретению являются особенно хорошо применимыми для пациентов(людей). В частности, способы и дозы по настоящему изобретению могут быть применены для иммунодефицитных пациентов, включая, без ограничения, пациентов с раком, HIV-инфицированных пациентов и пациентов с иммунодегенеративным заболеванием. Кроме того, способы могут быть применены для пациентов с иммунодефицитом, находящихся в состоянии ремиссии. Способы и дозы по настоящему изобретению также могут быть применены для пациентов, проходящих другие антивирусные лечения. Способы профилактики по настоящему изобретению являются особенно применимыми для пациентов при риске вирусной инфекции. Эти пациенты включают, без ограничения, работников здравооохранения,например докторов, медицинских сестер, работников хосписов; военных; учителей; работников по уходу- 17013594 за детьми; пациентов, путешествующих или проживающих в иностранных регионах, в частности регионах третьего мира, включая социальных работников, миссионеров и иностранных дипломатов. В конечном счете способы и композиции включают лечение трудноизлечимых пациентов или пациентов, устойчивых к лечению, таких как устойчивых к ингибиторам обратной траскриптазы, протеасомным ингибиторам и т.д. Дозы. Токсичность и эффективность соединений по изобретению может быть определена путем стандартных фармацевтических методик на клеточных культурах или экспериментальных животных, например для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции). Отношение доз между токсическими и терапевтическими эффектами представляет собой терапевтический индекс и может быть выражено как отношение LD50/ED50. Данные, полученные из исследований на клеточных культурах и на животных, могут быть применены при определении диапазона дозировки соединений для применения на людях. Дозировка таких соединений лежит предпочтительно в пределах диапазона обращающихся концентраций, которые включают ED50 с небольшой или отсутствующей токсичностью. Дозировка может варьировать в пределах этого диапазона в зависимости от применяемой формы дозировки и использованного пути назначения. Для любого соединения, применяемого по способу изобретения, терапевтически эффективная доза может быть оценена сначала из исследований на клеточной культуре. Доза может быть рецептурирована в моделях на животных для достижения диапазона концентрации в циркулирующей плазме, который включает IC50 (т.е. концентрацию тестового соединения, которая достигает половины от максимального ингибирования симптомов), как определено на клеточной культуре; альтернативно, доза соединений может быть рецептурирована в моделях на животных для достижения для соединения диапазона концентрации в циркулирующей плазме, который дает концентрацию, требующуюся для достижения фиксированной величины отклика. Такая информация может быть применена для того, чтобы более точно определить применимые дозы на людях. Уровни в плазме могут быть измерены, например, методом жидкостной хроматографии высокого разрешения. Протоколы и композиции по изобретению предпочтительно тестировать in vitro и затем in vivo на желательную терапевтическую или профилактическую активность перед применением на людях. Например, исследования in vitro, которые могут быть применены для определения того, требуется ли назначение по специфическому терапевтическому протоколу, включают исследования клеточной культуры invitro, где клетки, которые являются восприимчивыми к действиям пролекарства формулы I, соединения формулы II и других соединений по изобретению, подвергаются действию лиганда, и величина отклика измеряется по соответствующей методике. Оценочные значения для соединений затем исследовали в отношении результативности соединения и степени конверсии между пролекарством формулы I и основного соединения формулы II. Перед тестированиями на людях соединения для применения в способах по изобретению могут быть протестированы в приемлемых модельных системах на животном, включая, без ограничения, крыс, мышей, куриц, коров,обезьян, кроликов, хомяков и т.д. Соединения затем могут быть применены в соответствующих клинических испытаниях. Величина профилактической или терапевтической дозы пролекарства формулы I, соединения формулы II или другого соединения по изобретению или их фармацевтически приемлемой соли, сольвата,или гидрата при лечении острого или хронического заболевания или профилактике инфекции или состояния будет варьировать в зависимости от природы и тяжести инфекции и пути, по которому назначается активный компонент. Доза, и возможно частота дозы, будет также варьировать согласно излечиваемой инфекции, возраста, массы тела и реакции индивидуального пациента. Приемлемые режимы дозирования могут быть быстро выбраны специалистами в данной области при должном обсуждении таких факторов. В одном варианте осуществления назначенная доза зависит от применяемого специфического соединения, массы и состояния пациента. Также доза может различаться для различных отдельных соединений по изобретению; приемлемые дозы могут быть предсказаны на основании вышеупомянутых измерений in vitro и на основании исследований на животном, так что меньшие дозы будут приемлемы для тех соединений, которые обнаруживают эффективность при меньших концентрациях, чем другие соединения, при измерении в системах, описанных или процитированных здесь. В общем суточная доза находится в диапазоне от около 0,001 до 100 мг/кг, предпочтительно от около 1 до 25 мг/кг, более предпочтительно от около 5 до 15 мг/кг. Для лечения людей, инфицированных вирусами гепатита С, назначают, в режиме от одной до четыре порций в день, от около 0,1 мг до приблизительно 15 г в день, предпочтительно от 100 мг до 12 г в день, более предпочтительно от 100 до 8000 мг в день. Кроме того, рекомендуемая дневная доза может быть назначена в виде циклов отдельных агентов или в комбинации с другими терапевтическими агентами. В одном варианте осуществления дневную дозу назначают как отдельную дозу или разделенную на равные части дозу. В конкретном варианте осуществления рекомендуемая дневная доза может быть назначена 1 раз раза в неделю, 2 раза в неделю, 3 раза в неделю, 4 раза в неделю или 5 раз в неделю.- 18013594 В предпочтительном варианте осуществления соединения по изобретению назначали для обеспечения системного распределения соединения внутри пациента. В конкретном варианте осуществления соединения по изобретению вводили для получения системного эффекта в организме. В следующем варианте осуществления соединения по изобретению назначали пероральным, относящимся к слизистой оболочке (включая сублингвальный, трансбуккальный, ректальный, назальный или вагинальный), парентеральным (включая подкожный, внутримышечный, болюсную иньекцию, внутриартериальный или внутривенный), чрескожным или местным путем назначения. В специфическом варианте осуществления соединения по изобретению назначали относящимся к слизистой оболочке (включая сублинвальный, трансбуккальный, ректальный, назальный или вагинальный), парентеральным (включая подкожный, внутримышечный, болюсную инъекцию, внутриартериальный или внутривенный), чрескожным или местным путем назначения. В следующем специфическом варианте осуществления соединения по изобретению назначали пероральным путем назначения. В следующем специфическом варианте осуществления соединения по изобретению не назначали пероральным путем назначения. Различные терапевтически эффективные количества могут применяться при различных инфекциях,как будет легко понятно специалистам в данной области техники. Подобным же образом устанавливаются количества дозировки и частота дозировки, достаточные для лечения или профилактики таких инфекций, но которые недостаточны для того, чтобы вызвать, или достаточны для того, чтобы уменьшить неблагоприятные эффекты, ассоциированные с традиционными терапиями. Комбинированная терапия Специфические способы по изобретению далее включают назначение дополнительного терапевтического агента (т.е. терапевтического агента, отличного от соединения по изобретению). В определенных вариантах осуществления по настоящему изобретению соединения по изобретению могут быть применены в комбинации по меньшей мере с одним другим терапевтическим агентом. Терапевтические агенты включают, без ограничения, антибиотики, противорвотные агенты, антидепрессанты и противогрибковые агенты, противовоспалительные агенты, антивирусные агенты, антираковые агенты, иммуномодуляторные агенты, -интерфероны, алкилаторные агенты, гормоны или цитокины. В предпочтительном варианте осуществления изобретение включает назначение добавочного терапевтического агента, который является HCV-специфическим или проявляет анти-HCV активность. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с антибиотиками. Например, они могут быть рецептурированы с макролидом (например, тобрамицин (Tobi, цефалоспорином (например, цефалексин(например, цефбуперазон, цефметазол и цефминокс), монобактамами (например, азтреонам, карумонам и тигемонам), оксацефемами (например, фломоксеф и моксалактам), пенициллинами (например, амдиноцилин, амдиноцилин-пивоксил, амоксицилин, бакампицилин, бензилпенициллиновая кислота, бензилпенициллин-натрий, эпицилин, фенбеницилин, флоксацилин, пенамцилин, гидройодид пенетамата, пенициллин орто-бенетамин, пенициллин О, пенициллин V, пенициллин V бензатин, пенициллин V гидрабамин, пенимепициклин и фенцихицилин-калий), линкозамидами (например, клиндамицин и линкомицин),амфомицином, бацитрацином, капреомицином, колистином, эндурацидином, энвиомицином, тетрациклинами (например, апициклин, хлортетрациклин, кломоциклин и демеклоциклин), 2,4-диаминопиримидинами (например, бродимоприм), нитрофуранами (например, фуральтадон и хлорид фуразолия),хинолонами и их аналогами (например, циноксацин, клинафлоксацин, флумекин и грепаглоксацин),сульфонамидами (например, ацетил сульфаметоксипиразин, бензилсульфамид, ноприлсульфамид, фталилсульфацетамид, сульфакризоидин и сульфацитин), сульфонами (например, диатимосульфон, глюкосульфонат натрия и соласульфон), циклосерином, мупироцином и туберином. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению также могут быть назначены или рецептурированы в комбинации с противорвотным агентом. Приемлемые противорвотные агенты включают, без ограничения, метоклопромид, домперидон, прохлорперазин, прометазин,хлорпромазин, триметобензамид, ондансентрон, гранисентрон, гидроксизин, моноэтаноламинацетиллейцин, ализаприд, азасетрон, бензхинамид, биетанаутин, бромприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксиперндил,- 19013594 пипамазин, скополамин, сульпирид, тетрагидроканабинолы, тиэтилперазин, тиопроперазин, трописетрон и их смеси. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с антидепрессантом. Приемлемые антидепрессанты включают, без ограничения, бинедалин, кароксазон, циталопрам, диметазан, фенкамин, индалпин, гидрохлорид инделоксазина, нефопам, номифензим, окситриптан, оксипертин, пароксетин, сертралин, тиазесим, тразодон, бенмоксин, ипроклозид, ипрониазид, изокарбоксазид, ниаламид, октамоксин, фенелзин,котинин, ролициприн, ролипрам, мапротилин, метралиндол, миансерин, миртазепин, адиназолам, амитриптилин, амитриптилиноксид, амоксапин, бутриптилин, кломипрамин, демексиптилин, дезипрамин,дибензипин, диметакрин, дотиепин, доксепин, флуацизин, имипрамин, имипрамин N-оксид, иприндол,лофепрамин, мелитрацен, метапрамин, нортриптулин, ноксиптилин, опипрамол, пизотилин, пропизепин,протриптилин, хинупрамин, тианептин, тримипрамин, адрафинил, бенактизин, бупропион, бутацетин,диоксадрол, дулоксетин, этоперидон, фебарбамат, фемоксетин, фенпентадиол, флуоксетин, флувоксамин, гематопорфирин, гидерицин, левофацетоперан, медифоксамин, милнаципран, минаприн, моклобемид, нефазолодон, оксафлозан, пибералин, пролинтан, пирисукцидеанол, ритансерин, роксиндол, хлорид рубидия, сулпирид, тандоспирон, тозалинон, тофенацин, толоксатон, транилципромин, L-триптофан,венлафаксин, вилоксазин и зимельдин. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с противогрибковым агентом. Приемлемые противогрибковые агенты включают, без ограничения, амфотерицин В, итроконазол, кетоконазол, флуконазол, интратекал, флуцитозин, миконазол, бутоконазол, клотримазол, нистатин, терконазол, тиоконазол, циклопирокс, эконазол, галопрогрин, нафтифин, тербинафин, ундециленат и гризеофулдин. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с противовоспалительным агентом. Противовоспалительные агенты, которые могут быть применены, включают, без ограничения, нестероидные противовоспалительные препараты, такие как салициловая кислота, ацетилсалициловая кислота, метил салицилат, дифлунисал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин,сулиндак, этодолак, мефенаминовую кислоту, меклофенамат натрия, толметин, кеторолак, диклофенак,ибупрофен, напроксен, напроксен-натрий, фенопрофен, кетопрофен, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, набуметом, фенилбутазон,оксифенбутазон, антипирин, аминопирин, апазон и нимесулид; лейкотриеновые антагонисты, включая,без ограничения, зилейтон, ауротиоглюкозу, тиомалат золота-натрия и ауранофин; стероиды, включая,без ограничения, дипропионат алклометазона, амцинонид, дипропионат беклометазона, бетаметазон,бензоат бетаметазона, дипропионат бетаметазона, бетаметазонфосфат натрия, валерат бетаметазона,пропионат клобетасола, пивалат клокортолона, гидрокортизон, производные гидрокортизона, дезонид,дезоксиматазон, дексаметазон, флунизолид, флукоксинолид, флурандренолид, галциноцид, медризон,метилпреднизолон и ацетат метпреднизолона, метилпреднизолон-сукцинат натрия, фуроат мометазона,ацетат параметазона, преднизолон, ацетат преднизолона, преднизолон-фосфат натрия, тебуатат преднизолона, преднизон, триамцинолон, ацетонид триамцинолона, диацетат триамцинолона и гексацетонид триамцинолона; и другие противовоспалительные агенты, включая, без ограничения, метотрексат, колхицин, аллопуринол, пробенецид, сулфинпиразон и бензбромарон. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с другим антивирусным агентом. Антивирусные агенты,которые могут быть применены, включают, без ограничения протеазные ингибиторы, нуклеозидные ингибиторы обратной транскриптазы, ненуклеозидные ингибиторы обратной транскриптазы и аналоги нуклеозидов. Антивирусные агенты включают, без ограничения, зидовудин, ацикловир, гангцикловир,видарабин, идоксуридин, трифлуридин, левовирин, вирамидин и рибавирин, а также фоскарнет, амантадин, римантадин, сакинавир, индинавир, ампренавир, лопинавир, ритонавир, альфа-интерфероны; бетаинтерфероны; адефовир, клевадин, энтекавир, плеконарил. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с иммуномодуляторным агентом. Иммуномодуляторные агенты включают, без ограничения, метотрексат, лефлуномид, циклофосфамид, циклоспорин А, микофенолат мофетил, рапамицин (сиролимус), мизорибин, дезоксиспергуалин,брехинар, малононитрилоамиды (например, лефлунамид), модуляторы Т-клеточного рецептора и модуляторы цитокинового рецептора, пептидомиметики и антитела (например, человеческие, гуманизированные, химерные, моноклональные, поликлональные, Fvs, ScFvs, Fab или F(ab)2 фрагменты или эпитопсвязывающие фрагменты), молекулы нуклеиновых кислот (например, антисмысловые молекулы нуклеиновых кислот и тройные спирали), небольшие молекулы, органические соединения и неорганические соединения. Примеры модуляторов Т-клеточного рецептора включают, без ограничения, антитела к Т-клеточным рецепторам (например, антитела к CD4 (например, cM-T412 (Boehringer), IDEC-CE9.1(например, IDEC-114 (IDEC и CTLA4-иммуноглобулин. Примеры модуляторов цитокинового рецептора включают, без ограничения, растворимые цитокиновые рецепторы (например, экстраклеточный домен TNF- рецептора или его фрагмент, экстраклеточный домен IL-1 рецептора или его фрагмент и экстраклеточный домен IL-6 рецептора или его фрагмент), их цитокины или фрагменты (например, интерлейкин (IL)-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9,IL-10, IL-11, IL-12, IL-15, TNF-, интерферон (IFN)-, IFN-, IFN- и GM-CSF), антитела к цитокиновому рецептору (например, антитела к IFN-рецептору, антитела к IL-2 рецептору (например, Zenapax (Protein Design Labs, антитела к IL-4 рецептору, антитела к IL-6 рецептору, антитела к IL-10 рецептору и антитела к IL-12 рецептору, антитела к цитокину (например, антитела к IFN, антитела к TNF-, антитела к IL-1S, антитела к IL-6, антитела к IL-8 (например, ABX-IL-8 (Abgenix и антитела к IL-12). Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с агентом, который ингибирует вирусные энзимы, включая, без ограничения, ингибиторы HCV протеазы, такие как BILN 2061, и ингибиторы NS5b полимеразы,такие как NM107 и его пролекарство NM283 (Idenix Pharmaceuticals, Inc., Cambridge, MA). Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с агентом, который ингибирует HCV-полимеразу, такие как те, что описаны в Wu, Curr. Drug Targets Infect Disord, 2003; 3 (3): 207-19, или в комбинации с соединениями, которые ингибируют функционирование геликазы вируса, такие как те, что описаны вBretner M., et al., Nucleosides, Nucleotides, and Nucleic Acids 2003; 22 (5-8), 1531, или с ингибиторами других HCV-специфических мишеней, таких как те, что описаны в Zhang X. IDrugs. 2002; 5 (2), 154-8. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с агентом, который ингибирует вирусную репликацию. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с цитокинами. Примеры цитокинов включают, без ограничения, интерлейкин-2 (IL-2), интерлейкин-3 (IL-3), интерлейкин-4 (IL-4), интерлейкин-5 (IL-5), интерлейкин-6 (IL-6), интерлейкин-7 (IL-7), интерлейкин-9 (IL-9), интерлейкин-10 (IL-10), интерлейкин-12(IL-12), интерлейкин-15 (IL-15), интерлейкин-18 (IL-18), тромбоцитарный фактор роста (PDGF), эритропоэтин (Epo), фактор роста эпидермиса (EGF), фактор роста фибробластов (FGF), гранулоцитмакрофагоцитарный стимулирующий гормон (GM-CSF), (G-CSF), колониестимулирующий фактор макрофагов (MCSF), пролактин и интерферон (IFN), например IFN- и IFN-). Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с гормонами. Примеры гормонов включают, без ограничения, релизинг-фактор лютеинизирующего гормона (LHRH), ростовой гормон (GH), релизинг-фактор ростового гормона, АСТН, соматостатин, соматотропин, соматомедин, паратиреоидный гормон, релизинг-гормоны гипоталамуса, инсулин, глюкагон, энкефалины, вазопрессин, кальцитонин, гепарин, низкомолекулярные гепарины, гепариноиды, синтетические и природные опиоиды, инсулиновые тиреотропные гормоны и эндорфины. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с -интерферонами, которые включают, без ограничения,интерферон бета-1a, интерферон бета-1b. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с -интерферонами, которые включают, без ограничения,интерферон альфа-1, интерферон альфа-2 а (роферон), интерферон альфа-2b, интрон, пегинтрон, пегасус(Pegasys), консенсусный интерферон (инферген) и альбуферон. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с агентом, усиливающим абсорбцию, особенно таким,который нацелен на лимфатическую систему, включая, без ограничения, гликоколят натрия; капрат натрия; N-лаурилD-мальтопиранозид; ЭДТА; смешанную мицеллу; и те, что описаны в Muranishi Crit.Rev. Ther. Drug Carrier Syst., 7-1-33, которые здесь включены посредством цитирования во всей полноте. Другие известные агенты, усиливающие абсорбцию, также могут быть применены. Так, изобретение также включает фармацевтическую композицию, включающую одно или несколько пролекарств формулы I, соединений формулы II и других соединений по изобретению и один или несколько агентов, усиливающих абсорбцию. Пролекарства формулы I, соединения формулы II и другие соединения по изобретению могут быть назначены или рецептурированы в комбинации с алкилирующим агентом. Примеры алкилирующих агентов включают, без ограничения, азотные горчичные масла, этиленимины, метилмеламины, алкилсульфонаты, нитрозомочевины, триазены, меклоретамин, циклофосфамид, ифосфамид, мелфалан, кло- 21013594 рамбуцил, гексаметилмелаин, тиотепа, бусульфан, кармустин, стрептозоцин, дакарбазин и темозоломид. Пролекарства формулы I, соединения формулы II, другие соединения по изобретению и агент другой направленности действия могут действовать дополнительно друг к другу или более предпочтительно синергически. В предпочтительном варианте осуществления композиция, включающая соединение по изобретению, назначается одновременно с назначением другого терапевтического агента, который может являться частью той же композиции или композиции, отличной от той, что включает соединения по изобретению. В другом варианте осуществления соединение по изобретению назначается перед или после назначения другого терапевтического агента. В отдельном варианте осуществления соединение по изобретению назначается пациенту, который ранее не проходил или не проходит в текущий момент лечения другим терапевтическим агентом, особенно антивирусным агентом. В одном варианте осуществления способы по изобретению включают назначение одного или нескольких пролекарств формулы I, соединений формулы II и других соединений по изобретению без дополнительного терапевтического агента. Фармацевтические композиции и формы дозировки Фармацевтические композиции и формы дозировки со стандартным элементом, включающие пролекарства формулы I, соединения формулы II и другие соединения по изобретению или их фармацевтически приемлемую соль, или гидрат также включаются в изобретение. Индивидуальные формы дозировки по изобретению могут быть пригодны для перорального, относящегося к слизистой оболочке (включая подъязычный, трансбуккальный, ректальный, назальный или вагинальный), парентерального (включая подкожный, внутримышечный, путем болюсной инъекции, внутриартериальный или внутривенный),чрескожного или местного назначения. Фармацевтические композиции и формы дозировки по изобретению типично также включают один или несколько фармацевтически приемлемых наполнителей. Также включены стерильные формы дозировки. В альтернативном варианте осуществления фармацевтическая композиция, подразумеваемая этим вариантом осуществления, включает пролекарство формулы I, соединение формулы II или другое соединение по изобретению или их фармацевтически приемлемую соль или гидрат и по меньшей мере один дополнительный терапевтический агент. Примеры дополнительных терапевтических агентов включают,без ограничения, те, что перечислены выше. Композиция, вид и тип формы дозировки по изобретению будут обычно изменяться в зависимости от ее применения. Например, форма дозировки, применяемая при лечении острой формы болезни или взаимосвязанной болезни, может содержать количества одного или нескольких активных компонентов,большие, чем включает форма дозировки, применяемая при лечении хронической формы той же болезни. Аналогично, парантерельная форма дозировки может содержать количества одного или нескольких активных компонентов, меньшие, чем включает пероральная форма дозировки, применяемая для лечения той же болезни или расстройства. Эти и другие пути, относительно которых отличаются друг от друга специфические формы дозировки, включенные в данное изобретение, будут легко очевидны для специалистов в данной области. См., например, Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing,Easton PA (1990). Примеры форм дозировки включают, без ограничения, таблетки; капсульные таблетки; капсулы, такие как мягкие эластичные желатиновые капсулы; крахмальные капсулы; пастилки; ромбы; дисперсии; суппозитории; мази; катаплазмы (припарки); пасты; порошки; повязки; кремы; пластыри; растворы; патчи; аэрозоли (например, назальные спреи или ингаляторы); гели; жидкие формы дозировки,пригодные для перорального или относящегося к слизистой оболочке назначения пациенту, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии масло-в-воде или жидкие эмульсии вода-в-масле), растворы и эликсиры; жидкие формы дозировки, пригодные для парентерального назначения пациенту; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), которые могут быть обработаны для получения жидкой формы дозировки, пригодной для парентерального назначения пациенту. Типичные фармацевтические композиции и формы дозировки включают один или несколько носителей, наполнителей или разбавителей. Пригодные наполнители являются хорошо известными для специалистов в области фармации, и здесь предоставлены неограничивающие примеры пригодных наполнителей. Является ли отдельный наполнитель пригодным для включения в фармацевтическую композицию или форму дозировки, зависит от различных факторов, хорошо известных в технике, включая, без ограничения, путь, которым форма дозировки будет назначаться пациенту. Например, пероральные формы дозировки, такие как таблетки, могут содержать наполнители, не приемлемые для применения в парентеральных формах дозировки. Приемлемость отдельного наполнителя также может зависеть от специфических активных компонентов в форме дозировки. Далее данное изобретение включает безводные фармацевтические композиции и формы дозировки,включающие активные компоненты, так как вода может облегчать разложение некоторых соединений. Например, добавление воды (например, 5%) является широко распространенным в области фармацевтики как метод облегчения долговременного хранения для того, чтобы определить характеристики, такие как срок хранения или стабильность рецептуры далее отведенного срока. См., например, Jens Т.Carstensen, Drug Stability: PrinciplesPractice, 2nd Ed., Marcel Dekker, NY, NY, 1995, p. 379-80. В действительности, вода и тепло ускоряют разложение некоторых соединений. Так, действие воды на рецептуру может иметь большое значение, так как влага и/или влажность обычно неожиданно попадают в течение производства, перемещения, упаковки, хранения, поставки и применения рецептур. Безводные фармацевтические композиции и формы дозировки по изобретению могут быть получены с применением безводных или маловодных компонентов и условий с низким содержанием воды или паров воды. Безводная фармацевтическая композиция должна быть получена и сохраняться так, чтобы ее безводный характер сохранялся. Согласно этому безводные композиции предпочтительно паковать с применением материалов, которые известны как предотвращающие попадание воды, так что они могут быть включены в приемлемые предписанные правилами пакеты. Примеры пригодных упаковок включают, без ограничения, герметически запаянную фольгу, пластики, контейнеры стандартной дозы (например, пузырьки), прозрачные упаковки и контурные упаковки. Далее изобретение включает фармацевтические композиции и формы дозировки, которые включают одно или несколько соединений, которые уменьшают скорость, с которой будет разлагаться активный компонент. Такие соединения, которые обозначаются здесь как "стабилизаторы", включают, без ограничения, антиоксиданты, такие как аскорбиновая кислота, рН буферы или солевые буферы. Подобно количеству и типу наполнителей количества и специфические типы активных компонентов в форме дозировки могут различаться в зависимости от факторов, таких как, без ограничения, путь,по которому они назначаются пациентам. Однако типичные формы дозировки по изобретению, включающие соединения по изобретению или их фармацевтически приемлемую соль или гидрат, включают от 0,1 до 1500 мг на стандартный элемент для предоставления доз от около 0,01 до 200 мг/кг в день. Пероральные формы дозировки. Фармацевтические композиции по изобретению, которые являются пригодными для перорального назначения, могут быть представлены как дискретные формы дозировки, такие как, без ограничения,таблетки (например, жевательные таблетки), капсульные таблетки, капсулы и жидкости (например, сиропы с отдушкой). Такие формы дозировки содержат предварительно определенные количества активных компонентов и могут быть получены методами фармации, хорошо известными для специалистов в данной области. См. для общего сведения, Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing,Easton PA (1990). Типичные пероральные формы дозировки по изобретению приготовляются путем комбинирования активного компонента(ов) в гомогенной смеси по меньшей мере с одним наполнителем согласно традиционным фармацевтическим методикам компаундирования. Наполнители могут принимать широко разнообразные формы в зависимости от формы рецептуры, желательной для назначения. Например, наполнители, пригодные для применения в пероральной жидкой или аэрозольной формах дозировки, включают, без ограничения, воду, гликоли, масла, спирты, отдушки, консерванты и окрашивающие агенты. Примеры наполнителей, пригодных для применения в твердых пероральных формах дозировки (например, порошки, таблетки, капсулы и капсульные таблетки), включают, без ограничения, крахмалы, сахара,микрокристаллическую целлюлозу, разбавители, гранулирующие агенты, смазки, связующие и дезинтегрирующие агенты. Благодаря легкости их назначения таблетки и капсулы представляют собой наиболее благоприятные пероральные формы дозировки со стандартным элементом, и в таком случае применяются твердые наполнители. Если желательно, таблетки могут быть покрыты по стандартным водным или неводным методикам. Такие формы дозировки могут быть приготовлены любым из способов фармации. В целом,фармацевтические композиции и формы дозировки приготовляются путем единообразного смешения до гомогенного состояния активных компонентов с жидкими носителями, тщательно раздробленными твердыми носителями, или обоими и затем, если необходимо, формованием продукта в желаемой форме. Например, таблетка может быть получена путем прессования или формования. Прессованные таблетки могут быть получены путем прессования активных компонентов в приемлемой машине в сыпучей форме, такой как порошок или гранулы, необязательно смешанных с наполнителем. Формованные таблетки могут быть произведены путем формования смеси порошкообразного соединения, смоченной инертным жидким разбавителем в приемлемой машине. Примеры наполнителей, которые могут быть применены в пероральных формах дозировки по изобретению, включают, без ограничения, связующие,наполнители, дезинтегрирующие агенты и смазки. Связующие, приемлемые для применения в фармацевтических композициях и формах дозировки, включают, без ограничения, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как аравийская, альгинат натрия, альгиновую кислоту, другие альгинаты, порошковый трагакант, гуаровую смолу, целлюлозу и ее производные (например, этилцеллюлозу, ацетат целлюлозы, кальцийкарбоксиметилцеллюлозу, натрий-карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу,пептизированный крахмал, гидроксипропилметилцеллюлозу (например,2208, 2906, 2910), макрокристаллическую целлюлозу и их смеси.- 23013594 Примеры наполнителей, приемлемых для применения в фармацевтических композициях и формах дозировки, описанных здесь, включают, без ограничения, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраны, каолин,маннит, кремниевую кислоту, сорбит, крахмал, пептизированный крахмал и их смеси. Связующее или наполнитель в фармацевтических композициях по изобретению типично присутствуют в количестве от около 50 до около 99 мас.% от фармацевтической композиции или формы дозировки. Пригодные формы микрокристаллической целлюлозы включают, без ограничения, материалы, продаваемые как AVICEL-PH-101, AVICEL-PH-103, AVICEL RC-581, AVICEL-PH-105 (доступный от FMCCorporation, American Viscose Division, Avicel Sales, Marcus Hook, PA) и их смеси. Специфическое связующее представляет собой смесь микрокристаллической целлюлозы и натрий-карбокиметилцеллюлозы,продаваемой как AVICEL RC-581. Пригодные безводные или маловодные наполнители или добавки включают AVICEL-PH-103 и крахмал 1500 LM. Дезинтегрирующие агенты применяются в композициях по изобретению для приготовления таблеток, которые дезинтегрируются при контакте с водной средой. Таблетки, которые содержат слишком много дезинтегрирующего агента, могут дезинтегрироваться при хранении, в то время как те, что содержат слишком мало, могут не дезинтегрироваться с желаемой скоростью или в желаемых условиях. Таким образом, достаточное количество дезинтегрирующего агента, которое не является ни слишком большим,ни слишком маленьким для непоправимого изменения высвобождения активных компонентов, должно быть применено при приготовлении твердых пероральных форм дозировки по изобретению. Количество применяемого дезинтегрирующего агента варьируют, основываясь на типе рецептуры, что будет легко очевидно для специалистов в данной области. Типичные фармацевтические композиции включают от около 0,5 до приблизительно 15 мас.% дезинтегрирующего агента, особенно от около 1 до около 5 мас.% дезинтегрирующего агента. Дезинтегрирующие агенты, которые могут быть применены в фармацевтических композициях и формах дозировки по изобретению, включают, без ограничения, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, кроскармеллозу натрия, кросповидон, полакрилин калия, крахмалгликолят натрия, картофельный или тапиоковый крахмал, пептизированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, камеди и их смеси. Смазки, которые могут быть применены в фармацевтических композициях и формах дозировки по изобретению, включают, без ограничения, стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, тальк, гидрированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло),стеарат цинка, этилолеат, этиллаурат, агар и их смеси. Дополнительные смазки включают, например,силоидный силикагель (AEROSIL 200, производимый W.R. Grace Co., Baltimore, MD), коагулированный аэрозоль синтетического оксида кремния (поставляемый от Degussa Co., Piano, TX), CAB-O-SIL (пирогенный продукт диоксид кремния, продаваемый Cabot Co., Boston, MA) и их смеси. Если вообще применяются, смазки типично применяются в количестве менее чем около 1 мас.% от фармацевтических композиций или форм дозировки, в которые они включены. Формы дозировки с отсроченным высвобождением. Активные компоненты по изобретению могут быть назначены способами контролируемого высвобождения или путем доставки устройствами, которые хорошо известны для специалистов в данной области. Примеры включают, без ограничения, те, что описаны в патентах США 3845770, 3916899,3536809, 3598123; 4008719, 5674533, 5059595, 5591767, 5120548, 5073543, 5639476, 5354556 и 5733566,каждый из который включен здесь посредством цитирования. Такие формы дозировки могут быть применены для обеспечения медленного или контролируемого высвобождения одного или нескольких активных компонентов с применением, например, гидропропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, мультислойных покрытий, микрочастиц, липосом, микросфер или их комбинации для обеспечения желательного профиля высвобождения с варьируемыми соотношениями. Приемлемые рецептуры контролируемого высвобождения известны для специалистов в данной области, включая те, что описаны здесь, могут быть легко выбраны для применения с активными компонентами по изобретению. Таким образом, изобретение включает формы дозировки со стандартным элементом, пригодные для перорального назначения, такие как, без ограничения, таблетки,капсулы, гелевые капсулы и капсульные таблетки, которые адаптированы для контролируемого высвобождения. Все контролируемые высвобождения фармацевтических продуктов имеют общую цель - улучшение лекарственной терапии по сравнению с той, что достигается в случае неконтролируемых аналогов. В идеале применение оптимизированных рецептур контролируемого высвобождения при медицинском лечении характеризуется минимумом лекарственного вещества, применяемого для остановки или контроля состояния за минимальное количество времени. Преимущества рецептур контролируемого высвобождения включают повышенную активность лекарства, уменьшенную частоту дозировки и повышенную степень согласия пациента. Кроме того, рецептуры контролируемого высвобождения могут быть- 24013594 применены для воздействия на время начала действия или другие характеристики, такие как уровни лекарства в крови, и могут так воздействовать на частоту проявления побочных (например, вредных) эффектов. Большинство рецептур контролируемого высвобождения создаются для начального высвобождения количества лекарства (активный компонент), которое прямо производит желаемый терапевтический эффект, и постепенного и непрерывного высвобождения следующих количеств лекарства для поддержания этого уровня терапевтического или профилактического эффекта в течение запланированного периода времени. Для того чтобы поддержать этот постоянный уровень лекарства в организме, лекарство должно высвобождаться из формы дозировки со скоростью, которая будет замещать количество лекарства, метаболизируемого и экскретируемого из организма. Контролируемое высвобождение активного компонента может быть стимулировано различными условиями, включая, без ограничения, рН, температуру, энзимы, воду или другие физиологические условия или соединения. Парентеральные формы дозировки. Парентеральные формы дозировки могут быть назначены пациентам различными путями, включая,без ограничения, подкожный, внутривенный (включая болюсную инъекцию), внутримышечный и внутриартериальный. Поскольку их назначение типично обходит природные системы защиты пациента от загрязняющих веществ, парентеральные формы дозировки предпочтительно являются стерильными или пригодны к стерилизации перед назначением пациенту. Примеры парентеральных форм дозировки включают, без ограничения, растворы, готовые для инъекции, сухие и/или лиофилизированные продукты, готовые к растворению или суспендированию в фармацевтически приемлемом носителе для инъекции (восстанавливаемые порошки), суспензии, готовые для инъекции и эмульсии. Приемлемые носители, которые могут быть применены при получении парентеральных форм дозировки по изобретению, являются хорошо известными для специалистов в данной области. Примеры включают, без ограничения, воду для инъекций USP; водные носители, такие как, без ограничения, инъекция хлорида натрия, инъекция Рингера (Ringer), инъекция декстрозы, инъекция декстрозы и хлорида натрия и лактонизованная инъекция Рингера (Ringer); водосмешиваемые носители, такие как, без ограничения, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как,без ограничения, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат,изопропил миристат и бензилбензоат. Соединения, которые увеличивают растворимость одного или нескольких активных компонентов, впервые описанных здесь, также могут быть включены в парентеральные формы дозировки по изобретению. Чрескожные формы дозировки. Чрескожные формы дозировки включают пластыри "резервуарного типа" или "матричного типа",которые могут быть применены к коже и носиться в течение определенного периода времени с тем, чтобы обеспечить попадание желаемого количества активных компонентов. Приемлемые наполнители (например, носители и разбавители) и другие вещества, которые могут быть применены для приготовления чрескожных и местных форм дозировки, включаемых в данное изобретение, являются хорошо известными для специалистов в области фармацевтики и зависят от особенностей ткани, к которой данная фармацевтическая композиция или форма дозировки будет применяться. С учетом этого типичные наполнители включают, без ограничения, воду, ацетон, этанол, этиленгликоль,пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпалмитат, минеральное масло и их смеси. В зависимости от специфики излечиваемой ткани дополнительные компоненты могут применяться в соединении с, перед или после лечения активными компонентами изобретения. Например, агенты,усиливающие проникновение, могут применяться для облегчения высвобождения активных компонентов в ткань. Приемлемые агенты, усиливающие проникновение, включают, без ограничения, ацетон; различные спирты, такие как этанол, олеиловый и тетрагидрофуриловый спирт; алкилсульфоксиды, такие как диметилсульфоксид, диметилацетамид; диметилформамид, полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; разновидности поливинилпирролидона (Повидон, Поливидон); мочевину и различные водорастворимые или нерастворимые эфиры сахаров, такие как Tween 80 (Полисорбат 80) и Спан 60 (моностеарат сорбитана). рН фармацевтической композиции, или формы дозировки, или ткани, к которой применяется фармацевтическая композиция или форма дозировки, также могут быть установлены для улучшения доставки одного или нескольких активных компонентов. Аналогичным образом, полярность растворяющего носителя, его ионная сила или тонус могут регулироваться для улучшения доставки. Соединения, такие как стеараты, также могут добавляться к фармацевтическим композициям или формам дозировки для положительного изменения гидрофильности или липофильности одного или нескольких активных компонентов для улучшения доставки. В этом отношении стеараты могут служить жидкими носителями для рецептуры в качестве эмульгирующего агента или поверхностно-активного вещества и в качестве агента,облегчающего доставку или облегчающего проникновение. Различные соли, гидраты или сольваты активных компонентов могут применяться для дальнейшей регуляции свойств полученной композиции.- 25013594 Местные формы дозировки. Местные формы дозировки по изобретению включают, без ограничения, кремы, лосьоны, мази, гели, растворы, эмульсии, суспензии или другие формы, известные для специалистов в данной области. См., например, Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990) иIntroduction to Pharmauceutical Dosage Forms, 4th ed., LeaFebiger, Philadelphia (1985). Приемлемые наполнители (например, носители и разбавители) и другие вещества, которые могут быть применены для приготовления чрескожных и местных форм дозировки, включаемых в данное изобретение, хорошо известны для специалистов в области фармацевтики и зависят от особенностей ткани,к которой будет применяться данная фармацевтическая композиция или форма дозировки. С учетом этого типичные наполнители включают, без ограничения, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси. В зависимости от специфики излечиваемой ткани дополнительные компоненты могут применяться в соединении с, перед или после лечения активными компонентами изобретения. Например, агенты, усиливающие проникновение, могут применяться для облегчения высвобождения активных компонентов в ткань. Приемлемые агенты, усиливающие проникновение, включают, без ограничения, ацетон; различные спирты, такие как этанол, олеиловый и тетрагидрофуриловый спирт; алкилсульфоксиды, такие как диметилсульфоксид; диметилацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; разновидности поливинилпирролидона (Повидон, Поливидон); мочевину и различные водорастворимые или нерастворимые эфиры сахаров, такие как Твин 80 (Полисорбат 80) и Спан 60 (моностеарат сорбитана). Формы дозировки, относящиеся к слизистой оболочке. Относящиеся к слизистой оболочке формы дозировки по изобретению включают, без ограничения,офтальмические растворы, спреи и аэрозоли или другие формы, известные для специалиста в данной области. См., например, Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990); и Introduction to Pharmauceutical Dosage Forms, 4th ed., LeaFebiger, Philadelphia (1985). Формы дозировки, приемлемые для обработки относящихся к слизистой оболочке тканей в пределах ротовой полости,могут быть рецептурированы как жидкости для полоскания рта или как пероральные гели. В одном варианте осуществления аэрозоль включает носитель. В другом варианте осуществления аэрозоль не содержит носителя. Соединения по изобретению также могут назначаться прямо в легкое путем ингаляции. Для назначения путем ингаляции соединение по изобретению может удобно доставляться в легкое рядом различных устройств. Например, ингалятор с измерением дозы ("MDI"), который использует контейнеры, содержащие приемлемый низкокипящий пропеллант, например дихлордифторметан, трихлорфторметан,дихлортетрафторэтан, диоксид углерода или другой приемлемый газ, может быть применен для доставки соединения прямо в легкое. MDI устройства доступны от ряда поставщиков, таких как 3M Corporation,Aventis, Boehringer Ingleheim, Forest Laboratories, Glaxo-Wellcome, Schering Plough и Vectura. Альтернативно, для назначения соединения по изобретению в легкое может быть применено устройство ингаляции сухого порошка (DPI) (см., например, Raleigh et al., Proc. Amer. Assoc. Cancer Research Annual Meeting, 1999, 40, 397, которая включена здесь посредством цитирования). DPI устройства типично используют механизм, такой как выброс газа, для создания облака сухого порошка внутри контейнера, которое затем может вдыхаться пациентом. DPI устройства также являются хорошо известными в технике и могут быть куплены у ряда поставщиков, которые включают, например, Fisons,Glaxo-Wellcome, Inhale Therapeutic Systems, ML Laboratories, Qdose и Vectura. Широко распространенный вариант представляет собой множественнодозовую DPI ("MDDPI") систему, которая позволяет доставку более чем одной терапевтической дозы. MDDPI устройства доступны от компаний, таких какAstraZeneca, Glaxo-Wellcome, IVAX, Schering Plough, SkyePharma и Vectura. Например, капсулы и картриджи из желатина для применения в ингаляторе или вдувателе могут быть рецептурированы для этих систем как содержащие порошковую смесь соединения и приемлемого порошкового основания, такого как лактоза или крахмал. Другой тип устройства, которое может быть применено для высвобождения соединения по изобретению в легкое, представляет собой устройство с жидкостным распылением, поставляемое, например, отAradigm Corporation. Устройства с жидкостным распылением используют крайне небольшие форсуночные отверстия для превращения в аэрозоль жидких лекарственных рецептур, которые могут затем прямо ингалироваться в легкое. В предпочтительном варианте осуществления распыляющее устройство применяли для высвобождения соединения по изобретению в легкое. Распылители создают аэрозоли из жидких лекарственных рецептур путем применения, например, ультразвуковой энергии для образования тонкодисперсных частиц, которые могут легко ингалироваться (см., например, Verschoyle et al., British J. Cancer, 1999, 80,Suppl 2, 96, которая здесь включена посредством цитирования). Примеры распылителей включают устройства, поставляемые от Sheffield/Systemic Pulmonary Delivery Ltd. (см. Armer et al., патент США 5954047; van der Linden et al., патент США 5950619; van der Linden et al., патент США 5970974,которые включены здесь посредством цитирования), Aventis and Batelle Pulmonary Therapeutics.- 26013594 В особенно предпочтительном варианте осуществления электрогидродинамическое ("EHD") аэрозольное устройство применяют для высвобождения соединений по изобретению в легкое.EHD-аэрозольные устройства используют электрическую энергию для превращения в аэрозоль жидких лекарственных растворов или суспензий (см., например, Noakes et al., патент США 4765539; Coffee,патент США 4962885; Coffee, заявка РСТ, WO 94/12285; Coffee, заявка РСТ, WO 94/14543; Coffee,заявка РСТ, WO 95/26234, Coffee, заявка РСТ, WO 95/26235, Coffee, заявка РСТ, WO 95/32807, которые здесь включены посредством цитирования). Электрохимические свойства рецептуры могут являться важными параметрами при оптимизации высвобождения этого лекарства в легкое с помощьюEHD-аэрозольного устройства, и такая оптимизация рутинно проводится специалистами в данной области. EHD-аэрозольные устройства могут более эффективно доставлять лекарства в легкое, чем существующие пульмонарные технологии доставки. Другие способы внутрилегочной доставки соединений по изобретению будут известны специалисту в данной области и находятся в пределах объема изобретения. Жидкие лекарственные рецептуры, приемлемые для применения в распылителях и устройствах с распылением жидкости и EHD-аэрозольных устройствах, будут типично включать соединение по изобретению с фармацевтически приемлемым носителем. Предпочтительно фармацевтически приемлемый носитель представляет собой жидкость, такую как спирт, вода, полиэтиленгликоль или перфторуглеводород. Необязательно, другое вещество может быть добавлено для изменения аэрозольных свойств раствора или суспензии соединения. Предпочтительно это вещество представляет собой жидкость, такую как спирт, гликоль, полигликоль или жирная кислота. Другие способы рецептурирования жидких лекарственных растворов или суспензии, приемлемой для применения в аэрозольных устройствах, известны для специалистов в данной области (см., например,Biesalski, патент США 5112598; Biesalski, 5556611, которые включены здесь посредством цитирования). Соединение также может быть рецептурировано в ректальных или вагинальных композициях, таких как суппозитории или удерживающие клизмы, например, содержащие традиционные свечевые основания, такие как масло какао или другие глицериды. В добавление к составам, описанным ранее, соединение по изобретению также может быть рецептурировано в виде рецептуры с замедленным выделением. Такие рецептуры продолжительного действия могут быть назначены путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, соединения могут быть рецептурированы с приемлемым полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле), или ионообменными смолами, или в виде малорастворимых производных, например в виде малорастворимой соли. Альтернативно, могут применяться другие фармацевтические системы доставки. Липосомы и эмульсии являются хорошо известными примерами доставляющих носителей, которые могут применяться для высвобождения соединений по изобретению. Также могут применяться определенные органические растворители, такие как диметилсульфоксид, хотя обычно ценой большей токсичности. Соединения по изобретению также могут высвобождаться в контролируемой системе высвобождения. В одном варианте осуществления может быть применен насос (Sefton, CRC Crit. Ref Biomed Eng.,1987, 14, 201; Buchwald et al., Surgery, 1980, 88, 507; Saudek et al., N. Engl. J. Med., 1989, 321, 574). В другом варианте осуществления могут применяться полимерные материалы (см. Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); Controlled Drug Bioavailability,Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, J.al., Ann. Neurol, 1989, 25, 351; Howard et al., 1989, J. Neurosurg, 71, 105). В следующем варианте осуществления система контролируемого высвобождения может быть помещена в непосредственной близости от мишени соединений по изобретению, например легкого, что требует присутствия только части системной дозы (см., например, Goodson, в Medical Applications ofControlled Release, см. ранее, vol. 2, p. 115 (1984. Может быть применена другая система контролируемого высвобождения (см., например, Langer, Science, 1990, 249, 1527). Приемлемые наполнители (например, носители и разбавители) и другие материалы, которые могут быть применены для приготовления форм дозировки, относящихся к слизистой оболочке, включенные в данное изобретение, являются хорошо известными для специалистов в области фармацевтики и зависят от особенностей места или способа, которым данная фармацевтическая композиция или форма дозировки будет назначаться. С учетом этого типичные наполнители включают, без ограничения, воду, этанол,этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси, которые являются нетоксичными и фармацевтически приемлемыми. Примеры таких добавочных компонентов являются хорошо известными в технике. См., например, Remington'spH фармацевтической композиции, или формы дозировки, или ткани, к которой применяются фармацевтическая композиция или форма дозировки, также может быть установлен для улучшения доставки одного или нескольких активных компонентов. Аналогично, полярность растворяющего носителя, его ионная сила или токсичность могут быть изменены для улучшения доставки. Соединения, такие как стеараты, также могут быть добавлены к фармацевтическим композициям или формам дозировки для- 27013594 благоприятного изменения гидрофильности или липофильности одного или нескольких активных компонентов для улучшения доставки. В этом отношении стеараты могут служить в качестве липидного носителя для рецептуры как эмульгирующий агент или поверхностно-активное вещество и как агент, облегчающий доставку или облегчающий проникновение. Различные соли, гидраты или сольваты активных компонентов могут применяться для дальнейшей регулировки свойств полученной композиции. Комплекты. Изобретение представляет фармацевтический пакет или комплект, включающие один или несколько контейнеров, включающих пролекарство формулы I, соединение формулы II или другое соединение по изобретению, которое может быть применено для лечения или предотвращения вирусной инфекции гепатита С. В других вариантах осуществления изобретение представляет фармацевтический пакет или комплект, включающий один или несколько контейнеров, включающих соединение по изобретению, которое может быть применено для лечения или предотвращения вирусной инфекции гепатита С, и один или несколько контейнеров, включающих дополнительный терапевтический агент, включая, без ограничения, те, что перечислены выше, в частности антивирусный агент, интерферон, агент, который ингибирует вирусные энзимы, или агент, который ингибирует вирусную репликацию, предпочтительно дополнительный терапевтический агент является HCV-специфическим или имеет анти-HCV-активность. Изобретение также представляет фармацевтический пакет или комплект, включающий один или несколько контейнеров, включающих один или несколько из компонентов фармацевтических композиций по изобретению. Необязательно, такой контейнер(ы) может(гут) комплектоваться извещением в форме, установленной государственным органом, регулирующим производство, применение или реализацию фармацевтических препаратов или биологических продуктов, отражающим одобрение для назначения человеку государственным органом по производству, применению или сбыту. Агенты по изобретению могут быть получены с применением реакционных путей и синтетических схем, как описано ниже, использующих общие методики, известные в технике с применением исходных веществ, которые легко доступны. Синтез оставшихся соединений по изобретению может быть успешно проведен путем модификаций, очевидных для специалистов в данной области, например применением соответствующих защитных групп, путем замены на другие приемлемые реагенты, известные в технике,или путем выполнения рутинных модификаций условий реакции. Альтернативно, другие реакции, впервые описанные здесь или общеизвестные в технике, будут указаны как имеющие применимость для получения других соединений по изобретению. Получение соединений. На синтетических схемах, описанных ниже, пока не указано иное, все температуры представлены в градусах Цельсия и все части и процентные составы указаны по массе. Пока не указано иное, реагенты закупались от коммерческих поставщиков, таких как Aldrich Chemical Company или Lancaster SynthesisLtd., и применялись без дальнейшей очистки. Тетрагидрофуран (THF) и N,N-диметилформамид (DMF) закупались в Aldrich в бутылках Sure Seal и применялись как есть. Пока не указано иное, следующие растворители и реагенты перегоняли в токе сухого азота. THF и Et2O перегоняли надNa-бензофенонкетилом; CH2Cl2, диизопропиламин, пиридин и Et3N перегоняли над СаН 2; MeCN перегоняли сначала над P2O5, затем над СаН 2; МеОН перегоняли над Mg; PhMe, EtOAc и изо-PrOAc перегоняли над СаН 2; TFAA очищали путем простой перегонки при атмосферном давлении под сухим аргоном. Реакции, указанные ниже, проводили, как правило, под положительным давлением аргона при температуре окружающей среды (пока не указано иное) в безводных растворителях, реакционные колбы снабжались резиновой диафрагмой для введения субстратов и реагентов через шприц. Стеклянную посуду высушивали в печи и/или высушивали нагреванием. Реакции исследовали методом TLC и завершали по установлению полного расходования исходного вещества. Аналитическую тонкослойную хроматографию (TLC) проводили на 0,2-мм пластинах с алюминиевой основой и силикагелем 60 F254 (EMScience) и осматривали в UV-свете (254 нм) с последующим нагреванием с коммерческой этанольной фосформолибденовой кислотой. Препаративную тонкослойную хроматографию (TLC) проводили на 1,0-мм пластинах с алюминиевой основой и силикагелем 60 F254 (EM Science) и осматривали в UV-свете(254 нм). Пока не указано иное, обработку типично проводили путем удваивания реакционного объема реакционным растворителем или растворителем для экстракции и затем путем промывания указанными водными растворами с использованием 25 об.% от объема экстракции. Полученные растворы сушили над безводным Na2SO4 и/или Mg2SO4 перед фильтрованием и упариванием растворителей при пониженном давлении в роторном испарителе и фиксировали момент, когда растворители были удалены в вакууме. Колоночную хроматографию проводили при положительном давлении с применением 230-400 меш силикагеля или 50-200 меш нейтральной окиси алюминия. Гидрогенолиз проводили при давлении, указанном в примерах, или при давлении окружающей среды. 1H ЯМР спектры измеряли на приборе Varian Mercury-VX400, функционирующем при 400 МГц, и 13 С-ЯМР спектры измеряли при 75 МГц. ЯМР спектры были получены для CDCl3 растворов (указано в м.д.) с применением соответственно в качестве стандарта хлороформа (7,27 и 77,00 м.д.), CD3OD (3,4, 4,8- 28013594 и 49,3 м.д.), ДМСО-d6 и тетраметилсилана (0,00 м.д.). При необходимости применялись другие ЯМР-растворители. Для указанных мультиплетностей пика применялись нижеследующие сокращения:s - синглет,d - дублет,t - триплет,q - квартет,m - мультиплет,br - уширенный,dd - дублет дублетов,dt - дублет триплетов. Когда присутствуют, константы связывания измерены в герцах (Гц). Инфракрасные (IR) спектры измеряли на спектрометре FT-IR в виде чистых масел, в виде гранулKBr или в виде растворов в CDCl3 и, когда присутствуют, указаны в волновых числах (см-1). Приведенные масс-спектры представляют собой (+)-ES LC/MS, выполненные в отделении аналитической химии вAnadys Pharmaceuticals, Inc. Элементные анализы проводились в Atlantic Microlab, Inc. в Норкроссе, GA. Точки плавления (т.пл.) определяли в аппарате с открытым капилляром и не корректировали. Описанные синтетические пути и экспериментальные методики используют множество обычных химических сокращений, таких какHPLC - жидкостная хроматография высокого разрешения; К гетерогенной смеси гетероцикла 1 (168 мг, 1,00 ммоль) и пербензоилрибозы 2 [полученной согласно способу Wolfe et al., J. Org. Chem. 1997, 62, 1754-1759] (522 мг, 0,90 ммоль) в безводном MeCN(10 мл) добавляли BSA (742 мкл, 3,00 ммоль). Конечную смесь перемешивали 15 мин, после чего добавляли TMSOTf (333 мкл, 1,50 ммоль). Реакционную смесь перемешивали в течение 4 ч при 65 С, затем 3 ч при 90 С. Затем смесь охлаждали до комнатной температуры, разбавляли DCM (150 мл) и выдерживали с буфером рН 7 (100 мл). Водную фазу далее экстрагировали DCM (350 мл), объединенные органические фазы сушили над Na2SO4 и фильтровали. Прозрачный фильтрат разбавляли EtOAc (200 мл),фильтровали через небольшой слой SiO2, концентрировали и подвергали флэш-хроматографии (10-40%EtOAc-DCM), что дало 380 мг (67%) нуклеозида 3 в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)8,43 (с, 1 Н), 7,85-8,02 (м, 6 Н), 7,46-7,97 (м, 7 Н), 7,35 (т, J=8,06 Гц,2 Н), 6,96 (ушир.с, 2 Н), 6,77 (ушир.с, 1 Н), 4,54-4,82 (м, 4 Н), 1,77 (с, 3H); К суспензии нуклеозида 3 (380 мг, 0,606 ммоль) в МеОН (20 мл) добавляли K2CO3 (17 мг,0,12 ммоль) при комнатной температуре. Полученную смесь перемешивали 18 ч при комнатной температуре, после чего ее обрабатывали НОАс (15 мкл, 0,25 ммоль), концентрировали и подвергали очистке методом HPLC (MeCN-H2O), что дало 20 мг (10%) указанного в заголовке соединения 4 в виде белого твердого вещества после лиофилизации. 1
МПК / Метки
МПК: C07D 495/04, A61K 31/435
Метки: 3h-тиазоло[4,5-d, 3,5,7-тризамещенные, пиримидин-2-оны, пролекарства, 3,5-дизамещенные, 3h-оксазоло
Код ссылки
<a href="https://eas.patents.su/30-13594-35-dizameshhennye-i-357-trizameshhennye-3h-oksazolo-i-3h-tiazolo45-d-pirimidin-2-ony-i-ih-prolekarstva.html" rel="bookmark" title="База патентов Евразийского Союза">3,5-дизамещенные и 3,5,7-тризамещенные 3h-оксазоло- и 3h-тиазоло[4,5-d] пиримидин-2-оны и их пролекарства</a>
Предыдущий патент: Жидкость для буровых скважин (варианты), способ захоронения шлама и способ обработки подземной скважины
Следующий патент: Гетероциклические, тетрациклические производные гидрофурана в качестве ингибиторов 5нт2 в терапии расстройств цнс
Случайный патент: Новые производные полигидроксипиразинов, способ их получения и содержащие их фармацевтические композиции