Фунгицидные 5-фенил-замещенные 2-(цианоамино)пиримидины
Номер патента: 5927
Опубликовано: 25.08.2005
Авторы: Хеффернан Гейвин, Пфренгле Вальдемар, Пес Клаус-Юрген
Формула / Реферат
1. Пиримидины формулы (I)
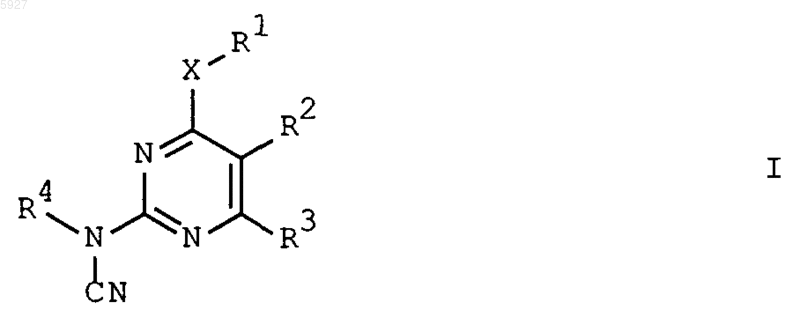
в которой R1 означает C1-C10алкил, C1-C10галоалкил, C2-C6алкенил, C2-C6алкинил, C4-C8алкадиенил, C1-C10алкокси, C3-C8циклоалкил, фенил или три-C1-C6алкилсилил, формил или C1-C10алкоксикарбонил;
причем группы R1 не замещены или замещены 1-3 группами Ra, при этом Ra означает галоген, нитрогруппу, цианогруппу, гидроксигруппу илиC1-C10алкил, C3-C6циклоалкил, C3-C6циклоалкенил, C1-C10галоалкил, C3-C6галоциклоалкил, C1-C10алкокси, C1-C10-галоалкокси, C1-C6алкоксикарбонил, три-C1-C4алкилсилил, фенил, гало- или дигалофенил или 5- или 6-членный гетероарил, содержащий 1-4 атома азота или 1-3 атома азота и один атом серы или кислорода;
R2 означает фенил, необязательно замещенный 1-3 группами, выбранными из галогена, C1-C10алкила и C1-C10алкокси;
R3 означает галоген;
R4 означает C1-C10алкил, C2-C6алкенил или C2-C6алкинил, не замещенные или замещенные 1-3 группами Ra; и
X означает O, S, NR5 или простую связь, причем R5 представляет собой водород или C1-C10алкил; или
R1 и R5 вместе с размещенным между ними атомом азота образуют гетероцикл, такой как пиперидин или азепан, необязательно замещенные одной или несколькими C1-C10алкильными группами.
2. Пиримидины формулы (I) по п.1, в которых R2 означает фенильную группу формулы
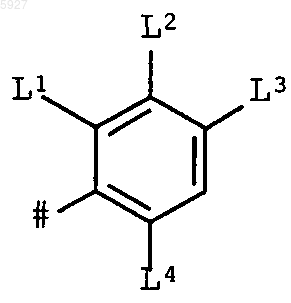
в которой L1-L4 независимо означают водород, фтор, хлор или метокси.
3. Пиримидины формулы (IA)
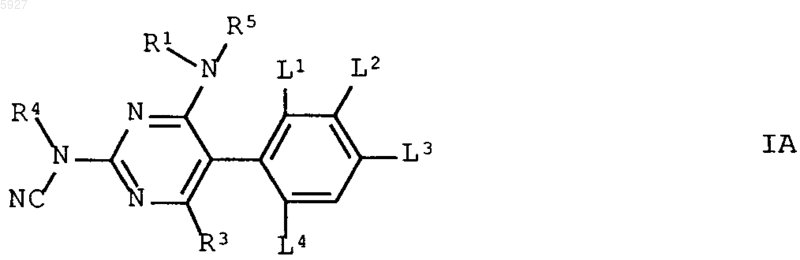
в которой R1-R5 имеют указанные в п.1 значения и L1-L4 имеют указанные в п.2 значения.
4. Пиримидины по пп.1-3, в которых R3 означает хлор.
5. Пиримидины по пп.1-4, в которых R4 означаетC1-C6алкил или бензил.
6. Способ получения пиримидинов формулы (I) по п.1 путем обработки соединений формулы (II)

в которой R1-R3 и X имеют указанные для формулы (I) значения, основанием и агентом алкилирования формулы (III)
R4-Y III,
в которой R4 означает C1-C10алкил, C1-C6алкенил или C1-C6алкинил, не замещенные или замещенные 1-3 группами R3, и Y означает атом галогена.
7. Способ получения пиримидинов формулы (I) по п.1 путем взаимодействия сульфонов формулы (VI)

в которой R1-R3 и X имеют указанные для формулы (I) значения и R6 означает C1-C6алкил или C1-C6галоалкил, с алкилированными цианамидами формулы (VII)

в которой R4 означает C1-C10алкил, C2-C6алкенил или C2-C6алкинил, незамещенные или замещенные 1-3 группами Ra, причем сульфоны формулы (VI) получают путем взаимодействия производных 2-тиопиримидинов формулы (VIII)

в которой заместители имеют указанные для формулы (VI) значения, с агентами окисления.
8. Соединения формул (VIa) и (VIIIa)

в которых R1, Ra имеют указанные в п.1 значения;
R2 означает фенил, замещенный 2 или 3 заместителями, выбранными из галогена, C1-C10алкила и C1-C10алкокси;
R3 означает хлор;
R5 означает водород, C1-C10алкил или C1-C10галоалкил;
или NR5R1 представляет собой пиперидиновое или азепановое кольцо, незамещенное или замещенное одной или несколькими группами C1-C10алкил;
R6 означает C1-C6алкил или C1-C6галоалкил.
9. Фунгицидная композиция, содержащая носитель и по меньшей мере одно соединение формулы (I) по п.1 в эффективном количестве.
10. Способ борьбы с грибами на месте их обитания, включающий обработку места их обитания эффективным количеством по меньшей мере одного соединения формулы (I) по п.1.
Текст
005927 Настоящее изобретение относится к пиримидинам формулы (I)R1 означает C1-С 10-алкил, C1-С 10-галоалкил, С 2-С 6-алкенил, С 2-С 6-алкинил, C4-C8-алкадиенил, C1 С 10-алкокси, С 3-С 8-циклоалкил, фенил, или 5- или 6-членный гетероарил или 5- или 6-членный гетероциклил, содержащие 1-4 атома азота или 1-3 атома азота и один атом серы или кислорода, или три-С 1-С 6 алкилсилил, формил или C1-С 10-алкоксикарбонил; причем группы R1 не замещены или замещены 1-3 группами Ra, при этом Rа означает галоген, нитрогруппу, цианогруппу, гидроксигруппу или C1-C10-алкил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкенил, C1 С 10-галоалкил, С 3-С 6-галоциклоалкил, C1-С 10-алкокси, C1-С 10-галоалкокси, C1-С 10-галоалкокси, C1-С 6 алкоксикарбонил, три-С 1-С 4-алкилсилил, фенил, гало- или дигалофенил или 5- или 6-членный гетероарил, содержащий 1-4 атома азота или 1-3 атома азота и один атом серы или кислорода;R2 означает фенил, С 3-С 6-циклоалкил или 5- или 6-членный гетероарил, содержащий 1-4 атома азота или 1-3 атома азота и один атом серы или кислорода, незамещенные или замещенные 1-3 группами Ra;R3 означает водород, галоген или C1-С 10-алкил, C1-С 10-алкокси, C1-С 10-алкилтио, C1-C10-алкиламино или ди-C1-С 10-алкиламино, незамещенные или замещенные 1-3 группами Rа;R4 означает C1-C10-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, незамещенные или замещенные 1-3 группами Ra; и Х означает О, S, NR5 или простую связь, причемR5 представляет собой водород или C1-С 10-алкил; илиR1 и R5 вместе с размещенным между ними атомом азота образуют гетероцикл. Кроме того, настоящее изобретение относится к способам и промежуточным соединениям для получения данных соединений, к композициям, включающим данные соединения, и к их применению для борьбы со вредными грибами. В Vestn. Slov. Kem. Drus. (1986), 33(3), 353-66 (ISSN [международный стандартный номер книги]: 0560-3110, CAN 107:39701) описано, что в результате взаимодействия оксимов N-пиримид-2 илформамида с диэтиловым ацеталемN,N-диметилформамида получают 2-(N-циано-Nэтиламино)пиримидины. В J. Org. Chem. 39 (9) 1256-1252 (1974) описаны N-гликолизованные 2-(Nцианоамино)-пиримидины, а в патенте США 4,711,959 раскрыт способ получения 2-(N-цианоамино)пиримидинов. Задача изобретения заключается в разработке фунгицидных соединений, обладающих повышенной активностью. Данная задача решается с помощью вышеописанных соединений. Кроме того, были разработаны способы их получения, композиции, включающие данные соединения, и способы борьбы с фитопатогенными грибами, в которых применяются соединения формулы (I). Соединения формулы (I), в которых R4 представляет собой незамещенную или замещенную алкильную, алкенильную или алкинильную группу согласно вышестоящему определению, можно получать путем обработки соединения формулы (II) в которой R1-R3 и Х имеют указанные для формулы (I) значения, сильным основанием и агентом алкилирования формулы (III)III 4 в которой R означает C1-С 6 алкил, C1-С 6 алкенил или C1-С 6 алкинил, незамещенные или замещенные 1-3 группами Rа, a Y означает нуклеофильную заменяемую, уходящую группу, предпочтительно атом галогена, в частности, атом йода. Соединения формулы (II) известны, например, из патента США 5,593,996, международных заявок, опубликованных подWO-A 98/46608, WO-A 99/41255 и WO-A 99/48893, или французской заявкиFR-A 2,765,875. Реакцию взаимодействия триазолпиримидинов формулы (II), сильного основания и агента алкилирования формулы (III) предпочтительно осуществляют в среде инертного растворителя. Пригодными растворителями являются, например, простые эфиры как, например, диоксан, простой диэтиловый эфир-1 005927 и тетрагидрофуран, галогенированные углеводороды как, например, дихлорметан, амиды, как, например,диметилформамид или N-метилпирролидон, и ароматические углеводороды как, например, толуол, или смеси указанных растворителей. Взаимодействие целесообразно осуществляют при температуре от -78 до 100 С, предпочтительно от 10 до 80 С, в частности, при комнатной температуре. Пригодными сильными основаниями являются, например, гидриды металлов как, например, гидрид натрия, калия или кальция, и амиды металлов как, например, амид натрия или калия, диизопропиламид лития или гексаметилдисилацид калия, или алканы металлов как, например, метиллитий, н-бутиллитий или трет.-бутиллитий. Далее, соединения формулы (I), в которых R4 означает незамещенные или замещенные алкил, алкенил или алкинил, можно получать путем взаимодействия оксима N-пиримид-2-илформамида формулы в которой R1-R3 и Х имеют указанные для формулы (I) значения, с N,N-диметилформамиддиалкилацетатом формулы (V) в которой R4 представляет собой C1-C6-алкил, C1-C6-алкенил или C1-С 6-алкинил, незамещенные или замещенные 1-3 группами Ra. Взаимодействие соединений формулы (IV) и соединений формулы (V) можно осуществлять аналогично реакции, описанной в Vestn. Slov. Kem. Drus. (1986), 33(3), стр. 353-366. Соединения формулы (I), в которой R4 означает водород, предпочтительно получают путем обработки сульфонов формулы (VI) в которой R1-R3 и Х имеют указанные для формулы (I) значения, а R6 означает C1-С 6 алкил или C1 С 6 галоалкил, цианамидом или солью металла цианамида. При этом может быть целесообразным применение основания и/или растворителя. Данный процесс предпочтительно осуществляют в среде инертного растворителя. Пригодными растворителями являются, например, ароматические углеводороды как, например, толуол или ксилол, хлорированные углеводороды как, например, метиленхлорид, хлороформ,хлорбензол, кетоны как, например, ацетон, метилэтилкетон, метилизопропилкетон или метилизобутилкетон, нитрилы как, например, простые эфиры ацетонитрила или пропионитрила как, например, простой диэтиловый эфир, простой диизопропиловый эфир, простой метил-трет.бутиловый эфир, диметоксиэтан,тетрагидрофуран или диоксан, амиды как, например, диметилацетамид или диэтилацетамид, сульфоксиды как, например, диметилсульфоксид или сульфолан, или их смеси. Может быть целесообразным осуществлять данную реакцию в присутствии основания. Пригодными основаниями являются, например, гидриды щелочных и щелочно-земельных металлов как, например,гидриды натрия, калия или кальция, гидроксиды щелочных и щелочно-земельных металлов как, например, гидроксиды натрия, калия или кальция, карбонаты щелочных и щелочно-земельных металлов как,например, карбонат натрия, калия или кальция, бикарбонаты щелочных и щелочно-земельных металлов как, например, бикарбонат натрия, калия или кальция, амиды металлов как, например, амид натрия или калия, диизопропиламид лития или гексаметилдисилацид калия, алканы металлов как, например, метиллитий, н-бутиллитий или трет.-бутиллитий, или апротонные амины как, например, пиридин, трибутиламин, N,N-диметилбензиламин или диазабициклоундецен. При осуществлении реакции можно пользоваться разными свойствами цианамида. Из практических соображений может быть предпочтительным использование водного раствора цианамида. Также возможно использование солей металлов с цианамидом, например цианамида калия, цианамида дикалия или цианамида кальция. В зависимости от используемого цианамида или его соли, и в зависимости от основания выбирают пригодный растворитель. Взаимодействие целесообразно осуществляют при температуре между -78 С и температурой кипения с обратным холодильником, предпочтительно при температуре от 0 до 150 С, в частности, при комнатной температуре.-2 005927 Основание берут в общем в количестве от 1 до 3 эквивалентов, предпочтительно от 1,5 до 2,5 эквивалентов на эквивалент сульфона формулы (VI). Цианамид или его соль берут в общем в количестве от 2 до 6 эквивалентов, предпочтительно от 3 до 5 эквивалентов на эквивалент сульфона общей формулы (VI). Соединения формулы (I), в которых R4 означает C1-С 6 алкил, C1-С 6 алкенил или C1-С 6 алкинил, незамещенные или замещенные 1-3 группами Ra, можно получать путем алкилирования соединений формулы (I), в которых R4 означает водород, агентом алкилирования формулы (III). Может быть целесообразным осуществление данной реакции в присутствии основания. Пригодными основаниями являются, например, гидриды щелочных и щелочно-земельных металлов как, например,гидриды натрия, калия или кальция, гидроксиды щелочных и щелочно-земельных металлов как, например, гидроксиды натрия, калия или кальция, карбонаты щелочных и щелочно-земельных металлов как,например, карбонат натрия, калия или кальция, бикарбонаты щелочных и щелочно-земельных металлов как, например, бикарбонат натрия, калия или кальция, амиды металлов как, например, амид натрия или калия, диизопропиламид лития или гексаметилдисилацид калия, алканы металлов как, например, метиллитий, н-бутиллитий или трет.-бутиллитий, или апротонные амины как, например, пиридин, трибутиламин, N,N-диметилбензиламин или диазабициклоундецен. Алкилирование предпочтительно осуществляют в среде инертного растворителя. Пригодными растворителями являются, например, ароматические углеводороды как, например, толуол или ксилол, хлорированные углеводороды как, например, метиленхлорид, хлороформ, хлорбензол, кетоны как, например, ацетон, метилэтилкетон, метилизопропилкетон или метилизобутилкетон, нитрилы как, например,ацетонитрил, простые эфиры пропионитрила как, например, простой диэтиловый эфир, простой диизопропиловый эфир, простой метил-трет.-бутиловый эфир, диметоксиэтан, тетрагидрофуран или диоксан,амиды как, например, диметилацетамид или диэтилацетамид, сульфоксиды как, например, диметилсульфоксид или сульфолан, или их смеси. Взаимодействие целесообразно осуществляют при температуре от -78 С до температуры кипения с обратным холодильником, предпочтительно при температуре от 0 до 150 С, в частности, при комнатной температуре. Агент алкилирования формулы (III) берут в общем в количестве от 0,8 до 5 эквивалентов, предпочтительно от 0,8 до 4,5 эквивалентов на эквивалент соединения формулы (I). Основание берут в общем в количестве от 0,8 до 3 эквивалентов, предпочтительно от 0,8 до 2,5 эквивалентов на эквивалент соединения формулы (I). Соединения формулы (I), в которых R4 означает C1-С 6-алкил, C1-C6-алкенил или C1-С 6-алкинил, незамещенные или замещенные 1-3 группами Ra, можно также получать путем взаимодействия сульфона формулы (VI) в которой R1-R3 и Х имеют указанные для формулы (I) значения, и R6 означает C1-С 6-алкил или C1-C6 галоалкил, с алкилированным цианамидом формулы (VII) в которой R4 означает C1-С 6 алкил, C1-С 6 алкенил или C1-С 6 алкинил, незамещенные или замещенные 1-3 группами Ra. Может быть целесообразным осуществить взаимодействие в присутствии основания и/или растворителя. Пригодными являются основания и растворители, указанные и для взаимодействия с цианамидом. Взаимодействие целесообразно осуществляют при температуре от -78 С до температуры кипения с обратным холодильником, предпочтительно при температуре от 0 до 150 С, в частности, при комнатной температуре. В общем взаимодействие осуществляют при нормальном давлении. Основание берут в общем в количестве от 1 до 3 эквивалентов, предпочтительно от 1,5 до 2,5 эквивалентов на эквивалент сульфона формулы (VI). Алкилированный цианамид формулы (VII) берут в общем в количестве от 2 до 6 эквивалентов,предпочтительно от 3 до 5 эквивалентов на эквивалент сульфона формулы (VI). Сульфоны формулы (VI) получают путем взаимодействия производных 2-тиопиримидина формулы в которой заместители имеют указанные для формулы (VI) значения, с окислителями, например мхлорпербензойной кислотой, перуксусной кислотой, трифторперуксусной кислотой, хлорной водой,хлорноватистой кислотой, или растворами их солей с металлом в воде или перекиси водорода, в случае необходимости, в присутствии катализатора, например, вольфрамата. В случае использования пригодных растворителей, например, метиленхлорида, хлороформа, тетрахлорида углерода, 1,2-дихлорэтана или хлорбензола, взаимодействие осуществляют при температуре от-20 С до температуры флегмы. Производные 2-тиопиримидина формулы (VIII) можно получать путем взаимодействия 6-гало-2 тиопиримидинов формулы (IX) в которой заместители имеют вышеуказанные значения и "Hal" означает галоген, с нуклеофильным соединением формулы (X)X 1 в которой R и Х имеют указанные для формулы (I) значения, в случае необходимости, в присутствии пригодного основания и, в случае необходимости, в среде органического растворителя. Используемые растворители и основания похожи на те, которые приведены выше для получения соединений формулы(I). 6-гало-2-тиопиримидины формулы (IX) известны, или их можно получать путем нижеследующей последовательности реакций:(R2, R3 и R6 имеют вышеуказанные значения, и R представляет собой алкильную группу). Условия реакций являются общеизвестными. Путем взаимодействия диалкилмалоната с тиомочевиной в присутствии основания в качестве катализатора получают 2-тиобарбитуровую кислоту формулы (XII), которую можно избирательно алкилировать в присутствии серы с получением соединения формулы (XIII). Затем путем галогенирования, предпочтительно хлорирования или бромирования, в частности, хлорирования, например, с использованием фосфорного оксихлорида или фосфорного оксибромида, в присутствии основания третичного амина получают дигалопроизводное формулы (XIV).-4 005927 Путем последующего введения радикала R3, в случае необходимости, путем нуклеофильного замещения, получают 6-гало-2-тиопиримидин формулы (IX). Сульфоны формулы (VI) и производные 2-тиопиримидина формулы (VIII) являются новыми. В вышеприведенных остатках употреблены общие понятия, которые в общем представляют собой следующие:- C1-С 6-алкил и алкильные группы C1-C6-алкокси, C1-С 6-алкилтио, C1-C6-алкиламино, ди-С 1-С 6 алкиламин или C1-C6-алкоксикарбонил означают насыщенные, разветвленные или неразветвленные углеводородные остатки с 1-6 атомами углерода, предпочтительно С 1-С 4 алкил как, например, метил, этил,пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил; или пентил, 1 метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил,1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил,1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1 этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2 метилпропил; предпочтительно этил или метил;- C1-С 6-галоалкил и галоалкильные группы C1-C6-галоалкокси означают разветвленные или неразветвленные алкильные группы с 1-6 атомами углерода (указанные выше), причем атомы водорода в данных группах могут частично или полностью быть заменены атомами галогена, указанными выше, например, С 1-C2 галоалкил как, например, хлорметил, бромметил, дихлорметил, трихлорметил, фторметил,дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 1-хлорэтил, 1 бромэтил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2,2 дифторэтил, 2,2-дихлор-2-фторэтил, 2,2,2-трихлорэтил и пентафторэтил; предпочтительно 2,2,2-трифторэтил или 1,1,1-трифторпроп-2-ил;- С 3-С 8-циклоалкил означает моноциклические, насыщенные углеводородные остатки с 3-6 или 8 кольцевыми атомами углерода, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил,предпочтительно с 5-7 атомами углерода, в частности, циклопентил, незамещнный или замещенный одним или несколькими атомами галогена, нитрогруппой, цианогруппой, C1-С 6 алкилом или C1 С 6 алкоксигруппой.- С 2-С 4-алкенил означает ненасыщенные, разветвленные или неразветвленные углеводородные остатки с 2-4 атомами углерода и с двойной связью в любом положении, например, этенил, 1-пропенил, 2 пропенил, 1-метилэтенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-метил-1-пропенил, 2-метил-1-пропенил, 1 метил-2-пропенил и 2-метил-2-пропенил; предпочтительно аллил или 2-метилаллил.- С 2-С 4-галоалкенил и галоалкенильные группы С 2-С 4-галоалкенилокси означают ненасыщенные,разветвленные или неразветвленные углеводородные остатки с 2-4 атомами углерода и с двойной связью в любом положении (как указано выше), причем атомы водорода в данных группах могут быть частично или полностью быть заменены атомами галогена, как указано выше, в частности, атомами фтора, хлора и брома;- С 2-С 4-алкинил означает разветвленные или неразветвленные углеводородные остатки с 3-4 атомами углерода и с тройной связью в любом положении, например, этилил, 1-пропинил, 2-пропинил, 1 бутинил, 2-бутинил, 3-бутинил и 1-метил-2-пропинил;- С 3-С 4-галоалкинил и галоалкинильные группы С 2-С 4-галоалкинилокси означают ненасыщенные,линейные или разветвленные углеводородные радикалы с 2-4 атомами углерода и с тройной связью в любом положении (как указано выше), причем атомы водорода в данных группах могут частично или полностью быть заменены атомами галогена, как указано выше, в частности, атомами фтора, хлора и брома; 5-членный гетероарил, содержащий 1-4 атома азота или 1-3 атома азота и один атом серы или кислорода: 5-членные гетероарильные группы, которые в дополнение к атомам углерода в качестве членов кольца могут содержать 1-4 атома азота или 1-3 атома азота и один атом серы или кислорода, например,2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пирролил, 3-пирролил, 3-изоксазолил, 4-изоксазолил, 5 изоксазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2 оксазолил, 4-оксазолил, 5-оксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-имидазолил, 4-имидазолил,1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,2,4-триазол-3 ил, 1,3,4-оксадиазол-2-ил, 1,3,4-тиадиазол-2-ил и 1,3,4-триазол-2-ил; 6-членный гетероарил, содержащий 1-4 атома азота: 6-членные гетероарильные группы, которые в дополнение к атомам углерода в качестве членов кольца могут содержать 1-3 или 1-4 атома азота, например, 2-пиридинил, 3-пиридинил, 4-пиридинил, 3-пиридазинил, 4-пиридазинил, 2-пиримидинил, 4 пиримидинил, 5-пиримидинил, 2-пиразинил, 1,3,5-триазин-2-ил и 1,2,4-триазин-3-ил; предпочтительными гетарильными группами являются пиридил, пиримидил, пиразолил или тиенил. 5- или 6-членный гетероциклил, содержащий 1-4 атома азота или 1-3 атома азота и один атом серы или кислорода, например, 2-тетрагидрофуранил, 3-тетрагидрофуранил, 2-тетрагидротиенил, 3-5 005927 тетрагидротиенил, 2-пирролидинил, 3-пирролидинил, 3-изоксазолидинил, 4-изоксазолидинил, 5 изоксазолидинил, 3-изотиазолидинил, 4-изотиазолидинил, 5-изотиазолидинил, 3-пиразолидинил, 4 пиразолидинил, 5-пиразолидинил, 2-оксазолидинил, 4-оксазолидинил, 5-оксазолидинил, 2-тиазолидинил,4-тиазолидинил, 5-тиазолидинил, 2-имидазолидинил, 4-имидазолидинил, 1,2,4-оксадиазолидин-3-ил,1,2,4-оксадиазолидин-5-ил, 1,2,4-тиадиазолидин-3-ил, 1,2,4-тиадиазолидин-5-ил, 1,2,4-триазолидин-3-ил,1,3,4-оксадиазолидин-2-ил, 1,3,4-тиадиазолидин-2-ил, 1,3,4-триазолидин-2-ил, 2,3-дигидрофур-2-ил, 2,3 дигидрофур-3-ил, 2,4-дигидрофур-2-ил, 2,4-дигидрофур-3-ил, 2,3-дигидротиен-2-ил, 2,3-дигидротиен-3 ил, 2,4-дигидротиен-2-ил, 2,4-дигидротиен-3-ил, 2-пирролин-2-ил, 2-пирролин-3-ил, 3-пирролин-2-ил, 3 пирролин-3-ил, 2-изоксазолин-3-ил, 3-изоксазолин-3-ил, 4-изоксазолин-3-ил, 2-изоксазолин-4-ил, 3 изоксазолин-4-ил, 4-изоксазолин-4-ил, 2-изоксазолин-5-ил, 3-изоксазолин-5-ил, 4-изоксазолин-5-ил, 2 изотиазолин-3-ил, 3-изотиазолин-3-ил, 4-изотиазолин-3-ил, 2-изотиазолин-4-ил, 3-изотиазолин-4-ил, 4 изотиазолин-4-ил, 2-изотиазолин-5-ил, 3-изотиазолин-5-ил, 4-изотиазолин-5-ил, 2,3-дигидропиразол-1 ил, 2,3-дигидропиразол-2-ил, 2,3-дигидропиразол-3-ил, 2,3-дигидропиразол-4-ил, 2,3-дигидропиразол-5 ил, 3,4-дигидропиразол-1-ил, 3,4-дигидропиразол-3-ил, 3,4-дигидропиразол-4-ил, 3,4-дигидропиразол-5 ил, 4,5-дигидропиразол-1-ил, 4,5-дигидропиразол-3-ил, 4,5-дигидропиразол-4-ил, 4,5-дигидропиразол-5 ил, 2,3-дигидрооксазол-2-ил, 2,3-дигидрооксазол-3-ил, 2,3-дигидрооксазол-4-ил, 2,3-дигидрооксазол-5 ил, 3,4-дигидрооксазол-2-ил, 3,4-дигидрооксазол-3-ил, 3,4-дигидрооксазол-4-ил, 3,4-дигидрооксазол-5 ил, 3,4-дигидрооксазол-2-ил, 3,4-дигидрооксазол-3-ил, 3,4-дигидрооксазол-4-ил, 2-пиперидинил, 3 пиперидинил, 4-пиперидинил, 1,3-диоксан-5-ил, 2-тетрагидропиранил, 4-тетрагидропиранил, 2 тетрагидротиенил, 3-гексагидропиридазинил, 4-гексагидропиридазинил, 2-гексагидропиримидинил, 4 гексагидропиримидинил, 5-гексагидропиримидинил, 2-пиперазинил, 1,3,5-гексагидротриазин-2-ил и 1,2,4-гексагидротриазин-3-ил; предпочтительными гетероциклильными группами являются пирролидинил, пиразолидинил, пиперидинил, пиперазинил или морфолин-4-ил. Особенно предпочтительные промежуточные соединения относительно заместителей соответствуют соединениям, имеющим заместители R1, R2, R3 и R4 согласно формуле (I). С учетом их применения предпочитают пиримидины формулы (I), включающие следующие заместители, причем предпочтение в каждом случае относится или к отдельным случаям, или к их комбинации: Предпочтительными являются соединения формулы (I), в которых R1 означает С 3-С 10 алкил, С 3 С 8 циклоалкил, С 3-С 8 циклоалкил-С 1-С 6 алкил, C1-С 10 галоалкил или фенил, незамещенные или замещенные 1-3 атомами галогена, C1-С 10-алкилом или C1-С 10 алкоксигруппой. Далее, особенно предпочтительными являются соединения формулы (I), в которых R1 означает C1 С 10-галоалкил, предпочтительно полифторированный алкил, в частности, 2,2,2-трифторэтил, 2-(1,1,1 трифторпропил) или 2-(1,1,1-трифторбутил). Кроме того, особенно предпочтительными являются соединения формулы (I), в которых R1 означает незамещенный или замещенный С 3-С 8 циклоалкил, предпочтительно циклопентил или циклогексил. Далее, особенно предпочтительными являются соединения формулы (I), в которых R2 означает фенил, замещенный 2 или 3 заместителями. Наиболее предпочтительно, по меньшей мере, один из данных заместителей связан с пиримидиновой группой в положении 2 по отношению к точке связывания. Такими заместителями предпочтительно являются галоген или алкокси. Дальнейшими особенно предпочтительными соединениями формулы (I) являются те, в которых R2 представляет собой фенильную группу формулы в которой L1-L4 независимо означают водород, фтор, хлор или метокси, в частности, L1 означает фтор или хлор, L2 и L4 независимо означают водород, фтор или хлор, и L3 означает водород, фтор, хлор или метокси. В частности предпочитают соединения формулы (I), в которых R3 означает хлор. Кроме того, особенно предпочтительными являются соединения формулы (I), в которых R4 означает водород, C1-C6-алкил, C2-С 6-алкенил или С 2-С 6-алкинил; или фенил-С 1-С 4-алкил, в котором фенильное кольцо может быть замещено одним или двумя атомами галогена. Далее, особенно предпочитают соединения формулы (I), в которых R4 означает водород, C1-С 6 алкил или бензил, в частности, C1-С 6-алкил. В частности предпочтительными являются соединения формулы (I), в которых Х означает NR5,причем R5 представляет собой водород, C1-С 10-алкил или C1-С 10-галоалкил, в частности водород. Далее, особенно предпочитают соединения формулы (I), в которых R5 означает C1-С 6-алкил, особенно водород или метил.-6 005927 Кроме того, особенно предпочтительными являются также соединения формулы (I), в которых Х означает NR5, и R1 вместе с промежуточным атомом азота образует незамещенный или замещенный гетероцикл, предпочтительно незамещенный или замещенный 3-7-членный гетероцикл, в частности пирролидин, пиперидин, тетрагидропиридин, в частности циклический 1,2,3,6-тетрагидропиридин или азепан, незамещенный или замещенный одной или несколькими C1-С 10-алкильными группами. Наиболее предпочтительными являются соединения формулы (IA) в которых R1-R5 имеют указанное для формулы (I) значение, L1 означает фтор или хлор, L2 и L4 независимо означают водород, фтор или хлор, и L3 означает водород, фтор, хлор или ОСН 3. Кроме того, наиболее предпочтительными являются соединения, в которых R3 означает хлор, Х означает NH, R4 представляет собой С 1-С 6 алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, в частности C1-С 6 алкил,R2 означает фенил, незамещенный или замещенный одним или несколькими атомами фтора и/или хлора и/или метоксигруппами. Особенно предпочтительными являются дальнейшие соединения формулы (IA): Настоящее изобретение распространяется также на (R)- и (S)-изомеры соединений общей формулы(I), имеющие хиральный центр, и на их рацематы, соли, N-оксиды и кислотно-аддитивные соединения. Соединения формулы (I) отличаются ценными фунгицидными свойствами, в частности, улучшенным системным действием. Например, их можно применять в сельском хозяйстве или связанных с ним отраслях для борьбы с фитопатогенными грибами как, например, Alternaria solani, Botrytis cinerea, Cercospora beticola, Cladosporium herbarum, Corticium rolfsi, Erysiphe graminis, Helminthosporium tritici repentis,Lepfosphaeria nodorum, Micronectriella nivalis, Monilinia fructigena, Mycosphaerella ligulicola, Mycosphaerella pinodes, Rhizoctonia solani, Sclerotinia sclerotiorum, Uncinula necator и Venturia maequalis, в частностиPyricularia oryzae, Rhizoctonia solani и Venturia inaequalis. Соединения формулы (I) согласно изобретению обладают сильной фунгицидной активностью в широком интервале концентраций. Благодаря их отличному действию соединения формулы (I) можно применять при выращивании растений, где заражение фитопатогенными грибами нежелательно, например, зерновых культур, пасленовых, овощей, бобовых культур, яблони, винограда. Настоящее изобретение далее относится к фунгицидной композиции, включающей активное вещество, представляющее собой по меньшей мере одно соединение формулы (I) согласно изобретению, и один или несколько носителей. Изобретение относится также к способу получения такой композиции,включающему смешивание соединения формулы (I) согласно вышеприведенной дефиниции по меньшей мере с одним носителем. Такая композиция может содержать одно активное вещество или же смесь нескольких активных веществ согласно настоящему изобретению. Также возможно, что разные изомеры или смеси изомеров могут обладать разными уровнями или диапазонами действия и, таким образом,композиции могут содержать индивидуальные изомеры или смеси изомеров.-7 005927 Композиция согласно изобретению предпочтительно содержит от 0,5 до 95 мас.% активного вещества. В композиции согласно изобретению в качестве носителя можно использовать любое вещество, с которым смешивают активное вещество для облегчения применения на подлежащем обработке месте,например, на растении, семенах, почве или в воде, в которой растет растение, или для облегчения хранения, перевозки или манипулирования. В качестве носителя может иметься твердое вещество или жидкость, а также вещество, обычно имеющееся в виде газа и сжатое до жидкого состояния. Композиции можно получать путем общеизвестных методов, например, в виде концентрированных эмульсий, растворов, эмульсий типа масло-в-воде, смачиваемых порошков, растворимых порошков, концентрированных суспензий, пылей, гранул, диспергируемых в воде гранул, микрокапсул, гелей, таблеток и препаратов других видов. Данные известные методы включают интенсивное перемешивание и/или измельчение активных веществ с другими веществами как, например, наполнителями, растворителями,твердыми носителями, поверхностно-активными веществами, и, в случае необходимости, твердыми и/или жидкими вспомогательными веществами и/или адъювантами. Вид аппликации, то есть, например,распрыскивание, распыление, диспергирование или разливание, можно выбрать, как и композиции, в зависимости от желаемого эффекта и конкретных условий. В качестве растворителей могут иметься ароматические углеводороды, например Solvess200, замещенные нафталены, сложные эфиры фталевой кислоты как, например, дибутил- или диоктилфталат,алифатические углеводороды как, например, циклогексан, или парафины, спирты и гликоли и их простые и сложные эфиры, например этанол, простой моно- и диметиловый эфир этиленгликоля, кетоны как, например, циклогексанон, сильно полярные растворители как, например, N-метил-2-пирролидон,или г-бутиролактон, высшие алкилпирролидоны как, например, н-октилпирролидон или циклогексилпирролидон, эпоксидированные сложные эфиры растительных масел, например, метилированные сложные эфиры кокосового или соевого масла и вода. Часто пригодны смеси разных жидкостей. В качестве твердых носителей, которые можно использовать для получения пылей, смачиваемых порошков, диспергируемых в воде гранул или гранул, можно взять минеральные наполнители как, например, кальцит,тальк, каолин, монтмориллонит или аттапульгит. Физические свойства можно улучшить путем добавления высоко диспергированного силикагеля или полимеров. В качестве носителя для получения гранул можно использовать пористые вещества как, например, пемзу, каолин, сепиолит, бентонит, и в качестве несорбирующих носителей можно взять кальцит или песок. Кроме того, можно использовать множество заранее гранулированных неорганических или органических веществ как, например, доломит или измельченные растительные остатки. Пестицидные композиции часто получают и перевозят в концентрированном виде, и затем пользователь разбавляет их перед применением. Последнее облегчается благодаря наличию небольшого количества поверхностно-активного вещества в качестве носителя. Поэтому предпочтительно по меньшей мере один из носителей в предлагаемой композиции представляет собой поверхностно-актвное вещество. Например, композиция может содержать два или больше носителей, причем по меньшей мере один из них представляет собой поверхностно-активное вещество. Поверхностно-активные вещества могут представлять собой неионные, анионные, катионные или диполярные вещества, обладающие хорошими диспергирующими, эмульгирущими и смачивающими свойствами, в зависимости от соединения общей формулы (I), которое необходимо перевести в препарат. Под поверхностно-активными веществами подразумеваются также смеси отдельных поверхностноактивных веществ. Композиции согласно изобретению можно перевести в препарат, например, в виде смачиваемых порошков, диспергируемых в воде гранул, пылей, гранул, таблеток, растворов, эмульгируемых концентратов, эмульсий, концентрированных суспензий и аэрозолей. Смачиваемые порошки обычно содержат от 5 до 90 мас.% активного вещества, и они обычно дополнительно к инертному твердому носителю содержат от 3 до 10 мас.% агентов диспергирования и смачивания и, в случае необходимости, до 10 мас.% стабилизатора или стаблизаторов и/или дальнейших добавок, например, содействующих проникновению или адгезионных веществ. Пыли обычно получают в виде концентрированной пыли с составом, похожим на состав смачиваемого порошка, но без диспергатора, и их можно разбавлять с помощью дальнейшего твердого носителя для получения композиции, обычно содержащей от 0,5 до 10 мас.% активного вещества. Гранулы, в том числе и диспергируемые в воде гранулы, обычно получают с размером от 0,15 и 2,0 мм, и их можно получать путем разных методов. В общем такие гранулы содержат от 0,5 до 90 мас.% активного вещества и до 20 мас.% добавок как стабилизаторов, поверхностно-активных веществ, замедляющих высвобождение агентов и связывающих веществ. Так называемые "сухие текучие вещества" представляют собой сравнительно небольшие гранулы со сравнительно высокой концентрацией активного вещества. Эмульгируемые концентраты дополнительно к растворителю или смеси растворителей содержат обычно от 1 до 80 мас.% активного вещества в пересчете на объем, от 2 до 20 мас.% эмульгаторов в пересчете на объем и до 20 мас.% в пересчете на объем других добавок как стабилизаторов, содействующих проникновению веществ и ингибиторов коррозии. Концентрированные суспензии обычно измельчают для получения стабильного, не оседающего текучего вещества, и они обычно содержат от 5-8 005927 до 75 мас.% активного вещества в пересчете на объем, от 0,5 до 15 мас.% диспергаторов в пересчете на объем, от 0,1 до 10 мас.% суспендирующих агентов, например, защитных коллоидов и тиксотропных агентов, в пересчете на объем, до 10 мас.% в пересчете на объем других добавок как, например, противовспенивающих агентов, ингибиторов коррозии, стабилизаторов, содействующих проникновению и адгезионных агентов, и воду или органическую жидкость, в которой активное вещество практически не растворимо. В препарате в растворенном виде могут иметься также органические или неорганические твердые вещества, препятствующие оседанию и кристаллизации или действующие в качестве понижающих температуру замерзания воды агентов. Водные дисперсии и эмульсии, например, композиции, полученные путем растворения переведенного в препарат продукта согласно изобретению водой, также входят в объем настоящего изобретения. Особенный интерес для продления длительности защитной активности соединений согласно изобретению представляет применение носителя, обеспечивающего замедленное высвобождение пестицидных соединений в окружающую среду растения, подлежащего защите. Биологическую активность активного вещества можно также повысить путем включения адъюванта в предназначенный для распрыскивания раствор. В данном контексте под адъювантом следует понимать вещество, способное к повышению биологической активности активного вещества, но само не обладающее заметной биологической активностью. Адъювант можно или включать в препарат в качестве составной части препарата или носителя, или же его можно подать в резервуар под среду для распрыскивания вместе с препаратом, содержащим активное вещество. Для продажи композиции предпочтительно имеются в концентрированном виде, в то время как пользователь употребляет в общем разбавленные композиции. Композиции можно разбавлять до концентрации 0,001% активного вещества. Дозы обычно составляют от 0,01 до 10 кг активного вещества на га. В нижеследующей таблице приведены некоторые примеры препаратов согласно изобретению. имеется в торговле; продукт фирмы ICI Surfactants имеется в торговле; продукт фирмы Deutsche Shell AG 3) имеется в торговле; продукт фирмы Rhone-Poulenc 4) имеется в торговле; продукт фирмы Kelco Co. 5) имеется в торговле; продукт фирмы Zeneca 6) имеется в торговле; продукт фирмы Witco 7) имеется в торговле; продукт фирмы International Speciality Products. Композиции согласно настоящему изобретению можно применять на растениях или окружающей их среде одновременно с другими активными веществами или последовательно с ними. Такие другие 2)- 11005927 активные вещества могут представлять собой удобрения, поставляющие микроэлементы агенты или другие препараты, влияющие на рост растений. Однако, они могут также представлять собой избирательные гербициды, инсектициды, фунгициды,бактерициды, нематициды, альгициды, моллюскициды, родентициды, вирусициды, соединения, вызывающие резистентность в растениях, биологические агенты защиты растений как, например, вирусы,бактерии, нематоды, грибы и другие микроорганизмы, репелленты птиц и животных, регуляторы роста растений, или смеси нескольких из таких средств, в случае необходимости, с другими носителями,обычно используемыми при получении препаратов, поверхностно-активными средствами или другими добавками, облегчающими применение препаратов. Далее, другой пестицид может иметь синергетический эффект на пестицидное действие соединения формулы (I). Другое фунгицидное соединение может обладать, например, способностью ингибирования заболеваний зерновых культур (например пшеницы), к примеру, заболеваний, вызываемых Erysiphe, Puccinia,Septoria, Gibberella и Helminthosporium spp., заболеваний, возникающих на семенах и в почве, настоящей и ложной мучнистой росы винограда, бурой пятнистости и бурой гнили пасленовых, мучнистой росы и парши яблони и т.д. Такие смеси фунгицидов могут иметь больший диапазон действий, чем одно соединение общей формулы (I). Кроме того, другой фунгицид может оказывать синергистическое действие на фунгицидную активность соединения формулы (I). В качестве примеров других фунгицидных соединений можно называть анилазин, азоксистробин,беналаксил, беномил, бинапакрил, битертанол, бластицидин С, бордосскую жидкость, бромуконазол,бупиримат, каптафол, каптан, карбендазим, карбоксин, карпропамид, хлорбензтиазон, хлорталонил, хлозолинат, медьсодержащие соединения как, например, оксихлорид меди и сульфат меди, циклогексимид,цимоксанил, ципофурам, ципроконазол, ципродинил, дихлофлуанид, дихлон, дихлоран, диклобутразол,диклоцимет, дикломезин, диэтофенкарб, дифеноконазол, дифлуметорим, диметиримол, диметоморф,диниконазол, динокап, диталимфос, дитианон, додеморф, додин, эдифенфос, эпоксиконазол, этаконазол,этиримол, этридиазол, фамоксадон, фенапанил, фенамидон, фенаримол, фенбуконазол, фенфурам, фенгексамид, феноксанил, фенпиклонил, фенпропидин, фенпропиморф, фентин, фентинацетат, фентингидроксид, феримзон, флуазинам, флудиоксонил, флуметовер, флухинконазол, флусилазол, флусульфамид,флутоланил, флутриафол, фолпет, фосетилалюминий, фуберидазол, фуралаксил, фураметпир, гуазатин,гексаконазол, IKF-916, имазалил, иминоктадин, ипконазол, ипродион, изопротиолан, ипроваликарб, казугамицин, КН-7281, китазин П, крезоксимметил, манкозеб, манеб, мепанипирим, мепронил, металаксил,метконазол, метфуроксам, MON 65500, миклобутанил, неоасозин, диметилдитиокарбамат никеля, нитротализопропил, нуаримол, офурас, органические соединения ртути, оксадиксил, оксикарбоксин, пенконазол, пенцикурон, феназиноксид, фталид, полиоксин Д, полграм, пробеназол, прохлораз, процимидон,пропамокарб, пропиконазол, пропинеб, пираклостробин, пиразофос, пирифенокс, пириметанил, пирохилон, пироксифур, хинометионат, хиноксифен, хинтозен, спироксамин, SSF-126, SSF-129, стрептомицин,сера, тебуконазол, теклофталам, текназен, тетраконазол, тиабендазол, тифлузамид, тиофанатметил, тирам, толклофосметил, толилфлуанид, триадимефон, триадименол, триазбутил, триазоксид, трициклазол,тридеморф, трифлоксистробин, трифлумизол, трифорин, тритиконазол, валидамицин А, винклозолин,XRD-563, зариламид, цинеб, цирам. Кроме того, препараты согласно изобретения могут содержать, по меньшей мере, одно соединение формулы (I) и любой биологический агент защиты растений, например из класса вирусов, бактерий, нематодов, грибов и других микроорганизмов, способных к ингибированию насекомых, сорняков и заболеваний растений, или способный вызвать резистентность в растениях. В качестве примеров таких биологических агентов можно называть: Bacillus thuringiensis, Verticillium lecanu, Autographica californica NPV,Beauvaria bassiana, Ampelomyces quisqualis, Bacilis subtilis, Pseudomonas chlororaphis, Pseudomonas fluorescens, Steptomyces griseoviridis и Trichoderma harzianum. Далее, препараты согласно изобретению могут содержать, по меньшей мере, одно соединение формулы (I) и химическое средство, вызывающее системную приобретенную резистентность растений, например, изоникотиновую кислоту или ее производные, 2,2-дихлор-3,3-диметилциклопропанкарбоновую кислоту или BION. Соединения формулы (I) можно смешивать с почвой, торфом или другим материалом для укоренения растений с целью их защиты от грибковых болезней, заражающих семена, почву или листья растений. Дальнейшими объектами настоящего изобретения являются применение соединения формулы (I) согласно вышеприведенной дефиниции или композиции согласно вышеприведенной дефиниции в качестве фунгицида и способ борьбы с грибами на определенном месте, включающий обработку таким соединением или такой композицией данного места, которое может представлять собой, например, растения, подвергаемые заражению грибами, семена таких растений или среда, в которых растут растения. Настоящее изобретение можно применять в широкой области защиты культурных и декоративных растений от заражения грибами. Типичными культурными растениями, которые можно защищать с помощью настоящего изобретения, являются, например, зерновые культуры, такие как пшеница, ячмень,- 12005927 рис, сахарная свекла, земляной орех, картофель, овощи и томат. Длительность защиты обычно зависит от конкретно используемого соединения, а также от разных других факторов, например, климата, влияние которого обычно снижают путем выбора подходящего препарата. Примеры получения соединений Описанные в нижеследующих примерах методы синтеза были использованы также для получения дальнейших соединений формулы (I), причем использовались соответствующие другие исходные соединения. Получаемые соединения и их физические данные перечислены в таблицах. Пример 1. Получение 2-(N-циано-N-метиламино)-4-хлор-5-(2,4,6-трифторфенил)-6-(1,1,1 трифторпроп-2-иламино)-пиримидина Смесь 2,5 г (6,3 ммоль) 5-хлор-6-(2,4,6-трифторфенил)-7-(1,1,1-трифторпроп-2-иламино)триазол[1.5 а]пиримидина, полученного согласно международной заявке WO-A 98/46608,15 мл диметилформамида, 0,25 г 60%-ного гидрида натрия и метилйодида размешивают при комнатной температуре в течение 45 мин. Полученную реакционную смесь выливают в 400 мл воды и дважды экстрагируют, каждый раз используя 300 мл простого диэтилового эфира. Органическую фазу отделяют, сушат безводным сульфатом натрия и фильтруют. Фильтрат упаривают при пониженном давлении и очищают путем флеш-хроматографии с получением 0,2 г продукта в виде бесцветного масла. Примеры 2-20: Таблица 1 (полученные аналогично примеру 1)- 13005927 Пример 26. Получение 2-(N-циано-N-метиламино)-4-хлор-5-(2,4,6-трифторфенил)-6-циклогексилпиримидина Смесь 2,5 г (6,3 ммоль) 5-хлор-6-(2,4,6-трифторфенил)-7-циклогексилтриазол[1.5 а]пиримидина, полученного согласно заявке WO-A 99/41255, 15 мл диметилформамида, 0,25 г 60 %-ного гидрида натрия и метилйодида размешивают при комнатной температуре в течение 45 мин. Реакционную смесь выливают в 400 мл воды и дважды экстрагируют, каждый раз используя 300 мл простого диэтилового эфира. Органическую фазу отделяют, сушат над безводным сульфатом натрия и фильтруют. Фильтрат упаривают при пониженном давлении и очищают путем флеш-хроматографии с получением 0,2 г продукта в виде бесцветного масла. Примеры 27-39. Таблица 2 (полученные аналогично примеру 26) Пример 40. Получение 4-хлор-2-(N-цианоамино)-6-[(4-метил)-пиперидин-1-ил]-5-фенилпиримидина К раствору 1,0 г (2,7 ммоль) 4-хлор-6-[(4-метил)-пиперидин-1-ил]-2-метил-сульфонил-5-фенилпиримидина в 8 мл диметилформамида при комнатной температуре добавляют 0,76 г (5,47 ммоль) карбоната калия. После размешивания реакционной смеси при комнатной температуре в течение 17,5 ч разбавляют путем добавления 70 мл воды, и полученный мутный раствор подкисляют до значения рН 1 путем добавления 4 мл концентрированной хлористо-водородной кислоты. Полученную белую суспензию размешивают при комнатной температуре в течение 2 ч, затем фильтруют, промывают сперва водой и затем гексаном и сушат в вакууме в течение ночи. Полученный сырой продукт перекристаллизовывают из смеси метиленхлорида и гексана, в результате чего получают 0,71 г целевого соединения в виде белого кристаллического твердого вещества. Выход: 79 %, точка плавления: 219-220 С (разложение). Пример 41. Получение 4-хлор-2-(N-циано-N-метиламино)-6-[(4-метил)-пиперидин-1-ил]-5 фенилпиримидина К раствору 0,1 г (0,305 ммоль) 4-хлор-2-(N-цианоамино)-6-[(4-метил)-пиперидин-1-ил]-5 фенилпиримидина в 4 мл диметилформамида при комнатной температуре добавляют сперва 2 мл воды, а затем 0,084 г (0,61 ммоль) карбоната калия. Полученную суспензию нагревают медленно до получения прозрачного раствора. Данный раствор охлаждают, добавляют 0,076 мл (1,22 ммоль) метилйодида и реакционную смесь размешивают при комнатной температуре в течение 2,5 ч. Разбавляют добавлением 40 мл насыщенного водного раствора хлорида аммония. После добавления 40 мл этилацетата двуфазную смесь размешивают в течение 5 мин. Затем отделяют органическую фазу, промывают 50 мл насыщенного соляного раствора, сушат над сульфатом магния и сгущают в вакууме с получением желтого сиропа. Сырой продукт подвергают хроматографии на силикагеле с использованием в качестве элюента смеси гексана и этилацетата в объемном соотношении 90 : 10, в результате чего получают 0,09 г целевого продукта в виде бесцветного сиропа. Выход: 87%.- 14005927 Пример 42. Получение 2-(N-бензил-N-циано)-4-хлор-6-[(4-метил)-пиперидин-1-ил]-5-фенилпиримидина К раствору 0,37 г (1,13 ммоль) 4-хлор-2-(N-цианоамино)-6-[(4-метил)-пиперидин-1-ил]-5-фенилпиримидина в 10 мл диметилформамида при комнатной температуре добавляют 3 мл воды и 0,19 г (1,35 ммоль) карбоната калия. К полученной мутной суспензии добавляют 0,16 мл (1,35 ммоль) бензилбромида и размешивают при комнатной температуре в течение 18,75 ч, после чего разбавляют добавлением 40 мл насыщенного водного раствора хлорида аммония. Полученную смесь затем распределяют между 75 мл этилацетата и 75 мл воды, сушат над сульфатом магния и сгущают в вакуме до получения желтого сиропа. Сырой продукт подвергают хроматографии на силикагеле с использованием в качестве элюента смеси гексана и этилацетата в объемном соотношении 90 : 10, и получают 0,47 г целевого продукта в виде белого кристаллического твердого вещества. Выход: 100 %, точка плавления 98-100 С. Пример 43. Альтернатива получения 4-хлор-2-(N-циано-N-метиламино)-6-[(4-метил)-пиперидин-1 ил]-5-фенилпиримидина К раствору 0,5 г (1,37 ммоль) 4-хлор-6-[(4-метил)-пиперидин-1-ил]-2-метил-сульфонил-5-фенилпиримидина в 6 мл диметилформамида добавляют сперва 0,38 г (2,73 ммоль) карбоната калия и затем 0,31 г (5,47 ммоль) метилцианамида. Реакционную смесь размешивают при комнатной температуре в течение 19 ч, затем разбавляют добавлением 75 мл воды и экстрагируют с использованием 75 мл этилацетата. Органическую фазу промывают сперва 75 мл воды, а затем 75 мл насыщенного соляного раствора, сушат над сульфатом магния и сгущают в вакууме до получения желтого сиропа. Сырой продукт подвергают хроматографии на силикагеле с использованием в качестве элюента смеси гексана и этилацетата в объемном соотношении 90 : 10, и получают 0,39 г целевого продукта в виде бесцветного сиропа. Выход: 84 %. Пример 44. Получение исходного соединения 4-хлор-6-[(4-метил)-пиперидин-1-ил]-2-метилсульфонил-5-фенилпиримидина Стадия а: 5-Фенил-2-метилтио-4,6(1 Н,5 Н)-пиримидиндион 60,0 г (208 ммоль) этил 2-фенилмалоната и 19,0 г (249 ммоль) тиомочевины нагревают в 77 г (416 ммоль) три-н-бутиламина при температуре 150 С в течение 2,5 ч. Большую часть образовавшегося этанола удаляют путем перегонки. После охлаждения реакционной смеси добавляют 180 мл водного раствора 24,9 г (623 ммоль) NaOH. После добавления 50 мл циклогексана и размешивания примерно в течение полчаса водную фазу отделяют, обрабатывают добавлением 35,4 г (142 ммоль) метилйодида и размешивают примерно при температуре 20-25 С в течение примерно 16 ч. Подкисляют разбавленным раствором НСl, размешивают в течение примерно полчаса и отфильтровывают осадок. Промывают водой,сушат, и получают 16,7 г целевого продукта (28 % теории) в виде белых кристаллов. Стадия б: 4,6-Дихлор-5-фенил-2-метилтиопиримидина К раствору 48,8 г (170 ммоль) продукта стадии а) в 200 мл фосфорилхлорида добавляют 3 мл диметилформамида (ДМФ) и нагревают при температуре флегмы в течение 40 ч. Большую часть фосфорилхлорида удаляют путем перегонки, и остаток разбавляют этилацетатом. Добавляют воду, перемешивая при температуре 15-20 С. Фазы разделяют, органическую фазу промывают водой и разбавленным раствором NaHCO3, затем сушат и удаляют растворитель. Получают 37,5 г целевого продукта (68 % теории) в виде масла, которое используют на стадии в) без дальнейшей очистки. Стадия в: 6-Хлор-5-фенил-4-[(4-метил)пиперидин-1-ил]-2-метилтиопиримидина Раствор 37,5 г (324 ммоль) продукта стадии б) в 150 мл безводного дихлорметана обрабатывают добавлением 24 г (406 ммоль) изопропиламина и размешивают при температуре примерно 20-25 С в течение 5 ч. Растворитель отгоняют, остаток поглощают этилацетатом, промывают разбавленным НСl, водой и разбавленным раствором NaHCO3, затем сушат и удаляют растворитель. В результате хроматографии остатка на силикагеле (циклогексан/метил-трет.бутиловый эфир в соотношении от 100:1 до 19:1) получают 13,4 г целевого соединения (33 % теории) в виде бесцветных кристаллов, которые используют на следующей стадии без дальнейшей очистки. Стадия г: Получение 6-хлор-4-[(4-метил)-пиперидин-1-ил]-2-метилсульфонил-5 фенилпиримидина Раствор 17,19 г (51,5 ммоль) 4-хлор-6-[(4-метил)-пиперидин-1-ил]-2-метилтио-5-фенилпиримидина в 350 мл метиленхлорида охлаждают до температуры 0 С. К реакционной смеси добавляют 25,4 г (103 ммоль) 70 %-ной хлорпербензойной кислоты и размешивают при температуре 0 С в течение часа и при комнатной температуре в течение полутора часов. После этого реакционную смесь концентрируют в вакууме до небольшого объема, разбавляют добавлением 400 мл этилацетата, промывают трижды 5%-ным водным раствором карбоната натрия (3 х 300 мл) и раз насыщенным соляным раствором(300 мл), сушат над сульфатом магния и сгущают в вакууме с получением белого твердого вещества, которое перекристаллизовывают из смеси этилацетата и гексана, в результате чего получают 14,68 г (выход: 78%) целевого продукта в виде беловатого кристаллического твердого вещества. Точка плавления: 160-162 С.- 15005927 Пример 45. Получение промежуточного соединения 4-хлор-6-(N-циклопентил)амино-5-(2 фторфенил)-2-метилтиопиримидин Стадия а: Получение 5-(2-фторфенил)-2-тиобарбитуровой кислоты К 200 мл абсолютного этанола при комнатной температуре в атмосфере азота добавляют 3,62 г (157 ммоль) натрия. Реакционную смесь размешивают до полной реакции натрия. Затем добавляют сперва раствор 20 г (78,7 ммоль) диэтил-(2-фторфенил)малоната в 50 мл абсолютного этанола и затем 8,38 г (110 ммоль) тиомочевины. Реакционную смесь нагревают в атмосфере азота при температуре кипения с обратным холодильником в течение 17 ч. Затем охлаждают, выливают в 800 мл воды, полученную смесь размешивают в течение 15 мин и экстрагируют добавлением 500 мл простого диэтилового эфира. Органическую фазу экстрагируют добавлением 150 мл соляного раствора, насыщенного на 1/3, и объединяют водные слои. К водной фазе добавляют 14 мл концентрированной хлористо-водородной кислоты, и полученную белую суспензию размешивают осторожно в течение часа. Суспензию фильтруют, полученное твердое вещество промывают сначала водой и затем простым диэтиловым эфиром, и сушат в вакууме примерно в течение 12 ч. Получают 8,59 г целевого соединения в виде белого твердого вещества с точкой плавления выше 240 С. Выход: 46 %. Стадия б: Получение 4,6-дигидрокси-5-(2-фторфенил)-2-метилтиопиримидина К смеси 8,20 г (34,3 ммоль) 5-(2-фторфенил)-2-тиобарбитуровой кислоты и 68,8 мл (13,8 ммоль) 0,2 М водного раствора гидроксида натрия при перемешивании при комнатной температуре в течение 30 мин прикапывают 4,348 г (34,4 ммоль) диметилсульфата. После этого реакционную смесь перемешивают еще в течение 24 ч при комнатной температуре. Дважды промывают этилацетатом, каждый раз используя 100 мл, затем водную фазу подкисляют до значения рН 1 путем добавления 8 мл концентрированной хлористо-водородной кислоты. Полученную белую суспензию размешивают в течение 30 мин, фильтруют и полученное белое твердое вещество промывают сначала водой и потом гексаном, после чего сушат в вакууме с получением 7,11 г белого твердого вещества. К сырому продукту добавляют 100 мл этилацетата и полученную суспензию при перемешивании нагревают при температуре кипения с обратным холодильником в течение 15 мин. Суспензию охлаждают, фильтруют и сушат, в результате чего получают 5,41 г (выход: 615) целевого соединения в виде белого твердого вещества. Точка плавления 240 С. Стадия в: Получение 4,6-дихлор-5-(2-фторфенил)-2-метилтиопиримидина К суспензии 0,75 г (2,97 ммоль) 4,6-дигидрокси-5-(2-фторфенил)-2-метилтиопиримидина в 7,5 мл(80,5 ммоль) фосфорного оксихлорида при комнатной температуре в атмосфере азота добавляют 1,24 мл(6,54 ммоль) три-н-пропиламина. Реакционную смесь нагревают при температуре флегмы в течение 18 ч,охлаждают до комнатной температуры и сгущают в вакууме. Полученный темно-коричневый остаток растворяют в небольшом количестве ацетонитрила, и при размешивании добавляют к 75 мл воды. Затем добавляют 75 мл этилацетата, и полученную двуфазную смесь размешивают интенсивно в течение часа. Органическую фазу отделяют, промывают раз 75 мл 2 М водной хлористо-водородной кислоты, дважды насыщенным водным раствором бикарбоната натрия, каждый раз используя 75 мл, и раз 75 мл насыщенного соляного раствора. После сушки над сульфатом магния органическую фазу сгущают в вакууме, и получают светло-коричневое масло. Сырой продукт подвергают хроматографии на силикагеле с использованием в качестве элюента смеси гексана и этилацетата в объемном соотношении 98 : 2, и получают 0,74 г (выход: 86 %) целевого соединения в виде бесцветных кристаллов. Стадия г: Получение 4-хлор-6-(N-циклопентил)амино-5-(2-фторфенил)-2-метилтиопиримидина К раствору 0,74 г (256 ммоль) 4,6-дихлор-5-(2-фторфенил)-2-метилтиопиримидина в 1 мл метиленхлорида при комнатной температуре в атмосфере азота добавляют 1,01 мл (10,24 ммолль) циклопентиламина, и реакционную смесь размешивают при комнатной температуре в течение 15 ч. Затем разбавляют путем добавления 75 мл смеси простого диэтилового эфира и этилацетата в объемном соотношении 1:1, промывают дважды 1 М водной хлористо-водородной кислотой, каждый раз используя 75 мл, раз 75 мл насыщенного водного раствора бикарбоната натрия и раз 75 мл насыщенного соляного раствора, сушат над сульфатом магния и сгущают в вакууме до получения бесцветного сиропа. Сырой продукт подвергают хроматографии на силикагеле с использованием в качестве элюента смеси гексана и этилацетата в объемном соотношении 95:5. Получают 0,87 г (выход: 100%) целевого соединения в виде белого кристаллического твердого вещества. Точка плавления: 81-83 С. Пример 46. Получение промежуточного соединения 4,6-дихлор-5-(2-хлор-6-фторфенил)-2 метилтиопиримидина Стадия а: Получение 4,6-дигидрокси-5-(2-хлор-5-фторфенил)-2-метилтиопиримидина Смесь 12,01 г (41,6 ммоль) диэтил(2-хлор-6-фторфенил)малоната, 3,8 г (49,92 ммоль) тиомочевины и 19,82 мл (83,2 ммоль) трибутиламина размешивают при температуре 150 С в атмосфере азота в течение 3 ч. Охлажденную реакционную смесь при интенсивном размешивании в течение 15 мин распределяют между 84 мл этилацетата и 83,2 мл (106 ммоль) 2,0 М растовра гидроксида натрия. Затем отделяют водную фазу, добавляют 5,258 г (41,6 ммоль) диметилсульфата, и полученную смесь размешивают при комнатной температуре в течение примерно 12 ч. Дополнительно добавляют 33,4 мл (166 ммоль) 5,0 М раствора гидроокиси натрия и 2,63 г (20,8 ммоль) диметилсульфата, и полученную смесь размешивают в- 16005927 течение дальнейших 2 ч. Полученную суспензию фильтруют, фильтрат подкисляют до значения рН 1 путем добавления концентрированной хлористо-водородной кислоты и размешивают в течение 30 мин. Суспензию фильтруют, полученное белое твердое вещество промывают сперва водой и затем гексаном,и сушат в вакууме примерно в течение 12 ч. Получают 2,57 г (выход: 22 %) целевого соединения в виде белого твердого вещества. Стадия б: Получение 4,6-дихлор-5-(2-хлор-6-фторфенил)-2-метилтиопиримидина К суспензии 2,57 г (8,96 ммоль) 4,6-дигидрокси-5-(2-хлор-6-фторфенил)-2-метилтиопиримидина в 25,7 мл (276 ммоль) фосфорного оксихлорида при комнатной температуре в атмосфере азота добавляют 3,75 мл (19,72 ммоль) три-н-пропиламина. Реакционную смесь нагревают с обратным холодильником при температуре 140 С в течение 40 ч, охлаждают до комнатной. К суспензии 2,57 г (8,96 ммоль) 4,6 дигидрокси-5-(2-хлор-6-фторфенил)-2-метилтиопиримидина в 25,7 мл (276 ммоль) фосфорного оксихлорида при комнатной температуре в атмосфере азота добавляют 3,75 мл (19,72 ммоль) три-нпропиламина. Реакционную смесь нагревают с обратным холодильником при температуре 140 С в течение 40 ч, охлаждают до комнатной температуры, и затем сгущают в вакууме с получением черного масла. Сырой продукт распределяют между 250 мл этилацетата и 250 мл воды, и полученную бифазную смесь размешивают интенсивно в течение 15 мин. Органическую фазу отделяют, промывают дважды 2 М водной хлористо-водородной кислотой, каждый раз используя 250 мл, дважды насыщенным раствором бикарбоната натрия, каждый раз используя также 250 мл, и раз 250 мл насыщенного соляного раствора. После сушки над сульфатом магния органическую фазу сгущают в вакууме с получением 2,3 г (выход: 79%) целевого соединения в виде темно-коричневого твердого вещества. Примеры 47-49: Таблица 3 (полученные аналогично примерам 40-46) Биологические исследования А Определение минимальной ингибирующей концентрации исследуемых соединений в серийном опыте разбавления на Pyricularia Oryzae Значение МИК (минимальной ингибирующей концентрации), указывающее минимальную концентрацию активного вещества в питательной среде, полностью ингибирующую рост мицелия, определяют с помощью серийных опытов разбавления с использованием микротировых пластинок, снабженных 24 или 48 углублениями на пластину. Разбавление исследуемых соединений в питательной среде и распределение на углубления осуществляют с помощью процессора образцов типа TECAN RSP 5000 RoboticSample Processor. Используют следующие концентрации исследуемых соединений: 0,05; 0,10; 0,20; 0,39; 0,78; 1,56; 3,13; 6,25; 12,50; 25,00; 50,00 и 100,00 мг/мл. Для получения питательной среды 333 мл овощного сока V8 смешивают с 4,95 г карбоната кальция, центрифугируют, 200 мл надосадочной жидкости разбавляют 800 мл воды и размещают в автоклаве при температуре 121 С в течение 30 мин. Инокулят Pyricularia Oryzae добавляют в углубления в виде суспензии спор в количестве 50 мл (5 х 105/мл) или пластинок агара (6 мм) культуры гриба на агаре. После инкубации при температуре 18-25 С в течение 6-12 дней определяют значения МИК путем визуальной оценки пластинок, см. табл. 4. Таблица 4 Б Исследование фунгицидной активности исследуемых соединений in vivo- 17005927 Исследуемые соединения растворяют в ацетоне и разбавляют деионизированной водой (95 частей воды на 5 частей ацетона), содержащей 0,05 TWEEN 20, представляющее собой поверхностноактивное вещество на основе сорбитанового монолаурата полиоксиэтилена, производимое фирмой AtlasChemical Industries, до концентрации 200 частей на миллион. Растения опрыскивают растворами исследуемых соединений, их сушат и заражают грибами позже в тот же самый день. По достижении оптимального развития симптомов заболеваний растения оценивают относительно ингибирования болезни по нижеприведенной шкалы оценки. В каждый опыт входят зараженные обработанные растения, зараженные необработанные растения и зараженные растения, обработанные сравнительными фунгицидами. Полученные результаты приведены в табл. 5. Шкала оценки В. Исследование фунгицидной активности in vitro против Rhizoctonia solani Исследуемые соединения растворяют в ацетоне до концентрации 10 частей на миллион, и их подают в отдельные углубления (пластинки с 24 углублениями фирмы Corning), в которые заранее подавали суспензию измельченной грибковой мицелии в питательной среде с определенным химическим составом. После инкубации в течение 3-7 дней ингибиции роста мицелия оценивают на основе нижеследующей шкалы. Полученные результаты приведены в табл. 6. в которой R1 означает C1-С 10 алкил, С 1-С 10 галоалкил, С 2-С 6 алкенил, С 2-С 6 алкинил, C4-С 8 алкадиенил, C1 С 10 алкокси, С 3-С 8 циклоалкил, фенил или три-С 1-С 6 алкилсилил, формил или C1-С 10 алкоксикарбонил; причем группы R1 не замещены или замещены 1-3 группами Rа, при этом Rа означает галоген, нитрогруппу, цианогруппу, гидроксигруппу или C1-С 10 алкил, С 3-С 6 циклоалкил, С 3-С 6 циклоалкенил, C1 С 10 галоалкил, С 3-С 6 галоциклоалкил, C1-С 10 алкокси, C1-С 10-галоалкокси, C1-C6 алкоксикарбонил, три-С 1 С 4 алкилсилил, фенил, гало- или дигалофенил или 5- или 6-членный гетероарил, содержащий 1-4 атома азота или 1-3 атома азота и один атом серы или кислорода;R4 означает C1-C10 алкил, С 2-С 6 алкенил или С 2-С 6 алкинил, незамещенные или замещенные 1-3 группами Ra; и Х означает О, S, NR5 или простую связь, причем R5 представляет собой водород или C1-С 10 алкил; илиR1 и R5 вместе с размещенным между ними атомом азота образуют гетероцикл, такой как пиперидин или азепан, необязательно замещенные одной или несколькими C1-С 10 алкильными группами. 2. Пиримидины формулы (I) по п.1, в которых R2 означает фенильную группу формулы в которой R1-R5 имеют указанные в п.1 значения и L1-L4 имеют указанные в п.2 значения. 4. Пиримидины по пп.1-3, в которых R3 означает хлор. 5. Пиримидины по пп.1-4, в которых R4 означает С 1-С 6 алкил или бензил. 6. Способ получения пиримидинов формулы (I) по п.1 путем обработки соединений формулы (II) в которой R1-R3 и Х имеют указанные для формулы (I) значения, основанием и агентом алкилирования формулы (III)III 4 в которой R означает C1-С 10 алкил, C1-C6 алкенил или C1-C6 алкинил, незамещенные или замещенные 1-3 группами Rа, и Y означает атом галогена. 7. Способ получения пиримидинов формулы (I) по п.1 путем взаимодействия сульфонов формулы в которой R1-R3 и Х имеют указанные для формулы (I) значения и R6 означает C1-C6 алкил или C1 С 6 галоалкил, с алкилированными цианамидами формулы (VII) в которой R4 означает C1-C10 алкил, С 2-С 6 алкенил или С 2-С 6 алкинил, незамещенные или замещенные 1-3 группами Ra, причем сульфоны формулы (VI) получают путем взаимодействия производных 2 тиопиримидинов формулы (VIII) в которой заместители имеют указанные для формулы (VI) значения, с агентами окисления. 8. Соединения формул (VIa) и (VIIIa)R5 означает водород, С 1-С 10 алкил или C1-C10 галоалкил; или NR5R1 представляет собой пиперидиновое или азепановое кольцо, незамещенное или замещенное одной или несколькими группами C1-С 10 алкил;R6 означает С 1-С 6 алкил или C1-C6 галоалкил. 9. Фунгицидная композиция, содержащая носитель и по меньшей мере одно соединение формулы- 20005927 10. Способ борьбы с грибами на месте их обитания, включающий обработку места их обитания эффективным количеством по меньшей мере одного соединения формулы (I) по п.1.
МПК / Метки
МПК: A01N 43/54, C07D 239/48
Метки: фунгицидные, 2-(цианоамино)пиримидины, 5-фенил-замещенные
Код ссылки
<a href="https://eas.patents.su/23-5927-fungicidnye-5-fenil-zameshhennye-2-cianoaminopirimidiny.html" rel="bookmark" title="База патентов Евразийского Союза">Фунгицидные 5-фенил-замещенные 2-(цианоамино)пиримидины</a>
Предыдущий патент: Нестероидные ингибиторы воспалений
Следующий патент: Способ получения кристаллической формы i каберголина
Случайный патент: Система экспрессии












