Карбамоильные производные бициклических карбониламинопиразолов в качестве пролекарств
Формула / Реферат
1. Применение соединения формулы (I)
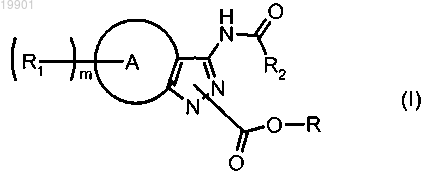
где R представляет собой линейную или разветвленную C1-C3 алкильную группу;
R1 представляет собой атом водорода или заместитель, присоединенный к любому доступному атому кольца А, где указанный заместитель выбран из галогена, нитро, оксогруппы (=O), карбокси, циано, (C1-C6) алкила, полифторированного (C1-С6) алкила, (С2-С6) алкенила, (С2-С6) алкинила, (С3-С6) циклоалкила, (С4-С6) циклоалкенила; арила, гетероциклила, (C1-C6) алкилгетероциклила, гетероциклил (C1-C6) алкила, аминогрупп и их производных; карбониламиногрупп и их производных; гидроксигрупп и их производных; карбонильных групп и их производных; сульфурированных производных;
R2 представляет собой необязательно замещенную группу, выбранную из линейного или разветвленного С1-С6 алкила, арила, гетероарила, С3-С6 циклоалкила, С2-С6 алкенила или С2-С6 алкинила, С3-С6 циклоалкил С1-С6 алкила, арил С1-С6 алкила, гетероарил C1-C6 алкила, 5- или 6-членного гетероциклила и гетероциклил C1-C6 алкила с 1-3 гетероатомами, выбранными из азота, кислорода и серы, где заместитель группы R2 определен выше для R1;
кольцо А представляет собой фенил или гетероцикл; и
m имеет значение от 1 до 6,
где под термином "арильная группа" подразумевается фенильная, нафтильная или бифенильная группы;
под термином "гетероарил" подразумевается необязательно бензоконденсированное 5- или 6-членное ароматическое гетероциклическое кольцо, содержащее от 1 до 3 гетероатомов, выбранных из N, О или S;
под термином "гетероциклил" подразумевается необязательно бензоконденсированный 4-7-членный насыщенный, частично насыщенный или ароматический гетероцикл, содержащий от 1 до 3 гетероатомов, выбранных из N, О и S; и
где аминогруппы и их производные представляют собой (С1-С6) алкиламино, ди(C1-C6) алкиламино, ариламино, диариламино, уреидо, (C1-C6) алкилуреидо или арилуреидо;
карбониламиногруппы и их производные представляют собой формиламино, (C1-C6) алкилкарбониламино, (С2-С6) алкенилкарбониламино, арилкарбониламино, (C1-С6) алкоксикарбониламино;
гидроксигруппы и их производные представляют собой (C1-С6) алкокси, полифторированный (C1-C6) алкокси, арилокси, гетероциклилокси, (C1-C6) алкилкарбонилокси, арилкарбонилокси, (С4-С6) циклоалкенилокси или (С2-С6) алкилиденаминокси;
карбонильные группы и их производные представляют собой (С1-С6) алкилкарбонил, арилкарбонил, (C1-C6) алкоксикарбонил, арилоксикарбонил, (С3-С6) циклоалкилоксикарбонил, аминокарбонил, (C1-С6) алкиламинокарбонил, ди (C1-C6) алкиламинокарбонил;
сульфурированные производные представляют собой (C1-С6) алкилтио, арилтио, (C1-C6) алкилсульфонил, арилсульфонил, (C1-С6) алкилсульфинил, арилсульфинил, арилсульфонилокси, аминосульфонил, (С1-С6) алкиламиносульфонил или ди (С1-С6) алкиламиносульфонил;
или его фармацевтически приемлемой соли в качестве пролекарства для лечения клеточно-пролиферативных расстройств, вызванных и/или связанных с изменением активности протеинкиназы.
2. Применение соединения формулы (I) по п.1 в качестве пролекарства для лечения рака.
3. Фармацевтическая композиция, включающая соединение формулы (I) по п.1 или его фармацевтически приемлемую соль в ассоциации с фармацевтически приемлемым эксципиентом.
4. Применение соединения формулы
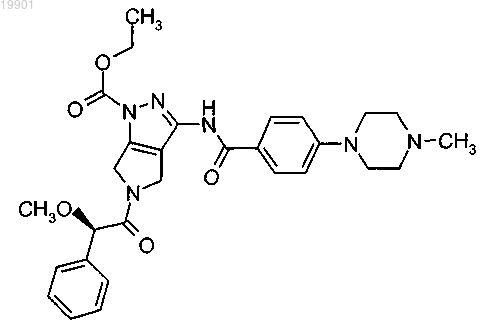
или его фармацевтически приемлемой соли в качестве пролекарства для лечения клеточно-пролиферативных расстройств, вызванных и/или связанных с изменением активности протеинкиназы.
5. Применение соединения по п.4 в качестве пролекарства для лечения рака.
6. Применение соединения, выбранного из группы, включающей
А023 метиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А025 виниловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А026 пропиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А027 изопропиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А028 аллиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А029 пропаргиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А030 бутиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А032 изобутиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А033 трет-бутиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А035 неопентиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А036 гексиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А038 бензиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А041 2-метоксиэтиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
А042 (1R,2S,5R)-2-изопропил-5-метилциклогексиловый эфир 5-((R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты;
С02 этиловый эфир 5-(1-метил-1-фенилэтилкарбамоил)-3-(4-пиперидин-1-илметилбензоиламино)тиено[2,3-е]пиразол-1-карбоновой кислоты;
С068 этиловый эфир 3-[4-(изопропиламинометил)бензоиламино]-5-(1-метил-1-фенилэтилкарбамоил)тиено[2,3-с]пиразол-1-карбоновой кислоты;
D02 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензоиламино]-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-карбоновой кислоты;
Е01 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензоиламино]индазол-1-карбоновой кислоты;
Е040 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[2-((S)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты;
Е060 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[2-((R)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты и
Е080 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты,
в качестве лекарственного средства для лечения клеточно-пролиферативных расстройств, вызванных и/или связанных с изменением активности протеинкиназы.
Текст
КАРБАМОИЛЬНЫЕ ПРОИЗВОДНЫЕ БИЦИКЛИЧЕСКИХ КАРБОНИЛАМИНОПИРАЗОЛОВ В КАЧЕСТВЕ ПРОЛЕКАРСТВ Обеспечиваются бициклические карбониламинопиразолы формулы (I), где переменные имеют значения, определенные в формуле изобретения, для использования в качестве лекарственного средства, в частности, для лечения заболеваний, вызванных нарушением функции протеинкиназ(PK), таких как рак, фармацевтические композиции, включающие такие карбамоильные производные и их применение в качестве пролекарств терапевтически активных веществ. Способ лечения и некоторые новые бициклические карбониламинопиразолы также являются объектом настоящего изобретения.(71)(73) Заявитель и патентовладелец: НЕРВИАНО МЕДИКАЛ САЙЕНСИЗ С.р.л. (IT) Изобретение относится к карбамоильным производным бициклических карбониламино-пиразолов для применения в качестве лекарственного средства, в частности, для лечения заболеваний, вызванных нарушением функции протеинкиназ (РК), таких как рак и опухоли, к фармацевтическим композициям,включающим такие карбамоильные производные, и к их применению в качестве пролекарств терапевтически активных средств. Настоящее изобретение также относится к способу лечения рака и клеточно-пролиферативных расстройств с применением таких пролекарств и к некоторым новым карбамоильным производным. Нарушение функции протеинкиназ (РК) является признаком различных заболеваний. Большая доля онкогенов и протоонкогенов, вовлеченных в раковые заболевания человека, кодируют РК. Повышенные активности РК также связаны со многими незлокачественными заболеваниями, такими как доброкачественная гиперплазия простаты, семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, пролиферация клеток гладких мышц сосудов, связанная с атеросклерозом, фиброз легких, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. РК также вовлечены в воспалительные состояния и в размножение вирусов и паразитов. РК также могут играть существенную роль в патогенезе и развитии нейродегенеративных расстройств. Общие сведения о нарушении или неправильной регуляции функций РК см., например, CurrentOpinion in Chemical Biology 1999, 3, 459-465. Среди некоторых протеинкиназ, известных из уровня техники как вовлеченных в рост раковых клеток, можно указать киназы Aurora, в частности Aurora-2. Было обнаружено, что сверхэкспрессия Aurora-2 имеет место в ряде различных опухолей. Картирование ее локуса имеет место в 20q13, область хромосомы, которая часто амплифицируется при многих типах рака, включая рак молочной железы [Cancer Res. 1999, 59(9), 2041-4] и рак толстой кишки. Амплификация 20q13 коррелирует с плохим прогнозом у пациентов с раком молочной железы без поражения лимфатических узлов, и повышенная экспрессия Aurora-2 является показателем плохого прогноза и уменьшенного периода выживания у пациентов с раком мочевого пузыря [J. Natl. Cancer Inst.,2002, 94(17), 1320-9]. Общие сведения о роли Aurora-2 в аномальной функции центросомы при раке также см. в Molecular Cancer Therapeutics, 2003, 2, 589-595. Рецептор инсулиноподобного фактора роста 1 (IGF-1R, IGF1R) является членом субсемейства инсулиновых рецепторов RTK. Существует несколько линий подтверждения того, что сигнальная активность IGF-1R может способствовать опухолевому генезу и что вмешательство в функцию IGF-1R является ценным терапевтическим подходом при раке. Принудительная экспрессия этого рецептора приводит к лиганд-зависимому трансформированному росту фибробластов мыши и крысы (например, Kaleko M.,Rutter W.J. and Miller A.D. Mol Cell Biol vol. 10, pages 464-73, 1990; Rubini M., Hongo A., D'Ambrosio C.and Baserga R. Exp Cell Res vol. 230, pages 284-92, 1997), и такие трансформированные клетки способны образовывать опухоли in vivo, как с in vitro странсформацией, так и опухолеобразованием in vivo, зависимых от активного киназного домена (см. обзор в Blakesley V.A., Stannard B.S., Kalebic Т., Helman L.J.,and LeRoith D. J Endocrinol, vol. 152, pages 33 9-44, 1997). Соединения, которые заявлены, обладающие активностью ингибирования протеинкиназы, для применения в лечении различных заболеваний, связанных с нарушением функции протеинкиназ, раскрыты например, в WO 02/12242 (различные конденсированные пиразолы); WO 03/028720, WO 08/074749 и WO 09/013126 (аминоиндазолы); WO 04/056827, WO 05/005427, WO 2008017465 и WO 2008043745 (пирролопиразолы); WO 04/007504, WO 04/013146, WO 05/074922, WO 07/009898, WO 07/138017 и ЕР 2058315(фуро- и тиенопиразолы); WO 07/099171, WO 07/068637, WO 07/99166 и WO 07/068619 (арилсульфопирролопиразолы и арилсульфопирролопиридины). Такие патентные заявки также раскрывают способы получения заявленных соединений, которые могут включать промежуточные соединения, которые отличаются тем, что они содержат этоксикарбонильную группу по одному из атомов азота, присутствующих в пиразольном кольце. Все патенты, патентные заявки и научные публикации, на которые ссылаются в настоящем раскрытии, включены в настоящую заявку посредством ссылки. Однако, например, введение и терапевтическая эффективность таких соединений, обладающих активностью ингибирования протеинкиназы, могут быть ограничены из-за низкой или отсутствующей пероральной биодоступности, низкой водорастворимости или стабильности. Более того, поскольку эти химиотерапевтические средства могут быть цитотоксичными для нормальных тканей, применение пролекарств является выгодным с точки зрения снижения побочных эффектов. Известно большое количество пролекарственных стратегий, основанных на различных модификациях исходного лекарственного средства, но ни одна из них не раскрывает и не предлагает специфические пролекарства по настоящему изобретению. Наоборот, указанные выше патентные заявки описывают некоторые карбамоильные производные в качестве полезных промежуточных соединений для химического получения желаемых конечных активных лекарственных средств. Нахождение нового применения, поэтому, является совершенно неожиданным. Задача настоящего изобретения состоит в обеспечении соединения формулы (I) для применения в качестве пролекарства, полезного в терапии в качестве средства против заболеваний хозяина, вызванных и/или связанных с нарушением регуляции активности протеинкиназ, то есть для лечения заболеваний,вызванных нарушением функции протеинкиназ (РК), таких как рак или опухоли. Более конкретно, пролекарства по настоящему изобретению являются полезными для лечения различных типов рака, включая, но не ограничиваясь этим: такую как карциному мочевого пузыря, молочной железы, толстой кишки, почки, печени, легкого, включая мелкоклеточный рак легкого, пищевода,желчного пузыря, яичника, поджелудочной железы, желудка, шейки матки, щитовидной железы, предстательной железы и кожи, включая сквамозно-клеточную карциному; гемотопоэтические опухоли лимфоидного происхождения, включая лейкоз, острый лимфоцитарный лейкоз, острый лимфобластный лейкоз, В-клеточную лимфому, Т-клеточную-лимфому, лимфому Ходжкина, неходжкинскую лимфому, волосисто-клеточную лимфому и лимфому Беркетта; гемотопоэтические опухоли миелоидного происхождения, включая острый и хронический миелогенный лейкозы, миелодиспластический синдром и промиелоцитарный лейкоз; опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому,глиому и шванномы; другие опухоли, включая меланому, семиному, тератокарциному, остеосаркому,пигментную ксеродерму, кератоксантому, тиреоидный фолликулярный рак и саркому Капоши. Поскольку PK играют ключевую роль в регуляции клеточной пролиферации, эти пролекарства также являются полезными для лечения различных клеточно-пролиферативных расстройств, таких как, например, доброкачественная гиперплазия простаты, семейный аденоматоз, полипоз, нейрофиброматоз,псориаз, пролиферация клеток гладких мышц сосудов, связанная с атеросклерозом, фиброз легких, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. Соответственно, в первом варианте воплощения настоящее изобретение обеспечивает применение соединения формулы (I) где R представляет собой линейную или разветвленную С 1-С 3 алкильную группу,R1 представляет собой атом водорода или заместитель, присоединенный к любому доступному атому кольца А, где указанный заместитель выбран из: галогена, нитро, оксогруппы (=O), карбокси, циано,(C1-C6) алкила, полифторированного (С 1-С 6) алкила, (С 2-С 6) алкенила, (С 2-С 6) алкинила, (С 3-С 6) циклоалкила, (С 4-С 6) циклоалкенила; арила, гетероциклила, (C1-C6) алкилгетероциклила, гетероциклил-(C1-C6) алкила, аминогрупп и их производных; карбониламиногрупп и их производных; гидроксигрупп и их производных; карбонильных групп и их производных; сульфурированных производных;R2 представляет собой необязательно замещенную группу, выбранную из линейного или разветвленного С 1-С 6 алкила, арила, гетероарила, С 3-С 6 циклоалкила, С 2-С 6 алкенила или С 2-С 6 алкинила, С 3-С 6 циклоалкил C1-C6 алкила, арил С 1-С 6 алкила, гетероарил С 1-С 6 алкила, 5 или 6-членного гетероциклила и гетероциклил C1-C6 алкила с 1-3 гетероатомами, выбранными из азота, кислорода и серы, где заместитель группы R2 определен выше для R1; кольцо А представляет собой фенил или гетероцикл, иm имеет значение от 1 до 6,где под термином "арильная группа" подразумевается фенильная, нафтильная или бифенильная группы; под термином "гетероарил" подразумевается необязательно бензоконденсированное, 5- или 6 членное ароматическое гетероциклическое кольцо, содержащее от 1 до 3 гетероатомов, выбранных из N,О или S; под термином "гетероциклил" подразумевается необязательно бензоконденсированный 4-7 членный насыщенный, частично насыщенный или ароматический гетероцикл, содержащий от 1 до 3 гетероатомов, выбранных из N, О и S; и где аминогруппы и их производные представляют собой (C1-С 6) алкиламино, ди (C1-C6) алкиламино, ариламино, диариламино, уреидо, (C1-C6) алкилуреидо или арилуреидо; карбониламиногруппы и их производные представляют собой формиламино, (C1-C6) алкилкарбониламино, (С 2-С 6) алкенилкарбониламино, арилкарбониламино, (С 1-С 6) алкоксикарбониламино; гидроксигруппы и их производные представляют собой (C1-С 6) алкокси, полифторированный (C1C6) алкокси, арилокси, гетероциклилокси, (C1-C6) алкилкарбонилокси, арилкарбонилокси, (С 4-С 6) циклоалкенилокси или (С 2-С 6) алкилиденаминокси; карбонильные группы и их производные представляют собой (C1-С 6) алкилкарбонил, арилкарбонил,(C1-C6) алкоксикарбонил, арилоксикарбонил, (С 3-С 6)циклоалкилоксикарбонил, аминокарбонил, (C1-C6) алкиламинокарбонил, ди(C1-C6) алкиламинокарбонил; сульфурированные производные представляют собой (С 1-С 6)алкилтио, арилтио, (C1-C6) алкилсульфонил, арилсульфонил, (С 1-С 6)алкилсульфинил, арилсульфинил, арилсульфонилокси,аминосульфонил, (C1-C6) алкиламиносульфонил или ди(С 1-С 6)алкиламиносульфонил; или его фармацевтически приемлемой соли в качестве пролекарства для лечения клеточнопролиферативных расстройств, вызванных и/или связанных с изменением активности протеинкиназы. Предпочтительно применение соединения формулы (I) в качестве пролекарства для лечения рака. Еще одним объектом настоящего изобретения является применение соединения формулы: или его фармацевтически приемлемой соли в качестве пролекарства для лечения клеточнопролиферативных расстройств, вызванных и/или связанных с изменением активности протеинкиназы. Предпочтительно применени указанного выше соединения в качестве пролекарства для лечения рака. Ещ одним другим объектом настоящего изобретения является применение соединения, выбранного из группы, включающей: А 023 метиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 025 виниловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-арбоновой кислоты; А 026 пропиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 027 изопропиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 028 аллиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 029 пропаргиловый эфир 5-R)-2-метокси-2-фенил-ацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 030 бутиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 032 изобутиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 033 трет-бутиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 035 неопентиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 036 гексиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 038 бензиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 041 2-метоксиэтиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 042 (1R,2S,5R)-2-изопропил-5-метилциклогексиловый эфир 5-R)-2-метокси-2-фенилацетил)-3[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; С 02 этиловый эфир 5-(1-метил-1-фенилэтилкарбамоил)-3-(4-пиперидин-1-илметилбензоиламино) тиено[2,3-c]пиразол-1-карбоновой кислоты; С 068 этиловый эфир 3-[4-(изопропиламинометил)бензоиламино]-5-(1-метил-1-фенилэтилкарбамоил)тиено[2,3-с]пиразол-1-карбоновой кислоты;D02 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензоиламино]-4,5,6,7-тетрагидропиразоле-[4,3-c]пиридин-1-карбоновой кислоты; Е 01 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензоиламино]индазол-1-карбоновой кислоты; Е 040 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[2-S)-2-метокси-1-метилэтиламино)-4-(4 метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты; Е 060 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[2-R)-2-метокси-1-метилэтиламино)-4-(4 метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты; и Е 080 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты, в качестве лекарственного средства для лечения клеточно-пролиферативных расстройств, вызванных и/или связанных с изменением активности протеинкиназы. Объектом настоящего изобретения также является фармацевтическая композиция, включающая охарактризованное выше соединение формулы (I) или его фармацевтически приемлемую соль в ассоциации с фармацевтически приемлемым эксципиентом. Фармацевтически приемлемый эксципиент может представлять собой носитель или разбавитель. Более полное понимание настоящего изобретения и многих связанных с ним преимуществ будет возможным при обращении к следующему далее подробному описанию. Соединения формулы (I) могут содержать асимметрические атомы углерода и поэтому могут существовать либо в виде рацемических смесей, либо в виде индивидуальных оптических изомеров. Соответственно, все возможные изомеры и их смеси также включены в объем настоящего изобретения. В дополнение к указанному выше, как должно быть очевидно, соединения формулы (I) могут существовать в виде изомеров или смесей изомеров формул (Ia) и (Ib) Два изомера формулы (Ia) и (Ib) можно удобным образом разделить в соответствии с хорошо известными способами, например, в условиях хроматографии, и каждый изомер, выделенный таким образом, на следующих стадиях можно подвергнуть обработке. В альтернативном случае, смесь изомеров можно обработать, как на следующих стадиях способа, без какого-либо разделения. Указанный выше способ можно осуществить в соответствии со способами, хорошо известными из уровня техники. Из вышеуказанного специалисту в данной области должно быть понятно, что, когда соединение формулы (I), полученное в соответствии с описанным выше способом, получают в виде смеси изомеров,их разделение на отдельные изомеры формулы (I), осуществляемое в соответствии с традиционными способами, также включено в объем настоящего изобретения. Подобным образом, преобразование в свободное соединение (I) в форме его соответствующей соли в соответствии с хорошо известными способами, также включено в объем настоящего изобретения. В соответствии с настоящим изобретением, кольцо А в формуле (I) выше представляет собой фенил или гетероцикл, такой как где R1 и m определены выше. Когда m имеет значение, отличное от 1 или 0, два или более заместителей, представленные как Rl,могут иметь одинаковое значение, например две метильные группы, или могут иметь разные значения,например атом галогена и алкил, по одному и тому же атому или по двум или более разным атомам кольца А. В свою очередь, когда это является подходящим, каждый из указанных выше заместителей может быть дополнительно замещен одной или несколькими из указанных выше групп. В соответствии со значениями, представленными для группп R и R2, любая из групп, указанных в их определениях выше, необязательно, может быть дополнительно замещена в любом из свободных положений одной или несколькими группами, например 1-6 группами, при этом такие заместители определены выше для R1. Термин "фармацевтически приемлемые соли" охватывает соли, обычно используемые для получения солей щелочных металлов и для получения аддитивных солей со свободными кислотами или свободными основаниями. Природа соли не является критической, при условии, что она является фармацевтически приемлемой. Подходящие фармацевтически приемлемые кислотно-аддитивные соли соединений по настоящему изобретению можно получить из неорганической или органической кислоты. Примеры таких неорганических кислот включают хлористо-водородную, бромисто-водородную, иодистоводородную, азотную, угольную, серную и фосфорную кислоту. Подходящие органические кислоты могут быть выбраны из алифатических, циклоалифатических, ароматических, арилалифатических, гетероциклических, карбоновых и сульфоновых органических кислот, примеры которых включают муравьиную, уксусную, трифторуксусную, пропионовую, янтарную, гликолевую, глюконовую, молочную, яблочную, винную, лимонную, аскорбиновую, глюкуроновую, малеиновую, фумаровую, пирувиновую,аспарагиновую, глутаминовую, бензойную, антраниловую, мезиловую, салициловую, п-гидроксибензойную, фенилуксусную, миндальную, эмбоновую (памовую), метансульфоновую, этансульфоновую,-4 019901 бензолсульфоновую, пантотеновую, толуолсульфоновую, 2-гидроксиэтансульфоновую, сульфаниловую,стеариновую, циклогексиламиносульфоновую, альгеновую, оксимасляную, галактаровую и галактуроновую кислоту. Подходящие фармацевтически приемлемые основно-аддитивные соли соединений по настоящему изобретению включают соли с металлами, полученные из алюминия, кальция, лития, магния,калия, натрия и цинка, или органические соли, полученные из N,N'-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумина (N-метил-глюкамин) и прокаина. Все из этих солей можно получить традиционными способами из соответствующих соединений по настоящему изобретению, например, путем их взаимодействия с подходящей кислотой или основанием. Предпочтительно, настоящее изобретение обеспечивает соединение формулы (Ii), (Iii), (Iiii), (Iiv), (Iv), (Ivi), (Ivii) где m, R, R1 и R2 определены выше; например, когда m имеет значение 2 или 3, дополнительный R1 заместитель(заместители) в фенильном или гетероциклическом кольце представляет собой метильную,этильную или циклопропильную группу. В представленных формулах в настоящей описании пунктирная линия пересекает связь, которая связывает заместитель с основным каркасом молекулы. Предпочтительно R представляет собой группу, выбранную из Предпочтительно, для соединения формулы (Ii), (Iii), (Iiii), (Iiv), (Iv) или (Ivi), Ri представляет собой группу, выбранную из: и, более предпочтительно, определенный выше заместитель R1 в соединении формулы (Iiv), (Iv) или(I ) расположен по гетероатому. Предпочтительно для соединения формулы (Ivii) или (Iviii), R1 представляет собой группу, выбранную из И, наконец, R2 предпочтительно представляет собой группу, выбранную из: Соединения формулы (I) и их фармацевтически приемлемые соли могут быть получены в соответствии со способом, включающим: а) взаимодействие необязательно защищенного бициклического соединения формулы (II): где A, R1, R2 и m определены выше, с любым подходящим агентом для ввода желаемой -С(О)OR группы, где R определен выше, по одному из атомов азота пиразола, таким как хлорформиатное производное, с последующим необязательным удалением защитной группы, если она присутствует;b) если это необходимо, преобразование полученного соединения формулы (I): где A, R, R1, R2 и m определены выше, в другое соединение формулы (I), где один или несколько изRl, R2 или m имеет другое значение, с использованием известных реакций; разделение, если это необходимо, полученных изомеров формулы (Ia) и (Ib), определенных выше, в соответствии с хорошо известными способами; преобразование соединения формулы (I), определенного выше в фармацевтически приемлемую соль, или преобразование соли такого соединения в свободное соединение формулы (I), определенное выше. Ссылки на любое конкретное соединение формулы (I) по настоящему изобретению, необязательно в форме фармацевтически приемлемой соли, смотри в экспериментальном разделе ниже. Альтернативно, соединения формулы (I) по настоящему изобретению также можно получить с ис-8 019901 пользованием хорошо известного способа, описанного в патентной литературе, указанной выше, где такие соединения описаны как полезные промежуточные соединения. Следует отметить, что соединения формулы (II), определенные выше, также могут присутствовать в любой из их таутомерных форм а или b, а не только в а форме, описанной выше: Описанные выше способы являются аналогичными способами, которые можно осуществить в соответствии с методами, известными из уровня техники. Как указано выше, специалистам в данной области должно быть понятно, что, если соединение формулы (I), полученное в соответствии с описанным выше способом, получено в виде смеси изомеров, их разделение на отдельные изомеры формулы (I), осуществляемое в соответствии с традиционными способами, также включено в объем настоящего изобретения. В соответствии со стадией (а) способа конденсированное пиразольное производное формулы (II) подвергают взаимодействию, в соответствии с хорошо известными способами, с агентом для введения желаемой карбамоильной группы (-COOR) по одному из атомов азота пиразола. В качестве примера указанную выше реакцию можно осуществлять с алкилхлорформиатом, который также называют хлоркарбонатом, в подходящем растворителе, таком как тетрагидрофуран, дихлорметан, хлороформ, ацетонитрил, толуол или смеси таких растворителей, при температуре в пределах от около -5 С до около 35 С и в течение времени от около 30 мин до около 72 ч в присутствии подходящего акцептора протонов, такого как триэтиламин или диизопропилэтиламин. На основании вышеизложенного, специалистам в данной области должно быть понятно, что эту реакцию можно осуществлять различными путями и с использованием различных рабочих условий, которые хорошо известны из уровня техники для получения карбамоильных производных. Сведения, касающиеся получения соединений формулы (II) можно найти в опубликованной патентной заявке, на которую имеется ссылка выше. Фармакология Как указано выше, соединения формулы (I) по настоящему изобретению можно применять в качестве лекарственного средства и, в частности, в качестве пролекарства для высвобождения активного исходного лекарственного средства в соответствии с формулой (IA) где A, R1, R2 и m определены выше, in vivo. Выделенные соединения формулы (IA) являются активными в качестве ингибиторов протеинкиназ,более конкретно, ингибиторов киназ Aurora или ингибиторов IGF-R1, и поэтому они являются полезными, например, для ограничения нерегулируемой пролиферации опухолевых клеток. В терапии их можно примененять в лечении различных опухолей, таких как указанные выше, а также в лечении других клеточно-пролиферативных расстройств, таких как псориаз, пролиферация клеток гладких мышц сосудов, связанная с атеросклерозом и послеоперационным стенозом и рестенозом. Ингибиторное действие и активность выбранных соединений определяют методом анализа, основанным на использовании SPA технологии (Amersham Pharmacia Biotech). Анализ включает перенос радиоактивно меченной фосфатной группы при помощи киназы к биотинилированному субстрату. Обеспечивают возможность связывания полученного 33 Р-меченного биотинилированного продукта с имеющими стрептавидиновое покрытие SPA шариками (концентрация биотина 130 пмоль/мг) и испускаемое излучению измеряют с использованием сцинтилляционного счетчика. Анализ ингибирования IGF-1R киназной активности Буферы/компоненты, используемые в анализе, представляли собой следующие. Киназный буфер(буфер KB) состоял из 50 мМ HEPES, 3 мМ MnCl2, 1 мМ DTT, 3 мкМ Na3VO4, pH 7,9. Ферментный буфер (буфер ЕВ) состоял из буфера KB, содержащего 0,6 мг/мл BSA (бычий сывороточный альбумин). Сцинтилляционные шарики SPA (Код продукта RPNQ0007, Amersham Biosciences, Piscataway, NJ USA) получали в виде 10 мг/мл суспензии в PBS, содержащей 32 мМ EDTA, 500 мкМ немеченного АТФ и 0,1% Triton Х-100. Этот препарат указан ниже как "суспензия SPA шариков". В день анализа, IGF-1R предварительно фосфорилировали, чтобы получить линейную кинетику реакции. Для достижения этого желаемое количество фермента инкубировали в течение 30 мин при 28 С при концентрации 1050 нМ фермента в буфер ЕВ, содержащем 100 мкМ немеченного АТФ. После пре-инкубации и непосредственно перед анализом этот предварительно фосфорилированный IGF-1R киназный препарат разбавляли до концентрации фермента 60 нМ путем добавления 16,5 объемов буфера КВ. Этот разбавленный предварительно фосфорилированный фермент указан ниже как "ферментная смесь". Субстрат, используемый в анализе, представлял собой биотинилированный по карбокси-концу пептид, имеющий следующую последовательность: KKKSPGEYVNIEFGGGGGK-биотин. Пептид получали партиями с чистотой пептида 95% от American Peptide Company, Inc. (Sunnyvale, CA, USA). "АТФ смесь", указанная ниже, состояла из буфера KB, содержащего 6 нМ 33Pg-АТФ (гамма фосфат-меченный,Redivue Кодовый номер АН 9968, 1000-3000 Ки/ммоль, Amersham Biosciences Piscataway, NJ USA), 18 мкМ немеченного АТФ и 30 мкМ биотинилированного пептидного субстрата. Этот раствор содержал эти компоненты при 3 Х их конечных концентрациях в реакции. Соединения, которые испытывали, получали в 100% DMSO при подходящих концентрациях. Эти препараты затем разбавляли 33-кратно с использованием буфера KB, с получением соединения при 3 Х желаемой конечной анализируемой концентрации в буфере KB, содержащем 3% DMSO. Этот ЗХ препарат указан ниже как "рабочий раствор соединения". Киназная реакция: реакции осуществляли в 96-луночных микротитровальных планшетах с Uобразным дном (таких как Продукт 650101, Greiner Bio-One, Kremsmuenster Austria) с использованием конечного реакционного объема 30 мкл. В каждую лунку для испытания добавляли 10 мкл "рабочего раствора соединения", содержащего подходящее разведение соединения, с последующим добавлением 10 мкл "АТФ смеси" и 10 мкл "Ферментной смеси", таким образом, запуская реакцию. Содержимое лунок сразу смешивали путем пипетирования и реакционные смеси инкубировали в течение 60 мин при комнатной температуре. После инкубации реакции останавливали путем добавления 100 мкл/лунка "суспензии SPA шариков". Лунки инкубировали еще в течение 15 мин при комнатной температуре, затем из каждой лунки извлекали по 110 мкл и переносили в отдельные лунки 96-луночных непрозрачных сцинтилляционных планшетов (таких как OptiPlate -96, PerkinElraer LAS, Inc. Boston, MA, USA), каждая из которых содержала 100 мкл/лунка 5 М CsCl. После 4 ч покоя при комнатной температуре для обеспечения возможности флотации SPA шариков, эти планшеты считывали с использованием сцинтилляционного счетчика (Packard TopCount NXT, PerkinElmer LAS, Inc. Boston, MA, USA) для количественного определения испускаемого излучения из каждой лунки (пропорционально количеству фосфата, включенного в пептидный субстрат в процессе киназной реакции). Многие из стадий, описанных выше, такие как стадии, включающие разведение соединений, добавление смесей в реакцию, перенос смеси после завершения реакции в счетные планшеты, могут быть автоматизированы с использованием роботизированных устройств для пипетирования (таких как манипуляторы для жидкостей Multimek и Biomek, Beckman Coulter Inc., Fullerton CA USA), и кривую разведения известного ингибитора киназы, такого как стауроспорин, можно включать рутинным образом в качестве положительного контроля для ингибирования IGF-1R. Результаты: данные анализировали с использованием пакета программ "Assay Explorer" (ElsevierMDL, San Leandro, CA 94577). Для отдельных концентраций соединения ингибиторную активность типично выражали как % ингибирования, полученный в присутствии соединения, по сравнению с общей активностью фермента, полученной, когда ингибитор не использовали. Соединения, демонстрирующие желаемое ингибирование, можно подвергнуть дальнейшему анализу для исследования активности ингибитора через вычисление ИК 50. В этом случае, данные ингибирования, полученные с использованием серийных разведений ингибитора, могут быть обработаны при помощи метода нелинейной регрессии с использованием следующего уравнения: где b означает базовую линию скорости,означает наблюдаемую скорость реакции, 0 означает скорость в отсутствие ингибиторов, и [I] означает концентрацию ингибитора. Вестерн-блот-анализ фосфорилирования рецептора после стимуляции при помощи IGF-1 в MCF-7 человеческих раковых клетках молочной железы MCF-7 Клетки (АТСС НТВ-22) высевали в 12-луночные планшеты для культуры ткани при плотности 2105 клеток/лунка в Е-МЕМ среду (МЕМ+ Earle' s BSS+ 2 мМ глутамина + 0,1 мМ заменимых аминокислот) + 10% FCS и инкубировали в течение ночи при 37 С, 5% CO2, 100% относительной влажности. Клетки затем истощали путем замены среды Е-МЕМ +10% FCS средой Е-МЕМ + 0,1% BSA и инкубирования в течение ночи. После этой инкубации лунки обрабатывали желаемыми концентрациями соединения в течение 1 ч при 37 С и затем стимулировали при помощи 10 нМ рекомбинантного человеческогоIGF-1 (Invitrogen, Carlsbad, CA, USA) в течение 10 мин при 37 С. Клетки затем промывали при помощиPBS и лизировали в 100 мкл/лунка буфере для клеточного лизиса (M-PER реагент для экстракции белка млекопитающих [Продукт 78501, Pierce, Rockford, IL, USA] + 10 мМ EDTA+ коктейль ингибитора протеазы [Sigma-Aldrich продукт Р 8340] + коктейль ингибитора фосфатазы [Sigma-Aldrich продукты Р 2850 + Р 5726]). Клеточные лизаты очищали путем центрифугирования при 10000g в течение 5 мин и 10 мкг/полоска очищенного белка лизата вымывали на NuPAGE гели (NuPAGE 4-12% 10-lane Bis-Trisgels, Invitrogen) при помощи протекающего буфера MOPS, затем переносили на Hybond-ECL нитроцеллюлозные фильтры (Amersham Biosciences, Little Chalfont, Buckinghamshire, UK) с использованием MiniTyr1131/InsR Tyr 1146 антитела (продукт 3021, Cell Signaling Technology, Beverly, MA, USA) для детекции фосфорилированного IGF-1R, или 1/1000 разведение кроличьего IGF-1r(H-60) антитела (продуктsc-9038, Santa Cruz Biotechnology, Inc., Santa Cruz, CA, USA) для детекции общего количествацепиIGF-1R. В любом случае, фильтры затем промывали в течение 30 мин, заменяя несколько раз TBS + 0,15% Tween 20, и инкубировали в течение 1 ч в промывочном буфере, содержащем 1/5000 разведение конъюгированного с пероксидазой хрена анти-кроличьего IgG (Amersham, продукт NA934), затем промывали снова и проявляли с использованием ECL хемилюминесцентной системы (Amersham) в соответствии с рекомендациями изготовителя. Если не указано иное, используемые реагенты получали отSigma-Aldrich, St. Louis, МО, USA. Индуцируемое ростовым фактором фосфорилирование S6 рибосомального белка в первичных человеческих фибробластах. Фосфорилирование S6 рибосомального белка в ответ на стимуляцию ростовым фактором нормальных человеческих дермальных фибробластов (NHDF) спользовали для оценки активности соединения по ингибированию индуцированной IGF-1 сигнальной трансдукции в клетках и селективност в отношенииEGF и PDGF стимула. NHDF клетки, полученные от PromoCell (Heidelberg, Germany), поддерживали при 37 С в атмосфере влажности 5% CO2 в полной среде для роста фибробластов (PromoCell). Для анализа,NHDF высевали 384-луночные планшеты для культуры тканей (прозрачные и плоскодонные черные планшеты; Matrix Technologies Inc., Hudson, NH, USA) при плотности 5000 клеток/лунка в бессывороточной среде, содержащей 0,1% бычьего сывороточного альбумина (BSA), и инкубировали в течение 5 дней. Истощенные клетки обрабатывали в течение 1 ч желаемыми дозами соединений и затем стимулировали еще в течение 2 ч при помощи либо 10 нМ IGF-1 (Invitrogen Corp., CA, USA), 10 нМ EGF (GibcoBRL, USA), либо 1 нМ PDGF-B/B (Roche Diagnostics GmbH, Germany). Клетки затем фиксировали вPBS/3,7% параформальдегида в течение 20 мин при комнатной температуре, промывали Х 2 при помощиPBS и обрабатывали путем просачивания PBS/0,3% Triton X-100 в течение 15 мин. Лунки затем насыщали PBS/1% обезжиренного сухого молока (Bio-Rad Laboratories, Hercules, CA, USA) в течение 1 ч и затем зондировали в течение 1 ч при 37 С при помощи анти-фосфо-S6 (Ser 235/236) антитела (Cell SignalingTechnology, Beverly, MA, USA, cat. 2211) при 1/200 разведении в PBS/1% молока/0,3% Tween 20. Лунки затем промывали два раза при помощи PBS и инкубировали в течение 1 ч при 37 С с PBS/1% молока/0,3% Tween 20+1 мкг/мл DAPI (4,6-диамидино-2-фенилиндол) + 1/500 козьего анти-кроличьего Су 5-конъюгированного вторичного антитела (Amersham Biosciences, Little Chalfont, Buckinghamshire, UK). Лунки затем промывали Х 2 при помощи PBS, и 40 мкл PBS оставалось в каждой лунке для иммунофлуоресцентного анализ. Флуоресцентные изображения в DAPI и Су 5 каналах получали автоматически,хранили и анализировали с использованием устройства Cellomics ArrayScanIV (Cellomics, Pittsburgh,USA); использовали алгоритм цитотоксичности Cellomics количественного определения цитоплазматической флуоресценции, ассоциированной с фосфо-S6 (Су 5 сигнальный параметр: "Mean Lyso MasspH"), для каждой клетки в 10 полях/лунка и, в конечном счете, выражали в виде средней величины популяции. Если не указано иное, реагенты получали от Sigma-Aldrich, St. Louis, МО, USA. Анализ ингибирования активности Aurora-2 Киназная реакция: 8 биотинилированный пептид (4 повтора LRRWSLG), 10 АТФ (0,5 мкКи Р 33 АТФ), 7,5 нг Aurora 2, ингибитор в конечном объеме 30 l буфера (HEPES 50 мМ рН 7,0, MgCl2 10 мМ, 1 мМ DTT, 0,2 мг/мл BSA, 3 М ортованадата) добавляли в каждую лунку 96-луночного планшета с Uобразным дном. После 60 мин инкубации при комнатной температуре реакцию останавливали и биотинилированный пептид захватывали путем добавления 100 l суспензии шариков. Стратификация: 100 l CsCl 5 М добавляли в каждуюю лунку и давали выстояться в течение 4 ч перед измерением радиоактивности с использованием счетчика Top-Count. Определение ИК 50: ингибиторы испытывали при разных концентрациях в пределах от 0,0015 до 10 М. Экспериментальные данные анализировали при помощи компьютерной программы GraphPad Prizm с использованием расчетного уравнения с четырьмя параметрами: у = нижнее значение+(верхнее значение-нижнее значение)/(1 + 10logИK50-х)угол наклона где х представляет собой логарифм концентрации ингибитора, у представляет собой ответ; у начинается от нижнего значения и идет к верхнему значению с сигмоидальной формой. Расчет Ki. Экспериментальный способ: реакцию осуществляли в буфере (10 мМ Tris, рН 7,5, 10 мМ MgCl2, 0,2 мг/мл BSA, 7,5 мМ DTT), содержащем 3,7 нМ фермента, гистон и АТФ (постоянное отношение холодный/меченный АТФ 1/3000). Реакцию останавливали при помощи EDTA и субстрат захватывали на фосфомембране (96-луночные планшеты Multiscreen от Millipore). После тщательной промывки планшеты multiscreen считывали при помощи счетчика. Определяли контрольное значение (время ноль) для каждой концентрации АТФ и гистона. План эксперимента: скорости реакций измеряли при четырех концентрациях АТФ, субстрата (гис- 11019901 тон) и ингибитора. Получали 80-точечную матрицу концентраций вокруг соответствующих Km значений АТФ и субстрата и значений ИК 50 для ингибитора (0,3, 1, 3, 9-кратные значения Km или ИК 50). Предварительный в течение определенного времени эксперимент в отсутствие ингибитора и при разных концентрациях АТФ и субстрата позволял выбрать одну конечную точку времени (10 мин) в линейных пределах реакции для эксперимента по определению Ki. Определение кинетических параметров: кинетические параметры определяли путем одновременного использования метода нелинейной регрессии и наименьших квадратов с использованием [уравнение 1] (конкурентный ингибитор относительно АТФ, рандомизированный механизм) с использованием полного комплекта данных (80 точек): где А=[АТФ], В=[cубстрат], I=[ингибитор], Vm= максимальная скорость, Ka, Kb, Ki константы диссоциации АТФ, субстрата и ингибитора, соответственно, и показатель кооперативности связывания между субстратом и АТФ и связывания субстрата и ингибитора соответственно. Соединения по настоящему изобретению также были испытаны, in vitro, для оценки антипролиферативного эффекта на клеточные культуры. Анализ клеточной пролиферации in vitro Клеточную линию рака толстой кишки человека НСТ-116 высевали при 5000 клеток/см 2 в 24 луночный планшет (Costar) с использованием F12 среды (Gibco), дополненной 10% FCS (EuroClone,Italy), 2 мМ L-глутамина и 1% пенициллина/стрептомицина, и поддерживали при 37 С, 5% СО 2 и 96% относительной влажности. На следующий день планшеты обрабатывали два раза при помощи 5 мкл подходящего разведения соединений, начиная с 10 мМ исходного раствора в DMSO. По две необработанные контрольные лунки были включены в каждый планшет. После 72 ч обработки среду удаляли и клетки отделяли из каждой лунки с использованием 0,5 мл 0,05% (мас./об.) трипсина, 0,02% (мас./об.) EDTA(Gibco). Образцы разбавляли при помощи 9,5 мл изотона (Coulter) и подсчитывали с использованием 3 ячеечного счетчика Multisizer (Beckman Coulter). Данные оценивали как процент от контрольных лунок:% от CTR = (Обработка - Слепой опыт)/(Контроль - Слепой опыт). Значения ИК 50 рассчитывали при помощи LSW/Анализа данных с использованием сигмоидальной кривой Microsoft Excel. Как указано выше, соединения формулы (I) по настоящему изобретению оказались чрезвычайно полезными в качестве лекарственного средства, предпочтительно в качестве пролекарств, еще более предпочтительно в качестве пролекарств для лечения заболеваний, вызванных нарушением функции протеинкиназ (РК), таких опухолей. Примеры биодоступности В табл. I ниже представлены экспериментальные данные для некоторых репрезентативных соединений по настоящему изобретению, которые были испытаны. Соединения формулы (I), сформулированные в 0,5% Methocel, вводили перорально мышам (10-100 мг/кг) в фармакокинетических испытаниях и преобразование соединений формулы (I) в соответствующее исходное активное соединение (IA), определенное выше (т.е. без -COOR группы, где R имеет значение, определенное выше) отслеживали в крови при помощи ВЭЖХ/МС анализа в точке времени 15 и 30 мин, 1, 6 и 24 ч после введения. Все образцы крови брали из подкожной вены задней конечности. Пероральную биодоступность (Fos) рассчитывали как процентное отношение среднего п/о значенияAUC исходного соединения после введения пролекарства к среднему в/в значению AUC исходного соединения после введения исходного соединения как такового после нормализации дозы исходного соединения. Кроме того, было показано, что испытываемые соединения также обладают чрезвычайно замечательным антипролиферативным эффектом. Исходя из вышеизложенного, оказалось, что соединения формулы (I) по настоящему изобретению имеют биологический профиль, который, рассматриваемый в целом, неожиданно превосходит известный из уровня техники, и, следовательно, являются особенно полезными в терапии против пролиферативных расстройств, связанных с изменением киназной активности,в частности, изменением активности киназы Aurora-2. Соединения по настоящему изобретению можно вводить либо в виде отдельного средства, либо,альтернативно, в сочетании с известными противораковыми лечениями, такими как лучевая терапия или химиотерапия, в сочетании с цитостатическими или цитотоксичными средствами, антибиотиками, алкилирующими средствами, антиметаболитными средствами, гормональными средствами, иммунологическими средствами, средствами типа интерферона, ингибиторами циклооксидазы (например, ингибиторами СОХ-2), ингибиторами металлопротеиназы матрикса, ингибиторами теломеразы, ингибиторами тирозиновых киназ, средствами против рецепторов факторов роста, анти-HER средствами, анти-EGFR средствами, средствами против ангиогенеза (например, ингибиторами ангиогенеза), ингибиторами фарнезилтрансферазы, ингибиторами пути сигнальной трансдукции ras-raf, ингибиторами клеточного цикла, другими ингибиторами cdks, агентами связывания тубулина, ингибиторами топоизомеразы I, ингибиторами топоизомеразы II и подобными средствами. Когда они сформулированы в виде фиксированной дозы, такие продукты сочетания включают соединения по настоящему изобретению в пределах доз, которые описаны ниже, и другое фармацевтически активное средство в установленных пределах доз. Соединения формулы (I) можно использовать последовательно с известными противораковыми средствами, когда комбинированная композиция не является подходящей. Соединения формулы (I) по настоящему изобретению, подходящие для введения млекопитающему,например человеку, можно вводить обычным путем, и уровень доз зависит от возраста, массы тела и состояния пациента, а также пути введения. Например, подходящая доза, принятая для перорального введения соединения формулы (I), может находиться в пределах от около 10 до около 500 мг на дозу, от 1 до 5 раз в день. Соединения по настоящему изобретению можно вводить в различных лекарственных формах, например, перорально в форме таблеток, капсул, таблеток с сахарным или пленочным покрытием, жидких растворов или суспензий; ректально в форме суппозиториев; парентерально, например, внутримышечно или при помощи внутривенной, и/или интратекальной, и/или интраспинальной инъекции или инфузии. Настоящее изобретение также включает фармацевтические композиции, включающие соединение формулы (I) или его фармацевтически приемлемую соль в ассоциации с фармацевтически приемлемым эксципиентом, который может представлять собой носитель или разбавитель. Еще одним объектом поэтому является применение соединения формулы (I) или его фармацевтически приемлемой соли, определенных выше, для получения лекарственного средства для лечения заболевания, вызванного и/или связанного с нарушенной регуляцией активности протеинкиназ, в частности,для лечения заболевания, вызванного и/или связанного снарушенной регуляцией активности IGF-1R или киназ Aurora, предпочтительно с нарушенной регуляцией активности киназ Aurora. Такое лекарственное средство также обеспечивает ингибирование ангиогенеза и метастазов опухоли. Заболевание, подлежащее лечению, предпочтительно выбрано из группы, включающей рак, клеточно-пролиферативные расстройства, вирусные инфекции, ретинопатии, включая диабетическую и неонатальную ретинопатии и возрастную дегенерацию желтого пятна, атеросклероз и состояния, включающие пролиферацию клеток гладких мышц сосудов или образование неоинтимы, такие как рестеноз после ангиопластики или хирургической операции, заболевание сосудов трансплантата, такие, которые возникают после трансплантации сосудов или органа, акромегалию и вторичные расстройства,связанные с акромегалией, а также другие гипертрофические состояния, в которые вовлечена передача сигнала IGF/IGF-1R, такие как доброкачественная гиперплазия простаты, псориаз, фиброзные заболевания легких, фиброз легких, патологии, связанные с хроническим или острым окислительным стрессом или вызванным гипероксией поражением ткани, и метаболические расстройства с повышенным уровнем IGF или повышенной активностью IGF-1R, такие как ожирение. Еще одним объектом настоящего изобретения является применение соединения формулы (I) или его фармацевтически приемлемой соли, определенных выше, для получения лекарственного средства с противоопухолевой активностью. В соответствии с настоящим изобретением подлежащий лечению рак выбран из группы, включающей карциному, сквамозно-клеточную карциному, гемотопоэтические опухоли миелоидного или лимфоидного происхождения, опухоли мезенхимального происхождения, опухоли центральной и периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, пигментную ксеродерму,кератоксантомы, тиреоидный фолликулярный рак и саркому Капоши. Кроме того, подлежащий лечению рак выбран из группы, включающей рака молочной железы, рак легкого, колоректальный рак, рак предстательной железы, рак яичников, эндометриальный рак, рак жедулка, светлоклеточную почечноклеточную карциному, увеальную меланому, множественную миелому,- 14019901 рабдомиосаркому, саркому Эвинга, саркому Капоши и медуллобластому. Подлежащее лечению клеточно-пролиферативное расстройство выбрано из группы, включающей доброкачественную гиперплазию простаты, семейный аденоматоз, полипоз, нейрофиброматоз, псориаз,пролиферацию клеток гладких мышц сосудов, связанную с атеросклерозом, фиброз легких, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. Фармацевтические композиции, содержащие соединения по настоящему изобретению, обычно получают традиционными способами и вводят в подходящей фармацевтической форме. Например, твердые пероральные формы могут содержать, вместе с активным соединением, разбавители, например лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; смазывающие вещества, например диоксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связующие, например крахмалы, аравийскую камедь, желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; разрыхлители, например крахмал, альгиновую кислоту, альгинаты или натрий крахмал гликолят; смеси шипучих веществ; красители; подсластители; смачивающие вещества, такие как лецитин, полисорбаты, лаурилсульфаты; и, как правило, нетоксичные и фармакологически неактивные вещества, используемые для формулирования фармацевтических композиций. Эти фармацевтические препараты можно получать известными способами, например, путем смешивания, гранулирования, таблетирования, нанесения сахарного покрытия или пленочного покрытия. Жидкие дисперсии для перорального введения могут представлять собой, например, сиропы,эмульсии и суспензии. В качестве примера, сиропы могут содержать в качестве носителя, сахарозу или сахарозу с глицерином и/или маннитом и сорбит. Суспензии и эмульсии могут содержать, в качестве примеров носителей, природную камедь, агар,альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинил спирт. Суспензии или растворы для внутримышечных инъекций могут содержать, вместе с активным соединением, фармацевтически приемлемый носитель, например стерильную воду, оливковое масло, этилолеат, гликоли, например пропиленгликоль, и, если это желательно, подходящее количество лидокаингидрохлорида. Растворы для внутривенных инъекций или инфузий могут содержать в качестве носителя стерильную воду, или, предпочтительно, они могут быть в форме стерильных водных изотонических солевых растворов, или они могут содержать пропиленгликоль в качестве носителя. Суппозитории могут содержать, вместе с активным соединением, фармацевтически приемлемый носитель, например масло какао, полиэтиленгликоль, поверхностно-активное вещество на основе сложного эфира жирной кислоты полиоксиэтиленсорбитана или лецитин. Примеры Следующие далее примеры предназначены для иллюстрации, а не для какого-либо ограничения изобретения. Хотя изобретение описано со ссылкой на конкретные способы и варианты воплощения,должно быть понятно, что возможны различные модификации без отступления от настоящего изобретения. Пример 1. Этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензоиламино]-4,5,6,7-тетрагидропиразоле-[4,3-c]пиридин-1-карбоновой кислоты К раствору N-[5-(3,5-дифторбензолсульфонил)-4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-c]пиридин-3 ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамида (1,38 г, 2,24 ммоль) в безводном ТГФ (150 мл), охлажденному до -40 С, в атмосфере аргона, добавляли бис(триметилсилил)амид лития 1,0 М в ТГФ (2,35 мл, 2,35 ммоль). Смесь перемешивали в течение 5 мин. Затем добавляли этилхлорформиат (0,225 мл, 2,35 ммоль). Реакционную смесь перемешивали при -40 С в течение 1 ч, затем выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали водой, насыщенным солевым раствором и сушили при помощи сульфата натрия. После фильтрования и упаривания неочищенное вещество растирали в порошок с простым эфиром с получением указанного в заголовке соединения в виде белого твердого вещества (1,32 г, 86%). 1 Н-ЯМР (400 МГц),(м.д., ДМСО-d6): 10,49 (ушир.с, 1 Н), 8,27 (д, J=7,56 Гц, 1 Н), 7,75 (д, J=9,15 Гц,1 Н), 7,70 (м, 1 Н), 7,57 (м, 2 Н), 6,22 (дд, J1=2,07 Гц, J2 = 9,15 Гц, 1 Н), 6,12 (д, J=2,07 Гц, 1 Н), 4,39 (кв.,J=7,07 Гц, 2 Н), 4,08 (ушир.с, 2 Н), 3,82 (м, 2 Н), 3,73 (м, 1 Н), 3,55-3,49 (м, 4 Н), 3,28 (т, J=5,12 Гц, 4 Н), 3,02 К раствору (1-метил-1-фенилэтил)амида 3-(4-пиперидин-1-илметилбензоиламино)-1 Н-тиено[2,3-c] пиразол-5-карбоновой кислоты (500 мг, 1 ммоль) в безводном ТГФ (20 мл) добавляли диизопропилэтиламин (1,027 мл, 6 ммоль) по каплям при комнатной температуре. Реакционную смесь перемешивали в течение 5 мин и затем также по каплям добавляли этилхлорформиат (130 мг, 0,115 мл, 1,2 ммоль). После перемешивания в течение 1 ч растворитель выпаривали, неочищенное вещество, поглощенное в дихлорметан, тщательно промывали водой, насыщенным солевым раствором и сушили при помощи сульфата натрия. После фильтрования и упаривания неочищенное вещество растирали в порошок с простым этиловым эфиром с получением указанного в заголовке соединения в виде белого твердого вещества. 1 Н-ЯМР (400 МГц),(м.д., ДМСО-d6): 1,39 (т, 3 Н), 1,47-1,91 (м, 12 Н), 2,27-2,99 (м, 4 Н), 3,53 (м,1 Н), 4,38 (м, 1 Н), 4,52 (кв., 2 Н), 7,19 (м, 1 Н), 7,31 (м, 2 Н), 7,39 (м, 2 Н), 7,73 (м, 2 Н), 8,20 (м, 2 Н), 8,37 (с,1 Н), 8,88 (ушир.с, 1 Н), 11,80 (ушир.с, 1 Н). [М+Н]+ 574; HRMS (ES+) рассчитано 574,2483, найдено 574,2463. Пример 8. Метиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты (А 023). Следуя процедуре, аналогичной описанной в примере 7, получали указанное в заголовке соединение. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 2,22 (с, 3 Н), 2,43 (м, 4 Н), 3,31 (м, 4 Н), 3,34 (дс, 3 Н), 3,94 (дс,3 Н), 4,36-4,99 (м, 4 Н), 5,12 (дс, 1 Н), 6,96 (д, 2 Н), 7,32-7,45 (м, 5 Н), 7,93 (дд, 2 Н), 11,11 (ушир.с, 1 Н). Н ЯМР (400 МГц, ДМСО-d6)м.д. 0,76 (м, 3 Н), 0,92, (м, 6 Н), 1,46-1,96 (м, 7 Н), 2,06 (м, 2 Н), 2,23 (с,3 Н), 2,44 (м, 4 Н), 3,29-3,33 (м, 4 Н), 3,35, 3,37 (дс, 3 Н), 4,53-4,98 (м, 5 Н), 5,13 (с, 1 Н), 6,97 (д, 2 Н), 7,337,45 (м, 5 Н), 7,94 (м, 2 Н), 11,15 (д, 1 Н). [М+Н]+ 657; HRMS (ES+) рассчитано 657,3759, найдено 657,3781. Пример 21. Бензиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты (А 038). Следуя процедуре, аналогичной описанной в примере 7, получали указанное в заголовке соединение. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 2,24 (с, 3 Н), 2,46 (м, 4 Н), 3,30 (м, 4 Н), 3,34 (с, 3 Н), 4,49-4,94 (м,4 Н), 5,01, 5,13 (дс, 1 Н), 5,42 (с, 2 Н), 6,97 (д, 2 Н), 7,31-7,55 (м, 10 Н), 7,94 (м, 2 Н), 11,13 (д, 1 Н) [М+Н]+ 608; HRMS (ES+) рассчитано 609,2820, найдено 609,2823. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы (I) где R представляет собой линейную или разветвленную C1-C3 алкильную группу;R1 представляет собой атом водорода или заместитель, присоединенный к любому доступному атому кольца А, где указанный заместитель выбран из галогена, нитро, оксогруппы (=O), карбокси, циано,(C1-C6)алкила, полифторированного (C1-С 6) алкила, (С 2-С 6) алкенила, (С 2-С 6) алкинила, (С 3-С 6) циклоалкила, (С 4-С 6) циклоалкенила; арила, гетероциклила, (C1-C6) алкилгетероциклила, гетероциклил-(C1-C6) алкила, аминогрупп и их производных; карбониламиногрупп и их производных; гидроксигрупп и их производных; карбонильных групп и их производных; сульфурированных производных;R2 представляет собой необязательно замещенную группу, выбранную из линейного или разветвленного С 1-С 6 алкила, арила, гетероарила, С 3-С 6 циклоалкила, С 2-С 6 алкенила или С 2-С 6 алкинила, С 3-С 6 циклоалкил С 1-С 6 алкила, арил С 1-С 6 алкила, гетероарил C1-C6 алкила, 5- или 6-членного гетероциклила и гетероциклил C1-C6 алкила с 1-3 гетероатомами, выбранными из азота, кислорода и серы, где заместитель группы R2 определен выше для R1; кольцо А представляет собой фенил или гетероцикл иm имеет значение от 1 до 6,где под термином "арильная группа" подразумевается фенильная, нафтильная или бифенильная группы; под термином "гетероарил" подразумевается необязательно бензоконденсированное 5- или 6 членное ароматическое гетероциклическое кольцо, содержащее от 1 до 3 гетероатомов, выбранных из N,О или S; под термином "гетероциклил" подразумевается необязательно бензоконденсированный 4-7 членный насыщенный, частично насыщенный или ароматический гетероцикл, содержащий от 1 до 3 гетероатомов, выбранных из N, О и S; и где аминогруппы и их производные представляют собой (С 1-С 6) алкиламино, ди(C1-C6) алкиламино,ариламино, диариламино, уреидо, (C1-C6) алкилуреидо или арилуреидо; карбониламиногруппы и их производные представляют собой формиламино, (C1-C6) алкилкарбониламино, (С 2-С 6) алкенилкарбониламино, арилкарбониламино, (C1-С 6) алкоксикарбониламино; гидроксигруппы и их производные представляют собой (C1-С 6) алкокси, полифторированный (C1C6) алкокси, арилокси, гетероциклилокси, (C1-C6) алкилкарбонилокси, арилкарбонилокси, (С 4-С 6) циклоалкенилокси или (С 2-С 6) алкилиденаминокси; карбонильные группы и их производные представляют собой (С 1-С 6) алкилкарбонил, арилкарбонил,(C1-C6) алкоксикарбонил, арилоксикарбонил, (С 3-С 6) циклоалкилоксикарбонил, аминокарбонил, (C1-С 6) алкиламинокарбонил, ди(C1-C6) алкиламинокарбонил; сульфурированные производные представляют собой (C1-С 6) алкилтио, арилтио, (C1-C6) алкилсульфонил, арилсульфонил, (C1-С 6) алкилсульфинил, арилсульфинил, арилсульфонилокси, аминосульфонил,(С 1-С 6) алкиламиносульфонил или ди(С 1-С 6) алкиламиносульфонил; или его фармацевтически приемлемой соли в качестве пролекарства для лечения клеточнопролиферативных расстройств, вызванных и/или связанных с изменением активности протеинкиназы. 2. Применение соединения формулы (I) по п.1 в качестве пролекарства для лечения рака. 3. Фармацевтическая композиция, включающая соединение формулы (I) по п.1 или его фармацевтически приемлемую соль в ассоциации с фармацевтически приемлемым эксципиентом. 4. Применение соединения формулы или его фармацевтически приемлемой соли в качестве пролекарства для лечения клеточнопролиферативных расстройств, вызванных и/или связанных с изменением активности протеинкиназы. 5. Применение соединения по п.4 в качестве пролекарства для лечения рака. 6. Применение соединения, выбранного из группы, включающей А 023 метиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 025 виниловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 026 пропиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 027 изопропиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 028 аллиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 029 пропаргиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 030 бутиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 032 изобутиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 033 трет-бутиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 035 неопентиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 036 гексиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 038 бензиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 041 2-метоксиэтиловый эфир 5-R)-2-метокси-2-фенилацетил)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; А 042 (1R,2S,5R)-2-изопропил-5-метилциклогексиловый эфир 5-R)-2-метокси-2-фенилацетил)-3[4-(4-метилпиперазин-1-ил)бензоиламино]-5,6-дигидро-4 Н-пирроло[3,4-с]пиразол-1-карбоновой кислоты; С 02 этиловый эфир 5-(1-метил-1-фенилэтилкарбамоил)-3-(4-пиперидин-1-илметилбензоиламино) тиено[2,3-е]пиразол-1-карбоновой кислоты; С 068 этиловый эфир 3-[4-(изопропиламинометил)бензоиламино]-5-(1-метил-1-фенилэтилкарбамоил)тиено[2,3-с]пиразол-1-карбоновой кислоты;D02 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензоиламино]-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-карбоновой кислоты; Е 01 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензоиламино]индазол-1-карбоновой кислоты; Е 040 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[2-S)-2-метокси-1-метилэтиламино)-4-(4 метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты; Е 060 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[2-R)-2-метокси-1-метилэтиламино)-4-(4 метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты и Е 080 этиловый эфир 5-(3,5-дифторбензолсульфонил)-3-[2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты,в качестве лекарственного средства для лечения клеточно-пролиферативных расстройств, вызванных и/или связанных с изменением активности протеинкиназы.
МПК / Метки
МПК: C07D 231/56, C07D 471/04, A61K 31/4162, A61P 35/00, A61K 31/416, C07D 487/04, C07D 497/04
Метки: бициклических, качестве, карбамоильные, карбониламинопиразолов, производные, пролекарств
Код ссылки
<a href="https://eas.patents.su/21-19901-karbamoilnye-proizvodnye-biciklicheskih-karbonilaminopirazolov-v-kachestve-prolekarstv.html" rel="bookmark" title="База патентов Евразийского Союза">Карбамоильные производные бициклических карбониламинопиразолов в качестве пролекарств</a>
Предыдущий патент: Бездымная сигарета
Следующий патент: Способ получения низкоконцентрированного этилена для химического применения
Случайный патент: Способ выполнения рельефного сварного соединения и устройство












