Сульфонамидные производные в качестве пролекарств, ингибиторов аспартилпротеаз
Номер патента: 3509
Опубликовано: 26.06.2003
Авторы: Казмерский Веслав Мечислав, Танг Роджер Д., Бейкер Кристофер Т., Ферфайн Эрик Стивен, Спалтенштейн Эндрю, Хейл Майкл Р., Кальдор Иштван
Формула / Реферат
1. Соединение формулы
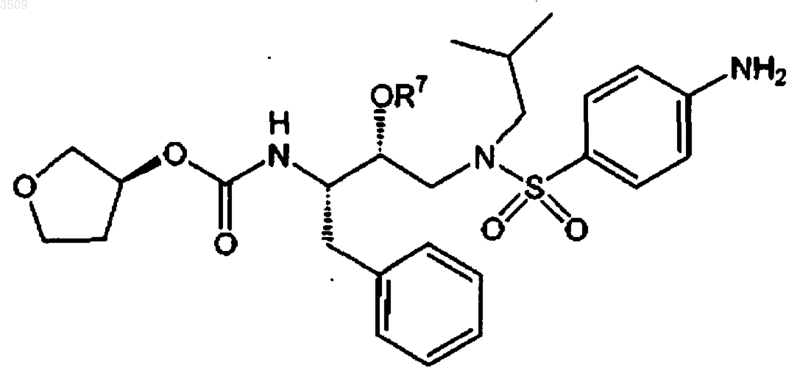
где R7 выбран из -PO32-Na2+, -PO32-K2+, -PO32-Mg2+,
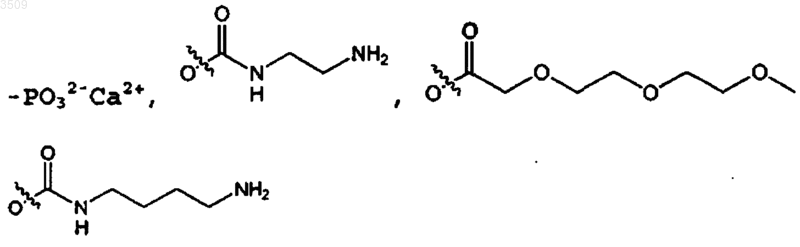
2. Соединение по п.1, где R7 выбран из -PO32-Na2+, -PO32-K2+ или -PO32-Ca2+.
3. Соединение по п.2, где R7 представляет собой -PO32-Ca2+.
4. Фармацевтическая композиция, содержащая соединение, охарактеризованное в любом из пп.1-3, в количестве, эффективном для лечения инфекции, вызванной вирусом, характеризующимся наличием аспартилпротеазы; и фармацевтически приемлемый носитель, адъювант или наполнитель.
5. Фармацевтическая композиция по п.4, где указанный вирус представляет собой ВИЧ.
6. Фармацевтическая композиция по п.4, где указанная фармацевтическая композиция приготовлена для перорального применения.
7. Фармацевтическая композиция по п.4, дополнительно содержащая один или несколько агентов, независимо выбранных из противовирусного средства, ингибитора протеазы ВИЧ, отличного от соединения, охарактеризованного в п.1, или иммуностимулятора.
8. Фармацевтическая композиция по п.7, дополнительно содержащая один или несколько агентов, выбранных из зидовудина (AZT), зальцитабина (ddC), диданозина (ddI), ставудина (d4T), ламивудина (3TC), абакавира (1592U89), саквинавира (Ro 31-8959), индинавира (MK-639, L-735,524), ритонавира (ABT 538, A84538), нелфинавира (AG 1343), XM 450, CGP 53,437, 935U83, 524W91, SC-52151, XM 412, тускаразола, полисульфированных полисахаридов, ганцикловира, дидеоксицитидина, рибавирина, ацикловира, TIBO, невирапина, IL-2, GM-CSF, альфа интерферона или эритропоэтина (EPO).
9. Способ ингибирования аспартилпротеазной активности у млекопитающих, включающий стадию контактирования указанного млекопитающего с фармацевтической композицией, охарактеризованной в п.4, или введения указанному млекопитающему фармацевтической композиции, охарактеризованной в п.4.
10. Способ лечения ВИЧ-инфекции у млекопитающего, включающий стадию введения указанному млекопитающему фармацевтической композиции, охарактеризованной в п.4.
11. Способ по п.10, где указанному млекопитающему дополнительно вводят одно или несколько дополнительных средств, выбранных из противовирусного средства, ингибитора протеазы ВИЧ, отличного от соединения, охарактеризованного в п.1, или иммуностимулятора, либо в виде части одной дозированной формы с указанной фармацевтической композицией, либо в виде дробной дозированной формы.
12. Способ по п.11, где указанное одно или несколько дополнительных средств выбраны из зидовудина (AZT), зальцитабина (ddC), диданозина (ddI), ставудина (d4T), ламивудина (3TC), абакавира (1592U89), саквинавира (Ro 31-8959), индинавира (MK-639, L-735,524), ритонавира (ABT 538, A84538), нелфинавира (AG 1343), XM 450, CGP 53,437, 935U83, 524W91, SC-52151, XM 412, тускаразола, полисульфированных полисахаридов, ганцикловира, дидеоксицитидина, рибавирина, ацикловира, TIBO, невирапина, IL-2, GM-CSF, альфа интерферона или эритропоэтина (EPO).
13. Способ по п.10, где указанная стадия введения включает пероральное введение.
Текст
1 Область техники Настоящее изобретение относится к пролекарствам класса сульфонамидов, которые представляют собой ингибиторы аспартилпротеаз. В одном из воплощений данное изобретение относится к новому классу пролекарств,являющихся ингибиторами аспартилпротеаз ВИЧ, характеризующихся хорошей водорастворимостью, высокой биологической доступностью при пероральном применении и легким воспроизведением in vivo активного компонента. Данное изобретение также относится к фармацевтическим композициям, содержащим данные пролекарства. Пролекарство и фармацевтические препараты по данному изобретению,являются особенно хорошо подходящими для снижения лекарственной нагрузки и большего удобства пациентов. Данное изобретение также относится к способам лечения млекопитающих данными пролекарствами и фармацевтическими композициями. Предпосылки изобретения Ингибиторы аспартилпротеаз рассматривают как наиболее эффективное существующее лекарство против ВИЧ-инфекции. Однако данные ингибиторы должны обладать определенными физико-химическими свойствами для достижения хорошей эффективности против фермента. Одним из данных свойств является высокая гидрофобность. К сожалению, данное свойство выражается в плохой водорастворимости и низкой биологической доступности при пероральном применении. В патенте США 5585397 описан класс сульфонамидных соединений, представляющих собой ингибиторы аспартилпротеаз. Данные соединения иллюстрируют недостатки, присущие фармацевтическим композициям, содержащим гидрофобные ингибиторы аспартилпротеаз. Например, VX-478 (4-амино-N-2-син,3S)2-гидрокси-4-фенил-3S)-тетрагидрофуран-3 ил-оксикарбониламино)-бутил-N-изобутилбензолсульфонамид) является ингибитором аспартилпротеаз, описанным в патенте 5585397. Он обладает относительно низкой водорастворимостью. Хотя биологическая доступность при пероральном применении данного ингибитора в виде растворов является превосходной, дозировка VX-478 в данном виде является строго ограниченной количеством присутствующей жидкости в отдельной жидкой дозированной форме, например, инкапсулированной в мягкую желатиновую капсулу. Более высокая водорастворимость позволит увеличить количество лекарства в разовой дозированной форме VX-478. В настоящее время препараты в виде растворов VX-478 обеспечивает верхний предел дозировки 150 мг VX-478 в каждой капсуле. При необходимой терапевтической дозе в 2400 мг/сутки VX-478, использование данной формы вынудит пациента принимать 16 капсул в сутки. 2 Подобная высокая лекарственная нагрузка будет, вероятно, приводить к неудобству для пациента, таким образом приводя к субоптимальной терапевтической пользе лекарства. Высокая лекарственная нагрузка также сдерживает увеличение количества лекарства, принимаемого в сутки пациентом. Другой недостаток лекарственной нагрузки и сопутствующей проблемы участия пациента проявляется при лечении детей, инфицированных ВИЧ. Более того, данные препараты в виде растворов, такие как мезилатный препарат, содержат насыщенный раствор VX-478. Это создает реальную возможность кристаллизации лекарственного вещества из раствора при различных условиях хранения и/или транспортировки. Это,в свою очередь, вероятно, будет приводить к некоторому уменьшению биологической доступности при пероральном применении, достигаемой при применении VX-478. Одним путем решения данных проблем является создание стандартной твердой дозированной формы, такой как таблетка или капсула,или суспензионной формы. К сожалению, подобные твердые дозированные формы обладают гораздо более низкой биологической доступностью при пероральном применении лекарства. Таким образом, существует необходимость в усовершенствовании лекарственной нагрузки на единицу дозированной формы для ингибиторов аспартилпротеаз. Подобная усовершенствованная дозированная форма будет снижать лекарственную нагрузку и увеличивать участие пациента в лечении. Также будет обеспечиваться возможность увеличения количества лекарства, принимаемого пациентом в сутки. Сущность изобретения Настоящее изобретение относится к новым пролекарствам, класса сульфонамидных соединений, которые являются ингибиторами аспартилпротеаз, в частности, аспартилпротеаз ВИЧ. Данные пролекарства характеризуются превосходной водорастворимостью, повышенной биологической доступностью и легко метаболизируются в активные ингибиторы in vivo. Настоящее изобретение относится к фармацевтическим композициям, содержащим данные пролекарства, и способам лечения ВИЧ-инфекции млекопитающих с помощью данных пролекарств и фармацевтических композиций на их основе. Данные пролекарства могут применяться отдельно или в сочетании с другими терапевтическими или профилактическими средствами,такими как противовирусные средства, антибиотики, иммуномодуляторы или вакцины, для лечения или профилактики вирусной инфекции. Основным объектом настоящего изобретения являются новые пролекарства класса сульфонамидных соединений, которые являются ингибиторами аспартилпротеаз, в частности,ингибиторами аспартилпротеаз ВИЧ. Данный новый класс сульфонамидов представлен формулой-PO32-K2+, Объектом данного изобретения также являются фармацевтические композиции, содержащие сульфонамидные производные, указанные выше, и способы их применения в качестве ингибиторов аспартилпротеаз ВИЧ. Подобное описание изобретения Для того чтобы описываемое здесь изобретение было более понятно, представлено следующее подробное описание. В описании используют следующие сокращения: Обозначения Ас Реагент или фрагмент ацетил метил этил бензил трифенилметилD- или L-валин трет-бутоксикарбонил бензилоксикарбонил(карбобензилокси) 9-флуоренилметоксикарбонил дициклогексилкарбодиимид диизопропилкарбодиимид 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид 1-гидроксибензотриазол 1-гидроксисукцинимид трифторуксусная кислота диизопропилэтиламин 1,8-диазобицикло (5.4.0)-ундец-7-ен этилацетат Здесь используются следующие термины. Если не указано иного, термины "-SO2-" и"-S(O)2-", используемые здесь, относятся к сульфону или производному сульфона (т.е. обе группы присоединены к S), а не к сложному сульфинатному эфиру. Для соединений указанной формулы и промежуточных соединений стереохимию группы OR7 определяют относительно бензильной группы на соседнем атоме углерода, когда молекулу изображают в виде вытянутого зигзага. Если оба они, и OR7, и бензильная группа,располагаются по одну сторону от плоскости,определяемой вытянутым скелетом соединения,то стереохимия OR7, несущего атом углерода, 4 будет относиться к "син". Если OR7 и бензильная группа располагаются по разные стороны плоскости, стереохимия OR7, несущего атом углерода, будет относиться к "анти". Термины "протеаза ВИЧ" и "аспартилпротеаза ВИЧ" являются взаимозаменяемыми и относится к аспартилпротеазе, кодируемой вирусом иммунодефицита человека типа 1 или 2. В предпочтительном воплощении данного изобретения данные термины относятся к аспартилпротеазе вируса иммунодефицита человека типа 1. Термин "фармацевтически эффективное количество" относится к количеству, эффективному при лечении ВИЧ-инфекции у пациента. Термин "профилактически эффективное количество" относятся к количеству, эффективному для предупреждения ВИЧ-инфекции у пациента. Используемый здесь термин "пациент" относится к млекопитающему, включая человека. Термин "фармацевтически приемлемый носитель или адъювант" относится к нетоксичному носителю или адъюванту, который может быть введен пациенту вместе с соединением по данному изобретению и который не нарушает фармакологической активности данного соединения. Фармацевтически приемлемые соли соединений по данному изобретению включают соли, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. Примерами подходящих кислот являются хлористо-водородная,бромистоводородная, серная, азотная, надхлорная, фумаровая, малеиновая, фосфорная, гликолевая, молочная, салициловая, янтарная, п-толуолсульфоновая, винная, уксусная, лимонная, метансульфоновая, муравьиная, бензойная, малоновая, 2-нафталинсульфоновая и бензолсульфоновая кислоты. Другие кислоты, такие как щавелевая, хотя и не являются сами фармацевтически приемлемыми, могут применяться для образования солей, используемых в качестве промежуточных соединений для получения соединений изобретения и их фармацевтически приемлемых кислотно-аддитивных солей. Соли, полученные из подходящих оснований, включают соли щелочных металлов (например, натрия), щелочно-земельных металлов(например, магния), аммония и N-(C1-4 алкил)4+ соли. Термин "тиокарбаматы" относится к соединениям,содержащим функциональную группу N-SO2-O. Соединения по данному изобретению содержат один или несколько асимметричных атомов углерода, и, таким образом, существуют в виде рацематов и рацемических смесей, отдельных энантиомеров, смесей диастереомеров и отдельных диастереомеров. Все подобные изомерные формы данных соединений несо 5 мненно включены в настоящее изобретение. Каждый стереогенный атом углерода может иметь R- или S-конфигурацию. Точно указанный гидроксил также предпочтительно находится в форме син относительно D, в вытянутой зигзагообразной конформации между атомами азота, показанными в соединениях формулы I. Комбинациями заместителей и переменных, представленными в данном изобретении,являются только такие, которые приводят к образованию устойчивых соединений. Термин"устойчивый", используемый здесь, относится к соединениям, которые обладают необходимой стабильностью, позволяющей изготавливать и вводить их млекопитающему методами, известными специалистам в данной области. Обычно подобные соединения устойчивы при температуре 40 С или ниже, при отсутствии влажности или других химически реакционноактивных условиях, по крайней мере, в течение недели. Соединения по настоящему изобретению могут использоваться в виде солей, полученных из неорганических или органических кислот. Подобные соли кислот включают, например,следующие: ацетат, адипат, альгинат, аспартат,бензоат, бензилсульфонат, бисульфат, бутират,цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат,этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат,гидрохлорид, гидробромид, гидройодид, 2 гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат,оксалат, памоат, пектинат, персульфат, 3 фенилпропионат, пикрат, пивалат, пропионат,сукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Данное изобретение также предусматривает кватернизацию любых основных азотсодержащих групп соединений, описываемых здесь. Основный азот может быть кватернизован с помощью любых агентов, известных специалистам в данной области, включая, например, низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, бромиды и йодиды; диалкилсульфаты, включающие диметил-, диэтил-,дибутил- и диамилсульфаты; длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; и аралкилгалогениды, включающие бензил- и фенэтилбромиды. Водо- или маслорастворимые или диспергируемые продукты могут быть получены в результате подобной кватернизации. Новые сульфонамиды по данному изобретению представлены формулой I-РO32-Са 2+. Более предпочтительными являются соединения, где R7 представляет собой -РO32-Са 2+. Пролекарства по настоящему изобретению могут быть синтезированы с помощью традиционных синтетических методик. В патенте США 5585397 описан синтез соединений формулы где А, В, х, D, D' и Е имеют значения, указанные выше. Пролекарства формулы (I) по настоящему изобретению могут быть легко синтезированы из соединений 5585397 с помощью традиционных методик. Специалисту в данной области хорошо известны обычные реагенты синтеза для преобразования -ОН группы соединений 5585397 в желаемую -OR7 по настоящему изобретению, где R7 имеет значение, указанное выше. Относительная легкость, с которой соединения по данному изобретению могут быть синтезированы, представляет огромное преимущество для широкомасштабного производства данных соединений. Например, VX-478, соединение, описанное в патенте США 5585397, может быть легко преобразованно в соответствующее бис-фосфатное производное сложного эфира, как показано ниже Альтернативно, если требуется сложный монофосфатный эфир VX-478, то схема синтеза может быть легко адаптирована с помощью замены исходного соединения 4-нитрофенильным производным VX-478, как показано нижеVX-478, которые могут быть преобразованы в пролекарства по данному изобретению с помо 7 щью подобных методов (и синтезы таких промежуточных соединений в соединения по настоящему изобретению) описаны в WO 94/05639 и WO 96/33184, включенных сюда в качестве ссылки. Фармацевтически приемлемые соли соединений по настоящему изобретению легко могут быть получены с помощью известных способов. Например, динатриевая соль монофосфатного эфира, изображенная выше, может быть получена, как показано ниже Соединения по данному изобретению могут быть модифицированы с помощью присоединения подходящих функциональных групп для усиления отдельных биологических свойств. Подобные модификации известны в данной области и включают такие, которые увеличивают биологическое проникновение в данные биологические системы (например, кровь,лимфатическую систему, центральную нервную систему), увеличивают биологическую доступность при пероральном применении, увеличивают растворимость, позволяющую производить инъекционное введение, изменяют метаболизм и изменяют скорость выведения. Не ограничиваясь конкретной теорией, авторы предположили, что два различных механизма вовлечены в преобразование пролекарств по данному изобретению в активное лекарство в зависимости от структуры пролекарства. Первый механизм включает ферментативное или химическое преобразование пролекарственных частиц в активную форму. Второй механизм включает ферментативное или химическое расщепление функциональной группы пролекарства с получением активного соединения. Химическое или ферментативное преобразование можно провести в виде переноса функциональной группы (т.е. R7) с одного гетероатома на другой гетероатом в пределах молекулы. Данный перенос продемонстрирован в химических реакциях, показанных ниже Механизм расщепления продемонстрирован реакцией, приведенной ниже, в которой пролекарство с фосфоэфирной группой преобразуется в активную форму лекарства с помощью удаления фосфатной группы. Данные ингибиторы протеаз и их применение в качестве ингибиторов аспартилпротеаз описаны в патенте США 5585397, включенном сюда в качестве ссылки. Пролекарства по настоящему изобретению характеризуются неожиданно высокой водной растворимостью. Такая растворимость способствует введению более высоких доз пролекарства, что приводит к большему содержанию лекарства на разовую дозу. Пролекарства по настоящему изобретению также характеризуются легким гидролитическим расщеплением с высвобождением активного ингибитора аспартилпротеазы in vivo. Высокая водорастворимость и незатруденный метаболизм in vivo приводят к большей биологической доступности лекарства. В результате лекарственная нагрузка на пациента существенно уменьшается. Пролекарства по данному изобретению могут применяться обычным образом для лечения вирусных инфекций, таких как ВИЧ или вирус человеческого Т-клеточного лейкоза, которые содержат аспартилпротеазы, необходимые для обязательных стадий в ходе их жизненного цикла. Подобные способы лечения, уровни дозировок и требования могут подбираться специалистами в данной области, исходя из доступных способов и технологий. Например, пролекарство по данному изобретению может быть объединено с фармацевтически приемлемым адъювантом для введения инфицированному вирусом пациенту фармацевтически приемлемым способом и в количестве, эффективном для снижения тяжести вирусной инфекции. Альтернативно, пролекарства по данному изобретению могут применяться в виде вакцин и способов защиты человека от вирусной инфекции в течение длительного периода времени. Пролекарства могут применяться в подобных вакцинах как отдельно, так и с другими соединениями по данному изобретению согласно обычному способу применения вакцин с ингибиторами протеаз. Например, пролекарство по данному изобретению можно сочетать с фармацевтически приемлемым адъювантом, обычно применяемым в вакцинах, и вводить в профилактичеки эффективных дозах для защиты человека в течение длительного периода времени от ВИЧ-инфекции. Также новые ингибиторы протеаз по данному изобретению могут вводиться в качестве препаратов для лечения или профилактики ВИЧ-инфекции у млекопитающих. Пролекарства по данному изобретению могут вводиться здоровым или ВИЧинфицированным пациентам как в виде отдельного препарата, так и в сочетании с другими 9 противовирусными препаратами, которые препятствуют репликации ВИЧ. При введении соединений данного изобретения с другими противовирусными препаратами, имеющими мишенью различные стадии в жизненном цикле вируса, потенциируется терапевтический эффект данных соединений. Например, совместно вводимыми противовирусными препаратами могут служить препараты, влияющие на ранние стадии жизненного цикла вируса, такие как внедрение в клетку, обратная транскрипция и встраивание вирусной ДНК в ДНК клетки. Противовирусные препараты, влияющие на ранние стадии жизненного цикла, включают диданозин(растворимый CD4), ганикловир, дидезоксицитидин, тринатриевый фосфоноформиат, эфлорнитин,рибавирин,ацикловир,альфаинтерферон и трименотрексат. Кроме того, могут применяться ненуклеозидные ингибиторы обратной транскриптазы, такие как TIBO или невирапин, для потенциирования эффекта соединений по данному изобретению, а также ингибиторы декапсидации вируса, ингибиторы транс-активирующих белков, таких как tat илиrev или ингибиторы вирусной интегразы. Совместная терапия согласно данному изобретению оказывает синергический эффект на ингибирование репликации ВИЧ, поскольку каждый входящий препарат воздействует на различные точки репликации ВИЧ. Применение подобных комбинаций также благоприятно уменьшает дозу принимаемого обычного противовирусного препарата, требующуюся для достижения желаемого терапевтичеcкого или профилактического эффекта, при сравнении с введением данного препарата в виде монотерапии. Данные комбинации могут уменьшать или устранять побочные эффекты лечения одним обычным противовирусным препаратом, не влияя при этом на противовирусную активность данных препаратов. Данные комбинации уменьшают возможность устойчивости к терапии отдельным препаратом, при этом минимизируя любую сопутствующую токсичность. Данные комбинации также могут увеличивать эффективность обычного препарата без увеличения сопутствующей токсичности. В частности, авторами открыто, что данные пролекарства действуют синергично на предотвращение репликации ВИЧ в Т-клетках человека. Предпочтительные схемы совместной терапии включают введение пролекарства по данному изобретению с AZT, ddI, ddC или d4T. Альтернативно, пролекарства по данному изобретению также могут вводиться вместе с друими ингибиторами ВИЧ протеаз, такими как(Du-Pont Merck) и A-80,987 (Abbott) для увеличения эффекта лечения или профилактики про 003509 10 тив различных мутантов вируса или вирусов других сходных с ВИЧ видов. Авторы считают предпочтительным введение пролекарств по данному изобретению в виде отдельных препаратов или в сочетании с ингибиторами ретровирусной обратной транскриптазы, такими как производные AZT или другими ингибиторами аспартилпротеазы ВИЧ. Авторы полагают, что совместное введение соединений по данному изобретению с ингибиторами ретровирусной обратной транскриптазы или ингибиторами аспартилпротеазы ВИЧ может оказывать существенный синергитический эффект, таким образом предотвращая, существенно уменьшая или полностью устраняя вирусную инфекцию и связанные с ней симптомы. Пролекарства по данному изобретению также можно вводить в сочетании с иммуномодуляторами (например, бромпиримином, антителами против альфа-интерферона человека, IL2, GM-CSF, метионинэнкефалином, альфаинтерфероном, диэтилдитиокарбаматом, фактором некроза опухоли, налтрексоном и rЕРО); и антибиотиками (например, пентамидинизетиоратом) для предотвращения или борьбы с инфекцией и болезнями, связанными с ВИЧинфекцией, такими как СПИД и ARC. Если пролекарства по данному изобретению вводятся в сочетании с другими препаратами, то введение пациенту можно проводить последовательно или одновременно. Альтернативно, фармацевтические или профилактические комбинации согласно данному изобретению могут включать сочетание пролекарства по данному изобретению и другого терапевтического или профилактического препарата. Хотя данное изобретение сконцентрировано на применении описываемых здесь пролекарств для предупреждения и лечения ВИЧинфекции, соединения по данному изобретению также могут применяться в качестве ингибиторов, действующих на другие вирусы, находящиеся в зависимости от участия подобных аспартилпротеаз в обязательных стадиях их жизненного цикла. Данные вирусы включают, не ограничиваясь, также как и СПИД-подобные заболевания, вызванные ретровирусами, такими как вирусы иммунодефицита обезьян, вирусы человеческого Т-клеточного лейкоза I и II. Кроме того, соединения по данному изобретению можно применять для ингибирования других аспартилпротеаз и, в частности, других аспартилпротеаз человека, включая ренин- и аспартилпротеазы, которые процессируют предшественники эндотелина. Фармацевтические композиции по данному изобретению включают в себя любые соединения по настоящему изобретению и их фармацевтически приемлемые соли с любым фармацевтически приемлемым носителем, адъювантом или растворителем. Фармацевтически приемлемые носители, адъюванты и разбавители, 11 которые могут применяться в фармацевтических препаратах по данному изобретению,включают, не ограничиваясь этим, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, динатрийгидрофосфат, гидрофосфат калия, хлорид натрия, соли цинка,коллоидный кремнезем, трисиликат магния,поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрийкарбоксиметилцеллюлозу, полиакрилаты, воски, (полиэтиленполиоксипропилен)блокполимеры, полиэтиленгликоль и ланолин. Фармацевтические композиции по данному изобретению могут быть введены перорально, парентерально, в виде ингаляционного спрея, местно, ректально, назально, буккально,вагинально или посредством имплантированного депо. Авторы считают предпочтительным пероральное введение или инъекционное введение. Фармацевтические композиции по данному изобретению могут содержать любые обычные нетоксичные фармацевтически приемлемые основы, адъюванты или разбавители. Термин парентеральный, применяемый здесь, включает подкожный, внутрикожный, внутривенный,внутримышечный, внутрисуставный, внутрисиновиальный, внутристернальный, внутриоболочечный, внутриочаговый и внутричерепной инъекционные пути введения или инфузионные способы. Фармацевтические композиции могут существовать в виде стерильного инъекционного раствора, например, в виде стерильной инъекционной водной или масляно-водной суспензии. Данная суспензия может быть приготовлена согласно известным в данной области способам,применяя подходящие диспергирующие или смачивающие агенты (такие как, например,Tween 80) и суспендирующие агенты. Стерильный инъекционный препарат также может существовать в виде стерильного инъекционного раствора или суспензии в нетоксичном, приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Приемлемые разбавители и растворители, которые могут быть использованы, включают маннит, воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, обычно в качестве растворителя или суспендирующей среды применяют стерильные нелетучие масла. Для этой цели может быть использовано любое мягкое нелетучее масло, включая моно- и диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицериновые производные являются пригодными для приготовления инъекционных форм, как 12 натуральные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных формах. Данные масляные растворы или суспензии также могут содержать длинноцепочечные спиртовые разбавители или диспергирующие агенты, такие как Ph. Helv. или сходный спирт. Фармацевтические композиции по данному изобретению могут вводиться перорально в виде любой перорально приемлемой дозированной формы, включая, но не ограничиваясь этим,капсулы, таблетки и водные суспензии и растворы. В случае таблеток для перорального применения обычно используемыми основами являются лактоза и кукурузный крахмал. Также обычно добавляют смазывающие агенты, такие как стеарат магния. Для перорального введения в виде капсул применяют наполнители, включающие лактозу и сухой кукурузный крахмал. При пероральном введении водных суспензий активное вещество смешивают с эмульгирующими и суспендирующими агентами. Если требуется, то могут быть добавлены определенные подсластители и/или ароматизаторы и/или красители. Фармацевтические композиции по данному изобретению также можно вводить в виде ректальных суппозиториев. Данные препараты можно приготовить смешиванием соединения по данному изобретению с подходящей не вызывающей раздражения лекарственной основой,которая является твердой при комнатной температуре, но жидкой при ректальной температуре,и поэтому будет расплавляться в прямой кишке с высвобождением активных компонентов. Подобные вещества включают, не ограничиваясь,масло какао, пчелиный воск и полиэтиленгликоли. Местное применение фармацевтических композиций по данному изобретению особенно приемлемо, когда желаемая обработка включает поверхности или органы, легко поддающиеся местной обработке. Для местного применения на коже фармацевтическая композиция может быть изготовлена в виде подходящей мази, содержащей активное вещество, суспендированное или растворенное в основе. Основами для местного применения соединений по данному изобретению могут служить, не ограничиваясь,минеральное масло, вазелиновое масло, медицинский вазелин, пропиленгликоль, полиоксиэтиленовое полиоксипропиленовое соединение,эмульгирующий воск и вода. Альтернативно,фармацевтическая композиция может быть изготовлена в виде лосьона или крема, содержащего активное вещество, суспендированное или растворенное в основе. Подходящими основами могут быть, не ограничиваясь, минеральное масло, сорбитмоностеарат, полисорбат 60, цетиловый эфирный воск, цетеариловый спирт, 2 октилдодеканол, бензиловый спирт и вода. 13 Фармацевтические композиции по данному изобретению можно также местно применять в нижних отделах кишечного тракта в виде ректальных суппозиториев или в форме клизмы. В данном изобретении также рассматривается чрескожное введение. Фармацевтические композиции по данному изобретению можно вводить в виде назальных аэрозолей или ингаляций. Подобные препараты получают согласно хорошо известным в области фармации способам и могут быть получены в виде растворов в физиологическом растворе, используя бензиловый спирт или другие подходящие консерванты, активаторы абсорбции для усиления биологической доступности,фторуглероды и/или другие солюбилизирующие или диспергирующие агенты, известные в данной области. Уровни дозировки активного соединения,находящиеся между 0,01 и 100 мг/кг массы в сутки, предпочтительно между 0,5 и 50 мг/кг массы в сутки, являются подходящими для профилактики и лечения вирусной инфекции,включая ВИЧ-инфекцию. Обычно фармацевтические препараты по данному изобретению будут вводиться приблизительно от 1 до 5 раз в сутки или, напротив, путем непрерывного вливания. Подобное введение может применяться для хронического или острого лечения. Количество активного вещества, которое может сочетаться с веществами основы для получения отдельной дозированной формы, будет изменяться в зависимости от подвергаемого лечению пациента и конкретного способа введения. Обычный препарат будет содержать приблизительно от 5 до 95% активного соединения (мас./мас.). Предпочтительно, подобные препараты содержат приблизительно от 20 до 80% активного соединения. При улучшении состояния пациента может вводиться, при необходимости, поддерживающая доза соединения, препарата или их сочетание по данному изобретению. Следовательно,доза или частота введения или они оба, как функция симптомов, могут быть уменьшены до уровня, при котором достигается лучшее состояние, а когда симптомы ослабляются до желаемого уровня, лечение будет прекращено. Однако пациентам может требоваться прерывистое лечение в течение длительного периода на основании любых возвратных симптомов болезней. Как понятно специалисту в данной области, могут потребоваться меньшие или большие дозы, чем перечисленные выше. Специальная дозировка и схемы лечения для любого отдельного пациента будут зависеть от множества факторов, включающих активность применяемого специфического соединения, возраст, массу тела, общее состояние здоровья, пол, питание, время введения, скорость выведения, сочетание лекарств, тяжесть и течение инфекции, 003509 14 подверженность пациента инфекции и мнение лечащего врача. Для более полного понимания данного изобретения представлены следующие примеры. Данные примеры предназначены исключительно для иллюстративных целей и не должны истолковываться как какое-либо ограничение объема изобретения. Пример 1. Основные условия: Смесь, состоящую из 2,0 г (3,7 ммоль) соединения 197 и 3,0 г (16 ммоль) пдинитрофенилкарбоната в 10 мл диметилформамида обрабатывали при 25 4 мл (4 ммоль) Р 4 фосфазенового основания (Fluka, 1M в гексане). Смесь перемешивали в течение 6 ч при 25 до тех пор, когда весь исходный спирт не был израсходован. Реакционную смесь распределяли между этилацетатом и 1 н. хлористо-водородной кислотой. Органическую фазу промывали 1 н. гидроксидом натрия и солевым раствором, сушили над сульфатом магния и концентрировали в вакууме. Титрование дихлорметаном давало желаемый смешанный карбонат (1,2 г фракция 1 и 0,6 г фракция 2) в виде тонкоизмельченного порошка. Объединенный выход: 69%. Rf=0,13(1,14 ммоль) 1-метилпиперидина и смесь перемешивали в течение ночи при комнатной температуре. Все растворители затем выпаривали и твердый остаток распределяли между EtOAc и водой. Летучие компоненты удаляли и остаток обрабатывали 1:1 ТФК/DCM в течение 30 мин при комнатной температуре для удаления Вос защитной группы. Продукт растворяли в 0,25 мл ТФК и 1,5 мл ТГФ. Желаемое соединение получали гидрированием в течение 10 ч в присутствии 30 мг 10% Pd/C. Окончательную очистку проводили на препаративной с обращенной фазой С 18, используя условия примера 1, кроме скорости элюции, равной 18 мл/мин.LC/MS (ES+) 632 (М+1) 1 пик при 4,71 мин Аналитическая ЖХВД (A) t=N/A мин 1 Н: 0,71 (3H, д), 0,74 (3H, д), 1,80 (2 Н, м),2,03 (1 Н, м), 2,63 (2 Н, м), 2,74 (1 Н, м), 2,82 (3H,с), 2,92 (2 Н, м), 3,20 (4 Н, м), 3,42 (3H, м), 3,62(1,12 ммоль) ДЦК, затем 29 мг (0,23 ммоль) ДМАП. Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Образовавшийся осадок удаляли с помощью фильтрации. Фильтрат затем концентрировали в вакууме. Конечное соединение очищали на препаративной колонке с обращенной фазой С 18 с помощью ЖХВД C18 Waters Delta Prep 3000 Column: YMC-Pack ODS AA 12S05-2520WT 25020 мм I.D. S-5 мм, 120, 0-100% В в течение 1/2 ч,скорость элюции = 18 мл/мин, наблюдение при 220 нм, В=0,1% трифторуксусная кислота в ацетонитриле, А=0,1% трифторуксусная кислота в воде. Аналитическая колонка: YMC-Pack ODS АА 1 2S05-2520WT 2504,6 мм I.D. S-5 мм,120, 0-100% В при 1,5 мл/мин, в течение 1/2 ч,наблюдение при 220 нм, В=0,1% трифторуксусная кислота в ацетонитриле, А=0,1% трифторуксусная кислота в воде. Водную фазу лиофилизовали с получением 59 мг, (16,3%) GW431896X, (U11484-72-10) Взвесь соединения 209 (170 мг) и 10 мг 10% Pd.C в 95% EtOH продували током водорода в сцинтилляционной пробирке, снабженной перегородкой и механической мешалкой. Продолжавшееся в течение ночи гидрирование с помощью баллона с водородом привело к полному преобразованию. Неочищенный препарат далее отделяли от катализатора фильтрованием и очищали на RP C18 ЖХВД (Prep Nova-Pack С 186 um, 60 А, градиент 0-100% В в течение 30 мин. Желаемый продукт собирали и лиофилизовали, получая белый твердый порошок (50 мг,30,8%). Соединение 211 получали следующими способами ацилирования и восстановления по примеру 12. Соединение 212 получали с помощью реакций примера 12. Соединение 213 получали с помощью реакций примера 12. 21 Соединение 214 получали с помощью реакций примера 12. Соединение 215 получали с помощью реакций примера 12. Соединение 216 получали с помощью реакций примера 12. 1 Соединение 217 получали с помощью реакций примера 12. 1 Смесь из 0,5 г (1 ммоль) (3S)-тетрагидро-3 фурфурил-N-1S,2R)-1-бензил-2-гидрокси-3(N-изобутил-4-аминобензолсульфонамидо) пропил)карбамата, 0,4 г (1,5 ммоль) Воc-(S)-3 пиридилаланина, 0,29 г (1,5 ммоль) EDCI и 0,1 г 4-диметиламинопиридина в 10 мл N,N-диметилформамида перемешивали при 25C в течение 12 ч. Летучие примеси удаляли в вакууме и остаток распределяли между этилацетатом и 1 н. хлористо-водородной кислотой. Органическую фазу промывали 1 н. гидроксидом натрия и солевым раствором, сушили с помощью сульфата магния и концентрировали в вакууме. Остаток хроматографировали на 2-дюймовой колонке с силикагелем (1:1 этилацетат:гексан) с получением желаемого N-ацилированного вещества. Удаление защитных групп обработкой 50 мл трифторуксусной кислотой с последующим выпариванием оставшейся кислоты с метанолом приводило к получению желаемого пролекарства в виде белой пены (0,2 г, 26%). 1 Н-ЯМР (ацетонитрил-D3): 0,95 (6 Н, дд),2,0 (2 Н, м), 2,25 (1 Н, м), 2,8-3,1 (5 Н, м), 3,6-4,0 Соединение 220 получали, применяя основную реакцию по примеру 20. 1 Н-ЯМР (ацетон-d6/метанол-d4): 0,95 (6 Н,т), 2,0 (2 Н, м), 2,2 (1 Н, м), 2,90 (1 Н, дд), 2,95 Соединение 221 получали, применяя основную реакцию по примеру 20. 1 Соединение 222 получали, применяя основную реакцию по примеру 20. 1 Н ЯМР (ацетонитрил-d3): 1,0 (6 Н, т), 2,0 Соединение 223 получали, применяя основную реакцию по примеру 20. Соединение 224 получали, применяя основную реакцию по примеру 20. Пример 26. O,N-диацилированные пролекарства. Основную реакцию получения N,Oдиацилированных соединений проводили согласно протоколу, изложенному выше в примере 20, за исключением того, что применяли пятикратный избыток реагентов относительно исходного вещества. К смеси соединения 197 (2,93 г, 5,47 ммоль) и фосфорной кислоты (Aldrich, 2,2 экв.,12,03 ммоль, 987 мг) в 20 мл пиридина добавляли 1,3-дициклогексилкарбодиимид (Aldrich, 2,1 экв., 11,49 ммоль, 2,37 г) и реакционную смесь нагревали до 60 С в атмосфере азота в течение 3 ч. Растворитель удаляли в вакууме, остаток обрабатывали 200 мл 0,1 н. водного бикарбоната натрия и перемешивали 1 ч при температуре окружающей среды. Смесь фильтровали,фильтрат подкисляли до рН 1,5 добавлением конц. HCl и экстрагировали этилацетатом (3100 мл). Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением 3,15 г (96%) желаемого продукта 226, который непосредственно использовали в следующей реакции. ЖХВД: Rt = 8,91 мин (96%), MS (AP+) 600,5 Суспензию соединения 226 (5,47 ммоль) в 18 мл гексаметилдисилазана перемешивали при 120 С до гомогенного состояния с последующим добавлением бис(триметилсилил) пероксида (Gelest, Inc., 2,3 экв., 12,58 ммоль,2,24 г, 2,71 мл). Через час смесь охлаждали до комнатной температуры, растворитель удаляли в вакууме, остаток смешивали со 100 мл метанола, растворитель удаляли в вакууме, остаток смешивали со 100 мл 0,1 н. водного бикарбоната натрия, подкисляли до рН 1,5 добавлением конц. HCl, обрабатывали насыщенным солевым раствором и экстрагировали этилацетатом(3100 мл). Смешанные органические фазы сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением 2,98 г(88%) желаемого продукта 227, который непосредственно использовали в следующей реакции. ЖХВД: Rt = 9,28 мин (90%), MS (AP+) 616,5 (М+1). Альтернативно, 227 может быть синтезирован из 197. В данном способе 197 растворяли в пиридине (300 мл). Полученный раствор концентрировали в вакууме до приблизительно 150 мл при 50-55 С. Далее раствор охлаждали в атмосфере N2 до 5 С, и обрабатывали РОСl3 (6,5 мл, 1,24 экв.) в течение 2 мин. Охлаждающую баню убирали и реакционную смесь перемешивали при температуре окружающей среды в течение 2,5 ч. Далее раствор охлаждали до 5 С и добавляли воду (300 мл) в течение 30 мин. Полученную смесь экстрагировали 4 метилпентан-2-оном (MIBK, 2150 мл). Смешанные экстракты промывали 2 н. HCl (2250 мл). Кислый промывной раствор вновь экстрагировали MIBK (60 мл), затем смешанныеMIBK растворы обрабатывали 2 н. HCl (150 мл). Двухфазную смесь быстро перемешивали и нагревали до 50 С в течение 2 ч. Реакционную смесь охлаждали до 20 С, разделяли фазы иMIBK раствор промывали насыщенным солевым раствором (150 мл). Продукт 227 выделяли,обезвоживая раствор над сульфатом магния,фильтруя осушитель и концентрируя в вакууме при 40 С с получением продукта в виде бледножелтой пены (31 г, 90% выхода). Пример 29. Раствор 227 (2,98 г, 4,84 ммоль) в 50 мл этилацетата обрабатывали 10%-м палладием на углероде (Aldrich, 300 мг) и помещали под давлением водорода 35 фунтов на квадратный дюйм в аппарат Парра на 15 ч. Катализатор удаляли с помощью фильтрации и растворитель удаляли в вакууме с получением 2,66 г (94%) желаемого продукта 228. ЖХВД: Rt = 7,23 мин Твердое соединение 228 (2,66 г, 4,54 ммоль) помещали в 10 мл водного бикарбоната натрия (Baker, 3,0 экв., 13,63 ммоль, 1,14 г) и наносили на колонку со смолой [Mitsubishi Kasei Corp., MCI-gel, CHP-20). Через колонку пропускали дистиллированную воду до тех пор,пока элюент не становился нейтральным, и затем элюировали продукт 1% ацетонитрилом в 26 воде. Очищенные фракции смешивали и лиофилизовали с получением 918 мг очищенной динатриевой соли 229. Альтернативно, 7 г 228 растворяли в 100 мл EtOAc с нагреванием и раствор экстрагировали 100 мл водного 250 ммоль бикарбоната триэтиламмония (ТЕАВС) (2 х). Водные экстракты смешивали и разбавляли до 1500 мл водой. Данный раствор наносили на 300 мл DEAE52 колонку (Whatman), которую уравновешивали 50 мМ ТЕАВС. Колонку промывали 8 л 50 мМ ТЕАВС и соль TEA элюировали 2 л 250 мМ ТЕАВС. Раствор выпаривали в вакууме до 100 мл, далее лиофилизовали с получением солиHCl и смесь экстрагировали EtOAc (3200 мл). Раствор этилацетата сушили над МgSО 4, затем выпаривали в вакууме с получением 4 г свободной кислоты. Два грамма свободной кислоты растворяли в 50 мл ацетонитрила и добавляли раствор 573 мг NaHCO3 в 200 мл воды. Смесь лиофилизовали с получением 2,1 г динатриевой соли (соединение 229). Пример 31. 0,53 г (3,0 ммоль) 2-[2-(2-метоксиэтокси) этокси]уксусной кислоты добавляли в смешанный раствор 1,2 г (3,15 ммоль) HATU 0,2 г (1,47 ммоль) HOAt 0,4 г (4,0 ммоль) NMM в 10 мл безводного N,N-диметилформамида. Смесь перемешивали при комнатной температуре в течение 30 мин, затем добавляли 0,5 г (1 ммоль)(3S)-тетрагидро-3-фурфурил-N-1S,2R)-1 бензил-2-гидрокси-3-(N-изобутил-4-аминобензолсульфонамидо)пропил)карбамата одной порцией. Смесь перемешивали при 20 С в течение одного часа, затем при 50 С дополнительно в течение 12 ч. Затем охлаждали до 20 С, добавляли 50 мл эфира и раствор трижды промывали водой. Водную фазу промывали эфиром и затем смешанные органические фазы сушили с помощью безводного сульфата магния и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле с получением желаемых моно-(N)ацилированных (102 мг, 15%) и бис-(O,N)-ацилированных (262 мг, 32%) соединений. 1 Моно-(N)-ацилированные: Н-ЯМР Растворяли 0,521 г (1 мМ) 1273W94 в 5 мл ТГФ, затем охлаждали до -78 С в атмосфере азота и добавляли 1,56 мл (2,5 мМ) 1,6 М раствора н-BuLi в гексане. После 20 мин при -78 С добавляли 105 мкл (1,1 мМ) этилхлоркарбамата и нагревали реакционную смесь до комнатной температуры с последующим добавлением других 105 мкл этилхлоркарбамата. После перемешивания дополнительно в течение 4 ч реакционную смесь охлаждали водой и выпаривали органический растворитель. Часть неочищенного продукта очищали на силикагеле (Rf=0,69 (1:2 этилацетат:гексан, получая 0,131 г продукта. С, Н, N: вычисл.: 46,06, 4,97, 5,88, найдено: 45,90, 4,97, 5,88 С 23 Н 33N5 О 5S12,2 ТФК Растворяли 0,131 г вышеуказанного этилкарбоната в 4 мл DCM и далее добавляли 4 мл ТФК. Затем растворители удаляли после выдерживания 45 мин при комнатной температуре,с получением вышеуказанного соединения. 1 Н (ДМСО): 8,37 (2 Н, д, J=7,2), 8,15 (2 Н,м), 8,00 (2 Н, д, J=7,0), 7,37 (5 Н, м), 5,04 (1 Н, д,J=6,9), 4,06 (2 Н, к, J=7,0), 3,82 (1 Н, м), 3,35 (2 Н,м), 2,95 (4 Н, м), 1,82 (1 Н, м), 1,20 (3H, т, J=7,0),0,72 (перекрывающиеся дубли, 6 Н, J=6,2). Синтез соединения 235 выполняли аналогично данному в примере 1. Выход 15,2%; tЖХВД=25,2 мин (А). Растворяли 150 мг 235 в 3 мл безводного диоксана, добавляли 0,35 мл S(+)-3-ОН-ТТФ и 0,14 мл триэтиламина. Смесь осторожно нагревали в колбе с обратным холодильником в атмосфере азота в течение 2 дней. Преобразование в 236 было количественное. Растворитель удаляли и соединение очищали на силикагеле (В).(1 Н, м), 3,10 (3H, м, перекрывание), 2,88 (2 Н, м),2,64 (1 Н, м), 2,14 (1 Н, м), 2,05 (1 Н, м), 1,84 (1 Н, 29 м), 1,27 (9 Н, s), 0,78 (6 Н, два перекрывающихся д). Пример 37. Пролекарство на основе углеводов.(1,8 ммоль) EDCI и 0,556 мл (4 ммоль) триэтиламина в 10 мл диметилформамида перемешивали при комнатной температуре в течение 24 ч. Добавляли другие 3 ммоль каждого из кислоты,EDCI и триэтиламина и продолжали перемешивание дополнительно в течение 96 ч. Добавляли третью порцию кислоты и EDCI (3 ммоль каждого) и смесь перемешивали 72 ч до завершения реакции. Затем реакционную смесь разбавляли этилацетатом и экстрагировали 1 н. хлористоводородной кислотой, насыщали бикарбонатом натрия и промывали водой. Выпаривание растворителя и очистка на силикагеле (30% этилацетат-гексан) давало желаемый продукт (500 мг) в виде воскообразного твердого продукта.(5 Н, м), 7,95 (2 Н, д), 8,36 (2 Н, д). 450 мг соединения 238 растворяли в 30 мл тетрагидрофурана и обрабатывали 20 мл воды и 50 мл уксусной кислоты. Смесь перемешивали при комнатной температуре в течение 2 ч и выпаривали. Титрование гексаном давало желаемый спирт (290 мг) в виде белого твердого вещества. Смесь 0,15 г (0,24 ммоль) спирта, полученного выше по предыдущей реакции, 0,205 г(0,5 ммоль) тетраацетилглюкозилбромида и 0,191 г (0,7 ммоль) карбоната серебра в 3 мл дихлорметана перемешивали при комнатной температуре в течение 6 ч. Добавляли дополнительно 150 мг глюкозилбромида и 150 мг карбоната серебра и смесь перемешивали при ком 003509 30 натной температуре в течение ночи. Смесь помещали на колонку с силикагелем и элюировали 30% этилацетат/гексаном с получением желаемого защищенного углеводородного пролекарства в виде белой пены (200 мг). 1,5 г (9,4 ммоль) комплекса SО 3 Ру добавляли к перемешиваемому раствору 1 г (1,87 ммоль) 197 в 25 мл безводного тетрагидрофурана. Смесь перемешивали при 20 С в течение 12 ч, затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток переносили на колонку с силикагелем и элюировали EtOAc (неразбавленный), далее 100 мг (0,162 ммоль) 239 растворяли в 15 мл безводного тетрагидрофурана и добавляли к раствору 200 мг Pd/BaSO4 (5%). Смесь перемешивали при атмосферном давлении водорода в течение 8 ч и затем отфильтровывали катализатор. Фильтрат концентрировали при пониженном давлении, затем высушивали в вакууме (1 мм рт.ст., 48 ч) с получением 80 мг (81%) 240 в виде бесцветной пены. 1 780 мг (3 ммоль) 2-хлор-1,3,2-диоксафосфолана добавляли к перемешиваемому раствору 1,07 г (2 ммоль) 197 и 0,7 мл (4 ммоль) N,Nдиизопропилэтиламина в 25 мл дихлорметана при 0 С. Смесь нагревали до комнатной темпе 31 ратуры и перемешивали в течение 2 ч. Затем смесь охлаждали до 0 С и добавляли 1,5 г (9,3 ммоль) брома в 5 мл дихлорметана. Смесь перемешивали в течение часа при 20 С с последующим выпариванием при пониженном давлении. К остатку добавляли водный раствор (50%) 15 мл триметиламина и смесь перемешивали при 20 С в течение 12 ч. Растворители удаляли при пониженном давлении и к остатку добавляли 50 млEtOAc:EtOH (9:1). Твердое вещество отфильтровывали, промывали EtOAc:EtOH (9:1), затем фильтрат концентрировали при пониженном давлении. Остаток хроматографировали на 3 дюймовой колонке силикагеля, используя этилацетат (неразбавленный), затем метанол (неразбавленный) в качестве элюентов с получением 1,15 г (82%) 241 в виде не совсем белого твердого вещества. 1 Н ЯМР (CDCl3): 0,60 (дд, 6 Н), 1,70 (м,1 Н), 1,95 (м, 1 Н), 2,10 (м, 1 Н), 2,8-3,2 (м, 6 Н),3,4 (ушир.с, 9 Н), 5,09 (ушир.с, 1 Н), 7,25 (м, 5 Н),7,83 (д, 2 Н), 8,28 (д, 2 Н). 250 мг Pd/C (10%) добавляли к раствору 250 мг (0,35 ммоль) 241 в 10 мл метанола, смесь перемешивали при атмосферном давлении водорода в течение 4 ч при 20 С. Смесь фильтровали и фильтрат концетрировали при пониженном давлении. Остаток затем растворяли в 10 мл воды и лиофилизовали с получением 174 мг(74%) 242 в виде твердого белого вещества. 1 Н ЯМР (ДМСО-d6): 0,82 (дд, 6 Н), 1,802,00 (м, 2 Н), 2,10 (м, 1 Н), 2,80 (м, 3H), 3,00 (м,2 Н), 3,2 (ушир.с, 9 Н), 4,0-4,3 (м, 4 Н), 4,91 0,175 мл (2 ммоль) трихлорида фосфора добавляли к перемешиваемому раствору 1,07 г(2 ммоль) 197 и 0,35 мл (2 ммоль) N,Nдиизопропилэтиламина в 25 мл дихлорметана при 20 С. Смесь перемешивали в течение 4 ч при 20 С, затем добавляли 1 мл воды и переме 003509 32 шивали дополнительно в течение 12 ч при 20 С. К смеси добавляли 3 г безводного сульфата магния и перемешивали в течение 30 мин, затем фильтровали. Фильтрат концентрировали при пониженном давлении и очищали с помощью хроматографии на силикагеле, используяMS (ES-): 550 (М-1), 568 М+Н 2O)-1). Пример 44. Фармакокинетика у крыс Sprague-Dawley после приема одной пероральной дозы. Для изучения фармакокинетики пролекарств по данному изобретению авторы вводили отдельные пероральные дозы серии как пролекарств данного соединения, так и VX-478, самцам и самкам крыс Sprague-Dawley. Исследовали введение молярных эквивалентов ряда пролекарств по данному изобретению в различных фармацевтических носителях. Отдельные группы самцов и самок крысSprague-Dawley (3/пол/группа) получали пероральные дозы соединения 229 в виде пероральной формы в различных носителях в одинаковом эквиваленте дозы (40 мг/кг молярного эквивалента VX-478). Различными носителями соединения 229 являлись: 1) вода; 2) 5/4/1; 3) ПЭГ 400; 4) TPGS/ПЭГ 400; и 5) ПЭГ. Носителями 34 для VX-478 являлись: 1) 33% ТРGS/ПЭГ 400/ ПЭГ; и 2) 12,5 % TPGS/ПЭГ 400/ПЭГ. Собирали образцы крови после введения в различные промежутки времени и анализировали на наличие соединения 229 и его метаболита,VX-478, с помощью методов ЖХВД и МС. Результаты данного исследования представлены ниже в виде табл. 1. Таблица 1 Соединение Носитель Количество крыс Молярная эквивалентная доза/доза 478, мг/кг АUС, мкгч/мл Сmах, мкМ Время полужизни, ч Относительная доступность VX-478- Представляет среднее гармоническоеОтносительная доступность VX-478 по сравнению с образцом клинического исследованияОтносительная доступность VX-478 по сравнению с образцом токсикологического исследования Авторы проводили подобное исследование на собаках, применяя твердую капсульную форму соединения 229 и форму в виде этанол/метилцеллюлозного раствора, по сравнению с формой VX-478 в виде TPGS-содержащего раствора. Результаты исследования представлены ниже в табл. 2. Таблица 2 Соединение Носитель Количество собак Молярная экв. доза/доза 478, мг/кг Результаты показали, что пероральное введение соединения 229 в виде водного раствора приводит к улучшению биологической доступности по сравнению с другими исследованными носителями. Также после введения соединения 229, оно не обнаруживается в образце крови на первой временной точке (или более поздних образцах), что предполагает первый метаболический переход в VX-478. Сравнение водной дозы соединения 229 с двумя неводными препаратами, применяемыми для VX-478, показало равнозначность в доставки, что иллюстрируется обнаруженным интервалом биологической доступности. Добавляли 0,28 мл (3,0 ммоль) РОСl3 к перемешиваемому раствору 1,07 г (2,0 ммоль) соединения 197 в 10 мл безводного пиридина при 5 С. Смесь нагревали до комнатной температуры и перемешивали при 20 С в течение 3 ч. Смесь охлаждали до 0 С, и резко охлаждали 10 мл воды. Растворители удаляли при пониженном давлении, остаток растворяли в 100 мл этилацетата и промывали 20 мл 1 М раствора бикарбоната натрия. Органическую фазу сушили над безводным сульфатом магния, фильтровали, затем концентрировали. Хроматографиче 35 ская очистка (SiO2, EtOAc) давала 280 мг соединения 400 (выход 23%). 1 Н ЯМР (ДМСО d6): 0,86 (дд, 6 Н), 2,05 (м,2 Н), 2,84 (д, 2 Н), 2,95 (дд, 1 Н), 3,06 (м, 1 Н), 3,25 Соединение 400 преобразовывали в соединение 401 с помощью стандартного способа гидрирования, описанного выше, применяяHOAt, 0,4 г (4,0 ммоль) NММ в 10 мл ДМФ. Смесь перемешивали при комнатной температуре в течение 2 ч, далее добавляли 0,5 г (1,0 ммоль) соединения 218 и раствор перемешивали при 50 С в течение 12 ч. Смесь охлаждали до комнатной температуры, добавляли 100 мл эфира и экстрагировали 550 мл воды. Органическую фазу сушили над безводным сульфатом магния, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали с помощью хроматографии на силикагеле Соединения 350 А, 350 В и 350 С преобразовывали в соединения 402, 403 и 404, соответственно, применяя стандартный способ гидрировали, рассматриваемый выше: H2/Pd.C(10%),атмосферное давление, 4 ч, комнатная температура, растворитель: EtOH, Выход: 81%. Соединение 402. 1 Н ЯМР (CDCl3): 0,80 (дд, 6 Н), 1,38 (с, 9 Н),1,8 (м, 6 Н), 2,10 (м, 2 Н), 2,75-3,30 (м, 8 Н), 3,504,00 (м, 7 Н), 4,55 (ушир.с, 1 Н), 7,2 (м, 5 Н), 7,60 Добавляли 5 мл ТФК к перемешиваемому раствору 260 мг (0,3 ммоль) соединения 350 А,350B или 350 С в 20 мл хлороформа. Смесь перемешивали в течение 5 ч при комнатной температуре и затем растворители удаляли при пониженном давлении. Остаток растворяли в 20 мл дихлорметана, 2 мл (11 ммоль) N,Nдиизопропилэтиламина и 1 мл (10 ммоль) уксусного ангидрида добавляли к реакционной смеси. Раствор перемешивали в течение одного часа, затем растворители удаляли. Остаток очищали с помощью хроматографии на силикагеле (элюент: EtOAc-EtOH (9:1 с получением 170 мг (71%) соединения 351 А, 351 В или 351 С соответственно. Соединение 351 А. 1 Н ЯМР (CDCl3): 0,85 (дд, 6 Н), 1,60 (м,3H), 1,80-2,00 (м, 3H), 2,06 (2, 3H), 2,75 (дд, 1 Н),2,80-3,20 (м, 5 Н), 3,60-3,90 (м, 7 Н), 4,85 (д, 2 Н),5,10 (м, 3H), 6,46 (д, 1 Н), 7,25 (м, 10 Н), 7,67 (с,4 Н), 9,30 (с, 1 Н). ремешивали при 100 С в течении 5 ч, затем охлаждали до 40 С, к реакционной смеси добавляли 2 г (18,5 ммоль) бензилового спирта и смесь перемешивали при 20 С в течение 12 ч. Осадок фильтровали, промывали 210 мл толуола и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюенты: гексанEtOAc (1:1), затем EtOAc (неразбавленный с выходом 550 мг (20%) соединения 352. 1 Н ЯМР (CDCl3): 0,67 (дд, 6 Н), 1,53 (д, 3H),1,70 (м, 1 Н), 1,90-2,10 (м, 2 Н), 2,65-3,20 (м, 6 Н),3,55 (д, 1 Н), 3,80 (м, 3H), 4,10 (м, 1 Н), 4,70 (к,1 Н), 4,90-5,20 (м, 4 Н), 6,37 (д, 1 Н), 7,2-7,4 (м,10 Н), 7,90 (д, 2 Н), 8,30 (д, 2 Н). Преобразование соединений 351 А, 351 В и 351 С в 405, 406 и 407, соответственно, достигали путем стандартного гидрирования, используя Соединение 352 преобразовывали в соединение 408, применяя стандартный способ гидрирования: H2/Pd.C (10%), атмосферное давление, 2 ч, комнатная температура, растворитель: МеОН; выход: 78%. 1 Н ЯМР (ДМСО d6): 0,84 (дд, 6 Н), 1,44 (д,3H), 1,82 (м, 1 Н), 1,90-2,10 (м, 2 Н), 2,62 (м, 2 Н),2,95 (м, 2 Н), 3,10 (д, 1 Н), 3,39 (д, 1 Н), 3,45-3,80MS (ES-): 582 (М-1). Хотя авторы описали ряд осуществлений данного изобретения, очевидно, что данные основные конструкции могут быть изменены для обеспечения других воплощений, использующих продукты и реакции по данному изобретению. Поэтому, будет иметь большое значение,что возможности данного изобретения еще лучше определяются прилагаемой формулой изобретения, чем особые воплощения, представленные с помощью примера. Добавляли 1,0 г (7,5 ммоль) метанфосфонилдихлорида к перемешиваемому раствору 2,14 г (4,00 ммоль) соединения 197 в 20 мл толуола, содержащего 10% пиридина. Смесь пе ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 3. Соединение по п.2, где R7 представляет собой -РO32-Са 2+. 4. Фармацевтическая композиция, содержащая соединение, охарактеризованное в любом из пп.1-3, в количестве, эффективном для лечения инфекции, вызванной вирусом, характеризующимся наличием аспартилпротеазы; и фармацевтически приемлемый носитель, адъювант или наполнитель. 5. Фармацевтическая композиция по п.4,где указанный вирус представляет собой ВИЧ. 6. Фармацевтическая композиция по п.4,где указанная фармацевтическая композиция приготовлена для перорального применения. 7. Фармацевтическая композиция по п.4,дополнительно содержащая один или несколько агентов, независимо выбранных из противовирусного средства, ингибитора протеазы ВИЧ,отличного от соединения, охарактеризованного в п.1, или иммуностимулятора. 8. Фармацевтическая композиция по п.7,дополнительно содержащая один или несколько агентов, выбранных из зидовудина (AZT), зальцитабина (ddC), диданозина (ddI), ставудина(d4T), ламивудина (3 ТС), абакавира (1592U89),саквинавира (Rо 31-8959), индинавира (МК-639,L-735,524), ритонавира (АВТ 538, А 84538), нелфинавира (AG 1343), ХМ 450, СGР 53,437,935U83, 524W91, SC-52151, ХМ 412, тускаразола, полисульфированных полисахаридов, ганцикловира, дидеоксицитидина, рибавирина,ацикловира, TIBO, невирапина, IL-2, GM-CSF,альфа интерферона или эритропоэтина (ЕРО). 9. Способ ингибирования аспартилпротеазной активности у млекопитающих, включаю 40 щий стадию контактирования указанного млекопитающего с фармацевтической композицией,охарактеризованной в п.4, или введения указанному млекопитающему фармацевтической композиции, охарактеризованной в п.4. 10. Способ лечения ВИЧ-инфекции у млекопитающего, включающий стадию введения указанному млекопитающему фармацевтической композиции, охарактеризованной в п.4. 11. Способ по п.10, где указанному млекопитающему дополнительно вводят одно или несколько дополнительных средств, выбранных из противовирусного средства, ингибитора протеазы ВИЧ, отличного от соединения, охарактеризованного в п.1, или иммуностимулятора,либо в виде части одной дозированной формы с указанной фармацевтической композицией, либо в виде дробной дозированной формы. 12. Способ по п.11, где указанное одно или несколько дополнительных средств выбраны из зидовудина (AZT), зальцитабина (ddC), диданозина (ddI), ставудина (d4T), ламивудина (3 ТС),абакавира (1592U89), саквинавира (Ro 31-8959),индинавира (МК-639, L-735,524), ритонавира(АВТ 538, А 84538), нелфинавира (AG 1343),ХМ 450, CGP 53,437, 935U83, 524W91, SC52151, ХМ 412, тускаразола, полисульфированных полисахаридов, ганцикловира, дидеоксицитидина, рибавирина, ацикловира, TIBO, невирапина, IL-2, GM-CSF, альфа интерферона или эритропоэтина (ЕРО). 13. Способ по п.10, где указанная стадия введения включает пероральное введение.
МПК / Метки
МПК: A61K 31/63, C07H 15/04, A61P 31/18, C07C 311/16, C07D 307/20, C07F 9/655
Метки: качестве, ингибиторов, пролекарств, сульфонамидные, производные, аспартилпротеаз
Код ссылки
<a href="https://eas.patents.su/21-3509-sulfonamidnye-proizvodnye-v-kachestve-prolekarstv-ingibitorov-aspartilproteaz.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфонамидные производные в качестве пролекарств, ингибиторов аспартилпротеаз</a>
Предыдущий патент: Композиции с контролируемым высвобождением пароксетина
Следующий патент: Ингибиторы фарнезилпротеинтрансферазы, применяемые для лечения артропатий
Случайный патент: Моющие композиции для личного пользования, включающие специфические смеси насыщенных и ненасыщенных триглицеридных масел












