Алканолпиперазиновые производные бензотиофена и их применение в качестве антидепрессанта
Формула / Реферат
1. Алканолпиперазиновое производное бензотиофена формулы (1)
или его фармацевтически приемлемая соль,
где Ar1 обозначает
R1 и R2, каждый независимо, обозначают водород; С1-С6-алкил; С5- или С6-алициклическое кольцо или фенил;
R3 обозначает водород; C1-C6-алкил; фенил или фенил, замещенный одним-четырьмя заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-C6-алкокси, гидроксила, аминогруппы или галогена; 5- или 6-членное кольцо, содержащеее N или О; гидроксил; C1-C6-алкокси; аминогруппу; аминогруппу, замещенную C1-C6-алкилом или C1-C6-галогеналкилом; галоген или нитрогруппу;
R4 обозначает водород, метил, метокси, амино, метиламино или галоген;
X обозначает CH или N;
Y обозначает CH или N, причем X и Y не обозначают одновременно N;
m=1, 2 или 3 и
n=1 или 2.
2. Алканолпиперазиновое производное бензотиофена по п.1, отличающееся тем, что R3 обозначает водород; С1-С2-алкил; гидроксил; метокси; этокси; аминогруппу; аминогруппу, замещенную C1-C6-алкилом или C1-C6-галогеналкилом; атом фтора; фенил или фенил, замещенный одним-четырьмя заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-С6-алкокси, гидроксила, аминогруппы и галогена.
3. Алканолпиперазиновое производное бензотиофена по п.1, отличающееся тем, что R3 обозначает C1-C2-алкил или атом фтора.
4. Алканолпиперазиновое производное бензотиофена по п.1, отличающееся тем, что асимметрические атомы углерода в структуре данного соединения представляют собой ахиральные атомы углерода или хиральные атомы углерода в R- или S-конфигурации.
5. Алканолпиперазиновое производное бензотиофена по п.1, отличающееся тем, что указанная фармацевтически приемлемая соль представляет собой гидрохлоридную соль, гидробромидную соль, сульфатную соль, трифторацетатную соль или метансульфонатную соль.
6. Алканолпиперазиновое производное бензотиофена по п.1, отличающееся тем, что указанная фармацевтически приемлемая соль содержит от 0,5 до 3 молекул кристаллической воды.
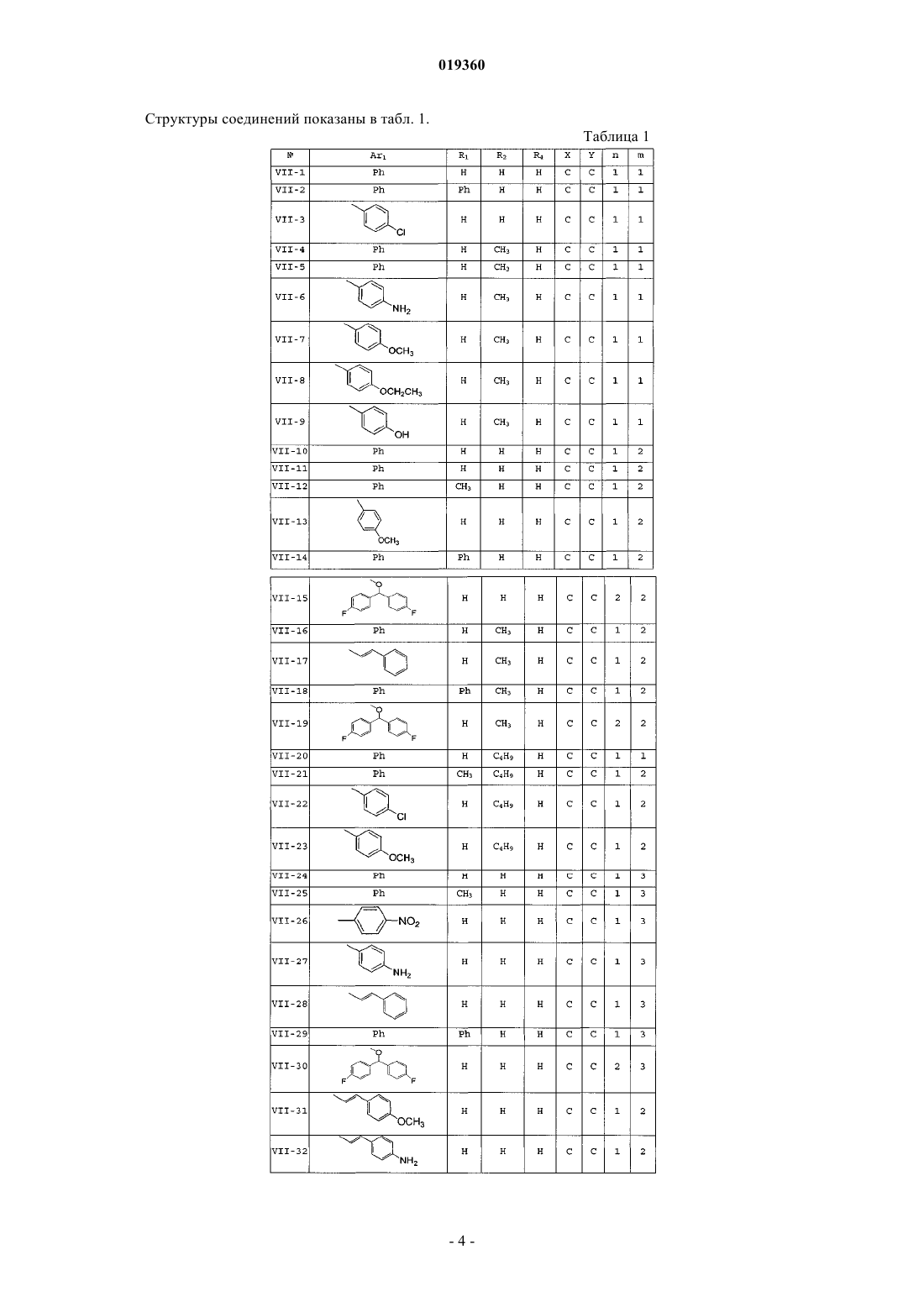
7. Алканолпиперазиновое производное бензотиофена по п.1, выбранное из группы, включающей:
VII-1: N1-бензил-N4-[2-гидрокси-2-(бензо[b]тиофен-3-ил)]этилпиперазин,
VII-2: N1-бензгидрил-N4-[2-гидрокси-2-(бензо[b]тиофен-3-ил)]этилпиперазин,
VII-3: N1-(п-хлорбензил)-N4-[2-гидрокси-2-(бензо[b]тиофен-3-ил)]этилпиперазин,
VII-4: N1-бензил-N4-[1-метил-2-гидрокси-2-(бензо[b]тиофен-3-ил)]этилпиперазин (трео-изомер),
VII-5: N1-бензил-N4-[1-метил-2-гидрокси-2-(бензо[b]тиофен-3-ил)]этилпиперазин (эритро-изомер),
VII-6: N1-п-аминобензил-N4-[1-метил-2-гидрокси-2-(бензо[b]тиофен-3-ил)]этилпиперазин,
VII-7: N1-п-метоксибензил-N4-[1-метил-2-гидрокси-2-(бензо[b]тиофен-3-ил)]этилпиперазин,
VII-8: N1-п-этоксибензил-N4-[1-метил-2-гидрокси-2-(бензо[b]тиофен-3-ил)]этилпиперазин,
VII-9: N1-(п-гидроксибензил-N4-[1-метил-2-гидрокси(бензо[b]тиофен-3-ил)]этилпиперазин,
VII-10: N1-бензил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-11: N1-циннамил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-12: N1-α-фенетил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-13: N1-п-метоксилбензил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-14: N1-бензгидрил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VI1-15: N1-(4,4'-дифтордифенилметоксил)этил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-16: N1-бензил-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-17: N1-циннамил-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-18: N1-бензгидрил-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-19: N1-(4,4'-дифтордифенилметокси)этил-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-20: N1-бензил-N4-[2-бутил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-21: N1-α-фенетил-N4-[2-бутил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-22: N1-(п-хлорбензил)-N4-[2-бутил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-23: N1-(п-метоксилбензил)-N4-[2-бутил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-24: N1-бензил-N4-[4-гидрокси-4-(бензо[b]тиофен-3-ил)]бутилпиперазин,
VII-25: N1-α-фенетил-N4-[4-гидрокси-4-(бензо[b]тиофен-3-ил)]бутилпиперазин,
VII-26: N1-п-нитробензил-N4-[4-гидрокси-4-(бензо[b]тиофен-3-ил)]бутилпиперазин,
VII-27: N1-п-аминобензил-N4-[4-гидрокси-4-(бензо[b]тиофен-3-ил)]бутилпиперазин,
VII-28: N1-циннамил-N4-[4-гидрокси-4-(бензо[b]тиофен-3-ил)]бутилпиперазин,
VII-29: N1-бензгидрил-N4-[4-гидрокси-4-(бензо[b]тиофен-3-ил)]бутилпиперазин,
VII-30: N1-(4,4'-дифтордифенилметокси)этил-N4-[4-гидрокси-4-(бензо[b]тиофен-3-ил)]бутилпиперазин,
VII-31: N1-(п-метоксилциннамил)-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-32: N1-п-аминоциннамил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-33: N1-(4,4'-дифтордифенилметокси)этил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-34: N1-(4,4'-дигидроксидифенилметокси)этил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-35: N1-п-нитроциннамил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-36: N1-бензил-N4-[3-гидрокси-3-(5-метилбензо[b]тиофен-3-ил)]пропилпиперазин,
VII-37: N1-бензил-N4-[3-гидрокси-3-(5-метоксилбензо[b]тиофен-3-ил)]пропилпиперазин,
VII-38: N1-бензил-N4-[3-гидрокси-3-(6-аминобензо[b]тиофен-3-ил)]пропилпиперазин,
VII-39: N1-бензил-N4-[3-гидрокси-3-(6-хлорбензо[b]тиофен-3-ил)]пропилпиперазин,
VII-40: N1-бензил-N4-[3-гидрокси-3-(6-метиламинобензо[b]тиофен-3-ил)]пропилпиперазин,
VII-41: N1-(β-пиридинметил)-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-42: N1-(4-морфолинбензил)-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,
VII-43: N1-бензил-N4-[2-циклопентилметил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин.
8. Фармацевтическая композиция антидепрессантного действия, отличающаяся тем, что указанная фармацевтическая композиция содержит терапевтически эффективное количество алканолпиперазинового производного бензотиофена по любому из пп.1-7 в сочетании с фармацевтически приемлемым носителем.
9. Применение алканолпиперазинового производного бензотиофена по любому из пп.1-7 в производстве антидепрессанта.
Текст
АЛКАНОЛПИПЕРАЗИНОВЫЕ ПРОИЗВОДНЫЕ БЕНЗОТИОФЕНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИДЕПРЕССАНТА Изобретение относится к алканолпиперазиновым производным бензотиофена и к их применению в качестве антидепрессантов. В изобретении описано указанное алканолпиперазиновое производное бензотиофена, оказывающее тройной ингибирующий эффект на повторное поглощение 5-ГТ,НА и ДА. В сравнении с применяемыми в настоящее время в медицине антидепрессантами,которые имеют всего одну мишень, такими как дезипрамин и флуоксетин, и с применяемыми в медицине антидепрессантами с двумя мишенями воздействия, например с венлафаксином и дулоксетином, указанные алконолпиперазиновые производные бензотиофена по настоящему изобретению характеризуются более широким диапазоном показаний для их применения,меньшими токсическими и побочными эффектами в отношении нервной системы. Указанные алконолпиперазиновые производные бензотиофена представляют собой соединения указанной ниже формулы или фармацевтически приемлемые соли таких соединений, где Ar1, R1-R4, X, Y, m и n определены в п.1 формулы изобретения.(71)(73) Заявитель и патентовладелец: СиЭсПиСи ЧЖУНЦИ ФАРМАСЬЮТИКАЛ ТЕКНОЛОДЖИ (ШИЦЗЯЧЖУАН) КО., ЛТД.; ШАНХАЙ ИНСТИТЬЮТ ОФ ФАРМАСЬЮТИКАЛ ИНДАСТРИ (CN) Область техники, к которой относится изобретение Настоящее изобретение относится к алканолпиперазиновым производным бензотиофена и к их применению в качестве антидепрессантов широкого спектра действия. Предпосылки создания изобретения Депрессия представляет собой синдром, характеризующийся выраженным и продолжительным снижением настроения, где указанное снижение настроения проявляется в основном как аффективное расстройство. Симптомы депрессии включают плохое настроение, неразговорчивость, сниженную ментальную способность и медлительность движений и даже склонность к суициду. Депрессия, как хроническое ментальное расстройство, стала важной проблемой, которая вызывает озабоченность медицинской службы Китая, в связи с длительным курсом ее лечения, поздним развитием эффекта лечения и высоким уровнем рецидивов, нетрудоспособностью и суицидом. Согласно данным Всемирной организации здравоохранения по оценке заболеваемости в мире ("World Health Reports") депрессия стала четвертой крупной болезнью, поражающей население мира, и к 2020 году может стать вторым по распространенности заболеванием после болезней сердца, создав, таким образом, серьезную проблему для здоровья всего человечества. К настоящему времени механизм действия депрессантов полностью не изучен. Те лекарственные средства, которые оказывают определенный эффект, действуют в основном на синапсы нервных окончаний и проявляют свой лечебный эффект за счет корректировки уровня нейротрансмиттеров в синаптической щели. Результаты биохимического исследования этиологии этого заболевания показали, что депрессия имеет отношение в основном к пяти типам нейротрансмиттеров, т.е. это главный 5-гидрокситриптамин (5-ГТ), норадреналин (НА), допамин (ДА), ацетилхолин (Ach) и -аминомасляная кислота (ГАМК). Антидепрессанты могут быть разделены на две группы: ранее разработанные неселективные антидепрессанты и новые селективные ингибиторы повторного захвата. Неселективные антидепрессанты включают в основном ингибиторы моноаминоксидазы (МАОИ) и трициклические антидепрессанты(ТЦА), а селективные ингибиторы повторного захвата в основном включают селективные ингибиторы повторного захвата 5-гидрокситриптамина (5-ГТ) (SSRI), ингибиторы повторного захвата норадреналина(НА) (NRI), норадренергические и специфические ингибиторы повторного захвата 5-ГТ (NDRI), ингибиторы повторного захвата 5-ГТ и ингибиторы повторного захвата НА (SNRI), усилители повторной абсорбции 5-ГТ и т.п. В изучении антидепрессантов прослеживаются две тенденции в глобальном масштабе. Одна тенденция основана на доработке уже существующих лекарственных средств. Она включает 1) дальнейшее развитие за счет выявления новых показаний для уже существующих лекарственных средств и 2) изменение дозированных форм уже существующих лекарственных средств. Другая тенденция относится к разработке новых продуктов, в частности разработке новых антидепрессантов с повышенным антидепрессантным эффектом, более быстрым началом действия препарата и улучшенными показателями безопасности, чем существующие в настоящее время коммерчески доступные препараты, за счет поиска нового структурного типа соединения, которое действует на новую мишень или за счет его действия на много мишеней. В заявке на патент Китая 2006100135485 описывается бензо[b]тиофеновое соединение, модифицированное замещенным фенилпиперазином, для лечения депрессии. Однако его непросто было применять на практике, поскольку нет каких-либо фармакологических данных по его антидепрессантному эффекту ни in vitro, ни in vivo. Имеющиеся в настоящее время антидепрессанты не могут удовлетворить существующую потребность в лечении этого заболевания. Исследования тройных селективных ингибиторов повторного захвата привлекают внимание специалистов и можно ожидать, что удастся решить проблему, определяемую гистерезисом существующих антидепрессантов, а также повысить эффективность и безопасность таких препаратов и т.п. Тройные селективные ингибиторы повторного захвата известны специалистам как антидепрессанты "широкого спектра" действия, т.е. как соединения, которые способны одновременно селективно ингибировать три типа моноаминных нейротрансмиттеров 5-ГТ, НА и ДА, тесно связанных с депрессией. Исследования тройных селективных ингибиторов повторного захвата 5-ГТ, НА и ДА начались с двойных ингибиторов повторного захвата, антидепрессантный эффект которых широко изучался, поскольку они демонстрировали улучшенные показатели по началу действия и по эффективности. Новые тройные селективные ингибиторы повторного захвата проходят в настоящее время стадию клинического испытания. Так, например, тройной селективный ингибитор повторного захватаDOV-216303, разработанный компанией DOV Pharmaceutical Inc., находится на фазе III клинического испытания; NS-2359, разработанный совместно компаниями GlaxoSmithKline и NeuroSearch Inc., находится в настоящее время на фазе II клинического испытания данного препарата в качестве антидепрессанта. Указанные тройные селективные ингибиторы повторного захвата моноаминного нейротрансмиттера обладают преимуществами, определяемыми их высокой эффективностью и быстрым началом действия, и становятся "горячими точками" в области исследования антидепрессантов. Исследования и раз-1 019360 работка антидепрессантов все еще находятся на начальной стадии, особенно в том, что касается новых тройных антидепрессантов, действующих на 5-ГТ, НА и ДА, и будут и дальше привлекать все большее внимание специалистов. Описание изобретения Один из объектов настоящего изобретения относится к типу алконолпиперазинового производного бензотиофена, к преодолению недостатков, присущих имеющимся в настоящее время антидепресантам,таких как, например, медленное начало действия, низкая эффективность, побочные реакции и низкая безопасность и т.п., и, таким образом, к удовлетворению имеющейся в настоящее время потребности в лечении депрессии. Другой объект настоящего изобретения относится к применению указанного выше производного в качестве нового антидепрессанта. Алканолпиперазиновое производное бензотиофена по настоящему изобретению представляет собой соединение формулы (1) или его фармацевтически приемлемую соль,где Ar1 обозначаетR3 обозначает водород; C1-C6-алкил; фенил или фенил, замещенный одним-четырьмя заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-C6-алкокси, гидроксила, аминогруппы или галогена; 5- или 6-членное кольцо, содержащеее N или О; гидроксил; C1-C6-алкокси; аминогруппу; аминогруппу, замещенную C1-C6-алкилом или C1-C6-галогеналкилом; галоген или нитрогруппу;Y обозначает CH или N, причем X и Y не обозначают одновременно N;n=1 или 2. Предпочтительно R3 обозначает водород; C1-C2-алкил; гидроксил; метокси; этокси; аминогруппу; аминогруппу, замещенную C1-C6-алкилом или C1-C6-галогеналкилом; атом фтора; фенил или фенил, замещенный одним-четырьмя заместителями, независимо выбранными из группы, состоящей изC1-C6-алкила, C1-C6-алкокси, гидроксила, аминогруппы и галогена. Более предпочтительно R3 обозначает C1-C2-алкил или атом фтора. Асимметрические атомы углерода в структуре данного соединения представляют собой ахиральные атомы углерода или хиральные атомы углерода в R- или S-конфигурации. Предпочтительно указанная фармацевтически приемлемая соль представляет собой гидрохлоридную соль, гидробромидную соль, сульфатную соль, трифторацетатную соль или метансульфонатную соль. Предпочтительно указанная фармацевтически приемлемая соль содержит от 0,5 до 3 молекул кристаллической воды. Предпочтительные соединения включают:N1-(4,4'-дигидроксидифенилметокси)этил-N4-[3-гидрокси-3-(бензо[b]тиофен-3 ил)]пропилпиперазин,VII-35: N1-п-нитроциннамил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,VII-36: N1-бензил-N4-[3-гидрокси-3-(5-метилбензо[b]тиофен-3-ил)]пропилпиперазин,VII-37: N1-бензил-N4-[3-гидрокси-3-(5-метоксилбензо[b]тиофен-3-ил)]пропилпиперазин,VII-38: N1-бензил-N4-[3-гидрокси-3-(6-аминобензо[b]тиофен-3-ил)]пропилпиперазин,VII-39: N1-бензил-N4-[3-гидрокси-3-(6-хлорбензо[b]тиофен-3-ил)]пропилпиперазин,VII-40: N1-бензил-N4-[3-гидрокси-3-(6-метиламинобензо[b]тиофен-3-ил)]пропилпиперазин,VII-41: N1-(-пиридинметил)-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,VII-42: N1-(4-морфолинбензил)-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,VII-43: N1-бензил-N4-[2-циклопентилметил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин. Следующим объектом настоящего изобретения является фармацевтическая композиция антидепрессантного действия, содержащая терапевтически эффективное количество указанного алканолпиперазинового производного бензотиофена в сочетании с фармацевтически приемлемым носителем. Еще одним объектом настоящего изобретения является применение указанного алканолпиперазинового производного бензотиофена в производстве антидепрессанта. Наиболее предпочтительным алканолпиперазиновым производным бензотиофена является VII-10,т.е. N1-бензил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)пропилпиперазин. Структуры соединений показаны в табл. 1. Таблица 1 Соединения по настоящему изобретению могут быть синтезированы согласно указанному ниже способу: В соответствии с указанной выше схемой идет следующий процесс: Синтез указанных алканолпиперазиновых производных бензотиофена начинают с пиперазина (I). Вначале проводят реакцию нуклеофильного замещения с использованием соответствующего галогенсодержащего арилалкана с получением N-моноалкилированного соединения (II). Указанную реакцию проводят в условиях межфазного катализа с использованием бромида цетилтриметиламмония (СТАВ), в качестве межфазного катализатора в реакционной среде бензол/вода. N-моноалкилирование пиперазина может быть осуществлено под действием KOH, и выход в этой реакции составляет до 86%. Соединение (III) подвергают реакции с соответствующим хлорангидридом в реакции ФриделяКрафтца с получением алканона бензотиофена (IV). Указанную реакцию проводят в хлороформе в качестве растворителя, при комнатной температуре с использованием безводного хлорида алюминия в качестве катализатора, и выход в этой реакции составляет примерно 60%. Соединение (IV) бромируют с получением галогенсодержащего алканона бензотиофена (V). Указанную реакцию проводят при нагревании при температуре кипения с обратным холодильником с использованием CaBr2 в качестве бромирующего агента и в качестве растворителя используют смесь хлороформа и этилацетата, и выход в этой реакции составляет примерно 75%. Соединение (II) может быть подвергнуто реакции с соединением (V) в рамках реакцииN4-алкилирования с получением соединения алканолпиперазина бензотиофена (VI). Указанную реакцию проводят при нагревании при температуре кипения с обратным холодильником в течение 8-24 ч с использованием K2CO3/CH3COCH3 в качестве реакционной системы, с достижением выхода 80%. В рамках указанных выше стадий может быть получено основное промежуточное соединение (VI) для получения целевого соединения (VII). Соединение (VI) подвергают реакции с NaBH4 в метаноле при комнатной температуре в течение 0,5-2 ч для восстановления карбонильной группы с получением соответствующих алканолпиперазиновых соединений бензотиофена (VII). С использованием указанных выше стадий могут быть получены целевые соединения VII-1-VII-43. Галогенарилалкан, бензотиофен и замещенные соединения бензотиофена (III), а также алкилхлорангидриды в пп.a, b и с на приведенной выше схеме коммерчески доступны, причем алкилхлорангидрид может быть также получен из соответствующей алкановой кислоты и сульфоксид-хлорида по известному способу синтеза. Указанные алканолпиперазиновые производные бензотиофена оказывают тройной ингибирующий эффект на процесс повторного захвата 5-ГТ, НА и ДА и могут использоваться для получения антидепрессантов. Указанные алканолпиперазиновые производные бензотиофена по настоящему изобретению могут вводиться пациентам, при наличии такой необходимости, в виде композиции путем перорального введения, инъекцией и т.п. Такая композиция содержит терапевтически эффективное количество указанных алканолпиперазиновых производных бензотиофена и соответствующий фармацевтический носитель. Указанный носитель является традиционным носителем, применяемым в области фармацевтики, и включает, например, разбавители, эксципиенты, такие как вода; адгезивные средства, такие производные целлюлозы, желатин, поливинилпирролидон; наполнители, такие как крахмал, и т.п.; дезинтегрирующее средство, такое как карбонат кальция, бикарбонат натрия; кроме того, в композицию могут быть добавлены другие вспомогательные вещества, такие как вкусовое вещество и подсластители. Для целей перорального введения композиции могут быть изготовлены в виде стандартных твердых препаратов, таких как таблетка, порошок или капсула; для введения инъекцией может быть получен инъецируемый раствор. Различные препараты композиции по настоящему изобретению могут быть получены с использованием известных в медицине стандартных методов, и в указанных препаратах содержание активного ингредиента составляет от 0,1 до 99,5 вес.%. Количество вводимой композиции по настоящему изобретению может варьировать в зависимости от способа введения, веса и возраста пациента, от типа и тяжести заболевания, подлежащего лечению, и т.п, и дневная доза составляет 5-30 мг/кг веса тела (пероральный прием) или 1-10 мг/кг веса тела (введение инъекцией). Производные по настоящему изобретению демонстрируют антагонистический эффект в отношении депрессии в экспериментах на моделях животных. Автор настоящего изобретения обнаружил, что структуры соединений по настоящему изобретению отличаются тем, что N1-положение в пиперазине соединено с фенильным кольцом через 1-3 атома углерода, структура которого не только отличается по типу от структур соединений, приведенных в указанных выше публикациях, но также оказывает тройной ингибирующий эффект на процесс повторного захвата 5-ГТ, НА, ДА и обладает антидепрессантной активностью in vivo. В сравнении с клинически используемыми антидепрессантами, обладающими одинарным или двойным механизмом действия, такими, например, как дезипрамин, флуоксетин, венлафаксин и т.п., указанные алканолпиперазиновые производные бензотиофена по настоящему изобретению могут иметь более широкий диапазон показаний для применения, демонстрировать более быстрое начало действия и характеризоваться меньшими токсическими и побочными эффектами. Конкретные варианты осуществления настоящего изобретения Общий метод 1. Синтез гидрохлорида. N-аралкилпиперазина (II). К 18 мл воды добавляли гексагидрат пиперазина (350 ммоль, продукт завода химических реактивов в Шанхае), твердый KOH (100 ммоль) и СТАВ (гексадецилтриметиламмония бромид, 1 ммоль) и все нагревали до растворения. 140 мл раствора аралкилхлорида (100 ммоль, коммерчески доступный препарат) в бензоле добавляли по каплям при температуре 70C. После добавления по каплям реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 3 ч, выстаивали и промывали органическую фазу 50 мл воды и 50 мл насыщенного раствора NaCl соответственно, высушивали надMgSO4 и фильтровали. Растворитель выпаривали досуха в вакууме и полученный концентрат затем растворяли в 50 мл абсолютного этанола и корректировали значение рН до 3 путем капельного добавления раствора HCl/С 2 Н 5 ОН. Затем полученный твердый осадок отфильтровывали и высушивали.N-аралкилгидрохлорид пиперазина получали при перекристаллизации из этанола. Выход продукта составлял 75-86%. Общий метод 2. Синтез алканона бензотиофена (IV). Алканоилхлорид (28,4 ммоль) согласно схеме синтеза b растворяли в хлороформе (30 мл) и добавляли AlCl3 (30,8 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре,при этом происходило постепенное растворение AlCl3, и раствор приобретал окраску от темно- до светло-коричневого. Поддерживали температуру смеси на уровне ниже 10C. К указанной смеси добавляли по каплям 10 мл раствора бензотиофена (23,7 ммоль) в хлороформе. После капельного добавления реакционную смесь доводили естественным образом до комнатной температуры и перемешивали в течение 1 ч. Цвет реакционного раствора темнел до достижения коричневого окрашивания. Реакционный раствор выливали в смесь хлористо-водородной кислоты (20 мл)/кусочков льда (50 г), при перемешивании, при этом наблюдалось осветление органической фазы, которая приобретала цвет от светло-желтого до желтого. Органическую фазу отделяли, промывали водой (320 мл) до нейтральной реакции водной фазы и высушивали над безводным Na2SO4 в течение ночи. Осушитель отфильтровывали и остаток промывали небольшим количеством хлороформа. Затем растворитель в фильтрате выпаривали, получая в итоге светло-желтое маслянистое вещество. Указанное светло-желтое маслянистое вещество выделяли хроматографией на колонке (этилацетат:петролейный эфир/1:400-1:60), выстаивали, с последующим отверждением продукта. Выход продукта составлял 75-85%. Общий метод 3. Синтез алкамона бромбензотиофена (V). Алканон бензотиофена (21 ммоль) растворяли в этилацетате (50 мл) и хлороформе (50 мл), затем добавляли CuBr2 (40,2 ммоль) и проводили реакцию при температуре кипения с обратным холодильником в течение 3 ч. Отфильтровывали образованный CuBr. Фильтрат промывали водой (320 мл) и высушивали над безводным Na2SO4 в течение ночи. Осушитель отфильтровывали, остаток промывали небольшим количеством этилацетата. Растворитель в фильтрате выпаривали. Получали светло-желтое кристаллическое вещество путем перекристаллизации из этанола. Выход продукта составлял примерно 75%. Общий метод 4. Синтез гидрохлорида формилалкилпиперазин-N1-аралкил-N4- бензотиофена (VI). Гидрохлорид N-аралкилпиперазина (II) (10 ммоль), алканон бромбензотиофена (V) (12 ммоль), иодид калия (1 ммоль) и безводный K2CO3 (35 ммоль) вносили в ацетон (50 мл) для реакции при температуре 50C в течение 8 ч. После фильтрования растворитель выпаривали досуха в вакууме. Добавляли 50 мл воды и экстрагировали реакционную смесь EtOAc (3100 мл). Эфирные слои объединяли и последовательно промывали с использованием 20 мл воды и 30 мл насыщенного раствора NaCl и затем высушивали над MgSO4. После фильтрования растворитель выпаривали. Концентрат растворяли при добавлении 30 мл этанола и корректировали величину рН до 2 с использованием HCl/С 2 Н 5 ОН (5 н.). Осажденный твердый материал отфильтровывали и перекристаллизовывали из этанола/воды или метанола с получением гидрохлоридной соли соединения (VI). Общий метод 5. Синтез гидрохлорида алканолпиперазин-N1-аралкил-N4-бензотиофена (VII). Гидрохлорид формилалкилпиперазин-N1-аралкил-N4-бензотиофена (VI) (3,5 ммоль) вносили в 60 мл метанола и добавляли порциями NaBH4 (14 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После удаления метанола выпариванием в вакууме добавляли 20 мл воды и реакционную смесь экстрагировали EtOAc (340 мл). Эфирные слои объединяли и промывали с использованием 20 мл насыщенного раствора NaCl, после чего высушивали над MgSO4. После фильтрования и удаления растворителя выпариванием в вакууме остаток растворяли в 20 мл этанола и корректировали величину рН до 2 с использованием HCl/С 2 Н 5 ОН. Отфильтровывали осажденный твердый материал. Гидрохлоридную соль продукта (VII) получали при перекристаллизации из этанола/воды. Если продукт представлял собой смесь трео-формы и эритро-формы изомера, то соответствующие трео-форма и эритро-форма соединений могли быть получены при разделении на колонке с нейтральным глиноземным наполнителем. Пример 1.(20 ммоль) в рамках общего метода 4, после чего проводили реакцию восстановления карбонильной группы в рамках общего метода 5. Получают 3,2 г продукта с выходом 75,7%. Т.пл.=267,8-269,4C (разлож.). МС (m/z): 353,2 [M+1]+. 1(9 ммоль) синтезировали с использованием N1-бензгидрилпиперазина (20 ммоль) и 3-(2-хлорацетил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,1 г продукта с выходом 80,5%. Т.пл.=278,0-279,8C (разлож.).(20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,6 г продукта. Т.пл.=250,1-252,3C (разлож.). МС (m/z): 388,12 [M+1]+. 1(20 ммоль) и 3-(2-бромпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 1,2 г продукта при разделении колоночной хроматографией. Т.пл.=268,0-270,4C (разлож).(20 ммоль) и 3-(2-бромпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 1,95 г продукта при разделении колоночной хроматографией. Т.пл.=220,7-222,0C (разлож).(20 ммоль) и 3-(2-бромпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,2 г продукта с выходом 76,2%. Т.пл.=255,7-257,4C (разлож.).(20 ммоль) и 3-(2-бромпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,7 г продукта. Т.пл.=262,0-264,4C (разлож.).(20 ммоль) и 3-(2-бромпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 1,2 г продукта с выходом 27,3%. Т.пл.=268,0-270,4C (разлож.). МС (m/z): 411,2 [M+1]+. 1(20 ммоль) и 3-(2-бромпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,7 г продукта. Т.пл.=256,4-258,3C (разлож.). МС (m/z): 383,2 [M+1]+. 1 Н-ЯМР (ДМСО): 7,28-7,81 (м, 4 Н, Ar-H), 7,24-7,28 (м, 4 Н, Ar-H), 7,22 (с, 1 Н, тиофен), 4,60 (м,J=10 Гц, 1 Н, -CH-ОН), 3,54 (м, 2 Н, -CH2-Ph), 2,75-2,78 (м, 1 Н, -CH-CH3), 2,52-2,74 (м, 8 Н, пиперазин),0,93 (д, 3H, -CH-CH3). Пример 10.(20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,95 г продукта с выходом 90%. Т.пл.=257,5-259,0C (разлож.). МС (m/z): 367,1 [M+1]+. 1(20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофен (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,35 г продукта с выходом 93%. Т.пл.=191,5-192,4C (разлож.). МС (m/z): 393,1 [M+1]+. 1 Н-ЯМР (ДМСО): 7,65-7,90 (м, 4 Н, Ar-H), 7,46 (с, 1 Н, тиофен), 7,43-7,45 (м, 5 Н, Ar-H), 6,15-6,33 (м,2 Н, N-CH=CH-Ph), 5,26-5,29 (м, 1 Н, -CH2CHOH), 3,73-3,74 (м, 2 Н, N-CH2-CH=), 3,51 (м, 2 Н,-CHOHCH2-), 2,58-3,51 (м, 8 Н, пиперазин), 2,24-2,56 (м, 2 Н, -CH2CH2N). Пример 12.(10 ммоль) синтезировали с использованием N1 фенетилпиперазина (20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,0 г продукта с выходом 76,7%. 1N1-п-метоксилбензил-N4-[3-карбонил-3-(бензо[b]тиофен-3-ил)]пропилпиперазина (10 ммоль) синтезировали с использованием N1-п-метоксилбензилпиперазина (20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,30 г продукта с выходом 87,4%. Т.пл.=240,0-242,0C (разлож.). МС (m/z): 420,9 [M+1]+. 1(10 ммоль) синтезировали с использованием N1-бензгидрилпиперазина (20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 2,95 г продукта с выходом 57,5%. Т.пл.=119,2-121,0C (разлож.). МС (m/z): 443,1 [M+1]+. 1VII-15: Гидрохлорид N1-(4,4'-дифтордифенилметоксил)этил-N4-[3-гидрокси-3-(бензо[b]тиофен-3 ил)]пропилпиперазина. 5,93 г гидрохлорида N1-(4,4'-дихлордифенилметокси)этил-N4-[3-карбонил-3-(бензо[b]тиофен-3 ил)]пропилпиперазина (10 ммоль) синтезировали с использованием N1-(4,4'-дифтордифенилметокси)этилпиперазина (20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,93 г продукта с выходом 82,8%. Т.пл.=155,3-158,0C (разлож). МС (m/z): 523,1 [M+1]+ 1 Н-ЯМР (ДМСО): 7,84-7,92 (м, 4 Н, Ar-H), 7,48 (с, 1 Н, тиофен), 7,32-7,39 (м, 8 Н, Ar-H), 5,49 (м, 1 Н,-O-CH-Ph2), 5,25 (д, 1 Н, CH-ОН), 3,76 (м, 2 Н, -CH2-CH2-О), 3,27 (м, 8 Н, пиперазин), 3,12 (шир., 2 Н, -CH2CH2-N), 2,80 (шир., 2 Н, N-CH2-CH2-), 2,36-2,40 (м, 2 Н, -CHOH-CH2-). Пример 16.(13 ммоль) синтезировали с использованием N1-бензилпиперазина (20 ммоль) и 3-(2-метил-3 хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,2 г продукта. Т.пл.=155,3-158,0C (разлож.). МС (m/z): 381,1 [M+1]+. 1N1-циннамил-N4-[2-метил-3-карбонил-3-(бензо[b]тиофен-3-ил)]пропилпиперазина (12 ммоль) синтезировали с использованием N1-циннамилпиперазина (16,2 ммоль) и 3-(2-метил-3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,3 г продукта.N1-бензгидрил-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазина. 4,5 г гидрохлорида N1-бензгидрил-N4-[2-метил-3-карбонил-3-(бензо[b]тиофен-3-ил)]пропилпиперазина (10 ммоль) синтезировали с использованием N1-бензгидрилпиперазина (16,2 ммоль) и 3-(2-метил-3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,9 г продукта с выходом 86,6%. Т.пл.=159,3-161,0C (разлож.). МС (m/z): 457,1 [M+1]+. 1(16,2 ммоль) и 3-(2-метил-3N1-(4,4'-дифтордифенилметокси)этилпиперазина хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,8 г продукта с выходом 81,4%. Т.пл.=154,3-155,0C (разлож.). МС (m/z): 537,1 [M+1]+. 1(13 ммоль) синтезировали с использованием N1-бензилпиперазина (16,2 ммоль) и 3-(2-бутил-3 хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,9 г продукта с выходом 89,1%. Т.пл.=156,3-158,0C (разлож.). МС (m/z): 423,1 [M+1]+. 1 Н-ЯМР (ДМСО): 7,65-7,90 (м, 4 Н, Ar-H), 7,46 (с, 1 Н, тиофен), 7,43-7,45 (м, 5 Н, Ar-H), 5,26-5,29 (м,1 Н, -CHOH), 4,28 (с, 2 Н, N-CH2-Ph), 3,51 (м, 1 Н, -CHOHCH-), 2,58-3,51 (м, 8 Н, пиперазин), 2,24-2,56 (м,2 Н, -CHCH2N), 1,25-1,29 (м, 6 Н, CH2-CH2-CH2-CH3), 0,96 (3H, CH2CH2-CH3). Пример 21.(13 ммоль) синтезировали с использованием N1 фенетилпиперазина (16,2 ммоль) и 3-(2-бутил-3 хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,9 г продукта с выходом 87,5%. Т.пл.=165,3-168,0C (разлож.). МС (m/z): 437,1 [M+1]+. 1VII-22: Гидрохлорид N1-п-хлорбензил-N4-[2-бутил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазина. 5,5 г гидрохлорида N1-(п-хлорбензил)-N4-[2-бутил-3-карбонил-3-(бензо[b]тиофен-3-ил)]пропилпиперазина (12 ммоль) синтезировали с использованием N1-п-хлорбензилпиперазина (16,2 ммоль) и 3-(2-бутил-3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,7 г продукта с выходом 85,4%. Т.пл.=153,6-156,0C (разлож.). МС (m/z): 458,1 [M+1]+. 1(16,2 ммоль) и 3-(2-бутил-3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 5,2 г продукта с выходом 88,1%. Т.пл.=159,7-162,0C (разлож.). МС (m/z): 453,2 [M+1]+. 1(20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,3 г продукта с выходом 87,8%. Т.пл.=153,3-155,7C (разлож.).(15 ммоль) синтезировали с использованием N1 фенетилпиперазина (16,2 ммоль) и 3-(4-хлорбутирил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 5,2 г продукта с выходом 88,1%. Т.пл.=155,3-158,0C (разлож.). МС (m/z): 395,1 [M+1]+. 1(12 ммоль) синтезировали с использованием N1-п-нитробензилпиперазина (16,2 ммоль) и 3-(4-хлорбутирил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,8 г продукта. Т.пл.=168,4-171,0C (разлож.). МС (m/z): 442,1 [M+1]+. 1(14 ммоль) синтезировали с использованием N1-п-аминобензилпиперазина (16,2 ммоль) и 3-(4-хлорбутирил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,7 г продукта. Т.пл.=158,0-161,1C (разлож.). МС (m/z): 396,1 [M+1]+. 1(14 ммоль) синтезировали с использованием N1-циннамилпиперазина (16,2 ммоль) и 3-(4-хлорбутирил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 5,0 г продукта с выходом 87,8%. Т.пл.=145,5-148,2C (разлож.). МС (m/z): 407,1 [M+1]+. 1(12 ммоль) синтезировали с использованием N1-бензгидрилпиперазина (16,2 ммоль) и 3-(4-хлорбутирил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,8 г продукта с выходом 87,3%. Т.пл.=165,9-168,3C (разлож.).VII-30: Гидрохлорид N1-(4,4'-дифтордифенилметокси)этил-N4-[4-гидрокси-4-(бензо[b]тиофен-3 ил)]бутилпиперазина. 6,4 г гидрохлорида N1-(4,4'-дифтордифенилметокси)этил-N4-[4-карбонил-4-(бензо[b]тиофен-3 ил)]бутилпиперазина (12 ммоль) синтезировали с использованием N1-(4,4'-дифтордифенилметокси)этилпиперазина (16,2 ммоль) и 3-(4-хлорбутирил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 5,3 г продукта с выходом 82,8%. Т.пл.=157,3-159,7C (разлож.). МС (m/z): 537,1 [M+1]+. 1(20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,87 г продукта с выходом 92%. Т.пл.=2 5 б,5-258,0C (разлож.).N1-п-аминоциннамил-N4-[3-карбонил-3-(бензо[b]тиофен-3-ил)]пропилпиперазина (10 ммоль) синтезировали с использованием N1-п-аминоциннамилпиперазина (20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,60 г продукта с выходом 88%. Т.пл.=252,5-255,0C (разлож.). МС (m/z): 408,1 [M+1]+. 1VII-33: Гидрохлорид N1-(4,4'-дифтордифенилметокси)этил-N4-[3-гидрокси-3-(бензо[b]тиофен-3 ил)]пропилпиперазина. 5,01 г гидрохлорида N1-(4,4'-дифтордифенилметокси)этил-N4-[3-карбонил-3-(бензо[b]тиофен-3 ил)]пропилпиперазина (9 ммоль) синтезировали с использованием N1-(4,4'-дифтордифенилметокси)этилпиперазина (20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,15 г продукта с выходом 83%. Т.пл.=267,5-269,0C (разлож.). МС (m/z): 556,1 [M+1]+. 1N1-(4,4'-дигидроксидифенилметокси)этилпиперазина (20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,45 г продукта с выходом 83%. Т.пл.=275,5-277,0C (разлож.). МС (m/z): 519,1 [M+1]+. 1 Н-ЯМР (ДМСО): 7,84-7,92 (м, 4 Н, Ar-H), 7,48 (с, 1 Н, тиофен), 7,36-7,45 (м, 8 Н, Ar-H), 5,49 (с, 1 Н,O-CH-Ph2), 5,25 (д, 1 Н, CH-ОН), 3,76 (м, 2 Н, -CH2-CH2-О), 3,27 (м, 8 Н, пиперазин), 3,12 (м, 2 Н,-CH2-CH2-N), 2,80 (ушир., 2 Н, N-CH2-CH2-), 2,36-2,40 (м, 2 Н, CHOH-CH2-). Пример 35.(20 ммоль) и 3-(3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,42 г продукта с выходом 87%. Т.пл.=240,5-242,0C (разлож.). МС (m/z): 438,1 [M+1]+. 1(8 ммоль) синтезировали с использованием N1-бензилпиперазина (20 ммоль) и 3-(3-хлорпропионил)-5 метилбензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 2,65 г продукта с выходом 87%. Т.пл.=252,5-254,0C (разлож.). МС (m/z): 381,1 [M+1]+. 1N1-бензил-N4-[3-карбонил-3-(5-метоксилбензо[b]тиофен-3-ил)]пропилпиперазина (10 ммоль) синтезировали с использованием N1-бензилпиперазина (20 ммоль) и 3-(3-хлорпропионил)-5-метоксилбензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,35 г продукта с выходом 86%. Т.пл.=252,5-255,0C (разлож.). МС (m/z): 397,1 [M+1]+. 1(9 ммоль) синтезировали с использованием N1-бензилпиперазина (20 ммоль) и 3-(3-хлорпропионил)-6 аминобензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,02 г продукта с выходом 88%. Т.пл.=242,5-245,0C (разлож.). МС (m/z): 382,1 [M+1]+. 1(8 ммоль) синтезировали с использованием N1-бензилпиперазина (20 ммоль) и 3-(3-хлорпропионил)-6 хлорбензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,01 г продукта с выходом 93%. Т.пл.=251,5-253,0C (разлож.). МС (m/z): 402,1 [M+1]+. 1VII-40: Гидрохлорид N1-бензил-N4-[3-гидрокси-3-(6-метиламинобензо[b]тиофен-3-ил)]пропилпиперазина. 3,87 г гидрохлорида N1-бензил-N4-[3-карбонил-3-(6-метиламинобензо[b]тиофен-3-ил)]пропилпиперазина (10 ммоль) синтезировали с использованием N1-бензилпиперазина (20 ммоль) и 3-(3-хлорпропионил)-6-метиламинобензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 3,35 г продукта с выходом 86%. Т.пл.=252,5-255,0C (разлож.).N1-(-пиридинметил)-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3 ил)]пропилпиперазина. 4,9 г гидрохлорида N1-(-пиридинметил)-N4-[2-метил-3-карбонил-3-(бензо[b]тиофен-3-ил)]пропилпиперазина (13 ммоль) синтезировали с использованием N1-(-пиридинметил) пиперазина (20 ммоль) и 3-(2-метил-3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,2 г продукта. Т.пл.=157,3-159,0C (разлож.). МС (m/z): 382,1 [M+1]+. 1(20 ммоль) и 3-(2-метил-3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,5 г продукта. Т.пл.=151,3-153,0C (разлож.).N1-бензил-N4-[2-циклопентилметил-3-карбонил-3-(бензо[b]тиофен-3 ил)]пропилпиперазина (12 ммоль) синтезировали с использованием N1-бензилпиперазина (20 ммоль) и 3-(2-циклопентилметил-3-хлорпропионил)бензо[b]тиофена (20 ммоль) по процедуре общего метода 4 и затем проводили реакцию восстановления карбонильной группы по процедуре общего метода 5. Получают 4,8 г продукта. Т.пл.=159,3-161,0C (разлож.).H-ЯМР (ДМСО): 7,65-7,90 (м, 4 Н, Ar-H), 7,46 (с, 1 Н, тиофен), 7,43-7,45 (м, 5 Н, Ar-H), 5,26-5,29 (м,1 Н, -CHOH), 4,28 (с, 2 Н, N-CH2-Ph), 3,51 (м, 1 Н, -CHOHCH-), 2,58-3,51 (м, 8 Н, пиперазин), 2,24-2,56 (м,2 Н, -CHCH2N), 1,49-1,65 (м, 9 Н, Ar-H). Пример 44. Таблетка: производные из примеров 1-43 10 мг сахароза 150 мг кукурузный крахмал 38 мг стеарат кальция 2 мг Получение: Активный ингредиент смешивают с сахарозой и кукурузным крахмалом, затем полученную смесь смачивают добавлением в нее воды, равномерно перемешивают, сушат и затем дробят,далее просеивают и добавляют стеарат кальция. Полученную смесь аккуратно просеивают и затем прессуют с получением таблеток. Вес каждой таблетки составляет 200 мг, и каждая таблетка содержит 10 мг активного ингредиента. Пример 45. Инъекционный препарат: производные из примеров 1-43 20 мг вода для инъекций 80 мг Получение: Активный ингредиент равномерно перемешивают с водой для инъекций, после чего полученную смесь в стерильных условиях фасуют в ампулы. Вес каждой ампулы составляет 10 мг, и каждая ампула содержит 2 мг активного ингредиента. Пример 46. Фармакологические экспериментальные исследования in vivo и in vitro антидепрессантного эффекта соединений. 1. Ингибирующее действие исследуемых соединений на поглощение 5-ГТ, НА и ДА синаптосомами головного мозга. Проводилось изучение повторного поглощения моноаминных нейротрансмиттеров синаптосомами головного мозга, которое в настоящее время является одним из важнейших инструментов фармакологических исследований центральной нервной системы, принятых во всем мире. Данный метод может использоваться не только для изучения механизма действия лекарственного средства, но также может применяться для скрининга новых лекарственных средств, действующих согласно данному механизму. В рамках данного эксперимента проводились исследования ингибирующего эффекта соединений по настоящему изобретению на повторное поглощение 5-ГТ, НА и ДА синаптосомами головного мозга, при использовании данного метода в сочетании, как отмечалось выше, с венлафаксином (эффективный двойной ингибитор повторного поглощения 5-ГТ и НА) и DOV 21947 (тройной ингибитор повторного поглощения 5-ГТ, НА и ДА) в качестве положительных контролей. Указанный способ осуществлялся следующим образом. 1.1. Получение синаптосом головного мозга крыс. Самцов крыс линии SD умерщвляли смещением шейных позвонков, после чего у них быстро отбирали головной мозг, проводя декапитацию, и помещали мозг в лед. Отделяли и взвешивали ткани головного мозга, которые подлежали исследованию (в эксперименте по оценке повторного поглощения с использованием [3 Н]5-ГТ и [3 Н]НА брали префронтальную кору; для исследования повторного поглощения в эксперименте с использованием [3 Н]ДА брали полосатое тело). Добавляли 10-кратное количество (объем/вес) 0,32 моль/л охлажденного на льду раствора сахарозы и гомогенизировали в электрическом гомогенизаторе с использованием в приборе компонентов из стекла-тефлона. Далее гомогенат центрифугировали при температуре 4C при 1000g в течение 10 мин. После центрифугирования супернатант отбирали и снова центрифугировали при температуре 4C при 17000g в течение 20 мин. Полученный осадок суспендировали в 30 объемах буфера KRH (125 мМ NaCl, 4,8 мМ KCl, 1,2 мМ CaCl2, 1,2 мМ MgSO4,1,0 мМ KH2PO4, 22 мМ NaHCO3, 25 мМ HEPES, 10 мМ глюкозы, 10 мМ Pargyline, 0,2 мг/мл аскорбиновой кислоты) и затем все оставляли на льду до использования (в эксперименте по повторному поглощению НА, кору необходимо было суспендировать в 20 объемах буфера KRH). 1.2. Эксперименты по оценке повторного поглощения с использованием [3 Н]5-ГТ/НА/ДА. Как и эталонный препарат, концентрированный раствор исследуемого вещества оттаивали непосредственно перед использованием и разбавляли буфером KBH до концентрации 100 мкмоль/л. 50 мкл этого раствора добавляли к 500 мкл реакционной смеси, так что конечная концентрация составляла 10 мкмоль/л. Затем добавляли 50 мкл суспендированных синаптических мембран и равномерно все перемешивали, инкубировали в водяной бане в течение 30 мин при температуре 37C. Затем добавляли 10 нмоль/л [3 Н]5-ГТ (50 нмоль/л [3 Н]ДА или 60 нмоль/л [3 Н]НА). После инкубации в течение 10 мин реакционную смесь сразу отбирали и реакцию останавливали добавлением 2 мл охлажденного на льду 150 ммоль/л Трис-HCl буфера. Образцы собирали путем фильтрования в вакууме на круглой мембране из стекловолокна и затем мембрану промывали 3 раза с использованием 3 мл охлажденного на льду Трис-HCl буфера. Мембрану убирали, помещали на 15 мин в инфракрасную печь и далее вносили в ЕР пробирку. Добавляли 1,5 мл сцинтилляционной жидкости и проводили подсчет в жидкостном сцинтилляционном счетчике в течение ночи. В пробирку общего связывания для контроля растворителя и в пробирку неспецифического связывания не добавляли исследуемое вещество; в пробирку общего связывания добавляли 50 мкл растворителя; в пробирку неспецифического связывания в эксперименте по оценке повторного поглощения с использованием [3 Н]5-ГТ добавляли 600 мкмоль/л кокаина; в пробирку неспецифического связывания в эксперименте по оценке повторного поглощения с использованием[3 Н]НА добавляли 100 мкмоль/л DOV 21947; в пробирку неспецифического связывания в эксперименте по оценке повторного поглощения с использованием [3 Н]ДА добавляли 600 мкмоль/л кокаина. 1.3. Результаты. При одной и той же концентрации (для лекарственных средств, взятых в качестве контроля, и для исследуемых веществ концентрация составляла 0,1 ммоль/л), в случае венлафаксина (антидепрессант,уже имеющийся на фармацевтическом рынке) и DOV 21947 (новое соединение, находящееся на фазе II клинических испытаний), которые были взяты в качестве положительных контролей, результаты, определяемые скоростью ингибирования повторного поглощения 5-ГТ, НА и ДА, показаны в табл. 2. Таблица 2 Ингибирующий эффект соединений на повторное поглощение 5-ГТ, НА и ДА синаптосомами головного мозга В концентрации 10 мкмоль/л пять соединений, а именно VII-10, VII-11, VII-12, VII-14 и VII-15, обладали более сильной ингибирующей активностью на повторное поглощение 5-ГТ, НА и ДА. Они продемонстрировали эффективность, аналогичную таковой для венлафаксина и DOV 21947. 2. Результаты оценки антидепрессантного эффекта in vivo соединения VII-10. Было проведено предварительное исследование in vivo антидепрессантного эффекта соединенияVII-10 с использованием теста принудительного плавания в рамках эксперимента по оценке приобретенной беспомощности, где в качестве положительного контроля был взят венлафаксин. Полученные результаты показаны в табл. 3. Таблица 3 Результаты оценки предпочтительных соединений в тесте принудительного плавания В сравнении с группой положительного контроля, р 0,5, наблюдается значимое различие. В сравнении с группой положительного контроля, р 0,05, наблюдается очень значимое различие. В тесте принудительного плавания соединение VII-10 было способно значительно снизить время неподвижности у животных, вызванной наступающим в воде отчаянием. Эффективность (8448,9 с) в дозе 25,4 мг/кг была близка к эффективности положительного контроля венлафаксина (80,846,8 с) в одинаковых молярных количествах, т.е. составляла 18,24 мг/кг, при этом было выявлено очень значимое различие относительно группы животных, оцениваемых в качестве слепой пробы. Было высказано предположение, что соединение VII-10 обладает гораздо более сильной антидепрессантной активностью invivo, чем контрольные соединения, и эффективностью, близкой к венлафаксину. 3. Острая токсичность. Первоначальный скрининг проводили по методу, описанному в руководстве "ModernPharmacological Experiments Methods", изданном Zhang Juntian. Показатель LD50 при однократном введении мышам составлял 1,1 г/кг соединения VII-10, где указанный параметр оценивали при проведении пробит-анализа (анализа Блисса). 4. Тест на способность соединения VII-10 вызывать обратимую мутацию у бактерий. Бактерии: ауксотрофные по гистидину мутантные штаммы Salmonella TA97, TA98, TA100 и ТА 102. Экспериментальный метод: метод, опубликованный в литературе: Maron D.M. et al. (1983), MutayRes. 113, 173-216. Результаты: эксперимент включал две части: -S9 и +S9. TA98 в -S9 тест-системе и ТА 97 в +S9 тестсистеме, оба штамма, продемонстрировали бактериостатический эффект в дозе 5000 мкг на чашку Петри. Другие дозировки не оказывали бактериостатического эффекта ни на один из исследованных штаммов при хорошо растущем фоне. Для всех исследованных дозировок и в тест-системе-S9, и в тестсистеме +S9 не было обнаружено значительного повышения числа обратимых мутаций. Тест Эймса был также отрицательным. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Алканолпиперазиновое производное бензотиофена формулы (1) или его фармацевтически приемлемая соль,где Ar1 обозначаетR3 обозначает водород; C1-C6-алкил; фенил или фенил, замещенный одним-четырьмя заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-C6-алкокси, гидроксила, аминогруппы или галогена; 5- или 6-членное кольцо, содержащеее N или О; гидроксил; C1-C6-алкокси; аминогруппу; аминогруппу, замещенную C1-C6-алкилом или C1-C6-галогеналкилом; галоген или нитрогруппу;Y обозначает CH или N, причем X и Y не обозначают одновременно N;n=1 или 2. 2. Алканолпиперазиновое производное бензотиофена по п.1, отличающееся тем, что R3 обозначает водород; С 1-С 2-алкил; гидроксил; метокси; этокси; аминогруппу; аминогруппу, замещеннуюC1-C6-алкилом или C1-C6-галогеналкилом; атом фтора; фенил или фенил, замещенный одним-четырьмя заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-С 6-алкокси, гидроксила, аминогруппы и галогена. 3. Алканолпиперазиновое производное бензотиофена по п.1, отличающееся тем, что R3 обозначаетC1-C2-алкил или атом фтора. 4. Алканолпиперазиновое производное бензотиофена по п.1, отличающееся тем, что асимметрические атомы углерода в структуре данного соединения представляют собой ахиральные атомы углерода или хиральные атомы углерода в R- или S-конфигурации. 5. Алканолпиперазиновое производное бензотиофена по п.1, отличающееся тем, что указанная фармацевтически приемлемая соль представляет собой гидрохлоридную соль, гидробромидную соль,сульфатную соль, трифторацетатную соль или метансульфонатную соль. 6. Алканолпиперазиновое производное бензотиофена по п.1, отличающееся тем, что указанная фармацевтически приемлемая соль содержит от 0,5 до 3 молекул кристаллической воды. 7. Алканолпиперазиновое производное бензотиофена по п.1, выбранное из группы, включающей:N1-(4,4'-дигидроксидифенилметокси)этил-N4-[3-гидрокси-3-(бензо[b]тиофен-3 ил)]пропилпиперазин,VII-35: N1-п-нитроциннамил-N4-[3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,VII-36: N1-бензил-N4-[3-гидрокси-3-(5-метилбензо[b]тиофен-3-ил)]пропилпиперазин,VII-37: N1-бензил-N4-[3-гидрокси-3-(5-метоксилбензо[b]тиофен-3-ил)]пропилпиперазин,VII-38: N1-бензил-N4-[3-гидрокси-3-(6-аминобензо[b]тиофен-3-ил)]пропилпиперазин,VII-39: N1-бензил-N4-[3-гидрокси-3-(6-хлорбензо[b]тиофен-3-ил)]пропилпиперазин,VII-40: N1-бензил-N4-[3-гидрокси-3-(6-метиламинобензо[b]тиофен-3-ил)]пропилпиперазин,VII-41: N1-(-пиридинметил)-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,VII-42: N1-(4-морфолинбензил)-N4-[2-метил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин,VII-43: N1-бензил-N4-[2-циклопентилметил-3-гидрокси-3-(бензо[b]тиофен-3-ил)]пропилпиперазин. 8. Фармацевтическая композиция антидепрессантного действия, отличающаяся тем, что указанная фармацевтическая композиция содержит терапевтически эффективное количество алканолпиперазинового производного бензотиофена по любому из пп.1-7 в сочетании с фармацевтически приемлемым носителем. 9. Применение алканолпиперазинового производного бензотиофена по любому из пп.1-7 в производстве антидепрессанта.
МПК / Метки
МПК: A61P 25/24, C07D 409/06, A61K 31/496, C07D 409/14
Метки: алканолпиперазиновые, применение, бензотиофена, производные, антидепрессанта, качестве
Код ссылки
<a href="https://eas.patents.su/21-19360-alkanolpiperazinovye-proizvodnye-benzotiofena-i-ih-primenenie-v-kachestve-antidepressanta.html" rel="bookmark" title="База патентов Евразийского Союза">Алканолпиперазиновые производные бензотиофена и их применение в качестве антидепрессанта</a>
Предыдущий патент: Инъекционная лекарственная форма для лечения острого ишемического инсульта и черепно-мозговой травмы и ее применение
Следующий патент: Способ получения замещенных пиримидиновых производных
Случайный патент: Связывающие белки, включающие антитела, производные антител и фрагменты антител, которые специфически связываются с cd154, и их применения