Перегруппированные пентанолы, способ их получения и их применение в качестве противовоспалительных средств
Номер патента: 9958
Опубликовано: 28.04.2008
Авторы: Ревинкель Хартмунт, Ярох Штефан, Шэкке Хайке, Менгель Анне, Кроликевич Конрад, Скубалла Вернер, Бергер Маркус, Шмес Норберт, Нгуен Дуй, Бойеле Штефан
Формула / Реферат
1. Стереоизомеры общей формулы I

в которой R1 представляет собой необязательно замещенный фенильный радикал, заместители которого выбраны из группы, включающей С1-С5-алкил, С1-С5-алкокси, галоген, гидроксил, трифторметил,
R2 представляет собой моноциклическую или бициклическую, ароматическую, частично ароматическую или неароматическую кольцевую систему, которая содержит атомы азота или кислорода и необязательно замещена в одном или более местах радикалом, выбранным из группы, включающей карбонил, галоген и С1-С5алкил,
R3 представляет собой С1-С3-алкильную группу или частично или полностью фторированную С1-С3-алкильную группу,
и пунктирная линия обозначает собой двойную связь между атомами а и b или двойную связь между атомами b и с, или только простую связь между атомами а и b, а также между b и с, а также их рацематы или представленные раздельно стереоизомеры и необязательно их физиологически совместимые соли.
2. Стереоизомеры по п.1, в которых фенильный радикал замещен одним или несколькими радикалами, выбранными из группы, включающей С1-С5-алкил, С1-С5-алкокси, галоген и гидроксил.
3. Стереоизомеры по п.1, в которых R2 представляет собой присоединенную через любое положение необязательно замещенную фталидильную, изоиндолильную, дигидроиндолильную, дигидроизоиндолильную, дигидроизохинолинильную, бензоксазинонильную, фталазинонильную, хинолинильную, изохинолинильную, хинолонильную, изохинолонильную, индазолильную, хиназолинильную, хиноксалинильную, циннолинильную, фталазинильную, 1,7- или 1,8-нафтиридинильную, дигидроиндолонильную, дигидроизоиндолонильную, бензимидазольную или индолильную группу.
4. Соединения по п.1, в которых R3 представляет собой трифторметильный или пентафторэтильный радикал.
5. Стереоизомеры по п.1, в которых фталидильная, изоиндолильная, дигидроиндолильная, дигидроизоиндолильная, дигидроизохинолинильная, бензоксазинонильная, фталазинонильная, хинолинильная, изохинолинильная, хинолонильная, изохинолонильная, индазолильная, хиназолинильная, хиноксалинильная, циннолинильная, кумаринильная, изокумаринильная, фталазинильная, 1,7- или 1,8-нафтиридинильная, дигидроиндолонильная, дигидроизоиндолонильная, бензимидазольная или индолильная группа R2 замещена от 0 до 3 одинаковыми или различными радикалами, выбранными из группы, включающей C1-С3-алкил, карбонил и галоген.
6. Стереоизомеры по п.5, в которых фталидильная, изоиндолильная, дигидроиндолильная, дигидроизоиндолильная, дигидроизохинолинильная, бензоксазинонильная, фталазинонильная, хинолинильная, изохинолинильная, хинолонильная, изохинолонильная, индазолильная, хиназолинильная, хиноксалинильная, циннолинильная, фталазинильная, 1,7- или 1,8-нафтиридинильная, дигидроиндолонильная, дигидроизоиндолонильная, бензимидазольная или индолильная группа R2 замещена метилом, хлором или фтором.
7. Применение соединений по п.1 для получения лекарственных средств.
8. Применение соединений по п.1 для получения лекарственных средств для лечения воспалительных заболеваний.
9. Способ получения соединений общей формулы I, характеризующийся тем, что имины общей формулы II
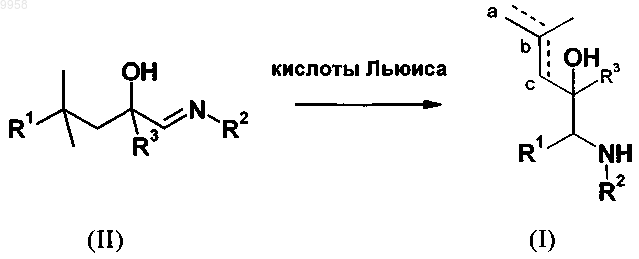
в которой R1, R2 и R3 имеют значения, указанные в п.1, подвергают взаимодействию с кислотами Льюиса в органическом растворителе и после обычной очистки получают соединения общей формулы I.
Текст
009958 Изобретение относится к соединениям формулы I, способу их получения и к их применению в качестве противовоспалительных средств. Из документов предшествующего уровня техники DE 10038639 и WO 02/10143 известны противовоспалительные средства следующей общей формулы в которой остаток Ar охватывает фталиды, тиофталиды, бензоксазиноны или фталазиноны. Эти соединения при их применении в экспериментальных исследованиях проявляют различную активность в отношении противовоспалительных и нежелательных метаболических эффектов и тем самым они превосходят описанные до настоящего времени нестероидные глюкокортикоиды или обладают, по меньшей мере,таким же хорошим действием. Тем не менее, избирательность соединений предшествующего уровня техники относительно других стероидных рецепторов все еще нуждается в улучшении. Следовательно, в основу настоящего изобретения была положена задача предложить соединения с улучшенной избирательностью в отношении других рецепторов стероидов. Указанная задача решается с помощью соединений, охарактеризованных в формуле изобретения. В соответствии с этим настоящее изобретение относится к соединениям общей формулы I в которой R1 представляет собой необязательно замещенный фенильный радикал,R2 представляет собой моноциклическую или бициклическую, ароматическую, частично ароматическую или неароматическую кольцевую систему, которая необязательно содержит 1-3 атома азота, 1-2 атома кислорода и/или 1-2 атома серы и необязательно замещена в одном или более местах радикалом,выбранным из группы, включающей карбонил, галоген, гидрокси, или С 1-С 5-алкил, который необязательно может быть замещен 1-3 гидрокси группами, 1-3 C1-C5-алкоксигруппами и/или 1-3 COOR6 группами, C1-C5-алкокси, C1-C5-алкилтио, C1-C5-перфторалкил, циано, нитро, или два заместителя вместе образуют группу, которая выбрана из групп -O-(CH2)n-O-, -O-(CH2)n-CH2-, -O-CH=CH-, -(CH2)n+2-, -NH(CH2)n+1-, -N(С 1-С 3-алкил)-(СН 2)n+1- и -NH-N=CH-,где n = 1 или 2, и концевые атомы кислорода и/или атомы углерода и/или атомы азота соединены с непосредственно смежными с ними кольцевыми атомами углерода,NR4R5,где R4 и R5 , независимо друг от друга, могут представлять собой водород, С 1-С 5-алкил или (СО)-С 1 С 5-алкил,COOR6,где R представляет собой водород или С 1-С 5-алкильную группу,(CO)NR7R8,где R7 и R8 , независимо друг от друга, представляют собой водород или С 1-С 5-алкильную группу,или (С 1-С 5-алкилен)-O-(СО)-С 1-С 5-алкильную группу,R3 представляет собой необязательно частично или полностью фторированную C1-С 3-алкильную группу,и пунктирная линия обозначает собой двойную связь между атомами а и b или двойную связь между атомами b и с или только простую связь между атомами а и b, а также между b и с,а также к их рацематам или представленным раздельно стереоизомерам и необязательно к их физиологически совместимым солям. Стереоизомеры общей формулы I, в которойR1 представляет собой необязательно замещенный фенильный радикал,R2 представляет собой моноциклическую или бициклическую ароматическую, частично ароматическую или неароматическую кольцевую систему, которая необязательно содержит 1-3 атома азота, 1-2 атома кислорода и/или 1-2 атома серы и необязательно замещена в одном или более местах радикалом,выбранным из группы, включающей карбонил, галоген, гидрокси, С 1-С 5-алкил, который необязательно может быть замещен 1 -3 гидроксигруппами, 1-3 С 1-С 5-алкоксигруппами и/или 1-3 COOR6 группами, С 1 С 5-алкокси, С 1-С 5-алкилтио, С 1-С 5-перфторалкил, циано, нитро,илиNR4R5,где R4 и R5 , независимо друг от друга, могут представлять собой водород, С 1-С 5-алкил или (СО)-С 1 С 5-алкил,COOR6,-1 009958 где R6 представляет собой водород или С 1-С 5-алкильную группу,(CO)NR7R8,где R7 и R8 , независимо друг от друга, представляют собой водород или С 1-С 5-алкильную группу,или (С 1-С 5-алкилен)-O-(СО)-С 1-С 5-алкильную группу,R3 представляет собой С 1-С 3-алкильную группу или частично или полностью фторированную С 1 С 3-алкильную группу,и пунктирная линия обозначает собой двойную связь между атомами а и b или двойную связь между атомами b и с или только простую связь между атомами а и b, а также между b и с, а также их рацематы или представленные раздельно стереоизомеры и необязательно их физиологически совместимые соли, представляют собой другой вариант осуществления изобретения. Соединения общей формулы I, в которых фенильный радикал R1 замещен одним или несколькими радикалами из группы, включающей С 1-С 5-алкил, С 1-C5-алкокси, С 1-С 5-алкилтио, С 1-С 5-перфторалкил,галоген, гидрокси, циано, нитро, -O-(СН 2)n-O-, -O-(СН 2)n-СН 2-, -O-СН=СН-, -(СН 2)n+2-, -NH-(CH2)n+1,N(C1-С 3-алкил)-(СН 2)n+1 или -NH-N=CH-,где n = 1 или 2, и концевые атомы кислорода и/или атомы углерода и/или атомы азота соединены с непосредственно смежными с ними кольцевыми атомами углерода, или NR4R5,где R4 и R5 , независимо друг от друга, могут представлять собой водород, С 1-С 5-алкил или (СО)-С 1 С 5-алкил,представляют собой другой вариант осуществления изобретения. Предпочтительными являются С 1 С 5-алкил, С 1-С 5-алкокси, гидрокси и галоген. Предпочтительными согласно настоящему изобретению являются соединения, в которых R1 содержит ди- или три-замещенный фенильный радикал. Предпочтительными заместителями для группы R1 являются алканоильная группа, С 1-С 5-алкил, С 1 С 5-алкокси, гидрокси, галоген, циано, -O-(СН 2)n-O-, -О-(СН 2)n-СН 2-, -O-СН=СН- и -(CH2)n+2- наиболее предпочтительными заместителями для группы R1 являются алканоильная группа, С 1-С 5-алкил, C1-С 5 алкокси, гидрокси, галоген и циано. Под алканоилом понимают радикал С 1-С 5-алкил-(СО)-. Соединения общей формулы I, в которых R2 представляет собой моноциклическую или бициклическую, ароматическую или частично ароматическую гетероциклическую кольцевую систему, в особенности бициклическую кольцевую систему, являются вариантом осуществления настоящего изобретения. В определении моноциклической или бициклической ароматической, частично ароматической или неароматической кольцевой системы, которая необязательно содержит 1-3 атома азота и/или 1-2 атома кислорода и/или 1-2 атома серы, ароматические кольцевые системы представляют собой бициклические кольцевые системы, которые содержат только одно ароматическое кольцо, включая алифатические кольцевые системы, которые могут иметь 1-7 гетероатомов или не иметь гетероатомов. Соединения общей формулы I, в которых R представляет собой присоединенную через любое положение необязательно замещенную фталидильную, изоиндолильную, дигидроиндолильную, дигидроизоиндолильную, дигидроизохинолинильную, тиофталидильную, бензоксазинонильную, фталазинонильную, хинолинильную, изохинолинильную, хинолонильную, изохинолонильную, индазолильную, бензотиазолильную,хиназолинильную, хиноксалинильную, циннолинильную, фталазинильную, 1,7-или 1,8-нафтиридинильную,дигидроиндолонильную, дигидроизоиндолонильную, бензимидазольную или индолильную группу, в особенности, если эти гетероциклические системы замещены, представляют собой предпочтительный вариант осуществления изобретения, если они замещены от 0 до 3 одинаковыми или различными радикалами из группы,включающей С 1-С 3-алкил, гидрокси, карбонил или галоген, и в наиболее предпочтительном варианте осуществления изобретения они замещены метилом, хлором или фтором. Соединения общей формулы I, в которых R2 представляет собой присоединенную через любое положение фталидильную, тиофталидильную, бензоксазинонильную, фталазинонильную, хинолинильную,изохинолинильную, хинолонильную, изохинолонильную, индазолильную, бензотиазолильную, хиназолинильную, хиноксалинильную, циннолинильную, фталазинильную, 1,7- или 1,8-нафтиридинильную,дигидроиндолонильную, дигидроизоиндолонильную, бензимидазольную или индолильную группу, представляют другой вариант осуществления изобретения. Соединения формулы I, в которых R2 несет кумаринильный или изокумаринильный радикал, в особенности изокумаринильный радикал, который необязательно может быть замещен от 0 до 3 одинаковыми или различными радикалами из группы, включающей С 1-С 3-алкил, гидрокси, карбонил или галоген, в частности, метилом, хлором или фтором, в особенности соединение из примера 9, представляет собой вариант осуществления изобретения.R2 может быть замещен в одном или нескольких местах радикалом из группы, включающей карбонил, галоген, гидрокси, С 1-С 5-алкил, С 1-С 5-алкокси, С 1-С 5-алкилтио, С 1-С 5-перфторалкил, циано, нитро,NR4R5, COOR6, (CO)NR7R8 или (С 1-С 5-алкилен)-O-(СО)-С 1-С 5-алкильную группу, предпочтительно из группы, включающей С 1-С 3-алкил, С 1-С 3-алкокси, гидрокси, галоген или карбонил; предпочтительно замещен метилом, хлором или фтором. Заместители могут быть одинаковыми или разными. Карбонильный заместитель для группы R2 определен таким образом, что карбонильный атом угле-2 009958 рода представляет собой кольцевой атом углерода, к которому присоединен с помощью двойной связи атом кислорода. Соединения общей формулы I, в которых радикал R2 незамещен или один или несколько раз замещен одинаковыми или разными радикалами из группы, включающей С 1-С 3-алкил, С 1-С 3-алкокси, гидрокси, галоген или карбонил, предпочтительно незаметен или один или несколько раз замещен одинаковыми или разными радикалами из группы, включающей С 1-С 3-алкил, гидрокси, карбонил или галоген, в частности один или несколько раз замещен одинаковыми или разными радикалами из группы, включающей метил, хлор или фтор, более предпочтительно метилом, хлором или фтором, представляют собой вариант осуществления изобретения. Атом азота индазола, хинолона, изохинолона и фталазина в радикале R2 согласно п.1 также может быть алкилирован С 1-С 3-алкильной группой. Соединения общей формулы I, в которых R2 представляет собой присоединенную через любое положение моноциклическую 5- или 6-членную гетероциклическую кольцевую систему, такую как, например, фуран или тиофен, представляют другой вариант осуществления изобретения. Соединения общей формулы I, в которых R2 представляет собой необязательно замещенное фенильное кольцо или нафтильное кольцо, представляют другой вариант осуществления изобретения. В качестве заместителей подходящими являются те, которые уже были описаны для R1, представляющего собой фенил. Под бициклическими системами с предпочтительно ароматической кольцевой системой подразумеваются те, которые содержат ароматическое кольцо и неароматическое кольцо, такие как, например, бензоксазиноны или дигидроиндолон. Соединения в соответствии с п.1, в которых R3 представляет собой трифторметил или пентафторэтил, представляют собой особый вариант осуществления изобретения. Соединения общей формулы I, в которых R1 представляет собой фенильную группу, которая необязательно замещена 0-3 одинаковыми или различными заместителями, выбранными из группы, включающей карбонил, С 1-С 3-алкокси, гидрокси и галоген, в особенности карбонил, метокси, гидрокси, фтор, хлор или бром,R2 представляет собой дигидроизоиндолонил, изохинолонил, хиназолинил, индазолил, кумаринил,изокумаринил, в особенности дигидроизоиндолонильную, изохинолонильную, хиназолинильную, индазолильную, изокумаринильную, фталазинильную, хинолонильную группу, которая необязательно может быть замещена 0-2 заместителями, выбранными из группы, включающей карбонил, С 1-С 3-алкил и галоген, в особенности метил и фтор, и R3 представляет собой CF3 или C2F5, в особенности CF3, представляют собой предпочтительный вариант осуществления изобретения. Кроме того, изобретение относится к применению соединений общей формулы I для получения лекарственных средств, а также к их применению для получения лекарственных средств для лечения воспалительных заболеваний. С 1-С 5-алкильные группы могут иметь прямую или разветвленную цепь и представляют собой метильную, этильную, н-пропильную, изопропильную, н-бутильную, изобутильную, трет-бутильную или н-пентильную группу, или 2,2-диметилпропильную, 2-метилбутильную или 3-метилбутильную группу. Предпочтительной является метильная или этильная группа. Они могут быть необязательно замещенными 1-3 гидрокси, 1-3 С 1-С 5-алкокси и/или 1-3 COOR6 группами. Предпочтительными являются гидроксигруппы.COOR6 может представлять собой свободную кислоту или сложный С 1-С 5-алкиловый эфир, где алкильный радикал имеет значения, уже указанные выше. С 1-С 5-алкоксигруппы в R1 и R2 могут иметь прямую или разветвленную цепь и представляют собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси или н-пентокси, 2,2 диметилпропокси, 2-метилбутокси или 3-метилбутокси группу. Предпочтительной является метокси или этоксигруппа. С 1-С 5-алкилтио группы могут иметь прямую или разветвленную цепь и представляют собой метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, трет-бутилтио или н-пентилтио, 2,2 диметилпропилтио, 2-метилбутилтио или 3-метилбутилтио группу. Предпочтительной является метилтио- или этилтиогруппа. Для частично или полностью фторированной С 1-С 3-алкильной группы принимают во внимание следующие частично или полностью фторированные группы: фторметил, дифторметил, трифторметил, фторэтил, 1,1-дифторэтил, 1,2-дифторэтил, 1,1,1-трифторэтил, тетрафторэтил и пентафторэтил. Среди них предпочтительной является трифторметильная группа или пентафторэтильная группа. Термин "атом галогена" или "галоген" означает атом фтора, хлора, брома или йода. Предпочтителен при этом атом фтора, хлора или брома. Группа NR4R5 может представлять собой, например, NH2, N(H)CH3, N(CH3)2, N(H)(CO)CH3,N(CH3)(CO)CH3, N[(CO)CH3]2, N(H)CO2CH3, N(CH3)CO2CH3 или N(CO2CH3)2. Двойная связь в общей формуле I может находиться между атомами а и b или атомами b и с. Также объектами изобретения являются соединения, которые не имеют двойной связи ни между атомами а и b, ни между атомами b и с.-3 009958 Соединения общей формулы I в соответствии с изобретением из-за наличия у них асимметрических центров могут существовать в виде стереоизомеров. Объектами настоящего изобретения являются все возможные диастереомеры, а также рацематы и в энантиомерно-чистой форме. Соединения в соответствии с изобретением также могут находиться в виде солей с физиологически совместимыми анионами, например в виде гидрохлоридов, сульфатов, нитратов, фосфатов, пивалатов,малеатов, фумаратов, тартратов, бензоатов, мезилатов, цитратов или сукцинатов. Соединения могут быть получены с помощью способа, описанного ниже. Соединения, описанные в настоящей заявке, получают путем взаимодействия соответствующих иминов с кислотами Льюиса, в особенности путем взаимодействия с трибромидом бора в органическом растворителе, предпочтительно в полярном растворителе, например дихлорметане, и последующей обычной очистки. Взаимодействие осуществляют при температуре в интервале от -70 до +30 С (предпочтительно от -30 до +30 С). В свою очередь, имины образуются путем взаимодействия соответствующих описанных альдегидов с требуемыми аминами общепринятым путем. Это осуществляют путем взаимодействия с титанатами или путем реакции в кислой среде или приблизительно в нейтральных условиях (например, ТГФ/спирт), или путем перемешивания при комнатной температуре или путем кипячения в водоотделителе. Предлагаемые в изобретении соединения, когда они представлены в виде рацемических смесей,можно разделять известными для специалиста в данной области методами разделения рацематов на чистые, оптически активные формы. Так, например, рацемические смеси можно разделять на чистые изомеры хроматографией на носителе, который сам является оптически активным (CHIRALPAK AD). Возможен и иной подход, а именно, свободную гидроксильную группу в рацемическом соединении общей формулы I можно эстерифицировать оптически активной кислотой и полученные сложные диастереоизомерные эфиры разделять путем фракционированной кристаллизации или хроматографическим путем и разделенные эфиры омылять соответственно до оптически чистых изомеров. В качестве оптически активной кислоты можно использовать миндальную кислоту, камфорсульфоновую кислоту или винную кислоту. Связывание предлагаемых в изобретении соединений с глюкокортикоидным рецептором (GR) и другими рецепторами стероидных гормонов (минералокортикоидным рецептором (MR), прогестероновым рецептором (PR) и андрогенным рецептором (AR проверяют с помощью полученных рекомбинантным путем рецепторов. При этом в исследованиях связывания используют препараты цитозоля из клеток Sf9, инфицированных рекомбинантными бакуловирусами, кодирующими GR-рецептор. Степень аффинности, проявляемой предлагаемыми в изобретении соединениями к GR-рецептору, в сопоставлении со сравнительным веществом, которым служит [3 Н]-дексаметазон, можно оценить как высокую и очень высокую. Так для соединения из примера 3 было определено значение IC50(GR) = 64 нМ. Важным молекулярным механизмом, лежащим в основе противовоспалительного действия глюкокортикоидов, принято считать опосредуемое GR-рецептором подавление транскрипции цитокинов, молекул адгезии, ферментов и иных провоспалительных факторов. Подобное подавление транскрипции обусловлено взаимодействием GR-рецептора с другими факторами транскрипции, например АР-1 и NFкаппа-В (обзорную информацию по этому можно найти у Cato А.С.В. и Wade E., BioAssays, 18, 1996, cc. 371-378). Предлагаемые в изобретении соединения общей формулы I ингибируют инициированную липополисахаридом (ЛПС) секрецию цитокина IL-8 в человеческих моноцитах линии ТНР-1. Концентрацию цитокинов определяли в супернатанте с использованием имеющихся в продаже наборов для ELISAанализа. Соединение из примера 3 проявляет ингибирование IC50(IL8)=25 нмоль. Противовоспалительное действие соединений общей формулы I исследовали в эксперименте на животных проведением опыта с вызванным кротоновым маслом воспалением у крыс и мышей (J. Exp.Med., 182, 1995, cc. 99-108). Для этого кротоновое масло в этанольном растворе локально наносили на уши животных. Одновременно с обработкой кротоновым маслом или за два часа до нее также локально наносили или же системно вводили тестируемые вещества. Через 16-24 ч измеряли массу ушей, которая служила мерой воспалительного отека, а также определяли пероксидазную активность, которая служила мерой притока гранулоцитов, и эластазную активность, которая служила мерой притока нейтрофильных гранулоцитов. В этом опыте соединения общей формулы I ингибируют после их локального нанесения,равно как и после их системного введения в организм три вышеуказанных параметра воспаления. Одним из наиболее часто встречающихся нежелательных действий при глюкокортикоидной терапии является так называемый "стероидный диабет" (см. Hatz H.J., Glucocorticoide: Immunologische Grund-4 009958lagen, Pharmakologie und Therapierichtlinien, (Глюкокортикоиды: иммунологические основания, фармакология и терапевтические указания), изд-во Wissenschafliche Verlagsgesellschaft mbH, Штутгарт, 1998). Причиной стероидного диабета является стимуляция глюконеогенеза в печени, обусловленная индукцией ответственных за это ферментов и действием свободных аминокислот, образующихся в результате разложения белков (катаболическое действие глюкокортикоидов). Ключевым ферментом катаболического обмена веществ в печени является тирозинаминотрансфераза (ТАТ). Активность этого фермента, которую можно определять фотометрически в гомогенатах печени, служит эффективной мерой нежелательного действия глюкокортикоидов на метаболизм. Для определения индукции ТАТ животных умерщвляют через 8 ч после введения тестируемых веществ, извлекают у них печень и измеряют активность ТАТ в гомогенате. В этом опыте соединения общей формулы I в дозах, в которых они обладают противовоспалительной эффективностью, не индуцируют вовсе тирозинаминотрансферазу или индуцируют ее лишь в незначительной степени. Предлагаемые в изобретении соединения общей формулы I благодаря их противовоспалительному,а также дополнительному противоаллергическому, иммунодепрессивному и антипролиферативному действию могут использоваться в качестве лекарственных средств для лечения или профилактики следующих патологических состояний у млекопитающих и человека, которые в последующем описании называются собирательным термином "заболевание" и к которым относятся следующие показания:(i) заболевания легких, обусловленные воспалительными, аллергическими и/или пролиферативными процессами: хронические обструктивные заболевания легких любого происхождения, прежде всего бронхиальная астма,бронхит различного происхождения,все формы рестриктивных заболеваний легких, прежде всего аллергический альвеолит,все формы отека легких, прежде всего токсический отек легких,саркоидозы и гранулематозы, прежде всего болезнь Бека;(ii) ревматические заболевания/аутоиммунные заболевания/заболевания суставов, обусловленные воспалительными, аллергическими и/или пролиферативными процессами: все формы ревматических заболеваний, прежде всего ревматический артрит, острая ревматическая лихорадка, ревматическая полимиалгия,реактивный артрит,воспалительные заболевания мягких тканей другого происхождения,симптомы артрита при дегенеративных заболеваниях суставов (артрозах),травматические артриты,коллагенозы любого происхождения, например системная красная волчанка, склеродермия, полимиозит, дерматомиозит, синдром Гужеро-Шегрена, болезнь Стилла, синдром Фелти;(iii) аллергии, обусловленные воспалительными и/или пролиферативными процессами: все формы аллергических реакций, например отек Квинке, сенной насморк, аллергия к укусам насекомых, аллергические реакции на лекарственные средства, препараты крови, контрастные вещества и иные аналогичные аллергены, анафилактический шок, крапивница, контактный дерматит;(iv) воспаления стенок сосудов (васкулиты): нодозный панартериит, темпоральный артериит, нодозная эритема;(v) кожные болезни, обусловленные воспалительными, аллергическими и/или пролиферативными процессами: атопический дерматит (прежде всего у детей),псориаз,красный волосяной лишай,эритематозные заболевания, вызванные различными патогенными факторами, например, облучением, химикатами, ожогами и т.д.,пузырчатые дерматозы,заболевания лихеноидного характера,кожный зуд (например, аллергического происхождения),себорейная экзема,розацеа,обыкновенная пузырчатка,многоформная экссудативная эритема,баланит,вульвит,выпадение волос, например круговидное облысение,кожная Т-клеточная лимфома;(vii) заболевания печени, обусловленные воспалительными, аллергическими и/или пролиферативными процессами: острый распад печеночных клеток,острый гепатит различного происхождения, например вирусный, токсический, лекарственный,хронический агрессивный и/или хронический персистирующий гепатит;(viii) желудочно-кишечные заболевания, обусловленные воспалительными, аллергическими и/или пролиферативными процессами: региональный энтерит (болезнь Крона),язвенный колит,гастрит,рефлюкс-эзофагит,неспецифические язвенные колиты другого происхождения, например глютеновая болезнь;(xii) неврологические заболевания, обусловленные воспалительными, аллергическими и/или пролиферативными процессами: отек головного мозга, прежде всего обусловленный опухолью отек головного мозга,рассеянный склероз,острый энцефаломиелит,менингит,различные формы судорожных припадков, например молниеносные кивательные судороги;(xiv) онкологические заболевания, обусловленные воспалительными, аллергическими и/или пролиферативными процессами: острый лимфолейкоз,злокачественная лимфома,лимфогранулематозы,лимфосаркомы,обширное метастазирование, прежде всего при раке молочной железы, бронха и предстательной железы;(xvii) состояния тяжелого шока, например анафилактический шок, синдром системной воспалительной реакции (ССВР);-6 009958 врожденной первичной недостаточности коры надпочечников, например врожденном адреногенитальном синдроме,приобретенной первичной недостаточности коры надпочечников, например болезни Аддисона, аутоиммунном воспалении надпочечников, постинфекционной недостаточности коры надпочечников, опухолях, метастазах и т.д.,врожденной вторичной недостаточности коры надпочечников, например врожденном гипопитуитаризме,приобретенной вторичной недостаточности коры надпочечников, например постинфекционной недостаточности коры надпочечников, опухолях и т.д.;(xix) рвота, обусловленная воспалительными, аллергическими и/или пролиферативными процессами,например, рвота обусловленная применением цитостатиков в сочетании с 5-НТ 3-антагонистом;(хх) боли воспалительного происхождения, например люмбаго. Помимо этого предлагаемые в изобретении соединения общей формулы I можно также применять для лечения и профилактики других, не перечисленных выше патологических состояний, при которых на сегодняшний день используют искусственные глюкокортикоиды (информацию по этом вопросу см. уHatz H.J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und The-rapierichtlinien, изд-во Wissenschafliche Verlagsgesellschaft mbH, Штутгарт, 1998). Все рассмотренные выше показания (i)-(xx) подробно описаны у Hatz H.J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien, изд-во Wissenschafliche VerlagsgesellschaftmbH, Штутгарт, 1998. Дозировка, в которой предлагаемые в изобретении соединения необходимо применять для достижения терапевтического эффекта при указанных выше патологических состояниях, является переменной величиной и зависит, например, от эффективности конкретного соединения общей формулы I, хозяина,метода введения лекарственного средства в организм, типа и тяжести подлежащих лечению состояний, а также от того, применяется ли предлагаемое в изобретении соединение в качестве профилактического или лечебного средства. Объектами настоящего изобретения являются также следующие:(i) применение одного из предлагаемых в изобретении соединений формулы I или их смеси для получения лекарственного средства для лечения "заболевания";(ii) способ лечения "заболевания", заключающийся в том, что пациенту, нуждающемуся в подобном лекарственном средстве, вводят предлагаемое в изобретении соединение в количестве, эффективном для подавления болезни;(iii) фармацевтическая композиция для лечения "заболевания", содержащая одно из предлагаемых в изобретении соединений или их смесь и по меньшей мере одно фармацевтическое вспомогательное вещество и/или носитель. При лечении животных удовлетворительных результатов в целом можно ожидать при применении предлагаемого в изобретении соединения в суточной дозе от 1 мкг до 100 мг на кг веса тела. В организм более крупных млекопитающих, например человека, предлагаемое в изобретении соединение рекомендуется вводить в суточной дозе от 1 мкг до 100 мг на кг веса тела. В предпочтительном варианте доза предлагаемого в изобретении соединения должна составлять от 10 мкг до 30 мг на кг веса тела, более предпочтительно от 10 мкг до 10 мг на кг веса тела. Такую дозу целесообразно вводить в организм в течение суток несколькими меньшими дозами. Для лечения острого шока (например, анафилактического шока) предлагаемое в изобретении соединение можно применять в разовых дозах, значительно превышающих вышеуказанный диапазон дозировок. Фармацевтические препараты на основе предлагаемых в изобретении новых соединений приготавливают по известной технологии путем переработки действующего вещества совместно с широко используемыми в галенике носителями, наполнителями, влияющими на распад лекарственной формы веществами, связующими, влагоудерживающими средствами, скользящими веществами, абсорбентами,разбавителями, улучшающими вкус веществами, красителями и т.д. и перевода в требуемую лекарственную форму. В этом отношении можно сослаться на книгу Remington's Pharmaceutical Science, 15-e изд.,изд-во Mack Publishing Company, Восточная Пенсильвания, 1980. Для перорального применения пригодны прежде всего таблетки, таблетки с покрытием, капсулы,пилюли, порошки, грануляты, пастилки, суспензии, эмульсии или растворы. Для парентерального применения можно использовать составы для инъекций и инфузий. Для внутрисуставной инъекции можно использовать приготовленные соответствующим образом кристаллические суспензии. Для внутримышечной инъекции можно использовать водные и масляные растворы для инъекций или суспензии либо соответствующие депо-препараты. Для ректального применения предлагаемые в изобретении новые соединения можно использовать в терапевтических целях как системно, так и локально в составе суппозиториев, капсул, растворов (вводимых, например, с помощью клизм) и мазей.-7 009958 Для введения предлагаемых в изобретении новых соединений в легкие можно использовать аэрозоли и средства для ингаляции. Для локального применения на глазах, наружном слуховом проходе, среднем ухе, полостях носа и околоносовых пазухах предлагаемые в изобретении новые соединения можно использовать в составе соответствующих фармацевтических препаратов в виде капель, мазей и настоек. Для наружного применения можно использовать препараты в виде гелей, мазей, жирных мазей, кремов, паст, присыпок, молочка и настоек. Для достижения достаточного фармакологического действия содержание соединений общей формулы I в таких лекарственных формах должно составлять от 0,01 до 20%. В объем изобретения включены также предлагаемые в нем соединения общей формулы I в качестве терапевтических действующих веществ. Помимо этого в объем изобретения включены предлагаемые в нем соединения общей формулы I в качестве терапевтических действующих веществ в сочетании с физиологически совместимыми и приемлемыми вспомогательными веществами и носителями. Объектом изобретения является также фармацевтическая композиция, которая содержит одно из фармацевтически активных предлагаемых в изобретении соединений или их смесь или его фармацевтически приемлемую соль или фармацевтически приемлемые вспомогательные вещества и носители. Экспериментальная часть Пример 1.(рац.) 4-[1-(4-Хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)-пент-4-ен-1-ил]амино-6-фтор-2,3-дигидроизоиндол-1-он 4-Амино-6-фтор-2,3-дигидроизоиндол-1-он 2-Метил-5-фтор-3-нитробензойная кислота 116 мл серной кислоты вносили и смешивали порциями при -15 С с 14,70 г (95,37 ммоль) 5-фтор-2 метилбензойной кислоты. К этой смеси по каплям добавляли нитрующую смесь (4,79 мл дымящей азотной кислоты и 21,8 мл концентрированной серной кислоты), в особенности при температуре от -15 до -10 С в течение 90 мин. После перемешивания в течение более 3 ч реакционную смесь вливали в смесь воды со льдом и интенсивно перемешивали приблизительно в течение 30 мин. Осажденные кристаллы отсасывали, нейтрально промывали водой и высушивали. Получали 8,56 г (45,1%) смеси различных региоизомеров и побочных продуктов. Затем эту смесь использовали на последующей стадии (эстерификации) и очищали на этой стадии. Метиловый эфир 2-метил-5-фтор-3-нитробензойной кислоты 8,56 г (42,99 ммоль) 2-метил-5-фтор-3-нитробензойной кислоты добавляли в 76 мл N,Nдиметилформамида и смешивали с 9,15 г (64,48 ммоль) метилйодида и 8,91 г (64,48 ммоль) карбоната калия. После перемешивания в течение 65 ч при комнатной температуре реакционную смесь добавляли к смеси воды со льдом и несколько раз экстрагировали этилацетатом. Объединенные органические экстракты промывали водой и соляным раствором. После высушивания (сульфат натрия) осушитель отсасывали и растворитель удаляли центрифугированием. После многократной хроматографии на силикагеле(подвижный растворитель этилацетат/гексан) получали требуемое соединение, а именно с выходом 25,9% (2,37 г). 1 Н-ЯМР (300 МГц, CDCl3):= 2,60 (3 Н), 3,96 (3 Н), 7,61 (1 Н), 7,77 (1 Н). Метиловый эфир 2-(бромметил)-5-фтор-3-нитробензойной кислоты 2,37 г (11,12 ммоль) метилового эфира 5-фтор-2-метил-3-нитробензойной кислоты добавляли в 35 мл четыреххлористого углерода и смешивали с 2,24 г (12,24 ммоль) N-бромсукцинимида и 5,4 мг бензоилпероксида. После четырех дней нагревания в колбе с обратным холодильником и последующего охлаждения сукцинимид отсасывали (стекловолоконный фильтр) и затем фильтрат центрифугировали до безводного состояния. После хроматографии на носителе Flashmaster получали 2,47 г (75,9%) требуемого соединения. 1H-ЯМР (300 МГц, CDCl3):= 4,01 (3 Н), 5,13 (2 Н), 7,72 (1 Н), 7,87 (1 Н). Метиловый эфир 2-(азидометил)-5-фтор-3-нитробензойной кислоты 2,47 г (8,46 ммоль) метилового эфира 2-(бромметил)-5-фтор-3-нитробензойной кислоты смешивали с 8,3 мл N,N-диметилформамида и 5,5 мл воды. После добавления 0,82 г (12,66 ммоль) азида натрия партию перемешивали всю ночь. Реакционную смесь добавляли к воде и трижды экстрагировали метил трет-бутиловым эфиром. Объединенные органические экстракты промывали водой и соляным раствором. После высушивания над сульфатом натрия полученное вещество фильтровали и растворитель удаляли центрифугированием. После хроматографии на носителе Flashmaster получали 2,06 г (95,8%) требуемого азида. 1 Н-ЯМР (300 МГц, CDCl3): = 4,00 (3 Н), 4,90 (2 Н), 7,73 (1 Н), 7,87 (1 Н). 4-Амино-6-фтор-2,3-дигидроизоиндол-1-он 1,86 г (7,32 ммоль) метилового эфира 2-(азидометил)-5-фтор-3-нитробензойной кислоты добавляли в 46 мл этанола и 3,4 мл ледяной уксусной кислоты, и смесь смешивали с 256,6 мг Pd/C. После перемешивания в течение ночи при комнатной температуре в атмосфере водорода, катализатор отсасывали с-8 009958 помощью стекловолоконного фильтра и фильтрат упаривали до безводного состояния. Остаток, 1,18 мг(97,5%) требуемого соединения, в дальнейшем использовали в неочищенном виде. 1 Н-ЯМР (300 МГц, ДМСО-d6): = 4,10 (2 Н), 5,75 (2 Н), 6,46-6,57 (2 Н), 8,50 (1H). 4-(4-Хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентан-1-ол Раствор 3 г этилового эфира 2-гидрокси-4-метилен-2-(трифторметил)валериановой кислоты в 22 мл 3-хлоранизола порциями смешивали при комнатной температуре с трихлоридом алюминия. После перемешивания в течение 48 ч при комнатной температуре партию смешивали с 2 н. соляной кислотой и гексаном и ее перемешивали в течение дополнительно часа. После промывания 2 н. соляной кислотой и водой, избыток 3-хлоранизола отгоняли в вакууме. Оставшийся остаток очищали путем хроматографии на силикагеле (подвижный растворитель: гексан/этилацетат). Получали 2,85 г смеси этилового эфира 4-(4 хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)валериановой кислоты и региоизомерного соединения этилового эфира 4-(2-хлор-4-метоксифенил)-2-гидрокси-4-мети-2-(трифторметил)валериановой кислоты в виде желтого масла. Эту смесь веществ смешивали в 90 мл простого эфира при 0 С с 445 мг литийалюминийгидрида и перемешивали в течение 12 ч. Партию добавляли к насыщенному раствору бикарбоната натрия и фильтровали через диатомовую землю. Фазы разделяли и водную фазу экстрагировали этил ацетатом. Ее промывали водой и соляным раствором, высушивали с помощью сульфата натрия и концентрировали путем упаривания в вакууме. После хроматографии на силикагеле (подвижный растворитель гексан/этилацетат) получали 1,87 г требуемого соединения 4-(4-хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентан-1-ола в виде первой фракции, и 160 мг региоизомерного соединения 4-(2-хлор-4-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентан-1-ола в виде второй фракции в виде бесцветных масел. 1-я фракция: 1 Н-ЯМР (300 МГц, CDCl3), =1,41 (s, 3 Н), 1,51 (s, 3 Н), 2,24 (d, 1H), 2,51 (d, 1 Н), 2,84(bs, 1H), 3,33 (d, 1H), 3,55 (d, 1H), 3,80 (s, 3H), 6,78 (dd, 1H), 6,90 (d, 1H), 7,38 (d, 1H) 4-(4-Хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналь 854,6 мг (6,733 ммоль) оксалилхлорида в 14,5 мл дихлорметана вносили в обогреваемую колбу. При-70 С по каплям добавляли 1,05 мл ДМСО, растворенного в 3 мл дихлорметана, и партию перемешивали дополнительно в течение 5 мин. Затем по каплям добавляли 2 г (6,12 ммоль) 4-(4-хлор-2-метоксифенил)2-гидрокси-4-метил-2-трифторметил-пентан-1-ола, растворенного в 6 мл дихлорметана. После перемешивания в течение 20 мин партию осторожно смешивали с 4,24 мл (30,61 ммоль) триэтиламина, в частности при температуре в интервале от -70 до -60 С. После перемешивания в течение 5 мин при -70 С,реакционной смеси давали медленно нагреться до комнатной температуры. Добавляли 25 мл воды и партию перемешивали еще в течение одного часа при комнатной температуре. После разделения фаз водную фазу один раз встряхивали с 100 мл дихлорметана. Объединенные органические экстракты промывали 1%-ной серной кислотой, 5%-ным раствором бикарбоната натрия и соляным раствором. В соответствии с обычной методикой, получали 1,92 г (96,9%) требуемого альдегида, который использовали на последующей стадии в неочищенной форме. 1 Н-ЯМР (300 МГц, CDCl3): =1,37 (3 Н), 1,45 (3 Н), 2,22 (1 Н), 3,35 (1 Н), 3,59 (1 Н), 3,90 (3 Н), 6,80-6,92(2 Н), 7,04 (1H), 9,02 (1H). 4-[4-(4-Хлор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметил)пентилиден]амино 6-фтор 2,3-дигидроизоиндол-1-он 250 мг (0,769 ммоль) рац-4-(4-хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя перемешивали в течение четырех дней при комнатной температуре с 127,9 мг (0,769 ммоль) 4 амино-6-фтор-2,3-дигидроизоиндол-1-она в 1,12 мл ледяной уксусной кислоты. Смесь трижды смешивали с толуолом и упаривали до безводного состояния на роторном испарителе. Остаток хроматографировали на силикагеле (подвижный растворитель этилацетат/гексан). Выделяли 236,7 мг (65%) требуемого соединения. 1 Н-ЯМР (300 МГц, CDCl3): =1,38 (3 Н), 1,53 (3 Н), 2,21 (1 Н), 3,40 (1 Н), 3,90 (3 Н), 4,30 (2 Н), 4,54(1 Н), 6,22 (1 Н), 6,70 (1 Н), 6,78 (1 Н), 6,89 (1 Н), 7,04 (1 Н), 7,45 (1 Н), 7,49 (1H). 4-[1-(4-Хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)-пент-4-ен-1-ил]амино-6 фтор-2,3-дигидроизоиндол-1-он) 145 мг (0,307 ммоль) 4-[4-(4-хлор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметил)пентилиден]амино 6-фтор-2,3-дигидроизоиндол-1-она смешивали при -30 С с 6,1 мл 1 М раствора ВВк 3 в дихлорметане и перемешивали в течение 1,5 ч при -20 С. Реакционную смесь по каплям смешивали при 20 С с насыщенным раствором бикарбоната натрия до достижения рН, равного 8. После смешивания с этилацетатом, охлаждающую баню удаляли и перемешивали в течение 15 мин. После экстрагирования этилацетатом (два раза), объединенные органические экстракты промывали водой и соляным раствором и высушивали (сульфат натрия). Осушитель отфильтровали, затем растворитель удаляли центрифугированием и остаток хроматографировали на силикагеле (подвижный растворитель метанол/ дихлорметан). Выделяли 25 мг (17,2%) требуемого соединения. Н-ЯМР (300 МГц, CD3OD): =1,78 (3 Н), 2,22 (1 Н), 2,48 (1H), 4,02 (3 Н), 4,22-4,43 (2 Н), 4,67 (1H),4,82 (1 Н), 5,25 (1 Н), 6,31 (1 Н), 6,71 (1 Н), 6,99 (1H), 7,10 (1H), 7,52 (1 Н). Пример 2. 4-[1-(5-Хлор-2-гидроксифенил)-2-гидрокси-4-метил-2-(трифторметил)-пент-4-ен-1-ил]амино-6 фтор-2,3-дигидроизоиндол-1-он 4-[4-(5-Хлор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметил)пентилиден]амино 6-фтор 2,3-дигидроизоиндол-1-он 250 мг (0,769 ммоль) рац-4-(5-хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя перемешивали в течение четырех дней при комнатной температуре с 127,9 мг (0,769 ммоль) 4 амино-6-фтор-2,3-дигидроизоиндол-1-она в 1,12 мл ледяной уксусной кислоты. Смесь трижды смешивали с толуолом и концентрировали путем упаривания на роторном испарителе до достижения безводного состояния. Остаток хроматографировали на силикагеле (подвижный растворитель этилацетат/гексан). Выделяли 244,8 мг (67,2%) требуемого соединения. 1 Н-ЯМР (300 МГц, CDCl3): =1,38 (3 Н), 1,53 (3 Н), 2,20 (1H), 3,49 (1 Н), 3,89 (3 Н), 4,38 (2 Н), 4,60H-ЯМР (300 МГц, CD3OD): =1,78 (3 Н), 2,25 (1 Н), 2,59 (1 Н), 4,42-4,45 (2 Н), 4,69 (1H), 4,82 (1 Н),5,22 (1 Н), 6,47 (1H), 6,73 (1 Н), 6,87 (1 Н), 7,13 (1 Н), 7,48 (1 Н). Пример 3. 5-[1-(5-Бром-2-гидроксифенил)-2-гидрокси-4-метил-2-(трифторметил)-пент-4-ен-1-ил]аминоизохинолин-1(2 Н)-он 5-Амино-изохинолин-1(2 Н)-он 5-Нитроизокумарин 16,4 г (84,03 ммоль) метилового эфира 2-метил-3-нитробензойной кислоты, который описан в примере 1, перемешивали с 26,8 г (225,1 ммоль) диметилацеталя N,N-диметилформамида в 85 мл диметилформамида в течение 12 ч при 130 С. Растворитель удаляли на роторном испарителе, остаток ресуспендировали в метил трет-бутиловом эфире и его три раза промывали водой. После промывания насыщенным раствором NaCl органическую фазу высушивали. Затем осушитель отфильтровали и растворитель удаляли центрифугированием, и оставшийся остаток хроматографировали на силикагеле (подвижный растворитель этилацетат/гексан). Выделяли 8,73 г (54,5%) требуемого соединения. 1 Н-ЯМР (300 МГц, CDCl3): =7,39 (1 Н), 7,45 (1 Н), 7,68 (1H), 8,49 (1 Н), 8,65 (1H). 5-Нитроизохинолин-1(2 Н)-он 2,51 г (13,13 ммоль) 5-нитроизокумарина добавляли в 100 мл этанола. Аммиак спрессовывали под давлением в автоклаве. Продукт осаждался и его отсасывали. Выделяли 1,98 г (79,7%) требуемого соединения. 1H-ЯМР (300 МГц, ДМСО-d6): =6,97 (1 Н), 7,45 (1 Н), 7,65 (1 Н), 8,43 (1 Н), 8,57 (1 Н), 11,5 (1 Н). 5-Аминоизохинолин-1(2 Н)-он 268,3 мг (1,51 ммоль) 5-нитроизохинолин-1(2 Н)-она добавляли с 376,5 мг хлорида аммония и 2,6 мл воды в 14 мл этанола и 5,4 мл тетрагидрофурана. После добавления порциями 1,23 г порошка цинка (нагревание от 30 до 35 С), смесь перемешивали в течение двух часов. Реакционную смесь отсасывали через стекловолоконный фильтр и повторно промывали этилацетатом. Затем фильтрат промывали водой и насыщенным раствором хлорида натрия, органическую фазу высушивали, как обычно. После отфильтровывания осушителя и удаления растворителя путем центрифугирования получали 196,5 мг (88,1%) требуемого амина. 1 Н-ЯМР (300 МГц, ДМСО-d6): =5,6 (2 Н), 6,68 (1 Н), 6,87,45 (1 Н), 7,00 (1 Н), 7,17 (1 Н), 7,39 (1H),11,7 (1 Н). 5-[4-(5-Бром-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)-пентилиден]аминоизохинолин-1 (2 Н)-он 400 мг (1,297 ммоль) рац-4-(5-бром-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметил)пентаналя перемешивали в 1,57 мл ледяной уксусной кислоты с 173,5 мг (1,083 ммоль) 5-аминоизохинолин 1(2 Н)-она в течение 6 дней при комнатной температуре. Смесь трижды смешивали с толуолом и упаривали до безводного состояния на роторном испарителе. Остаток хроматографировали на силикагеле- 10009958 5-[1-(5-Бром-2-гидроксифенил)-2-гидрокси-4-метил-2-(трифторметил)пент-4-ен-1-ил]аминоизохинолин-1(2 Н)-он 195 мг (0,381 ммоль) 5-[4-(5-бром-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентилиден]аминоизохинолин-1(2 Н)-она смешивали с 3,8 мл 1 М раствора BBr3 в дихлорметане и перемешивали в течение 90 мин при комнатной температуре. Реакционную смесь добавляли ко льду, значение рН доводили до 8 с помощью раствора бикарбоната натрия и дополнительно обрабатывали, как описано в примере 1. Вместе с остатком из другой партии, в которой использовали 145 мг (0,283 ммоль) рац-5[E/Z)-[4-(5-бром-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентилиден]аминоизохинолин-1(2 Н)-она, остаток хроматограф ировали с помощью носителя Flashmaster (аминовая фаза; подвижный растворитель дихлорметан/метанол). Выделяли 45,1 мг (13,64%) требуемого соединения. 1 Н-ЯМР (300 МГц, CD3OD): =1,80 (3 Н), 2,39 (1 Н), 2,60 (1 Н), 4,68 (1 Н), 4,82 (1H), 5,22 (1H), 6,636,89 (3 Н), 7,12-7,30 (3 Н), 7,50 (1H), 7,60 (1H). Пример 4.(рац.) 4-[1-(5-Фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-(трифторметил)пент-3-ен-1-ил]амино-2,3-дигидроизоиндол-1-он 4-(5-Фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметил)-пентаналь 6,55 г (21,11 ммоль) рац-4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметил)пентан-1 ола (наименование) (WO 00/32584) растворяли в 224 мл дихлорметана и смешивали при комнатной температуре с 74 мл безводного диметилсульфоксида и 10,68 г (105,55 ммоль) триэтиламина. При 15-18 С,порциями добавляли 10,08 г (63,33 ммоль) комплекса SO3/пиридин в течение 40 мин. После перемешивания в течение ночи при комнатной температуре добавляли 84 мл насыщенного раствора хлорида аммония. Происходило незначительное нагревание. После перемешивания в течение 15 мин при комнатной температуре смесь дважды экстрагировали каждый раз 300 мл диэтилового эфира. Органические фазы промывали водой и соляным раствором и высушивали (сульфат натрия). После отфильтровывания растворителя и удаления растворителя центрифугированием, оставшийся остаток хроматографировали на силикагеле (подвижный растворитель этилацетат/гексан). Выделяли 5,85 г (90%) требуемого соединения. 1 Н-ЯМР (300 МГц, CDCl3): - 1,40 (3 Н), 1,46 (3 Н), 2,22 (1 Н), 3,38 (1 Н), 3,59 (1 Н), 3,86 (1H), 6,706,80 (1 Н), 6,82-6,97 (2 Н), 9,05 (1 Н). 4-[4-(5-Фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентилиден]амино 2,3 дигидроизоиндол-1-он 400 мг (1,297 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметил)пентаналя перемешивали с 192,1 мг (1,297 ммоль) 4-амино-2,3-дигидроизоиндол-1-она в 1,89 мл ледяной уксусной кислоты в течение четырех дней при комнатной температуре. Смесь трижды смешивали с толуолом и упаривали до безводного состояния на роторном испарителе. Остаток хроматографировали на силикагеле (подвижный растворитель этилацетат/гексан). Выделяли 429,7 мг (75,5%) требуемого соединения. 1(1 Н), 6,53-6,68 (3 Н), 6,72-6,95 (2 Н), 7,37 (1 Н), 7,49 (1H), 7,75 (1H). 4-[1-(5-Фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-(трифторметил)пент-4-ен-1-ил]амино-2,3 дигидроизоиндол-1-он 420 мг (0,958 ммоль) соединения 4-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентилиден]амино-2,3-дигидроизоиндол-1-она, которое описано в предыдущем абзаце, смешивали с 9,6 мл 1 М раствора трибромида бора в дихлорметане и перемешивали в течение 45 мин при комнатной температуре. Реакционную смесь по каплям смешивали при -30 С с насыщенным бикарбонатом натрия до достижения рН, равного 8. После разведения этилацетатом, охлаждающую баню удаляли, и смесь интенсивно перемешивали в течение 15 мин. После этого два раза экстрагировали этилацетатом,органические фазы промывали водой и насыщенным раствором хлорида натрия. После высушивания над сульфатом натрия и удаления растворителя центрифугированием, остаток хроматографировали на носителе Flashmaster (силикагель, Flash NH2) (подвижный растворитель дихлорметан/метанол). Выделяли 37,8 мг (9,3%) требуемого соединения. 1H-ЯМР (300 МГц, CD3OD): =1,82 (3 Н), 2,38 (1H), 2,55 (1 Н), 4,28-4,50 (2 Н), 4,69 (1 Н), 4,81 (1H),5,20 (1 Н), 6,70-6,87 (3 Н), 7,06-7,17 (2 Н), 7,22 (1 Н). Дополнительно, выделяли 12,8 мг региоизомерного соединения 4-[1-(5-фтор-2-гидроксифенил)-2 гидрокси-4-метил-2-(трифторметил)пент-3-ен-1-ил]амино-2,3-дигидроизоиндол-1-она. Точка плавления: 195-197 С. Пример 5.- 11009958 380 мг (0,832 ммоль) рац-4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметил)пентаналя, который описан в примере 4, подвергали взаимодействию с 1,89 мл ледяной уксусной кислоты с 215,4 мг (1,297 ммоль) 4-амино-6-фтор-2,3-дигидроизоиндол-1-она, который описан в примере 1, и смесь перемешивали в течение 4 дней при комнатной температуре. Поскольку исходное вещество все еще присутствовало, согласно ТСХ, то реакционную смесь смешивали с толуол и кипятили в течение 20 ч в водоотделителе. Толуол удаляли на роторном испарителе, и остаток хроматографировали на силикагеле (подвижный растворитель этилацетат/гексан). Выделяли 383,4 мг (64,7%) требуемого имина. 1 Н-ЯМР (300 МГц, CDCl3): =1,37 (3 Н), 1,53 (3 Н), 2,20 (1 Н), 3,47 (1 Н), 3,88 (3 Н), 4,32 (2 Н), 4,57(1H), 6,22 (1 Н), 6,63-6,88 (4 Н), 7,42 (1 Н), 7,48 (1 Н). 4-[1-(5-Фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-(трифторметил)-пент-4-ен-1-ил]амино-6 фтор-2,3-дигидроизоиндол-1-он 380 мг (0,832 ммоль) 4-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентилиден]амино 6-фтор-2,3-дигидроизоиндол-1-она смешивали при комнатной температуре с 8,3 мл 1 М раствора BBr3 в дихлорметане и перемешивали в течение одного часа при температуре ледяной бани. Осуществляли обработку партии, как описано в примере 4. Затем неочищенный продукт хроматографировали на носителе Flashmaster (аминовая фаза; подвижный растворитель метанол/дихлорметан), получая 22,2 мг (6,03%) требуемого соединения. 1H-ЯМР (300 МГц, CD3OD): = 1,80 (3 Н), 2,30 (1 Н), 2,55 (1 Н), 4,22-4,48 (2 Н), 4,68 (1 Н), 4,81 (1 Н),5,17 (1 Н), 6,49 (1 Н), 6,72 (1H), 6,75-6,90 (2 Н), 7,17 (1H). Пример 6. 2-4-Хлор-альфа-[(2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-4 ен-2-ол и 2-4-хлор-альфа-[(2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-3-ен-2-ол 5-Амино-2-метихиназолин 12,7 г (ммоль) 2-метил-5-нитро-3 Н-хиназолин-4-она (М. Т. Bogert, V. J. Chambers J. Org. Chem. 1905, cc. 649-658) и 37,5 г пентахлорида фосфора нагревали в колбе с обратным холодильником в 75 мл фосфорилхлорида в течение 20 ч. После охлаждения смесь вливали в насыщенный раствор NaHCO3 и экстрагировали этилацетатом. Органическую фазу высушивали и растворитель удаляли. Получали 14 г 4-хлор-2-метил-5-нитрохиназолина, из которого 4,5 г (20,2 ммоль) растворяли в 225 мл этилацетата и 22,5 мл триэтиламина. Добавляли 2 г палладия на угле и смесь перемешивали в течение четырех часов в атмосфере водорода при атмосферном давлении, в это время ее охлаждали на льду. Из раствора удаляли катализатор путем фильтрации через целит, затем продукт повторно промывали 200 мл этанола и концентрировали путем упаривания. После хроматографии на силикагеле с этилацетатом-этанолом (0-10%),получали 530 мг продукта. 1(2,50 ммоль) тетраизопропилата титана при комнатной температуре. Смесь перемешивали в течение 3 ч при 105 С. После охлаждения смесь добавляли к воде, перемешивали в течение нескольких минут, отсасывали с помощью диатомовой земли, повторно промывали этилацетатом и фазы разделяли. Водную фазу несколько раз экстрагировали этилацетатом, и объединенные органические фазы промывали насыщенным раствором NaCl, и высушивали с помощью сульфата натрия. Растворитель удаляли на роторном испарителе и неочищенный продукт хроматографировали на силикагеле (элюент: гексан/этилацетат 4:1). Выделяли 130 мг (28%) требуемого соединения.(рац.) 2-4-Хлор-алъфа-[(2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-4-ен-2-ол: 130 мг (0,28 ммоль) 1,1,1,-трифтор-4-(4-хлор-2-метоксифенил)-2-[(2-метилхиназол-5-ил)иминометил]-4-метилпентан-2-ола вносили в 5 мл дихлорметана и по каплям добавляли 5,6 мл 1 М раствора трибромида бора в дихлорметане при -70 С. Смесь оставляли достичь -10 С в течение 1,5 ч, затем добавляли 5 мл насыщенного раствора NaHCO3, фазы разделяли, водную фазу экстрагировали дихлорметаном, объединенные органические фазы промывали насыщенным раствором NaHCO3 и насыщенным растворомNaCl и высушивали с помощью сульфата натрия. После удаления растворителя на роторном испарителе,неочищенный продукт хроматографировали на силикагеле (элюент: дихлорметан/метанол 98:2). Получали 80 мг (62%) требуемого продукта в виде желтого твердого вещества. Точка плавления: 193 С. Кроме того, в виде немного более полярного побочного продукта, получали 7 мг изомерного соединения с двойной связью 2-4-хлор-альфа-[(2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1 трифтор-4-метилпент-3-ен-2-ола.(рац.) 2-4-Хлор-альфа-[(8-фтор-2-метилхиназолин-5-ил)амино]-2-метоксибензил -1,1,1-трифтор 4-метилпент-3-ен-2-ол 5-Амино-8-фтор-2-метилхиназолин Раствор 2,4 г (18,6 ммоль) 2,5-дифторанилина в 11 мл воды и 1,6 мл концентрированной соляной кислоты (37%), температура которой равна 50 С, добавляли к раствору 3,35 г (20,25 ммоль) хлораль гидрата и 21,27 г (149,7 ммоль) сульфата натрия в 72 мл воды, который заранее перемешивали в течение 1 ч при этой температуре. Смесь перемешивали еще в течение 30 мин при комнатной температуре и затем добавляли 4,09 г (58,9 ммоль) хлорида гидроксиламмония в 19 мл воды, смесь нагревали в течение 45 мин до 125 С и выдерживали при этой температуре в течение 5 мин. После охлаждения и еще через один час, осажденный светло-коричневый осадок отфильтровали, промывали водой и высушивали. В качестве промежуточного продукта получали 3,0 г (15,0 ммоль) гидроксилимина, который порциями растворяли в 15 мл концентрированной серной кислоты при 60 С. После завершения добавления, смесь нагревали в течение 2 ч до 80 С и в течение 4 ч до 90 С. Ей давали возможность охладиться, и раствор вливали в 100 г льда. Смесь экстрагировали этилацетатом, органическую фазу промывали водой, высушивали над сульфатом натрия и концентрировали путем упаривания. После хроматографии на силикагеле с гексаномэтилацетатом (0-45%), получали 1,2 г (7,1 ммоль) 4,7-дифторизатина. 1,8 мл 30 %-ного раствора перекиси водорода по каплям добавляли к изатину в 30 мл 1-молярного раствора гидроксида натрия в течение 10 мин. Через 2 ч перемешивания при комнатной температуре смесь охлаждали до 0 С, добавляли 5 мл 4-молярной соляной кислоты и разводили 50 мл воды. Смесь экстрагировали этилацетатом, высушивали над сульфатом натрия, концентрировали путем упаривания и таким образом получали с количественным выходом 1,27 г 3,6-дифторантраниловой кислоты, которую подвергали реакции без дополнительной очистки. 3,6-Дифторантраниловую кислоту нагревали в 8 мл ангидрида уксусной кислоты в течение 45 мин до 100 С. После охлаждения, полученную уксусную кислоту и избыток ангидрида уксусной кислоты удаляли азеотропически с толуолом в вакууме. Остаток смешивали с 40 мл 25%-ного раствора аммиака,в это время его охлаждали на льду и перемешивали в течение 72 ч. Смесь разводили водой и подкисляли с помощью уксусной кислоты. Ее экстрагировали этилацетатом, органическую фазу промывали водой,высушивали над сульфатом натрия и концентрировали путем упаривания. Таким образом полученные 1,03 г (5,25 ммоль) 5,8-дифтор-2-метил-3 Н-хиназолин-4-она и 6 г пентахлорида фосфора нагревали в 20 мл фосфорилхлорида в течение 12 ч до 125 С. После охлаждения смесь вливали в насыщенный растворNaHCO3 и экстрагировали этилацетатом. Органическую фазу высушивали, и растворитель удаляли. Получали с количественным выходом 1,7 г 4-хлор-5,8-дифтор-2-метилхиназолина, который растворяли в 60 мл этилацетата и 5 мл триэтиламина. Добавляли 600 мг палладия на угле и смесь встряхивали в течение 2 ч (480 мл абсорбции водорода) в атмосфере водорода при атмосферном давлении. Из раствора удаляли катализатор путем фильтрации через целит, при этом его промывали 100 мл этанола и концентрировали путем упаривания. После хроматографии на силикагеле с гексаном-этилацетатом-этанолом (0-40%) получали 550 мг 5,8-дифтор-2-метилхиназолина. 890 мг (13,7 ммоль) азида натрия добавляли к 240 мг (1,3 ммоль) 5,8-дифтор-2-метилхиназолина, 300 мг (1,13 ммоль) 18-краун-6 в 10 мл ДМФА и смесь нагревали в течение 8 ч до 125 С. Растворитель удаляли в вакууме, хроматографировали на силикагеле с этилацетатом и получали 52 мг продукта. 1 Н-ЯМР (300 МГц, CDCl3); = 2,92 (s, 3 Н), 4,31 (br., 2H), 6,67 (dd, 1H), 7,38 (dd, 1H), 9,37 (s, 1H).(рац.) 1,1,1,-Трифтор-4-(4-хлор-2-метоксифенил)-2-[(8-фтор-2-метил-хиназол-5-ил)иминометил]-4 метил-пентан-2-ол 2,40 г (7,39 ммоль) рац-4-(4-хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя растворяли в 1,30 г (7,34 ммоль) 5-амино-8-фгор-2-метилхиназолина в 30 мл толуола и добавляли 3,10 мл (14,7 ммоль) триэтилата титана при комнатной температуре. Смесь перемешивали в течение 3 ч при 105 С. После охлаждения смесь добавляли к воде, перемешивали в течение нескольких минут,отсасывали с помощью диатомовой земли, повторно промывали этилацетатом и водой и фазы разделяли. Водную фазу несколько раз экстрагировали этилацетатом и объединенные органические фазы промывали насыщенным раствором NaCl и высушивали с помощью сульфата натрия. Растворитель удаляли на роторном испарителе и неочищенный продукт хроматографировали на силикагеле (элюент гексан/этилацетат 4:1). Выделяли 3,20 г (90%) требуемого соединения.(рац.) 2-4-Хлор-алъфа-[(8-фтор-2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4 метилпент-4-ен-2-ол 3,1 г (6,4 ммоль) (рац.) 1,1,1-трифтор-4-(4-хлор-2-метоксифенил)-2-[(8-фтор-2-метил-хиназол-5- 13009958 ил)иминометил]-4-метилпентан-2-ола вносили в 50 мл дихлорметана и по каплям добавляли 128 мл 1 М раствора трибромида бора в дихлорметане при -75 С. Смесь оставляли достичь -20 С в течение 2,5 ч. После этого реакционную смесь добавляли к 300 мл насыщенного раствора NaHCO3, перемешивали дополнительно в течение 15 мин, фазы разделяли, водную фазу экстрагировали дихлорметаном, объединенные органические фазы промывали насыщенным раствором NaHCO3 и насыщенным раствором NaCl и высушивали с помощью сульфата натрия. После удаления растворителя на роторном испарителе неочищенный продукт хроматографировали на силикагеле (элюент: гексан/этилацетат 3:1 до 1:1). После этого его снова очищали с помощью ВЭЖХ. Получали 650 мг (26%) требуемого продукта в виде желтого твердого вещества. Точка плавления: 110 С. Кроме того, изомерное соединение с двойной связью (рац.) 2-4-хлор-альфа-[(8-фтор-2 метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-3-ен-2-ол может быть выделено в виде слабополярного побочного продукта. Точка плавления: 118 С. Основной продукт разделяли на его энантиомеры: 1. Chiralpak AD 20, гекс/EtOH 95/5. 2. Luna C18,CH3CN/H2O 50/50. МС (ESI): 484/486 (M+l), 516/518 (М+1+МеОН); 1(1H), 6,69-7,10 (2 Н), 7,10 (1H), 7,42 (1 Н), 8,13 (1H) Пример 9. 5-[1-(4-Хлор-2-гидроксифенил)-2-гидрокси-4-метил-2-(трифторметил)-пент-3-ен-1-ил]аминоизокумарин 5-([4-(4-Хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентилиден]аминоизокумарин 200 мг (0,616 ммоль) 4-(4-хлор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя смешивали с 99,3 мг (0,616 ммоль) 5-аминоизокумарина (полученного восстановлением 5 нитроизокумарина, описанного в примере 3, с цинком и хлоридом аммония в EtOH, тетрагидрофуране,воде) в 0,9 мл ледяной уксусной кислоты и смесь перемешивали в течение четырех дней при комнатной температуре. Реакционную смесь три раза сливали с толуолом и оставшийся остаток хроматографировали на силикагеле (подвижный растворитель этилацетат/гексан). Выделяли 279,4 мг (96,9%) требуемого имина. 1 Н-ЯМР (300 МГц, CDCl3): = 1,37 (3 Н), 1,58 (3 Н), 2,23 (1 Н), 2,42 (1H), 3,87 (3 Н), 4,64 (1H), 6,50(1 Н), 6,10-6,19 (2 Н), 6,22 (1 Н), 7,03 (1 Н), 7,33 (1H), 7,35-7,46 (2 Н), 8,20 (1H) 5-[1-(4-Хлор-2-гидроксифенил)-2-гидрокси-4-метил-2-(трифторметил)-пент-3-ен-1-ил]аминоизокумарин 270 мг (0,577 ммоль) вышеописанного имина смешивали с 5,7 мл 1 М раствора BBr3 в дихлорметане и перемешивали в течение 2,5 ч при комнатной температуре. После осуществления обычной обработки остаток хроматографировали на носителе Flashmaster (NH2 колонка, подвижный растворитель метанол/дихлорметан). Выделяли 38,6 мг требуемого соединения. Точка плавления: 103-107 С. Пример 10. 2-4-Фтор-альфа-[(2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-4 ен-2-ол и 2-4-фтор-альфа-[(2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4 метилпент-3-ен-2-ол Аналогично примеру 6, 340 мг (1,1 ммоль) 4-(4-фтор-2-метоксифенил)-2-гидрокси-4-метил-2(трифторметил)пентаналя и 211 мг (1,32 ммоль) 5-амино-2-метилхиназолина (описанного в примере 6) подвергали реакции с 0,46 мл (2,2 ммоль) триэтилата титана для образования имина. После аналогичной перегруппировки с трибромидом бора и последующей хроматографии на силикагеле с гексаном- 14009958 этилацетатом (0-50%), получали 156 мг смеси, которая содержит 2-4-фтор-альфа-[(2-метилхиназолин-5 ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-4-ен-2-ол и 2-4-фтор-альфа-[(2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-3-ен-2-ол. Разделение осуществляли с помощью препаративной тонкослойной хроматографии на силикагеле (дихлорметан/2-пропанол 5%) и получали 51 мг основного компонента и 9 мг минорного компонента. 1 Н-ЯМР (300 МГц, CDCl3) основного компонента: = 1,74 (s, 3H), 2,33 (d, 1 Н), 2,50 (d, 1H), 2,85 (s,3H), 3,41 (s, 1H), 3,98 (s, 3H), 4,58 (s, 1H), 5,02 (s, 1H), 5,31 (d, 1H), 6,12 (d, 1H), 6,27 (d, 1H), 6,60-6,71 (m,2H), 7,17 (d, 1H), 7,40 (dd, 1 Н), 7,50 (t, 1H), 9,39 (s, 1H). 1(t, 1H), 9,46 (s, 1H). Пример 11. 2- (4-Фтор-альфа-[(2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпентан 2-ол 17 мг (0,04 ммоль) (рац.) 2-4-фтор-альфа-[(2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1 трифтор-4-метилпент-4-ен-2-ола встряхивали в 2 мл метанола, 2 мл этилацетата и 0,05 мл триэтиламина с 20 мг палладия на угле (10%) в течение 5 ч в атмосфере водорода. Реакционную смесь смешивали с 200 мг активированного диоксида марганца и фильтровали через целит в течение 10 мин. Смесь концентрировали путем упаривания, и получали 3 мг требуемого продукта после препаративной тонкослойной хроматографии на силикагеле (циклогексан/этилацетат 50%). 1 Н-ЯМР (300 МГц CDCl3); = 0,83 (d, 3 Н), 0,91 (s, 3 Н), 1,78 (m, 1 Н), 2,85 (s, 3 Н), 3,98 (s, 3 Н), 5,25 (d,1H), 6,10 (d, 1H), 6,35 (d, 1H), 6,63-6,72 (m, 2H), 7,19 (d, 1H), 7,40 (dd, 1H), 7,53 (t, 1H), 9,40 (s, 1H). Пример 12. 2-4-Хлор-5-фтор-альфа-[(2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4 метилпент-4-ен-2-ол Аналогично примеру 6, 200 мг (0,58 ммоль) 4-(4-хлор-5-фтор-2-метоксифенил)-2-гидрокси-4-метил 2-(трифторметил)пентаналя и 111 мг (0,70 ммоль) 5-амино-2-метилхиназолина подвергали реакции с 0,24 мл (1,16 ммоль) триэтилата титана для образования имина. После аналогичной перегруппировки с трибромидом бора и последующей хроматографии на силикагеле (дихлорметан/метанол 5%), получали 34 мг указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, CDCl3); = 1,45 (s, 3 Н), 1,64 (s, 3 Н), 2,75 (s, 3 Н), 3,92 (s, 3 Н), 5,31 (s, 1H), 5,33 (d,1H), 6,23 (d, 1H), 6,42 (d, 1H), 6,54-6,64 (m, 2H), 7,15 (d, 1H), 7,46 (dd, 1H), 7,53 (t, 1H), 9,46 (s, 1H). Пример 13. 2-4-Фтор-альфа-[(7-фтор-2-метилхиназолин-5-ил)амино]-2-метоксибензил]-1,1,1-трифтор-4 метилпент-3-ен-2-ол 5-Амино- 7-фтор-2-метихиназолин 17 г (70,5 ммоль) 3,6-дифтор-2-N-пивалоиламинобензальдегида (L. Florvall, I. Fagervall, L.-G. Larsson, S. В. Ross, Eur. J. Med. Chem. 34, 1999, cc. 137-151), 9,2 г гидрохлорида ацетамидина, 13,4 г карбоната калия и 10,4 г молекулярного сита (4 А) вместе добавляли в 70 мл бутиронитрила. Смесь нагревали до 145 С, при этом ее интенсивно перемешивали в течение 17 ч и растворитель удаляли в вакууме. После хроматографирования остатка на силикагеле с гексаном/этилацетатом (0-70%), получали 4,5 г 7-фтор-5N-пивалоиламино-2-метихиназолина. 1 г (3,82 ммоль) 7-фтор-5-N-пивалоиламино-2-метихиназолина растворяли в 74 мл толуола и охлаждали до -70 С. В течение 30 мин, по каплям добавляли 9,5 мл (11,4 ммоль) 1,2 М раствора гидрида диизобутилалюминия в толуоле. Реакционной смеси позволяли нагреться до -40 С и ее перемешивали в течение 4 ч при -40 С. Медленно добавляли воду и смесь перемешивали в течение 30 мин до образования осадка, который удаляли путем фильтрации через целит. Фазы разделяли, промывали насыщенным раствором хлорида натрия и высушивали над сульфатом натрия. После хроматографии на силикагеле с гексаном-этилацетатом (0-100%), получали 64 мг продукта. 1H-ЯМР (300 МГц, CDCl3); = 2,83 (s, 3 Н), 4,67 (br., 2 Н), 6,50 (dd, 1H), 6,93 (dd, 1H), 9,23 (s, 1H). 0,25 мл триэтилата титана добавляли к 150 мг (0,48 ммоль) 4-(4-фтор-2-метоксифенил)-2-гидрокси 4-метил-2-(трифторметил)-пентаналя и 85 мг (0,48 ммоль) 5-амино-7-фтор-2-метилхиназолина в 8 мл толуола и смесь нагревали до 100 С в течение 2 ч. После охлаждения ее вливали в воду и продолжали интенсивно перемешивать. Суспензию фильтровали через целит и тщательно повторно промывали этилацетатом. Фазы фильтрата разделяли и смесь снова экстрагировали этилацетатом. Ее высушивали над сульфатом натрия и растворитель удаляли в вакууме. Таким образом полученного в неочищенном виде 220 мг 4-(4-фтор-2-метоксифенил)-1-(7-фтор-2-метилхиназолин-5-илимино)-4-метил-2-(трифторметил)пентан-2-ола ресуспендировали в 8 мл дихлорметана и смесь охлаждали до -70 С. По каплям добавляли 3 мл (3 ммоль) 1 М раствора тетрахлорида титана в дихлорметане в течение 10 мин, и смеси позволяли нагреться в течение 4 ч до комнатной температуры. Раствор вливали в насыщенный раствор бикарбоната натрия и интенсивно перемешивали в течение 5 мин. Смесь экстрагировали этилацетатом, промывали- 15009958 насыщенным раствором хлорида натрия и высушивали над сульфатом натрия. После концентрирования путем упаривания и хроматографирования на силикагеле (дихлорметан/метанол 10%), получали 25 мг требуемого продукта. 1 Н-ЯМР (300 МГц, CDCl3); = 1,53 (s, 3 Н), 1,66 (s, 3 Н), 2,12 (d, 1H), 2,27 (d, 1H), 2,84 (s, 3 Н), 4,94 (d,1H), 5,99 (s, 1H), 6,00 (s, 1H), 6,02 (d, 1H), 6,50 (dd, 1H), 6,68 (d, 1H), 6,83 (d, 1H), 6,89 (dd, 1H), 9,26 (s,1H). Пример 14. 2-6-Фтор-альфа-[(8-фтор-2-метилхиназолин-5-ил)амино]-2-гидроксибензил-1,1,1-трифтор-4 метилпент-4-ен-2-ол Аналогично примеру 6, 200 мг (0,65 ммоль) 4-(6-фтор-2-метоксифенил)-2-гидрокси-4-метил-2(трифторметил)пентаналя и 141 мг (0,80 ммоль) 5-амино-8-фтор-2-метилхиназолина (получение описано в примере 7) подвергали реакции с 0,33 мл (1,58 ммоль) триэтилата титана для образования имина. После аналогичной перегруппировки с трибромидом бора и последующей хроматографии на силикагеле (гексан/ацетон 50%) получали 28 мг указанного в заглавии соединения. 1H-ЯМР (300 МГц, CDCl3); = 1,80 (s, 3 Н), 2,38 (d, 1H), 2,55 (d, 1H), 2,85 (s, 3H), 4,66 (s, 1H), 4,95 (s,1H), 5,45 (d, 1H), 6,34 (d, 1H), 6,60-6,74 (m, 3H), 7,13 (m, 1H), 7,46 (t, 1H), 9,43 (s, 1H). Пример 15. 2-4-Фтор-альфа-[(2-метилфталазин-1-он-5-ил)амино]-2-гидроксибензил-1,1,1-трифтор-4-метилпент-4 ен-2-ол и 2-4-фтор-альфа-[(2-метилфталазин-1-он-5-ил)амино]-2-гидроксибензил-1,1,1-трифтор-4-метилпент-3-ен-2-ол 3-Бром-4-нитрофталид 5,37 г 4-нитрофталида (TeTpahedron Lett. 42, 2001, cc. 1647-50), 8,04 г N-бромсукцинимида и 196 мг бензоилпероксида нагревали в 80 мл бензотрифторида в колбе с обратным холодильником и выдерживали на свету до завершения взаимодействия. Смесь добавляли к воде, экстрагировали дихлорметаном,несколько раз промывали водой, высушивали и растворитель удаляли в вакууме. Получали 7,24 г 3 бром-4-нитрофталида в виде твердого вещества. 1 Н-ЯМР (CDCl3),(част. на млн.) = 7,26 (s, 1H), 7,88 (t, 1H), 8,3 (d, 1H), 8,56 (d, 1H). 5-Нитрофталазин-1-он 18,25 г гидразинсульфата и 14,88 г карбоната натрия перемешивали в 300 мл ДМФА при 100 С в течение 1 ч. После этого добавляли 7,24 г 3-бром-4-нитрофталида в 100 мл ДМФА и смесь перемешивали еще в течение 4 ч при 100 С. Ее добавляли к воде, несколько раз экстрагировали этилацетатом и органическую фазу промывали водой и соляным раствором. Смесь высушивали и растворитель удаляли в вакууме. После перекристаллизации из этилацетата получали 2,35 г 5-нитрофталазин-1-она в виде твердого вещества. 1 Н-ЯМР (ДМСО),(част. на млн.) = 8,05 (t, 1H), 8,57-8,66 (m, 2 Н), 8,73 (s, 1 Н), 13,13 (bs, 1H). 2-Метил-5-нитрофталазин-1-он 1,6 г 5-нитро-талазин-1-она и 2,31 г карбоната калия перемешивали в течение 10 мин при комнатной температуре в 60 мл ДМФА. Добавляли 1,1 мл метилйодида, и смесь перемешивали всю ночь. Смесь добавляли к воде, несколько раз экстрагировали этилацетатом и органическую фазу промывали водой и соляным раствором. Ее высушивали и растворитель удаляли в вакууме. Получали 1,57 г 2-метил-5 нитрофталазин-1-она в виде желтого твердого вещества. 1 Н-ЯМР (ДМСО),(част. на млн.) = 3,73 (s, 3H), 8,05 (t, 1H), 8,62 (d, 2H), 8,75 (s, 1H). 5-Амино-2-метилфталазин-1-он 1,57 г 2-метил-5-нитрофталазин-1-она и 130 мл палладия на активированном угле суспендировали в 45 мл этилацетата и гидрировали водородом при атмосферном давлении. Смесь фильтровали через диатомовую землю, и растворитель удаляли в вакууме. Получали 1,26 г 5-амино-2-метилфталазин-1-она в виде желтого твердого вещества. 1 Н-ЯМР (CDCl3),(част. на млн.) = 3,81 (s, 3H), 7,0 (d, 1H), 7,5 (t, 1H), 7,8 (d, 1H), 8,16 (s, 1H). 2-4-Фтор-алъфа-[(2-метилфталазин-1-он-5-ил)амино]-2-гидроксибензил-1,1,1-трифтор-4 метилпент-4-ен-2-ол и 2-4-фтор-алъфа-[(2-метилфталазин-1-он-5-ил)амино]-2-гидроксибензил-1,1,1 трифтор-4-метилпент-3-ен-2-ол Аналогично примеру 6, 1,0 г 4-(4-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил) пентаналя и 560 мг 5-амино-2-метилфталазин-1-она подвергали реакции с 3,8 мл триэтилата титана для образования имина. После аналогичной перегруппировки с трибромидом бора и последующей ВЭЖХ хроматографии получали 110 мг 2-4-фтор-альфа-[(2-метилфталазин-1-он-5-ил)амино]-2-гидроксибензил-1,1,1-трифтор-4-метилпент-4-ен-2-ола в качестве основного соединения и 38 мг 2-4-фторальфа-[(2-метилфталазин-1-он-5-ил)амино]-2-гидроксибензил-1,1,1-трифтор-4-метилпент-3-ен-2-ола в качестве вторичного соединения. Основное соединения: 1 Н-ЯМР (300 МГц, CD3OD):= 1,79 (s, 3H), 2,32 (d, 1 Н), 2,56 (d, 1H), 3,81 (s,3H), 4,65 (s, 1H), 4,81 (s, 1H), 5,25 (s, 1H), 6,50 (dd, 1H), 6,57 (d, 1H), 6,90 (d, 1H), 7,36-7,55 (m, 3H), 8,52 (s,1H).(-)-2-4-Фтор-альфа-[(2-метилфталазин-1-он-5-ил)амино]-2-гидроксибензил-1,1,1-трифтор-4-метилпент-3-ен-2-ол и (+)-2-(4-фтор-альфа-[(2-метилфталазин-1-он-5-ил)амино]-2-гидроксибензил-1,1,1-трифтор 4-метилпент-3-ен-2-ол Разделение (+/-)-2-4-фтор-альфа-[(2-метилфталазин-1-он-5-ил)амино]-2-гидроксибензил-1,1,1-трифтор 4-метилпент-3-ен-2-ола Смесь энантиомеров разделяли путем хроматографии на хирапьном носителе (CHIRALPAK AD,компания DAICEL) с гексаном/этанолом (93 : 7, об.). Таким образом получали(+)-энантиомер: МС (EI): М+ = 451, []D -146,3 (с = 1,0; CHCl3) Пример 18. 2- 4-Бром-альфа-[(хинолин-2-он-5-ил)амино 1-2-гидроксибензил-1,1,1-трифтор-4-метилпент-4-ен 2-ол и 2-(4-бром-альфа-[(хинолин-2-он-5-ил)амино]-2-гидроксибензил-1,1,1-трифтор-4-метилпент-3-ен 2-ол 5-Аминохинолин-2(1 Н)-он 4,5 г 5-нитрохинолин-2(1 Н)-она (Chem. Pharm. Bull. 29, 1981, cc. 651-56) гидрировали водородом в 200 мл этилацетата и 500 мл метанола в присутствии 45 мг палладия на активированном угле в качестве катализатора при атмосферном давлении до завершения реакции. Катализатор удаляли путем фильтрации через диатомовую землю и реакционный раствор концентрировали путем упаривания в вакууме. Получали 3,8 г указанного в заглавии соединения в виде желтого твердого вещества. 1 Н-ЯМР (ДМСО): = 5,85 (bs, 2H), 6,27 (d, 1H), 6,33 (d, 1H), 6,43 (d, 1H), 7,10 (t, 1H), 8,07 (d, 1H),11,39 (bs, 1H) Аналогично примеру 6, 800 мг 4-(4-бром-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя и 348 мг 5-амино-хинолин-2-она подвергали реакции с 2,5 мл триэтилата титана для образования имина. После аналогичной перегруппировки с трибромидом бора и последующей хроматографии на силикагеле получали 53 мг 2-4-бром-альфа-[(хинолин-2-он-5-ил)амино]-2-гидроксибензил 1,1,1-трифтор-4-метилпент-4-ен-2-ола (фракция А) и 54 мг 2-4-бром-альфа-[(хинолин-2-он-5-ил)амино]2-гидроксибензил-1,1,1-трифтор-4-метилпент-3-ен-2-ола (фракция Б). Фракция А: 1 Н-ЯМР (300 МГц, CD3OD):= 1,78 (s, 3 Н), 2,31 (d, 1H), 2,59 (d, 1H), 4,67 (s, 1H), 4,82(s, 1H), 5,26 (s, 1H), 6,29 (d, 1H), 6,55 (d, 1H), 6,62 (d, 1H), 6,96 (dd, 1H), 7,01 (d, 1H), 7,22 (t, 1H), 7,33 (d,1H), 8,21 (d, 1H). Фракция Б: 1 Н-ЯМР (300 МГц, CD3OD): =1,46 (s, 3 Н), 1,62 (s, 3 Н), 5,28 (s, 1H), 5,32 (d, 1H), 6,23 (d,1H), 6,55 (d, 1H), 6,60 (d, 1H), 6,89 (dd, 1H), 6,94 (d, 1H), 7,21 (t, 1H), 7,32 (d, 1H), 8,22 (d, 1H). Пример 19. 4-Хлор-5-фтор[(7-фтор-2-метилхиназолин-5-ил)амино]-2-метокси(2-метил-2-пропенил)-(трифторметил)бензол этанол Аналогично примеру 6, 200 мг (0,58 ммоль) 4-(4-хлор-5-фтор-2-метоксифенил)-2-гидрокси-4-метил 2-(трифторметил)пентаналя и 123 мг (0,70 ммоль) 5-амино-7-фтор-2-метилхиназолина подвергали реакции с 0,24 мл (1,16 ммоль) триэтилата титана для образования имина. После аналогичной перегруппировки с трибромидом бора и последующей хроматографии на силикагеле (гексан/этилацетат 33%) получали 51 мг указанного в заглавии соединения. 1 Н-ЯМР (CDCl3);= 1,78 (s, 3 Н), 2,26 (d, 1H), 2,52 (d, 1H), 2,77 (s, 3H), 4,05 (s, 3H), 4,66 (s, 1H), 4,82(рац.)-4-Хлор-5-фтор[(2-метилхиназолин-5-ил)амино](2-метил-2-пропенил)-2-метокси-(трифторметил)бензол этанол расщепляли путем препаративной хиральной ВЭЖХ (Chiralpak AD 20 М) на энантиомерно-чистые соединения:- 17009958 трибромида бора (1M B дихлорметане) и перемешивали в течение 2 ч при комнатной температуре. После осуществления обычной обработки и хроматографировании на носителе Flashmaster получали 1,6 мг(0,52%) требуемого соединения. 1 Н-ЯМР (CD3OD):= 1,33 (3 Н), 1,62 (3 Н), 2,79 (3 Н), 5,09 (1H), 4,92 (1 Н, находится под водным пиком метанола), 6,43 (1 Н), 6,50-6,70 (2 Н), 76,95 (1H), 9,49 (1 Н). Примеры 23 и 24.(-) 2-4-Хлор[(8-фтор-2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-3-ен-2-ол и (+) 2-(4-хлор[(8-фтор-2-метилхиназолин-5-ил)амино]-2-метоксибензил-1,1,1 трифтор-4-метилпент-3-ен-2-ол Побочный продукт (рац.) 2-4-хлор[(8-фтор-2-метилхиназолин-5-ил)амино]-2-метоксибензил 1,1,1-трифтор-4-метилпент-3-ен-2-ол из примера 7 разделяли на его энантиомеры с помощью хиральной препаративной ВЭЖХ. Колонка: Chiralpak AD 10 (25020 мм); элюент гексан/7% изократический 2 пропанол; поток: 20 мл/мин. Анализ: Chiralpak AD 10 (2054,6 мм); элюент гексан/7% изократический 2-пропанол; поток: 1,0 мл/мин; 25 С.(-)-Энантиомер получали при времени удерживания Rt = 10,35 мин; спец. оптическое вращение: 278,3 (с = 0,230; CHCl3).(+)-Энантиомер получали при времени удерживания Rt = 15,41 мин. Примеры 25 и 26.(+/-)-2-4-фтор-альфа-[(2-метилфталазин-1-он-5-ил)амино]-2-гидроксибензил-1,1,1 трифтор-4-метилпент-4-ен-2-ол Смесь энантиомеров разделяли путем хроматографии на хиральном носителе (CHIRALPAK AD,компания DAICEL) с гексаном/этанолом (93 : 7, об.). Таким образом получали(+)-энантиомер: МС (EI): М+ = 451, []D +207,6 (с = 1,0; CHCl3) Пример 27. 2-4-Хлор-альфа-[(фталазин-1-он-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-4-ен 2-ол и 2-4-хлор-альфа-[(фталазин-1-он-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-3-ен 2-ол 5-Аминофталазин-1-он 980 мг 5-нитрофталазин-1-она (пример 66) и 100 мг палладия на активированном угле суспендировали в 50 мл этилацетата и 1 мл триэтиламина и гидрировали водородом при атмосферном давлении. Смесь фильтровали через диатомовую землю и растворитель удаляли в вакууме. В качестве неочищенного продукта получали 830 мг 5-аминофталазин-1-она в виде твердого вещества. 1 Н-ЯМР (ДМСО),(част. на млн.) = 6,26 (bs, 2H), 7,00 (d, 1H), 7,32 (d, 1 Н), 7,44 (t, 1H), 8,48 (s, 1H),12,35 (bs, 1H) Аналогично примеру 6,500 мг 4-(4-хлор-2-метоксифенил)-2-гидрокси-4-метил-2(трифторметил)пентаналя и 250 мг 5-аминофталазин-1-она подвергали реакции с 1,8 мл триэтилата титана для образования имина. После аналогичной перегруппировки с трибромидом бора и последующей хроматографии на силикагеле получали 38 мг 2-4-хлор-альфа-[(фталазин-1-он-5-ил)амино]-2 метоксибензил-1,1,1-трифтор-4-метилпент-4-ен-2-ола (фракция А) и 47 мг 2-4-хлор-альфа-[(фталазин 1-он-5-ил)амино]-2-метоксибензил-1,1,1-трифтор-4-метилпент-3-ен-2-ола (фракция Б). Фракция А: 1H-ЯМР (300 МГц, CD3OD):= 1,80 (s, 3 Н), 2,27 (d, 1H), 2,52 (d, 1H), 4,04 (s, 3H), 4,67(s, 1H), 4,84 (s, 1H), 5,35 (s, 1H), 6,80 (d, 1H), 6,97 (dd, 1H), 7,11 (d, 1H), 7,47-7,63 (m, 3H), 8,55 (s, 1H). Фракция Б: 1 Н-ЯМР (300 МГц, CD3OD): = 1,37 (s, 3 Н), 1,62 (s, 3 Н), 3,98 (s, 3 Н), 5,25 (s, 1H), 5,32 (s,1H), 6,70 (d, 1H), 6,91 (dd, 1H), 7,04 (d, 1H), 7,44-7,62 (m, 3H), 8,57 (s, 1H). Пример 28. 5-[4-Хлор-5-фтор-2-метокси(2-метил-1-пропенил)(трифторметил)бензолэтанолил]амино 2-метилфталазин-1-он Аналогично примеру 6 260 мг (0,76 ммоль) 4-(4-хлор-5-фтор-2-метоксифенил)-2-гидрокси-4-метил 2-(трифторметил)пентаналя и 160 мг (0,91 ммоль) 5-амино-2-метилфталазин-1-она подвергали реакции с 0,3 мл (1,5 ммоль) триэтилата титана для образования имина. После аналогичной перегруппировки с трибромидом бора и последующей хроматографии на силикагеле (гексан/этилацетат 0-50%), получали 70 мг указанного в заглавии соединения. 1 Н-ЯМР (CDCl3);= 1,64 (s, 3 Н), 1,67 (s, 3 Н), 3,84 (s, 3 Н), 3,92 (s, 3 Н), 5,20 (s, 1 Н), 5,24 (br, 1H), 5,69- 18009958 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стереоизомеры общей формулы I в которой R1 представляет собой необязательно замещенный фенильный радикал, заместители которого выбраны из группы, включающей С 1-С 5-алкил, С 1-С 5-алкокси, галоген, гидроксил, трифторметил,R2 представляет собой моноциклическую или бициклическую, ароматическую, частично ароматическую или неароматическую кольцевую систему, которая содержит атомы азота или кислорода и необязательно замещена в одном или более местах радикалом, выбранным из группы, включающей карбонил,галоген и С 1-С 5 алкил,R3 представляет собой С 1-С 3-алкильную группу или частично или полностью фторированную С 1 С 3-алкильную группу,и пунктирная линия обозначает собой двойную связь между атомами а и b или двойную связь между атомами b и с, или только простую связь между атомами а и b, а также между b и с, а также их рацематы или представленные раздельно стереоизомеры и необязательно их физиологически совместимые соли. 2. Стереоизомеры по п.1, в которых фенильный радикал замещен одним или несколькими радикалами, выбранными из группы, включающей С 1-С 5-алкил, С 1-С 5-алкокси, галоген и гидроксил. 3. Стереоизомеры по п.1, в которых R2 представляет собой присоединенную через любое положение необязательно замещенную фталидильную, изоиндолильную, дигидроиндолильную, дигидроизоиндолильную, дигидроизохинолинильную, бензоксазинонильную, фталазинонильную, хинолинильную,изохинолинильную, хинолонильную, изохинолонильную, индазолильную, хиназолинильную, хиноксалинильную, циннолинильную, фталазинильную, 1,7- или 1,8-нафтиридинильную, дигидроиндолонильную, дигидроизоиндолонильную, бензимидазольную или индолильную группу. 4. Соединения по п.1, в которых R3 представляет собой трифторметильный или пентафторэтильный радикал. 5. Стереоизомеры по п.1, в которых фталидильная, изоиндолильная, дигидроиндолильная, дигидроизоиндолильная, дигидроизохинолинильная, бензоксазинонильная, фталазинонильная, хинолинильная,изохинолинильная, хинолонильная, изохинолонильная, индазолильная, хиназолинильная, хиноксалинильная, циннолинильная, кумаринильная, изокумаринильная, фталазинильная, 1,7- или 1,8 нафтиридинильная, дигидроиндолонильная, дигидроизоиндолонильная, бензимидазольная или индолильная группа R2 замещена от 0 до 3 одинаковыми или различными радикалами, выбранными из группы, включающей C1-С 3-алкил, карбонил и галоген. 6. Стереоизомеры по п.5, в которых фталидильная, изоиндолильная, дигидроиндолильная, дигидроизоиндолильная, дигидроизохинолинильная, бензоксазинонильная, фталазинонильная, хинолинильная,изохинолинильная, хинолонильная, изохинолонильная, индазолильная, хиназолинильная, хиноксалинильная, циннолинильная, фталазинильная, 1,7- или 1,8-нафтиридинильная, дигидроиндолонильная, дигидроизоиндолонильная, бензимидазольная или индолильная группа R2 замещена метилом, хлором или фтором. 7. Применение соединений по п.1 для получения лекарственных средств. 8. Применение соединений по п.1 для получения лекарственных средств для лечения воспалительных заболеваний. 9. Способ получения соединений общей формулы I, характеризующийся тем, что имины общей формулы II в которой R1, R2 и R3 имеют значения, указанные в п.1, подвергают взаимодействию с кислотами Льюиса в органическом растворителе и после обычной очистки получают соединения общей формулы I. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07D 237/32, C07D 215/38, A61K 31/352, A61K 31/4035, A61P 29/00, A61K 31/47, C07D 209/46, C07D 311/76, A61K 31/416, C07D 239/74, C07D 231/56
Метки: способ, перегруппированные, качестве, пентанолы, применение, противовоспалительных, средств, получения
Код ссылки
<a href="https://eas.patents.su/20-9958-peregruppirovannye-pentanoly-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-protivovospalitelnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Перегруппированные пентанолы, способ их получения и их применение в качестве противовоспалительных средств</a>
Предыдущий патент: Фармацевтическая композиция с замедленным высвобождением, включающая венлафаксин
Следующий патент: Гербицидные смеси
Случайный патент: Смазочный состав с адаптивным коэффициентом трения для резьбового элемента составной части трубных резьбовых соединений
























