Производные 3 (5)-аминопиразола, способ их получения и их применение в качестве противоопухолевых средств
Номер патента: 5373
Опубликовано: 24.02.2005
Авторы: Певарелло Паоло, Фритцен Эдвард Л., Пирс Бетси С., Орсини Паоло, Варази Марио, Варпехоски Марта А., Тракуанди Габриэлла, Браска Мария Габриелла
Формула / Реферат
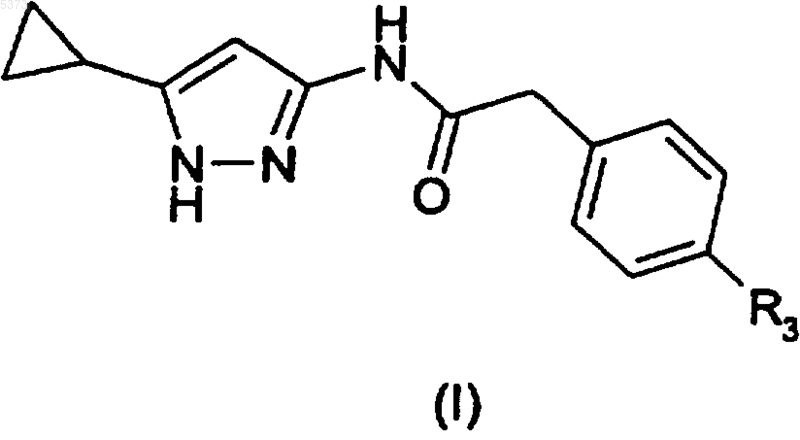
1. Производное 3-аминопиразола, представленное формулой (I)
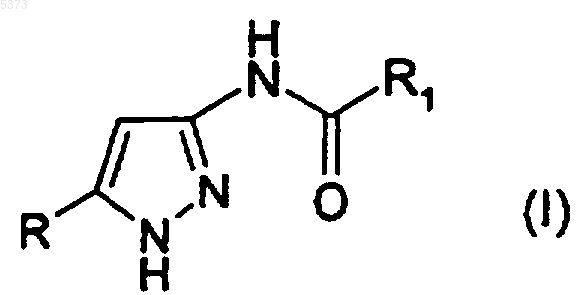
где R представляет собой циклоалкильную группу, необязательно замещенную линейной или разветвленной алкильной или арилалкильной группой;
R1 представляет собой линейную или разветвленную алкильную, алкенильную, циклоалкильную, циклоалкенильную, гетероциклическую, арильную, арилалкильную, арилкарбонильную, арилоксиалкильную или арилалкенильную группу, каждая из которых необязательно может быть далее замещенной,
где алкил представляет собой C1-C6-алкил,
алкенил представляет собой C2-C4-алкенил,
циклоалкил представляет собой C3-C6-циклоалкил, а также производные циклоалкильные группы, имеющие, например, до 10 углеродных атомов, например, группу адамантана,
циклоалкенил представляет собой циклоалкил, указанный выше, который содержит по крайней мере одну двойную связь углерод-углерод,
арил включает моно-, би- или поликарбоциклические или гетероциклические углеводороды, содержащие от 1 до 4 кольцевых групп, где по крайней мере одно из колец является ароматическим, которое либо конденсировано, либо присоединено к другому простыми связями, и арил может насчитывать от 5 до 20 атомов углерода,
гетероцикл, включающий, следовательно, гетероароматические кольца, также указываемые как арильные группы, содержит 3-6-членные насыщенные или ненасыщенные карбоциклические группы, где один или несколько атомов углерода заменены одним или несколькими атомами, выбранными из азота, кислорода и серы,
или его фармацевтически приемлемая соль.
2. Производное 3-аминопиразола по п.1, где R представляет собой циклоалкильную группу, необязательно замещенную линейной или разветвленной алкильной группой; R1 представляет собой линейную или разветвленную алкильную, алкенильную, циклоалкильную, арильную, арилалкильную, арилкарбонильную, арилоксиалкильную или арилалкенильную группу, которая необязательно замещена одной или более группами, выбранными из группы, состоящей из циклоалкила, гидрокси, алкилтио, алкокси, амино, алкиламино, диалкиламино, алкоксикарбониламино, алкоксикарбонилалкиламино, алкилкарбонила, алкилсульфонила, алкоксикарбонила, карбокси, галогена, нитро, арилокси, арилтио, арилсульфонила, N-алкилпиперазинила, пиперидинила, 4-морфолинила, ариламино, циано, алкила, арила, оксо, галогеноарила, галогеноалкила, галогеноарилокси, галогеноарилсульфонила, аминосульфонила, аминокарбонила, арилкарбонила, перфторированного алкила, и перфорированной алкоксигруппы; или его фармацевтически приемлемая соль.
3. Производное 3-аминопиразола по п.1, где R представляет собой циклоалкильную группу и R1 представляет собой C1-C4-алкил, циклоалкил, арил, арилалкил, 5- или 6-членную гетероциклическую или гетероциклоалкильную группу, которые могут быть необязательно замещенными далее, как описано выше.
4. Производное 3-аминопиразола по п.1, где R представляет собой циклоалкильную группу и R1 представляет собой C1-C4-алкил, фенил, фенилалкил, фенилалкенил, бифенил, бифенилалкил, a - или b -нафтил, a - или b -нафтилалкил, пиридил, тиенил, тиенилалкил, изоксазолил, изоксазолилалкил, пиразолил, пиразолилалкил, фурил, тиазолил, тиазолилалкил, пирролил, дигидропирролил, индолил, индолилалкил, бензотиенил, бензотиенилалкил, флуоренилалкил, пиримидинилалкил, хиноксалинил и циклопропил.
5. Производное 3-аминопиразола по п.3 или 4, где R представляет собой циклопропил.
6. Производное 3-аминопиразола по п.1, где R1 представляет собой любую из групп, определенных в п.1, необязательно замещенную в любом из свободных положений одной или более группами, независимо друг от друга выбранными из галогена, нитро, оксогрупп (C=O), циано, алкила, перфторированного алкила, гидроксиалкила, арила, арилалкила, гетероциклила, циклоалкила, гидрокси, алкокси, перфторированной алкокси, арилокси, гетероциклилокси, метилендиокси, алкилкарбонилокси, арилкарбонилокси, карбокси, алкоксикарбонила, арилоксикарбонила, циклоалкилоксикарбонила, амино, уреидо, алкиламино, диалкиламино, ариламино, диариламино, формиламино, алкилкарбониламино, арилкарбониламино, гетероциклилкарбониламино, алкоксикарбониламино, алкоксиимино, алкилсульфониламино, арилсульфониламино, формила, алкилкарбонила, арилкарбонила, циклоалкилкарбонила, гетероциклилкарбонила, аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, алкилсульфонила, арилсульфонила, аминосульфонила, алкиламиносульфонила, диалкиламиносульфонила, арилтио и алкилтио.
7. Производное 3-аминопиразола по п.1, которое выбрано из группы, включающей
N-(5-циклопропил-1H-пиразол-3-ил)-2,2-дифенилацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-(4-нитрофенил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-4-метоксибензамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-(3-метоксифенил)ацетамид;
2-(1,3-бензодиоксол-5-ил)-N-(3-циклопропил-1H-пиразол-5-ил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-фенилпропанамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-(3,4-диметоксифенил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-(5-метокси-1H-индол-3-ил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-(1-метил-1H-индол-3-ил)ацетамид;
2-(5-хлор-1-бензотиофен-3-ил)-N-(3-циклопропил-1H-пиразол-5-ил)ацетамид;
2-(1-бензотиофен-3-ил)-N-(3-циклопропил-1H-пиразол-5-ил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-3-циклопентилпропанамид;
2-(4-хлорфенил)-N-(3-циклопропил-1H-пиразол-5-ил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-4-оксо-4-фенилбутанамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-(2,3-дигидро-1H-инден-5-ил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-оксо-2-фенилацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-(4-метилфенил)ацетамид;
2-[1,1'-бифенил]-4-ил-N-(3-циклопропил-1H-пиразол-5-ил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-(1-нафтил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-метокси-2-фенилацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-4-фенил-3-бутенамид;
4-[(4-хлорфенил)сульфонил]-N-(5-циклопропил-1H-пиразол-3-ил)-3-метил-2-тиофенкарбоксамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-фенилацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-хлорбензамид;
N-(3-циклопропил-1H-пиразол-5-ил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-4-хлорбензамид;
N-(3-циклопропил-1H-пиразол-5-ил)-1-бензотиофен-2-карбоксамид;
N-(3-циклопропил-1H-пиразол-5-ил)-[1,1'-бифенил]-4-карбоксамид;
N-(3-циклопропил-1H-пиразол-5-ил)-3-фенилпропанамид;
метил-4-{[(3-циклопропил-1H-пиразол-5-ил)амино]карбонил}бензоат;
N-(3-циклопропил-1H-пиразол-5-ил)-3-бромбензамид;
N-(3-циклопропил-1H-пиразол-5-ил)-3,4-дихлорбензамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-бромбензамид;
N-(3-циклопропил-1H-пиразол-5-ил)-3-метоксибензамид;
N-(3-циклопропил-1H-пиразол-5-ил)-3-трифторметилбензамид;
N-(3-циклопропил-1H-пиразол-5-ил)-4-бутоксибензамид;
N-(3-циклопропил-1H-пиразол-5-ил)-1H-индол-2-карбоксамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-[5-(2,6-дифторбензил)-2-метоксифенил]ацетамид;
N'-(3-циклопропил-1H-пиразол-5-ил)терефталамид;
N-(5-циклопропил-1H-пиразол-3-ил)-4-(2-метилбензоил)-1H-пиррол-2-карбоксамид;
2-[(4-ацетиламино)фенил]-N-(5-циклопропил-1H-пиразол-3-ил)ацетамид;
4-бром-N-(5-циклобутил-1H-пиразол-3-ил)бензамид;
N-(5-циклопропил-1H-пиразол-3-ил)-4-(3-фторбензоил)-1H-пиррол-2-карбоксамид;
N-(5-циклопропил-1H-пиразол-3-ил)-4-(2-фторбензоил)-1H-пиррол-2-карбоксамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-[4-(1-пирролидинил)фенил]ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-5-(метилсульфонил)-2-тиофенкарбоксамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-оксо-4-фенил-3-бутенамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-[4-(3-тиенил)фенил]ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2,5-диметил-1-(2-тиенилметил)-1H-пиррол-3-карбоксамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-метил-5-фенил-3-фурамид;
N-{2-[(5-циклопропил-1H-пиразол-3-ил)амино]-2-оксоэтил}бензамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2-нафтил)ацетамид;
5-хлор-N-(5-циклопропил-1H-пиразол-3-ил)-2-тиофенкарбоксамид;
4'-{2-[(5-циклопропил-1H-пиразол-3-ил)амино]-2-оксоэтил}-[1,1'-бифенил]-4-карбоновую кислоту;
4'-{2-[(5-циклопропил-1H-пиразол-3-ил)амино]-2-оксоэтил}-[1,1'-бифенил]-4-карбоксамид;
2-амино-N-(4-{2-[(5-циклопропил-1H-пиразол-3-ил)амино]-2-оксоэтил}фенил)ацетамид;
2-[4-(аминометил)фенил]-N-(5-циклопропил-1H-пиразол-3-ил)ацетамид;
2-[4-(1,3-бензодиоксол-5-ил)-5-метил-3-изоксазолил]-N-(3-циклопропил-1H-пиразол-5-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-этил-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-трет-бутил-[1,1'-бифенил]-4-ил)ацетамид;
4-{2-[(5-циклопропил-1H-пиразол-3-ил)амино]-2-оксоэтил}бензамид;
N-(3-циклопропил-1H-пиразол-5-ил)-1H-пиррол-2-карбоксамид;
N-(3-циклобутил-1H-пиразол-5-ил)-1H-пиррол-2-карбоксамид;
(2S)-N-(5-циклопропил-1H-пиразол-3-ил)-2-(6-метокси-2-нафтил)пропанамид;
(2S)-N-(3-циклопропил-1H-пиразол-5-ил)-3,3,3-трифтор-2-метокси-2-фенилпропанамид;
(2S)-N-(3-циклопропил-1H-пиразол-5-ил)-2-метокси-2-фенилэтанамид;
(2S)-N-(3-циклопропил-1H-пиразол-5-ил)-2,5-дигидро-1H-пиррол-2-карбоксамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2,5-дифторфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3-метилфенил)ацетамид;
(2S)-2-амино-N-(3-циклопропил-1H-пиразол-5-ил)-2-фенилэтанамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4-нитрофенил)пропанамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-[3,5-бис(трифторметил)фенил]ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2-хлор-6-фторфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4-бромметилфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4-метилсульфонилфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2-метилфенил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-оксо-2-(2-тиенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3,5-диметоксифенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3,4-дифторфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3,4-дихлорфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3-бромфенил)ацетамид;
(1R)-2-[(3-циклопропил-1H-пиразол-5-ил)амино]-2-оксо-1-фенилэтилацетат;
9H-флуорен-9-ил-(2S)-2-{[(3-циклопропил-1H-пиразол-5-ил)амино]карбонил}-2,5-дигидро-1H-пиррол-1-карбоксилат;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4-метилсульфанилфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2-бромфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4-гидрокси-3-нитрофенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3-нитрофенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2,4-дихлорфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3,5-ди-трет-бутил-4-гидроксифенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3,5-дифторфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4-бутоксифенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3-фторфенил)ацетамид;
(1S)-2-[(3-циклопропил-1H-пиразол-5-ил)амино]-2-оксо-1-фенилэтилацетат;
N-(3-циклопропил-1H-пиразол-5-ил)-2-фтор-2-фенилацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2-метоксифенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3,4,5-триметоксифенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(пентафторфенил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-3-метил-2-фенилпентанамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2-нитрофенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-1-фенилциклопентан-1-карбоксамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4-трифторметоксифенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4-этоксифенил)ацетамид;
N-(5-циклопропил-1H-прразол-3-ил)-2-(2-фторфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2-нитро-4-трифторметилфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2,6-дихлорфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2,6-дифторфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2,4,6-триметилфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-[2,5-бис(трифторметил)фенил]ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-[2-(2,4-дифторфенил)-1,3-тиазол-4-ил]ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-(2-фтор-[1,1'-бифенил]-4-ил)пропанамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3-метилсульфониламинофенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-{4-[2-оксо-(1-пирролидинил)этокси]фенил}ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-[3-(2-амино-2-оксоэтокси)фенил]ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-феноксиацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2,4-дихлорфенокси)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2,3,6-трифторфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-фтор-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2'-фтор-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3'-фтор-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3'-метокси-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-(трифторметокси)-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3'-формил-4'-метокси-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-фтор-3'-метил-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3'-ацетил-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-формил-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2',5'-дифтор-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2',5'-диметил-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-метокси-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(5'-фтор-2'-метокси-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2',5'-диметокси-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-ацетил-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-этокси-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-((4'-метилтио)-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3'-хлор-4'-фтор-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3'-этокси-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3',4'-диметокси-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2'-этокси-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3',5'-дифтор-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2',4'-диметокси-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2',3'-диметил-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3'-(трифторметокси)-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3'-ацетамидо-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-трифторметил-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4'-(гидроксиметил)-[1,1'-бифенил]-4-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-[4-(2-нафтил)фенил]ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-[4-(5-метил-2-тиенил)фенил]ацетамид;
2-[4-(1-бензофуран-2-ил)фенил]-N-(5-циклопропил-1H-пиразол-3-ил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-[4-(2-тиенил)фенил]ацетамид;
2-[4-(1-бензотиен-2-ил)фенил]-N-(5-циклопропил-1H-пиразол-3-ил)ацетамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(2-трифторметилфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(3-трифторметилфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-2-(4-фторфенил)ацетамид;
N-(5-циклопропил-1H-пиразол-3-ил)-4-бромбензамид;
N-(3-циклопропил-1H-пиразол-5-ил)-2,4-дихлорбензамид;
или их фармацевтически приемлемую соль.
8. Способ получения производного 3-аминопиразола, указанного в п.1, или его фармацевтически приемлемой соли, включающий
(a) взаимодействие соединения, представленного формулой (II)
R-COOR2 (II),
где R является таким, как определено п.1, и R2 представляет собой алкильную группу, с ацетонитрилом в присутствии основного агента с получением соединения, представленного формулой (III)
R-CO-CH2-CN (III),
где R является таким, как определено выше;
(b) взаимодействие соединения, представленного формулой (III), с гидроксидом гидразина с получением соединения, представленного формулой (IV)
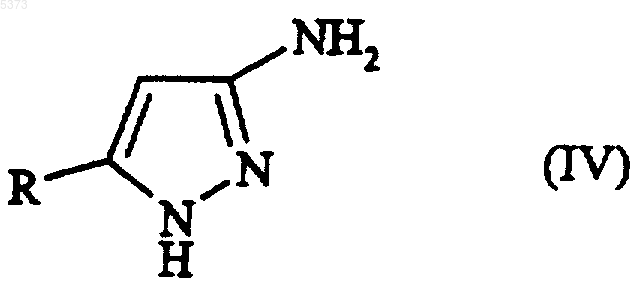
где R является таким, как определено выше;
(c) окисление соединения, представленного формулой (IV), с получением соединения, представленного формулой (V)
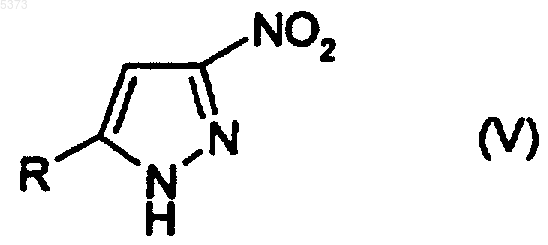
где R является таким, как определено выше;
(d) взаимодействие соединения, представленного формулой (V), с ангидридом трет-бутоксикарбониловой кислоты (Boc2O) с получением соединения, представленного формулой (VI)
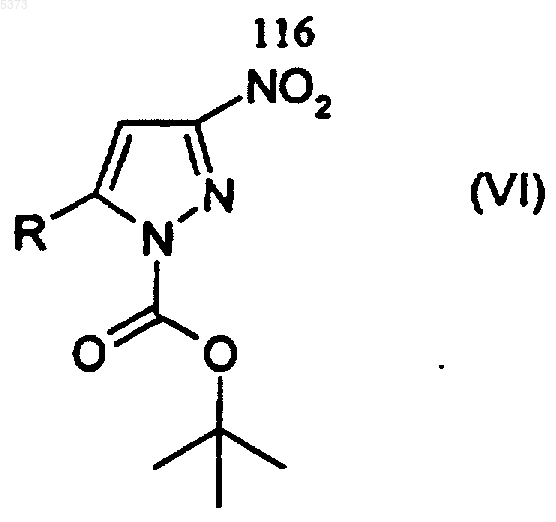
где R является таким, как определено выше;
(e) восстановление соединения, представленного формулой (VI), с получением соединения, представленного формулой (VII)
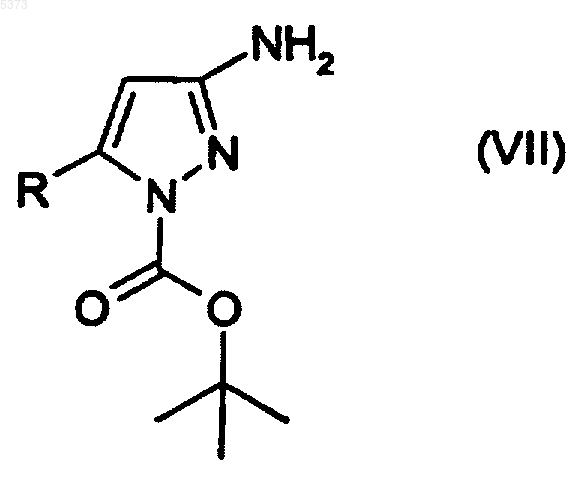
где R является таким, как определено выше;
(f) взаимодействие соединения, представленного формулой (VII) с соединением, представленным формулой (VIII)
R1-COX (VIII),
где X представляет собой гидрокси- или подходящую удаляемую группу и R1 является таким, как определено п.1, с получением соединения, представленного формулой (IX)
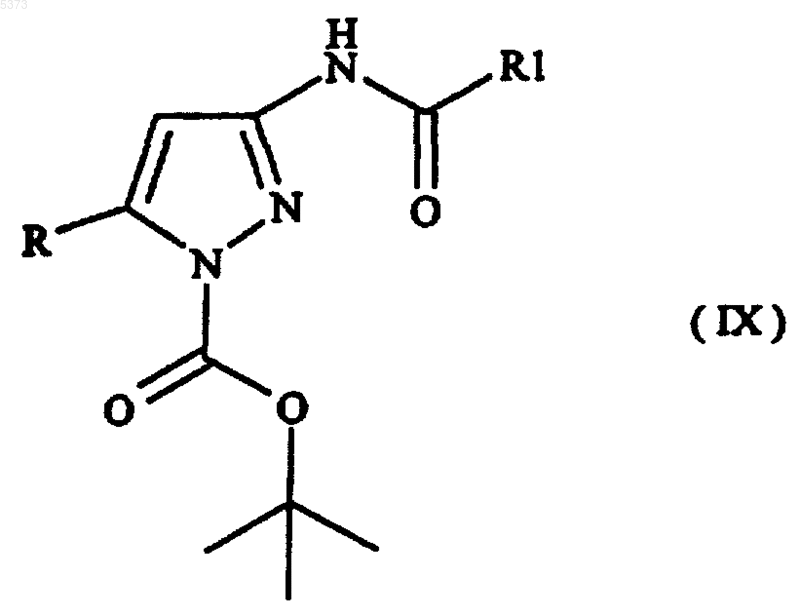
где R и R1 являются такими, как определено выше; и
(g) гидролиз соединения, представленного формулой (IX), в кислой среде с получением соединения формулы (I), где R и R1 являются такими, как указано выше.
9. Способ получения производного 3-аминопиразола, указанного в п.1, или его фармацевтически приемлемой соли, включающий
(a) взаимодействие соединения, представленного формулой (IV)
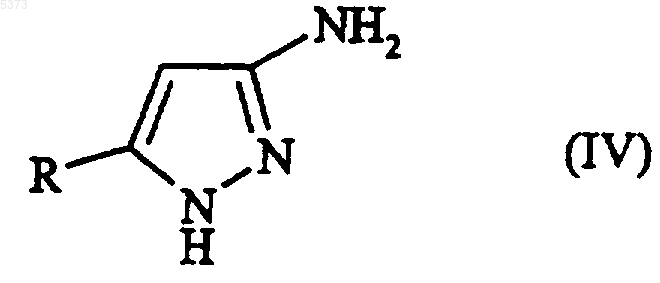
с соединением, представленным формулой (VIII)
R1-COX (VIII),
где R и R1 являются такими, как определено п.1, и X представляет собой гидрокси- или подходящую удаляемую группу, такую как группу хлора или брома, с получением соединения, представленного формулой (X)

где R и R1 являются такими, как определено выше; и
(b) селективный гидролиз соединения формулы (X) в основной среде с получением соединения, представленного формулой (I).
10. Способ получения производного 3-аминопиразола, указанного в п.1, или его фармацевтически приемлемой соли, включающий взаимодействие соединения, представленного формулой (IV)
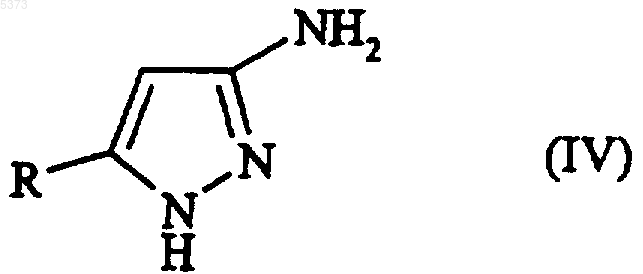
с соединением, представленным формулой (XI)
R1-COCCl3 (XI),
где R и R1 являются такими, как определено п.1.
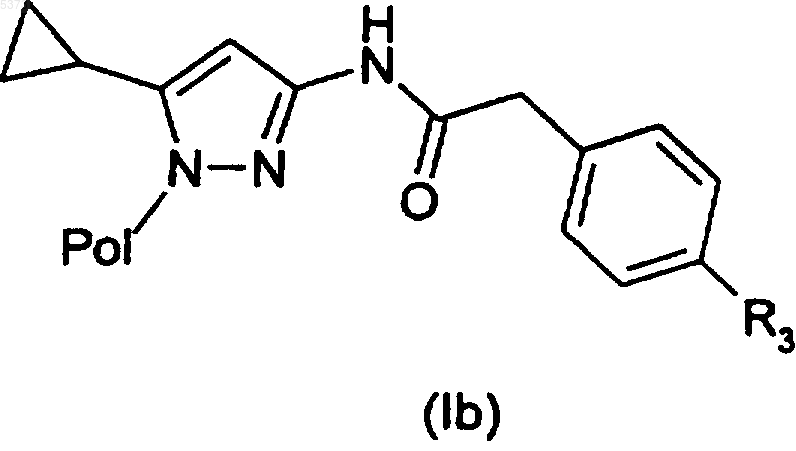
11. Способ получения производного 3-аминопиразола, указанного в п.1, или его фармацевтически приемлемой соли, включающий взаимодействие соединения формулы (I), где R1 представляет собой 4-галогенфенилацетильную группу, или его формы на полимерном носителе (Ib)
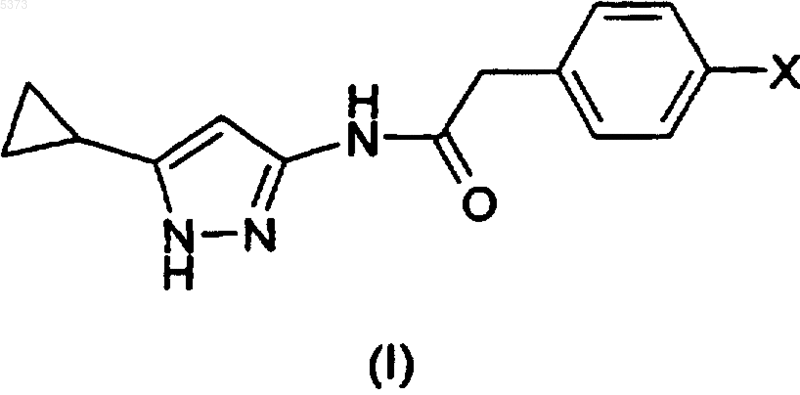
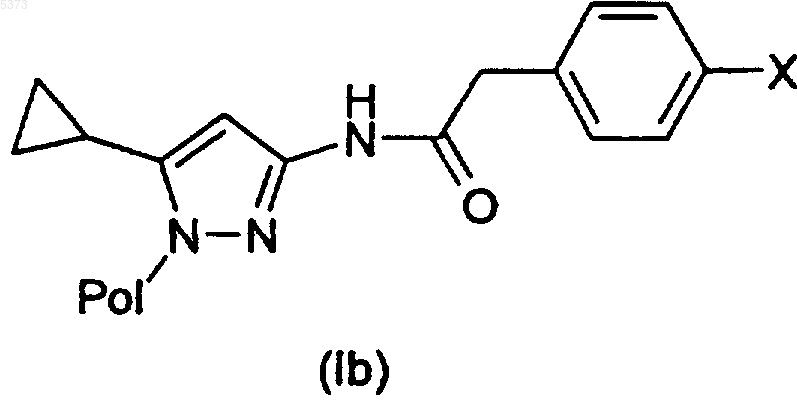
где X представляет собой атом галогена, такого как бром или иод, с соединением формулы (XII)
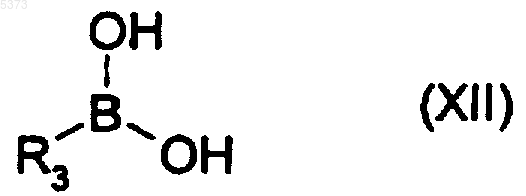
где R3 представляет собой арильную группу, с получением соединения формулы (I), где R3 представляет собой арил, или его формы на полимерном носителе (Ib)
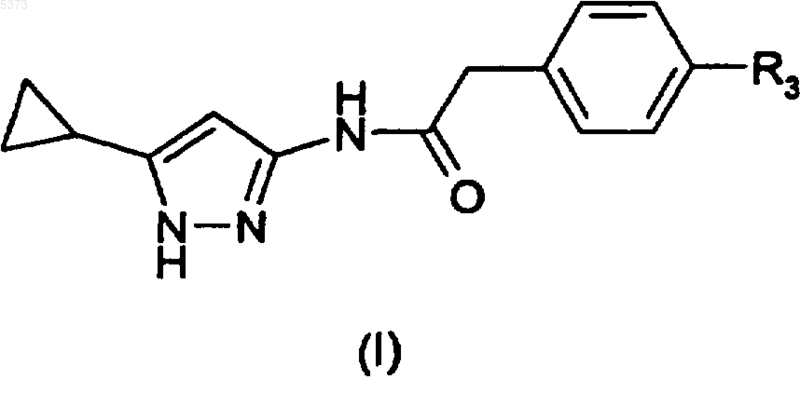
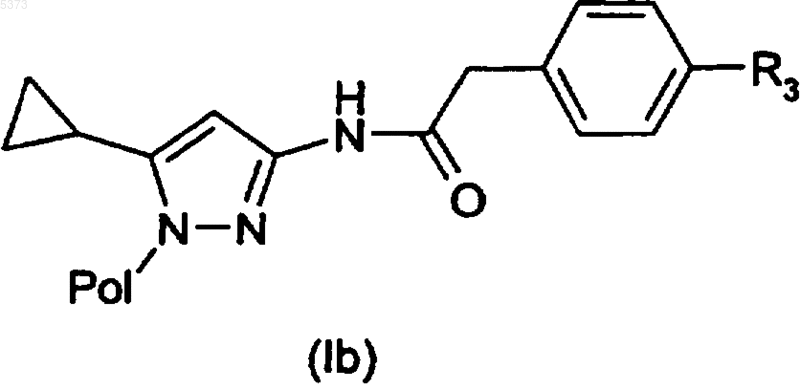
и, в случае соединения на полимерном носителе (Ib), его гидролиз посредством кислотной обработки с получением вышеуказанного соединения формулы (I).
12. Способ получения производного 3-аминопиразола, указанного в п.1, или его фармацевтически приемлемой соли, включающий
a) взаимодействие соединения формулы (I), где R1 представляет собой 4-галогенфенилацетильную группу, или его формы на полимерном носителе (Ib) с пинаконовым эфиром дибороновой кислоты с получением соединения формулы (XIII) или его формы на полимерном носителе (XIIIb)
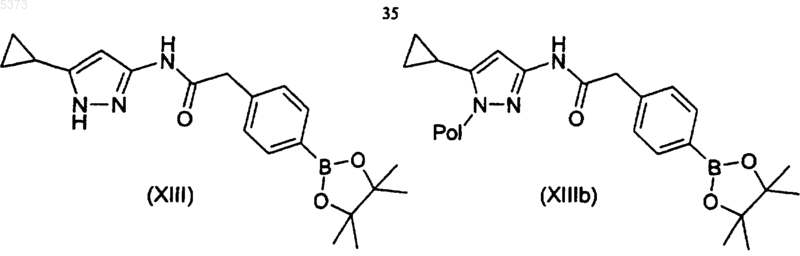
b) взаимодействие соединения формулы (XIII) или его формы на полимерном носителе (XIIIb) с соединением формулы (XIV)
R3X (XIV),
где R3 представляет собой арил и X представляет собой бром или йод, с получением соединения формулы (I), где R3 представляет собой арил, или его формы на полимерном носителе (Ib)
c) и в случае соединения на полимерном носителе (Ib) его гидролиз посредством кислотной обработки с получением вышеуказанного соединения формулы (I).
13. Способ по любому из пп.8-12, дополнительно включающий преобразование производного 3-аминопиразола, представленного формулой (I), в другое производное, представленное формулой (I), и/или в его соль.
14. Соединение, представленное формулой (V)
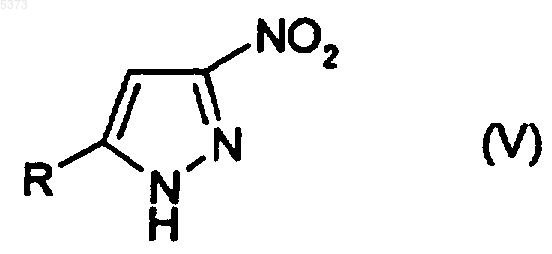
где R представляет собой C3-C6-циклоалкильную группу, необязательно замещенную линейной или разветвленной C1-C6-алкильной группой.
15. Фармацевтическая композиция, содержащая производное 3-аминопиразола по п.1 и по крайней мере один фармацевтически приемлемый носитель и/или разбавитель.
16. Фармацевтическая композиция по п.15, дополнительно включающая одно или несколько химиотерапевтических средств.
17. Продукт, включающий соединение по п.1 или его фармацевтическую композицию по п.15 и одно или несколько химиотерапевтических средств, как комбинированный препарат для одновременного, раздельного или последовательного использования в противораковой терапии.
18. Применение соединения по п.1 в качестве лекарственного средства.
19. Применение соединения по п.1 при получении лекарственного средства, обладающего противоопухолевой активностью.
Текст
005373 Предпосылки изобретения Область изобретения Настоящее изобретение относится к производным 3(5)-аминопиразола, к способу их получения, содержащим их фармацевтическим композициям и их применению в качестве терапевтических средств, в частности, при лечении злокачественных опухолей и нарушений клеточной пролиферации. Обсуждение предпосылок Некоторые цитотоксические лекарственные средства, как, например, фторурацил (5-ФУ), доксорубицин и камптотецины, повреждают ДНК или влияют на клеточные метаболические пути, и, таким образом, во многих случаях вызывают косвенное блокирование клеточного цикла. Поэтому эти средства приводят к значительной токсичности и побочным эффектам посредством нанесения необратимых повреждений как нормальным, так и опухолевым клеткам. В связи с этим требуются соединения, способные действовать как высокоизбирательные противоопухолевые средства, приводя к выключению и апоптозу опухолевых клеток со сравнимой эффективностью, но пониженной токсичностью по сравнению с доступными в настоящее время лекарственными средствами. Хорошо известно, что последовательность событий в течение клеточного цикла управляется рядом контрольных точек, по-другому называемых точками рестрикции, которые регулируются семейством ферментов, известных как циклинзависимые киназы (cdk). В свою очередь, сами cdk регулируются на многих уровнях, таких как, например, связывание циклинов. Координированная активация и инактивация различных комплексов циклин/cdk необходима для нормальной последовательности событий в течение клеточного цикла. Оба критических перехода G1-S иG2-M контролируются активацией деятельности различных циклинов/cdk. Предполагают, что во времяG1 циклин D/cdk4 и циклин E/cdk2 опосредуют запуск S-фазы. Для течения S-фазы требуется активность циклина A/cdk2, тогда как активация циклина A/cdc2 (cdk1) и циклина B/cdc2 требуется для запуска метафазы. Для общей ссылки на циклин и циклин-зависимые киназы см., например, Kevin R. Webster et al, в Ехр. Opin. Invest. Drugs, 1998, Vol.7(6), 865-887. Контрольные точки в опухолевых клетках являются дефективными, что частично приводит к нарушению регуляции активности cdk. Например, измененная экспрессия циклина Е и cdk наблюдалась в опухолевых клетках, а делеция в гене р 27 KIP ингибитора cdk приводила, как было показано, к большему распространению злокачественной опухоли у мышей. Увеличивающееся количество доказательств поддерживает идею того, что cdk являются ферментами, лимитирующими скорость течения клеточного цикла и, как таковые, представляют собой молекулярные мишени для терапевтического вмешательства. В частности, прямое ингибирование активностиcdk/циклиновой киназы должно способствовать ограничению нерегулируемой пролиферации опухолевой клетки. Сущность изобретения Объектом изобретения являются соединения, которые могут использоваться при лечении клеточных пролиферативных нарушений, ассоциированных с измененной клеточно-зависимой киназной активностью. Другим объектом являются соединения, которые обладают ингибирующей активностью в отношении cdk/циклиновой киназы. Другим объектом изобретения являются соединения, которые могут использоваться в терапии противоопухолевыми средствами, но в плане токсичности и побочных эффектов лишены недостатков, связанных с доступными в настоящее время противоопухолевыми лекарственными средствами, что обсуждались выше. В настоящее время авторы данного изобретения обнаружили, что 3-аминопиразолы обладают ингибирующей активностью в отношении cdk/циклиновой киназы и могут использоваться в терапии в качестве противоопухолевых средств, а в плане токсичности и побочных эффектов лишены вышеупомянутых недостатков, связанных с доступными в настоящее время противоопухолевыми лекарственными средствами. Более конкретно, 3-аминопиразолы по изобретению могут использоваться при лечении разнообразных злокачественных опухолей, включающих в качестве неограничивающих примеров карциному, такую как карциномы мочевого пузыря, молочной железы, толстого кишечника, почки, печени, легких,включая мелкоклеточный рак легких, пищевода, желчного пузыря, яичника, поджелудочной железы,желудка, шейки матки, щитовидной железы, предстательной железы и кожи, включая плоскоклеточную карциному; гемопоэтические опухоли лимфоидного ряда, включая лейкемию, острую лимфоцитарную лейкемию, острую лимфобластическую лейкемию, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, неходжкиновскую лимфому, волосато-клеточную лимфому и лимфому Беркитта; гемопоэтические опухоли миелоидного ряда, включая острую и хроническую миелогенные лейкемии, миелодиспластический синдром и промиелоцитарную лейкемию; опухоли мезенхимального происхождения,включая фибросаркому и рабдомиосаркому, глиому и шванному; другие опухоли, включая меланому,семиному, тератокарциному, остеосаркому, пигментную склеродермию, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши.-1 005373 Ввиду ключевой роли cdk в регуляции клеточной пролиферации производные 3-аминопиразола также могут использоваться при лечении разнообразных нарушений клеточной пролиферации,таких как, например, доброкачественная гиперплазия предстательной железы, семейный аденоматозполипоз, нейрофиброматоз, псориаз, пролиферация гладкомышечных клеток сосудов, ассоциированная с атеросклерозом, фиброз легких, артрит-гломерулонефрит и послехирургические стеноз и рестеноз. Соединения по изобретению могут использоваться при лечении болезни Альцгеймера, что подтверждается тем фактом, что cdk5 вовлечена в фосфорилирование тау-белка (J.Biochem., 117, 741-749,1995). Соединения по данному изобретению в качестве модуляторов апоптоза могут быть также использованы при лечении злокачественных опухолей, вирусных инфекций, профилактике развития СПИД у ВИЧ-инфицированных субъектов, аутоиммунных заболеваний и нейродегенеративных нарушений. Соединения по данному изобретению могут быть использованы при ингибировании опухолевого ангиогенеза и метастазирования. Соединения по данному изобретению могут также действовать в качестве ингибиторов других протеинкиназ, например, протеинкиназы С, her2, raf1, MEK1, МАР-киназы, рецептора EGF, рецептораPDGF, рецептора IGF, киназы PI3, киназы weel, Src, Аbl, и таким образом быть эффективными при лечении заболеваний, ассоциированных с другими протеин-киназами. Соединения по данному изобретению также могут использоваться при лечении и профилактике индуцированной радиотерапией или химиотерапией алопеции. Соответственно, настоящее изобретение относится к способу лечения нарушений клеточной пролиферации, ассоциированной с измененной клеточно-опосредованной киназной активностью, путем введения млекопитающему, при такой необходимости, эффективного количества производного 3 аминопиразола, представленного формулой (I)R представляет собой С 3-С 6-циклоалкильную группу, необязательно замещенную линейной или разветвленной C1-С 6-алкильной или арилалкильной группой;R1 представляет собой линейную или разветвленную C1-С 6-алкильную, С 2-С 4-алкенильную, циклоалкильную, циклоалкенильную, гетероциклическую, арильную, арилалкильную, арилкарбонильную,арилоксиалкильную или арилалкенильную группу, каждая из которых необязательно может быть замещенной дополнительно,или его фармацевтически приемлемой соли. В предпочтительном осуществлении вышеописанного способа нарушение клеточной пролиферации выбрано из группы, состоящей из злокачественных опухолей, болезни Альцгеймера, вирусных инфекций, аутоиммунных заболеваний и нейродегенеративных нарушений. Конкретные типы злокачественных опухолей, которые можно лечить, включают карциному, плоскоклеточную карциному, гемопоэтические опухоли миелоидного и лимфоидного ряда, опухоли мезенхимального происхождения, опухоли центральной и периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, пигментную склеродермию, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши. В другом предпочтительном осуществлении вышеописанного способа нарушение клеточной пролиферации выбрано из группы, состоящей из доброкачественной гиперплазии предстательной железы,семейного аденоматоза-полипоза, нейрофиброматоза, псориаза, пролиферации гладкомышечных клеток сосудов, ассоциированной с атеросклерозом, фиброза легких, артрита-гломерулонефрита и послехирургических стеноза и рестеноза. Кроме того, способ по изобретению относится к ингибированию опухолевого ангиогенеза и метастазирования. Способ по изобретению также может относиться к ингибированию клеточного цикла илиcdk-циклинзависимому ингибированию. В дополнение к вышесказанному, способ по настоящему изобретению относится к лечению и профилактике индуцированной радиотерапией и химиотерапией алопеции. Настоящее изобретение также относится к производному 3-аминопиразола, представленного формулой (I)R представляет собой С 3-С 6-циклоалкильную группу, необязательно замещенную линейной или разветвленной C1-C6-алкильной или арилалкильной группой;R1 представляет собой линейную или разветвленную C1-С 6-алкильную, С 2-С 4-алкенильную, циклоалкильную, циклоалкенильную, гетероциклическую, арильную, арилалкильную, арилкарбонильную,арилоксиалкильную или арилалкенильную группу, каждая из которых необязательно может быть дополнительно замещенна,или его фармацевтически приемлемую соль. Настоящее изобретение также относится к способам синтеза производного 3-аминопиразола, представленного формулой (I). Фармацевтическая композиция, содержащая производное 3-аминопиразола,представленное формулой (I), также относится к настоящему изобретению. Настоящее изобретение также относится к соединению, которое может использоваться в синтезе производного 3-аминопиразола, представленного формулой (I), которое представлено формулой (V) где R представляет собой С 3-С 6-циклоалкильную группу, необязательно замещенную линейной или разветвленной C1-С 6-алкильной группой. Более полная оценка изобретения и его многих сопутствующих преимуществ будет возможна и понятна из следующего подробного описания. Подробное описание изобретения Некоторые производные 3-аминопиразола известны в качестве пестицидов, гербицидов или даже в качестве терапевтических средств. Среди них примерами служат гетероарилпиразолы, активные в качестве ингибиторов киназы р 38 (WO 98/52941, G.D. Searle and Co.), и другие 3-аминопиразолы, которые ингибируют протеинкиназы (WО 96/14843, COR Therapeutics, Inc.). Как легко понять, пиразолы с незамещенным азотом кольца в соединениях по изобретению в растворе, как известно, быстро достигают равновесия в виде смесей обоих таутомеров: Соответственно, в настоящем изобретении, где только один таутомер обозначен для соединений формулы (I), другой, (Iа), также входит в объем настоящего изобретения, если иное не особым образом отмечено. Употреблямый здесь термин С 3-С 6-циклоалкил, если не указано иначе, включает циклопропил,циклобутил, циклопентил и циклогексил; также предполагается, что термин циклоалкил охватывает циклоалкильные группы, например, имеющего до 10 углеродных атомов, например, группу адамантана. Употреблямый здесь термин циклоалкенил, если не указано иначе, включает вышеуказанные циклоалкильные кольца, где по крайней мере одна связь углерод-углерод, образующая указанное кольцо,является двойной связью. Употреблямый здесь термин алкил, если не указано иначе, включает линейные или разветвленные C1-С 6-алкильные группы, как, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, третичный бутил, н-пентил, н-гексил и тому подобное. Употреблямый здесь термин С 2-С 4-алкенил, если не указано иначе, включает группу, выбранную из винила, аллила, 1-пропенила, изопропенила, 1-бутенила, 2-бутенила, 3-бутенила и тому подобное. Термин арил включает моно-, би- или поликарбоциклические или гетероциклические углеводороды, содержащие от 1 до 4 кольцевых групп, где по крайней мере одно из колец является ароматическим, конденсированных или связанных друг с другом простыми связями. Так, эти группы могут насчитывать от 5 до 20 атомов углерода. Предпочтительно от 6 до 20 атомов углерода. Примерами арильных групп, в частности, служат фенил, бифенил, - и -нафтил, дигидронафтил,тиенил, бензотиенил, фурил, изобензофуранил, дигидробензофуранил, хроменил, ксантенил, пирролил,имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, изоиндолил, пуринил, хинолил, изохинолил, дигидрохинолинил, хиноксалинил, бензодиоксолил, инданил, инденил, флуоренил, бицикло[4.2.0]окта-1,3,5-триенил, дибензо[b,d]фуранил, хроманил, хроменил, триазолил, тетразолил, тетразол[1,5-b]пиридазинил, бензодиоксинил и тому подобное. Термин гетероцикл, включающий, следовательно, гетероароматические кольца, также относится к арильным группам, содержащим от 3 до 6-членных насыщенных или ненасыщенных карбоциклов, где один или несколько атомов углерода заменены одним или несколькими атомами, выбранными из азота,кислорода и серы. Примерами насыщенных или частично ненасыщенных гетероциклов служат, в частно-3 005373 сти, азетидин, пиран, пирролидин, пирролин, имидазолидин, имидазолин, дигидрофуран, тетрагидрофуран, дигидропиррол, 1,3-диоксолан, пиперидин, морфолин и тому подобное. Согласно вышеуказанным значениям заместителей и кроме специально определенных по-другому случаев, любая из вышеуказанных групп R1 может быть необязательно замещенной по любому из свободных положений одной или несколькими группами, в частности, от 1 до 6 группами, независимо друг от друга выбранными из: галогена,нитро-, оксогрупп (С=O), циано, алкила, перфторированного алкила,гидроксиалкила, арила, арилалкила, гетероциклила, циклоалкила, гидрокси, алкокси, перфторированного алкокси, арилокси, гетероциклилокси, метилендиокси, алкилкарбонилокси, арилкарбонилокси, карбокси,алкоксикарбонила, арилоксикарбонила, циклоалкилоксикарбонила, амино, уреидо, алкиламино, диалкиламино, ариламино, диариламино, формиламино, алкилкарбониламино, арилкарбониламино, гетероциклилкарбониламино, алкоксикарбониламино, алкоксиимино, алкилсульфониламино, арилсульфониламино, формила, алкилкарбонила, арилкарбонила, циклоалкилкарбонила, гетероциклилкарбонила, аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, алкилсульфонила, арилсульфонила, аминосульфонила, алкиламиносульфонила, диалкиламиносульфонила, арилтио и алкилтио. В свою очередь, всякий раз, когда это уместно, каждый из вышеуказанных возможных заместителей может быть дополнительно замещен одной или несколькими вышеуказанных групп. Соединения формулы (I), где данная группа R1 замещена одним или несколькими вышеуказанными заместителями,которые, в свою очередь, являются необязательно замещенными дополнительно, как указано выше, приведены ниже. В качестве примера соединение N-(3-циклопропил-1 Н-пиразол-5-ил)-2-[2,2-дифтор-3-(3-фторфенил)циклопропил]ацетамид представлено формулой (I), где R1 представляет собой собой алкил (например, метил), где алкил замещен циклоалкилом (например, циклопропилом), где циклоалкил в свою очередь замещен двумя атомами галогена (например, фтора) и арильной группой (например, фенилом),где арильная группа замещена атомом галогена (например, фтора). В определениях заместителей, кроме обозначенных по-другому случаев, термин галоген включает фтор, хлор, бром и йод; термин перфорированная алкильная и алкоксигруппа включает алкильную или алкоксигруппу, далее замещенную более чем одним атомом фтора, такую как, например, трифторметил, трифторметокси и тому подобное. Также любой из терминов, таких как, например, алкилтио, алкиламино, диалкиламино, алкоксикарбонил, алкоксикарбониламино, гетероциклилкарбонил, гетероциклилкарбониламино, циклоалкоксикарбонил, и тому подобное, включает группы, где фрагменты алкил, алкокси, арил, циклоалкил и гетероциклил являются такими же, как указано выше. Фармацевтически приемлемые соли соединений формулы (I) включают соли добавления кислот неорганических или органических кислот, например, азотной, хлористо-водородной, бромоводородной,серной, перхлорной, фосфорной, уксусной, трифторуксусной, пропионовой, гликолевой, молочной, щавелевой, малоновой, яблочной, малеиновой, янтарной, лимонной, бензойной, коричной, миндальной,метанизосульфоновой, изэтионовой и салициловой кислоты, также как соли неорганических и органических оснований, например, щелочных и щелочно-земельных металлов, особенно гидроксидов карбонатов и бикарбонатов натрия, калия, кальция и магния, ациклических или циклических аминов, предпочтительно метиламина, этиламина, диэтиламина, триэтиламина или пиперидина. Соединения формулы (I) могут обладать ассиметричными углеродными атомами и поэтому могут существовать как рацемические смеси или как индивидуальные оптические изомеры. Таким образом, применение в качестве противоопухолевых средств всех возможных изомеров и их смесей и как метаболитов, так и фармацевтически приемлемых биологических предшественников (подругому упоминаемых как пролекарственные средства) соединений формулы (I) также находится в рамках настоящего изобретения. Предпочтительными соединениями формулы (I) являются такие, где R представляет собой циклоалкильную группу, и R1 представляет собой C1-C4-алкил, циклоалкил, арил, арилалкил, 5- или 6-членную гетероциклическую или гетероциклоалкильную группу, которые могут быть необязательно дополнительно замещенными, как описано выше. Даже более предпочтительными соединениями, представленными формулой (I) , являются такие,где R представляет собой циклоалкильную группу, и R1 представляет собой С 1-С 4-алкил, фенил, фенилалкил, фенилалкенил, бифенил, бифенилалкил, - или -нафтил, - или -нафтилалкил, пиридил, тиенил, тиенилалкил, изоксазолил, изоксазолилалкил, пиразолил, пиразолилалкил, фурил, тиазолил, тиазолилалкил, пирролил, дигидропирролил, индолил, индолилалкил, бензотиенил, бензотиенилалкил, флуоренилалкил, пиримидинилалкил, хиноксалинил и циклопропил. Однако, более предпочтительными внутри класса являются соединения формулы (I), где R представляет собой циклопропил. Примеры предпочтительных соединений по изобретению, которые могут находиться в форме фармацевтически приемлемых солей, например, гидробромидов или гидрохлоридов, включают следующие: 1. N-(5-циклопропил-1 Н-пиразол-3-ил)-2,2-дифенилацетамид; 2. N-(3-циклопропил-1 Н-пиразол-5-ил)-2-(4-нитрофенил)ацетамид;(2 Е)-3-(4'-2-[(5-циклопропил-1 Н-пиразол-3-ил)амино]-2-оксоэтил-[1,1'-бифенил]-4-ил)-2 пропеновую кислоту; 538. N-(5-циклопропил-1 Н-пиразол-3-ил)-2-4'-[(Е)-2-нитроэтенил]-[1,1'-бифенил]-4-илацетамид; 539. 2-(4'-хлор-[1,1'-бифенил]-4-ил)-N-(5-циклопропил-1 Н-пиразол-3-ил)ацетамид; 540. N-(5-циклопропил-1 Н-пиразол-3-ил)-2-(3'-метил-[1,1'-бифенил]-4-ил)ацетамид; 541. 2-(4'-фенил-[1,1'-бифенил]-4-ил)-N-(5-циклопропил-1 Н-пиразол-3-ил)ацетамид; 542. N-(5-циклопропил-1 Н-пиразол-3-ил)-2-(4'-фенокси-[1,1'-бифенил]-4-ил)ацетамид; 543. N-(5-циклопропил-1 Н-пиразол-3-ил)-2-(2'-формил-[1,1'-бифенил]-4-ил)ацетамид; 544. 2-(3'-хлор-[1,1'-бифенил]-4-ил)-N-(5-циклопропил-1 Н-пиразол-3-ил)ацетамид; 545. N-(5-циклопропил-1 Н-пиразол-3-ил)-2-(3'-формил-[1,1'-бифенил]-4-ил)ацетамид; 546. трет-бутил-2-(4-2-[(5-циклопропил-1 Н-пиразол-3-ил)амино]-2-оксоэтилфенил)-1 Н-пиррол-1 карбоксилат; 547. 2-(3'-циано-[1,1'-бифенил]-4-ил)-N-(5-циклопропил-1 Н-пиразол-3-ил)ацетамид; 548. N-(5-циклопропил-1 Н-пиразол-3-ил)-2-(4-дибензо[b,d]фуран-4-илфенил)ацетамид. Соединения формулы (I) и их соли можно получить, например, способом, включающим:(II),где R является таким, как определено выше, и R2 представляет собой алкильную группу, с ацетонитрилом в присутствии основного агента, с получением соединения, представленного формулой (III)(VIII) где X представляет собой гидрокси- или подходящую уходящую группу, и R1 является таким, как определено выше с получением соединения, представленного формулой (IX)(g) гидролиз соединения, представленного формулой (IX) в кислой среде, чтобы получить соединение формулы (I), где R и R1 являются такими, как определено выше; и, если требуется, преобразование производного 3-аминопиразола, представленного формулой (I), в другое производное, представленное формулой (I) и/или в его соль. В качестве альтернативы, соединения, представленные формулой (I) и их фармацевтически приемлемые соли можно получить способом, включающим:(VIII) где R и R1 являются такими, как определено выше, и X представляет собой гидрокси- или подходящую уходящую группу, предпочтительно хлор или бром с получением соединения, представленного формулой (X)(b) селективный гидролиз соединения формулы (X) в основной среде с получением соединения,представленного формулой (I). В качестве альтернативы, соединения, представленные формулой (I), и их фармацевтически приемлемые соли можно получить путем взаимодействия соединения, представленного формулой (IV)(XI),где R и R1 являются такими, как определено выше. В качестве альтернативы, соединения, представленные формулой (I) и их фармацевтически приемлемые соли можно получить путем взаимодействия соединения формулы (I), где R1 представляет собой 4-галогенфенилацетильную группу, или его формы на полимерном носителе (Ib) где X представляет собой атом галогена, такого как бром или иод, с соединением формулы (XII) где R3 представляет собой арил, при хорошо известных условиях Судзуки (Suzuki) с получением соединения формулы (I), где R3 представляет собой арил, или его формы на полимерном носителе (Ib) и, в случае соединения на полимерном носителе (Ib), путем его гидролиза посредством кислотной обработки с получением вышеуказанного соединения формулы (I). В качестве альтернативы, соединения, представленные формулой (I) и их фармацевтически приемлемые соли можно получить способом, включающим: а) взаимодействие соединения формулы (I), где R1 представляет собой 4-галогенфенилацетильную группу, или его формы на полимерном носителе (Ib) с пинаконовым сложным эфиром диборонового соединения при условиях Мияуры (Miyaura) с получением соединения формулы (XIII) или его формы на полимерном носителе (XIIIb)b) взаимодействие соединения формулы (XIII) или его формы на полимерном носителе (XIIIb) с соединением формулы (XIV)(XIV),где R3 представляет собой арил, и X представляет собой бром или йод, с получением соединения формулы (I), где R3 представляет собой арил, или его формы на полимерном носителе (Ib) с) и, в случае соединения на полимерном носителе (Ib), путем его гидролиза посредством кислотной обработки с получением вышеуказанного соединения формулы (I). Как будет легко понять, если соединения формулы (I), полученные по любому из вышеописанных способов, получают в виде смеси изомеров, их разделение на отдельные изомеры формулы (I) посредством общепринятых методов находится в рамках настоящего изобретения. Сходным образом, в рамках настоящего изобретения находится также преобразование в свободные соединения формулы (I) соответствующих им солей. Взаимодействие соединения формулы (II) с получением соединения формулы (III) может проводиться с ацетонитрилом и основанием, таким как гидрид натрия, в подходящем растворителе, таком как диэтиловый эфир, тетрагидрофуран, диоксан, при температуре, находящейся в пределах от комнатной температуры до 120 С. Взаимодействие соединения формулы (III) с получением соединения формулы (IV) проводится с гидратом гидразина, в таком растворителе, как метанол или этанол, при температуре, находящейся в пределах от комнатной температуры до 80 С. Взаимодействие соединения формулы (IV) с получением соединения формулы (V) проводится с оксоном (охоn; пероксимоносульфат калия) или другим окислителем, при температуре, находящейся в пределах от 0 С до комнатной температуры. Взаимодействие соединения формулы (V) с получением соединения формулы (VI) проводится с ангидридом трет-бутоксикарбонила в подходящем растворителе, таком как смеси метиленхлорид-вода при комнатной температуре. Взаимодействие соединения формулы (VI) с получением соединения формулы (VII) может проводиться непосредственно с водородом в присутствии катализатора, такого как палладий на угле, в подходящем растворителе, таком как метанол или этанол, при комнатной температуре. Взаимодействие соединения формулы (VII) с соединением формулы (VIII), где X представляет собой гидроксигруппу, проводится в присутствии связывающего агента, такого как, в частности, карбодиимид, например, 1,3-дициклогексилкарбодиимид, 1,3-диизопропилкарбодиимид или 1-(3-диметиламинопропил)-3-этилкарбодиимид, в подходящем растворителе, таком как, например, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, 1,4-диоксан, ацетонитрил, толуол или N,Nдиметилформамид, при температуре, находящейся в пределах примерно от -10 С до температуры кипе-16 005373 ния с обратным холодильником, в течение подходящего времени, например, примерно от 30 мин до 96 ч. Взаимодействие соединения формулы (VII) с соединением формулы (VIII) может также проводиться с использованием связывающего агента на полимерном носителе, такого как дициклогексилкарбодиимид на полистироловом носителе, в подходящем растворителе, таком как метиленхлорид, хлороформ, диоксан, ацетонитрил, N,N-диметилформамид, тетрагидрофуран, при комнатной температуре в течение времени в интервале от 12 до 96 ч. Взаимодействие соединением формулы (VII) с соединением формулы (VIII) может также проводиться, например, методом с использованием смешанного ангидрида, с использованием алкилхлорформиата, такого как этил-, изобутил-, и изопропилхлорформиат, в присутствии третичного основания, такого как триэтиламин, N,N-диизопропилэтиламин или пиридин, в подходящем растворителе, таком как,например, толуол, дихлорметан, хлороформ, тетрагидрофуран, ацетонитрил, диэтиловый эфир, 1,4 диоксан или N,N-диметилформамид, при температуре, находящейся в пределах примерно от -30 С до комнатной температуры. Взаимодействие соединения формулы (IX) с получением соединения формулы (I) может проводиться с кислотой, такой как трифторуксусная кислота, хлористоводородная кислота, муравьиная кислота, в подходящем растворителе, таком как метиленхлорид, при температуре, находящейся в пределах от 10 С до комнатной температуры. Взаимодействие соединения формулы (IV) с соединением формулы (VIII), где X представляет собой подходящую уходящую группу, может проводиться в присутствии третичного основания, такого как триэтиламин, N-метилморфолин, N,N-диизопропилэтиламин или пиридин, в подходящем растворителе,таком как толуол, дихлорметан, хлороформ, диэтиловый эфир, тетрагидрофуран, ацетонитрил, диоксан или N,N-диметилформамид, при температуре, находящейся в пределах примерно от 10 С до температуры кипения с обратным холодильником. Взаимодействие между соединением формулы (IV) и соединением формулы (VIII) также может проводиться в присутствии третичного основания, связанного с полимерным носителем, такого как связанный с полистиролом N-метилморфолин, в подходящем растворителе, в частности, в толуоле, дихлорметане, хлороформе, диэтиловом эфире, тетрагидрофуране, ацетонитриле, диоксане или N,N-диметилформамиде, при комнатной температуре. Взаимодействие соединения формулы (X) с получением соединения формулы (I) может проводиться с основанием, таким как гидроксид натрия, гидроксид калия, карбонат натрия или карбонат калия, в подходящем растворителе, таком как смесь метанола или этанола с водой, при комнатной температуре. Взаимодействие соединения формулы (X) с получением соединения формулы (I) также может проводиться с использованием трисамина, связанного с полистиролом, в качестве основного агента. Взаимодействие соединения формулы (IV) с соединением формулы (XI) с получением соединения формулы (I) может проводиться в присутствии основания, такого как триэтиламин, N,Nдиизопропилэтиламин, N-метилморфолин, в подходящем растворителе, таком как ацетонитрил, диоксан,тетрагидрофуран, диметилформамид, при температуре, находящейся в пределах от комнатной температуры до температуры кипения с обратным холодильником. Взаимодействие соединения формулы (I), где R1 представляет собой 4-галогенфенилацетил, с соединением формулы (XII) с получением соединения формулы (I), где R1 представляет собой 4 арилфенилацетил, может проводиться в присутствии основания, такого как CsF, Nа 2 СО 3, K2 СО 3, и катализатора, такого как Pd(PPh3)4, PdCl2 (РРh3)2, Pd(OAc)2/PPh3 в подходящей смеси растворителей, таких как диметоксиэтилен и метанол, диоксан, тетрагидрофуран, диметоксиэтан, при температуре, находящейся в пределах от комнатной температуры до температуры кипения с обратным холодильником. Взаимодействие соединения формулы (I), где R1 представляет собой 4-галогенфенилацетил, с пинаколовым эфиром дибороновой кислоты с получением соединения формулы (XIII) может проводиться в присутствии основания, такого как ацетат калия, триэтиламин, и катализатора, такого как PdCl2 (дифенилфосфинферроцен), PdCl2 (PPh3)2, в подходящем растворителе, таком как диметилформамид, диоксан,диметилсульфоксид, диметоксиэтан, ацетонитрил, при температуре, находящейся в пределах от комнатной температуры до температуры кипения с обратным холодильником. Взаимодействие соединения формулы (XIII) с соединением формулы (XIV) может проводиться в присутствии подходящего катализатора, такого как Pd(PPh3)4, PdCl2 (PPh3)2, и К 3 РО 4, K2CO3, Nа 2 СО 3, в подходящем растворителе, таком как диметилформамид, диоксан, тетрагидрофуран, диметоксиэтан. Соединения формулы (I) и промежуточные продукты для их получения в виде форм на полимерном носителе могут быть легко получены согласно принятым способам, известным в данной области; см.,например, Tetrahedron Letters 38 (15), 2629-2632 (1997). Сходным образом, преобразование этих связанных с полимером форм в свободные соединения проводится согласно принятым процедурам кислотного гидролиза. Также необязательное преобразование соединения формулы (I) в другое соединение формулы (I) может проводиться известными способами. Необязательное образование соли соединения формулы (I) или преобразование соли в свободное соединение, а также разделение смеси изомеров на отдельные изомеры, может проводиться общеобщепринятыми способами.-17 005373 Соединения формул (II), (VIII), где X представляет собой гидрокси- или удаляемую группу, как определено выше, (XI), (XII) и (XIV) известны или могут быть получены общепринятыми способами. При получении соединений формулы (I) необязательные функциональные группы как в исходном продукте, так и в его промежуточных продуктах, которые могут вызывать нежелательные побочные реакции, предпочтительно защищаются общепринятыми способами. Сходным образом, преобразование этих защищенных соединений в свободные соединения с удаленными защитными группами может проводиться согласно хорошо известным процедурам. Фармакология Соединения формулы (I) активны как ингибиторы cdk/циклина, поскольку они дают положительные результаты при тестировании по следующей процедуре. Ингибиторную активность предполагаемых ингибиторов cdk/циклина, и силу действия выбранных соединений определяли способом анализа, основанным на использовании 96-луночного планшета Multiscreen PH (Millipore), на дно каждой лунки которого помещена фосфоцеллюлозная фильтровальная бумага, обеспечивающая связывание положительно заряженного субстрата после стадии промывки/фильтрации. При переносе с помощью сериновой/треониновой киназы радиоактивно меченной фосфатной группы на связанный с фильтром гистон испускаемое излучение измеряли в сцинтиляционном счетчике. Анализ ингибирования активности cdk2/ циклина А проводили по следующему протоколу: киназная реакция: 1,5 мкМ субстрата гистона H1, 25 мкМ АТФ (0,5 мкКи Р 33g-АТФ) , 10 нг комплекса циклин A/cdk2, 10 мкМ ингибитора в конечном объеме 100 мкл буфера (TRIS HCl 10 мМ рН 7,5,МgСl2 10 мМ, 7,5 мМ ДТТ) добавляли в каждую лунку 96-луночного планшета с U-образным дном. После 10 мин инкубации при 37 С реакцию останавливали 20 мкл ЭДТА 120 мМ. Связывание: из каждой лунки переносили 100 мкл в планшет Multiscreen, чтобы позволить субстрату связаться с фосфоцеллюлозным фильтром. Затем планшеты отмывали 3 раза 150 мкл/лунку PBS, не содержащего Са/Мg, и фильтровали посредством системы фильтрации Multiscreen. Детекция: фильтры высушивали при 37 С, затем добавляли 100 мкл/лунку сцинтиллятора, и проводили детекцию меченного 33 Р гистона путем счета радиоактивности на приборе Top-Count. Результаты: данные анализировали и представляли в виде % ингибирования по отношению к общей активности фермента (=100%). Все соединения, проявляющие ингибирование 50%, анализировали далее с целью изучения и определения кинетического профиля ингибитора через расчет Ki. Применяемый протокол был тем же, что описан выше, кроме концентраций АТФ и субстрата. Концентрации АТФ и гистона варьировали: 4, 8, 12, 24, 48 мкМ для АТФ (содержит пропорционально разведенный Р 33g-АТФ) и 0,4, 0,8, 1,2, 2,4, 4,8 мкМ для гистона использовали при отсутствии и присутствии двух разных, должным образом выбранных концентраций ингибитора. Экспериментальные данные анализировали посредством компьютерной программы SigmaPlot с целью определения Ki с использованием уравнения случайной системы двух реагентов:V = 1+ (А) + (В) + (А) (В) КА KB аКАКВ где А = АТФ и В = гистон H1. Кроме того, ингибиторную активность предполагаемых ингибиторов cdk/циклина и силу действия выбранных соединений определяли с использованием способа анализа, основанного на SPA (ScintillationProximity Assay) в 96-луночном планшете. Анализ основан на способности покрытых стрептавидином гранул для SPA захватывать биотинилированный пептид, происходящий из сайта фосфорилирования гистона. При переносе с помощью сериновой/треониновой киназы радиоактивно меченной фосфатной группы на биотинилированный пептид гистона испускаемое излучение измеряли в сцинтиляционном счетчике. Анализ ингибирования активности cdk5/ p25 проводили по следующему протоколу; Киназная реакция: 1,0 мкМ биотинилированного пептида гистона, 0,25 мкКи Р 33g-АТФ, 4 нМ комплекса cdk5/p25, 0100 мкМ ингибитора в конечном объеме 100 мкл буфера (Hepes 20 мМ рН 7,5, МgСl2 15 мМ, 1 мМ ДТТ) добавляли в каждую лунку 96-луночного планшета с U-образным дном. После 30 мин инкубации при 37 С реакцию останавливали добавлением 500 мкг гранул SPA в фосфатно-солевом буфере, содержащем 0,1% Triton Х-100, 50 М АТФ и 5 мМ ЭДТА. Гранулам давали осесть, и определяли радиоактивность,включенную в меченные 33 Р пептиды на сцинтилляционном счетчике Top Count. Результаты: данные анализировали и представляли в виде % ингибирования, используя формулу: 100x(1-(неизвестное-фон)/(ферм.контроль-фон,Значения IC50 рассчитывали с использованием вариации логарифмического уравнения с четырьмя параметрами:Y = 100/[1 + 10(LogEC50 - Х)наклон],где X = log(мкМ) и Y=% ингибирования. Поэтому соединения формулы (I) могут использоваться для подавления нерегулируемой пролиферации опухолевых клеток, следовательно, для терапии при лечении различных опухолей, таких как, в частности, карциномы, например, карцинома молочной железы, карцинома, карцинома мочевого пузыря,карцинома толстого кишечника, опухоли эндометрия и яичников, саркомы, например, саркомы мягких тканей и кости, и гематологические злокачественные состояния, как, например, лейкемии. Кроме того, соединения формулы (I) также могут использоваться при лечении других нарушений клеточной пролиферации, таких как псориаз, пролиферация гладкомышечных клеток сосудов, ассоциированная с атеросклерозом и послехирургические стеноз и рестеноз, и при лечении болезни Альцгеймера. Соединения по настоящему изобретению могут назначаться как в виде отдельных средств, так, альтернативно, и в комбинации с известными противораковыми способами лечения, такими как, радиационная терапия или химиотерапевтический режим в комбинации с цитостатическими или цитотоксическими средствами, антибиотикоподобными средствами, алкилирующими средствами, средствамиантиметаболитами, гормональными средствами, иммунологическими средствами, интерфероноподобными средствами, ингибиторами циклооксигеназы (например, ингибиторами СОХ-2), ингибиторами матриксных металлопротеаз, ингибиторами теломеразы, ингибиторами тирозиновых киназ, средствамиантиагонистами рецепторов факторов роста, анти-HER средствами, анти-EGFR средствами, средствами,действующими против ангиогенеза, ингибиторами фарнезил-трансферазы, ингибиторами пути трансдукции сигнала raf-raf, ингибиторами клеточного цикла, другими ингибиторами cdk, тубулинсвязывающими средствами, ингибиторами топоизомеразы I, ингибиторами топоизомеразы II, и тому подобное. В качестве примера, соединения по изобретению могут назначаться в комбинации с одним или более химиотерапевтическими средствами, такими как, в частности, таксан, производные таксана, инкапсулированные таксаны, СРТ-11, производные камптотецина, гликозиды антрациклина, например, доксорубицин, идарубицин, эпирубицин, этопозид, навелбин, винбластин, карбоплатин, цисплатин, эстрамустин, целекоксиб, Sugen SU-5416, Sugen SU-6668, Herceptin, и тому подобное, необязательно с их липосомными композициями. Такие комбинированные продукты, если они составляются в виде фиксированной дозы, задействуют соединения данного изобретения в рамках интервала дозировки, описанного ниже, и другое фармакологически активное средство в рамках утвержденного интервала дозировки. Соединения формулы (I) могут использоваться последовательно с известными противораковыми средствами, когда комбинированная композиция является неприемлемой. Соединения формулы (I) по настоящему изобретению, подходящие для введения млекопитающим,например, человеку, могут вводиться обычными путями и в дозировке, величина которой зависит от возраста, веса, условий жизни пациента и пути введения. Например, подходящая дозировка, адаптированная для перорального введения соединения формулы (I), может изменяться от 10 до примерно 500 мг на дозу, от 1 до 5 раз ежесуточно. Соединения по изобретению могут вводиться в различных дозированных формах, например, перорально в форме таблеток, капсул, таблеток, покрытых сахаром или пленкой, жидких растворов или суспензий; ректально в форме суппозиториев; парентерально, например, внутримышечно или путем внутривенной и/или внутритекальной и/или внутриспинальной инъекции или инфузии. Настоящее изобретение также включает фармацевтические композиции, включающие соединение формулы (I) или его фармацевтически приемлемые соли в ассоциации с фармацевтически приемлемым наполнителем, который может быть носителем или разбавителем. Фармацевтические композиции, содержащие соединения по изобретению, обычно получают, следуя принятым способам, и вводят в фармацевтически приемлемой форме. Например, твердые пероральные формы могут содержать, совместно с активным соединением, разбавители, например, лактозу, декстрозу сахарозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; смазки, например, диоксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связывающие средства, например, крахмалы, гуммиарабик, желатин,метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; дезинтегрирующие средства,например, крахмал, альгиновую кислоту, альгинаты или крахмальный гликолят натрия; шипучие смеси; красители; подсластители; смачивающие средства, такие как лецитин, полисорбаты, лаурилсульфаты; и,вообще, нетоксичные и фармакологически не активные вещества, используемые в фармацевтических композициях. Эти фармацевтические препараты могут производиться известным способом, например,посредством процедур смешивания, гранулирования, таблетирования, покрытия сахаром или покрытия пленкой. Жидкие дисперсии для перорального введения могут представлять собой, например, сиропы,эмульсии и суспензии. Сиропы могут содержать в качестве носителей, например, сахарозу или сахарозу с глицерином,и/или маннит и сорбит.-19 005373 Суспензии и эмульсии могут содержать в качестве носителей, например, натуральную смолу, агар,альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать, совместно с активным соединением, фармацевтически приемлемый носитель, например, стерильную воду, оливковое масло,этилолеат, гликоли, например, пропиленгликоль и, если требуется, подходящее количество лидокаина гидрохлорида. Суспензии или растворы для внутривенных инъекций или инфузий могут содержать в качестве носителя, например, стерильную воду, или, предпочтительно, они могут находиться в виде стерильных водных изотонических солевых растворов, или они могут содержать в качестве носителя пропиленгликоль. Суппозитории могут содержать вместе с активным компонентом фармацевтически приемлемый носитель, например, масло какао, полиэтиленгликоль, поверхностно-активное вещество на основе полиоксиэтиленового сорбитанового эфира жирной кислоты или лецитин. Примеры После того, как данное изобретение было подробно описано, дальнейшее понимание может быть достигнуто при обращении к конкретным примерам, которые приведены здесь только для целей иллюстрации, и не предназначены для ограничений, кроме специально определенных по-другому случаев. Пример 1. N-(5-Циклопропил-1 Н-пиразол-3-ил)-2,2-дифенилацетамид. К раствору 45,6 мг (0,215 ммоль) дифенилуксусной кислоты в 3 мл дихлорметана при 0 С добавляли 41,2 мг (0,215 ммоль) гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида. Через 1 ч при той же температуре при перемешивании добавляли 40 мг (0,179 ммоль) трет-бутил-3 амино-5-циклопропил-1 Н-пиразол-1-карбоксилата. Смесь выдерживали при комнатной температуре в течение 16 ч, а затем разбавляли дихлорметаном и промывали насыщенным раствором гидрокарбоната натрия. Органический слой высушивали над безводным сульфатом натрия, упаривали досуха, получая после колоночной хроматографии (гексан-этилацетат) 60 мг (80% выход) N-(5-циклопропил-1 третбутоксикарбонилпиразол-3-ил)-2,2-дифенилацетамида. Этот промежуточный продукт подвергали гидролизу с помощью 15 мл трифторуксусной кислоты, 10% об./об. в дихлорметане, в течение часа. Затем растворитель выпаривали в вакууме. Осадок снова растворяли в дихлорметане и промывали насыщенным раствором гидрокарбоната натрия. Органический слой высушивали над безводным сульфатом натрия и упаривали, получая 42 мг (92% выход) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДMCO-d6) м.д.: 0,62 (м, 2 Н, циклопропил СНН + СНН) ; 0,88 (м, 2 Н, циклопропил СНН + СНН) ; 1,81 (дддд, 1 Н, J=5,2; 5,2; 8,4; 8,4, циклопропил СН); 5,17 (с, 1 Н, CHPh2); 6,17 (с, 1 Н,пиразол СН) ; 7,30 (м, 10 Н, фенил СН) ; 10,6 (с, 1 Н, амидная NH); 12,04 (с, 1 Н, пиразол NH).ESI(+)-MC: m/z 318 (100, МН+). Т.пл. 218-220 С. Аналогичным образом были получены следующие продукты, исходя из соответствующей карбоновой кислоты:N-(3-циклопропил-1 Н-пиразол-5-ил)-2-оксо-1,2-дигидро-4-хинолинкарбоксамид; 2-анилино-N-(3-циклопропил-1 Н-пиразол-5-ил)ацетамид. Пример 2. 2-(1,3-Бензодиоксол-5-ил)-N-(3-циклопропил-1 Н-пиразол-5-ил)ацетамид. К раствору 96,8 мг (0,537 ммоль) 2-(1,3-бензодиоксол-5-ил)уксусной кислоты в 3 мл дихлорметана добавляли 360 мг (0,720 ммоль) дициклогексилкарбодиимида на полистирольном носителе (загрузка = 2 ммоль/г) и 40 мг (0,179 ммоль) трет-бутил-3-амино-5-циклопропил-1 Н-пиразол-1-карбоксилата. Смесь выдерживали при комнатной температуре при перемешивании в течение 96 ч и после этого фильтровали,промывали несколько раз дихлорметаном и упаривали досуха. Остаток снова растворяли в 3 мл 10% об./об. трифторуксусной кислоты в дихлорметане и промывали насыщенным раствором гидрокарбоната натрия. Органический слой упаривали досуха с получением после растирания с диэтиловым эфиром 32 мг (63% выход) указанного в заголовке соединения.ESI( + ) МС: m/z 268(100, МН+). Т.пл. 174-176 С. Аналогичным образом получали следующие продукты:N-(3-циклопропил-1 Н-пиразол-5-ил)бицикло[4.2.0]окта-1,3,5-триен-7-карбоксамид. Все соединения были охарактеризованы масс-спектрометрией (МС). При помощи ЖХ-МС было подтверждено, что в каждом случае основной компонент включает молекулярный ион, соответствующий ожидаемому продукту. Соединения представляли в виде % площади ВЭЖХ, изменяющегося от 78 до 100. Анализ ВЭЖХ: Растворитель A: H2O/CH3CN=90/10 + 0,1% TFA; Растворитель В: H2O/CH3CN=10/90 + 0,075% TFA Время (мин)%В 0 0 100 6,5 0 100 7 100 0 10 100 0 Скорость: 1,5 мл/мин. Детекция: УФ 254 нм. Температура: комнатная температура. Колонка: Supelco, Discovery ОФ Амид С 16, 5 мкм, (50 х 4,6)мм. Пример 3. 3-Циклопропил-3-оксопропаннитрил. 4,5 г (0,15 моль) 80% гидрида натрия суспендировали в 200 мл диоксана, добавляли по каплям 7,5 мл ацетонитрила (0,15 моль), и через 20 мин добавляли раствор этилциклопропанкарбоксилата (0,125 моль) в 100 мл того же растворителя. Смесь кипятили с обратным холодильником в течение 3 ч при перемешивании, затем добавляли 400 мл воды, и экстрагировали непрореагировавший исходный материал метиленхлоридом. Водный слой подкисляли растворенной хлористо-водородной кислотой и экстрагировали тем же растворителем. Органический слой высушивали над безводным сульфатом натрия и упаривали досуха с получением остатка, который после колоночной хроматографии (циклогексан-этилацетат) давал 7,8 г (57% выход) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, CDCl3) м.д.: 1,20 (м,2 Н, циклопропил СНН + СНН); 1,21 (м, 2 Н, СНН + CHN); 2,12 (дддд, 1 Н, J=7,6, 7,6, 4,5, 4,5, циклопропил СН); 3,59 (с, 2 Н, СОСН 2). EI-MC: m/z 69 (85, М-С 3 Н 5-);-28 005373 5 г (0,046 моль) 3-циклопропил-3-оксопропаннитрила растворяли в 200 мл этанола, и добавляли 2,26 мл (0,046 моль) гидрата гидразина. Раствор оставляли кипеть с обратным холодильником в течение 5 ч, а затем растворитель выпаривали в вакууме. Остаток снова растворяли в метиленхлориде и промывали несколько раз солевым раствором. Органический слой высушивали над безводным сульфатом натрия,и выпаривали растворитель с получением 4,53 г (80% выход) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6) м.д.: 0,54 (м, 2 Н, пиразол СНН + СНН); 0,76 (м, 2 Н, СНН + СНН); 1,68 (дддд, 1 Н, J=4,9, 4,9, 8,3, 8,3, пиразол СН); 5,02 (с, 1 Н, пиразол СН); 6-7 (ушир., 3 Н, NH + NH2).ESI-MC: m/z 124 (100, МН+). Аналогичным образом получали следующие соединения: 3-циклобутил-5-амино-1 Н-пиразол; 1 Н-ЯМР (400 МГц, ДМСО-d6) м.д. 11,10 (ушир. с, 1 Н), 5,23 (с, 1 Н), 4,43 (ушир.с; 1 Н), 3,31 (м, 1 Н),2,18 (м, 2 Н) , 2,04 (м, 2 Н), 1,80 (м, 2 Н); МС (FAB): m/z 138 (100, МН+); 3-(2-Бензилциклопропил)-1 Н-пиразол-5-амин гидрохлорид; 1 Н-ЯМР (400 МГц, ДМСО-d6) м.д. 7,23 (комплекс, 5 Н) , 5,48 (с, 1 Н) , 2,67 (м, 2 Н) , 1,85 (м, 1 Н), 1,48(комплекс, 4 Н), 1,80 (комплекс, 2 Н), 1,39 (комплекс, 2 Н). Пример 5. 3-Циклопропил-5-нитро-1 Н-пиразол. К раствору 2,7 г гидроксида натрия в 454 мл воды при 0 С добавляли 7,1 г (0,058 моль) 3 циклопропил-5-амино-1 Н-пиразола и 46,5 г гидрокарбоната натрия. Через 10 мин по каплям добавляли одновременно раствор 337 мл ацетона в 221 мл воды и раствор 130 г (0,21 моль) оксона в 580 мл воды при энергичном перемешивании. Через 4 ч при той же температуре реакцию гасили насыщенным раствором сульфита натрия, и реакционную смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом натрия и упаривали досуха с получением 4,6 г (52% выход) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, CDCl3) м.д.: 0,79 (м, 2 Н, циклопропил СНН + СНН); 1,10 (м, 2 Н, циклопропил СНН + СНН); 2,01 (дддд, 1 Н, J=5,l, 5,1, 8,2, 8,2, циклопропил СН) ; 6,51 (с, 1 Н, пиразол СН) .EI-MC: m/z 153 (100, М+); 136 (60, М-ОН). Пример 6. Трет-бутил-3-нитро-5-циклопропил-1 Н-пиразол-1-карбоксилат. 4,9 г (0,032 моль) 3-циклопропил-5-нитро-1 Н-пиразола растворяли в 200 мл метиленхлорида, и добавляли 200 мл насыщенного раствора гидрокарбоната натрия. Затем добавляли 35 г (0,16 моль) ангидрида трет-бутоксикарбониловой кислоты при перемешивании при комнатной температуре. Через 24 ч слои разделяли, и органический слой высушивали над сульфатом натрия и упаривали в вакууме. Остаток хроматографировали на колонке с силикагелем (циклогексан-этилацетат) с получением 7,7 г (95% выход) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, CDCl3) м.д.: 0,78 (м, 2 Н, циклопропил СНН + СНН); 1,13 (м, 2 Н, циклопропил СНН + СНН); 1,68 (дддд, 1 Н, J=5,3, 5,3, 8,5, 8,5, циклопропил СН); 6,49 (с, 1 Н, пиразол СН).ESI(+)MC: m/z 276 (100, MNa+); 220 [60, (MNa-C4H8)+]. Пример 7. Трет-бутил-3-амино-5-циклопропил-1 Н-пиразол-1-карбоксилат. 1,2 г (4,74 ммоль) трет-бутил-3-нитро-5-циклопропил-1 Н-пиразол-1-карбоксилата растворяли в 20 мл этанола и гидрировали в присутствии 200 мг палладия на угле (10%) при 50 фунт/дюйм 2 и комнатной температуре с получением после фильтрации на целите и выпаривании растворителя 0,96 г (95% выход) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, CDCl3) м.д.: 0,64 (м, 2 Н, циклопропил СНН + СНН); 0,97 (м, 2 Н, циклопропил СНН + СНН); 1,63 (с, 9 Н, (СН 3)3); 2,34 (дддд, 1 Н, J=5,2, 5,2, 8,4, 8,4, циклопропил СН); 3,82 (с, ушир, 2 Н,NH2), 5,39 (с, 1 Н, пиразол СН).ESI( + )MC: m/z 246 (200, MNa+) ; 168 [100, (MH-C4H8)+]; 124 [90, (MH-C5H8O2)+]. Пример 8. N-(3-Циклопропил-1 Н-пиразол-5-ил)бензамид. К раствору 0,37 г (3 ммоль) 3-циклопропил-5-амино-1 Н-пиразола в 15 мл дихлорметана последовательно добавляли при комнатной температуре 0,8 мл (7,3 моль) N-метилморфолина и 0,8 мл (6,9 моль) бензоилхлорида. После 16 ч при перемешивании смесь концентрировали и осадок растворяли в 15 мл метанола. 3,5 мл 2,5 М гидроксида натрия добавляли по каплям, и в конце добавляли 10 мл тетрагидрофурана с получением гомогенного раствора. Через 15 мин смесь концентрировали и вливали в воду. Осадок фильтровали и высушивали в вакууме с получением 585 мг (86% выход) указанного в заголовке соединения. Т.пл. 234 С; 1 Н=ЯМР (ДMCO-d6) м.д. 12,1 (с, 1 Н) , 10,65 (с, 1 Н), 7,97 (app.d., 2 Н), 7,7 (м, 3 Н), 6,31 (с, 1 Н), 0,93-29 005373 МС (EI) m/z (отн. интенсивность) 227 (м+, 22), 226 (11), 199 (23), 106 (13), 105 (95), 78 (11), 77 (99),66 (9), 65 (14), 51 (29). Аналогичным образом получали следующие продукты, исходя из соответствующей карбоновой кислоты:
МПК / Метки
МПК: A61K 31/415, C07D 231/40
Метки: применение, получения, 5)-аминопиразола, производные, средств, способ, качестве, противоопухолевых
Код ссылки
<a href="https://eas.patents.su/30-5373-proizvodnye-3-5-aminopirazola-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-protivoopuholevyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3 (5)-аминопиразола, способ их получения и их применение в качестве противоопухолевых средств</a>
Предыдущий патент: Замещенные производные пурина в качестве ингибиторов клеточной адгезии
Следующий патент: Новые соединения бензо [b]пирано[3,2-h]акридин-7-она, способ их получения и содержащие их фармацевтические композиции
Случайный патент: Устройство для хранения и дозированного нанесения вязкого лекарственного средства












