Конденсированное бициклическое соединение – ингибитор mtor, фармацевтическая композиция, его содержащая, и способ лечения рака
Номер патента: 15463
Опубликовано: 31.08.2011
Авторы: Тэвэрес Пола А.Р., Вэн Цинхуа, Кру Эндрю-Филип, Биард Джеймз Девид, Бхарадвадж Апурба, Сью Кэм В., Хонда Аяко, Вернер Дуглас С., Чэнь Синь, Волк Браян, Цзинь Мейчжун, Дон Хань-Цин, Коут Хизер, Ван Цзин, Малвихилл Кристен Мишель, Малвихилл Марк Джозеф, Пэникер Биджой, Арнольд Ли Д.
Формула / Реферат
1. Соединение
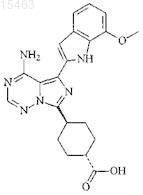
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, включающая соединение по п.1 вместе с фармацевтически приемлемым носителем.
3. Способ лечения лимфомы или рака яичников, включающий введение эффективного количества соединения или соли по п.1 пациенту, нуждающемуся в этом.
Текст
Дата публикации и выдачи патента Номер заявки КОНДЕНСИРОВАННОЕ БИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ - ИНГИБИТОР Настоящее изобретение относится к соединению, представленному приведенной ниже формулой,или его фармацевтически приемлемой соли. Соединение является ингибитором mTOR и полезно при лечении рака. Изобретение также относится к фармацевтической композиции, содержащей соединение, и спососбу лечения лимфомы или рака яичника, включающему введение соединения 015463 Область техники, к которой относится изобретение Настоящее изобретение относится к бициклическому соединению, являющемуся ингибитором киназы белков-мишеней рапамицина млекопитающих (mammalian Target Of Rapamicin, mTOR) (также известной как FRAP, RAFT, RAPT, SEP). В частности, данное изобретение направлено на конденсированное бициклическое соединение, являющееся ингибитором mTOR, полезное при лечении рака яичников и лимфомы. Сведения о предшествующем уровне техники В международной публикации патента WO 2001/019828 описывается препарат из гетероароматических аминов в качестве ингибиторов протеинкиназы. В международной публикации патента WO 2005/047289 указываются соединения пирролопиримидина, использующиеся при лечении рака. Бергстром и др., J. Org. Chem., 56:5598-5602 (1991) описывает синтез C-5 пиримидиннуклеозидтиоэфиров из дисульфидов и нуклеозидов ртути при участии палладия. Было продемонстрировано, что высокий уровень разрегулирования активности mTOR связан с разнообразием видов рака у человека и несколькими синдромами гамартомы, включая комплекс туберозного склероза, синдромы гамартомы на основе PTEN и синдром Пейтца-Егерса. Несмотря на то что аналоги рапамицина, как и ингибитор киназы mTOR, находятся на стадии клинической разработки, результаты исследований, проводимых с CCI-779, у пациентов с раком молочной железы и почки оказались средними. Возможно, это связано с частичным ингибированием функции mTOR рапамицином из-за наличия комплекса раптор-mTOR (mTORC1). Также было обнаружено, что 2/3 пациентов с раком молочной железы и 1/2 пациентов с раком почек являются устойчивыми к лечению рапамицином. Недавнее открытие комплекса риктор-mTOR (mTORC2), который участвует в фосфорилировании AKT (S473), играющем важную роль в процессе контроля выживаемости клеток и модуляции PKC, которая, в свою очередь,имеет решающее значение для регуляции организации актинового цитоскелета независящим от рапамицина образом, показало, что ингибирование данных функций mTOR, вероятно, является ключевым для расширения спектра противоопухолевой активности и увеличения эффективности ингибиторов. Поэтому так необходима разработка новых соединений, которые являются прямыми ингибиторами mTOR-киназы и могут оказаться ингибиторами mTORC1 и mTORC2. В ряде исследований показано, что макролидный антибиотик рапамицин способен специфически ингибировать активность mTOR-киназы in vitro и in vivo. Хотя точный механизм, посредством которого рапамицин ингибирует функцию mTOR, не совсем ясен, все же известно, что сначала рапамицин связывается с белком с FKBP12 (FK506-связывающий белок), затем связывается с FRB-доменом mTOR и благодаря этому ингибирует активность mTOR, индуцируя конформационные изменения, которые ингибируют связывание субстрата. Рапамицин широко использовался в качестве специфического ингибитораmTOR при проведении доклинических исследований с целью демонстрации роли mTOR в передаче сигналов и развитии рака. Но разработка рапамицина не предназначалась для терапии рака из-за проблем,связанных с его устойчивостью и растворимостью, хотя при обследовании типа NCI наблюдалось достижение значительного противоопухолевого эффекта. Однако синтез аналогов рапамицина с отличными характеристиками по устойчивости и растворимости привел к проведению клинических исследований с аналогами CCI-779, RAD001, АР 23573. Аналог рапамицина CCI-779 с улучшенными свойствами продемонстрировал скромный противоопухолевый эффект при проведении клинических исследований на стадии II рака молочной железы, карциномы почек и лимфомы клеток коры головного мозга. Первоначально Tor-гены были обнаружены в дрожжах в качестве мишени рапамицина. Позже был обнаружен mTOR млекопитающих, который является структурно и функционально консервативным эквивалентом дрожжевого TOR. mTOR относится к семейству киназ, родственных киназе фосфоинозитидов (PIKK), но фосфорилирует не фосфоинозитиды, а белки по остаткам серина и треонина. Генетические исследования показали, что mTOR имеет важное значение для клеточного роста и развития плодовых мушек, нематод и млекопитающих, а нарушение генов, кодирующих mTOR, приводит к летальности у всех видов. Разные исследования показали, что mTOR имеет важное значение для контроля клеточного роста, пролиферации и метаболизма. mTOR регулирует широкий спектр клеточных функций, включая трансляцию, транскрипцию, оборот мРНК, стабильность белков, организацию актинового цитоскелета и аутофагию. Различают два комплекса mTOR в клетках млекопитающих. Комплекс mTOR I (mTORC1) является комплексом раптор-mTOR, который в основном контролирует клеточный рост рапамицинчувствительным путем, в то время как комплекс mTOR II (mTORC2) относится к комплексу рикторmTOR, который регулирует структуру цитоскелета рапамицин-нечувствительным путем. Наиболее хорошо изученной функцией mTOR в клетках млекопитающих является регуляция трансляции. Рибосомная киназа S6 (S6K) и эукариотический белок 1, связывающий фактор инициации 4E (4EBP1), наиболее хорошо изученные субстраты mTOR, являются ключевыми регуляторами белковой трансляции. S6K является основной рибосомной протеинкиназой в клетках млекопитающих. Фосфорилирование белка S6 киназой S6K выборочно увеличивает трансляцию мРНК, содержащих участок пиримидинового мотива; данные мРНК часто кодируют рибосомные белки и другие трансляционные регуляторы. Следовательно, S6K усиливает общую трансляционную способность клеток. 4E-BP1, другая хорошо известная мишень mTOR, действует в качестве трансляционного репрессора путем связывания и ин-1 015463 гибирования эукариотического фактора инициации трансляции 4E (eIF4E), который распознает 5'концевой участок эукариотических мРНК. Фосфорилирование 4E-BP1 при помощи mTOR приводит к диссоциации 4E-BP1 от eIF4E, при этом снижается ингибирование 4E-BP1 на стадии eIF4E-зависимой инициации трансляции. Суперэкспрессия eIF4E усиливает клеточный рост и трансформирует клетки посредством увеличения трансляции подгруппы ключевых белков, стимулирующих рост, включая циклинD1, c-Myc и VEGF. Следовательно, mTOR-зависимая регуляция как 4E-BP1, так и S6K может быть общим механизмом, посредством которого mTOR усиливает клеточный рост. mTOR объединяет два самых важных внеклеточных и внутриклеточных сигнала, которые участвуют в процессе регуляции клеточного роста: факторы роста и питательные вещества. Факторы роста, как, например, инсулин или IGF1, и такие питательные вещества, как аминокислоты или глюкоза, стимулируют функцию mTOR, о чем свидетельствует увеличение уровня фосфориляции S6K и 4E-BP1. Рапамицин или доминантный негативныйmTOR ингибируют данные процессы, указывая тем самым, что mTOR интегрирует регуляцию сигналов,получаемых от факторов роста и питательных веществ. Пути проведения сигналов, находящихся вверху и внизу от mTOR, часто являются разрегулированными при различных типах рака, включая рак молочной железы, легких, почек, предстательной железы,крови, печени, яичников, щитовидной железы, пищеварительного тракта и лимфомы. Онкогены, включая сверхэкспрессированные рецепторные тирозиновые киназы и конститутивно активированные мутантные рецепторы, активируют PI3K-зависимые сигнальные пути. Дополнительные изменения пути PI3K-mTOR при наличии у человека рака включают амплификацию p110 - каталитической субъединицы PI3K, потерю функции фосфатазы PTEN, амплификацию AKT2, мутации TSC1 или TSC2 и избыточную экспрессию или амплификацию eIF4E или S6K1. Мутация или потеря гетерозиготности в TSC1 или TSC2 часто провоцируют развитие синдрома туберозного склероза (TSC). TSC редко наблюдается при обнаружении злокачественных опухолей, хотя пациенты, страдающие TSC, находятся в группе риска заболевания раком почек с гистологией чистых клеток (clear-cell histology). Хотя инактивация TSC сама по себе не должна привести к злокачественному образованию, все же нарушение регулировки пути проведения сигнала, вероятно, может быть решающим в процессе ангиогенеза формирующегося злокачественного образования. TSC2 регулирует выработку сосудистого эндотелиального фактора роста (VEGF) какmTOR-зависимым, так и mTOR-независимым путями. После недавнего открытия рапамицин-независимой функции mTOR (при помощи mTOR2) в процессе фосфорилирования AKT (по остатку S473), что важно при регуляции выживания клеток и модуляции PKC, которая имеет решающее значение в регуляции строения актинового цитоскелета, существует мнение, что ингибирование функции mTOR рапамицином является неполным. Следовательно, открытие прямого ингибитора киназы mTOR, который будет полностью ингибировать функции как mTORC1, так и mTORC2, необходимо для получения более широкого спектра противоопухолевой активности и повышения эффективности. В данном документе приводится описание прямых ингибиторов киназы mTOR,которые можно применять при лечении различных видов рака, включая рак молочной железы, легких,почек, предстательной железы, крови, печени, яичников, щитовидной железы, желудочно-кишечного тракта и лимфомы, и других заболеваний, таких как ревматоидный артрит, синдромы гамартомы, отторжение трансплантата, IBD, рассеяный склероз и подавление иммунитета. Последние успешные результаты применения Tarceva, ингибитора киназы EGFR, для лечения немелкоклеточного рака легкого (NSCLC) и предыдущий успех, связанный с применением Gleevec для лечения хронической миелогенной лейкемии (CML), свидетельствует о возможности разработки селективных ингибиторов киназы для эффективного лечения рака. Хотя существует несколько противораковых препаратов, включая ингибиторы киназы, все же продолжает ощущаться потребность в более усовершенствованных противораковых лекарствах, приветствуется разработка новых химических соединений с более высоким показателем избирательности, силы действия или со сниженной токсичностью и побочными эффектами. Таким образом, необходима разработка таких химических соединений, для которых присуще подавление mTOR, для лечения больных раком пациентов. Кроме того, данные соединения могут проявлять активность в отношении других видах киназ, например PI3K, Src, KDR, с целью увеличения эффективности при лечении рака молочной железы, немелкоклеточного рака легких (NSCLC), карциномы клеток почек, лимфомы клеток коры головного мозга, рака эндометрия или других синдромов гамартомы. Сущность изобретения Настоящее изобретение обеспечивает соединение, представленное формулой или его фармацевтически приемлемой солью, являющееся ингибитором mTOR и пригодное для лечения рака. Также настоящее изобретение обеспечивает фармацевтическуюя композицию, включающую соединение приведенной выше формулы, составленное вместе с фармацевтически приемлемым носителем. Также настоящее изобретение обеспечивает способ лечения лимфомы или рака яичников, включающий введение эффективного количества соединения приведенной выше формулы или его соли пациенту, нуждающемуся в этом. Осуществление изобретения Соединение настоящего изобретения представлено формулой или его фармацевтически приемлемой солью. Настоящее изобретение включает композицию, содержащую соединение с приведенной выше формулой, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Настоящее изобретение включает способ лечения гиперпролиферативного нарушения, включающий этап введения эффективного количества соединения с приведенной выше формулой или его фармацевтически приемлемой соли. Настоящее изобретение включает способ лечения гиперпролиферативного нарушения, включающий этап введения эффективного количества соединения с приведенной выше формулой или его фармацевтически приемлемой соли, при этом к гиперпролиферативному нарушению относится рак яичников или лимфома. Настоящее изобретение включает промежуточные соединения, которые полезны для получения соединений настоящего изобретения. Эти промежуточные химические соединения содержат соединения,которые представлены следующими соединениями или их фармацевтически приемлемыми солями: Настоящее изобретение также охватывает фармацевтическую композицию, в которой содержится соединение с приведенной выше формулой в сочетании с фармацевтически приемлемым носителем. Предпочтительно композиция содержит фармацевтически приемлемый носитель и терапевтически эффективное количество соединения с приведенной выше формулой, как указано выше (или его фармацевтически приемлемую соль). Более того, изобретение в его предпочтительном воплощении охватывает фармацевтическую композицию для лечения болезней посредством ингибирования mTOR, включающую фармацевтически приемлемый носитель и нетоксическое эффективное для терапевтических целей количество соединения с приведенной выше формулой, как указано выше (или его фармацевтически приемлемой соли). Термин фармацевтически приемлемые соли означает соли, которые получены из фармацевтически приемлемых нетоксических щелочей или кислот. Если соединение согласно данному изобретению является кислотным, то его соль соответственно может легко быть получена из фармацевтически приемлемых нетоксических щелочей, включая неорганические и органические щелочи. Соли, полученные из таких неорганических щелочей, содержат алюминий, аммоний, кальций, медь (соли двух- и одновалентной меди), окисное железо, закисное железо, литий, магний, марганец (соли трех- и двухвалентного марганца), калий, натрий, цинк и тому подобные соли. Особое предпочтение отдается солям аммония, кальция, магния, калия, натрия. Соли, полученные из фармацевтически приемлемых органических нетоксических щелочей, содержат в себе соли первичных, вторичных, третичных аминов, а также циклических и замещенных аминов, как, например, аминов, полученных естественным и синтетическим способом. Другие фармацевтически приемлемые органические нетоксические щелочи, из которых могут быть получены соли, включают ионообменные смолы, как, например, аргинин, бетаин, кофеин, N',N'дибензилэтилендиамин, диетиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурин,теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и тому подобное. Если соединение согласно настоящему изобретению является щелочным, то его соль соответственно может легко быть получена из нетоксических кислот, включая неорганические и органические кислоты. Данные кислоты включают, например, уксусную, бензолосульфоновую, бензойную, камфоросульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромисто-водородную,соляную, изетионическую, молочную, малеиновую, яблочную, метансульфоновую, слизевую, азотную,памоевую, пантотеновую, фосфорную, янтарную, серную, виннокаменную кислоту, птолуолсульфоновую кислоту и другие. Особое предпочтение отдается лимонной, бромисто-водородной,соляной, малеиновой, фосфорной, серной и виннокаменной кислотам. Фармацевтические композиции согласно настоящему изобретению содержат соединение, представленное приведенной выше формулой (или его фармацевтически приемлемую соль), в качестве активного ингредиента, фармацевтически приемлемый носитель и необязательно другие лекарственные компоненты или активирующие добавки. Фармацевтические композиции включают композиции, предназначенные для перорального, ректального, локального и парентерального (включая подкожное, внутримышечное и внутривенное) введения, хотя в каждом конкретном случае наиболее подходящий способ определяется в зависимости от состояния организма пациента, происхождения и сложности протекания заболевания, изза которого вводится активный ингредиент. Фармацевтические композиции могут быть удобно порционно упакованы и изготовлены при использовании хорошо известных в фармацевтике способов.-4 015463 На практике соединения, представленные с приведенной выше формулой, или их фармацевтически приемлемые соли согласно настоящему изобретению могут служить в качестве активного ингредиента и тесно сочетаться с фармацевтическим носителем, что возможно при использовании традиционных технологий компаундирования лекарственных препаратов. Носитель при этом может принимать различные формы в зависимости от препарата, который будет вводиться, например, перорально или/и парентерально (включая внутривенное введение). Таким образом, фармацевтические композиции настоящего изобретения могут быть представлены в виде отдельных порционных упаковок, пригодных для перорального приема, как, например, капсулы, облатки или таблетки, в которых содержится предварительно установленная доза активного ингредиента. Кроме того, соединения могут быть в виде порошка, гранул, раствора, суспензии в водном растворе, неводной жидкости, масляно-водной эмульсии, водно-масляной жидкой эмульсии. Вместе с тем кроме привычных форм дозировки, указанных выше, соединение с приведенной выше формулой или его фармацевтически приемлемая соль может вводиться с помощью средств контролируемого высвобождения и/или устройствами для доставки. Возможно изготовление композиций посредством любых методов, известных в аптечном деле. Все эти методы направлены в целом на соединение активного ингредиента с носителем, который содержит один или более необходимых ингредиентов. Обычно композиции получают при помощи равномерного и тщательного смешивания активного ингредиента с жидкими носителями или мелко измельченными твердыми носителями или теми и другими. Затем продукту придают желаемую форму. Таким образом, фармацевтические композиции настоящего изобретения могут содержать фармацевтически приемлемый носитель и соединение или фармацевтически приемлемую соль приведенной выше формулы. Соединения приведенной выше формулы или их фармацевтически приемлемые соли также могут быть включены в фармацевтические композиции в сочетании с одним или несколькими терапевтически активными соединениями. Используемый фармацевтический носитель может быть, например, в твердом, жидком или газообразном состоянии. Примером твердого носителя может быть лактоза, каолин, сахароза, тальк, желатин,агар, пектин, гуммиарабик, стеарат магния, стеариновая кислота. Примерами жидкого носителя являются сахарный сироп, арахисовое масло, оливковое масло, вода. Примером газообразного носителя могут быть углекислый газ и азот. При изготовлении композиций для пероральной лекарственной формы можно прибегнуть к использованию любой традиционной фармацевтической среды. Например, вода, гликоли, масла, спирты, ароматизирующие вещества, антикоагулянты, красящие вещества и другие применяются для получения таких жидких препаратов для перорального введения, как суспензии, эликсиры и растворы; в то время как такие носители, как крахмал, сахар, микрокристаллическая целлюлоза, разбавители, гранулированные вещества, лубрикаторы, связывающие и диспергирующие вещества и другие, используются для получения твердых препаратов для перорального введения, таких как порошки, капсулы и таблетки. Из-за простоты введения капсулы и таблетки относятся к предпочтительной дозированной лекарственной форме для перорального использования, при этом применяются твердые фармацевтические носители. По выбору на таблетки наносится покрытие посредством стандартных водных или неводных методов. Таблетка, содержащая композицию в соответствии с настоящим изобретением, изготавливается при помощи прессования или формования, необязательно добавляются один или несколько вспомогательных компонентов или лекарственных веществ. Спрессованные таблетки производятся при сжатии, осуществляемом соответствующим оборудованием, активного ингредиента в виде сыпучего вещества или гранул с добавлением по выбору связующих веществ, смазывающих веществ, инертных разбавителей, поверхностно-активных или диспергирующих веществ. Формованные таблетки производятся прессовочной машиной из смеси порошкообразного компонента, смоченного инертным жидким разбавителем. В каждой таблетке предпочтительно содержится от приблизительно 0,05 мг до приблизительно 5 г активного ингредиента, в каждой облатке или капсуле предпочтительно содержится от приблизительно 0,05 мг до приблизительно 5 г активного ингредиента. Например, препарат, предназначенный для перорального введения человеку, может содержать от приблизительно 0,05 мг до приблизительно 5 г активного ингредиента, который соединен с определенным и необходимым количеством носителя, что может составлять от приблизительно 5 до приблизительно 95% от общего объема композиции. В стандартной лекарственной форме обычно содержится от приблизительно 1 мг до приблизительно 2 г активного ингредиента, как правило, 25, 50, 100, 200, 300,400, 500, 600, 800 или 1000 мг. Фармацевтические композиции настоящего изобретения, пригодные для парентерального введения,могут быть представлены в виде растворов или суспензий активных соединений на водной основе. Возможно добавление такого поверхностно-активного соединения, как, например, гидроксипропилцеллюлоза. Дисперсии производятся на основе глицерина, жидкого полиэтиленгликоля или их смеси в масле. Кроме того, возможно включение консервантов для предотвращения пагубного роста микроорганизмов. Фармацевтические композиции настоящего изобретения, пригодные для инъекционного введения,содержат стерильные водные растворы или дисперсии. Кроме того, соединения могут быть представлены в виде стерильного порошка, приготовленного для немедленного введения такого стерильного инъ-5 015463 екционного раствора или дисперсий. В любом случае, окончательная инъекционная форма должна быть стерильной и достаточно жидкой для введения препарата шприцом. Фармацевтические композиции должны отличаться стабильными характеристиками в условиях производства и хранения; следовательно,они должны быть основательно защищены от пагубного воздействия таких микроорганизмов, как бактерии и грибы. Носителем может быть раствор или диспергирсионная среда, содержащая, например, воду,этанол, полиол (т.е. глицерин, пропиленглиголь и жидкий полиэтиленглиголь), растительные масла и их подходящие смеси. Фармацевтические композиции настоящего изобретения могут иметь форму, подходящую для локального применения, как, например, аэрозоль, крем, мазь, лосьон, опудривающее средство и другие. Кроме того, композиции могут иметь форму, пригодную для использования в устройствах трансдермального введения. Данные препараты производятся на основе соединения, представленного приведенной выше формулой настоящего изобретения, или его фармацевтически приемлемой соли при использовании традиционных методов обработки. Например, крем или мазь изготовляется путем смешивания гидрофильного вещества и воды с добавлением около 5-10 мас.% соединения для производства крема или мази нужной консистенции. Фармацевтические композиции настоящего изобретения могут иметь форму, подходящую для ректального введения, при этом носитель представляет собой твердое вещество. Предпочтительной формой смеси для порционной дозы являются суппозитории. Подходящим носителем является масло какао и другие материалы, которые обычно применяются в данной области техники. Суппозитории легко формируются посредством смешивания соединения с размягченным или расплавленным носителем(ями),затем следует процесс охлаждения и придания формы в пресс-формах. В добавление к вышеупомянутым ингредиентам носителей, фармацевтические композиции, описанные выше, могут, как правило, содержать один или более дополнительных ингредиентов носителя,как, например, разбавители, буферные растворы, ароматизаторы, связующие вещества, поверхностноактивные вещества, загустители, смазывающие вещества, консерванты (включая антиоксиданты) и другие. Кроме того, могут быть включены другие вспомогательные вещества для придания композиции изотоничности с кровью реципиента. Композиции, содержащие соединение с приведенной выше формулой или его фармацевтически приемлемые соли, могут принимать форму порошка или жидкого концентрата. Соединения и композиции настоящего изобретения применяются для лечения рака яичников и лимфомы. Как правило, пациентом принимается доза в пределах от приблизительно 0,01 до около 150 мг/кг веса тела в день при лечении вышеуказанных заболеваний или в качестве альтернативы от около 0,5 мг до около 7 г в день. Например, рак яичников и лимфома эффективно лечатся при введении пациенту от приблизительно 0,01 до приблизительно 50 мг соединения на 1 кг веса тела пациента в день или в качестве альтернативы от около 0,5 мг до около 3,5 г в день. Но вместе с тем необходимо понимать, что специфическией уровень дозировки для каждого конкретного пациента будет зависеть от множества факторов, включая возраст, массу тела, общее состояние здоровья, пол, придерживаемую диету, время и способ введения препарата, скорость выведения, сочетание лекарств, этап развития конкретного заболевания, подвергающегося терапии. Биохимический анализ ингибирования активности mTOR. Способность соединения приведенной выше формулы ингибировать активность mTOR-киназы была определена в процессе иммунопреципитации (IP) киназы in vitro при использовании рекомбинанта 4EBP1 в качестве субстрата. Исследование демонстрирует способность соединений ингибировать фосфорилирование 4E-BP1 хорошо известного физиологического субстрата mTOR. Комплекс иммунозахватаmTOR из клеток HeLa инкубируется с различными концентрациями соединений и His-tag 4E-BP1 в буферном растворе для определения активности киназы до момента добавления АТР для запуска реакции при комнатной температуре. Реакция останавливается через 30 мин, в течение ночи собирают фосфорилированный His-tag 4E-BP1 на никелевохелатной пластине при 4C. Затем производят замер содержания фосфотреонина в 4E-BP1 при использовании первичного антитела против фосфо-4E-BP1 (T37/46) и соответствующего антикроличьего конъюгированного вторичного антитела IgG HRP. Вторичное антитело содержит ковалентно присоединенный репортерный фермент (например, пероксидазу хрена, HRP), поэтому связывание первичного антитела с фосфорилированным 4E-BP1 можно определить количественно,поскольку вторичное антитело связывается с ним в равном количестве. Количество вторичного антитела можно зарегистрировать с помощью инкубации с определенным субстратом HRP. Использованы следующие основные реагенты. Буферный раствор клеточного лизиса: 40 мМ HEPES, pH 7,5, содержащий 120 мМ NaCl, 1 мМ ЭДТА, 10 мМ пирофосфата натрия, 10 мМ -глицерофосфата, 50 мМ фторида натрия, 1,5 мМ ванадата натрия и 0,3% CHAPS. Полный мини-комплект ингибиторов протеаз, не содержащий ЭДТА (Roche, каталог 11 836 170 001). Осадок клеток HeLa (Paragon Bioservices).-6 015463 Пластины с покрытием из белка G, для иммунопреципитации (Pierce, каталог 15131). Антитело mTOR (aka FRAP) N-19 (Santa Cruz Biotechnology, каталог sc-1549). Промывочный буферный раствор для IP: HEPES 50 мМ, pH 7,5, содержащий NaCl 150 мМ. Буферный раствор для киназы: HEPES 20 мМ, pH 7,5, содержащий MgCl2 10 мМ, MnCl2 4 мМ, меркаптоэтанол 10 мМ, ванадата натрия 200 мкМ. Для проведения анализа состав должен быть свежим. Рекомбинантный 4E-BP1 (aka PHAS I) (Calbiochem, каталог 516675). Развести 120 раз штамм 4E-BP1 (1 мг/мл) в буферном растворе киназы для анализа для получения концентрации 0,25 мкг/ячейка в 30 мкл. Раствор АТФ. Подготовить 330 мкМ сконцентрированный раствор АТФ в буферном растворе для киназы.Ni-хелатная пластина (Pierce, каталог 15242). Буферный раствор для разведения антител: TBST с содержанием обезжиренного молока 5%. Антитело против фосфо-4E-BP1 (Т 37/46): Раствор 1: 1000 антитела фосфо-4E-BP1 (Т 37/46) (Cell Signaling Technology, каталог 9459) в буферном растворе для разведения антитела. Антикроличный IgH осла, конъюгированный с HRP. Разведение в соотношении антикроличьего 1:10,000 IgH, конъюгированного с HRP (GE Healthcare,каталогNA934) в буферном растворе для разведения антитела.HRP субстрат: Хемилюминесцентные реагенты (Pierce, каталог 37074). Протокол проведения анализа. Лизат клеток HeLa был получен посредством гомогенизации 25 г клеточного осадка в 60 мл буферного раствора для клеточного лизиса, с последующим центрифугированием при 12,000 об/мин в течение 30 мин. Прозрачная надосадочная жидкость была перелита в чистую пробирку, разделена на порции,быстро заморожена, отложена на хранение при -80C до момента использования. 96-луночный планшет с покрытием из протеина G сначала промывали буферным раствором для лизиса, в каждую лунку было добавлено 50 мкл разбавленного антитела mTOR, время выдержки при комнатной температуре составило 30-60 мин. Затем 50 мкг лизата клеток HeLa было добавлено в каждую лунку, содержащую 50 мкл буфера для лизиса, раствор выдерживался в прохладном помещении при 4C при встряхивании в течение 2-3 ч. Лизат был удален, планшет 3 раза промывали 100 мкл буфера для лизиса. Затем планшет промывали 2 раза 100 мкл буфера для промывки с высоким содержанием соли. Разбавленный (субстрат) 4E-BP1 был добавлен в каждую из лунок по 30 мкл. Соединения в различной концентрации были введены по 5 мкл в каждую из лунок. Концентрация лекарства варьировала от 30 до 0,1 мкМ. Конечная концентрация DMSO составила 1%. Только DMSO был добавлен в лунки положительного контроля. В лунки отрицательного контроля раствор АТФ не вводился, вместо него был добавлен буфер для киназы в объеме 15 мкл, реакция началась при добавлении 15 мкл АТФ для получения конечной концентрации 100 мкМ в оставшиеся лунки, за исключением лунок отрицательного контроля. Реакция проводилась в течение 30 мин при комнатной температуре. Затем 45 мкл реакционной смеси было перенесено на Ni-хелатный планшет и выдержано в течение ночи при 4C. Планшет промывали один раз буфером для разведения антител, в каждую лунку добавляли 50 мкл разбавленного антитела фосфо-4EBP1, выдерживали в течение 1 ч при комнатной температуре. Планшет промывали 4 раза 100 мкл TBST,в каждую лунку добавляли 50 мкл разбавленного вторичного антитела, выдерживали в течение 1 ч при комнатной температуре. Планшет промывали 4 раза 100 мкл TBST. Добавляли 50 мкл хемилюминесцентного реагента Pierce Femto, посредством измерительного устройства был произведен замер хемилюминесценции. Сравнение результатов анализа, полученных в присутствии соединения, с результатами, полученными в лунках положительного и отрицательного контроля, позволяет определить степень ингибирования фосфорилирования фосфо-4E-BP1 в отношении диапазона концентрации соединения. Значения ингибирования представляли в виде сигмоидальной кривой ингибирования доза-ответ с целью определения значений IC50 (т.е концентрация соединения, которая ингибирует фосфорилирование фосфо-4E-BP1 на 50%). Механистический анализ mTOR в клетках для измерения ингибирования фосфорилирования 4EBP1 (Т 37/46). Клетки MDA-MB-231 помещали в 96-луночные планшеты в количестве 2104 клеток/ячейку в 90 мкл полной питательной среды и инкубировали при 37C в CO2-инкубаторе. Клетки обрабатывали различными соединениями в дозо-зависимом режиме в течение 3 ч при 37C в CO2-инкубаторе, затем получали клеточный лизат для измерения уровня ингибирования фосфо-4E-BP1 в Т 37/46. Клеточные лизаты были перенесены в 96-луночный планшет, покрытый антителами 4E-BP1, для улавливания фосфо-4EBP1 (Т 37/46), температура инкубации составила 4C. Затем было измерено количество фосфо-4E-BP1 в каждой лунке после внесения в лунки антикроличьих антител к фосфо-4E-BP1 (Т 37/46) и соответствующих козьих антикроличьих IgG, конъюгированных с HRP. Содержание HRP в каждой лунке было изме-7 015463 рено посредством хемилюминесцентного метода, что соответствует содержанию фосфо-4E-BP1 в каждой лунке. Были определены значения IC50 по кривой типа доза-реакция, содержащей 6 точек. Биохимический анализ ингибирования активности IGF-1R. Ингибирование IGF-1R было продемонстрировано при проведении анализа тирозин киназы с применением очищенного слитого белка GST, содержащего домен цитоплазматической киназы человекаIGF-1R, экспрессированного в клетках Sf9. Измерение проводилось в конечном объеме 90 мкл, содержащем 1-100 нМ (в зависимости от специфической активности) на 96-луночном планшете типа Immulon4 (Thermo Labsystems), на который был предварительно нанесен субстрат полиглутир в количестве 1 мкг/лунку (отношение 4:1) в буфере для киназы (50 мМ Hepes, pH 7,4, 125 мМ NaCl, 24 мМ MgCl2, 1 мМMnCl2, 1% глицерин, 200 мкМ Na3VO4 и 2 мМ DTT). При добавлении АТФ до конечной концентрации 100 мкМ была запущена ферментативная реакция. После инкубации в течение 30 мин при комнатной температуре планшеты промывали 2 мМ забуференным имидазолом физиологическим раствором с 0,02% Tween-20. Затем в планшет вносили антифосфотирозиновое моноклональное антитело мыши pY20, конъюгированное с пероксидазой (HRP) (Calbiochem) хрена в концентрации 167 нг/мл, разведенное в забуференном фосфатом физиологическом растворе (PBS), содержащем 3% бычьего сывороточного альбумина (BSA), 0,5% Tween-20, 200 мкМ Na3VO4 с инкубацией в течение 2 ч при комнатной температуре. После трехкратной промывки 250 мкл связанные антитела против фосфотирозина выявляли при помощи инкубации с ABTS (KirkegarardPerry Labs, Inc.) объемом 100 мкл/лунку в течение 30 мин при комнатной температуре. Реакция была остановлена при добавлении 100 мкл/лунку 1% SDS, произведен замер сигнала, характеризующего фосфотирозин, спектрофотометром для считывания планшетов при 405/490 нм. Примеры настоящего изобретения показали по меньшей мере одно из следующего: 1) ингибирование фосфорилирования 4E-BP1 иммунозахваченной mTOR человека при определении с помощью биохимического анализа ингибирования активности mTOR с IC50 в диапазоне от 0,001 до 11,00 мкМ. Предпочтительно, чтобы значения IC50 были меньше 1,00 мкМ, еще более предпочтительно,чтобы значения IC50 составляли меньше 0,1 мкМ. Еще более предпочтительно, чтобы значения IC50 составляли меньше 0,01 мкМ; 2) ингибирование фосфорилирования 4E-BP1 (Т 37/46) в механистическом анализе mTOR в клетках со значением IC50 ниже 40 мкМ; 3) ингибирование IGF-1R в биохимическом анализе ингибирования активности IGF-1R со значением IC50 ниже 15 мкМ. Соединение формулы I-AQ является равным соединению формулы I, где X1=CH; X2, X3 и X5=N; X4,X6 и X7=C и J=H или NH2 Способ AQ применялся при получении соединения формулы I-AQ, как показано ниже на схеме 37. Метод AQ. Схема 37 где Q1 и R3 определены ранее для соединения с приведенной выше формулой, A11 = галоген, как Cl, Br или I, B(OR)2 = подходящая борная кислота/эфир и J = H или NH2. При типичном получении соединения формулы I-AQ, соединение формулы II-Q реагировало с подходящей борной кислотой/эфиром (Q1-B(OR)2) в подходящем растворителе посредством типичных процедур конденсации Сузуки. Подходящие растворители для использования в вышеупомянутом процессе включили, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диметоксиэтан и т.п.; диметилформамид (DMF); диметилсульфоксид (DMSO); ацетонитрил (CH3CN); спирты, такие как метанол, этанол, изопропанол, трехфтористый этанол и т.п.; и хлорированные растворители, как метиленхлорид (CH2Cl2) или хлороформ (CHCl3). Если было нужно, использовались смеси этих растворителей, однако предпочтительным растворителем был диметоксиэтан/вода. Вышеупомянутый процесс был осуществлен при температурах между около -78 и приблизительно 120C. Предпочтительно, чтобы реакция была выполнена между около 80 и 100C. Чтобы произвести соединения настоящего изобретения, выше-8 015463 упомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Эквимолярные, по существу, количества реагентов использовались предпочтительно, хотя использовались количества выше или ниже, если было необходимо. Специалист в данной области техники оценит, что альтернативные методы могут быть применимы для получения соединений формулы I-AQ из формулы II-Q. Например, соединение формулы II-Q может вступить в реакцию с подходящим оловоорганическим реактивом Q'-SnBu3 или подобным ему в подходящем растворителе через типичные процедуры конденсации Stille. Соединения формулы II-Q из схемы 37 были получены, как показано ниже на схеме 38. Схема 38 где R3 определено ранее для соединения с формулой I и A11 = галоген, как Cl, Br или I, и J = H или NH2. При типичном получении соединения формулы II-Q соединение формулы III-Q реагировало с оксихлоридом фосфора (POCl3), триазолом и пиридином, с последующей обработкой аммиаком (NH3) в подходящем растворителе. Подходящие растворители для использования в вышеупомянутом процессе включили, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диметоксиэтан и т.п.; диметилформамид (DMF); диметилсульфоксид (DMSO); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трехфтористый этанол и т.п.; и хлорированные растворители, как метиленхлорид(CH2Cl2) или хлороформ (CHCl3). Если было нужно, использовались смеси этих растворителей, однако предпочтительным растворителем был изопропанол. Вышеупомянутый процесс был осуществлен при температурах между около -20 и приблизительно 50C. Предпочтительно, чтобы реакция была выполнена между около 0 и 25C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Использовались предпочтительно эквимолярные, по существу, количества реагентов, хотя, если было необходимо, использовались и количества выше или ниже. Соединения формулы III-Q из схемы 38 были получены, как показано ниже на схеме 39. Схема 39 где R3 определен ранее для соединения с формулой I; A11 = галоген, как Cl, Br или I, и J = H или NH2. При типичном получении соединения формулы III-Q промежуточное соединение формулы V-Q было преобразовано в соединение формулы IV-Q. Промежуточное соединение формулы V-Q было обработано оксихлоридом фосфора (POCl3) в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диметоксиэтан и т.п., хлорированные растворители,как метиленхлорид (CH2Cl2) или хлороформ (CHCl3) и ацетонитрил. Если было нужно, использовались смеси этих растворителей. Предпочтительным растворителем был ацетонитрил. Вышеупомянутый процесс был осуществлен при температурах между около -78 и приблизительно 120C. Предпочтительно,чтобы реакция была выполнена между около 40 и около 95C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Промежуточное соединение формулы III-Q было получено реакцией промежуточного соединения формулы IV-Q с соответствующим галогенирующим реагентом. Подходящие галогенирующие реагенты включали, но ими не ограничивались, Br2, I2, Cl2, N-хлоросукцинимид, N-бромсукцинимид или N-йодсукцинимид. Предпочтительным галогенирующим агентом был N-йодсукцинимид. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран(THF), диметоксиэтан и т.п.; диметилформамид (DMF); диметилсульфоксид (DMSO); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трехфтористый этанол и т.п.; и хлорированные растворители, как метиленхлорид (CH2Cl2) или хлороформ (CHCl3). Если было нужно, использовались смеси этих растворителей, однако предпочтительным растворителем был DMF. Вышеупомянутый процесс был осуществлен при температурах между около -78 и приблизительно 120C. Предпочтительно реакция была выполнена между около 40 и 75C. Чтобы получить соединения настоящего изобретения, вышеупо-9 015463 мянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Эквимолярные, по существу, количества реагентов использовались предпочтительно, хотя использовались количества выше или ниже, если было необходимо. Соединения формул IV-Q и III-Q, где J = NH2, могут быть соответственно преобразованы в соединения формул IV-Q и III-Q, где J = H, процедурами диазотации, известными специалисту в данной области техники. Типичная процедура включает обработку соединения формулы IV-Q или III-Q, где J = NH2, с трет-бутилнитритом в подходящем растворителе, таком как THF или DMF. Соединения формулы V-Q схемы 39 были получены, как показано ниже на схеме 40. Схема 40 где R1 определен ранее для соединения формулы I; A1 = OH, алкокси или уходящая группа, такая как хлор или имидазол; и J = H или NH2. При типичном получении соединения формулы V-Q соединение формулы VI-Q и соединение формулы V вступали в реакцию в подходящих условиях для конденсации амидов. Подходящие условия включали, но ими не ограничивались, обработку соединения с формулой VI-Q и V (где A1 = OH) с конденсирующими реагентами, такими как DCC или EDC в совокупности с DMAP, HOBt, HOAt и т.п., или такими реактивами, как EEDQ. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диметоксиэтан и т.п., диметилформамид (DMF); диметилсульфоксид (DMSO); ацетонитрил; галогенизированные растворители, такие как хлороформ или метиленхлорид. Если было нужно, использовались смеси этих растворителей, однако предпочтительным растворителем был метиленхлорид. Вышеупомянутый процесс был осуществлен при температурах между около 0 и приблизительно 80C. Предпочтительно реакция была выполнена при температуре 22C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. В качестве альтернативы соединения с формулой VI-Q и V (где A1 = F, Cl, Br, I) вступали в реакцию с основаниями, такими как триэтиламин или этилдиизопропиламин и т.п. в совокупности с DMAP и подобными. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран(THF), диметоксиэтан и т.п.; диметилформамид (DMF); диметилсульфоксид (DMSO); ацетонитрил; пиридин; галогенсодержащие растворители, такие как хлороформ или метиленхлорид. Если было нужно,использовались смеси этих растворителей, однако предпочтительным растворителем был DMF. Вышеупомянутый процесс был осуществлен при температурах между около -20 и приблизительно 40C. Предпочтительно реакция была выполнена между температурой около 0 и 25C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Эквимолярные, по существу, количества реагентов соединений формулы VI-Q и V (где A1 = F, Cl, Br, I) и основания и субстехиометрические количества DMAP использовались предпочтительно, хотя использовались количества выше или ниже, если было необходимо. Кроме того, другие подходящие условия реакции для преобразования амина (соединение формулы VI-Q) в амид (соединение формулы V-Q) могут быть найдены в Larock, R.С., Comprehensive Organic Transformations, 2nd ed.; Wiley and Sons: New York, 1999, pp 1941-1949. Соединения формулы VI-Q схемы 40, где J = H, были получены, как показано ниже на схеме 41. При типичном получении соединения формулы VI-Q соединение формулы VII-Q реагировало в подходящих условиях в подходящем растворителе. Подходящие условия включают обработку соединения формулы VII-Q гидразином или метилгидразином в подходящем растворителе. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры,- 10015463 такие как тетрагидрофуран (THF), диметоксиэтан и т.п., диметилформамид (DMF); диметилсульфоксид(DMSO); ацетонитрил; галогенированные растворители, такие как хлороформ или метиленхлорид; спиртовые растворители, такие как метанол и этанол. Если было нужно, использовались смеси этих растворителей, однако предпочтительными растворителями были этанол и метиленхлорид. Вышеупомянутый процесс был осуществлен при температурах между около 0 и приблизительно 80C. Предпочтительно реакция была выполнена при температуре около 22C. Чтобы произвести соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Эквимолярные, по существу,количества реагентов соединений использовались предпочтительно, хотя использовались количества выше или ниже, если было необходимо. Соединения формулы VI-Q, где J=NH2, могут быть получены согласно процедурам, описанным в J.Het. Chem., (1984), 21, 697. Соединения формулы VII-Q схемы 41 были получены, как показано ниже на схеме 42. Схема 42 При типичном получении соединения формулы VII-Q соединение формулы VIII-Q реагировало с никелем Ренея в подходящем растворителе. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диметоксиэтан и т.п., диметилформамид (DMF); диметилсульфоксид (DMSO); ацетонитрил; спирты, как метанол, этанол, изопропанол, трехфтористый этанол и т.п.; хлорированные растворители, такие как метиленхлорид (CH2Cl2) или хлороформ (CHCl3). Если было нужно, использовались смеси этих растворителей, однако предпочтительным растворителем был этанол. Вышеупомянутый процесс может быть осуществлен между приблизительно комнатной температурой и приблизительно 100C. Предпочтительно реакция была выполнена при температуре около 80C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении,хотя давления выше или ниже использовались, если было необходимо. Эквимолярные, по существу, количества реагентов соединений использовались предпочтительно, хотя использовались количества выше или ниже, если было необходимо. Дополнительно соединение формулы VII-Q может быть получено реакцией соединения формулы VIII-Q с подходящим окисляющим реагентом в подходящем растворителе. Подходящий окисляющий реагент включает, но не ограничивает, перекись водорода (H2O2), 3 хлорпероксибензойную кислоту (mCPBA) и т.п. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры типа THF, диметоксиэтан и т.п.;DMF; DMSO; CH3CN; и диметилацетамид (DMA); хлорированные растворители, типа CH2Cl2 или CHCl3. Если было нужно, использовались смеси этих растворителей, однако предпочтительным растворителем был DMA. Вышеупомянутый процесс может быть осуществлен между температурой 0 и приблизительно 100C. Предпочтительно реакция была выполнена при температуре около 70C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Эквимолярные, по существу, количества реагентов соединений использовались предпочтительно, хотя использовались количества выше или ниже, если было необходимо. Соединения формулы VIII-Q схемы 42 были получены, как показано ниже на схеме последовательности операций 43. Схема 43 При типичном получении соединения формулы VIII-Q соединение формулы IX-Q реагировало с тиосемикарбазидом и подходящим основанием в подходящем растворителе. Подходящие основания включали, но ими не ограничивались, триэтиламин, этилдиизопропиламин и т.п. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диметоксиэтан и т.п., диметилформамид (DMF); диметилацетамид (DMA),диметилсульфоксид (DMSO); ацетонитрил (CH3CN); спирты, как метанол, этанол, изопропанол, трехфтористый этанол и т.п.; хлорированные растворители, такие как метиленхлорид (CH2Cl2) или хлоро- 11015463 форм (CHCl3). Если было нужно, использовались смеси этих растворителей, однако предпочтительным растворителем был этанол. Вышеупомянутый процесс может быть осуществлен между приблизительно комнатной температурой и приблизительно 100C. Предпочтительно реакция была выполнена при температуре между около 40 и 80C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Эквимолярные, по существу, количества реагентов соединений использовались предпочтительно, хотя использовались количества выше или ниже, если было необходимо, соединение формулы IX-Q может быть получено согласно процедуре, описанной Knutsen, Lars J.S. et al., J. Chem. Soc. Perkin Trans 1: Organic and Bio-Organic Chemistry (1972-1999), 1984, 229238. Специалист в данной области техники оценил бы, что в некоторых ситуациях заместитель, который является идентичным или имеет ту же самую реактивность по сравнению с функциональной группой,которая была изменена в одном из вышеупомянутых процессов, должен будет подвергнуться защите,сопровождаемой снятием этой защиты, чтобы предоставить желаемый продукт и избежать нежелательных побочных реакций. В качестве альтернативы другой из процессов, описанных в рамках настоящего изобретения, может использоваться с целью, чтобы избежать конкурирующих функциональных групп. Примеры подходящих защитных групп и методов для их введения и удаления могут быть найдены в следующей ссылке: "Protective Groups in Organic Syntheses", Т.W. Greene and P.G.M. Wuts, John Wiley andSons, 1989. Способ AW также применялся при получении соединений формулы II-Q, как показано ниже на схеме 44. Способ AW. Схема 44 где Q1 и R3 определены ранее для соединения с формулой I; A11 = галоген, как Cl, Br или I. При типичном получении соединений формулы II-Q соединение формулы III-W реагировало с аммиаком в подходящем растворителе. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диметоксиэтан и т.п.; спирты, такие как метанол, этанол, изопропанол, трехфтористый этанол и т.п.; и хлорированные растворители, как метиленхлорид (CH2Cl2) или хлороформ (CHCl3). Если было нужно, использовались смеси этих растворителей, однако предпочтительным растворителем был изопропанол. Вышеупомянутый процесс был осуществлен при температурах между около 0 и приблизительно 50C. Предпочтительно реакция была выполнена между около 0 и 22C. Чтобы получить соединения настоящего изобретения,вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Эквимолярные, по существу, количества реагентов использовались предпочтительно, хотя использовались количества выше или ниже, если было необходимо. Соединения формулы III-W схемы 44 были получены, как показано ниже на схеме последовательности операций 45. Схема 45 где R3 определен ранее для соединения с формулой I; A11 = галоген, как Cl, Br или I. При типичном получении соединения формулы III-W соединение V-W был преобразовано в соединение с формулой IV-W. Соединение формулы V-W было обработано оксихлоридом фосфора (POCl3) или изолированной солью Вильсмейра [CAS 33842-02-3] в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диметоксиэтан и т.п., хлорированные растворители, как метиленхлорид (CH2Cl2) или хлороформ (CHCl3), и ацетонитрил (CH3CN). Если было нужно, использовались смеси этих растворителей. Предпочтительным растворителем был- 12015463 ацетонитрил. Вышеупомянутый процесс был осуществлен при температурах между около -78 и приблизительно 120C. Предпочтительно реакция была осуществлена между около 40 и около 95C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Соединения формулы III-W были получены в результате реакции соединения формулы IV-W с соответствующим галогенирующим реагентом. Подходящие галогенирующие реагенты включали, но ими не ограничивались, Br2, I2, Cl2, N-хлоросукцинимид, N-бромсукцинимид или N-йодсукцинимид. Предпочтительным галогенирующим реагентом был N-йодсукцинимид. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диметоксиэтан и т.п.; диметилформамид (DMF); диметилсульфоксид (DMSO); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трехфтористый этанол и т.п.; и хлорированные растворители, как метиленхлорид (CH2Cl2) или хлороформ (CHCl3). Если было нужно, использовались смеси этих растворителей, однако предпочтительным растворителем был DMF. Вышеупомянутый процесс был осуществлен при температурах между около -78 и приблизительно 120C. Предпочтительно реакция была выполнена между около 40 и около 75C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении,хотя давления выше или ниже использовались, если было необходимо. Эквимолярные, по существу, количества реагентов использовались предпочтительно, хотя использовались количества выше или ниже,если было необходимо. Соединения формулы V-W схемы 45 были получены, как показано ниже на схеме 46. Схема 46 где R3 определен ранее для соединения с формулой I, X12 = азидо или моно- или дизащищенный амин иA1 = OH, алкокси или уходящая группа, как хлоро или имидазол. При типичном получении соединения формулы V-W соединение формулы VI-W реагировало с соединением формулы V в подходящих условиях для конденсации амида. Подходящие условия включали,но ими не ограничивались, те, которые описаны для преобразования соединения XIII в соединение XII,как показано на схеме 10. Соединения с формулой VI-W были получены из соединений с формулой VIIW. Типичная процедура для преобразования соединений с формулой VII-W в соединения с формулой VIW включает обработку соединения с формулой VII-W, где X12 = азидо, в условиях восстановления, но не ограничивается каталитической гидрогенизацией в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диметоксиэтан и т.п., спиртовые растворители, как метанол, этанол и т.п., эфиры, как этилацетат, метилацетат и т.п. Если было нужно, использовались смеси этих растворителей. Предпочтительными растворителями были ацетат и метанол. Вышеупомянутый процесс был осуществлен при температурах между -78 и приблизительно 120C. Предпочтительно реакция была осуществлена при температуре между 40 и около 95C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. В качестве альтернативы, где X12 = азидо, восстановление соединений с формулой VI-W может быть достигнуто обработкой соединения с формулой VII-W с триарил- или триалкилфосфинами в присутствии воды в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, эфиры, такие как тетрагидрофуран (THF), диоксан и т.п., спиртовые растворители, как метанол, этанол и т.п., эфиры, такие как этилацетат, метилацетат и т.п., DMF, ацетонитрил и пиридин. Если было нужно, использовались смеси этих растворителей. Предпочтительными растворителями были THF и ацетонитрил. Вышеупомянутый процесс был осуществлен при температурах между -78 и приблизительно 120C. Предпочтительно реакция была осуществлена при температуре между 40 и около 95C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Когда X12 = моно- или дизащищенный амин, снятие защиты может быть произведено в соответствии с процедурами, известными специалисту в данной области техники, и раскрыто в "Protective Groupsin Organic Syntheses", Т.W. Greene and P.G.M. Wuts, John Wiley and Sons, 1989. Соединения с формулой VII-W схемы 46 были получены, как показано ниже на схеме 47. где R3 определен ранее для соединения формулы I, X12 определен для соединения формулы VII-W и A12 = йод, бром, хлор, тозилат, мезилат или другая уходящая группа. При типичном получении соединения с формулой VII-W, где X12 = азид, соединение формулы VIIIW реагировало с азидом соли, такой как азид лития или натрия, в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, спиртовые растворители, как этанол, бутанол и т.п., эфиры, такие как этилацетат, метилацетат и т.п., DMF, ацетонитрил, ацетон, DMSO. Если было нужно, использовались смеси этих растворителей. Предпочтительными растворителями были ацетон и DMF. Вышеупомянутый процесс был осуществлен при температурах между -78 и приблизительно 120C. Предпочтительно реакция была осуществлена при температуре между 40 и около 95C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. В качестве альтернативы, где X12 = моно- или дизащищенный амин, соединения формулы VIII-W вступили в реакцию с подходящими защищенными аминами, где уходящая группа выбрана таким образом, что нуклеофильная природа азота или сохранялась, или когда она могла быть усилена действием реактива типа основания. Специалисту в данной области техники понятно, что такие защитные группы включают, но не ограничиваются, производные бензила, тритила, аллила и алкилоксикарбонила, как BOC, CBZ и FMOC. Соединения с формулой VIII-W, где A12 = галоген, пролучены из соединений с формулой XI-W. В типичной процедуре соединения с формулой XI-W обрабатываются с галогенирующими реактивами,такими как N-йодсукцинимид, N-бромсукцинимид, N-хлоросукцинимид, треххлористая изоциануровая кислота, N,N'-1,3-дибромо-5,5-диметилгидантоин, бром и йод, предпочтительно в присутствии одного или более радикальных источников, типа пероксида дибензоила, азобисизобутиронитрила или света в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, хлорированные растворители, такие как четырххлористый углерод, метилендихлорид, -трехфтористый толуол и т.п., эфиры,такие как метилформиат, метилацетат и т.п., DMF, ацетонитрил. Если было нужно, использовались смеси этих растворителей. Предпочтительными растворителями были четырххлористый углерод и трехфтористый толуол. Вышеупомянутый процесс был осуществлен при температурах между -78 и приблизительно 120C. Предпочтительно реакция была осуществлена при температурах между 40 и около 95C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались,если было необходимо. В качестве альтернативы соединения формулы VIII-W, где A12 = тозилат или мезилат, были получены из соединений формулы X-W, как показано на схеме 48. При типичном получении соединения формулы VIII-W соединение формулы X-W реагировало с сульфонилирующим реактивом, таким как метансульфохлорид или p-толуолсульфонилхлорид в присутствии основания, включая без ограниченияDIPEA или триэтиламин в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в вышеупомянутом процессе включили, но не ограничивались, хлорированные растворители, такие как дихлорметан, 1,2-дихлорэтан и т.п., эфиры, такие как THF, диэтиловый эфир и т.п., DMF и ацетонитрил. Если было нужно, использовались смеси этих растворителей. Предпочтительными растворителями были THF и дихлорметан. Вышеупомянутый процесс был осуществлен при температурах между -78 и приблизительно 120C. Предпочтительно реакция была осуществлена при температуре между 40 и около 95C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Схема 48 Соединения с формулой X-W были получены из соединений с формулой XI-W. При типичном по- 14015463 лучении соединения с формулой X-W соединение с формулой XI-W реагировало с восстановливающим реактивом, включая без ограничения боргидрид натрия, литийборгидрид или литийалюминийгидрид в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в вышеупомянутом процессе включали, но не огранивались, эфиры, такие как THF, диэтиловый эфир и т.п., и спирты, такие как этанол, метанол, изопропанол и т.п. Если было нужно, использовались смеси этих растворителей. Предпочтительными растворителями были THF и метанол. Вышеупомянутый процесс был осуществлен при температурах между -78 и приблизительно 120C. Предпочтительно реакция была осуществлена при температуре между 40 и около 95C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Соединения с формулой XI-W были получены из соединений с формулой XI-W. При типичном получении соединения с формулой XI-W, соединение с формулой XI-W реагировало с окисляющим реагентом, но не ограничивалось, таким как диоксид селена, диоксид марганца, перманганат калия и т.п., в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в вышеупомянутом процессе включали, но ими не ограничивались, хлорированные растворители, такие как дихлорметан, 1,2-дихлорэтан и т.п., воду, уксусную кислоту и сульфолан. Если было нужно, использовались смеси этих растворителей. Вышеупомянутый процесс был осуществлен при температурах между -78 и приблизительно 120C. Предпочтительно реакция была осуществлена при температуре между 40 и около 95C. Чтобы получить соединения настоящего изобретения, вышеупомянутый процесс был предпочтительно выполнен при примерно атмосферном давлении, хотя давления выше или ниже использовались, если было необходимо. Специалист в данной области техники оценит, что соединения с формулой IX-W могут быть получены путями, изложенными в литературе, например, в Bulletin de la Societe Chimique de France, (1973), (6)(Pt. 2), 2126. Соединения с формулой I-AQ и/или их предшественники могут быть подвергнуты различным взаимопревращениям функциональных групп как средство для того, чтобы получить доступ к небольшому количеству функциональных возможностей, которые не могут быть введены непосредственно в результате несовместимой химии. Примеры таких манипуляций функциональных групп, применимых к соединениям с формулой I-AQ и их предшественникам, являются сходными, но не ограничиваются описанными в схемах последовательности операций 16-27, 34 и 35, которые касаются соединений с формулами I-AA, I-P, I-P', I-Q, I-R, I-AB и I-AC. 7-Хлор-2-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1H-индол. Колба, содержащая Ir(Ome)2(COD)2 [Inorganic Syntheses (1985), 23, 126] (850 мг, 0,0013 моль), 4,4'ди-трет-бутил-[2,2']бипиридинил (686 мг, 0,00256 моль) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2 диоксаборолан (15,2 г, 0,0600 моль), была освобождена от воздуха и заполнена Ar (3), затем был добавлен безводный DME (400 мл, 3 моль) и раствор 7-хлор-1H-индола (0,086 моль) в DME (10 мл). Получившаяся смесь была перемешана под Ar в течение 16 ч, затем сконцентрирована и прохроматографирована на силикагеле с элюцией 10% EtOAc/гептан, для образования желаемого воскообразного вещества с выходом 96%. 1 Получен согласно процедуре, аналогичной описанной для 7-хлор-2-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1H-индола, с использованием 7-метокси-1H-индола. 4-(Метоксикарбонил)-4-метилциклогексанкарбоновая кислота.N,N-Диизопропиламин (1,18 мл, 8,35 ммоль) был добавлен капельным путем к 2 М раствору бутил- 15015463 лития (4,18 мл, 8,4 ммоль) при температуре -78C в атмосфере азота. Через 15 мин при этой температуре раствор нагрелся, и его температура была 0C в течение 15 мин перед повторным охлаждением до -78C и обработкой раствором 4-(карбометоксил)циклогексанкарбоновой кислоты (0,62 г, 3,34 ммоль) в тетрагидрофуране (8 мл). Через 30 мин йодометан (0,31 мл, 5 ммоль) был добавлен капельным путем, и смеси дали нагреться до комнатной температуры на 2 ч. Смесь была охлаждена до 0C, реакция была остановлена 2N HCl (10 мл), затем смесь была проэкстрагирована EtOAc (210 мл), промыта солевым раствором(315 мл) и высушена над безводным сульфат магния. Концентрация комбинированных органических экстрактов дала желтое твердое вещество. NMR (CDCl3) вместе с сырым необходимым продуктом. Метил транс-4-[(2,5-диоксопирродилин-1-ил)окси]карбонилциклогексанкарбоксилат. К раствору N-гидроксисукцинимида (6,18 г, 0,0537 моль) и транс-4-(карбометоксил)циклогексанкарбоновой кислоты (10,00 г, 0,05370 моль) в тетрагидрофуране (100,00 мл) был добавлен (N,N'дициклогексилкарбодиимид (11,08 г, 0,0537 моль) в тетрагидрофуране (16 мл). Эта реакционная смесь перемешивалась при комнатной температуре в течение еще 16 ч, затем перемешивалась при температуре 45C в течение 1 ч. Реакционная смесь была профильтрована еще в теплом состоянии через пористую воронку. Полученная масса была промыта еще 3 порциями тетрагидрофолевой кислоты, и фильтрат был сконцентрирован в вакууме, был перекристаллизирован из i-PrOH (300 мл) и профильтрован через пористую воронку с образованием 11,8 г, (выход 78%) титульного соединения в виде белых кристаллов. 1(2,00 г, 0,0113 моль) в H2O (60,0 мл, 3,33 моль) был охлажден до 0C, и в него по каплям был добавлен 1,00 М NaHCO3 в H2O (22,5 мл), и смеси дали нагреться до комнатной температуры. В эту смесь добавили метил транс-4-[(2,5-диоксопирродилин-1-ил)окси]карбонилциклогексанкарбоксилат (3,8 г, 0,012 моль) в 1:1 смеси THF/MeCN (40 мл). Через 30 мин в реакционной смеси начал образовываться осадок. Смесь перемешивали при комнатной температуре еще 16 ч, а затем осадок был профильтрован через пористую воронку и промыт H2O (2), диэтиловым эфиром (2) и был высушен в вакууме для получения титульного соединения 2,92 г (выход 84%) в виде желтоватого твердого вещества. 1 К раствору метил-транс-4-[(3-амино-5-оксо-4,5-дигидро-1,2,4-триазин-6-ил)метил]карбамоил циклогексанкарбоксилата (2,00 г, 0,00646 моль) в 1,2-дихлорэтане (130 мл) был добавлен POCl3 (4,2 мл,0,045 моль), и он нагревался с обратным холодильником в течение 3 ч. Реакционная смесь была сконцентрирована в вакууме, затем распределена между EtOAc и насыщенным NaHCO3 и разделена. Водная фракция была вновь проэкстрагирована с EtOAc (3), и объединенные органические фракции были высушены над Na2SO4, профильтрованы и сконцентрированы в вакууме для получения 1,43 г (выход 76% ) титульного соединения в виде желтоватого твердого вещества. 1 Раствор метил-транс-4-(2-амино-4-оксо-3,4-дигидроимидазо[5,1-f][1,2,4]триазин-7-ил)циклогексанкарбоксилата (0,200 г, 0,000686 моль) и N-йодосукцинимида (0,278 г, 0,00124 моль) в безводном диметилформамиде (4,0 мл) перемешивался при комнатной температуре в течение 48 ч. Реакционная смесь была сконцентрирована в вакууме, затем разделена между H2O и EtOAc. Водная часть была повторно проэкстрагирована EtOAc (3) и объединенные органические фракции были промыты H2O (2),Na2S2O3 (2) и солевым раствором (1). Водная фракция была повторно проэкстрагирована CHCl3 и вместе с фракциями EtOAc высушена над Na2SO4, профильтрована и сконцентрирована в вакууме с получением 229 мг (выход 79,9%) титульного соединения в виде светло-оранжевого твердого вещества. 1 Н NMR (400 МГц, DMSO-d6)ppm 1,34-1,65 (m, 4H), 1,88-2,06 (m, 4H), 2,33-2,45 (m, 1H), 2,913,01 (m, 1H), 3,61 (s, 3H), 6,17 (s, 2H) и 10,82 (br. s, 1H); MS (ES+): m/z 417,82 [MH+]. Метил-транс-4-(5-йодо-4-оксо-3,4-дигидроимидазо[5,1-f][1,2,4]триазин-7-ил)циклогексанкарбоксилат. В раствор метил-транс-4-(2-амино-5-йод-4-оксо-3,4-дигидроимидазо[5,1-f][1,2,4]триазин-7 ил)циклогексанкарбоксилата (0,880 г, 0,00211 моль) в безводной тетрагидрофуране (74 мл) и диметилформамиде (13,2 мл) был добавлен трет-бутилнитрит (1,2 мл, 0,010 моль), и смесь перемешивали при комнатной температуре в течение 2 ч. Реакционная смесь была сконцентрирована в вакууме и была очищена с помощью хроматографии на силикагеле [элюирование 5% MeOH в CHCl3] с получением в 570 мг В раствор 1H-1,2,4-триазол (0,881 г, 0,0128 моль) в пиридине (3,00 мл) был добавлен POCl3 (0,396 мл, 0,00425 моль), и раствор премешивался при комнатной температуре в течение 15 мин. К этой смеси по каплям был добавлен метил транс-4-(5-иодо-4-оксо-3,4-дигидроимидазо[5,1-f][1,2,4]триазин-7 ил)циклогексанкарбоксилат (0,570 г, 0,00142 моль) в пиридине (6,00 мл), и смесь перемешивалась при комнатной температуре еще на 2,45 ч. Реакция была остановлена избытком 2 М NH3 в i-PrOH (40,00 мл) при температуре 0C и оставлена при перемешивании при комнатной температуре еще на 3 ч. Реакционная смесь была сконцентрирована в вакууме и распределена между EtOAc и насыщенным NaHCO3 и разделена. Водный слой был промыт EtOAc (3), и объединенные органические фракции были промыты солевым раствором (1). Водный слой был вновь проэкстрагирован CHCl3 (3), и органическая фракция была добавлена к фракциям EtOAc. Объединенные органические фракции были высушены над Na2SO4,- 17015463 профильтрованы и сконцентрированы в вакууме. Полученное коричнево-красное твердое вещество было очищено хроматографией на силикагеле [элюирование 5% MeOH в CHCl3] с получением 438 мг (выход 76%) титульного соединения в виде светло-желтого твердого вещества. 1 3-Циклобутил-1-(1H-индол-5-ил)имидазо[1,5-]пиразин-8-амин. Сухая смесь 8-амино-3-циклобутил-1-йодоимидазо[3,4-]пиразина (30 мг, 0,096 ммоль), карбоната цезия (38 мг, 0,117 ммоль) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индола (26 мг, 0,107 ммоль) продувалась аргоном 3 раза перед добавлением тетракистрифенилфосфопалладия(0) (6 мг, 0,005 ммоль). Смесь была опродута еще два раза и затем обработана дегазированной смесью диметилового эфира с водой (5:1, 2 мл). Получившийся раствор был еще два раза дегазирован и затем нагревался при температуре 80C в течение ночи. Получившаяся реакционная смесь была сконцентрирована в вакууме,осадок был растворен в 1:1 MeCN:MeOH (1,5 мл) и очищен посредством массонаправленной препаративной ВЭЖХ для получения 3-циклобутил-1-(1H-индол-5-ил)имидазо[1,5-]пиразин-8-амина. 1 транс-4-(8-Амино-1-(1H-индол-2-ил)имидазо[1,5-a]пиразин-3-ил)циклогексанекарбоновая кислота. Смесь 37% HCl (30 мл) и метил-транс-4-(8-амино-1-(1H-индол-2-ил)имидазо[1,5-a]пиразин-3 ил)циклогексанэкарбоксилата (500,0 мг, 1,28 ммоль) перемешивалась в течение 18 ч при комнатной температуре. Смесь, полученная в результате реакции, затем была сконцентрирована в вакууме, а остаток- 18015463 был промыт диэтиловым эфиром (310 мл) и этилацетатом (210 мл), затем ледяным (по температуре) ацетонитрилом (10 мл) с целью получения 0,3 г заданного продукта. 1 Н ЯМР (d6-DMSO, 400 МГц):12,15 (brs, 1H), 11,69 (s, 1H), 8,45 (br s, 2H), 7,97 (d, J=6,4 Гц, 1H),7,63 (d, J=8,0 Гц, 1H), 7,50 (dd, J=8,0, 0,4 Гц, 1H), 7,19 (m, 1H), 7,13 (d, J=6,0 Гц, 1H), 7,06 (m, 1H), 6,83 (d,J=1,6 Гц, 1H), 3,27 (td, J=11,6, 3,2, 3,2 Гц, 1H), 2,33 (td, J=10,8, 3,2, 3,2 Гц, 1H), 2,05 (m, 4H), 1,73 (m, 2H) и 1,58 (mz, 2H). MS (ES+): m/z 376,05 [MH+]. Следующий пример иллюстрирует соединение, полученное в соответствии с процедурами, описанными выше, с использованием способов химического синтеза, где это необходимо, известных в данной области техники. или его фармацевтически приемлемая соль. 2. Фармацевтическая композиция, включающая соединение по п.1 вместе с фармацевтически приемлемым носителем. 3. Способ лечения лимфомы или рака яичников, включающий введение эффективного количества соединения или соли по п.1 пациенту, нуждающемуся в этом.
МПК / Метки
МПК: A61K 31/4985, C07D 487/04, C07D 519/00, A61P 35/00
Метки: способ, лечения, фармацевтическая, бициклическое, ингибитор, mtor, рака, соединение, содержащая, композиция, конденсированное
Код ссылки
<a href="https://eas.patents.su/20-15463-kondensirovannoe-biciklicheskoe-soedinenie-ingibitor-mtor-farmacevticheskaya-kompoziciya-ego-soderzhashhaya-i-sposob-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Конденсированное бициклическое соединение – ингибитор mtor, фармацевтическая композиция, его содержащая, и способ лечения рака</a>
Предыдущий патент: Алкоксиалкилзамещенные спироциклические тетрамовые и тетроновые кислоты
Следующий патент: Гербицидные составы с улучшенной эффективностью
Случайный патент: Способ подавления пыли измельченного минерального вещества
























