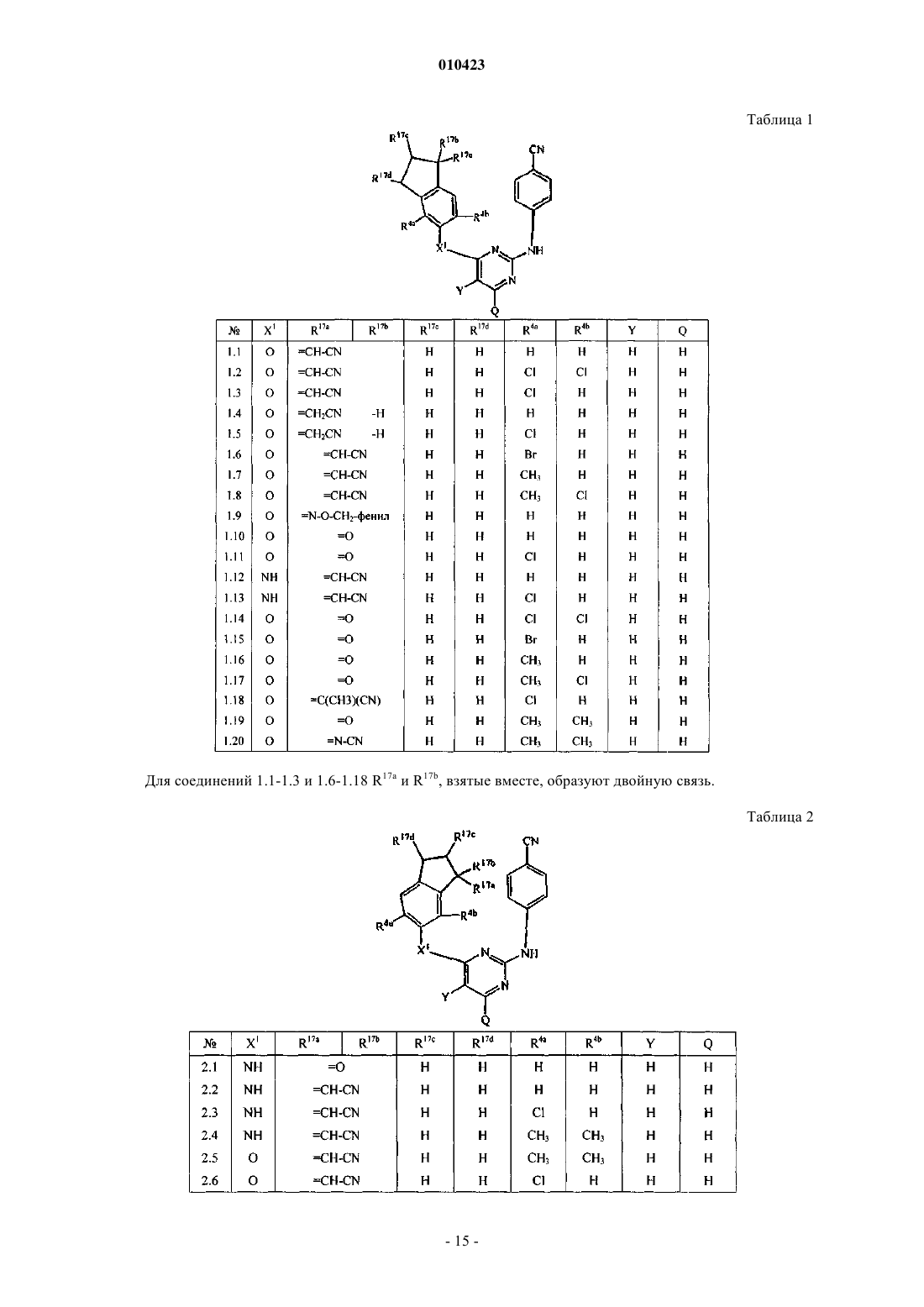
Инданзамещенные пиримидины, ингибирующие репликацию вич
Номер патента: 10423
Опубликовано: 29.08.2008
Авторы: Хертогс Курт, Койманс Люсьен Мария Хенрикус, Паскье Элизабет Тереза Жанна, Винкерс Хендрик Мартен, Де Жонж Марк Рене, Леви Паулус Йоаннес, Жанссен Поль Адриан Ян, Хэрес Ян, Дайер Фредерик Франс Дезире, Гийемон Жером Эмиль Жорж, Беттенс Эва
Формула / Реферат
1. Соединение формулы (I)
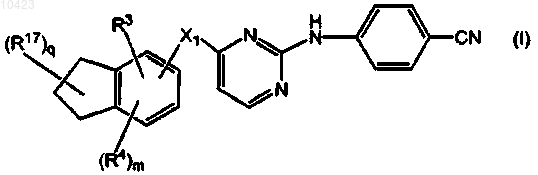
его N-оксида, фармацевтически приемлемой аддитивной соли или стереохимически изомерной формы,
где m равно 0, 1;
q равно 0, 1 или 2;
X1 обозначает -NH-, -O;
R3 обозначает водород, галоген, C1-6алкил;
R4 обозначает галоген, гидрокси, C1-6алкил;
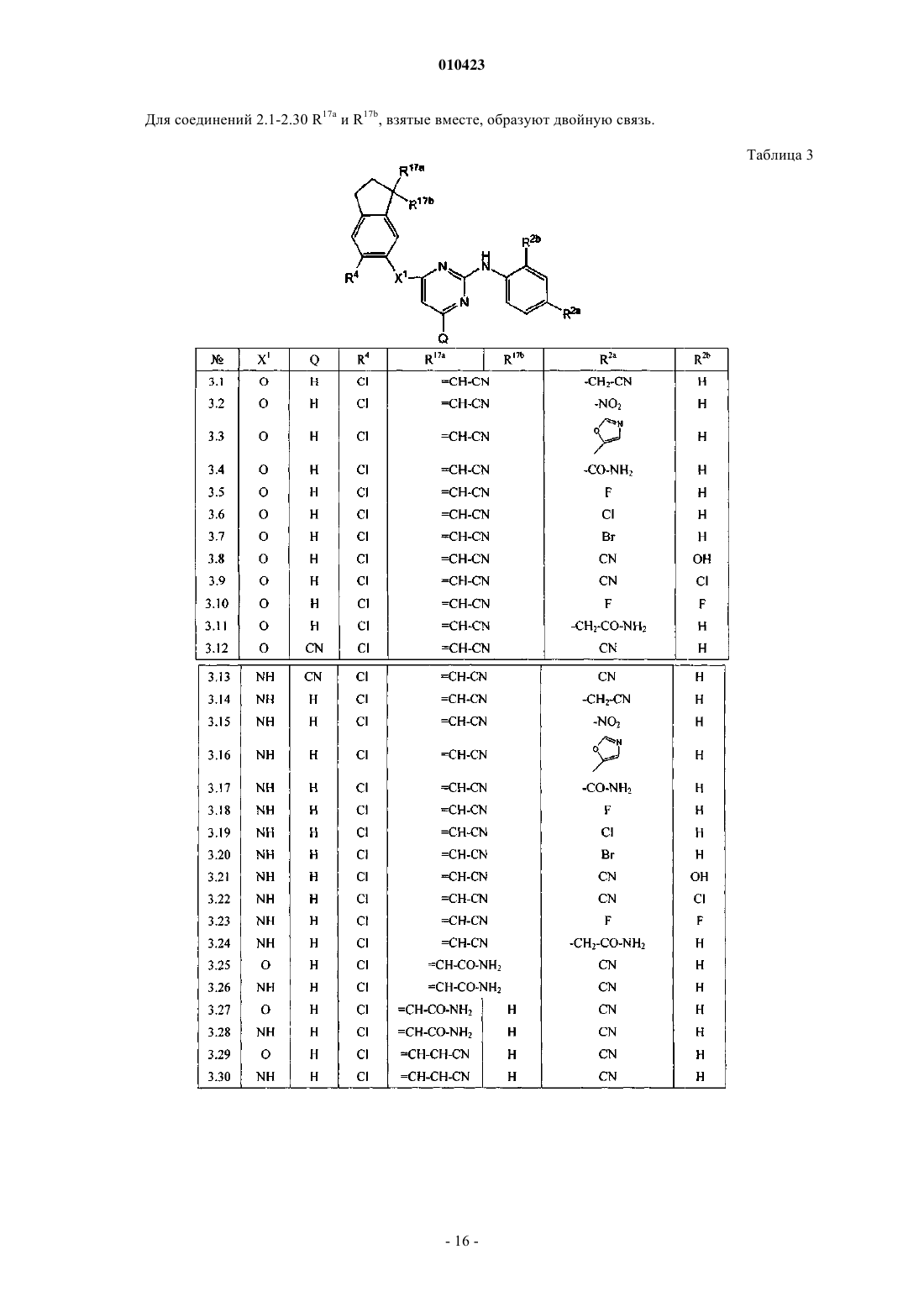
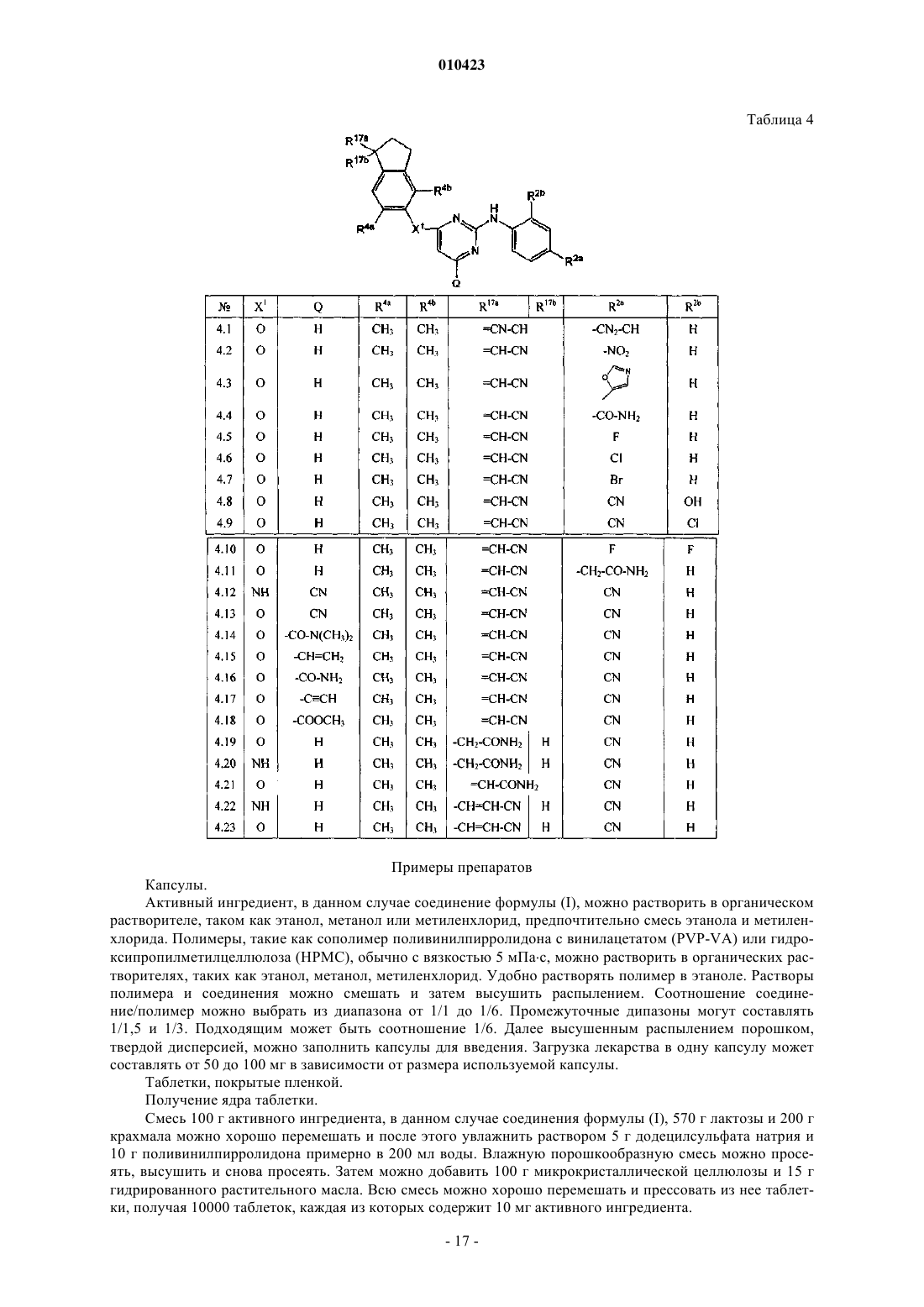
R17, каждый независимо, обозначает циано, галоген, гидрокси, -С(=O)-NR13R14, C1-6алкил, замещенный циано и, если возможно, R17 может также быть присоединен к фрагменту -CH2-CH2-CH2- двойной связью, при этом R17 представляет собой =O, =N-CN, =N-O-CH2-C6H5, =N-O-R7, =CH-CN или =C(CH3)CN.
2. Фармацевтическая композиция, содержащая (а) эффективное количество соединения формулы (I) по п.1 и (b) фармацевтически приемлемый носитель.
3. Продукт, содержащий (а) соединение формулы (I) по п.1 и (b) другое антиретровирусное соединение в виде объединенного препарата для одновременного, раздельного или последовательного применения при лечении или профилактике ВИЧ-инфекции.
4. Способ получения соединения формулы (I) по п.1, отличающийся тем, что включает взаимодействие индана формулы (а-1) с реагентом (а-2)
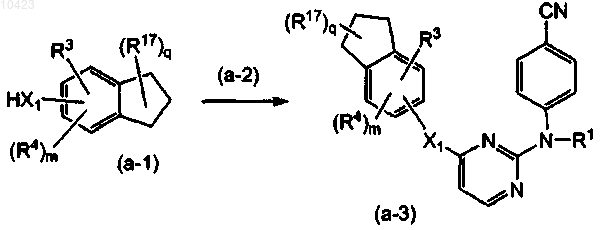
причем реагент (а-2) имеет общую формулу
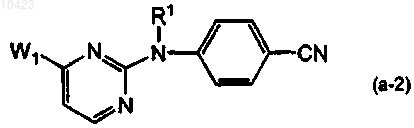
где заместители имеют значения, определенные в п.1, W1 означает уходящую группу, и получение его фармацевтически приемлемой аддитивной соли или стереохимически изомерной формы.
Текст
010423 Настоящее изобретение относится к производным пиримидина, обладающим свойствами ингибирования репликации ВИЧ (вируса иммунодефицита человека). Настоящее изобретение также относится к способам их получения и содержащих их фармацевтических композиций. Настоящее изобретение также относится к применению указанных производных для получения лекарственного средства для профилактики или лечения ВИЧ-инфекции. Целью настоящего изобретения является обеспечение специфических новых серий производных пиримидина, обладающих свойствами ингибирования репликации ВИЧ. WO 99/50250, WO 00/27825 иWO 01/85700 раскрывают некоторые замещенные аминопиримидины, и WO 99/50256 и ЕР-834507 раскрывают аминотриазины, обладающие свойствами ингибирования репликации ВИЧ. Соединения данного изобретения отличаются от соединений известного уровня техники по структуре, фармакологической активности и/или фармакологической эффективности. Обнаружено, что соединения данного изобретения действуют благоприятным образом не только в смысле их способности ингибировать репликацию вируса иммунодефицита человека (ВИЧ), но также обладают повышенной способностью ингибировать репликацию мутантных штаммов, в частности, штаммов, которые приобрели устойчивость к коммерчески доступным лекарствам (так называемых лекарственно-устойчивых или мультилекарственно-устойчивых ВИЧ-штаммов). Таким образом, в одном аспекте настоящее изобретение относится к соединенинию формулы его N-оксиду, фармацевтически приемлемой аддитивной соли или стереохимически изомерной формы,где m равно 0, 1;R17, каждый независимо, обозначает циано, галоген, гидрокси, -С(=O)-NR13R14, C1-6 алкил, замещенный циано и, если возможно, R17 может также быть присоединен к фрагменту -СН 2-СН 2-СН 2- двойной связью, при этом R17 представляет собой =O, =N-CN, =N-O-CH2-C6H5, =N-O-R7, =CH-CN или=C(CH3)CN. Термин С 1-4 алкил, используемый здесь выше и далее для обозначения группы или части группы,определяет линейные или разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 4 атомов углерода, такие как метил, этил, пропил, 1-метилэтил, бутил; термин C1-6 алкил, используемый для обозначения группы или части группы, определяет линейные или разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 6 атомов углерода, такие как группы, определенные для С 1-4 алкила, и пентил, гексил, 2-метилбутил и подобные; термин С 2-6 алкил, используемый для обозначения группы или части группы, определяет линейные или разветвленные насыщенные углеводородные радикалы, имеющие от 2 до 6 атомов углерода, такие как этил, пропил, 1-метилэтил, бутил, пентил, гексил, 2 метилбутил и подобные; С 1-4 алкандиил определяет линейные или разветвленные насыщенные двухвалентные углеводородные радикалы, имеющие от 1 до 4 атомов углерода, такие как метилен, 1,2-этандиил или 1,2-этилиден, 1,3-пропандиил или 1,3-пропилиден, 1,4-бутандиил или 1,4-бутилиден и подобные; С 3-7 циклоалкил является общим обозначением циклопропила, циклобутила, циклопентила, циклогексила и циклогептила; С 2-6 алкенил определяет линейные и разветвленные углеводородные радикалы,имеющие от 2 до 6 атомов углерода и содержащие двойную связь, такие как этенил, пропенил, бутенил,пентенил, гексенил и подобные; С 2-6 алкинил определяет линейные и разветвленные углеводородные радикалы, имеющие от 2 до 6 атомов углерода и содержащие тройную связь, такие как этинил, пропинил, бутинил, пентинил, гексинил и подобные. Используемая здесь выше группа, обозначенная (=O), образует карбонильный фрагмент, если присоединена к атому углерода, сульфоксидный фрагмент, если присоединена к атому серы, и сульфонильный фрагмент, если две указанных группы присоединены к атому серы. Термин галоген является общим для фтора, хлора, брома и йода. Линии, нарисованные от заместителей в циклические системы, указывают, что связь может осуществляться по любому из подходящих кольцевых атомов. Для терапевтического применения соли соединений формулы (I) представляют собой такие соединения, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований,которые не являются фармацевтически приемлемыми, также можно применять, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, являются они фармацевтически приемлемыми или нет, включены в сбласть настоящего изобретения.-1 010423 Подразумевают, что фармацевтически приемлемые аддитивные соли, которые упоминаются здесь выше, содержат терапевтически активные нетоксические формы аддитивных солей кислот, которые способны образовывать соединения формулы (I). Последние обычно можно получить, обрабатывая основную форму такими подходящими кислотами, как неорганические кислоты, например галогенводородные кислоты, например хлористо-водородная, бромисто-водородная и подобные; серная кислота; азотная кислота; фосфорная кислота и подобные; или органические кислоты, например уксусная, пропионовая,гидроксиуксусная, 2-гидроксипропионовая, 2-оксопропионовая, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, 2-гидрокси-1,2,3-пропантрикарбоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, 4-метилбензолсульфоновая, циклогексансульфамовая, 2-гидроксибензойная, 4-амино-2-гидроксибензойная и подобные кислоты. Солевую форму можно превратить обратно в форму свободного основания обработкой щелочью. Соединения формулы (I), содержащие кислотные протоны, можно превратить в их терапевтически активные нетоксические формы аддитивных солей металлов или аминов обработкой подходящими органическими и неорганическими основаниями. Подходящие формы солей оснований включают, например,соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и подобные, соли с органическими основаниями, например с первичными, вторичными и третичными алифатическими и ароматическими аминами, такие как соли метиламина, этиламина, пропиламина, изопропиламина, четырех изомеров бутиламина, диметиламина, диэтиламина, диэтаноламина,дипропиламина, диизопропиламина, ди-н-бутиламина, пирролидина, пиперидина, морфолина, триметиламина, триэтиламина, трипропиламина, гуинуклидина, пиридина, хинолина и изохинолина, бензатина,N-метил-D-глюкамина, 2-амино-2-(гидроксиметил)-1,3-пропандиола, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и подобные. Солевые формы можно превратить обратно в форму свободной кислоты обработкой кислотой. Выражение аддитивная соль включает также гидраты и формы с присоединенным растворителем(сольваты), которые способны образовывать соединения формулы (I). Примерами таких форм являются,например, гидраты, алкоголяты и подобные. Понятно, что некоторые соединения формулы (I) и их N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы могут содержать один или более хиральных центров и существуют как стереохимически изомерные формы. Используемое здесь выше выражение "стереохимически изомерные формы" определяет все возможные стереоизомерные формы, которые могут иметь соединения формулы (I) и их N-оксиды, аддитивные соли, четвертичные амины или физиологически функциональные производные. Пока не упомянуто или не указано по-другому, химическое изображение соединений обозначает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры, а также каждая из индивидуальных изомерных форм формулы (I) и их N-оксиды, соли, сольваты или четвертичные амины, по существу, не содержат других изомеров, то есть ассоциированы с другими изомерами в количестве менее 10%, предпочтительно менее 5%, в частности менее 2% и наиболее предпочтительно менее 1%. Таким образом, если соединение формулы (I) описано, например, как (Е), это означает, что данное соединение, по существу, не содержит изомера (Z). В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь цис- или трансконфигурацию. Соединения, содержащие двойные связи, могут иметь Е (entgegen) или Z (zusammen)-стереохимию по указанной двойной связи. Обозначения цис, транс, R, S, Е и Z хорошо известны специалистам в данной области. Стереохимически изомерные формы соединений формулы (I), очевидно, следует включить в область данного изобретения. Некоторые соединения формулы (I) могут также существовать в виде таутомерных форм. Такие формы, хотя и не указаны точно в приведенной выше формуле, следует включить в область настоящего изобретения. Считается, что выражение соединения формулы (I), где бы ни использовалось здесь далее, включает их N-оксиды, соли, четвертичные амины и стереохимически изомерные формы. Специальный интерес представляют соединения формулы (I), которые являются стереохимически чистыми. Особый интерес представляют подгруппы соединений формулы (I), в которых m равно 1. Еще особые группы соединений составляют также соединения формулы (I), для которых применимо одно или более из следующих условий:(а-2) X1 связан с одним из атомов углерода в мета-положении к атомам углерода, общим для обоих колец бициклической системы, с которой связан X1;(а-4) R3 обозначает водород или C1-6 алкил. Также интересную группу составляют соединения формулы (I), для которых R4 обозначает C1-6 алкил, в особенности метил; галоген.-2 010423 Особый интерес представляют соединения формулы (I) или любые из определенных здесь подгрупп, в которых R4 обозначает галоген. Также особый интерес представляют соединения формулы (I) или любые из определенных здесь подгрупп, в которых R17 обозначает галоген, циано. Другую интересную группу соединений представляют соединения формулы (I) или любые из определенных здесь подгрупп, в которых R17 обозначает оксо, C1-6 алкил, замещенный циано, =N-O-СН 2 алкилфенил, оксо, C1-6 алкил, замещенный циано. Дополнительные подгруппы соединений в соответствии с настоящим изобретением составляют соединения формулы (I) или любые из определенных здесь подгрупп соединений формулы (I), в которых один или более C1-6 алкилов ограничены С 1-4 алкилами, один или более С 1-4 алкилов ограничены C1-2 алкилами. Синтез. Соединения формулы (I) можно получить рядом способов, некоторые из них объяснены здесь далее более подробно. Соединения формулы (I) обычно можно получить взаимодействием индана (а-1) с производным пиримидина (а-2). Группы HX1 и W1 выбраны таким образом, что образуется связывающий фрагмент X1. В частности, W1 является удобной уходящей группой и Х 1 обозначает гетероатом. Примерами удобных уходящих групп в (а-2) являются галогены, в частности хлор и бром, тозилат, мезилат, трифлат и подобные группы. Для получения соединений формулы (I), в которых X1 отличен от гетероатома, -W1 и-X1H могут иметь другие значения, которые указаны в общих чертах здесь далее. Превращение (а-1) при помощи (а-2) в (а-3) на приведенной выше схеме является особенно подходящим в случае, когда Х 1 обозначает -О-. Указанное выше взаимодействие обычно осуществляют в присутствии подходящего растворителя. Подходящими растворителями являются, например, ацетонитрил, спирты, такие как, например, этанол,2-пропанол, этиленгликоль, пропиленгликоль, полярные апротонные растворители, такие как N,Nдиметилформамид; N,N-диметилацетамид, диметилсульфоксид, 1-метил-2-пирролидинон, [bmim]PF5; простые эфиры, такие как 1,4-диоксан, монометиловый эфир пропиленгликоля. В случае, когда X1 обозначает -NH-, взаимодействие (а-1) с реагентом (а-2) обычно проводят в нейтральной среде или в кислой среде, что предпочтительно обычно при повышенных температурах и при перемешивании. Кислую среду можно получить, добавляя некоторое количество подходящей кислоты или используя кислотные растворители, например хлористо-водородную кислоту, растворенную в спирте, таком как 1- или 2-пропанол, или в ацетонитриле. Указанное выше взаимодействие можно проводить в присутствии подходящего растворителя. Подходящими растворителями являются, например, ацетонитрил, спирт, такой как, например, этанол, 2 пропанол, 2-пропанол-HCl; N,N-диметилформамид; N,N-диметилацетамид, 1-метил-2-пирролидинон; 1,4-диоксан, монометиловый эфир пропиленгликоля. Предпочтительным растворителем является 2 пропанол, 6 н. HCl в 2-пропаноле или ацетонитрил, в особенности ацетонитрил. Необязательно может присутствовать гидрид натрия. В случае, когда X1 обозначает -O-, взаимодействие обычно проводят следующим образом. Сначала осуществляют взаимодйствие промежуточного продукта (а-1) с гидридами в органическом растворителе при перемешивании и комнатной температуре. После этого добавляют к смеси растворитель, такой какN-метилпирролидинон, диметилацетамид или диметилформамид, и затем добавляют реагент (а-2). Обычно реакционную смесь перемешивают в течение ночи при повышенных температурах, получая соединение (а-3). Соединения формулы (а-3), имеющие заместитель R17, который обозначает оксогруппу (=O) (представлено структурой (а-3-1 можно использовать в качестве исходного вещества для получения соединения формулы (I), имеющего заместитель R17, который представляет собой заместитель =N-R18, в котором =N-R18 является =NH, =N-R15, =N-R7, =N-O-R15, =N-O-R7, как определено выше. В этом пути пре-3 010423 вращения осуществляют взаимодействие промежуточного продукта (а-3-1) с реагентом (а-7) (реагент (а 7) имеет общую формулу NH3, NH2-R15, NH2-R7, NH2-O-R15, NH2-O-R7, в частности арил-С 1-6 алкил-ОNH2) при повышенных температурах в спиртовом растворителе в присутствии основания, получая соединение формулы (а-8). Аналогично, соединения формулы (а-3-1) можно использовать в качестве исходного вещества для получения соединения формулы (I), имеющего заместитель R17, который является заместителем =Х, в котором =Х представляет собой =СН 2, =СН-С(=O)-NR13R14, =CH-R7 или =CH-R15, как определено выше. Далее осуществляют взаимодействие промежуточного продукта (а-3) с реагентом (а-4) по реакции Виттига или реакции Виттига-Хорнера. В первом случае реагент (а-4) является реагентом Виттига, таким как трифенилфосфонийилид, во втором случае реагентом Виттига-Хорнера, в частности фосфонатом, таким как, например, реагент формулы ди(C1-6 алкилокси)-Р(=O)-Х 4, в котором Х 4 является заместителем R17,который может быть связан с циклом через двойную связь (экзо-двойную связь). Реакцию ВиттигаХорнера обычно проводят в присутствии основания, предпочтительно сильного основания, в апротонном органическом растворителе при комнатной температуре. Завершение реакции требует достаточного времени, обычно в течение ночи, что дает соединение (а-5). Далее можно провести взаимодействие данного последнего соединения в спиртовом растворителе и восстановительных условиях для получения соединения формулы (а-6). Оба превращения изображены на следующей реакционной схеме: Оксогруппа в соединениях (а-3-1) может также находиться в других положениях в кольце, имеющем заместитель(и) R17, преобразование аналогичного типа можно осуществить с получением в результате позиционных изомеров (а-8), (а-5) и (а-6). Соединения формулы (I) можно также получить, как изображено на реакционной схеме здесь ниже.-4 010423 Проводят взаимодействие индана формулы (a-1) с пиримидином (а-9), в котором заместители имеют определенные здесь значения и W1 является удобной уходящей группой, такой как, например, галоген, трифлат, тозилат, метилсульфонил и подобные, получая промежуточный продукт (а-10). Данное взаимодействие можно провести аналогично тому, которое описано выше для взаимодействия (а-1) с (а 2), в частности, для различных возможностей линкера -X1-. Если необходимо, группу W1, которая не участвует в данном взаимодействии, можно заменить предшественником уходящей группы, таким как ОНфункциональность, которая на определенной стадии реакционной методики превращается в уходящую группу, например, превращением ОН-группы в галоген или взаимодействием с подходящим реагентом,таким как POCl3, тозилхлорид, мезилхлорид и подобные. Конечные продукты (I) можно получить из данных исходных веществ (а-10) при взаимодействии с аминозамещенным ароматическим соединением (а-11) по реакции типа арилирования. Подходящими растворителями для взаимодействия (а-1) с (а-9) и (а-10) с (а-11) являются простые эфиры, например 1,4-диоксан, ТГФ, спирты, этанол, пропанол, бутанол, этиленгликоль, пропиленгликоль, монометиловый эфир пропиленгликоля, апротонные растворители, такие как ацетонитрил, ДМФА,ДМА, 1-метил-2-пирролидинон и подобные. Если необходимо, можно добавить основание. Подходящими для данного взаимодействия основаниями являются, например, ацетат натрия, ацетат калия, N,Nдиэтилэтанамин, гидрокарбонат натрия, гидроксид натрия и подобные. В данном и последующих получениях продукты взаимодействия можно выделить из реакционной среды и, если необходимо, дополнительно очистить согласно обычной методологии, известной в данной области, такой как, например, экстракция, кристаллизация, перегонка, растирание и хроматография. Соединения формулы (I) можно также получить превращением соединения формулы (I) в каждое другое соединение в соответствии с известными в данной области реакциями преобразования групп. Некоторые из соединений формулы (I) и некоторые из промежуточных продуктов в настоящем изобретении могут содержать асимметричный атом углерода. Применяя известные в данной области методики, можно получить стереохимически чистые изомерные формы указанных соединений и указанных промежуточных продуктов. Например, диастереоизомеры можно разделить физическими способами,такими как селективная кристаллизация или хроматографические методики, например, распределение в противотоке, жидкостная хроматография и подобные способы. Энантиомеры можно получить из рацемических смесей первоначальным превращением указанных рацемических смесей в смеси диастереомерных солей или соединений при помощи подходящих агентов для разделения, таких как, например,хиральные кислоты; последующим физическим разделением указанных смесей диастереомерных солей или соединений, например, селективной кристаллизацией или хроматографическими методами, например жидкостной хроматографией и подобными способами; и окончательным превращением указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Стереохимически чистые изомерные формы можно также получить из стереохимически чистых изомерных форм подходящих промежуточных продуктов и исходных веществ при условии, что происходящие реакции протекают стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных продуктов включает жидкостную хроматографию, в частности жидкостную хроматографию с применением хиральной неподвижной фазы. Некоторые из промежуточных продуктов и исходных веществ являются известными соединениями и могут быть коммерчески доступны или могут быть получены по известным в данной области методикам, или некоторые из соединений формулы (I) или описанных промежуточных продуктов могут быть получены по методикам, описанным в WO 99/50250 и WO 00/27825. Промежуточные продукты формулы (а-2), где W1 обозначает уходящую группу, можно получить взаимодействием промежуточного продукта формулы (b-1) с подходящим галогенирующим агентом,например N-бромсукцинимидом, N-хлорсукцинимидом, PCl3, PCl5 или с подходящим агентом введения уходящей группы формулы (b-2), в которой W1 представляет уходящую группу и L представляет часть агента введения уходящей группы, такого как, например, POCl3, трифлилхлорид, тозилхлорид, мезилхлорид и подобные. Данное взаимодействие обычно проводят в подходящем растворителе, если требуется, в присутствии подходящего основания, например ацетата натрия, ацетата калия, N,N-диэтилэтанамина, гидрокарбоната натрия, гидроксида натрия и подобных. Подходящими растворителями в указанном выше взаимодействии являются, например, ацетонитрил, N,N-диметилацетамид, ионные жидкости, например [bmim]PF6, N,N-диметилформамид, вода, тетрагидрофуран, диметилсульфоксид, 1-метил-2-пирролидинон и подобные.-5 010423 Соединения формулы (I), которые получены в описанных здесь выше способах, можно синтезировать в виде смеси стереоизомерных форм, в частности в виде рацемических смесей энантиомеров, которые можно отделить друг от друга известными в данной области методиками разделения. Рацемические соединения формулы (I) можно превратить в соответствующие диастереомерные формы солей взаимодействием с подходящей хиральной кислотой. Затем указанные диастереомерные формы солей делят,например, методом селективной или фракционной кристаллизации и выделяют из них энантиомеры щелочью. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы можно также получить из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ при условии, что взаимодействие происходит стереоспецифически. Если требуется определенный стереоизомер, предпочтительно синтезировать указанное соединение стереоспецифическими способами получения. Данные способы преимущественно используют энантиомерно чистые исходные вещества. Специалистам в данной области понятно, что в описанных выше способах может потребоваться блокировка функциональных групп промежуточных соединений защитными группами. Функциональные группы, которые желательно защищать, включают гидрокси, амино и карбоксильные группы. Подходящие защитные группы для гидроксигруппы включают триалкилсилильные группы (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), бензил и тетрагидропиранил. Подходящие защитные группы для аминогруппы включают трет-бутилоксикарбонил или бензилоксикарбонил. Подходящие защитные группы для карбокислотной группы включают C1-6 алкил или бензиловые сложные эфиры. Защита и удаление защиты с функциональных групп может происходить до или после реакционной стадии. Применение защитных групп полно описано в работах "Protective Groups in Organic Chemistry", edited by J.W.F. McOmie, Plenum Press (1973) и "Protective Groups in Organic Synthesis" 2nd edition, T.W.GreeneP.G.M. Wutz, Wiley Interscience (1991). Соединения формулы (I) демонстрируют антиретровирусные свойства (свойства ингибирования обратной транскриптазы), в частности, против вируса иммунодефицита человека (ВИЧ), который является этиологическим агентом синдрома приобретенного иммунодефицита (СПИД) у людей. ВИЧ предпочтительно инфицирует клетки Т-4 человека и разрушает их или изменяет их нормальное функционирование, в частности координацию иммунной системы. В результате инфицированный пациент всегда имеет пониженное количество клеток Т-4, которые, кроме того, ведут себя аномально. Следовательно, система иммунологической защиты не способна бороться с инфекциями и новообразованиями, и обычно ВИЧинфицированный субъект умирает от условно-патогенных инфекций, таких как пневмония, или от рака. Другие состояния, связанные с ВИЧ-инфицированием, включают тромбоцитопению, саркому Капоши и инфекцию центральной нервной системы, характеризующуюся прогрессирующей демиелинизацией, результатом которой является слабоумие и такие симптомы, как прогрессирующая дизартрия, атаксия и дезориентация. ВИЧ-инфекция связана также с периферической невропатией, прогрессирующей генерализованной лимфаденопатией (PGL) и комплексом, связанным со СПИДом (ARC). Настоящие соединения также демонстрируют активность против (мульти)лекарственно-устойчивых штаммов ВИЧ, в частности (мульти)лекарственно-устойчивых штаммов ВИЧ-1, конкретнее, настоящие соединения демонстрируют активность против штаммов ВИЧ, в особенности штаммов ВИЧ-1, которые приобретают устойчивость к одному или нескольким известным в данной области ненуклеозидным ингибиторам обратной транскриптазы. Известными в данной области ненуклеозидными ингибиторами обратной транскриптазы являются соединения, отличные от соединений настоящего изобретения и, в частности, коммерческие ненуклеозидные ингибиторы обратной транскриптазы. Настоящие соединения также обладают слабым (или не обладают) сродством связывания с человеческим -1 кислотным гликопротеином; человеческий -1 кислотный гликопротеин не влияет или только слабо влияет на анти-ВИЧ активность настоящих соединений. Благодаря своим антивирусным свойствам, в частности своим анти-ВИЧ свойствам, в особенности своей анти-ВИЧ-1 активности, соединения формулы (I), их N-оксиды, фармацевтически приемлемые аддитивные соли, четвертичные амины и стереохимически изомерные формы полезны при лечении индивидуумов, инфицированных ВИЧ, и для профилактики данных инфекций. Вообще, соединения настоящего изобретения могут быть полезны при лечении теплокровных животных, инфицированных вирусами, наличие которых опосредовано или зависит от фермента обратной транскриптазы. Состояния,для которых можно провести профилактику или лечение соединениями настоящего изобретения, в особенности состояния, связанные с ВИЧ и другими патогенными ретровирусами, включают СПИД, СПИДсвязанный комплекс (ARC), прогрессирующую генерализованную лимфаденопатию (PGL), а также хронические заболевания центральной нервной системы, вызванные ретровирусами, такие как, например,ВИЧ-опосредованное слабоумие и множественный склероз. Таким образом, еще в одном аспекте соединения настоящего изобретения, включая соединения лю-6 010423 бой определенной здесь подгруппы, можно применять в качестве лекарственных средств, в частности,против упоминаемых выше состояний. Указанное применение в качестве лекарственного средства или способ лечения включает введение ВИЧ-инфицированным субъектам некоторого количества соединения, эффективного для борьбы с состояниями, связанными с ВИЧ и другими патогенными ретровирусами, в особенности ВИЧ-1. В частности, соединения формулы (I) можно применять в производстве медикамента для лечения или профилактики ВИЧ-инфекций. С точки зрения фармакологических свойств соединений формулы (I), обеспечен способ лечения теплокровных животных, включая людей, страдающих от вирусных инфекций, в особенности ВИЧ инфекций, или способ профилактики теплокровных животных, включая людей. Указанный способ включает введение, предпочтительно пероральное введение, эффективного количества соединения формулы (I),его N-оксидной формы, фармацевтически приемлемой аддитивной соли, четвертичного амина или возможной стереоизомерной формы теплокровным животным, включая людей. В другом аспекте настоящее изобретение также касается фармацевтических композиций, содержащих терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или разбавитель. Еще в одном аспекте обеспечен способ получения описанной здесь фармацевтической композиции, включающий смешивание соединения формулы (I) с подходящим фармацевтически приемлемым носителем или разбавителем. Соединения настоящего изобретения или соединения любой их подгруппы можно приготовить в виде различных фармацевтических форм для целей введения. В качестве подходящих композиций можно перечислить все композиции, обычно применяемые для системного введения лекарств. Для приготовления фармацевтических композиций данного изобретения эффективное количество конкретного соединения, необязательно в виде аддитивной соли, объединяют в качестве активного ингредиента в однородной смеси с фармацевтически приемлемым носителем, указанный носитель может иметь широкое разнообразие форм в зависимости от формы препарата, предназначенной для введения. Данные фармацевтические композиции желательны в виде единичной дозированной формы, подходящей, в частности, для введения перорально, ректально, подкожно или парентеральной инъекцией. Например, при получении композиций в виде дозированной формы для перорального введения можно использовать любую из обычных фармацевтических сред, такую как, например, вода, гликоли, масла, спирты и подобные, в случае жидких препаратов для перорального приема, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, лубриканты, связующие, разрыхлители и подобные в случае порошков, пилюль, капсул и таблеток. Из-за простоты приема таблетки и капсулы представляют собой наиболее полезные единичные дозированные формы для перорального приема,в которых, очевидно, используют твердые фармацевтические носители. Носитель для парентеральных композиций обычно содержит стерильную воду, по меньшей мере, большую часть, хотя могут быть включены другие ингредиенты, например, способствующие растворению. Например, можно получить инъекционно вводимые растворы, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Можно также получить инъекционно вводимые суспензии, в данном случае можно применять подходящие жидкие носители, суспендирующие агенты и подобные. Включены также твердые препараты, которые предназначены для превращения в жидкие препараты непосредственно перед использованием. В композициях, подходящих для введения подкожно, носитель необязательно содержит агент для усиления проницаемости и/или подходящий смачивающий агент, необязательно вместе с подходящими добавками любой природы при малом содержании, данные добавки не оказывают существенного вредного влияния на кожу. Указанные добавки могут облегчить введение в кожу и/или могут быть полезны для получения желательных композиций. Данные композиции можно применять различными способами, например, в виде трансдермального пластыря,нанесенного пятна (spot-on), мази. Соединения настоящего изобретения можно также вводить посредством ингаляции или инсуффляции, применяя способы и препараты, используемые в данной области для введения данным способом. Таким образом, вообще соединения настоящего изобретения можно вводить в легкие в виде раствора,суспензии или сухого порошка. Любая система, разработанная для доставки растворов, суспензий или сухих порошков перорально или посредством носовой ингаляции или инсуффляции, является подходящей для введения настоящих соединений. Для повышения растворимости соединений формулы (I) можно включить в композиции подходящие ингредиенты, например циклодекстрины. Подходящими циклодекстринами являются -, -, циклодекстрины или их простые эфиры и смешанные простые эфиры, в которых одна или более гидроксигрупп ангидроглюкозных звеньев циклодекстрина являются замещенными С 1-6 алкилом, конкретно метилом, этилом или изопропилом, например статистически метилированный -CD; гидроксиС 1-6 алкил,конкретно гидроксиэтил, гидроксипропил или гидроксибутил; карбоксиС 1-6 алкил, конкретно, карбоксиметил или карбоксиэтил; C1-6 алкилкарбонил, конкретно ацетил. Особенно заслуживающими внимания в качестве комплексантов и/или растворителей являются -CD, статистически метилированный -CD, 2,6 диметилCD, 2-гидроксиэтилCD, 2-гидроксиэтилCD, 2-гидроксипропилCD и (2-карбокси-7 010423 метокси)пропилCD и, в частности, 2-гидроксипропилCD (2-HPCD). Выражение смешанный эфир обозначает производные циклодекстрина, в которых по меньшей мере две гидроксигруппы циклодекстрина этерифицированы различными группами, такими как, например, гидроксипропил и гидроксиэтил. В качестве меры среднего числа молей алкоксиединиц на моль ангидроглюкозы используют величину среднего молярного замещения (M.S.). Средняя степень замещения (D.S.) обозначает среднее количество замещенных гидроксилов на единицу ангидроглюкозы. Значения M.S. и D.S. можно определить при помощи различных аналитических методик, таких как ядерный магнитный резонанс (ЯМР), массспектрометрия (МС) и инфракрасная спектроскопия (ИК). В зависимости от используемой методики можно получить несколько различающиеся значения для одного данного производного циклодекстрина. Предпочтителен диапазон M.S. от 0,125 до 10 и диапазон D.S. от 0,125 до 3, измеренные методом массспектрометрии. Другие подходящие композиции для перорального или ректального введения содержат частицы,состоящие из твердой дисперсии, содержащей соединение формулы (I) и один или более подходящих фармацевтически приемлемых водорастворимых полимеров. Используемое здесь далее выражение твердая дисперсия определяет систему в твердом состоянии (в противоположность жидкому или газообразному состоянию), содержащую по меньшей мере два компонента, в данном случае соединение формулы (I) и водорастворимый полимер, в котором один компонент диспергирован более или менее равномерно в другом компоненте или компонентах (в случае,когда включены дополнительные фармацевтически приемлемые агенты, способствующие получению препарата, обычно известные в данной области, такие как пластификаторы, консерванты и подобные). Если указанная дисперсия компонентов такова, что система является химически и физически однородной или гомогенной по всему объему или состоит из одной фазы, как определяется в термодинамике, то такую твердую дисперсию называют твердым раствором. Твердые растворы являются предпочтительными физическими системами, так как компоненты в них обычно легко биологически доступны для организмов, в которые их вводят. Данное преимущество, вероятно, можно объяснить легкостью, с которой указанные твердые растворы могут образовывать жидкие растворы при контакте с жидкой средой, такой как желудочно-кишечные соки. Легкость растворения может быть обусловлена, по меньшей мере, частично тем фактом, что энергия, необходимая для растворения компонентов из твердого раствора, меньше, чем энергия, необходимая для растворения компонентов из кристаллической или микрокристаллической твердой фазы. Выражение "твердая дисперсия" включает также дисперсии, которые являются менее гомогенными по всему объему, чем твердые растворы. Такие дисперсии не являются химически и физически однородными по всему объему или содержат более одной фазы. Например, выражение "твердая дисперсия" касается также системы, имеющей домены или небольшие области, в которых аморфное, микрокристаллическое или кристаллическое соединение формулы (I), или аморфный, микрокристаллический или кристаллический водорастворимый полимер, или оба диспергированы более или менее равномерно в другой фазе, содержащей водорастворимый полимер или соединение формулы (I), или твердом растворе, содержащем соединение формулы (I) и водорастворимый полимер. Указанные домены представляют собой области в твердой дисперсии явно заметные по некоторому физическому признаку, небольшие по размеру и равномерно и статистически распределенные по всему объему твердой дисперсии. Существуют различные способы получения твердых дисперсий, включая экструзию расплава, сушку распылением и выпаривание раствора. Способ выпаривания раствора включает следующие стадии:a) растворение соединения формулы (I) и водорастворимого полимера в подходящем растворителе,необязательно при повышенных температурах;b) нагревание раствора, получаемого в пункте а), необязательно в вакууме, до выпаривания растворителя. Можно также вылить раствор на большую поверхность таким образом, чтобы получить тонкую пленку, и испарить из нее растворитель. В методике сушки распылением два компонента также растворяют в подходящем растворителе и затем распыляют полученный раствор через форсунку сушильной установки с последующим испарением растворителя из полученных капель при повышенных температурах. Предпочтительной методикой получения твердых дисперсий является способ экструзии расплава,включающий следующие стадии:a) смешивание соединения формулы (I) и подходящего водорастворимого полимера,b) необязательное смешивание добавок с полученной таким образом смесью,c) нагревание и соединение полученной таким образом смеси до получения гомогенного расплава,d) продавливание полученного таким образом расплава через одну или несколько форсунок и е) охлаждение данного расплава до его отверждения. Термины "расплав" и "плавление" следует интерпретировать в широком смысле. Данные термины не означают изменение состояния от твердого до жидкого, а могут также касаться перехода в стеклообразное или эластичное состояние, в котором один компонент смеси может быть внедрен более или менее-8 010423 гомогенно в другой. В конкретных случаях один компонент будет плавиться и другой компонент(ы) будет растворяться в расплаве, образуя, таким образом, раствор, который после охлаждения может образовать твердый раствор, обладающий полезными характеристиками растворения. После получения твердых дисперсий, которые описаны здесь выше, полученные продукты можно необязательно размолоть и просеять. Твердый дисперсионный продукт можно размолоть или измельчить до частиц, имеющих размер менее 600 мкм, предпочтительно менее 400 мкм и наиболее предпочтительно менее 125 мкм. Частицы, полученные, как описано здесь выше, можно далее приготовить по обычным методикам в виде фармацевтических дозированных форм, таких как таблетки и капсулы. Понятно, что специалист в данной области способен оптимизировать параметры описанных выше методик получения твердых дисперсий, такие как наиболее подходящий растворитель, рабочая температура, тип используемого аппарата, скорость сушки распылением, скорость прохождения расплава в экструдере. Водорастворимые полимеры в виде частиц представляют собой полимеры, которые имеют кажущуюся вязкость от 1 до 5000 мПас, будучи растворенными при 20 С в водном растворе при 2%(мас./об.), более предпочтительно от 1 до 700 мПас и наиболее предпочтительно от 1 до 100 мПас. Например, подходящие водорастворимые полимеры включают алкилцеллюлозы, гидроксиалкилцеллюлозы,гидроксиалкилалкилцеллюлозы, карбоксиалкилцеллюлозы, соли щелочных металлов и карбоксиалкилцеллюлоз, карбоксиалкилалкилцеллюлозы, сложные эфиры карбоксиалкилцеллюлозы, крахмалы, пектины, производные хитина, ди-, олиго- и полисахариды, такие как трегалоза, альгиновая кислота или ее соли щелочных металлов и аммония, каррагенаны, галактоманнаны, трагакант, агар-агар, гуммиарабик,гуаровая смола и ксантановая смола, полиакриловые кислоты и их соли, полиметакриловые кислоты и их соли, метакрилатные сополимеры, поливиниловый спирт, поливинилпирролидон, сополимеры поливинилпирролидона с винилацетатом, комбинации поливинилового спирта и поливинилпирролидона, полиалкиленоксиды и сополимеры этиленоксида и пропиленоксида. Предпочтительными водорастворимыми полимерами являются гидроксипропилметилцеллюлозы. Также один или более циклодекстринов можно использовать в качестве водорастворимого полимера в получении упоминаемых выше частиц, как раскрыто в WO 97/18839. Указанные циклодекстрины включают фармацевтически приемлемые незамещенные и замещенные циклодекстрины, известные в данной области, более конкретно, -, - или -циклодекстрины или их фармацевтически приемлемые производные. Замещенные циклодекстрины, которые можно использовать для получения описанных выше частиц, включают полимерные простые эфиры, описанные в патенте США 3459731. Кроме того, замещенными циклодекстринами являются простые эфиры, в которых водород одной или нескольких гидроксильных групп циклодекстрина замещен C1-6 алкилом, гидроксиС 1-6 алкилом, карбоксиС 1-6 алкилом или С 1-6 алкилоксикарбонилС 1-6 алкилом или их смешанными простыми эфирами. В частности, такие замещенные циклодекстрины представляют собой простые эфиры, в которых водород одной или нескольких гидроксильных групп циклодекстрина замещен C1-3 алкилом, гидроксиС 2-4 алкилом или карбоксиС 1-2 алкилом или более подробно метилом, этилом, гидроксиэтилом, гидроксипропилом, гидроксибутилом,карбоксиметилом или карбоксиэтилом. Особо применимы простые эфиры -циклодекстринов, например диметилциклодекстрин, который описан в работе Drugs of the Future, Vol. 9, No. 8, p. 577-578, M. Nogradi (1984), и полимерные простые эфиры, например гидроксипропилциклодекстрин и гидроксиэтилциклодекстрин, являющиеся примерами. Таким алкиловым эфиром может быть метиловый эфир со степенью замещения примерно от 0,125 до 3, например примерно от 0,3 до 2. Такой гидроксипропилциклодекстрин может, например, быть получен взаимодействием между -циклодекстрином и пропиленоксидом и иметь значение MS примерно от 0,125 до 10, например примерно от 0,3 до 3. Другой тип замещенных циклодекстринов представляют сульфобутилциклодекстрины. Соотношение соединения формулы (I) и водорастворимого полимера можно изменять в широких пределах. Например, можно применять соотношения от 1/100 до 100/1. Интерес представляют соотношения соединения формулы (I) и циклодекстрина в диапазоне примерно от 1/10 до 10/1. Более интересны соотношения в диапазоне примерно от 1/5 до 5/1. Также может быть удобно готовить препараты соединений формулы (I) в виде наночастиц, которые имеют модификатор поверхности, адсорбированный на их поверхности в количестве, достаточном для сохранения эффективного среднего размера частиц менее 1000 нм. Полагают, что полезные модификаторы поверхности включают соединения, которые физически прилипают к поверхности соединения формулы (I), но не связывают указанное соединение химически. Подходящие модификаторы поверхности предпочтительно могут быть выбраны из известных органических и неорганических фармацевтических наполнителей. Такие наполнители включают различные полимеры, олигомеры с низкой молекулярной массой, природные продукты и ПАВ. Предпочтительные модификаторы поверхности включают неионные и анионные ПАВ.-9 010423 Другой интересный способ получения препарата соединения формулы (I) включает составление фармацевтической композиции, при котором соединения формулы (I) включают в гидрофильные полимеры, и нанесение данной смеси в виде покрывающей пленки на небольшие шарики, получая, таким образом, композицию, которую можно удобно производить и которая подходит для получения фармацевтических дозированных форм для перорального приема. Указанные шарики содержат центральное ядро, округлое или сферическое, покрывающую пленку гидрофильного полимера и соединения формулы (I) и необязательно слой изолирующего покрытия. Материалы, подходящие для применения в качестве ядер в гранулах, являются разнообразными при условии, что указанные материалы фармацевтически приемлемы и имеют подходящие размеры и твердость. Примерами таких материалов являются полимеры, неорганические вещества, органические вещества и полисахариды и их производные. Для простоты введения и единообразия дозировки особенно полезно получать указанные выше фармацевтические композиции в виде единичной дозированной формы. Используемое здесь выражение единичная дозированная форма относится к физически дискретным единицам, удобным в качестве стандартных доз, причем каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное для производства желательного терапевтического эффекта, в ассоциации с необходимым фармацевтическим носителем. Примерами таких стандартных дозированных форм являются таблетки (включая таблетки с насечкой или с покрытием), капсулы, пилюли, пакетики с порошками, облатки, суппозитории, растворы или суспензии для инъекций и подобное и их отдельные множества. Специалисты в области лечения ВИЧ-инфекций могут определить эффективное ежедневное количество по представленным здесь результатам тестов. Вообще, предполагается, что эффективное дневное количество должно составлять от 0,01 до 50 мг/кг массы тела, более предпочтительно от 0,1 до 10 мг/кг массы тела. Подходящим вариантом может быть введение требуемой дозы в виде двух, трех, четырех или более субдоз с подходящими интервалами в течение дня. Указанные субдозы можно приготовить как единичные дозированные формы, например, содержащие от 1 до 1000 мг, и, в частности, от 5 до 200 мг активного ингредиента на стандартную дозированную форму. Точная дозировка и частота введения зависит от конкретного используемого соединения формулы(I), конкретного состояния, подлежащего лечению, тяжести состояния, подлежащего лечению, возраста,веса и общего физического состояния конкретного пациента, а также других лечебных средств, которые может принимать данный пациент, что хорошо известно специалистам в данной области. Более того,очевидно, что указанное эффективное дневное количество можно уменьшить или увеличить в зависимости от реакции подвергаемого лечению пациента и/или в зависимости от оценки лечащего врача, прописывающего соединения данного изобретения. Следовательно, указанные здесь выше диапазоны эффективного ежедневного количества представляют собой только руководство и никоим образом не предназначены для ограничения области или применения данного изобретения. Настоящие соединения формулы (I) можно использовать сами по себе или в комбинации с другими терапевтическими агентами, такими как антивирусные агенты, антибиотики, иммуномодуляторы или вакцины для лечения вирусной инфекции. Их можно также применять сами по себе или в комбинации с другими профилактическими агентами для профилактики вирусной инфекции. Настоящие соединения можно применять в вакцинах и способах защиты людей против вирусной инфекции в течение длительного периода времени. Данные соединения можно применять в таких вакцинах сами по себе или вместе с другими соединениями данного изобретения, или вместе с другими антивирусными агентами способом,согласующимся с обычным применением ингибиторов обратной транскриптазы в вакцинах. Таким образом, настоящие соединения можно объединять с фармацевтически приемлемыми адъювантами, обычно применяемыми в вакцинах, и вводить в профилактически эффективных количествах для защиты людей против ВИЧ-инфекции в течение продолжительного периода времени. Данную комбинацию антивирусного соединения и соединения настоящего изобретения также можно применять в качестве лекарственного средства. Таким образом, настоящее изобретение касается также продукта, содержащего (а) соединение настоящего изобретения и (b) другое антивирусное соединение, как комбинированного препарата для одновременного, раздельного или последовательного применения при профилактике или лечении ретровирусной инфекции, в частности при лечении инфекций мультилекарственно-устойчивыми ретровирусами. Таким образом, для борьбы, профилактики или лечения ВИЧ-инфекций или инфекции и заболевания, связанного с ВИЧ-инфицированием, такого как синдром приобретенного иммунодефицита (СПИД) или связанный со СПИДом комплекс (ARC), соединения данного изобретения можно вводить в виде комбинации, например, совместно с ингибиторами связывания, такими как, например, декстрансульфат, сурамин, полианионы, растворимый CD4, PRO-542, BMS806; ингибиторы плавления, такие как, например, Т 20, Т 1249, RPR 103611, YK-FH312, IC 9564, 5-helix,D-пептид ADS-J1; ингибиторы связывания корецепторов, такие как, например, AMD 3100, AMD-3465,AMD7049, AMD3451 (бициклам), TAK 779, Т-22, ALX40-4C; SHC-C (SCH351125), SHC-D, PRO-140,RPR103611; RT-ингибиторы, такие как, например, фоскарнет и пролекарства; нуклеозиды RTI, такие как,например, AZT, ЗТС, DDC, DDI, D4T, абакавир, FTC, DAPD (амдоксовир), dOTC (ВСН-10652), фозиву- 10010423 дин, DPC 817; нуклеотиды RTI, такие как, например, РМЕА, РМРА (тенофовир); NNRTI, такие как, например, невирапин, делавирдин, эфавиренц, 8 и 9-Cl TIBO (тивирапин), ловирид, ТМС-125, дапивирин,MKC-442, UC 781, UC 782, каправирин, QM96521, GW420867X, DPC 961, DPC963, DPC082, DPC083,ТМС-125, каланолид A, SJ-3366, TSAO, 4"-деаминированный TSAO, MV150, MV026048, PNU-142721; ингибиторы РНКазы Н, такие как, например, SP1093V, PD126338; ингибиторы ТАТ, такие как, например, RO-5-3335, K12, K37; ингибиторы интегразы, такие как, например, L 708906, L 731988, S-1360; ингибиторы протеазы, такие как, например, ампренавир и пролекарство GW908 (фосампренавир), ритонавир, нелфинавир, саквинавир, индинавир, лопинавир, палинавир, BMS 186316, атазанавир, DPC 681, DPC 684, типранавир, AG1776, мозенавир, DMP-323, GS3333, KNI-413, KNI-272, L754394, L756425, LG71350, PD161374, PD173606, PD177298, PD178390, PD178392, PNU 140135, ТМС-114, маслиновая кислота, U-140690; ингибиторы гликозилирования, такие как, например, кастаноспермин, дезоксиноджиримицин; ингибиторы встраивания CGP64222. При введении соединения настоящего изобретения с другими антивирусными агентами, которые нацелены на различные события в вирусном жизненном цикле, терапевтическое действие данных соединений может быть усилено. Комбинационные терапии, которые описаны выше, вызывают синергический эффект в ингибировании ВИЧ-репликации, так как каждый компонент данной комбинации действует на различные сайты ВИЧ-репликации. Применение таких комбинаций может снизить дозировку данного обычного антиретровирусного агента, которая потребовалась бы для желательного терапевтического или профилактического эффекта, по сравнению с применением данного агента при монотерапии. Данные комбинации могут уменьшить или исключить побочные эффекты обычной антиретровирусной терапии с применением одного агента, не влияя на антивирусную активность данных агентов. Данные комбинации снижают возможность сопротивления терапии с применением одного агента, уменьшая при этом до минимума связанную с ним токсичность. Данные комбинации могут также повышать эффективность общеизвестного агента, не повышая связанную с ним токсичность. Соединения настоящего изобретения можно также вводить в комбинации с иммуномодуляторными агентами, такими как левамизол, бропиримин, антиантитела -интерферона человека, -интерферон,интерлейкин 2, метионин энкефалин, диэтилдитиокарбамат, фактор некроза опухолей, налтрексон и подобные; антибиотиками, такими как пентамидинизетиорат и подобные; холинергическими агентами, такими как такрин, ривастигмин, донепезил, галантамин и подобные; блокаторами NMDA-каналов, такими как мемантин, для профилактики или борьбы с инфекцией и заболеванием или симптомами заболевания,связанного с ВИЧ-инфекциями, такого как СПИД и ARC, например слабоумия. Соединение формулы (I) можно также объединить с другим соединением формулы (I). Хотя настоящее изобретение фокусируется на применении настоящих соединений для профилактики или лечения ВИЧ-инфекций, настоящие соединения можно также использовать как ингибирующие агенты для других вирусов, которые зависят от аналогичных обратных транскриптаз в течение обязательных событий в их жизненном цикле. Примеры Следующие примеры предназначены для иллюстрации настоящего изобретения. Здесь далее ДМФА обозначает N,N-диметилформамид, ДИПЭ обозначает диизопропиловый эфир,ТГФ обозначает тетрагидрофуран, ДМСО обозначает диметилсульфоксид, "EtOAc" обозначает этилацетат. Примеры 1-12. Синтез соединений 1.10, 1.11, 1.18 и 1.9. Пример 1. Получение промежуточного продукта 1b.N-Хлорсукцинимид (0,025 моль) добавляют частями к смеси 5-гидрокси-1-инданона 1 а (0,022 моль) в ацетонитриле (60 мл). Смесь перемешивают и кипятят с обратным холодильником в течение ночи. Добавляют Н 2 О и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат MgSO4, фильтруют и выпаривают. Остаток (6 г) очищают методом колоночной хроматографии на силикагеле (элюент: циклогексан/EtOAc 60/40; 15-40 мкм). Две фракции собирают и выпаривают, получая 2,2 г Fl и 1,3 г исходного вещества. Fl кристаллизуют из простого диизопропилового эфира. Осадок отфильтровывают и сушат,получая 0,9 г промежуточного продукта 1b (22%) (температура плавления: 212 С). Пример 2. Получение соединения 1.10. Гидрид натрия (60% в масле) (0,0191 моль) добавляют частями к смеси промежуточного продукта 1 а (0,0183 моль) в 1,4-диоксане (25 мл). Смесь перемешивают при комнатной температуре в течение 10 мин, после чего медленно добавляют 1-метилпирролидинон (25 мл). Добавляют промежуточный продуктI-1 (0,0183 моль) и смесь перемешивают при 150 С в течение ночи, выливают на лед. Осадок фильтруют,промывают простым диэтиловым эфиром и сушат, получая 4,43 г соединения 1.10 (85%) (температура плавления: 260 С; (МН+): 343). Пример 3. Получение соединения 1.11. Гидрид натрия (60% в масле) (0,0054 моль) добавляют к смеси 1b (0,0049 моль) в 1,4-диоксане (10 мл) и перемешивают в течение 10 мин. Затем добавляют 1-метилпирролидинон (10 мл) и перемешивают смесь в течение 10 мин. Добавляют промежуточный продукт I-1 (0,0049 моль) и перемешивают смесь при 140 С в течение ночи. Добавляют к смеси Н 2 О и смесь экстрагируют CH2Cl2. Органический слой промывают 10% K2CO3, сушат (MgSO4), фильтруют и выпаривают, получая 1,6 г промежуточного продукта. Данную фракцию кристаллизуют из CH3CN. Осадок отфильтровывают и сушат, получая 0,46 г соединения 1.11 (29%) (температура плавления: 260 С; (МН+): 388). Соединения формул 1.14-1.17 получают по такой же методике. Пример 4. Получение соединения 1.1 (E/Z = 50/50). трет-Бутоксид калия (0,0018 моль) добавляют при 0 С к смеси диэтилцианометилфосфоната (0,0011 моль) в ТГФ (40 мл). Смесь перемешивают при комнатной температуре в течение 1 ч. Медленно добавляют смесь соединения 1.10 (0,0011 моль) в ТГФ (40 мл). Смесь перемешивают при комнатной температуре в течение ночи, выливают на лед и экстрагируют EtOAc. Органический слой отделяют, сушат(MgSO4), фильтруют и выпаривают. Остаток (0,48 г) очищают методом колоночной хроматографии на силикагеле (элюент: CH2Cl2/EtOAc 98/3; 10 мкм). Чистые фракции собирают и растворитель выпаривают,получая 0,1 г продукта. Данную фракцию кристаллизуют из простого диизопропилового эфира. Осадок отфильтровывают и сушат, получая 0,086 г соединения 1.1 (19%) (температура плавления: 225 С, (МН+): 366).- 12010423 Соединения формулы 1.2, 1.3, 1.6, 1.7 и 1.8 можно получить по той же методике. Пример 5. Получение соединения 1.18 (E/Z = 70/30). трет-Бутоксид калия (0,0009 моль) добавляют частями при 5 С к смеси диэтил(1 цианоэтил)фосфоната (0,0009 моль) в ТГФ (8 мл) под током N2. Смесь перемешивают при 10 С в течение 30 мин, затем при комнатной температуре в течение 30 мин. Добавляют раствор соединения 1.11 (0,0006 моль) в ТГФ (8 мл). Смесь перемешивают при комнатной температуре в течение ночи. Добавляют Н 2 О и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают. Остаток (0,25 г) очищают методом колоночной хроматографии на кромасиле (элюент:CH2Cl2/циклогексан 50/50; 10 мкм). Две фракции собирают и выпаривают, получая 0,084 г Fl (вторичный продукт) и 0,042 г соединения 1.18 (18%) (температура плавления: 245 С; (МН+): 414). Пример 6. Получение соединения 1.9 (E/Z = 85/15).EtOH (20 мл) перемешивают и кипятят с обратным холодильником в течение 2 ч. Добавляют 10% K2CO3. Смесь экстрагируют EtOAc. Органический слой отделяют, сушат MgSO4, фильтруют и выпаривают. Остаток (0,03 г) кристаллизуют из смеси диэтиловый эфир/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,03 г соединения 1.9 (12%) (температура плавления: 134 С). Пример 7. Получение соединения 2.1. Смесь 6-аминоиндан-1-она (0,0003 моль) и промежуточного продукта I-1 (0,0003 моль) в 3 н. HCl (2 мл) перемешивают и кипятят с обратным холодильником в течение 2 ч. Осадок фильтруют, промывают Н 2 О и диизопропиловым эфиром и сушат. Выход продукта по данной методике составляет 0,06 г (52%). Данную фракцию кристаллизуют из смеси CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,035 г соединения 2.1 (30%) (температура плавления: 260 С). Пример 8. Получение соединения 2.2 (100% Е). трет-Бутоксид калия (0,0016 моль) добавляют при 5 С к смеси диэтилцианометилфосфоната (0,0016 моль) в ТГФ (3 мл) под током N2. Смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют раствор соединения 2.1 (0,0011 моль) в ТГФ (3 мл). Смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют Н 2 О. Смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат(MgSO4), фильтруют и выпаривают. Остаток (0,82 г) очищают методом колоночной хроматографии на силикагеле (15-35 мкм). Чистые фракции собирают и выпаривают растворитель, получая 0,122 г продукта (30%). Данную фракцию кристаллизуют из смеси CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,035 г соединения 2.2 (9%) (температура плавления: 270 С, (МН+): 375). Схема 2- 13010423 Пример 9. Получение промежуточного продукта 3b. Дымящую азотную кислоту (0,362 моль) добавляют при -40 С к 5-хлориндан-1-ону (промежуточный продукт 3 а, 26,7 ммоль). Смесь перемешивают в течение 2 ч при -40 С. Затем выливают ее на лед и экстрагируют дихлорметаном. Органический слой отделяют, промывают насыщенным раствором соли,сушат MgSO4, фильтруют и выпаривают. Остаток очищают методом колоночной хроматографии на силикагеле (элюент: циклогексан/AcOEt 65/35; 15-40 мкм). Чистые фракции собирают и выпаривают растворитель, получая 4,15 г промежуточного продукта 3b (73%) (температура плавления: 129 С). Пример 10. Получение промежуточного продукта 3 с. В аппарат Парра для гидрирования добавляют 0,5 г никеля Ренея к раствору промежуточного продукта 3b (8,60 ммоль) в смеси ТГФ и МеОН (6/1). Сосуд продувают азотом и помещают в атмосферу водорода (3 бара). Смесь перемешивают в течение 1 ч при комнатной температуре, фильтруют через целит и выпаривают досуха, получая 1,50 г промежуточного продукта 3 с (96%) (температура плавления: 214 С). Пример 11. Получение промежуточного продукта 3d (E/Z=89/11). трет-Бутоксид калия (56,4 ммоль) добавляют частями при 0 С к раствору цианометилфосфоната(56,4 ммоль) в ТГФ. Смесь перемешивают в течение 15 мин при 15 С. Затем добавляют по капле раствор промежуточного продукта 3 с (14,1 ммоль) в ТГФ при 0 С. Реакционную смесь перемешивают при комнатной температуре в течение ночи, выливают в воду, подкисляют 3 М хлористо-водородной кислотой и экстрагируют дихлорметаном. Органический слой отделяют, промывают 10% раствором карбоната калия, насыщенным раствором соли, сушат над сульфатом магния, фильтруют и выпаривают. Остаток очищают методом колоночной хроматографии на силикагеле (элюент: дихлорметан; 35-70 мкм). Чистые фракции собирают и растворитель выпаривают, получая 1,88 г промежуточного продукта 3d (65%) (температура плавления: 196 С). Пример 12. Получение соединения 2.3 (Z 100%). Промежуточные продукты 3d и I-2 тонко перемалывают вместе и плавят при помощи нагревательной пушки. Остаток экстрагируют смесью 90/10 дихлорметана и метанола и 10% раствором карбоната калия. Органический слой отделяют, промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и выпаривают. Остаток очищают методом колоночной хроматографии на силикагеле(элюент: дихлорметан/AcOEt 85/15; 15-40 мкм). Две фракции собирают и выпаривают, получая 0,126 г соединения 2.3 (13%) и 0,104 г другого изомера (11%). Каждую фракцию перекристаллизовывают в ацетонитриле, получая соединение 2.3 (температура плавления: 248-249 С) и его изомер (температура плавления 250 С). Примеры 13-14. Синтез соединения 1.20. Схема В Пример 13. Получение соединения 1.19. Раствор 4,6-диметил-5-гидроксииндан-1-она 4 а (2,07 ммоль) в диоксане и NMP охлаждают до 0 С. Добавляют гидрид натрия (2,28 ммоль) и смесь перемешивают при комнатной температуре в течение 30 мин. Затем добавляют раствор промежуточного продукта 2 в NMP. Реакционную смесь кипятят с обратным холодильником в течение 7 дней и затем выпаривают досуха. Остаток промывают смесью 90/10 дихлорметана и метанола, получая 0,601 г соединения 1.19 (78%). Пример 14. Получение соединения 1.20. трет-Бутоксид калия (5,26 ммоль) добавляют частями при 0 С к раствору цианометилфосфоната(5,26 ммоль) в ТГФ. Смесь перемешивают в течение 15 мин при 15 С. Затем добавляют по капле раствор соединения 1.19 (1,75 ммоль) в ТГФ при 0 С. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, выливают в 0,5 М хлористо-водородную кислоту и экстрагируют смесью 90/10 дихлорметана и метанола. Органический слой отделяют, промывают водой и насыщенным раствором соли,сушат над сульфатом магния, фильтруют и выпаривают. Остаток промывают дихлорметаном и диизопропиловым эфиром, получая 0,205 г соединения 1.20 (30%) (температура плавления 250 С). Примеры препаратов Капсулы. Активный ингредиент, в данном случае соединение формулы (I), можно растворить в органическом растворителе, таком как этанол, метанол или метиленхлорид, предпочтительно смесь этанола и метиленхлорида. Полимеры, такие как сополимер поливинилпирролидона с винилацетатом (PVP-VA) или гидроксипропилметилцеллюлоза (НРМС), обычно с вязкостью 5 мПас, можно растворить в органических растворителях, таких как этанол, метанол, метиленхлорид. Удобно растворять полимер в этаноле. Растворы полимера и соединения можно смешать и затем высушить распылением. Соотношение соединение/полимер можно выбрать из диапазона от 1/1 до 1/6. Промежуточные дипазоны могут составлять 1/1,5 и 1/3. Подходящим может быть соотношение 1/6. Далее высушенным распылением порошком,твердой дисперсией, можно заполнить капсулы для введения. Загрузка лекарства в одну капсулу может составлять от 50 до 100 мг в зависимости от размера используемой капсулы. Таблетки, покрытые пленкой. Получение ядра таблетки. Смесь 100 г активного ингредиента, в данном случае соединения формулы (I), 570 г лактозы и 200 г крахмала можно хорошо перемешать и после этого увлажнить раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона примерно в 200 мл воды. Влажную порошкообразную смесь можно просеять, высушить и снова просеять. Затем можно добавить 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Всю смесь можно хорошо перемешать и прессовать из нее таблетки, получая 10000 таблеток, каждая из которых содержит 10 мг активного ингредиента.- 17010423 Покрытие. К раствору 10 г метилцеллюлозы в 75 мл денатурированного этанола можно добавить раствор 5 г этилцеллюлозы в 150 мл дихлорметана. Затем можно добавить 75 мл дихлорметана и 2,5 мл 1,2,3 пропантриола. 10 г полиэтиленгликоля можно расплавить и растворить в 7 5 мл дихлорметана. Последний раствор можно добавить к первому и затем можно добавить 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной цветной суспензии, и все это можно гомогенизировать. Ядра таблеток можно покрыть полученной таким образом смесью в аппарате для нанесения покрытий. Антивирусные исследования. Соединения настоящего изобретения исследуют на антивирусную активность в клеточном исследовании. Исследование показывает, что данные соединения демонстрируют сильную анти-ВИЧ активность против лабораторного ВИЧ-штамма дикого типа (ВИЧ-1 штамм LAI). Клеточное исследование проводят согласно следующей методике. Экспериментальный способ клеточного исследования. ВИЧ- или "mock-инфицированные клетки МТ 4 инкубируют в течение 5 дней в присутствии различных концентраций ингибитора. В конце периода инкубации все ВИЧ-инфицированные клетки убиты реплицирующим вирусом в контрольных культурах в отсутствие какого-либо ингибитора. Жизнеспособность клеток определяют, измеряя концентрацию МТТ, желтого водорастворимого тетразольного красителя, который превращается в пурпурный нерастворимый в воде формазан только в митохондрии живой клетки. После солюбилизации полученных кристаллов формазана изопропанолом контролируют абсорбцию раствора при 540 нм. Данные значения коррелируют непосредственно с количеством живых клеток,оставшихся в культуре по прошествии 5 дней инкубации. Ингибиторную активность соединения контролируют на вирус-инфицированных клетках и выражают как ЕС 50 и ЕС 90. Эти величины представляют количества данного соединения, необходимые для защиты 50% и 90% клеток соответственно, от цитопатогенного эффекта данного вируса. Токсичность данного соединения определяют на "mock"инфицированных клетках и выражают как СС 50, которая обозначает концентрацию соединения, необходимую для ингибирования роста клеток на 50%. Индекс селективности (SI) (отношение СС 50/ЕС 50) является показателем селективности анти-ВИЧ активности ингибитора. Как бы не были представлены результаты, например как значения pEC50 или pCC50, результат выражают в виде отрицательного логарифма результата, выраженного как ЕС 50 или СС 50 соответственно. Антивирусный спектр. Вследствие возрастающей частоты появления лекарственноустойчивых штаммов ВИЧ, настоящие соединения исследуют на их эфективность против клинически выделенных штаммов ВИЧ, несущих несколько мутаций. Эти мутации связаны с устойчивостью к ингибиторам обратной транскриптазы и дают в результате вирусы, которые демонстрируют различные степени фенотипической кросс-устойчивости к коммерчески доступным в настоящее время лекарствам, таким как, например, AZT и делавирдин. Антивирусную активность соединения настоящего изобретения оценивают в присутствии ВИЧ дикого типа и мутантов ВИЧ, несущих мутации в гене обратной транскриптазы. Активность соединений оценивают, применяя клеточное исследование, и остаточную активность выражают в величинах pEC50. Колонка А содержит pEC50 относительно штамма А (штамм А содержит мутацию 100I в обратной транскриптазе ВИЧ), колонка В содержит рЕС 50 относительно штамма В (штамм В содержит мутацию 100I и 103N в обратной транскриптазе ВИЧ), колонка С содержит рЕС 50 относительно штамма С (штамм С содержит мутацию 103N в обратной транскриптазе ВИЧ), колонка D содержит pEC50 относительно штамма его N-оксида, фармацевтически приемлемой аддитивной соли или стереохимически изомерной формы,где m равно 0, 1;R17, каждый независимо, обозначает циано, галоген, гидрокси, -С(=O)-NR13R14, C1-6 алкил, замещенный циано и, если возможно, R17 может также быть присоединен к фрагменту -CH2-CH2-CH2- двойной связью, при этом R17 представляет собой =O, =N-CN, =N-O-CH2-C6H5, =N-O-R7, =CH-CN или=C(CH3)CN. 2. Фармацевтическая композиция, содержащая (а) эффективное количество соединения формулы (I) по п.1 и (b) фармацевтически приемлемый носитель. 3. Продукт, содержащий (а) соединение формулы (I) по п.1 и (b) другое антиретровирусное соединение в виде объединенного препарата для одновременного, раздельного или последовательного применения при лечении или профилактике ВИЧ-инфекции. 4. Способ получения соединения формулы (I) по п.1, отличающийся тем, что включает взаимодействие индана формулы (а-1) с реагентом (а-2) где заместители имеют значения, определенные в п.1, W1 означает уходящую группу, и получение его фармацевтически приемлемой аддитивной соли или стереохимически изомерной формы.
МПК / Метки
МПК: C07D 413/12, C07D 239/48, C07D 239/47, A61K 31/505, A61P 31/18
Метки: репликацию, инданзамещенные, ингибирующие, вич, пиримидины
Код ссылки
<a href="https://eas.patents.su/20-10423-indanzameshhennye-pirimidiny-ingibiruyushhie-replikaciyu-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Инданзамещенные пиримидины, ингибирующие репликацию вич</a>
Предыдущий патент: Замещённые индол-о-глюкозиды
Следующий патент: Пиридо[2,3-d]пиримидин-2,4-диамины в качестве ингибиторов pde 2
Случайный патент: Эластомерный сополимер и способ его получения