Замещённые индол-о-глюкозиды
Номер патента: 10422
Опубликовано: 29.08.2008
Авторы: Рибжински Филип, Биверз Мэри Пэт, Чжан Сяоянь, Урбански Мод, Пател Мона
Формула / Реферат
1. Соединение формулы (I)
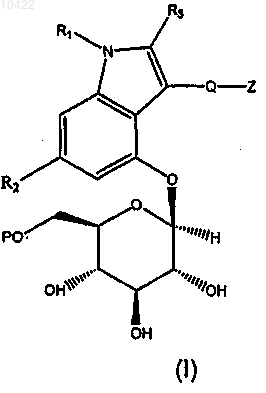
где R1 представляет собой H, C1-4алкил или R4R5N-(CO)-; каждый из R4 и R5 независимо представляет собой C1-5алкил;
R2 представляет собой H, F, Cl или C1-4алкил;
R3 представляет собой H или C1-4алкил, при условии, что когда R3 представляет собой C1-4алкил, тогда R2 представляет собой H;
Q представляет собой -C=O- или -(CH2)n-, где n=0, 1 или 2;
P=H, C1-7ацил или (C1-6алкокси)карбонил;
Z является замещенным или незамещенным и выбран из C3-7циклоалкила, фенила, 5- или
6-членного гетероциклила, содержащего 1 или 2 гетероатома, независимо выбранных из N, О и S, биарила, 9- или 10-членного конденсированного бициклила или конденсированного гетеробициклила, где указанный конденсированный гетеробициклил содержит от 1 до 4 гетероатомов, независимо выбранных из N, О и S;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой H.
3. Соединение по п.1, где R2 представляет собой H, метил или этил.
4. Соединение по п.1, где Q представляет собой -(CH2)n- и n представляет собой 1 или 2.
5. Соединение по п.1, где Z является незамещенным или независимо замещенным 1-3 заместителями, независимо выбранными из C1-4алкокси, фенокси, C1-4алкила, C3-6циклоалкила, галогена, гидрокси, циано, амино, C1-4алкилтио, C1-4алкилсульфонила, C1-4алкилсульфинила, C1-4аминоалкила, моно- и
ди(C1-4 алкил)амино, фенила, C1-4алкиламиносульфонила (SO2NHR), амино(C1-4алкилсульфонил) (NHSO2R), ди-C1-4алкиламиносульфинила (SONHRR), C1-4алкиламидо (NHCOR), C1-4алкилкарбамидо (CONHR), 5-6-членного гетероциклила, содержащего от 1 до 3 гетероатомов, независимо выбранных из N, S и О; и где заместитель(и) у Z могут быть дополнительно независимо замещены 1-3 заместителями, независимо выбранными из C1-4алкокси, C1-4алкила, галогена, гидрокси, циано, амино, моно- или
ди(C1-4алкил)амино и C1-4алкилтио.
6. Соединение по п.1, где Z выбран из 4-замещенного фенила, 3,4-дизамещенного фенила, бензгидрила, замещенного или незамещенного тиофена, биарила, бензофуранила, дигидробензофуранила,
4-замещенного пиридила, бензо[b]тиенила, хроманила, бензотиофенила, инданила и нафтила.
7. Соединение по п.5, где Z является незамещенным или замещен 1-2 заместителями, независимо выбранными из метокси, этокси, фтора, хлора, метила, этила, пропила, бутила и изопропила.
8. Соединение по п.1, где Z представляет собой бифенил, 4-(3-пиридил)фенил, 4-(2-тиенил)фенил, 4-(1H-пиразол-1-ил)фенил, 2-(5-фенил)тиофенил, (4-этил)фенил, (4-пропил)фенил, (4-метокси)фенил, дигидробензофуран-5-ил или дигидробензофуран-6-ил.
9. Соединение по п.1, где R1 представляет собой H и R2 представляет собой H, метил, этил, пропил или изопропил.
10. Соединение по п.1, где Q представляет собой -(CH2)n-; n представляет собой 1 или 2 и R2 представляет собой H, метил или этил.
11. Соединение по п.1, где P представляет собой H, C1-3ацил или (C1-3алкокси)карбонил.
12. Соединение по п.2, где R1 представляет собой H; R2 представляет собой H, метил или этил; Q представляет собой -(CH2)n- и n представляет собой 1 или 2; Z представляет собой 4-замещенный фенил, 3,4-дизамещенный фенил, бензгидрил, замещенный или незамещенный тиофен, биарил, бензофуранил, дигидробензофуранил, 4-замещенный пиридил, бензо[b]тиенил, хроманил, бензотиофенил, инданил и нафтил.
13. Соединение по п.1, где R1 представляет собой H; R2 представляет собой H, метил или этил; где Z представляет собой 4-замещенный фенил, 3,4-дизамещенный фенил, бензгидрил, замещенный или незамещенный тиофен, биарил, бензофуранил, дигидробензофуранил, 4-замещенный пиридил,
бензо[b]тиенил, хроманил, бензотиофенил, инданил и нафтил и Z является незамещенным или замещен 1-2 заместителями, независимо выбранными из метокси, этокси, фтора, хлора, метила, этила, пропила, бутила и изопропила.
14. Соединение по п.1, выбранное из
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-1H-индол-4-илокси}-b-D-глюкопиранозида;
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-1-метил-1H-индол-4-илокси}-b-D-глюкопиранозида;
2-{3-[2-(4-метоксифенил)этил]-1H-индол-4-илокси}-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-О-метоксикарбонил-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-O-этоксикарбонил-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-O-гексаноил-b-D-глюкопиранозида;
2-[3-(4-метилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-(3-бифенил-4-илметил-1H-индол-4-илокси)-b-D-глюкопиранозида;
2-[3-(4-этоксибензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-метилсульфанилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-6-метил-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-тиофен-3-илбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида и
2-[3-(4-пиридин-3-илбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида.
15. Соединение по п.1, выбранное из
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-1H-индол-4-илокси}-6-О-ацетил-b-D-глюкопиранозида;
2-[3-(2-бензо[1,3]диоксол-5-илэтил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-{3-[2-(2,3-дигидробензо[1,4]диоксин-6-ил)этил]-1H-индол-4-илокси}-b-D-глюкопиранозида;
2-[3-(2-нафталин-2-илэтил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-{3-[2-(4-этоксифенил)этил]-1H-индол-4-илокси}-b-D-глюкопиранозида;
2-{3-[2-(4-метоксифанил)этил]-6-метил-1H-индол-4-илокси}-b-D-глюкопиранозида;
2-[3-(3-фтор-4-метилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-пропилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-изопропилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(2-фторбифенил-4-илметил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-метоксибензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(3-фтор-4-метоксибензил)-1H-индол-4-илокси]-D-глюкопиранозида;
2-[3-(4-феноксибензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-хлорбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-(3-нафталин-2-илметил-1H-индол-4-илокси)-b-D-глюкопиранозида и
2-[3-(4-этилбензил)-2-метил-1H-индол-4-илокси]-b-D-глюкопиранозида.
16. Соединение по п.1, выбранное из
2-{3-[2-(4-этилфенил)этил]-1H-индол-4-илокси}-b-D-глюкопиранозида;
2-[1-диэтилкарбамоил-3-(4-метоксибензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-метоксибензил)-1-метил-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-1-изопропил-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-метил-2-тиенил-(1H-индол-4-илокси)]-b-D-глюкопиранозида;
2-[3-(2,3-дигидробензофуран-5-илметил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензоил)-1H-индол-4-илокси]-b-D-глюкопиранозида и
2-[3-(4-метоксифенил-1H-индол-4-илокси]-b-D-глюкопиранозида.
17. Соединение по п.1, выбранное из
2-[3-(4-циклопропилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-пиразол-1-илбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[6-хлор-3-(4-этилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-6-фтор-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(5-этилтиофен-2-илметил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(5-пропилтиофен-2-илметил)-1H-индол-4-илокси]-b-D-глюкопиранозида и
2-[3-(5-фенилтиофен-2-илметил)-1H-индол-4-илокси]-b-D-глюкопиранозида.
18. Соединение по п.1, выбранное из
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-1H-индол-4-илокси}-b-D-глюкопиранозида;
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-1-метил-1H-индол-4-илокси}-b-D-глюкопиранозида;
2-[3-(3-фтор-4-метилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-метилсульфанилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-6-метил-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-метилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-O-метоксикарбонил-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-O-этоксикарбонил-b-D-глюкопиранозида;
2-[3-(4-пропилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-тиофен-3-илбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-циклопропилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-пиразол-1-илбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида,
2-[6-хлор-3-(4-этилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-6-фтор-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(5-этилтиофен-2-илметил)-1H-индол-4-илокси]-b-D-глюкопиранозида и
2-[3-(5-фенилтиофен-2-илметил)-1H-индол-4-илокси]-b-D-глюкопиранозида.
19. Соединение по п.1, выбранное из
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-1H-индол-4-илокси}-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-1H-индол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-O-этоксикарбонил-b-D-глюкопиранозида и
2-(3-(4-тиофен-3-илбензил)-1H-индол-4-илокси)-b-D-глюкопиранозида.
20. Фармацевтическая композиция, включающая соединение по пп.1, 5, 6, 11, 12, 14-18 или 19.
21. Фармацевтическая композиция, включающая соединение, выбранное из п.18 или 19.
22. Способ лечения диабета у млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении, эффективного количества фармацевтической композиции по п.18 или 19.
23. Способ по п.22, где указанный диабет представляет собой диабет типа II.
24. Способ снижения содержания глюкозы в сыворотке у млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении, эффективного количества фармацевтической композиции по п.18 или 19.
25. Способ лечения пониженной толерантности к глюкозе у млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении, эффективного количества фармацевтической композиции по п.18 или 19.
26. Способ лечения или ингибирования пониженной толерантности к глюкозе у млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении, эффективного количества фармацевтической композиции по п.18 или 19.
27. Способ снижения индекса массы тела, массы тела, процентного содержания жира в организме млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении, эффективного количества фармацевтической композиции по п.18 или 19.
28. Способ по п.27, где указанное снижение индекса массы тела представляет собой способ лечения ожирения или состояния избыточной массы тела.
29. Способ лечения диабета или синдрома X либо связанных с ними симптомов или осложнений у субъекта, включающий:
(а) введение указанному субъекту совместно эффективного количества соединения формулы (I) и
(b) введение указанному субъекту совместно эффективного количества антидиабетического средства,
при этом указанное совместное введение осуществляют в любом порядке, и совместно эффективные количества обеспечивают желаемый терапевтический эффект.
30. Способ лечения диабета или синдрома X либо связанных с ними симптомов или осложнений у субъекта, включающий:
(a) введение указанному субъекту совместно эффективного количества соединения формулы (I) и
(b) введение указанному субъекту совместно эффективного количества второго антидиабетического средства,
при этом указанное совместное введение осуществляют в любом порядке, и совместно эффективные количества обеспечивают желаемый терапевтический эффект.
31. Способ по п.29 или 30, где диабет или синдром X либо связанные с ними симптомы или осложнения выбраны из IDDM, NIDDM, IGT, IFG, ожирения, нефропатии, невропатии, ретинопатии, атеросклероза, синдрома поликистоза яичников, гипертензии, ишемии, удара, заболевания сердца, синдрома раздраженной толстой кишки, воспаления и катаракты.
32. Способ по п.29 или 30, где диабет или синдром X либо связанные с ними симптомы или осложнения представляют собой IDDM.
33. Способ по п.29 или 30, где диабет или синдром X либо связанные с ними симптомы или осложнения представляют собой NIDDM.
34. Способ по п.29 или 30, где диабет или синдром X либо связанные с ними симптомы или осложнения представляют собой IGT или IFG.
35. Способ по п.29 или 30, дополнительно включающий введение указанному субъекту совместно эффективного количества третьего антидиабетического средства.
36. Способ по п.34, где третье антидиабетическое средство выбрано из:
(аа) инсулинов,
(bb) аналогов инсулина;
(cc) модуляторов секреции инсулина и
(dd) средств, усиливающих секрецию инсулина.
37. Способ по п.29 или 30, где соединение формулы (I) представляет собой ингибитор SGLT.
38. Способ по п.37, где соединение формулы (I) представляет собой ингибитор SGLT1.
39. Способ по п.37, где соединение формулы (I) представляет собой ингибитор SGLT2.
40. Способ по п.37, где соединение формулы (I) представляет собой соединение формулы (I) или его изомер, энантиомер, диастереомер, рацемат или рацемическую смесь, сложный эфир, пролекарственную форму или фармацевтически приемлемую соль.
41. Способ по п.29 или 30, где совместно эффективное количество ингибитюЁр SGLT составляет от около 10 до 1000 мг.
42. Способ по п.29 или 30, где совместно эффективное количество ингибитора SGLT представляет собой количество, достаточное для снижения уровня глюкозы в плазме после приема пищи.
43. Способ ингибирования начала развития диабета или синдрома X либо связанных с ними симптомов или осложнений у субъекта, включающий:
(a) введение указанному субъекту совместно эффективного количества соединения формулы (I) и
(b) введение указанному субъекту совместно эффективного количества второго антидиабетического средства,
при этом указанное совместное введение осуществляют в любом порядке, и совместно эффективные количества обеспечивают желаемый профилактический эффект.
44. Способ по п.43, где указанное начало развития представляет собой состояние от преддиабетического до NIDDM.
45. Фармацевтическая композиция, включающая соединение формулы (I), второе антидиабетическое средство и фармацевтически приемлемый носитель.
46. Способ получения фармацевтической композиции, включающий объединение в одну композицию соединения формулы (I), второго антидиабетического средства и фармацевтически приемлемого носителя.
47. Способ получения фармацевтической композиции, включающий смешивание одного или нескольких соединений формулы (I) в сочетании со вторым антидиабетическим средством для получения лекарственного средства для лечения состояния, выбранного из IDDM, NIDDM, IGT, IFG, ожирения, нефропатии, невропатии, ретинопатии, атеросклероза, синдрома поликистоза яичников, гипертензии, ишемии, удара, заболевания сердца, синдрома раздраженной толстой кишки, воспаления и катаракты.
48. Способ ингибирования развития преддиабетического состояния у субъекта до диабетического состояния, включающий:
(a) введение указанному субъекту совместно эффективного количества соединения формулы (I) и
(b) введение указанному субъекту совместно эффективного количества антидиабетического средства,
при этом указанное совместное введение осуществляют в любом порядке, и совместно эффективные количества обеспечивают желаемый эффект ингибирования.
49. Способ по п.48, где указанное состояние представляет собой IGT или IFG.
50. Способ по п.48, где указанное ингибирование развития преддиабетического состояния представляет собой предотвращение развития преддиабетического состояния до диабетического состояния.
51. Способ по п.48, где соединение формулы (I) представляет собой ингибитор SGLT.
52. Способ по п.48, где соединение формулы (I) необязательно содержит одну или несколько гидроксил- или диолзащитных групп или представляет собой оптический изомер, энантиомер, диастереомер, рацемат или рацемическую смесь, сложный эфир, пролекарственную форму или фармацевтически приемлемую соль такого соединения.
Текст
010422 Область техники Настоящее изобретение относится к замещенным индол-O-глюкозидам, к содержащим их композициям и к способам их применения, например, для лечения или профилактики диабета и синдрома X. Уровень техники Диабет является хроническим расстройством, влияющим на углеводный, жировой и белковый обмен в организме животного. Сахарный диабет типа I, составляющий примерно 10% от всех случаев диабета, раньше называли инсулин-зависимым сахарным диабетом ("IDDM") или юношеским диабетом. Это заболевание характеризуется прогрессивной утратой функции секреции инсулина бета-клетками поджелудочной железы. Такая характеристика также относится и к неидиопатическому, или "вторичному", диабету, первопричиной которого является заболевание поджелудочной железы. Сахарный диабет типа I ассоциируется со следующими клиническими признаками или симптомами: постоянно повышенная концентрация глюкозы в плазме или гипергликемия; полиурия; полидипсия и/или гиперфагия; хронические микрососудистые осложнения, такие как ретинопатия, нефропатия и невропатия; и макрососудистые осложнения, так как гиперлипидемия и гипертензия, которые могут привести к потере зрения, терминальной стадии почечной недостаточности, ампутации конечностей и инфаркту миокарда. Сахарный диабет типа II (инсулин-независимый сахарный диабет, или NIDDM) является метаболическим расстройством, характеризующимся нарушением глюкозного метаболизма и пониженной чувствительностью к инсулину. Сахарный диабет типа II обычно развивается в период полового созревания и связан с неспособностью организма утилизировать или секретировать достаточное количество инсулина. Помимо резистентности к инсулину, наблюдаемой в определенных тканях, пациенты, страдающие сахарным диабетом типа II, имеют относительную инсулиновую недостаточность, т.е. пациенты имеют более низкие уровни инсулина, чем должны быть для данной концентрации глюкозы в плазме. Сахарный диабет типа II характеризуется следующими клиническими признаками или симптомами: постоянно повышенная концентрация глюкозы в плазме или гипергликемия; полиурия; полидипсия и/или гиперфагия; хронические микрососудистые осложнения, такие как ретинопатия, нефропатия и невропатия; и макрососудистые осложнения, так как гиперлипидемия и гипертензия, которые могут привести к потере зрения, терминальной стадии почечной недостаточности, ампутации конечностей и инфаркту миокарда. Синдром X, который также называют синдромом резистентности к инсулину (IRS), метаболическим синдромом или метаболическим синдромом X, определяют примерно в 2% случаев диагностической коронарной катетеризации. Он часто приводит к потере трудоспособности и включает симптомы или факторы риска развития сахарного диабета типа II и сердечно-сосудистых заболеваний, включая пониженную толерантность к глюкозе (IGT), пониженные уровни глюкозы натощак (IFG), гиперинсулинемию, резистентность к инсулину, дислипидемию (например, повышенный уровень триглицеридов, пониженный уровень HDL), гипертензию и ожирение. Методы терапевтического лечения пациентов с IDDM постоянно были сфокусированы на введении экзогенного инсулина, который можно получить из различных источников (например, человеческий,бычий, свиной инсулин). Использование веществ, полученных из гетерологических видов, приводит к образованию антител против инсулина, которые обладают эффектом ограничения его активности и приводят к все большей потребности в больших дозах для достижения желаемых гипогликемических эффектов. Типичное лечение сахарного диабета типа II сфокусировано на поддержании уровня глюкозы в крови, по возможности более близкого к нормальному, путем изменения образа жизни, что связано с диетой и физическими упражнениями, и при необходимости, с применением лечения антидиабетическими средствами, инсулином или их сочетанием. NIDDM, который нельзя контролировать при помощи диеты, лечат при помощи пероральных антидиабетических средств. Хотя резистентность к инсулину лечат не всегда и не у всех пациентов с синдромом X, тех пациентов, у которых обнаружено преддиабетическое состояние (например, IGT, IFG), когда уровни глюкозы натощак могут быть выше, чем нормальные, но еще не достигшие критерия, когда ставится диагноз"диабет", в некоторых странах (например, в Германии) лечат метформином для профилактики диабета. Антидиабетические средства можно объединять с фармакологическими средствами для лечения сопутствующих заболеваний (например, гипотензивные средства от гипертензии, гиполипидемические средства от липидемии). Первоочередная терапия типично включает метформин и средства на основе сульфонилмочевины, а также тиазолидиндионы. Метформиновая монотерапия является первоочередным выбором, особенно для лечения сахарного диабета типа II у пациентов, также страдающих ожирением и/или дислипидемией. Когда отсутствует соответствующая ответная реакция на метформин, часто проводят лечение метформи-1 010422 ном в сочетании с сульфонилмочевинными препаратами, тиазолидиндионами или инсулином. Монотерапия сульфонилмочевинными препаратами (включая все поколения лекарственных средств) также является традиционным первоочередным выбором лечения. Другим первоочередным выбором терапевтического лечения могут быть тиазолидиндионы. Ингибиторы альфа-глюкозидазы также используют в качестве первоочередной и второстепенной терапии. Когда отсутствует соответствующая ответная реакция на пероральную антидиабетическую монотерапию, пациентам вводят комбинации указанных выше лекарственных средств. Когда гликемический контроль нельзя поддерживать при помощи используемых отдельно пероральных антидиабетических средств, применяют инсулиновую терапию либо в виде монотерапии, либо в сочетании с пероральными антидиабетическими средствами. Одна из последних разработок в области лечения гипергликемии сфокусирована на экскреции избыточного количества глюкозы непосредственно в мочу. Было показано, что специфические ингибиторыSGLT (котранспортеров натрия-глюкозы) повышают экскрецию глюкозы в мочу и снижают кровяное давление в моделях IDDM и NIDDM у грызунов. Краткое описание изобретения Один аспект настоящего изобретения направлен на способы и композиции для лечения или профилактики диабета, синдрома X или связанных с ними симптомов или осложнений. Более конкретно, настоящее изобретение направлено на новый способ лечения диабета или синдрома X либо связанных с ними симптомов или осложнений у субъекта, у которого обнаружено такое состояние, при этом указанный способ включает введение одного или нескольких ингибиторов обратного поглощения глюкозы и введение одного или нескольких антидиабетических средств для лечения диабета или синдрома X либо связанных с ними симптомов или осложнений. Другой аспект настоящего изобретения направлен на соединения формулы где R1 представляет собой H, C1-4 алкил или R4R5N-(CO)-; каждый из R4 и R5 независимо представляет собой C1-5 алкил;Z является замещенным или незамещенным и выбран из C3-7 циклоалкила, фенила, 5- или 6-членного гетероциклила, содержащего 1 или 2 гетероатома, независимо выбранных из N, О и S, биарила и 9- или 10-членного конденсированного бициклила или конденсированного гетеробициклила, где указанный конденсированный гетеробициклил содержит от 1 до 4 гетероатомов (и предпочтительно от 1 до 2 гетероатомов), независимо выбранных из N, О и S; или их фармацевтически приемлемые соли. Один аспект настоящего изобретения направлен на фармацевтическую композицию, включающую ингибитор обратного поглощения глюкозы (отдельно или в сочетании с одним или несколькими дополнительными антидиабетическими средствами) и фармацевтически приемлемый носитель. Настоящее изобретение также обеспечивает способ получения фармацевтической композиции, включающий объединение в одну композицию ингибитора обратного поглощения глюкозы (необязательно, по меньшей мере с одним антидиабетическим средством) и фармацевтически приемлемого носителя. Вариант воплощения настоящего изобретения представляет собой способ лечения диабета или синдрома X либо связанных с ними симптомов или осложнений у субъекта, при этом указанный способ включает введение указанному субъекту совместно эффективного количества ингибитора обратного поглощения глюкозы и введение указанному субъекту совместно эффективного количества антидиабетического средства, при этом указанное совместное введение обеспечивает желаемый терапевтический эффект.-2 010422 Другой вариант воплощения настоящего изобретения представляет собой способ ингибирования начала развития диабета или синдрома X либо связанных с ними симптомов или осложнений у субъекта,при этом указанный способ включает введение указанному субъекту совместно эффективной дозы ингибитора обратного поглощения глюкозы и введение указанному субъекту совместно эффективного количества одного или нескольких антидиабетических средств, при этом указанное совместное введение обеспечивает желаемый профилактический эффект. В раскрываемых способах диабет или синдром X либо связанные с ними симптомы или осложнения выбраны из IDDM, NIDDM, IGT, IFG, ожирения, нефропатии, невропатии, ретинопатии, атеросклероза,синдрома поликистоза яичников, гипертензии, ишемии, удара, заболевания сердца, синдрома раздраженной толстой кишки, воспаления и катаракты. Настоящее изобретение также включает использование одного или нескольких ингибиторов обратного поглощения глюкозы в сочетании с одним или несколькими антидиабетическими средствами для получения лекарственного средства для лечения состояния, выбранного из IDDM, NIDDM, IGT, IFG,ожирения, нефропатии, невропатии, ретинопатии, атеросклероза, синдрома поликистоза яичников, гипертензии, ишемии, удара, заболевания сердца, синдрома раздраженной толстой кишки, воспаления и катаракты. Подробное описание изобретения У всех диабетиков, независимо от генетических предпосылок этого заболевания или предпосылок,связанных с окружающей средой, - имеется общая особенность - очевидный недостаток инсулина или нарушенная функция инсулина. Поскольку транспорт глюкозы из крови в мышцы и жировую ткань является инсулинозависимым, у диабетиков отсутствует способность к адекватной утилизации глюкозы,что приводит к нежелательному накоплению глюкозы в крови (гипергликемия). Хроническая гипергликемия приводит к снижению секреции инсулина и способствует повышенной резистентности к инсулину и, как результат, концентрация глюкозы в крови повышается так, что диабет сам по себе обостряетсяinsulin resistance: implications for the management diabetes", vol. 28, p. 119); Diabetes Cares, 1990, vol. 13,No. 6, "Glucose Toxicity", p. 610-630). Поэтому при лечении гипергликемии указанный выше самообостряющийся цикл прерывается таким образом, что становится возможной профилактика или лечение диабета. Патент США 6153632 на имя R. Rieveley раскрывает способ и композицию, предназначенную,как это заявлено, для лечения сахарного диабета (типа I, пониженной толерантности к глюкозе ["IGT"] и типа II), которая включает терапевтическое количество одного или нескольких инсулинсенсибилизирующих средств вместе с одним или несколькими средствами, включающими инсулин для перорального приема, инсулин для инъекций, сульфонилмочевину, бигуанид или ингибитор альфаглюкозидазы, для лечения сахарного диабета. В соответствии с одним аспектом настоящее изобретение направлено на комбинацию модулятораPPAR, предпочтительно агониста PPAR , и ингибитора SGLT, предпочтительно ингибитора SGLT 2 или селективного ингибитора SGLT 2. А. Термины. Некоторые термины определены ниже путем их использования в настоящем раскрытии. Если не указано иное, "алкил" и "алкокси", как использовано в настоящем изобретении, отдельно или как часть группы заместителя включают линейный, циклический и разветвленный алкил, содержащий 1-8 атомов углерода или любое их количество в указанных пределах. Например, алкильные радикалы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, 2-бутенил,2-бутинил, н-пентил, 3-(2-метил)бутил, 2-пентил, 2-метилбутил, неопентил, н-гексил, 2-гексил и 2-метилпентил. Алкоксирадикалы представляют собой простые эфиры, образованные из описанных выше линейных или разветвленных алкильных групп. Алкильные и алкоксигруппы могут быть независимо замещены 1-5, предпочтительно 1-3 группами, выбранными из галогена (F, Cf, Br, I), оксо, OH, амино,карбоксила и алкокси. Алкильные и алкоксигруппы также могут быть независимо связаны с одним или несколькими PEG радикалами (полиэтиленгликоль). Термин "ацил", как он использован в настоящем изобретении, отдельно или как часть группы заместителя означает органический радикал, содержащий карбонильную группу, связанную с углеводородной группой, содержащей 1-7 атомов углерода, с разветвленной или линейной цепью или циклической, полученной из органической кислоты путем удаления гидроксильной группы. Например, C4 ацил может включать (CO)CH2CH2CH2CH3 и (CO)(CH2(CH)(CH3)2; аналогичным образом, C6 ацил включает как (CO)(C6H13), так и (CO)(C6H5). Термин "Ac", как он использован в настоящем изобретении, отдельно или как часть группы заместителя означает ацетил."Арил" представляет собой карбоциклический ароматический радикал, включающий, но не ограничивающийся этим, фенил, 1- или 2-нафтил и т.п. Карбоциклический ароматический радикал может быть замещен путем независимой замены 1-3 атомов водорода этого радикала, галогеном, OH, CN, меркапто,нитро, амино, циано, необязательно замещенным C1-C8 алкилом, необязательно замещенным алкокси,алкилтио, алкилсульфинилом, алкилсульфонилом, алкиламино, ди(C1-C8 алкил)амино, формилом,-3 010422 карбоксилом, алкоксикарбонилом, алкоксикарбонилокси, алканоилокси, фенилом, карбамоилом,карбоксамидом, динизшим алкилкарбамоилокси, феноксикарбонилоксигруппой, низшим алкилендиокси,бензоилокси, алкил-CO-O-, алкил-O-CO, -CONH2, алкил-O-CO-O- или алкил-CO-NH-. Примеры арильных радикалов включают, например, фенил, нафтил, бифенил, инден индан фторфенил,дифторфенил, бензил, бензоилоксифенил, карбоэтоксифенил, ацетилфенил, этоксифенил, феноксифенил,гидроксифенил, карбоксифенил, трифторметилфенил, метоксиэтилфенил, ацетамидофенил, толил, ксилил, диметилкарбамилфенил и т.п. "Ph" или "PH" означают фенил. Термин "гетероарил", как он использован в настоящем изобретении, представляет стабильную 5 или 6-членную моноциклическую или бициклическую ароматическую кольцевую систему, которая состоит из атомов углерода и 1-3 гетероатомов, выбранных из N, O и S. Гетероарильная группа может быть присоединена по любому гетероатому или атому углерода, в результате чего получают стабильную структуру. Примеры гетероарильных групп включают, но не ограничиваются этим, бензофуранил, бензотиофенил, пиридинил, пиразинил, пиридазинил, пиримидинил, тиофенил, фуранил, имидазолил,изоксазолил, оксазолил, пиразолил, пирролил, тиазолил, тиадиазолил, триазолил, бензимидазолил, бензофуранил, бензотиенил, бензизоксазолил, бензохазолил, бензопиразолил, индолил, бензотиазолил, бензотиадиазолил, бензотриазолил или хинолинил. Предпочтительньные гетероарильные группы включают пиридинил, тиофенил, фуранил, и хинолинил. Когда гетероарильная группа является замещенной, такая гетероарильная группа может содержать от 1 до 3 заместителей, независимо выбранных из галогена, OH,CN, меркапто, нитро, амино, циано, необязательно замещенного C1-C8 алкила, необязательно замещенного алкокси, алкилтио, алкилсульфинила, алкилсульфонила, алкиламино, ди(C1-C8 алкил)амино, формила,карбоксила, алкоксикарбонила, алкоксикарбонилокси, алканоилокси, фенила, карбамоила, карбоксамида,динизшего алкилкарбамоилокси, феноксикарбонилокси группы, низшего алкилендиокси, бензоилокси,алкил-CO-O-, алкил-O-CO-, -CONH2, алкил-O-CO-O- или алкил-CO-NH-. Термины "гетероцикл", "гетероциклический" и "гетероциклил" относятся к необязательно замещенной, полностью или частично насыщенной, ароматической или неароматической циклической группе, которая представляет собой, например, 4-7-членную моноциклическую, 7-11-членную (или 9-10 членную) бициклическую (гетеробициклил) или 10-15-членную трициклическую кольцевую систему,содержащую по меньшей мере один гетероатом в содержащем по меньшей мере один атом углерода кольце. Каждое кольцо гетероциклической группы, содержащей гетероатом, может содержать 1, 2 или 3 гетероатома, выбранных из атомов азота, атомов кислорода и атомов серы, где гетероатомы азота и серы могут также, необязательно, быть окисленными. Атомы азота могут, необязательно, быть кватернизированы. Гетероциклическая группа может быть присоединена по любому гетероатому или атому углерода. Примеры моноциклических гетероциклических групп включают пирролидинил; оксетанил; пиразолинил; имидазолинил; имидазолидинил; оксазолил; оксазолидинил; изоксазолинил; тиазолидинил; изотиазолидинил; тетрагидрофурил; пиперидинил; пиперазинил; 2-оксопиперазинил; 2-оксопиперидинил; 2-оксопирролидинил; 4-пиперидонил; тетрагидропиранил; тетрагидротиопиранил; тетрагидротиопиранилсульфон; морфолинил; тиоморфолинил; тиоморфолинил сульфоксид; тиоморфолинилсульфон; 1,3-диоксолан; диоксанил; тиетанил; тииранил и т.п. Примеры бициклических гетероциклических групп(или гетеробициклилов) включают хинуклидинил; тетрагидроизохинолинил; дигидроизоиндолил; дигидрохиназолинил (такой как 3,4-дигидро-4-оксохиназолинил); дигидробензофурил; дигидробензотиенил; дигидробензотиопиранил; дигидробензотиопиранилсульфон; дигидробензопиранил; индолинил; изохроманил; бензимидазолил; бензтиазолил; изоиндолинил; пиперонил; тетрагидрохинолинил и т.п. Когда гетероарильная группа является замещенной, гетероциклил может быть независимо замещен 1-5, предпочтительно 1-3 группами, выбранными из галогена, OH, CN, меркапто, нитро, амино, циано,необязательно замещенного C1-C8 алкила, необязательно замещенного алкокси, алкилтио, алкилсульфинила, алкилсульфонила, алкиламино, ди(C1-C8 алкил)амино, формила, карбоксила, алкоксикарбонила,алкоксикарбонилокси, алканоилокси, фенила, карбамоила, карбоксамида, динизшего алкилкарбамоилокси, феноксикарбонилоксигруппы, низшего алкилендиокси, бензоилокси, алкил-CO-O-, алкил-O-CO-,-CONH2, алкил-O-CO-O- или алкил-CO-NH-. Термин "биарил" включает гетероарил, связанный с фенилом, фенил, связанный с гетероарилом-4 010422 Термин "композиция" охватывает продукт, включающий указанные ингредиенты в указанных количествах, а также любой продукт, являющийся прямым или косвенным результатом сочетаний указанных ингредиентов в указанных количествах. Термин "совместное введение" включает совместное введение, где: 1) два или более средств вводят субъекту, по существу, в одно и то же время; 2) два или более средств вводят субъекту в разное время, с независимыми интервалами, которые могут пересекаться или совпадать, но могут и не пересекаться, и не совпадать. Термин "субъект", как он использован в настоящем изобретении, относится к животному, предпочтительно к млекопитающему, наиболее предпочтительно к человеку, являющемуся объектом лечения,наблюдения или эксперимента. Термин "модулятор RXR", как он использован в настоящем изобретении, относится к агонистам,частичным агонистам или антагонистам ретиноидных X-рецепторов. Предпочтительно такой модулятор повышает чувствительность к инсулину. В соответствии с одним аспектом модулятор представляет собой агонист RXR. Диабет, синдром X и связанные с ними симптомы или осложнения включают такие состояния, какIDDM, NIDDM, IGT, IFG, ожирение, нефропатия, невропатия, ретинопатия, атеросклероз, синдром поликистоза яичников, гипертензия, ишемия, удар, заболевание сердца, синдром раздраженной толстой кишки, воспаление и катаракта. Примеры преддиабетических состояний включают IGT и IFG. Из уровня техники известны способы определения эффективных доз для терапевтических и профилактических целей для раскрываемых фармацевтических композиций или раскрываемых комбинаций лекарственных средств, независимо от того, объединены они в одну композицию или нет. Для терапевтических целей термин "совместно эффективное количество", как он использован в настоящем изобретении, означает такое количество каждого активного соединения или фармацевтического средства, отдельно или в сочетании, которое вызывает биологический или медицинский ответ в системе ткани у животного или человека, которого добивается исследователь, ветеринар, врач или другой клиницист, включающий ослабление симптомов заболевания или расстройства, подлежащего лечению. Для профилактических целей (т.е. подавления начала развития или прогрессирования расстройства) термин "совместно эффективное количество" относится к такому количеству каждого активного соединения или фармацевтического средства, отдельно или в сочетании, которое ингибирует у субъекта начало развития или прогрессирование расстройства, как этого добивается исследователь, ветеринар, врач или другой клиницист,и задержка развития такого расстройства опосредована активностью модуляции обратного поглощения глюкозы или другой антидиабетической активностью (такой как RXR активность) или и тем, и другим. Таким образом, настоящее изобретение обеспечивает комбинации двух или более лекарственных средств, где, например:(a) каждое лекарственное средство независимо вводят в терапевтически или профилактически эффективном количестве;(b) по меньшей мере одно лекарственное средство в такой комбинации вводят в количестве, которое является субтерапевтическим или субпрофилактическим при его отдельном введении, но является терапевтическим или профилактическим при введении в сочетании со вторым или дополнительным лекарственными средствами в соответствии с настоящим изобретением или(c) оба лекарственных средства вводят в количестве, которое является субтерапевтическим или субпрофилактическим при введении отдельно, но эти количества являются терапевтическими или профилактическими при совместном введении. Термин "защитные группы" относится к таким известным из уровня техники группам, которые используют для защиты функциональных групп; защитные группы можно удалить в процессе последующих синтетических преобразований или путем метаболических или других процессов при введении invivo. В ходе любого из способов получения соединений по настоящему изобретению может быть необходимо и/или желательно защитить чувствительные или реакционноспособные группы в любой из молекул, которые представляют интерес. Это достигается при помощи традиционно используемых защитных групп, таких как группы, описанные в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, PlenumWileySons, 1999. Защитные группы можно удалить на удобной для этого последующей стадии, используя способы, известные из уровня техники. Примеры защитных групп для гидроксила и диола представлены ниже. Защита для гидроксильной группы включает метиловые эфиры, замещенные метиловые эфиры, замещенные этиловые эфиры, замещенные бензиловые эфиры и силиловые эфиры. Замещенные метиловые эфиры. Примеры замещенных метиловых эфиров включают метилоксиметил, метилтиометил, третбутилтиометил, (фенилдиметилсилил)метоксиметил, бензилоксиметил, п-метоксибензилоксиметил,(4-метоксифенокси)метил, трет-бутоксиметил, 4-пентенилоксиметил, силоксиметил, 2-метоксиэтоксиметил, 2,2,2-трихлорэтоксиметил, бис-(2-хлорэтокси)метил, 2-(триметилсилил)этоксиметил, тетрагидропиранил, 3-бромтетрагидропиранил, тетрагидротиопиранил, 1-метоксициклогексил, 4-метокситетра-5 010422 гидропиранил,4-метокситетрагидротиопиранил,4-метокситетрагидротиопиранилS,S-диоксидо,1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4-ил, 1,4-диоксан-2-ил, тетрагидрофуранил, тетрагидротиофуранил и 2,3,3 а,4,5,6,7,7 а-октагидро-7,8,8-триметил-4,7-метанобензофуран-2-ил. Замещенные этиловые эфиры. Примеры замещенных этиловых эфиров включают 1-этоксиэтил, 1-(2-хлорэтокси)этил,1-метил-1-метоксиэтил, 1-метил-1-бензилоксиэтил, 1-метил-1-бензилокси-2-фторэтил, 2,2,2-трихлорэтил,2-триметилсилилэтил, 2-(фенилселенил)этил, трет-бутил, аллил, п-хлорфенил, п-метоксифенил,2,4-динитрофенил, бензил и простые эфиры полиэтиленгликоля. Замещенные бензиловые эфиры. Примеры замещенных бензиловых эфиров включают п-метоксибензил, 3,4-диметоксибензил,о-нитробензил, п-галогенбензил, 2,6-дихлорбензил, п-цианобензил, п-фенилбензил, 2- и 4-пиколил,3-метил-2-пиколил N-оксидо, дифенилметил, п,п'-динитробензгидрил, 5-дибензосуберил, трифенилметил,-нафтилдифенилметил,п-метоксифенилдифенилметил,ди(п-метоксифенил)фенилметил,4-(4'-бромфенацилокси)фенилдифенилметил,4,4',4"-трис-(4,5-дихлортри(п-метоксифенил)метил,фталимидофенил)метил, 4,4',4-трис-(левулиноилоксифенил)метил, 4,4',4"-трис-(бензоилоксифенил)метил,3-(имидазол-1-илметил)-бис-(4',4"-диметоксифенил)метил,1,1-бис-(4-метоксифенил)-1'пиренилметил, 9-антрил, 9-(9-фенил)ксантенил, 9-(9-фенил-10-оксо)антрил, 1,3-бензодитиолан-2-ил и бензизотиазолил S,S-диоксидо. Силиловые эфиры. Примеры силиловых эфиров включают триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, трет-бутилдиметилсилил, третбутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил и третбутилметоксифенилсилил. Сложные эфиры. Помимо простых эфиров, гидроксильная группа может быть защищена в виде сложного эфира. Примеры сложных эфиров включают формиат, бензоилформиат, ацетат, хлорацетат, дихлорацетат,трихлорацетат,трифторацетат,метоксиацетат,трифенилметоксиацетат,феноксиацетат,п-хлорфеноксиацетат,п-Р-фенилацетат,3-фенилпропионат,4-оксопентаноат(левулинат),4,4-(этилендитио)пентаноат, пивалоат, адамантоат, кротоноат, 4-метоксикротоноат, бензоат,п-фенилбензоат, 2,4,6-триметилбензоат(мезитоат) и сложные эфиры полиэтиленгликоля. Карбонаты. Примеры карбонатов включают метил, 9-флуоренилметил, этил, 2,2,2-трихлорэтил,2-(триметилсилил)этил, 2-(фенилсульфонил)этил, 2-(трифенилфосфонио)этил, изобутил, винил, аллил,п-нитрофенил, бензил, п-метоксибензил, 3,4-диметоксибензил, о-нитробензил, п-нитробензил,S-бензилтиокарбонат, 4-этокси-1-нафтил, метилдитиокарбонат и полиэтиленгликолькарбонаты. Группы, способствующие отщеплению. Примеры групп, способствующих отщеплению, включают 2-йодбензоат, 4-азидобутират 4-нитро-4 метилпентаноат,о-(дибромметил)бензоат, 2-формилбензолсульфонат, 2-(метилтиометокси)этилкарбонат, 4-(метилтиометокси)бутират и 2-(метилтиометоксиметил)бензоат. Разные сложные эфиры. Примеры разных сложных эфиров включают 2,6-дихлор-4-метилфеноксиацетат, 2,6-дихлор-4(1,1,3,3-тетраметилбутил)феноксиацетат, 2,4-бис-(1,1-диметилпропил)феноксиацетат, хлордифенилацетат, изобутират, моносукциноат, (Е)-2-метил-2-бутеноат(тиглоат), о-(метоксикарбонил)бензоат,п-Р-бензоат, -нафтоат, нитрат, алкил N,N,N',N'-тетраметилфосфородиамидат, N-фенилкарбамат, борат,диметилфосфинотиоил и 2,4-динитрофенилсульфенат. Сульфонаты. Примеры сульфонатов включают сульфат, метансульфонат (мезилат), бензилсульфонат и тозилат. Защита для 1,2- и 1,3-диолов. Циклические ацетали и кетали. Примеры циклических ацеталей и кеталей включают метилен, этилиден, 1-трет-бутилэтилиден, 1 фенилэтилиден, (4-метоксифенил)этилиден, 2,2,2-трихлорэтилиден, ацетонид (изопропилиден), циклопентилиден,циклогексилиден,циклогептилиден,бензилиден,п-метоксибензилиден,2,4-диметоксибензилиден, 3,4-диметоксибензилиден и 2-нитробензилиден. Циклические ортоэфиры. Примеры циклических ортоэфиров включают метоксиметилен, этоксиметилен, диметоксиметилен,1-метоксиэтилиден,1-этоксиэтилиден,1,2-диметоксиэтилиден,-метоксибензилиден,1-(N,N-диметиламино)этилиденовое производное, -N,N-диметиламино)бензилиденовое производное и 2-оксациклопентилиден. Производные силила. Примеры производных силила включают ди-трет-бутилсилиленовую группу и 1,3-(1,1,3,3 тетраизопропилдисилоксанилиден)овое производное.-6 010422 Ингибиторы обратного поглощения глюкозы. Один способ лечения гипергликемии включает экскрецию избыточного количества глюкозы непосредственно в мочу, так чтобы нормализовалась концентрация глюкозы в крови. Например, котранспортеры натрия-глюкозы (SGLTs), в основном присутствующие в хорионической мембране кишечника и почек, представляют собой семейство белков, активно участвующих в нормальном процессе поглощения глюкозы. Из них SGLT1 присутствует в эпителиальных клетках кишечника и почек (Lee et al.,1994), тогда как SGLT2 обнаружен в эпителии почек (You et al., 1995, MacKenzie et al., 1994). Поглощение глюкозы в кишечнике, прежде всего, опосредовано SGLT1, высокоаффинным транспортером низкой емкости с соотношением транспорта Na+:глюкоза 2:1. SGLT2, также известный как SAAT1, транспортирует Na+ и глюкозу при соотношении 1:1 и действует как низкоаффинный транспортер высокой емкости. Эти SGLT охарактеризованы в табл. 1. Таблица 1 Обратное поглощение глюкозы в почках опосредовано SGLT1 и SGLT2 (Silverman et al., 1992;Deetjen et al., 1995). Глюкоза из плазмы фильтруется в клубочках и трансэпителиально обратно поглощается в проксимальных канальцах. SGLT1 и SGLT2 расположены в апикальных плазматических мембранах эпителия и получают свою энергию из внутреннего градиента натрия, создаваемого Na+/K+ АТФазными насосами, расположенными на базолатеральной мембране. После обратного поглощения повышенное количество глюкозы в цитозоле затем транспортируется в область кишечника при помощи транспортеров глюкозы (GLUT1 и GLUT2). Поэтому ингибирование SGLT снижает концентрацию глюкозы в плазме через подавление обратного поглощения глюкозы в почках. Терапевтически или профилактически эффективное количество ингибитора SGLT, достаточное для повышения экскреции глюкозы в мочу или для снижения концентрации глюкозы в плазме у субъекта на такое количество в день, насколько это необходимо, можно легко определить, используя способы, известные из уровня техники. Недавно было обнаружено, что флоризин - природный гликозид, присутствующий в коре и стволе растений семейства Rosaceae (например, яблоня, груша и т.п.), ингибирует котранспортеры Na+-глюкозы, расположенные в хорионической мембране кишечника и почек. Путем ингибирования активности котранспортеров Na+-глюкозы флоризин ингибирует обратное поглощение глюкозы в почечных канальцах и способствует экскреции глюкозы таким образом, что при ежедневном подкожном введении этого средства содержание глюкозы в плазме контролируется на нормальном уровне в течение длительного времени (Journal of Clinical Investigation, 1987, vol. 79, p. 1510). Другие ингибиторы SGLT включают алкил- и фенилглюкозиды, 1-5-изохинолинсульфонил-2 метилпиперазин-HCl (опосредованно через протеинкиназу C), п-хлормеркурибензоат (PCMB),N,N'-дициклогексилкарбодиимид (DCCD), ионы меди и кадмия и трехвалентные лантаниды.-7 010422 В. Соединения. Настоящее изобретение направлено на соединения формулы где R1 представляет собой H, С 1-4 алкил или R4R5N-(CO)-; каждый из R4 и R5 независимо представляет собой C1-5 алкил;Z является замещенным или незамещенным и выбран из C3-7 циклоалкила, фенила, 5- или 6 членного гетероциклила, содержащего 1 или 2 гетероатома, независимо выбранных из N, О и S, 9- или 10-членного конденсированного бициклила (такого как нафтил) или конденсированного гетеробициклила, где конденсированный гетеробициклил содержит от 1 до 4 гетероатомов (и предпочтительно от 1 до 2 гетероатомов), независимо выбранных из N, O и S. Примеры соединений формулы (I) включают такие соединения, где:(d) Z является незамещенным или независимо замещенным 1-3 заместителями, независимо выбранными из C1-4 алкокси, фенокси, C1-4 алкила, C3-6 циклоалкила, галогена, гидрокси, циано, амино,C1-4 алкилтио, C1-4 алкилсульфонил, C1-4 алкилсульфинил, C1-4 аминоалкил, моно и ди(C1-4 алкил,амино,фенил,C1-4-ди(C1-4 алкил) амино,фенила,C1-4 алкилминосульфонила(NHCOR), C1-4 алкилкарбамидо (CONHR), 5-6-членного гетероциклила, содержащего от 1 до 3 гетероатомов, независимо выбранных из N, S и О; и где заместитель(и) у Z могут быть дополнительно независимо замещены 1-3 заместителями, независимо выбранными из C1-4 алкокси, C1-4 алкила, галогена, гидрокси,циано, амино, моно- или ди(C1-4 алкил) амино и C1-4 алкилтио;(e) Z представляет собой 4-замещенный фенил, 3,4-дизамещенный фенил, бензгидрил, замещенный или незамещенный тиофен, биарил, бензофуранил, дигидробензофуранил, 4-замещенный пиридил, бензо[b]тиенил, хроманил, бензотиофенил, инданил или нафтил;(f) Z является незамещенным или замещеным 1-2 заместителями, независимо выбранными из метокси, этокси, фтора, хлора, метила, этила, пропила, бутила и изопропила;-(CH2)n- и n представляет собой 1 или 2 и Z представляет собой 4-замещенный фенил, 3,4-дизамещенный фенил, бензгидрил, замещенный или незамещенный тиофен, биарил, бензофуранил, дигидробензофуранил, 4-замещенный пиридил, бензо[b]тиенил, хроманил, бензотиофенил, инданил, орнафтил;(l) R1 представляет собой H; R2 представляет собой H, метил или этил; где Z представляет собой 4-замещенный фенил, 3,4-дизамещенный фенил, бензгидрил, замещенный или незамещенный тиофен,биарил, бензофуранил, дигидробензофуранил, 4-замещенный пиридил, бензо[b]тиенил, хроманил, бензотиофенил, инданил или нафтил и Z является незамещенным или замещен 1-2 заместителями, независимо(m) и сочетания указанных выше значений. Предпочтительные примеры включают: 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-1H-индол-4-илоксиD-глюкопиранозид; 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-1-метил-1H-индол-4-илоксиD-глюкопиранозид; 2-3-[2-(4-метоксифенил)этил]-1H-индол-4-илоксиD-глюкопиранозид; 2-[3-(4-этилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-О-метоксикарбонилD-глюкопиранозид; 2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-O-этоксикарбонилD-глюкопиранозид; 2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-O-гексаноилD-глюкопиранозид; 2-[3-(4-метилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-(3-бифенил-4-илметил-1H-индол-4-илокси)D-глюкопиранозид; 2-[3-(4-этоксибензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-метилсульфанилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензил)-6-метил-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-тиофен-3-илбензил)-1H-индол-4-илокси]D-глюкопиранозид и 2-[3-(4-пиридин-3-илбензил)-1H-индол-4-илокси]D-глюкопиранозид. Следующие примеры предпочтительных соединений включают: 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-1H-индол-4-илокси-6-О-ацетилD-глюкопиранозид; 2-[3-(2-бензо[1,3]диоксол-5-илэтил)-1H-индол-4-илокси]D-глюкопиранозид; 2-3-[2-(2,3-дигидробензо[1,4]диоксин-6-ил)этил]-1H-индол-4-илоксиD-глюкопиранозид; 2-[3-(2-нафталин-2-илэтил)-1H-индол-4-илокси]D-глюкопиранозид; 2-3-[2-4-этоксифенил)этил]-1H-индол-4-илоксиD-глюкопиранозид; 2-3-[2-(4-метоксифенил)этил]-6-метил-1H-индол-4-илоксиD-глюкопиранозид; 2-[3-(3-фтор-4-метилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-пропилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-изопропилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-2-фторбифенил-4-илметил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-метоксибензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(3-фтор-4-метоксибензил)-1H-индол-4-илокси]-D-глюкопиранозид; 2-[3-(4-феноксибензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-хлорбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-(3-нафталин-2-илметил-1H-индол-4-илокси)D-глюкопиранозид и 2-[3-(4-этилбензил)-2-метил-1H-индол-4-илокси]D-глюкопиранозид. Дополнительные примеры соединений настоящего изобретения включают: 2-3-[2-(4-этилфенил)этил]-1H-индол-4-илоксиD-глюкопиранозид; 2-[1-диэтилкарбамоил-3-(4-метоксибензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-метоксибензил)-1-метил-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензил)-1-изопропил-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-метил-2-тиенил-(1H-индол-4-илокси)D-глюкопиранозид; 2-[3-(2,3-дигидробензофуран-5-илметил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензоил)-1H-индол-4-илокси]D-глюкопиранозид и 2-[3-(4-метоксифенил)-1H-индол-4-илокси]D-глюкопиранозид. Дополнительные примеры включают: 2-[3-(4-циклопропилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-пиразол-1-илбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[6-хлор-3-(4-этилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензил)-6-фтор-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(5-этилтиофен-2-илметил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(5-пропилтиофен-2-илметил)-1H-индол-4-илокси]D-глюкопиранозид и 2-[3-(5-фенилтиофен-2-илметил)-1H-индол-4-илокси]D-глюкопиранозид.-9 010422 Более предпочтительные соединения включают в себя: 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-1H-индол-4-илоксиD-глюкопиранозид; 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-1-метил-1H-индол-4-илоксиD-глюкопиранозид; 2-[3-(3-фтор-4-метилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-метилсульфанилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензил)-6-метил-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-метилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-O-метоксикарбонилD-глюкопиранозид; 2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-О-этоксикарбонилD-глюкопиранозид; 2-[3-(4-пропилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-(3-(4-тиофен-3-илбензил)-1H-индол-4-илокси)D-глюкопиранозид; 2-[3-(4-циклопропилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-пиразол-1-илбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[6-хлор-3-(4-этилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензил)-6-фтор-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(5-этилтиофен-2-илметил)-1H-индол-4-илокси]D-глюкопиранозид и 2-[3-(5-фенилтиофен-2-илметил)-1H-индол-4-илокси]D-глюкопиранозид. Наиболее предпочтительными соединениями являются 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-1H-индол-4-илоксиD-глюкопиранозид; 2-[3-(4-этилбензил)-1H-индол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензил)-1H-индол-4-илокси]-6-O-этоксикарбонилD-глюкопиранозид и 2-(3-(4-тиофен-3-илбензил)-1H-индол-4-илокси)D-глюкопиранозид.C. Способы синтеза. Соединения по настоящему изобретению можно получить в соответствии с традиционными методами органического синтеза, а также в соответствии с комбинаторными методами синтеза или методами матричного синтеза. Следующие три схемы и химические примеры 1-38 представляют общее руководство. Схема 1 Соединения по настоящему изобретению, где R3 представляет собой H и Z представляет собой ароматическое кольцо, можно получить, как показано на схемах 1 и 3. Соединения формулы 1, где R2 представляет собой любую группу, отличную от водорода, определеную в п.1, можно получить из коммерчески доступного или легко получаемого 4-замещенного 2-гидроксибензальдегида (Acta Chem. Scand 1999,53, 258; WO 2003043621), как описано Fresneda et. al. (Tetrahedron 2001, 57, 2355-2363). Соединения формулы 2, где P1 представляет собой бензил или метил и P2 представляет собой бензолсульфонил, можно получить йодированием коммерчески доступного 4-бензилоксииндола или 4-метоксииндола, или соединений формулы 1, где R2 представляет собой любую группу, отличную от водорода, определеную в п.1, используя хлорйодид, в присутствии основания, такого как пиридин, в дихлорметане с последующей защитой азота индола бензолсульфонильной группой. Соединения формулы 3 можно получить путем сочетания соединений формулы 2 с выбранными арил- или гетероарилбороновыми кислотами, используя известные условия реакции сочетания Сузуки(Suzuki) [Miyaura.N.; Suzuki, A.; Chem. Rev. 1995, 95, 2457-2483]. Соединения формулы 3, где Z представляет собой биарил, можно получить либо путем сочетания коммерчески доступных биарилбороновых кислот, либо через две последовательные реакции сочетания. Первая реакция сочетания присоединяет коммерчески доступную 4-хлорфенилбороновую кислоту с последующим присоединением второй- 10010422 арил- или гетероарилбороновой кислоты в условиях реакции сочетания Сузуки. У азота индола в соединениях формулы 3 может быть удалена защита при помощи основания, такого как гидроксид калия, в кипящем этаноле с получением соединений формулы 5. Натриевую соль соединения 5 обрабатывают алкилгалогенидом с получением N-алкилированного (R1) продукта с последующим гидрированием с использованием палладиевого катализатора при давлении водорода 10-30 фунт/кв.дюйм с получением соединений формулы 6. Соединение формулы 2 также можно обработать этилмагнийбромидом при 0C в безводном ТГФ с последующим добавлением арилкарбоксальдегида с получением индолкарбинола. Неочищенный индолкарбинол можно восстановить при помощи триэтилсилана и хлорида олова в дихлорметане при -78C с получением соединений формулы 9, где n имеет значение 1. Защитные группы фенола в соединениях формулы 3 или 9 можно удалить при помощи трибромида бора при -78C в хлорированном растворителе, когда P1 представляет собой метил, или в условиях каталитического гидрирования при давлении водорода в пределах 10-40 фунт/кв.дюйм, когда P1 представляет собой бензил, с получением соединений формулы 4 или 10. Схема 2 Соединения по настоящему изобретению, где n имеет значение 1 или 2, можно получить, как показано на схемах 2 и 3. Соединения формулы 1, где R2 представляет собой водород и R3 представляет собой любую группу, отличную от водорода, определенную в п.1, можно получить из 3-амино-о-крезола или 2-метил-3-фенилметоксианилина (Pitzele, et al. EP 155635, 1985), как описано Dillard et al. (J. Med. Chem. 1996, 39, 5119-5136). Соединения формулы 7, где P1 представляет собой бензил, можно получить формилированием соединений формулы 1 при помощи оксихлорида фосфора в известных реакционных условиях. Азот индола синтезированных соединений формулы 7 или коммерчески доступного 4-бензилокси-1H-индол-3 карбоксальдегида может быть защищен путем обработки либо ди-трет-бутилдикарбонатом, либоN,N-диэтилкарбамилхлоридом с получением соединений формулы 8. Такие защищенные индолы можно обработать илидами в стандартных условиях реакции Виттига (Wittig) с получением смеси E/Z соединений. Восстановление алкена обеспечивает соединения формулы 9, где n имеет значение 2. Соединение формулы 8 также можно обработать арилмагнийбромидом в ТГФ с получением индолкарбинола. Неочищенный индолкарбинол можно восстановить при помощи триэтилсилана и хлорида олова в дихлорметане при -78C с получением соединений формулы 9, где n имеет значение 1. Альтернативно, соединения формулы 1, где R2 и P1 представляют собой метил и R3 представляет собой водород, или коммерчески доступный 4-метоксииндол можно обработать замещенными бензоилхлоридами, используя стандартные условия ацилирования Фриделя-Крафта (Friedel-Craft) с последующей защитой азота индола при помощи бензолсульфонилхлорида с получением соединений формулы 11. Последующее восстановление при помощи борогидрида натрия в присутствии трифторуксусной кислоты в хлорированном растворителе может дать соединения формулы 9. Соединения формулы 11, где Z представляет собой 4-бромфенил, можно затем сочетать с замещенными арил- или гетероарилбороновыми- 11010422 кислотами в стандартных условиях реакции Сузуки с получением биарильных аналогов. Защитные группы фенола в соединениях формулы 9 или 11 можно удалить при помощи трибромида бора при -78C в хлорированном растворителе, когда P1 представляет собой метил, или в условиях каталитического гидрирования при давлении водорода в пределах 10-40 фунт/кв.дюйм, когда P1 представляет собой бензил, с получением соединений формулы 10 или 14. У азота индола в соединениях формулы 9 можно удалить защиту путем обработки трифторуксусной кислотой в хлорированном растворителе при 0C для удаления BOC-группы или путем обработки водным раствором основания, такого как гидроксид натрия, для удаления N,N-диэтилкарбамильной группы, с получением соединений формулы 12. Последующее алкилирование азота индола с последующим удалением защитных групп у фенольной группы, как описано выше, обеспечивает соединения формулы 13. Альтернативно, соединения формулы 12, где n имеет значение 1 и R3 представляет собой любую группу, отличную от водорода, можно получить непосредственно из соединения формулы 1 и ароматического альдегида в присутствии триэтилсилана и трифторуксусной кислоты в дихлорметане при 0C Соединения формулы 17, где Q и Z имеют значения, указанные в п.1, и R1 представляет собой водород, можно получить из соединений формулы 15 (имеющих формулу 4, где Q отсутствует, или формулы 10, где Q представляет собой (CH2)n и n имеет значение 1 или 2, или формулы 14, где Q представляет собой C=O), полученных на схемах 1 или 2, путем гликозилирования фенольной группы при помощи 2,3, 4, 6-тетра-O-ацетилD-глюкопиранозилбромида в подходящем растворителе, таком как ацетон, ацетонитрил или ДМФА, в щелочных условиях, например, с использованием карбоната калия или карбоната лития. Удаление защиты у азота индола и ацетильных групп можно осуществить в одну стадию при помощи основания, такого как гидроксид калия или гидроксид натрия, в кипящем этаноле с получением соединений формулы 18, где P представляет собой H. Соединения формулы 18, где Q и Z имеют значения, указанные в п.1, P представляет собой H и R1 представляет собой либо H, либо любую группу, отличную от водорода, можно получить из соединений формулы 16 (имеющих формулу 6, где Q отсутствует, или формулу 13, где Q представляет собой (CH2)n и n имеет значение 1 или 2), полученных на схемах 1 и 2, путем гликозилирования фенольной группы,как описано выше, с последующим удалением защитных групп в спиртовом растворителе, таком как метанол, в умеренных щелочных условиях, например используя карбонат калия или метоксид натрия, при комнатной температуре. Соединения формулы 18, где P представляет собой H, можно обработать одним эквивалентом алкилхлорформиата или алкилхлорангидрида в коллидине для селективного ацилирования 6-OH группы глюкозы с получением соединений формулы 18, где P представляет собой ацильную или алкоксикарбонильную группу.D. Дополнительные антидиабетические средства. Антидиабетические средства, которые можно использовать в соответствии с настоящим изобретением в качестве второго или третьего антидиабетического средства в составе фармацевтической композиции, препарата или комбинированного способа лечения (режим), включают, но не ограничиваются этим, средства, указанные в табл. 2.E. Комбинации. Настоящее изобретение направлено на комбинированную терапию, включающую введение ингибитора обратного поглощения глюкозы, такого как ингибитор SGLT, и по меньшей мере одного антидиабетического средства для лечения диабета или синдрома X либо связанных с ними симптомов или осложнений. Продемонстрированная эффективность ингибиторов SGLT в различных моделях NIDDM является подтверждением применимости настоящего лекарственного средства отдельно для лечения NIDDM у человека. Поскольку ингибиторы обратного поглощения глюкозы имеют механизм действия, который отличается от механизма действия других антидиабетических средств, таких как модуляторы RXR, раскрываемая комбинация может обладать преимуществом снижения количества любого лекарственного средства, необходимого для достижения совместной терапевтической или фармацевтической эффективности, по сравнению с использованием такого средства отдельно, снижая, таким образом, один или более побочных эффектов, которые часто включают увеличение веса, отек, гипертрофию сердца, гепатогипертрофию, гипогликемию или гепатотоксичность либо любое их сочетание. Настоящее изобретение обеспечивает способ лечения диабета или синдрома X либо их осложнений у субъекта, при этом указанный способ включает введение указанному субъекту совместно эффективного количества ингибитора обратного поглощения глюкозы в сочетании с совместно эффективным количеством антидиабетического средства. В одном аспекте настоящего изобретения антидиабетическое средство представляет собой агонист или антагонист RXR, который повышает чувствительность к инсулину у субъекта. Способы определения активности средства, направленной на повышение чувствительности к инсулину, хорошо известны из уровня техники. Например, инсулин-сенсибилизирующее средство может повышать толерантность к глюкозе у субъекта в пероральном тесте переносимости глюкозы. В частности, диабет или синдром X либо связанные с ними симптомы или осложнения выбраны изIDDM, NIDDM, IGT и IFG. В частности, ингибитор обратного поглощения глюкозы представляет собой ингибитор SGLT1 и/или SGLT2. Более конкретно, ингибитор обратного поглощения глюкозы выбран из соединения формулы (III) и его производного. Для медицинского применения соль или соли соединений формулы (III) относятся к нетоксичной"фармацевтически приемлемой соли или солям". Однако можно использовать другие соли для получения соединений по настоящему изобретению или их фармацевтически приемлемых солей. Примеры органических или неорганических кислот включают, но не ограничиваются этим, хлористо-водородную, бромисто-водородную, йодисто-водородную, перхлорную, серную, азотную, фосфорную, уксусную, пропионовую, гликолевую, молочную, янтарную, малеиновую, фумаровую, яблочную, винную, лимонную,бензойную, миндальную, метансульфоновую, гидроксиэтансульфоновую, бензолсульфоновую, щавелевую, памовую, 2-нафталинсульфоновую, п-толуолсульфоновую, циклогексансульфаминовую, салициловую, сахариновую или трифторуксусную кислоты. Примеры основных/катионных солей включают, но не ограничиваются этим, соли бензатина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглуми- 17010422 на, прокаина, алюминия, кальция, лития, магния, калия, натрия или цинка. Соединения формулы (III) или их фармацевтически приемлемые соли могут включать их внутримолекулярные соли, или их сольваты,или гидраты.F. Введение, составление композиций и дозы. Применимость раскрываемых соединений, композиций и комбинаций для лечения расстройств глюкозного и липидного метаболизма можно определить в соответствии с процедурами, хорошо известными из уровня техники (см. ссылочные документы, указанные ниже), а также процедурами, описанными в патентах США 5424406, 5731292, 5767094, 5830873, 6048842, WO 01/16122 и WO 01/16123, которые включены в настоящее изобретение посредством ссылки. Соединение можно вводить пациенту любым традиционным путем введения, включая, но не ограничиваясь этим, внутривенный, пероральный,подкожный, внутримышечный, внутрикожный и парентеральный. Предпочтительно композиции предназначены для перорального введения. Настоящее изобретение также обеспечивает фармацевтические композиции, включающие один или несколько ингибиторов обратного поглощения глюкозы и одно или несколько антидиабетических средств в ассоциации с фармацевтически приемлемым носителем. Суточная доза продуктов может варьировать в широких пределах, от 1 до 1000 мг на взрослого человека в день. Для перорального введения композиции предпочтительно обеспечивать в форме таблеток,содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250 или 500 мг активного ингредиента, для симптоматического регулирования дозы для пациента, подлежащего лечению. Соединения можно вводить по схеме от 1 до 2 раз в день. Однако дозы можно варьировать в зависимости от потребностей пациентов, тяжести состояния, подлежащего лечению и от используемого соединения. Можно использовать либо ежедневное введение, либо постпериодическое дозирование. Предпочтительно такие композиции обеспечивают в стандартных лекарственных формах, таких как таблетки, пилюли,капсулы, порошки, гранулы, стерильные парентеральные растворы или суспензии, дозируемые аэрозоли или жидкие спреи, капли, ампулы, автоматические инжекторные устройства или суппозитории; для перорального, парентерального, интраназального, подъязычного или ректального введения либо для введения путем ингаляции или инсуффляции. Альтернативно композиция может быть представлена в форме,подходящей для введения раз в неделю или раз в месяц; например, нерастворимая соль активного соединения, такая как деканоат, может быть приспособлена для получения депо препарата для внутримышечной инъекции. Для получения твердых композиций, таких как таблетки, активный ингредиент или ингредиенты смешивают с фармацевтическим носителем, например, традиционно используемым при таблетировании ингредиентами, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, дикальцийфосфат или смолы и другие фармацевтические разбавители,например вода, с получением твердой предварительной композиции, содержащей гомогенную смесь одного или нескольких ингибиторов обратного поглощения глюкозы и одного или нескольких антидиабетических средств или их фармацевтически приемлемых солей. Когда указано, что такие предварительные композиции являются гомогенными, это значит, что активный ингредиент или ингредиенты диспергированы равномерно в композиции, так чтобы композицию можно было легко разделить на равно эффективные лекарственные формы, такие как таблетки, пилюли и капсулы. Такую твердую предварительную композицию затем подразделяют на стандартные лекарственные формы типа, описанного выше,содержащие от 0,1 до около 500 мг активного ингредиента или ингредиентов по настоящему изобретению. На таблетки или пилюли новой композиции можно нанести покрытие или их можно каким-либо иным образом скомпаундировать для получения лекарственной формы, обладающей таким преимуществом, как пролонгированное действие. Например, таблетка или пилюля может содержать внутренний и внешний компонент дозы, причем последний имеет форму оболочки, заключающей в себе первый. Эти два компонента могут быть разделены энтеросолюбильным слоем, который служит для предотвращения разложения в желудке и позволяет внутреннему компоненту проходить интактным в двенадцатиперстную кишку или задерживает его высвобождение. Для таких энтеросолюбильных слоев или покрытий можно использовать различные вещества, при этом такие вещества включают различные полимерные кислоты с такими веществами, как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы, в которые могут быть включены новые композиции по настоящему изобретению для введения перорально или путем инъекции, включают водные растворы, имеющие подходящие отдушки сиропы, водные или масляные суспензии и эмульсии с отдушками, которые содержат пищевые масла, такие как масло семян хлопчатника, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и подобные фармацевтические наполнители. Подходящие диспергаторы или суспендирующие вещества для водных суспензий включают синтетические и природные смолы, такие как трагакант, аравийская камедь, альгинат, декстран, натрий карбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин. Жидкие формы для имеющих подходящий вкус или запах суспендирующих агентов или диспергаторов могут также включать синтетические и природные смолы, например,такие как трагакант, аравийская камедь, метилцеллюлоза и т.п. Для парентерального введения желательны стерильные суспензии и растворы. Изотонические препараты, как правило, содержащие подходящие консерванты, используют, когда желательно внутривенное введение.- 18010422 Обеспечивается такое преимущество, что комбинации одного или нескольких ингибиторов обратного поглощения глюкозы по настоящему изобретению можно вводить отдельно или в сочетании с одним или несколькими антидиабетическими средствами в виде одной суточной дозы или общее количество суточной дозы можно вводить в виде раздельных доз два, три или четыре раза в день. Более того, один или несколько ингибиторов обратного поглощения глюкозы и/или одно или несколько антидиабетических средств по настоящему изобретению можно вводить в интраназальной лекарственной форме путем местного применения подходящих интраназальных носителей или с использованием наносимых на кожу пластырей для чрескожного введения, хорошо известных специалистам средней квалификации. В случае использования чрескожной системы доставки для введения лекарственного средства введение дозы, конечно, должно быть непрерывным, а не прерывистым на протяжении всего режима введения. Например, для перорального введения в форме таблетки или капсулы активный лекарственный компонент может быть объединен с пероральным нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Более того, когда это желательно или необходимо, в смесь также могут быть включены подходящие связующие: смазывающие вещества, разрыхлители и красители. Подходящие связующие включают, без ограничения, крахмал, желатин, природные сахара,такие как глюкоза или бета-лактоза, сахаристые вещества из кукурузы, природные и синтетические смолы, такие как аравийская камедь, трагакант или олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Разрыхлители включают, без ограничения, крахмал, метилцеллюлозу, агар, бентонит, ксантановую смолу и т.п. Когда настоящее изобретение направлено на введение комбинации, совместное введение соединений может быть одновременным, последовательным или в одной фармацевтической композиции. Когда соединения вводят отдельно, количество доз каждого соединения, вводимых в день, необязательно должно быть одинаковым, например, у одного соединения продолжительность действия может быть больше и поэтому его нужно вводить реже. Оптимальные дозы для введения могут быть легко определены специалистом в данной области, и они будут варьировать в зависимости от конкретного используемого соединения, активности препарата,способа введения и стадии заболевания. Кроме того, факторы, связанные с конкретным пациентом, которого лечат, включая возраст, вес, режим питания пациента и время введения, влияют на необходимость коррекции доз. Новые композиции по настоящему изобретению также можно вводить в форме липосомных систем доставки, таких как малые однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы можно получить из различных липидов, включая, но не ограничиваются этим, амфипатические липиды, так как фосфатидилхолины, сфингомиелины, фосфатидилэтаноламины, кардиолипины, фосфатидилсерины, фосфатидилглицерины, фосфатидиновые кислоты, фосфатидилинозиты, диацилтриметиламмонийпропаны, диацилдиметиламмонийпропаны и стеариламин, нейтральные липиды,такие как триглицериды, и их сочетания. Они могут содержать холестерин либо могут не содержать холестерина. Из формулы (I) и других раскрываемых формул следует, что некоторые соединения в композициях по настоящему изобретению могут содержать один или несколько асимметричных атомов углерода в своей структуре. Предполагается, что настоящее изобретение охватывает стереохимически чистые изомерные формы соединений, а также их рацематы. Стереохимически чистые изомерные формы можно получить с применением правил, известных из уровня техники. Диастереоизомеры можно разделить при помощи способов физического разделения, таких как фракционная кристаллизация и хроматографическое разделение, а энантиомеры можно отделить друг от друга путем селективной кристаллизации диастереомерных солей с использованием оптически активных кислот или оснований или путем хиральной хроматографии. Чистые стереоизомеры также могут быть получены синтетически из подходящих стереохимически чистых исходных веществ или при помощи стереоспецифических реакций. Некоторые соединения в композициях по настоящему изобретению могут содержать различные индивидуальные изомеры, такие как транс- и цис-, и различные альфа- и бета-присоединения (ниже и выше плоскости схемы). Кроме того, когда способы получения соединений по настоящему изобретению приводят к получению смеси стереоизомеров, такие изомеры можно разделить традиционными методами,такими как препаративная хроматография. Соединения могут быть получены в виде отдельного стереоизомера или в рацемической форме в виде смеси некоторых возможных стереоизомеров. Нерацемические формы можно получить либо путем синтеза, либо путем разделения. Соединения, например, можно разделить на составляющие их энантиомеры стандартными методами, такими как образование диастереомерных пар путем солеобразования. Соединения также можно разделить путем ковалентного связывания с хиральным вспомогательным агентом с последующим хроматографическим разделением и/или кристаллографическим разделением и удалением хирального вспомогательного агента. Альтернативно,соединения можно разделить, используя хиральную хроматографию. Если не указано иное, предполагается, что настоящее изобретение охватывает все такие изомеры или стереоизомеры per se, а также смеси цис- и транс-изомеров, смеси диастереомеров и рацемические смеси энантиомеров (оптические изомеры).- 19010422 Терапевтический эффект ингибитора обратного поглощения глюкозы, вводимого в сочетании с антидиабетическим средством при лечении диабета, синдрома X или связанных с ними симптомов или осложнений, может быть продемонстрирован при помощи способов, известных из уровня техники. Представленные ниже примеры комбинированного лечения при помощи ингибиторов SGLT и антидиабетических средств предназначены для иллюстрации настоящего изобретения, а не для его ограничения.G. Примеры химического синтеза. Один аспект настоящего изобретения направлен на соединения формулы (I), как описано выше в разделе "Краткое описание изобретения", в описании и прилагаемой формуле изобретения. Такие раскрываемые соединения могут быть получены в соответствии с традиционными способами синтеза, принятыми в органической химии, или в соответствии со способами матричной или комбинаторной химии. Приведенные ниже схемы и примеры обеспечивают общее руководство. Спектры 1H ЯМР получали на спектрометре Brucker AC-300 (300 МГц), используя тетраметилсиланA. Диэтиламид 4-бензилокси-3-формилиндол-1-карбоновой кислоты. К суспензии гидрида натрия (1,52 г, 38 ммоль) в безводном ТГФ (48 мл) добавляли по каплям раствор 4-бензилокси-1H-индол-3-карбальдегида (7,93 г, 32 ммоль) в безводном ТГФ (80 мл) при 0C. После перемешивания при 0C в течение 15 мин к реакционной смеси добавляли по каплямN,N-диэтилкарбамилхлорид (4,76 мл, 38 ммоль). Смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь затем гасили водой и экстрагировали этилацетатом. Органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток кристаллизовали из смеси эфир/гексан с получением указанного в заголовке соединения (8,93 г, 80%) в виде белого твердого вещества.(полученного в соответствии с Harrowven, D.C. et al. in Tetrahedron, 2001, 57, 4447-4454) в ТГФ (200 мл) при -78C добавляли LDA (10,6 мл, 21,05 ммоль) и полученную реакционную смесь оставляли для перемешивания при -78C в течение 1 ч. Затем добавляли альдегид, полученный на предыдущей стадии(2,5 г, 7,14 ммоль) и полученную реакционную смесь оставляли для перемешивания при комнатной температуре в течение 2 ч. Реакционную смесь выливали в 0,2 М HCl и экстрагировали этилацетатом. Объединенные этилацетатные экстракты промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Хроматография (SiO2, элюент 0-25% этилацетат-гексан) давала желаемое соединение с количественным выходом.C. Диэтиламид 3-[2-(2,3-дигидробензофуран-5-ил)этил]-4-гидроксииндол-1-карбоновой кислоты. К раствору винилмочевины, полученной на стадии B (400 мг, 0,86 ммоль), в EtOAc (10 мл) и EtOH(10 мл) при комнатной температуре добавляли 10% Pd/C (80 мг) и полученную реакционную смесь оставляли для перемешивания в аппарате Парра (Parr) при давлении водорода 10 фунт/кв.дюйм в течение 5 ч. После извлечения из аппарата Парра реакционную смесь фильтровали через слой целита и фильтрат концентрировали в вакууме. Хроматография (SiO2, элюент 0-25% этилацетат-гексан) давала 1,1 г желаемого соединения (теоретически 1,62 г, выход 68%).D. 2-3-[2-(2,3-Дигидробензофуран-5-ил)этил]-1H-индол-4-илокси-2,3,4,6-тетра-О-ацетилDглюкопиранозид. К раствору мочевины, полученной на стадии C (1 г, 2,65 ммоль), в ацетоне (8 мл) при комнатной температуре добавляли карбонат калия (1,82 г, 13,2 ммоль) с последующим добавлением 2,3,4,6-тетра-ОацетилD-глюкопиранозилбромида (1,17 г, 5,27 ммоль) и полученную реакционную смесь оставляли для перемешивания при комнатной температуре в течение 72 ч. Реакционную смесь фильтровали через целит и фильтрат промывали этилацетатом. Объединенные органические слои концентрировали в вакууме. Хроматография (SiO2, элюент 0-20% этилацетат-гексан) давала 0,54 г желаемого соединения (теоретически 1,87 г, выход 29%).E. 2-3-[2-(2,3-Дигидробензофуран-5-ил)этил]-1H-индол-4-илоксиD-глюкопиранозид. К раствору ацетилиндола, полученного на стадии D (530 мг 0,75 ммоль), в этаноле (50 мл) добавляли 25% NaOH (16 мл) и полученную реакционную смесь оставляли для перемешивания при кипячении с обратным холодильником в течение 3 ч. Реакционную смесь разбавляли водой (200 мл) и pH доводили до 11 добавлением 1 н. HCl. Реакционную смесь затем концентрировали в вакууме для удаления этанола.- 20010422 Водный слой экстрагировали этилацетатом. Объединенные этилацетатные экстракты промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в вакууме. Хроматография (SiO2, элюент 0-10% MeOH-CH2Cl2) давала 290 мг желаемого соединения в виде белого твердого вещества (теоретический выход 330 мг, выход 88%). 1 Указанное в заголовке соединение выделяли в виде побочного продукта в примере 1, часть E. 1A. 4-бензилокси-1-метил-1H-индол-3-карбальдегид. К раствору коммерчески доступного 4-бензилокси-1H-индол-3-карбальдегида (1 г, 3,98 ммоль) в ДМФА (15 мл) при 0C добавляли NaH (262 мг, 8,75 ммоль, 80% дисперсия в масле) с последующим добавлением метилйодида (0,25 мл, 3,98 ммоль) и полученную реакционную смесь оставляли для перемешивания при комнатной температуре в течение 6 ч. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенные этилацетатные экстракты промывали насыщенным солевым раствором,сушили над безводным сульфатом натрия и концентрировали в вакууме с получением желаемого соединения с количественным выходом.B. 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-1-метил-1H-индол-4-илоксиD-глюкопиранозид. Указанное в заголовке соединение получали из 4-бензилокси-1-метил-1H-индол-3-карбальдегида(получение описано в части А) и [2,3-дигидробензофуран-5-ил)метил]трифенилфосфонийбромида по той же методике, как описано на стадии B-E в примере 1. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты, полученного на стадии A примера 1, и 5-пиперонилметилтрифенил- 21010422 фосфонийбромида по той же методике, как описано в примере 1. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и 2,3-дигидробензо[1,4]диоксо-6-метилтрифенилфосфонийбромида по той же методике, как описано в примере 1. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и 2-нафтилметилтрифенилфосфонийхлорида по той же методике, как описано в примере 1. 1 Н ЯМР (300 МГц, CD3COCD3)9,89 (ушир. с, 1H), 7,9-7,75 (м, 4H), 7,55-7,35 (м, 3H), 7,1-6,9 (м,3H), 6,74 (6, J=7 Гц, 1H), 5,26 (д, J=7 Гц, 1H), 4,5-4,4 (м, 2H), 3,95-3,85 (м, 1H), 3,8-3,55 (м, 6H), 3,45-3,35 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и 4-метоксибензилтрифенилфосфонийхлорида по той же методике, как описано в примере 1. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и 4-этоксибензилтрифенилфосфонийхлорида по той же методике, как описано в примере 1. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и (4-этилбензил)трифенилфосфонийхлорида по той же методике, как описано в примере 1. 1A. 2-бензилокси-4-метилбензальдегид. К раствору коммерчески доступного 2-гидрокси-4-метилбензальдегида (20 г, 147,05 ммоль) в ДМФА (200 мл) при 0 С добавляли гидрид натрия (6,47 г, 161,76 ммоль, 60% дисперсия в масле) с последующим добавлением по каплям бензилбромида (19,3 мл, 161,76 ммоль). По завершении добавления бензилбромида ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенные этилацетатные экстракты сушили над безводным сульфатом натрия и концентрировали в вакууме. Хроматография (SiO2, элюент 2-5% EtOAc-гексан) давала 29,58 г желаемого продукта в виде белого твердого вещества (теоретически 33,24 г, выход 89%).B. Этиловый эфир 2-азидо-3-(2-бензилокси-4-метилфенил)акриловой кислоты. К раствору этоксида натрия (46 мл, 3,1 М в этаноле) в этаноле (50 мл) при -15C добавляли по каплям раствор альдегида, полученного на предыдущей стадии (4 г, 17,7 ммоль), и этилазидоацетат (23 мл,53,09 ммоль, 2,3 М раствор в дихлорметане) и полученную реакционную смесь оставляли для перемешивания при 15C в течение 72 ч. Реакционную смесь выливали в насыщенный раствор бикарбоната натрия и экстрагировали этилацетатом. Объединенные этилацетатные экстракты сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт (4,15 г) использовали без дополнительной очистки на следующей стадии последовательности синтеза.C. Этиловый эфир 4-бензилокси-6-метил-1 Н-индол-2-карбоновой кислоты. Раствор азидосоединения, полученного на предыдущей стадии (4,15 г), в толуоле (60 мл) кипятили с обратным холодильником в течение 18 ч. Реакционную смесь концентрировали в вакууме. Хроматография (SiO2, элюент 5-10% EtOAC-гексан) давала 2,52 г желаемого продукта в виде желтого твердого- 23010422 вещества (5,47 г, выход от двух стадий 46%).D. 4-бензилокси-6-метил-1 Н-индол-2-карбоновая кислота. К раствору эфира, полученного на предыдущей стадии (500 мг, 1,62 ммоль), в тетрагидрофуране(4 мл) при комнатной температуре добавляли гидроксид лития (240 мг, 10 ммоль) с последующим добавлением воды (2 мл) и метанола (2 мл) и полученную реакционную смесь оставляли для перемешивания при комнатной температуре в течение 72 ч. Реакционную смесь выливали в 15% лимонную кислоту и экстрагировали этилацетатом. Объединенные этилацетатные экстракты сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 437 мг желаемого продукта в виде не совсем белого твердого вещества (теоретически 455 мг, выход 96%).E. 4-Бензилокси-6-метил-1H-индол. К раствору кислоты, полученной на предыдущей стадии (150 мг, 0,53 ммоль), в хинолине (2 мл) при комнатной температуре добавляли порошок меди (10 мг, 0,16 ммоль) и полученную реакционную смесь оставляли для перемешивания при 235C в течение 900 с в микроволновом реакторе. Реакционную смесь выливали в 1 н. HCl и экстрагировали этилацетатом. Объединенные этилацетатные экстракты сушили над безводным сульфатом натрия и концентрировали в вакууме. Хроматография (SiO2) элюент 10 до 20% этилацетат-гексан) давала 617 мг желаемого продукта в виде темного масла (теоретически 759 мг, выход 81%).F. 4-Бензилокси-6-метил-1H-индол-3-карбальдегид. К раствору POCl3 (1 мл) в ДМФА (4 мл) при 0C добавляли индол, полученный на предыдущей стадии (617 мг, 02,59 ммоль), в ТГФ (6 мл) и полученную реакционную смесь оставляли для перемешивания при нагревании до комнатной температуры в течение 3 ч. Реакционную смесь выливали на насыщенный раствор бикарбоната натрия и экстрагировали этилацетатом. Объединенные этилацетатные экстракты сушили над безводным сульфатом натрия и концентрировали в вакууме. Хроматография (SiO2, элюент 40% этилацетат-гексан) давала 220 мг желаемого соединения в виде бледно-желтого твердого веществаG. Диэтиламид 4-бензилокси-3-формил-6-метилиндол-1-карбоновой кислоты. К раствору альдегида, полученного на предыдущей стадии (240 мг, 0,91 ммоль), в тетрагидрофуране (6 мл) при комнатной температуре добавляли гидрид натрия (54 мг, 1,35 ммоль, 60% дисперсия в масле) и полученную реакционную смесь оставляли для перемешивания при комнатной температуре в течение 0,5 ч. Затем добавляли N,N-диэтилкарбамилхлорид (0,17 мл, 1,35 ммоль) и реакционную смесь оставляли для перемешивания при комнатной температуре в течение 18 ч. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенные этиловые экстракты сушили над безводным сульфатом натрия и концентрировали в вакууме. Хроматография (SiO2, элюент 30% EtOAc-гексан) давала 290 мг желаемого продукта в виде бледно-желтого твердого вещества (теоретически 331 мг, выход 88%).H. 2-3-[2-(4-Метоксифенил)этил]-6-метил-1H-индол-4-илоксиD-глюкопиранозид. Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формил-6-метилиндол 1-карбоновой кислоты и 4-метоксибензилтрифенилфосфонийхлорида по той же методике, как описано в примере 1. 1A. Диэтиламид 4-бензилокси-3-(4-этилбензил)индол-1-карбоновой кислоты. К раствору диэтиламида 4-бензилокси-3-формилиндол-1-карбоновой кислоты, полученной на стадии A примера 1 (1,0 г, 2,8 ммоль), в 6 мл безводного ТГФ добавляли по каплям 0,5 М раствор 4-этилфенилмагнийбромида в безводном ТГФ (6,2 мл, 3,1 ммоль) при 0C. Реакционную смесь продолжали перемешивать при 0C в течение 30 мин, гасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Органические экстракты сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт использовали непосредственно на следующей стадии. К раствору неочищенного индолкарбинола в 6 мл дихлорметана добавляли триэтилсилан (0,46 г, 4,0 ммоль) при -78C с последующим добавлением раствора 1,0 М хлорида олова (IV) в дихлорметане (3,6 мл, 3,6 ммоль). Ре- 24010422 акционную смесь продолжали перемешивать при -78C в течение 20 мин, гасили водой и нагревали до комнатной температуры. После экстрагирования дихлорметаном органические экстракты сушили над сульфатом натрия, концентрировали в вакууме и хроматографировали на силикагеле, элюируя смесью этилацетат/гексан (25:100) с получением указанного в заголовке соединения (0,91 г, выход: 74%) в виде бесцветного масла.B. Диэтиламид 3-(4-этилбензил)-4-гидроксииндол-1-карбоновой кислоты. Раствор, полученный в части A (0,91 г, 2,1 ммоль), в этаноле (10 мл) и этилацетате (20 мл) гидрировали над 10% Pd-C (0,18 г) в атмосфере H2 (14 фунт/кв.дюйм) в течение 7 ч. Катализатор удаляли фильтрованием и фильтрат концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью метанол/хлороформ (4:100), с получением указанного в заголовке соединения (0,42 г, 57%) в виде белого твердого вещества.(1,08 г, 2,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Затем твердые вещества фильтровали и промывали этилацетатом. Органические экстракты промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью этилацетат/гексанD. 2-[3-(4-Этилбензил)-1H-индол-4-илокси]D-глюкопиранозид. Соединение, полученное в части C (0,37 г, 0,5 ммоль), растворяли в этаноле (30 мл) и 25% водном растворе гидроксида натрия (10 мл) и полученный раствор доводили до кипения с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры смесь разбавляли водой (20 мл), концентрировали в вакууме для удаления основного количества этанола и экстрагировали этилацетатом. Органические экстракты промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью метанол/хлороформ (10:100), с получением конечного продукта (0,16 г,76%) в виде не совсем белого твердого вещества. 1 Раствор 1,0 М метилхлорформиата в дихлорметане (0,24 мл, 0,24 ммоль) добавляли по каплям к раствору 2-[3-(4-этилбензил)-1H-индол-4-илокси]D-глюкопиранозида (пример 11, 0,093 г, 0,22 ммоль) в 2,4,6-коллидине (1 мл) при -30C. Смесь нагревали до комнатной температуры в течение 2 ч и перемешивали при комнатной температуре в течение ночи. Реакцию гасили добавлением воды и смесь разбавляли диэтиловым эфиром. pH водного слоя доводили до pH 7 путем добавления холодной 1 н. HCl и смесь экстрагировали диэтиловым эфиром. Органические слои промывали насыщенным солевым раствором, сушили над беззодным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью метанол/хлороформ (8:100), с получением конечного продукта (0,052 г, 50%) в виде не совсем белого твердого вещества. 1 Указанное в заголовке соединение получали из 2-[3-(4-этилбензил)-1H-индол-4-илокси]Dглюкопиранозида (пример 11) и этилхлорформиата по той же методике, как описано в примере 12. 1 Раствор гексаноилхлорида (0,072 мг, 0,53 ммоль) в дихлорметане (0,05 мл) добавляли по каплям к раствору 2-[3-(4-этилбензил)-1H-индол-4-илокси]D-глюкопиранозида (пример 11, 0,22 г, 0,53 ммоль) в 2,4,6-коллидине (2 мл) при -30C. Смесь перемешивали при температуре ниже 0C в течение 30 мин. Реакцию гасили добавлением воды и смесь разбавляли диэтиловым эфиром. pH водного слоя доводили доpH 7 путем добавления холодного 1 н. раствора HCl и смесь экстрагировали диэтиловым эфиром. Органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью метанол/хлороформ (8:100), с получением конечного продукта (0,207 г, 76%) в виде не совсем белого твердого вещества. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и 4-метилфенилмагнийбромида по той же методике, как описано в примере 11. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и 3-фтор-4-метилфенилмагнийбромида по той же методике, как описано в примере 11. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и 4-пропилфенилмагнийбромида по той же методике, как описано в примере 11. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и 4-изопропилфенилмагнийбромида по той же методике, как описано в примере 11. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и 4-бифенилмагнийбромида по той же методике, как описано в примере 11. Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты и 3-фтор-4-бифенилмагнийбромида по той же методике, как описано в примере 11. 1[1-Диэтилкарбамоил-3-(4-метоксибензил)-1H-индол-4-илокси]-2,3,4,6-тетра-О-ацетилDглюкопиранозид (0,13 г, 0,19 ммоль, полученный из 4-бензилокси-N,N-диэтилкарбамилиндол 3-карбоксальдегида, который был получен на стадии A примера 1, и 4-метоксифенилмагнийбромида по той же методике, как описано в примере 11, часть A, B и C) растворяли в метаноле (1 мл) и хлороформе(0,2 мл) с последующим добавлением избыточного количества карбоната калия. Полученную смесь перемешивали при комнатной температуре в течение ночи. Затем твердые вещества фильтровали и промывали этилацетатом. Этилацетатный раствор промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Продукт очищали хроматографией на силикагеле, элюируя смесью метанол/хлороформ (10:100), с получением указанного в заголовке соединения (0,03 г, выход: 31%) в виде белого твердого вещества. 1[1-Диэтилкарбамоил-3-(4-метоксибензил)-1H-индол-4-илокси]-2,3,4,6-тетра-О-ацетил]Dглюкопиранозид (0,16 г, 0,23 ммоль, полученный из 4-бензилокси-N,N-диэтилкарбамилиндол 3-карбоксальдегида, который был получен на стадии A примера 1, и 4-метоксифенилмагнийбромида, по той же методике, как описано в примере 11, часть A, B и C) растворяли в этаноле (15 мл) и 25% водном- 28010422 растворе гидроксида натрия (5 мл) и полученный раствор доводили до температуры кипения с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры смесь разбавляли водой (20 мл), концентрировали в вакууме для удаления основного количества этанола и экстрагировали этилацетатом. Органические экстракты промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью метанол/хлороформ (10:100), с получением конечного продукта(0,062 г, 65%) в виде не совсем белого твердого вещества. 1A. 4-Бензилокси-3-(4-метоксибензил)-1H-индол. Диэтиламид 4-бензилокси-3-(4-метоксибензил)индол-1-карбоновой кислоты (0,38 г, 0,86 ммоль, получен из диэтиламида 4-бензилокси-3-формилиндол-1-карбоновой кислоты, полученного на стадии A примера 1, и 4-метоксифенилмагнийбромида по той же методике, как описано в примере 11, часть A) растворяли в этаноле (15 мл) и 25% водном растворе гидроксида натрия (5 мл) и полученный раствор доводили до кипения с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры смесь разбавляли водой (20 мл), концентрировали в вакууме для удаления основного количества этанола и экстрагировали этилацетатом. Органические экстракты промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт (0,25 г, 86%, желтое твердое вещество) был чистым и его непосредственно использовали на следующей стадии.B. 4-Бензилокси-3-(4-метоксибензил)-1-метил-1H-индол. К суспензии гидрида натрия (0,029 г, 38 ммоль, 60% суспензия в масле) в безводном ДМФА(0,5 мл) добавляли по каплям раствор продукта части A (0,24 г, 0,69 ммоль) в безводном ДМФА (2 мл) при 0C. После перемешивания при 0C в течение 15 мин к реакционной смеси добавляли по каплям йодметан (0,11 г, 0,76 ммоль). Смесь нагревали до комнатной температуры и перемешивали в течение 30 мин. Затем реакцию гасили водой и экстрагировали этилацетатом. Органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт (0,24 г, 99%, оранжевое масло) был чистым и его непосредственно использовали на следующей стадии.C. 3-(4-Метоксибензил)-1-метил-1H-индол-4-ол. Раствор продукта части B (0,24 г, 0,69 ммоль) в этаноле (5 мл) и этилацетате (10 мл) гидрировали над 10% Pd-C (0,05 г) в атмосфере H2 (50 фунт/кв.дюйм) в течение 3 ч. Катализатор удаляли фильтрованием и фильтрат концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью метанол/хлороформ (4:100), с получением указанного в заголовке соединения(0,17 г, 92%) в виде желтого твердого вещества.D. 2-[3-(4-Метоксибензил)-1-метил-1H-индол-4-илокси]D-глюкопиранозид. К раствору продукта части C (0,17 г, 0,63 ммоль) в ацетоне (1 мл) добавляли карбонат калия (0,43 г,3,2 ммоль) с последующим добавлением 2,3,4,6-тетра-О-ацетилD-глюкопиранозилбромида (0,51 г, 1,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Затем твердые частицы фильтровали и промывали этилацетатом. Этилацетатный раствор промывали водой и насыщенным солевым раствором сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растворяли в метаноле (2 мл) и хлороформе (0,5 мл) с последующим добавлением избыточного количества карбоната калия. Полученную смесь перемешивали при комнатной температуре в течение 4 ч. Затем твердые частицы фильтровали и промывали этилацетатом. Этилацетатный раствор промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Продукт очищали хроматографией на силикагеле, элюируя смесью метанол/хлороформ(10:100), с получением конечного продукта (0,035 г, выход: 9%) в виде белого твердого вещества. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты, полученного на стадии A примера 1, и 3-фтор-4-метоксифенилмагнийбромида по той же методике, как описано в примере 11. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты, полученного на стадии A примера 1, и 4-этоксифенилмагнийбромида по той же методике, как описано в примере 11. 1 Указанное в заголовке соединение получали из диэтиламида 4-бензилокси-3-формилиндол-1 карбоновой кислоты, полученного на стадии A примера 1, и 4-феноксифенилмагнийбромида по той же методике, как описано в примере 11. 1
МПК / Метки
МПК: A61K 31/70, C07H 17/00
Метки: замещённые, индол-о-глюкозиды
Код ссылки
<a href="https://eas.patents.su/30-10422-zameshhyonnye-indol-o-glyukozidy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые индол-о-глюкозиды</a>
Предыдущий патент: Способ разделения циркония и гафния
Следующий патент: Инданзамещенные пиримидины, ингибирующие репликацию вич
Случайный патент: Оконное стекло для транспортного средства и способ его получения












