Замещенные производные пурина в качестве ингибиторов клеточной адгезии
Номер патента: 5372
Опубликовано: 24.02.2005
Авторы: Гейдек Томас Р., Рюксер Жан-Мари, Гурве Жан-Франсуа, Кнолле Йохен, Пейман Ануширван
Формула / Реферат
1. Соединение формулы I
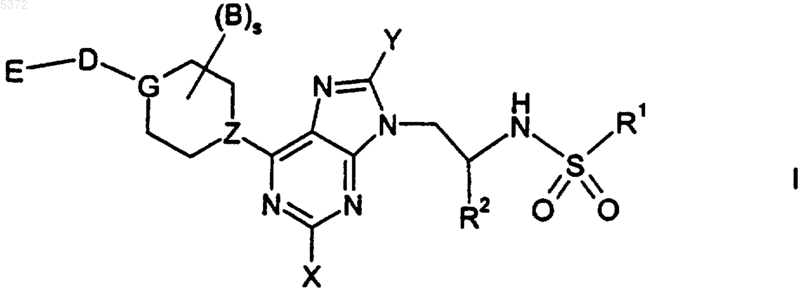
где D представляет -C(O)-NH-, где данный двухвалентный остаток связан с группой E через его атом азота;
E представляет остаток
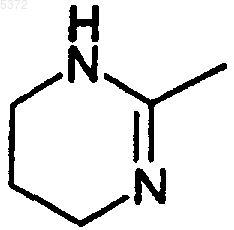
G представляет CH;
X представляет водород;
Y представляет водород;
Z представляет N;
R1 представляет (C1-C18)-алкил, фенил, нафтил или бензил, возможно замещенные одним, двумя или тремя одинаковыми или разными заместителями из группы, состоящей из фтора, хлора, брома, циано, трифторметила, (C1-C6)-алкила, (C1-C6)-алкокси и (C5-C14)-арила;
R2 представляет -C(O)R5;
R5 представляет гидрокси или (C1-C6)-алкокси;
s равно 0;
во всех его стереоизомерных формах и их смесях во всех отношениях, и их физиологически приемлемые соли.
2. Способ получения соединения по п.1, включающий взаимодействие соединения формулы V с соединением формулы VIa
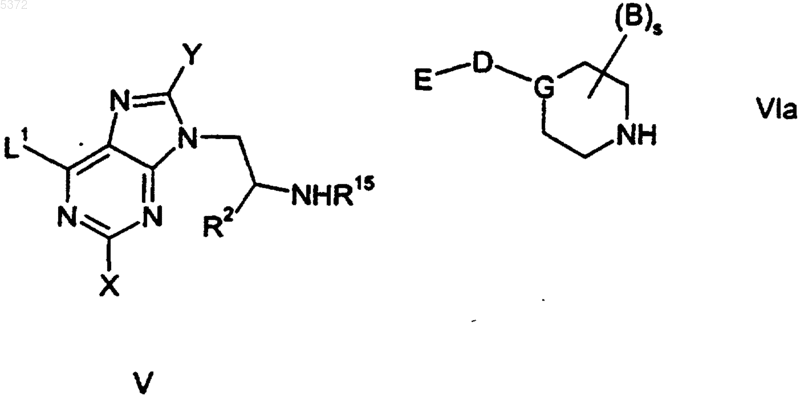
где L1 представляет уходящую группу, R15 представляет R1-SO2- или аминозащитную группу и B, D, E, G, X, R2 и s имеют значения, указанные в п.1, но где функциональные группы могут присутствовать также в форме групп-предшественников или в защищенной форме.
3. Фармацевтическая композиция, включающая по меньшей мере одно соединение формулы I по п.1, и/или его физиологически переносимые соли, и/или его пролекарства и фармацевтически приемлемый носитель.
4. Применение соединения формулы I по п.1 и/или его физиологически переносимых солей для использования в качестве фармацевтического средства.
5. Применение соединения формулы I по п.1 и/или его физиологически переносимых солей для использования в качестве антагониста рецептора витронектина.
Текст
005372 Настоящее изобретение относится к соединениям формулы I где В, D, Е, G, X, Y, Z, R1, R2 и s имеют значения, указанные ниже, их физиологически переносимым солям и их пролекарствам. Соединения формулы I являются ценными фармакологически активными соединениями. Они являются антагонистами рецептора витронектина и ингибиторами клеточной адгезии и подходят для терапии и профилактики заболеваний, которые основаны на взаимодействии между рецепторами витронектина и их лигандами в процессах взаимодействия клетка-клетка или клетка-матрица или которые можно предотвратить, ослабить или лечить воздействием на такое взаимодействие. Например,их можно применять для ингибирования резорбции костей остеокластами и, таким образом, для лечения и предотвращения остеопороза или для ингибирования нежелательного развития кровеносных сосудов или пролиферации клеток васкулярной гладкой мускулатуры. Изобретение, кроме того, относится к способам получения соединений формулы I, их использованию, особенно в качестве активных ингредиентов в фармацевтических препаратах, и содержащим их фармацевтическим композициям. Кости человека подвергаются процессу постоянного динамического обновления, включающему резорбцию костей и образование костей. Эти процессы регулируются типами клеток, специализированными для этих целей. Резорбция костей основана на деструкции костной матрицы остеокластами. Большинство костных заболеваний основаны на нарушенном равновесии между образованием костей и резорбцией костей. Остеопороз является заболеванием, характеризующимся низкой костной массой и повышенной хрупкостью костей, приводящей к повышенному риску переломов. Он является результатом дефицита нового костного образования по сравнению с резорбцией костей во время продолжительного процесса реконструирования. Общепринятое лечение остеопороза включает, например, введение бисфосфонатов, эстрогенов, эстрогена/прогестерона (гормональная заместительная терапия или HRT), агонистов/антагонистов эстрогена (селективные модуляторы рецептора эстрогена или SERMs), кальцитонина,аналогов витамина D, паратироидного гормона, средств, усиливающих секрецию гормона роста или фторида натрия (Jardine et al., Annual Reports in Medicinal Chemistry 31 (1996) 211). Активированные остеокласты являются полинуклеарными клетками, имеющими диаметр вплоть до 400 мкм, которые удаляют костную матрицу. Активированные остеокласты становятся прикрепленными к поверхности костной матрицы и секретируют протеолитические ферменты и кислоты в так называемую зону герметизации, область между их клеточной мембраной и костной матрицей. Кислотная окружающая среда и протеазы вызывают деструкцию кости. Соединения формулы I ингибируют костную резорбцию остеокластами. Исследования показали, что присоединение остеокластов к костям регулируется рецепторами интегрина на клеточной поверхности остеокластов. Интегрины являются суперсемейством рецепторов, которые включают, среди прочего, рецептор фибриногена IIb3 на тромбоцитах крови и рецептор витронектина v3. Рецептор витронектина v3 является мембранным гликопротеином, который экспрессируется на клеточной поверхности ряда клеток, таких как эндотелиальные клетки, клетки васкулярной гладкой мускулатуры, остеокласты и опухолевые клетки. Рецептор витронектина v3, который экспрессируется на остеокластной мембране, регулирует процесс присоединения к костям и резорбции костей и, таким образом, способствует остеопорозу. v3 в этом случае связывается с белками костных матриц, такими как остеопонтин, костный сиалопротеин и тромбоспонтин, которые содержат трипептидный мотивHorton и соавторы описали пептиды RGD и антитела (23 С 6) против рецептора витронектина, которые ингибируют деструкцию зубов остеокластами и миграцию остеокластов (Horton et al., Exp. Cell. Res. 195 (1991) 368). В J. Cell Biol. 111 (1990), 1713 Sato et al. описывают эхистатин, пептид RGD из яда змеи,в качестве сильнодействующего ингибитора резорбции костей в тканевой культуре и в качестве ингибитора адгезии остеокластов к костям. Fisher et al. (Endocrinology 132 (1993) 1411) и Yamamoto et al. (Endocrinology 139 (1998) 1411) смогли показать на крысе, что эхистатин также ингибирует резорбцию костейin vivo. Кроме того, было показано, что витронектин v3 на клетках васкулярной мускулатуры аорты человека стимулирует миграцию этих клеток в неоинтиму, которая, наконец, приводит к артериосклерозу и рестенозу после пластической операции на сосудах (Brown et al., Cardiovascular Res. 28 (1994) 1815). Yueet al. (Pharmacology Reviews and Communications 10 (1998) 9) обнаружили ингибирование образования неоинтимы с использованием антагониста v3.Brooks et al. (Cell 79 (1994) 1157) обнаружили, что антитела против v3 или антагонисты v3 могут вызвать сжимание опухолей индуцированием апоптоза клеток кровеносных сосудов во время разви-1 005372 тия кровеносных сосудов. Рецептор витронектина v3 вовлекается также в развитие различных других типов рака и сверхэкспрессируется в злокачественных клетках меланомы (Engleman et al., Annual Reportsin Medicinal Chemistry 31 (1996) 191). Инвазивность меланомы коррелировала с этой сверхэкспрессией(1996) 639). Carron et al. (Cancer Res. 58 (1998) 1930) описывают ингибирование роста опухоли и ингибирование гиперкальциемии злокачественности с использованием антагониста v3.Friedlander et al. (Science 270 (1995) 1500) описали антитела против v3 или антагонисты v3, которые ингибируют bFGF-индуцированные процессы развития кровеносных сосудов в глазах крысы,свойство, которое можно использовать терапевтически при лечении ретинопатии и при лечении псориаза. Storgard et al. (J. Clin. Invest. 103 (1999) 47) описали использование антагонистов. Влияние рецептора витронектина или взаимодействия, в которые он вовлекается, таким образом,предоставляет возможность влияния на различные болезненные состояния, для терапии и профилактики которых продолжает оставаться потребность в подходящих фармацевтически активных ингредиентах. В eвропейских патентах ЕР-А-528586 и ЕР-А-528587 описываются аминоалкилзамещенные или гетероциклилзамещенные производные фенилаланина, и в WO-A-95/32710 описываются арилпроизводные в качестве ингибиторов костной резорбции остеокластами. В WO-A-95/28426 пептиды RGD описаны в качестве ингибиторов резорбции костей, развития кровеносных сосудов и рестеноза. В международной патентной заявке РСТ/ЕР 98/08051 описаны производные карбаминовых эфиров, и в международной патентной заявке РСТ/ЕР 99/00242 описаны сульфонамиды, которые являются антагонистами рецептора витронектина. Следующие антагонисты рецептора витронектина описаны в WO-A-98/08840 и WO-A98/18461. Замещенные производные пурина в качестве ингибиторов резорбции костей описываются в ЕР-А-853084. Следующими исследователями было показано, что соединения формулы I являются особенно сильнодействующими ингибиторами рецептора витронектина и резорбции костей остеокластами. Настоящее изобретение относится к соединениям формулы I в которой D представляет -C(O)-NH-, где данный двухвалентный остаток связан с группой Е через его атом азота; Е представляет остатокR1 представляет (C1-C18)-алкил, фенил, нафтил или бензил, возможно, замещенные одним, двумя или тремя одинаковыми или разными заместителями из группы, состоящей из фтора, хлора, брома, циано, трифторметила, (C1-C6)-алкила, (C1-C6)-алкокси и (C5-C14)-арила;R5 представляет гидрокси или (C1-C6)-алкокси; во всех их стереоизомерных формах и их смесях во всех отношениях, и их физиологически приемлемые соли. Алкильные остатки могут иметь неразветвленную или разветвленную цепь и могут быть насыщенными, или мононенасыщенными, или полиненасыщенными. Это также применяют, если они имеют заместители или присутствуют в виде заместителей на других остатках, например в алкоксиостатках, алкоксикарбонильных остатках или арилалкильных остатках. Замещенные алкильные остатки могут быть замещены в любом подходящем положении. Примерами алкильных остатков, содержащих от 1 до 18 атомов углерода, являются метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, тетрадецил, гексадецил и октадецил, н-изомеры всех этих остатков, изопропил, изобутил, изопентил, неопентил, изогексил, изодецил, 3-метилпентил, 2,3,4-триметилгексил, втор-бутил, третбутил или трет-пентил. Предпочтительная группа алкильных остатков образована остатками метил, этил,н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Ненасыщенные алкильные остатки могут содержать одну или несколько, например одну, две или три, двойные связи и/или тройные связи. Ненасыщенный алкильный остаток, конечно, должен иметь по-2 005372 меньшей мере 2 атома углерода. Примерами ненасыщенных алкильных остатков являются алкенильные остатки, такие как винил, 1-пропенил, аллил, бутенил или 3-метил-2-бутенил, или алкинильные остатки,такие как этинил, 1-пропинил или пропаргил. Алкильные остатки могут также быть ненасыщенными,когда они замещены. Ненасыщенный алкильный остаток, предпочтительно, является мононенасыщенным и содержит одну двойную связь или тройную связь. Эти определения, относящиеся к алкильным остаткам, соответственно используют к остаткам, которые могут рассматриваться как двухвалентные или поливалентные алкильные остатки, например алкильному остатку в замещенном алкильном остатке, подобном гидроксиалкилу-. Связи, через которые заместители в замещенном алкильном остатке присоединены к алкильной части, и связь, через которую алкильная связь присоединена к ее соседней группе, могут быть расположены в любых требуемых положениях. Примерами карбоциклических (C6-C14)-арильных остатков являются фенил, нафтил, такой как 1 нафтил или 2-нафтил, бифенилил, такой как 2-бифенилил, 3-бифенилил или 4-бифенилил, антрил или флуоренил, где предпочтительными являются (C6-C12)-арильные остатки, особенно 1-нафтил, 2-нафтил и фенил. Если не оговорено особо, арильные остатки, в частности фенильные остатки, могут быть незамещенными или замещенными одним или несколькими, предпочтительно одним, двумя или тремя, одинаковыми или разными заместителями. В частности, замещенные арильные остатки могут быть замещены одинаковыми или разными остатками из группы, состоящей из (C1-C8)-алкила, особенно (C1-C4)-алкила,(C1-C8)-алкокси, в частности (C1-C4)-алкокси, фтора, хлора и брома, нитро, амино, (C1-C4)-алкиламино,ди-C1-C4)-алкил)амино, трифторметила, гидрокси, метилендиокси, циано, гидроксикарбонила-, аминокарбонила-, (C1-C4)-алкоксикарбонила, фенила, фенокси, бензила, бензилокси, тетразолила, (R9O)2P(O)- и(R9O)2P(О)-О-, где R9 представляет водород, (C1-C10)-алкил, (C6-C14)-арил или (C6-C14)-арил-(C1-C8)алкил. В общем, только до двух нитрогрупп могут присутствовать в соединениях формулы I и аналогично все другие группы, заместители или гетероатомы, указанные в определении соединений формулы I,могут присутствовать в соединениях формулы I только в таких положениях, и в таком количестве, и в таких комбинациях, чтобы образовавшаяся молекула была стабильна и не обладала характеристиками,которые не желательны для предназначенного использования. В монозамещенных фенильных остатках заместитель может быть расположен в 2-положении, 3 положении или 4-положении, причем 3-положение и 4-положение предпочтительны. Если фенил является дизамещенным, заместители могут быть в 2,3-положении, 2,4-положении, 2,5-положении, 2,6 положении, 3,4-положении или 3,5-положении. В дизамещенных фенильных остатках два заместителя,предпочтительно, расположены в 3,4-положении относительно места присоединения. В тризамещенных фенильных остатках заместители могут быть в 2,3,4-положении, 2,3,5-положении, 2,3,6-положении,2,4,5-положении, 2,4,6-положении или 3,4,5-положении. Аналогично этому, нафтильные остатки и другие арильные остатки могут быть замещены в любом нужном положении, например 1-нафтильный остаток в 2-, 3-, 4-, 5-, 6-, 7- и 8-положении и 2-нафтильный остаток в 1-, 3-, 4-, 5-, 6-, 7- и 8-положении. Вышеуказанное, относящееся к арильным остаткам, соответственно используют также для арильной части в группах, подобных арилалкилу. Примерами арилалкильных остатков, которые могут содержать также в арильной части заместители, перечисленные выше, являются бензил, 1-фенилэтил или 2 фенилэтил. Если в формуле гетероциклического остатка, представляющего группу Е, связь, через которую остаток соединяется с группой D, не является определенно направленной к определенному атому углерода кольца, а обозначена через сторону кольца, это означает, что связь, через которую остаток связывается с группой D, может быть расположена на любом подходящем атоме углерода в кольце остатка. Оптически активные атомы углерода, присутствующие в соединениях формулы I, могут независимо друг от друга иметь R-конфигурацию или S-конфигурацию. Соединения формулы I могут присутствовать в форме чистых энантиомеров, или чистых диастереомеров, или в форме смесей энантиомеров, например в форме рацематов или смесей диастереомеров. Настоящее изобретение относится как к чистым энантиомерам, так и смесям энантиомеров, а также чистым диастереомерам и смесям диастереомеров. Изобретение включает смеси двух или более двух стереоизомеров формулы I, оно включает все отношения стереоизомеров в смесях. Соединения формулы I, содержащие соответствующие структурные звенья, могут также быть представлены как Е-изомеры или Z-изомеры (или транс-изомеры или цисизомеры). Изобретение относится как к чистым Е-изомерам, чистым Z-изомерам, чистым цис-изомерам,чистым транс-изомерам, так и E/Z-смесям и цис/транс-смесям во всех отношениях. Изобретение включает также все таутомерные формы соединений формулы I. Диастереомеры, включающие E/Z-изомеры,можно разделить на индивидуальные изомеры, например, хроматографией. Рацематы можно разделить на два энантиомера обычными способами, например хроматографией на хиральных фазах или расщеплением на оптические изомеры, например, кристаллизацией диастереомерных солей, полученных с оптически активными кислотами или основаниями. Стереохимически однородные соединения формулы I можно также получить с использованием стереохимически однородных исходных материалов или с использованием стереоселективных реакций. Физиологически толерантные соли соединений формулы I являются нетоксичными солями, которые являются физиологически приемлемыми, особенно фармацевтически приемлемыми солями. Такие-3 005372 соли соединений формулы I, содержащие кислотные группы, например карбоксил, являются, например,солями щелочных металлов или солями щелочно-земельных металлов, такими как, например, натриевыми солями, калиевыми солями, магниевыми солями и кальциевыми солями, а также солями с физиологически толерантными четвертичными аммониевыми ионами и основно-аддитивными солями с аммиаком и физиологически толерантными органическими аминами, такими как, например, триэтиламин, этаноламин или трис-(2-гидроксиэтил)амин. Основные группы в соединениях формулы I могут образовывать кислотно-аддитивные соли, например, с неорганическими кислотами, такими как хлористо-водородная кислота, серная кислота или фосфорная кислота, или с органическими кар-боновыми кислотами и сульфоновыми кислотами, такими как уксусная кислота, лимонная кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота, метансульфоновая кислота или п-толуолсульфоновая кислота. Соединения формулы I, которые одновременно содержат основную группу и кислотную группу,например карбоновую группу кроме основных атомов азота, могут присутствовать в виде цвиттерионов(или бетаинов, или внутренних солей), которые таким же образом входят в объем настоящего изобретения. Соли соединений формулы I можно получить обычными способами, известными специалисту в данной области, например смешиванием соединения формулы I с неорганической или органической кислотой или основанием в растворителе или разбавителе или из других солей катионообменным или анионообменным способом. Предметом настоящего изобретения являются также все соли соединений формулыI, которые, вследствие низкой физиологической толерантности, не являются непосредственно подходящими для использования в фармации, но являются, например, подходящими в качестве промежуточных продуктов для проведения дальнейших химических модификаций соединений формулы I или в качестве исходных материалов для получения физиологически толерантных солей. Настоящее изобретение, кроме того, включает все сольваты соединений формулы I, например гидраты или аддукты со спиртами, а также производные соединений формулы I, подобные сложным эфирам и другим физиологически толерантным производным, а также активные метаболиты соединений формулы I. В соединениях изобретения, предпочтительно, присутствует действительная пуриновая структура,показанная в формуле I, в которой атомы азота в 3-положении и в 7-положении действительно присутствуют, и атом углерода, с которым связана группа Y, действительно присутствует в 8-положении. В соединениях формулы I по изобретению различные группы, остатки и числа могут независимо друг от друга иметь вышеуказанные предпочтительные определения или могут иметь одно или несколько конкретных значений, приведенных в их соответствующих определениях или в общем объяснении соответствующих групп и остатков. Предпочтительными соединениями настоящего изобретения являются те соединения формулы I, в которых один или несколько остатков имеют предпочтительные определения или имеют одно или несколько определенных значений, данных в их соответствующих определениях или общих объяснениях,причем все комбинации таких предпочтительных определений и конкретных значений являются предметом настоящего изобретения. Соединения настоящего изобретения могут быть также представлены формулой Iа где R1 и R5 имеют вышеуказанные значения. Кроме того, предпочтительными соединениями настоящего изобретения являются те соединения, у которых асимметричный атом углерода в формуле I, с которым связаны группы R2 и R1-SO2-NH-, имеютS-конфигурацию, и их физиологически толератные соли. Настоящее изобретение относится также к способам получения, посредством которых доступны соединения формулы I и которые включают проведение одной или нескольких стадий синтеза, описанных ниже. Соединения формулы I можно обычно получить, например, в ходе конвергентного синтеза связыванием двух или более фрагментов, которые можно получить ретросинтетическим способом из соединения формулы I. При получении соединений формулы I может быть выгодно или необходимо в ходе синтеза ввести функциональные группы, которые могли привести к нежелательным реакциям или побочным реакциям в соответствующей стадии синтеза, в форме групп-предшественников, которые позднее превращают в требуемые функциональные группы, или временно блокированных функциональных групп защитными группами, подходящими для синтеза. Такие методы хорошо известны специалисту в данной области (см., например, Greene and Wuts, Protective Groups in Organic Synthesis, Wiley, 1991). В качестве примеров групп-предшественников можно указать нитрогруппы и цианогруппы, которые можно позднее превратить восстановлением, например каталитическим гидрированием, в аминогруппы и аминометильные группы, соответственно. Защитные группы, указанные выше в качестве примеров в отношении функциональных групп, в амикислотных остатках, присутствующих в соединениях формулы I, соответ-4 005372 ственно можно использовать в качестве защитных групп для функциональных групп во время синтеза соединений формулы I. Например, для получения соединения формулы I можно использовать строительный блок формулы III в которой L1 представляет обычно нуклеофильно замещаемую уходящую группу. Подходящие группы L1 известны специалисту в данной области, и они могут быть, например, хлором, бромом, иодом или сульфонилоксигруппой, такой как п-толуолсульфонилокси (-OTos), метансульфонилокси (-OMes) или трифторметансульфонилокси (-OTf), предпочтительно хлором или бромом. Х и Y в соединениях формулы III имеют значения, указанные выше, но могут, необязательно, присутствовать также функциональные группы в форме групп-предшественников или могут быть защищены защитными группами. Соединение формулы III подвергают взаимодействию со строительным блоком формулы IVIV 2 где R имеет указанные выше значения, но где функциональные группы в R2 могут также, необязательно,присутствовать в форме групп-предшественников или могут быть защищены защитными группами. В частности, например, группа R2 в соединении формулы I, означающая гидроксикарбонил- (-СООН),предпочтительно присутствует в исходном соединении формулы IV в виде сложного эфира, подобного группе трет-бутилового эфира, или метилового эфира, или этилового эфира. Группа L2 в соединениях формулы IV представляет гидрокси или обычную нуклеофильно замещаемую уходящую группу. Подходящие уходящие группы L2 известны специалисту в данной области, и они могут быть, например, хлором, бромом, иодом, -OTos, -OMes или -OTf. Группа R15 означает группу R1-SO2-, где R1 имеет значения,указанные выше, или R15 представляет аминозащитную группу. Подходящие аминозащитные группы известны специалисту в данной области (см., например, Greene and Wuts, Protective Groups in OrganicSynthesis, Wiley, 1991). Примерами аминозащитных групп являются бензилоксикарбонильная группа,трет-бутоксикарбонильная группа или 9-флуоренилметоксикарбонильная группа. Из соединений формулIII и IV получают соединение формулы V где L1, X, Y, R2 и R15 имеют значения, указанные выше, но где функциональные группы могут, необязательно, присутствовать также в форме групп-предшественников или могут быть защищены защитными группами. Взаимодействие соединений формул III и IV можно проводить способами, известными специалисту в данной области (см., например, публикацию J. March, Advanced Organic Chemistry, Fourth Edition, Wiley, 1992 и литературный источник, цитированный в ней). Взаимодействие, предпочтительно,проводят в подходящем органическом растворителе или разбавителе, например дихлорметане (ДХМ),хлороформе, тетрагидрофуране (ТГФ), диэтиловом эфире, н-гептане, н-гексане, н-пентане, циклогексане,диизопропиловом эфире, метил-трет-бутиловом эфире, ацетонитриле, диметилформамиде (ДМФ), диметилсульфоксиде (ДМСО), диоксане, толуоле, бензоле, этилацетате или смеси этих растворителей, если подходит, с добавлением основания, такого как, например, бутиллитий, диизопропиламид лития (LDA),гидрид натрия, амид натрия, трет-бутоксид калия, карбонат кальция, карбонат цезия, триэтиламин, N,Nдиизопропилэтиламин или комплексное основание (например, амид натрия вместе с алкоголятом R25ONa,где R25 представляет (С 2-С 6)-алкил или СН 3 СН 2 ОСН 2 СН 2-). В случае соединений формулы IV, в которойL2 представляет гидрокси, взаимодействие проводят после активации гидроксигруппы, например, взаимодействием с трифенилфосфином и диэтилазодикарбоксилатом (DEAD) в ТГФ в условиях хорошо известной реакции Мицунобу. Соединения формулы I получают путем взаимодействия соединения формулы V с соединением формулы VIa где В, D, Е, G и s имеют значения, указанные выше, но где функциональные группы могут также, необязательно, присутствовать в форме групп-предшественников или могут быть защищены защитными группами. Взаимодействие соединений формул V и VIa можно проводить методами, хорошо известнымиEdition, Wiley, 1992 и литературный источник, цитированный в ней). Во взаимодействии соединения формулы V с соединением формулы VIa нуклеофильно замещаемая уходящая группа в одном участнике взаимодействия заменяется нуклеофильным атомом азота в другом участнике взаимодействия, как в случае взаимодействий соединений формул III и IV. Вышеприведенное относительно растворителей или оснований, подходящих для взаимодействия соединений формул III и IV, следовательно, соответственно относится к взаимодействию соединений формул V и VIa. В качестве основания при взаимодействии соединений формул V и VIa можно также использовать избыток соединения формулы VIa. Взаимодействие соединения формулы V с соединением формулы VIa приводит к образованию соединения формулы VII где В, D, Е, G, X, Y, Z, R2, R15 и s имеют значения, указанные выше, но где функциональные группы могут, необязательно, также присутствовать в форме групп-предшественников или могут быть защищены защитными группами. Стандартными способами группы-предшественники, необязательно, все же присутствуют в соединениях формулы VII, затем превращают в требуемые конечные группы и/или защитные группы, необязательно, все же присутствующие, затем удаляют. Например, группы трет-бутиловых сложных эфиров, особенно группу трет-бутилового эфира, которая представляет группу R2 в соединении формулы VII и которая является защитной формой гидроксикарбонильной группы, представляющей R2 в целевом соединении формулы I, можно превратить в группу карбоновой кислоты обработкой трифторуксусной кислотой. Если группа R15 в соединении формулы VII не означает группу R1-SO2-, которая должна присутствовать в требуемой целевой молекуле формулы I, но означает аминозащитную группу, проводят стадию снятия защиты, в результате которой соединение формулы VII превращается в соединение формулы VIII где В, D, Е, G, X, Y, Z, R2 и s имеют значения, указанные выше, но где функциональные группы могут,необязательно, также присутствовать в форме групп-предшественников или могут быть защищены защитными группами. Если, например, R15 представляет бензилоксикарбонильную группу, превращение группы R15NH в группу H2N можно выполнить каталитическим гидрированием, например, над палладием на угле в растворителе, подобном уксусной кислоте или этанолу или метанолу, если R15 представляет 9-флуоренилметоксикарбонильную группу, превращение группы R15NH в группу H2N можно выполнить обработкой пиперидином. Для введения группы R1-SO2- соединение формулы VIII затем подвергают взаимодействию с галогенангидридом сульфоновой кислоты формулы R1-SO2-Hal или ангидридом сульфоновой кислоты формулы R1-SO2-O-SO2-R1, где R1 имеет указанные выше значения и Hal обозначает фтор, хлор или бром,предпочтительно хлор. Данную реакцию сульфонилирования предпочтительно проводят в подходящем органическом растворителе или разбавителе, например в диметилформамиде, N-метилпирролидоне, дихлорметане, хлороформе, тетрагидрофуране, диоксане, диметилсульфоксиде, толуоле, бензоле, этилацетате или смеси этих растворителей, необязательно, с добавлением основания, такого как, например, триэтиламин или N,N-диизопропилэтиламин. При синтезе соединения формулы I можно также сначала провести взаимодействие соединения формулы III с соединением формулы VIa или VIb, приводящее к замене группы L1 в формуле III 6 членным кольцом, и затем взаимодействие образовавшегося промежуточного продукта с соединением формулы IV. При желании, дальнейшие взаимодействия с соединениями формулы VII или с продуктами сульфонилирования соединений формулы VIII можно затем проводить стандартными способами, например реакциями ацилирования или реакциями этерификации. Кроме того, например, заместитель Х в 2 положении пуриновой структуры можно также ввести только в конце вышеописанного синтеза соединений формулы I способами, известными per se, например, как описано в D.A. Nugiel, J. Org. Chem. 62Org. Chem. 33 (1968) 1600; J.L. Kelley et al., J. Med. Chem. 33 (1990) 196 или Е. Vanotti et al., Eur. J. Chem. 29 (1994) 287, все из которых включены здесь в качестве ссылки. Кроме того, если нужно, соединение формулы VII или продукт сульфонилирования соединения формулы VIII можно превратить в физиологически толерантную соль или пролекарство стандартными способами, известными специалисту в данной области. Соединения формулы I, в которой D представляет -CO-NH-, где атом азота связан с группой Е,группа G представляет СН и группа Z представляет азот, можно получить также следующим образом. Соединение формулы V подвергают взаимодействию с соединением формулы IX с получением соединения формулы Х. В, X, Y, R2, R15 и s в соединениях формул IX и X имеют указанные выше значения, но функциональные группы, необязательно, также могут присутствовать в форме групп-предшественников или могут быть защищены защитными группами. Группа U в соединениях формулы IX представляет группу карбоновой кислоты СООН или подходящим способом защищенную группу карбоновой кислоты, например бензиловый эфир, трет-бутиловый эфир или силиловый эфир. Если U представляет защищенную группу карбоновой кислоты, защитную группу, предпочтительно, выбирают так, чтобы ее можно было освободить от защитной группы независимо от других защищенных групп карбоновой кислоты, которые могут присутствовать, например, в R2, или от защищающей группы R7. Взаимодействие соединений формул IX и Х можно проводить способами, хорошо известными специалисту в данной области (см.,например, J. March, Advanced Organic Chemistry, Fourth Edition, Wiley, 1992 и цитированные в них литературные источники). При взаимодействии соединения формулы IX с соединением формулы Х нуклеофильно замещаемая уходящая группа в одном участнике взаимодействия заменяется нуклеофильным атомом азота в другом участнике взаимодействия, как, например, в случае взаимодействия соединений формул III и IV. Вышеуказанное относительно растворителей и оснований, подходящих для взаимодействия соединений формул III и IV, следовательно, соответственно относится к взаимодействию соединений формул IX и X. В качестве основания при взаимодействии соединений формул IX и Х можно использовать также избыток соединения формулы IX. Если используют соединение формулы IX, в которойU представляет группу СООН, взаимодействие непосредственно приводит к соединению формулы X. В противном случае соединение формулы Х получают после удаления защитной группы карбоновой кислоты, присутствующей в U, по известным способам. Группу карбоновой кислоты в 4-положении пиперидин-1-ильного остатка в соединениях формулы I можно затем активировать, например, способами, используемыми для сочетания пептидов, которые хорошо известны специалисту в данной области и обзор которых дается, например, в F. Albericio and L.A.Carpino, Methods Enzymol. 289 (1997), 104. Примерами подходящих активирующих агентов являются тетрафторборат О-циано(этоксикарбонил)метилен)амино-1,1,3,3-тетраметилурония (TOTU), гексафторфосфат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (HBTU), гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) или карбодиимиды, подобные N,N'-дициклогексилкарбодиимиду или N,N'-диизопропилкарбодиимиду. Активацию можно также подходящим способом выполнить превращением карбоновой кислоты в пентафторфениловый эфир взаимодействием сN,N'-дициклогексилкарбодиимидом и пентафторфенолом. После активации соединение формулы Х подвергают взаимодействию с соединением формулы H-NR6-E, в которой R6 и Е имеют указанные выше значения, но функциональные группы могут, необязательно, присутствовать также в форме групппредшественников или могут быть защищены защитными группами, с получением соединения формулыVII, в которой D означает C(O)-NR6, где атом азота связан с группой Е, группа G означает СН и группа Z означает азот. Соединение формулы VII затем превращают в соединение формулы I, как описано выше. Исходные соединения формул III, IV, VIa, VIb и IX, которые связывают для образования соединений формулы I, являются коммерчески доступными или их можно получить способами, описанными ниже или в литературе, или способами, аналогичными им. Соединения формулы I являются ценными фармакологически активными соединениями, которые являются подходящими, например, для терапии и профилактики костных нарушений, опухолевых заболеваний, сердечно-сосудистых нарушений и воспалительных состояний. Соединения формулы I и их физиологически переносимые соли и их пролекарства можно вводить животным, предпочтительно млекопитающим, и особенно людям в качестве фармацевтических средств для терапии или профилактики. Их можно вводить как таковые или в смесях друг с другом или в форме фармацевтических композиций,-7 005372 которые допускают возможность энтерального или парентерального введения и которые в качестве активного компонента содержат эффективную дозу по меньшей мере одного соединения формулы I, и/или его физиологически переносимых солей, и/или его пролекарств помимо обычных фармацевтически приемлемых веществ-носителей и/или добавок. Настоящее изобретение, следовательно, относится также к соединениям формулы I, и/или их физиологически переносимым солям, и/или их пролекарствам для использования в качестве фармацевтических средств, к использованию соединений формулы I, и/или их физиологически переносимых солей,и/или их пролекарств для получения фармацевтических средств для терапии и профилактики заболеваний, указанных выше или ниже, например для терапии или профилактики костных нарушений, а также к использованию соединений формулы I, и/или их физиологически переносимых солей, и/или их пролекарств для терапии или профилактики указанных заболеваний и способам такой терапии и профилактики. Кроме того, настоящее изобретение относится к фармацевтическим композициям (или фармацевтическим препаратам), которые содержат эффективную дозу по меньшей мере одного соединения формулыI, и/или его физиологически переносимых солей, и/или его пролекарств и обычный фармацевтически приемлемый носитель. Фармацевтические средства можно вводить перорально, например в форме пилюль, таблеток, лакированных таблеток, покрытых таблеток, гранул, твердых и мягких желатиновых капсул, растворов, сиропов, эмульсий, суспензий или аэрозольных смесей. Введение, однако, можно также проводить ректально, например в форме суппозиториев, или парентерально, например внутривенно, внутримышечно или подкожно в форме растворов для инъекции или растворов для инфузии, микрокапсул, имплантатов или палочек, или чрескожно или местно, например в форме мазей, растворов, эмульсий или настоек, или другими путями, например в форме аэрозолей или назальных спреев. Фармацевтические композиции по изобретению получают способом, известным per se и знакомым специалисту в данной области, причем одно или несколько соединений формулы I, и/или их физиологически переносимых солей, и/или их пролекарств смешивают с одним или несколькими фармацевтически приемлемыми инертными неорганическими и/или органическими веществами-носителями и/или добавками и, при желании, с одним или несколькими другими фармацевтически активными соединениями и превращают в подходящую для введения форму и дозированную лекарственную форму, которую можно использовать в медицине или ветеринарии. Для получения пилюль, таблеток, покрытых таблеток и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.д. Носителями для мягких желатиновых капсул и суппозиторий являются, например, жиры, воски, полутвердые и жидкие полиолы, природные или гидрогенизированные масла и т.д. Подходящими веществами-носителями для получения растворов, например растворов для инъекций, эмульсий или сиропов, являются, например, вода, спирты, глицерин, полиолы,сахароза, инвертный сахар, глюкоза, растительные масла и т.д. Подходящими носителями для микрокапсул, имплантатов или палочек являются, например, сополимеры гликолевой кислоты и молочной кислоты. Фармацевтические композиции обычно содержат приблизительно от 0,5 до 90 мас.% соединений формулы I, и/или их физиологически переносимых солей, и/или их пролекарств. Количество активного ингредиента формулы I, и/или его физиологически переносимой соли, и/или его пролекарства в фармацевтических композициях обычно составляет приблизительно от 0,2 до приблизительно 500 мг, предпочтительно приблизительно от 1 до приблизительно 200 мг. Помимо активных ингредиентов формулы I, и/или их физиологически переносимых солей, и/или их пролекарств и носителей, фармацевтические композиции могут содержать добавки (или вспомогательные вещества), такие как, например, наполнители, дезинтеграторы, связующие, смазывающие вещества,смачивающие агенты, стабилизаторы, эмульгаторы, консерванты, подслащивающие вещества, окрашивающие вещества, корригенты, ароматизаторы, загустители, разбавители, буферные вещества, растворители, солюбилизаторы, агенты для достижения эффекта депо, соли для изменения осмотического давления, агенты для создания покрытий или антиоксиданты. Они могут содержать также два или более соединений формулы I, и/или их физиологически переносимых солей, и/или их пролекарств. Кроме того,помимо по меньшей мере одного соединения формулы I, и/или его физиологически переносимых солей,и/или его пролекарств они могут также содержать один или несколько других терапевтически или профилактически активных ингредиентов. Соединения формулы I являются антагонистами рецептора витронектина и ингибиторами клеточной адгезии. Они обладают, например, способностью ингибировать связывание остеокластов с костной поверхностью и, тем самым, ингибируют резорцию костей остеокластами. Действие соединений формулы I можно показать, например, в анализе, в котором определяют ингибирование связывание выделенного рецептора витронектина или клеток, которые содержат рецептор витронектина, с лигандом рецептора витронектина. Детали такого анализа приводятся ниже. В качестве антагонистов рецептора витронектина соединения формулы I, и их физиологически переносимые соли, и их пролекарства обычно являются подходящими для терапии и профилактики заболеваний, которые основаны на взаимодействии между рецепторами витронектина и их лигандами в процессах взаимодействия клетка-клетка или в процессах взаимодействия клетка-матрица, или на которые оказывает влияние ингибирование взаимодействий та-8 005372 кого типа, или для предотвращения, облегчения или лечения которых требуется ингибирование взаимодействий такого типа. Как объясняется вначале, такие взаимодействия играют роль, например, в резорбции костей, в развитии кровеносных сосудов или в пролиферации клеток васкулярной гладкой мускулатуры. Соединения формулы I, и их физиологически переносимые соли, и их пролекарства, следовательно, являются подходящими, например, для предотвращения, ослабления или лечения заболеваний, которые вызываются, по меньшей мере, частично, нежелательной степенью костной резорбции, развития кровеносных сосудов или пролиферации клеток васкулярной гладкой мускулатуры. Костными заболеваниями, для лечения или профилактики которых можно использовать соединения формулы I по изобретению, являются, особенно, остеопороз, гиперкальциемия, остеопения, например,вызванная метастазами, зубные нарушения, гиперпаратиреоз, вокругсуставные эрозии при ревматоидном артрите и болезнь Педжета. Кроме того, соединения формулы I можно использовать для облегчения,профилактики или терапии костных нарушений, которые вызываются глюкокортикоидной, стероидной или кортикостероидной терапией или недостатком полового(ых) гормона(ов). Все эти заболевания характеризуются костной потерей, которая основана на отсутствии равновесия между образованием костей и деструкцией костей и на которую можно оказывать благоприятное влияние ингибированием резорбции костей остеокластами. Соединения формулы I, и/или их физиологически переносимые соли, и/или их пролекарства можно также благоприятно использовать в качестве ингибитора костной резорбции, например для терапии или профилактики остеопороза, в комбинации с общепринятыми лечениями остеопороза, например в комбинации с агентами, подобными бисфосфонатам, эстрогенам, эстрогену/прогестерону, агонистам/антагонистам эстрогена, кальцитонину, аналогам витамина D, паратироидному гормону, средствам, усиливающим секрецию гормона роста, или фториду натрия. Введение соединений формулы I, и/или их физиологически переносимых солей, и/или их пролекарств и других активных ингредиентов, эффективных для лечения или профилактики остеопороза и подобных активным ингредиентам, перечисленным выше, можно проводить одновременно или последовательно в любом порядке и совместно или раздельно. Для использования при таком комбинационном лечении или профилактике соединения формулы I, и/или их физиологически переносимые соли, и/или их пролекарства и один или несколько других активных ингредиентов, подобных перечисленным выше, могут присутствовать вместе в одной фармацевтической композиции, например таблетках, капсулах или гранулах, или могут присутствовать в двух или более отдельных фармацевтических композициях, которые могут содержаться в одной упаковке или в двух или более отдельных упаковках. Использование соединений формулы I, и/или их физиологически переносимых солей, и/или их пролекарств в такой комбинационной терапии или профилактике и их использование для получения фармацевтических препаратов для такой комбинационной терапии или профилактики также являются предметами настоящего изобретения. Изобретение, кроме того, относится к фармацевтическим композициям, которые включают эффективные количества по меньшей мере одного соединения формулы I, и/или его физиологически переносимых солей, и/или его пролекарств вместе по меньшей мере с одним другим активным ингредиентом, эффективным для лечения или профилактики остеопороза или для ингибирования резорбции костей, подобным ингредиентам, перечисленным выше, вместе с обычным фармацевтически приемлемым носителем. Вышеприведенное по фармацевтическим композициям соответственно относится к таким фармацевтическим комбинационным композициям. Помимо использования в качестве ингибиторов костной резорбции остеокластами, соединения формулы I, и их физиологически переносимые соли, и их пролекарства можно использовать, например, в качестве ингибиторов роста опухолей и метастазов опухолей, в качестве противовоспалительных средств, для терапии или профилактики ревматоидного артрита, для терапии псориаза, для терапии или профилактики сердечно-сосудистых нарушений, таких как артериосклероз или рестеноз, для лечения или профилактики нефропатии или ретинопатии, такой как, например, диабетическая ретинопатия. В качестве ингибиторов роста опухолей или метастазов опухолей соединения формулы I, и/или их физиологически переносимые соли, и/или их пролекарства можно также благоприятно использовать в комбинации с общепринятой терапией раковых заболеваний. Примеры общепринятой терапии раковых заболеваний приводятся в Bertino (Editor), Encyclopedia of Cancer, Academic Press, 1997, которая включается здесь в качестве ссылки. Все вышеуказанное, относящееся к использованию соединений формулы I в комбинации с общепринятой терапией остеопороза, подобнoе, например, возможным способам введения и фармацевтическим комбинационным композициям, соответственно, относится к использованию соединений формулы I в комбинации с общепринятой терапией раковых заболеваний. При использовании соединений формулы I доза может изменяться в пределах широких ограничений и, как обычно, должна быть подходящей для отдельных состояний в каждом индивидуальном случае. Она зависит, например, от используемого соединения, от природы и серьезности заболевания, которое нужно лечить, или от того, лечат ли острое или хроническое состояние, или от того, проводят ли профилактику. В случае перорального введения суточная доза обычно составляет приблизительно от 0,01 до приблизительно 100 мг/кг, предпочтительно приблизительно от 0,1 до приблизительно 50 мг/кг,особенно приблизительно от 0,1 до приблизительно 5 мг/кг, для достижения эффективных результатов у взрослого пациента, весящего приблизительно 75 кг (в каждом случае в мг на кг массы тела). Кроме того,-9 005372 в случае внутривенного введения суточная доза обычно составляет приблизительно от 0,01 г до приблизительно 100 мг/кг, предпочтительно приблизительно от 0,05 до приблизительно 10 мг/кг (в каждом случае в мг на кг массы тела). Суточную дозу можно разделить, особенно в случае введения относительно больших количеств, на несколько частей, например для 2, 3 или 4 введений. Обычно, в зависимости от поведения индивидуума, может быть необходимо изменить ее в сторону повышения или понижения от указанной суточной дозы. Кроме использования в качестве фармацевтических активных ингредиентов соединения формулы I можно также использовать в качестве наполнителей или носителей для других активных ингредиентов,чтобы перенести активный ингредиент точно к месту действия (=доставка лекарственного средства в цель; см., например, публикацию Targeted Drug Delivery, R.C. Juliano, Handbook of Experimental Pharmacology, Vol. 100, Ed. Born, G.V.R. et al., Springer Verlag, которая включается здесь в качестве ссылки). Активными ингредиентами, которые нужно перенести, являются особенно те, которые можно использовать для лечения вышеуказанных заболеваний. Соединения формулы I и их соли можно, кроме того, использовать для диагностических целей, например для установления диагнозов in vitro, и в качестве вспомогательных средств в биохимических исследованиях, в которых требуется блокирование рецептора витронектина или оказание влияния на взаимодействия клетка-клетка или клетка-матрица. Их можно, кроме того, использовать в качестве синтетических промежуточных продуктов для получения других соединений, особенно других фармацевтически активных ингредиентов, которые доступны из соединений формулы I, например, введением заместителей или модификацией функциональных групп. Примеры Аббревиатуры АсОН Уксусная кислота ДХМ Дихлорметан ДМФN,N-Диметилформамид ЭА Этилацетат МеОН Метанол ТФУ Трифторуксусная кислота ТГФ Тетрагидрофуран Пример 1. (2S)-2-(Нафталин-1-сульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота. а) трет-Бутиловый эфир (2S)-2-бензилоксикарбониламино-3-(6-хлорпурин-9-ил)пропионовой кислоты. К суспензии 7,73 г (50 ммоль) 6-хлорпурина в 350 мл абсолютного ТГФ добавляют 14,43 г (55 ммоль) трифенилфосфина при температуре от -10 до 0 С с последующим добавлением 9,57 г (55 ммоль) диэтилазодикарбоксилата и 14,8 г (50 ммоль) трет-бутилового эфира N-бензилоксикарбонил-L-серина в 100 мл абсолютного ТГФ и смесь перемешивают при 0 С в течение 48 ч. Растворитель выпаривают и остаток растворяют в смеси ЭА/гептан (2:1), фильтруют и растворитель удаляют в вакууме. Сырой продукт очищают флэш-хроматографией на силикагеле (ЭА/н-гептан (1:1) и ДХМ/ЭА (85:15. Выход: 6,6 г. 1 Н ЯМР=(200 МГц, ДМСО-D6): =1,30 (с, 9 Н, С(СН 3)3); 4,48-4,73 (м, 3 Н, CH2-CH-N); 4,98 (с, 2 Н,СН 2-арил); 7,19-7,40 (м, 5 Н, арил-Н); 7,87 (д, 1 Н, NH); 8,61+8,77 (c+c, 2H, C6-H+C8-H).b) 1-(9-2S)-2-Бензилоксикарбониламино-2-трет-бутоксикарбонилэтил)пурин-6-ил)пиперидин-4 карбоновая кислота. К 5,92 г (45,8 ммоль) пиперидин-4-карбоновой кислоты в 200 мл ДМФ добавляют 18,65 г (92 ммоль) N,О-бистриметилсилилацетамида. Смесь доводят до комнатной температуры и перемешивают в течение 2,5 ч. Затем добавляют 6,6 г (15,3 ммоль) соединения стадии а) в 50 мл ДМФ и смесь перемешивают при комнатной температуре в течение 18 ч. Растворитель удаляют в вакууме и остаток растворяют в ЭА и экстрагируют водным раствором KHSO4/K2SO4 и насыщенным раствором рассола. Раствор сушат над МgSO4, фильтруют и растворитель удаляют в вакууме. Сырой продукт очищают флэшхроматографией на силикагеле (ЭА/н-гептан (1:1) и ДХМ/МеОН/АсОН (100:3:0,5. Выход: 4,7 г.- 10005372 К 4,65 г (8,87 ммоль) соединения стадии b) и 1,45 г (10,65 ммоль) гидрохлорида 2-амино-1,4,5,6 тетрагидропиримидина в 120 мл абсолютного ДМФ добавляют 3,2 г (9,76 ммоль) тетрафторбората Оциано(этоксикарбонил)метилен)амино)-1,1,3,3-тетраметилурония (TOTU) и 4,59 г (6,04 ммоль) N,Nдиизопропилэтиламина и смесь перемешивают в течение 5 ч при комнатной температуре. Добавляют 2,66 мл ледяной уксусной кислоты и растворитель удаляют в вакууме. Остаток растворяют в ЭА и экстрагируют водным раствором NаНСО 3 и насыщенным раствором соли, раствор сушат над MgSO4, фильтруют и растворитель удаляют в вакууме. Сырой продукт очищают флэш-хроматографией на силикагелеd) трет-Бутиловый эфир (2S)-2-амино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил) пиперидин-1-ил)пурин-9-ил)пропионовой кислоты. Соединение стадии с) в количестве 1 г растворяют в 30 мл ледяной уксусной кислоты и гидрируют над 0,5 г катализатора палладий/уголь (10%). Катализатор отфильтровывают, растворитель удаляют в вакууме и продукт очищают флэш-хроматографией на силикагеле (ДХМ/МеОН/АсОН/Н 2 Оe) трет-Бутиловый эфир (2S)-2-(нафталин-1-сульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты. К 0,25 г (0,47 ммоль) соединения стадии d) в 4 мл абсолютного ДМФ добавляют при 0 С 160 мг (0,7 ммоль) нафталин-1-сульфонилхлорида и 152 мг (1,18 ммоль) N,N-диизопропилэтиламина и смесь перемешивают при 0 С в течение 3 ч. Растворитель удаляют в вакууме, остаток растворяют в ЭА и раствор экстрагируют водным раствором NаНСО 3 и насыщенным раствором рассола, сушат над МgSO4, фильтруют и концентрируют в вакууме. Сырой продукт очищают флэш-хроматографией на силикагелеf) (2S)-2-(Нафталин-1-сульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота. Соединение стадии е) в количестве 173 мг растворяют в 40 мл охлажденной 95% ТФУ и перемешивают в течение 30 мин при 0 С и затем в течение 40 мин при комнатной температуре. ТФУ удаляют в вакууме и продукт 3 раза упаривают совместно с толуолом и 3 раза с этанолом. Выход: 190 мг (соль ТФУ).a) трет-Бутиловый эфир (2S)-2-(нафталин-2-сульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты. Синтез проводят аналогично примеру 1 е) с использованием соединения примера 1, стадия d), и нафталин-2-сульфонилхлорида. Выход: 71,3%.b) (2S)-2-(Нафталин-2-сульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота. Синтез проводят аналогично примеру 1f) с использованием 80 мг соединения стадии а). Выход: 65,3 мг (соль ТФУ).(2S)-2-(4-трет-бутилбензолсульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты. Синтез проводят аналогично примеру 1 е) с использованием соединения примера 1, стадия d), и 4 трет-бутилбензолсульфонилхлорида. Выход: 62%.b) (2S)-2-(4-трет-Бутилбензолсульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота. Синтез проводят аналогично примеру 1f) с использованием 62 мг соединения стадии а). Выход: 48 мг (соль ТФУ).a) трет-Бутиловый эфир (2S)-2-(н-пропан-1-сульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты. Синтез проводят аналогично примеру 1 е) с использованием соединения примера 1, стадия d), и пропан-1-сульфонилхлорида. Выход: 10%.b) (2S)-2-(Пропан-1-сульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота. Синтез проводят аналогично примеру 1f) с использованием 7 мг соединения стадии а). Выход: 6,3 мг (соль ТГФ).a) трет-Бутиловый эфир (2S)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1 ил)пурин-9-ил)-2-(4-трифторметилбензолсульфониламино)пропионовой кислоты. Синтез проводят аналогично примеру 1 е) с использованием соединения примера 1, стадия d), и 4 трифторметилбензолсуль-фонилхлорида. Выход: 67%.b) (2S)-3-(6-(4-(1,4,5,6-Тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)-2-(4-трифторметилбензолсульфониламино)пропионовая кислота. Синтез проводят аналогично примеру 1f) с использованием 60 мг соединения стадии а). Выход: 53 мг (соль ТФУ).a) трет-Бутиловый эфир (2S)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил) пурин-9-ил)-2-(3-трифторметилбензолсульфониламино)пропионовой кислоты. Синтез проводят аналогично примеру 1 е) с использованием соединения примера 1, стадия d), и 3 трифторметилбензолсульфонилхлорида. Выход: 61%.b) (2S)-3-(6-(4-(1,4,5,6-Тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)-2-(3-трифторметилбензолсульфониламино)пропионовая кислота. Синтез проводят аналогично примеру 1f) с использованием 55 мг соединения стадии а). Выход: 40 мг (соль ТФУ).a) трет-Бутиловый эфир (2S)-2-фенилметансульфониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин 2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты. Синтез проводят аналогично примеру 1 е) с использованием соединения примера 1, стадия d), и фенилметансульфонилхлорида. Выход: 26%.b) (2S)-2-Фенилметансульфониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота. Синтез проводят аналогично примеру 1f) с использованием 55 мг соединения стадии а). Выход: 40 мг (соль ТФУ). а) трет-Бутиловый эфир (2S)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1 ил)пурин-9-ил)-2-трифторметансульфониламинопропионовой кислоты. К 53,2 мг (0,1 ммоль) соединения примера 1d) в 1 мл абсолютного ДХМ добавляют при -70 С 56,5 мг (0,2 ммоль) ангидрида трифторуксусной кислоты в 0,5 мл абсолютного ДХМ с последующим добавлением 38,8 мг (0,3 ммоль) N,N-диизопропилэтиламина в 0,5 мл абсолютного ДХМ. Смесь перемешивают при -70 С в течение 1 ч, затем медленно нагревают до 0 С и перемешивают при 0 С в течение 2 ч. Растворитель удаляют в вакууме, остаток растворяют в ЭА и раствор экстрагируют водным растворомNаНСО 3 и насыщенным раствором рассола, сушат над МgSО 4, фильтруют и растворитель удаляют в вакууме. Сырой продукт очищают флэш-хроматографией на силикагеле (ДХМ/МеОН/АсОН/Н 2 О(2S)-3-(6-(4-(1,4,5,6-Тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)-2-трифторметансульфониламинопропионовая кислота. Синтез проводят аналогично примеру 1f) с использованием 29 мг соединения стадии а). Выход: 26 мг (соль ТФУ). а) трет-Бутиловый эфир (2S)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1 ил)пурин-9-ил)-2-(2,2,2-трифторэтансульфониламино)пропионовой кислоты. Синтез проводят аналогично примеру 1 е) с использованием соединения примера 1, стадия d), и 2,2,2-трифторэтансульфонилхлорида. Выход: 75%.b) (2S)-3-(6-(4-(1,4,5,6-Тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)-2-(2,2,2 трифторэтансульфониламино)пропионовая кислота. Синтез проводят аналогично примеру 1f) с использованием 72 мг соединения стадии а). Выход: 68 мг (соль ТФУ).a) 1-(9-2S)-2-Амино-2-трет-бутоксикарбонилэтил)пурин-6-ил)пиперидин-4-карбоновая кислота. Соединение примера 1b) в количестве 1,7 г в 200 мл АсОН гидрируют над катализатором палладий/уголь (10%) в течение 40 мин при комнатной температуре. Катализатор отфильтровывают, растворитель удаляют в вакууме и продукт лиофилизуют. Выход: 1,28 г.b) 1-(9-2S)-2-трет-Бутоксикарбонил-2-(2-метилпропан-1-сульфониламино)этил)пурин-6-ил)пиперидин-4-карбоновая кислота. К 160 мг (0,41 ммоль) соединения стадии а) в 2 мл ДМФ добавляют 3 эквивалента N,O-бистриметилсилилацетамида и смесь перемешивают в течение 30 мин при 0 С и затем в течение 30 мин при комнатной температуре. Добавляют 64 мг (0,41 ммоль) 2-метилпропан-1-сульфонилхлорида при 0 С и температуру смеси медленно доводят до комнатной температуры и перемешивают в течение 2 ч. Растворитель удаляют в вакууме и сырой продукт очищают хроматографией на силикагелеc) трет-Бутиловый эфир (2S)-2-(2-метилпропан-1-сульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты. Соединение стадии b) в количестве 80 мг (0,157 ммоль) растворяют в 2 мл ацетонитрила и обрабатывают 35 мг N,N'-дициклогексилкарбодиимида и 29 мг пентафторфенола. Смесь перемешивают в течение 30 мин при комнатной температуре и растворитель удаляют в вакууме. Остаток растворяют в 2 мл ДМФ и добавляют 31 мг 2-амино-1,4,5,6-тетрагидропиримидина. Смесь перемешивают в течение 12 ч при комнатной температуре, растворитель выпаривают и сырой продукт очищают хроматографией на силикагеле (ДХМ/МеОН/АсОН/Н 2 О (95:5:0,5:0,5). Выход: 45 мг (49%).d) (2S)-2-(2-Метилпропан-1-сульфониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-ил-карбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота. Соединение стадии с) в количестве 45 мг (0,076 ммоль) растворяют в смеси ТФУ/Н 2 О (95:5) и перемешивают при комнатной температуре в течение 30 мин. Растворитель удаляют в вакууме и остаток лиофилизуют. Выход: 100% (соль ТФУ). а) 1-(9-2S)-2-трет-Бутоксикарбонил-2-(толуол-4-сульфониламино)этил)пурин-6-ил)пиперидин-4 карбоновая кислота. Синтез проводят аналогично примеру 10b) с использованием соединения примера 10 а) и толуол-4 сульфонилхлорида. Выход: 37%.b) трет-Бутиловый эфир (2S)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил) пурин-9-ил)-2-(толуол-4-сульфониламино)пропионовой кислоты. Синтез проводят аналогично примеру 10 с) с использованием соединения стадии а). Выход: 85%.c) (2S)-3-(6-(4-(1,4,5,6-Тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)-2-(толуол-4-сульфониламино)пропионовая кислота. Синтез проводят аналогично примеру 10d) с использованием соединения стадии b). Выход: 100%a) 1-(9-2S)-2-трет-Бутоксикарбонил-2-(2,4,6-триметилбензолсульфониламино)этил)пурин-6-ил)пиперидин-4-карбоновая кислота. Синтез проводят аналогично примеру 10b) с использованием соединения примера 10 а) и 2,4,6 триметилбензолсульфонилхлорида. Выход: 60%.b) трет-Бутиловый эфир (2S)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил) пурин-9-ил)-2-(2,4,6-триметилбензолсульфониламино)пропионовой кислоты. Синтез проводят аналогично примеру 10 с) с использованием соединения стадии а). Выход: 84%.MS (FAB): m/e=654,5 (30%, (M+H)+); 327,8 (50%); 299,8 (100%). с) (2S)-3-(6-(4-(1,4,5,6-Тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)-2-(2,4,6 триметилбензолсульфониламино)пропионовая кислота. Синтез проводят аналогично примеру 10d) с использованием соединения стадии b). Выход: 100%MS (FAB): m/e=598,4 (15%, (М+Н)+); 299,8 (100%). Фармакологическое испытание 1) Анализ связывания кистрина. Ингибирование связывания кистрина с рецептором витронектина человека (VnR), описанное ниже,является способом испытания, которым можно определить антагонистическое действие соединений изобретения на рецептор витронектина v3 (испытание ELISA v3; данный способ испытания обозначают аббревиатурой как K/VnR в перечне результатов испытаний). Очистка кистрина Кистрин очищают по способам Dennis et al., как описано в Proc. Natl. Acad. Sci. USA 87 (1989) 2471and Proteins: Structure, Function and Genetics 15 (1993) 312. Очистка рецептора витронектина человека (v3) Рецептор витронектина человека получают из плаценты человека по способу Putela et al., MethodsEnzymol. 144 (1987) 475. Рецептор витронектина человека v3 можно также получить из некоторых клеточных линий (например, из клеток 293, линии клеток почек эмбриона человека), которые трансфекцируют совместно ДНК-последовательностями как для субъединиц v, так и 3 рецептора витронектина. Субъединицы экстрагируют октилгликозидом и затем хроматографируют через конканавалин А, гепарин-сефарозу и S300. Моноклональные антитела Мышиные моноклональные антитела, которые являются специфическими для субъединиц 3 рецептора витронектина, получают по способу Newman et al., Blood, 1985, 227, или аналогичным способом. Конъюгат кроличьего Fab 2 антимышиного Fc с пероксидазой из хрена (антимышиный Fc HRP) получают от Pel Freeze (Catalog715 305-1). Испытание ELISA Способность веществ ингибировать связывание кистрина с рецептором витронектина можно определить с использованием испытания ELISA. Для этой цели 96-луночные титрационные микропланшетыNunc покрывают раствором кистрина (0,002 мг/мл) по способу Dennis et аl., как описано в Proteins:Structure, Function and Genetics 15 (1993) 312. Планшеты затем промывают дважды системой PBS/0,05% Твин-20 и блокируют инкубированием (60 мин) с бычьим сывороточным альбумином (BSA, 0,5%, сортRIA или лучше) в растворе буфера (Трис-НСl (50 мМ), NaCl (100 мМ), MgCl2 (1 мМ), CaCl2 (1 мМ),MnCl2 (1 мМ, рН 7). Растворы известных ингибиторов и испытуемых веществ получают при концентрации от 210-12 до 210-6 моль/л в буфере для анализа (BSA (0,5%, сорт RIA или лучше); Трис-НСl (50 мМ), NaCl (100 мМ), MgCl2 (1 мМ), CaCl2 (1 мМ), MnCl2 (1 мМ, рН 7). Блокированные планшеты опорожняют и в каждом случае 0,025 мл данного раствора, который содержит определенную концентрацию(от 210-12 до 210-6 моль/л) либо известного ингибитора, либо испытуемого вещества, добавляют в каждую лунку. 0,025 мл раствора рецептора витронектина в буфере для анализа (0,03 мг/мл) пипетируют в каждую лунку планшета и планшет инкубируют при комнатной температуре в течение 60-180 мин на шюттель-аппарате. Тем временем получают раствор (6 мл/планшет) мышиных моноклональных антител,специфических для субъединицы 3 рецептора витронектина в буфере для анализа (0,0015 мг/мл). Вторичное кроличье антитело (0,001 мл исходного раствора/6 мл раствора мышиного моноклонального антитела анти-3), которое является конъюгатом антитела, антимышиный Fc-HRP, добавляют к этому раствору и данную смесь мышиного антитела анти-3 и конъюгата антитела, кроличий антимышиный FcHRP, инкубируют в течение времени инкубации системы рецептор-ингибитор. Планшеты для испытания- 15005372 промывают 4 раза раствором PBS, который содержит 0,05% Твин-20, и в каждом случае 0,05 мл/лунку смеси антител пипетируют в каждую лунку планшета и инкубируют в течение 60-180 мин. Планшет промывают 4 раза PBS/0,05% Твин-20 и затем проявляют 0,05 мл/лунку раствора PBS, который содержит 0,67 мг/мл о-фенилендиамина и 0,012% H2O2. Альтернативно этому, о-фенилендиамин можно использовать в буфере (рН 5), который содержит Nа 3 РO4 и лимонную кислоту. Проявление цвета останавливают 1 н H2SO4 (0,05 мл/лунку). Поглощение для каждой лунки измеряют при 492-405 нм и данные оценивают стандартными методами. 2) Испытание системы витронектин/клетки 293. В данном испытании определяют ингибирование связывания клеток 293 с витронектином человека(Vn) соединениями согласно изобретению (способ испытания обозначают аббревиатурой как испытаниеVn/клетка 293 в перечне результатов испытаний). Очистка витронектина человека Витронектин человека выделяют из плазмы человека и очищают афинной хроматографией по методу Yatohgo et al., Cell Structure and Function 23 (1988) 281. Испытание клеток Клетки 293, клеточная линия почек эмбрионов человека, которые были сотрансфекцированы ДНКпоследовательностями для субъединиц v и 3 рецептора витронектина v3, отбирают для экспрессии с высокой скоростью (500000 рецепторов v3/клетку) по методу FACS. Отобранные клетки культивируют и снова сортируют при помощи FACS, чтобы получить стабильную клеточную линию (15 D) со скоростями экспрессии 1000000 копий v3 на клетку. 96-луночный планшет для культуры тканей Linbro с плоским дном покрывают в течение ночи при 4 С витронектином человека (0,01 мг/мл, 0,05 мл/лунку) в забуференном фосфатом физиологическом растворе (PBS) и затем блокируют BSA (бычий сывороточный альбумин) с концентрацией 0,5%. Получают растворы испытуемых веществ от 10-10 до 210-3 моль/л в содержащей глюкозу среде DMEM и в каждом случае в планшет добавляют 0,05 мл/лунку. Клетки, которые экспрессируют большие уровни v3(например, 15 D), суспендируют в содержащей глюкозу среде DMEM и суспензию регулируют до содержания 25000 клеток/0,05 мл среды. 0,05 мл данной суспензии клеток добавляют в каждую лунку и планшет инкубируют при 37 С в течение 90 мин. Планшет промывают 3 раза теплым PBS для удаления несвязанных клеток. Связанные клетки лизируют в цитратном буфере (25 мМ, рН 5,0), который содержит 0,25% тритон Х-100. Затем добавляют субстрат гексосезамидазы, п-нитрофенил-N-ацетилDглюкозамидин, и планшет инкубируют при 37 С в течение 90 мин. Реакцию останавливают смесью глицин (50 мМ)/буфер ЭДТУ (5 мM) (pH 10,4) и поглощение каждой лунки измеряют при длине волны от 405 до 650 нм. Данные анализируют по стандартным методам. 3) Анализ Pit. Ингибирование резорбции костей соединениями изобретения можно определить, например, с помощью испытания на резорбцию остеокластами (Анализ PIT), например аналогично WO-A-95/32710,которая включена здесь в качестве ссылки. Были получены следующие результаты испытаний (ингибирующие концентрации IС 50). Испытание Vn/ Анализ Pit клетки 293 где D представляет -С(O)-NН-, где данный двухвалентный остаток связан с группой Е через его атом азота; Е представляет остатокR1 представляет (C1-C18)-алкил, фенил, нафтил или бензил, возможно замещенныe одним, двумя или тремя одинаковыми или разными заместителями из группы, состоящей из фтора, хлора, брома, циано, трифторметила, (C1-C6)-алкила, (C1-C6)-алкокси и (C5-C14)-арила;R5 представляет гидрокси или (C1-C6)-алкокси;s равно 0; во всех его стереоизомерных формах и их смесях во всех отношениях, и их физиологически приемлемые соли. 2. Способ получения соединения по п.1, включающий взаимодействие соединения формулы V с соединением формулы VIa где L1 представляет уходящую группу, R15 представляет R1-SO2- или аминозащитную группу и В, D, Е,G, X, R2 и s имеют значения, указанные в п.1, но где функциональные группы могут присутствовать также в форме групп-предшественников или в защищенной форме. 3. Фармацевтическая композиция, включающая по меньшей мере одно соединение формулы I по п.1, и/или его физиологически переносимые соли, и/или его пролекарства и фармацевтически приемлемый носитель. 4. Применение соединения формулы I по п.1 и/или его физиологически переносимых солей для использования в качестве фармацевтического средства. 5. Применение соединения формулы I по п.1 и/или его физиологически переносимых солей для использования в качестве антагониста рецептора витронектина.
МПК / Метки
МПК: A61K 31/52, C07D 473/34
Метки: ингибиторов, качестве, клеточной, замещенные, адгезии, пурина, производные
Код ссылки
<a href="https://eas.patents.su/18-5372-zameshhennye-proizvodnye-purina-v-kachestve-ingibitorov-kletochnojj-adgezii.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные пурина в качестве ингибиторов клеточной адгезии</a>
Предыдущий патент: Глюкопиранозидные конъюгаты 2-(4-гидроксифенил)-1-[4-(2-амин-1-илэтокси)бензил]-1h-индол-5-олов
Следующий патент: Производные 3 (5)-аминопиразола, способ их получения и их применение в качестве противоопухолевых средств
Случайный патент: Инъекционное устройство












