(r)-n-[[4-[[(2-метилфениламино)карбонил]амино]фенил]ацетил]-l-пропил-3- метил- бета-аланин и его применение в качестве ингибитора клеточной адгезии, опосредуемой интегрином альфа4бета1
Формула / Реферат
1. (R)-N-[[4-[[(2-метилфениламино)карбонил]амино]фенил]ацетил]-L-пролил-3-метил-b-аланин, ингибирующий клеточную адгезию
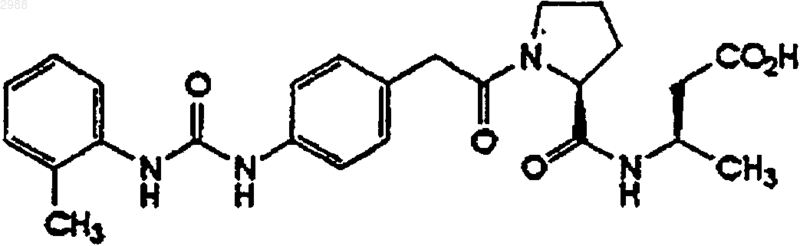
или его фармацевтически приемлемое производное, пролекарство или соль.
2. Соединение по п.1, в котором пролекарство представляет собой сложный эфир соединения.
3. Соединение по п.2, представляющее собой сложный эфир, полученный путем взаимодействия (R)-N-[[4-[[(2-метилфениламино)карбонил]амино]фенил]ацетил]-L-пролил-3-метил-b-аланина с C1-10 спиртом с линейной или разветвленной цепью.
4. Соединение по п.2, представляющее собой сложный эфир, полученный путем взаимодействия (R)-N-[ [4-[[(2-метилфениламино)карбонил]амино]фенил]ацетил]-L-пролил-3-метил-b-аланина с C1-4 спиртом с линейной или разветвленной цепью.
5. Соединение по п.2, представляющее собой сложный эфир формулы
где R представляет собой C1-10алкил с линейной или разветвленной цепью.
6. Соединение по п.5, в котором R представляет собой C1-4алкил с линейной или разветвленной цепью.
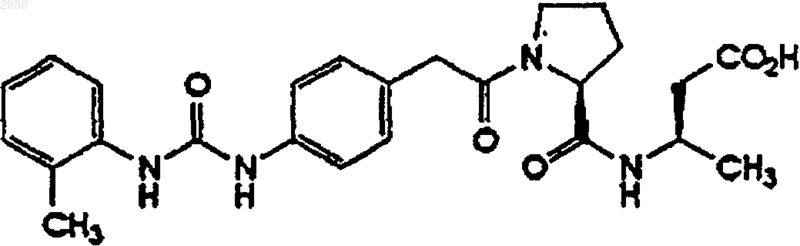
7. Соединение по п.1, имеющее формулу

8. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый носитель.
9. Фармацевтическая композиция по п.8, в которой соединение, ингибирующее клеточную адгезию, представлено в виде его соли.
10. Фармацевтическая композиция по п.8, дополнительно включающая еще один агент, выбираемый из группы, включающей кортикостериоды, бронхолитические агенты, антиастматические агенты, противовоспалительные агенты, противоревматические агенты, иммунодепрессанты, антиметаболиты, иммуномодуляторы, средства против псориаза и антидиабетические агенты.
11. Фармацевтическая композиция по п.8, дополнительно включающая одно или более соединений ингибиторов клеточной адгезии.
12. Фармацевтическая композиция по п.11, в которой указанное одно или более соединений ингибиторов клеточной адгезии представляют собой ингибиторы интегрина a4b1.
13. Фармацевтическая композиция по п.8, в которой соединение представляет собой пролекарство - сложный эфир.
14. Способ предотвращения, ингибирования или подавления клеточной адгезии у млекопитающих, включающий стадию введения указанному млекопитающему эффективного количества фармацевтической композиции по п.8 или 9.
15. Способ по п.14, в котором указанный способ используется для предотвращения, ингибирования или подавления воспаления.
16. Способ лечения астмы, аллергического ринита, рассеянного склероза, атеросклероза, воспалительного заболевания кишечника или множественной миеломы у млекопитающих, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.8 или 9.
17. Способ лечения рассеянного склероза у млекопитающих, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.8 или 9.
18. Способ лечения воспалительных заболеваний кишечника у млекопитающих, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.8 или 9.
19. Способ лечения, предотвращения или смягчения симптомов астмы, включающий введение пациенту, страдающему астмой, терапевтически эффективного количества соединения по п.1.
20. Применение соединения по любому из пп.2-7 для изготовления лекарства для лечения расстройства, опосредуемого клеточной адгезией.
21. Применение по п.19, в котором расстройство (заболевание) выбрано из группы, включающей астму, рассеянный склероз, аллергический ринит, аллергический конъюнктивит, воспаление легких, множественные миеломы, септический артрит, диабет типа 1, отторжение трансплантируемого органа и воспалительные заболевания кишечника.
22. Применение по п.21, в котором расстройством является рассеянный склероз.
23. Применение по п.21, в котором расстройством являются воспалительные заболевания кишечника.
Текст
1 Настоящее изобретение относится к новым соединениям, которые полезны для ингибирования, изменения или предотвращения клеточной адгезии и патологий, опосредуемых клеточной адгезией. Данное изобретение также относится к фармацевтическим готовым формам препаратов, включающим эти соединения, и к способам их применения для ингибирования и предотвращения клеточной адгезии и патологий, опосредуемых клеточной адгезией. Соединения и фармацевтические композиции данного изобретения могут использоваться в качестве терапевтических или профилактических агентов. Они особенно хорошо подходят для лечения многих воспалительных и аутоиммунных заболеваний. Предпосылки изобретения Клеточная адгезия представляет собой процесс, в ходе которого клетки ассоциируются друг с другом, мигрируют в направлении специфической мишени или локализуются в пределах внеклеточной матрицы. Сама по себе клеточная адгезия составляет один из фундаментальных механизмов, лежащих в основе большого числа биологических явлений. Например,клеточная адгезия отвечает за адгезию кроветворных клеток с эндотелиальными клетками и последующую миграцию этих кроветворных клеток из кровеносных сосудов и к участку повреждения. Как таковая клеточная адгезия играет роль во множестве патологий, таких как, например, воспалительные и иммунные реакции у млекопитающих. Исследования молекулярной основы клеточной адгезии выявили, что различные макромолекулы на поверхности клетки - в целом известные как клеточно-адгезионные молекулы или рецепторы - опосредуют межклеточные или клеточно-матричные взаимодействия. Например, белки суперсемейства, называемого интегринами, являются ключевыми медиаторами адгезионных взаимодействий между кроветворными клетками и окружающей их микросредой(М.Е. Hemler, VLA Proteins in the Integrin Family: Structures, Functions and Their Role on Leukocytes", Ann. Rev. Immunol., 8, p. 365 (1990. Интегрины представляют собой нековалентные гетеродимерные комплексы, состоящие из двух субъединиц, называемыхи . Существует, по меньшей мере, 17 различныхсубъединиц (110, -L, -М, -D, -X, -IIB, -V и -E) и, по меньшей мере, 9 различныхсубъединиц (19), которые идентифицированы на сегодняшний день. На основе типа компонентов субъединицимолекула каждого интегрина может быть отнесена к подсемейству. Интегрин 41, также известный как самый поздний антиген-4 (very late antigen-4-VLA4) или CD49d/CD29, представляет собой поверхностный рецептор клетки лейкоцита, который участвует в большом числе как межклеточ 002988 2 ных, так и клеточно-матричных адгезионных взаимодействий (М.Е. Hemler, Ann. Rev. Immunol., 8, р.365 (1990. Он служит в качестве рецептора для поверхностного белка индуцируемой цитокином эндотелиальной клетки, адгезионной молекулы-1 васкулярных клеток(vascular cell adhesion, molecule-1-"VCAM-1"), а также для внеклеточного матричного белка фибронектина ("FN") (Ruegg et al., J. Cell Biol.,177, p. 179 (1991); Wayner et al., J. Cell Biol., 105,p. 1873 (1987); Kramer et al., J. Biol. Chem., 264,p.4684 (1989); Gehlsen et al Science, 24, p. 1228(1988. Показано, что моноклональные антитела анти-VLА-4 ("mAb s") ингибируют VLA-4 зависимые адгезивные взаимодействия как inVLA-4-зависимой клеточной адгезии может предотвращать, ингибировать или изменять некоторые воспалительные и аутоиммунные патологии (R.L. Lobb et al., "The PathophysiologicRole of 4 Integrins In Vivo", J.Clin. Invest., 94,pp.1722-28 (1994. Для того чтобы идентифицировать минимальную активную аминокислотную последовательность, необходимую для связывания с VLA4, Komoriya с соавторами синтезировали ряд перекрывающихся пептидов на основе аминокислотной последовательности CS-1 области(VLA-4-связывающий домен) конкретных видов фибронектина ("The Minimal Essential Sequence(23), стр. 15075-79, (1991. Они идентифицировали 8-аминокислотый пептид, Glu-Ile-Leu-AspVal-Pro-Ser-Thr, а также два более мелких перекрывающихся пентапептида, Glu-Ile-Leu-AspVal и Leu-Asp-Val-Pro-Ser, которые обладают ингибирующей активностью в отношении FNзависимой адгезии клеток. Эти результаты означают, что трипептид Leu-Asp-Val является минимальной последовательностью для клеточно-адгезионной активности. Позднее было показано, что Leu-Asp-Val связывается только с лимфоцитами, которые экспрессируют активированную форму VLA-4, что вызывает сомнения в возможности использования такого пептида in vivo (E.A. Wayner et al., "ActivationDependent Recognition by Hematopoietic Cells ofthe LDV Sequence in the V Region of Fibronectin",J.Cell. Biol., 116 (2), стр. 489-497 (1992. Однако впоследствии было показано, что некоторые более крупные пептиды, содержащие последовательность LDV, являются активными in vivoInterrupting Leukocyte Adhesion and Recruitment",J. Clin. Invest., 94, pp. 655-62 (1994. Также описан циклический пентапептид, который может ингибировать адгезию как VLA-4, так и VLA-5 с(27), стр. 20352-59 (1993); а также публикацию РСТ PCT/US 91/04862). Данный пентапептид основан на трипептидной последовательностиArg-Gly-Asp из FN, которая известна как основной лейтмотив при распознавании сайта для некоторых внеклеточных матричных белков. Примеры других ингибиторов VLA-4 приводятся, например, в находящейся совместно на рассмотрении патентной заявке США 08/376372 и WO 98/04913, которые специально включены в качестве справочного материала. В USSN 376372 описаны линейные пептидильные соединения, содержащие -аминокислоты, которые обладают ингибирующей активностью в отношении клеточной адгезии. Международные патентные заявки WO 94/15958 и WO 92/00995,специально включенные в качестве справочного материала, описывают циклический пептид и пептидомиметические соединения с активностью, модулирующей адгезию клеток. В международных патентных заявках WO 93/08823 иWO 92/08464 (включены в качестве справочного материала) описываются гуанидинил-, мочевину- и тиомочевинусодержащие соединения, модулирующие клеточную адгезию. В патенте США 5260277 (также включен в качестве справочного материала) описываются гуанидинильные соединения, модулирующие клеточную адгезию. Несмотря на эти достижения, все еще остается потребность в низкомолекулярных специфических ингибиторах VLA-4-зависимой адгезии клеток, которые обладают улучшенными фармакокинетическими и фармакодинамическими свойствами, такими как пероральная биодоступность и значительная продолжительность действия. Такие соединения могли бы дать полезные агенты для лечения, изменения,предотвращения и подавления различных патологий, опосредуемых клеточной адгезией и связыванием VLA-4. Сущность изобретения Соединения настоящего изобретения являются ингибиторами VLA-4 интегрина, блокируя тем самым связывание VLA-4 с его различными лигандами, такими как VCAM-1 и области фибронектина. Таким образом, данные соединения полезны в процессах ингибирования клеточной адгезии, в том числе клеточной активации, миграции, пролиферации и дифференцировки. Эти соединения полезны для ингибирования, предотвращения и подавления опосредуемой VLA-4 клеточной адгезии и патологий, 002988 4 связанных с этой адгезией, таких как воспалительные и иммунные реакции, включая, например, рассеянный склероз, астму, аллергический ринит, аллергический конъюнктивит, воспалительные легочные заболевания, ревматоидный артрит, септический артрит, диабет 1-го типа,трансплантацию органов, рестеноз, аутотрансплантацию костного мозга, воспалительные последствия вирусных инфекций, миокардит, воспалительное заболевание пищеварительного тракта, в том числе неспецифический язвенный колит и болезнь Крона, некоторые типы токсического и иммунного нефрита, повышенную дермальную чувствительность, псориаз, опухолевый метастаз, множественную миелому и атеросклероз. Соединения данного изобретения могут использоваться по одному или в сочетании с другими терапевтическими или профилактическими агентами для ингибирования, изменения, предотвращения или подавления клеточной адгезии. Настоящее изобретение также предлагает фармацевтические готовые формы препаратов, содержащие данные ингибиторыVLA-4-опосредуемой клеточной адгезии, и способы применения соединений и композиций настоящего изобретения для ингибирования клеточной адгезии. Краткое описание чертежей На фиг. 1 показана восприимчивость дыхательных путей овец после лечения oMePUPA-V. Овец, чувствительных от природы к Ascarissuum, провоцируют аэрозолем аллергена AscarisoMePUPA-V в указанных дозах или эквивалентного количества носителя. В указанные периоды времени измеряют механику легочного дыхания и записывают в виде изменения удельного сопротивления дыхательных путей в сравнении с предшествующим исследованию базовым значением (левая группа графиков). Устойчивость или сопротивление дыхательных путей вдыхаемому карбахолу определяют до начала исследования и через 24 ч после провокации аллергеном(правая группа графиков). Восприимчивость дыхательных путей приводят в виде отношения РС 400 (количество карбахола, требуемое для увеличения устойчивости на 400%) путем сравнения величин до провокации и после провокации. Фиг. 2. Овец, чувствительных от природы к Ascaris suum, провоцируют введением аэрозоля oMePUPA-V в указанных дозах или аэрозоляAscaris suum. Изменения в устойчивости дыхательных путей измеряют после аэрозольной провокации и пиковую удельную легочную устойчивость (в см Н 2 О/с) после провокации сравнивают с базовыми значениями.= р 0,05 в сравнении с PBS-контролем,односторонний дисперсионный анализ, с последующим тестом Даннетта для множественного сравнения с контрольной группой. Показывает статистически значимое увеличение пиковой 5 удельной легочной устойчивости в сравнении сPBS (фосфатно-солевой буферный раствор) контрольной группой. Фиг. 3. Овец, чувствительных от природы к Ascaris suum, провоцируют аэрозолем аллергена Ascaris suum через 24 ч после четвертого ежедневного введения аэрозоля oMePUPA-V(0,03 мг) или эквивалентного количества носителя (этанол:обычный физиологический раствор, 1:2, верхний график; Tris:обычный физиологический раствор, 1:499, нижний график). В указанное время измеряют механику легочного дыхания и выражают в виде изменения удельной устойчивости дыхательных путей от базового значения перед исследованием (левые графики). Устойчивость дыхательных путей к вдыхаемому карбахолу определяют до начала исследования и через 24 ч после провокации аллергеном (правые графики). Восприимчивость дыхательных путей записывают в виде отношения РС 400 (количество карбахола, требуемого для увеличения устойчивости на 400%) сравнением значений до провокации и после провокации. Фиг. 4. Мышей Balb/c, предварительно сенсибилизированных к DNFB (динитрофторбензол), провоцируют путем нанесения DNFB на тыльную поверхность левого уха и носителя на тыльную поверхность правого уха. Спустя 24 ч измеряют толщину каждого уха с помощью микрометра. oMePUPA-V вводят в указанных дозах через 4 ч после провокации DNFB. Соединение положительного контроля (+КОНТ) дают в максимально эффективной кишечной дозе. Значения представляют собой средние значениястандартная ошибка среднего для 8 животных. Верхний график показывает абсолютное опухание уха. Нижний график показывает процент ингибирования опухания уха по сравнению с контролем с использованием носителя (VEH). Фиг. 5. Анализ конкуренции междуoMePUPA-V и известным ингибитором при различных условиях активации. Jurkat-клеткиTS2/16, обрабатывают 5 нМ 3H-известного ингибитора одного или 5 нМ 3H-известного ингибитора плюс 10 нМ BIO 1591 в течение 30 мин при комнатной температуре. Клетки затем пеллетизируют центрифугированием, снова суспендируют в 100 мкл TBS плюс Мn2+ и анализируют с помощью сцинтилляционного подсчета. Количество импульсов, связанное в этих условиях, определяет интегрин, который не занят испытуемым соединением и, следовательно,свободен для связывания с 3H-известным ингибитором. Подробное описание изобретения Настоящее изобретение предлагает соединения, которые способны ингибировать VLA-4 002988 6 опосредуемую клеточную адгезию ингибированием связывания лигандов с рецептором. Предпочтительным соединением является (R)N-4-(2-метилфениламино)карбонил]амино] фенил]ацетил]-L-пролил-3-метилаланин, обозначаемый здесь как oMePUPA-V и представленный следующей формулой I: Изобретение также охватывает фармацевтически приемлемые производные, соли и эфиры oMePUPA-V. Соединения формулы I содержат один или более асимметричных центров и, следовательно,могут быть в виде рацемических смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Настоящее изобретение предполагает охват всех таких изомерных форм соединения формулы I. Заявляемое изобретение также подразумевает, что в его объем входят фармацевтически приемлемые соли соединения формулы I. Понятие фармацевтически приемлемые соли относится к солям, получаемым из фармацевтически приемлемых нетоксичных оснований или кислот, включая органические и неорганические основания и органические или неорганические кислоты. Соли, получаемые из неорганических оснований, включают соли алюминия, аммония,кальция, меди, железа (III), железа (II), лития,магния, марганца (III), марганца (II), калия, натрия, цинка и т.д. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Соли, получаемые из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, в том числе природных замещенных аминов, циклических аминов и основных ионообменных смол,таких как аргинин, бетаин, кофеин, холин, N,N'дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин,гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины, теобромин,триэтиламин, триметиламин, трипропиламин,трометамин и др. Когда соединение настоящего изобретения является основным, соли могут получаться из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такими кислотами являются уксусная,бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этансульфоновая, фумаровая,глюконовая, глутаминовая, бромисто-водород 7 ная, соляная, изэтионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая,слизевая, азотная, памовая, пантотеновая, фосфорная, янтарная, серная, винная, п-толуолсульфоновая кислота и аналогичные. Особенно предпочтительными являются лимонная, бромисто-водородная, соляная, малеиновая, фосфорная, серная и винная кислоты. Кроме того, заявляемое изобретение охватывает пролекарства, в частности сложноэфирные пролекарства, в которых карбоксильная группа (R)-N-4-(2-метилфениламино)карбонил]амино]фенил]ацетил]-L-пролил-3-метил-аланина этерифицирована любым из спиртов. Предпочтительными спиртами являются метанол, этанол, пропанол, бутанол или С 1-10 алкиловые спирты с линейными или разветвленными цепочками. Способность соединений формулы I антагонизировать действию VLA-4 делает их полезными для предотвращения, лечения или реверсии симптомов, расстройств или заболеваний,индуцируемых связыванием VLA-4 с их лигандами. Так, данные антагонисты ингибируют процессы клеточной адгезии, в том числе клеточной активации, миграции, пролиферации и дифференцировки. Таким образом, согласно еще одному аспекту настоящего изобретения предоставляются способы лечения, предотвращения, изменения или подавления нарушений или заболеваний, опосредуемых VLA-4. Такими заболеваниями и нарушениями являются, например, астма, рассеянный склероз, аллергический ринит, аллергический конъюнктивит, воспалительные легочные заболевания, ревматоидный артрит, множественная миелома, септический артрит, диабет 1-го типа, отторжение трансплантированного органа, воспалительное заболевание кишечника и др. Соединения данного изобретения могут синтезироваться с использованием любого обычного приема, несколько примеров которых приведены в описании. Предпочтительно эти соединения химически синтезируются из легкодоступных исходных материалов, таких как аминокислоты и их функциональные эквиваленты. Модулярные и конвергентные методы синтеза этих соединений также являются предпочтительными. При конвергентном подходе, например, крупные отрезки конечного продукта доставляются вместе на последней стадии синтеза, вместо того, чтобы добавлять небольшие фрагменты к растущей молекулярной цепочке. Соединения данного изобретения могут также модифицироваться присоединением соответствующих функциональных групп для усиления селективных биологических свойств. Такие модификации известны в данной области и включают видоизменения, которые повышают биологическую проницаемость в данную биологическую систему (например, в кровь, лимфати 002988 8 ческую систему, центральную нервную систему), повышают пероральную доступность, повышают растворимость, чтобы обеспечить возможность введения путем инъекции, меняют метаболизм и скорость выведения. Примерами таких модификаций являются, но не ограничиваются ими, этерификация полиэтиленгликолями, получение производных с помощью пиволатов или жирнокислотных заместителей,превращение в карбаматы, гидроксилирование ароматических колец и гетероатомное замещение в ароматических кольцах. Во всем описании термин пациент относится к млекопитающим, в том числе к человеку. А понятие клетка относится к любой клетке, предпочтительно к клеткам млекопитающих,включая клетки человека. После синтеза активность и VLA-4 специфичность соединений настоящего изобретения может быть определена с использованием исследований in vitro и in vivo. Например, ингибирующая клеточную адгезию активность этих соединений может быть измерена путем определения концентрации ингибитора, требуемой для блокирования связывания VLA-4-экспрессирующих клеток с планшетами, покрытыми фибронектином или CS1. При испытании этого типа лунки микротитровального планшета покрывают или фибронектином (содержащим CS-1 последовательность) или CS-1. Если используется CS-1, то он должен быть конъюгирован с белком носителя, таким как бычий сывороточный альбумин, для того,чтобы прикрепить его к лункам. После покрытия лунок добавляют варьируемые концентрации испытуемого соединения вместе с подходящим образом мечеными VLA-4-экспрессирующими клетками. Альтернативно можно сначала добавлять испытуемое соединение и дать ему возможность инкубироваться с покрытыми лунками перед добавлением клеток. Клетки оставляют инкубироваться в лунках, по меньшей мере, на 30 мин. После инкубации лунки опустошают и промывают. Ингибирование связывания измеряют путем количественного определения флуоресценции или радиоактивности, связанной с планшетом, для каждой из различных концентраций испытуемого соединения, а также для контроля, не содержащего испытуемое соединение. Клетки, экспрессирующие VLA-4, которые могут быть использованы в этом испытании,включают Ramos клетки, Jurkat клетки, клетки А 375 меланомы, а также лимфоциты периферической крови (PBL) человека. Клетки, используемые в данном испытании, могут метиться любым подходящим способом, например, флуоресцентно или могут иметь радиоактивную метку. Для количественного определения ингибирующей активности соединении изобретения может также использоваться метод непосредст 9 венного или прямого связывания. В данном анализе белок слияния, VCAM-IgG, содержащий первые два иммуноглобулиновых доменаVCAM (D1D2), присоединенные выше междоменной области молекулы IgGl ("VCAM2DIgG"), конъюгируется с маркерным ферментом,таким как щелочная фосфатаза (АР). Синтез данного белка слияния "VCAM-IgG" описан в РСТ публикации WO 90/13300, содержание которой включено в качестве справочного материала. Конъюгирование данного белка слияния с маркерным ферментом достигается методами поперечной сшивки, хорошо известными в данной области.VCAM-IgG-ферментый конъюгат затем помещают в лунки многолуночного фильтрационного планшета, такого как планшет, содержащийся в системе Millipore Multiscreen AssaySystem (Millipore Corp., Bedford, MA). Затем в лунки добавляют различные концентрации испытуемого ингибирующего соединения последующим добавлением клеток, экспрессирующихVLA-4. Клетки, соединение и VCAM-IgGферментный конъюгат смешивают вместе и оставляют инкубироваться при комнатной температуре. После инкубации лунки вакуумно дренируются, оставляя клетки и любые связанныеVCAM определяют путем добавления соответствующего колориметрического субстрата для фермента, конъюгированного с VCAM-IgG, и определения количества продукта реакции. Уменьшенное количество продукта реакции указывает на повышенную ингибирующую связывание активность. Протокол некоторых анализов описан ниже. Для того чтобы оценить VLA-4 ингибирующую специфичность соединения настоящего изобретения, проводят анализ на других основных группах интегринов, т.е. 2 и 3, а также других 1 интегринов, таких как VLA-5,VLA-6 и 47. Эти анализы могут быть аналогичны анализам ингибирования адгезии и непосредственного связывания, описанным выше, с заменой соответствующей интегрин-экспрессирующей клетки и соответствующего лиганда. Например, полиморфно-ядерные клетки(PMN) экспрессируют 2 интегрины на своей поверхности и связываются с ICAM. Интегрины 3 вовлечены в агрегацию тромбоцитов, и ингибирование может быть измерено с помощью стандартного анализа агрегации тромбоцитов.VLA-5 специфично связывается с последовательностями Arg-Gly-Asp, тогда как VLA-6 связывается с ламинином. 47, представляет собой недавно открытый гомолог VLA-4, который также связывается с фибронектином и VCAM. Специфичность относительно 47 определяют с помощью анализа связывания, в котором используют описанный выше маркерный конъю 002988 10 гат VCAM-IgG-фермент и линию клеток, которые экспрессируют 47, но не VLA-4, такую как клетки RMPI-8866 или JY. После идентификации VLA-4-специфичных ингибиторов их можно дополнительно охарактеризовать в анализах in vivo. В одном из таких анализов испытывается ингибирование контактной гиперчувствительности у животных,в таком, как описан P.L. Chisholm et al., "Monoclonal Antibodies to the Integrein -4 Subunit Inhibit the Murine Contact Hypersensitivity Response", Eur. J. Immunol., 23, pp. 682-688 (1993),и в "Current Protocol in Immunology", J.E. Coligan, et al., Eds., John WileySons, New York, 1,pp. 4.2.1-4.2.5 (1991), содержание которых включены в качестве справочного материала. В данном анализе кожу животного сенсибилизируют путем воздействия раздражителя, такого как динитрофторбензол, с последующим легким физическим раздражением, таким как легкое почесывание кожи острой кромкой. После периода выздоровления животных повторно сенсибилизируют, следуя той же методике. Через несколько дней после сенсибилизации одно ухо животного подвергают воздействию химического раздражителя, тогда как другое ухо обрабатывают нераздражающим контрольным растворителем. Вскоре после обработки ушей животным вводят различные дозы ингибитора VLA-4 путем подкожной инъекции. In vivo ингибирование воспаления, связанного с клеточной адгезией, оценивают измерением реакции опухания обработанного уха животного относительно необработанного. Опухание измеряют с использованием штангенциркуля или другого подходящего инструмента для измерения толщины уха. Таким образом, можно идентифицировать те ингибиторы изобретения, которые наиболее хорошо подходят для ингибирования воспаления. Еще один метод in vivo, который может применяться для испытания ингибиторов данного изобретения, представляет собой анализ астмы у овец. Данный анализ проводят по существу так, как описано в работе W.M. Abraham etBronchial Responses and Prolonged Airway Hyperresponsiveness in Sheep", J. Clin. Invest., 93. pp. 776-87 (1994), содержание которой включено в качестве справочного материала. В этом анализе измеряют ингибирование индуцированной антигеном Ascaris ответной реакции дыхательных путей поздней фазы и гиперчувствительности дыхательных путей у аллергических овец. Соединения данного изобретения могут быть также испытаны в анализе агрегации тромбоцитов. Ингибиторы VLA-4 изобретения показали поразительно благоприятную активность и селективность. В целом эти соединения селективны для VLA-4 (более чем в 1000 раз в сравнении с 47 и 51), дают отрицательный результатnon-GLP тесте Эймса, безупречны в стандартных дополнительных фармакологических тестах и эффективны на модели овец после введения один раз в день согласно предписанному уровню применения на людях 1 мг/день или менее. Заявленные соединения обладают неожиданно превосходной активностью в сравнении со структурно родственными VLA-4 ингибиторами. Например, у Ascaris-чувствительных овец,обрабатываемых один раз в день в течение четырех дней с помощью распыленного лекарственного средства в дозе 0,1 мг/кг и затем обработанных антигеном через 24 ч после введения последней дозы лекарства, ранее испытанные соединения по существу смягчали раннюю реакцию и блокировали бронхостеноз поздней фазы и развитие неспецифической гипервосприимчивости. С учетом биоэквивалентности для человека потребуется суммарная доза для пациента весом 70 кг в 7 мг. Кроме того, лекарство вводилось овцам через эндотрахеальную трубку при дозах отложения, которые оцениваются в 2 раза больше, чем обычно достигаемые у человека с помощью пероральных ингаляторных устройств. Кроме того, вероятно, что потребуется добавление наполнителей (эксципиентов) к конечной твердой рецептуре, чтобы оптимизировать процесс заполнения устройства и доставку лекарства. Данные факторы предполагают возможную дозу, требуемую человеку,14 мг или более, которая превышает технический предел 1-5 мг, который может доставляться однократным приведением в действие ингалятора сухого порошка (DPI). Хотя необходимая доза могла бы доставляться с помощью многократного приведение в действие DPI, это являлось бы недостатком на рынке астматических препаратов, где обычные дозы ингалируемого стероида составляют 0,2-1,0 мг.oMePUPA-V ослабляет раннюю реакцию,блокирует бронхостеноз поздней фазы и нормализует гипервосприимчивость при минимальной 12 дозе 0,003 мг/кг при введении в виде однократной распыленной дозы за 2 ч до провокации антигеном. Более того, суточная доза в 0,001 мг/кг в течение 4 дней при провокации антигеном через 24 ч после последней дозы дает максимальную реакцию. Таким образом, oMePUPAV в 30-100 раз более активен, чем предшествующие соединения, и имеет уровень доз в пределах наилучших продаваемых ингалируемых стероидов. oMePUPA-V, так же как и предпоследнее промежуточное соединение синтеза,имеет высокую степень кристалличности (см. фиг. 1, табл. 1). Кроме того, oMePUPA-V имеет улучшенный метаболический профиль по сравнению с известными соединениями ингибиторами VLA4. Например, после аэрозольного введения заявленные соединения быстро превращаются в менее активный метаболит, который является преобладающим продуктом, выделяемым бронхоальвеолярной промывной жидкостью (BALF), и также преобладающим продуктом, обнаруживаемым в большом круге кровообращения, где он проявляет более длительный период полувыведения из плазмы, чем исходное соединение. Хотя быстрое метаболическое превращение в менее активные соединения является полезной стратегией для достижения пониженного системного воздействия, соединения, которые метаболизируются в побочные продукты почти или совсем не обладающие активностью, создают меньше сложностей при разработке и являются предпочтительными с точки зрения возможных перспектив. Потенциальные протеолитические продукты oMePUPA-V являются неактивными в анализах VLA-4-связывания, поэтому протеолиз будет приводить к неактивным продуктам, не заслуживающим внимания. Тем не менее, исследования метаболизма in vitro, а также in vivo фармакокинетические исследования на крысах,собаках и овцах показали, что oMePUPA-V является протеолитически стабильным.IC50 против адгезии 51-FN Минимальная эффективная доза на модели овец:- повторяемая доза 0,03-0,1 мг/кг 0,001 мг/кг Кристалличность Отсутствует Есть Фармаскрининг in vitro в 85 тестах 1 слабый выпад Безупречен АСЕ-активность АСЕ-субстрат Безупречен Глюкуронидирование Низкие уровни Плановое Тест Эймса (мутагенность) Безупречны Безупречен Вспомогательная фармакология (побочные эффекты) Безупречны Системное воздействие (10 мг аэрозольная доза овцы) Закончены 40 нг/млч Метаболический профиль Активные метаболиты 13 Пероральная доступность Стабильность в объеме (40 С, ОН 75%) Стабильность в препарате (40 С) Соединения настоящего изобретения могут быть приготовлены в виде готовых форм фармацевтических композиций, которые могут вводиться перорально, парентерально, с помощью спреев для ингаляции, локально, ректально, назально, трансбуккально, вагинально или через имплантируемый резервуар. Понятие парентерально, которое используется в данном описании, включает подкожное, внутривенное,внутримышечное, интраартикулярное или внутрисуставное, внутригрудинное, внутриоболочечное, внутрипеченочное введение, введение внутрь повреждения и внутричерепное введение с помощью инъекций или вливания. Фармацевтические композиции данного изобретения включают любое из соединений настоящего изобретения или его фармацевтически приемлемое производное вместе с фармацевтически приемлемым носителем. Понятие носитель, используемое в данном описании,включает фармацевтически приемлемые адъюванты и растворители. Фармацевтически приемлемые носители, которые могут использоваться в фармацевтических композициях изобретения,включают, но не ограничиваются ими, ионообменники, окись алюминия, стеарат алюминия,лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, вторичный кислый фосфат натрия, кислый фосфат калия, хлорид натрия,соли цинка, коллоидную двуокись кремния,трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрийкарбоксиметилцеллюлозу, полиакрилаты, воски, блоксополимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и ланолин. В соответствии с настоящим изобретением фармацевтические композиции могут быть в форме стерильных инъецируемых препаратов,например, стерильных инъецируемых водных или масляных суспензий. Суспензии могут быть приготовлены в соответствии с известными в данной области приемами с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильные инъецируемые препараты могут также представлять стерильные растворы или суспензии для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, как раствор в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут применяться, находятся вода, раствор Рингера и изотонический раствор хлористого натрия. Кроме того, в качестве растворителя или суспензионной среды удобно применяются стерильные нелетучие масла. Для данной цели может применяться любое легкое нелетучее масло,в том числе синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, полезны при получении препаратов для инъекций,как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, в особенности в виде их полиоксиэтилированных производных. Эти масляные растворы или суспензии также могут содержать длинноцепочечный спиртовый разбавитель или дисперсант. Фармацевтические композиции данного изобретения могут вводиться в любой перорально приемлемой лекарственной дозированной форме, включающей, но, не ограниченной ими, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения, носителями, которые обычно используются, являются лактоза и кукурузный крахмал. Обычно добавляются смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул полезными разбавителями являются лактоза и высушенный кукурузный крахмал. Если для перорального применения требуются водные суспензии, активный ингредиент смешивается с эмульгирующими и суспендирующими агентами. При желании, могут также добавляться некоторые подслащивающие, вкусовые и красящие агенты. Альтернативно, фармацевтические композиции данного изобретения могут вводиться в форме свечей для ректального применения. Они могут приготавливаться смешением агента с подходящим нераздражающим эксципиентом,который является твердым при комнатной температуре, но жидким при ректальной температуре, и поэтому будет плавиться в прямой кишке с высвобождением лекарства. К таким материалам относятся масло какао, пчелиный воск и полиэтиленгликоли. Фармацевтические композиции изобретения также могут вводиться местно или топически, особенно когда целью лечения являются области или органы, легко доступные для местного введения, включая, например, заболевания глаз, кожи или нижней области кишечного тракта. Подходящие препараты для местного применения легко приготавливаются для каждого из этих участков или органов. Местное применение в нижней области кишечного тракта может осуществляться с использованием лекарственных форм в виде све 15 чей (см. выше) или подходящих препаратов для клизм. Могут также использоваться местные трансдермальные пластыри. Для местного применения фармацевтические композиции могут быть приготовлены в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или более носителях. Носители для местного введения соединений настоящего изобретения включают, но не ограничиваются ими,минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль, полиоксиэтилен,полиоксипропиленовые соединения, эмульгирующий воск и воду. Альтернативно, фармацевтические композиции могут быть сформированы в виде подходящего лосьона или крема, содержащего активные компоменты, суспендированные или растворенные в одном или более фармацевтически приемлемых носителях. Подходящими носителями являются, но не ограничиваются ими, минеральное масло, моностеарат сорбитана, полисорбат 60, цетиловые эфиры воска, цетариловый спирт, 2-октилдодеканол,бензиловый спирт и вода. Для применения на глазах фармацевтические композиции могут быть приготовлены в виде тонкоизмельченных суспензий в изотоническом стерильном физиологическом растворе с установленным значением рН, или предпочтительно в виде растворов в изотоническом физиологическом растворе с установленным значением рН или с добавлением или без добавления консерванта, такого как бензилалконийхлорид. Альтернативно, глазные фармацевтические композиции могут быть получены в виде мази,такой как вазелин. Фармацевтические композиции данного изобретения могут также вводиться в виде назального аэрозоля или ингаляции с использованием распылителя, ингалятора сухого порошка или дозирующего ингалятора. Такие композиции готовят в соответствии с хорошо известными в области фармацевтических препаратов приемами, и могут быть получены в виде растворов в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов, промоторов абсорбции для усиления биодоступности, фторуглеродов и/или других общепринятых солюбилизирующих или диспергирующих агентов. Кроме того, композиции изобретения могут включать любые фармацевтически приемлемые носители, такие как,например, лактоза, для сухих порошковых препаратов. Количество активного ингредиента, которое может сочетаться с материаламиносителями для приготовления однократной дозированной формы, меняется в зависимости от реципиента, подвергаемого лечению, и конкретного способа введения. Следует понимать,однако, что конкретная дозировка и схема приема лекарственного препарата для любого 16 конкретного пациента будет зависеть от ряда факторов, в том числе активности конкретно используемого соединения, возраста, веса тела,общего состояния здоровья, пола, режима питания, времени введения, скорости выведения,лекарственного сочетания, а также от мнения лечащего врача и серьезности заболевания. Количество активного ингредиента может также зависеть от терапевтического или профилактического агента, если он используется, с которым этот ингредиент вводится совместно. Дозировка и уровень дозы соединений настоящего изобретения, эффективные для предотвращения, подавления или ингибирования клеточной адгезии, будут зависеть от ряда факторов, таких как природа ингибитора, вес пациента, цель лечения, природа патологии, подвергаемой лечению, используемая конкретная фармацевтическая композиция, а также мнение лечащего врача. Полезны уровни доз примерно между 0,001 и 100 мг/кг веса тела в день, предпочтительно между 0,01 и 50 мг/кг и более предпочтительно примерно 10 мг активного соединения в день на кг веса тела в день. В тех случаях, когда используются композиции для внутривенного введения, подходящий интервал доз составляет приблизительно от 0,001 мг до 25 мг/кг, более предпочтительно примерно от 0,01 мг до 1 мг/кг. В соответствии с еще одним вариантом осуществления изобретения композиции, содержащие соединения настоящего изобретения,могут также включить дополнительный агент,выбранный из группы, включающей кортикостероиды, бронхолитические средства, антиастматические средства (стабилизаторы тучных клеток), противовоспалительные средства, противоревматические средства, иммунодепрессанты, антиметаболиты, иммуномодуляторы, средства против псориаза и противодиабетические средства. Конкретные соединения, относящиеся к каждому из этих классов, могут быть выбраны из любых соединений, перечисленных в соответствующей группе в издании: ComprehensiveMedicinal Chemistry, Pergamon Press, Oxford,England, стр. 970-986 (1990) (включено в качестве справочного материала). Также в данную группу входят такие соединения, как теофиллин, сульфазалазин и аминосалицилаты (противовоспалительные средства); циклоспорин, FK506 и рапамицин (иммунодепрессанты); циклофосфамид и метотрексат (антиметаболиты); стероиды (ингалируемые, пероральные или топические) и интерфероны (иммуномодуляторы). Кроме того, соединения изобретения могут вводиться в сочетании с дополнительными ингибиторами клеточной адгезии. При введении одного или нескольких дополнительных агентов в сочетании с заявленными VLA-4-ингибиторами,активные ингредиенты могут рецептурироваться вместе, или, альтернативно, могут вводиться в сочетании. Введение одного или более актив 17 ных агентов в сочетании с ингибиторами VLA4, заявленного изобретения может быть, по существу, одновременным или последовательным. Квалифицированные в данной области специалисты могут легко определить наиболее подходящий метод применения в зависимости от вводимых агентов, желаемого результата, пациента и его состояния. В соответствии с другим вариантом осуществления изобретение предлагает способы предотвращения, ингибирования или подавления ассоциированного с клеточной адгезией воспаления и ассоциированных с клеточной адгезией иммунных или аутоиммунных реакций у пациента. Ассоциированная с VLA-4 клеточная адгезия играет центральную роль при различных воспалениях, иммунных и аутоиммунных заболеваниях. Таким образом, ингибирование клеточной адгезии с помощью соединений настоящего изобретения может быть использовано в способах лечения или предотвращения воспалительных, иммунных и аутоиммунных заболеваний. Предпочтительно заболевания,которые можно лечить способами настоящего изобретения, выбираются из таких заболеваний,как астма, артрит, псориаз, отторжение трансплантата, рассеянный склероз, диабет и воспалительное заболевание кишечника. В этих способах соединения настоящего изобретения могут использоваться в монотерапии или в сочетании с противовоспалительными агентами или иммунодепрессантами. Такая комбинационная терапия включает введение агентов в разовой дозированной форме или в виде множественных дозированных форм в одно и то же или в различное время. Примеры Пример 1. Получение oMePUPA-V.oMePUPA-V, (R)-N-4-(2-метилфениламино)карбонил]амино]фенил]ацетил]-L-пролил-3-метилаланин, получают по конвергентной схеме синтеза из промышленно производимых сукцинимидил Воc-(L)-пролина (BocPro-OSu; Bachem) и полусульфата (R)-бензил-3 аминобутирата (Celgene Corp.). Сочетание исходных веществ в CH2Cl2 в присутствии Et3N с последующим гидролизом бутоксикарбонильной (Воc) группы 4 н. НСl в диоксане давало НСl-соль, которая перекристаллизовывалась из смеси CH2Cl2/Et2O. Сочетание HCl-соли с сукцинимидил-2-[4-[2-(метилфениламинокарбонил)]амино]фенилацетатом (MPUPA-OSu), полученным из соответствующей кислотыMPUPA-OH (Ricerca, Inc.), давало кристаллический бензиловый эфир oMePUPA-V, который каталитически гидрировался (10% Pd/C) в смеси ТГФ/Н 2 О (9:1), давая oMePUPA-V. Конечный продукт получался в виде белого твердого вещества после перекристаллизации из 20%-го водного ацетона. Краткое описание физических характеристик Химическое название:(R)-N-4-(2 метилфениламино)карбонил]амино]фенил] ацетил]-L-пролил-3-метилаланин. Эмпирическая формула: С 25 Н 30N4O5 Молекулярный вес: 466,53 Внешний вид: чистый белый порошок Температура плавления: 153,6-154,4 С Схема 1 Получение MPUPA-OSu (2) из MPUPA-OH (1) Синтез oMePUPA-V Химический синтез, используемый для получения oMePUPA-V, представлен на схемах 1 и 2. Исходные материалы получают из коммерческих источников и от производителей по контракту: (1) приготовлен в большом фирмой Ricerca, Inc., Painesville, ОН; (3) получен от фирмыBachem Bioscience, Inc., King of Prussia, PA и (4) получен от фирмы Celgene Corp., Warren, NJ. Получение oMePUPA-V: Общие аналитические методы (1 Н ЯМР,13 С ЯМР, масс-спектрометрия, ИК-спектрометрия и высокоэффективная жидкостная хроматография (ВЭЖХ. Спектроскопию 1H ЯМР проводят или на приборе Bruker AC 300, Varian 500, или Varian 600, образцы анализируют либо в ДМСО-d6 относительно сигнала ДМСО-d6 ( 2,49 м.д.), либо в СDСl3 относительно сигнала остаточного СНСl3 ( 7,24 м.д.). Спектроскопию 13 С ЯМР проводят либо на приборе Varian 500, либо на приборе Varian 600,образцы анализируют либо в ДМСО-d6 относительно сигнала ДМСО-d6 ( 40,5 м.д.), либо в СDСl3 относительно сигнала СDСl3 ( 77,0 м.д.). Масс-спектры записывают на массспектрометрической системе Fisons VG PlatformHewlett Packard Model 1500, и данные обрабатывают с использованием рабочей станции для 19 масс-спектрометрии Fisons VG MassLynx. Массспектры высокого разрешения (HRMS) определяют с использованием бомбардировки быстрыми атомами при М-сканировании (РА) на высокопольном масс-спектрометре VG Analytical ZAB 2SE относительно SOPMS-002, MS006, MS-012 и MS-023. Для генерирования ионов используют цезиевую пушку, полученные масс-спектры записывают с использованием системы обработки данных PDP-11-250J. ИК-спектры записывают на Perkin-Elmer 1600 Series FTIR. Аналитическую ВЭЖХ проводят следующим образом. 1. Хроматограммы с использованием программы 1 (уравновешивание при 20% В, ввод образца, 20% В (1 мин), 20-70% В (24 мин), 70100% В (17 мин получают с использованием автоматической системы отбора проб для ВЭЖХ Perkin Elmer Series 200 с УФ-детекторомNelson 1020. Приводится только процент площади. 2. Хроматограммы с использованием программы 8 (уравновешивание при 15% В, ввод образца, 15% В (1 мин), 15-40% В (25 мин), 40% В (10 мин получают с использованием системы подачи растворителя Applied Biosystems 400 с УФ-детектором 783 А с использованием автоматического пробоотборника Waters 717. Данные обрабатывают с использованием интегратора Hewlett Packard 3396 Series II. На интеграторе устанавливают следующие параметры: Затухание = 8, Порог = 5, Отклонение площади = 10000, Ширина пика = 0,04, Скорость диаграммы = 0,2. Все работы с использованием ВЭЖХ проводят с использованием колонки Vydac С-18(размер пор 5m, 4,5 мм 25 см, каталожный номер 218 ТР 54). Растворитель А: (вода+0,1% трифторуксусной кислоты (TFA). Растворитель В: (ацетонитрил+0,1% TFA). Скорость потока: 1 мл/мин. Используют следующие градиентные программы. Программа 1: (уравновешивание при 20% В, ввод образца, 20% В (2 мин), 20-70% В (25 мин), 100% В (5 мин). Физические данные для 4-(2 метилфенил)амино]карбонил]амино]фенил] уксусной кислоты (1, MPUPA-OH, вещество,производимое фирмой Ricerca Inc.): Т. пл.: 210-215 С (разл.). ИК-(КВr): 3295 (ушир. полоса), 3034C16H16N2O3: С 67,59, Н 5,67, N 9,85. Найдено: С 67,60, Н 5,70, N 10,01. Получение сукцинимидил-[4-(2-метилфенил)амино]карбонил]амино]фенил]ацетата (2,MPUPA-OSu). К кипящей суспензии о-метилфенилмочевины-фенилуксусной кислоты (1, MPUPA-OH,150 г, 0,501 моль, от фирмы Ricerca Inc.) в ацетонитриле (600 мл) на протяжении 10 мин при энергичном перемешивании добавляют тионилхлорид (41 мл, 0,558 моля). Выделяется большое количество НСl. Реакционную смесь при непрерывном перемешивании в течение 1,5 ч охлаждают до комнатной температуры. Реакционная смесь становится розовой суспензией, к которой одной порцией добавляют твердый Nгидроксисукцинимид (HOSu, 75,5 г, 0,636 моля). К данной смеси по каплям добавляют триэтиламин (174 мл) в течение 30 мин, при этом температуру реакционной смеси поддерживают ниже 60 С с помощью водяной бани. Перемешивание продолжают в течение 2 ч и затем к реакционной смеси добавляют дистиллированную воду(500 мл). Твердое вещество отфильтровывают и промывают 2 л дистиллированной воды и ацетонитрилом (2200 мл), сушат на воздухе и затем сушат над P2O5 под вакуумом (0,1 мм рт.ст.), получая сырой продукт (175 г, выход 97%) в виде бежевого порошка. Сырой продукт(3,5 л) с углем (10 г) для обесцвечивания, получая 129 г MPUPA-OSu (2, выход 68%) в виде белого порошка (чистота 99%). Т.пл.: 211,2-211,8 С. ИК-(КВr): 3904-3203 (ушир. полоса), 1816,1783, 1654, 1368, 1304, 1244, 1116, 1021 см-1. 1(дд, J=7,4, 7,3 Гц, 1 Н), 4,02 (с, 2 Н), 2,80 (с, 4 Н),2,23 (с, 3 Н). МС (EI, ES+): m/z 382 [(М+1)+], 239, 108,106; Физические данные для сукцинимидилВос-(L)-пролина (Boc-Pro-OSu, 3, вещество, получаемое от фирмы Bachem Bioscience): Т. пл.: 132-136 С. ИК (KBr): 3456, 2940, 1731, 1619, 1561,1541, 1497, 1454, 1395, 1337, 1259, 1202, 1118,1060 см-1.(с, 4 Н), 2,32 (м, 1 Н), 2,27 (м, 1H), 1,94 (м, 2 Н),1,43 (с, 9 Н). МС (EI): m/z 335 (M+N2)+, 279, 213, 138,114, 86; ВЭЖХ: 97,1%. Физические данные для полусульфата бензил-(R)-3-аминобутирата (4, вещество, получаемое от фирмы Celqene Corp.): Т. пл.: 249,4-249,8 С. ИК (KBr): 3515, 3383, 2989, 2945, 2880,1821, 1788, 1744, 1701, 1476, 1454, 1421, 1394,1368, 1260, 1241, 1202, 1159, 1077 см-1. 1(ушир. с, 2 Н), 7,26 (c, 5 Н), 5,06 (АВ кв., J=12,3 Гц, 2 Н), 4,35 (м, 2 Н), 3,73 (м, 1H), 2,92 (дд,J=6,4, 17,1 Гц, 1H), 2,66 (дд, J=6,4, 17,0 Гц, 1H),1,35 (д, J=6,5 Гц, 3 Н). МС (EI): m/z 195 (М+3)+, 194 (М+2)+, 106,92, 91; ВЭЖХ: 99,0%. Получение бензилового эфира N-(третбутоксикарбонил)-L-пролил-3-метил-(R)-аланина (5). К хорошо перемешиваемой суспензии полусульфата бензил-(R)-3-аминобутирата (4; 66,7 г, 213 ммоля) в CH2Cl2 (200 мл) добавляют Boc(L)-Pro-OSu (3; 53,9 г, 222 ммоля) и Et3N (95 мл,681 ммоль). Реакционную смесь оставляют перемешиваться при комнатной температуре в течение 2 ч. Реакционную смесь распределяют между EtOAc (1,5 л) и Н 2 О (250 мл) и органический слой промывают 10%-й лимонной кислотой (3250 мл), H2O (250 мл), насыщенным раствором бикарбоната натрия (250 мл), Н 2O(250 мл) и рассолом (3250 мл), сушат Na2SO4 и концентрируют сначала на роторном испарителе (40 С; 80 мм рт.ст.) и затем в высоком вакууме (комнатная температура, 16 ч, 0,2 мм рт.ст.), получая промежуточное соединение 5 в виде вязкого масла (88,1 г), которое содержит остаточный EtOAc и CH2Cl2 (согласно ЯМР) и имеет чистоту 98% (ВЭЖХ). Это вещество используют в последующей реакции без дополнительной очистки. 1(ушир. с, 2 Н), 1,40 (с, 9 Н), 1,17 (д, J = 6,0 Гц,3 Н). МС (EI): m/z 413 [M+Na]+, 313, 291, 191,194, 165, 91. Получение гидрохлорида бензилового эфира L-пролил-3-метил-(R)аланина (6). К промежуточному соединению 5 из предыдущей реакции постепенно добавляют раствор 4 н. HCl в диоксане (240 мл). Наблюдается сильное выделение газа (осторожно, реакция экзотермическая). Реакционную смесь оставля 002988 22 ют перемешиваться при комнатной температуре(2 ч) и затем концентрируют сначала на роторном испарителе (45 С; 80 мм рт.ст.), а затем в высоком вакууме в течение ночи (комнатная температура, 14 ч, 0,2 мм рт.ст.), получая крайне вязкое вещество, которое перекристаллизовывают из CH2Cl2/Et2O (600 мл/700 мл),получая 64,0 г (общий выход 92% для двух стадий) HCl-соли 6 в виде белого твердого вещества (чистота по данным ВЭЖХ 99,6%). Т. пл.: 119,8-120,5 С. ИК (KBr): 3217, 3072, 2904, 2756, 1736,1681, 1560, 1446, 1387, 1352, 1295, 1244, 1178,1096 см-1. 1C16H23N2O3Cl: С 58,80, Н 7,094, N 8,57. Найдено: С 58,95, Н 6,99, N 8,46. Получение бензилового эфира N-4-(2 метилфениламино)карбонил]амино]фенил] ацетил]-L-пролил-3-метил-(R)аланина (7). К раствору HCl-соли 6 (61,77 г, 189 ммоля) в ДМФ (125 мл) добавляют MPUPA-OSu (2; 69,39 г, 181,9 ммоля) и затем Et3N (90 мл, рН 10). Реакционную смесь оставляют перемешиваться в течение 3,5 ч, затем разбавляют EtOAc(1 л) и экстрагируют Н 2 О (3250 мл). В этот момент продукт начинает выпадать в осадок. К органическому слою добавляют 10%-й раствор лимонной кислоты (250 мл) (осторожно, экзотермическая реакция) и при встряхивании образуется обильный осадок. Твердое вещество фильтруют через воронку со спекшимся стеклом (фильтр Шотта) (объем 2 л, М). Твердое вещество промывают лимонной кислотой (10%,2250 мл), H2O (250 мл), насыщенным бикарбонатом натрия (2250 мл), Н 2 О (250 мл) и рассолом (3250 мл) и оставляют сушиться на воронке при отсасывании (80 мм рт.ст.) в течение ночи (14 ч). Получают не совсем белое твердое вещество, которое перекристаллизовывают из смеси ТГФ/Et2 О (1 л/1,4 л), получая 83,3 г соединения 7 (чистота по данным ВЭЖХ 99,6%) в виде белого твердого вещества. Фильтрат дополнительно промывают лимонной кислотой (10%, 3250 мл), Н 2 О (250 мл), насыщенным бикарбонатом (2250 мл),Н 2 О (250 мл) и рассолом (3250 мл). С каждой последующей промывкой водой выпадает до 23 полнительное количество осадка, однако, промывку продолжают, проявляя осторожность,чтобы не потерять осадок. Фильтрование дает 4,02 г продукта в виде белого твердого вещества. Фильтрат наконец разбавляют Et2O (1 л),фильтруют и твердое вещество промывают Et2O(1,67 г) белого твердого вещества. Общий выход для данной реакции составляет 88%. Т.пл.: 153-153,5 С. ИК (KBr): 3342, 3307, 3119, 2966, 1737,1702, 1643, 1590, 1543, 1514, 1455, 1414, 1308,1238, 1179 см-1. 1 24 давлении 55 фунтов/дм 2 (3,87 кг/см 3) в присутствии Pd/C (10%, 2,44 г). Через 25 ч реакционную смесь фильтруют через Solka Floc (144 г;Fiber SalesDevelopment Corp.) на фильтре Шотта. Фильтрат повторно фильтруют через еще один слой Solka Floc (115 г), концентрируют до объема 250 мл и постепенно выливают в толуол (3 л) при энергичном перемешивании. Суспензию оставляют перемешиваться в течение 0,5 ч, фильтруют (через фильтр Шотта объемом 2 л) и полученный порошок сушат, сначала на фильтре с отсасыванием (80 мм рт.ст., 0,5 ч) и затем в вакуумной печи (14 ч, 45 С, давление доводят до 25 мм рт.ст. потоком N2). Белые комки измельчают (ступка и пестик) в тонкий порошок, получая 58,3 г (выход 87%)oMePUPA-V в виде белого твердого вещества. Продукт перекристаллизовывают из смеси ацетон/H2O (320 мл/75 мл). Кристаллы собирают и сушат сначала на фильтре Шотта с отсасыванием (1 ч, 80 мм рт.ст.) и затем в вакуумной печи(25 ч, 45 С, давление доводят до 25 мм рт.ст. потоком N2), получая 47,0 г (84% выделено при кристаллизации) oMePUPA-V в виде белого твердого вещества (чистота по данным ВЭЖХ 99,1%). Т. пл.: 153,6-154,4 С. ИК (KBr): 3354, 3307, 1719, 1643, 1590,1543, 1514, 1449, 1308, 1237 см-1. 1 Н ЯМР (600 МГц, ДМСО-d6), смесь ротамеров 3:2, , м.д. (пики основной конформации): 12,21 (ушир. с, 1 Н), 8,99 (с, 1 Н), 7,91 (с, 1 Н),7,87 (д, J=8,2 Гц, 1 Н), 7,68 (д, J=7,9 Гц, 1 Н), 7,40(СН 3), 17,9 (СН 3); и , м.д. (пики второстепенной конформации): 172,5 (С=O), 171,0 (С=O), 25 160,5 (С=O), 152,7 (С=O), 138,19 (С), 137,5 (С),130,2 (СН), 129,8 (СН), 129,6 (СН), 128,8 (С),127,4 (С), 126,1 (СН), 122,6 (СН), 120,9 (СН),118,0 (СН), 117,9 (СН), 59,9 (СН), 47,1 (CH2),42,0 (CH2), 39,8 (CH2), 40,3 (СН 2), 31,8 (СН 2),24,2 (СН 2), 20,2 (СН 3), 17,9 (СН 3); МС (EI): m/z 468 [M+Na]+, 336, 267, 137; Элементный анализ для (С 25 Н 30N4O5). Вычислено, %: С 64,36, Н 6,48, N 12,01. Найдено,%: С 64,07, Н 6,40, N 11,85. Пример 2. Активность на модели аллергического легочного воспаления у овец. Ислользовали аллергических овец весом между 27 и 50 кг. Было показано предварительно, что все овцы проявляли как раннюю, так и позднюю бронхиальные реакции на ингалированный распыленный аллерген Ascaris suum. Овцы находились в сознании и удерживались в модифицированной тележке для покупок в распростертом состоянии с неподвижными головами. После местной анестезии носовых проходов 2%-м лидокаином, через одну ноздрю в нижнюю часть пищевода продвигался катетербаллон. Животных интубировали с помощью эндотрахеальной трубки с надувной манжетой через другую ноздрю с использованием гибкого бронхоскопа с волоконной оптикой в качестве направляющего зонда. Все протоколы испытаний, используемые при этом исследовании,одобрены Mount Sinai Medical Center AnimalResearch Committee, который отвечает за обеспечение гуманного отношения и использование экспериментальных животных. Плевральное давление оценивалось с использованием катетера-баллона в пищеводе (заполненного 1 мл воздуха), который располагался на 5-10 см от желудочно-пищеводного соединения. В этом положении конечное плевральное давление при выдохе составляло в интервале от -2 до -5 см Н 2 О. После размещения баллона его закрепляли так, чтобы он оставался в этом же положении в течение всего опыта. Боковое давление в трахее измерялось с помощью катетера с боковым отверстием (внутренний диаметр 2,5 см), продвинутого через эндотрахеальную трубку и расположенного на расстоянии от верхнего ее конца. Катетеры трахеального и плеврального давления соединялись с дифференциальным датчиком давления (МР 45, Validyne, Northridge,CA) для измерения транслегочного давления,которое определяется как разница между трахеальным и плевральным давлением. Прохождение воздуха измерялось путем соединения проксимального конца эндотрахеальной трубки с пневматографом (Fleisch, Dyna Sciences, Inc.,Blue Bell, PA). Сигналы транслегочного давления и проходимость дыхательных путей регистрировались на многоканальном физиологическом регистрирующем устройстве, которое связано с персональным компьютером 80-386 DOS для оперативного расчета среднего сопротивления легких протоку (RL) делением изменения 26 транслегочного давления на изменение протока при среднем дыхательном объеме (полученном с помощью цифровой интеграции). Среднее значение, по меньшей мере, пяти дыханий, свободных от искусственного глотания, использовали для получения RL, в см Н 2 О/л/с. Сразу же после измерения RL определяли грудной газовый объем (Vtg) в плетизмографе постоянного объема тела для получения удельного сопротивления легких (SRL = RLVtg) в лсм Н 2 О/л/с. Все жидкие дозы аэрозолей получались с использованием одноразового медицинского распылителя с насадкой (Raindrop, PuritanBennett, Lenexa, KS), который давал аэрозоль со среднемассовым аэродинамическим диаметром 3,2 мкм, определяемым с помощью каскадного импактора Андерсона. Распылитель соединялся дозирующей системой, состоящей из электромагнитного клапана и источника сжатого воздуха (20 фунтов/кв.дюйм или 1,41 кг/см). Выпуск распылителя направлялся в пластиковую Тобразную деталь, один конец которой был присоединен к дыхательному отверстию клапанного респиратора (Harvard Apparatus, S.Natick,МА). Электромагнитный клапан активировался в течение одной секунды в начале дыхательного цикла респиратора. Аэрозоли подавались при дыхательном объеме 500 мл и скорости 20 вдохов в минуту. Для оценки бронхиальной восприимчивости строились кривые кумулятивной концентрационной реакции на карбахол путем измерения SRL сразу же после ингаляции буфера и после каждого последовательного введения с 10 вдохами повышающихся концентраций карбахола (0,25, 0,5, 1,0, 2,0 и 4,0 вес.%/об. в буферном физиологическом растворе). Провокационный тест прекращался, когда SRL увеличивался на более чем 400% от уровня после введения физиологического раствора или после введения наиболее высокой концентрации карбахола. Бронхиальная восприимчивость оценивалась путем определения кумулятивной концентрации карбахола (в единицах дыхания),которая повышала SRL на 400% относительно величины после введения физиологического раствора (РС 400) путем интерполяции по кривой дозареакция. Одна единица дыхания определялась как один вдох 1 вес.%/об. распыленного раствора карбахола. Дозы oMePUPA-V растворялись в смеси этанол:обычный физиологический раствор 1:2,или этанол:200 мМ фосфата натрия 1:5, или вTris-буфере. При использовании Tris-буфера любые необходимые разбавления осуществлялись с использованием обычного физиологического раствора. Дозы приготавливались в 3-5 мл общего объема. Во всех исследованиях базовое значение восприимчивости дыхательных путей (т.е. РС 400) определяли за три-четыре дня до начала исследования. При исследовании предварительной обработки однократной дозой измеряли SRL и животных обрабатывали соединением или растворителем. SRL измеряли повторно через 2 ч после обработки (непосредственно перед провокацией) и затем животных провоцировали аллергеном. В исследовании с использованием многократных доз, начиная за 4 дня до провокации аллергеном, животных обрабатывали один раз в день в течение 4 дней и провоцировали аллергеном через 24 ч после введения последней дозы. SRL измеряли до и после введения последней дозы соединения или после обработки растворителем. Во всех исследованиях SRL измеряли сразу же после провокации аллергеном, ежечасно в течение 1-6 ч после провокации и каждые полчаса в течение 6,5-8 ч после провокации аллергеном. Постпровокационные определения восприимчивости дыхательных путей(РС 400) проводили через 24 ч после провокации аллергеном. Полученные значения выражены в виде среднего значениястандартная ошибка среднего. Изменение SRL вычисляли для каждой овцы в виде разницы от предпровокационного базового значения SRL. Послепровокационные изменения в значении SRL характеризовались ранней реакцией дыхательных путей (EAR),которая развивавалась в течение приблизительно 0-4-часового периода. За ней следует поздняя реакция дыхательных путей (LAR), которая развивалась в течение приблизительно 4-8 часового периода после провокации аллергеном. Площади под кривыми EAR и LAR вычислялись для каждого животного с использованием правила трапеций. Значительные уменьшения площади под кривыми EAR и LAR по сравнению с плацебо-контролем, принимались как терапевтическое воздействие на индуцирован 28 ные аллергеном изменения SRL. Восприимчивость дыхательных путей к карбахолу (РС 400),оцененную до и через 24 ч после провокации аллергеном, выражали в виде отношения РС 400(пост/предпровокационные значения РС 400) для каждой овцы. Значительное повышение отношения РС 400 по сравнению с плацебо-контролем считалось терапевтическим эффектом. Сравнения с плацебо-контролем проводились с использованием одностороннего дисперсионного анализа последующим тестом Даннетта для множественного сравнения с контролем. Сравнения,которые приводили к р 0,05, считались статистически значимыми. Фиг. 1 показывает зависимость от аэрозолизованной ингибирующей дозы oMePUPA-V ответной реакции, наблюдаемой у чувствительных к Ascaris suum овец, провоцированных через 2 ч после введения дозы. Левые графики демонстрируют изменение удельного легочного сопротивления SRL, см Н 2 О/с. Правые графики показывают восприимчивость дыхательных путей к ингалированному карбахолу (отношение РС 400 пред/постпровокационное значение), определенную через 24 ч после провокации.oMePUPA-V при дозах 0,01 и 0,03 мг не ингибировали раннюю или позднюю реакцию дыхательных путей или не изменяли гипервосприимчивость к карбахолу через 24 ч после провокации аллергеном. Дозы 0,1, 1 и 3 мг ингибируют раннюю реакцию дыхательных путей и максимально ингибировали позднюю реакцию дыхательных путей. Эти дозы также ингибировали гипервосприимчивость к карбахолу через 24 ч после провокации аллергеном. Статистический анализ этих данных представлен в табл. 2. Таблица 2 Введение дозы за 2 ч до провокации аллергеном 12 5,850,62 4,850,69 0,490,03 0,01NS - обычный физиологический раствор= р 0,05 в сравнении с PBS-контролем, односторонний дисперсионный анализ с последующим тестом Даннетта для множественного сравнения с контрольной группой. Показывает статистически значимое уменьшение EAR или LAR в сравнении с контрольной группой с введением PBS. Овец, от природы чувствительных к Ascaris suum, провоцировали аэрозолем аллергенаoMePUPA-V в указанных дозах или через 24 ч после последней дозы повторяемого ежедневного введения в течение 4 дней подпороговой дозы oMePUPA-V или эквивалентного количестваPBS. Механику легочного дыхания, описывае мую как изменение удельного сопротивления дыхательных путей от базового значения до проведения исследования, измеряют в течение 8 ч после аллергической провокации. Раннюю реакцию дыхательных путей (0-4 ч, EAR) и позднюю реакцию дыхательных путей (4-8 ч,LAR) выражают в виде средней площади под кривой зависимостиудельного легочного со 29 противления от времениs.e.m. (стандартная ошибка среднего). Сопротивление дыхательных путей ингалируемому карбахолу определяли до начала исследований и через 24 ч после провокации аллергеном. Восприимчивость дыхательных путей приводится в виде отношения РС 400(количество карбахола, требуемое для повышения сопротивления на 400%) при сравнении предпровокационной и постпровокационной величин. Раздражающее действие разовой дозы. Ни одна из доз oMePUPA-V, использовавшихся в описанном выше исследовании, не оказывала раздражающего действия, о чем свидетельствует отсутствие изменения сопротивления дыхательных путей по сравнению с базовым сопротивлением после провокации аллергеномAscaris suum. Это показано на фиг. 2. Изучение повторяемых доз. На фиг. 3 видно, что доза oMePUPA-V 0,03 мг, которая, как было показано, не эффективна,когда используется в качестве разовой дозы при экстренном предварительном введении, тем не менее, обладает защитным действием, если ее вводить один раз в день в течение 4 дней, когда провокацию антигеном проводят через 24 ч после введения последней дозы. Верхний и нижний левые графики показывают, что этот эффект наблюдался при использовании двух различных препаратов. Гипервосприимчивость к 30 карбахолу после дополнительных 24 ч также ингибировалась максимально, как показано на верхнем и нижнем правых графиках фиг. 3. Защитное действие oMePUPA-V было значительным против EAR и LAR и относительно гипервосприимчивости к карбахолу. Количественный анализ представлен в табл. 3. Результаты данного исследования показывают, что разовое предварительное введение небольшой молекулы ингибитора VLA-4,oMePUPA-V, с помощью аэрозоля, может защищать индуцируемых аллергеном ранних и поздних реакций дыхательных путей и от индуцируемой после провокации аллергеном гипервосприимчивости дыхательных путей (AHR) на модели аллергических овец. Никакого раздражающего действия на дыхательные пути не наблюдалось при введении любой из дозoMePUPA-V, даваемых в виде разового предварительного введения. Результаты показали также, что эффективная доза oMePUPA-V может быть уменьшена за счет многократных обработок. Суммарно эти данные дают веское свидетельство того, что адгезия VLA-4 играет ключевую роль в патофизиологических показателях(LAR и AHR) длительных воспалительных событий, которые инициируются в дыхательных путях аллергических овец после провокации аллергеном.EAR (SLRч) LAR (SLRч) РС 400 (пост/пред) мг Введение дозы один раз в день в течение 4 дней, провокация через 24 ч после введения последней дозыTris:NS 4 1,400,35 0,020,06 1,040,04= р 0,05 в сравнении с PBS-контролем, односторонний дисперсионный анализ, с последующим тестом Даннетта для множественного сравнения с контрольной группой. Показывает статистически значимое уменьшение EAR или LAR или значительное увеличение отношения РС 400 в сравнении с контрольной группой с использованием PBS. Овец, от природы чувствительных к Ascaris suum, провоцировали аэрозолем аллергенаAscaris suum через 24 ч после введения последней дозы при повторяемом ежедневном введении в течение 4 дней подпороговой дозыPBS. Механику легочного дыхания, описываемую как изменение удельного сопротивления дыхательных путей от базового значения до проведения исследования, измеряли в течение 8 ч после провокации аллергеном. Раннюю реакцию дыхательных путей (0-4 ч, EAR) и позднюю реакцию дыхательных путей (4-8 ч, LAR) выражают в виде средней площади под кривой зависимости удельного легочного сопротивления от времениs.e.m. Сопротивление дыхательных путей к ингалированному карбахолу определялось до инициирования исследования и через 24 ч после провокации аллергеном. Восприимчивость дыхательных путей приводится в виде отношения РС 400 (количество карбахола,требуемое для повышения сопротивления на 400%) при сравнении значений до провокации и после провокации. Пример 3. Активность на моделях аллергической реакции замедленного типа. Исследования эритроцитов овец. Во всех опытах использовали свободных от специфических патогенов самок мышей Ваlb/с в возрасте 8-10 недель, полученных отJackson Labs. Животным дают пищу и воду без ограничений. Эритроциты овец (sRBC) в растворе Элсевера (Alsever's solution) от одних и тех же овец получали еженедельно от CharlesRiver Pharm. Services (Southbridge, MA). sRBC пеллетизировали центрифугированием при 1000g в течение 10 мин при 4 С и любую видимую лейкоцитную пленку удаляли. Клетки затем промывали в физиологическом растворе. Пеллеты клеток повторно суспендировали в физиологическом растворе и подсчитывались с использованием гемоцитометра. Клетки разбавлялись фосфатно-солевым буфером (PBS) до концентрации 2108 sRBC на мл. На 0 день мышей сенсибилизировали подкожной инъекцией 2107PBS до конечной концентрации 4109 sRBC/мл. Из этого препарата 25 мкл инъецировали подкожно в подушечку правой задней лапы. Для введения в кишечник соединения,oMePUPA-V (партия 2770-029) преобразовывался в готовую форму препарата в растворителе - 60% PEG400 в 0,02 М TRIS - до исходной концентрации 5 мг/мл. Соответствующие разведения готовили в растворителе PEG/TRIS и вводили энтерально в объеме 100 мкл. Анти-VLА-4 антитело (PS/2) разбавляли физиологическим раствором в концентрации 4,3 мг/кг и вводили внутрибрюшинно в 100 мкл. Все обработки проводились сразу же после провокации овецsRBC. Опухание непровоцированной контрольной (левой) и провоцированной (правой) подушечек задних лап измеряли с использованием натяжного толщиномера (Mitutoyo, модель 304-196, Dyer, Lancaster, PA) через 20 ч после провокации подушечки лапы. Полученные данные представляют в виде изменения толщины подушечки, определяемого путем вычитания толщины левой задней лапы из толщины правой задней лапы. Изменения толщины подушечек сравнивали с использованием двухстороннего критерия Стьюдента. Антитело анти-VLА-4 PS/2 в дозе 4,3 мг/кг(внутрибрюшинно) ингибировало опухание приблизительно на 30%, тогда как oMePUPA-V,введенный энтерально в дозе 20 мг/кг, на данной модели не проявлял никакого действия(данные не представлены). Изучалась эффективность oMePUPA-V, вводимого в дозе 20 мг/кг через кишечник, на DTH модели, индуцированной sRBC, на мышах, и при этом не наблюдалось никакой эффективности. Пример 4. Активность на моделях гиперчувствительности замедленного типа (DTH). Модель контактной гиперчувствительности. Во всех исследованиях использовали свободных от вирусов самок мышей Balb/c (JacksonLaboratories, Bar Harbor, ME), содержавшихся по четыре на клетку в клетках микроизолятора в устройстве для животных, свободных от биогенных вирусов, и получавших без ограничений корм для мышей и питьевую воду. Мышей анестезировали смесью кетамин:ксилазин (90:10 мг/кг, внутрибрюшинно). Участок брюшной 32 кожи площадью 3 см 2, мечеобразный по направлению к лобку, открывался тщательным выбриванием шерсти, и кожу протирали 70% этанолом. На обнаженную брюшную кожу равномерно наносился 25 мкл 0,5 об./% DNFB в растворителе, состоящем из ацетона и оливкового масла, 4:1 об./об. Кожу слегка царапали кончиком пипетки, чтобы спровоцировать небольшое воспаление. Мышей укладывали навзничь в их клетках и давали им отойти от анестезии. Через 24 ч после начальной сенсибилизации мышей снова сенсибилизировали 25 мкл 0,5%-го DNFB в растворителе на том же участке брюшной кожи, после чего снова слегка царапали кончиком пипетки. Вторую сенсибилизацию проводили на мышах без анестезии. На 5-й день(приблизительно через 120 ч после начальной сенсибилизации) субраздражающую дозу сенсибилизирующего вещества (0,2% DNFB в растворителе ацетон:оливковое масло, 4:1 об./об.) использовали для провокации иммунной реакции. Мышей анестезировали смесью кетамин: ксилазин (90:10 мг/кг, внутрибрюшинно) и по 10 мкл 0,2%-го раствора DNFB наносили на тыльную поверхность левого уха. На правом ухе проводили аналогичное нанесение растворителя ацетон:оливковое масло, 4:1 об./об. На протяжении последующих 24 ч развивалась двухфазная реакция опухания уха, как показано на фиг. 4. Через 24 ч после провокации мышей снова анестезировали смесью кетамин:ксилазин и измеряли толщину обоих ушей с использованием инженерного микрометра с точностью до 10-4 дм (2,5410-4 см). Соединения (100 мкл) или соответствующий растворитель(Диметилсульфоксид,ДМСО) в изотоническом фосфатно-солевом буферном растворе (PBS) (100 мкл), вводили перорально с помощью желудочного зонда через 4 ч после провокации иммунной реакции на 5-й день. Для каждой проводимой обработки использовали группы из 8 мышей. oMePUPA-V(партия 2044-076) растворяли в дистиллированной воде с добавлением 0,5% натрийфосфатного буфера, рН=8,8, и 3% ДМСО. Реакцию распухания уха у каждой из мышей вычисляли как разницу между толщиной уха после обработки растворителем и толщиной уха после провокации DNFB через 24 ч после провокации. Обычно индуцированное DNFB распухание уха составляло 65-7510-4 дм (165-19110-4 см). Ингибирование реакции распухания уха определяли путем сравнения обработанной группы животных с контрольной группой, обработанной растворителем. Статистическую значимость разницы среди обработанных групп оценивали с использованием одностороннего дисперсионного анализа с последующим тестом Даннетта для множественных сравнений с контрольной группой (Systat, SPSS Inc.) с использованием р 0,05. 33 Полученные величины выражались в виде средних значенийстандарная ошибка. На фиг. 4 представлено сравнение реакций распухания уха, которые были измерены через 24 ч после провокации DNFB на мышах, которые получали растворитель (ДМСО, PBS), соединение положительного контроля (даваемое в дозе 0,03 мкг/кг) или 0,03 или 0,3 мг/кг(верхний график). Процент ингибирования, вызванного обработкой, представлен на нижнем графике. Обе дозы oMePUPA-V значительно ингибировали реакцию распухания уха до степени, близкой к степени, проявляемой положительным контрольным соединением. Разовые тонкокишечные дозы в 0,03 или 0,3 мг/кг oMePUPA-V, даваемые через 4 ч после провокации DNFB, могут значительно ингибировать реакцию распухания уха на модели контактной аллергической реакции на мышах. Пример 5. Биохимия. 5.1. Рецепторное сродство oMePUPA-V,измеренное с использованием конъюгатаVCAM-Ig со щелочной фосфатазой при проведении оценки прямого связывания (DBA) сA. et al. Cell Adhesion and Communication 3, 131142, 1995). Конъюгацию с кишечной щелочной фосфатазой (АР) плода крупного рогатого скота с целью расщепления хромогенного субстрата проводили в соответствии с публикацией LobbR.R. et al. Cell Adhesion and Communication 3,385-397, 1995. Связывание с VLA-4 оценивали на линии Т-клеток человека, Jurkat (41). На поверхности этих клеток в присутствии 1 мМMn+2 VCAM-Ig-AP и oMePUPA-V конкурировали за связывание с 41. При оценке реакции прямого связывания сVCAM-Ig oMePUPA-V конкурирует с VCAMIg-AP за связывание с клетками Jurkat в присутствии 1 мМ MnCl2 в зависимости от концентрации с IC50 81 нМ (n=9). Полученные результаты представлены в табл. 4. 5.2. Рецепторное сродство oMePUPA-V,измеренное с использованием конъюгатаVCAM-Ig со щелочной фосфатазой методом анализа очищенный VLA-4 белок/белок.VLA-4 очищался от экстракта детергента высокоэкспрессирующего подклона 4 трансфекцированных К 562 клеток с помощью аффинной хроматографии с антителами и иммобилизовался в лунках микротитровального планшета для проведения анализа конкурентного связывания белок/белок. VCAM-Ig-AP связывали с планшетом, покрытым очищеннымиoMePUPA-V (партия 2) и 1 мМ MnCl2. Планшеты считывались при длине волны 405 нм, и 34 данные анализировались с использованием программы SoftMax v. 2.32. Связывание конъюгата VCAM-Ig с очищенным VLA-4 блокировалось полностью специфическим нейтрализующим моноклональным антителом анти-4 (НР 1/2). Два значения IC50,полученные для oMePUPA-V при приведении анализа VLA-4 белок/белок, представлены в табл. 4, как и значения IC50, полученные на клетках Jurkat при оценке конкурентного связывания с VCAM-Ig-AP и при оценке адгезии CS1 клеток. 5.3. Рецепторное сродство oMePUPA-V,оцененное в анализе адгезии клеток CS1. в. Адгезия клеток Jurkat к конъюгатуCS1/BSA. Пептид NН 2-цистеин-тирозин-СS-1 синтезируют и конденсируют с BSA-SMCC (SMCC представляет собой гетеробифункциональный кросс-линкер, который реагирует со свободными аминогруппами на бычьем сывороточном альбумине (BSA) и одним цистеином синтетического пептида) при соотношении CS1/BSA 10:1. Лунки планшета покрывают на протяжении ночи 100 мкл конъюгата, разбавленного до конечной концентрации 1 мкг/мл. На следующий день лунки блокируют BSA в PBS в течение 1 ч и затем промывают три раза. Линию Т-клеток человека, Jurkat, метят с помощью 2 мкМ флуоресцентного красителя(Molecular Probes Inc., Eugene, Oregon; каталог В-1150), который интернализуется и деэтерифицируется, улавливая, таким образом, краситель внутрь живых клеток. Клетки Jurkat (1105 клеток/лунка) в буфере, содержащем 1 мМMn2+, добавляют к покрытым планшетам в присутствии последовательных трехкратных разбавлений ингибитора. Каждую концентрацию оценивают дважды. После 30 мин нахождения при комнатной температуре планшеты переворачивают и промывают три раза или до тех пор,пока не будет клеток, прикрепленных к контрольным лункам, покрытым только BSA. CS1 прикрепленные клетки определяют количественно в флуоресцентном планшет-ридере Cytofluor с использованием длины волны возбуждения 485 нм и эмиссионной длины волны 530 нм. Клетки, прикрепившиеся к CS1/BSA в отсутствие соединения, служат в качестве контроля с ингибированием 0%, тогда как клетки, прикрепившиеся к одному BSA, служат в качестве контроля со 100%-м ингибированием. ЗначенияDeltagraph, версия 5. Адгезия меченых клеток Jurkat в присутствии Mn+2 полностью блокируется EDTA и нейтрализующим анти-41, mАв (моноклональное антитело) НР 1/2, указывая на то, что связывание является специфическим. В табл. 4 пред 35 ставлена активность oMePUPA-V в анализе адгезии к CSl/BCA, а также результаты оценки реакции связывания.oMePUPA-V является сильным антагонистом VLA-4 в буферах, содержащих Mn2+. Он в 80 раз более активен при оценке в присутствииJurkat при оценке реакции связывания.oMePUPA-V является функциональным антагонистом, что обнаруживается по его способности в зависимости от дозы и полностью блокировать адгезию клеток Jurkat к CS1. Абсолютные значения при оценке адгезии являются большими,чем значения, которые наблюдаются при оценке реакции связывания. Это может быть следствием многовалентной природы адгезии. Во всех форматах исследований ингибирование связывания с помощью EDTA и НР 1/2 иллюстрирует специфическое связывание с VLA-4. Таблица 4 Рецепторное сродство oMePUPA-V в присутствии 1 мМ MnCl2, измеренное в анализе реакции конкурентного связывания с VCAM-Ig, адгезии клеток CS1 и в анализе очищенный VLA-4 белок/белок Анализ Клетки Jurkat Связывание с VCAM-Ig Клетки Jurkat Адгезия к CS1 Очищенный VLA-4 Связывание с VCAM-Ig 5.4. Специфичность ингибирующего действия oMePUPA-V. а). Специфичность oMePUPA-V, оцениваемая с использованием JY-клеток в анализе реакции прямого связывания с VCAM-Ig и адгезии к CS1. Связывание с 47 оценивают на JYклетках в присутствии Mn2+. В анализе связывания VCAM-Ig и oMePUPA-V конкурируют за связывание с 47 на JY-клетках (см. раздел 4.1.1. для протокола анализа). При исследовании клеточной адгезии oMePUPA-V испытывают на его способность блокировать связываниеoMePUPA-V не блокирует 47-связывание с VCAM-Ig или CS1/BSA. Mab анти-7,Fib27 (Pharmingen), ингибирует эти взаимодействия, однозначно показывая, что связывание является 47-специфичным. Следовательно, 36oMePUPA-V является специфичным ингибитором для VLA-4. Полученные результаты представлены в табл. 5. б). Специфичность oMePUPA-V, изученная с использованием адгезии клеток К 562 к лункам, покрытым Fn-120. Необработанные 96-луночные полистирольные планшеты с плоским дном покрывают 5 мкг/мл Fn-120 в течение ночи при 4 С. Планшеты промывают дважды фосфатно-солевым буферным раствором (PBS) и блокируют 1% бычьим сывороточным альбумином (BSA) в течение 1 ч при комнатной температуре. Планшеты промывают дважды ТВS-буфером, содержащим 1 мМ MnCl2 (буфер для исследования). Клетки К 562 метят с помощью 2 мкМ флуоресцентного красителя, BCECF-AM, (см. раздел 4.1.3) и связывают с планшетом в течение 30 мин при комнатной температуре. Планшеты переворачивают и промывают три раза и прикрепленные клетки количественно определяют в флуоресцентном планшет-ридере Cytofluor с использованием возбуждающей длины волны 485 нм и эмиссионной длины волны 530 нм. Адгезия клеток К 562 к Fn-120 полностью блокируется нейтрализующим антителом анти 5, IIAl (Pharmingen), указывая на специфическое связывание через VLA-5. Ингибирование связывания клеток К 562 с фрагментами Fnl20K с помощью oMePUPA-V в дозах 100 мкМ отсутствовало. См. ниже табл. 5. в). Оценка реакции агрегации, проведенная с целью определения специфичности oMePUPAV. Методы Активность против gpIIbIIIa оценивают с помощью стандартной агрегометрии тромбоцитов с использованием обогащенной тромбоцитами плазмы. ADP используют для инициирования агрегации в присутствии плазмы, где Са+2 и Mg+2 являются основными двухвалентными катионами. В качестве положительного контроля используют GRGDSP при 100 мкг/мл. РезультатыoMePUPA-V испытывают в трех дозах 1,10 и 100 мкМ. Он не ингибирует агрегацию тромбоцитов, индуцированную ADP, ни в одной из доз. Полученные результаты приведены в табл. 5. oMePUPA-V является высоко (10000 раз) специфичным для VLA-4. Он не имеет заметной активности (100 мкМ) в отношении родственных интегринов, 47 и VLA-5 или в отношении 3-интегрина, gрIIbIIIа. Таблица 5 Ингибирующая активность oMePUPA-V, измеренная в анализе конкурентного связывания с 47 иVCAM-Ig, в анализе адгезии 47 и VLA-5 и при изучении агрегации тромбоцитов Линия клеток Лиганд Двухвалентный катионCS1/BSA Мn+2 Нет ингибирования Адгезия при 100 мкМ (n = 4)(IIbIIIa) Агрегация при 100 мкМ (n = 1) Пример 6. Оценка oMePUPA-V для индукции LIBS 6.1. Измерения на клетках Jurkat с использованием антитела LIBS 9EG7. а). Индукцию LIBS антагонистами 41 оценивают in vitro с использованием анализаFACS. Клетки Jurkat (2105/лунка) предварительно инкубируют при 37 С в течение 20 мин с физиологическим раствором с буфером TRIS,содержащим 2 мМ MgCl2 (Mg+2-TBS), отдельно или с последовательными разбавлениями испытуемых соединений. Образцы переносят на ледяную баню и дополняют антителом LIBS,9EG7, с конечной концентрацией 10 мкг/мл. Клетки промывают дважды с помощью Mg+2TBS и снова суспендируют при разбавлении 1:200 IgG козла против крыс, конъюгированного с FITC (изотиоцианат флуоресцеина) в Mg+2-TBS, и выдерживают в течение 30 мин при 4 С. Клетки промывают дважды и снова суспендируют в Мg+2-ТВS. Среднюю интенсивность флуоресценции (MFI) определяют с помощью анализа FACS (Becton DickinsonFACScan). Результаты выражены в виде MFI. Данные анализируют с использованием программ Microsoft Exel v5.0 и Deltagraph v4.0. На фиг. 5 показано, что oMePUPA-V индуцирует открытие LIBS эпитопа в сравнении с 2 мМ Мg+2-буфера (График В). Индукция является концентрационно-зависимой и аналогична по величине индукции, наблюдаемой в случае 1 мМ Mn+2 (График А). Пропуск LIBS антитела и детекции антитела, или пропуск только детекции антитела устраняет лечение (График В). Заключение Представленные данные показывают, чтоoMePUPA-V индуцирует то же самое конформационное изменение в VLA-4, которое наблюдается в случае природных лигандов. Величины для LIBS обычно попадают в интервал, определенный методами анализа связывания и адгезии,которые для oMePUPA-V равны соответственно 8 и 22 нМ. 6.2. Многовидовой рецепторный скрининг. а). Рецепторное сродство oMePUPA-V, измеренное при оценке прямого связыванияVCAM-Ig с использованием конъюгата VCAMIg со щелочной фосфатазой и лимфоцитов периферической крови или клеток селезенки, полученных от различных видов. Лимфоциты периферической крови (PBL) выделяют из периферической крови человека,овец и собак, используя методы, описанные дляPBL овец (Abraham W.M. et al. J. Clin. Invest. 93:776-787, 1994). Анализ конкурентного связывания VCAM-Ig-AP используют для сравнения связывания oMePUPA-V с этими различными типами клеток. Значения IC50, измеренные для oMePUPAV на лимфоцитах периферической крови или на клетках селезенки, полученных от различных видов, в присутствии Mn+2, представлены в табл. 6. В присутствии Mn+2 oMePUPA-V ингибирует с аналогичными значениями IC50 связывание VCAM-Ig с лимфоцитами человека, крыс,собак, овец и мышей. Отсутствуют свидетельства видовой специфичности. Это согласуется с высокой степенью сохранения последовательности, наблюдаемой среди видов для VLA-4 и его природных лигандов, CS1 и VCAM. Таблица 6 Рецепторное сродство oMePUPA-V, измеренное в анализе конкурентного связывания VCAM-Ig с использованием конъюгата VCAM-Ig со щелочной фосфатазой и лимфоцитов периферической крови или клеток селезенки, от различных видов Вид Источник Двухвалентный катионoMePUPA-V. 7.1. Конкурентный анализ с использованием в качестве зонда 3H-известного ингибитора. Клетки Jurkat выдерживают в среде RPMI1640 плюс 10% сыворотки плода крупного рогатого скота при 37 С в термостате для тканевых культур. Для изучения реакции связывания клетки пеллетизируют центрифугированием,промывают два раза TBS (50 мМ Tris-HCl, 150 мМ NaCl, 0,1% бычьего сывороточного альбумина, 2 мМ глюкозы, 10 мМ HEPES, рН 7,4),суспендируют при концентрации приблизительно 2106 клеток/мл в TBS и подсчитывают с использованием гемоцитометра Neubauer. Клетки дополнительно разбавляют до концентрации 1,5106/мл в указанных буферах и подвергают специфичной обработке, определенной для каждого опыта. Клетки затем пеллетизируют центрифугированием, снова суспендируют в 100 мкл буфера для анализа и переносят в сцинтилляционный сосуд, содержащий 2,9 мл ScintiVerse II (Fisher Scientific). Радиоактивность,связанную с клетками, количественно определяют с помощью сцинтилляционного подсчета. Импульсы, связанные в этих условиях, определяют интегрин, который не занят испытуемым соединением и, следовательно, свободен для соединения с 3H-известным ингибитором. Все исследования проведены в покрытых кремнием пробирках (eppendorf tube) емкостью 1,5 мл со стандартным объемом образца 1 мл. Неспецифическое связывание 3H-известного ингибитора с клеткам (фон) измеряют путем определения ингибитора, связанного в отсутствии иона металла. Связанные специфические импульсы вычисляют путем вычитания неспецифических импульсов из общего количества связанных импульсов. Проведен ряд конкурентных исследований для подтверждения того, что oMePUPA-V и известный ингибитор конкурируют за один и тот же сайт на VLA-4. Во-первых, 3H-известный ингибитор смешивают с эквимолярным количеством oMePUPA-V, 10-кратным избытком и со 100-кратным избытком, инкубируют с клеткамиJurkat и оценивают способность не содержащего радиоактивности ингибитора (холодного ингибитора) конкурировать за связывание с известным ингибитором. Обработка с помощьюoMePUPA-V дает зависимое от дозы ингибирование связывания 3H-известного ингибитора. Концентрация oMePUPA-V, которая необходима для конкурирования со связыванием 3Hизвестного ингибитора, в 10 раз больше, чем необходимо, когда не содержащий радиоактивности ингибитор используется в качестве конкурента, что согласуется с его более низким сродством к Мn+2-активируемому VLA-4. Вовторых, Мn+2-активируемые клетки Jurkat обрабатывают 3H-известным ингибитором для того, 002988 40 чтобы сначала занять VLA-4 радиоактивным зондом и затем добавляют избыток холодногоoMePUPA-V. Последующие обработки избытком не содержащего радиоактивностиoMePUPA-V или известным ингибитором не различаются по их способности вытеснять радиоактивный зонд. В-третьих, Мn+2-активируемые клетки Jurkat обрабатывают насыщающими количествами oMePUPA-V и измеряют скорость, при которой oMePUPA-V диссоциирует. В отличие от длительного периода полураспада известного ингибитора для Мn+2-активируемого(t1/2) менее чем 10 мин. Большое различие в t1/2 для oMePUPA-V и известного ингибитора означает, что более низкое сродство oMePUPA-V кVLA-4 является результатом его более высокой скорости выведения. Данные по диссоциации показывают, что связывание oMePUPA-V с VLA-4 зависит в высокой степени от состояния активации VLA-4, и что он проявляет ту же самую селективность для активации, наблюдаемую в случае известного ингибитора. Как и в случае Мn+2 активированных VLA-4, время t1/2 диссоциацииoMePUPA-V из Мg+2-активированных VLA-4 составляет менее 10 мин, наименьшую временную точку, которая может быть определена при конкурентном формате. С другой стороны, в присутствии Mg+2 плюс активирующее антитело, TS2/16, t1/2 продлевается (до 20 мин). Все возможные состояния активации не оценивались подробно, однако, разработан простой скриниг, который может легко прояснять различия. В этом исследовании фиксированные концентрации oMePUPA-V (10 нМ) смешивают с 5 нМ 3H-известного ингибитора и проводят связывание в этих условиях при разных состояниях активации. Если oMePUPA-V имеет аномально высокое или низкое сродство с VLA-4,это можно определить по разнице в количестве 3H-известного ингибитора. Различия в процентной величине связанного при различных условиях активации 3H-известного ингибитора приближаются к тому, что можно было бы предсказать на основании известных свойств ингибитора. Исследования реакции связывания подтверждают, что oMePUPA-V конкурирует с известным ингибитором за связывание с VLA-4 в концентрациях, согласующихся с его сродством,и показывают, что два соединения конкурируют за один и тот же сайт на интегрине. СходствоoMePUPA-V и известного ингибитора при связывании при различных состояниях активацииVLA-4, означает, что механизм связывания является аналогичным. 7.2. Изучение oMePUPA-V в Panlabs и в скринингах Сеrер. 41 Проведены испытания oMePUPA-V в Panlabs ProfilingScreen, DiscoveryScreen и по иммунноскрининговому графику радиолиганд ных, ферментных и функциональных анализов,а также по графику мембранных рецепторов Сеrер. Не наблюдается никакой значительной активности oMePUPA-V при 10 мкМ в любом анализе, включая анализ NK1 рецептора, в отношении которого известные ингибиторы проявляют некоторую активность. По данным Сереr сообщается также, чтоoMePUPA-V не оказывает никакого ингибирующего действия на АСЕ-протеазу человека. Источником АСЕ-протеаз являются эндотелиальные клетки человека (HUVEC). 3H-HGG,добавленный к HUVEC, превращается в 3Hгиппуровую кислоту и глицилглицин с помощью АСЕ. Каптоприл, сильный АСЕ-ингибитор,блокирует это превращение с IC50 990 пМ, тогда как oMePUPA-V в концентрации 10 мкМ не блокирует. Физические свойства.oMePUPA-V представляет собой от белого до не совсем белого цвета кристаллический порошок. Он растворим в ДМСО, и имеет растворимость в воде 0,120 мг/мл. ПоведениеoMePUPA-V при нагревании, изученное с помощью дифференциальной сканирующей калориметрии (DSC), термогравиметрического анализа (TGA) и микроскопии в горячем состоянии,показывает, что материал плавится приблизительно при 160 С. Данные анализа DSC и TGA приблизительно при 136 С означают, чтоoMePUPA-V теряет летучие примеси, что, вероятно, согласуется с дегидратацией моногидрата. Готовая форма препарата. Препарат для распыления Указания по производству 100 мл препарата для распыления, содержащего 5 мг/млoMePUPA-V, представлены ниже. Приготовить 200 мл исходного буферного раствора следующим образом. 1. Взвесить 0,286 г Трометамина (фармакопея США) в подходящем контейнере. 2. Взвесить 1,676 г хлористого натрия(фармакопея США) в том же контейнере. 3. Добавить 200 мл воды для инъекций(фармакопея США). Смешать до получения гомогенной смеси. 1. Взвесить 0,500 г oMePUPA-V в подходящем контейнере. 2. Добавить 100 мл буфера, приготовленного на стадии 1. 3. Смешать до получения гомогенной смеси. 4. Профильтровать стерильно в подходящий контейнер. 5. Герметично закрыть подходящей крышкой. Типичные свойства препарата: рН: 7.4,Осмотическое давление: 290 мОсм.Tris/NaCl/вода (объемный промежуточный продукт) или в 0,1% TFA/45% ацетонитрила (конечный продукт). Определение: УФ 254 нм (основное) и 215 нм Контроль: oMePUPA-V, нагретый в кипящей воде в течение 20 мин. Предварительные методы качественного определения закончены. Стабильность лекарственного соединения. Не наблюдается никакого разложения в объемном промежуточном продукте при хранении в течение двух недель при следующих условиях хранения: при 40 С в закрытом сосуде; при 50 С в закрытом сосуде; при 25 С и относительной влажности (OВ) 60%; и при 40% и ОВ 75%. Спустя четыре недели, один или два пика разложения становятся заметными при хранении при 40 и 50 С, но уровень пика каждой примеси еще составляет менее 0,02%. Стабильность раствора.Tris/NaCl, хранившийся при комнатной температуре в течение двух месяцев, имеет пики разложения с ранним временем элюирования при общем уровне 1% (при 254 нм) и 2-3% (при 215 нМ).b). Нагревание препарата для распыления в кипящей воде в течение 20 мин снижает чистоту от 99,9% до 98,7% при 254 нМ и от 100% до 93,6% при 215 нм.Tris/NaCl/вода при нейтральном значении рН стабилен при 2-8 С, по меньшей мере, в течение недели. Для квалифицированного в данной области специалиста очевидно, что различные модификации и изменения могут быть проведены в заявленном изобретении без отступления от сути и объема изобретения. Таким образом, подразу 43 мевается, что настоящее изобретение охватывает модификации и варианты настоящего изобретения, при условии, что они находятся в пределах объема прилагаемой формулы изобретения и ее эквивалентов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. (R)-N-4-(2-метилфениламино)карбонил]амино]фенил]ацетил]-L-пролил-3-метил-аланин, ингибирующий клеточную адгезию или его фармацевтически приемлемое производное, пролекарство или соль. 2. Соединение по п.1, в котором пролекарство представляет собой сложный эфир соединения. 3. Соединение по п.2, представляющее собой сложный эфир, полученный путем взаимодействия (R)-N-4-(2-метилфениламино)карбонил]амино]фенил]ацетил]-L-пролил-3-метил-аланина с C1-10 спиртом с линейной или разветвленной цепью. 4. Соединение по п.2, представляющее собой сложный эфир, полученный путем взаимодействия (R)-N-4-(2-метилфениламино)карбонил]амино]фенил]ацетил]-L-пролил-3-метил-аланина с C1-4 спиртом с линейной или разветвленной цепью. 5. Соединение по п.2, представляющее собой сложный эфир формулы где R представляет собой C1-10 алкил с линейной или разветвленной цепью. 6. Соединение по п.5, в котором R представляет собой C1-4 алкил с линейной или разветвленной цепью. 7. Соединение по п.1, имеющее формулу 8. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый носитель. 9. Фармацевтическая композиция по п.8, в которой соединение, ингибирующее клеточную адгезию, представлено в виде его соли. 10. Фармацевтическая композиция по п.8,дополнительно включающая еще один агент,выбираемый из группы, включающей кортикостериоды, бронхолитические агенты, антиастматические агенты, противовоспалительные 44 агенты, противоревматические агенты, иммунодепрессанты, антиметаболиты, иммуномодуляторы, средства против псориаза и антидиабетические агенты. 11. Фармацевтическая композиция по п.8,дополнительно включающая одно или более соединений ингибиторов клеточной адгезии. 12. Фармацевтическая композиция по п.11,в которой указанное одно или более соединений ингибиторов клеточной адгезии представляют собой ингибиторы интегрина 41. 13. Фармацевтическая композиция по п.8,в которой соединение представляет собой пролекарство - сложный эфир. 14. Способ предотвращения, ингибирования или подавления клеточной адгезии у млекопитающих, включающий стадию введения указанному млекопитающему эффективного количества фармацевтической композиции по п.8 или 9. 15. Способ по п.14, в котором указанный способ используется для предотвращения, ингибирования или подавления воспаления. 16. Способ лечения астмы, аллергического ринита, рассеянного склероза, атеросклероза,воспалительного заболевания кишечника или множественной миеломы у млекопитающих,включающий введение указанному млекопитающему терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.8 или 9. 17. Способ лечения рассеянного склероза у млекопитающих, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.8 или 9. 18. Способ лечения воспалительных заболеваний кишечника у млекопитающих, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.8 или 9. 19. Способ лечения, предотвращения или смягчения симптомов астмы, включающий введение пациенту, страдающему астмой, терапевтически эффективного количества соединения по п.1. 20. Применение соединения по любому из пп.2-7 для изготовления лекарства для лечения расстройства, опосредуемого клеточной адгезией. 21. Применение по п.19, в котором расстройство (заболевание) выбрано из группы,включающей астму, рассеянный склероз, аллергический ринит, аллергический конъюнктивит,воспаление легких, множественные миеломы,септический артрит, диабет типа 1, отторжение трансплантируемого органа и воспалительные заболевания кишечника. 22. Применение по п.21, в котором расстройством является рассеянный склероз. 23. Применение по п.21, в котором расстройством являются воспалительные заболевания кишечника.
МПК / Метки
МПК: C07D 207/16, A61K 31/40, A61P 11/06
Метки: адгезии, интегрином, альфа4бета1, клеточной, r)-n-[[4-[[(2-метилфениламино)карбонил]амино]фенил]ацетил]-l-пропил-3, качестве, метил, опосредуемой, применение, бета-аланин, ингибитора
Код ссылки
<a href="https://eas.patents.su/25-2988-r-n-4-2-metilfenilaminokarbonilaminofenilacetil-l-propil-3-metil-beta-alanin-i-ego-primenenie-v-kachestve-ingibitora-kletochnojj-adgezii-oposreduemojj-integrinom-alfa4beta1.html" rel="bookmark" title="База патентов Евразийского Союза">(r)-n-[[4-[[(2-метилфениламино)карбонил]амино]фенил]ацетил]-l-пропил-3- метил- бета-аланин и его применение в качестве ингибитора клеточной адгезии, опосредуемой интегрином альфа4бета1</a>
Предыдущий патент: Асимметрический способ получения бензоксазинонов
Следующий патент: Способ и аппаратура для перевода с одного языка на другой
Случайный патент: Модуляторы рецепторов глюкокортикоидов












