Производные 4-(диарилметил)-1-пиперазинила
Номер патента: 7794
Опубликовано: 27.02.2007
Авторы: Чокши Хемант Ашвинбхай, Читтури Тринадха Рао, Теннати Раджаманнар, Мидха Аджай Соханлал
Формула / Реферат
1. Соединение формулы I
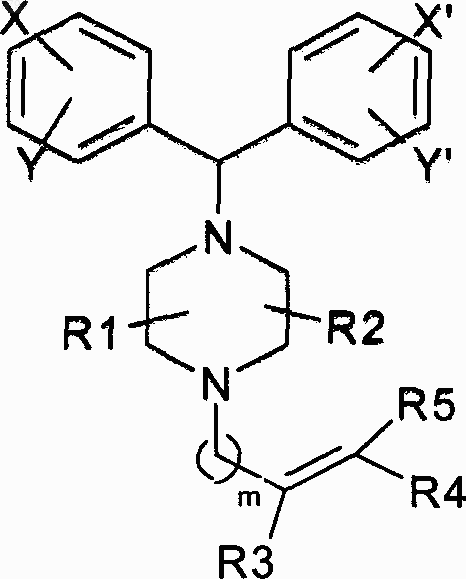
в которой X, Y, X' и Y' выбирают из водорода, галогена; замещенного или незамещенного алкила, линейного, разветвленного или циклического, алкилокси- и галоидалкильной группы; R1, R2, R3 и R4 выбирают из водорода, замещенных или незамещенных алкильных групп, линейных, разветвленных или циклических; в которой заместители R1 и R2 в пиперазинильном фрагменте находятся или в syn-, или в anti-положении друг к другу, и необязательно R3 и R4 вместе с атомами углерода, с которыми они связаны, образуют моноциклическое насыщенное или арильное, или замещенное арильное, или гетероарильное, или замещенное гетероарильное кольцо, содержащее один или несколько гетероатомов, выбранных из N, S и О, с размером кольца, находящемся в интервале от 3 до 6 атомов; при условии, что когда R3 и R4 вместе не образуют часть кольца, они могут существовать или в Е- или в Z-конфигурации; R5 представляет собой группу (CH2)n-O-CH2-CO-Z, в которой n означает число от 1 до 6; Z выбирают из ОН, OR, NRR', N(OR)R', N(R)-N(R)R' и  , где R и R' выбирают из водорода, замещенных или незамещенных алкильных групп, линейных, разветвленных или циклических, и В выбирают из -(СН2)n- (n равно 1-6) и -(CH2)x-D-(CH2)y, где D представляет собой О, NR, S или SO2, x и у независимо означают числа от 1 до 6; и m выбирают из чисел от 1 до 6; и их фармацевтически приемлемые соли.
, где R и R' выбирают из водорода, замещенных или незамещенных алкильных групп, линейных, разветвленных или циклических, и В выбирают из -(СН2)n- (n равно 1-6) и -(CH2)x-D-(CH2)y, где D представляет собой О, NR, S или SO2, x и у независимо означают числа от 1 до 6; и m выбирают из чисел от 1 до 6; и их фармацевтически приемлемые соли.
2. Соединение по п.1, в котором X, Y, X' и Y' выбирают из водорода, хлора и фтора;
R1 и R2 представляют собой водород;
R3 и R4 означают водород, причем существуют в Е- или Z-конфигурации или необязательно, когда они находятся в Z-конфигурации, R3 и R4 вместе с атомами углерода, с которыми они связаны, образуют бензольное кольцо; и
R5 означает группу CH2-O-CH2-CO-Z, в которой Z выбирают из ОН и OR, где R может быть выбран из метила, этила и изопропила; и
m означает 1.
3. {4-{4-[бис-(4-Фторфенил)метил]пиперазин-1-ил}-(Z)-бут-2-енилокси}уксусная кислота или ее фармацевтически приемлемая соль.
4. {4-[4-[(4-Хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2-енилокси}уксусная кислота или ее фармацевтически приемлемая соль.
5. [4-(4-Бензгидрилпиперазин-1-ил)-(Z)-бут-2-енилокси]уксусная кислота или ее фармацевтически приемлемая соль.
6. {4-{4-[бис-(2,4-Дифторфенил)метил]пиперазин-1-ил}-(Z)-бут-2-енилокси}уксусная кислота или ее фармацевтически приемлемая соль.
7. {4-[4-[бис-(4-Хлорфенил)метил]пиперазин-1-ил]-(Z)-бут-2-енилокси}уксусная кислота или ее фармацевтически приемлемая соль,
8. Метиловый эфир {4-{4-[бис-(4-фторфенил)метил]пиперазин-1-ил}-(Z)-бут-2-енилокси}уксусной кислоты или его фармацевтически приемлемая соль.
9. Этиловый эфир {4-{4-[бис-(4-фторфенил)метил]пиперазин-1-ил}-(Z)-бут-2-енилокси}уксусной кислоты или его фармацевтически приемлемая соль.
10. Изопропиловый эфир {4-{4-[бис-(4-фторфенил)метил]пиперазин-1-ил}-(Z)-бут-2-енилокси}уксусной кислоты или его фармацевтически приемлемая соль.
11. Изопропиловый эфир {4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2-енилокси}уксусной кислоты или его фармацевтически приемлемая соль.
12. Метиловый эфир {4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2-енилокси}уксусной кислоты или его фармацевтически приемлемая соль.
13. Этиловый эфир {4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2-енилокси}уксусной кислоты или его фармацевтически приемлемая соль.
14. {2-{4-[бис-(4-Фторфенил)метил]пиперазин-1-илметил}бензилокси}уксусная кислота или ее фармацевтически приемлемая соль.
15. {2-{4-[(4-Хлорфенил)фенилметил]пиперазин-1-илметил}бензилокси}уксусная кислота или ее фармацевтически приемлемая соль.
16. {4-[4-[бис-(4-Фторфенил)метил]пиперазин-1-ил]-(Е)-бут-2-енилокси}уксусная кислота или ее фармацевтически приемлемая соль.
17. {4-[4-[(4-Хлорфенил)фенилметил]пиперазин-1-ил]-(Е)-бут-2-енилокси}уксусная кислота или ее фармацевтически приемлемая соль.
18. {4-[4-[(4-Фторфенил)фенилметил]пиперазин-1-ил]-(Е)-бут-2-енилокси}уксусная кислота или фармацевтически приемлемая соль.
19. Фармацевтическая композиция, содержащая соединение формулы I по любому из пп.1-18, и фармацевтически приемлемый носитель.
Текст
007794 Область техники, к которой относится изобретение Настоящее изобретение относится к соединению формулы (I), производным 4-(диарилметил)-1 пиперазинила с алкенильным фрагментом, замещенным в положении 1 пиперазинового звена Формула I в которой X, Y, X' и Y' выбраны из атомов водорода, галогена, замещенного или незамещенного алкилаR1, R2, R3 и R4 выбраны из водорода, замещенных или незамещенных алкильных групп (линейных,разветвленных или циклических), арильных, гетероарильных групп или аралкильных групп, гетероциклов, содержащих один или несколько гетероатомов (а именно, N, S, О), замещенных или незамещенных алкенильных или алкинильных групп, содержащих 2-6 атомов углерода; в которой заместители R1 и R2 во фрагменте пиперазинила ориентированы или syn-, или anti- друг к другу, и необязательно R3 и R4 вместе с атомами углерода, с которыми они связаны, образуют моноциклическое насыщенное, или арильное, или замещенное арильное, или гетероарильное, или замещенное гетероарильное кольцо, содержащее один или несколько гетероатомов, выбранных из N, S и О, с размером кольца, находящемся в интервале от 3 до 6 атомов; при условии, что когда R3 и R4 вместе не образуют часть кольца, они могут существовать или в Е-, или в Z-конфигурации;R5 представляет собой группу (CH2)n-O-CH2-CO-Z, в которой n означает число от 1 до 6; Z выбирают из ОН, OR, NRR', N(OR)R', N(R)-N(R)R' и где R и R' выбраны из водорода, замещенных или незамещенных алкильных групп (линейных, разветвленных или циклических), арильных, гетероарильных групп или аралкильных групп, гетероциклов, содержащих один или несколько гетероатомов (а именно,N, S, О), замещенных или незамещенных алкенильных или алкинильных групп, содержащих 2-6 атомов углерода; и В выбирают из -(СН 2)n-(n равно 1-6) и -(CH2)x-D-(CH2)y, где D представляет собой О, NR, S или SO2, x и у независимо означают числа от 1 до 6; и m выбирают из чисел от 1 до 6; и их фармацевтически приемлемые соли. Группа R5 в формуле I представляет собой алкилоксиуксусную кислоту и ее производные, такие как сложный эфир, амид, гидроксамовую кислоту или гидразид. Эти соединения включают нетоксичные фармацевтически приемлемые кислотно аддитивные соли и соли, полученные из щелочных металлов,щелочно-земельных металлов или аминов, в том числе гидроксиалкиламины и полигидроксиалкиламины. Соединение настоящего изобретения представляет собой антигистаминное соединение, используемое при лечении заболеваний, опосредованных гистамином. Уровень техники В патенте США 4525358 раскрыто антигистаминное соединение - цетиризин которое применяется в качестве антиаллергического, антигистаминного, бронхорасширяющего или спазмолитического средства. Оно используется пациентами, страдающими заболеваниями, для лечения которых требуются упомянутые выше средства. Однако в нем отсутствует олефиновая боковая цепь в пиперазиновом кольце. В публикации РСТ WO 01/79188 раскрыты новые соединения формулы, которые более гидрофобны по природе, чем цетиризин, когда Y представляет собой замещенный или незамещенный карбоциклический, гетероциклический, полициклический гидрокарбонил, гетерополициклический, карбоциклический аренил, гетерополициклический аренил или теофиллиновую группу. В публикации РСТ WO 00/58295 раскрыты новые соединения формулы: для лечения астмы, аллергии и воспалительных заболеваний, в которой W или заместитель в фенильном кольце представляет собой гидроксиламин. В европейском патенте 598123 раскрыты производные пиперазина формулы которые отличаются от соединения формулы I, так как они не содержат олефиновой боковой цепи, связанной с пиперазиновым кольцом. Заявители обнаружили новые соединения, обладающие антигистаминными свойствами. Объекты изобретения Целью настоящего изобретения является предоставление соединения формулы I и его фармацевтически приемлемых солей, обладающих антигистаминными свойствами. Сущность изобретения Соединение формулы I Формула I в которой X, Y, X' и Y' выбирают из водорода, галогена; замещенного или незамещенного алкила (линейного, разветвленного или циклического), арила, алкилокси- и галоидалкильной группы;R1, R2, R3 и R4 выбирают из водорода, замещенных или незамещенных алкильных групп (линейной, разветвленной или циклической), арильных, гетероарильных групп или аралкильных групп, гетероциклов, содержащих один или несколько гетероатомов (а именно, N, S, О), замещенных или незамещенных алкенильных или алкинильных групп с числом атомов углерода от 2 до 6; в которой заместители R1 и R2 на пиперазинильном фрагменте ориентированы, или syn-, или anti- друг к другу и необязательно R3 и R4 вместе с атомами углерода, с которыми они связаны, образуют моноциклическое насыщенное, или арильное, или замещенное арильное, или гетероарильное, или замещенное гетероарильное кольцо, содержащее один или несколько гетероатомов, выбранных из N, S и О, с размером кольца, находящемся в интервале от 3 до 6 атомов; при условии, что когда R3 и R4 вместе не образуют часть кольца, они могут существовать или в Е-, или в Z-конфигурации;R5 представляет собой группу (CH2)n-O-CH2-CO-Z, в которой n означает число от 1 до 6; Z выбирают из ОН, OR, NRR', N(OR)R', N(R)-N(R)R' и, где R и R' выбраны из водорода, замещенных или незамещенных алкильных групп (линейных, разветвленных или циклических), арильных, гетероарильных групп или аралкильных групп, гетероциклов, содержащих один или несколько гетероатомов (а именно,N, S, О), замещенных или незамещенных алкенильных или алкинильных групп, содержащих 2-6 атомов углерода; и В выбирают из -(СН 2)n- (n равно 1-6) и -(CH2)x-D-(CH2)y, где D представляет собой О, NR, S или SO2, х и у независимо означают числа от 1 до 6; и m выбирают из чисел от 1 до 6; и их фармацевтически приемлемые соли.-2 007794 Подробное описание изобретения Соответственно, настоящее изобретение обеспечивает соединение формулы I Формула I в которой X, Y, X' и Y' выбирают из водорода, галогена; замещенного или незамещенного алкила (линейного, разветвленного или циклического), арила, алкилокси- и галоидалкильной группы;R1, R2, R3 и R4 выбирают из водорода, замещенных или незамещенных алкильных групп (линейной, разветвленной или циклической), арильных, гетероарильных групп или аралкильных групп, гетероциклов, содержащих один или несколько гетероатомов (а именно, N, S, О), замещенных или незамещенных алкенильных или алкинильных групп с числом атомов углерода от 2 до 6; в которой заместители R1 и R2 на пиперазинильном фрагменте ориентированы или syn-, или anti- друг к другу и необязательно R3 и R4 вместе с атомами углерода, с которыми они связаны, образуют моноциклическое насыщенное или арильное, или замещенное арильное, или гетероарильное, или замещенное гетероарильное кольцо, содержащее один или несколько гетероатомов, выбранных из N, S и О, с размером кольца в интервале от 3 до 6 атомов; при условии, что когда R3 и R4 вместе не образуют часть кольца, они могут существовать или в Е-, или в Z-конфигурации;R5 представляет собой группу (CH2)n-O-CH2-CO-Z, в которой n означает число от 1 до 6; Z выбира, где R и R' выбирают из водорода, замещенных или ют из ОН, OR, NRR', N(OR)R', N(R)-N(R)R' и незамещенных алкильных групп (линейных, разветвленных или циклических), арильных, гетероарильных групп или аралкильных групп, гетероциклов, содержащих один или несколько гетероатомов (а именно, N, S, О), замещенных или незамещенных алкенильных или алкинильных групп, содержащих 2-6 атомов углерода; и В выбирают из -(СН 2)n- (n равно 1-6) и -(CH2)x-D-(CH2)y, где D представляет собой О,NR, S или SO2, x и у независимо означают числа от 1 до 6; и m выбирают из чисел от 1 до 6; и их фармацевтически приемлемые соли. Соединение настоящего изобретения, в котором R3 и R4 вместе с атомами углерода, с которыми они связаны, образуют моноциклическое насыщенное, или арильное, или замещенное арильное, или гетероарильное, или замещенное гетероарильное кольцо, содержащее один или несколько гетероатомов,выбранных из N, S и О, с размером кольца, находящемся в интервале от 3 до 6 атомов, обозначено в настоящем описании как соединение формулы II Формула II Предпочтительным соединением формулы II является соединение, в котором кольцо представляет собой бензольное кольцо-3 007794 Соединение настоящего изобретения, в котором R3 и R4 находятся в Е-конфигурации, обозначено в настоящем описании как соединение формулы III Формула III Предпочтительным является соединение формулы I, в которой X, Y, X' и Y' выбирают из водорода,хлора и фтора;R5 представляет собой группу CH2-O-CH2-CO-Z, в которой Z выбирают из ОН и OR, где R может быть выбран из метила, этила и изопропила; и m означает 1. Соединения настоящего изобретения могут быть получены с использованием различных схем синтеза. Например, как продемонстрировано на схемах 1-4. В способе, показанном на схеме 1: Схема 1 Формула IV в которой X,Y,X', Y', R1 и R2 такие, как указано выше, N-алкилируют соединением формулы V, в которой L представляет собой отщепляемую группу, выбранную из галоидной, или алкильной, или арилсульфонатной группы, например, метансульфонат или п-толуолсульфонат и т.п., чтобы получить соединение формулы VI Формула VI которое затем взаимодействует с соединением X1CH2COZ, где X1 является галоидной группой, такой как хлоро-, с образованием соединения формулы I. Исходный продукт, соединение формулы IV, может быть приготовлен способом, известным из уровня техники, таким как описано Baltzly, R. и др., J. Org. Chem., 14, 775, 1949; Yung, D.K и др. J. Pharm.Sci., 67(7), 1978. В способе, показанном на схеме 2 Схема 2 соединение формулы I, в которой R3 и R4 вместе образуют кольцо, выбранное из циклического арила или замещенного арила, гетероциклических арильных групп или замещенных гетероциклических арильных групп, содержащих один или несколько гетероатомов (а именно, N, S, О), с размером кольца, выбранным в интервале от 3 до 6 атомов, обозначенное в настоящем описании как соединение формулы II,может быть получено по способу, который аналогичен описанному выше, в котором соединение формулы IV N-алкилируется соединением формулы VII, в которой L представляет собой удаляемую группу,выбранную из галоидной или алкильной, или арилсульфонатной группы, например, метансульфоната или п-толуолсульфоната и т.п., для того чтобы получить соединение формулы VIII Формула VIII которое затем взаимодействует с соединением X1CH2COZ, в котором X1 означает галоидную группу,такую как хлоро-, с образованием соединения формулы I. В способе, показанном на схеме 3: соединение формулы I, в которой R3 и R4 означают водород и находятся в Е- или Z-конфигурации, может быть получено путем N-алкилирования соединения формулы IV с соединением формулы IX формула X в котором Р может представлять собой Н или любую защитную группу, такую как ацетат, с образованием соединения формулы X, которое восстанавливают, чтобы получить соединение формулы XI. Затем соединение формулы XI, после удаления защитной группы, если это необходимо, взаимодействует с соединением X1CH2COZ, в котором X1 означает галоидную группу, такую как хлоро-, чтобы получить соединение формулы I. формула XI В способе, показанном на схеме 4 Схема 4 соединение формулы I, в которой R3 и R4 находятся в E-конфигурации, может быть получено путем Nалкилирования соединения формулы IV соединением формулы XII с получением соединения формулыXIII, которое затем восстанавливают, для того чтобы получить соединение формулы XIV. Формула XIII Соединение формулы XIV обрабатывают соединением X1CH2COZ, в котором X1 представляет собой галоидную группу, такую как хлоро-, для того чтобы получить соединение формулы I. Формула XIV В другом аспекте настоящее изобретение относится к составу соединения формулы I в подходящей форме, которую можно вводить пациенту. Соединения настоящего изобретения могут быть предоставлены в виде фармацевтической композиции для использования при лечении заболеваний, опосредованных гистамином. Эта композиция содержит соединение формулы I и фармацевтически приемлемые компоненты. Такие композиции могут быть получены путем смешивания соединения формулы I и фармацевтически приемлемых компонентов. Обычно эти композиции предназначены для орального введения. Тем не менее, они могут быть предназначены для других способов введения, например парентерального,подъязычного, введения через кожу (трансдермального) или офтальмологического. Композиции могут иметь форму таблеток, капсул, порошков, гранул, спреев для носа, аэрозолей,лепешек, мазей, кремов, трансдермальных пластырей, восстанавливаемых порошков или жидких препаратов, таких как оральные или стерильные растворы или суспензии. С целью достижения совместимости при введении, предпочтительно, чтобы композиция согласно изобретению находилась в форме единичной дозы. Формой единичной дозы для орального введения могут быть таблетки и капсулы, при этом они могут содержать традиционные эксципиенты, такие как связывающие агенты, например сироп, смола акации, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазка для таблетирования, например стеарат магния; разрыхлители, например крахмал, поливинилпирролидон, натрий-гликолят крахмала или микрокристаллическая целлюлоза; или фармацевтически приемлемый смачивающий агент, такой как лаурилсульфат натрия. Предпочтительно композиция находится в форме единичной дозы в количестве, целесообразном для обеспечения соответствующей суточной дозировки. Твердые оральные композиции могут быть получены традиционными методами смешения, наполнения или таблетирования, которые известны специалистам в этой области техники. С целью равномерного распределения активного вещества могут быть использованы повторные операции смешения этих композиций с использованием больших количеств наполнителей. Конечно, такие операции являются традиционными в этой области техники. На таблетки могут быть нанесены покрытия с использованием методов, которые хорошо известны в обычной фармацевтической практике. Оральные жидкие препараты могут иметь форму, например, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для разведения водой или другим подходящим носите-7 007794 лем до использования. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлоза, желатин, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, гель стеарата алюминия, гидрированные пищевые жиры; эмульгирующие агенты,например, лецитин, моноолеат сорбита, или смола акации; неводные носители (которые могут включать пищевые жиры), например миндальное масло, фракционированное кокосовое масло, масляные сложные эфиры, такие как сложные эфиры глицерина, пропиленгликоля, или этилового спирта; консерванты, например метил- или пропил-п-гидроксибензоат или сорбиновая кислота; и, по желанию, традиционные вкусовые или окрашивающие агенты. Жидкие формы единичной дозы для парентерального введения готовят с использованием соединения и стерильного носителя, причем, в зависимости от применяемой концентрации, они могут быть или суспендированы, или растворены в носителе. При получении растворов соединения могут быть растворены в воде для инъекции, и фильтрат стерилизуют, прежде чем заполнить им подходящий пузырек или ампулу и герметизировать. Преимущественно, адьюванты, такие как местные анестетики, консерванты и буферные агенты, могут быть растворены в носителе. С целью повышения стабильности композиция может быть заморожена после заполнения ампулы, и вода удалена в вакууме. Для офтальмологического введения может быть приготовлен стерильный раствор или суспензия. Офтальмологический раствор может быть приготовлен путем растворения соединения в воде для инъекции вместе с подходящим консервантом, хелатным агентом, осмотическим агентом, средством, повышающим вязкость, антиоксидантом и буферным агентом. Раствор фильтруют в стерильных условиях и заполняют им подходящий пузырек или ампулу из подходящего материала. Аналогично может быть приготовлена суспензия путем антисептического диспергирования стерильного соединения в стерильном водном носителе, содержащем подходящий консервант, хелатный агент, осмотический агент, суспендирующее средство, антиоксидант и буферный агент. Кроме того, аналогичным образом могут быть получены единичные дозировки, не содержащие консервант, в виде раствора или суспензии, и ими стерильно заполняют контейнеры для единичных дозировок. Композиции могут содержать от 0,1 до 99,0%, предпочтительно от 10 до 60% в расчете на вес активного вещества в зависимости от способа введения. При желании композиция может находиться в виде упаковки с сопроводительной инструкцией по ее использованию. Соединение формулы I в виде композиции применяется для лечения различных заболеваний, опосредованных гистамином. Для соединений, полученных согласно настоящему изобретению, были найдены значения IC50 (концентрация, вызывающая 50% ингибирование). Примеры Пример 1. 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2-ен-1-ол, (VIa, X=X'=4-F;Y=Y'=R1=R2=R3=R4=H; m=n=l) Раствор, содержащий 1-[бис-(4-фторфенил)метил]пиперазин (140 г, 0,485 моль), толуол (700 мл), 4 хлор-2-бутен-1-ол (67,25 г, 0,631 моль) и диизопропилэтиламин (125,8 г, 0,971 моль), перемешивают при 47-49 С в течение 5 ч. В реакционную смесь добавляют воду (350 мл), отделяют органический слой, и водный слой экстрагируют дихлорметаном (2 раза по 200 мл). Объединенные органические слои промывают водой (200 мл) и концентрируют, для того чтобы получить сырой продукт, который очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь дихлорметан-метанол (9,6:0,4) в качестве подвижной фазы, получая чистый продукт. Спектр 1 Н-ЯМР (CDCl3, , ч./млн): 2,15-2,80 (m, 8H), 3,01 (d, J=4,90 Гц, 2H), 4,13 (d, J=3,96 Гц, 2 Н),4,20 (s, 1 Н), 5,55-5,75 (m, 1H), 5,75-6,00 (m, 1H), 6,96 (t, 1=8,14 Гц, 4 Н), 7,20-7,40 (m, 4H). Пример 2. (R,S)-4-4-[(4-хлорфенил)фенилметил]пиперазин-1-ил-(Z)-бут-2-eн-1-ол [VIb(R,S),X=C1; X'=Y=Y'=R1=R2=R3=R4=H; m=n=l](R,S)-4-4-[(4 хлорфенил)фенилметил]пиперазин-1-ил-(Z)-бут-2-ен-1-ол таким же образом, как в примере 1. Неочищенный продукт получают в виде сиропообразной массы, которую очищают методом флэшхроматографии на колонке с силикагелем, используя смесь толуол-метанол (9:1) в качестве подвижной фазы, чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,10-2,90 (m, 8H), 3,01 (d, J=5,75IX 2H), 4,13 (d, 1=5,25 Гц, 2 Н), 4,19 (s,1 Н), 5,50-5,75 (т, 1H), 5,75-6,00 (т, 1 Н), 7,00-7,40 (т, 9 Н). Пример 3. 4-4-бензгидрилпиперазин-1-ил-(Z)-бут-2-ен-1-ол,(VIc,X=X'=Y=Y'=H;R1=R2=R3=R4=H; m=n=l) Раствор, содержащий 1-бензгидрилпиперазин (3 г, 0,0119 моль), толуол (20 мл), 4-хлор-2-бутен-1 ол (1,65 г, 0,0155 моль), диизопропилэтиламин (3,81 г, 0,0295 моль) и диметилформамид (ДМФ) (3 мл),перемешивают при 55-60 С в течение 5 ч. Реакционную смесь выливают в ледяную воду (20 мл), отделяют органический слой и водный слой экстрагируют дихлорметаном (2 раза по 20 мл). Органический экстракт промывают водой (10 мл) и концентрируют, получая сырой продукт, который очищают мето-8 007794 дом флэш-хроматографии на колонке с силикагелем, используя смесь дихлорметан-метанол (9,3:0,7) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,10-2,80 (m, 8 Н), 3,01 (d, J=5,52 Гц, 2 Н), 4,13 (dd, J1=5,19 Гц, J2=0,68 Гц,2 Н), 4,21 (s, 1H), 5,50-5,75 (m, 1 Н), 5,75-6,00 (m, 1H), 7,00-7,50 (m, 10 Н). Пример 4. 4-4-[бис-(2,4-дифторфенил)метил]пиперазин-1-ил-(Z)-бут-2-eн-1-ол,(VId,X=X'=Y=Y'=F; R1=R2=R3=R4=H; m=n=l) 1-[бис-(2,4-дифторфенил)метил]пиперазин (20,0 г, 0,0617 моль) превращают в 4-4-[бис-(2,4 дифторфенил)метил]пиперазин-1-ил-(Z)-бут-2-ен-1-ол таким же образом, как в примере 1. Сырой продукт получается в виде сиропообразной массы, которую очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (9:1) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,20-2,85 (m, 8 Н), 3,02 (dd, J1=6,00 Гц, J2=0,74 Гц, 2 Н), 4,14 (dd, J1=5,31 Гц, J2=0,98 Гц, 2 Н), 4,94 (s, 1 Н), 5,50-5,75 (m, 1H), 5,75-6,00 (m, 1 Н), 6,55-7,00 (m, 4 Н), 7,30-7,60 (m, 2 Н). Пример 5. 4-4-[бис-(4-хлорфенил)метил]пиперазин-1-ил-(Z)-бут-2-ен-1-ол, (VIe, Х=Х'=Сl;(5,044 г) превращают в 4-4-[бис-(4 хлорфенил)метил]пиперазин-1-ил-(Z)-бут-2-ен-1-ол таким же образом, как в примере 1. Полученный сырой продукт очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (9:1) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,10-2,80 (m, 8 Н), 3,01 (d, J=5,8 Гц, 2 Н), 4,13 (dd, J1=5,26 Гц, J2=0,88, 2 Н),4,18 (s, 1 Н), 5,50-5,75 (m, 1H), 5,75-6,00 (m, 1H), 7,00-7,40 (m, 8H). Пример 6. 2-4-[бис-(4-фторфенил)метил]пиперазин-1-илметилфенилметанол (Villa, X=X'=F;Y=Y'=R1=R2=H; m=n=l, A= бензольное кольцо) 1-[бис-(4-хлорфенил)метил] пиперазин (5,0 г, 0,0173 моль) превращают в 2-4-[бис-(4 фторфенил)метил]пиперазин-1-илметилфенилметанол, используя 2-(хлорметил)бензиловый спирт,таким же образом, как в примере 1. Полученный сырой продукт (коричневато-желтый сироп) очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (9,2:0,8) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,00-2,80 (m, 8H), 3,6 (s, 2H), 4,18 (s, 1H), 4,57 (s, 2H), 6,70-7,03 (m, 4 Н),7,05-7,40 (m, 8 Н). Пример 7. 2-4-[(4-хлорфенил)фенилметил]пиперазин-1-илметилфенилметанол (VIIIb, X=C1;X'=Y=Y'=R1=R2-H; m=n=l, A= бензольное кольцо) 1-[бис-(4-хлорфенил)метил]пиперазин (4,0 г, 0,0140 моль) превращают в 2-4-[(4 хлорфенил)фенилметил]пиперазин-1-илметилфенилметанол таким же образом, как в примере 1. Полученный сырой продукт очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (9,2:0,8) в качестве подвижной фазы, для того чтобы получить чистый продукт в виде белого пенистого твердого вещества. 1 Н-ЯМР (CDCl3, , ч/млн): 2,00-2,80 (m, 8H), 3,60 (s, 2H), 4,16 (s, 1H), 4,56 (s, 2H), 6,86 (шир., может замещаться D2O), 6,95-7,40 (m, 13H). Пример 8. 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-бут-2-ин-1-ол(1800 мл) и диизопропилэтиламин (242,1 г, 1,873 моль), по каплям добавляют 4-хлор-2-бутин-1-ол (130,5 г, 1,248 моль) в течение 1 ч при 10-15 С. После перемешивания при 10-15 С в течение 1,5 ч температуру смеси постепенно повышают до 25-30 С и дополнительно перемешивают 7 ч. После этого добавляют раствор лимонной кислоты (437,3 г, 2,08 моль) в воде (500 мл) и смесь концентрируют при пониженном давлении при температуре ниже 60 С, чтобы удалить большую часть растворителя. Полученную водную массу промывают толуолом (2 раза по 400 мл), подкисляют до рН 9-10, и продукт экстрагируют дихлорметаном (2 раза по 400 мл). Дихлорметановый слой промывают водой (300 мл) и дегазируют, получая сырой продукт, который очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (9:1) в качестве подвижной фазы. 1 Н-ЯМР (CDCl3, , ч./млн): 1,84 (шир., 1H, может замещаться D2O), 2,20-2,80 (m, 8H), 3,31 (t, J=1,84 Гц, 2 Н), 4,21 (s, 1 Н), 4,29 (t, J=1,80 Гц, 2H), 6,80-7,05 (m, 4H), 7,10-7,50 (m, 4H). Способ В: с использованием 2-бутин-1,4-диола Раствор метансульфонилхлорида (48,69 г, 0,425 моль) в тетрагидрофуране (100 мл) добавляют по каплям к перемешиваемому раствору 2-бутин-1,4-диола (100 г, 1,162 моль) и диизопропилэтиламина(62,45 г, 0,483 моль) в тетрагидрофуране (400 мл) в течение 2 ч при температуре 0-5 С. После перемешивания в течение 1 ч при 0-5 С температуру повышают до 25-30 С и смесь перемешивают еще 1 ч. Затем реакционную смесь охлаждают до 10-15 С, добавляют к ней диизопропилэтиламин (99,34 г, 0,769 моль) и после этого 1-[бис-(4-фторфенил)метил]пиперазин (110,81 г, 0,384 моль) по частям в течение 30 мин.-9 007794 Реакционную смесь перемешивают при температуре 10-15 С в течение 1 ч и затем при 25-30 С еще 8 ч. В смесь добавляют толуол (500 мл) и промывают водой (2 раза по 400 мл). После этого добавляют раствор лимонной кислоты (161,52 г, 0,769 моль) в воде (500 мл) и смесь концентрируют при пониженном давлении при температуре ниже 60 С, для того чтобы удалить большую часть растворителя. Образовавшуюся водную массу промывают гексаном (2 раза по 250 мл), подщелачивают до рН=9-10 и продукт экстрагируют этилацетатом (2 раза по 300 мл). Этилацетатный слой промывают водой (200 мл) и дегазируют, получая сырой продукт, который очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (9,3:0,7) в качестве подвижной фазы, для того чтобы получить чистый продукт. Пример 9. (R,S)-4-4-[(4-хлорфенил)фенилметил]пиперазин-1-илбут-2-ин-1-ол (по способу А в примере 10), (Хb, Х=Сl; X'=Y=Y'=R1=R2=H; m=l) Раствор, содержащий (R,S)-1-[(4-хлорфенил)фенилметил]пиперазин (10 г, 0,0349 моль), толуол (50 мл), 4-хлор-2-бутин-1-ол (4,74 г, 0,0453 моль) и диизопропилэтиламин (9,02 г, 0,0698 моль), перемешивают при 45-50 С в течение 6 ч. Реакционную смесь выливают в ледяную воду (20 мл). Отделяют органический слой, и водный слой экстрагируют дихлорметаном (2 раза по 30 мл). Органические слои промывают водой (20 мл) и концентрируют, получая сырой продукт в виде сиропообразной массы, которую очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь дихлорметанметанол (9,6:0,4) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 1,88 (шир., 1 Н), 2,20-2,75 (m, 8 Н), 3,31 (t, J=1,72 Гц, 2 Н), 4,20 (s, 1 Н),4,29 (t, J=1,63 Гц, 2 Н), 7,05-7,50 (m, 9 Н). Пример 10. (R,S)-4-4-[(4-фторфенил)фенилметил]пиперазин-1-илбут-2-ин-1-ол (по способу В в примере 10) (Хс, X=F; X'=Y=Y'=R1=R2=H; m=l) Раствор метансульфонилхлорида (1,86 г, 16,27 ммоль) в тетрагидрофуране (5 мл) добавляют по каплям в перемешиваемый раствор 2-бутин-1,4-диола (3,82 г, 44,3 ммоль) и диизопропилэтиламина (6,30 г,48,8 ммоль) в тетрагидрофуране (20 мл) в течение 30 мин при температуре 0-5 С. После 1 ч перемешивания температуру повышают до 25-30 С и смесь перемешивают еще 1 ч. Полученную смесь, содержащую мезилат 2-бутин-1,4-диола, добавляют по каплям в перемешиваемый раствор (R,S)-l-[(4 фторфенил)фенилметил]пиперазина (4,0 г, 14,79 моль) в тетрагидрофуране (25 мл) в течение 1 ч при 510 С. Реакционную смесь перемешивают при температуре 5-10 С в течение 1 ч и затем при 25-30 С еще в течение 5 ч. После этого добавляют лимонную кислоту (3,2 г, 0,01523 моль) и смесь концентрируют при пониженном давлении при температуре ниже 60 С, для того чтобы удалить большую часть растворителя. В оставшуюся массу добавляют воду (50 мл) и образовавшийся водный слой промывают гексаном (2 раза по 30 мл), подщелачивают до рН=9-10 и продукт экстрагируют дихлорметаном (3 раза по 30 мл). Дихлорметановый слой промывают водой (25 мл) и дегазируют, получая сырой продукт в виде клейкого твердого вещества, которое очищают методом флэш-хроматографии на колонке с силикагелем,используя смесь дихлорметан-метанол (9,2:0,8) в качестве подвижной фазы, для того чтобы получить чистый продукт в виде густой сиропообразной массы. 1 Н-ЯМР (CDCl3, , ч./млн): 1,87 (b), 2,25-2,70 (m, 8 Н), 3,30 (t, J=1,83 Гц, 2 Н), 4,21 (s, 1 Н), 4,29 (t,J=1,78 Гц, 2 Н), 6,85-7,02 (m, 2 Н), 7,13-7,42 (m, 7 Н). Пример 11. 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Е)-бут-2-ен-1-ол (XIVa, X=X'=4-F;Y=Y'=R1=R2-R3=R4=H; m=n=l) В перемешиваемый раствор метилового эфира 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Е)бут-2-еновой кислоты (380 г, 0,984 моль) в тетрагидрофуране (1900 мл) при температуре от -10 до 0 С добавляют по каплям 20%-ный раствор диизобутилалюминийгидрида (560 г, 3,938 моль) в толуоле приблизительно в течение 2-3 ч. По окончании добавления реакционную смесь перемешивают еще в течение 1,0 ч при температуре от 0 до 10 С и затем охлаждают, последовательно добавляя этилацетат (400 мл) и воду (800 мл). После интенсивного перемешивания в течение 2 ч смесь фильтруют. Органический слой отделяют от фильтрата, промывают водой (1500 мл) и концентрируют, получая сырой продукт. Этот сырой продукт распределяют в толуоле (2000 мл), экстрагируют 10%-ной уксусной кислотой(2000 мл), водный экстракт подщелачивают до рН 9-10 водным раствором (20%) гидроксида натрия и продукт экстрагируют дихлорметаном (3 раза по 1500 мл). Дихлорметановый слой промывают водой(800 мл) и концентрируют, получая сиропообразную массу, которую очищают методом флэшхроматографии на колонке с силикагелем, используя смесь толуол-метанол (9:1) в качестве подвижной фазы.Y=Y'=R1=R2=H; m=l). В перемешиваемый раствор 4-4-[бис-(4-фторфенил)метил]пиперазин-1-илбут-2-ин-1-ола (135 г,0,379 моль) в тетрагидрофуране (4300 мл) при температуре 5-10 С по частям добавляют литийалюминийгидрид (43,1 г, 1,136 моль) в течение 3-4 ч. Реакционную смесь перемешивают еще в течение 5-6 ч и- 10007794 затем реакцию прерывают путем добавления этилацетата (135 мл), затем воды (100 мл) при температуре 5-10 С. Образовавшуюся смесь фильтруют, органический слой отделяют от фильтрата и концентрируют,получая сырой продукт, который очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (9:1) в качестве подвижной фазы, чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 1,77 (шир., может замещаться D2O), 2,20-2,70 (m, 8H), 3,00 (d, J=4,91 Гц,2 Н), 4,11 (d, J=3,71 Гц, 2H), 4,21 (s, 1H), 5,55-5,90 (m, 2H), 6,80-7,05 (m, 4H), 7,10-7,50 (m,4H). Пример 13. (R,S)-4-4-[(4-хлорфенил)фенилметил]пиперазин-1-ил-(Е)-бут-2-ен-1-ол, (XIb, X=C1;(R,S)-4-4-[(4-хлорфенил)фенилметил]пиперазин-1-илбут-2-ин-1-ол (3,5 г) превращают в (R,S)-44-[(4-хлорфенил)фенилметил]пиперазин-1-ил-(Е)-бут-2-ен-1-ол таким же образом, как в примере 14. Сырой продукт получают в виде сиропообразной массы, которую очищают методом флэшхроматографии на колонке с силикагелем, используя смесь толуол-метанол (9:1) в качестве подвижной фазы, чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,20-2,65 (m, 8 Н), 3,00 (d, J=4,83 Гц, 2 Н), 4,11 (d, J=3,52 Гц, 2 Н), 4,20 (s,1 Н), 5,60-5,90 (m, 2 Н), 7,00-7,50 (m, 9 Н). Пример 14. (R,S)-4-4-[(4-фторфенил)фенилметил]пиперазин-1-ил-(Е)-бут-2-ен-1-ол (XIc, X=F;(R,S)-4-4-[(4-фторфенил)фенилметил]пиперазин-1-илбут-2-ин-1-ол (2,13 г, 0,0063 моль) превращают в (R,S)-4-4-[(4-фторфенил)фенилметил]пиперазин-1-ил-(Е)-бут-2-ен-1-ол таким же образом, как в примере 14. Сырой продукт получают в виде сиропообразной массы, которую очищают методом флэшхроматографии на колонке с силикагелем, используя смесь дихлорметан-метанол (9,3:0,7) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 1,71 (шир., может замещаться D2O), 2,10-2,70 (m, 8H), 3,00 (d, J=5,23 Гц,2 Н), 4,11 (d, J=4,20 Гц, 2 Н), 4,22 (s, 2H), 5,65-5,90 (m, 2H), 6,85-7,02 (m, 2 Н), 7,10-7,45 (m,7H). Пример 15. Метиловый эфир 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Е)-бут-2-еновой кислоты (ХIIIа, X=X'=4-F; R=CH3; Y=Y'=R1=R2=R3=R4=H; m=n=l) Раствор метилового эфира 4-бромкротоновой кислоты (46,56 г, 0,260 моль) в толуоле (50 мл) добавляют по каплям к смеси, содержащей 1-[бис-(4-фторфенил)метил]пиперазин (50 г, 0,173 моль), диизопропилэтиламин (49,30 г, 0,381 моль) в толуоле (250 мл), при температуре 25-30 С в течение 30 мин. После перемешивания в течение 8 ч реакционную смесь последовательно промывают водой (2 раза по 150 мл), 0,2 н. соляной кислотой (3 раза по 150 мл) и водой (150 мл). В органический слой при температуре 5-10 С добавляют 3 н. соляную кислоту (200 мл), смесь перемешивают и отделяют водный слой, содержащий продукт. Затем его промывают толуолом (200 мл), подщелачивают до рН= 9-10 20%-ным раствором гидроксида натрия и продукт экстрагируют этилацетатом (2 раза по 150 мл). Органический слой промывают 1 раз водой (100 мл), концентрируют и дегазируют. Остаток растирают в порошок в гексане(150 мл) и отфильтровывают твердое вещество. Продукт дополнительно очищают путем перекристаллизации из циклогексана. 1 Н-ЯМР (CDCl3, , ч./млн): 1,63 (шир., 1H, может замещаться D2O), 2,20-2,65 (m, 8 Н), 3,13 (d,J=5,00 Гц, 2 Н), 3,72 (s, 3 Н), 4,22 (s, 1 Н), 5,88-6,03 (m, 1H), 6,80-7,05 (m, 5H), 7,20-7,40 (m, 4H). Пример 16. Метиловый эфир 4-4-[(4-хлорфенил)фенилметил]пиперазин-1-ил-(Е)-бут-2-еновой кислоты (ХIIIb, Х=С 1; X'=Y=Y'=R1=R2=R3=R4=H; m=n=l) Раствор, содержащий (R,S)-1-[(4-хлорфенил)фенилметил]пиперазин (5 г, 0,0174 моль), ДМФ (30 мл), метиловый эфир 4-бромкротоновой кислоты (4,7 г, 0,0263 моль) и диизопропилэтиламин (6,75 г,0,0522 моль), перемешивают при температуре 27-30 С в течение 6 ч. Реакцию прерывают, добавляя воду(40 мл), и продукт экстрагируют дихлорметаном (3 раза по 30 мл). Органический слой промывают водой(2 раза по 30 мл) и концентрируют, получая сырой продукт, который очищают методом флэшхроматографии на колонке с силикагелем, используя смесь этилацетат-гексан (6,5:3,5) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,20-2,65 (m, 8 Н), 3,14 (dd, J1=6,20 Гц, J2=1,39 Гц, 2 Н), 3,72 (s, 3 Н), 4,20(s, 1 Н), 5,85-6,05 (m, 1H), 6,8-7,05 (m, 1 Н), 7,05-7,50 (m, 9 Н). Пример 17. Дигидрохлорид 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2 енилоксиуксусной кислоты, (Iа) В перемешиваемый раствор 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2-ен-1-ол (97,0 г, 0,271 моль) и трет-бутоксида калия (54,7 г, 0,487 моль) в безводном трет-бутаноле (776 мл), нагретом до 60-65 С, в течение 1 ч добавляют в атмосфере азота сухой хлорацетат натрия (63 г, 0,541 моль). Затем реакционную смесь кипятят с обратным холодильником еще в течение 5 ч. Затем смесь концентрируют при пониженном давлении при температуре ниже 60 С, пока трет-бутанол полностью не удалится. Остаток диспергируют в воде (800 мл) и промывают этилацетатом (2 раза по 500 мл). Затем водный раствор подкисляют до рН 5-6, экстрагируют дихлорметаном (3 раза по 500 мл), промывают дихлорметановый слой водой (300 мл) и концентрируют, получая сырой продукт, который очищают методом флэш- 11007794 хроматографии на колонке с силикагелем, используя смесь толуол-метанол (4:1) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,40-2,80 (m, 4 Н), 2,80-3,20 (m, 4 Н), 3,65 (d, J=7,51 Гц, 2 Н), 3,96 (s, 2 Н),4,19 (d, J= 4,51 Гц, 2 Н), 4,32 (s, 1 Н), 5,00-5,30 (m, 1 Н), 5,30-6,10 (m, 1 Н), 6,80-7,05 (m, 4 Н), 7,00-7,50 (m,4 Н) Суспензию 4-[4-[бис-(4-фторфенил)метил]пиперазин-1-ил]-(Z)-бут-2-енилоксиуксусной кислоты(83,8 г, 0,201 моль) в воде (335 мл) при перемешивании при 25-30 С подкисляют 6 н. соляной кислотой до рН 1-2. Раствор фильтруют, концентрируют при пониженном давлении при температуре ниже 50 С (пока объем раствора не составит приблизительно 170 мл) и подвергают лиофилизации, для того чтобы получить дигидрохлоридсодержащую соль. Пример 18. Дигидрохлорид (R,S)-4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2 енилоксиуксусной кислоты [Ib (R,S)].(R,S)-4-4-[(4-хлорфенил)фенилметил]пиперазин-1-ил-(Z)-бут-2-eн-1-ол (100,0 г, 0,28 моль) превращают в (R,S)-4-[4-[(4-хлорфенил)фенилметил]шшеразин-1-ил]-(Z)-бут-2-енилоксиуксусную кислоту таким же образом, как в примере 19. Полученный сырой продукт представляет собой пенистое твердое вещество, которое очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (4:1) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,40-2,75 (m, 4 Н), 2,75-3,20 (m, 4 Н), 3,62 (d, J=7,43 Гц, 2 Н), 3,95 (s, 2 Н),4,17 (d, J= 4,9 Гц, 2 Н), 4,28 (s, 1H), 5,50-5,80 (m, 1H), 5,80-6,1 (m, 1 Н), 6,95-7,40 (m, 9 Н), 8,98 (шир., может замещаться D2O). Продукт превращают в дигидрохлоридсодержащую соль, как в примере 17. Пример 19. Дигидрохлорид [4-(4-бензгидрилпиперазин-1-ил)-(Z)-бут-2-енилокси]уксусной кислоты(Iс) 4-(4-бензгидрилпиперазин-1-ил)-(Z)-бут-2-ен-1-ол (2,1 г, 0,0065 моль) превращают в [4-(4 бензгидрилпиперазин-1-ил)-(Z)-бут-2-енилокси]уксусную кислоту таким же образом, как в примере 17. Сырой продукт, полученный в виде пенистого твердого вещества, очищают методом флэшхроматографии на колонке с силикагелем, используя смесь толуол-метанол (8,5:1,5) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,40-2,85 (m, 4 Н), 2,85-3,20 (m, 4 Н), 3,68 (d, J=7,53 Гц, 2 Н), 3,96 (s, 2 Н),4,18 (d, J= 4,60 Гц, 2 Н), 4,33 (s, 1 Н), 5,50-5,80 (m, 1H), 5,90-6,10 (m, 1 Н), 7,00-7,50 (m, 10 Н) Продукт превращают в дигидрохлоридсодержащую соль, как в примере 19. Пример 20. Дигидрохлорид 4-4-[бис-(2,4-дифторфенил)метил]пиперазин-1-ил-(Z)-бут-2 енилоксиуксусной кислоты (Id). 4-4-[бис-(2,4-дифторфенил)метил]пиперазин-1-ил-(Z)-бут-2-ен-1-ол (6,2 г, 0,0157 моль) превращают в 4-4-[бис-(2,4-дифторфенил)метил]пиперазин-1-ил-(Z)-бут-2-енилоксиуксусную кислоту таким же образом, как в примере 17. Полученный сырой продукт представляет собой пенистое твердое вещество, которое очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (4:1) в качестве подвижной фазы, чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,20-2,75 (m, 4 Н), 2,75-3,20 (m, 4 Н), 3,57 (d, J=6,07 Гц, 2 Н), 3,96 (s, 2 Н),4,17 (d, J=3,90 Гц, 2 Н), 4,99 (s, 1H), 5,50-6,10 (m, 2H), 6,45-7,0 (m, 4H), 7,20-7,65 (m, 2H), 9,87 (шир.) Продукт диспергируют в этилацетате (12 мл), подкисляют раствором НСl в безводном этилацетате до значения рН от 1,0 до 2,0, концентрируют и дегазируют, получая дигидрохлоридсодержащую соль. Пример 21. Дигидрохлорид 4-[4-[бис-(4-хлорфенил)метил]пиперазин-1-ил]-(2)-бут-2 енилоксиуксусной кислоты (Iе) 4-4-[бис-(4-хлорфенил)метил]пиперазин-1-ил-(Z)-бут-2-eн-1-ол (2,26 г) превращают в 4-[4-[бис(4-хлорфенил)метил]пиперазин-1-ил]-(Z)-бут-2-енилоксиуксусную кислоту таким же образом, как в примере 17. Полученный сырой продукт очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (4:1) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,50-2,80 (m, 4 Н), 2,80-3,20 (m, 4 Н), 3,60 (d, J=7,38 Гц, 2 Н), 3,94 (s, 2 Н),4,20 (d, J=4,08 Гц, 2 Н), 4,31 (s, 1H), 5,23 (шир., может замещаться D2O), 5,50-5,80 (m, 1 Н), 5,80-6,10 (m,1H), 7,10-7,40 (m, 8H). Продукт превращают в дигидрохлоридсодержащую соль, как в примере 17. Пример 22. Метиловый эфир 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2-енилокси уксусной кислоты, дигидрохлорид, (If) В перемешиваемый раствор 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2 енилоксиуксусной кислоты (35 г, 0,084 моль) в метаноле (560 мл) добавляют раствор НСl в безводном этилацетате до рН 1-2. Раствор кипятят с обратным холодильником в течение 2 ч, охлаждают до 25-30 С и перемешивают в течение 4 ч. Кристаллы твердого вещества фильтруют, промывают этилацетатом (2 раза по 5 мл) и сушат в шкафу при температуре 60-65 С, для того чтобы получить продукт. Н-ЯМР (D2O, , ч./млн): 3,20-3,60 (m, 8 Н), 3,64 (s, 3 Н), 3,94 (d, J=7,66 Гц, 2 Н), 4,00-4,20 (m, 4 Н),5,31 (s, 1 Н), 5,50-5,78 (m, 1H), 5,90-6,20 (m, 1H), 6,85-7,15 (m, 4 Н), 7,30-7,60 (m, 4 Н). Пример 23. Этиловый эфир 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2 енилоксиуксусной кислоты, дигидрохлорид (Ig) В перемешиваемый раствор 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2-енилокси уксусной кислоты (1,0 г, 0,0024 моль) в этаноле (20 мл) добавляют раствор НСl в безводном этаноле до значения рН 1-2. Раствор кипятят с обратным холодильником приблизительно в течение 2 ч, охлаждают до 25-30 С и перемешивают еще 4 ч. Кристаллическое твердое вещество отфильтровывают, промывают этанолом (2 раза по 5 мл) и сушат в шкафу при температуре 60-65 С, для того чтобы получить продукт. 1 Н-ЯМР (CDCl3 + (ДМСО-d6), , ч./млн): 1,28 (t, J=7,10 Гц, 3 Н), 2,70-4,30 (m, 17H), 5,70-6,20 (m,2 Н), 7,10 (t, J=8,62 Гц, 4 Н), 7,40-7,80 (m, 4 Н). Пример 24. Изопропиловый эфир 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2 енилокси уксусной кислоты, дигидрохлорид (In) В перемешиваемый раствор 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2-енилокси уксусной кислоты (1,0 г, 0,0024 моль) в изопропиловом спирте (20 мл) добавляют раствор НСl в безводном изопропиловом спирте, пока значение рН раствора не станет равным 1-2. Раствор кипятят с обратным холодильником приблизительно 2 ч, охлаждают до 25-30 С и перемешивают в течение 4 ч. Кристаллы твердого вещества отфильтровывают, промывают изопропиловым спиртом (2 раза по 5 мл) и сушат в шкафу при 60-65 С, для того чтобы получить 0,968 г продукта (выход 75,85%). 1 Н-ЯМР (CDCl3+ДМСО-d6, , ч./млн): 1,23 (d, J=6,25 Гц, 6 Н), 2,60-3,70 (m, 8H), 3,70-4,40 (m, 7 Н),4,80-5,20 (m, 1 Н), 5,60-5,90 (m, 1H), 5,90-6,10 (m, 1 Н), 7,16 (t, J=8,56 Гц, 4H), 7,40-7,90 (m, 4 Н). Пример 25. Изопропиловый эфир (R,S)-4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут 2-енилоксиуксусной кислоты, дигидрохлорид (Ii): Соединение получают, используя (R,S)-4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут 2-енилокси уксусную кислоту таким же образом, как в примере 24. 1 Н-ЯМР (CDCl3+ДMCO-d6, , ч./млн): 1,26 (d, J=6,26 Гц, 6 Н), 2,80-3,70 (m, 8H), 3,80-4,15 (m, 3 Н),4,21 (d, J=5,57 Гц, 4 Н), 4,90-5,15 (m, 1H), 5,70-5,95 (m, 1 Н), 5,95-6,15 (m, 1 Н), 7,10-7,90 (m, 9 Н). Пример 26. Метиловый эфир (R,S)-4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2 енилоксиуксусной кислоты, дигидрохлорид (Ij) В перемешиваемый раствор (R,S)-4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2 енилокси уксусной кислоты (1 г, 0,0024 моль) в метаноле (20 мл) добавляют безводный раствор НСl в этилацетате, пока значение рН раствора не станет равным 1-2. Раствор кипятят с обратным холодильником в течение 2 ч, охлаждают до 25-30 С, добавляют безводный диэтиловый эфир до небольшого помутнения и перемешивают в течение 4 ч. Кристаллическое твердое вещество отфильтровывают, промывают диэтиловым эфиром (2 раза по 5 мл) и сушат в шкафу при 60-65 С, для того чтобы получить продукт. 1 Н-ЯМР (CDCl3+ДMCO-d6, , ч./млн): 3,10-3,90 (m, 8H), 3,73 (s, 3 Н), 3,90-4,30 (m, 7 Н), 5,70-6,00 (m,1 Н), 6,00-6,20 (m, 1 Н), 7,10-7,50 (m, 5 Н), 7,50-8,00 (m, 4 Н). Пример 27. Этиловый эфир (R,S)-4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2 енилоксиуксусной кислоты, дигидрохлорид (Ik): Используют (R,S)-4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2-енилоксиуксусную кислоту таким же образом, как в примере 25, чтобы получить продукт. 1 Н-ЯМР (CDCl3+ДMCO-d6, , ч./млн): 1,27 (t, J=7,12 Гц, 3 Н), 3,10-3,90 (m, 8H), 3,90-4,30 (m, 9 Н),5,75-5,95 (m, 1 Н), 5,95-6,15 (m, 1 Н), 7,10-7,50 (m, 5 Н), 7,50-8,00 (m, 4 Н). Пример 28. Дигидрохлорид 2-4-[бис-(4-фторфенил)метил]пиперазин-1-илметилбензилоксиуксусной кислоты (IIа) 2-4-[бис-(4-фторфенил)метил]пиперазин-1-илметилфенилметанол (5,0 г, 0,0122 моль) превращают в 2-4-[бис-(4-фторфенил)метил]пиперазин-1-илметилбензилоксиуксусную кислоту таким же образом, как в примере 17. Полученный сырой продукт очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (8,5:1,5) в качестве подвижной фазы, для того чтобы получить чистый продукт в виде белого пенистого твердого вещества. 1 Н-ЯМР (CDCl3, , ч./млн): 2,40-2,75 (m, 4H), 2,75-3,20 (m, 4H), 4,06 (s, 2H), 4,10 (s, 2 Н), 4,28 (s, 1 Н),4,58 (s, 2H), 6,70-7,10 (m, 4H), 7,10-7,50 (m, 8H). Продукт диспергируют в этилацетате (12 мл), подкисляют раствором НСl в безводном этилацетате до значения рН от 1,0 до 2,0, концентрируют и дегазируют, чтобы получить дигидрохлоридную соль в виде белого твердого вещества. Пример 29. Дигидрохлорид (R,S)2-4-[(4-хлорфенил)фенилметил]пиперазин-1-илметилбензилоксиуксусной кислоты (IIb) 2-4-[(4-хлорфенил)фенилметил]пиперазин-1-илметилфенилметанол (4,0 г, 9,83 ммоль) превращают в 2-4-[(4-хлорфенил)фенилметил]пиперазин-1-илметилбензилоксиуксусную кислоту таким же образом, как в примере 17. Полученный сырой продукт, имеющий вид твердой не совсем белой пены,очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол(8,5:1,5) в качестве подвижной фазы, для того чтобы получить чистый продукт в виде белого пенистого твердого вещества. 1 Н-ЯМР (CDCl3, , ч./млн): 2,40-2,80 (m, 4 Н), 2,80-3,20 (m, 4 Н), 4,06 (s, 2H), 4,14 (s, 2 Н), 4,28 (s, 1 Н),4,58 (s, 2 Н), 7,00-7,50 (m, 13 Н). Продукт превращают в дигидрохлоридную соль, используя раствор НСl в безводном этилацетате,как в примере 28. Пример 30. Дигидрохлорид 4-[4-[бис-(4-фторфенил)метил]пиперазин-1-ил]-(Е)-бут-2 енилоксиуксусной кислоты (IIIа) В перемешиваемый раствор 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Е)-бут-2-ен-1-ола(247,0 г, 0,689 моль) и трет-бутоксида калия (139,2 г, 1,240 моль) в безводном трет-бутаноле (2000 мл),нагретом до 60-65 С, в течение 1 ч, в атмосфере азота, добавляют сухой хлорацетат натрия (160,5 г, 1,378 моль). Затем реакционную смесь кипятят с обратным холодильником еще в течение 5 ч. Затем смесь концентрируют при пониженном давлении при температуре ниже 60 С, пока трет-бутанол полностью не удалится. Остаток диспергируют в воде (1500 мл) и промывают этилацетатом (2 раза по 1500 мл). Затем водный раствор подкисляют до рН 5-6, экстрагируют дихлорметаном (2 раза по 750 мл), промывают дихлорметановый слой водой (300 мл) и концентрируют, для того чтобы получить сырой продукт в виде пенистого твердого вещества. Сырой продукт очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (4:1) в качестве подвижной фазы. Продукт превращают в дигидрохлоридную соль, как в примере 17. 1 Н-ЯМР (D2O, , ч./млн): 3,20-3,70 (m, 8 Н), 3,82 (d, J=6,79 Гц, 2 Н), 3,93-4,05 (m, 4H), 5,35 (s, 1H),5,65-5,80 (m, 1H), 5,97-6,12 (m, 1H), 6,80-7,00 (m, 4H), 7,36-7,50 (m, 4H). Пример 31. Дигидрохлорид (R,S)-4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Е)-бут-2 енилоксиуксусной кислоты (IIIb)(R,S)-4-4-[(4-хлорфенил)фенилметил]пиперазин-1-ил-(Е)-бут-2-ен-1-ол (1,9 г, 0,0053 моль) превращают в (R,S)-4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Е)-бут-2-енилоксиуксусную кислоту, как в примере 30. Сырой продукт получают в виде пенистого твердого вещества, которое очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (8:2) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,40-2,75 (m, 4 Н), 2,75-3,20 (m, 4 Н), 3,30-3,50 (m, 2 Н), 3,93 (s, 2 Н), 4,004,15 (m, 2 Н), 4,26 (s, 1 Н), 5,70-6,00 (m, 2 Н), 6,82 (шир.), 7,00-7,50 (m, 9 Н). ЭТОТ продукт превращают в дигидрохлоридную соль, как в примере 17. Пример 32. Дигидрохлорид (R,S)-4-[4-[(4-фторфенил)фенилметил]пиперазин-1-ил]-(Е)-бут-2 енилоксиуксусной кислоты (IIIс)(R,S)-4-4-[(4-фторфенил)фенилметил]пиперазин-1-ил-(Е)-бут-2-ен-1-ол (0,7 г, 2,06 ммоль) превращают в (R,S)-4-[4-[(4-фторфенил)фенилметил]пиперазин-1-ил]-(Е)-бут-2-енилоксиуксусную кислоту, как в примере 30. Полученный сырой продукт (0,77 г) очищают методом флэш-хроматографии на колонке с силикагелем, используя смесь толуол-метанол (3:2) в качестве подвижной фазы, для того чтобы получить чистый продукт. 1 Н-ЯМР (CDCl3, , ч./млн): 2,40-3,20 (m, 8 Н), 3,20-3,50 (m, 2 Н), 3,92 (s, 2H), 4,00-4,15 (m, 2 Н), 4,26(s, 1 Н), 5,65-5,95 (m, 2 Н), 6,80-7,03 (m, 2 Н), 7,07-7,50 (m, 7 Н), 10,70 (шир., может замещаться). Этот продукт превращают в дигидрохлоридную соль, как в примере 17. Определение значений IC50 с использованием функционального анализа выделенной подвздошной кишки морской свинки Терминальный сегмент соединения подвздошной кишки морской свинки Dunken Hartley приблизительно на расстоянии 10 см от илеоцекального соединения, отделенный от брыжеечных связок, немедленно удаляют и помещают в раствор Тироде состава: NaCl 137,0 мМ, КСl 2,7 мМ, СаСl2 1,8 мМ, MgCl2 1,05 мМ, NaHCO3 11,9 мМ, NaH2PO4 0,42 мМ и глюкозы 5,6 мМ, при постоянной температуре 35 С. Просвет подвздошной кишки осторожно промывают раствором Тироде, чтобы удалить какие-либо частицы, без воздействия на мукозный слой ткани. Нарезают кусочки длиной 1,5-2,0 см и помещают их в ванночку для органов емкостью 20 мл, соединяя один конец с держателем ткани, а другой с датчиком с помощью тонкой хлопковой нити. Систему предварительно калибруют до начала каждого эксперимента. Ткань выдерживают в натяжении покоя, равном 0,5-0,75 г. Раствор в ванночке непрерывно барботируют смесью газов 95% О 2 и 5% СO2 и поддерживают при температуре 35 С. После первоначального 30 минутного периода уравновешивания регистрируют нулевую линию, и первоначально регистрируют некумулятивные ответы на субмаксимальную дозу гистамина (7,210-7 М) до тех пор, пока ответы являлись воспроизводимыми. Сокращения в ответ на эту типичную дозу гистамина в отсутствие (т.е. только для носителя) и в присутствии по меньшей мере трех различных концентраций испытуемых соединений регистрируют спустя постоянное время инкубации - 15 мин. Для определения величины IC50 строят график процент ингибирования, вызванного различными концентрациями, относительно логарифма молярной концентрации испытуемых соединений.- 14007794 Таблица. Испытание активности соединений формулы I в виде гидрохлоридной соли Среднеквадратичная ошибка ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I в которой X, Y, X' и Y' выбирают из водорода, галогена; замещенного или незамещенного алкила, линейного, разветвленного или циклического, алкилокси- и галоидалкильной группы; R1, R2, R3 и R4 выбирают из водорода, замещенных или незамещенных алкильных групп, линейных, разветвленных или циклических; в которой заместители R1 и R2 в пиперазинильном фрагменте находятся или в syn-, или вanti-положении друг к другу, и необязательно R3 и R4 вместе с атомами углерода, с которыми они связаны, образуют моноциклическое насыщенное или арильное, или замещенное арильное, или гетероарильное, или замещенное гетероарильное кольцо, содержащее один или несколько гетероатомов, выбранных из N, S и О, с размером кольца, находящемся в интервале от 3 до 6 атомов; при условии, что когда R3 иR4 вместе не образуют часть кольца, они могут существовать или в Е- или в Z-конфигурации; R5 представляет собой группу (CH2)n-O-CH2-CO-Z, в которой n означает число от 1 до 6; Z выбирают из ОН, OR где R и R' выбирают из водорода, замещенных или незамещенныхNRR', N(OR)R', N(R)-N(R)R' и алкильных групп, линейных, разветвленных или циклических, и В выбирают из -(СН 2)n- (n равно 1-6) и (CH2)x-D-(CH2)y, где D представляет собой О, NR, S или SO2, x и у независимо означают числа от 1 до 6; и m выбирают из чисел от 1 до 6; и их фармацевтически приемлемые соли. 2. Соединение по п.1, в котором X, Y, X' и Y' выбирают из водорода, хлора и фтора;R3 и R4 означают водород, причем существуют в Е- или Z-конфигурации или необязательно, когда они находятся в Z-конфигурации, R3 и R4 вместе с атомами углерода, с которыми они связаны, образуют бензольное кольцо; иR5 означает группу CH2-O-CH2-CO-Z, в которой Z выбирают из ОН и OR, где R может быть выбран из метила, этила и изопропила; и- 15007794 3. 4-4-[бис-(4-Фторфенил)метил]пиперазин-1-ил-(Z)-бут-2-енилоксиуксусная кислота или ее фармацевтически приемлемая соль. 4. 4-[4-[(4-Хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2-енилоксиуксусная кислота или ее фармацевтически приемлемая соль. 5. [4-(4-Бензгидрилпиперазин-1-ил)-(Z)-бут-2-енилокси]уксусная кислота или ее фармацевтически приемлемая соль. 6. 4-4-[бис-(2,4-Дифторфенил)метил]пиперазин-1-ил-(Z)-бут-2-енилоксиуксусная кислота или ее фармацевтически приемлемая соль. 7. 4-[4-[бис-(4-Хлорфенил)метил]пиперазин-1-ил]-(Z)-бут-2-енилоксиуксусная кислота или ее фармацевтически приемлемая соль,8. Метиловый эфир 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2-енилоксиуксусной кислоты или его фармацевтически приемлемая соль. 9. Этиловый эфир 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2-енилоксиуксусной кислоты или его фармацевтически приемлемая соль. 10. Изопропиловый эфир 4-4-[бис-(4-фторфенил)метил]пиперазин-1-ил-(Z)-бут-2 енилоксиуксусной кислоты или его фармацевтически приемлемая соль. 11. Изопропиловый эфир 4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2 енилоксиуксусной кислоты или его фармацевтически приемлемая соль. 12. Метиловый эфир 4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2 енилоксиуксусной кислоты или его фармацевтически приемлемая соль. 13. Этиловый эфир 4-[4-[(4-хлорфенил)фенилметил]пиперазин-1-ил]-(Z)-бут-2-енилоксиуксусной кислоты или его фармацевтически приемлемая соль. 14. 2-4-[бис-(4-Фторфенил)метил]пиперазин-1-илметилбензилоксиуксусная кислота или ее фармацевтически приемлемая соль. 15. 2-4-[(4-Хлорфенил)фенилметил]пиперазин-1-илметилбензилоксиуксусная кислота или ее фармацевтически приемлемая соль. 16. 4-[4-[бис-(4-Фторфенил)метил]пиперазин-1-ил]-(Е)-бут-2-енилоксиуксусная кислота или ее фармацевтически приемлемая соль. 17. 4-[4-[(4-Хлорфенил)фенилметил]пиперазин-1-ил]-(Е)-бут-2-енилоксиуксусная кислота или ее фармацевтически приемлемая соль. 18. 4-[4-[(4-Фторфенил)фенилметил]пиперазин-1-ил]-(Е)-бут-2-енилоксиуксусная кислота или фармацевтически приемлемая соль. 19. Фармацевтическая композиция, содержащая соединение формулы I по любому из пп.1-18, и фармацевтически приемлемый носитель.
МПК / Метки
МПК: A61P 37/08, A61P 27/14, C07D 295/096, C07D 295/084, A61K 31/495, C07D 295/14, A61P 11/06
Метки: производные, 4-(диарилметил)-1-пиперазинила
Код ссылки
<a href="https://eas.patents.su/17-7794-proizvodnye-4-diarilmetil-1-piperazinila.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 4-(диарилметил)-1-пиперазинила</a>