Новый способ синтеза (7-метокси-3,4-дигидро -1- нафталинил)ацетонитрила и его применение при синтезе агомелатина
Формула / Реферат
1. Способ промышленного синтеза соединения формулы (I)
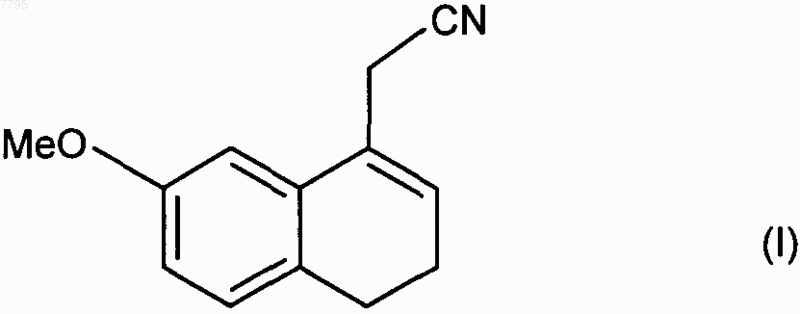
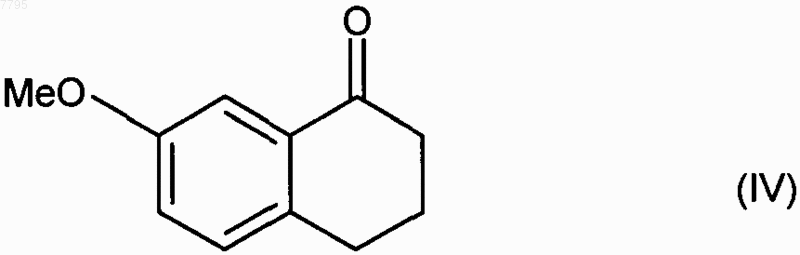
отличающийся тем, что 7-метокси-1-тетралон формулы (IV)
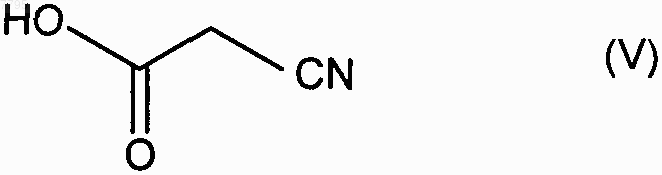
подвергают взаимодействию с цианоуксусной кислотой формулы (V)
в условиях, когда образованную воду удаляют, в присутствии каталитического количества соединения формулы (VI)
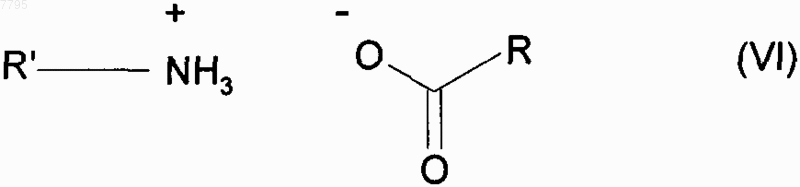
в которой R и R', которые могут быть одинаковыми или разными, каждая представляет собой линейную или разветвленную (С3-С10)алкильную группу, незамещенную или замещенную арильную группу или незамещенную или замещенную линейную или разветвленную арил(С1-С6)алкильную группу,
получая соединение формулы (I) после фильтрации и промывания раствором гидроокиси натрия, где соединение формулы (I) выделяют в виде твердого вещества после перекристаллизации,
причем под арилом подразумевают фенильную, нафтильную или бифенильную группу,
термин "замещенный", охватывающий термины "арил" и "арилалкил", обозначает, что ароматическая часть этих групп может быть замещена 1-3 одинаковыми или разными группами, выбранными из линейного или разветвленного (С1-С6)алкила, гидрокси и линейного или разветвленного (С1-С6)алкокси.
2. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что реакцию осуществляют с нагреванием в колбе с обратным холодильником с толуолом.
3. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что применяемый катализатор представлен формулой (VIa)
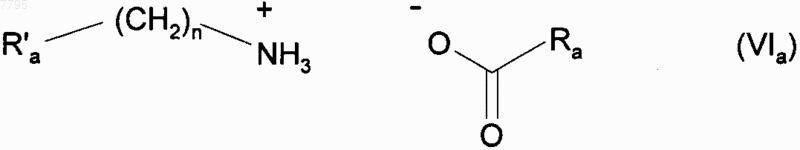
в которой Ra' представляет собой фенильную группу, незамещенную или замещенную одной или несколькими линейными или разветвленными (С1-С6)алкильными группами, n представляет собой 0 или 1 и Ra представляет собой линейную (С3-С10)алкильную группу.
4. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что R представляет собой гексильную группу.
5. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что R' представляет собой бензильную группу.
6. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что применяемый катализатор представляет собой гептаноат бензиламмония формулы (VII)
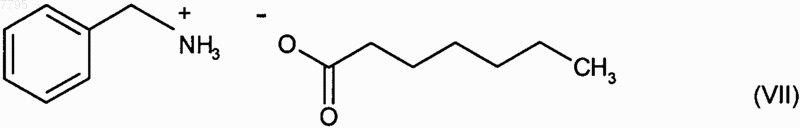
7. Соединение формулы (I), которое представляет собой (7-метокси-3,4-дигидро-1-нафталинил)ацетонитрил, для применения в качестве промежуточного продукта при синтезе агомелатина.
8. Способ синтеза агомелатина, исходя из соединения формулы (I), отличающийся тем, что соединение формулы (I) получают путем способа синтеза в соответствии с любым из пп.1-6 и подвергают ароматизации, затем восстановлению и после этого сочетанию с уксусным ангидридом.
Текст
007795 Настоящее изобретение относится к способу промышленного синтеза (7-метокси-3,4-дигидро-1 нафталинил)ацетонитрила и к его применению при промышленном получении агомелатина, или N-[2-(7 метокси-1-нафтил)этил]ацетамида. В частности, настоящее изобретение относится к способу промышленного синтеза соединения формулы (I) Соединение формулы (I), полученное в соответствии со способом по изобретению, пригодно для синтеза агомелатина, или N-[2-(7-метокси-1-нафтил)этил]ацетамида, формулы (II) Агомелатин, или N-[2-(7-метокси-1-нафтил)этил]ацетамид, обладает ценными фармакологическими свойствами. Действительно, он имеет двойственное свойство, с одной стороны, являясь агонистом рецепторов мелатонинэргической системы, а, с другой стороны, - антагонистом 5-НТ 2C рецептора. Эти свойства задействованы в его активности в центральной нервной системе, и в частности при лечении тяжелых депрессий, сезонных аффективных расстройств, нарушений сна, патологии сердечно-сосудистой системы,патологии пищеварительной системы, бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, нарушений аппетита и ожирения. Агомелатин, его получение и терапевтическое применение описаны в заявке на европейский патент ЕР 0 447 285. В связи с ценными фармацевтическими свойствами этого соединения является важным получать его при помощи эффективного способа промышленного синтеза, который легко заменим в промышленном масштабе и обеспечивает получение агомелатина с высоким выходом и очень хорошей степенью очистки. В заявке на патент ЕР 0 447 285 описано получение агомелатина посредством восьми стадий, исходя из 7-метокси-1-тетралона, что обеспечивает, в среднем, выход меньше чем 30%. В этом способе предусматривается взаимодействие этилбромацетата с последующей ароматизацией и омылением, что приводит к образованию соответствующей кислоты, которую потом превращают в ацетамид и затем дегидратируют, получая (7-метокси-1-нафтил)ацетонитрил, который после этого восстанавливают, и затем конденсируют ацетилхлорид. При смещении к осуществлению способа в промышленном масштабе быстро выявляются трудности его выполнения, вызванные в большинстве случаев сложностями воспроизводимости первой стадии,которая предусматривает воздействие этилбромацетата на 7-метокси-1-тетралон в соответствии с реакцией Реформатского с получением этил (7-метокси-3,4-дигидро-1(2H)-нафталинилиден)этаноата. Кроме того, последующая стадия ароматизации этил (7-метокси-3,4-дигидро-1(2H)-нафталинилиден)этаноата очень часто осуществляется не полностью, что приводит к образованию, после омыления,смеси продуктов, которую сложно очистить. Сейчас заявителем был разработан новый способ промышленного синтеза, который приводит к получению агомелатина чистоты, совместимой с его применением в качестве фармацевтически активного компонента, и этот способ воспроизводим и не требует трудоемкой очистки. Альтернативно по отношению к трудностям, которые встречаются при осуществлении способа, описанного в заявке на патент ЕР 0 447 285, синтез осуществляют путем прямой конденсации цианосоединения с 7-метокси-1-тетралоном. Также необходимо, чтобы соединение, полученное при конденсации, быстро могло быть подвергнуто ароматизации, что приводит к получению (7-метокси-1-нафтил)ацетонитрила. Очевидно, что (7-метокси-3,4-дигидро-1-нафталинил)ацетонитрил будет являться идеальным промежуточным продуктом для синтеза, который соответствует требованиям для осуществления прямого синтеза из 7-метокси-1-тетралона и представляет собой очень хороший субстрат для стадии ароматизации. Реакции прямой конденсации тетралонов с ацетонитрилом или соединениями ацетонитрила описаны в литературе. В частности, в патенте US 3 992 403 описана конденсация цианометилфосфоната с 6 фтор-1-тетралоном, и в патенте US 3 931 188 описана конденсация ацетонитрила с тетралоном, которая приводит к образованию промежуточного цианопродукта, который непосредственно применяют в последующей реакции. Применительно к 7-метокси-1-тетралону, конденсация ацетонитрила приводит к образованию смеси изомеров, в которой "экзо" соответствует основной части и "эндо" - второстепенной части в соответствии со схемой Получение такой смеси вызывает необходимость последующей ароматизации в жестких условиях,что не совместимо с требованиями осуществления промышленного синтеза агомелатина. Сейчас заявителем был разработан новый способ промышленного синтеза, который предоставляет возможность получения (7-метокси-3,4-дигидро-1-нафталинил)ацетонитрила воспроизводимым способом, который не требует трудоемкой очистки, в особенности без "экзо" примеси формулы (III) и эта примесь не может подвергаться последующей ароматизации в рабочих условиях, что совместимо с промышленными требованиями для осуществления синтеза агомелатина. В частности, настоящее изобретение относится к способу промышленного синтеза соединения формулы (I) подвергают взаимодействию с цианоуксусной кислотой формулы (V) в условиях, когда образованную воду удаляют, в присутствии каталитического количества соединения формулы (VI) в которой R и R', которые могут быть одинаковыми или разными, каждая представляет собой линейную или разветвленную (С 3-С 10)алкильную группу, незамещенную или замещенную арильную группу или незамещенную или замещенную линейную или разветвленную арил(С 1-С 6)алкильную группу,получая соединение формулы (I) после фильтрации и промывания раствором гидроокиси натрия,где соединение формулы (I) выделяют в виде твердого вещества после перекристаллизации,причем: под арилом подразумевают фенильную, нафтильную или бифенильную группу,термин замещенный, охватывающий термины арил и арилалкил, обозначает, что ароматическая часть этих групп может быть замещена 1-3 одинаковыми или разными группами, выбранными из линейного или разветвленного (С 1-С 6)алкила, гидрокси и линейного или разветвленного (C1-С 6)алкокси. Более предпочтительно воду, образованную при реакции, удаляют путем перегонки. Предпочтительно применять в реакции растворитель, который имеет температуру кипения выше, чем температура кипения воды, или такую же, и наиболее предпочтительно, чтобы он образовывал азеотропную смесь с водой,такой как, например, ксилол, толуол, анизол, этилбензол, тетрахлорэтилен, циклогексен или мезитилен. Реакцию предпочтительно осуществляют с нагреванием в колбе с обратным холодильником с толуолом или ксилолом и более предпочтительно с нагреванием в колбе с обратным холодильником с толуолом. Предпочтительно одна из групп R или R' применяемого катализатора представляет собой линейную или разветвленную (С 3-С 10)алкильную группу, а другая представляет собой арильную или арилалкиль-2 007795 ную группу. Более предпочтительно, применяемый катализатор представлен формулой (VIa) в которой R'a представляет собой фенильную группу, незамещенную или замещенную одной или несколькими линейными или разветвленными (C1-С 6)алкильными группами, n представляет собой 0 или 1 и Ra представляет собой линейную (С 3-С 10)алкильную группу. Предпочтительно R'a представляет собой незамещенную или замещенную фенильную группу, более предпочтительно, незамещенную фенильную группу. Предпочтительно группа Ra представляет собой гексильную группу. Предпочтительно n равен 1. Предпочтительный катализатор, который применяется в способе согласно изобретению, представляет собой гептаноат бензиламмония формулы (VII) Предпочтительно соединение формулы (VI) получают после фильтрации и промывания раствором неорганического или органического основания, такого как NaOH, KОН, Са(ОН)2, Sr(OH)2 или NH4OH, и более предпочтительно раствором гидроокиси натрия. Этот способ представляет особый интерес в связи со следующими основаниями. Он приводит к получению исключительно "эндо" соединения в промышленном масштабе. Этот результат является совершенно неожиданным, принимая во внимание тот факт, что в литературе для реакций такого типа наиболее часто описано получение "экзо"/"эндо" смесей (Tetrahedron, 1966, 22, 30213026). Этот результат обеспечивается применением в качестве катализатора реакции соединения формулы (VI) вместо ацетатов аммония, которые в настоящее время применяются в таких реакциях (Bull. Soc.Chim. Fr., 1949, 884-890). Степень осуществленного превращения является очень высокой, более 97%, в отличие от наблюдаемой при использовании уксусной кислоты, для которой она не превышает 75%. Таким образом полученное соединение формулы (I) является новым и пригодно в качестве промежуточного продукта при синтезе агомелатина, при котором его подвергают ароматизации, затем восстановлению и после этого сочетанию с уксусным ангидридом. Примеры, представленные ниже, приведены с целью иллюстрации и никоим образом не ограничивают изобретение. Пример 1. (7-Метокси-3,4-дигидро-1-нафталинил)ацетонитрил. В реактор объемом 670 л вносили 85,0 кг 7-метокси-1-тетралона, 60,3 кг цианоуксусной кислоты и 15,6 кг гептановой кислоты в толуоле в присутствии 12,7 кг бензиламина. Смесь нагревали с обратным холодильником. После того как все исходные вещества исчезали, раствор охлаждали и фильтровали. Полученный осадок промывали толуолом и после этого полученный фильтрат промывали 2 н. раствором гидроокиси натрия и затем водой до тех пор, пока он не становился нейтральным. После удаления растворителя путем выпаривания полученное твердое вещество перекристаллизовывали из смеси этанол/вода (80/20), получая указанный в заглавии продукт при выходе 90% и с химической чистотой, превышающей 99%. Точка плавления: 48-50 С. Пример 2. (7-Метокси-3,4-дигидро-1-нафталинил)ацетонитрил. В реактор объемом 670 л вносили 85,0 кг 7-метокси-1-тетралона, 60,3 кг цианоуксусной кислоты и 15,6 кг гептановой кислоты в толуоле в присутствии 11,0 кг анилина. Смесь нагревали с обратным холодильником. После того как все исходные вещества исчезали, раствор охлаждали и фильтровали. Полученный осадок промывали толуолом и после этого полученный фильтрат промывали 2 н. раствором гидроокиси натрия и затем водой до тех пор, пока он не становился нейтральным. После удаления растворителя путем выпаривания полученное твердое вещество перекристаллизовывали из смеси этанол/вода (80/20),получая указанный в заглавии продукт при выходе 87% и с химической чистотой, превышающей 99%. Точка плавления: 48-50 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ промышленного синтеза соединения формулы (I) подвергают взаимодействию с цианоуксусной кислотой формулы (V) в условиях, когда образованную воду удаляют, в присутствии каталитического количества соединения формулы (VI) в которой R и R', которые могут быть одинаковыми или разными, каждая представляет собой линейную или разветвленную (С 3-С 10)алкильную группу, незамещенную или замещенную арильную группу или незамещенную или замещенную линейную или разветвленную арил(С 1-С 6)алкильную группу,получая соединение формулы (I) после фильтрации и промывания раствором гидроокиси натрия,где соединение формулы (I) выделяют в виде твердого вещества после перекристаллизации,причем под арилом подразумевают фенильную, нафтильную или бифенильную группу,термин замещенный, охватывающий термины арил и арилалкил, обозначает, что ароматическая часть этих групп может быть замещена 1-3 одинаковыми или разными группами, выбранными из линейного или разветвленного (С 1-С 6)алкила, гидрокси и линейного или разветвленного (С 1-С 6)алкокси. 2. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что реакцию осуществляют с нагреванием в колбе с обратным холодильником с толуолом. 3. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что применяемый катализатор представлен формулой (VIa) в которой Ra' представляет собой фенильную группу, незамещенную или замещенную одной или несколькими линейными или разветвленными (С 1-С 6)алкильными группами, n представляет собой 0 или 1 и Ra представляет собой линейную (С 3-С 10)алкильную группу. 4. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что R представляет собой гексильную группу. 5. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что R' представляет собой бензильную группу. 6. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что применяемый катализатор представляет собой гептаноат бензиламмония формулы (VII) 7. Соединение формулы (I), которое представляет собой (7-метокси-3,4-дигидро-1 нафталинил)ацетонитрил, для применения в качестве промежуточного продукта при синтезе агомелатина. 8. Способ синтеза агомелатина, исходя из соединения формулы (I), отличающийся тем, что соединение формулы (I) получают путем способа синтеза в соответствии с любым из пп.1-6 и подвергают ароматизации, затем восстановлению и после этого сочетанию с уксусным ангидридом. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07C 253/00, C07C 233/17, C07C 231/06, C07C 255/37
Метки: синтезе, нафталинил)ацетонитрила, новый, агомелатина, применение, способ, синтеза, 7-метокси-3,4-дигидро
Код ссылки
<a href="https://eas.patents.su/5-7795-novyjj-sposob-sinteza-7-metoksi-34-digidro-1-naftalinilacetonitrila-i-ego-primenenie-pri-sinteze-agomelatina.html" rel="bookmark" title="База патентов Евразийского Союза">Новый способ синтеза (7-метокси-3,4-дигидро -1- нафталинил)ацетонитрила и его применение при синтезе агомелатина</a>
Предыдущий патент: Производные 4-(диарилметил)-1-пиперазинила
Следующий патент: Связующее для дорожного покрытия (варианты) и способ его получения
Случайный патент: Натягиваемое абсорбирующее изделие









