Фармацевтические композиции, содержащие производные азетидина, новые производные азетидина и их получение
Номер патента: 7109
Опубликовано: 30.06.2006
Авторы: Майерс Майкл, Бушар Эрве, Гризони Серж, Ашар Даниель, Иттэнжер Огюстэн, Букерель Жан, Филош Брюно
Формула / Реферат
1. Фармацевтическая композиция для лечения и профилактики расстройств, затрагивающих центральную нервную систему, иммунную систему, сердечно-сосудистую систему, эндокринную систему, дыхательную систему, органы желудочно-кишечного тракта, и расстройств репродуктивной системы, содержащая в качестве активного начала по меньшей мере одно соединение формулы

в которой
R1 обозначает радикал -N(R4)R5, -N(R4)-CO-R5, -N(R4)-SO2R6;
R2 и R3, одинаковые или разные, обозначают либо фенил, который может быть незамещенным или замещенным одним или несколькими галогенами, либо гетероароматический радикал, выбранный из следующих циклов: пиридил, пиримидил, которые могут быть незамещенными или замещенными галогеном;
R4 обозначает радикал -С(R11)(R12)-Het, Het, -С(R11)(R12)-Ar, Ar, циклоалкил или норборнил;
R5 обозначает атом водорода или радикал алкокси или алкил, возможно замещенный одним или несколькими галогенами;
R6 обозначает алкил или радикал NHCOOC(СН3)3;
R11 обозначает атом водорода;
R12 обозначает атом водорода;
Ar обозначает фенил, который может быть замещен одним или несколькими из следующих заместителей: галоген, алкил, алкокси, гидрокси, гидроксиалкил;
Het обозначает хинолин, пиридин, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, 1,1-диоксо-1Н-1l6-бензо[d]изотиазолил, причем эти гетероциклы могут быть замещены одним или несколькими алкилами, галогенами или оксогруппами;
причем алкильные радикалы и части молекул или алкоксильные радикалы и части молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода,
оптические изомеры этих соединений и их фармацевтически приемлемые соли с минеральными или органическими кислотами.
2. Фармацевтическая композиция по п.1, для которой в соединении формулы I
R1 обозначает радикал -N(R4)-SO2R6;
R2 и R3, одинаковые или разные, обозначают либо фенил, незамещенный или замещенный одним или несколькими галогенами, либо гетероароматический радикал, выбранный из пиридильного, пиримидильного циклов, причем эти гетероароматические радикалы могут быть незамещенными или замещенными галогеном;
R4 обозначает радикал -C(R11)(R12)-Het, -Het, -C(R11)(R12)-Ar, Ar, циклоалкил или норборнил;
R6 обозначает алкил или радикал NHCOOC(СН3)3;
R11 обозначает атом водорода;
R12 обозначает атом водорода;
Ar обозначает фенил, который может быть замещен одним или несколькими из следующих заместителей: галоген, алкил, алкокси, гидрокси или гидроксиалкил;
Het обозначает хинолин, пиридин, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, причем эти гетероциклы могут быть замещены одним или несколькими алкилами, галогенами или оксогруппами;
причем алкильные радикалы и части молекул или алкоксильные радикалы и части молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода,
оптические изомеры этих соединений и их фармацевтически приемлемые соли с минеральными или органическими кислотами.
3. Композиция по п.1, для которой соединение формулы I, выбирают из следующих соединений:
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(6-хлорпирид-2-ил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(6-этилпирид-2-ил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-хинол-6-илметансульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-хинол-5-илметилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-изохинол-5-илметилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-пирид-3-илметилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(1-оксидпирид-3-ил)метилсульфонамид,
N-(1R,2S,4S)-бицикло[2.2.1]гепт-2-ил-N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}метилсульфонамид,
N-(1R,2R,4S)-бицикло[2.2.1]гепт-2-ил-N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(тиазол-2-ил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3-метоксифенил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3-гидроксифенил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3-гидроксиметилфенил)метилсульфонамид,
этиловый эфир N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(метилсульфонил)-3-аминобензойной кислоты,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(1-изобутилпиперид-4-ил)метилсульфонамид,
N-бензил-N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}амин,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3,5-дифторбензил)амин,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3,5-дифторбензил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(пирид-3-илметил)метилсульфонамид,
N-{1-[бис(4-фторфенил)метил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(RS)-N-{1-[(4-хлорфенил)пирид-3-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(R)-N-{1-[(4-хлорфенил)пирид-3-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(S)-N-{1-[(4-хлорфенил)пирид-3-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(RS)-N-{1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(R)-N-{1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(S)-N-{1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(RS)-N-{1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(R)-N-{1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(S)-N-{1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3,5-дифторфенил)бензилсульфонамид.
4. Соединение формулы
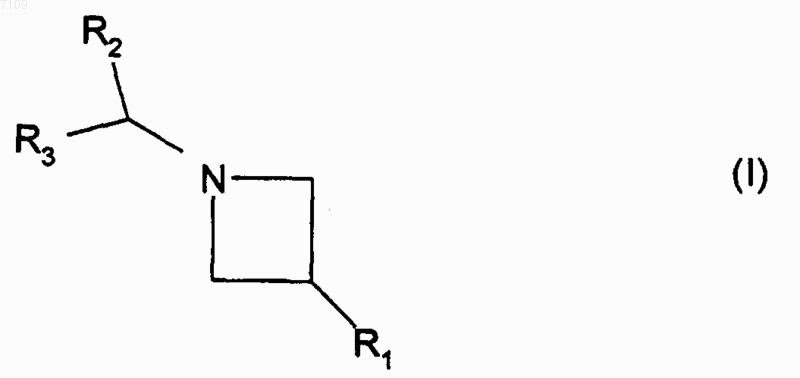
в которой
R1 обозначает радикал -N(R4)R5, -N(R4)-CO-R5, -N(R4)-SO2R6;
R2 и R3, одинаковые или разные, обозначают либо фенил, который может быть незамещенным или замещенным одним или несколькими галогенами, либо гетероароматический радикал, выбранный из следующих циклов: пиридил, пиримидил, которые могут быть незамещенными или замещенными галогеном;
R4 обозначает радикал -С(R11)(R12)-Het, Het, -С(R11)(R12)-Ar, Ar, циклоалкил или норборнил;
R5 обозначает атом водорода или радикал алкокси или алкил, возможно замещенный одним или несколькими галогенами;
R6 обозначает алкил или радикал NHCOOC(СН3)3;
R11 обозначает атом водорода;
R12 обозначает атом водорода;
Ar обозначает фенил, который может быть замещен одним или несколькими из следующих заместителей: галоген, алкил, алкокси, гидрокси, гидроксиалкил;
Het обозначает хинолин, пиридин, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, 1,1-диоксо-1Н-1l6-бензо[d]изотиазолил, причем эти гетероциклы могут быть замещены одним или несколькими алкилами, галогенами или оксогруппами;
причем алкильные радикалы и части молекул или алкоксильные радикалы и чаётш молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода,
оптические изомеры этих соединений и их фармацевтически приемлемые соли с минеральными или органическими кислотами, за исключением соединения, у которого R2 и R3 являются фенильными радикалами, R1 является радикалом -N(R4)SO2R6, где R4 обозначает фенил и R6 обозначает метил.
5. Соединения формулы I по п.4, в которой
R1 обозначает радикал -N(R4)-SO2R6;
R2 и R3, одинаковые или разные, обозначают либо фенил, незамещенный или замещенный одним или несколькими галогенами, либо гетероароматический радикал, выбранный из пиридильного, пиримидильного циклов, причем эти гетероароматические радикалы могут быть незамещенными или замещенными галогеном;
R4 обозначает радикал -C(R11)(R12)-Het, -Het, -C(R11)(R12)-Ar, Ar, циклоалкил или норборнил;
R6 обозначает алкил или радикал NHCOOC(СН3)3;
R11 обозначает атом водорода;
R12 обозначает атом водорода;
Ar обозначает фенил, который может быть замещен одним или несколькими из следующих заместителей: галоген, алкил, алкокси, гидрокси или гидроксиалкил;
Het обозначает хинолин, пиридин, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, причем эти гетероциклы могут быть замещены одним или несколькими алкилами, галогенами или оксо-группами;
причем алкильные радикалы и части молекул или алкоксильные радикалы и части молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода,
оптические изомеры этих соединений и их фармацевтически приемлемые соли с минеральными или органическими кислотами, за исключением соединения, у которого R2 и R3 являются фенильными радикалами, R1 является радикалом -N(R4)SO2R6, где R4 обозначает фенил и R6 обозначает метил.
6. Соединение формулы I по п.4, выбранное из следующих соединений:
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(6-хлорпирид-2-ил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(6-этилпирид-2-ил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-хинол-6-илметилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-хинол-5-илметилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-изохинол-5-илметилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-пирид-3-илметилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(1-оксидпирид-3-ил)метилсульфонамид,
N-(1R,2S,4S)-бицикло[2.2.1]гепт-2-ил-N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}метилсульфонамид,
N-(1R,2R,4S)-бицикло[2.2.1]гепт-2-ил-N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(тиазол-2-ил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3-метоксифенил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3-гидроксифенил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3-гидроксиметилфенил)метилсульфонамид,
этиловый эфир N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(метилсульфонил)-3-аминобензойной кислоты,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(1-изобутилпиперид-4-ил)метилсульфонамид,
N-бензил-N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}амин,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3,5-дифторбензил)амин,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3,5-дифторбензил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(пирид-3-илметил)метилсульфонамид,
N-{1-[бис(4-фторфенил)метил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(RS)-N-{1-[(4-хлорфенил)пирид-3-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(R)-N-{1-[(4-хлорфенил)пирид-3-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(S)-{1-[(4-хлорфенил)]пирид-3-илметилазетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(RS)-N-{1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(R)-N-{1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(S)-N-{1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(RS)-N-{1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(R)-N-{1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
(S)-N-{1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид,
N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3,5-дифторфенил)бензилсульфонамид,
оптические изомеры этих соединений и их фармацевтически приемлемые соли с минеральными или органическими кислотами.
7. N-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-N-(3,5-дифторфенил)метилсульфонамид, его оптические изомеры и фармацевтически приемлемые соли с минеральными или органическими кислотами.
8. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)R5, в котором R5 обозначает атом водорода, R4 обозначает радикал -CR11R12-Ar или -CR11R12-Het и R12 обозначает атом водорода, отличающийся тем, что производное Rb-COR11, у которого R11 имеют те же значения, как в п.4, вводят во взаимодействие с производным формулы
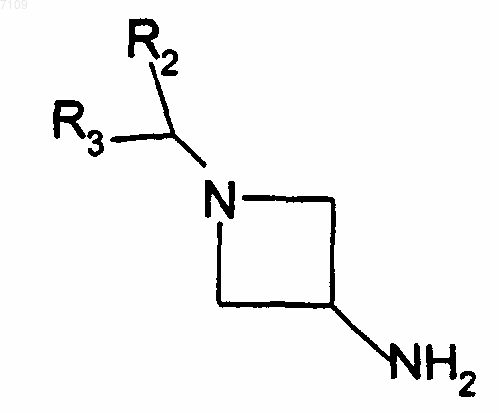
Rb обозначает радикал Ar или Het, R2, R3, R11, Ar и Het имеют те же значения, как в п.4, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль.
9. Способ получения соединений формулы I по п.4, у которых R1 является радикалом N(R4)-CO-R5, в котором R4 обозначает радикал -C(R11)(R12)-Het или -C(R11)(R12)-Ar и R12 обозначает атом водорода, отличающийся тем, что производное Hal-COR5 вводят во взаимодействие с производным формулы
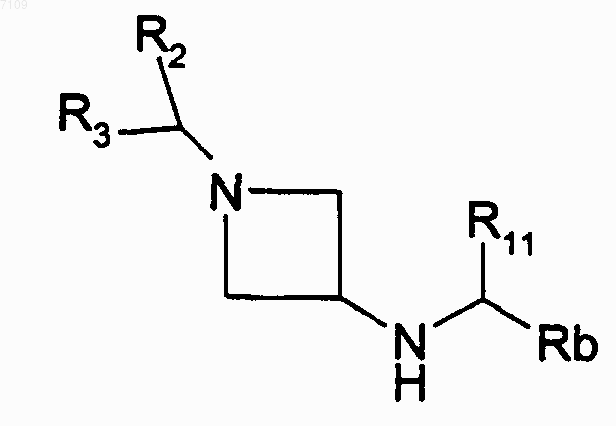
Hal обозначает атом галогена, Rb обозначает Ar или Het, R2, R3, R5, R11, Ar и Het имеют те же значения, как в п.4, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль.
10. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)-SO2-R6, в котором R4 обозначает -C(R11)(R12)-Ar или -C(R11)(R12)-Het и R12 обозначает атом водорода, отличающийся тем, что производное Hal-SO2R6 вводят во взаимодействие с производным формулы
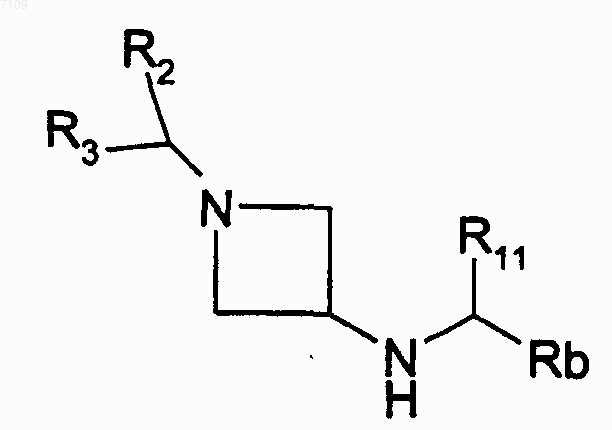
R2, R3, R11, R5 имеют те же значения, как в п.4, Hal обозначает атом галогена и Rb обозначает Ar и Het, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль.
11. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)R5, отличающийся тем, что производное R5(R4)NH вводят во взаимодействие с производным формулы
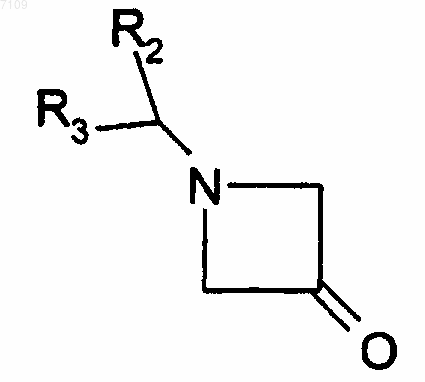
R2, R3, R4, R5 имеют те же значения, как в п.4, выделяют продукт и, при необходимостш, превращают его в фармацевтически приемлемую соль.
12. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)SO2R6, отличающийся тем, что производное Hal-SO2R6 вводят во взаимодействие с производным формулы
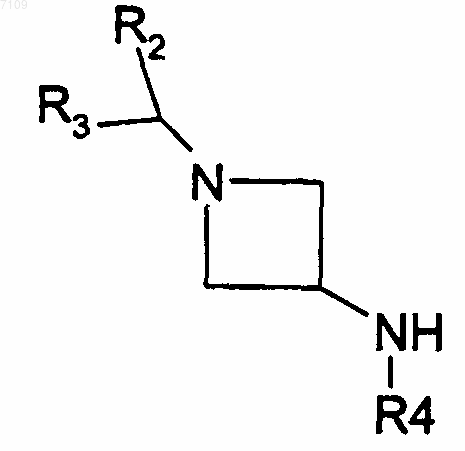
R2, R3, R4 и R6 имеют те же значения, как в п.4, и Hal обозначает атом галогена, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль.
13. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)COR5, отличающийся тем, что производное Hal-COR6 вводят во взаимодействие с производным формулы
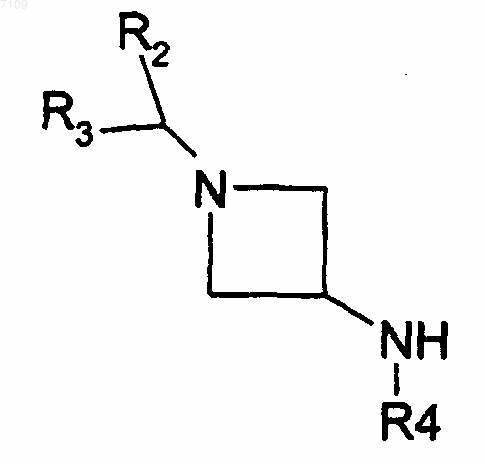
R2, R3, R4 и R5 имеют те же значения, как в п.4, и Hal обозначает атом галогена, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль.
14. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)-SO2-R6, в котором R4 обозначает радикал Het или Ar, отличающийся тем, что производное Rd-NH-SO2-R6 вводят во взаимодействие с производным формулы

Rd обозначает Ar или Het, R2, R3 и R6 имеют те же значения, как в п.4, и Ms обозначает радикал метилсульфонилокси, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль.
15. Способ получения соединений формулы I по п.4, отличающийся тем, что производное R2-CHBr-R3 вводят во взаимодействие с производным формулы
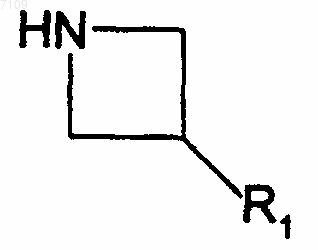
R1, R2 и R3 имеют те же значения, как в п.4, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль.
16. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)-SO2-R6, в котором R4 обозначает пиперид-4-ил, замещенный по азоту алкильным радикалом, отличающийся тем, что алкилируют соответствующее соединение формулы I, у которого R1 является радикалом -N(R4)-SO2-R6, в котором R4 обозначает пиперид-4-ил, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль.
17. Лекарственное средство для лечения и профилактики расстройств, затрагивающих центральную нервную систему, иммунную систему, сердечно-сосудистую систему, эндокринную систему, дыхательную систему, органы желудочно-кишечного тракта, и расстройств репродуктивной системы, содержащее в качестве действующего начала соединение формулы I как оно определено в п.4.
18. Лекарственное средство по п.17 для лечения и/или профилактики психозов, шизофрении, тревожных нарушений, депрессии, болезни Паркинсона и болезни Альцгеймера.
19. Лекарственное средство по п.17 для лечения и/или профилактики ожирения.
Текст
007109 Настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного начала по меньшей мере одно соединение формулы или одну из его фармацевтически приемлемых солей, к новым производным формулы I, их фармацевтически приемлемым солям и их получению. Соединение формулы I, у которого R2 и R3 являются фенильными радикалами, R1 обозначает радикал -N(R4)O2R6, R4 обозначает фенильный радикал и R6 обозначает метильный радикал, описано как промежуточный продукт синтеза в патенте WO 99/01451. Другие соединения и фармацевтически приемлемые соли являются новыми и как таковые составляют часть изобретения. В формуле I R1 обозначает радикал -N(R4)R5, -N(R4)-CO-R5, -N(R4)-SO2R6;R2 и R3, одинаковые или разные, обозначают либо фенил, который может быть незамещенным или замещенным одним или несколькими галогенами; либо гетероароматический радикал, выбранный из следующих циклов: пиридил, пиримидил, которые могут быть незамещенными или замещенными галогеном;R5 обозначает атом водорода или радикал алкокси или алкил, возможно замещенный одним или несколькими галогенами;R6 обозначает алкил или радикал NHCOOC(СН 3)3;Ar обозначает фенил, который может быть замещен одним или несколькими из следующих заместителей: галоген, алкил, алкокси, гидрокси, гидроксиалкил;Het обозначает хинолин, пиридин, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, 1,1 диоксо-1 Н-16-бензо[d]изотиазолил, причем эти гетероциклы могут быть замещены одним или несколькими алкилами, галогенами или оксогруппами; причем алкильные радикалы и части молекул или алкоксильные радикалы и части молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода. В приведенных и последующих определениях, если не оговорено особо, алкильные радикалы и части молекул или алкоксильные радикалы и части молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода. Из алкильных радикалов можно назвать метил, этил, н-пропил, изопропил, н-бутил, втор-бутил,изобутил, трет-бутил, пентил, гексил. Из радикалов алкокси можно назвать радикалы метокси, этокси, нпропокси, изопропокси, н-бутокси, втор-бутокси, изобутокси, трет-бутокси, пентилокси. Из циклоалкильных радикалов можно назвать циклопропил, циклобутил, циклопентил, циклогексил. Термин галоген подразумевает хлор, фтор, бром и йод. Из гетероциклических радикалов, обозначаемых Het, можно назвать следующие гетероциклы: бензимидазол, бензоксазол, бензотиазол, бензотиофен, циннолин, тиофен, хиназолин, хиноксалин, хинолин,пиразол, пиррол, пиридин, имидазол, индол, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, пиперазин, триазол, фуран, тетрагидроизохинолин и тетрагидрохинолин, которые могут быть замещены одним или несколькими из следующих заместителей: алкил, алкокси, галоген, алкоксикарбонил, оксо,гидрокси, OCF3 или CF3. Соединения формулы I могут быть в форме энантиомеров или диастереоизомеров. Эти оптические изомеры и их смеси также составляют часть изобретения. Преимущественно соединения формулы I представляют собой такие соединения, для которыхR1 обозначает радикал -N(R4)-SO2R6,R2 и R3, одинаковые или разные, обозначают либо фенил, незамещенный или замещенный одним или несколькими галогенами, либо гетероароматический радикал, выбранный из пиридильного, пиримидильного циклов, причем эти гетероароматические радикалы могут быть незамещенными или замещенными галогеном;R6 обозначает алкил или радикал NHCOOC(СН 3)3;Ar обозначает фенил, который может быть замещен одним или несколькими из следующих заместителей: галоген, алкил, алкокси, гидрокси или гидроксиалкил;Het обозначает хинолин, пиридин, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, причем эти гетероциклы могут быть замещены одним или несколькими алкилами, галогенами или оксогруппами; причем алкильные радикалы и части молекул или алкоксильные радикалы и части молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода. Из предпочтительных соединений могут быть названы следующие соединения:N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(6-хлорпирид-2-ил)метилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(6-этилпирид-2-ил)метилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-хинол-6-илметилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-хинол-5-илметилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-изохинол-5-илметилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-пирид-3-илметилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1-оксидпирид-3-ил)метилсульфонамид,N-(1R,2S,4S)-бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-илметилсульфонамид,N-(1R,2R,4S)-бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-илметилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(тиазол-2-ил)метилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3-метоксифенил)метилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3-гидроксифенил)метилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3-гидроксиметилфенил)метилсульфонамид,этиловый эфир N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(метилсульфонил)-3-аминобензойной кислоты,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1-изобутил-пиперид-4-ил)метилсульфонамид,N-бензил-N-1-[бис(4-хлорфенил)метил]азетидин-3-иламин,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторбензил)амин,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторбензил)метилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(пирид-3-илметил)метилсульфонамид,N-1-[бис(4-фторфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(RS)-N-1-[(4-хлорфенил)пирид-3-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(R)-N-1-[(4-хлорфенил)пирид-3-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(S)-N-1-[(4-хлорфенил)пирид-3-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(RS)-N-1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(R)-N-1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(S)-N-1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(RS)-N-1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(R)-N-1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(S)-N-1-[бис(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)бензилсульфонамид,их оптические изомеры и их фармацевтически приемлемые соли. Соединения формулы I, у которых R1 является радикалом -N(R4)R5, где R5 обозначает атом водорода, -N(R4)-CO-R5 или -N(R4)-SO2R6, R4 обозначает радикал C(R11)(R12)-Ar или -C(R11)(R12)-Het и R12 обозначает атом водорода, могут быть получены по следующей реакционной схеме: В приведенных формулах R2, R3, R6 и R11 имеют те же значения, что и в формуле I, Rb обозначает радикал Ar или Het, Ar и Het имеют те же значения, что и в формуле I, и Hal обозначает атом галогена,преимущественно хлор или бром. Стадию а обычно проводят в инертном растворителе, таком как тетрагидрофуран, диоксан, хлорсодержащий растворитель (например, дихлорметан, хлороформ) при температуре в пределах от 15 до 30 С в присутствии основания такого как триалкиламин (например, триэтиламин, дипропилэтиламин) или в пиридине при температуре от 0 до 30 С. Стадию b проводят преимущественно в метаноле в автоклаве при температуре в пределах от 50 до 70 С. Стадию с обычно проводят в инертном растворителе, таком как хлорсодержащий растворитель (например, дихлорметан) в присутствии триацетоксиборогидрида натрия и уксусной кислоты при температуре, близкой к 20 С. Стадии d и е обычно проводят в инертном растворителе, таком как тетрагидрофуран, диоксан, хлорсодержащий растворитель (например, дихлорметан, хлороформ) в присутствии амина, такого как триалкиламин (например, триэтиламин) при температуре от 5 до 20 С. Производные Rb-COR11 являются промышленными продуктами или могут быть получены по методам, описанным в R.C. Larock, Comprehensive Organic Transformations, VCH editor. Производные Hal-SO2R6 являются промышленными продуктами или могут быть получены галогенированием соответствующих сульфоновых кислот, в частности, in situ в присутствии хлорсульфонилизоцианата и спирта в галогенсодержащем растворителе (например, дихлорметане, хлороформе). Производные Hal-CO-R5 являются промышленными продуктами или могут быть получены галогенированием соответствующих карбоновых кислот, в частности in situ в присутствии тионилхлорида в галогенсодержащем растворителе (например, дихлорметане, хлороформе). Азетидинолы 1 могут быть получены с применением или адаптацией методов, описанных KatritzkyA.R. с соавт. J. Heterocycl. Chem., 271 (1994) или Dave P.R., J. Org. Chem., 61, 5453 (1996), и в примерах. Работу обычно ведут по следующей схеме реакции: в формулах которой R2 и R3 имеют те же значения, что и в формуле I, a Hal обозначает атом хлора или брома. В стадии А работают преимущественно в инертном растворителе, таком как алифатический C1-C4 спирт (например, метанол, этанол), возможно в присутствии гидроксида щелочного металла, при температуре кипения реакционной среды. В стадии В восстановление обычно проводят с использованием гидрида лития и алюминия в тетрагидрофуране при температуре кипения реакционной среды. В стадии С работают преимущественно в инертном растворителе, таком как алифатический C1-C4 спирт (например, этанол, метанол), в присутствии гидрокарбоната натрия при температуре в пределах от 20 С до температуры кипения реакционной среды. В стадии D работают по методу, описанному Grisar М. с соавт. в J. Med. Chem., 885 (1973). Приготовляют магнийорганическое соединение из бромпроизводного и затем в реакцию вводят нитрил в эфире, таком как диэтиловый эфир, при температуре от 0 С до температуры кипения реакционной среды. После гидролиза спиртом промежуточный имин восстанавливают in situ борогидридом натрия при температуре от 0 С до температуры кипения реакционной среды. Производные R2-CO-R3 являются промышленными продуктами или могут быть получены с применением или адаптацией методов, описанных Kunder N.G. с соавт., J. Chem. Soc. Perkin Trans 1, 2815Consonni R. с соавт., J. Chem. Soc. Perkin Trans 1, 1989 (1996); FR-96-2481 и JP-94-261393. Производные R3Br являются промышленными продуктами или могут быть получены с применением или адаптацией методов, описанных Brandsma L. Synth. Comm., 20 (11) 1967 с соавт., 3153 (1990);Lemaire М. с соавт., Synth. Comm., 24 (1) 95 (1994); Goda Н. с соавт., Synthesis, 9, 849 (1992); Bauerle Р. с соавт., J. Chem. Soc. Perkin Trans 2, 489 (1993). Производные R3CN являются промышленными продуктами или могут быть получены с применением или адаптацией методов, описанных Bouyssou Р. с соавт., J. Het. Chem., 29 (4) 895 (1992); Suzuki N. с соавт., J. Chem. Soc. Chem. Comm., 1523 (1984); Marburg S. с соавт., J. Het. Chem., 17, 1333 (1980); Percec V. с соавт., J. Org. Chem., 60 (21) 6895 (1995). Соединения формулы I, у которых R1 является радикалом -N(R4)R5, могут быть получены по следующей схеме реакции: в формулах которой R2, R3 R4 и R5 имеют те же значения, что и в формуле I. Эту реакцию обычно проводят в инертном растворителе, таком как хлорсодержащий растворитель(например, дихлорметан), в присутствии триацетоксиборогидрида натрия и уксусной кислоты при температуре близкой к 20 С. Соединения HN(R4)R5 являются промышленными продуктами или могут быть получены в соответствии с классическими, известными специалистам методами или с применением или адаптацией мето-4 007109 дов, описанных Park К.К., J. Org. Chem., 60 (19) 6202 (1995); Kalir A. J. Med. Chem., 12 (3) 473 (1969);(1968); Bull. Soc. Chim. Fr., 835 (1962). Азетидиноны 2 могут быть получены окислением соответствующих азетидинолов преимущественно в диметилсульфоксиде с помощью комплекса пиридинсульфотриоксид при температуре близкой к 20 С или с помощью диметилсульфоксида в присутствии оксалилхлорида и триэтиламина при температуре от -70 до -50 С. Соединения формулы I, у которых R1 является радикалом -N(R4)COR5 или -N(R4)SO2R6 могут быть получены по следующей схеме реакции: В приведенных формулах R2, R3, R4, R5 и R6 имеют те же значения, что и в формуле I, a Hal обозначает галоген, преимущественно хлор. Стадии а и b обычно проводят в инертном растворителе, таком как тетрагидрофуран, диоксан,хлорсодержащий растворитель (например, дихлорметан, хлороформ) в присутствии амина, такого как триалкиламин (например, триэтиламин) при температуре от 5 до 20 С. Соединения формулы I, у которых R1 является радикалом -N(R4)-SO2R6, в котором R4 обозначаетHet или Ar, могут быть получены по следующей схеме реакции: В приведенных формулах R2, R3 и R6 имеют те же значения, что и в формуле I, Rd обозначает радикал Ar или Het (Het и Ar имеют те же значения, что и в формуле I), и Ms обозначает радикал метансульфонилокси. Стадию а обычно проводят в инертном растворителе, таком как тетрагидрофуран, в присутствии трифенилфосфина и диэтилазодикарбоксилата при температуре от 0 С до температуры кипения реакционной среды. Стадию b обычно проводят в инертном растворителе, таком как тетрагидрофуран, диоксан, хлорсодержащий растворитель (например, дихлорметан, хлороформ), при температуре в пределах от 15 до 30 С в присутствии основания, такого как триалкиламин (например, триэтиламин, дипропилэтиламин) или в пиридине при температуре в от 0 до 30 С. Стадию с предпочтительно проводят в инертном растворителе, таком как диоксан, в присутствииCsCO3 в кипящей реакционной смеси. Производные, у которых Rd является N-оксидом азотсодержащего гетероцикла, могут быть восстановлены до неокисленного соединения по методу, описанному Sanghanel Е. с соавт., Synthesis 1375(1996). Производные Rd-NH-SO2R6 могут быть получены по следующей схеме реакции: В приведенных формулах Hal обозначает атом галогена, a Rd обозначает радикал Het или Ar. Реакцию проводят в инертном растворителе, таком как тетрагидрофуран, диоксан, хлорсодержащий растворитель (например, дихлорметан, хлороформ), при температуре в пределах от 15 до 30 С в присутствии-5 007109 основания, такого как триалкиламин (например, триэтиламин, дипропилэтиламин), или в пиридине при температуре от 0 до 30 С. Производные, у которых Rd является N-оксидом азотсодержащего гетероцикла, могут быть получены по методу, описанному Rhie R., Heterocycles, 41 (2) 323 (1995). Соединения формулы I могут быть также получены по следующей схеме реакции: В приведенных формулах R1, R2 и R3 имеют те же значения, что и в формуле I, a Ph обозначает фе Стадию а обычно проводят в спирте, таком как метанол, в присутствии борогидрида натрия при температуре близкой к 20 С. В стадии b приготовляют из бромпроизводного магнийорганическое соединение и вводят его в реакцию в инертном растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре в пределах от 0 С до температуры кипения реакционной среды. Стадию с проводят с использованием галогенирующего агента, такого как бромисто-водородная кислота, тионилбромид, тионилхлорид, смесь трифенилфосфина и четырехбромистого или четыреххлористого углерода в уксусной кислоте или в инертном растворителе, таком как дихлорметан, хлороформ,четыреххлористый углерод или толуол при температуре от 0 С до температуры кипения реакционной среды. Стадию d проводят с использованием водорода в присутствии палладия на угле в спирте, таком как метанол, при температуре близкой к 20 С. Стадию е проводят в инертном растворителе, таком как ацетонитрил, в присутствии карбоната щелочного металла (например, карбоната калия) и йодида калия при температуре от 20 С до температуры кипения реакционной среды. Производные R3Br и производные R2-СНО являются промышленными продуктами или могут быть получены по методам, описанным, например, R.C. Larock, Comprehensive Organic Transformations, VCHeditor. Соединения формулы I, у которых R1 является радикалом -N(R4)-SO2-R6, где R4 обозначает радикал пиперид-4-ил, возможно замещенный по азоту алкильным радикалом, могут быть также получены по следующей схеме реакции: В приведенных формулах R2, R3 и R6 имеют те же значения, что и в формуле I, alk обозначает алкильный радикал, и Re обозначает радикал трет-бутилкарбонилокси. Стадию а проводят в инертном растворителе, таком как хлорсодержащий растворитель (например,дихлорметан), в присутствии гидрида, такого как триацетоксиборогидрид натрия, и уксусной кислоты при температуре от 0 С до температуры кипения реакционной среды. Стадию b обычно проводят в инертном растворителе, таком как тетрагидрофуран, диоксан, хлорсодержащий растворитель (например, дихлорметан, хлороформ), в присутствии амина, такого как триалкиламин (например, триэтиламин), при температуре от 5 до 20 С. Стадию с проводят с использованием хлористо-водородной кислоты в диоксане при температуре от 0 С до температуры кипения реакционной среды. Стадию d проводят с использованием любого известного специалистам средства для алкилирования амина без затрагивания остальной части молекулы. Могут быть, например, использованы алкилгалогениды в присутствии органического основания, такого как триэтиламин, гидроксид щелочного металла(например, гидроксид натрия и калия), возможно в присутствии бромида тетрабутиламмония в инертном растворителе, таком как диметилсульфоксид, диметилформамид или пиридин, при температуре от 20 до 50 С. Соединения формулы I, у которых R1 является радикалом -N(R4)-SO2-R6, где R4 обозначает пирролид-1-илзамещенный фенильный радикал, могут быть также получены действием пирролидина на соответствующее соединение формулы I, у которого R1 является радикалом -N(R4)SO2R6, где R4 обозначает фенил, замещенный атомом галогена. Эту реакцию преимущественно проводят в диметилсульфоксиде при температуре от 50 до 95 С. Для специалиста является очевидным, что при осуществлении описанных выше способов по изобретению может оказаться необходимым во избежание побочных реакций вводить защитные группы для аминных, гидроксильных и карбоксильных функций. Такими группами являются группы, которые могут быть удалены без затрагивания остальной части молекулы. В качестве примеров защитных групп для аминной функции можно назвать трет-бутил- или метилкарбаматы, которые могут быть регенерированы с помощью йодтриметилсилана, или аллилкарбамат, который может быть удален с помощью палладиевых катализаторов. В качестве примеров защитных групп для гидроксильной функции можно назвать триэтилсилил, трет-бутилдиметилсилил, которые могут быть регенерированы с помощью фторида тетрабутиламмония, или же несимметричные ацетали (например, метоксиметил, тетрагидропиранил), регенерируемые с помощью хлористо-водородной кислоты. В качестве защитных групп для карбоксильных функций можно назвать сложные эфиры (например, аллиловый, бензиловый), оксазолы и 2-алкил-1,3 оксазолины. Другие пригодные для использования защитные группы описаны Greene T.W. с соавт., Protecting groups in Organic Synthesis, second edition, 1991, John WileySons. Соединения формулы I могут быть очищены обычными известными методами, например кристаллизацией, хроматографией или экстракцией. Энантиомеры соединений формулы I могут быть получены расщеплением рацемических смесей,например, с помощью хроматографии на хиральной колонке по Pickle W.H. с соавт., Assymetric Synthesis,vol.1, Academic Press (1983) или путем образования солей или синтезом из хиральных предшественников.-7 007109 Диастереоизомеры могут быть получены с помощью известных классических методов (кристаллизации,хроматографии или из хиральных предшественников). Соединения формулы I могут быть при необходимости превращены в солевые аддукты с минеральными или органическими кислотами действием кислоты в органическом растворителе, таком как спирт,кетон, простой эфир или хлорсодержащий растворитель. Эти соли также составляют часть изобретения. В качестве примеров фармацевтически приемлемых солей могут быть названы следующие соли: бензолсульфонат, гидробромид, гидрохлорид, цитарат, этансульфонат, фумарат, глюконат, йодат, изетионат, малеат, метансульфонат, метилен-бис-b-оксинафтоат, нитрат, оксалат, памоат, фосфат, салицилат, сукцинат, сульфат, тартрат, теофиллинацетат и п-толуолсульфонат. Соединения формулы I обладают интересными фармакологическими свойствами. Эти соединения характеризуются сильным сродством к каннабиноидным рецепторам и, в частности, к рецепторам типа СВ 1. Они являются антагонистами рецептора СВ 1 и, следовательно, могут быть использованы при лечении и профилактике расстройств, затрагивающих центральную нервную систему, иммунную систему,сердечно-сосудистую или эндокринную систему, респираторную систему, желудочно-кишечный аппарат и расстройства репродуктивной системы (Hollister, Pharm. Rev., 38, 1986, 1-20; Reny и Sinha, Prog. Drug.Res., 36, 71-114 (1991); Consroe и Sandyk, в Marijua na/Cannabinoids, Neurobiology and Neurophysiology,459; Murphy L. and Barthe A. Eds, CRC Press, 1992). Таким образом, эти соединения могут быть использованы для лечения и предупреждения психозов,включая шизофрению, тревожных состояний, депрессии, эпилепсии, нейродегенерации, мозжечковых и спинномозжечковых расстройств, нарушения когнитивных функций, черепномозговой травмы, панических приступов, периферических нейропатий, глауком, мигрени, болезни Паркинсона, болезни Альцгеймера, хореи Гентингтона, синдрома Рейно, тремора, обсессивно-импульсивного синдрома, старческого слабоумия, нарушений тимуса, синдрома Туретта, замедленной дискинезии, двухполюсных расстройств,рака, нарушений двигательного аппарата под влиянием лекарств, дистоний, эндотоксемических шоков,гемморрагических шоков, гипотензии, бессонницы, иммунологических заболеваний, рассеянного склероза, рвот, астмы, нарушений аппетита (булимия, анорексия), ожирения, нарушений памяти, нарушений прохода по кишечнику, при отмене хронического лечения, при лечении синдрома отмены алкоголя или лекарств (например, опиоидов, барбитуратов, конопли, кокаина, амфетаминов, фенциклида, галлюциногенов, бензодиазепинов), таких как аналгетики или усилители анальгетической активности наркотических и ненаркотических лекарств. Они могут быть также использованы для лечения или профилактики прохода по кишечнику. Сродство соединений формулы I к рецепторам конопли было определено по методу, описанному(1993). В проводимом тесте значение CI50 для соединений формулы I ниже или равно 1000 нМ. Их антагонистическая активность была продемонстрирована с помощью модели гипотермии, вызываемой агонистом рецепторов конопли (СР-55940) у мыши, по методу, описанному Pertwee в R.G. в Marijuana, Harvey D.J. eds, 84 Oxford IRL Press, 263-277 (1985). В этом тесте значение DE50 для соединений формулы I ниже или равно 50 мг/кг. Соединения формулы I имеют низкую токсичность. Их DL50 выше 40 мг/кг при подкожном введении у мыши. Изобретение иллюстрируют следующие примеры. Пример 1.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(6-хлорпирид-2-ил)метилсульфонамид может быть получен следующей последовательностью операций: к раствору 1,54 г 1-[бис(4-хлорфенил) метил]азетидин-3-ола и 1,22 г N-(6-хлорпирид-2-ил)метилсульфонамида в 120 см 3 безводного тетрагидрофурана добавляют под аргоном 2,4 см 3 диэтилазодикарбоксилата и 1,44 г трифенилфосфина. После 20 ч перемешивания при 20 С реакционную смесь досуха упаривают при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,040-0,063 мм, высота 30 см,диаметр 4,5 см), элюируя под давлением 0,5 бар аргона смесью циклогексана и этилацетата (80/20 по объему) и собирая фракции объемом 60 см 3. Фракции 6-9 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 1,75 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(6-хлорпирид 2-ил)метилсульфонамида в виде белой пенистой массы [спектр ЯМР 1H (300 МГц, CDCl3,в м.д.): 2,853,00 (м:2 Н); 2,91 (с:3H); 3,57 (т расщепл., J=7 и 2 Гц:2 Н); 4,25 (с:1 Н); 4,64 (м:1 Н); от 7,20 до 7,35 (м:9 Н); 7,36 (дд, J=8 и 1 Гц:1 Н); 7,71 (т, J=8 Гц:1 Н)]. 1-[Бис(4-хлорфенил)метил]азетидин-3-ол может быть получен в соответствии с последовательностью операций, описанной Katritzky A.R. с соавт. J. Heterocycl. Chem., 271 (1994), исходя из 35,5 г гидрохлорида [бис(4-хлорфенил)метил]амина и 11,0 см 3 эпихлоргидрина. Выделяют 9,0 г 1-[бис(4 хлорфенил)метил]азетидин-3-ола. Гидрохлорид [бис(4-хлорфенил)метил]амина может быть получен по методу, описанному Grisar М. с соавт. J. Med. Chem., 885 (1973).N-(6-Хлорпирид-2-ил)метилсульфонамид может быть получен следующей последовательностью операций. К охлажденному до +5 С раствору 2-амино-6-хлорпиридина в 12,5 см 3 пиридина прибавляют по каплям в течение 1 ч 7,8 см 3 метилсульфонилхлорида. После достижения комнатной температуры и перемешивания в течение 20 ч к черной реакционной смеси добавляют 140 см 3 воды и экстрагируют 200 см 3 дихлорметана. Органическую фазу отделяют, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Полученный масляный остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм, высота 30 см, диаметр 4 см), элюируя под давлением 0,5 бар аргона смесью циклогексана и этилацетата (70/30 по объему) и собирая фракции объемом 60 см 3. Фракции 5-10 объединяют и досуха упаривают при пониженном давлении (2,7 кПа), получая 17 гN-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(6-этилпирид-2-ил)метилсульфонамид может быть получен повторением последовательности операций, описанной в примере 1, исходя из 0,61 г 1-[бис(4 хлорфенил)метил]азетидин-3-ола, 0,40 г N-(6-этилпирид-2-ил)метилсульфонамида, 50 см 3 безводного тетрагидрофурана, 0,96 см 3 диэтилазодикарбоксилата и 0,577 г трифенилфосфина. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,040-0,063 мм, высота 20 см, диаметр 2 см),элюируя под давлением 0,5 бар аргона смесью циклогексана и этилацетата (70/30 по объему) и собирая фракции объемом 30 см 3. Фракции 6-9 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,3 г масла, которое растирают в смеси 5 см 3 диэтилового эфира и 5 см 3 диизопропилового эфира. Суспензию фильтруют, твердое вещество отжимают и сушат при пониженном давлении (2,7 кПа), получая 0,11 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(6-этилпирид-2-ил)метилсульфонамида в виде белого твердого вещества. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 1,26 (т, J=7,5 Гц:3H); 2,76 (кв, J=7,5 Гц:2 Н); от 2,85 до 2,95 (м:2 Н); 2,90 (с:3H); 3,53 (т расщепл., J=7 и 2 Гц:2 Н); 4,22N-(6-Этилпирид-2-ил)метилсульфонамид может быть получен следующей последовательностью операций. К охлажденному до +5 С раствору 2,50 г 2-амино-6-хлорпиридина в 2,50 см 3 пиридина прибавляют по каплям 1,56 см 3 метилсульфонилхлорида. После 20 ч перемешивания при 20 С к реакционной смеси добавляют 8 см 3 воды и затем смесь фильтруют. Фильтрат досуха упаривают при 50 С и пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,040-0,063 мм, высота 30 см, диаметр 4 см), элюируя под давлением 0,5 бар аргона 1,5 л дихлорметана и затем смесью дихлорметана и этанола (98/2 по объему) и собирая фракции объемом 60 см 3. Фракции 8-12 объединяют и досуха упаривают при пониженном давлении (2,7 кПа), получая 2,8 г N-(6-этилрпирид-2 ил)метилсульфонамида в виде желтого масла. Пример 3.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-хинол-6-илметилсульфонамид может быть получен следующим образом. К раствору 0,50 г N-хинол-6-илметилсульфонамида в 50 см 3 безводного тетрагидрофурана добавляют под аргоном 0,70 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола, 0,597 трифенилфосфина, после чего приливают 0,40 см 3 диэтилазодикарбоксилата. После 20 ч перемешивания при 20 С реакционную смесь нагревают при температуре кипения в течение 4 ч и добавляют 2,98 г трифенилфосфина и 2,0 см 3 диэтилазодикарбоксилата. После 48 ч перемешивания при 20 С смесь досуха упаривают при пониженном давлении (2,7 кПа). Остаток забирают 30 см 3 диэтилового эфира и полученную суспензию фильтруют, а фильтрат досуха упаривают. Часть полученного остатка (0,90 г) хроматографируют на колонке Bond Elut с катионообменной сульфоновокислотной смолой SCX (гранулометрия 0,054 мм, высота 4 см, диаметр 3 см), элюируя вначале метанолом и затем 2 М аммиачным раствором для элюирования целевого продукта и собирая фракции объемом 5 см 3. Фракции 16-19 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,33 г масла, которое перемешивают в 10 см 3 диизопропилового эфира. Образовавшуюся суспензию фильтруют. Отфильтрованный повторно фильтрат выделяет через 15 мин твердое вещество, которое сушат при 50 С и пониженном давлении (2,7 кПа). Получают 83 мг N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-хинол-6-илметилсульфонамида в виде белого твердого вещества. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 2,87 (с:3H); 2,89 (м:2 Н); 3,55 (т расщепл., J=7 и 1 Гц:2 Н); 4,18 (с:1 Н); 4,69 (м:1 Н); от 7,15 до 7,30 (м:8 Н); 7,47 (дд, J=8,5 и 4 Гц:1 Н); 7,58 (дд,J=9 и 2,5 Гц:1 Н); 7,73 (д, J=2,5 Гц:1 Н); 8,10-8,20 (м:2 Н); 8,97 (дд, J=4 и 1,5 Гц:1 Н)].N-Хинол-6-илметилсульфонамид может быть получен следующим образом. К охлажденному до+3 С раствору 1,98 г 6-аминохинолеина в 1,75 см 3 пиридина приливают в течение 1 ч по каплям 1,1 см 3 метилсульфонилхлорида. После 20 ч перемешивания при 20 С к реакционной смеси добавляют 50 см 3 дихлорметана и затем смесь фильтруют. Фильтрат разделяют на фазы. Органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа), получая 1,15 г N-хинол-6-илметилсульфонамида в виде твердого вещества желто-кремового цвета. Пример 4.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-хинол-5-илметилсульфонамид может быть получен следующим образом. К раствору 0,50 г N-хинол-5-илметилсульфонамида в 70 см 3 безводного тетра-9 007109 гидрофурана добавляют под аргоном 0,70 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола, 0,597 г трифенилфосфина, после чего приливают 0,40 см 3 диэтилазодикарбоксилата и 0,45 г 1,2-бис(дифенилфосфин)этана. После 20 ч перемешивания при 20 С реакционную смесь досуха упаривают при пониженном давлении (2,7 кПа). Остаток забирают 70 см 3 этилацетата и образовавшийся раствор промывают 30 см 3 соляного раствора, высушивают над сульфатом магния, фильтруют и досуха упаривают при 0 С и пониженном давлении (2,7 кПа). Полученное фиолетовое масло хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм, высота 35 см, диаметр 3,9 см), элюируя под давлением 0,5 бар аргона смесью циклогексана и этилацетата (40/60, затем 30/70 и 20/80 по объему) и собирая фракции объемом 50 см 3. Фракции 6-12 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток забирают 15 см 3 метанола, образовавшуюся белую суспензию фильтруют, твердое вещество отжимают и сушат при 50 С и пониженном давлении (2,7 кПа), получая 0,35 г N-1-[бис(4-хлорфенил) метил]азетидин-3-ил-N-хинол-5-илметилсульфонамида в виде белого твердого вещества. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 2,60 (т, J=7 Гц:1 Н); 2,84 (т, J=7 Гц:1 Н); 2,99 (с:3H); 3,36 (т расщепл., J=7 и 2,5 Гц:1 Н); 3,56 (т расщепл., J=7 и 2,5 Гц:1 Н); 4,01 (с:1 Н); 4,85 (м:1 Н); от 7,10 до 7,25 (м:8 Н); 7,40 (дд,J=7,5 и 1 Гц:1 Н); 7,54 (дд, J=8,5 и 4 Гц:1 Н); 7,74 (дд, J=8 и 7,5 Гц:1 Н); 8,20 (д ушир., J=8 Гц:1 Н); 8,54 (д ушир., J=9 Гц:1 Н); 8,99 (дд, J=4 и 1,5 Гц:1 Н)].N-Хинол-5-илметилсульфонамид может быть получен повторением последовательности операций,описанной в примере 3, исходя из 2,0 г аминохинолеина, 3,0 см 3 пиридина и 1,1 см 3 метилсульфонилхлорида. Получают 2,47 г N-хинол-5-илметилсульфонамида в виде коричнево-желтого твердого вещества. Пример 5.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-изохинол-5-илметилсульфонамид может быть получен повторением последовательности операций, описанной в примере 4, исходя из 0,497 г N(изохинол-5-ил)метилсульфонамида, 70 см 3 безводного тетрагидрофурана, 0,712 г 1-[бис(4-хлорфенил) метил]азетидин-3-ола, 0,597 г трифенилфосфина, 0,40 см 3 диэтилазодикарбоксилата и 0,45 г 1,2 бис(дифенилфосфин)этана. Полученное неочищенное бурое масло очищают хроматографией на колонке с силикагелем (гранулометрия 0,063-0,200 мм, высота 38 см, диаметр 3 см), элюируя смесью циклогексана и этилацетата (30/70 по объему) и собирая фракции объемом 40 см 3. Фракции 8-23 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток перемешивают в 15 см 3 диэтилового эфира, суспензию фильтруют и нерастворимый материал хроматографируют на колонке со смолой SCX (высота 4 см, диаметр 3 см), промывая вначале смесью метанола с дихлорметаном (50/50 по объему) и затем элюируя 2 М раствором аммиака в метаноле и собирая фракции объемом 20 см 3. Фракции 1-6 объединяют и отфильтровывают появившийся белый нерастворимый твердый материал, который отжимают и затем сушат при 50 С и пониженном давлении (2,7 кПа). Получают 0,169 г N-1-[бис(4 хлорфенил)метил]азетидин-3-ил-N-изохинол-5-илметилсульфонамида в виде белого твердого вещества.N-(Изохинол-5-ил)метилсульфонамид может быть получен повторением последовательности операций, описанной в примере 4, исходя из 2,0 г 5-аминоизохинолеина, 3,0 см 3 пиридина и 1,1 см 3 метилсульфонилхлорида. Получают 2,3 г N-(изохинол-5-ил)метилсульфонамида в виде твердого вещества бежевого цвета. Пример 6.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-пирид-3-илметилсульфонамид может быть получен следующим образом. К раствору 0,144 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1-оксидпирид-3-ил)метилсульфонамида в 5 см 3 хлороформа вливают 0,042 см 3 треххлористого фосфора и нагревают смесь при температуре кипения. После перемешивания в течение 1 ч 30 мин реакционную смесь оставляют до возвращения ее температуры к комнатной, добавляют 5 см 3 0,1 н. соляной кислоты, перемешивают и разделяют фазы. Органическую фазу разбавляют 20 см 3 хлороформа, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм, высота 9 см, диаметр 1,8 см),элюируя под давлением 0,1 бар аргона смесью дихлорметана и метанола (95/5 по объему) и собирая фракции объемом 15 см 3. Фракции 2-4 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток перемешивают в 15 см 3 диэтилового эфира, суспензию фильтруют и твердый материал сушат при пониженном давлении (2,7 кПа). Получают 35 мг N-1-[бис(4-хлорфенил)метил]азетидин-3 ил-N-пирид-3-илметилсульфонамида в виде твердого вещества кремового цвета. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 2,80-2,95 (м:2 Н); 2,87 (с:3H); 3,51 (т расщепл., J=7 и 1,5 Гц:2 Н); 4,18 (с:1 Н); 4,65N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1-оксидпирид-3-ил)метилсульфонамид может быть получен следующим образом. К раствору 0,265 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола и 0,162 г N-(1-оксидпирид-3-ил)метилсульфонамида в 25 см 3 безводного тетрагидрофурана добавляют под аргоном 0,16 см 3 диэтилазодикарбоксилата и 0,226 г трифенилфосфина. После 20 ч перемешивания при 20 С и затем 24 ч при температуре кипения реакционную смесь досуха упаривают при пониженном давлении(2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм, высота 20 см, диаметр 1,5 см), элюируя под давлением 0,5 бар аргона смесью дихлорметана и метанола (98/2 по объему) и собирая фракции объемом 40 см 3. Фракции 26-64 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток перемешивают в 10 см 3 диэтилового эфира, суспензию фильтруют,нерастворимый материал отжимают и сушат при пониженном давлении (2,7 кПа). Получают 0,10 г N-1[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1-оксидпирид-3-ил)метилсульфонамида в виде белого твердого вещества. [Спектр ЯМР 1H (400 МГц, (CD3)2SO d6,в м.д.): 2,78 (т, J=7 Гц:2 Н); 3,06 (с:3H); 3,37 (т,J=7 Гц:2 Н); 4,45 (с:1 Н); 4,71 (м:1 Н); 7,30-7,50 (м:10 Н); 8,21 (д ушир., J=6,5 Гц:1 Н); 8,27 (с ушир.:1 Н)].N-(1-Оксид-пирид-3-ил)метилсульфонамид может быть получен следующим образом. К раствору 1,81 г N-пирид-3-ил-метилсульфонамида в 71 см 3 N,N-диметилформамида и 3 см 3 метанола добавляют частями 7,1 г 50-55%-ной 3-хлорнадбензойной кислоты и затем 0,56 см 3 40%-ной фтористо-водородной кислоты. После 2 ч перемешивания при 20 С реакционную смесь выливают на 500 г льда, перемешивают и затем фильтруют. Фильтрат досуха упаривают при 60 С и пониженном давлении (2,7 кПа). Остаток забирают 50 см 3 смеси дихлорметана с метанолом (98/2 по объему) и фильтруют. Фильтрат хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм, высота 27 см, диаметр 4 см), элюируя под давлением 0,5 бар аргона смесью дихлорметана и метанола (98/2 по объему) и собирая фракции объемом 60 см 3. Фракцию 62 досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,96 г N-(1 оксид-пирид-3-ил)метилсульфонамида в виде желтоватого твердого вещества.N-Пирид-3-илметилсульфонамид может быть получен повторением последовательности операций,описанной в примере 1, исходя из 2 г 3-аминопиридина, 5 см 3 пиридина и 1,8 см 3 метилсульфонилхлорида. Полученный сырой продукт перемешивают в 40 см 3 диэтилового эфира, суспензию фильтруют и твердый материал отжимают и сушат при пониженном давлении (2,7 кПа), получая 2,47 г N-пирид-3-илметилсульфонамида в виде розоватого твердого вещества. Пример 8.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-циклогексилметилсульфонамид может быть получен следующим образом. К раствору 1,8 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил)-Nциклогексиламина, 0,7 см 3 триэтиламина и 20 мг 4-диметиламинопиридина в 25 см 3 дихлорметана добавляют при перемешивании 0,4 см 3 метилсульфонилхлорида. После 48 ч перемешивания при 20 С добавляют к реакционной смеси 20 см 3 дихлорметана, 20 см 3 воды, перемешивают и разделяют фазы. Органическую фазу высушивают над сульфатом магния и упаривают при 50 С и пониженном давлении (2,7 кПа). Бурый масляный остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,2 мм, высота 20 см, диаметр 2,0 см), элюируя под давлением 0,1 бар аргона смесью дихлорметана и метанола (96/4 по объему) и собирая фракции объемом 10 см 3. Фракции 2-4 и 5-10 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем(гранулометрия 0,063-0,2 мм, высота 30 см, диаметр 1,5 см), элюируя под давлением 0,1 бар аргона смесью циклогексана и этилацетата (70/30 по объему) и собирая фракции объемом 5 см 3. Фракции 7-10 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,10 г N-1-[бис(4 хлорфенил)метил]азетидин-3-ил-N-метилсульфонамида в виде пенистой массы кремового цвета.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил)-N-циклогексиламин может быть получен следующим образом. К раствору 1,5 г 1-[бис(4-хлорфенил)метил]азетидин-3-она в 25 см 3 1,2-дихлорэтана добавляют 0,5 г циклогексиламина, 1 г триацетоксиборогидрида натрия и 0,3 см 3 100%-ной уксусной кислоты. После 20 ч перемешивания при 20 С добавляют к реакционной смеси при перемешивании 20 см 3 дихлорметана и 10 см 3 воды, после чего смесь нейтрализуют до рН 7-8 1 н. водным раствором гидроксида натрия. Смесь разделяют на фазы, органическую фазу высушивают над сульфатом магния и досуха упаривают при 50 С и пониженном давлении (2,7 кПа). Получают 1,8 г N-1-[бис(4-хлорфенил)метил]азетидин-3 ил)-N-циклогексиламин в виде пасты кремового цвета, которая будет использована как таковая в последующей стадии. 1-[бис(4-хлорфенил)метил]азетидин-3-он может быть получен в соответствии со следующей последовательностью операций: к раствору 5,0 см 3 оксалилхлорида в 73 см 3 охлажденного до -78 С дихлорметана добавляют раствор 8,1 см 3 диметилсульфоксида в 17,6 см 3 дихлорметана. Смесь выдерживают 5 ч при -78 С и приливают раствор 16,0 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола в 50 см 3 дихлорметана. Смесь выдерживают 5 ч при -78 С, прибавляют по каплям 26,6 см 3 триэтиламина и оставляют смесь до возвращения ее температуры к комнатной. Через 16 ч реакционную смесь 4 раза промывают 200 см 3 во- 11007109 ды и затем 200 см 3 насыщенного раствора хлорида натрия, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Полученный остаток хроматографируют на колонке с силикагелем (гранулометрия 0,04-0,06 мм, диаметр 9,2 см высота 21 см), элюируя под давлением 0,5 бар аргона смесью этилацетата и циклогексана (40/60 по объему) и собирая фракции объемом 200 см 3. Фракции 15-25 объединяют и досуха упаривают при пониженном давлении (2,7 кПа), получая 8,9 г 1-[бис(4-хлорфенил)метил]азетидин-3-она в виде бледно-желтых кристаллов с т.пл. 111 С. Пример 9.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-циклопропилметилсульфонамид может быть получен повторением последовательности операций, описанной в примере 8, исходя из 1,6 г N-1-[бис(4 хлорфенил)метил]азетидин-3-ил)-N-циклопропиламина, 25 см 3 дихлорметана, 0,7 см 3 триэтиламина, 20 мг 4-диметиламинопиридина и 0,4 см 3 метилсульфонилхлорида и перемешивая смесь в течение 20 ч при 20 С. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,2 мм, высота 30 см, диаметр 2,0 см), элюируя под давлением 0,1 бар аргона смесью дихлорметана и метанола (97/3 по объему) и собирая фракции объемом 10 см 3. Фракции 6-9 и 10-20 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Полученный остаток хроматографируют на колонке с силикагелем(гранулометрия 0,063-0,200 мм, высота 30 см, диаметр 2,0 см), элюируя под давлением 0,1 бар аргона смесью циклогексана и этилацетата (70/30 по объему) и собирая фракции объемом 10 см 3. Фракции 6-11 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,14 г N-1-[бис(4 хлорфенил)метил]азетидин-3-ил-N-циклопропилметилсульфонамида в виде пенистой массы кремового цвета. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 0,79 (м:2 Н); 0,95 (м:2 Н); 2,11 (м:1 Н); 2,84 (с:3H); 3,17N-1-[бис(4-хлорфенил)метил]азетидин-3-ил)-N-циклопропиламин может быть получен, как описано в примере 8, исходя из 1,5 г 1-[бис(4-хлорфенил)метил]азетидин-3-она, 25 см 3 1,2-дихлорэтана, 0,37 см 3 циклопропиламина, 1 г триацетоксиборогидрида натрия и 0,3 см 3 100%-ной уксусной кислоты. Получают 1,6 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил)-N-циклопропиламина в виде бурого масла, которое будет использовано как таковое в последующей стадии. Пример 10.N-(1R,2S,4S)-Бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-илметилсульфонамид может быть получен повторением последовательности операций, описанной в примере 8, исходя из 2,0 г N-(1R,2S,4S)-бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-иламина, 25 см 3 дихлорметана, 0,7 см 3 триэтиламина, 20 мг 4-диметиламинопиридина и 0,4 см 3 метилсульфонилхлорида и перемешивая смесь в течение 20 ч. Бурый маслянистый остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,2 мм, высота 30 см, диаметр 2,0 см), элюируя под давлением 0,1 бар аргона смесью дихлорметана и метанола (97/3 по объему) и собирая фракции объемом 10 см 3. Фракции 618 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,2 мм, высота 30 см, диаметр 2,0 см), элюируя под давлением 0,1 бар аргона смесью циклогексана и этилацетата (70/30 по объему) и собирая фракции объемом 10 см 3. Фракции 8-14 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,70 г N-(1R,2S,4S)-бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-илметилсульфонамида в виде пенистой массы кремового цвета. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 1,20-1,75N-(1R,2S,4S)-Бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-иламин может быть получен повторением последовательности операций, описанной в примере 8, исходя из 1,5 г 1-[бис(4-хлорфенил)метил]азетидин-3-она, 25 см 3 1,2-дихлорэтана, 1,5 г (1R,2S,4S)-бицикло[2.2.1]гептил-3 амина, 1 г триацетоксиборогидрида натрия и 0,3 см 3 100%-ной уксусной кислоты. Получают 2 г N(1R,2S,4S)-бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-иламина в виде бурого масла которое будет использовано как таковое в последующей стадии. Пример 11.N-(1R,2R,4S)-Бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-илметилсульфонамид может быть получен повторением последовательности операций, описанной в примере 8, исходя из 1,8 г N-(1R,2R,4S)-бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-иламина, 25 см 3 дихлорметана, 0,7 см 3 триэтиламина, 20 мг 4-диметиламинопиридина и 0,4 см 3 метилсульфонилхлорида и перемешивая смесь в течение 20 ч. Бурый маслянистый остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,2 мм, высота 30 см, диаметр 2,0 см), элюируя под давлением 0,1 бар аргона смесью циклогексана и этилацетата (60/40 по объему) и собирая фракции объемом 10 см 3. Фракции 3-12 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,2 мм, высота 30 см, диаметр 2,0 см), элюируя под давлением 0,1 бар аргона смесью циклогексана и этилацетата (70/30 по объему) и собирая фракции объемом 10 см 3. Фракции 4-10 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,10 г N-(1R,2R,4S)-бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-илметилсуль- 12007109 фонамида в виде желтой пенистой массы. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 1,00-1,85 (м:8 Н); 2,14 (м:1 Н); 2,33 (м:1 Н); 2,82 (с:3H); 3,40-3,60 (м:4 Н); 3,71 (дд ушир., J=8 и 6 Гц:1 Н); 4,10 (м:1 Н); 4,47N-(1R,2R,4S)-Бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-иламин может быть получен повторением последовательности операций, описанной в примере 8, исходя из 1,5 г 1-[бис(4-хлорфенил)метил]азетидин-3-она, 25 см 3 1,2-дихлорэтана, 0,6 г (1R,2R,4S)-бицикло[2.2.1]гептил-3 амина, 1,0 г триацетоксиборогидрида натрия и 0,3 см 3 100%-ной уксусной кислоты. Получают 1,8 г N(1R,2R,4S)-бицикло[2.2.1]гепт-2-ил-N-1-[бис(4-хлорфенил)метил]азетидин-3-иламина в виде пасты кремового цвета, которую используют как таковую в последующей стадии. Пример 12.N-[(1-Бензгидрил)азетидин-3-ил]-N-фенилметилсульфонамид может быть получен следующим образом. К раствору 2 г 1-бензгидрил-3-анилиноазетидина в 40 см 3 дихлорметана приливают 0,7 см 3 метилсульфонилхлорида и затем добавляют 1,34 г триэтиламина. После перемешивания в течение 4 ч 15 мин при 20 С реакционную смесь дважды промывают водой и органическую фазу высушивают над сульфатом магния и затем досуха упаривают при 50 С и пониженном давлении (2,7 кПа). Полученное каштанового цвета масло хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,2 мм, высота 26 см, диаметр 3,6 см), элюируя под давлением 0,5 бар аргона смесью циклогексана и этилацетата (70/30 по объему) и собирая фракции объемом 50 см 3. Фракции 10-15 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток растирают в диэтиловом эфире, суспензию фильтруют, твердый материал отжимают и затем сушат при пониженном давлении (2,7 кПа). Получают 35 мг N-[(1 бензгидрил)азетидин-3-ил]-N-фенилметилсульфонамида в виде белого твердого вещества. [Спектр ЯМР 1 Н (300 МГц, (CD3)2SO d6 с добавкой нескольких капель CD3COOD d4,в м.д.): 2,72 (м:2 Н); 2,92 (с:3H); 3,36 (м:2 Н); 4,32 (с:1 Н); 4,73 (м:1 Н);7,10-7,45 (м:15 Н)]. 1-Бензгидрил-3-анилиноазетидин может быть получен повторением последовательности операций,описанной в примере 8, исходя из 5 г 1-бензгидрилазетидин-3-она, 1,92 см 3 анилина, 74 см 3 1,2 дихлорэтана, 6,3 г триацетоксиборогидрида натрия и 1,2 см 3 100%-ной уксусной кислоты. Получают 8,81 г 1-бензгидрил-3-анилиноазетидина в виде смолы каштанового цвета, которая будет использована как таковая в последующей стадии. Пример 13.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид может быть получен следующим образом. К раствору 1,23 г 1-[бис(4-хлорфенил)метил]азетидин-3-илового эфира метилсульфоновой кислоты и 0,66 г N-(3,5-дифторфенил)метилсульфонамида в 25 см 3 диоксана добавляют 1,0 г карбоната цезия. После 5 ч перемешивания при температуре кипения и затем 20 ч при 20 С к реакционной смеси добавляют 50 см 3 диэтилового эфира и 30 см 3 соляного раствора, после чего перемешивают и разделяют фазы. Органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при 50 С и пониженном давлении (2,7 кПа). Полученное оранжевое масло хроматографируют на колонке с силикагелем (гранулометрия 0,040-0,063 мм, высота 25 см, диаметр 2,0 см), элюируя под давлением 0,5 бар аргона смесью циклогексана и этилацетата (65/35 по объему) и собирая фракции объемом 10 см 3. Фракции 6-10 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,040-0,063 мм, высота 15 см, диаметр 1,0 см), элюируя под давлением 0,5 бар аргона смесью циклогексана и этилацетата (65/35 по объему) и собирая фракции объемом 5 см 3. Фракцию 7 досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,11 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамида в виде белого порошка. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 2,82 (с:3H); 2,85 (м:2 Н); 3,52 (т расщепл., J=7 и 2 Гц:2 Н); 4,22 (с:1 Н); 4,47 (м:1 Н); 6,75-6,90 (м:3H); 7,20-7,35 (м:8 Н)]. Метод 2. К раствору 1,41 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола и 0,95 г N-(3,5-дифторфенил) метилсульфонамида в 100 см 3 безводного тетрагидрофурана добавляют под аргоном 0,78 см 3 диэтилазодикарбоксилата и 1,31 г трифенилфосфина. После 16 ч перемешивания при 20 С добавляют 300 см 3 этилацетата, реакционную смесь дважды промывают 100 см 3 воды, высушивают над сульфатом магния и досуха упаривают при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,2-0,063 мм, высота 50 см, диаметр 4 см), элюируя под давлением 0,6 бар аргона смесью циклогексана и этилацетата (75/25 по объему) и собирая фракции объемом 125 см 3. Фракции 6-12 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 1,8 г твердого вещества,которое растворяют при нагревании в смеси этилацетат/диизопропиловый эфир (15/2 по объему), охлаждают и разбавляют 100 см 3 пентана для инициирования кристаллизации. После отфильтровывания и сушки получают 1,0 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамида в виде белых кристаллов, плавящихся при 154 С.N-(3,5-Дифторфенил)метилсульфонамид может быть получен следующим образом. К раствору 3,5 г 3,5-дифторанилина в 75 см 3 дихлорметана, медленно прибавляют 2,0 см 3 метилсульфонилхлорида, 3,8 см 3 триэтиламина и 20 мг 4-диметиламинопиридина. После 20 ч перемешивания при 20 С к реакционной- 13007109 смеси добавляют 20 см 3 дихлорметана и 20 см 3 воды, смесь перемешивают и разделяют фазы. Органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм, высота 20 см, диаметр 2,0 см), элюируя под давлением 0,1 бар аргона дихлорметаном и собирая фракции объемом 25 см 3. Фракции 14-20 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,66 г N-(3,5-дифторфенил)метилсульфонамида в виде белого порошка. 1-[бис(4-хлорфенил)метил]азетидин-3-иловый эфир метилсульфоновой кислоты может быть получен следующим образом. К раствору 12 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола в 200 см 3 дихлорметана добавляют под аргоном в течение 10 мин 3,5 см 3 метилсульфонилхлорида, охлаждают смесь до +5 С и в течение 10 мин приливают 3,8 см 3 пиридина. После 30 ч перемешивания при +5 С и затем 20 ч при 20 С реакционную смесь разбавляют 100 см 3 воды и 100 см 3 дихлорметана, фильтруют и разделяют на фазы. Органическую фазу промывают водой, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Полученное масло хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм, высота 40 см, диаметр 3,0 см), элюируя под давлением 0,5 бар аргона смесью циклогексана и этилацетата (70/30 по объему) и собирая фракции объемом 100 см 3. Фракции 4-15 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 6,8 г 1-[бис(4 хлорфенил)метил]азетидин-3-илового эфира метилсульфоновой кислоты в виде желтого масла. 1-[бис(4-хлорфенил)метил]азетидин-3-ол может быть получен, используя последовательность операций, описанной Katritzky A.R. с сотр., J. Heterocycl. Chem., 271 (1994), исходя из 35,5 г гидрохлорида[бис(4-хлорфенил)метил]амина и 11,0 см 3 эпихлоргидрина. Гидрохлорид [бис(4-хлорфенил)метил]амина может быть получен по методу, описанному Grisar М. с сотр. в J. Med. Chem., 885 (1973). Пример 14.N-[1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(4,6-диметилпиримид-2-ил)метилсульфонамид может быть получен повторением последовательности операций, описанной в примере 13 (метод 2), исходя из 0,20 г N-(4,6-диметилпиримид-2-ил)метилсульфонамида и 0,308 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола. После хроматографирования на колонке с силикагелем (гранулометрия 0,06-0,04 мм, высота 50 см, диаметр 2 см), элюируя под давлением 0,6 бар аргона дихлорметаном и затем смесью дихлорметана с 1% метанола и собирая фракции объемом 200 см 3. Фракции 4-7 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). После кристаллизации из диизопропилового эфира, отфильтровывания и сушки получают 0,20 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(4,6 диметилпиримид-2-ил)метилсульфонамида в виде белого твердого вещества. [Спектр ЯМР 1 Н (300 МГц,CDCl3,в м.д.): 2,39 (с:6 Н); 2,89 (т ушир., J=7,5 Гц:2 Н); 3,51 (с:3H); 3,77 (м:2 Н); 4,27 (с:1 Н); 4,77 (м:1 Н); 6,73 (с:1 Н); 7,20-7,35 (м:8 Н)].N-(4,6-Диметилпиримид-2-ил)метилсульфонамид может быть получен следующим образом. К смеси 1,23 г 2-амино-4,6-диметилпиримидина, 0,77 см 3 метилсульфонилхлорида и 50 мг 4 диметиламинопиримидина, растворенной в 50 см 3 дихлорметана, добавляют 1,4 см 3 триэтиламина при температуре 0 С. Реакционную среду оставляют на 16 ч при комнатной температуре, дважды промывают 100 см 3 воды, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 1,0 г желтого порошка, который в течение 1 ч обрабатывают при 100 С 15 см 3 10%-ного раствора гидроксида натрия. После охлаждения реакционную смесь дважды экстрагируют 50 см 3 дихлорметана. Водную фазу подкисляют 5 см 3 10 н. соляной кислоты до рН 1 и дважды экстрагируют 50 см 3 дихлорметана. Полученные органические фазы объединяют, промывают 50 см 3 воды, высушивают над сульфатом магния, фильтруют и упаривают. Получают 0,20 г N-(4,6-диметилпиримид-2 ил)метилсульфонамида в виде желтого порошка. Пример 15.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1,3,4-тиадиазол-2-ил)метилсульфонамид может быть получен повторением последовательности операций, описанной в примере 13 (метод 2), исходя из 0,10 г N-(1,3,4-тиадиазол-2-ил)метилсульфонамида и 0,215 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола. После хроматографирования на колонке с силикагелем (гранулометрия 0,06-0,04 мм, высота 50 см, диаметр 1 см), элюируя под давлением 0,8 бар аргона смесью этилацетат/циклогексан 20/80 и затем 40/60 по объему и собирая фракции объемом 60 см 3. Фракции 26-31 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). После кристаллизации из диизопропилового эфира, отфильтровывания и сушки получают 40 мг N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1,3,4-тиадиазол-2-ил)метилсульфонамида в виде белого твердого вещества. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 3,01 (с:3H); 3,09 (т расщепл., J=7 и 1,5 Гц:2 Н); 3,70 (т расщепл., J=7 и 1,5 Гц:2 Н); 4,28 (с:1 Н); 4,76 (м:1 Н); 7,20-7,35N-(1,3,4-Тиадиазол-2-ил)метилсульфонамид может быть получен следующим образом. К смеси 2,02 г 2-амино-1,3,4-тиадиазола в 10 см 3 пиридина добавляют 1,5 см 3 метилсульфонилхлорида. Реакционную смесь оставляют на 2 ч при комнатной температуре, добавляют к ней 60 см 3 воды и фильтруют. Собранную водную фазу подкисляют 1 н. соляной кислотой до рН 2 и дважды экстрагируют 50 см 3 этилацетата.- 14007109 Органическую фазу 2 раза промывают 50 см 3 воды, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа), получая 0,1 г желтого порошка. Пример 16.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(тиазол-2-ил)метилсульфонамид может быть получен повторением последовательности операций, описанной в примере 15, исходя из 0,50 г N-(тиазол-2 ил)метилсульфонамида и 0,5 г 1-[бис (4-хлорфенил)метил]азетидин-3-ола. После хроматографирования на колонке с силикагелем (гранулометрия 0,06-0,04 мм, высота 60 см, диаметр 2 см), элюируя под давлением 0,9 бар аргона смесью этилацетат/циклогексан 20/80 и затем 40/60 по объему, собирают фракции объемом 30 см 3. Фракции 9-12 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). После кристаллизации из диизопропилового эфира, отфильтровывания и сушки получают 0,21 г N-1[бис(4-хлорфенил)метил]азетидин-3-ил-N-(тиазол-2-ил)метилсульфонамида в виде белого твердого вещества [Спектр ЯМР 1H (300 МГц, CDCl3,в м.д.): 2,95-3,10 (м:2 Н); 3,00 (с:3H); 3,59 (м:2 Н); 4,22 (с ушир.:1 Н); 4,69 (м:1 Н); 7,20-7,35 (м:9 Н); 7,60 (м:1 Н)].N-(Тиазол-2-ил)метилсульфонамид может быть получен следующим образом. К смеси 1,0 г 2 аминотиазола в 10 см 3 пиридина добавляют 1,5 см 3 метилсульфонилхлорида. Реакционную смесь оставляют на 2 ч при комнатной температуре, добавляют к ней 60 см 3 воды, фильтруют и собирают твердый материал (0,35 г). Собранную водную фазу подкисляют 1 н. соляной кислотой до рН 2 и дважды экстрагируют 40 см 3 этилацетата. Органическую фазу 2 раза промывают 50 см 3 воды, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа), получая 0,15 г белого твердого вещества со спектральными характеристиками, близкими к характеристикам отфильтрованного твердого вещества, соответствующего смеси N-(тиазол-2-ил)метилсульфонамида и N-(тиазол-2-ил)ди(метилсульфонил)имида, который используют как таковой в последующей стадии. Пример 17.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3-гидроксифенил)метилсульфонамид может быть получен следующим образом. К смеси 0,5 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3 метоксифенил)метилсульфонамида в 20 см 3 дихлорметана прибавляют по каплям при 2 С 7,63 см 3 1 М раствора трибромида бора. Реакционную смесь оставляют на 20 ч при комнатной температуре, выливают на лед и экстрагируют 60 см 3 дихлорметана. Органическую фазу трижды промывают 80 см 3 воды и затем дважды 80 см 3 насыщенного водного раствора хлорида натрия, высушивают над сульфатом магния,фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,33 г белую пенистую массу, которую забирают ацетонитрилом, фильтруют и сушат, получая 0,20 г белого твердого вещества.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3-метоксифенил)метилсульфонамид может быть получен повторением последовательности операций, описанной в примере 15, исходя из 1,58 г N-(3 метоксифенил)метилсульфонамида и 2,0 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола. После хроматографирования на колонке с силикагелем (гранулометрия 0,06-0,04 мм, высота 24 см, диаметр 7,8 см),элюируя под давлением 0,7 бар аргона смесью этилацетат/циклогексан 50/50 и затем 40/60 по объему,собирают фракции объемом 100 см 3. Фракции 7-10 объединяют и досуха упаривают при пониженном давлении (2,7 кПа) (2,05 г). После кристаллизации из диизопропилового эфира, отфильтровывания и сушки получают 0,21 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3-метоксифенил)метилсульфонамида.N-(3-Метоксифенил)метилсульфонамид может быть получен следующим образом. К смеси 5,0 г 3 метоксианилина в 150 см 3 пиридина добавляют при 3 С 3,14 см 3 метилсульфонилхлорида. Оставляют реакционную среду на 20 ч при комнатной температуре, добавляют к ней 200 см 3 воды и 400 см 3 этилацетата и разделяют на фазы. Органическую фазу 3 раза промывают 400 см 3 воды и 400 см 3 насыщенного раствора хлорида натрия, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). После хроматографирования на колонке с силикагелем (гранулометрия 0,06-0,04 мм, высота 23 см, диаметр 7,8 см), элюируя под давлением 0,7 бар аргона смесью этилацетат/циклогексан 25/75 по объему, собирают фракции объемом 100 см 3. Фракции 24-36 объединяют и досуха упаривают при пониженном давлении (2,7 кПа), получая 6,21 г N-(3-метоксифенил)метилсульфонамида в виде оранжевого масла. Пример 19.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3-гидроксиметилфенил)метилсульфонамид может быть получен следующим образом. К смеси 0,5 г этилового эфира N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(метилсульфонил)-3-аминобензойной кислоты в 20 см 3 толуола прибавляют по каплям при -50 С 1,46 см 3 20%-ного толуольного раствора гидрида диизопропилалюминия. Реакционную среду оставляют на 1,5 ч при 0 С и 1,5 ч при 20 С, охлаждают до 0 С и медленно прибавляют 20 см 3 воды. После отфильтровывания осадка и экстрагирования его этилацетатом органическую фазу 2- 15007109 раза промывают 80 см 3 воды и затем 80 см 3 насыщенного водного раствора хлорида натрия, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,46 г масла, которое хроматографируют на колонке с силикагелем (гранулометрия 0,060,4 мм, высота 16 см, диаметр 4,0 см), элюируя под давлением 0,7 бар аргона смесью этилацетата/циклогексан (60/40 по объему) и собирая фракции объемом 20 см 3. Фракции 72-76 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,20 г N-1-[бис(4 хлорфенил)метил]азетидин-3-ил-N-(3-гидроксиметилфенил)метилсульфонамида в виде белого твердого вещества. [Спектр ЯМР 1H (300 МГц, CDCl3,в м.д.): 1,80 (м:1 Н); 2,83 (с:3H); 2,87 (м:2 Н); 3,52 (м:2 Н); 4,21 (с ушир.:1 Н); 4,60 (м: 1 Н); 4,74 (д ушир., J=4 Гц:2 Н); 7,10-7,45 (м:12 Н)]. Пример 20. Этиловый эфирN-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(метилсульфонил)-3-аминобензойной кислоты может быть получен повторением последовательности операций, описанной в примере 15, исходя из 1,58 г этилового эфира N-(метилсульфонил)-3-аминобензойной кислоты и 2,0 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола. После хроматографирования на колонке с силикагелем (гранулометрия 0,06-0,04 мм, высота 24 см, диаметр 7,8 см), элюируя под давлением 0,7 бар аргона смесью этилацетат/циклогексан 50/50 и затем 40/60 по объему, собирают фракции объемом 100 см 3. Фракции 7-10 объединяют и досуха упаривают при пониженном давлении (2,7 кПа), получая 2,0 г желтого масла. Этиловый эфир N-(метилсульфонил)-3-аминобензойной кислоты может быть получен следующим образом. К смеси 5,0 г этил-3-амино бензоата в 150 см 3 пиридина добавляют при 3 С 2,35 см 3 метилсульфонилхлорида. Оставляют реакционную среду на 20 ч при комнатной температуре, добавляют к ней 200 см 3 воды и 400 см 3 этилацетата и разделяют на фазы. Органическую фазу промывают 3 раза 400 см 3 воды и 400 см 3 насыщенного раствора хлорида натрия, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). После хроматографирования на колонке с силикагелем (гранулометрия 0,06-0,04 мм, высота 25 см, диаметр 7,8 см), элюируя под давлением 0,7 бар аргона смесью этилацетат/циклогексан 25/75 по объему, собирают фракции объемом 100 см 3. Фракции 2736 объединяют и досуха упаривают при пониженном давлении (2,7 кПа), получая 5,24 г этилового эфираN-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1-изобутилпиперид-4-ил)метилсульфонамид может быть получен следующим образом. К раствору 0,47 г N-1-[бис(4-хлорфенил)метил]азетидин-3-илN-(1-пиперид-4-ил)метилсульфонамида в 20 см 3 дихлорметана добавляют 0,11 см 3 изомасляного альдегида, 0,057 см 3 100%-ной уксусной кислоты и 32 0 мг триацетоксиборогидрида натрия. После 20 ч перемешивания при 20 С к реакционной смеси добавляют 50 см 3 насыщенного водного раствора гидрокарбоната натрия и разделяют фазы. Органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток очищают хроматографированием на колонке с силикагелем (гранулометрия 0,063-0,200 мм, высота 20 см, диаметр 2 см), элюируя под давлением 0,5 бар аргона смесью циклогексана и этилацетата (40/60 по объему) и собирая фракции объемом 30 см 3. Фракции 3-15 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 0,22 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1-изобутилпиперид-4-ил)метилсульфонамида в виде белой пенистой массы. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 0,87 (д, J=7 Гц:6 Н); 1,60-1,90 (м:5 Н); 1,93 (т ушир., J=11,5 Гц:2 Н); 2,03 (д, J=7,5 Гц:2 Н); 2,84 (с:3H); 2,89 (д ушир., J=11,5 Гц:2 Н) ; 3,38 (т ушир., J=7 Гц:2 Н); 3,47 (т ушир., J=7 Гц:2 Н); 3,62 (м:1 Н); 4,08 (м:1 Н); 4,43 (с:1 Н); 7,20-7,40 (м:8 Н)]. 1-[бис(4-Хлорфенил)метил]азетидин-3-ил-N-(1-пиперид-4-ил)метилсульфонамид может быть получен следующим образом. К раствору 19 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1-третбутоксикарбонилпиперид-4-ил)метилсульфонамида в 199 см 3 диоксана медленно приливают 50 см 3 6 н. раствора хлористо-водородной кислоты в диоксане. После 20 ч перемешивания при 20 С реакционную смесь упаривают при 50 С и пониженном давлении (2,7 кПа). Остаток забирают 200 см 3 этилацетата и 200 см 3 воды. Водную фазу подщелачивают 4 н. водным раствором гидроксида натрия и затем экстрагируют 200 см 3 этилацетата. Эту органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при 50 С и пониженном давлении (2,7 кПа). Получают 15,5 г N-1-[бис(4 хлорфенил)метил]азетидин-3-ил-N-(пиперид-4-ил)метилсульфонамида в виде пенистой массы кремового цвета.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1-трет-бутоксикарбонилпиперид-4-ил)метилсульфонамид может быть получен следующим образом. К раствору 14,7 г 4-1-[бис(4 хлорфенил)метил]азетидин-3-иламино-(1-трет-бутилкарбонил)пиперидина в 250 см 3 дихлорметана медленно прибавляют 4,60 см 3 метилсульфонилхлорида, затем 4,60 см 3 триэтиламина и 100 мг 4 диметиламинопиридина. После 20 ч перемешивания при 20 С к реакционной смеси добавляют 200 см 3 насыщенного водного раствора гидрокарбоната натрия, после чего смесь перемешивают в течение 30 мин и разделяют на фазы. Органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). К полученной пенистой массе, забранной 250 см 3 дихлорметана, вновь медленно прибавляют 4,60 см 3 метилсульфонилхлорида, затем 4,60 см 3 триэтиламина- 16007109 и 100 мг 4-диметиламинопиридина. После 20 ч перемешивания при 20 С к реакционной смеси добавляют 200 см 3 насыщенного водного раствора гидрокарбоната натрия, после чего смесь перемешивают в течение 30 мин и разделяют на фазы. Органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток очищают хроматографией на колонке с силикагелем (гранулометрия 0,063-0,200 мм, высота 35 см, диаметр 5 см), элюируя под давлением 0,5 бар аргона смесью циклогексана и этилацетата (70/30 по объему) и собирая фракции объемом 250 см 3. Фракции 4-18 объединяют и досуха упаривают при пониженном давлении (2,7 кПа). Получают 19 гN-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1-трет-бутилкарбонилпиперид-4-ил)метилсульфонамида в виде вспененной массы кремового цвета, которая будет использована как таковая в последующей стадии. 4-1-[бис(4-хлорфенил)метил]азетидин-3-иламино-(1-трет-бутоксикарбонил)пиперидин может быть получен следующим образом. К раствору 9,22 г 1-[бис(4-хлорфенил)метил]азетидин-3-иламина в 300 см 3 дихлорметана добавляют 6,58 г 1-трет-бутоксикарбонилпиперидин-4-она. К охлажденной до+5 С смеси добавляют двумя порциями 9,54 г триацетоксиборогидрида натрия и затем приливают 1,72 см 3 100%-ной уксусной кислоты. После 20 ч перемешивания при 20 С к реакционной смеси медленно прибавляют 500 см 3 насыщенного водного раствора гидрокарбоната натрия, после чего смесь хорошо перемешивают и разделяют на фазы. Органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при 50 С и пониженном давлении (2,7 кПа). Получают 15 г 4-1-[бис(4 хлорфенил)метил]азетидин-3-иламино-(1-трет-бутоксикарбонил)пиперидина в виде вспененной массы кремового цвета, которая будет использована как таковая в последующей стадии. Пример 22. N-Бензил-N-1-[бис(4-хлорфенил)метил]азетидин-3-иламин. К раствору 369 мг 1-[бис(4-хлорфенил)метил]азетидин-3-иламина в 15 см 3 дихлорметана добавляют при комнатной температуре в атмосфере аргона 0,134 см 3 бензальдегида. Смесь охлаждают до 0 С, после чего последовательно добавляют 382 мг триацетоксиборогидрида натрия и затем 70 мм 3 уксусной кислоты. После 16 ч перемешивания при комнатной температуре смесь вливают в 50 см 3 насыщенного водного раствора гидрокарбоната натрия, после чего дважды экстрагируют 25 см 3 дихлорметана. Объединенные органические фазы высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Полученный остаток очищают флэш-хроматографией на колонке с силикагелем[элюент: дихлорметан/метанол (95/5 по объему)]. Получают 0,29 г N-бензил-N-1-[бис(4 хлорфенил)метил]азетидин-3-иламина в виде бесцветного масла. [Спектр ЯМР 1H (300 МГц, CDCl3,в м.д.): 2,71 (т ушир., J=7 Гц:2 Н); 3,42 (м:2 Н); 3,49 (м:1 Н); 3,70 (с:2 Н); 4,25 (с:1 Н); 7,20-7,40 (м:13 Н)]. 1-[бис(4-Хлорфенил)метил]азетидин-3-иламина может быть получен следующим образом. К 27 г 1[бис(4-хлорфенил)метил]азетидин-3-илового эфира метилсульфоновой кислоты, помещенной в предварительно охлажденный до -60 С автоклав, добавляют 400 см 3 смеси метанола и жидкого аммиака (50/50 по объему). Реакционную среду перемешивают после этого 24 ч при 60 С, затем оставляют на воздухе для испарения аммиака и, наконец, досуха упаривают при пониженном давлении (2,7 кПа). Остаток забирают 500 см 3 0,37 н. водного раствора гидроксида натрия и четыре раза экстрагируют 500 см 3 диэтилового эфира. Объединенные органические фазы последовательно промывают два раза 100 см 3 воды и 100 см 3 насыщенного раствора хлорида натрия, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Полученный остаток очищают флэш-хроматографией на колонке с силикагелем [элюент: дихлорметан/метанол (95/5 по объему)]. Получают 14,2 г 1-[бис(4 хлорфенил)метил]азетидин-3-иламина в виде масла, застывающего с образованием твердого вещества кремового цвета. Пример 23. N-Бензил-N-1-[бис(4-хлорфенил)метил]азетидин-3-илметилсульфонамид. К раствору 120 мг N-бензил-N-1-[бис(4-хлорфенил)метил]азетидин-3-иламина в 5 см 3 дихлорметана добавляют при комнатной температуре в атмосфере аргона 104 мм 3 триэтиламина. Смесь охлаждают до 0 С и затем добавляют 46,4 мм 3 метилсульфонилхлорида и перемешивают 16 ч при комнатной температуре, после чего разбавляют 20 см 3 дихлорметана и дважды промывают 15 см 3 дистиллированной воды. Органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа) с образованием лака, который кристаллизуют растиранием в метаноле. Получают 42 мг N-бензил-N-1-[бис(4-хлорфенил)метил]азетидин-3-илметилсульфонамида в виде порошка кремового цвета, плавящегося при 171 С. Пример 24.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторбензил)амин может быть получен как в примере 22, но с использованием 188 мг 3,5-дифторбензальдегида и 369 мг 1-[бис(4-хлорфенил)метил]азетидин-3-иламина и 382 мг триацетоксиборогидрида натрия без очистки флэшхроматографией. Получают 0,48 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторбензил)амина в виде бесцветного масла. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 2,73 (м:2 Н); 3,40-3,55- 17007109 К раствору 433 мг N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторбензил)амина в 30 см 3 дихлорметана добавляют при комнатной температуре в атмосфере аргона 347 мм 3 триэтиламина. Смесь охлаждают до 0 С и затем добавляют раствор 46,4 мм 3 метилсульфонилхлорида в 5 см 3 дихлорметана и перемешивают 1 ч при комнатной температуре, после чего реакционную смесь разбавляют 20 см 3 дихлорметана и дважды промывают 15 см 3 дистиллированной воды. Органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток вводят в виде метанольного раствора в патрон Bond Elut SCX (10 г), последовательно элюируя метанолом и 1 М раствором аммиака в метаноле. Аммиачные фракции объединяют и досуха упаривают при пониженном давлении (2,7 кПа), получая таким образом 0,44 г N-1-[бис(4-хлорфенил)метил]азетидин-3 ил-N-(3, 5-дифторбензил)метилсульфонамида в виде пенистой массы кремового цвета. [Спектр ЯМР 1 Н(с:1 Н); 4,40 (м:1 Н); 4,54 (с:2 Н); 6,75 (тт, J=9 и 2 Гц:1 Н); 6,95 (м:2 Н); 7,25 (м:8 Н)]. Пример 26. N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторбензил)ацетамид. К раствору 2 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторбензил)амина в 75 см 3 дихлорметана добавляют при комнатной температуре в атмосфере аргона 1,6 см 3 триэтиламина. Смесь охлаждают до 0 С и затем прибавляют по каплям раствор 0,66 см 3 ацетилхлорида и перемешивают 16 ч при комнатной температуре, после чего реакционную смесь разбавляют 50 см 3 дихлорметана и дважды промывают 20 см 3 дистиллированной воды. Органическую фазу высушивают над сульфатом магния,фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Полученный остаток очищают флэш-хроматографией на колонке с силикагелем [элюент: дихлорметан/метанол (98/2 по объему). Получают 1,2 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторбензил)ацетамида в виде бесцветного масла. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.), наблюдают смесь ротамеров: 2,06 и 2,14 (2 с: 3H в сумме); 2,97 (м:2 Н); 3,43 (м:2 Н); 4,20 и 4,25 (2 с:1 Н в сумме); 4,54 и 4,75-4,80 (м:1 Н в сумме); 4,68 и 4,78 (2 с ушир.:2 Н в сумме); 6,70 (м:3H); 7,24 (с ушир.:8 Н)]. Пример 27. N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(пирид-4-илметил)метилсульфонамид. К раствору 398 мг N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(пирид-4-илметил)амина в 8 см 3 дихлорметана добавляют при комнатной температуре в атмосфере аргона 346 мм 3 триэтиламина. Реакционную смесь охлаждают до 0 С, добавляют 155 мм 3 метилсульфонилхлорида, перемешивают 3 ч при комнатной температуре, разбавляют 35 см 3 дихлорметана и дважды промывают 20 см 3 дистиллированной воды. Органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Полученный остаток очищают флэш-хроматографией на колонке с силикагелем [элюент: дихлорметан/метанол (97/3 по объему)]. Получают 288 мг N-1-[бис(4 хлорфенил)метил]азетидин-3-ил-N-(пирид-4-илметил)метилсульфонамида в виде пенистой массы кремового цвета. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 2,83 (с:3H); 3,02 (т ушир., J=7,5 Гц:2 Н); 3,40 (т ушир., J=7,5 Гц:2 Н); 4,23 (с:1 Н); 4,43 (м: 1 Н); 4,57 (с:2 Н); 7,20-7,35 (м: 8 Н); 7,32 (д ушир., J=5,5 Гц:2 Н); 8,60 (д ушир., J=5,5 Гц:2 Н)]. Пример 28.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(пирид-4-илметил)амин может быть получен следующим образом. К раствору 369 мг 1-[бис(4-хлорфенил)метил]азетидин-3-иламина в 15 см 3 дихлорметана добавляют при комнатной температуре в атмосфере аргона 0,126 см 3 4-пиридоксаля. Реакционную смесь охлаждают до 0 С и затем последовательно добавляют 382 мг триацетоксиборогидрида натрия и затем 70 мм 3 уксусной кислоты. После 72 ч перемешивания при комнатной температуре смесь вливают в 100 см 3 насыщенного водного раствора гидрокарбоната натрия, после чего дважды экстрагируют 100 см 3 дихлорметана. Объединенные органические фазы промывают 50 см 3 дистиллированной воды, высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Остаток вводят в виде раствора в 5 см 3 метанола в патрон Bond Elut SCX (10 г), последовательно элюируя 50 см метанола и 60 см 3 1 М раствором аммиака в метаноле. Аммиачные фракции объединяют и досуха упаривают при пониженном давлении (2,7 кПа), получая таким образом 0,48 г N-1-[бис(4 хлорфенил)метил]азетидин-3-ил-N-(пирид-4-илметил)амина в виде бесцветного масла. Пример 29. N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(пирид-3-илметил)метилсульфонамид. Повторяя последовательность операций примера 27, но исходя из 380 мг N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(пирид-3-илметил)амина, получают 319 мг N-1-[бис(4-хлорфенил) метил]азетидин-3-ил-N-(пирид-3-илметил)метилсульфонамида в виде пенистой массы кремового цвета.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(пирид-3-илметил)амин может быть получен как в примере 28, но исходя из 0,124 см 3 3-пиридоксаля, 0,36 г 1-[бис(4-хлорфенил)метил]азетидин-3-иламина и 0,38 г триацетоксиборогидрида натрия. Получают таким образом 0,44 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(пирид-3-илметил)амина в виде бесцветного масла.- 18007109 Пример 31. N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1,1-диоксо-1 Н-1-6-бензо[d]изотиазол-3-ил)амин. К 386 мг 1-[бис(4-хлорфенил)метил]азетидин-3-илового эфира метилсульфоновой кислоты в 10 см 3 диметилформамида добавляют 182 мг 1,2-бензизотиазол-3-амин-1,1-диоксида и 326 мг карбоната цезия. После этого реакционную среду перемешивают 9 ч при 100 С и досуха упаривают при пониженном давлении (2,7 кПа). Остаток четыре раза промывают 5 см 3 кипящей дистиллированной воды, разбивают перемешиванием в 5 см 3 дистиллированной воды при комнатной температуре, затем отфильтровывают и очищают флэш-хроматографией на колонке с силикагелем [элюент: дихлорметан/метанол (98/2 по объему)]. Получают 53 мг N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(1,1-диоксо-1 Н-1-6-бензо[d] изотиазол-3-ил)амина в виде пастообразного продукта. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 3,17(м:2 Н); 3,61 (т ушир., J=7,5 Гц:2H); 4,37 (с:1 Н); 4,75 (м: 1 Н); 6,30-6,40 (м:1 Н); 7,20-7,35 (м: 8 Н); 7,62 (д ушир., J=7,5 Гц:1 Н); 7,69 (т ушир., J=7,5 Гц:1 Н); 7,7 6 (т ушир., J=7,5 Гц:1 Н); 7,93 (д ушир., J=7,5 Гц:1 Н)]. 1,2-Бензизотиазол-3-амин-1,1-диоксид может быть получен по методу, описанному Stoss P. с соавт.,Chem. Ber. (1975), 108 (12), 3855-63. Пример 32.N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)-N'-трет-бутилоксикарбонилсульфамид может быть получен следующим образом. К раствору 0,095 см 3 трет-бутилового спирта в 2 см 3 безводного дихлорметана добавляют 0,048 см 3 хлорсульфонилизоцианата, перемешивают 2 мин и последовательно добавляют 0,21 г N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)амина в 1,25 см 3 безводного дихлорметана и затем 0,084 см 3 триэтиламина. После перемешивания в течение 1 ч при температуре близкой к 20 С добавляют при быстром перемешивании 2 см 3 насыщенного раствора бикарбоната натрия. Реакционную смесь разделяют на фазы, высушивают над сульфатом магния, фильтруют и досуха упаривают при 50 С и пониженном давлении (2,7 кПа). Полученный остаток хроматографируют в патроне Varian (6 см 3), содержащем 3 г тонкого силикагеля (0,040-0,063 мм),вводя и элюируя смесью петролейный эфир/этилацетат с помощью насоса Duramat и собирая фракции объемом 2 см 3. Фракции 6-17 объединяют и досуха упаривают при пониженном давлении (2,7 кПа) и 40 С в течение 2 ч. Получают таким образом 61 мг N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5 дифторфенил)-N'-трет-бутилоксикарбонилсульфамида в виде белой пенистой массы. [Спектр ЯМР 1 Н(RS)-N-1-[(4-Хлорфенил)пиридин-3-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид может быть получен следующим образом. К смеси 0,2 г 3-[бром-(4-хлорфенил)метил]пиридина и 0,22 г гидрохлорида N-азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамида в 10 см 3 ацетонитрила добавляют 0,2 г карбоната калия и 23 мг йодида калия, после чего кипятят смесь в течение 3 ч. После добавления 0,2 г карбоната калия кипятят смесь еще 15 ч. После охлаждения до 21 С удаляют фильтрацией нерастворимый материал и досуха упаривают фильтрат при 40 С и давлении 2,7 кПа. Получают 170 мг бесцветного лака, который очищают хроматографией в патроне с силикагелем (SIL-020-005, FlashPack, Jones Chromatography Limited, New Road, Hengoed, Mid Glamorgan, CF82 8AU, Соединенное Королевство), элюируя смесью циклогексан/этилацетат 1/1 (6 см 3/мин, фракции по 5 см 3). Фракции с Rf=5/57(циклогексан/этилацетат, пластинка с силикагелем, Merck 1.05719, Merck KgaA, 64271 Darmstadt, Германия) объединяют и досуха упаривают при давлении 2,7 кПа и 40 С, что дает 100 мг (RS)-N-1-[(4 хлорфенил)пиридин-3-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамида, плавящегося при 110 С. [Спектр ЯМР 1 Н (300 МГц, (CD3)2SO d6,в м.д.): 2,77 (м:2 Н); 2,98 (с:3H); 3,38 (м:2 Н); 4,50(с:1 Н); 4,70 (м:1 Н); 7,11 (м:2 Н); 7,20-7,40 (м:2 Н); 7,34 (д, J=8 Гц:2 Н); 7,41 (д, J=8 Гц:2 Н); 7,72 (д ушир.,J=8 Гц:1 Н); 8,40 (дд, J=5 и 1,5 Гц:1 Н); 8,58 (д, J=l,5 Гц:1 Н)]. Оба изомера (RS)-N-1-[(4-хлорфенил)пиридин-3-илметил]азетидин-3-ил-N-(3,5-дифторфенил) метилсульфонамида могут быть разделены на неподвижной хиральной фазе CHIRACEL OD. Первый изомер. Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 2,82 (с:3H); 2,87 (м:2 Н); 3,53 (м:2 Н); 4,29 (с:1 Н); 4,47 (м:1 Н); 6,80 (м:3H); 7,19 (дд, J=8 и 5 Гц:2 Н); 7,20-7,35 (м:4 Н); 7,62 (д ушир., J=8 Гц:1 Н); 8,45 (д ушир, J=5 Гц:1 Н); 8,59 (с ушир.:1 Н)]. Второй изомер. Спектр ЯМР 1H (300 МГц, CDCl3,в м.д.): 2,82 (с:3H); 2,87 (м:2 Н); 3,54 (м:2 Н); 4,29 (с:1 Н); 4,48 (м:1 Н); 6,80 (м:3H); 7,19 (дд, J=8 и 5 Гц:1 Н); 7,25-7,35 (м:4 Н); 7,62 (дт, J=8 и 2 Гц:1 Н); 8,46 (дд, J=5 и 2 Гц:1 Н); 8,59 (д ушир., J=2 Гц:1 Н)]. Гидрохлорид N-азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамида может быть получен следующим образом. В 500-см 3 гидрогенизаторе гидрируют в течение 4 ч раствор 1 г N-(1-бензгидрилазетидин-3-ил)-N-(3,5-дифторфенил)метилсульфонамида в смеси 2,5 см 3 1 М соляной кислоты и 0,41 см 3 уксусной кислоты в присутствии 0,161 г гидроксида палладия под давлением 30 бар водорода. Катализатор удаляют фильтрацией через слой целлита, после чего фильтрат досуха упаривают при 40 С и давлеN-(1-Бензгидрилазетидин-3-ил)-N-(3,5-дифторфенил)метилсульфонамид может быть получен повторением последовательности операций, описанной в примере 13 (метод 2), следующим образом. К раствору 2 г 1-бензгидрилазетидин-3-ола в 100 см 3 тетрагидрофурана последовательно добавляют 0,86 г N(3,5-дифторфенил)метилсульфонамида, 3,28 г трифенилфосфина и затем 2 мл диэтилазодикарбоксилата наблюдается повышение температуры от 22 до 29 С, а также образование осадка после завершения добавления диэтилазодикарбоксилата. Смесь оставляют на 20 ч при 22 С, удаляют осадок фильтрацией и досуха упаривают фильтрат при 40 С и давлении 2,7 кПа. Остаток 20 мин растирают с 5 см 3 метанола при 21 С, получая 1,07 г N-(1-бензгидрилазетидин-3-ил)-N-(3,5-дифторфенил)метилсульфонамида в виде белого аморфного твердого вещества. 1-Бензгидрилазетидин-3-ол может быть получен в соответствии с последовательностью операций,описанной Katritzky A.R. с сотр., J. Heterocycl. Chem., 271 (1994). 3-[Бром-(4-хлорфенил)метил]пиридин получают следующим образом. К 1,5 г (4-хлорфенил)пирид 3-илметанола добавляют 3,5 см 3 48%-ного раствора бромисто-водородной кислоты в уксусной кислоте и 1 см 3 ацетилбромида. Полученную таким образом смесь, имеющую янтарный цвет, кипятят 4 ч, затем охлаждают до 20 С и досуха упаривают при 40 С давлении 2,7 кПа, получая 1,53 г 3-[бром-(4 хлорфенил)метил]пиридина (Rf=75/90, 254 нм, пластинки с силикагелем, тип 1.05719, Merck KgaA,64271 Darmstadt, Германия).(4-Хлорфенил)пирид-3-илметанол получают следующим образом. К раствору 3 г 3-пиридоксаля в тетрагидрофуране при 5 С добавляют 20 см 3 1 М раствора 4-хлорфенилмагнийбромида в диэтиловом эфире. После охлаждения до 20 С продолжают реакцию в течение 15 ч при перемешивании. После этого добавляют 20 см 3 насыщенного раствора хлорида аммония и затем 20 см 3 этилацетата. Смесь разделяют на фазы и органические фазы экстрагируют дополнительными 20 см 3 этилацетата. Органические экстракты объединяют и высушивают над сульфатом магния, после чего досуха упаривают при 40 С и давлении 2,7 кПа. Полученный остаток хроматографируют на силикагеле (Amicon, 20-45 м, 50 г силикагеля, колонка диаметром 5 см), элюируя смесью от 80/20 до 50/50 под давлением аргона 0,4 бар. Фракции,содержащие соединение с Rf=13/53 (пластинки с силикагелем, Merck 1.05719, Merck KgaA, 64271 Darmstadt, Германия) объединяют и досуха упаривают при 40 С давлении 2,7 кПа, получая 2,53 г (4 хлорфенил)пирид-3-илметанола. Пример 34.N-1-[бис(4-фторфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид получают следующим образом. К смеси 0,2 г 4,4'-дифторбензгидрилхлорида и 0,2 6 г гидрохлорида N-азетидин-3 ил-N-(3,5-дифторфенил)метилсульфонамида в 10 см 3 ацетонитрила добавляют 0,36 г карбоната калия и 27 мг йодида калия, после чего кипятят смесь в течение 3 ч. После охлаждения до 21 С удаляют фильтрацией нерастворимый материал и досуха упаривают смесь при 40 С и давлении 2,7 кПа. Остаток растирают с 30 см 3 этилацетата и удаляют твердый материал фильтрацией. Фильтрат досуха упаривают при 40 С и давлении 2,7 кПа, получая 90 мг бледно-желтого твердого вещества, которое очищают хроматографией в патроне BondElut SCX, содержащем 2 г привитого оксида кремния (1225-6019, Varian Associates, Inc, 24201 Frampton Avenue, Harbor City, CA90710, USA), элюируя 2 M метанольным раствором аммиака. Фракции с Rf 16/82 (циклогексан/этилацетат 7/3, пластинка с силикагелем, тип 1.05719, MerckKgaA, 64271 Darmstadt, Германия) объединяют и упаривают при давлении 2,7 кПа и 40 С, получая 243 мг N-1-[бис(4-фторфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамида, плавящегося при 98 С. [Спектр ЯМР 1 Н (300 МГц, (CD3)2SO d6,в м.д.): 2,74 (т ушир.,J=7 Гц:2 Н); 3,00 (с:3H); 3,37 (т ушир., J=7 Гц:2 Н); 4,43 (с:1 Н); 4,69 (м:1 Н); 7,05-7,20 (м:6 Н); 7,28 (тт, J=9 и 2,5 Гц:2 Н); 7,40 (м:4 Н)]. Пример 35.(RS)-N-1-[бис(4-хлорфенил)пирид-4-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид может быть получен следующим образом. Смесь приблизительно 100 мг (4-пиридил)-(4 хлорфенил)хлорметана, 143 мг N-азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамида, 17 мг йодида калия и 200 мг карбоната калия в 5 см 3 ацетонитрила перемешивают приблизительно 18 ч при температуре близкой к 20 С. После этого реакционную смесь кипятят 3 ч, добавляют 17 мг йодида калия и продолжают кипячение еще 2 ч. После охлаждения до температуры близкой к 20 С реакционную смесь фильтруют на пористом стекле. Твердый материал ополаскивают ацетонитрилом и затем 2 раза 3 см 3 этилацетата. Объединенный фильтрат досуха упаривают при пониженном давлении. Получают 230 мг бледно-желтой пасты, которую очищают с помощью препаративной хроматографии в тонком слое силикагеля [4 препаративные пластинки Mreck Kieselgel 60F254; 2020 см, толщина 0,5 мм], элюируя смесью метанол/дихлорметан (5/95 по объему). После элюирования зоны, соответствующей целевому продукту,фильтрации на пористом стекле и упаривании растворителей при пониженном давлении и температуре близкой к 40 С получают 12 мг (RS)-N-1-[бис(4-хлорфенил)пирид-4-илметил]азетидин-3-ил-N-(3,5 дифторфенил)метилсульфонамида. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 2,82 (с:3H); 2,96 (м:2 Н); 3,50-3,80 (м:2 Н); 4,33 (м:1 Н); 4,54 (м: 1 Н) ; 6,82 (м:3H); 7,20-7,45 (м:бН); 8,53 (д ушир., J=5,5 Гц:2 Н)].- 20007109 Оба изомера (RS)-N-1-[бис(4-хлорфенил)пирид-4-илметил]азетидин-3-ил-N-(3,5-дифторфенил) метилсульфонамида могут быть разделены на неподвижной хиральной фазе CHIRACEL OD. Первый изомер. Спектр ЯМР 1H (300 МГц, CDCl3,в м.д.): 2,83 (с:3H); 2,87 (т ушир., J=7,5 Гц:2 Н); 3,51 (м:1 Н); 3,60 (м:1 Н); 4,24 (с:1 Н); 4,50 (м:1 Н); 6,82 (м:3H); 7,20-7,35 (м:6 Н); 8,50 (д ушир., J=5,5 Гц:2 Н)]. Второй изомер. Спектр ЯМР 1H (300 МГц, CDCl3,в м.д.): 2,83 (с:3H); 2,88 (т, J=7,5 Гц:2 Н); 3,51(4-Пиридил)-(4-хлорфенил)хлорметан может быть получен следующим образом. К суспензии 100 мг (4-пиридил)-4-хлорфенил)метанола в 2 см 3 толуола, охлажденной до температуры близкой к 0 С, добавляют 0,0598 см тионилхлорида. Оставляют реакционную среду на 2 ч при температуре близкой к 0 С и затем на 1 ч при температуре близкой к 20 С и упаривают при пониженном давлении. Получают приблизительно 100 мг (4-пиридил)-(4-хлорфенил)хлорметана в виде белого твердого вещества.(4-Пиридил)-4-хлорфенил)метанол может быть получен следующим образом. К раствору 2 г 4-(4 хлорбензоил)пиридина в 160 см 3 этанола добавляют при температуре близкой к 20 С 348 мг тетрагидроборида натрия. После 2 ч перемешивания при температуре близкой к 20 С добавляют 90 мг тетрагидроборида натрия. Через 1,5 ч (при той же температуре) реакционную среду разбавляют 200 см 3 дихлорметана и 200 см 3 воды. рН водной фазы доводят до величины 5 добавлением приблизительно 13 см 3 1 н. соляной кислоты. После разделения фаз водную фазу 3 раза экстрагируют 100 см 3 дихлорметана. Органические фазы объединяют, высушивают над сульфатом магния, фильтруют и упаривают при пониженном давлении. Получают 2 г (4-пиридил)-4-хлорфенил)метанола в виде белого порошка. Пример 36. К раствору 330 мг N-1-[бис(4-хлорфенил)метил]азетидин-3-ил(3,5-дифторбензил)амина в 25 см 3 тетрагидрофурана добавляют при комнатной температуре в атмосфере аргона 24,4 мг 75%-ной дисперсии гидрида натрия в минеральном масле. Смесь перемешивают 1 ч при комнатной температуре и добавляют 59 мм 3 метилхлорформиата и продолжают перемешивание в течение 18 ч в тех же условиях. К реакционной смеси добавляют 0,3 см 3 дистиллированной воды и отгоняют тетрагидрофуран на роторном испарителе. Полученный остаток экстрагируют дихлорметаном, органическую фазу высушивают над сульфатом магния, фильтруют и досуха упаривают при пониженном давлении (2,7 кПа). Полученный остаток очищают флэш-хроматографией на колонке с силикагелем [элюент: дихлорметан/метанол(97,5/2,5 по объему). Получают 328 мг метилового эфира 1-[бис(4-хлорфенил)метил]азетидин-3-ил(3,5 дифторбензил)карбаминовой кислоты в виде бесцветного масла. [Спектр ЯМР 1 Н (300 МГц, CDCl3,в м.д.): 2,97 (м:2 Н); 3,39 (м:2 Н); 3,71 (с:3H); 4,24 (с ушир.:1 Н); 4,45 (м: 1 Н); 4,57 (с:2 Н); 6,65-6,80 (м:3H); 7,15-7,30 (м:8 Н)]. Пример 37.(RS)-N-1-[(4-Хлорфенил)пиримидин-5-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид может быть получен повторением последовательности операций, описанной в примере 33, исходя из 0,16 (RS)-5-[бром-(4-хлорфенил)метил]пиримидина, 0,131 г гидрохлорида N-азетидин-3-ил-N(3,5-дифторфенил)метилсульфонамида в 5 см 3 ацетонитрила, 303 мг карбоната калия и 95 мг йодида калия. Получают 26 мг (RS)-N-1-[(4-хлорфенил)пиримид-5-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамида в виде желтой пенистой массы. [Спектр ЯМР 1H (400 МГц, CDCl3,в м.д.): 2,83 (с:3H); 2,91 (м:2 Н); 3,57 (м:2 Н); 4,31 (с:1 Н); 4,50 (м:1 Н); 6,75-6,90 (м:3H); 7,29 (с:4 Н); 8,71 (с:2 Н); 9,08 (с:1 Н)]. Лекарственные средства по изобретению состоят из соединения формулы I, или изомера, или соли этого соединения в чистом состоянии или в виде композиции, в которой это соединение ассоциировано с каким либо другим фармацевтически совместимым продуктом, который может быть инертным или физиологически активным. Лекарственные средства по изобретению могут применяться перорально, парентерально, ректально или местно. В качестве твердых композиций для перорального применения могут использоваться таблетки, пилюли, порошки (желатиновые капсулы, крахмальные облатки) или гранулы. Активное начало по изобретению смешивают в этих композициях в токе аргона с одним или несколькими инертными разбавителями, такими как крахмал, целлюлоза, сахароза, лактоза или кремнезем. Эти композиции, кроме разбавителей, могут также содержать другие вещества, например один или несколько смазочных агентов, таких как стеарат магния или тальк, краситель, оболочку (драже) или лак. В качестве жидких композиций для перорального применения могут использоваться фармацевтически приемлемые растворы, суспензии, эмульсии, сиропы и эликсиры, содержащие инертные разбавители,такие как вода, этанол, глицерин, растительные масла или парафиновое масло. Эти композиции могут содержать и отличные от разбавителей вещества, например смачивающие, подслащивающие, загущающие, ароматизирующие или стабилизирующие продукты. Стерильные композиции для парентерального применения могут быть предпочтительно водными или неводными растворами, суспензиями или эмульсиями. В качестве растворителя или носителя может быть использована вода, пропиленгликоль, полиэтиленгликоль, растительные масла, в частности оливко- 21007109 вое масло, приемлемые для инъекции органические сложные эфиры, например этилолеат, или другие подходящие органические растворители. Эти композиции могут также содержать вспомогательные средства, в частности, смачивающие агенты, изотонизаторы, эмульгаторы, диспергенты и стабилизаторы. Стерилизация может быть осуществлена множеством способов, например асептической фильтрацией,введением в композицию стерилизующих агентов, облучением или нагреванием. Они могут быть также получены в виде твердых стерильных композиций, которые могут быть растворены непосредственно перед применением в стерильной воде или какой-либо другой пригодной для инъекций стерильной среде. Композиции для ректального применения представляют собой суппозитории или ректальные капсулы, которые кроме активного продукта содержат наполнители, такие как масло какао, полусинтетические глицериды или полиэтиленгликоли. Композиции для местного применения могут, например, представлять собой кремы, лосьоны, глазные примочки, жидкости для полоскания полости рта, капли для носа или аэрозоли. В области терапии человека соединения по изобретению могут быть, в частности, использованы для лечения и предупреждения психозов, включая шизофрению, тревожных состояний, депрессии, эпилепсии, нейродегенерации, мозжечковых и спинномозжечковых расстройств, нарушения когнитивных функций, черепномозговой травмы, панических приступов, периферических нейропатий, глауком, мигрени, болезни Паркинсона, болезни Альцгеймера, хореи Гентингтона, синдрома Рейно, тремора, обсессивно-компульсивного синдрома, старческого слабоумия, нарушений тимуса, синдрома Туретта, замедленной дискинезии, двухполюсных расстройств, рака, нарушений двигательного аппарата под влиянием лекарств, дистоний, эндотоксемических шоков, гемморрагических шоков, гипотензии, бессонницы, иммунологических заболеваний, рассеянного склероза, рвот, астмы, нарушений аппетита (булимия, анорексия), ожирения, нарушений памяти, нарушений прохода по кишечнику, при отмене хронического лечения, при лечении синдрома отмены алкоголя или лекарств (например, опиоидов, барбитуратов, конопли,кокаина, амфетаминов, фенциклида, галлюциногенов, бензодиазепинов), таких как аналгетики или усилители анальгетической активности наркотических и ненаркотических лекарств. Дозы зависят от желаемого эффекта, от продолжительности лечения и от используемого способа введения. Обычно они лежат в пределах от 5 до 1000 мг в сутки при пероральном введении у взрослого,в то время как разовые дозы варьируют от 1 до 250 мг активного вещества. В общем случае врачу следует определять подходящую дозировку в зависимости от возраста, веса и других факторов, относящихся к подвергаемому лечению индивидууму. Композиции по изобретению иллюстрируют следующие примеры. Пример А. Используя обычные методы, приготовляют желатиновые капсулы с дозой 50 мг активного продукта, имеющие следующий состав, мг: Соединение формулы I 50 Целлюлоза 18 Лактоза 55 Коллоидный кремнезем 1 Карбоксиметилкрахмал натриевый 10 Тальк 10 Стеарат магния 1 Пример В. Используя обычные методы, приготовляют таблетки с дозой 50 мг активного продукта, имеющие следующий состав, мг: Соединение формулы I 50 Лактоза 104 Целлюлоза 40 Поливидон 10 Карбоксиметилкрахмал натриевый 22 Тальк 10 Стеарат магния 2 Коллоидный кремнезем 2 Смесь гидроксиметилцеллюлозы,глицерина и оксида титана (72/3,5/24,5) в достаточном количестве до 245 мг в конечной таблетке с оболочкой Пример С. Приготовляют раствор для инъекций, содержащий 10 мг активного продукта, имеющий следующий состав:- 22007109 Соединение формулы I Бензойная кислота Бензиловый спирт Бензоат натрия 95%-ный этанол Гидроксид натрия Пропиленгликоль Вода в достаточном количестве ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для лечения и профилактики расстройств, затрагивающих центральную нервную систему, иммунную систему, сердечно-сосудистую систему, эндокринную систему,дыхательную систему, органы желудочно-кишечного тракта, и расстройств репродуктивной системы,содержащая в качестве активного начала по меньшей мере одно соединение формулыR2 и R3, одинаковые или разные, обозначают либо фенил, который может быть незамещенным или замещенным одним или несколькими галогенами, либо гетероароматический радикал, выбранный из следующих циклов: пиридил, пиримидил, которые могут быть незамещенными или замещенными галогеном;R5 обозначает атом водорода или радикал алкокси или алкил, возможно замещенный одним или несколькими галогенами;R6 обозначает алкил или радикал NHCOOC(СН 3)3;Ar обозначает фенил, который может быть замещен одним или несколькими из следующих заместителей: галоген, алкил, алкокси, гидрокси, гидроксиалкил;Het обозначает хинолин, пиридин, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, 1,1 диоксо-1 Н-16-бензо[d]изотиазолил, причем эти гетероциклы могут быть замещены одним или несколькими алкилами, галогенами или оксогруппами; причем алкильные радикалы и части молекул или алкоксильные радикалы и части молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода,оптические изомеры этих соединений и их фармацевтически приемлемые соли с минеральными или органическими кислотами. 2. Фармацевтическая композиция по п.1, для которой в соединении формулы IR2 и R3, одинаковые или разные, обозначают либо фенил, незамещенный или замещенный одним или несколькими галогенами, либо гетероароматический радикал, выбранный из пиридильного, пиримидильного циклов, причем эти гетероароматические радикалы могут быть незамещенными или замещенными галогеном;R6 обозначает алкил или радикал NHCOOC(СН 3)3;Ar обозначает фенил, который может быть замещен одним или несколькими из следующих заместителей: галоген, алкил, алкокси, гидрокси или гидроксиалкил;Het обозначает хинолин, пиридин, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, причем эти гетероциклы могут быть замещены одним или несколькими алкилами, галогенами или оксогруппами; причем алкильные радикалы и части молекул или алкоксильные радикалы и части молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода,- 23007109 оптические изомеры этих соединений и их фармацевтически приемлемые соли с минеральными или органическими кислотами. 3. Композиция по п.1, для которой соединение формулы I, выбирают из следующих соединений:R2 и R3, одинаковые или разные, обозначают либо фенил, который может быть незамещенным или замещенным одним или несколькими галогенами, либо гетероароматический радикал, выбранный из следующих циклов: пиридил, пиримидил, которые могут быть незамещенными или замещенными галогеном;R5 обозначает атом водорода или радикал алкокси или алкил, возможно замещенный одним или несколькими галогенами;R6 обозначает алкил или радикал NHCOOC(СН 3)3;Ar обозначает фенил, который может быть замещен одним или несколькими из следующих заместителей: галоген, алкил, алкокси, гидрокси, гидроксиалкил;Het обозначает хинолин, пиридин, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, 1,1 диоксо-1 Н-16-бензо[d]изотиазолил, причем эти гетероциклы могут быть замещены одним или несколькими алкилами, галогенами или оксогруппами; причем алкильные радикалы и части молекул или алкоксильные радикалы и части молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода,оптические изомеры этих соединений и их фармацевтически приемлемые соли с минеральными или органическими кислотами, за исключением соединения, у которого R2 и R3 являются фенильными радикалами, R1 является радикалом -N(R4)SO2R6, где R4 обозначает фенил и R6 обозначает метил. 5. Соединения формулы I по п.4, в которойR2 и R3, одинаковые или разные, обозначают либо фенил, незамещенный или замещенный одним или несколькими галогенами, либо гетероароматический радикал, выбранный из пиридильного, пиримидильного циклов, причем эти гетероароматические радикалы могут быть незамещенными или замещенными галогеном;R6 обозначает алкил или радикал NHCOOC(СН 3)3;Ar обозначает фенил, который может быть замещен одним или несколькими из следующих заместителей: галоген, алкил, алкокси, гидрокси или гидроксиалкил;Het обозначает хинолин, пиридин, изохинолин, пиримидин, тиазол, тиадиазол, пиперидин, причем эти гетероциклы могут быть замещены одним или несколькими алкилами, галогенами или оксогруппами; причем алкильные радикалы и части молекул или алкоксильные радикалы и части молекул имеют прямую или разветвленную цепь и содержат от 1 до 6 атомов углерода, а циклоалкильные радикалы содержат от 3 до 10 атомов углерода,оптические изомеры этих соединений и их фармацевтически приемлемые соли с минеральными или органическими кислотами, за исключением соединения, у которого R2 и R3 являются фенильными радикалами, R1 является радикалом -N(R4)SO2R6, где R4 обозначает фенил и R6 обозначает метил. 6. Соединение формулы I по п.4, выбранное из следующих соединений:(RS)-N-1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(R)-N-1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(S)-N-1-[(4-хлорфенил)пирид-4-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(RS)-N-1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(R)-N-1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,(S)-N-1-[(4-хлорфенил)пиримидин-5-илметил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид,N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)бензилсульфонамид,оптические изомеры этих соединений и их фармацевтически приемлемые соли с минеральными или органическими кислотами. 7. N-1-[бис(4-хлорфенил)метил]азетидин-3-ил-N-(3,5-дифторфенил)метилсульфонамид, его оптические изомеры и фармацевтически приемлемые соли с минеральными или органическими кислотами. 8. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)R5, в котором R5 обозначает атом водорода, R4 обозначает радикал -CR11R12-Ar или -CR11R12-Het и R12 обозначает атом водорода, отличающийся тем, что производное Rb-COR11, у которого R11 имеют те же значения, как в п.4, вводят во взаимодействие с производным формулыRb обозначает радикал Ar или Het, R2, R3, R11, Ar и Het имеют те же значения, как в п.4, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль. 9. Способ получения соединений формулы I по п.4, у которых R1 является радикалом N(R4)-CO-R5,в котором R4 обозначает радикал -C(R11)(R12)-Het или -C(R11)(R12)-Ar и R12 обозначает атом водорода,отличающийся тем, что производное Hal-COR5 вводят во взаимодействие с производным формулыHal обозначает атом галогена, Rb обозначает Ar или Het, R2, R3, R5, R11, Ar и Het имеют те же значения,как в п.4, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль. 10. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)-SO2R6, в котором R4 обозначает -C(R11)(R12)-Ar или -C(R11)(R12)-Het и R12 обозначает атом водорода, отличающийся тем, что производное Hal-SO2R6 вводят во взаимодействие с производным формулыR2, R3, R11, R5 имеют те же значения, как в п.4, Hal обозначает атом галогена и Rb обозначает Ar и Het,выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль. 11. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)R5, отличающийся тем, что производное R5(R4)NH вводят во взаимодействие с производным формулыR2, R3, R4, R5 имеют те же значения, как в п.4, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль.- 26007109 12. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)SO2R6,отличающийся тем, что производное Hal-SO2R6 вводят во взаимодействие с производным формулыR2, R3, R4 и R6 имеют те же значения, как в п.4, и Hal обозначает атом галогена, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль. 13. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)COR5,отличающийся тем, что производное Hal-COR6 вводят во взаимодействие с производным формулыR2, R3, R4 и R5 имеют те же значения, как в п.4, и Hal обозначает атом галогена, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль. 14. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)-SO2R6, в котором R4 обозначает радикал Het или Ar, отличающийся тем, что производное Rd-NH-SO2-R6 вводят во взаимодействие с производным формулыRd обозначает Ar или Het, R2, R3 и R6 имеют те же значения, как в п.4, и Ms обозначает радикал метилсульфонилокси, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль. 15. Способ получения соединений формулы I по п.4, отличающийся тем, что производное R2-CHBrR3 вводят во взаимодействие с производным формулыR1, R2 и R3 имеют те же значения, как в п.4, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль. 16. Способ получения соединений формулы I по п.4, у которых R1 является радикалом -N(R4)-SO2R6, в котором R4 обозначает пиперид-4-ил, замещенный по азоту алкильным радикалом, отличающийся тем, что алкилируют соответствующее соединение формулы I, у которого R1 является радикалом -N(R4)SO2-R6, в котором R4 обозначает пиперид-4-ил, выделяют продукт и, при необходимости, превращают его в фармацевтически приемлемую соль. 17. Лекарственное средство для лечения и профилактики расстройств, затрагивающих центральную нервную систему, иммунную систему, сердечно-сосудистую систему, эндокринную систему, дыхательную систему, органы желудочно-кишечного тракта, и расстройств репродуктивной системы, содержащее в качестве действующего начала соединение формулы I как оно определено в п.4. 18. Лекарственное средство по п.17 для лечения и/или профилактики психозов, шизофрении, тревожных нарушений, депрессии, болезни Паркинсона и болезни Альцгеймера. 19. Лекарственное средство по п.17 для лечения и/или профилактики ожирения.
МПК / Метки
МПК: C07D 205/04, C07D 403/12, A61K 31/397, C07D 401/12, C07D 417/12, A61P 25/00
Метки: фармацевтические, содержащие, композиции, производные, азетидина, получение, новые
Код ссылки
<a href="https://eas.patents.su/28-7109-farmacevticheskie-kompozicii-soderzhashhie-proizvodnye-azetidina-novye-proizvodnye-azetidina-i-ih-poluchenie.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции, содержащие производные азетидина, новые производные азетидина и их получение</a>
Следующий патент: Вентилируемое курительное изделие
Случайный патент: Способ обработки целлюлозы












