Противовирусное соединение
Номер патента: 21974
Опубликовано: 30.10.2015
Авторы: Линк Джон О., Метобо Самуэль Е., Десай Манодж С., Макман Ричард, Лю Ци, Ян Чжэн-Юй, Бейкон Элизабет М., Сквайерс Нил, Тейлор Джеймс, Ким Чон Ю., Сожье Джозеф Х., Пюнь Хьюн-Цзюн, Криговский Эван С., Грауп Майкл, Го Хунянь, Кларк Майкл О'нил Ханрахан, Келлар Терри, Уоткинс Уильям Дж., Вивиан Рэндалл В., Перриш Джей П., Филлипс Бартон В., Киршберг Торстен А., Митчелл Майкл Л., Чо Эзоп, Лю Хунтао, Коттелл Джероми Дж., Тренкл Джеймс Д., Чоу Чиэнь-Хун, Лазервит Скотт И., Сунь Цзяньюй, Цзинь Хаолунь, Миш Майкл Р., Хэлкомб Рэндалл Л., Венкатарамани Чандрасекар, Като Дэррил, Макфадден Райан, Сюй Ляньхун, Шэн Сяонин, Каналес Эда, Це Уинстон С., Шрёдер Скотт Д.
Формула / Реферат
1. Соединение формулы
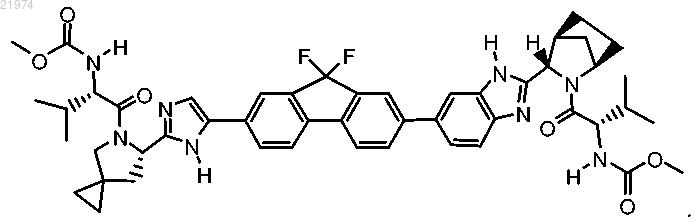
2. Фармацевтическая композиция для лечения нарушений, связанных с вирусом гепатита С (ВГС), включающая соединение по п.1 и фармацевтически приемлемый носитель.
3. Фармацевтическая композиция по п.2, дополнительно содержащая ингибитор полимеразы NS5B.
4. Применение соединения по п.1 для профилактики или лечения гепатита С.
5. Применение композиции по п.2 или 3 для профилактики или терапевтического лечения гепатита С.
6. Способ лечения гепатита С у пациента, представляющего собой человека, включающий введение указанному пациенту соединения по п.1.
7. Способ лечения гепатита С у пациента, представляющего собой человека, включающий введение указанному пациенту композиции по п.2 или 3.
8. Применение соединения по п.1 для приготовления лекарственного средства для лечения гепатита С.
9. Соединение формулы
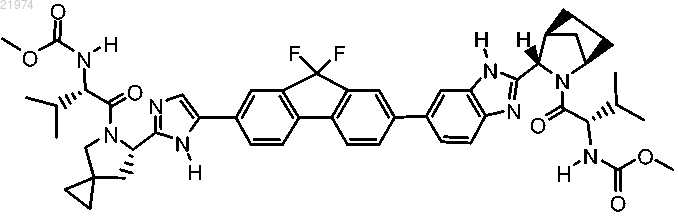
или фармацевтически приемлемая соль указанного соединения.
Текст
Настоящее изобретение относится к противовирусному соединению формулы композициям, включающим это соединение, и способам лечения, которые включают введение этого соединения.(71)(73) Заявитель и патентовладелец: ДЖИЛИД ФАРМАССЕТ ЛЛС (US) Приоритет Заявка на данный патент испрашивает приоритет на основании предварительных заявок на патент США 61/177972, поданной 13 мая 2009 г.;61/224745, поданной 10 июля 2009 г.; 61/238760, поданной 01 сентября 2009 г. Полное содержание каждой из этих заявок включено в настоящее описание посредством ссылки. Уровень техники Гепатит С известен как хроническое вирусное заболевание печени, характеризующееся заболеванием печени. Хотя лекарственные средства, действие которых направлено на печень, широко используются и продемонстрировали эффективность, их применение ограничено токсичностью и другими побочными эффектами. Ингибиторы вируса гепатита С (ВГС) можно применять для контроля развития и прогрессирования инфекции, вызванной ВГС, а также в диагностических тестах на ВГС. Существует потребность в новых терапевтических агентах против ВГС. Сущность изобретения В одном варианте реализации настоящего изобретения предложено соединение формулы или фармацевтически приемлемая соль. Также согласно настоящему изобретению предложена фармацевтическая композиция для лечения нарушений, связанных с вирусом гепатита С (ВГС), содержащая соединение согласно настоящему изобретению и фармацевтически приемлемый носитель. Также согласно настоящему изобретению предложена фармацевтическая композиция, дополнительно содержащая ингибитор полимеразы NS5B. Также согласно настоящему изобретению предложено применение соединения согласно настоящему изобретению для профилактики или лечения гепатита С. Также согласно настоящему изобретению предложено применение фармацевтической композиции согласно настоящему изобретению для профилактики или лечения гепатита С. Также согласно настоящему изобретению предложен способ лечения гепатита С, включающий введение пациенту, представляющему собой человека, соединения согласно настоящему изобретению. Также согласно настоящему изобретению предложен способ лечения гипатита С, включающий введение пациенту, представляющему собой человека, фармацевтической композиции согласно настоящему изобретению. Также согласно настоящему изобретению предложено применение соединения согласно настоящему изобретению в изготовлении лекарственного средства для лечения гипатита С. В одном варианте реализации настоящего изобретения предложено соединение, обладающее улучшенными ингибиторными и фармакокинетическими свойствами, включая повышенную активность против развития резистентности вируса, улучшенную биоактивность при пероральном введении, более высокую эффективность (например, в отношении ингибирования активности ВГС) или более продолжительный эффективный период полужизни in vivo. Соединение согласно настоящему изобретению характеризуется снижением побочных эффектов, менее сложными схемы дозирования или активны при пероральном введении. Подробное описание изобретения Ниже подробно описаны некоторые конкретные варианты реализации настоящего изобретения,примеры которых показаны в сопровождающих схемах и формулах. Предполагается, что настоящее изобретение охватывает все альтернативы, модификации и эквиваленты описанных вариантов реализации,которые могут быть включены в объем настоящего изобретения. Соединения согласно изобретению. Согласно одному варианту реализации настоящего изобретения предложено соединение формулы или его фармацевтически приемлемая соль. В одном из вариантов осуществления настоящего изобретения соединение находится в выделенной и очищенной форме. Обычно термин "выделенный и очищенный" означает, что указанное соединение по существу не содержит биологические материалы (например, кровь, ткань, клетки и т.д.). В одном из кон-1 021974 кретных вариантов осуществления настоящего изобретения указанный термин означает, что указанное соединение или конъюгат согласно настоящему изобретению по крайней мере на 50% свободен от биологических материалов; в другом конкретном варианте осуществления настоящего изобретения указанный термин означает, что указанное соединение или конъюгат согласно настоящему изобретению по крайней мере на 75% свободен от биологических материалов; в другом конкретном варианте осуществления настоящего изобретения указанный термин означает, что указанное соединение или конъюгат согласно настоящему изобретению по крайней мере на 90% свободен от биологических материалов; в другом конкретном варианте осуществления настоящего изобретения указанный термин означает, что указанное соединение или конъюгат согласно настоящему изобретению по крайней мере на 98% свободен от биологических материалов; и в другом конкретном варианте осуществления настоящего изобретения указанный термин означает, что указанное соединение или конъюгат согласно настоящему изобретению по крайней мере на 99% свободен от биологических материалов. В другом конкретном варианте осуществления настоящее изобретение предоставляет соединение или конъюгат согласно настоящему изобретению, который получен синтетическим путм (например, ex vivo). Стереоизомеры. В соединениях согласно настоящему изобретению могут присутствовать хиральные центры, например хиральные атомы углерода или фосфора. Таким образом, соединения согласно настоящему изобретению представляют собой рацемические смеси всех стереоизомеров, включая энантиомеры, диастереомеры и атропоизомеры. В дополнение, к соединениям согласно настоящему изобретению относятся обогащенные или разделнные оптические изомеры по любому асимметрическому хиральному атому или по всем атомам. Другими словами, указанные хиральные центры, очевидные из описания, представлены в виде хиральных изомеров или рацемических смесей. Как рацемические смеси, так и смеси диастереоизомеров, а также индивидуальные оптические изомеры, выделенные или синтезированные, по существу, свободные от их энантиомерных или диастереоизомерных партнров, включены в рамки настоящего изобретения. Указанные рацемические смеси разделяются на их индивидуальные, по существу оптически чистые изомеры с помощью хорошо известных методов, таких как, например, разделение диастереомерных солей, образовавшихся с оптически активными дополнениями, например, кислотами или основаниями, с последующим обратным превращением в оптически активные соединения. В большинстве случаем, необходимый оптический изомер синтезируют в процессе стереоспецифических реакций,начиная с подходящего стереоизомера в качестве необходимого стартового материала. Соединения согласно настоящему изобретению в некоторых случаях также могут существовать в виде таутомерных изомеров. И хотя может быть нарисована только одна нелокализованная резонансная структура, все такие формы включены в рамки настоящего изобретения. Например, ен-аминные таутомеры могут существовать для пуринов, пиримидинов, систем имидазола, гуанидина, амидина и тетразола, и все их возможные таутомерные формы включены в рамки настоящего изобретения. Соли и гидраты. Примеры физиологически приемлемых солей соединений согласно настоящему изобретению включают соли, полученные из приемлемого основания, такого как щелочной металл (например, натрий), щелочно-земельный металл (например, магний), аммоний и NX4+ (где X представляет собой C1-C4-алкил). Физиологически приемлемые соли атома водорода или аминогруппы включают соли органических карбоновых кислот, таких как уксусная, бензойная, молочная, фумаровая, винная, малеиновая, малоновая,яблочная, изоэтиновая, лактобионовая и янтарная кислоты; органические сульфоновые кислоты, такие как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота и ртолуолсульфоновая кислота; и неорганические кислоты, такие как соляная, серная, фосфорная, сульфаминовая кислоты. Физиологически приемлемые соли соединений с гидроксигруппой включают анион указанного соединения в комбинации с пригодным катионом, таким как Na+ и NX4+ (где X независимо выбран из следующего: Н или C1-C4-алкильной группы). Для терапевтического применения соли активных ингредиентов соединений согласно настоящему изобретению обычно будут физиологически приемлемыми, т.е. они будут представлять собой соли, образованные физиологически приемлемой кислотой или основанием. Однако соли кислот или оснований,которые не являются физиологически приемлемыми, также находят применение, например, в приготовлении или очистке физиологически приемлемых соединений. В объем настоящего изобретения включены все соли, вне зависимости от того, получены ли они из физиологически приемлемой кислоты или основания или нет. Соли металлов обычно готовят путем осуществления реакции гидроксида металла с соединением согласно настоящему изобретению. Примеры солей металлов, получаемых таким образом, представляют собой соли, содержащие Li+, Na+ и K+. Менее растворимая соль металла может быть осаждена из раствора путем добавления подходящего соединения металла. Кроме того, соли могут быть образованы путем присоединения некоторых органических или неорганических кислот, например, HCl, HBr, H2SO4, H3PO4 или органических сульфоновых кислот, к основным центрам, обычно аминам, или к кислотным группам. Наконец, очевидно, что описанные здесь композиции включают соединения согласно настоящему изобретению в неионизованной форме, а также в форме цвиттерионов, и комбинации со стехиометрическими количествами воды в форме гидратов. Также в объем настоящего изобретения включены соли исходных соединений с одной или более аминокислотами. Пригодна любая природная или неприродная аминокислота, в частности природные аминокислоты, встречающиеся в виде компонентов белков, хотя аминокислота обычно представляет собой аминокислоту, содержащую боковую цепь с основной или кислотной группой, например, лизин, аргинин или глютаминовая кислота, или нейтральную группу, такая как глицин, серин, треонин, аланин,изолейцин или лейцин. Фармацевтические составы. Соединения согласно настоящему изобретению включают в составы с обычными носителями и вспомогательными веществами, которые выбирают в соответствии с обычной практикой. Таблетки будут содержать вспомогательные вещества, вещества, обеспечивающие скольжение, наполнители, связующие и т.п. Водные составы готовят в стерильной форме, и в случае, когда они предназначены для доставки путем, отличным от перорального, они обычно являются изотоническими. Все составы будут, как правило, содержать вспомогательные вещества, такие как указаны в справочнике Handbook of PharmaceuticalExcipients (1986). Вспомогательные вещества включают аскорбиновую кислоту и другие антиоксиданты,хелатирующие агенты, такие как ЭДТА, углеводы, такие как декстрин, гидроксиалкилцеллюлоза, гидроксиметилцеллюлоза и т.п. pH таких составов лежит в пределах от примерно 3 до примерно 11, но обычно составляет примерно от 7 до 10. Хотя возможно вводить активные ингредиенты отдельно, может быть предпочтительно применять их в виде фармацевтических составов. Такие составы согласно настоящему изобретению, как для применения в ветеринарии, так и для применения у людей, содержат по меньшей мере один активный ингредиент, определенный выше, совместно с одним или более фармацевтически приемлемых носителей для него и возможно другими терапевтическими ингредиентами. Носитель (носители) должны быть "приемлемыми" в том смысле, что они должны быть совместимы с другими ингредиентами состава и физиологически безвредны для реципиента. Составы включают составы, пригодные для введения описанными ниже путями. Составы могут быть удобно представлены в дозированной лекарственной форме и могут быть приготовлены любым способом, известным в области фармацевтики. Общую информацию о методиках и составах можно найти в Remington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA). Такие способы включают стадию объединения активного ингредиента с носителем, который состоит из одного или более вспомогательных ингредиентов. В общем составы готовят путем равномерного и тщательного объединения активного ингредиента с жидкими носителями или тонко измельченными носителями, либо с обоими видами носителей, с последующим приданием формы продукту при необходимости. Составы согласно настоящему изобретению, пригодные для перорального введения, могут быть представлены в виде раздельных единиц, таких как капсулы, крахмальные капсулы или таблетки, каждая из которых содержит заранее определенное количество активного ингредиента; в виде порошков или гранул; в виде раствора или суспензии в водной или неводной жидкости; или в виде эмульсий масло-вводе или эмульсии вода-в-масле. Активный ингредиент можно вводить в виде болюса, электуария или пасты. Таблетку изготавливают путем прессования или формования, возможно с одним или более вспомогательными ингредиентами. Прессованные таблетки могут быть получены в подходящем устройстве из активного ингредиента в сыпучей форме, такой как порошок или гранулы, возможно в смеси со связующим, лубрикантом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим веществом. Формованные таблетки изготавливают путем формования в подходящем устройстве смеси активного ингредиента, измельченного в порошок, смоченного инертным жидким разбавителем. На таблетки может необязательно быть нанесено покрытие или риски и они необязательно могут быть изготовлены таким образом, чтобы обеспечивать медленное или контролируемое высвобождение активного ингредиента из таблеток. Для введения в глаза или внешние ткани, например рот или кожу, составы предпочтительно наносят в виде топической мази или крема, содержащих активный ингредиент (ингредиенты) в количестве,например, от 0.075 до 20% мас./мас. (включая активный ингредиент (ингредиенты) в диапазоне между 0.1 и 20% с шагом 0.1% мас./мас., например 0.6, 0.7% мас./мас. и т.д.), предпочтительно от 0.2 до 15% мас./мас. и наиболее предпочтительно от 0.5 до 10% мас./мас. В случае, когда состав изготовлен в форме мази, активный ингредиент может быть включен либо в парафиновую, либо в смешивающуюся с водой основу. В качестве альтернативы, активный ингредиент может быть представлен в форме крема с кремовой основой типа масло-в-воде. При желании водная фаза основы крема может включать, например, по меньшей мере 30% мас./мас., многоатомного спирта, т.е. спирта, содержащего две или более гидроксильных групп, такого как пропиленгликоль, бутан-1,3-диол, маннитол, сорбит, глицерин и полиэтиленгликоль (включая PEG 400) и их смеси. Топические составы могут при желании включать соединение, которое увиливает всасывание или проникание активного ингредиента через коду или другие пораженные участки. Примеру таких веществ, усиливающих проникание через кожу, включают диметилсульфоксид и его близкие ана-3 021974 логи. Масляная фаза эмульсий согласно настоящему изобретению может быть составлена из известных ингредиентов. Хотя эта фаза может состоять просто из эмульгатора (также известного как эмульгент),желательно, чтобы она содержала смесь по меньшей мере одного эмульгатора с жиром или маслом либо и с жиром, и с маслом. Вместе эмульгатор (эмульгаторы) со стабилизатором (стабилизаторами) или без него образуют так называемый эмульгирующий воск, а воск вместе с жиром и маслом образуют так называемую эмульгирующую основу для мази, которая образует маслянистую диспергированную фазу для составов в форме крема. Эмульгаторы и стабилизаторы эмульсии, пригодные для применения в составах согласно настоящему изобретению, включают Tween 60, Span 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерил-моностеарат и лаурилсульфат натрия. Выбор подходящих масел или жиров для состава основан на желаемых косметических свойствах. Крем предпочтительно должен быть нежирным, не пачкающимся и смывающимся продуктом с подходящей консистенцией, позволяющей избежать вытекания из тюбиков или других контейнеров. Можно использовать эфиры алкилов с линейной или разветвленной цепью, такие как диизоадипат, изоцетилстеарат, пропиленгликоль, изопропил миристат, децил олеат, изопропил пальмитат, бутил стеарат, 2 этилгексил пальмитат или смесь эфиров с разветвленными цепями, известную как Crodamol CAP, причем последняя является предпочтительной. Указанные вещества можно использовать по отдельности или в комбинации, в зависимости от необходимых свойств. В качестве альтернативы используют липиды с высокой температурой плавления, такие как мягкий парафин и/или жидкий парафин и другие минеральные масла. Фармацевтические составы согласно настоящему изобретению включают одно или более соединений согласно настоящему изобретению вместе с одним или более фармацевтически приемлемыми носителями или наполнителями и возможно другими терапевтическими агентами. Фармацевтические составы, содержащие активный ингредиент, могут быть представлены в любой форме, пригодной для предполагаемого способа введения. В случае перорального введения могут быть приготовлены, например, таблетки, лепешки, пастилки, водные или масляные суспензии, растворимые порошки или гранулы, эмульсии, твердые или мягкие капсулы, сиропы или эликсиры. Композиции, предназначенные для перорального применения, могут быть приготовлены в соответствии с любым способом, известным в области изготовления фармацевтических составов, и такие композиции могут содержать один или более агентов,включая подсластители, вкусоароматические вещества и консерванты, обеспечивающие получение пригодных для употребления препаратов. Также приемлемы таблетки, содержащие активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, которые пригодны для изготовления таблеток. Эти наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция или натрия, лактоза, лактоза моногидрат, кроскармеллоза натрий, повидон, фосфат кальция или натрия; гранулирующие и дезинтегрирующие вещества, такие как кукурузный крахмал или альгиновая кислота; связующие, такие как целлюлоза, микрокристаллическая целлюлоза, крахмал, желатин или гуммиарабик; и лубриканты, такие как стеарат магния, стеаровая кислота или тальк. Таблетки могут быть без покрытия или на них может быть нанесено покрытие по известной методике, включая микроинкапсулирование, обеспечивающее замедленную дезинтеграцию и всасывание в желудочнокишечном тракте, и, соответственно, обеспечивающее продолжительное действие в течение большего периода. Например, могут быть использованы такие задерживающие материалы, как глицерил моностеарат или глицерил дистеарат отдельно или с воском. Составы для перорального применения также могут быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, такой как кокосовое масло, жидкий парафин или оливковое масло. Водные суспензии согласно настоящему изобретению содержат активные материалы в смеси с вспомогательными веществами, пригодными для изготовления водных суспензий. Такие вспомогательные вещества включают натрий карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропил метилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и гуммиарабик, и диспергирующие или смачивающие вещества, такие как природные фосфатиды (например, лецитин), продукт конденсации оксида алкилена с жирной кислотой (например, полиоксиэтилен стеарат), продукт конденсации оксида алкилена с длинноцепочечным алифатическим спиртом (например, гептадекаэтиленоксиэтанол),продукт конденсации оксида алкилена с частичным сложным эфиром, полученным из жирной кислоты и гекситол ангидрида (например, полиоксиэтилен сорбитан моноолеат). Водная суспензия может также содержать один или более консервантов, таких как этил или n-пропил р-гидрокси-бензоат, один или более красителей, одно или более вкусоароматических веществ и один или более красителей и один или более подсластителей, таких как сахароза или сахарин. Масляные суспензии могут быть приготовлены путем суспендирования активного ингредиента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое мас-4 021974 ло, или в минеральном масле, таком как жидкий парафин. Суспензии для перорального применения могут содержать загустители, такие как пчелиный воск, твердый парафин или цетиловый спирт. Для получения оральных препаратов приятного вкуса могут быть добавлены подсластители, такие как описаны выше. Эти композиции могут быть приготовлены путем добавления антиоксиданта, такого как аскорбиновая кислота. Диспергируемые порошки и гранулы согласно настоящему изобретению, пригодные для приготовления водной суспензии путем добавления воды, содержат активный ингредиент в смеси с одним или более консервантами. Примеры пригодных диспергирующих или смачивающих и суспендирующих агентов приведены выше. Дополнительные вспомогательные вещества, например, подсластители, вкусоароматические агенты и красители, также могут присутствовать. Фармацевтическая композиция согласно настоящему изобретению может также быть представлена в форме эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло, такое как жидкий парафин, или смесь растительных масел. Подходящие эмульгирующие агенты включают природные камеди, такие как гуммиарабик и трагакантовая камедь, природные фосфатиды, такие как лецитин соевых бобов, сложные эфиры или частичные эфиры, полученные из жирных кислот и гекситол ангидридов, такие как сорбитан моноолеат и продукты конденсации этих частичных эфиров с этилен оксидом, такие как полиоксиэтилен сорбитан моноолеат. Эмульсии могут также содержать подсластители,такие как глицерин, и вкусоароматические вещества. В сиропы и эликсиры могут быть включены подсластители, такие как глицерин, сорбит или сахароза. Такие составы могут также содержать смягчающее вещество, консервант, пищеароматическое вещество или краситель. Фармацевтические композиции согласно настоящему изобретению могут быть представлены в форме стерильного состава для инъекций, такого как стерильная водная или масляная суспензия для инъекций. Такая суспензия может быть приготовлена способом, известным в данной области, с использованием пригодных диспергирующих или смачивающих агентов, таких как упомянутые выше. Стерильные составы для инъекций могут также представлять собой стерильные растворы для инъекций или суспензии в нетоксичном, пригодном для парентерального введения, разбавителе или растворителе, таком как раствор 1,3-бутан-диола или иметь форму лиофилизированного порошка. Приемлемые среды и растворители, которые можно использовать, включают воду, раствор Рингера и изотонический раствор хлорида натрия. Для этой цели могут быть использованы мягкие нелетучие масла, включая синтетические моно- и диглицериды. Дополнительно, в составы для инъекций могут быть включены жирные кислоты, такие как олеиновая кислота. Определенное количество активного ингредиента, которое может быть объединено с материалом носителя с получением формы, содержащей одну дозу, зависит от хозяина, которого лечат, и конкретного способа введения. Например, составы с замедленным высвобождением могут содержать приблизительно от 1 до 1000 мг активного материала, объединенного с подходящим и удобным количеством материала носителя, которое может варьировать от примерно 5 до примерно 95% от общего количества композиции (мас.:мас.). Может быть получена фармацевтическая композиция, обеспечивающая легко отмеряемые количества для введения. Например, водный раствор, предназначенный для внутривенного вливания, может содержать примерно от 3 до 500 мкг активного ингредиента на миллилитр раствора, что будет обеспечивать подходящий объем при скорости 30 мл/ч. Составы, пригодные для введения в глаз, включают глазные капли, в которых активный ингредиент растворен или суспендирован в пригодном носителе, в частности в водном растворителе для активного ингредиента. Активный ингредиент предпочтительно представлен в составе в концентрации от 0.5 до 20%, предпочтительно от 0.5 до 10%, и, в частности, примерно около 1.5% мас./мас. Составы, пригодные для топического применения во рту, включают пастилки, содержащие активный ингредиент во вкусоароматической основе, обычно сахарозе и гуммиарабике или трагаканте; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин, или сахароза и гуммиарабик и полоскания для рта, содержащие активный ингредиент в подходящем жидком носителе. Составы для ректального введения могут быть представлены в форме суппозиториев с подходящей основой, включающей масло какао или салицилат. Составы, пригодные для внутрилегочного и назалиного применения, характеризуются размером частиц в диапазоне от 0,1 до 500 мкм (включая размеры частиц в диапазоне между 0,1 и 500 мкм с шагом,таким как 0,5, 1, 30, 35 мкм и т.д.), которые вводят путем быстрого вдыхания через носовые ходы или путем вдыхания через рот, в результате чего оно достигает альвеолярных мешочков. Пригодные составы включают водные или масляные растворы активного ингредиента. Составы, пригодные для введения в форме аэрозоля или сухого порошка, могут быть приготовлены обычными способами и могут доставляться с другими терапевтическими агентами, такими как соединения, использовавшиеся ранее в лечении или профилактике состояний, ассоциированных с активностью ВГС. Формы, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пенок или спреев, содержащих в дополнение к активному ингредиенту такие носители, которые известны как приемлемые в данной области. Формы, подходящие для парентерального введения включают водные и не водные стерильные рас-5 021974 творы для инъекций, которые могут включать антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, которые придают форме изотоничность относительно крови реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Формы представлены в контейнерах, содержащих одну дозу или несколько доз, например, в запечатанных ампулах или пузырьках, и могут храниться в лиофилизированном состоянии (высушенные заморозкой), которое требует только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед использованием. Приготовляемые экстемпорально инъекционные растворы и суспензии готовят из стерильных порошков, гранул и таблеток описанных ранее видов. Предпочтительными дозированными лекарственными формами являются формы, содержащие дневную дозу или часть дневной дозы, как описано выше, или подходящую долю такой дозы активного ингредиента. Очевидно, что в дополнение к ингредиентам, которые конкретно упомянуты выше, формы согласно настоящему изобретению могут включать агенты, обычные для данной области, в зависимости от типа формы, например, формы, пригодные для перорального введения, могут включать ароматизаторы. Настоящее изобретение также предусматривает ветеринарные композиции, содержащие по меньшей мере один из определенных выше активных ингредиентов совместно с ветеринарным носителем для него. Ветеринарные носители представляют собой материалы, пригодные для целей введения композиции, и могут представлять собой твердые, жидкие или газообразные материалы, которые в остальном являются инертными или приемлемыми в области ветеринарии и которые совместимы с данным активным ингредиентом. Эти ветеринарные композиции можно вводить перорально, парентерально или любым другим желаемым путем. Соединения согласно настоящему изобретению могут также быть включены в форму, обеспечивающую контролируемое высвобождение активного ингредиента, что позволяет реже осуществлять введение или улучшить фармакокинетический профиль или профиль токсичности активного ингредиента. Соответственно, настоящее изобретение также обеспечивает композиции, включающие одно или более соединений согласно настоящему изобретению, для замедленного или контролируемого высвобождения. Эффективная доза активного ингредиента зависит по меньшей мере от природы состояния, которое лечат, токсичности, того, используют ли соединение в профилактических целях (более низкие дозы),способа доставки, и фармацевтической формы, и будут определяться врачом с использованием стандартных исследований по увеличению дозы. Пути введения. Одно или более соединений согласно настоящему изобретению (в настоящем описании называемых активами ингредиентами) вводят путем, подходящим для состояния, которое лечат. Подходящие пути включают пероральный, ректальный, назальный, топический (включая буккальный и подъязычный), вагинальный и парентеральный (включая подкожный, внутримышечный, внутрикожный, интратекальный и эпидуральный) и т.п. Очевидно, что предпочтительный путь может варьировать в зависимости от, например, состояния и реципиента. Преимуществом соединений согласно настоящему изобретению является то, что они биологически активны при пероральном введении и их можно вводить перорально. Комбинированная терапия. В другом варианте реализации неограничивающие примеры подходящих комбинаций включают комбинацию соединения согласно настоящему изобретению с ингибиторами полимеразы NS5B ВГС. Более конкретно, одно или более соединений согласно настоящему изобретению могут быть скомбинированы с одним или более соединений, выбранных из группы, состоящей из следующего: 1) нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B ВГС, например, R1626, R7128(R4048), IDX184, IDX-102, ВСХ-4678, валопицитабин (валоцитабин, NM-283) и МК-0608,2) не-нуклеозидные ингибиторы полимеразы NS5B ВГС, например, PF-868554, VCH-759, VCH-916,JTK-652, MK-3281, GS-9190, VBY-708, VCH-222, A848837, ANA-598, GL60667, GL59728, А-63890, А 48773, А-48547, ВС-2329, VCH-796 (nesbuvir), GSK625433, BILN-1941, XTL-2125 и GS-9190. В ещ одном варианте реализации в настоящей заявке раскрыта фармацевтическая композиция, содержащая соединение согласно настоящему изобретению или фармацевтически приемлемую соль, сольват и/или эфир такого соединения в комбинации с по меньшей мере одним дополнительным терапевтическим агентом и фармацевтически приемлемый носитель или наполнитель. Согласно настоящему изобретению, другой терапевтический агент, используемый в комбинации с соединением согласно настоящему изобретению, может представлять собой любой агент, обладающий терапевтическим эффектом при использовании в комбинации с соединением согласно настоящему изобретению. Например, терапевтический агент, используемый в комбинации с соединением согласно настоящему изобретению, может представлять собой ингибиторы полимеразы NS5b. Комбинации соединений формулы I и дополнительных активных терапевтических агентов могут быть выбраны для лечения пациентов, инфицированных ВГС и пациентов с другими состояниями, такими как ВИЧ-инфекция. Соответственно, соединения формулы I могут быть скомбинированы с одним или более соединений, пригодных для лечения ВИЧ, например, соединения, ингибирующие протеазу ВИЧ,не-нуклеозидные ингибиторы обратной транскриптазы ВИЧ, нуклеозидные ингибиторы обратной транс-6 021974 криптазы ВИЧ, нуклеотидные ингибиторы обратной транскриптазы ВИЧ, ингибиторы интегразы ВИЧ,ингибиторы gp41, ингибиторы CXCR4, ингибиторы gp120, ингибиторы CCR5, интерфероны, аналоги рибавирина, ингибиторы протеазы NS3, ингибиторы полимеразы NS5b, ингибиторы альфа-глюкозидазы 1, гепатопротекторы, не-нуклеозидные ингибиторы ВГС и другие лекарственные средства для лечения ВГС. Более конкретно, одно или несколько соединений согласно настоящему изобретению можно комбинировать с одним или более соединений, выбранных из группы, состоящей из следующего: 1) ингибиторы протеазы ВИЧ, например ампренавир, атазанавир, фосампренавир, индинавир, лопинавир, ритонавир, лопинавир+ритонавир, нелфинавир, саквинавир, типранавир, бреканавир, дарунавир, ТМС-126,ТМС-114, мозенавир (DMP-450), JE-2147 (AG1776), AG1859, DG35, L-756423, RO0334649, KNI-272,DPC-681, DPC-684, и GW640385X, DG17, PPL-100; 2) ненуклеозидные ингибиторы обратной транскриптазы ВИЧ, например каправирин, эмивирин, делавиридин, эфавиренц, невирапин, (+) каланолид А, этравирин, GW5634, DPC-083, DPC-961, DPC-963, MIV-150 и ТМС-120, ТМС-278 (рипливирин), эфавиренц,BILR 355 BS, VRX 840773, UK-453,061, RDEA806; 3) нуклеозидные ингибиторы обратной транскриптазы ВИЧ, например зидовудин, эмтрицитабин, диданозин, ставудин, залцитабин, ламивудин, абакавир,амдоксовир, элвуцитабин, аловудин, MIV-210, рацивир (-FTC), D-d4FC, эмтрицитабин, фосфазид, фозивудин тидоксил, фозалвудин тидоксил, априцитабин (AVX754), амдоксовир, KP-1461, абакавир + ламивудин, абакавир + ламивудин + зидовудин, зидовудин + ламивудин; 4) нуклеотидные ингибиторы обратной транскриптазы ВИЧ, например тенофовир, тенофовир дизопроксил фкмарат + эмтрицитабин, тенофовир дизопроксил фкмарат + эмтрицитабин + эфавиренц и адефовир; 5) ингибитор интегразы ВИЧ,например куркумин, производные куркумин, цикориевая кислота, производные цикориевой кислоты,3,5-дикаффеоилквиновая кислота, производные 3,5-дикаффеоилквиновой кислоты, ауринитрокарбоновойкислоты, производные ауринтрикарбоновая кислота, каффеиновой кислоты фенэтиловый эфир, производные каффеиновой кислоты фенэтилового эфира, тирфостин, производные тирфостина, кверцетин,производные кверцетина, S-1360, зинтевир (AR-177), L-870812 и L-870810, MK-0518 (ралтегравир),BMS-707035, MK-2048, BA-011, BMS-538158, GSK364735C; 6) ингибитор gp41, например энфувиртид,сифувиртид, FB006M, TRI-1144, SPC3, DES6, Locus gp41, CovX и REP 9; 7) ингибитор CXCR4, напримерrIFN-альфа 2 а, rIFN-альфа 2b, IFN альфа-2b XL, rIFN-альфа 2 а, консенсусный IFN альфа, инферген, ребиф, локтерон, AVI-005, PEG-инферген, пегилированный IFN-бета, интерферон альфа для перорального применения, ферон, реаферон, интермакс альфа, r-IFN-бета, инферген + актиммун, IFN-омега с DUROS,и альбуферон; 12) аналоги рибавирина, например ребетол, копегус, левовирин, VX-497 и вирамидин (тарибавирин); 13) ингибиторы NS5a, например А-831, А-689 и BMS-790052; 14) ингибиторы полимеразыSCH-503034 (SCH-7), VX-950 (Телапревир, Telaprevir), ITMN-191 и BILN-2065; 16) ингибиторы альфаглюкозидазы 1, например МХ-3253 (целгозивир) и UT-231B; 17) гепатопротекторы, например IDN-6556,ME 3738, MitoQ и LB-84451; 18) ненуклеозидные ингибиторы ВГС, например производные бензимидазола, производные бензо-1,2,4-тиадиазина и производные фенилаланина; 19) другие лекарственные средства для лечения гепатита С, например задаксин, нитазоксанид (алинеа), BIVN-401 (виростат), DEBIO025, VGX-410C, EMZ-702, AVI 4065, бавитуксимаб, оглуфанид, PYN-17, KPE02003002, актилон (СРО 10101), KRN-7000, цивацир, GI-5005, ANA-975 (изаторибин), XTL-6865, ANA 971, NOV-205, тарвацин,ЕНС-18 и NIM811, 19') агенты, улучшающие фармакокинетические свойства, например BAS-100 иSPI452; 20) ингибиторы РНКазы Н, например ODN-93 и ODN-112; 21) другие анти 0 ВИЧ агенты, например VGV-1, РА-457 (бевиримат), ампрлиген, HRG214, цитолин, полимун, VGX-410, KD247, AMZ 0026,CYT 99007, А-221 HIV, BAY 50-4798, MDX010 (иплимумаб), PBS119, ALG889 и РА-1050040. Примеры способов получения соединений согласно настоящему изобретению. Соединение согласно настоящему изобретению получают с использованием любой приемлемой методики органического синтеза. В данной области хорошо известно множество таких методик. Многие из таких методик подробно описаны в Compendium of Organic Synthetic Methods (John WileySons, NewSons, New York, 1985), Comprehensive Organic Synthesis. Selectivity, StrategyEfficiency in Modern Organic Chemistry. In 9 Volumes, Barry M. Trost, Editor-in-Chief (Pergamon Press, New York, 1993 printing). Другие методы, пригодные для приготовления соединения согласно настоящему изобретению, описаны в международной заявке на патентWO 2006/020276. Ряд примеров способов приготовления соединений согласно настоящему изобретению представлен в приведенных ниже схемах и примерах. Предполагается, что эти способы иллюстрируют природу при-7 021974 готовления, а не ограничивают объем применимых способов. В целом, условия реакции, такие как температура, время реакции, растворители, вещества, используемые для экстракции и т.п., являются обычно применяемыми в данной области для данного типа реакций. Цитируемые справочные материалы в комбинации с материалами, приведенными в настоящей заявке, содержат подробное описание таких условий. Температуры обычно будут лежать в диапазоне от -100 до 200C, растворители будут апротонными или протонными, а время реакции составляет от 10 с до 10 дней. Выделение продукта реакции обычно состоит из гашения всех непрореагировавших реагентов с последующим разделением в системе с водным/органическим слоем (экстракция) и отделением слоя,содержащего продукт. Реакции окисления и восстановления обычно проводят при температурах, близких к комнатной(около 20C), но металл-гидридного восстановления температуру часто понижают до диапазона с 0 до-100C, растворители обычно используют апротонные в случае реакций восстановления, и либо протонные либо апротонные для реакций окисления. Время реакции подбирают таким образом, чтобы достичь желаемых превращений. Реакции конденсации обычно осуществляют при температурах, близких к комнатной, хотя для реакций неравновесного кинетически регулируемой конденсации также часто используют более низкие температуры (от 0 до -100C). Растворители могут быть либо протонными (обычно для неравновесных реакций) или апротонными (обычно для кинетически регулируемых реакций). Стандартные методики синтеза, такие как удаление побочных продуктов реакции в азеотропных условиях и использования безводных условия проведения реакции (например, в атмосфере инертного газа) обычны для данной области и применяются, когда это уместно. Термины "обработанный", "обработка", "процесс обработки" и подобные при использовании применительно в операциям химического синтеза означают приведение в контакт, смешивание, осуществление химической реакции, обеспечение условия для протекания реакции, осуществление контакт и другие понятия которые обычно используют в данной области для обозначения того, что одну или более химических соединений обрабатывают одним или большим числом других химических соединений. Это означает, что "обработка соединения один соединением два" является синонимом "обеспечения условий для реагирования соединения один с соединений два", "осуществление контакта соединения один с соединением два", "осуществления реакции соединения один с соединением два" и других выражений, которые в данной области обычно обозначают, что соединение один "обработали", "осуществили реакцию соединения один", "обеспечили условия для реагирования соединения один" и т.д. с соединением два. Например, обработка обозначает разумный и обычный путь, которым обеспечивают реакции органических соединений. Если не указано другое, предполагается, что используют обычные концентрации (от 0,01 до 10 М, обычно от 0,1 до 1 М), температуры (от -100 до 250C, обычно от -78 до 150C, более типично от -78 до 100C и еще более типично от 0 до 100C), реакционные сосуды (обычно стеклянные,пластиковые, металлические), растворители, значения давления, атмосферы (обычно, воздух для реакций, не чувствительных к содержанию кислорода, или азот или аргон для реакций, чувствительных в присутствию кислорода или воды и т.д. Для выбора условий и устройств для "обработки" в каждом конкретном процессе используют знания об аналогичных реакциях, известных в данной области. В частности, средний специалист в области органического синтеза, выбирают условия и устройства, которые согласно его разумным ожиданиям, основанных на знаниях в данной области, обеспечат успешное осуществление химических реакций описываемого процесса. Модификации каждой из приведенных для примера схем и Примеров (здесь и далее "примерные схемы") обеспечивают различные аналоги конкретных получаемых материалов. Для осуществления таких модификаций можно использовать приведенные выше источники, описывающие пригодные методы органического синтеза. В каждой из примерных схем может быть предпочтительно отделить продукты реакции друг от друга и/или от исходных материалов. Целевой продукт каждого этапа выделяют и/или очищают (здесь и далее "выделяют") до желаемой степени гомогенности способами, известными в данной области. Обычно такие способы выделения включают многофазную экстракцию, кристаллизацию из растворителя или смеси растворителей, дистилляцию, сублимацию или хроматографию. Хроматография может включать любое число методов, включая, например, обращенно-фазовую хроматографию и хроматографию с обычными фазами; гель-фильтрацию; ионообменную хроматографию; хроматографию высокого, среднего и низкого давления и устройства для них; хроматографию в небольших объемах в аналитических целях; хроматографию с симулированным подвижным слоем (SMB) и препаративную хроматографию в тонком или тонком слое, а также методики тонкослойной и флэш-хроматографии. Другой класс способов разделения включает обработку смеси выбранным реагентом, связывающимся с или другим образом, обеспечивает возможность выделения целевого продукта, непрореагировавшего исходного материала, побочного продукта реакции и т.п. Такие реагенты включают адсорбенты или абсорбенты, такие как активированный уголь, молекулярное сита, ионообменные среды или подобные материалы. В альтернативном варианте реагенты могут представлять собой кислоты в случае основного материала, основания в случае кислотного материала, связывающие реагенты, такие как антитела,-8 021974 связывающие белки, селективные хелатирующие агенты, такие как краун-эфиры, реагенты для жидкостной/жидкостно-ионной экстракции (LIX) и т.п. Выбор подходящих способов разделения зависит от природы разделяемых материалов. Например,точки кипения, молекулярной массы при дистилляции и сублимации, присутствия или отсутствия полярных функциональных групп в случае хроматографии, стабильность материалов в кислой и основной среде в случае многофазной экстракции и т.п. Специалист в данной области применит способы, которые с наибольшей вероятностью обеспечат необходимое разделение. Единственный стереоизомер, например, энантиомер, по существу свободный от своего стереоизомера, может быть получен путем разделения рацемической смеси с использованием таких методов, как образование диастереомеров с использованием оптически активных разделяющих веществ (Stereochemistry of Carbon Compoundss (1962), by E. L. Eliel, McGraw Hill; Lochmuller, С. Н., (1975). Chromatogr., 113,3) 283-302). Рацемические смеси хиральных соединений могут быть разделены и выделены любым подходящим способом, включая: (1) образование ионных диастереомерных солей с хиральными соединениями и разделения путем фракционной кристаллизации или другими способами, (2) образование диастереомерных соединений с хиральными дериватизирующими агентами и превращение в чистые стереоизомеры, и (3) прямое разделение по существу чистых или обогащенных стереоизомеров в хиральных условиях. Согласно способу (1) диастереомерные соли могут быть получены в результате реакции энантиомерно чистых хиральных оснований, таких как бруцин, хинин, эфедрин, стрихнин, -метил-фенилэтиламин (амфетамин) и т.п. с асимметричными соединениями, несущими кислотную функциональную группу, такую как карбоновая кислоты или сульфоновая кислота. Разделение диастереомерных солей можно индуцировать путем фракционной кристаллизации или ионной хроматографии. В случае разделения оптических изомеров аминосоединений добавление хиральных карбоновых или сульфоновых кислот, таких как камфорсульфоновая кислота, винная кислота, миндальная кислота или молочная кислота, может привести к образованию диастереомерных солей. В альтернативном варианте, согласно способу (2), осуществляют реакцию субстрата, который необходимо разделить, с одним энантиомером хирального соединения, в результате чего образуется диастереомерная пара (Eliel, E. и Wilen, S. (1994), Stereochemistry of Organic Compounds, John WileySons,Inc., p. 322). Диастереомерные соединения могут быть получены путем осуществления реакций асимметричных соединений с энантиомерно чистыми хиральными дериватизирующими реагентами, такими как производные метила, с последующим разделением диастереомеров и гидролизом, в результате чего получают свободный энантиомерно обогащенный субстрат. Способ определения оптической чистоты включает получение хиральных эфиров, таких как метильный эфир, например (-)-метилхлорформат, в присутствии основания или эфира Моше, -метокси(трифторметил)фенил ацетата (Jacob III. (1982), J.Org. Chem. 47:4165), рацемической смеси и осуществления анализа спектра ЯМР на предмет присутствия двух диастереомеров атропоизомеров. Стабильные диастереомеры атропоизомерных соединений могут быть разделены и выделены посредством обычной и обращено-фазовой хроматографии, в соответствии со способами разделения атропоизомерных нафтил-изохинолинов (Ноуе, Т., WO 96/15111). Согласно способу (3) рацемическая смесь двух энантиомеров может быть разделена хроматографией с использованием хиральной стационарной фазы (Chiral Liquid Chromatography (1989), W. J. Lough, Ed. Chapman иHall, New York; Okamoto (1990), J. of Chromatogr. 513:375-378). Обогащенные или очищенные энантиомеры можно различить с использованием способов, используемых для различения других хиральных молекул с асимметричными атомами углерода, таких как оптическое вращение и круговой дихроизм. Общие аспекты приведенных примеров способов описаны ниже и в разделе "Примеры". Каждый из продуктов описанных процессов может быть подвергнут разделению, выделению и/или очистке перед использованием в следующем процессе. В настоящем описании, например, в разделе "Примеры", приведены примеры способов приготовления соединений согласно настоящему изобретению. Предполагается, что эти способы иллюстрируют природу вариантов получения, но не ограничивают объем доступных способов. Приведенные ниже неограничивающие примеры иллюстрируют настоящее изобретение. 2,7-Дибром-9,9-дифтор-9 Н-флюорен. 2,7-Дибром-флюорен-9-он (4.0 г, 11.8 ммоль) суспендировали в деоксофторе (12 мл) при комнатной температуре и добавляли EtOH (4 капли). Перемешиваемую суспензию нагревали при Т = 90 С в течение 24 ч (предупреждение: использование деоксофтора при повышенных температурах, как описано выше, настоятельно не рекомендуется, поскольку может возникнуть бурный экзотермический процесс). Реакционную смесь охлаждали до комнатной температуры и выливали на лд содержащий бикарбонат натрия. Полученное тврдое вещество собирали фильтрацией. Сырой материал разбавляли в EtOAc и промывали водным раствором HCl (1 М) и раствором хлорида натрия. Раствор сушили на сульфате натрия. Фильтрация и выпаривание растворителей давали сырой продукт, который очищали путем хроматографии на силикагеле (элюент: EtOAc/гексаны) с получением продукта 2,7-дибром-9,9-дифтор-9 Нфлюорен (3.2 г). 19F-NMR: 282 МГц, (ДМСО-d6) : -111.6 ppm. Полученный материал использовали на следующем этапе, где его в виде раствора в EtOAc обрабатывали углм. 5-Азаспиро[2.4]гептан-5,6-дикарбоксильная кислота 5-бензилового эфира 6-[2-(7-бром-9,9-дифтор 9 Н-флюорен-2-ил)-2-оксоэтил]эфир. 2,7-Дибром-9,9-дифтор-9 Н-флюорен (372 мг, 1.04 ммоль), Pd(PPh3)4 (30.0 мг, 0.026 ммоль),- 10021974PdCl2(PPh3)2 (18.2 мг, 0.026 ммоль), As(PPh3)3 (5.0 мг) растворяли в диоксане (10 мл) в атмосфере аргона. Добавляли этоксивинил-трибутил олово (376.4 мг, 1.04 ммоль). Смесь нагревали в течение 140 мин при 85C (масляная баня). Реакционную смесь охлаждали до комнатной температуры. Добавляли N-бром сукцинимид (177 мг, 1.0 ммоль), а затем воду (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, после чего большую часть диоксана удаляли в вакууме. Сырую реакционную смесь разбавляли EtOAc и промывали водой. Все летучие вещества удаляли в вакууме. Добавляли толуол и повторно удаляли все летучие вещества в вакууме. Сырой материал растворяли в ДМФ/MeCN (2 мл,1:1) при комнатной температуре, раствор N-Cbz-4-циклопропил-(L)-пролина (0.84 ммоль) и ДИЭФ (268 мг, 2.08 ммоль) в MeCN (2 мл) добавляли и продолжали перемешивать при комнатной температуре. Через 14 ч, большую часть MeCN удаляли в вакууме и сырую реакционную смесь разбавляли EtOAc. Смесь промывали водным раствором HCl (1 М), водным раствором LiCl (5%), раствором хлорида натрия и сушили на сульфате натрия. Фильтрация и выпаривание растворителей давали сырой продукт реакции,который очищали путем хроматографии на силикагеле (элюент: EtOAc/гексаны) с получением продукта 5-азаспиро[2.4]гептан-5,6-дикарбоксильная кислота 5-бензилового эфира 6-[2-(7-бром-9,9-дифтор-9 Нфлюорен-2-ил)-2-оксоэтил]эфира (176 мг). ЖХ-MC-ESI+: расч. для C30H24BrF2NO5: 596.4 (М+); Эксп.: 595.2/597.2 (М+Н+). 6-[5-(7-Бром-9,9-дифтор-9 Н-флюорен-2-ил)-1 Н-имидазол-2-ил]-5-азаспиро[2.4]гептан-5-карбоновой кислоты бензиловый эфир. 5-Азаспиро[2.4]гептан-5,6-дикарбоксильная кислота 5-бензилового эфира 6-[2-(7-бром-9,9-дифтор 9 Н-флюорен-2-ил)-2-оксоэтил]эфир (172 мг, 0.293 ммоль) растворяли в m-ксиленах (6.0 мл). Добавляли ацетат аммония (226 мг, 2.93 ммоль) и перемешивали реакционную смесь при 140C в течение 60 мин под действием микроволнового излучения. Реакционную смесь охлаждали до комнатной температуры и все летучие вещества удаляли в вакууме. Сырой материал очищали путем хроматографии на силикагеле(элюент: EtOAc/гексаны) с получением продукта 6-[5-(7-бром-9,9-дифтор-9 Н-флюорен-2-ил)-1Hимидазол-2-ил]-5-азаспиро[2.4]гептан-5-карбоновой кислоты бензилового эфира (80.3 мг). ЖХ-МС-ESI+: расч. для C30H24BrF2N3O2: 576.4 (М+); Эксп.: 575.2/577.2 (М+Н+).(1-6-[5-(7-Бром-9,9-дифтор-9 Н-флюорен-2-ил)-1 Н-имидазол-2-ил]-5-азаспиро[2.4]гептан-5 карбонил-2-метилпропил)карбаминовой кислоты метиловый эфир. 6-[5-(7-Бром-9,9-дифтор-9 Н-флюорен-2-ил)-1 Н-имидазол-2-ил]-5-азаспиро[2.4]гептан-5-карбоновой кислоты бензиловый эфир (800 мг, 1.38 ммоль) растворяли в ДХМ (15 мл), добавляли HBr в АсОН (37%,2 мл) и продолжали перемешивать при комнатной температуре. Через 180 мин суспензию разбавляли гексанами, собирали твердое вещество фильтрацией и промывали гексанами в вакууме. Сырой материал использовали на следующем этапе без дополнительной очистки. Сырой материал растворяли в ДМФ (4.0 мл) и ДИЭА (356 мг, 2.76 ммоль), добавляли раствор 2-(L)-метоксикарбониламино-3-метилмасляной кислоты (242 мг, 1.38 ммоль), HATU (524 мг, 1.38 ммоль) и добавляли ДИЭА (178 мг, 1.38 ммоль) в ДМФ(1 мл). Реакционную смесь перемешивали при комнатной температуре. Через 50 мин реакционную смесь разбавляли EtOAc и промывали водным раствором бикарбоната, водным раствором LiCl (5%), раствором хлорида натрия и сушили на сульфате натрия. Фильтрация и удаление растворителей в вакууме давали неочищенный материал, который очищали путем хроматографии на силикагеле (элюент: EtOAc/гексаны) с получением содержащего небольшое количество примесей продукта (1-6-[5-(7-бром-9,9-дифтор-9 Нфлюорен-2-ил)-1H-имидазол-2-ил]-5-азаспиро[2.4]гептан-5-карбонил-2-метилпропил)карбаминовой кислоты метилового эфира (878 мг). ЖХ-MC-ESI+: расч. для C29H29BrF2N4O3: 599.5 (М+); Эксп.: 598.5/600.5 (М+Н+). 3-[6-(9,9-Дифтор-7-2-[5-(2-метоксикарбониламино-3-метилбутирил)-5-азаспиро[2.4]гепт-6-ил]-3Hимидазол-4-ил-9 Н-флюорен-2-ил)-1 Н-бензимидазол-2-ил]-2-азабицикло[2.2.1]гептан-2-карбоновой кислоты трет-бутиловый эфир.(1-6-[5-(7-Бром-9,9-дифтор-9 Н-флюорен-2-ил)-1H-имидазол-2-ил]-5-азаспиро[2.4]гептан-5 карбонил-2-метилпропил)карбаминовой кислоты метиловый эфир (840 мг, 1.4 ммоль), 3-[6-(4,4,5,5 тетраметил-[1,3,2]диоксоборолан-2-ил)-1H-бензимидазол-2-ил]-2-азабицикло[2.2.1]гептан-2-карбоновой кислоты трет-бутиловый эфир (615 мг, 1.4 ммоль), Pd(PPh3)4 (161 мг, 0.14 ммоль), K2CO3 (579 мг, 4.2 ммоль), растворяли в смеси DME (15 мл)/вода (3 мл) в атмосфере аргона. Смесь нагревали в течение 120 мин при 85 - 90C (масляная баня). Через 120 мин добавляли дополнительный боронат эфир (61 мг, 0.14 ммоль) и продолжали нагревать. Через 3 ч реакционную смесь охлаждали до комнатной температуры. Большую часть DME удаляли в вакууме и сырую реакционную смесь разбавляли EtOAc. Смесь промывали раствором хлорида натрия и сушили на сульфате натрия. Фильтрация и выпаривание растворителей давали сырой продукт реакции, который очищали путем хроматографии на силикагеле (элюент: метилпропил)карбаминовой кислоты метиловый эфир. 3-[6-(9,9-Дифтор-7-2-[5-(2-метоксикарбониламино-3-метилбутирил)-5-азаспиро[2.4]гепт-6-ил]-3Hимидазол-4-ил-9 Н-флюорен-2-ил)-1H-бензимидазол-2-ил]-2-азабицикло[2.2.1]гептан-2-карбоновой кислоты трет-бутиловый эфир (115 мг, 0.138 ммоль) растворяли в ДХМ (2 мл), добавляли HCl в диоксане (4 М, 2 мл) и продолжали перемешивать при комнатной температуре. Через 20 мин все летучие вещества удаляли в вакууме. Сырой материал использовали на следующем этапе без дополнительной очистки. Сырой материал растворяли в ДМФ (1.5 мл) и ДИЭА (53.4 мг, 0.414 ммоль) добавляли раствор 2-(L)метоксикарбониламино-3-метилмасляной кислоты (24.2 мг, 0.138 ммоль), HATU (52.4 мг, 0.138 ммоль) и добавляли ДИЭА (17.8 мг, 0.138 ммоль) в ДМФ (1 мл). Реакционную смесь перемешивали при комнатной температуре. Через 20 мин реакционную смесь разбавляли EtOAc и промывали водным раствором бикарбоната, водным раствором LiCl (5%), раствором хлорида натрия и сушили на сульфате натрия. Фильтрация и удаление растворителей в вакууме давали неочищенный материал, который очищали путм ОФ-ВЭЖХ (элюент: вода/MeCN w/0.1% ТФА) с получением продукта (1-3-[6-(9,9-дифтор-7-2-[5(2-метоксикарбониламино-3-метилбутирил)-5-азаспиро[2.4]гепт-6-ил]-3H-имидазол-4-ил-9 Н-флюорен 2-ил)-1H-бензимидазол-2-ил]-2-азабицикло[2.2.1]гептан-2-карбонил-2-метилпропил)карбаминовой кислоты метилового эфира (76 мг). ЖХ-МС-ESI+: расч. для C49H54F2N8O6: 888.9 (М+); Эксп.: 890.0 (М+Н+). 1F-NMR: 282 МГц, (ДМСО-d6) : -109.1 ppm [-74.8 ppm ТФА]. Биологические тесты. Влияние белков сыворотки на эффективность репликона. Исследования репликона проводили в нормальной среде для выращивания клеток (ДМЭМ + 10% эмбриональной бычьей сыворотки), дополненной физиологическими концентрациями сывороточного альбумина человека (40 мг/мл) или -кислого гликопротеина (1 мг/мл). Значения ЕС 50 в присутствии белков сыворотки человека сравнивали со значением EC50 в нормальной среде для определения кратного изменения эффективности. Чувствительность ферментов. Ингибирование протеаз млекопитающих, включая эластазу поджелудочной железы свиньи, эластазу лейкоцитов человека, протеазу 3 и катепсин D, измеряли по Km соответствующих субстратов для каждого фермента. Значение IC50 для каждого фермента сравнивали со значением IC50, полученным для протеазы NS3 1b, для расчта чувствительности. Представленные соединения согласно настоящему изобретению проявляли активность. Цитотоксичность клеток МТ-4. Клетки МТ 4 обрабатывали последовательными разбавлениями соединений в течение пяти дней. Выживаемость клеток измеряли в конце указанного срока обработки с использованием теста PromegaCellTiter-Glo и затем строили нелинейную регрессию для расчта CC50. Концентрация соединения, ассоциированная с клетками при EC50. Культуры Huh-luc выращивали в присутствии соединения при концентрациях, равных EC50. несколько раз в различные моменты времени (0-72 ч) клетки дважды промывали холодной средой и экстрагировали 85% ацетонитрилом; также в каждый момент времени отбирали образец среды. Клетки и образцы среды анализировали с помощью LC/MS/MS для определения молярной концентрации соединений в каждой фракции. Представленные соединения согласно настоящему изобретению проявляли активность. Растворимость и стабильность. Стабильность определяют путм отбора аликвоты 10 мМ ДМСО маточного раствора и приготовления соединения в конечной концентрации 100 мкМ в растворе среды для тестирования (фосфатносолевой буферный раствор, pH 7.4 и 0.1 N HCl, pH 1.5) с общей концентрацией ДМСО 1%. Растворы среды для тестирования инкубируют при комнатной температуре со встряхиванием в течение 1 ч. Затем растворы центрифугируют и полученные супернатанты подвергают анализу ВЭЖХ/УФ. Растворимость рассчитывают, сравнивая количество вещества, обнаруженного в указанном анализируемом растворе, в сравнением с количеством, обнаруженным в ДМСО при той же концентрации. Стабильность соединений после 1 ч инкубирования в фосфатно-солевом буферном растворе PBS при 37C также определяют. Стабильность в замороженных гепатоцитах человека, собаки и крысы. Каждое соединение инкубировали в течение до 1 ч в суспензиях гепатоцитов (100 мкл, 80,000 клеток на лунку) при 37C. Замороженные гепатоциты восстанавливали в среде для выращивания, не содержащей сыворотки. Суспензию переносили в 96-луночный планшет (50 мкл на лунку). Соединения разбавляли до концентрации 2 мкМ в среде для инкубирования, затем добавляли к суспензиям гепатоцитов для начала инкубирования. Образцы отбирают при 0, 10, 30 и 60 мин. Начинали инкубирование и останавливали реакцию смесью, состоящей из 0.3% муравьиной кислоты в 90% ацетонитрил/10% вода. Концентрацию соединения в каждом образце анализировали LC/MS/MS. Время полуразложения соединения в суспензии гепатоцитов определяют подгонкой данных концентрация-время к монофазному экспоненциальному уравнению. Эти данные также масштабировали для представления внутреннего печночного допуска и/или общего печночного допуска. Стабильность в фракции S9 из человека, собаки и крысы. Каждое соединение инкубировали в течение 1 ч в суспензии S9 (500 мкл, 3 мг белка/мл) при 37C (n= 3). Указанные соединения добавляли к суспензии S9 для начала инкубирования. Образцы отбирали при 0, 10, 30 и 60 мин после начала инкубирования. Концентрацию соединения в каждом образце определяли с использованием LC/MS/MS. Время полуразложения соединения в суспензии S9 определяют подгонкой данных концентрация-время к монофазному экспоненциальному уравнению. Проницаемость Сасо-2. Соединения анализировали на контрактной основе (Absorption Systems, Exton, PA). Соединения предоставляли подрядчику слепым методом. Измеряют как прямую (А-к-В), так и обратную (В-к-А) проницаемость. Монослои сасо-2 выращивали до слияния на покрытых коллагеном микропористых поликарбонатных мембранах в 12-луночных планшетах Costar TRANSWELL. Соединения добавляли на верхнюю сторону для измерения прямой проницаемости (А-к-В) и на базолатеральную сторону для измерения обратной проницаемости (В-к-А). Клетки выращивали при 37C с 5% CO2 в инкубаторе с увлажнением. В начале инкубирования, а также после 1 ч и 2 ч с начала инкубирования аликвоты в 200 мкл отбирали в получающую камеру и замещали свежим буфером для тестов. Концентрацию соединения в каждом образце определяли с использованием LC/MS/MS. Рассчитывали видимую проницаемость, Рарр. Связывание с белками плазмы. Связывание белков плазмы измеряли равновесным диализом. Каждое соединение подсыпали в пустую плазму до конечной концентрации 2 мкМ. Плазму с добавками и фосфатный буфер помещали по разные стороны собранных ячеек для диализа, которые затем медленно вращали при 37C в водяной бане. В конце инкубирования определяли концентрацию соединения в плазме и в фосфатном буфере. Процент несвязанного соединения рассчитывали с использованием следующего уравнения: где Cf и Cb означают свободные и связанные концентрации, определнные как концентрации в постдиализном буфере и плазме соответственно. Определение профиля CYP450. Каждое соединение инкубировали с каждым из пяти рекомбинантных белков CYP450, включаяCYP1A2, CYP2C9, CYP3A4, CYP2D6 и CYP2C19, в присутствии или отсутствие НАДФ-Н. Образцы последовательно отбирали из инкубационной смеси вначале инкубирования и при 5, 15, 30, 45 и 60 мин после добавления соединения. Концентрацию соединения в инкубационной смеси определяли методомLC/MS/MS. Процент соединения, оставшегося после инкубирования в каждый момент времени рассчитывают путм сравнения с образцом, полученным в начале инкубирования. Стабильность в плазме крысы, собаки, обезьяны и человека. Соединения инкубируют в течение 2 ч в плазме (крыса, дог, обезьяна или человек) при 37C. Соединения добавляют в плазму до конечной концентрации 1 и 10 мкг/мл. Отбирают аликвоты в 0, 5, 15,30, 60 и 120 мин после добавления соединения. Концентрацию соединений и главные метаболиты для каждой временной точки измеряли с помощью LC/MS/MS. Оценка активности против HCV на клетках. Противовирусную эффективность (EC50) определяли с использованием теста с репортером репликона ВГЧ на основе люциферазы Renilla 1 (RLuc). Для выполнения этого теста клетки HCV 1b RLuc (содержащие двухцистронный репликон генотипа 1b Con1, кодирующий репортер a RLuc) или клетки HCV 1a RLuc (содержащие двухцистронный репликон генотипа 1a H77, который кодирует репортер RLuc) диспергировали в 384-луночных планшетах. Соединения снова суспендировали в ДМСО при концентрации 10 мМ и готовили серийные разведения в ДМСО с использованием автоматического устройства для раскапывания. Серийные разведения соединений смешивали со средой для культивирования клеток и добавляли к посеянным клеткам. ДМСО использовали в качестве отрицательного контроля (растворитель), а в качестве положительного контроля в анализ включали ингибитор протеазы ITMN-191 в концентрации 100EC50. Через 72 ч клетки лизировали и измеряли активность люциферазы Renilla в соответствии с рекомендациями производителя (Promega-Madison, WI). Для расчета значений EC50 использовали нелинейную регрессию. Обычно соединения согласно настоящему изобретению способны ингибировать несколько генотипов ВГС, например, соединения согласно настоящему изобретению проявляют активность в отношении генотипов ВГС, выбранных их 1 а, 1b, 2 а, 2b, 3 а, 4 а и 5 а. Биологические данные (противовирусная активность [EC50], полученные в тесте с репортером репликона ВГЧ на основе люциферазы Renilla 1 (RLuc). - HCV 1b RLuc) для примеров соединений согласно настоящему изобретению, приведены в таблице ниже. Эти соединения могут быть получены с использо- 13021974 Все публикации, патенты и патентные документы включены в настоящее описание путем ссылки,как если бы они были отдельно включены путем ссылки. Настоящее изобретение описано с указанием различных конкретных и предпочтительных вариантов осуществления и методик. Однако следует понимать, что возможны многочисленные вариации и модификации, не выходящие за пределы сущности и объема настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 2. Фармацевтическая композиция для лечения нарушений, связанных с вирусом гепатита С (ВГС),включающая соединение по п.1 и фармацевтически приемлемый носитель. 3. Фармацевтическая композиция по п.2, дополнительно содержащая ингибитор полимеразы NS5B. 4. Применение соединения по п.1 для профилактики или лечения гепатита С. 5. Применение композиции по п.2 или 3 для профилактики или терапевтического лечения гепатита С. 6. Способ лечения гепатита С у пациента, представляющего собой человека, включающий введение указанному пациенту соединения по п.1. 7. Способ лечения гепатита С у пациента, представляющего собой человека, включающий введение указанному пациенту композиции по п.2 или 3. 8. Применение соединения по п.1 для приготовления лекарственного средства для лечения гепатита С. 9. Соединение формулы или фармацевтически приемлемая соль указанного соединения.
МПК / Метки
МПК: C07D 417/14, C07D 409/14, C07D 417/04, C07D 413/04, C07D 401/14, C07D 403/14, C07D 403/04, C07D 405/14, C07D 495/04
Метки: соединение, противовирусное
Код ссылки
<a href="https://eas.patents.su/15-21974-protivovirusnoe-soedinenie.html" rel="bookmark" title="База патентов Евразийского Союза">Противовирусное соединение</a>
Предыдущий патент: Фиксирующее устройство, предназначенное для прикрепления инструмента к фиксирующему элементу внутри трубы
Следующий патент: Буровое оборудование и крепежные средства для этого оборудования
Случайный патент: Незамещенные тиеноизоксазолфенокси этил- и пропилпроизводные, используемые как антагонисты d4












