Жидкое противовирусное лекарственное средство
Номер патента: 21610
Опубликовано: 30.07.2015
Авторы: Маркова Инна Николаевна, Гапонюк Петр Яковлевич, Маркова Елена Алексеевна, Марков Илья Александрович, Гапонюк Полина Петровна
Формула / Реферат
1. Жидкое противовирусное лекарственное средство, содержащее в качестве активного вещества ковалентный конъюгат интерферона-альфа (ИНФ-α) с полиэтиленгликолем (ПЭГ), буфер, стабилизатор и фармацевтически приемлемый растворитель, отличающееся тем, что в качестве ковалентного конъюгата содержит
линейный монопегилированный ИНФ-α общей формулы (I)
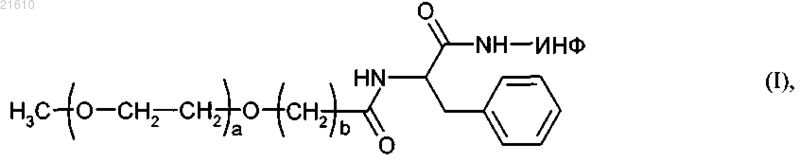
где a - целое число от 100 до 1800,
b - целое число от 1 до 9 и
ИНФ обозначает остаток интерферона-α с молекулярной массой от 5 до 80 кДа,
или разветвленный монопегилированный ИНФ-α общей формулы (II)
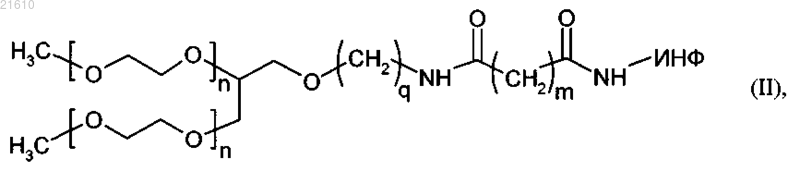
где n - целое число от 200 до 950,
q - целое число в интервале от 1 до 5,
m - целое число в интервале от 1 до 5 и
ИНФ обозначает остаток интерферона-α;
в качестве стабилизатора содержит смесь сорбита, полисорбата 20 и L-глутамата натрия, в качестве буфера содержит цитратно-фосфатный буфер, а в качестве фармацевтически приемлемого растворителя содержит воду при следующем соотношении компонентов, г/100 мл:
ковалентный конъюгат 0,005-0,1;
стабилизатор:
сорбит 1,0-10,0;
полисорбат 20 0,001-0,1;
L-глутамат натрия 0,1-1,0;
цитратно-фосфатный буфер 0,85-0,95;
вода остальное.
2. Лекарственное средство по п.1, отличающееся тем, что содержит указанные компоненты в следующем соотношении, г/100 мл:
ковалентный конъюгат 0,03;
стабилизатор 2,0;
сорбит
полисорбат 20 0,01;
L-глутамат натрия 0,5;
цитратно-фосфатный буфер 0,92;
вода остальное.
Текст
ЖИДКОЕ ПРОТИВОВИРУСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО Изобретение относится к областям фармакологии и медицины и обеспечивает жидкое лекарственное средство, содержащее в качестве активного вещества ковалентный конъюгат интерферона-альфа (ИНФ-) с полиэтиленгликолем (ПЭГ), буфер, стабилизатор и фармацевтически приемлемый растворитель, в котором ковалентный конъюгат является линейным или разветвлнным монопегилированным ИНФ- общей формулы (I) или (II), стабилизатором является смесь сорбита, полисорбата 20 и L-глутамата натрия, буфером является цитратнофосфатный буфер и фармацевтически приемлемым растворителем является вода. Техническим результатом изобретения является долговременная стабильность жидкого лекарственного средства с сохранением существенной доли активности немодифицированного интерферона-альфа,длительной циркуляцией в кровотоке и улучшенными характеристиками противовирусной активности и иммуногенности при хранении. Марков Илья Александрович,Маркова Елена Алексеевна, Гапонюк Полина Петровна, Маркова Инна Николаевна (RU), Гапонюк Петр Яковлевич (умер) Скибневский А.Ю. (RU) Область техники, к которой относится изобретение Изобретение относится к областям фармакологии и медицины, более конкретно - к жидкому противовирусному лекарственному средству, содержащему в качестве активного вещества пегилированный интерферон -2b, физиологически совместимый буфер, стабилизатор и фармацевтически приемлемый растворитель. Данное лекарственное средство предназначено для лечения вирусных и онкологических заболеваний, а также может служить иммуномодулятором. Предшествующий уровень техники Пегилированный интерферон (ПЭГ-ИНФ) является интерфероном (ИНФ), химически модифицированным ковалентным присоединением полиэтиленгликоля к его молекуле. ПЭГ-ИНФ, в отличие от немодифицированных ИНФ, существенно дольше находится в организме человека, сохраняя свою биологическую активность. В настоящее время в Российской Федерации разрешены к применению и зарегистрированы два вида ПЭГ-ИНФ: ПЭГ-ИНФ -2 а (препарат "Пегасис", производство фирмы Ля Рош) и ПЭГ-ИНФ -2b(препарат "ПегИнтрон", производство фирмы Шерринг). Специалисты рассматривают эти препараты как"золотой стандарт" средств противовирусной терапии для лечения гепатита С при сочетанном применении с рибавирином. Было показано, что введение полиэтиленгликоля не оказывает значимого эффекта на течение гепатита С, но приводит к увеличению продолжительности действия ИНФ. Это имеет большое практическое значение, заключающееся в снижении лекарственной нагрузки на организм пациента. Так, для достижения терапевтического эффекта достаточно однократной инъекции ПЭГ-ИНФ в неделю вместо трехкратного введения непегилированного ИНФ. Поскольку ПЭГ-ИНФ остается в организме человека дольше и его действие благодаря полиэтиленгликолю усиливается, при его применении можно ожидать лучших результатов, причем без увеличения выраженности побочных эффектов. Пегилированные интерфероны как в составе монотерапии, так и в сочетании с рибавирином, прошли многочисленные клинические исследования, в результате которых собрана обширная доказательная база относительно эффективности и переносимости препаратов. ПЭГ-ИНФ позволяют достичь устойчивого вирусологического ответа до 60% у пациентов с генотипом вируса 1 и до 85% для больных с генотипами вируса 2 и 3. Производство лекарственных форм интерферона сопряжено с рядом проблем, которые обусловлены чувствительностью активного компонента к физическим и химическим воздействиям. Как и другие белки, интерферон в водных растворах в первую очередь подвергается химической деградации, например протеолизу, окислению, дисульфидному обмену, олигомеризации и дезамидированию. К физической деградации главным образом относятся агрегация, выпадение в осадок и адсорбция. Кроме того, под воздействием света, повышенной температуры и при изменении рН среды возможна частичная рацемизация аминокислот, входящих в состав активного белка, которая может приводить к снижению фармакологического эффекта и увеличению нежелательных побочных эффектов и токсичности. Поскольку интерферон очень активен и присутствует в лекарственных формах в малых количествах, стабильность препаратов интерферона и обеспечение постоянной концентрации активного вещества имеет особое значение. Следовательно, лекарственная форма интерферона должна содержать добавки,которые максимально препятствуют протеканию перечисленных нежелательных превращений и противодействуют влиянию внешних факторов. Например, в качестве универсального стабилизатора коммерчески выпускаемых белковых препаратов ранее часто применяли человеческий сывороточный альбумин. Однако его введение в состав лекарственной формы обусловливает ряд проблем, например опасность вирусного заражения и образование агрегатов, которые, в свою очередь, могут привести к образованию антител. В связи с указанными недостатками в современные инъекционные фармакологические композиции человеческий сывороточный альбумин, как правило, не включают. Препараты пегилированных интерферонов можно разделить на два типа. К первому типу препаратов ПЭГ-ИНФ относится "ПегИнтрон", который является пролекарством интерферона, содержащим фрагмент линейного ПЭГ с молекулярной массой 12 кДа. Молекула полиэтиленгликоля присоединена к интерферону нестабильной карбаматной связью, легко поддающейся гидролизу. По этой причине препарат выпускают в виде сухого вещества (лиофилизата). В международной заявке WO 1999/048535 (опубл. 30.09.1999) раскрыт водный состав, включающий конъюгаты ПЭГ-ИНФ-, буфер, стабилизатор, криопротектор и растворитель. Состав, содержащий в качестве конъюгата ИНФ-, связанный уретановой (карбаматной) связью по гистидиновому остатку с одной молекулой ПЭГ, имеющей молекулярную массу 12 кДа, предназначен для приготовления лиофилизированного порошка, который восстанавливают в инъекционную лекарственную форму непосредственно перед применением. В предпочтительном варианте одна ампула, предназначенная для получения 0,5 мл препарата, содержит 0,1 мг ПЭГ-ИНФ в качестве активного вещества, 0,75 мг безводного двухосновного фосфата натрия и 0,75 мг дигидрата одноосновного фосфата натрия в качестве буферной смеси,40 мг сахарозы в качестве криопротектора и 0,05 мг полисорбата 80 в качестве стабилизатора. В патенте US 7632491 (опубл. 15.12.2009) предложен раствор для приготовления лиофилизированной композиции, включающий пегилированный интерферон, один или несколько криопротекторов, буфер, стабилизатор и воду, в котором по меньшей мере 80 мас.% криопротектора составляет трегалоза, а буфер обеспечивает поддержание рН в интервале от 4,5 и 7,1. В одном из предпочтительных осуществлений одна доза препарата содержит 0,1-0,3 мг ПЭГ-ИНФ, 1,5 мг безводного двухосновного фосфата натрия и 1,5 мг моногидрата одноосновного фосфата натрия в качестве буфера, 90 мг дигидрата трегалозы в качестве криопротектора, 0,1 мг полисорбата 80 в качестве стабилизатора и требуемое для растворения количество воды. Помимо сложности процесса производства основным недостатком известных лиофилизатов является необходимость восстановления лекарственной формы перед инъекцией, что требует внимания медицинского персонала при выполнении всех необходимых манипуляций и сопряжено с риском неправильного обращения с фармацевтическим продуктом. В патенте RU 2382048 (опубл. 20.02.2008) раскрыт жидкий состав для инъекций, включающий в качестве активного вещества ковалентный конъюгат интерферона-альфа с двумя остатками ПЭГ, в котором молекула интерферона через аминоспиртовый или гомосериновый линкер связана с фрагментом триазина, к которому присоединен ПЭГ. Состав сохраняет 25-38% активности исходного интерферона. Недостатком препарата является возможность присутствия в нм токсичных производных цианурхлорида или трифторэтансульфоновой кислоты. Кроме того, необходимость тщательной очистки промежуточного соединения с целью снижения токсичности активного вещества и повышения эффективности готового препарата снижает выход конечного продукта. В патенте US 5762923 (опубл. 09.06.1998) предложена не содержащая человеческого сывороточного альбумина водная композиция интерферона-альфа или пегилированного интерферона-альфа, растворнного в воде с неионогенным поверхностно-активным веществом и бензиловым спиртом, содержащая буфер в количестве, обеспечивающем поддержание рН в интервале от 4,5 до 6,0 и изотонический агент. Ко второму типу пегилированных интерферонов относится препарат "Пегасис", рассматриваемый как ближайший аналог предлагаемого жидкого лекарственного средства. Активное вещество представляет собой ковалентный конъюгат ИНФ -2 а, содержащий разветвленный ПЭГ с молекулярной массой 40 кДа. Присоединение полиэтиленгликоля к интерферону осуществлено через лизиновый линкер, соединенный с молекулой интерферона амидной связью, а с молекулой ПЭГ - карбаматной связью. По стабильности данный препарат превосходит "ПегИнтрон", что позволяет выпускать его в инъекционных формах, например, в виде раствора с рН 6, содержащего 0,18 мг ПЭГ-ИНФ, 4 мг хлорида натрия, 5 мг бензилового спирта, 1,3085 мг тригидрата ацетата натрия, 0,0231 мг уксусной кислоты, 0,025 мг полисорбата 80, воду для инъекций до 0,5 мл. Основным недостатком данной формы является малая доля сохраннной активности исходного интерферона (на уровне 1%). Другим недостатком является присутствие в качестве консерванта бензилового спирта, который особенно пагубно влияет на младенцев ("Neonatal Deaths Associated With Use Of Benzyl Alcohol - United States". Morbidity and Mortality Weekly Report. Vol. 31 (No. 22, 1982). P. 290-291;of metabolic acidosis and death in neonatal infants". Lancet (в печати. Кроме того, малая емкость ацетатного буферного раствора при рН 6 (Досон Р., Эллиот Д., Эллиот У., Джонс К. Справочник биохимика: Пер. с англ. -М.: Мир, 1991. 544 с) приводит к снижению стабильности лекарственной формы. Таким образом, технической задачей изобретения является разработка лекарственного средства с улучшенными фармакологическими свойствами и расширение арсенала жидких противовирусных средств, содержащих пегилированный интерферон-. Техническим результатом изобретения является долговременная стабильность жидкого лекарственного средства с сохранением существенной доли активности немодифицированного интерферонаальфа, длительной циркуляцией в кровотоке и улучшенными характеристиками противовирусной активности и иммуногенности при хранении. Для достижения указанного технического результата жидкое лекарственное средство, содержащее в качестве активного вещества ковалентный конъюгат интерферона-альфа (ИНФ-) с полиэтиленгликолем(ПЭГ), буфер, стабилизатор и фармацевтически приемлемый растворитель, согласно изобретению, в качестве ковалентного конъюгата содержит линейный монопегилированный ИНФ- общей формулы (I) где а - целое число от 100 до 1800, b - целое число от 1 до 9 и ИНФ обозначает остаток интерферона- с молекулярной массой от 5 до 80 кДа,или разветвлнный монопегилированный ИНФ- общей формулы (II) где n - целое число от 200 до 950, q - целое число в интервале от 1 до 5, m - целое число в интервале от 1 до 5 и ИНФ обозначает остаток интерферона-; в качестве стабилизатора содержит смесь сорбита, полисорбата 20 и L-глутамата натрия, дополнительно содержит цитратно-фосфатный буфер, а в качестве фармацевтически приемлемого растворителя содержит воду при следующем соотношении компонентов (г/100 мл): ковалентный конъюгат 0,005-0,1; стабилизатор: сорбит 1,0-10,0; полисорбат 20 0,001-0,1;L-глутамат натрия 0,1-1,0; цитратно-фосфатный буфер 0,85-0,95; вода остальное. Кроме того, лекарственное средство содержит вышеуказанные компоненты (г/100 мл): ковалентный конъюгат 0,03; стабилизатор 2,0; сорбит полисорбат 20 0,01;L-глутамат натрия 0,5; цитратно-фосфатный буфер 0,92; вода остальное. Сущность изобретения В результате обширных исследований авторы изобретения установили, что указанные недостатки решений, известных из уровня техники, могут быть преодолены получением жидкого противовирусного лекарственного средства, которое содержит в качестве активного вещества линейный или разветвленный ковалентный конъюгат интерферона-альфа (ИНФ-) с полиэтиленгликолем (ПЭГ), полученного азидной конденсацией пегилирующего агента (ПЭГ-агента) с ИНФ-. Химизм применяемой реакции азидной конденсации, предполагающий взаимодействие ПЭГ-агента общей формулы (III) или (IV) с ИНФ-, обусловливает отсутствие в структуре конъюгата гидролитически лабильной карбаматной связи, а также продуктов рацемизации субстрата, обладающих пониженной биологической активностью и проявляющих заметное побочное действие. Таким образом, настоящее изобретение обеспечивает получение жидкого противовирусного лекарственного средства, содержащее в качестве активного вещества ковалентный конъюгат интерферонаальфа (ИНФ-) с полиэтиленгликолем (ПЭГ), буфер, стабилизатор и фармацевтически приемлемый растворитель, в котором в качестве ковалентного конъюгата содержит линейный монопегилированный ИНФ- общей формулы (I) где a - целое число от 100 до 1800, b - целое число от 1 до 9 и ИНФ обозначает остаток интерферона- с молекулярной массой от 5 до 80 кДа,или разветвлнный монопегилированный ИНФ- общей формулы (II) где n - целое число от 200 до 950, q - целое число в интервале от 1 до 5, m - целое число в интервале от 1 до 5 и ИНФ обозначает остаток интерферона-; в качестве стабилизатора содержит смесь сорбита, полисорбата 20 и L-глутамата натрия, в качестве буфера содержит цитратно-фосфатный буфер, а в качестве фармацевтически приемлемого растворителя содержит воду при следующем соотношении компонентов (г/100 мл): ковалентный конъюгат 0,005-0,1; стабилизатор: сорбит 1,0-10,0; полисорбат 20 0,001-0,1;L-глутамат натрия 0,1-1,0; цитратно-фосфатный буфер 0,85-0,95; вода остальное. В предпочтительном осуществлении изобретения лекарственное средство содержит (г/100 мл): ковалентный конъюгат 0,03; стабилизатор 2,0; сорбит полисорбат 20 0,01;L-глутамат натрия 0,5; цитратно-фосфатный буфер 0,92; вода остальное. Лекарственное средство в соответствии с изобретением готовят путем смешения растворов компонентов, предварительно прошедших стерилизующую фильтрацию, с последующим установлением значения рН в интервале от 4,5 до 7,5 добавлением разбавленного раствора NaOH и доведения водой для инъекций до необходимого объема. Готовый раствор повторно подвергают стерилизующей фильтрации через фильтр с пористостью 0,22 мкм и в асептических условиях дозированно разливают в стерильные контейнеры. Лекарственное средство в соответствии с изобретением может находиться в виде стандартной дозируемой формы, предназначенной для парентерального введения. В этом случае стерильным контейнером является ампула, флакон, шприц, шприц-ручка или шприц-тюбик. Жидкое лекарственное средство можно вводить пациенту с помощью общепринятых приспособлений для инъекции, позволяющих вводить от 0,3 до 20 мл, предпочтительно - от 0,5 до 10 мл композиции в виде стандартной дозы. Лекарственное средство в соответствии с изобретением, содержащее монопегилированный линейный или разветвлнный ИНФ- общих формул (I) или (II) и имеющее рН от 5 до 7, является стабильным при хранении в течение полугода с сохранением противовирусной активности на уровне 90% е исходной величины. Это подтверждено результатами исследований растворов, приготовленных в соответствии с примером 1 (табл. 1 и 2). Таблица 1. Стабильность и противовирусная активность композиций линейного ПЭГ-ИНФ -2b формулы (I) с различными значениями рН в условиях 6-месячного хранения Таблица 2. Стабильность и противовирусная активность композиций разветвленного ПЭГ-ИНФ -2b формулы (II) с различными значениями рН в условиях 6-месячного храненияCA - содержание агрегатов; ПА - противовирусная активность Лекарственное средство в соответствии с изобретением характеризуется основными фармакокинетическими параметрами: временем циркуляции (Т); площадью под кривой (AUC); максимальной концентрацией в сыворотке (Cmax); временем достижения максимальной концентрации в сыворотке (Tmax); клиренсом (CL); объмом распределения (Vd) и временем полувыведения (t1/2), приведнными в табл. 3. Таблица 3. Основные фармакокинетические параметры лекарственных средств, содержащих линейный и разветвленный ПЭГ-ИНФ -2b Лекарственное средство в соответствии с изобретением можно применять для лечения таких вирусных заболеваний как хронический гепатит В (HBeAg-позитивный или HBeAg-негативный с компенсированным поражением печени и признаками вирусной репликации, хронический гепатит С без цирроза или с компенсированным циррозом, клинически стабильная ВИЧ-инфекция и хронический гепатит С с присоединнной ВИЧ-инфекцией. Далее изобретение будет проиллюстрировано предпочтительными примерами его осуществления,подтверждающими достижение технического результата. Пример 1. Приготовление жидкого лекарственного средства ПЭГ-ИНФ -2b В стерильных условиях в мерный стакан вместимостью 150 мл, снабжнный комбинированным потенциометрическим электродом "ЭКОМ рН ком", соединнным с рН-метром "Экотест-2000" при перемешивании магнитной мешалкой последовательно вносят стерильные растворы 525 мг моногидрата лимонной кислоты в 10 мл воды, 390 мг NaH2PO42 Н 2 О в 10 мл, 2 г сорбита в 10 мл воды, 500 мг Lглутамата натрия в 10 мл воды и 10 мг полисорбата 20 в 10 мл воды. К полученной смеси при перемешивании по каплям прибавляют 5% NaOH до установления требуемой величины рН и приливают 30 мл раствора соответствующего ПЭГ-ИНФ -2b с концентрацией 1 мг/мл. Далее значение рН полученного раствора корректируют прибавлением 5% NaOH и водой для инъекций доводят общий объем смеси до 100 мл. Раствор фильтруют через стерилизующий фильтр с размером пор 0,22 мкм, в асептических условиях разливают по 1 мл в стерильные флаконы, которые укупоривают и маркируют, прилагая инструкцию по медицинскому применению. Пример 2. Изучение стабильности жидкого лекарственного средства ПЭГ-ИНФ -2b. Контейнеры разделяют на 3 группы и закладывают на хранение при 4, 20 и 37 С. Далее осуществляют отбор по 3 ампулы из каждой группы на исследование по следующей схеме: ампулы, хранящиеся при 4 С, отбирают с периодичностью 1 раз в месяц, хранящиеся при 20 С отбирают с периодичностью 1 раз в 2 недели, а образцы, хранящиеся при 37 С, отбирают еженедельно. Перед началом исследований три образца, не подвергшиеся инкубации, объединяют и исследуют на содержание соответствующего ПЭГ-ИНФ -2b (СПИ) и его агрегатов (СА) эксклюзионной ВЭЖХ (колонка Superose 6 10/300 GL, 22 С, элюент: 50 ммоль натрия фосфат, 300 ммоль NaCl, 10% этанол, рН 6,8,0,4 мл/мин, 280 нм). Параллельно исследуют противовирусную активность (ПА) по методике, приведенной в примере 3. Полученные значения показателей СПИ, СА и ПА принимают за 100%. Аналогично исследуют объединнные образцы из каждой группы, отобранные в соответствующие моменты времени. Все результаты исследований выражают в процентах от показателей соответствующего неинкубированного раствора. Пример 3. Исследование токсичности и безопасности жидкого лекарственного средства ПЭГ-ИНФ-2b. Самцам белых нелинейных мышей массой 201 г вводят указанное жидкое лекарственное средство,приготовленное в соответствии с примером 1, в объеме 0,1 мл. У животных ежедневно в течение недели регистрируют клинические симптомы, взвешивают, отбирают пробы крови для проведения общего и биохимического анализа. В последний день животных подвергают эвтаназии и некропсии с забором органов для последующего гистологического анализа. Гибели подопытных животных на протяжении всего исследования не отмечено, показатели крови находились в норме. При патологоморфологическом исследовании лабораторных животных, не было обнаружено каких-либо значимых патологических изменений. В результате проведенных исследований доказано, что предлагаемое жидкое лекарственное средство является нетоксичным, апирогенным, не оказывает негативного влияния на системы и органы лабораторных животных, не обладает реактогенностью, и, таким образом, соответствуют требованиям 4 класса опасности "вещества малоопасные" (ГОСТ 12.1.007-76 "Вредные вещества"). Пример 4. Определение специфической противовирусной активности лекарственного средства ПЭГ-ИНФ -2b Противовирусную активность определяют микрометодом в 96-луночных планшетах с плоским дном по подавлению цитопатического действия тест-вируса везикулярного стоматита в диплоидной культуре клеток MDBK, чувствительных к интерферону-альфа. Для этого используют тест-вирус в дозе 100 ЦПД 50 и питательную среду Игла MEM с добавлением 10% сыворотки КРС. В качестве стандарта применяют международный стандарт ИНФ -2b. Перед началом исследований три образца, не подвергшиеся инкубации, объединяют и исследуют их специфическую противовирусную активность, которую принимают за 100%. Аналогично исследуют объединнные образцы из каждой группы, отобранные в соответствующие моменты времени. Все результаты исследований выражают в процентах от показателей соответствующего неинкубированного раствора. Пример 5. Исследование уровня бактериальных эндотоксинов в лекарственном средстве ПЭГ-ИНФ-2b. Содержание бактериальных эндотоксинов в лекарственном средстве ПЭГ-ИНФ -2b определяют invitro с помощью ЛАЛ-теста по стандартной методике (ГФХII, ч. 1, с. 128). В работе используют набор фирмы "Lonza", США. ЛАЛ-реактив PYROGENT с чувствительностью 0,03 ЕС/мл (номер в каталоге: 0000184452) и контрольный стандарт эндотоксина (номер в каталоге: 0000167426). Активность КСЭ 10 ЕЭ/нг. ЛАЛ-вода (номер в каталоге: 01022012). Показано, что содержание эндотоксинов в лекарственном средстве ПЭГ-ИНФ -2b составляет менее 2,5 ед. эндотоксина на 1 мг белка, что гораздо ниже уровня эндотоксинов, разрешенного Европейской Фармакопеей для рекомбинантных белков. Пример 6. Определение основных фармакокинетических параметров лекарственных средств на основе линейного и разветвленного ПЭГ-ИНФ -2b Нелинейных белых мышей (самцы) разделяют на две группы по количеству исследуемых препаратов. Исследуемые лекарственные средства, содержащие линейный или разветвленный конъюгат, вводят внутрибрюшинно в дозе 1 млн ME. Через каждые 6 у животных отбирают пробы крови и стандартным методом готовят из не сыворотку. Содержание ИНФ- в образцах сыворотки (нг/мл) определяют с помощью иммуно-ферментного аналитического набора (ИФА-набора) Human IFN- ELISA Kit (номер в каталоге: СК 2003-1). Из полученных данных с применением компьютерной программы Borgia 1.03 рас-6 021610 считывают фармакокинетические параметры. Результаты представлены в табл. 3. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Жидкое противовирусное лекарственное средство, содержащее в качестве активного вещества ковалентный конъюгат интерферона-альфа (ИНФ-) с полиэтиленгликолем (ПЭГ), буфер, стабилизатор и фармацевтически приемлемый растворитель, отличающееся тем, что в качестве ковалентного конъюгата содержит линейный монопегилированный ИНФ- общей формулы (I) где a - целое число от 100 до 1800,b - целое число от 1 до 9 и ИНФ обозначает остаток интерферона- с молекулярной массой от 5 до 80 кДа,или разветвлнный монопегилированный ИНФ- общей формулы (II) где n - целое число от 200 до 950,q - целое число в интервале от 1 до 5,m - целое число в интервале от 1 до 5 и ИНФ обозначает остаток интерферона-; в качестве стабилизатора содержит смесь сорбита, полисорбата 20 и L-глутамата натрия, в качестве буфера содержит цитратно-фосфатный буфер, а в качестве фармацевтически приемлемого растворителя содержит воду при следующем соотношении компонентов, г/100 мл: ковалентный конъюгат 0,005-0,1; стабилизатор: сорбит 1,0-10,0; полисорбат 20 0,001-0,1;L-глутамат натрия 0,1-1,0; цитратно-фосфатный буфер 0,85-0,95; вода остальное. 2. Лекарственное средство по п.1, отличающееся тем, что содержит указанные компоненты в следующем соотношении, г/100 мл: ковалентный конъюгат 0,03; стабилизатор 2,0; сорбит полисорбат 20 0,01;
МПК / Метки
МПК: A61P 35/00, A61K 38/21, A61P 31/12, C07K 14/715, A61P 37/00, A61K 47/48
Метки: лекарственное, противовирусное, жидкое, средство
Код ссылки
<a href="https://eas.patents.su/8-21610-zhidkoe-protivovirusnoe-lekarstvennoe-sredstvo.html" rel="bookmark" title="База патентов Евразийского Союза">Жидкое противовирусное лекарственное средство</a>
Предыдущий патент: Композиции для ухода за кожей, содержащие замещенные моноамины
Следующий патент: Катализатор ионно-жидкостного состава для получения поли-альфа-олефиновых синтетических базовых смазочных масел
Случайный патент: Музыкальный инструмент, содержащий громкоговоритель












