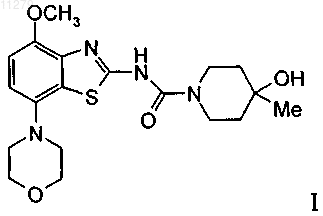
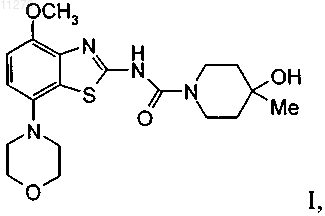
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-амид 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты
Номер патента: 11279
Опубликовано: 27.02.2009
Авторы: Поли Сония Мария, Ример Клаус, Флор Александер, Моро Жан-Люк, Стьюард Лусинда
Формула / Реферат
1. Соединение формулы
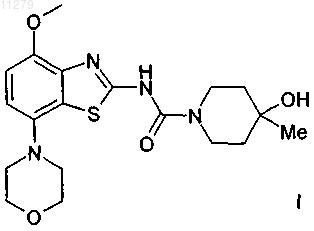
которое представляет собой (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты, и его фармацевтически приемлемые соли с кислотами.
2. Лекарственное средство, предназначенное для лечения или предупреждения заболеваний, связанных с аденозиновыми рецепторами, содержащее соединение по п.1 и фармацевтически приемлемые инертные наполнители.
3. Лекарственное средство по п.2, предназначенное для лечения или предупреждения заболеваний, связанных с аденозиновым рецептором A2A.
4. Лекарственное средство по п.3, предназначенное для лечения или предупреждения болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, обеспечения нейрозащиты, шизофрении, тревоги, боли, нарушений дыхания, депрессии, СДВГ (синдром дефицита внимания с гиперактивностью), злоупотребления наркотиками: амфетаминами, кокаином, опиоидами, этанолом, никотином, каннабиоидами, или для лечения астмы, аллергических реакций, гипоксии, ишемии, припадка, токсикомании, или для применимения в качестве мышечных релаксантов, нейролептических, противоэпилептических, противосудорожных и кардиозащитных средств.
5. Лекарственное средство по п.4, предназначенное для лечения или предупреждения болезни Паркинсона, СДВГ (синдром дефицита внимания с гиперактивностью), депрессивных нарушений и наркомании.
6. Способ получения соединения формулы I по п.1, который включает
а) введение в реакцию соединения формулы
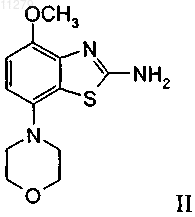
с соединением формулы
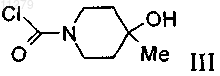
с образованием соединения формулы
или
b) введение в реакцию соединения формулы
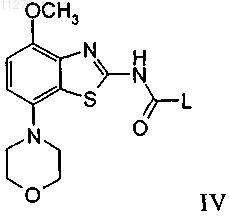
с соединением формулы
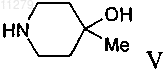
с образованием соединения формулы
где L обозначает отщепляющуюся группу, такую как галоген, -О-фенил, -О-нитрофенил или -О-низш. алкил, и
при необходимости превращение полученных соединений в фармацевтически приемлемые молекулярные соли с кислотами.
7. Соединение по п.1, полученное способом по п.6.
8. Применение соединения по п.1 для лечения или предупреждения заболеваний, связанных с аденозиновым рецептором A2A.
9. Применение соединения по п.1 для приготовления соответствующих лекарственных средств, предназначенных для лечения или предупреждения болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, обеспечения нейрозащиты, шизофрении, тревоги, боли, нарушений дыхания, депрессии, СДВГ (синдром дефицита внимания с гиперактивностью), злоупотребления наркотиками: амфетаминами, кокаином, опиоидами, этанолом, никотином, каннабиоидами, или для лечения астмы, аллергических реакций, гипоксии, ишемии, припадка, токсикомании, или для применимения в качестве мышечных релаксантов, нейролептических, противоэпилептических, противосудорожных и кардиозащитных средств.
10. Применение соединения по п.1 для приготовления соответствующих лекарственных средств, предназначенных для лечения болезни Паркинсона.
11. Применение соединения по п.1 для приготовления соответствующих лекарственных средств, предназначенных для лечения СДВГ (синдром дефицита внимания с гиперактивностью).
12. Применение соединения по п.1 для приготовления соответствующих лекарственных средств, предназначенных для лечения депрессии.
13. Применение соединения по п.1 для приготовления соответствующих лекарственных средств, предназначенных для лечения привыкания к наркотикам: амфетаминам, кокаину, опиоидам, этанолу, никотину и каннабиноидам.
Текст
011279 Настоящее изобретение относится к (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амиду 4 гидрокси-4-метилпиперидин-1-карбоновой кислоты, который является соединением формулы и к его фармацевтически приемлемым молекулярным солям с кислотами. Согласно изобретению неожиданно было установлено, что соединение формулы I является высокоаффинным, высокоселективным антагонистом аденозинового рецептора А 2 А, который при пероральном введении in vivo обладает активным и длительным антагонизмом к проявлению, вызванному агонистом аденозинового рецептора A2A. Это соединение в общем виде входит в объем WO 01/097786. Аденозин модулирует самые различные физиологические функции путем взаимодействия со специфическими рецепторами поверхности клетки. Обзор возможностей аденозиновых рецепторов, как мишеней для лекарственных препаратов, впервые были выполнен в 1982 г. Аденозин и структурно, и метаболически связан с биологически активными нуклеотидами аденозинтрифосфатом (АТФ), аденозиндифосфатом (АДФ), аденозинмонофосфатом (АМФ) и циклическим аденозинмонофосфатом(цАМФ); с биохимическим метилирующим агентом S-аденозил-L-метионином (SAM); и структурно - с коферментами НАД (никотинамидадениндинуклеотид), ФАД (флавинадениндинуклеотид) и коферментом А; и с РНК. Совместно аденозин и эти родственные соединения важны для регуляции многих аспектов клеточного метаболизма и модуляции различных типов активности центральной нервной системы. Рецепторы аденозина разделены на классы рецепторов А 1, A2A, A2B и А 3, относящихся к группе рецепторов, связывающих G-белок. Активация аденозиновых рецепторов аденозином инициирует механизмы трансдукции сигнала. Эти механизмы зависят от рецептора, связывающего G-белок. Каждый из подтипов аденозиновых рецепторов классически характеризовали с помощью аденозинциклазной эффекторной системы, в которой в качестве второго мессенджера используется цАМФ. Рецепторы A1 и А 3,связанные с белками Gi, ингибируют аденилатциклазу, что приводит к снижению концентраций цАМФ в клетках, тогда как рецепторы A2A и A2B связываются с белками Gs и активируют аденилатциклазу, что приводит к повышению концентраций цАМФ в клетках. Известно, что рецепторная система А 1 включает активацию фосфолипазы С и модуляцию и калиевых, и кальциевых ионных каналов. Подтип А 3 в дополнение к его ассоциации с аденилатциклазой также стимулирует фосфолипазу С и тем самым активирует кальциевые ионные каналы. Рецептор A1 (326-328 аминокислот) клонировали из различных видов (псовые, человек, крысы, собаки, куры, бычьи, морские свинки) и для видов млекопитающих идентифицировано 90-95% последовательности. Рецептор A2A (409-412 аминокислот) клонировали из псовых, крыс, человека, морских свинок и мышей. Рецептор A2B (332 аминокислот) клонировали из человека и мышей и он обнаруживает составляющую 45% гомологию с рецепторами человека A1 и А 2 А. Рецептор А 3 (317-320 аминокислот) клонировали из человека, крыс, собак, кроликов и овец. Предполагается, что подтипы рецепторов А 1 и A2A играют комплементарную роль в регуляции энергоснабжения аденозином. Аденозин, который является продуктом метаболизма АТФ, диффундирует из клетки и оказывает локальное воздействие по активации аденозиновых рецепторов с целью снижения потребности в кислороде (A1) или увеличения подачи кислорода (A2A) и тем самым восстанавливает баланс (поступление энергии):(потребность в энергии) в ткани. Воздействие обоих подтипов заключается в увеличении количества доступного для ткани кислорода и в защите клеток от повреждения, вызванного кратковременным нарушением баланса кислорода. Одной из важных функций эндогенного аденозина является предотвращение поражения при повреждениях, таких как гипоксия, ишемия, гипотензия и припадок. Кроме того, известно, что связывание агониста аденозинового рецептора с мастоцитами, экспрессирующими рецептор крыс А 3, приводит к повышению концентрации инозиттрифосфата и внутриклеточной концентрации кальция, что активирует вызванную антигеном секрецию медиаторов воспаления. Поэтому рецептор А 3 играет роль в опосредовании приступов астмы и других аллергических реакций. Аденозин является нейротрансмиттером, способным модулировать многие аспекты физиологической функции мозга. Содержание эндогенного аденозина, обеспечивающего основную взаимосвязь между метаболизмом энергии и неврональной активностью, меняется в соответствии с характером поведения и (пато)физиологическими условиями. При условиях повышенной потребности в энергии и уменьшении ее доступности (как при гипоксии, гипогликемии и/или чрезмерной неврональной активности) аденозин обеспечивает мощный защитный механизм обратной связи. Взаимодействие с аденозиновыми рецепторами является перспективной возможностью терапевтического воздействия при целом ряде неврологических и психических заболеваний, таких как эпилепсия, нарушения сна, нарушение движений (болезнь-1 011279 Паркинсона или Гентингтона), болезнь Альцгеймера, депрессия, шизофрения или наркомания. Усиление выработки нейротрансмиттера происходит после травм, таких как гипоксия, ишемия и припадки. Эти нейротрансмиттеры в конечном счете ответственны за дегенерацию нервной системы и гибель нервов,что вызывает поражение головного мозга или смерть индивидуума. Агонисты аденозинового рецептора А 1 имитируют эффекты ингибирования центральной нервной системы аденозином и поэтому могут применяться в качестве нейрозащитных средств. Аденозин был предложен в качестве эндогенного противосудорожного средства, ингибирующего выделение глутамата из возбужденных нейронов и ингибирующего импульсы нейронов. Поэтому агонисты аденозина можно применять в качестве противоэпилептических средств. Кроме того, показано, что антагонисты аденозина эффективны в качестве средств, усиливающих познавательную способность. Селективные антагонисты А 2 а обладают перспективой терапевтического применения при лечении различных форм слабоумия, например при болезни Альцгеймера, и нейродегенеративных нарушений, например удара. Антагонисты аденозинового рецептора А 2 а модулируют активность стриарных ГАМКэргических нейронов (ГАМК - гамма-аминомасляная кислота) и регулируют плавные и хорошо скоординированные движения и поэтому обладают перспективой терапевтического применения при лечении симптомов паркинсонизма. Аденозин также вовлечен в целый ряд физиологических процессов, участвующих в успокоении, гипнозе, шизофрении, тревоге, боли, дыхании,депрессии и наркотической зависимости (прием амфетамина, кокаина, опиоидов, этанола, никотина,каннабиноидов). Поэтому лекарственные средства, воздействующие на аденозиновые рецепторы, обладают перспективой применения в качестве успокоительных средств, мышечных релаксантов, нейролептических, анксиолитических, анальгетических средств, стимуляторов дыхания, антидепрессантов, и для лечения наркомании. Их также можно использовать при лечении СДВГ (синдром дефицита внимания с гиперактивностью). Важной ролью аденозина в сердечно-сосудистой системе является его кардиозащитное воздействие. Концентрации эндогенного аденозина увеличиваются в ответ на ишемию и гипоксию и он защищает сердечную ткань во время и после повреждения (предварительная адаптация). Путем воздействия на рецептор A1 агонисты аденозина A1 могут защищать от поражения, вызванного ишемией миокарда и реперфузией. Модулирующее воздействия рецепторов на адренергическую функцию может влиять на различные нарушения, такие как заболевание коронарной артерии и сердечная недостаточность. Антагонисты A2A могут быть полезны для лечения в случаях, когда желательна усиленная антиадренергическая реакция, например, при острой ишемии миокарда. Селективные антагонисты рецепторов А 2 а также могут повышать эффективность аденозина при подавлении наджелудочковой аритмии. Аденозин модулирует многие характеристики функции почек, включая выделение ренина, скорость клубочковой фильтрации и почечный кровоток. Соединения, которые оказывают антагонистическое влияние на воздействие аденозина, являются перспективными в качестве защищающих почки средств. Кроме того, антагонисты аденозиновых рецепторов А 3 и/или A2B могут оказаться применимыми для лечения астмы и других аллергических реакций и/или для лечения сахарного диабета и ожирения. Имеющаяся в настоящее время информация об аденозиновых рецепторах представлена в многочисленных документах, например, в следующих публикациях: BioorganicMedicinal Chemistry, 6, (1998),619-641, BioorganicMedicinal Chemistry, 6, (1998), 707-719, J. Med. Chem., (1998), 41, 2835-2845, J.Med. Chem., (1998), 41, 3186-3201, J. Med. Chem., (1998), 41, 2126-2133, J. Med. Chem., (1999), 42, 706721, J. Med. Chem., (1996), 39, 1164-1171, Arch. Pharm. Med. Chem., 332, 39-41, (1999), Am. J. Physiol, 276,H1113-1116, (1999) и Naimyn Schmied, Arch. Pharmacol. 362, 375-381, (2000). Объектами настоящего изобретения являются соединение формулы I само по себе, применение этого соединения и его фармацевтически приемлемых солей для приготовления лекарственных средств,предназначенных для лечения заболеваний, связанных с аденозиновым рецептором А 2, их получение,лекарственные средства, основанные на соединении, предлагаемом в настоящем изобретении, и их приготовление, а также применение соединения формулы I при лечении или предупреждении заболеваний,обусловленных модуляцией аденозиновой системы, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, для нейрозащитного воздействия, шизофрения, тревога, боль, нарушения дыхания, депрессия, злоупотребление наркотиками, такими как амфетамин, кокаин, опиоиды, этанол, никотин, каннабиоиды, или астма, аллергические реакции, гипоксия, ишемия, припадки и токсикомания. Кроме того, соединения, предлагаемые в настоящем изобретении, могут быть применимы в качестве успокоительных средств, мышечных релаксантов, нейролептических, противоэпилептических, противосудорожных и кардиозащитных средств при таких нарушениях, как заболевание коронарной артерии и сердечная недостаточность. В контексте настоящего изобретения наиболее предпочтительными показаниями являются такие, которые основаны на антагонистической активности по отношению к рецепторуA2A и которые включают заболевания центральной нервной системы, например, лечение или предупреждение болезни Альцгеймера, депрессивных нарушений, злоупотребления наркотиками, обеспечение нейрозащитного воздействия и лечение болезни Паркинсона, а также СДВГ. При использовании в настоящем изобретении термин "низш. алкил" обозначает насыщенную алкильную группу с линейной или разветвленной цепью, содержащую от 1 до 6 атомов углерода, например метильную, этильную, пропильную, изопропильную, н-бутильную, изобутильную, 2-бутильную, трет-2 011279 бутильную и т.п. Предпочтительными низш. алкильными группами являются группы, содержащие 1-4 атома углерода. Термин "галоген" обозначает хлор, йод, фтор и бром. Термин "фармацевтически приемлемые молекулярные соли с кислотами" включает соли с неорганическими и органическими кислотами, такими как хлористо-водородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, виннокаменная кислота, метансульфоновая кислота, птолуолсульфоновая кислота и т. п. Предлагаемое в настоящем изобретении соединение формулы I и его фармацевтически приемлемые соли можно получить по методикам, известным в данной области техники, например, способами, описанными ниже, и эти способы включают а) введение в реакцию соединения формулы где L обозначает отщепляющуюся группу, такую как галоген, -О-фенил, -О-нитрофенил или -Онизш. алкил, и при необходимости превращение полученных соединений в фармацевтически приемлемые молекулярные соли с кислотами. Соединения формулы I можно получить по вариантам а) и b) способа. Кроме того, в примерах 1-7 и на приведенных ниже схемах 1, 2 и 3 получение соединения формулыI описано более подробно. Исходные вещества являются известными соединениями или их можно получить по методикам, известным в данной области техники. Получение соединений формулы I Одним способом получения соединения формулы (I) в соответствии с приведенной ниже схемой 1 является следующий: к раствору промежуточного 7-(морфолин-4-ил)-4-метоксибензотиазол-2-иламина(II), который можно получить по схеме 3, в дихлорметане последовательно прибавляют основание, например пиридин или диизопропилэтиламин, и соединение формулы (III) и полученный раствор переме-3 011279 шивают в течение примерно 45 мин при температуре окружающей среды. Прибавляют насыщенный водный раствор бикарбоната натрия, органическую фазу отделяют и сушат. Схема 1 Другим способом получения соединения формулы (I) является следующий: к раствору соединения формулы (IV), которое можно получить по методикам, известным в данной области техники, и которые описаны в WO 01/97786, в инертном растворителе, например дихлорметане, последовательно прибавляют основание, например пиридин или диизопропилэтиламин и соединение формулы (V), и полученный раствор перемешивают в течение примерно 45 мин при 45 С. После охлаждения до температуры окружающей среды прибавляют насыщенный водный раствор бикарбоната натрия, органическую фазу отделяют и сушат. Схема 2d обозначает метанольный раствор метанолята натрия; е обозначает бром в трихлорметане. Выделение и очистка соединений Выделение и очистку соединений и промежуточных продуктов, описанных в настоящем изобретении, при желании можно выполнить по любой методике выделения или очистки, такой как, например,фильтрование, экстракция, кристаллизация, хроматография на колонке, тонкослойная хроматография,толстослойная хроматография, препаративная жидкостная хроматография при низком или высоком давлении или с помощью комбинации этих методик. Конкретные иллюстрации подходящих методик выделения и очистки приведены в представленных ниже описаниях синтезов и примерах. Однако разумеется,можно использовать и другие эквивалентные методики разделения или выделения. Соли соединений формулы I Превращение в соответствующую молекулярную соль с кислотой осуществляется путем обработки,по меньшей мере, стехиометрическим количеством подходящей кислоты, такой как хлористоводородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п. или органической кислоты, такой как уксусная кислота, пропионовая кислота, гликолевая кислота,пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота,малеиновая кислота, фумаровая кислота, виннокаменная кислота, лимонная кислота, бензойная кислота,коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, птолуолсульфоновая кислота, салициловая кислота и т.п. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или-4 011279 метанол и т.п., и прибавляют кислоту в аналогичном растворителе. Температуру поддерживают равной от 0 до 50 С. Полученная соль осаждается самопроизвольно или ее можно выделить из раствора с помощью менее полярного растворителя. Молекулярные соли с кислотами основных соединений формулы I можно превратить в соответствующие свободные основания путем обработки, по меньшей мере, стехиометрическим количеством подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммония и т. п. Соединения формулы I и их фармацевтически приемлемые молекулярные соли с кислотами обладают ценными фармакологическими характеристиками. Точнее, обнаружено, что соединения, предлагаемые в настоящем изобретении, являются лигандами аденозинового рецептора и обладают высоким сродством по отношению к аденозиновому рецептору A2A. Эти соединения исследованы в соответствии с представленными ниже методиками. Описание исследования Сродство (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амида 4-гидрокси-4-метилпиперидин-1 карбоновой кислоты к рецептору А 2 А исследовали с помощью рецептора A2A человека, рекомбинантно экспрессированного в клетки яичника китайского хомячка (ЯКХ) с использованием системы экспрессии вируса лихорадки леса Семлики. Клетки собирали, дважды промывали с помощью центрифугирования,гомогенизировали и повторно промывали с помощью центрифугирования. Конечную промытую таблетку мембран суспендировали в буфере Tris (50 мМ), содержащем 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 10 мМ MgCl2 (pH 7,4) (буфер А). Анализ связывания 3 Н SCH-58261 (Dionisotti et al., 1997, Br J Pharmacol 121, 353; 1 нМ) проводили в 96-луночных планшетах в присутствии 2,5 мкг мембранного белка, 0,5 мг гранул Ysi-поли-1-лизин ПАН (полиакрилонитрилат натрия) и 0,1 ЕД аденозиндезаминазы при конечном объеме буфера, равном 200 мкл. Неспецифическое связывание определяли с использованием соединения группы ксантинамина (СГК; 2 мкМ). Соединения исследовали при 10 концентрациях в диапазоне 10 мкМ- 0,3 нМ. Все исследования проводили дважды и повторяли не менее двух раз. Перед центрифугированием планшеты для анализа инкубировали в течение 1 ч при комнатной температуре и затем количество связанного лиганда определяли с помощью сцинтилляционного счетчика Packard Topcount. Значения IC50 рассчитывали с помощью программы нелинейной аппроксимации кривой и значения Ki рассчитывали с помощью уравнения Ченга-Пруссова. Результаты исследований Обнаружено, что (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты является высокоаффинным, активным и селективным антагонистом рекомбинантных аденозиновых рецепторов A2A человека. Он обладает сродством (pKi) к рецептору A2A человека,равным 8,3, и селективностью по отношению к рецептору A2A, которая на 2 порядка больше селективности по отношению к рецепторам А 1, A2B и A3. В других исследованиях оценена селективность 4-(4 метокси-7-морфолин-4-илбензотиазол-2-ил)-амида гидрокси-4-метилпиперидин-1-карбоновой кислоты по отношению к различным переносчикам нейтрорансмиттеров, ионным каналам и мишеням ферментов.(4-Метокси-7-морфолин-4-илбензотиазол-2-ил)-амид 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты обладает по отношению к рецептору A2A селективностью, которая более чем в 1000 раз превышает селективность по отношению к выбранным мишеням. Активность in vitro определяли путем изучения способности соединения оказывать антагонистическое воздействие на стимулированный посредством NECA (неспецифический агонист аденозинового рецептора) поток Са 2+ в клетках ЯКХ, экспрессирующих рецепторы A2A человека, связанные с G-белкомG16. (4-Метокси-7-морфолин-4-илбензотиазол-2-ил)-амидом 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты ингибирует опосредуемые A2A реакции при значении pIC50, равном 8,83 (наклон Хилла равен 0,6). (4-Метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты оказывает антагонистическое воздействие на стимулированный посредством NECA поток Са 2+ в клетках ЯКХ, экспрессирующих рецепторы A1 человека, связанные с G-белком G16 при значении pIC50, равном 5,22 (наклон Хилла равен 0,7). Таким образом, при этом функциональном исследовании (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты обнаруживает по отношению к рецептору A2A человека селективность, которая 4000 превышает селективность по отношению к рецептору A1 человека. Обнаружено, что in vivo (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты является активным, длительно действующим, активным при пероральном введении антагонистом. Он оказывает антагонистическое воздействие на гиполокомоцию, вызванную у крыс с помощью подкожных инъекций 0,01 мг/кг АРЕС, агониста аденозинового рецептораA2A. Рассчитанная доза этого соединения, приводящая после перорального введения к ингибированию на 50% вызванной АРЕС гиполокомоции, равна 0,5 мг/кг. Для обеспечения полного антагонистического воздействия на эту вызванную АРЕС гиполокомоцию необходима концентрация в плазме, равная 290 нг/мл. Это антагонистическое воздействие продолжается в течение нескольких часов и в этой модели характеризуется функциональным временем уменьшения вдвое, равным примерно 8 ч.-5 011279 Фармакокинетические параметры определены для крыс и собак. Для крыс после внутривенного введения период полувыведения соединения равнялся 4 ч, клиренс равнялся 11 мл/мин/кг, объем распределения составлял 1,4 л/кг; пероральная биологическая доступность после введения крысам 5 мг/кг составляла 77 %. Для собак после внутривенного введения период полувыведения соединения равнялся 2,2 ч, клиренс равнялся 8 мл/мин/кг, объем распределения составлял 1,2 л/кг; пероральная биологическая доступность после введения 5 мг/кг составляла 88%. В заключение можно отметить, что установлено, что (4-метокси-7-морфолин-4-илбензотиазол-2 ил)амид 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты является высокоаффинным, высокоселективным антагонистом аденозинового рецептора A2A, который при пероральном приеме in vivo обладает активным и длительным антагонизмом к проявлению, вызванному агонистом аденозинового рецептораA2A. Соединения формулы I и фармацевтически приемлемые соли соединений формулы I, можно применять в качестве лекарственных средств, например, в виде фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например, в виде таблеток, таблеток с покрытием, драже,капсул из твердого и мягкого желатина, растворов, эмульсий или суспензий. Однако введение можно выполнять ректально, например, в виде суппозиториев, парентерально, например, в виде растворов для инъекций. Соединения формулы I можно обработать с помощью фармацевтически инертных неорганических или органических носителей, предназначенных для изготовления фармацевтических препаратов. Лактозу, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и т.п. Можно использовать, например, в качестве таких носителей для таблеток, таблеток с покрытием, драже и капсул из твердого желатина. Для капсул из мягкого желатина подходящими носителями являются, например,растительные масла, воска, жиры, полужидкие и жидкие полиолы и т.п. Однако в зависимости от природы активного вещества в случае капсул из мягкого желатина носитель обычно не требуется. Носителями,подходящими для приготовления растворов и сиропов, являются, например, вода, полиолы, глицерин,растительное масло и т. п. Носителями, подходящими для суппозиториев, являются, например, натуральные или отвержденные масла, воска, жиры, полужидкие и жидкие полиолы и т. п. Фармацевтические препараты также могут дополнительно содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать и другие терапевтически полезные вещества. Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектом настоящего изобретения, как и способ их получения, который включает внесение одного или большего количества соединений формулыI и/или фармацевтически приемлемых молекулярных солей с кислотами и, при необходимости, одного или большего количества других терапевтически полезных веществ, в галенову лекарственную форму совместно с одним или большим количеством инертных носителей. В контексте настоящего изобретения соединение формулы I, а также его фармацевтически приемлемые соли применимы для лечения или предупреждения заболеваний, связанных с антагонистической активностью аденозинового рецептора А 2 А, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, для обеспечения нейрозащитного воздействия, шизофрении, тревоги, боли, нарушений дыхания, депрессии, СДВГ (синдром дефицита внимания с гиперактивностью), злоупотребления наркотиками, такими как амфетамины, кокаин, опиоиды, этанол, никотин, каннабиоиды, или для лечения астмы,аллергических реакций, гипоксии, ишемии, припадка, токсикомании или применимы в качестве мышечных релаксантов, нейролептических, противоэпилептических, противосудорожных и кардиозащитных средств. Наиболее предпочтительными показаниями в контексте настоящего изобретения являются такие,которые включают нарушения центральной нервной системы, например лечение или предупреждение болезни Паркинсона, СДВГ, депрессивных нарушений и наркомании. Дозировка может меняться в широких пределах и, разумеется, в каждом конкретном случае будет меняться в соответствии с индивидуальными потребностями. В случае перорального введения доза для взрослых может меняться от примерно 0,01 до примерно 1000 мг в сутки соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточная доза может вводиться в виде разовой дозы или разделенных доз и, кроме того, при наличии показания верхнее предельное значение может быть превышено. Приведенные ниже методики синтеза и примеры иллюстрируют настоящее изобретение, но не налагают ограничения на его объем. Пример 1. (4-Метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-гидрокси-4-метилпиперидин-1 карбоновой кислоты (I). К раствору фенилового эфира (4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты-6 011279 смесь кипятили с обратным холодильником в течение 1 ч. Затем реакционную смесь охлаждали до температуры окружающей среды и экстрагировали насыщенным водным раствором карбоната натрия (15 мл) и водой (25 мл). Заключительная сушка над сульфатом магния и выпаривание растворителя и перекристаллизация из этанола давали искомое соединение в виде белых кристаллов (выход 78%), т. пл.(56 мл) и пиридине (56 мл, 700 ммоль) при 0-5 С прибавляли фенилхлорформиат (15,7 мл, 125 ммоль) и реакционную смесь нагревали до температуры окружающей среды. Через 1 ч прибавляли воду (7,2 мл,400 ммоль) и реакционную смесь нагревали в течение 1 ч при 45 С. Затем прибавляли этилацетат (250 мл) и 2 М HCL (125 мл) и органическую фазу отделяли. После удаления растворителя и перекристаллизации из трет-бутилметилового эфира и в заключение из этанола искомое соединение получали в виде белого твердого вещества (выход 80 %), т. пл. 166-168 С. МС: m/e= 386(М+Н+). Пример 3. 4-Метокси-7-морфолин-4-илбензотиазол-2-иламин (II).(2-Метокси-5-морфолин-4-илфенил)тиомочевину (5,0 г, 19 ммоль) в хлороформе (130 мл) обрабатывали бромом (960 мкл) и смесь кипятили с обратным холодильником в течение 18 ч. После удаления летучих компонентов в вакууме продукт перекристаллизовывали из тетрагидрофурана (2,8 г, 57 %). МС:m/e= 266 (М+). Пример 4. (2-Метокси-5-морфолин-4-илфенил)тиомочевина. 1-Безоил-3-(2-метокси-5-морфолин-4-илфенил)тиомочевину (8,0 г, 21 ммоль), суспендированную в метаноле (260 мл), обрабатывали с помощью 6 мл метанолята натрия (5,4 М в метаноле) и смесь перемешивали до образования белого осадка. Смесь концентрировали в вакууме, кристаллы отделяли фильтрованием и промывали метанолом и гексаном (5,0 г, 86 %). МС: т/е= 268 (М+). Пример 5. 1-Бензоил-3-(2-метокси-5-морфолин-4-илфенил)тиомочевина. К раствору 2-метокси-5-морфолин-4-илфениламина (4,6 г, 22 ммоль) в ацетоне (140 мл) прибавляли раствор бензоилизотиоцианата (3,4 мл, 25 ммоль) в ацетоне (80 мл) и реакционную смесь перемешивали в течение еще 30 мин при при температуре окружающей среды. После удаления летучих компонентов в вакууме продукт выделяли с помощью флэш-хроматографии (диоксид кремния, элюент - смесь этилацетат/н-гексан 1:4, затем 1:2) в виде желтого твердого вещества (8,0 г, 97 %). МС: m/e= 272 (М+). Пример 6. 2-Метокси-5-морфолин-4-илфениламин. 4-(4-Метокси-3-нитрофенил)-морфолин (6 г) гидрировали в дихлорметане (100 мл) и метаноле (600 мл) в течение 12 ч с использованием палладия на угле (10 %, 600 мг). Катализатор удаляли фильтрованием и раствор выпаривали в вакууме. Очистка с помощью флэш-хроматографии (диоксид кремния, элюент - смесь этилацетат/н-гексан 1:1) давала продукт в виде почти белого твердого вещества (4,6 г, 88 %). МС: m/е= 209 (М+Н+). Пример 7. 4-(4-Метокси-3-нитрофенил)морфолин. 4-Бром-2-нитроанизол (8,5 г, 36 ммоль), морфолин (3,8 мл, 44 ммоль), фосфат калия (11 г, 51 ммоль), 2-бифенилдициклогексилфосфин (960 мг, 2,7 ммоль) и ацетат палладия(II) (411 мг, 1,8 ммоль) растворяли в диметоксиэтане (80 мл) и перемешивали при 80 С в течение 96 ч. Затем смесь охлаждали до комнатной температуры, разбавляли этилацетатом (50 мл) и фильтровали через дикалит. Флэшхроматография на диоксиде кремния (элюент - смесь дихлорметан/метанол 99:1) давала продукт в виде красного твердого вещества (6,0 г, 69 %). МС: m/е= 238 (М+). Композиция для таблетки (мокрое гранулирование) Методика изготовления 1. Перемешать компоненты 1, 2, 3 и 4 и гранулировать с использованием очищенной воды. 2. Высушить гранулы при 50 С. 3. Обработать гранулы на подходящем размалывающем оборудовании. 4. Прибавить компонент 5 и перемешивать в течение 3 мин; спрессовать с помощью подходящего пресса. которое представляет собой (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-гидрокси-4 метилпиперидин-1-карбоновой кислоты, и его фармацевтически приемлемые соли с кислотами. 2. Лекарственное средство, предназначенное для лечения или предупреждения заболеваний, связанных с аденозиновыми рецепторами, содержащее соединение по п.1 и фармацевтически приемлемые инертные наполнители. 3. Лекарственное средство по п.2, предназначенное для лечения или предупреждения заболеваний,связанных с аденозиновым рецептором A2A. 4. Лекарственное средство по п.3, предназначенное для лечения или предупреждения болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, обеспечения нейрозащиты, шизофрении, тревоги, боли, нарушений дыхания, депрессии, СДВГ (синдром дефицита внимания с гиперактивностью),злоупотребления наркотиками: амфетаминами, кокаином, опиоидами, этанолом, никотином, каннабиоидами, или для лечения астмы, аллергических реакций, гипоксии, ишемии, припадка, токсикомании, или для применимения в качестве мышечных релаксантов, нейролептических, противоэпилептических, противосудорожных и кардиозащитных средств. 5. Лекарственное средство по п.4, предназначенное для лечения или предупреждения болезни Паркинсона, СДВГ (синдром дефицита внимания с гиперактивностью), депрессивных нарушений и наркомании. 6. Способ получения соединения формулы I по п.1, который включает а) введение в реакцию соединения формулы где L обозначает отщепляющуюся группу, такую как галоген, -О-фенил, -О-нитрофенил или -Онизш. алкил, и при необходимости превращение полученных соединений в фармацевтически приемлемые молекулярные соли с кислотами. 7. Соединение по п.1, полученное способом по п.6. 8. Применение соединения по п.1 для лечения или предупреждения заболеваний, связанных с аденозиновым рецептором A2A. 9. Применение соединения по п.1 для приготовления соответствующих лекарственных средств,предназначенных для лечения или предупреждения болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, обеспечения нейрозащиты, шизофрении, тревоги, боли, нарушений дыхания, депрессии,СДВГ (синдром дефицита внимания с гиперактивностью), злоупотребления наркотиками: амфетаминами, кокаином, опиоидами, этанолом, никотином, каннабиоидами, или для лечения астмы, аллергических реакций, гипоксии, ишемии, припадка, токсикомании, или для применимения в качестве мышечных релаксантов, нейролептических, противоэпилептических, противосудорожных и кардиозащитных средств. 10. Применение соединения по п.1 для приготовления соответствующих лекарственных средств,предназначенных для лечения болезни Паркинсона. 11. Применение соединения по п.1 для приготовления соответствующих лекарственных средств,предназначенных для лечения СДВГ (синдром дефицита внимания с гиперактивностью). 12. Применение соединения по п.1 для приготовления соответствующих лекарственных средств,предназначенных для лечения депрессии. 13. Применение соединения по п.1 для приготовления соответствующих лекарственных средств,предназначенных для лечения привыкания к наркотикам: амфетаминам, кокаину, опиоидам, этанолу,никотину и каннабиноидам.
МПК / Метки
МПК: A61K 31/454, C07D 417/12, A61P 25/28, A61P 25/36
Метки: 4-метокси-7-морфолин-4-илбензотиазол-2-ил)-амид, кислоты, 4-гидрокси-4-метилпиперидин-1-карбоновой
Код ссылки
<a href="https://eas.patents.su/10-11279-4-metoksi-7-morfolin-4-ilbenzotiazol-2-il-amid-4-gidroksi-4-metilpiperidin-1-karbonovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-амид 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты</a>
Предыдущий патент: Применение ротиготина для лечения и предупреждения синдрома “паркинсонизм – плюс”
Следующий патент: Пиперазиновые производные алкилоксиндолов
Случайный патент: Дерматологическая антисептическая композиция и способ ее получения












