Пиперазиновые производные алкилоксиндолов
Номер патента: 11280
Опубликовано: 27.02.2009
Авторы: Леваи Дьёрдь, Гиглер Габор, Шимиг Дьюла, Сираи Нора, Паллаги Каталин, Баркоци Йожеф, Эдьед Андраш, Харсинг Ласло Габор, Каппилерне Дежёфи Рита, Мезеи Тибор, Сенаши Габор, Гачальи Иштван, Мориц Кристина, Вольк Балаж, Левелеки Чилла
Формула / Реферат
1. Производные 3-алкилиндол-2-она общей формулы (I)
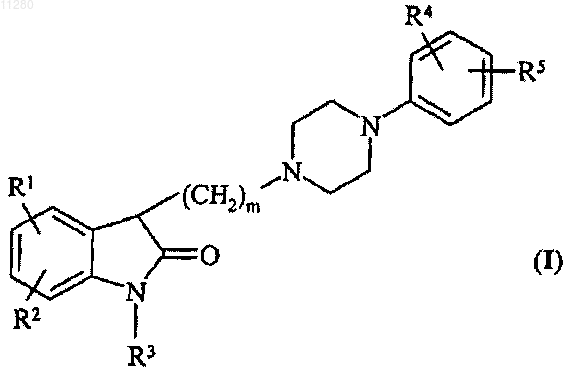
где
R1 и R2 независимо представляют собой водород, галоген, алкил, состоящий из 1-7 атомов углерода, алкокси, содержащий 1-7 атомов углерода, или трифторметил;
R3 представляет собой водород;
R4 и R5 независимо представляют собой водород, галоген, трифторметил или линейный или разветвленный алкил или алкокси, содержащий 1-7 атомов углерода,
m обозначает 1, 2, 3 или 4,
при условии, что, если m=2 и R4 представляет собой водород, то R5 не является водородом и хлором в положении 3 арильной группы, или, если m=4 и R4 представляет собой метокси в положении 2 арильной группы, то R5 не является водородом,
или их фармацевтически приемлемые соли присоединения кислоты.
2. Производные 3-алкилиндол-2-она общей формулы (I), где
R1 представляет собой водород, галоген или алкил, содержащий 1-7 атомов углерода;
R2 и R3 представляют собой водород;
R4 представляет собой водород или галоген;
R5 означает галоген;
m представляет собой 4,
и их фармацевтически приемлемые соли присоединения кислоты.
3. Производные 3-алкилиндол-2-она общей формулы (I), где R1 представляет собой водород или галоген;
R2, R3 и R4 означает водород;
R5 является галогеном;
m представляет собой 4,
и их фармацевтически приемлемые соли присоединения кислоты.
4. 3-{4-[4-(4-хлорфенил)пиперазин-1-ил]бутил}-6-фтор-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
5. 3-{4-[4-(4-фторфенил)пиперазин-1-ил]бутил}-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
6. 3-{4-[4-(4-хлорфенил)пиперазин-1-ил]бутил}-1,3-дигидро-2Н-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
7. 3-{4-[4-(3-хлорфенил)пиперазин-1-ил]бутил}-1,3-дигидро-2Н-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
8. 3-{4-[4-(3-хлорфенил)пиперазин-1-ил]бутил}-5-метил-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
9. 3-{4-[4-(4-хлорфенил)пиперазин-1-ил]бутил}-5-метил-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
10. 3-{4-[4-(4-хлор-3-трифторметилфенил)пиперазин-1-ил]бутил}-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
11. Фармацевтические композиции, содержащие в качестве активного компонента, по меньшей мере, соединение общей формулы (I) по любому из пп.1-10 или его фармацевтически приемлемую соль присоединения кислоты в смеси с одним или более обычно применяемым наполнителем или вспомогательным веществом.
12. Фармацевтические композиции по п.11, применяемые для лечения и профилактики нарушений центральной нервной системы, в частности, депрессии, тревожности, навязчивых состояний, панического расстройства, социальной фобии, шизофрении, расстройств настроения, мании, ухудшения умственных способностей, удара, гибели клеток в определенных участках центральной нервной системы, нейродегенерации с последующим ухудшением умственных способностей, болезни Альцгеймера, деменции, посттравматических заболеваний, стресса, нарушений сердечно-сосудистой системы, в частности, гипертензии.
13. Способ получения соединений общей формулы (I), раскрытых в п.1, который включает реакцию соединения общей формулы (II)
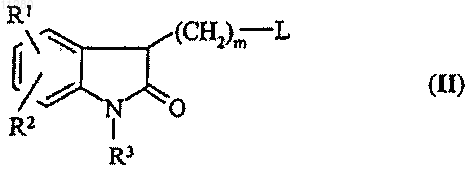
где L означает гидроксил, с арилсульфонилхлоридом или линейным или разветвленным алкилсульфонилхлоридом, содержащим 1-7 атомов углерода, в присутствии органического основания, и реакцию полученного таким способом соединения общей формулы (II), где L представляет собой арил- или алкилсульфонилоксигруппу, с производным пиридина общей формулы (III)
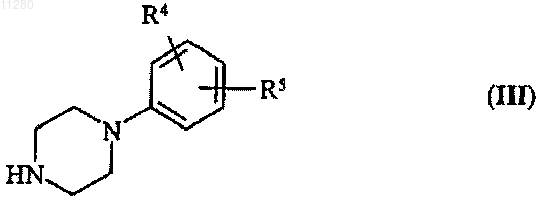
где R4, R5 и R6 и Q соответствуют названным выше, в присутствии связывающего кислоту агента.
14. Способ получения соединений общей формулы (I), раскрытых в п.1, который включает реакцию соединения общей формулы (V)
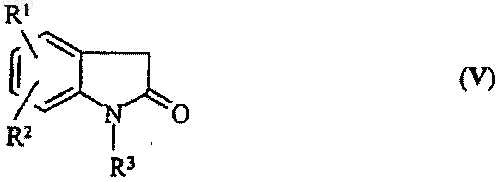
где R1, R2 и R3 соответствуют названным выше, с соединением общей формулы (VI)
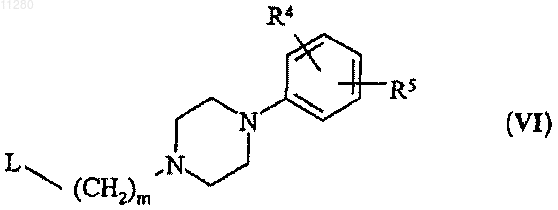
где R4, R5 и m соответствуют названным выше, a L является уходящей группой, в присутствии сильного основания.
15. Применение производных 3-алкилиндол-2-она общей формулы (I) по любому из пп.1-10 в качестве лекарства.
16. Способ получения фармацевтической композиции для лечения или профилактики нарушений центральной нервной системы, в частности, депрессии, тревожности, навязчивых состояний, панического расстройства, социальной фобии, шизофрении, расстройств настроения, мании, ухудшения умственных способностей, удара, гибели клеток в определенных участках центральной нервной системы, нейродегенерации с последующим ухудшением умственных способностей, болезни Альцгеймера, деменции, посттравматических заболеваний, стресса, нарушений сердечно-сосудистой системы, в частности, гипертензии, который включает смешивание по меньшей мере одного соединения общей формулы (I) по любому из пп.1-10 или его фармацевтически приемлемой соли присоединения кислоты с фармацевтическим носителем и, возможно, другим вспомогательным веществом и превращение смеси в галенову форму.
17. Применение соединений общей формулы (I) или их фармацевтически приемлемых солей присоединения кислоты для производства лекарств, пригодных для лечения или профилактики нарушений центральной нервной системы, в частности депрессии, тревожности, навязчивых состояний, панического расстройства, социальной фобии, шизофрении, расстройств настроения, мании, ухудшения умственных способностей, удара, гибели клеток в определенных участках центральной нервной системы, нейродегенерации с последующим ухудшением умственных способностей, болезни Альцгеймера, деменции, посттравматических заболеваний, стресса, нарушений сердечно-сосудистой системы, в частности гипертензии.
18. Способ лечения и профилактики нарушений центральной нервной системы, в частности депрессии, тревожности, навязчивых состояний, панического расстройства, социальной фобии, шизофрении, расстройств настроения, мании, ухудшения умственных способностей, удара, гибели клеток в определенных участках центральной нервной системы, нейродегенерации с последующим ухудшением умственных способностей, болезни Альцгеймера, деменции, посттравматических заболеваний, стресса, нарушений сердечно-сосудистой системы, в частности гипертензии, который включает введение пациенту, нуждающемуся в таком лечении, эффективной дозы фармацевтической композиции, содержащей по меньшей мере одно соединение общей формулы (I) или его фармацевтически приемлемую соль присоединения органической или неорганической кислоты.
Текст
011280 Область изобретения Изобретение относится к новым производным индол-2-она и их фармацевтически приемлемым солям присоединения кислоты, а также к способу получения указанных соединений. Изобретение также включает фармацевтические композиции, содержащие указанные новые производные индол-2-она и применение этих соединений для лечения заболеваний. Конкретнее, настоящее изобретение относится к производным индол-2-она общей формулы (I) где R1 и R2 независимо представляют собой водород, галоген, алкил, имеющий от 1 до 7 атомов углерода, алкокси, имеющий от 1 до 7 атомов углерода, или трифторметил;R4 и R5 независимо представляют собой водород, галоген, трифторметил или линейный или разветвленный алкил или алкокси, имеющий от 1 до 7 атомов углерода,m - это 1, 2, 3 или 4, при условии, что, если m=2 и R4 представляет собой водород, то R5 не является водородом и хлором в положении 3 арильной группы, или, если m=4 и R4 представляет собой метокси в положении 2 арильной группы, то R5 не является водородом,и их фармацевтически приемлемые соли присоединения кислоты. Предшествующий уровень техники Патент США 4452808 раскрывает избирательную D2-рецепторную активность производных 4 аминоалкил-индол-2-она. Эти соединения могут быть использованы для лечения гипертензии. Одно из соединений, описанных в этом патенте, применяется в терапии болезни Паркинсона. Европейский патент 281309 раскрывает, что производные индол-2-она, имеющие арилпиперазинил-алкильный заместитель в 5 положении, могут применяться для лечения психопатических состояний. Одно из соединений, описанных в этом патенте, а именно 5-[2-[4-(1,2-бензисотиазол-3-ил)-1 пиперазинил]этил]-6-хлор-1,3-дигидро-2 Н-индол-2-он, действует путем взаимодействия с D2, 5-HT1A и 5HT2 рецепторами и используется в клинической практике как антипсихопатическое лекарство. Европейский патент 376607 раскрывает, что производные индол-2-она, замещенные в 3-м положении алкилпиперазинил-арильной группой, которые проявляют свою активность через взаимодействие с 5-НТ 1A рецепторами, применяются для лечения болезней центральной нервной системы. В WO 98/008816 раскрываются производные индол-2-она, содержащие замещенные группы алкилпиперазинил, алкилпиперидинил или алкилциклогексил в 3-м положении. Эти соединения обладают психотропной активностью. В этом патенте ничего не говорится о механизме воздействия указанных соединений, а в качестве области применения указываются только депрессия и тревожность. Ускорение технико-социального развития в двадцатом веке вынуждает человека находиться в состоянии постоянной адаптации, что, при неблагоприятных обстоятельствах, может привести к адаптационным нарушениям. Нарушения адаптации создают угрозу развития заболеваний ментального и психосоматического происхождения, таких как анксиолитический синдром, стресс, депрессия, шизофрения,заболевания органов чувств, желудочно-кишечного тракта, сердечно-сосудистой системы и секреторных органов. Для лечения названых выше заболеваний очень широко применялись препараты, действующие на бензодиазепиновую систему (например, диазепам) или на центральные 5-НТ 1 А рецепторы (например,буспирон, ципразидон). При лечении психосоматических заболеваний анксиолитики часто сочетают с препаратами, обладающими антигипертензивным (действующими на 1 или 2 рецепторы) или противоязвенным действием (антагонисты H1-рецептора). Анксиолитики бензодиазепинового ряда вызывают, тем не менее, некоторые неблагоприятные побочные эффекты. Они обладают сильным седативным действием, снижают способность концентрации и ухудшают память, обладают расслабляющим мышцы эффектом. Имеющиеся в продаже активные вещества, обладающие анксиолитическим действием (буспирон, избирательный ингибитор обратного захвата серотонина, SSRI's) проявляют активность только спустя 10-14 дней после начала лечения. Кроме того, в начальном периоде введения лекарства, наблюдается анксиогенный эффект. Такие побочные эффекты негативно влияют на качество жизни пациентов, и это сужает область применения подобных лекарств. Помимо стресса, вызванного адаптацией к окружающей среде, серьезной проблемой современного общества является быстрое старение популяции. Благодаря успехам современной медицины средняя продолжительность жизни увеличилась, и скачкообразно возросло количество заболеваний, связанных со старением или развивающихся в преклонном возрасте, в частности, психических заболеваний. Лече-1 011280 ние болезни Альцгеймера, мультиинфарктной деменции, старческого слабоумия стало социальной проблемой. Перечисленные обстоятельства создают острую потребность в новых и эффективных препаратах,обеспечивающих более эффективное лечение подобных заболеваний, чем препараты, доступные в настоящее время. Краткое описание изобретения Целью настоящего изобретения является разработка фармацевтических соединений, обладающих большей эффективностью, чем те, что применяются в настоящее время, лишенных перечисленных выше недостатков и побочных эффектов и, в то же время, подходящих для лечения и профилактики заболеваний центральной нервной системы и сердечно-сосудистой системы. Изобретение основано на неожиданном открытии того, что производные индол-2-она общей формулы (I), в отличие от предшествующих соединений подобной структуры, хорошо связываются как с 5 НТ 7, так с 1 рецепторами и эффективно ингибируют синаптосомальный обратный захват серотонина. Таким образом, можно ожидать, что применять их можно будет для лечения заболеваний как центральной нервной системы, так и сердечно-сосудистой системы. Подробное описание изобретения В соответствии с целью настоящего изобретения разработаны новые производные индол-2-она общей формулы (I), гдеR1 и R2 независимо представляют собой водород, галоген, алкил, содержащий 1-7 атомов углерода,алкокси, содержащий 1-7 атомов углерода, или трифторметил;R4 и R5 независимо представляют собой водород, галоген, трифторметил, или линейный или разветвленный алкил или алкокси, содержащий 1-7 атомов углерода,m - это 1, 2, 3 или 4, при условии, что, если m=2 и R4 представляет собой водород, то R5 не является водородом и хлором в положении 3 арильной группы, или, если m = 4 и R4 представляет собой метокси в положении 2 арильной группы, то R5 не является водородом, и их фармацевтически приемлемые соли присоединения кислоты. Термин алкил, используемый здесь, обозначает прямую или разветвленную цепь насыщенных углеводородных групп, содержащую 1-7, предпочтительно из 1-4 атомов углерода, (например, метил,этил, 1-пропил, 2-пропил, н-бутил, изобутил или трет, бутил группы и т.д.). Термин галоген подразумевает атомы фтора, хлора, брома и йода, предпочтительно хлора и брома. Уходящая группа может быть алкилсульфонилокси или арилсульфонилоксигруппой, например метилсульфонилокси или п-толуолсульфонилоксигруппой, или атомом галогена, предпочтительно брома или хлора. Термин фармацевтически приемлемая соль присоединения кислоты относится к нетоксичным солям соединений общей формулы (I), образованным с фармацевтически приемлемыми органическими или неорганическими кислотами. Неорганическими кислотами, подходящими для образования солей, являются, например, соляная, бромоводородная, фосфорная, серная или азотная. В качестве органических кислот могут быть использованы муравьиная, уксусная, пропионовая, малеиновая, фумаровая, янтарная,молочная, яблочная, винная, лимонная, аскорбиновая, малоновая, щавелевая, миндальная, гликолевая,фталевая, бензолсульфоновая, п-толуолсульфоновая, нафтойная, метансульфоновая. Кроме того, карбонаты и гидрокарбонаты также рассматриваются как фармацевтически приемлемые соли. К подгруппе соединений общей формулы (I), обладающих ценными фармацевтическими качествами, относятся соединения, в которых R1 обозначает водород, галоген, алкил, содержащий 1-7 атомов углерода; R2 и R3 обозначают водород; R4 - водород или галоген; R5 обозначает галоген, m означает 4; и их фармацевтически приемлемые соли присоединения кислоты. К другой подгруппе эффективных соединений общей формулы (I) относятся соединения, в которыхR1 обозначает водород или галоген; R2, R3 и R4 обозначают водород; R5 - галоген; m - это 4, и их фармацевтически приемлемые соли присоединения кислоты. Особенно эффективными представителями соединений общей формулы (I) являются следующие производные: 3-4-[4-(4-хлорфенил) пиперазин-1-ил]-бутил-6-фтор-1,3-дигидро-2H-индол-2-он, 3-4-[4(4-[4-фторфенил)-пиперазин-1-ил]-бутил-1,3-дигидро-2 Н-индол-2-он, 3-4-[4-(4-хлорфенил)-пиперазин 1-ил]-бутил-1,3-дигидро-2 Н-индол-2-он,3-4-[4-(3-хлорфенил)-пиперазин-1-ил]-бутил-1,3-дигидро 2H-индол-2-он, 3-4-[4-(3-хлорфенил)-пиперазин-1-ил]-бутил-5-метил-1,3-дигидро-2 Н-индол-2-он, 34-[4-(4-хлорфенил)-пиперазин-1-ил]-бутил-5-метил-1,3-дигидро-2H-индол-2-он,3-4-[4-(4-хлор-3 трифторметилфенил)-пиперазин-1-ил]-бутил-1,3-дигидро-2H-индол-2-он, и их фармацевтические приемлемые соли присоединения кислоты. Согласно еще одному аспекту настоящего изобретения разработан способ получения соединений общей формулы (I) и их фармацевтически приемлемых солей присоединения кислоты, который включает(а) реакцию соединения общей формулы (II) где L обозначает гидрокси, с арилсульфонил хлоридом или линейным или разветвленным алкилсульфонилхлоридом, содержащим 1-7 атомов углерода, в присутствии органического основания, и реакцию полученного таким образом химического соединения общей формулы (II), где L означает арил- или алкилсульфонилокси, с производным пиперазина общей формулы (III) где R4 и R5 соответствуют названным выше в присутствии агента, связывающего кислоту, или(б) реакция компонента общей формулы (V) где R1, R2 и R3 соответствуют названным выше с соединением общей формулы (VI) где R4, R5 и m соответствуют названным выше,L - уходящая группа, в присутствии сильного основания. Соединения общей формулы (I), где R1-R5 и m соответствуют названым выше, могут быть получены благодаря реакции соединения общей формулы (II), где R1- R3 и m соответствуют названым выше, a L - уходящая группа, с соединением общей формулы (III), где R4 и R5 соответствуют названым выше, согласно методам, описанным в литературе [Houben-Weyl: Methoden der organishen Chemie, Georg Thieme Verlag, Stuttgart, 1992, ed. 4,vol E16d (ed.:D. Klamann); R.C. Larock: Comprehensive organic Transformations, ed. 2, John WilleySons, NewYork, 1999, 789; D. A. Walsh, Y-H. Chen, J. B. Green, J.C. Nolan, J.M, Yanni J. Med. Chem. 1990, 33, 1823-1827]. В процессе получения соединений общей Формулы (II) образование заместителей может быть произведено в произвольной последовательности, согласно методам, описанным в литературе. Целесообразно получать соединения общей формулы (II) путем реакции соединения общей формулы (IV),где L и m соответствуют названным выше, L' является уходящей группой или группой, которая может быть преобразована в уходящую, с соединением общей формулы (V), где R1-R3 соответствуют названным выше, которые были синтезированы согласно методам, описанным в литературе [Houben-Weyl:Simig Eur J. Org. Chem. 2003, 18, 3991-3996]. Соединения общей формулы (I), где R1-R5 и m соответствуют названным выше, также могут быть получены в результате реакции соединения общей формулы (V), где R1-R3 соответствуют названным выше, с соединением общей формулы (VI), где R4-R5 и др. соответствуют названным выше, L - уходящая группа, согласно описанным в литературе методам [R.J. Sundberg: The chemistry of indoles, AcademicWilkerson, A.A. Kergaye, S.W. Tarn J. Med. Chem. 1993, 36, 2899-2907]. Соединения общей формулы (I), где R1-R5 и m соответствуют названным выше, также могут быть получены путем образования заместителей R1-R5 в различной последовательности на заключительном этапе реакции. В таком случае, соединение общей формулы (1) используется в качестве исходного вещества, в котором все заместители соответствуют названным выше, за исключением одного получаемого заместителя, который может быть выбран из R1 R2, R3, R4 и R5. Введение и замена заместителя выполня-3 011280 ется согласно методам, описанным в литературе [Houben-Weyl: Methoden der organischen Chemie, GeorgThieme Verlag, Stuttgart, 1977, 4th Edition, IV/1a-d; vol. V/2b]. Для введения заместителей может быть необходимо применение или удаление защитных групп. Такие методы описаны в T.W. Greene, Protectivegroups in organic synthesis, John WileySons, 1981. Соединения общих формул (III), (IV), (V) и (VI) известны из литературных источников и могут быть получены аналогичными способами. Соединения общей формулы (I), полученные согласно способам по изобретению, могут быть выделены из их солей или превращены в фармацевтически приемлемые соли присоединения кислоты способами, описанными в литературе. Согласно следующему аспекту настоящего изобретения, получены фармацевтические композиции,содержащие в качестве активного ингредиента соединение общей формулы (I) или его фармацевтически приемлемую соль присоединения кислоты, в смеси с одним или более обычно применяемым носителем или вспомогательным агентом. Фармацевтическая композиция по изобретению содержит в общем 0,1-95 мас.%, предпочтительно 1-50 мас.%, особо предпочтительно 5-30 мас.% активного ингредиента. Фармацевтическая композиция по изобретению пригодна для перорального (например, таблетки,таблетки в оболочке, капсулы, микрокапсулы, пилюли, растворы, суспензии или эмульсии), парентерального (например, инъекции растворов для внутривенного, внутримышечного, подкожного или интраперитонеального введения), ректального (например, суппозитории), трансдермального (например, пластыри) или локального (например, мази или пластыри) введения или для применения в качестве импланта. Твердые, мягкие или жидкие фармацевтические композиции могут быть получены способами, традиционно применяемыми в фармацевтической индустрии. Твердые фармацевтические композиции для перорального введения, содержащие соединения общей формулы (I) или их фармацевтически приемлемые соли присоединения кислоты, могут содержать наполнители или носители (такие, как лактоза, глюкоза, крахмал, фосфат калия, микрокристаллическую целлюлозу), связывающие вещества (такие как желатин, сорбит, поливинилпирролидон), разрыхлители(такие как кроскармелоза, натрийкарбоксиметилцеллюлоза, кросповидон), вспомогательные вещества для таблеток (такие как стеарат магния, тальк, полиэтиленгликоль, кремниевая кислота, диоксид кремния) и поверхностно-активные вещества (например, лаурилсульфат натрия). Жидкие соединения, подходящие для перорального введения, могут быть растворами, суспензиями или эмульсиями. Такие композиции могут содержать суспендирующие агенты (например, желатин, карбоксиметилцеллюлозу), эмульгаторы (например, сорбитана моноолеат), растворители (например, воду,масла, глицерин, пропиленгликоль, этанол), буферные агенты (например, ацетатный, фосфатный, цитратный буферы) и консерванты (например, метил-4-гидроксибензоат). Жидкие фармацевтические композиции, подходящие для парентерального введения, представляют собой обычно стерильные изотонические растворы, содержащие, помимо растворителя, буферные вещества и консерванты. Мягкие фармацевтические композиции, например суппозитории, содержащие в качестве активного вещества соединение общей формулы (I) или его фармацевтически приемлемую соль присоединения кислоты, содержат активное вещество равномерно растворенным в основном веществе суппозитория(например, в пропиленгликоле или в масле какао). Согласно еще одному аспекту настоящего изобретения, осуществлено применение производного индол-2-она общей формулы (I) или его фармацевтически приемлемой соли присоединения кислоты для получения фармацевтической композиции, пригодной для лечения или профилактики нарушений центральной нервной системы или психосоматических заболеваний, включая синдромы беспокойства, общее тревожное расстройство, паническое расстройство, навязчивые состояния, социальную фобию, агорафобию, фобии, связанные с определенными ситуациями, посттравматический стресс, посттравматические нарушения памяти, когнитивные нарушения, сексуальные расстройства, связанные с нарушениями центральной нервной системы, депрессию, шизофрению, заболевания желудочно-кишечного тракта, заболевания сердечно-сосудистой системы, в частности, гипертензию. Фармацевтическая композиция по изобретению может быть получена способами, известными в фармацевтической промышленности. Активный компонент смешивается с фармацевтически приемлемыми твердыми или жидкими носителями и/или вспомогательными веществами и смесь переводится в галенову форму. Носители и вспомогательные вещества, а также способы, используемые в фармацевтической промышленности, раскрыты в литературе (Remington's Pharmaceutical Sciences, Edition 18, MackPublishing Co, Easton, USA, 1990). Фармацевтическая композиция по изобретению имеет дозировку. Суточная доза для взрослых составляет, в общем случае, 0,1-1000 мг/кг массы соединения общей формулы (I) или его фармацевтически приемлемой соли присоединения кислоты. Указанная доза может быть введена в один и более приемов. Величина суточной дозы зависит от нескольких факторов и определяется врачом. Согласно еще одному аспекту настоящего изобретения, соединения общей формулы (I) или их фармацевтически приемлемые соли присоединения кислоты применяются для лечения или профилактики нарушений центральной нервной системы и психосоматических заболеваний, включая синдромы бес-4 011280 покойства, общее тревожное расстройство, паническое расстройство, навязчивые состояния, социальную фобию, агорафобию, фобии, связанные с определенными ситуациями, стресс, посттравматический стресс, посттравматические нарушения памяти, когнитивные нарушения, сексуальные расстройства, связанные с нарушениями центральной нервной системы, депрессию, шизофрению, ухудшение умственных способностей, обусловленное церебральным цитолизисом, болезнь Альцгеймера, удар, деменции, более того, заболевания желудочно-кишечного тракта и сердечно-сосудистой системы, в частности гипертензию. Изобретение основано на неожиданном открытии того факта, что производные индол-2-она общей формулы (I) в отличие от соединений сходной структуры, известных из предшествующего уровня техники, обладают важной способностью связываться и с 5-НТ 7, и с 1 рецепторами, и ингибируют синаптосомальный захват серотонина. До сих пор такая активность не была описана в литературе, касающейся каких-либо ранее известных производных индолона. Для изучения связывания с 5-НТ 7 рецептором был использован клонированный рецептор человека. Связывание с 1 рецептором было изучено на изолированных препаратах лобной коры самцов крыс Wistar массой 120-200 г. Измерения захвата 5-НТ были проведены на препаратах изолированной мозговой коры самцов крыс. Содержание белков в препаратах мембран определялось по методу Лоури (1951). В ходе исследования связывания с 5-НТ 7 и 1 рецепторами в качестве лигандов использовались диэтиламид 3 Н-лизергиновой кислоты (ЛСД) (1,0 нМ) и 3 Н-празозин (0,3 нМ). Клозапин (25 М) и празозин(1 M) применялись для измерения неспецифического связывания. Изучение связывания 1 проводилось согласно методам Ридера и Гринграсса (Reader, T.A., Briere, R., Grondin, L: J. Neural Transm. 68, p. 79(1987); Greengrass, P., Brenner, R.: Eur. J. Pharmacol. 55, p. 323 (1979. При исследовании ингибирования обратного захвата серотонина в качестве лиганда был использован меченый тритием серотонин, неспецифическим лигандом был флуоксетин (100 M). В ходе теста измерялся уровень Ki. Соединения считались активными, если уровень Ki был ниже 100 М/л. Результаты представлены в табл. 1-3. Таблица 1. Эксперимент со связыванием 5-НТ 7 рецептора Таблица 2. Эксперимент со связыванием 1 рецептора-5 011280 Таблица 3. Ингибирование обратного захвата серотонина Исходя из данных представленных выше табл. 1-3, можно заключить, что исследуемые соединения демонстрируют заметную аффинность как к 5-НТ 7, так и к 1 рецептору, а также значительно ингибируют захват серотонина в синаптосомах. Основываясь на данных описанных выше фармакологических экспериментов, можно сделать вывод, что соединения по изобретению обладают очень полезными свойствами и могут использоваться для лечения или профилактики психических заболеваний и болезней сердечно-сосудистой системы, например, депрессии, тревожности, навязчивых состояний, панического расстройства, социальной фобии, шизофрении, расстройств настроения, мании, ухудшения умственных способностей, удара, гибели клеток в определенных участках центральной нервной системы, нейродегенерации с последующим ухудшением умственных способностей, болезни Альцгеймера, деменции, посттравматических заболеваний, стресса,нарушений сердечнососудистой системы, в частности, гипертензии. Дополнительные детали настоящего изобретения обсуждаются в последующих примерах без ограничения ими объема защиты. Получение метилсульфонил сложных эфиров (способ А) 3-(4-гидроксибутил)оксиндолы получают способом, описанным в литературе [B.Volk, Т. Mezei,Gy.Simig Synthesis 2002, 595; B.Volk, Gy.Simig Eur. J. Org. Chem. 2003, 18, 3991-3996]. 55 ммоль 3-(4-гидроксибутил)оксиндола растворяют в 150 мл ТГФ, добавляют 15,2 мл (110 ммоль) триэтиламина и раствор остужают на ацетоновой сухой ледяной бане до -78 С. При той же температуре,перемешивая, по каплям добавляют 8,5 мл (110 ммоль) метилсульфонил хлорида, после чего раствору дают нагреться до комнатной температуры. В течение часа раствор перемешивают при комнатной температуре, триэтиламин гидрохлорид отфильтровывают, фильтрат выпаривают, осадок переносят в этилацетат и несколько раз экстрагируют 10 об.% раствором соляной кислоты до тех пор, пока рН водной фазы не становится кислым. Органическую фазу сушат сульфатом натрия, выпаривают, остаточное масло кристаллизуют путем тритурации с диизопропиловым эфиром, фильтруют, промывают гексаном и высушивают. Продукт очищают путем рекристаллизации после достижения точки плавления данного вещества. Пример 1. 3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу А, начиная с 3-(4-гидроксибутил)-1,3-дигидро 2H-индол-2-она. Т.пл. 84-85 С (гептан-этилацетат). ИК (инфракрасный спектр) (KBr): 3180, 1705 (С=O) см-1 1 Н-ЯМР (CDCl3, ТМС (тетраметилсилан), 400 МГц): 9,33 (1 Н, s), 7,22 (1 Н, d, J=7,1 Гц), 7,21 (1 Н, t,J=7,0 Гц), 7,03 (1 Н, t, J=7,5 Гц), 6,93 (1 Н, d, J=7,6 Гц), 4,19 (2 Н, t, J=6,5 Гц), 3,49 (1 Н, t, J=6,0 Гц), 2,97(3H, s), 2,05-1,98 (2 Н, m), 1,82-1,72 (2 Н, m) 1,58-1,20 (2 Н, m) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 180,5, 141,6, 129,1, 127,9, 123,9, 122,3, 109,9, 69,5, 45,7, 37,2, 29,6,28,9, 21,6 млн-1. Пример 2. 5-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу А, начиная с 5-фтор-3-(4-гидроксибутил)-1,3 дигидро-2 Н-индол-2-она. Т.пл. 106-108 С (гексан-этилацетат). ИК (KBr): 3169, 1702 (С=O), 1356, 1175 (SO2) см-1. 1 Н-ЯМР (CDCl3, ТМС, 500 МГц): 1,43-1,55 (2 Н, m), 1,73-1,83 (2 Н, m), 1,97-2,05 (2 Н,m), 2,99 (3H, s),3,50 (1 Н, t,), 4,21 (2 Н, dq, J=1,4, 6,3 Гц), 6,86 (1 Н, dd, J=4,3, 8,4 Гц), 6,93 (1 Н, dt, J=2,3, 9,0 Гц), 6,97 (1 Н,dd, J=2,0, 7,3 Гц), 9,22 (1 Н, s) млн-1. 13 С-ЯМР (CDCl3, ТМС, 125,6 МГц): 180,2, 158,9 (d, J=240,6 Гц), 137,59 (d, J=1,7 Гц), 130,8 (d, J=8,5 Гц), 114,3 (d, J=27,5 Гц), 111,9 (d, J=24,8 Гц), 110,4 (d, J=8,1 Гц), 69,4, 46,2, 37,3, 29,5, 28,9, 21,5 млн-1. Пример 3. 6-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу А, начиная с 6-фтор-3-(4-гидроксибутил)-1,3 дигидро-2H-индол-2-она. Т.пл. 106-108 С (гексан-этилацетат). ИК (KBr): 3161, 1705 (С=O), 1335, 1313, 1167 (SO2) см-1. 1 Н-ЯМР (CDCl3, ТМС, 500 МГц): 1,46-1,51 (2 Н, m), 1,78 (2 Н, kv, J=6,7 Гц), 2,00 (2 Н, q, J=8,1 Гц),2,99 (3H, s), 3,46 (1 Н, t, J=5,9 Гц), 4,21 (2 Н, dt, J=1,5, 6,5 Гц), 6,68 (1 Н, dd, J=2,3, 8,8 Гц), 6,72 (1 Н, dt,J=2,3, 8,9 Гц), 7,15 (1 Н, dd, J=5,4, 8,1 Гц), 9,15 (1 Н, шир. s) млн-1. 13 С-ЯМР (CDCl3, ТМС, 125,6 МГц): 21,6, 28,9, 29,7, 37,3, 45,3, 69,5, 98,6 (d, J=27,4 Гц), 108,7 (d, J =-6 011280 2,5 Гц), 124,5 (d, J=3,0 Гц), 124,9 (d, J=9,5 Гц), 142,8 (d, J=11,8 Гц), 162,6 (d, J=244,6 Гц), 180,7 млн-1. Пример 4. 5-метил-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2H-индол-2-он Указанное соединение получают согласно способу А, начиная с 3-(4-гидроксибутил)-5-метил-1,3 дигидро-2 Н-индол-2-она. Т.пл. 89-90 С (гексан-этилацетат). ИК (KBr): 3175, 1710 (С=O), 1351, 1176 (SO2) см-1. 1 Н-ЯМР (CDCI3, ТМС, 400 МГц): 9,13 (1 Н, s), 7,03 (1 Н, s), 7,01 (1 Н, dd, J=7,9, 0,8 Гц), 6,81 (1 Н, d,J=7,9 Гц), 4,20 (2 Н, t, J=6,5 Гц), 3,45 (1 Н, t, J=5,9 Гц), 2,98 (3H,s), 2,33 (3H, s), 1,99 (2 Н, q, J=7,4 Гц), 1,791,75 (2 Н, m), 1,51-1,42 (2 Н, m) млн-1. 13 С-ЯМР (CDCI3, ТМС, 101 МГц): 180,4, 139,1, 131,7, 129,2, 128,2, 124,7, 109,5, 69,6, 45,8, 37,2, 29,6,28,9, 21,5, 21,0 млн-1. Реакция связывания метилсульфонил сложных эфиров с основаниями (способ Б) В реакции связывания метилсульфонил сложный эфир связывается со вторичным амином. Расплавленный вторичный амин (12 ммолей) нагревают до 120 С, слегка помешивая, и добавляют метилсульфониловое соединение (12 ммоль) и карбонат натрия (1,36 г; 12 ммоль) при той же температуре. Смеси дают прореагировать в течение 1 ч, расплаву дают остыть, добавляют этилацетат и воду и фазы разделяют. Органическую фазу выпаривают, оставшееся масло подвергают хроматографии на коротких колонках,используя в качестве элюента этилацетат. Основными продуктами реакции являются искомые соединения. Методика 1. Если очищенный хроматографией на колонках продукт становится кристаллическим при растирании с диэтилэфиром, его отфильтровывают и перекристаллизуют из смеси гексана и этилацетата. Искомые соединения получаются в форме белых кристаллов. Методика 2. Если основной продукт не становится кристаллическим при добавлении диэтилэфира,его растворяют в 200 мл эфира, незначительное количество всплывшего преципитата отфильтровывают и к чистому раствору добавляют по каплям, активно перемешивая, соответствующее количество (1 молярный эквивалент) соляной кислоты, растворенной в эфире, разбавленном 50 мл диэтилэфира. Получившуюся белую соль отфильтровывают, промывают эфиром и гексаном и сушат 3 ч при комнатной температуре под вакуумом. Методика 3. Если основной продукт не становится кристаллическим при добавлении диэтилэфира и не образует с соляной кислотой соль, которую можно отфильтровать, его растворяют в 100 мл горячего этилацетата и по каплям в течение 10 мин добавляют, перемешивая, раствор 1 молярного эквивалента щавелевой кислоты в 30 мл горячего этилацетата. При охлаждении выделяется белая соль оксалата. Ее отфильтровывают при комнатной температуре, промывают этилацетатом и гексаном и сушат. Пример 5. 3-4-[(3-хлорфенил)-пиперазин-1-ил]-бутил-6-фтор-1,3-дигидро-2 Н-индол-2-она монооксалат. Указанное соединение получают согласно способу Б с помощью методики 3, используя в качестве исходных компонентов 6-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2H-индол-2-он и 1-(3 хлорфенил)пиперазин. Т.пл. 217-219 С. ИК (KBr): 3256, 1712 (С=O), 1626, 1139 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц) 1,29-1,26 (2 Н, m), 1,65-1,58 (2 Н, m), 1,89-1,80 (2 Н, m), 2,88 (2 Н,t, J=7,9 Гц), 3,08 (4 Н, bra s), 3,38 (4 Н, bra s), 3,44 (1 Н, t, J=5,4 Гц), 6,65 (1H, did, J=2,4, 9,1 Гц), 6,75 (1H,dot, J=2,4, 9,1 Гц), 6,89 (1H, did, J=1,3, 7,8 Гц), 6,94 (1H, did, J=1,8, 8,48 Гц), 7,01 (1H, t, J=2,1 Гц), 7,24(d, J=21,7 Гц), 114,2, 115,2, 119,1, 125,4, (d, J=15,3 Гц), 125,5 (d, J=7,4 Гц), 130,7, 134,1, 144,5 (d, J=12,2 Гц), 151,4, 162,1 (d, J=240,7 Гц), 164,4, 179,4 млн-1. Элементарный анализ соединения C24H27CIFN3O5 (491,95): Рассчитано: С 58,60, Н 5,53, Cl 7,21, N 8,54%,Обнаружено: С 58,48, Н 5,52, Cl 7,11, N 8,50%. Пример 6. 3-4-[4-(4-хлорфенил)пиперазин-1-ил]l-бутил-5-фтор-1,3-дигидро-2 Н-индол-2-она моногидрохлорид. Указанное соединение получают согласно способу Б с помощью методики 2, используя в качестве исходных компонентов 5-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2H-индол-2-она и 1-(3 хлорфенил)пиперазин. Т.пл. 180-184 С. ИК (KBr): 3421, 3145, 1712 (СО), 1189,778 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц) 1,33-1,24 (2 Н, m), 1,93-1,70 (4 Н, m), 3,16-3,03 (4 Н, m), 3,18 (2 Н,m), 3,38 (1 Н, m), 3,49 (2 Н, d, J=12,4 Гц), 3,86 (2 Н, d, J=12,9 Гц), 6,81 (1 Н, dd, J=4,5, 8,4 Гц), 7,00 (1 Н, m),7,05 (1 Н, t, J=2,0 Гц), 7,21 (1 Н, dd, J=2,0, 8,5 Гц), 7,25 (1 Н, t, J=8,2 Гц), 10,4 (1 Н, s), 10,9 (1 Н, шир. s) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 22,5, 23,1, 29,3, 45,0, 45,5 (d, J=1,5 Гц), 50,4, 55,2, 109,9 (d,J=8,0 Гц), 111,2 (d, J=24,4 Гц), 114,0 (d, J=23,3 Гц), 114,3, 115,4, 119,4, 130,8, 131,6 (d, J=8,4 Гц), 134,1,139,1 (d, J=1,5 Гц), 151,0, 158,1 (d, J=236,1 Гц), 178,8 млн-1. Элементарный анализ соединения C22H26Cl2FN3O (438,38): Рассчитано: Н 5,98, Cl 16,17, N 9,59%,-7 011280 Обнаружено: Н 6,26, Cl 15,50, N 9,17%. Пример 7. 3-4-[4-(4-хлорфенил)пиперазин-1-ил]бутил-5-фтор-1,3-дигидро-2H-индол-2-она моногидрохлорид. Указанное соединение получают согласно способу Б с помощью методики 2, используя в качестве исходных компонентов 5-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(4 хлорфенил)пиперазин. Т.пл. 193-196 С. ИК (KBr): 3145, 1712 (С=O), 821 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц) 1,32-1,22 (2 Н, m), 1,95-1,71 (4 Н, m), 3,20-3,06 (6 Н, m), 3,53-3,49(3H, m), 3,80-3,76 (2 Н, m), 6,82 (1 Н, dd, J=4,5, 8,5 Гц), 7,04-6,98 (1 Н, m), 7,01 (2 Н, d, J=9,1 Гц), 7,21 (1 Н,dd, J=2,1, 8,6 Гц), 7,28 (2 Н, d, J=9,1 Гц), 10,5 (1 Н, s), 11,1 (1 Н, шир. s) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 22,5, 23,1, 29,3,42,6, 45,3, 45,4, 45,5 (d, J=1,9 Гц), 50,5, 55,1,110,0 (d, J=8,4 Гц), 112,1 (d, J=24,4 Гц), 114,0 (d, J=23,3 Гц), 117,6, 117,7, 123,7, 129,0, 131,6 (d, J=8,4 Гц),139,2 (d, J=1,9 Гц), 148,7, 14,1, 158,1 (d, J=235,8 Гц), 178,8 млн-1. Элементарный анализ соединения C22H26Cl2FN3O (438,38): Рассчитано: С 60,28, Н 5,98, Cl 16,17, N 9,59%,Обнаружено: С 59,35, Н 5,93, Cl 16,44, N 9,46%. Пример 8. 3-4-[4-(4-хлорфенил)пиперазин-1-ил]-бутил-6-фтор-1,3-дигидро-2 Н-индол-2-она моногидрохлорид. Указанное соединение получают согласно способу Б с помощью методики 2, используя в качестве исходных компонентов 6-фтор-3-(4-метилсульфонилоксибутил)1,3-дигидро-2 Н-индол-2-он и 1-(4 хлорфенил)пиперазин. Т.пл. 149-151 С. ИК (KBr): 3148, 2586, 2459, 1716 (С=O) см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц) 1,31-1,07 (2 Н, m), 1,91-1,66 (4 Н, m), 3,21-2,99 (6 Н, m), 3,51 (1 Н,t, J=5,9 Гц), 3,65-3,60 (2 Н, m), 3,81-3,78 (2 Н, m), 6,69-6,64 (1 Н, m), 6,80-6,72 (1 Н, m), 7,03-6,99 (2 Н, m),7,32-7,26 (3H, m), 10,6-10,5 (1 Н, s), 11,2 (1 Н, шир, s) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 182,2, 164,4 (d, J=234,0 Гц), 150,0, 144,7 (d, J=12,2 Гц), 130,3,128,6, 127,3, 126,5 (d, J=9,5 Гц), 119,5, 109,4 (d, J=22,5 Гц), 99,2 (d, J=27,5 Гц), 57,8, 53,1, 48,0, 46,7, 30,7,25,0, 21,6 млн-1. Элементарный анализ соединения C22H26Cl2FN3O (438,38): Рассчитано: С 69,42 Н 5,98, Cl 16,17, N 9,59%,Обнаружено: С 69,29 Н 5,94, Cl 15,51, N 9,16%. Пример 9. 3-4-[4-(3-хлорфенил)пиперазин-1-ил]бутил-5-метил-1,3-дигидро-2H-индол-2-он Указанное соединение получают согласно способу Б с помощью методики 1, используя в качестве исходных компонентов 5-метил-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(3 хлорфенил)пиперазин. Т.пл.: 122-124 С (гексан-EtOAc). ИК (KBr): 3174 (NH), 1690 (С=O) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 1,58-1,38 (4 Н, m), 2,00-1,95 (2 Н, m), 2,33 (3H, s), 2,36 (2 Н, t, J = 7,6 Гц), 2,54 (4 Н, t, J = 5,1 Гц), 3,17 (4 Н, t, J = 5,1 Гц), 3,44 (1 Н, t, J = 6,0 Гц), 6,76 (1 Н, ddd, J = 0,7, 2,5, 8,2 Гц),6,78 (1 Н, d, J = 8,1 Гц), 6,79(1 Н, ddd, J = 0,8, 1,9, 7,8 Гц), 6,85 (1 Н, t, J = 2,1 Гц), 7,01 (1 Н, d ,J= 7,9 Гц),7,04 (1 Н, d, J = 0,5 Гц), 7,14 (1 Н, t, J = 8,2 Тц), 8,78 (1 Н, s) млн-1. 13 С- ЯМР (CDCl3, ТМС, 101 МГц): 180,5, 152,3, 139,1, 134,9, 131,7, 129,9, 129,7, 128,1, 124,9, 119,1,115,6, 113,7, 109,3, 58,2, 52,9, 48,5, 46,0, 30,4, 26,7, 23,7, 21,1 млн-1. Элементарный анализ соединения C23H28ClN3O (397,95): Рассчитано: С 69,42, Н 7,09, Cl 8,91, N 10,56%,Обнаружено: С 69,29, Н 7,12, Cl 8,69, N 10,51%. Пример 10. 3-4-[4-(4-хлорфенил)пиперазин-1-ил]-бутил-5-метил-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу Б с помощью методики 1, используя в качестве исходных компонентов 5-метил-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(4 хлорфенил)-пиперазин. Т.пл: 159-161 С (EtOAc). ИК (KBr): 3186, 1702 (С=O) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 1,58-1,37 (4 Н, m), 2,02-1,95 (2 Н, m), 2,32 (3H, s), 2,55 (4 Н, t, J= 5,0 Гц), 3,13 (4 Н, t, J = 5,0 Гц), 3,44 (1 Н, t, J= 5,9 Гц), 6,78 (1 Н, d, J = 7,8 Гц), 6,81 (2 Н, d, J = 9,1 Гц), 6,99 (1 Н,d, J = 7,9 Гц), 7,04 (1 Н, s), 7,18 (2 Н, d, J = 9,1 Гц), 8,88 (1 Н, s) млн-1. 13 С-ЯМР (CDCI3, ТМС, 101 МГц): 180,5, 149,9, 139,1, 131,6, 129,7, 128,8, 128,1, 124,8, 124,4, 117,1,109,3, 58,2, 53,0, 49,0, 46,0, 30,3, 26,7, 23,7, 21,1 млн-1. Элементарный анализ соединения C23H28CIN3O (397,95): Рассчитано: С 69,42, Н 7,09, Cl 8,91, N 10,56%,Обнаружено: С 68,76, Н 7,10, Cl 8,80, N 10,54%. Пример 11. 3-4-[4-(4-фторфенил)пиперазин-1-ил]бутил-1,3-дигидро-2H-индол-2-он Указанное соединение получают согласно способу Б с помощью методики 1, используя в качестве исходных компонентов 3-(4-метилсульфонилоксибутил)-1,3-дигидро-2H-индол-2-он и 1-(4-фторфенил)пиперазин. Т.пл.: 113-115 С (гексан-EtOAc).K (KBr): 3192, 1720 (С=O) см-1. Н-ЯМР (CDCl3, ТМС, 400 МГц): 1,57-1,36 (4 Н, m), 2,04-1,95 (2 Н, m), 2,36 (2 Н, t, J = 7,5 Гц), 2,56 (4 Н, t, J = 5,0 Гц), 3,09 (4 Н, t, J = 5,0 Гц), 3,37 (1 Н, t, J= 5,9 Гц), 6,85 (2 Н, dd, J = 4,6, 9,2 Гц), 6,89 (1 Н, d, J = 7,7 Гц), 6,94 (2 Н,t, J = 8,8 Гц), 7,01 (1 Н, dt, J = 0,9, 7,5 Гц), 7,19 (1 Н, d, J = 7,7 Гц), 7,21 (1 Н, t, J = 6,7 Гц), 9,33 (1 Н, s) млн-1. 3 С-ЯМР (CDCl3, ТМС, 101 МГц): 23,7, 26,7, 30,3, 46,0, 50,0, 53,1, 58,2, 109,7, 115,4 (d,J = 22,1 Гц),117,6 (d, J = 7,6 Гц), 122,1, 124,0, 127,8, 130,0, 141,7, 147,9, 157,0 (d, J = 238,4 Гц), 180,7 млн-1. Элементарный анализ соединения C22H26FN3O (367,47): Рассчитано: С 71,91, Н 7,13, F 5,17, N 11,43%,Обнаружено: С 71,12, Н 7,32, N 11,28%. Пример 12. 3-4-[4-(3,4-дихлорфенил)пиперазин-1-ил]-бутил-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу Б с помощью методики 1, используя в качестве исходных компонентов 3-(4-метилсульфонилоксибутил)-1,3-дигидро-2H-индол-2-он и 1-(3,4 дихлорфенил)-пиперазин. T.пл.: 112-114 С (гексан-EtOAc) ИК (KBr): 3175, 1718 (С=O) см-1. 1 Н -ЯМР (CDCl3, ТМС, 400 МГц): 1,47-1,36 (2 Н, m), 1,60-1,56 (2 Н, m), 2,04-1,96 (2 Н, m), 2,44 (2 Н, t,J = 7,1 Гц), 2,63 (4 Н, m), 3,20 (4 Н, m), 3,47 (2 Н, t, J = 5,9 Гц), 6,71 (1 Н, dd, J=2,8, 9,0 Гц), 6,91 (1 Н, d, J = 9,2 Гц), 6,92 (1 Н, d, J = 2,9 Гц), 7,02 (1 Н, t, J= 7,5 Гц), 7,26-7,18 (3H, m) , 9,02 (1 Н, s) млн-1. 13 С- ЯМР (CDCl3, ТМС, 101 МГц): 180,4, 150,3, 141,6, 132,7, 130,4, 129,5, 127,9, 124,0, 122,2, 120,6,117,3, 115,3, 109,7, 57,9, 48,2, 45,9, 30,1, 26,2, 23,5 млн-1. Элементарный анализ соединения C22H25Cl2N3O (418,37): Рассчитано: С 63,16, Н 6,02, Cl 16,95, N 10,04%,Обнаружено: С 63,04, Н 6,02, Cl 16,78, N 10,01%. Пример 13. 3-4-[4-(4-хлор-2-метилфенил)пиперазин-1-ил]бутил-1,3-дигидро-2H-индол-2-она моногидрохлорид. Указанное соединение получают согласно способу Б с помощью методики 2, используя в качестве исходных компонентов 3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(4-хлор-2 метилфенил)пиперазин. Т.пл.: 224-225 С. ИК (KBr): 3229, 2456, 1708 (С=O) см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 1,32-1,20 (2 Н, m), 1,91-1,70 (4 Н, m), 2,21 (3H, s), 3,08 (8 Н, шир,s), 3,43 (3H, t, J = 5,8 Гц), 6,81 (1 Н, d, J = 7,7 Гц), 6,93 (1 Н, dt, J = 0,6, 7,5 Гц), 7,00 (1 Н, d, J = 8,6 Гц), 7,14(1 Н, t, J = 7,7 Гц), 7,18 (1 Н, dd, J = 2,5, 8,5 Гц), 7,23 (1 Н, d, J = 2,4 Гц), 7,24 (1 Н, d, J = 7,6 Гц), 10,38 (1 Н,s), 10,97 (1 Н, шир, s) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 17,4, 22,7, 23,2, 29,6, 45,0, 48,2, 51,4, 55,3, 109,4, 120,9, 121,4,124,2, 126,5, 127,7, 127,8, 129,7, 130,6, 134,7, 142,9, 148,9, 178,9 млн-1. Элементарный анализ соединения C23H29C12N3O (434,41): Рассчитано: С 63,59, Н 6,73, Cl 16,32, N 9,67%,Обнаружено: С 63,71, Н 6,74, Cl 16,01, N 9,54%. Пример 14. 3-4-[4-(3-хлор-4-фторфенил)пиперазин-1-ил]бутил-1,3-дигидро-2H-индол-2-сна моногидрохлорид Указанное соединение получают согласно способу Б с помощью методики 2, используя в качестве исходных компонентов 3-(4-метилсульфонилоксибутил)-1,3-дигидро-2H-индол-2-он и 1-(3-хлор-4-фторфенил)пиперазин. Т.пл.: 180-183 С. ИК (KBr): 3432, 1709 (C=O), 735 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 1,36-1,23 (2 Н, m), 1,94-1,72 (4 Н, m), 3,15-3,04 (4 Н, m), 3,19 (2 Н,t, J= 12,0 Гц), 3,51-3,44 (3H, m), 3,78 (2 Н, d, J = 12,2 Гц), 6,85 (1 Н, d, J= 7,7 Гц), 7,02-6,93 (2 Н, m), 7,227,15 (2 Н, m), 7,32-7,26 (2 Н, m), 10,43 (81H, S), 11,2 (1 Н, s) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 22,7, 23,1, 29,6, 45,0, 45,6, 50,4, 55,2, 109,4, 116,3 (d, J= 6,5 Гц),117,1 (d, J= 21,4 Гц), 117,6, 119,9 (d, J = 18,3 Гц), 121,4, 124,2, 127,8, 129,7, 142,9, 147,2, 151,5 (d, J= 239,2 Гц), 178,9 млн-1. Элементарный анализ соединения C22H26Cl2FN3O (438,38): Рассчитано: С 60,28, Н 5,98, Cl 16,17, N 9,59%,Обнаружено: С 59,60, Н 6,06, Cl 15,85, N 9,32%. Пример 15. 3-4-[4-(4-хлор-3-трифторметилфенил)пиперазин-1-ил]бутил-1,3-дигидро-2H-индол-2 она моногидрохлорид Указанное соединение получают согласно способу Б с помощью методики 2, используя в качестве исходных компонентов 3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(4-хлор-3 трифторметилфенил)пиперазин. Т.пл.: 123-125 С. ИК (KBr): 3150, 1709 (С=O), 2554, 2462, 1129 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 1,34-1,26 (2 Н, m), 1,94-1,74 (4 Н, m), 3,09-3,06 (4 Н, m), 3,30 (2 Н,t, J= 12,3 Гц), 3,64-3,47 (3H, m), 3,94 (2 Н, d, J = 12,6 Гц), 6,86 (1 Н, d, J = 7,6 Гц), 6,96 (1 Н, t, J= 7,4 Гц), 7,18 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 22,7, 23,1, 29,6, 44,8, 45,0, 50,2, 55,1, 109,4, 114,4 (q, J=5,0 Гц),120,0 (q), 120,5, 121,4, 123,1 (q, J = 273,1 Гц), 124,2, 127,2 (q, J=30,1 Гц), 127,8, 129,7, 132,3, 142,9, 148,6,178,9 млн-1. Элементарный анализ соединения C23H26Cl2F3N3O (488,38): Рассчитано: С 56,57, Н 5,37, Cl 14,52, F 11,67, N 8,60%,Обнаружено: С 55,88, Н 5,45,Cl 14,44, N 8,59%. Пример 16. 5-фтор-3-4-[4-(4-фторфенил)пиперазин-1-ил]бутил-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу Б с помощью методики 1, используя в качестве исходных компонентов 5-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(4 фторфенил)пиперазин. Т.пл.: 135-137 С (гексан-EtOAc). ИК (KBr): 3169, 1703 (С=O) см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 1,35-1,16 (2 Н, m), 1,46-1,35 (2 Н, m), 1,96-1,77 (2 Н, m), 2,26 (2 Н,t, J= 6,9 Гц), 2,44 (4 Н, t, J = 4,8 Гц), 3,02 (4 Н, t, J= 4,8 Гц), 3,48 (1 Н, t, J= 5,6 Гц), 6,79 (1 Н, dd, J = 4,5, 8,4 Гц), 6,92 (2 Н, dd, J = 4,8, 9,3 Гц), 7,03 (2 Н, t, J= 8,9 Гц), 7,06-6,96 (1 Н, m), 10,36 (1 Н, s) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 23,1, 26,3, 29,5, 45,8, 49,1, 52,8, 57,6, 109,8 (d, J= 8,4 Гц), 112,0(d, J= 24,4 Гц), 113,8 (d, J =22,9 Гц), 115,4 (d, J= 22,1 Гц), 131,8 (d, J = 8,4 Гц), 139,1, 148,1, 156,1 (d, J = 235,4 Гц), 158,0 (d, J = 235,7 Гц), 179,0 млн-1. Элементарный анализ соединения C22H25F2N3O (385,46): Рассчитано: Н 6,54, N 10,90 %,Обнаружено: Н 6,67, N 10,40 %. Пример 17. 3-4-[4-(4-хлорфенил)пиперазин-1-ил]бутил-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу Б с помощью методики 1, используя в качестве исходных компонентов 3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(4-хлорфенил)пиперазин. Т.пл.: 136-137 С (гексан-EtOAc). ИК (KBr): 3203, 1718 (С=O), 754 см-1. 1 Н -ЯМР (CDCl3, ТМС, 400 МГц): 1,58-1,36 (4 Н, m), 2,05-1,96 (2 Н, m), 2,36 (2 Н, t, J = 7,5 Гц), 2,55(4 Н, t, J= 5,0 Гц), 3,13 (4 Н, t, J = 5,0 Гц), 3,48 (1 Н, t, J = 6,0 Гц), 6,81 (2 Н, d, J = 9,2 Гц), 6,88 (1 Н, d, J = 7,7 Гц), 7,02 (1 Н, dt, J = 0,9, 7,6 Гц), 7,18 (2 Н, d, J = 9,1 Гц), 7,24-7,15 (2 Н, m), 8,60 (1 Н, s) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 180,3, 149,9, 141,5, 129,7, 128,8, 127,8, 124,4, 124,1, 122,2, 117,1,109,6, 58,2, 53,0, 49,1, 45,9, 30,4, 26,8, 23,7 млн-1. Элементарный анализ соединения C22H26ClN3O (383,93): Рассчитано: С 68,83, Н 6,83, Cl 9,23, N 10,94%,Обнаружено: С 68,49, Н 6,89, Cl 9,08, N 10,81%. Пример 18. 3-4-[4-(3-хлорфенил)пиперазин-1-ил]бутил-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу Б с помощью методики 1, используя в качестве исходных компонентов 3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и (3-хлорфенил)пиперазин. Т.пл.: 112-114 С (гексан-EtOAc). ИК (KBr): 3200, 1715 (С=O), 750 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 1,57-1,38 (4 Н, m), 2,03-1,97 (2 Н, m), 2,35 (2 Н, t, J = 7,5 Гц), 2,54(1 Н, t, J = 8,1 Гц), 7,21 (1 Н, dt, J = 0,7, 7,7 Гц), 7,22 (1 Н, d, J = 7,3 Гц), 9,05 (1 Н, s) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 180,6, 152,3, 141,7, 134,9, 129,9, 129,6, 127,8, 124,1, 122,2, 119,1,115,6, 113,7, 109,7, 58,2, 52,9, 48,5, 46,0, 30,3, 26,7, 23,7 млн-1. Элементарный анализ соединения C22H26ClN3O (383,93): Рассчитано: С 68,83, Н 6,83, Cl 9,23, N 10,94%,Обнаружено: С 68,31, Н 6,90, Cl 9,08, N 10,77%. Пример 19. 3-4-[4-(3-хлор-4-фторфенил)пиперазин-1-ил]бутил-6-фтор-1,3-дигидро-2H-индол-2 она моногидрохлорид. Указанное соединение получают согласно способу Б с помощью методики 2, используя в качестве исходных компонентов 6-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(3-хлор 4-фторфенил)пиперазин. Температура плавления 218-224 С. ИК (KBr): 2577, 1717 (С=O) см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 500 МГц): 1,35-1,24 (2 Н, m), 1,94-1,74 (4 Н, m), 3,07 (2 Н, t, J = 7,7 Гц), 3,21- 10011280 Элементарный анализ соединения C22H25Cl2F2N3O (456,37) Рассчитано: С 57,90, Н 5,52, Cl 15,54, N 9,21%,Обнаружено: С 57,25, Н 5,51, Cl 15,22, N 9,01%. Пример 20. 5-фтор-3-[4-(4-фенилпиперазин-1-ил)бутил]-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу Б с помощью методики 1, используя в качестве исходных компонентов 5-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-фенилпиперазин. Температура плавления 140-144 С. ИК (KBr): 3188 (NH), 1705 (С=O) см-1 1 Н -ЯМР (CDCl3, ТМС, 500 МГц): 1,45-1,34 (2 Н, m), 1,57-1,52 (2 Н, m), 1,99-1,95 (2 Н, m), 2,36 (2 Н, t,J = 7,7 Гц), 2,57 (4 Н, t, J= 5,0 Гц), 3,17 (4 Н, t, J= 5,0 Гц), 3,47 (1 Н, t, J= 6,0 Гц), 6,80 (1 Н, dd, J = 4,3, 8,4 Гц),6,84 (1 Н, t, J = 7,3 Гц), 6,92-6,87 (3H, m), 6,97 (1 Н, dd, J= 1,8, 8,1 Гц), 7,24 (2 Н, dd, J= 7,3, 8,8 Гц), 9,52 (1 Н,s) млн-1. 13 С- ЯМР (CDCl3, ТМС, 125,6 МГц): 23,6, 26,6, 30,2, 46,5 (d, J = 1,7 Гц), 49,0, 53,1, 58,1, 110,1 (d, J = 8,1 Гц), 112,0 (d, J = 24,8 Гц), 114,1 (d, J =23,5 Гц), 115,9, 119,6, 129,0, 131,2 (d, J =8,1 Гц), 137,6 (d, J = 2,1 Гц), 151,2, 158,9, 180,7 млн-1. Элементарный анализ соединения C22H26FN3O (367,47) Рассчитано: С 71,91, Н 7,13, N 11,43%,Обнаружено: С 72,17, Н 7,04, N 11,45 %. Пример 21. 3-4-[4-(3-хлор-4-фторфенил)пиперазин-1-ил]бутил-5-фтор-1,3-дигидро-2H-индол-2 она моногидрохлорид. Указанное соединение получают согласно способу Б с помощью методики 2, используя в качестве исходных компонентов 5-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2H-индол-2-он и 1-(3-хлор 4-фторфенил)пиперазин. Температура плавления 234-237 С. ИК (KBr): 3143, 2579,1712(С=O), 1189,734 см-1 1 Н-ЯМР (ДМСО-d6, ТМС, 500 МГц): 1,33-1,23 (2 Н, m), 1,95-1,67 (4 Н, m), 3,78-3,04 (10H, m), 3,51(d, J= 24,8 Гц), 114,0 (d, J= 23,5 Гц), 116,3 (d, J= 6,8 Гц), 117,1 (d, J=21,8 Гц), 117,6, 119,9 (d, J= 17,9 Гц),131,6 (d, J= 8,6 Гц), 139,1 (d, J=1,7 Гц), 147,3, 151,5 (d, J= 239,3 Гц), 158,1 (d, J = 235,9 Гц), 178,8 млн-1. Элементарный анализ соединения C22H25Cl2F2N3O (456,37) Рассчитано: С 57,90, Н 5,52, Cl 15,54, N 9,21%,Обнаружено: С 57,88, Н 5,63, Cl 14,94, N 9,04%. Пример 22. 3-4-[4-(3,5-дихлорфенил)пиперазин-1-ил]бутил-1,3-дигидро-2 Н-индол-2-она моногидрохлорид. Указанное соединение получают согласно способу Б с помощью методики 2, используя в качестве исходных компонентов 3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(3,5 дихлорфенил)пиперазин. Температура плавления 201-205 С. ИК (KBr): 3416, 3178, 2583, 1706 (С=O), 753 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 500 МГц): 1,33-1,24 (2 Н, m), 1,73 (2 Н, m), 1,94-1,78 (2 Н, m), 3,04 (4 Н, sz),3,25 (2 Н, sz), 3,46 (3H, t, J= 6,0 Гц), 3,92 (2 Н, sz), 6,83 (1 Н, d, J = 7,7 Гц), 6,95 (1 Н, d, J= 1,5 Гц), 6,95 (1 Н,dt, J= 1,0, 7,5 Гц), 7,04 (1 Н, d, J =1,4 Гц), 7,18 (1 Н, tt, J= 1,0, 7,6 Гц), 7,27 (1 Н, d, J= 7,3 Гц), 10,40 (1 Н, s),11,02 (1 Н, sz) млн-1. 13 С-ЯМР (ДМСО-d6, TMC, 125,6 МГц): 22,7, 23,1, 29,6, 44,6, 45,0, 50,2, 55,2, 109,4, 113,8, 118,3,121,4, 124,2, 127,8, 129,7, 134,9, 142,9, 151,5, 178,9 млн-1. Элементарный анализ соединения C22H26Cl3N3O (454,83): Рассчитано: С 58,10, Н 5,76, Cl 23,38, N 9,24%,Обнаружено: С 59,10, Н 5,90, Cl 22,44, N 9,22%. Пример 23. 3-4-[4-(3,4-дихлорфенил)пиперазин-1-ил]бутил-5-фтор-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу Б с помощью методики 1, используя в качестве исходных компонентов 5-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(3,4 дихлорфенил)пиперазин. Температура плавления 118-120 С. ИК (KBr): 3200, 1709 (С=O), 835 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 500 МГц): 1,29-1,21 (2 Н, m), 1,42 (2 Н, kv, J= 7,2 Гц), 1,93-1,80 (2 Н, m),2,25 (2 Н, t, J= 6,1 Гц), 2,42 (4 Н, t, J= 4,9 Гц), 3,13 (4 Н, t, 7-4,9 Гц), 3,48 (1 Н, X, J = 5,7 Гц), 6,79 (1 Н, dd, J= 4,5, 8,4 Гц), 6,91 (1 Н, dd, J= 2,9, 9,0 Гц), 6,99(1 Н, dt, J = 2,3, 8,9 Гц), 7,10 (1 Н, d, J=2,8 Гц), 7,16 (1 Н, dd,J=2,2, 8,4 Гц), 7,37 (1 Н, d, J= 9,0 Гц), 10,35 (1 Н, d, J=9,0 Гц) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 125,6 МГц): 23,1, 26,3, 29,5, 45,8, 47,7, 52,5, 57,6, 109,8 (d, J= 8,3 Гц),112,0 (d, J= 24,4 Гц), 113,8 (d, J= 23,0 Гц), 115,3, 116,2, 119,6, 130,6, 131,6, 131,8 (d, J = 8,3 Гц), 139,1 (d, 7= 1,5 Гц), 150,9, 158,0 (d, J= 235,8 Гц), 178,9 млн-1.- 11011280 Элементарный анализ соединения C22H24Cl2FN3O (436,36): Рассчитано: С 60,56, Н 5,54, Cl 16,25, N 9,63%,Обнаружено: С 60,71, Н 5,64, Cl 16,14, N 9,72%. Пример 24. 3-[4-(4-фенилпиперазин-1-ил)бутил]-1,3-дигидро-2 Н-индол-2-он Указанное соединение получают согласно способу Б с помощью методики 1, используя в качестве исходных компонентов 3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1 фенилпиперазин. Температура плавления 110-113 С. ИК (KBr): 3191, 1705 (С=О)см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 500 МГц): 1,31-1,24 (2 Н, m), 1,43 (2 Н, kv, J= 7,2 Гц), 1,82-1,79 (1 Н, m),1,91-1,81 (1 Н, m), 2,25 (2 Н, t, J= 7,3 Гц), 2,43 (4 Н, t, J= 5,0 Гц), 3,07 (4 Н, t, J =4,9 Гц), 3,42 (1 Н, t, J= 4,9 Гц), 6,76 (1 Н, t, J= 7,2 Гц), 6,82 (1 Н, d, J= 1,1 Гц), 6,90 (1 Н, dd, J = 1,0, 7,8 Гц), 6,94 (1 Н, dt, 7= 1,0, 7,6 Гц),7,21-7,14 (3H, m), 7,24 (1 Н, d, J = 7,3 Гц), 10,35 (1 Н, s) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 125,6 МГц): 23,3, 26,4, 29,9, 45,3, 48,3, 52,9, 57,8, 109,3, 115,4, 118,8,121,3, 124,1, 127,7, 129,0, 129,9, 142,9, 151,2, 179,1 млн-1. Элементарный анализ соединения C22H27N3O (349,48): Рассчитано: С 75,61, Н 7,79, N 12,02%,Обнаружено: С 74,53, Н 7,81, N 11,81%. Пример 25. 6-фтор-3-4-[4-(4-фторфенил)пиперазин-1-ил]бутил-1,3-дигидро-2 Н-индол-2-она моногидрохлорид Указанное соединение получают согласно способу Б с помощью методики 2, используя в качестве исходных компонентов 6-фтор-3-(4-метилсульфонилоксибутил)-1,3-дигидро-2 Н-индол-2-он и 1-(4 фторфенил)пиперазин. Температура плавления 184-189 С. ИК (KBr): 3125, 1717 (С=O), 1512 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 500 МГц): 1,32-1,24 (2 Н, m), 1,92-1,73 (4 Н, m), 3,17-3,06 (6 Н, m), 3,52-3,45(3H, m), 3,70-3,68 (2 Н, m), 7,31-6,66 (7 Н, m), 10,62 (1 Н, s), 11,2 (1H, sz) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 125,6 МГц): 22,6, 23,1, 29,6, 44,6, 46,2, 50,6, 55,1, 97,6 (d, J = 26,9 Гц),107,3 (d, J = 22,0 Гц), 115,6 (d, J = 22,0 Гц), 118,0, 125,3, 125,4, 144,5, 146,6, 155,8, 157,7, 161,1, 163,0,179,3 млн-1. Элементарный анализ соединения C22H26ClF2N3O (421,92) Рассчитано: С 62,63, Н 6,21, Cl 8,40, N 9,96%,Обнаружено: С 62,37, Н 6,31, Cl 8,41, N 9,78%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные 3-алкилиндол-2-она общей формулы (I)R1 и R2 независимо представляют собой водород, галоген, алкил, состоящий из 1-7 атомов углерода,алкокси, содержащий 1-7 атомов углерода, или трифторметил;R4 и R5 независимо представляют собой водород, галоген, трифторметил или линейный или разветвленный алкил или алкокси, содержащий 1-7 атомов углерода,m обозначает 1, 2, 3 или 4,при условии, что, если m=2 и R4 представляет собой водород, то R5 не является водородом и хлором в положении 3 арильной группы, или, если m=4 и R4 представляет собой метокси в положении 2 арильной группы, то R5 не является водородом,или их фармацевтически приемлемые соли присоединения кислоты. 2. Производные 3-алкилиндол-2-она общей формулы (I), гдеR4 представляет собой водород или галоген;m представляет собой 4,и их фармацевтически приемлемые соли присоединения кислоты. 3. Производные 3-алкилиндол-2-она общей формулы (I), где R1 представляет собой водород или галоген;m представляет собой 4,и их фармацевтически приемлемые соли присоединения кислоты. 4. 3-4-[4-(4-хлорфенил)пиперазин-1-ил]бутил-6-фтор-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты. 5. 3-4-[4-(4-фторфенил)пиперазин-1-ил]бутил-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты. 6. 3-4-[4-(4-хлорфенил)пиперазин-1-ил]бутил-1,3-дигидро-2 Н-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты. 7. 3-4-[4-(3-хлорфенил)пиперазин-1-ил]бутил-1,3-дигидро-2 Н-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты. 8. 3-4-[4-(3-хлорфенил)пиперазин-1-ил]бутил-5-метил-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты. 9. 3-4-[4-(4-хлорфенил)пиперазин-1-ил]бутил-5-метил-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты. 10. 3-4-[4-(4-хлор-3-трифторметилфенил)пиперазин-1-ил]бутил-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты. 11. Фармацевтические композиции, содержащие в качестве активного компонента, по меньшей мере, соединение общей формулы (I) по любому из пп.1-10 или его фармацевтически приемлемую соль присоединения кислоты в смеси с одним или более обычно применяемым наполнителем или вспомогательным веществом. 12. Фармацевтические композиции по п.11, применяемые для лечения и профилактики нарушений центральной нервной системы, в частности, депрессии, тревожности, навязчивых состояний, панического расстройства, социальной фобии, шизофрении, расстройств настроения, мании, ухудшения умственных способностей, удара, гибели клеток в определенных участках центральной нервной системы, нейродегенерации с последующим ухудшением умственных способностей, болезни Альцгеймера, деменции,посттравматических заболеваний, стресса, нарушений сердечно-сосудистой системы, в частности, гипертензии. 13. Способ получения соединений общей формулы (I), раскрытых в п.1, который включает реакцию соединения общей формулы (II) где L означает гидроксил, с арилсульфонилхлоридом или линейным или разветвленным алкилсульфонилхлоридом, содержащим 1-7 атомов углерода, в присутствии органического основания, и реакцию полученного таким способом соединения общей формулы (II), где L представляет собой арил- или алкилсульфонилоксигруппу, с производным пиридина общей формулы (III) где R4, R5 и R6 и Q соответствуют названным выше, в присутствии связывающего кислоту агента. 14. Способ получения соединений общей формулы (I), раскрытых в п.1, который включает реакцию соединения общей формулы (V) где R1, R2 и R3 соответствуют названным выше, с соединением общей формулы (VI) где R4, R5 и m соответствуют названным выше, a L является уходящей группой, в присутствии сильного основания. 15. Применение производных 3-алкилиндол-2-она общей формулы (I) по любому из пп.1-10 в качестве лекарства. 16. Способ получения фармацевтической композиции для лечения или профилактики нарушений центральной нервной системы, в частности, депрессии, тревожности, навязчивых состояний, панического расстройства, социальной фобии, шизофрении, расстройств настроения, мании, ухудшения умственных способностей, удара, гибели клеток в определенных участках центральной нервной системы, нейродегенерации с последующим ухудшением умственных способностей, болезни Альцгеймера, деменции,посттравматических заболеваний, стресса, нарушений сердечно-сосудистой системы, в частности, гипертензии, который включает смешивание по меньшей мере одного соединения общей формулы (I) по любому из пп.1-10 или его фармацевтически приемлемой соли присоединения кислоты с фармацевтическим носителем и, возможно, другим вспомогательным веществом и превращение смеси в галенову форму. 17. Применение соединений общей формулы (I) или их фармацевтически приемлемых солей присоединения кислоты для производства лекарств, пригодных для лечения или профилактики нарушений центральной нервной системы, в частности депрессии, тревожности, навязчивых состояний, панического расстройства, социальной фобии, шизофрении, расстройств настроения, мании, ухудшения умственных способностей, удара, гибели клеток в определенных участках центральной нервной системы, нейродегенерации с последующим ухудшением умственных способностей, болезни Альцгеймера, деменции, посттравматических заболеваний, стресса, нарушений сердечно-сосудистой системы, в частности гипертензии. 18. Способ лечения и профилактики нарушений центральной нервной системы, в частности депрессии, тревожности, навязчивых состояний, панического расстройства, социальной фобии, шизофрении,расстройств настроения, мании, ухудшения умственных способностей, удара, гибели клеток в определенных участках центральной нервной системы, нейродегенерации с последующим ухудшением умственных способностей, болезни Альцгеймера, деменции, посттравматических заболеваний, стресса, нарушений сердечно-сосудистой системы, в частности гипертензии, который включает введение пациенту,нуждающемуся в таком лечении, эффективной дозы фармацевтической композиции, содержащей по меньшей мере одно соединение общей формулы (I) или его фармацевтически приемлемую соль присоединения органической или неорганической кислоты.
МПК / Метки
МПК: A61K 31/40, A61P 25/00, C07D 209/34
Метки: алкилоксиндолов, производные, пиперазиновые
Код ссылки
<a href="https://eas.patents.su/15-11280-piperazinovye-proizvodnye-alkiloksindolov.html" rel="bookmark" title="База патентов Евразийского Союза">Пиперазиновые производные алкилоксиндолов</a>
Предыдущий патент: (4-метокси-7-морфолин-4-илбензотиазол-2-ил)-амид 4-гидрокси-4-метилпиперидин-1-карбоновой кислоты
Следующий патент: Макролиды
Случайный патент: Производные индола и 2,3-дигидроиндола, их применение, фармацевтическая композиция и способ лечения












