Производное пиридопиразиндиона и его применение в качестве противоязвенного средства
Номер патента: 22895
Опубликовано: 31.03.2016
Авторы: Паршин Валерий Александрович, Калинкина Марина Алексеевна, Граник Владимир Григорьевич, Любчанская Валерия Марковна
Формула / Реферат
1. Соединение, представляющее собой 9-(хинонил-2)-2-п-этоксифенилэтил-4,5,6,7,8,9,10,11-октагидропиридо[1,2-а]пиразиндион-1,4 формулы (I)
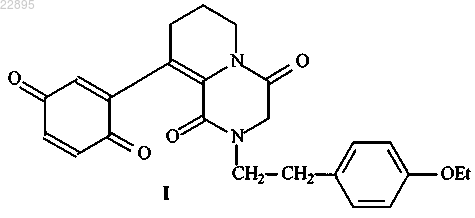
2. Применение соединения, представляющего собой 9-(хинонил-2)-2-п-этоксифенилэтил-4,5,6,7,8,9,10,11-октагидропиридо[1,2-а]пиразиндион-1,4 формулы (I)
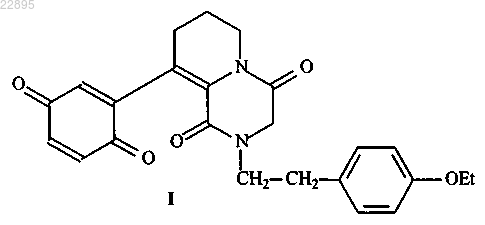
в качестве обратимого ингибитора Н,K-АТФазы.
3. Применение по п.2 в качестве антисекреторного средства для подавления секреции соляной кислоты в желудке.
4. Применение по п.2 в качестве гастропротекторного средства.
5. Применение по п.2 для лечения кислотозависимых заболеваний желудочно-кишечного тракта.
6. Применение по любому из пп.2-5 в качестве противоязвенного средства.
Текст
Изобретение относится к области химико-фармацевтической промышленности и медицины и касается нового соединения, которое может найти применение в качестве противоязвенного препарата. Соединение представляет собой 9-(хинонил-2)-2-п-этоксифенилэтил-4,5,6,7,8,9,10,11 октагидропиридо[1,2-а]пиразиндион-1,4 формулы (I). Соединение может быть применено в качестве противоязвенного средства. Область техники, к которой относится изобретение Изобретение относится к области химико-фармацевтической промышленности и медицины и касается нового соединения, которое может найти применение в качестве противоязвенного препарата. Предшествующий уровень техники Заболевания органов пищеварения всегда находились в центре внимания врачей по причине своей значительной распространенности. Из большого числа болезней данной группы особое социальное и медицинское значение имеет язвенная болезнь желудка и двенадцатиперстной кишки, поскольку по частоте она превышает всю другую патологию желудочно-кишечного тракта. Лечебные мероприятия при язвенной болезни направляют на снижение повреждающего воздействия желудочного сока (антисекреторные препараты) в отношении окружающих тканей; повышение резистентности подвергающихся его воздействию тканей, в первую очередь, слизистой желудка (гастропротекторные средства) и антимикробная терапия, направленная на уничтожение микроорганизмов Helicobacter Pylori. Основа лечения ЯБ - курсовая или поддерживающая терапия антисекреторными препаратами, это ингибиторы протонного насоса, блокаторы Н 2-рецепторов гистамина, антацидные препараты, препараты висмута (висмута субсалицилат/субцитрат), сукральфат (комбинация гидроокиси алюминия и сахарного октасульфата). При этом некогда популярные препараты 80-х годов блокаторы Н 2-гистаминовых рецепторов в значительной мере уступили место более эффективным антисекреторным средствам - ингибиторам протонной помпы (ИПП). Блокаторы протонного насоса впервые были синтезированы в 1976 г. Ими оказались два вещества тимопразол и омепразол. Тимопразол не нашел широкого применения, а омепразол получил широкое распространение. Именно он был официально рекомендован для клинического применения в 1988 г. на Всемирном конгрессе гастроэнтерологов в Риме. Одной из причин такого признания омепразола стало подтверждение его высокой эффективности в уничтожении бактерии Helicobacter pylori (HP), открытие которой в 1983 г. заставило пересмотреть взгляды на природу гастродуоденальных заболеваний. Значимость хеликобактерной инфекции приобрела огромное значение еще и потому, что эксперты ВОЗ после анализа результатов многочисленных исследований признали ее канцерогенной для человека. В связи с этим чрезвычайную актуальность приобретают вопросы эрадикации -уничтожения Helicobacter pylori в слизистой оболочке желудка с целью обеспечить благоприятные условия для заживления язв. Несмотря на всеобщее признание омепразола как первого эффективного представителя ИПП, поиски в направлении его совершенствования продолжались. И в 1992 г. специалисты японской фирмы Такеда синтезировали ИПП нового поколения - лансопразол. Спустя несколько лет в арсенале врачей всего мира появились ИПП следующих генераций: пантопразол, рабепразол, эзомепразол. Таким образом, ИПП (ингибиторы протонной помпы) - наиболее часто используемые препараты для лечения язвы желудка и двенадцатиперстной кишки в настоящее время во всем мире. ИПП используются для лечения ЯБ чуть больше 15 лет, поэтому еще не в полной мере известно о том, насколько они безопасны. Опасные побочные эффекты или представляющие угрозу для жизни пациента взаимодействия нового препарата с другими лекарственными средствами могут не быть выявлены до тех пор, пока не будет накоплен достаточный опыт применения - речь может идти о сотнях тысяч случаев использования. Однако уже и сейчас появляются сведения о негативном воздействии препаратов этого типа (в основном омепразола) на печень при применении у детей [1]. В клинике также отмечены такие побочные эффекты при применении ИПП, как диарея, тошнота, абдоминальная колика, сонливость, головная боль. При длительном применении омепразола и других ингибиторов протонной помпы (также как и при применении некоторых других антисекреторных препаратов) возможно стойкое и глубокое угнетение кислой желудочной секреции, а в некоторых случаях атрофии секреторных клеток желудка, что приводит к серьезным осложнениям (развитие новообразований типа гастриномы, аденокарциомы, обсеменение Helicobacter Pylori, кишечные инфекции, расстройство всасывания кишечником жиров, минералов и витаминов). Наряду с этим, надо учитывать, что метаболизм ИПП происходит с участием цитохром Р 450 - оксидазной системы, поэтому при длительном применении ИПП может развиться толерантность к данным препаратам при истощении активности данной ферментной системы [3]. С этим возможно связан синдром отмены препарата - рецидивы заболевания отмечены в разные сроки (от 2 до 22 недель) в среднем 14 недель после отмены омепразола [4]. Наблюдаются и другие побочные и нежелательные эффекты препаратов этого класса, которые в частности указаны в инструкции по применению препаратов (головная боль, диарея, аллергические реакции, гинекомастия и др.). Таким образом, ИПП являются эффективными препаратами, получившими широкое распространение для лечения ЯБ, однако необходимо учитывать их побочные эффекты и неблагоприятные последствия (наиболее опасные, вплоть до смертельных исходов - это инфицирование Helicobacter pylori и развитие опухолей желудка), а также определенный процент случаев, когда они оказываются не активными при лечении. Поэтому поиск новых противоязвенных средств является важной и актуальной задачей. Наиболее перспективным направлением в создании новых противоязвенных препаратов является получение препарата с гастропротекторными свойствами, так как в этом случае не происходит "жесткого" подавления желудочной секреции. Последнее приводит к основным неблагоприятным событиям обсеменению желудка Helicobacter pylori и развитию онкологических процессов. В ряде случаев такое подавление желудочной секреции и не нужно при сохранении нормальной секреции или вообще пониженной, что часто встречается при язвенной болезни. Просто достаточно "защитить" слизистую оболочку желудка от ее раздражающего действия, чтобы поврежденная слизистая желудка не разъедалась кислотой, а была защищена от нее. Такие препараты созданы на основе простагландинов. Положительными свойствами простагландинов при лечении язвы желудка является их способность активировать протеинкиназу, которая, воздействуя на клеточные мембраны, может защищать слизистую оболочку желудка от агрессивного влияния кислоты и пепсина, а также стимуляция ими секреции слизи. С другой стороны, простагландины обладают антисекреторной активностью в отношении желудочного сока. Такое сочетание противоязвенных эффектов делает простагландины очень привлекательными в качестве лекарственных средств, однако опыт применения этих препаратов относительно невелик, только на уровне клинических испытаний [5]. Перспективным направлением является создание гастропротекторых препаратов - доноров NO. Оксид азота действует как многофункциональный гастропротекторный медиатор, влияющий на ряд аспектов физиологии желудочно-кишечного тракта (ЖКТ), включая секрецию слизи и бикарбоната, ток крови в стенках ЖКТ [6]. Кроме того, известны противомикробные свойства NO, в частности в отношении бактерий Helicobacter pylori [7]. Прямым антисекреторным действием доноры NO не обладают, но бикарбонат, секретируемый в желудке под действием доноров оксида азота, взаимодействует с соляной кислотой и таким образом нейтрализует ее. В качестве противоязвенных средств используются также вещества, блокирующие секрецию соляной кислоты: это блокаторы Н 2-рецепторов (фамотидин, ранитидин, циметидин) и ингибиторы протонного насоса. Блокаторы H2-рецепторов имеют ряд недостатков по сравнению с ингибиторами протонного насоса: во-первых, блокируется только сигнал, возникающий при связывании гистамина, во-вторых, их действие обратимо, и они быстро элиминируются из кровеносного русла, поэтому пациент должен пить несколько таблеток в день. И, наконец, их применение приводит к усилению синтеза рецепторов для гистамина, в результате чего после отмены Н 2-блолкаторов наблюдается рикошетная вспышка секрецииHCl. Из ингибиторов протонного насоса первым на рынке в 80-е годы появился омепразол (фирма "Астра-Зенека"), который представляет собой замещенный бензимидазол. Ингибиторы протонного насоса,имеющиеся на рынке в настоящее время, также относятся к замещенным бензимидазолам. Это нексиум(очищенный S-изомер омепразола или эзомепразол, фирма "Астра Зенека"), многочисленные генерики омепразола, париет (рабепразол, фирма "Янсен Силаг") и контролок (пантопразол, фирма Бик Гульден,последний в России отсутствует). Все эти соединения представляют собой пролекарства. Они являются слабыми основаниями, которые при попадании в кислую среду париетальных канальцев связывают Н+ и претерпевают внутримолекулярную перестройку, приводящую к их превращению в собственно лекарство, активный сульфенамид, взаимодействующий с SH-группами Н,K-АТФазы, экспонированными в полость секреторного канальца. Сульфенамиды образуют ковалентную связь с SH-группами, вследствие чего их действие необратимо. Их эффект устраняется только после элиминации молекулы Н,K-АТФазы,модифицированной ингибитором, а время полужизни Н,K-АТФазы человека составляет около 40 ч. Именно по этой причине применение необратимых ингибиторов протонного насоса второго поколения,таких как париет и нексиум, обеспечивает очень высокую эффективность лечения кислотозависимых заболеваний. При лечении язвенной болезни этими ингибиторами в сочетании с антибиотиками, устраняющими инфекцию Helicobacter pylori, эффективность составляет более 90% [20]. Кроме необратимых ингибиторов протонного насоса известны также обратимые ингибиторы, лекарства, на основе которых до настоящего времени не выпускаются. По-видимому, это связано с очень высокой эффективностью и безопасностью действия лекарств на основе необратимых ингибиторов протонного насоса. Среди обратимых ингибиторов протонного насоса наиболее известен имидозопиридин SCH-28080,который ингибирует Н,K-АТФазу конкурентным по отношению к K+ способом с Ki (константой ингибирования) в ряду 0,2-0,24 мкМ [21]. Аналоги SCH-28080 взаимодействуют с фрагментом -субъединицы Н,K-АТФазы длиной в 44 аминокислотных остатка, начинающимся с Leu-854 и заканчивающимся Arg897. Этот фрагмент гомологичен подобному у Н,K-АТФазы, которую SCH-28080 также ингибирует, но с меньшим сродством. По-видимому, он представляет собой K-связывающий центр этих родственных ферментов. Помимо SCH-28080 известен более специфичный ингибитор SKF, который ингибирует только Н,K-АТФазу с 0,5 мкМ и конкурирует с SCH-28080 и K+, а также SKF 96356, ингибирующий Н,K-АТФазу с Ki=0,07 мкМ, который также конкурирует с SCH-28080 и K+. Препарат SCH 28080, имеющий формулу может быть указан в качестве наиболее близкого аналога [19]. Соединение является эффективным, однако возможно конкурирующее действие по отношению к ионам K, что может привести к неблагоприятным побочным эффектам. Сущность изобретения Задачей изобретения является создание соединения, обладающего эффективной противоязвенной активностью и не имеющего побочных действий, которыми обладают известные средства. Задача решается синтезом нового соединения, представляющего собой производное пиридопиразиндионов. Согласно изобретению предлагается соединение 9-(хинонил-2)-2-п-этоксифенилэтил 4,5,6,7,8,9,10,11-октагидропиридо[1,2-а]пиразиндион-1,4 формулы (I) Подробное описание изобретения Синтез целевого соединения I. Исходным для синтеза является производное хромена (II), которое под действием хлорацетилхлорида превращено в соответствующее хлорацетильное производное (III). Действие на последнее(п-этоксифенил)этиламина привело к раскрытию пиранового цикла, образованию пиперазиндионового кольца. Последующее окисление гидрохинонового фрагмента в промежуточном (IV) привело к целевому соединению I (получение хромена (II) описано нами в работе В.М. Любчанская, Л.М. Алексеева, С.А. Савина, А.С. Шашков, В.Г. Граник, Изв. АН, сер. хим., 2002,10, стр. 1736-1743). Получение III. К суспензии 4,23 г (19 ммоль) хромена (II) в 35 мл толуола добавляют при перемешивании 7,7 мл(95 ммоль) хлорацетилхлорида, кипятят 1 ч, охлаждают, отфильтровывают 5,47 г (III) (98%), т.пл. 159162 С (спирт). Спектр 1 Н ЯМР (d6 ДМСО)м.д.: 2,01 (кв., 2 Н), 2,89 (т., 2 Н), 3,71 (уш с., 2 Н), 4,38 (с.,2 Н), 7,03 (м, 2 Н), 7,26 (д., 1 Н), 9,60 (с., 1 Н). Получение IV. К раствору 0,88 г (3 ммоль) III в 6 мл ДМФА прибавляют 12 ммоль(п-этоксифенил)этиламина,перемешивают 10 ч при 20 С, разбавляют водой, отфильтровывают 1 г IV, выход 93%, т.пл. 169-171 С(ацетонитрил). Получение I. К суспензии 1 ммоль IV в 10 мл хлороформа прибавляют раствор 0,14 г бикарбоната натрия в 2,5 мл воды и окисляющую смесь из 0,6 г K3[Fe(CN)6], 0,14 г NaHCO3 и 0,18 г поташа 6 мл воды. Смесь перемешивают 1 ч при 20 С, органический слой отделяют и упаривают, остаток растирают с эфиром, получают 85% I, т.пл.137-140 С. Найдено: С 68.36, Н 6.12, N 6.57. C24H24N2O4. Вычислено: С 68.56, Н 5.75, N 6.66. Спектр 1 Н ЯМР (ДМСО-d6,м.д.): 1.32, 4.25 (тр., кв., 3 Н, СН 3 СН 2, J=7,5 Гц), 1.86 (к, 2 Н, 7-СН 2,J=7,5 Гц), 2.34 (уш.с, 2 Н, 8-СН 2), 2,68 и 3.40 (оба т., по 2 Н, 2-СН 2 СН 2, J=7,2 Гц), 4.04 (с, 2 Н, 3-СН 2), 6.68 Новое соединение обладает антисекреторной и гастропротекторной активностью. Пример 1. Исследование противоязвенной активности соединения I изучали на следующих моделях. 1.1. Повреждения слизистой оболочки желудка у мышей, вызванные введением 0,6 Н соляной кислотой и индометацином [13]. Мышей-самцов массой 23-24 г лишали пищи в течение 24 ч, доступ к воде не ограничивали. Исследуемое соединение в дозах 25, 50 и 100 мг/кг вводили зондом в желудок за 1, 3 и 6 ч до введения 0,6 Н соляной кислоты (5 мл/кг) и индометацина (20 мг/кг), еще через 1 ч животных забивали, извлекали желудки и подсчитывали число язв. В качестве препаратов сравнения применяли фамотидин в дозах 25 и 50 мг/кг внутрь и омепразол в дозе 50 мг/кг внутрь. 1.2. Повреждение слизистой оболочки у мышей, вызванные введением абсолютного этанола [14]. Мышей-самцов массой 20-23 г лишали пищи за 24 ч до опыта и за 18 ч до опыта ограничивали доступ к воде. Исследуемое соединение в дозах 25, 50 и 100 мг/кг вводили зондом в желудок за 1,3 и 6 ч до введения абсолютного этанола (0,3 мл), еще через 1 ч животных забивали, извлекали желудки и измеряли длину поврежденных участков слизистой оболочки в миллиметрах. В опытах использовали контроль - животных, не получавших исследуемое соединение, а только по 0,3 мл физиологического раствора. В качестве препаратов сравнения применяли фамотидин в дозах 25 и 50 мг/кг внутрь и омепразол в дозе 50 мг/кг внутрь. 1.3. Повреждения слизистой оболочки желудка у крыс, вызванные введением соединения 48/80[15]. Исследуемое соединение в дозе 25 и 100 мг/кг вводили зондом в желудок за 1 и 6 ч до внутрибрюшинного введения соединения 48/80, развитие повреждений слизистой оболочки желудка наблюдали через 3 ч после введения соединения 48/80. Животных забивали, извлекали желудки и измеряли длину поврежденных участков слизистой оболочки в миллиметрах. В качестве препаратов сравнения применяли фамотидин в дозах 25 и 50 мг/кг внутрь и омепразол в дозе 50 мг/кг внутрь. 1.4. Хроническая язва желудка, вызванная введением крысам 0,025 мл 20% уксусной кислоты [16]. Хроническую язву желудка у крыс вызывали введением 0,025 мл 20% уксусной кислоты под серозную оболочку желудка на границе фундального и антрального отделов. Через сутки после операции исследуемое соединение (в дозе 50 мг/кг) и препараты сравнения (омепразол 50 мг/кг и фамотидин 50 мг/кг) вводили зондом в желудок один раз в день в течение 21 дня. Каждые 7 дней по 6 животных из контрольной и подопытных групп забивали и определяли площадь язвенного дефекта желудка в мм 2. Пример 2. Исследование антисекреторной активности. 2.1. Изучение базальной секреции у крыс под влиянием исследуемых веществ [17]. Исследование проводили на крысах-самцах массой 180-200 г. Животных лишали пищи в течение 24 ч, воду не ограничивали. Под эфирным наркозом вскрывали брюшную полость и накладывали лигатуру на пилорический отдел желудка. Через 4 ч после операции исследовали желудочное содержимое; определяли объем секреции в расчете на 100 г массы тела животного, рН желудочного сока, свободную соляную кислоту и общую кислотность желудочного сока. Исследуемое соединение вводили внутрь при дозе 100 мг/кг в виде водной взвеси с добавлением твин-80 за 60 минут до перевязки пилоруса. Контрольным животным вводили дистиллированную воду с добавлением твин-80. В качестве препаратов сравнения применяли фамотидин в дозах 25 и 50 мг/кг внутрь и омепразол в дозе 50 мг/кг внутрь. 2.2. Изучение секреции желудка, стимулированной гистамином, пентагастрином и 1-аминопиреном. Исследование проводили на крысах-самцах массой 180-200 г. Животных лишали пищи в течение 24 ч, воду не ограничивали. Перед наложением лигатур на пилорический отдел желудка, крысам вводили подкожно гистамин (2,5 мг/кг), другой группе животных пентагастрин 10 мг/кг подкожно и третей группе животных 1-аминопирен 1 мг/кг. Исследуемое соединение вводили внутрь при дозе 100 мг/кг в виде водной взвеси с добавлением твин-80 за 1 и 3 ч до перевязки пилоруса. Контрольным животным вводили дистиллированную воду с добавлением твин-80. В качестве препаратов сравнения применяли фамотидин в дозах 25 и 50 мг/кг внутрь и омепразол в дозе 50 мг/кг внутрь. Через 4 ч после операции исследовали желудочное содержимое; определяли объем секреции в расчете на 100 г массы тела животного, рН желудочного сока, свободную соляную кислоту и общую кислотность желудочного сока. Пример 3. Исследование моторно-двигательной активности. 3.1. Исследование пропульсивной активности кишечника [18]. Исследуемые соединения вводили мышам-самцам массой 22-24 г зондом в желудок за 60 мин до введения активированного угля (0,3 мл 10% суспензии в желудок). Через 2 ч животных забивали с помощью CO2 и измеряли длину участка тонкого кишечника (в см), заполненного активированным углем. Контрольным животным вводили внутрь по 0,3 мл воды, препаратом сравнения был церукал в дозе 25 мг/кг внутрь. Пример 4. Определение токсичности (ЛД 50) исследуемых веществ при однократном введении [19]. Результаты исследования. 1. Показано, что изученные производные пиперазиндиона обладают гастропротекторным действием в отношении язв желудка, вызванных введением абсолютного этанола, введением вольтарена и язвы же-4 022895 лудка, вызванной введением соединения 48/80; а также оказывают противоязвенное действие, способствуя заживлению язвенного дефекта на модели хронической уксусной язвы желудка. Их эффективность выше, чем у фамотидина и равна омепразолу. По длительности эффекта изученные соединения также равны омепразолу и фамотидину, пролонгированным действием они не обладают. 2. При изучении антисекреторной активности показано, что омепразол блокирует базальную секрецию на 25% через 1 ч после его введения и на 40% через 3 ч; фамотидин: через 1 ч на 56% и через 3 ч на 80%. Изучаемое новое соединение не подавляет базальную кислотную желудочную секрецию, что принципиально отличает их от известных противоязвенных средств (блокаторов Н 2-рецепторов, ингибиторов протонной помпы). Таким образом, фамотидин сильно блокирует базальную секрецию, омепразол - умеренно блокирует базальную желудочную секрецию. Изученное новое соединение не подавляют базальный уровень желудочной секреции. 3. При изучении стимулированной секреции желудочного сока показано, что омепразол блокирует секрецию, стимулированную гистамином на 70% через 1 ч после его введения и на 80% через 3 ч; стимулированную пентагастрином также в среднем на 90% и стимулированную 1-аминопиреном на 90%. Фамотидин блокирует стимулированную гистамином секрецию на 90% через 1 ч после его введения и на 95% через 3 ч; стимулированную пентагастрином в среднем на 40% и стимулированную 1 аминопиреном через 1 ч на 36% и через 3 ч на 40%. Новое соединение блокирует секрецию, стимулированную гистамином, на 40% через 1 ч после его введения и на 57% через 3 ч; стимулированную пентагастрином также в среднем на 54% и стимулированную 1-аминопиреном на 50%. Таким образом, омепразол блокирует секрецию желудочного сока, стимулированную всеми тремя соединениями (гистамином, пентагастрином, 1-аминопиреном), фамотидин блокирует только секрецию,стимулированную гистамином, и слабо другими соединениями (пентагастрином и 1-аминопиреном),изученное соединение блокирует все три вида стимулированной секреции (так же как и омепразол), но более умерено. 4. При изучении моторно-двигательной активности желудка показано, что омепразол замедляет моторно-двигательную работу кишечника в среднем на 35%, фамотидин не влияет на моторнодвигательную активность кишечника, новое исследованное соединение также не влияет на моторнодвигательную активность кишечника. Таким образом, влияние на моторно-двигательную активность кишечника оказывает только омепразол. Данное свойство препарата, особенно при его длительном применении, может отрицательно сказаться на основном противоязвенном эффекте, так как при замедлении моторно-двигательной активности желудка и кишечника содержимое желудка оказывает дополнительное раздражающее действие на язвенный дефект. При изучении общей токсичности показано, что новое соединение и его соли малотоксичны, так же как и омепразол. При сравнении ЛД 50 омепразола, фамотридина и изученных соединений показано, что новые соединения менее токсичны по сравнению с фамотидином и омепразолом. Пример 5. Проверка действия соединения I на ферментативную активность Н,K-АТРазы из слизистой оболочки желудка кролика, при исследовании обратимости этого действия и оценке эффекта этого соединения в присутствии ионов K+. Препарат микросом, обогащенный активностью Н,K-АТРазы, был получен по методу, предложенному R.A. Farley и L.D. Faller. Слизистую оболочку желудка получали из кролика, которого предварительно подвергали декапитации. Все операции проводили на льду. Желудок разрезали по линии наибольшей кривизны, промывали и соскребали со стенок желудка слизистую оболочку. Полученную слизистую замораживали и хранили при -80 С. Для выделения препарата микросом, обогащенных Н,K-АТРазой, слизистую желудка размораживали и гомогенизировали в среде выделения (0,25 М сахароза, 5 мМ PIPES, 20 мМ ТРИС, рН 7,4) гомогенизатором типа Polytron (макс. обороты, 30 с). Соотношение веса ткань:среда выделения 1:20. Далее гомогенат центрифугировали 10 мин при 10000 g. Осадок отбрасывали, а супернатант центрифугировали 1 ч при 100000 g. Полученный осадок ресуспендировали в среде выделения (в минимальном объеме, необходимом для ресуспендирования). Суспензию наслаивали на ступенчатый градиент Фикола 400, приготовленного на среде выделения: 12% раствор Фикола, 4% раствор Фикола. Далее центрифугировали 180 мин при 100000 g. После центрифугирования на границе 4% Фикола и 12% фикола видна белая полоса, которая представляет собой фракцию микросом, обогащенную Н,K-АТРазой. Фракцию собирали, разделяли на аликвоты и хранили при -80 С. Активность измеряли по нарастанию в среде неорганического фосфата, который образуется при гидролизе АТФ. Концентрацию неорганического фосфата измеряли по методу Ратбуна и Бетлах. Среда инкубации содержала: 30 мМ имидазол, рН 7,4, 3 мМ MgCl2, 130 мМ NaCl, 20 мМ KCl, 3 мМ АТР, 2 мМ уабаина, 0,1 мМ ЭГТА, 2,25 мкМ валиномицина, 5 мМ NaN3, 5 мкМ СССР (протонофор карбонилцианид м-хлорофенил гидразон). В инкубационную пробу вносили среду инкубации и размороженную, и гомогенизированную фракцию микросом. Пробу инкубировали при 37 С 20 мин и останавливали реакцию добавлением хо-5 022895 лодного стоп-раствора (3 М ацетат натрия, 3,7% формальдегид, рН 4,3). Для оценки содержания фосфата, получаемого при энзиматическом гидролизе АТР, в пробу добавляли 2% раствор молибдата аммония и раствор хлорида олова (3 мг/мл). После развития синей окраски через 15 мин пробы колориметрировали при длине волны 650 нм. Активность Н,K-АТРазы определяли как активность, ингибируемую 0,1 мМ SCH-28080. Подавляемая этим ингибитором активность Н,K-АТРазы составляла около 30%. Концентрация исследуемого соединения варьировали в диапазоне от 10-8 до 10-4 М. Результаты исследования. Соединение I оказывает ингибирующее действие на активность Н,K-АТРазы из слизистой оболочки желудка кролика с I50=10-6 М. Эффект соединения I на Н,K-АТРазу обратим, он развивается во времени мгновенно и устраняется при разведении комплекса фермент-ингибитор. Было исследовано, существует ли конкуренция между I и ионами калия. С этой целью исследована зависимость активности Н,K-АТФазы от концентрации KCl, а затем ингибирующее действие I на этот фермент при насыщающих (20 мМ) и ненасыщающих (2 мМ) концентрациях KCl. Установлено, что соединение I не конкурирует с ионами K+, напротив, эффект соединения I на активность Н,K-АТРазы из слизистой оболочки желудка кролика усиливался под действием ионов K+: значение I50 составило 10-5 М при 2 мМ KCl и 10-6 М при 20 мМ KCl. Выводы. 1. Вещество I обратимо ингибирует гидролитическую активность Н,K-АТРазы, значение I50 составляет 10-6 М при 20 мМ KCl. 2. Ингибиторная способность вещества I усиливается при повышении концентрации K+. ЗначениеI50 снижается от 10-5 М при 2 мМ KCl до 10-6 М при 20 мМ KCl. Такое свойство вещества I возможно дает преимущество при его использовании в живых системах. Полученные результаты свидетельствуют, что соединение I является эффективным обратимым ингибитором Н,K-АТФазы. Однако в отличие от известного обратимого ингибитора SCH-28080 действие I не является конкурентным по отношению к калию. По-видимому, I не связывается в K-связывающем центре фермента. Более того, K+ усиливает ингибирующее действие I. Это может оказаться важным вне зависимости от того, со стороны цитоплазмы или со стороны секреторного канальца действует ингибитор, так как концентрация K+ может достигать высоких значений и в секреторном канальце, который непосредственно связан с полостью желудка. Таким образом, соединение I является новым неизвестным ранее типом обратимых ингибиторов Н,K-АТФазы, действие которых неконкурентно по отношению кin the rat"//Gastroenterology, 1945, N 5, P. 43-61. 18. Janssen P., Jageneau A. "Research papers a new series of potent analgesics: dextro 2;2;diphenyl-3methyl-4-morpholino-butyryl-pyrrolidine and related amides"//J. Pharm. Pharmacol., 1957, v. 9, P. 381-399. 19. Беленький М.Л. Элементы количественной оценки фармакологического эффекта. Ленинград,1963. 20. Kaminski J., et al. Antiulcer agents. 5. Inhibition of gastric H+/K(+)-ATPase by substituted imidazo[l,2a]pyridines and related analogues and its implication in modeling the high affinity potassium ion binding site of в качестве обратимого ингибитора Н,K-АТФазы. 3. Применение по п.2 в качестве антисекреторного средства для подавления секреции соляной кислоты в желудке. 4. Применение по п.2 в качестве гастропротекторного средства. 5. Применение по п.2 для лечения кислотозависимых заболеваний желудочно-кишечного тракта. 6. Применение по любому из пп.2-5 в качестве противоязвенного средства.
МПК / Метки
МПК: C07D 471/04, A61P 1/00, A61K 31/4985
Метки: пиридопиразиндиона, средства, качестве, применение, производное, противоязвенного
Код ссылки
<a href="https://eas.patents.su/8-22895-proizvodnoe-piridopirazindiona-i-ego-primenenie-v-kachestve-protivoyazvennogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Производное пиридопиразиндиона и его применение в качестве противоязвенного средства</a>
Предыдущий патент: Способ и устройство для производства лопающихся леденцов
Следующий патент: Способ получения f-18 меченых aβ лигандов
Случайный патент: Внутренняя оболочка шины, шина, включающая данную внутреннюю оболочку, и способ получения композиции для внутренней оболочки шины












