Новые хинолиновые производные
Формула / Реферат
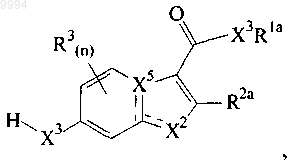
1. Соединение, имеющее структуру формулы (I)
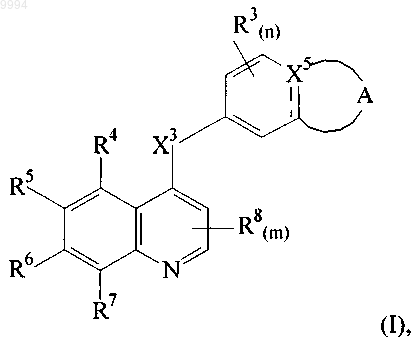
где
линия ----- в формуле (I) указывает на возможную связь;

представляет собой
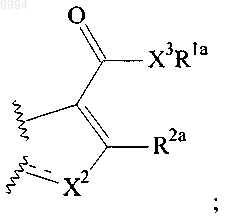
где линия ----- указывает на возможную связь;
X2 представляет собой О, S или NR9, когда ----- не является связью, или X2 представляет собой N или СН, когда ----- представляет собой связь;
R9 представляет собой Н или -CH3;
Rla выбран из группы, состоящей из Н, -(CR10R11)jCN, (CR10R11)j-(С3-С8)циклоалкила, -(CR10R11)j-(С5-С8)циклоалкенила, (С2-C6)алкенила, (С2-С6)алкинила, -(CR10R11)j-арила, -(CR10R11)j-гетероциклила и (С1-С8)алкила, и где атомы С в Rla могут быть возможно замещены 1-3 независимо выбранными группами R12;
R2a выбран из группы, состоящей из Н, -CH3, -CF3, -CN, -CH2CH3, -OCH3 и -OCF3;
R3 и R8 независимо представляют собой F;
X3 представляет собой О или NH;
X5 представляет собой С, когда ----- в формуле (I) представляет собой связь, или представляет собой СН или N, когда ----- в формуле (I) не является связью;
R4 и R7 независимо выбраны из Н, галогена, -CH3 и CF3;
R5 и R6 независимо выбраны из группы, состоящей из Н, галогена, -CF3, -N3, -NO2, -ОН, -NH2,
-OCF3, -X4(CR10R11)jCN, -X4(CR10R11)j-(С3-С8)циклоалкила, -X4(CR10R11)j-(С5-С8)циклоалкенила, -Х4(С2-С6)алкенила, -Х4(С2-С6)алкинила, -X4(CR10R11)j-арила, -X4(CR10R11)j-гетероциклила, гетероциклила и
-Х4(С1-С8)алкила, и где атомы С и N в R5 и R6 могут быть возможно замещены 1 -3 независимо выбранными группами R13, или где R5 и R6, взятые вместе, могут образовывать циклическую группировку, выбранную из группы, состоящей из 4-10-членного карбоциклила и 4-12-членного гетероциклила, возможно замещенного 1-3 независимо выбранными группами R13;
X4 выбран из группы, состоящей из связи, О, NH, -С(О)-, -NHC(O)-, -ОС(О)-, -С(O)O-, -C(O)NH- и S;
каждый из R10 и R11 независимо выбран из группы, состоящей из Н, F и (С1-C6)алкила, или R10 и R11, взятые вместе, могут образовывать карбоциклил, или две группы R10, присоединенные к соседним атомам углерода, могут быть выбраны вместе с образованием карбоциклила;
каждый из R12 и R13 независимо выбран из группы, состоящей из галогена, циано, нитро, тетразолила, гуанидино, амидино, метилгуанидино, азидо, -C(O)R14, -С(О), -CF3, -CF2CF3, -CH(CF3)2, -C(OH)(CF3)2, -OCF3, -OCF2H, -OCF2CF3, -OC(O)NH2, -OC(O)NHR14, -OC(O)NR14R15, -NHC(O)R14, -NHC(O)NH2,
-NHC(O)NHR14, -NHC(O)NR14R15, -C(O)OH, -C(O)OR14, -C(O)NH2, -C(O)NHR14, -C(O)NRl4R15, -P(O)3H2,
-P(O)3(R14)2, -S(O)3H, -S(O)mR14, -R14, -OR14, -OH, -NH2, -NH, -NHR14, -NR14, -NR14R15, -C(=NH)NH2,
-C(=NOH)NH2, -N-морфолино, (С2-C6)алкила, где любой из атомов С может быть возможно замещен атомом О, (С2-C6)алкенила, (С2-C6)алкинила, (С1-C6)галогеноалкила, (С2-C6)галогеноалкенила, (С2-C6)галогеноалкинила, (С1-С6)галогеноалкокси, -(CR16R17)rNH2, -(CR16R17)rNHR14, -CNR,4R15,
-(CR16R17)rNR14R15 и -S(O)m(CF2)qCF3;
или любые две группы R12 или любые две группы R13, присоединенные к соседним атомам углерода, могут быть выбраны вместе так, чтобы представлять собой -O[C(R16)(R17)]rO- или -O[C(Rl6)(R17)]r+1-;
или любые две группы R12, или любые две группы R13, присоединенные к одному и тому же или к соседним атомам углерода, могут быть выбраны вместе с образованием карбоциклила или гетероциклила;
каждый из R14 и R15 независимо выбран из группы, состоящей из (С1-С12)алкила, (С3-С8)циклоалкила, (C6-С14)арила, 4-12-членного гетероциклила, -(CR10R11)j-(С6-С10)арила и -(CR10R11)j-(4-12-членный гетероциклил);
каждый из R16 и R17 независимо выбран из группы, состоящей из водорода, (С1-С12)алкила, (C6-С14) арила, 4-12-членного гетероциклила, -(CR10R11)j-(C6-C10)арила и -(CR10R11)j-(4-12-членный гетероциклил);
и где любой из вышеупомянутых заместителей, содержащих группу CH3 (метил), СН2 (метилен) или СН (метин), которая не присоединена к галогену, группе SO или SO2, или к атому N, О или S, возможно имеет на указанной группе заместитель, выбранный из группы, состоящей из гидрокси, галогена, (С1-С4) алкила, (С1-С4)алкокси и -N[(С1-С4)алкил][(С1-С4)алкил];
и где j равно 0, 1, 2 или 3, и когда j равно 2 или 3, каждая группа CR10R11 может быть одинаковой или разной;
и где n равно 0, 1, 2 или 3, и m равно 0, 1 или 2;
и где q представляет собой целое число от 0 до 5, и r представляет собой целое число от 1 до 4;
и где арил представляет собой фенил или нафтил;
гетероциклил относится к ароматическим и неароматическим гетероциклическим группам, содержащим от одного до четырех гетероатомов, каждый выбранный из О, S и N, где каждая гетероциклическая группа имеет от 4 до 10 атомов в своей кольцевой системе, и при условии, что кольцо указанной группы не содержит два соседних атома О или S;
или его фармацевтически приемлемый сольват или фармацевтически приемлемая соль.
2. Соединение по п.1, где R2a представляет собой CH3.
3. Соединение по п.1, где R4, R5 и R7 представляют собой Н; R2a представляет собой CH3; и n и m оба равны 0.
4. Соединение по п.3, где X2 представляет собой любой из О, N или S.
5. Соединение по п.4, где R6 представляет собой -X4(CR10R11)j-гетероциклил и X4 представляет собой связь или О.
6. Соединение по п.1, выбранное из группы, состоящей из
6-[(7-иодхинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,
N-2-диметил-6-[(7-пиридин-4-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,
N-2-диметил-6-[(7-пиридин-3-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,
N-2-диметил-6-[(7-пиридин-2-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,
N-2-диметил-6-[(7-пиридин-4-илхинолин-4-ил)окси]-1-бензотиофен-3-карбоксамида,
6-{[7-(2-фурил)хинолин-4-ил]окси}-N,2-диметил-1-бензофуран-3-карбоксамида,
N-2-диметил-6-[(7-пиридин-3-илхинолин-4-ил)окси]-1-бензотиофен-3-карбоксамида,
6-[(7-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил}хинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,
6-[(7-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил}хинолин-4-ил)окси]-N,2-диметил-1-бензотиофен-3-карбоксамида,
N,2-диметил-6-[(7-пиримидин-2-илхинолин-4-ил)окси]-1-бензотиофен-3-карбоксамида,
N,2-диметил-6-[(7-пиримидин-2-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,
6-[(7-бромхинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,
6-[(7-бромхинолин-4-ил)окси]-N,2-диметил-1-бензотиофен-3-карбоксамида,
6-[(6-иодхинолин-4-ил)окси]-N,2-диметил-1-бензотиофен-3-карбоксамида,
6-[(6-иодхинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,
N,2-диметил-6-[(6-пиридин-4-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,
6-[(6-метоксихинолин-4-ил)окси]-N,2-диметил-1-бензотиофен-3-карбоксамида,
6-[(6-гидроксихинолин-4-ил)окси]-N,2-диметил-1-бензотиофен-3-карбоксамида,
N,2-диметил-6-({6-[2-(1-метилпирролидинил-2-ил)этокси]хинолин-4-ил}окси)-1-бензотиофен-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,
6-[(7-гидроксихинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,
N,2-диметил-6-{[(7-1,3-тиазол-2-ил)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N,2-диметил-6-{[(7-пиридин-2-ил)хинолин-4-ил]окси}-1-бензотиофен-3-карбоксамида,
N,2-диметил-6-{[7-(2-пиперидин-1-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N,2-диметил-6-{[7-(пиридин-2-илметокси)хинолин-4-ил]окси}-1-бензофуран-3 -карбоксамида,
N,2-диметил-6-{[7-(тиазол-2-илметокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N,2-диметил-6-{[7-(2-пирролидин-1-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N,2-диметил-6-{[7-(2-морфолин-4-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
6-({7-[2-(диметиламино)этокси]хинолин-4-ил}окси)-N,2-диметил-1-бензофуран-3-карбоксамида,
N-бутил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-пиридин-2-ил-1-бензофуран-3-карбоксамида,
N-бутил-6-[(7-гидроксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
6-{[7-(аллилокси)хинолин-4-ил]окси}-N,2-диметил-1 -бензофуран-3-карбоксамида,
N-изопропил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
N-бутил-2-метил-6-{[7-(2-пирролидин-1-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N-бутил-2-метил-6-{[7-(2-морфолин-4-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N-бутил-6-({7-[2-(диметиламино)этокси]хинолин-4-ил}окси)-2-метил-1-бензофуран-3-карбоксамида,
N-бутил-2-метил-6-{[7-(2-пиперидин-1-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N-циклопропил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
N-[2-(диметиламино)этил]-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
[(7-метоксихинолин-4-ил)окси]-2-метил-N-пропил-1-бензотиофен-3 -карбоксамида,
N-[3-(диметиламино)пропил]-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
N-циклогексил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
N-циклопентил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(пиридин-3-илметил)-1-бензотиофен-3-карбоксамида,
6-[(7-гидроксихинолин-4-ил)окси]-2-метил-N-пропил-1-бензотиофен-3-карбоксамида,
N-[2-(диметиламино)этил]-6-[(7-гидроксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
N-циклопентил-6-[(7-гидроксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
N-[3-(диметиламино)пропил]-6-[(7-гидроксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
6-[(7-гидроксихинолин-4-ил)окси]-2-метил-N-(пиридин-3-илметил)-1-бензотиофен-3-карбоксамида,
N,2-диметил-6-{[7-(трифторметил)хинолин-4-ил]окси}-1-бензотиофен-3-карбоксамида,
N,2-диметил-6-{[7-(трифторметил)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(3-морфолин-4-илпропил)-1-бензотиофен-3-карбоксамида,
N-циклопропил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(3-морфолин-4-илпропил)-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(пиридин-2-илметил)-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метилбензофуран-3-карбоновой кислоты (3-диметиламинопропил)амида,
N-(3-гидроксипропил)-6- [(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
N-(5-гидрокси-1H-пиразол-3-ил)-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
6-[(7-гидроксихинолин-4-ил)окси]-N-изопропил-2-метил-1-бензофуран-3-карбоксамида,
6-[(7-гидроксихинолии-4-ил)окси]-N-изопропил-2-метил-1-бензотиофен-3-карбоксамида,
N-изопропил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
[(7-метоксихинолин-4-ил)окси]-N,1,2-триметил-1H-индол-3-карбоксамида,
N-изопропил-2-метил-6-{[7-(трифторметокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-{[7-(трифторметокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N-бутил-2-метил-6-{[7-(трифторметокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-N,1,2-триметил-1Н-индол-3-карбоксамида,
N,1,2-триметил-6-{[7-(2-морфолин-4-илэтокси)хинолин-4-ил]окси}-1Н-индол-3-карбоксамида,
N,1,2-триметил-6-{[7-(2-пирролидин-1-илэтокси)хинолин-4-ил]окси}-1H-индол-3-карбоксамида,
N-(2-гидроксипропил)-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1 -бензотиофен-3-карбоксамида,
N-(2-гидроксибутил)-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
N-(3-гидроксибутил)-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,
N,1,2-триметил-6-{[7-(2-пиперидин-1-илэтокси)хинолин-4-ил]окси}-1H-индол-3-карбоксамида,
6-{[7-(1,3-диоксолан-2-илметокси)хинолин-4-ил]окси}-N,2-диметил-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-[(2R)-тетрагидрофуран-2-илметил]-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-[(2S)-тетрагидрофуран-2-илметил]-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-[этоксиэтил]-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-[2-метокси-1-метилэтил]-1-бензофуран-3-карбоксамида,
N-(2-метоксиэтил)-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-[(7-пиримидин-2-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-({7-[2-(метиламино)этокси]хинолин-4-ил}окси)-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-({7-[2-(диэтиламино)этокси]хинолин-4-ил}окси)-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-({7-[2-гидроксиэтокси]хинолин-4-ил}окси)-1-бензофуран-3-карбоксамида,
6-{[7-(2-бромэтокси)хинолин-4-ил]окси}-N-циклопропил-2-метил-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-{7-[2-(4-этилпиперазин-1-ил)этокси]хинолин-4-илокси}-1-бензофуран-3-карбоксамида,
N-циклопропил-6-({7-[2-(изопропиламино)этокси]хинолин-4-ил}окси)-2-метил-1-бензофуран-3-карбоксамида,
N-циклопропил-6-({7-[2-(циклопропиламино)этокси]хинолин-4-ил}окси)-2-метил-1-бензофуран-3-карбоксамида,
N-циклопропил-6-[(7-{2-[(2-метокси-1-метилэтил)амино]этокси}хинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
6-({7-[2-(трет-бутиламино)этокси]хинолин-4-ил}окси)циклопропил-2-метил-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-{[7-(2-морфолин-4-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
6-({7-[2-(циклобутиламино)этокси]хинолин-4-ил}окси)-N-циклопропил-2-метил-1-бензофуран-3-карбоксамида,
6-{[7-(бензилокси)хинолин-4-ил]окси}-N-(4,6-диметилпиридин-2-ил)-2-метил-1-бензофуран-3-карбоксамида,
N-(4,6-диметилпиридин-2-ил)-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
N-(4,6-диметилпиридин-2-ил)-6-[(7-гидроксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-{[7-(2-пирролидин-1-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-{[7-(2-пиперазин-1-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
N-циклопропил-6-({7-[2-(диметиламино)этокси]хинолин-4-ил}окси)-2-метил-1-бензофуран-3-карбоксамида,
6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-{6-[(3-метилбутил)амино]пиридин-3-ил}-1-бензофуран-3-карбоксамида,
7-[(7-гидроксихинолин-4-ил)окси]-N,2-диметилимидазо[1,2-a]пиридин-3-карбоксамида,
N,2-диметил-7-{[7-(2-морфолин-4-илэтокси)хинолин-4-ил]окси}имидазо[1,2-a]пиридин-3-карбоксамида,
N,2-диметил-6-({7-[(2-оксо-1,3-диоксолан-4-ил)метокси]хинолин-4-ил}окси)-1-бензофуран-3-карбоксамида,
6-гидрокси-N,2-диметил-1-бензофуран-3-карбоксамида,
N,2-диметил-6-[(6-пиридин-4-илхинолин-4-ил)окси]-1-бензотиофен-3-карбоксамида,
N-циклопропил-6-({7-[2-(этиламино)этокси]хинолин-4-ил}окси)-2-метил-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-{[7-(2-пиперидин-1-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
7-фтор-6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(6-морфолин-4-илпиридин-3-ил)-1-бензофуран-3-карбоксамида,
7-фтор-6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(3-морфолин-4-илпропил)-1-бензофуран-3-карбоксамида,
N-циклопропил-2-метил-6-{[7-(2-пиперазин-1-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
6-{[7-(2,3-дигидроксипропокси)хинолин-4-ил]окси}-N,2-диметил-1-бензофуран-3-карбоксамида,
N-[5-(аминометил)пиридин-2-ил]-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
N-[6-(аминометил)пиридин-3-ил]-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,
4-{[4-({2-метил-3-[(метиламино)карбонил]-1-бензофуран-6-ил}окси)хинолин-7-ил]окси}бутановой кислоты,
{[4-({2-метил-3-[(метиламино)карбонил]-1-бензофуран-6-ил}окси)хинолин-7-ил]окси}уксусной кислоты,
N-(4,6-диметилпиридин-2-ил)-2-метил-6-{[7-(2-пирролидин-1-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксамида,
метил-2-метил-6-{[7-(2-морфолин-4-илэтокси)хинолин-4-ил]окси}-1-бензофуран-3-карбоксилата,
6-({7-[2-гидрокси-3-(метиламино)пропокси]хинолин-4-ил}окси)-N,2-диметил-1-бензофуран-3-карбоксамида и
метил-4-{[4-({2-метил-3-[(метиламино)карбонил]-1-бензофуран-6-ил}окси)хинолин-7-ил]окси}бутаноата,
или его фармацевтически приемлемый сольват, или фармацевтически приемлемая соль.
7. Соединение по п.1, выбранное из следующей группы:
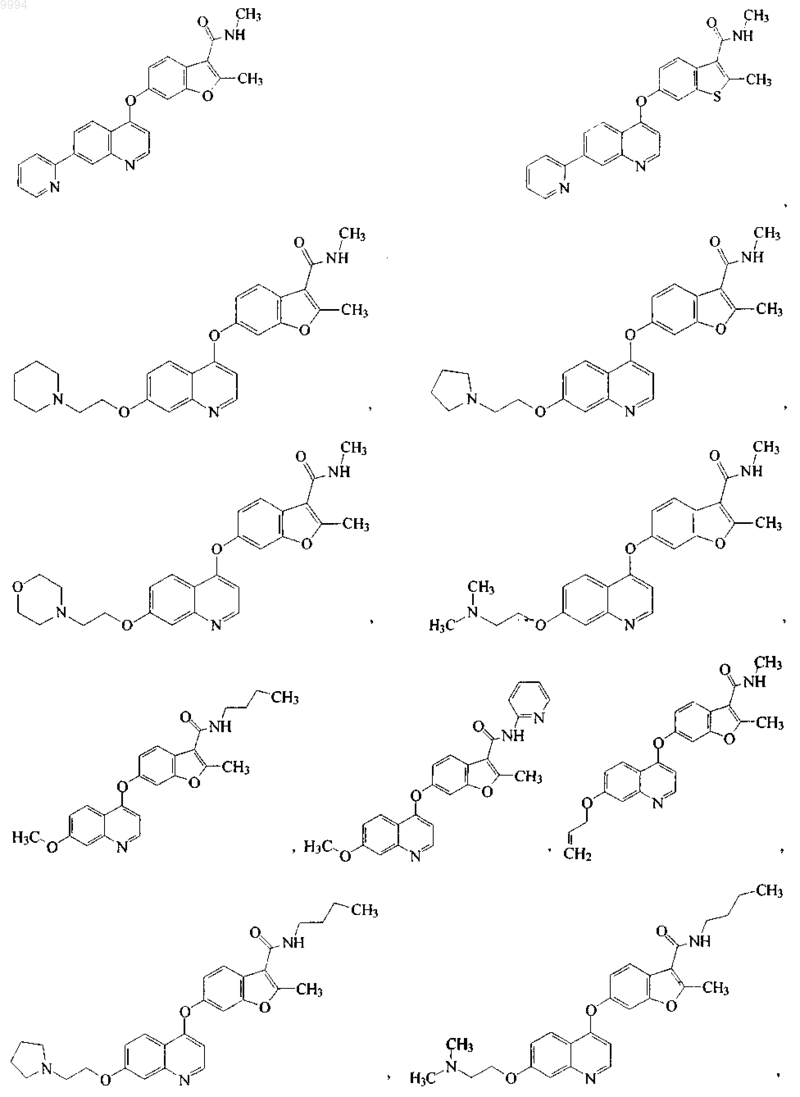

или его фармацевтически приемлемый сольват или фармацевтически приемлемая соль.
8. Фармацевтическая композиция для лечения гиперпролиферативного расстройства у млекопитающего, содержащая терапевтически эффективное количество соединения, соли или сольвата по п.1 и фармацевтически приемлемый носитель.
9. Фармацевтическая композиция по п.8, где указанное гиперпролиферативное расстройство представляет собой рак.
10. Способ получения соединения, имеющего формулу (I), где
представляет собой
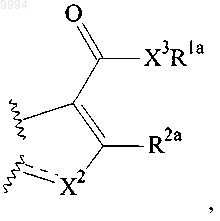
включающий:
(а) обработку карбоновой кислоты, имеющей формулу

активирующим агентом; и
(б) приведение в контакт соответствующего продукта с H2NR1a.
11. Способ получения соединения, имеющего формулу (I), где
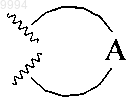
представляет собой
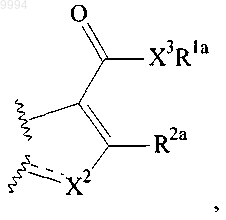
включающий
обработку хинолинового соединения, имеющего формулу
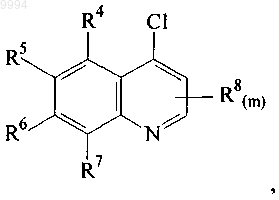
соединением, имеющим формулу
в присутствии основания.
Текст
009994 Эта заявка утверждает приоритет заявки на патент США 60/532725, поданной 23 декабря 2003 г.,которая включена при этом посредством ссылки. Данное изобретение относится к новым хинолиновым аналогам и их производным, включая фармацевтически приемлемые производные, такие как соли и сольваты. Соединения по настоящему изобретению ингибируют активность рецепторных киназ, таких как VEGFR и PDGFR, необходимых для клеточного роста и дифференцировки и ангиогенеза. В частности, соединения по этому изобретению ингибируют VEGFR/KDR и поэтому полезны для лечения заболеваний и состояний, которые ассоциированы с активностью VEGFR/KDR, например рака и офтальмологических заболеваний, таких как возрастная дегенерация желтого пятна. Это изобретение также относится к способу применения таких соединений в лечении гиперпролиферативных заболеваний у млекопитающих, в особенности у людей, и к фармацевтическим композициям, содержащим такие соединения. Предшествующий уровень техники Клетка может стать раковой в результате трансформации части ее ДНК в онкоген (то есть ген, который при активации приводит к образованию злокачественных опухолевых клеток). Многие онкогены кодируют белки, являющиеся аберрантными тирозинкиназами, способными вызывать клеточную трансформацию. Альтернативно, сверхэкспрессия нормальной протоонкогенной тирозинкиназы также может вызывать пролиферативные расстройства, иногда приводящие к злокачественному фенотипу. Рецепторные тирозинкиназы представляют собой крупные ферменты, пронизывающие клеточную мембрану и имеющие внеклеточный связывающий домен для факторов роста, трансмембранный домен и внутриклеточную часть, которая функционирует как киназа для фосфорилирования конкретного тирозинового остатка в белках и, следовательно, для влияния на клеточную пролиферацию. Тирозинкиназы можно классифицировать как рецепторные киназы ростовых факторов (например EGFR, PDGFR, FGFR иerbB2) или нерецепторные киназы (например c-src и bcr-abl). Такие киназы могут аномально экспрессироваться при таких распространенных у человека видах рака, как рак молочной железы, рак желудочнокишечного тракта, такой как рак толстой кишки, прямой кишки или желудка, лейкоз и рак яичников,бронхов или поджелудочной железы. Аберрантная активность erbB2 вовлечена в рак молочной железы,яичников, немелкоклеточный рак легкого, рак поджелудочной железы, желудка и толстой кишки. Исследования показывают, что рецептор эпидермального фактора роста (EGFR) подвергается мутации или сверхэкспрессии при многих видах рака у человека, таких как рак головного мозга, легкого, плоскоклеточный рак, рак мочевого пузыря, желудка, молочной железы, головы и шеи, пищевода, гинекологической сферы и щитовидной железы. Таким образом, ингибиторы рецепторных тирозинкиназ могут быть полезны в качестве селективных ингибиторов роста раковых клеток млекопитающих. Ингибиторы EGFR могут быть полезны в лечении заболевания поджелудочной железы и почек (такого как пролиферативный гломерулонефрит и индуцированная диабетом почечная болезнь) и могут с успехом снижать имплантацию бластоцитов и следовательно могут быть полезны в качестве противозачаточного средства. Смотри публикацию РСТ международной заявкиWO 95/19970 (опубликованную 27 июля 1995 года), включенную тем самым посредством ссылки во всей своей полноте. Полипептидные факторы роста, такие как сосудистый эндотелиальный фактор роста (VEGF), обладающий высоким сродством к человеческому киназному, содержащему инсерционный домен рецептору(KDR) или рецептору киназы-1 из эмбриональной печени мыши (FLK-1), ассоциированы с пролиферацией эндотелиальных клеток и, более конкретно, с васкулогенезом и ангиогенезом. Смотри публикацию РСТ международной заявкиWO 95/21613 (опубликованной 17 августа 1995 г), включенной тем самым посредством ссылки во всей своей полноте. Агенты, способные связываться с KDR/FLK-1 рецептором или модулировать его, могут быть использованы для лечения расстройств, ассоциированных с васкулогенезом и ангиогенезом, таких как диабет, диабетическая ретинопатия, возрастная дегенерация желтого пятна, гемангиома, глиома, меланома, саркома Капоши и рак яичников, молочной железы, легкого, поджелудочной железы, предстательной железы, кишечника и эпидермоидный рак. Соединения и способы, о которых сообщалось, что они могут быть использованы для лечения гиперпролиферативных заболеваний, описаны в следующих патентах и заявках: публикация РСТ международной заявки на патентWO 00/38665 (опубликованная 6 июля 2001 года), публикация РСТ международной заявки на патентWO 97/49688 (опубликованная 31 декабря 1997 года), публикация РСТ международной заявки на патентWO 98/23613 (опубликованная 4 июня 1998 года), заявка на патент США 09/502129 (поданная 10 февраля 2000 года), заявка на патент США 08/953078 (поданная 17 октября 1997 года), патент США 6071935, опубликованный 6 июня 2000 года, публикация РСТ международной заявки на патентWO 96/30347 (опубликованная 3 октября 1996 года), публикация РСТ международной заявки на патентWO 96/40142 (опубликованная 19 декабря 1996 года), публикация РСТ международной заявки на патентWO 97/13771 (опубликованная 17 апреля 1997 года), публикация РСТ международной заявки на патентWO 95/23141 (опубликованная 31 августа 1995 года), публикация РСТ международной заявки на патентWO 03/006059 (опубликованная 23 января 2003 года), публикация РСТ международной заявки на патентWO 03/035047 (опубликованная 1 мая 2003 года), публикация РСТ международной заявки на патентWO 02/064170 (опубликованной 22 августа 2002 года), публикации РСТ международной заявки на патентWO 02/41882 (опубликованная 30 мая 2002 года), пуб-1 009994 ликация РСТ международной заявки на патентWO 02/30453 (опубликованная 18 апреля 2002 года),публикация РСТ международной заявки на патентWO 01/85796 (опубликованная 15 ноября 2001 года), публикация РСТ международной заявки на патентWO 01/74360 (опубликованная 11 октября 2001 года), публикация РСТ международной заявки на патентWO 01/74296 (опубликованная 11 октября 2001 года), публикация РСТ международной заявки на патентWO 01/70268 (опубликованная 27 сентября 2001 года), публикация заявки на европейский патентЕР 1086705 (опубликованная 28 марта 2001 года) и публикация РСТ международной заявки на патентWO 98/51344 (опубликованная 19 ноября 1998 года). Приведенные выше патент и заявки все включены в данное описание изобретения посредством ссылки во всей своей полноте. Краткое изложение сущности изобретения В данном изобретении описаны соединения, способные модулировать активность рецепторных киназ, таких как VEGFR и PDGFR, и способы применения такой модуляции в лечении рака и других пролиферативных расстройств. Также описаны соединения, которые опосредуют и/или ингибируют активность протеинкиназ, и фармацевтические композиции, содержащие такие соединения. Также описаны терапевтическое или профилактическое применение таких соединений и композиций и способы лечения рака, а также других заболеваний, ассоциированных с нежелательными ангиогенезом и/или клеточной пролиферацией, путем введения эффективных количеств таких соединений. В одном аспекте предложены новые хинолиновые соединения. В другом аспекте предложены соединения, которые модулируют активность рецепторных киназ, таких как KDR/VEGFR2 киназа, in vitro и/или in vivo. Согласно следующему аспекту предложены соединения, которые могут селективно модулировать активность рецепторных киназ, таких как KDR/VEGFR2 киназа. В еще одном аспекте предложены фармацевтические композиции таких VEGFR2-модулирующих соединений, включая их фармацевтически приемлемые соли. Согласно еще одному аспекту предложены схемы синтеза для получения таких VEGFR2-модулирующих соединений и их фармацевтически приемлемых солей. В еще одном аспекте предложены способы модуляции KDR/VEGFR2 киназы, включающие приведение VEGFR2 модулирующих соединений или их фармацевтически приемлемых солей, описанных в данном изобретении, в контакт с KDR/VEGFR2 киназой. В еще одном аспекте предложены способы лечения пациентов,включающие введение терапевтически эффективного количества VEGFR2-модулирующего соединения или его фармацевтически приемлемой соли. В еще одном аспекте предложены комбинированные терапии, включающие введение антинеопластического агента и эффективного количества VEGFR2 модулирующего соединения или его фармацевтически приемлемой соли. В одном аспекте представлены соединения формулы (I) гдев формуле (I) указывает на возможную связь; линияуказывает на возможную связь;X1 представляет собой связь или -C(O)NH-;-(CR R )j-(С 5-С 8)циклоалкенила, (С 2-С 6)алкенила, (С 2-С 6)алкинила, -(CR10R11)j-арила, -(CR10R11)jгетероциклила и (С 1-С 8)алкила, и где атомы С в Rla и Rlb могут быть возможно замещены 1-3 независимо выбранными группами R12;R3 и R8 независимо представляют собой F;X5 представляет собой С, когдаформуле (I) представляет собой связь, или представляет собой СН или N, когдав формуле (I) не является связью;R4 и R7 независимо выбраны из Н, галогена, -CH3 и CF3;R5 и R6 независимо выбраны из группы, состоящей из Н, галогена, -CF3, -N3, -NO2, -ОН, -NH2,-OCF3, -X4(CR10R11)jCN, -Х 4(CR10R11)j-(С 3-С 8)циклоалкила, -X4(CR10R11)j-(С 5-С 8)циклоалкенила, -Х 4(С 2 С 6)алкенила, -Х 4(С 2-С 6)алкинила, -X4(CR10R11)j-арила, -X4(CR10R11)j-гетероциклила, гетероциклила и-Х 4(С 1-С 8)алкила, и где атомы С и N в R5 и R6 могут быть возможно замещены 1-3 независимо выбранными группами R13, или где R5 и R6, взятые вместе, могут образовывать циклическую группировку, выбранную из группы, состоящей из 4-10-членного карбоциклила и 4-12-членного гетероциклила, возможно замещенного 1-3 независимо выбранными группами R13;S; каждый из R10 и R11 независимо выбран из группы, состоящей из Н, F и (С 1-С 6)алкила, или R10 и R11,взятые вместе, могут образовывать карбоциклил, или две группы R10, присоединенные к соседним атомам углерода, могут быть выбраны вместе с образованием карбоциклила; каждый из R12 и R13 независимо выбран из группы, состоящей из галогена, циано, нитро, тетразолила, гуанидино, амидино, метилгуанидино, азидо, -C(O)R14, -С(О), -CF3, -CF2CF3, -CH(CF3)2, -C(OH)(CF3)2,-OCF3, -OCF2H, -OCF2CF3, -OC(O)NH2, -OC(O)NHR14, -OC(O)NR14R15, -NHC(O)R14, -NHC(O)NH2,-NHC(O)NHR14, -NHC(O)NR14R15, -C(O)OH, -C(O)OR14, -C(O)NH2, -C(O)NHR14, -C(O)NR14R15, -P(O)3H2,-P(O)3(R14)2, -S(O)3H, -S(O)mR14, -R14, -OR14, -OH, -NH2, -NH, -NHR14, -NR14, -NR14R15, -C(=NH)NH2,-C(=NOH)NH2, -N-морфолино, (С 2-С 6)алкила, где любой из атомов С может быть возможно замещен атомом О, (С 2-C6)алкенила, (С 2-C6)алкинила, (С 1-С 6)галогеноалкила, (С 2-C6)галогеноалкенила, (С 2-С 6)галогеноалкинила, (С 1-С 6)галогеноалкокси, -(CR16R17)rNH2, -(CR16R17)rNHR14, -CNR14R15, -(CR16R17)rNR14R15 и-S(O)m(CF2)qCF3; или любые две группы R12 или любые две группы R13, присоединенные к соседним атомам углерода, могут быть выбраны вместе так, чтобы представлять собой -O[C(R16)(R17)]rO- или -O[C(R16)(R17)]r+1-; или любые две группы R12 или любые две группы R13, присоединенные к одному и тому же или к соседним атомам углерода, могут быть выбраны вместе с образованием карбоциклила или гетероциклила; каждый из R14 и R15 независимо выбран из группы, состоящей из (С 1-С 12)алкила, (С 3-С 8)циклоалкила, (C6-С 14)арила, 4-12-членного гетероциклила, -(CR10R11)j-(C6-С 10)арила и -(CR10R11)j-(4-12-членный гетероциклил); каждый из R16 и R17 независимо выбран из группы, состоящей из водорода, (С 1-С 12)алкила, (C6-С 14) арила, 4-12-членного гетероциклила, -(CR10R11)j-(C6-C10)арила и -(CR10R11)j-(4-12-членный гетероциклил); и где любой из вышеупомянутых заместителей, содержащих группу СН 3 (метил), СН 2 (метилен) или СН (метин), которая не присоединена к галогену, группе SO или SO2, или к атому N, О или S, возможно несет на указанной группе заместитель, выбранный из группы, состоящей из гидрокси, галогена, (С 1 С 4)алкила, (С 1-С 4)алкокси и -N[(С 1-С 4) алкил][(С 1-С 4)алкил]; и где j равно 0, 1, 2 или 3, и когда j равно 2 или 3, тогда каждая группа CR10R11 может быть одинаковой или разной; и где n равно 0, 1, 2 или 3, и m равно 0, 1 или 2; и где q представляет собой целое число от 0 до 5, и r представляет собой целое число от 1 до 4; или их фармацевтически приемлемый сольват или фармацевтически приемлемая соль. В одном воплощении представлены соединения, имеющие структуру формулы (I), где где Rla, R2a, X2 и X3 такие, как они определены в соответствии с формулой (I). В других воплощениях предложены соединения, где (а) n и m оба равны 0; (б) X4 представляет собой О; (в) R4 и R7 оба представляют собой Н; (г) R2a представляет собой СН 3; (д) R4 и R7 оба представляют собой Н, R2a представляет собой CH3, и n и m оба равны 0 (и кроме того, где X2 представляет собой или О, или S); (е) X2 представляет собой или О, или S; или (ж) R4, R5 и R7 все представляют собой Н. Когда R4, R5 и R7 представляют собой Н, альтернативное воплощение относится к соединениям, где R2a представляет собой CH3, n иm оба равны 0, и X2 представляет собой или О, или S; это воплощение может дополнительно включать соединения, где (1) R6 представляет собой -X4(CR10R11)j-гетероциклил, и X4 представляет собой связь или О; или (2) R6 представляет собой -X4(С 1-С 8)алкил, и X4 представляет собой связь или О. В другом воплощении предложены соединения, имеющие структуру формулы (I), где где Rla, R2a и X2 такие, как они определены в соответствии с формулой (I), и j равно 0. В другом воплощении таких соединений Rla выбран из группы, состоящей из -(С 3-С 8)циклоалкила, -арила,-гетероциклила и (С 1-С 8)алкила, которые все могут быть возможно замещены 1-3 независимо выбранными группами R12. В другом воплощении предложены соединения, имеющие структуру формулы (I), где где X1, Rlb, R2b и R9 такие, как они определены в соответствии с формулой (I). В другом воплощении представлены соединения, в которых X3 представляет собой NH. В еще одном воплощении представлены такие соединения, в которых (а) X1 представляет собой -C(O)NH-; (б) R2b представляет собой -CH3; или (в) R2b представляет собой CH3, и n и m оба равны 0. Когда R2b представляет собой CH3, и n и m оба равны О, другое воплощение относится к соединениям, в которых X представляет собой -C(O)NH-. Это воплощение может дополнительно включать соединения, где (1) R6 представляет собой -X4(CR10R11)j-гетероциклил, и X4 представляет собой связь или О; или (2) R6 представляет собой -Х 4(С 1-С 8)алкил, и X4 представляет собой связь или О. В другом воплощении предложены соединения, имеющие структуру формулы (I), выбранные из следующей группы, состоящей из 5-[(7-хлорхиназолин-4-ил)амино]-N,2-диметил-1 Н-индол-1-карбоксамида,6-[(7-йодхинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,N-2-диметил-6-[(7-пиридин-4-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,N-2-диметил-6-[(7-пиридин-3-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,N-2-диметил-6-[(7-пиридин-2-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,N-2-диметил-6-[(7-пиридин-4-илхинолин-4-ил)окси]-1-бензотиофен-3-карбоксамида,N-2-диметил-5-[(7-пиридин-4-илхинолин-4-ил)амино]-1 Н-индол-1-карбоксамида,N,2-диметил-5-[(7-пиридин-3-илхинолин-4-ил)амино]-1 Н-индол-1-карбоксамида,6-[7-(2-фурил)хинолин-4-ил]окси-N,2-диметил-1-бензофуран-3-карбоксамида, N-2-диметил-6-[(7 пиридин-3-илхинолин-4-ил)окси]-1-бензотиофен-3-карбоксамида,6-[(7-[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонилхинолин-4-ил)окси]-N,2-диметил-1 бензофуран-3-карбоксамида,6-[(7-[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонилхинолин-4-ил)окси]-N,2-диметил-1 бензотиофен-3-карбоксамида,N,2-диметил-6-[(7-пиримидин-2-илхинолин-4-ил)окси]-1-бензотиофен-3-карбоксамида,N,2-диметил-6-[(7-пиримидин-2-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,6-[(7-бромхинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,б-[(7-бромхинолин-4-ил)окси]-N,2-диметил-1-бензотиофен-3-карбоксамида,6-[(6-йодхинолин-4-ил)окси]-N,2-диметил-1-бензотиофен-3-карбоксамида,6-[(6-йодхинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,N,2-диметил-6-[(6-пиридин-4-илхинолин-4-ил)окси]-1-бензофуран-3-карбоксамида,6-[(6-метоксихинолин-4-ил)окси]-N,2-диметил-1-бензотиофен-3-карбоксамида,-4 009994 6-[(6-гидроксихинолин-4-ил)окси]-N,2-диметил-1-бензотиофен-3-карбоксамида,N,2-диметил-6-(6-[2-(1-метилпирролидинил-2-ил)этокси]хинолин-4-илокси)-1-бензотиофен-3 карбоксамида,6-[(7-метоксихинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,6-[(7-гидроксихинолин-4-ил)окси]-N,2-диметил-1-бензофуран-3-карбоксамида,N,2-диметил-6-[(7-1,3-тиазол-2-ил)хинолин-4-ил]окси-1-бензофуран-3-карбоксамида,N,2-диметил-6-[(7-пиридин-2-ил)хинолин-4-ил]окси-1-бензотиофен-3-карбоксамида,N,2-диметил-5-[(7-пиридин-2-ил)хинолин-4-ил]амино-1H-индол-1-карбоксамида,N,2-диметил-6-[7-(2-пиперидин-1-илэтокси)хинолин-4-ил]окси-1-бензофуран-3-карбоксамида,N,2-диметил-6-[7-(пиридин-2-илметокси)хинолин-4-ил]окси-1-бензофуран-3-карбоксамида,N,2-диметил-6-[7-(тиазол-2-илметокси)хинолин-4-ил]окси-1-бензофуран-3-карбоксамида,N,2-диметил-6-[7-(2-пирролидин-1-илэтокси)хинолин-4-ил]окси-1-бензофуран-3 -карбоксамида,N,2-диметил-6-[7-(2-морфолин-4-илэтокси)хинолин-4-ил]окси-1-бензофуран-3-карбоксамида,6-(7-[2-(диметиламино)этокси]хинолин-4-илокси)-N,2-диметил-1-бензофуран-3-карбоксамида,N-бутил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-пиридин-2-ил-1-бензофуран-3-карбоксамида,N-бутил-6-[(7-гидроксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,6-[7-(аллилокси)хинолин-4-ил]окси-N,2-диметил-1-бензофуран-3-карбоксамида,N-изопропил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,N-бутил-2-метил-6-[7-(2-пирролидин-1-илэтокси)хинолин-4-ил]окси-1-бензофуран-3 карбоксамида,N-бутил-2-метил-6-[7-(2-морфолин-4-илэтокси)хинолин-4-ил]окси-1-бензофуран-3 карбоксамида,N-бутил-6-(7-[2-(диметиламино)этокси]хинолин-4-илокси)-2-метил-1-бензофуран-3 карбоксамида,N-бутил-2-метил-6-[7-(2-пиперидин-1-илэтокси)хинолин-4-ил]окси-1-бензофуран-3 карбоксамида,N-циклопропил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,N-[2-(диметиламино)этил]-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3 карбоксамида,[(7-метоксихинолин-4-ил)окси]-2-метил-N-пропил-1-бензотиофен-3-карбоксамида,N-[3-(диметиламино)пропил]-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3 карбоксамида,N-циклогексил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,N-циклопентил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(пиридин-3-илметил)-1-бензотиофен-3-карбоксамида,6-[(7-гидроксихинолин-4-ил)окси]-2-метил-N-пропил-1-бензотиофен-3-карбоксамида,N-[2-(диметиламино)этил]-6-[(7-гидроксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3 карбоксамида,N-циклопентил-6-[(7-гидроксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,N-[3-(диметиламино)пропил]-6-[(7-гидроксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3 карбоксамида,6-[(7-гидроксихинолин-4-ил)окси]-2-метил-N-(пиридин-3-илметил)-1-бензотиофен-3-карбоксамида,N,2-диметил-6-[7-(трифторметил)хинолин-4-ил]окси-1-бензотиофен-3-карбоксамида,N,2-диметил-6-[7-(трифторметил)хинолин-4-ил]окси-1-бензофуран-3-карбоксамида,6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(3-морфолин-4-илпропил)-1-бензотиофен-3 карбоксамида,N-циклопропил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,6-[(7-метоксихинолин-4-ил)окси]-2-метил-(3-морфолин-4-илпропил)-1-бензофуран-3-карбоксамида,6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(пиридин-2-илметил)-1-бензофуран-3-карбоксамида,6-[(7-метоксихинолин-4-ил)окси]-2-метилбензофуран-3-карбоновой кислоты (3-диметиламинопропил)амида,N-(3-гидроксипропил)-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3-карбоксамида,N-(5-гидрокси-1 Н-пиразол-3-ил)-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3 карбоксамида,6-[(7-гидроксихинолин-4-ил)окси]-N-изопропил-2-метил-1-бензофуран-3-карбоксамида,6-[(7-гидроксихинолин-4-ил)окси]-N-изопропил-2-метил-1-бензотиофен-3-карбоксамида,N-изопропил-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензотиофен-3-карбоксамида,[(7-метоксихинолин-4-ил)окси]-N,1,2-триметил-1 Н-индол-3-карбоксамида,N-изопропил-2-метил-6-[7-(трифторметокси)хинолин-4-ил]окси-1-бензофуран-3-карбоксамида,N-циклопропил-2-метил-6-[7-(трифторметокси)хинолин-4-ил]окси-1-бензофуран-3-карбоксамида,-5 009994N,2-диметил-6-[(6-пиридин-4-илхинолин-4-ил)окси]-1-бензотиофен-3-карбоксамида,N-циклопропил-6-(7-[2-(этиламино)этокси]хинолин-4-илокси)-2-метил-1-бензофуран-3 карбоксамида,N-циклопропил-2-метил-6-[7-(2-пиперидин-1-илэтокси)хинолин-4-ил]окси-1-бензофуран-3 карбоксамида,7-фтор-6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(6-морфолин-4-илпиридин-3-ил)-1-бензофуран 3-карбоксамида,7-фтор-6-[(7-метоксихинолин-4-ил)окси]-2-метил-N-(3-морфолин-4-илпропил)-1-бензофуран-3 карбоксамида,N-циклопропил-2-метил-6-[7-(2-пиперазин-1-илэтокси)хинолин-4-ил]окси-1-бензофуран-3 карбоксамида,6-[7-(2,3-дигидроксипропокси)хинолин-4-ил]окси-N,2-диметил-1-бензофуран-3-карбоксамида,N-[5-(аминометил)пиридин-2-ил]-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3 карбоксамида,N-[6-(аминометил)пиридин-3-ил]-6-[(7-метоксихинолин-4-ил)окси]-2-метил-1-бензофуран-3 карбоксамида,4-[4-(2-метил-3-[(метиламино)карбонил]-1-бензофуран-6-илокси)хинолин-7-ил]оксибутановой кислоты,[4-(2-метил-3-[(метиламино)карбонил]-1-бензофуран-6-илокси)хинолин-7-ил]оксиуксусной кислоты,N-(4,6-диметилпиридин-2-ил)-2-метил-6-[7-(2-пирролидин-1-илэтокси)хинолин-4-ил]окси-1 бензофуран-3-карбоксамида,метил-2-метил-6-[7-(2-морфолин-4-илэтокси)хинолин-4-ил]окси-1-бензофуран-3-карбоксилата,6-(7-[2-гидрокси-3-(метиламино)пропокси]хинолин-4-илокси)-N,2-диметил-1-бензофуран-3 карбоксамида и метил-4-[4-(2-метил-3-[(метиламино)карбонил]-1-бензофуран-6-илокси)хинолин-7 ил]оксибутаноата,или их фармацевтически приемлемого сольвата или фармацевтически приемлемой соли. В другом воплощении предложены соединения, имеющие структуру формулы (I), выбранные из группы, состоящей из или их фармацевтически приемлемого сольвата или фармацевтически приемлемой соли. В другом воплощении предложены способы получения соединения, имеющего структуру формулы(б) приведение соответствующего продукта в контакт с H2NR1a. В другом воплощении таких способов активирующий агент выбран из группы, состоящей из тионилхлорида, оксалилхлорида и O-(7 азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфата (HATU). В другом воплощении предложены способы получения соединения, имеющего структуру формулы включающие обработку хинолинового соединения, имеющего формулу в присутствии кислоты. В другом воплощении таких способов X представляет собой NH, и указанная кислота представляет собой HCl. В другом воплощении предложены способы получения соединения, имеющего структуру формулы включающие обработку хинолинового соединения, имеющего формулу в присутствии основания. Пациенты, которые могут быть подвергнуты лечению соединениями формулы (I) и фармацевтически приемлемыми солями или фармацевтически приемлемыми сольватами указанных соединений в соответствии со способами по данному изобретению, включают, например, пациентов с диагнозом псориаз, доброкачественная гипертрофия предстательной железы (ВРН), рак легкого, рак глаза, рак кости, рак поджелудочной железы, рак кожи, рак головы и шеи, кожная или внутриглазная меланома, рак матки,рак яичников, рак прямой кишки, рак анальной области, рак желудка, рак кишечника, рак молочной железы, опухоли гинекологической сферы (например, саркомы матки, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки, карцинома влагалища или карцинома вульвы), болезнь Ходжкина, рак пищевода, так тонкого кишечника, рак эндокринной системы (например, рак щитовидной, паращитовидной желез или надпочечников), саркомы мягких тканей, рак уретры, рак полового члена, рак-9 009994 предстательной железы, хронический или острый лейкоз, солидные опухоли у детей, лимфоцитарная лимфома, рак мочевого пузыря, рак почки или мочеточника (например, почечно-клеточная карцинома,карцинома почечной лоханки) или опухоли центральной нервной системы (например, первичная лимфома ЦНС, опухоли позвоночного столба, глиомы ствола мозга или аденомы гипофиза). Данное изобретение также относится к фармацевтической композиции для лечения гиперпролиферативного расстройства у млекопитающего, которая содержит терапевтически эффективное количество соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений и фармацевтически приемлемый носитель. В одном воплощении указанная фармацевтическая композиция предназначена для лечения рака, такого как рак головного мозга,легкого, глаза, плоскоклеточный рак, рак мочевого пузыря, желудка, поджелудочной железы, молочной железы, головы, шеи, почки, яичников, предстательной железы, колоректальный рак, рак пищевода, гинекологической сферы или щитовидной железы. В другом воплощении указанная фармацевтическая композиция предназначена для лечения гиперпролиферативного расстройства нераковой природы, такого как доброкачественная гиперплазия кожи (например, псориаз) или предстательной железы (например,доброкачественная гипертрофия предстательной железы (ВРН. Кроме того, изобретение относится к фармацевтической композиции для лечения панкреатита или заболевания почек (включая пролиферативный гломерулонефрит и индуцированное диабетом почечное заболевание) у млекопитающего, содержащей терапевтически эффективное количество соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений и фармацевтически приемлемый носитель. Кроме того, изобретение относится к фармацевтической композиции для предупреждения имплантации бластоцитов у млекопитающего, содержащей терапевтически эффективное количество соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений и фармацевтически приемлемый носитель. Кроме того, изобретение относится к фармацевтической композиции для лечения у млекопитающего заболевания, связанного с васкулогенезом или ангиогенезом, содержащей терапевтически эффективное количество соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений и фармацевтически приемлемый носитель. В одном воплощении указанная фармацевтическая композиция предназначена для лечения заболевания, выбранного из группы, состоящей из опухолевого ангиогенеза, хронического воспалительного заболевания, такого как ревматоидный артрит, атеросклероза, кожных заболеваний, таких как псориаз, экзема и склеродермия, диабета, диабетической ретинопатии, ретролетальной фиброплазии, возрастной дегенерации желтого пятна, гемангиомы, глиомы, меланомы, саркомы Капоши и рака яичников, молочной железы, легкого,поджелудочной железы, предстательной железы, кишечника и эпидермоидного рака. Данное изобретение также относится к способу лечения гиперпролиферативного расстройства у млекопитающего, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений. В одном воплощении указанный способ относится к лечению рака, такого как рак головного мозга, глаза, плоскоклеточный рак, рак мочевого пузыря, желудка,поджелудочной железы, молочной железы, головы, шеи, пищевода, предстательной железы, колоректальный рак, рак легкого, почки, яичников, гинекологической сферы или щитовидной железы. В другом воплощении указанный способ относится к лечению гиперпролиферативного расстройства нераковой природы, такого как доброкачественная гиперплазия кожи (например, псориаз) или предстательной железы (например, ВРН). Данное изобретение также относится к способу лечения гиперпролиферативного расстройства у млекопитающего, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений в комбинации с противоопухолевым агентом, выбранным из группы, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов ростовых факторов, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормональных средств и антиандрогенов. Лечение гиперпролиферативного расстройства у млекопитающего, которое включает введение указанному млекопитающему терапевтически эффективного количества ингибитора рецепторной тирозинкиназы VEGF, может приводить к устойчивому повышению кровяного давления. Соединения по настоящему изобретению могут быть использованы в сочетании с антигипертензивными средствами, такими как NORVASC или PROCARDIA XL, имеющимися в продаже от Pfizer, для применения в лечении гиперпролиферативного расстройства у млекопитающего. Данное изобретение также относится к фармацевтической композиции для лечения у млекопитающего заболевания, связанного с васкулогенезом или ангиогенезом, содержащей (а) терапевтически эффективное количество соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений, (б) терапевтически эффективное количество ан- 10009994 тигипертензивного агента в виде соединения, соли или сольвата и (в) фармацевтически приемлемый носитель. Данное изобретение также относится к фармацевтической композиции для лечения у млекопитающего заболевания, связанного с васкулогенезом или ангиогенезом, содержащей (а) терапевтически эффективное количество соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений, (б) терапевтически эффективное количество соединения, соли или сольвата ингибитора фактора некроза опухоли альфа и (в) фармацевтически приемлемый носитель. Данное изобретение также относится к фармацевтической композиции для лечения у млекопитающего заболевания, связанного с нежелательными ангиогенезом, миграцией эндотелиальных клеток или пролиферацией эндотелиальных клеток, содержащей (а) терапевтически эффективное количество соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений, (б) терапевтически эффективное количество соединения, соли или сольвата ингибитора NADPH-оксидазы и (в) фармацевтически приемлемый носитель. Данное изобретение также относится к фармацевтической композиции для ингибирования аномального клеточного роста у млекопитающего, включая человека, содержащей количество соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений, которое является эффективным в ингибировании фарнезил-протеинтрансферазы, и фармацевтически приемлемый носитель. Данное изобретение также относится к фармацевтической композиции для ингибирования аномального клеточного роста у млекопитающего, которая содержит количество соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений в комбинации с количеством химиотерапевтического средства, где количества соединения,соли или сольвата и химиотерапевтического средства вместе эффективны для ингибирования аномального клеточного роста. В настоящее время в данной области известно много химиотерапевтических средств. В одном воплощении химиотерапевтаческое средство выбрано из группы, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов ростовых факторов, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормональных средств, например антиандрогенов. Соединения, описанные в данном изобретении, могут быть использованы в способе предупреждения или снижения роста опухолевых клеток, экспрессирующих функциональные VEGF-1 рецепторы,путем введения эффективного количества низкомолекулярного антагониста VEGF-1 рецепторов, с целью ингибирования аутокринной стимуляции, и эффективного количества соединения формулы (I). Активные ингредиенты в таких композициях могут быть представлены в свободной форме или в форме фармацевтически приемлемой соли и возможно с по меньшей мере одним фармацевтически приемлемым носителем. Соединения, описанные в данном изобретении, могут быть использованы в комбинации с селективным ингибитором СОХ-2 для одновременного, раздельного или последовательного применения. Кроме того, соединения, описанные в данном изобретении, могут быть использованы в комбинации с укороченным растворимым Flkl/KDR рецептором для лечения субъектов с заболеванием или расстройством,ассоциированным с VEGF. Активные ингредиенты в таких композициях могут быть представлены в свободной форме или в форме фармацевтически приемлемой соли и возможно с по меньшей мере одним фармацевтически приемлемым носителем. Кроме того, соединения, описанные в данном изобретении, могут быть использованы в комбинации со вторым активным ингредиентом, который снижает активность эпидермального фактора роста (EGF),связывается с ним или иигибирует его. Активные ингредиенты в таких композициях могут быть представлены в свободной форме или в форме фармацевтически приемлемой соли и возможно с по меньшей мере одним фармацевтически приемлемым носителем. Кроме того, соединения, описанные в данном изобретении, могут быть использованы для ингибирования VEGF-опосредованного ангиогенеза в ткани посредством нескольких способов, включая, но не ограничиваясь этим, приведение ткани в контакт с ингибитором NADPH-оксидазы и эффективным количеством соединения формулы (I), приведение ткани в контакт с ингибитором реакционноспособных форм кислорода (ROS) и эффективным количеством соединения формулы (I) или приведение ткани в контакт с ингибитором супероксиддисмутазы (SOD) и эффективным количеством соединения формулы(I). Активные ингредиенты в таких композициях могут быть представлены в свободной форме или в форме фармацевтически приемлемой соли и возможно с по меньшей мере одним фармацевтически приемлемым носителем. Соединения, описанные в данном изобретении, также могут быть использованы в комбинации с молекулами, которые специфически связываются с плацентарным фактором роста, с целью подавления или предупреждения патологического ангиогенеза, индуцированного плацентарным фактором роста,просачивания через сосуды (отека), легочной гипертензии, опухолеобразования и/или воспалительных расстройств.- 11009994 Соединения, описанные в данном изобретении, также могут быть использованы в комбинации с молекулами, выбранными из группы, состоящей из: антитела или любого его фрагмента, которые специфически связываются с плацентарным фактором роста, небольшой молекулы, специфически связывающейся с плацентарным фактором роста или с рецептором-1 сосудистого эндотелиального фактора роста,антагонистов рецептора-1 сосудистого эндотелиального фактора роста или любого его фрагмента, рибозима против нуклеиновых кислот, кодирующих плацентарный фактор роста или рецептор-1 сосудистого эндотелиального фактора роста, и антисмысловых нуклеиновых кислот, гибридизующихся с нуклеиновыми кислотами, кодирующими плацентарный фактор роста или рецептор-1 сосудистого эндотелиального фактора роста. Активные ингредиенты в таких композициях могут быть представлены в свободной форме или в форме фармацевтически приемлемой соли и возможно по меньшей мере с одним фармацевтически приемлемым носителем. Соединения, описанные в данном изобретении, могут быть использованы в способе ингибирования у млекопитающих роста клеток несолидных опухолей, которые стимулируются лигандом рецептора сосудистого эндотелиального фактора роста (включая, но не ограничиваясь ею. VEGFR2 киназу), способе,включающем лечение млекопитающих эффективным количеством соединения формулы (I). Соединения,описанные в данном изобретении, могут быть использованы в способе ингибирования у млекопитающих роста клеток несолидных опухолей, которые стимулируются лигандом рецептора сосудистого эндотелиального фактора роста (включая, но не ограничиваясь ею, VEGFR2 киназу), способе, включающем лечение млекопитающих эффективным количеством соединения формулы (I) в комбинации с облучением. Соединения, описанные в данном изобретении, также могут быть использованы в комбинации сG2/M агентами и с терапевтическими агентами, чья терапевтическая эффективность зависит, по меньшей мере частично, от наличия интернализирующей клеточной поверхностной структуры на клетке-мишени. Такие G2/M агенты включают, но не ограничиваются этим, винорелбина тартрат, цисплатин, карбоплатин, паклитаксел, доксорубицин, 5FU (5-фторурацил), доцетаксел, винбластин, винкристин, циклофосфамид, апигенин, генистеин, циклоксазолин. Соединения, описанные в данном изобретении, также могут быть использованы в комбинации с веществами, которые ингибируют сигнальную трансдукцию, опосредованную Flt-1 рецептором VEGF человека. Соединения, описанные в данном изобретении, также могут быть использованы для лечения или предупреждения заболевания, опосредованного фактором некроза опухолей, включающего совместное введение пациенту антагониста фактора некроза опухолей альфа и эффективного количества соединения формулы (I). Рассматриваемые заболевания, опосредованные фактором некроза опухолей, включают, но не ограничиваются этим, аутоиммунное заболевание, острое и хроническое иммунное заболевание, воспалительное заболевание и нейродегенеративное заболевание. Кроме этого, данное изобретение относится к способу ингибирования у млекопитающего аномального клеточного роста, включающему введение этому млекопитающему количества соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений в комбинации с лучевой терапией, причем количество соединения, соли или сольвата в комбинации с лучевой терапией является эффективным в ингибировании аномального клеточного роста у млекопитающего. Методики применения лучевой терапии известны в данной области, и эти методики могут быть использованы в комбинированной терапии, описанной в данном изобретении. Введение соединения по изобретению в такой комбинированной терапии можно определить, как приведено в данном изобретении. Полагают, что соединения формулы (I) могут сделать аномальные клетки более чувствительными к лечению облучением в целях клеточного лизиса и/или ингибирования роста таких клеток. Соответственно, данное изобретение также относится к способу сенсибилизации аномальных клеток у млекопитающего для лечения облучением, включающему введение этому млекопитающему количества соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений, которое (количество) является эффективным в сенсибилизации аномальных клеток к лечению облучением или для усиления эффектов лечения облучением. Количество соединения, соли или сольвата формулы (I) в этом способе может быть определено согласно методикам выявления эффективных количеств таких соединений, описанным в данном изобретении. Данное изобретение также относится к способу и к фармацевтической композиции для ингибирования аномального клеточного роста у млекопитающего, которая содержит количество соединения формулы (I), или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений или их производного, меченного радиоактивным изотопом, и количество одного или более веществ, выбранных из антиангиогенезных агентов, ингибиторов трансдукции сигналов и антипролиферативных агентов. Антиангиогенезные агенты, такие как ингибиторы ММР-2 (матриксная металлопротеиназа 2), ингибиторы ММР-9 (матриксная металлопротеиназа 9) и ингибиторы СОХ-II (циклооксигеназа II), могут быть использованы вместе с соединением формулы (I) и фармацевтическими композициями, описанными в данном изобретении. Примеры полезных ингибиторов СОХ-II включают CELEBREX (алекоксиб),валдекоксиб и рофекоксиб. Примеры полезных ингибиторов матриксных металлопротеиназ описаны вWO 96/33172 (опубликованной 24 октября 1996 года), WO 96/27583 (опубликованной 7 марта 1996 года),заявке на европейский патент 97304971.1 (поданной 8 июля 1997 года), заявке на европейский патент 99308617.2 (поданной 29 октября 1999 года), WO 98/07697 (опубликованной 26 февраля 1998 года),WO 98/03516 (опубликованной 29 января 1998 года), WO 98/34918 (опубликованной 13 августа 1998 года), WO 98/34915 (опубликованной 13 августа 1998 года), WO 98/33768 (опубликованной 6 августа 1998 года), WO 98/30566 (опубликованной 16 июля 1998 года), публикации Европейского патента 606046(опубликованного 13 июля 1994 года), публикации Европейской патента 931788 (опубликованного 28 июля 1999 года), WO 90/05719 (опубликованной 31 мая 1990 года), WO 99/52910 (опубликованной 21 октября 1999 года), WO 99/52889 (опубликованной 21 октября 1999 года), WO 99/29667 (опубликованной 17 июня 1999 года), международной заявке РСТРСТ/IB98/01113 (поданной 21 июля 1998 года), заявке на европейский патент 99302232.1 (поданной 25 марта 1999 года), заявке на патент Великобритании 9912961.1 (поданной 3 июня 1999 года), предварительной заявке США 60/148464 (поданной 12 августа 1999 года), патенте США 5863949 (опубликованном 26 января 1999 года), патенте США 5861510(опубликованном 19 января 1999 года) и публикации Европейского патента 780386 (опубликованного 25 июня 1997 года); все они включены в данное описание изобретения во всей своей полноте посредством ссылки. Предпочтительными ингибиторами ММР-2 и ММР-9 являются ингибиторы, имеющие незначительную активность в отношении ингибирования ММР-1 или не имеющие такой активности. Более предпочтительными являются ингибиторы, селективно ингибирующие ММР-2 и/или ММР-9 по сравнению с другими матриксными металлопротеиназами (то есть ММР-1, ММР-3, ММР-4, ММР-5, ММР-6,ММР-7, ММР-8, ММР-10, ММР-11, ММР-12 и ММР-13). Некоторые конкретные примеры ингибиторов ММР, полезные в настоящем изобретении, представляют собой приномастат, RO 32-3555, RS 13-0830 и соединения, перечисленные в следующем далее списке: 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовая кислота; гидроксиамид 3-экзо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; гидроксиамид (2R,3R)-1-[4-(2-хлор-4-фторбензилокси-бензолсульфонил]-3-гидрокси-3-метилпиперидин-2-карбоновой кислоты; гидроксиамид 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклобутил)амино]пропионовая кислота; гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид (R)-3-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-3-карбоновой кислоты; гидроксиамид (2R,3R)-1-[4-(4-фтор-2-метилбензилокси)бензолсульфонил]-3-гидрокси-3-метилпиперидин-2-карбоновой кислоты; 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоил-1-метилэтил)амино]пропионовая кислота; 3-4-(4-фторфенокси)бензолсульфонил]-(4-гидроксикарбамоилтетрагидропиран-4-ил)амино]пропионовая кислота; гидроксиамид 3-экзо-3-[4-(4-хлорфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; гидроксиамид 3-эндо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; и гидроксиамид (R)-3-[4-(4-фторфенокси)бензолсульфониламино]тетрагидрофуран-3-карбоновой кислоты; и фармацевтически приемлемые соли и сольваты указанных соединений. Другие антиангиогенезные агенты, в том числе другие ингибиторы СОХ-II и другие ингибиторы ММР, также могут быть использованы в настоящем изобретении. Данное изобретение также относится к способу лечения у млекопитающего заболевания, связанного с васкулогенезом или ангиогенезом, включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы (I) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов указанных соединений вместе с терапевтически эффективным количеством антигипертензивного агента. Соединение формулы (I) также может быть использовано вместе с ингибиторами трансдукции сигналов, такими как агенты, которые могут ингибировать ответы EGFR (рецептор эпидермального фактора роста), как например антитела к EGFR, антитела к EGF и молекулы, являющиеся ингибиторами EGFR; ингибиторы VEGFR (рецептор эндотелиального фактора роста сосудов), как например органические молекулы или антитела, которые связываются с VEGF рецептором; и ингибиторы erbB2 рецептора, такие- 13009994 как органические молекулы или антитела, которые связываются с erbB2 рецептором, например HERCEPTIN (Genentech, Inc. of South San Francisco, California, США). Ингибиторы EGFR описаны, например в WO 95/19970 (опубликованной 27 июля 1995 г.), WO 98/14451 (опубликованной 9 апреля 1998 г.), WO 98/02434 (опубликованной 22 января 1998 г.) и патенте США 5747498 (опубликованном 5 мая 1998 г.), и такие вещества могут быть использованы в настоящем изобретении, как описано в данном изобретении. EGFR-ингибирующие агенты включают, но не ограничиваются этим, моноклональные антитела С 225 и анти-EGFR 22Mab (ImClone Systems Incorporated ofNew York, New York, США), соединения ZD-1839 (AstraZeneca), BIBX-1382 (Boehringer Ingelheim),MDX-447 (Medarex Inc. of Annandale, New Jersey, США) и OLX-103 (MerkCo. of Whitehouse Station,New Jersey, США), VRCTC-310 (Ventech Research) и токсин, слитый с EGF (Seragen Inc. of Hopkinton,Massachusettes). Эти и другие EGFR-ингибирующие агенты могут быть использованы в настоящем изобретении. Ингибиторы VEGFR, например SU-5416 и SU-6668 (Sugen Inc. of South San Francisco, California,США) также могут быть скомбинированы с соединением по настоящему изобретению. Ингибиторы(опубликованной 8 апреля 1999 г.) и WO 98/02437 (опубликованной 22 января 1998 г.); все они включены в данное описание изобретения во всей своей полноте посредством ссылки. Другими примерами некоторых конкретных ингибиторов VEGFR, полезных в настоящем изобретении, являются IM862 (CytranInc. of Kirkland, Washington, США); анти-VEGFR моноклональное антитело от Genentech, Inc. of SouthSan Francisco, California; и ангиозим - синтетический рибозим от Ribozyme (Boulder, Colorado) и Chiron(Emeryville, California). Эти и другие ингибиторы VEGFR могут быть использованы в настоящем изобретении, как изложено в данном описании. Кроме того, ингибиторы erbB2-рецептора, например GW-282974 (Glaxo Wellcome plc), и моноклональные антитела AR-209 (Aronex Pharmaceuticals Inc. of The Woodlands, Texas, США) и 2 В-1 (Chiron),можно комбинировать с соединением по изобретению, например соединения, указанные в WO 98/02434(опубликованной 17 апреля 1997 г.), WO 95/19970 (опубликованной 27 июля 1995 г.), патенте США 5587458 (опубликованном 24 декабря 1996 г.) и патенте США 5877305 (опубликованном 2 марта 1999 г.); все они тем самым включены в данное описание изобретения во всей своей полноте посредством ссылки. Ингибиторы erbB2-рецептора, полезные в настоящем изобретении, также описаны в предварительной заявке США 60/117341, поданной 27 января 1999 г., и предварительной заявке США 60/117346,поданной 27 января 1999 г., обе включены в данное описание изобретения во всей своей полноте посредством ссылки. Ингибирующие erbB2-рецептор соединения и вещества, описанные в вышеупомянутых заявках РСТ, патентах США и предварительных заявках США, а также другие соединения и вещества,ингибирующие erbB2-рецептор, могут быть использованы вместе с соединениями по настоящему изобретению. Соединения по изобретению могут быть использованы также вместе с другими агентами, полезными для лечения аномального клеточного роста или рака, включая, но не ограничиваясь ими, агенты, способные усиливать противоопухолевые иммунные ответы, такие как антитела к CTLA4 (цитотоксический лимфоцитарный антиген 4) и другие агенты, способные блокировать CTLA4; и антипролиферативные агенты, такие как другие ингибиторы фарнезил-протеинтрансферазы, и тому подобное. Специфические антитела к CTLA4, которые могут быть использованы в настоящем изобретении, включают таковые,описанные в предварительной заявке США 60/113647 (поданной 23 декабря 1998 года), которая включена посредством ссылки во всей своей полноте, однако и другие антитела к CTLA4 могут быть использованы в настоящем изобретении. Объект данного изобретения также включает меченные изотопами соединения, которые идентичны соединениям, описанным в формуле (Г), но с тем, что один или более чем один атом заменен атомом,имеющим атомную массу или массовое число, отличающиеся от атомной массы или массового числа,обычно встречающихся в природе. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора,такие как 2 Н, 3 Н, l3C, 14C, 15N, 18O, l7O, 31P, 32P, 35S, 18F и 36Cl, соответственно. Соединения по настоящему изобретению и фармацевтически приемлемые соли указанных соединений, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, находятся в пределах объема данного изобретения. Некоторые меченные изотопами соединения по настоящему изобре- 14009994 тению, например, соединения, в которые включены радиоактивные изотопы, такие как 3 Н и 14 С, полезны в анализах распределения лекарства и/или субстрата в тканях. В особенности предпочтительны тритиевые изотопы, то есть 3 Н, и углерод-14, то есть 14 С, ввиду легкости их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, то есть 2 Н, может давать некоторые терапевтические преимущества, вытекающие из большей метаболической стабильности, например требований увеличенного периода полувыведения in vivo или пониженной дозировки, и, следовательно,может быть использовано в некоторых обстоятельствах. Как правило, меченные изотопами соединения формулы (I) могут быть получены путем осуществления процедур, описанных ниже на схемах и/или в примерах, путем замещения не меченного изотопами реагента легко доступным реагентом, меченным изотопами. Соединения формулы (I) или фармацевтически приемлемые соли, или фармацевтически приемлемые сольваты указанных соединений, каждое из них также может быть независимо использовано для паллиативной неоадъювантной/адъювантной терапии, связанной с облегчением симптомов, ассоциированных с заболеваниями, перечисленными в данном изобретении, а также симптомов, ассоциированных с аномальным клеточным ростом. Такой вид терапии может представлять собой монотерапию или может осуществляться в комбинации с химиотерапией и/или иммунотерапией. Если заместители сами по себе не совместимы со способами синтеза по данному изобретению, то заместитель может быть защищен подходящей защитной группой, которая стабильна в реакционных условиях, используемых в этих способах. Защитная группа может быть удалена в подходящем месте последовательности реакций данного способа для получения желаемого промежуточного соединения или целевого соединения. Подходящие защитные группы и способы постановки и снятия защиты с разных заместителей с использованием таких подходящих защитных групп хорошо известны специалистам в данной области; примеры можно найти в Т. Greene and P. Wuts, Protecting Groups in Chemical Synthesis(3rd ed.), John WileySons, NY (1999), которая включена в данное описание изобретения посредством ссылки во всей своей полноте. В некоторых случаях можно специально выбрать заместитель, являющийся реакционноспособным в реакционных условиях, используемых в способах по данному изобретению. В этих обстоятельствах в данных реакционных условиях происходит превращение выбранного заместителя в другой заместитель, который либо является полезным в промежуточном соединении в способах по данному изобретению, либо является желательным заместителем в целевом соединении. Соединения по настоящему изобретению могут иметь асимметричные атомы углерода. Такие диастереомерные смеси могут быть разделены на их индивидуальные диастереомеры на основании их физико-химических различий способами, известными специалистам в данной области, например, хроматографией или фракционной кристаллизацией. Энантиомеры могут быть разделены путем превращения энантиомерных смесей в диастереомерную смесь путем осуществления взаимодействия с подходящим оптически активным соединением (например, спиртом), разделения диастереомеров и превращения (например, гидролизом) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Считается, что все такие изомеры, включая диастереомерные смеси и чистые энантиомеры, составляют часть данного изобретения. Соединения по настоящему изобретению в некоторых случаях могут существовать в виде таутомеров. Данное изобретение относится к применению всех таких таутомеров и их смесей. Предпочтительно, соединения по настоящему изобретению используют в форме, которая по меньшей мере на 90% является оптически чистой, то есть в форме, которая содержит по меньшей мере 90% одного изомера (80%-ный энантиомерный избыток (е.е.) или диастереомерный избыток (d.e., более предпочтительно по меньшей мере 95% (90%-ный е.е. или d.e.), еще более предпочтительно по меньшей мере 97,5% (95%-ный е.е. или d.e.) и наиболее предпочтительно по меньшей мере 99% (98%-ный е.е. илиd.e.). Кроме того, формулы предназначены для охвата сольватированных, а также несольватированных форм идентифицированных структур. Например, формула I включает соединения указанной структуры как в гидратированной, так и в негидратированной формах. Другие примеры сольватов включают структуры в комбинации с изопропанолом, этанолом, метанолом, ДМСО, этилацетатом, уксусной кислотой или этаноламином. В случае агентов, которые представляют собой твердые вещества, специалистам в данной области очевидно, что соединения и соли по изобретению могут существовать в различных кристаллических или полиморфных формах; которые все, как полагают, находятся в пределах объема настоящего изобретения и конкретных формул. Определения Как они использованы в данном изобретении, следующие термины имеют следующие значения, если не указано иначе. Термины содержащий и включающий использованы в расширенном, не ограничивающем смысле. Термины аномальный клеточный рост и гиперпролиферативное расстройство используются в данной заявке как взаимозаменяемые.- 15009994 Аномальный клеточный рост относится к клеточному росту, который не зависит от нормальных регуляторных механизмов (например, утрата контактного торможения), включая аномальный рост нормальных клеток и рост аномальных клеток. Он включает, но не ограничивается этим, аномальный рост:(1) опухолевых клеток (опухолей), как доброкачественных, так и злокачественных, экспрессирующих активированный онкоген Ras; (2) опухолевых клеток, как доброкачественных, так и злокачественных, в которых белок Ras активирован в результате онкогенной мутации в другом гене; (3) доброкачественных и злокачественных клеток при других пролиферативных заболеваниях, при которых наблюдается аберрантная активация Ras. Примерами таких доброкачественных пролиферативных заболеваний являются псориаз, доброкачественная гипертрофия предстательной железы, вирус папилломы человека (HPV) и рестеноз. Аномальный клеточный рост также относится к и включает аномальный рост клеток, как доброкачественных, так и злокачественных, являющийся результатом активности фермента фарнезилпротеинтрансферазы. Термин ацил включает алкильные, арильные или гетероарильные заместители, присоединенные к соединению через карбонильную функциональную группу (например, -С(O)-алкил, -С(O)-арил и так далее). Термин ациламино относится к ацильному радикалу, присоединенному к группе амино или алкиламино, и включает группы -C(O)-NH2 и -C(O)-NRR', где R и R' такие, как они определены для алкиламино. Термин ацилокси относится к сложноэфирной группе -OC(O)-R, где R представляет собой Н, алкил, алкенил, алкинил или арил. Термин алкенил включает алкильные группировки, имеющие по меньшей мере одну углеродуглеродную двойную связь, в том числе Е- и Z-изомеры указанной алкенильной группировки. Этот термин также включает циклоалкильные группировки, имеющие по меньшей мере одну углеродуглеродную двойную связь, то есть циклоалкенил. Примеры алкенильных радикалов включают этенил,пропенил, бутенил, 1,4-бутадиенил, циклопентенил, циклогексенил, проп-2-енил, бут-2-енил, бут-3-енил,2-метилпроп-2-енил, гекс-2-енил и тому подобное. Алкенильная группа может быть возможно замещена. Термин алкенилен относится к двухвалентной прямой цепи, разветвленной цепи или циклической насыщенной алифатической группе, содержащей по меньшей мере одну углерод-углеродную двойную связь и включающей Е- и Z-изомеры указанной алкениленовой группировки. Алкениленовая группа может быть возможно замещена. Термин алкокси означает О-алкильную группу. Примеры радикалов алкокси включают метокси,этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси и тому подобное. Термин алкил означает насыщенные одновалентные углеводородные радикалы, имеющие прямые, циклические или разветвленные группировки. Акильная группа может включать возможную углерод-углеродную двойную или тройную связь, причем алкильная группа содержит по меньшей мере два атома углерода. Циклоалкильные группировки требуют по меньшей мере трех атомов углерода. Примеры прямых или разветвленных алкильных радикалов включают метил (Me), этил (Et), н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, трет-амил, пентил, изопентил, гексил, гептил, октил и тому подобное. Алкильная группа может быть возможно замещена. Термин алкиламино относится к группе -NRR', где R и R' независимо выбраны из водорода (однако R и R' оба не могут быть водородом), алкильной и арильной групп; или R и R', взятые вместе, могут образовывать циклическую кольцевую систему. Термин алкилен относится к двухвалентной прямой цепи, разветвленной цепи или циклической насыщенной алифатической группе. Последняя группа также может быть отнесена более конкретно к циклоалкиленовой группе. Алкиленовая группа может быть возможно замещена. Термин алкилтио, один или в комбинации, относится к возможно замещенному радикалу алкилтио, алкил-S-. Термин алкинил относится к прямым и разветвленным алкинильным группам, имеющим от двух до двенадцати атомов углерода, предпочтительно от 2 до 6 атомов углеродов и более предпочтительно от 2 до 4 атомов углеродов. Иллюстративные алкинильные группы включают проп-2-инил, бут-2-инил, бут 3-инил, 2-метилбут-2-инил, гекс-2-инил и тому подобное. Алкинильная группа может быть возможно замещена. Термин амид относится к радикалу -C(O)N(R')(R"), где R' и R" каждый независимо выбран из водорода, алкила, алкенила, алкинила, -ОН, алкокси, циклоалкила, гетероциклоалкила, гетероарила, арила,которые определены выше; или R' и R" циклизуются вместе с азотом с образованием гетероциклоалкила или гетероарила. Термин амино относится к группе -NH2. Термин антинеопластический агент относится к агентам, способным ингибировать или предупреждать рост неоплазмов или контролировать созревание и пролиферацию злокачественных (раковых) клеток. Термин ароматический относится к соединениям или группировкам, содержащим множественные сопряженные двойные связи. Примеры ароматических группировок включают, но не ограничивают- 16009994 ся этим, арильные или гетероарильные кольцевые системы. Термин арил (Ar) означает органический радикал, происходящий из моноциклического или полициклического ароматического углеводорода путем удаления одного водорода, например фенил или нафтил. Предпочтительные арильные группы имеют от 4 до 20 кольцевых атомов и более предпочтительно от 6 до 14 кольцевых атомов. Арильная группа может быть возможно замещена. Иллюстративные примеры арильных групп включают следующие группировки: и тому подобное. Термин арилокси означает арил-О-. Термин арилтио означает радикал арилтио, арил-S-. Термин карбамоил или карбамат относится к группе -O-C(O)-NRR", где R и R" независимо выбраны из водорода, алкильной и арильной групп; и R и R", взятые вместе, могут образовать циклическую кольцевую систему. Термин карбоциклил включает возможно замещенные циклоалкильные и арильные группировки. Термин карбоциклил также включает циклоалкенильные группировки, имеющие по меньшей мере одну углерод-углеродную двойную связь. Термин карбокси-сложные эфиры относится к -C(O)OR, где R представляет собой алкил или арил. Термин циклоалкил относится к моноциклическому или полициклическому радикалу, который содержит только углерод и водород и может быть насыщенным, частично ненасыщенным или полностью ненасыщенным. Циклоалкильная группа может быть возможно замещена. Предпочтительные циклоалкильные группы включают группы, имеющие от трех до двенадцати кольцевых атомов, более предпочтительно от 5 до 10 кольцевых атомов. Иллюстративные примеры циклоалкильных групп включают следующие группировки: и подобные им соединения. Термин галогено или галоген означает фторо, хлоро, бромо или йодо. Предпочтительными группами галогено являются фторо, хлоро и бромо. Термины галогеноалкил, галогеноалкенил, галогеноалкинил и галогеноалкокси включают структуры алкила, алкенила, алкинила и алкокси, которые замещены одной или более группами галогено или их комбинациями. Термины гетероалкил, гетероалкенил и гетероалкинил включают возможно замещенные алкильные, алкенильные и алкинильные радикалы и радикалы, которые имеют один или более чем один атом в цепи остова, выбранный из атома, отличного от углерода, например кислорода, азота, серы, фосфора или их комбинаций. Термин гетероарил (гетеро-Ar) относится к арильной группе, содержащей один или более кольцевых гетероатомов, выбранных из азота, кислорода и серы. Гетероарильная группа может быть возможно замещена. Полициклическая гетероарильная группа может быть конденсированной или неконденсированной. Иллюстративные примеры арильных групп включают следующие группировки:- 17009994 и тому подобное. Термин гетероциклил относится к ароматическим и неароматическим гетероциклическим группам, содержащим от одного до четырех гетероатомов, каждый выбранный из О, S и N, где каждая гетероциклическая группа имеет от 4 до 10 атомов в своей кольцевой системе, и при условии, что кольцо указанной группы не содержит два соседних атома О или S. Неароматические гетероциклические группы включают группы, имеющие только 4 атома в своей кольцевой системе, а ароматические гетероциклические группы должны иметь по меньшей мере 5 атомов в своей кольцевой системе. Гетероциклические группы включают бензоконденсированные кольцевые системы. Примером 4-членной гетероциклической группы является азетидинил (происходящий из азетидина). Примером 5-членной гетероциклической группы является тиазолил. Примером 6-членной гетероциклической группы является пиридил, и примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил,тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино,тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2 Н-пиранил, 4 Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3 азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, 3H-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил,хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Приведенные выше группы, как происходящие из групп, перечисленных выше, могут быть С-присоединенными или N-присоединенными, где такое возможно. Например, группа, происходящая из пиррола, может представлять собой пиррол-1-ил (N-присоединенный) или пиррол-3-ил (С-присоединенный). Кроме того, группа, происходящая из имидазола, может представлять собой имидазол-1-ил или имидазол-3-ил (обе N-присоединенные) либо имидазол-2-ил, имидазол-4 ил или имидазол-5-ил (все С-присоединенные). Гетероциклические группы включают бензоконденсированные кольцевые системы и кольцевые системы, замещенные одной или двумя группировками оксо (=O), например пирролидин-2-он. Гетероциклильная группа может быть возможно замещена. Термин гетероциклический содержит как гетероциклоалкильные, так и гетероарильные группы. Гетероциклоалкильная группа относится к циклоалкильной группе, содержащей по меньшей мере один гетероатом, выбранный из азота, кислорода и серы. Эти радикалы могут быть сконденсированы с арилом или гетероарилом. Иллюстративные примеры гетероциклоалкильных групп включают и тому подобное. Термины 5-членный гетероциклический, 5- или 6-членный гетероциклический, 5-8-членный гетероциклический, 5-10-членный гетероциклический или 5-13-членный гетероциклический включают ароматические и неароматические гетероциклические группы, содержащие от одного до четырех гетероатомов, каждый выбраный из О, S и N, где каждая гетероциклическая группа имеет 5, 6, 5-8, 5-10 или 5-13 атомов в своей кольцевой системе, соответственно. Термин -членное кольцо может включать любую циклическую структуру. Термин -членный предназначен для обозначения количества структурных атомов, составляющих кольцо. Так, например,циклогексил, пиридин, пиран и тиопиран представляют собой 6-членные кольца, а циклопентил, пиррол,фуран и тиофен представляют собой 5-членные кольца.- 18009994 Термин неоплазма (или новообразование) определен как в Медицинском словаре Стедмана, 25 е издание (1990) (Stedman's Medical Dictionary 25th Edition (1990 и относится к аномальной ткани, которая растет в результате клеточной пролиферации более быстро, нежели нормальная, и продолжает расти после действия раздражителей, которые инициируют прекращение нового роста. Неоплазмы характеризуются частичной или полной утратой структурной организации и функционального взаимодействия по сравнению с нормальной тканью и обычно образуют отличающуюся массу ткани, которая может быть либо доброкачественной (доброкачественная опухоль), либо злокачественной (рак). Возможно замещенные группы могут быть замещенными или незамещенными. Когда замещены,заместители возможно замещенной группы могут включать, но не ограничиваются этим, один или более заместителей, независимо выбранных из следующих групп или из определенных наборов, составленных из них: (С 1-С 6)алкила, (С 2-С 6)алкенила, (С 2-C6)алкинила, (С 1-С 6)гетероалкила, (С 1-C6) галогеноалкила, (С 2-С 6)галогеноалкенила, (С 2-C6)галогеноалкинила, (С 3-C6)циклоалкила, фенила, (C1-C6)алкокси, фенокси, (C1-C6)галогеноалкокси, амино, (С 1-C6)алкиламино, (C1-C6)алкилтио, феннл-S-, оксо, (C1-C6)карбоксисложного эфира, (С 1-С 6)карбоксамидо, (С 1-С 6)ацилокси, Н, галогена, CN, NO2, NH2, N3, NHCH3,N(CH3)2, SH, SCH3, OH, OCH3, OCF3, CH3, CF3, C(O)CH3, CO2CH3, CO2H, C(O)NH2, пиридинила, тиофена,фуранила, (C1-C6)карбамата и (C1-C6)мочевины. Возможно замещенная группа может быть незамещенной (например -СН 2 СН 3), полностью замещенной (например -CF2CF3), однозамещенной (например-CH2CH2F) или замещенной на уровне где-нибудь между полностью замещенной и однозамещенной (например, -CH2CF3). Термин оксо означает группу О. Термин пергалогено относится к группам, где каждая связь С-Н заменена связью С-галогено на алифатической или арильной группе. Примеры пергалогеноалкильных групп включают -CF3 и -CFCl2. Термин замещенный означает, что рассматриваемая группа, например алкильная группа, и так далее, может нести один или более заместителей. Термин уреил или мочевина относится к группе -N(R)-C(O)-NR'R", где R, R' и R" независимо выбраны из водорода, алкила, арила; и где каждый из R-R', R'-R" или R-R", взятые вместе, могут образовать циклическую кольцевую систему. Фармацевтические препараты и композиции В дополнение к соединениям формулы I данное изобретение включает N-оксиды, фармацевтически приемлемые сольваты и фармацевтически приемлемые соли таких соединений и сольватов. Термин фармацевтически приемлемый означает фармакологически приемлемый и, по существу,нетоксичный для субъекта, которому его вводят, агент. Фармакологическая композиция относится к смеси одного или более соединений, описанных в данном изобретении, или их физиологически приемлемых солей с другими химическими компонентами,такими как физиологически приемлемые носители и/или эксципиенты. Цель фармакологической композиции заключается в том, чтобы облегчать введение соединения в организм. Физиологически приемлемый носитель относится к носителю или разбавителю, который не вызывает значительного или какого-либо другого неприемлемого раздражения в организме и не подавляет неприемлемым образом биологическую активность и свойства вводимого соединения. Эксципиент обычно относится к веществу, часто к инертному веществу, добавляемому в фармакологическую композицию или каким-либо другим образом используемому в качестве наполнителя для облегчения введения соединения. Примеры эксципиентов включают, но не ограничиваются этим, карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин,растительные масла и полиэтиленгликоли. Фармацевтически приемлемая соль предназначена для обозначения соли, которая сохраняет биологическую эффективность свободных кислот и оснований конкретного соединения и которая не является биологически или как-либо иначе нежелательной. Соединение по данному изобретению может иметь достаточно кислотные, достаточно основные или обе функциональные группы и соответственно взаимодействовать с любым из ряда неорганических или органических оснований и неорганических и органических кислот с образованием фармацевтически приемлемой соли. Типичные фармацевтически приемлемые соли включают такие соли, полученные путем взаимодействия соединений по настоящему изобретению с минеральной или органической кислотой либо неорганическим основанием, как например соли, включая сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, йодиды, ацетаты, пропионаты,деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты,малонаты, сукцинаты, субераты, себакаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты,бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, -гидроксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2-сульфонаты и манделаты. Если соединение по изобретению представляет собой основание, то желаемая фармацевтически приемлемая соль может быть получена любым подходящим способом, доступным в данной области, на- 19009994 пример обработкой свободного основания неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, серная кислота, сульфаминовая кислота, азотная кислота, фосфорная кислота и тому подобное, или органической кислотой, такой как уксусная кислота, фенилуксусная кислота, пропионовая кислота, стеариновая кислота, молочная кислота, аскорбиновая кислота, малеиновая кислота,гидроксималеиновая кислота, изэтионовая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидиловая кислота, как например глюкуроновая кислота или галактуроновая кислота, альфа-оксикислота, как например лимонная кислота или винная кислота, аминокислота, как например аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, как например бензойная кислота, 2-ацетоксибензойная кислота или коричная кислота, сульфоновая кислота, как например птолуолсульфоновая кислота, метансульфоновая кислота или этансульфоновая кислота, и тому подобное. Если соединение по изобретению представляет собой кислоту, то желаемая фармацевтически приемлемая соль может быть получена любым подходящим способом, например обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочных металлов или гидроксид щелочноземельных металлов и тому подобное. Иллюстративные примеры подходящих солей включают органические соли, являющиеся производными аминокислот, таких как глицин и аргинин, аммония, карбонатов, бикарбонатов, первичных, вторичных и третичных аминов и циклических аминов, таких как бензиламины, пирролидины, пиперидин, морфолин и пиперазин, и неорганические соли, являющиеся производными натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития. Фармацевтические композиции по данному изобретению могут, альтернативно или в дополнение к соединению формулы (I), содержать в качестве активного ингредиента фармацевтически приемлемые соли таких соединений. Такие соединения и соли иногда называются в данном изобретении в собирательном значении как активные агенты или агенты. Очевидно, что для цели настоящего изобретения может быть использована любая сольватная (например гидратная) форма соединений формулы (I). Для лечения заболеваний, опосредованных путем модуляции или регуляции протеинкиназ, можно использовать терапевтически эффективные количества активных агентов по изобретению. Эффективное количество предназначено для обозначения такого количества агента, которое в значительной степени ингибирует пролиферацию и/или предотвращает дедифференцировку эукариотической клетки, например клетки млекопитающих, насекомых, растений или грибов, и эффективно для показанного применения,например конкретного терапевтического лечения. Композиции, содержащие соединение(я), описанное(ые) в данном изобретении, могут быть введены для профилактических и/или терапевтических способов лечения. При терапевтических применениях композиции вводят пациенту, уже страдающему от пролиферативного расстройства или состояния(включая, но не ограничиваясь этим, рак), которое описано выше, в количестве, достаточном для излечения или по меньшей мере частичного подавления симптомов пролиферативного расстройства или состояния. Количество, адекватное для достижения этой цели, определяется как терапевтически эффективное количество или доза. Количества, эффективные для этого применения, будут зависеть от серьезности и течения пролиферативного расстройства или состояния, предыдущего лечения, состояния здоровья пациента и его реакции на лекарства и заключения лечащего врача. При профилактических применениях композиции, содержащие соединения, описанные в данном изобретении, вводят пациенту, подверженному или уже с риском конкретного пролиферативного расстройства или состояния. Такое количество определяется как профилактически эффективное количество или доза. При этом применении точные количества также зависят от состояния здоровья пациента, массы и тому подобного. Среди специалистов в данной области считается правильным определять такие терапевтически эффективные или профилактически эффективные количества путем обычного экспериментирования (например, с помощью клинического испытания с увеличением дозы). Термины повышать или повышающий относится к увеличению или пролонгированию желаемого эффекта либо по эффективности, либо по продолжительности. Так, что касается повышения эффекта терапевтических агентов, термин повышающий относится к способности увеличивать или пролонгировать, либо по эффективности, либо по продолжительности, эффект других терапевтических агентов на систему (например, опухолевую клетку). Термин повышающее эффективность количество, как он использован в данном изобретении, относится к количеству, адекватному для повышения эффекта другого терапевтического агента в желаемой системе (включая, только в качестве примера, опухолевую клетку пациента). Когда применяются для пациента, то количества, эффективные для такого применения, будут зависеть от серьезности и течения пролиферативного расстройства (включая, но не ограничиваясь этим,рак), предыдущего лечения, состояния здоровья пациента и его реакции на лекарства и заключения лечащего врача. Среди специалистов в данной области считается правильным определять такие повышающие эффективность количества путем обычного экспериментирования. Как только наступило улучшение состояния пациентов, вводят поддерживающую дозу, если необходимо. Впоследствии дозировка или частота введения, или и то и другое, могут быть снижены в зави- 20009994 симости от симптомов до уровня, при котором сохраняется улучшение пролиферативного расстройства или состояния. Когда симптомы смягчены до желаемого уровня, лечение можно прекратить. Однако пациентам может потребоваться прерывистое продолжительное лечение по мере любого рецидива симптомов заболевания. Количество заданного агента, которое будет соответствовать такому количеству, будет варьировать в зависимости от таких факторов, как конкретное соединение, болезненное состояние и его тяжесть, индивидуальные особенности (например масса) субъекта или реципиента, нуждающегося в лечении, но тем не менее оно может быть определено рутинным способом, известным в данной области, в соответствии в конкретными обстоятельствами, сопровождающими данный случай (заболевание), включая, например,конкретный вводимый агент, способ введения, состояние, подвергаемое лечению; и подвергаемый лечению субъект или реципиент. Лечение предназначено для обозначения по меньшей мере облегчения болезненного состояния у субъекта, такого как млекопитающее (например человек), при котором, по меньшей мере, частично затрагивается активность одной или более киназ, например протеинкиназ, таких как тирозинкиназы, и включает: предупреждение возникновения болезненного состояния у млекопитающего, в особенности когда обнаруживается, что данное млекопитающее предрасположено к данному болезненному состоянию, но еще не поставлен диагноз, что оно его имеет; модуляцию и/или ингибирование болезненного состояния; и/или облегчение болезненного состояния. Предпочтительными являются агенты, которые эффективно регулируют, модулируют или ингибируют клеточную пролиферацию. Что касается конкретных механизмов, то предпочтительными являются ингибирование протеинкиназной активности, ассоциированной, среди прочих, с CDK комплексами, и такие механизмы, при которых ингибируется ангиогенез и/или воспаление. Настоящее изобретение также относится к способам модуляции или ингибирования протеинкиназной активности, например в ткани млекопитающих, путем введения соединения формулы (I). Активность агентов в качестве антипролиферативных средств легко измеряется известными способами, например путем использования целых клеточных культур в МТТ-анализе. Активность соединений формулы (I) в качестве модуляторов протеинкиназной активности, например активности киназ, можно измерить любым из способов, имеющихся в распоряжении специалистов в данной области, включая анализы in vivo и/или in vitro. Примеры подходящих анализов для измерений активности включают анализы, описанные в публикации международной заявкиWO 99/21845; Parast, et al., Biochemistry, 37, 16788-16801 (1998); Connell-Crowley and Harpes,Cell Cycle: Materials and Methods, (Michele Pagano, ed. Springer, Berlin, Germany) (1995); публикации международной заявкиWO 97/34876; и публикации международной заявкиWO 96/14843. Эти свойства могут быть определены, например, путем использования одной или более методик биологического тестирования, приведенных в примерах ниже. Активные агенты по изобретению можно вводить в фармацевтические композиции, как описано ниже. Фармацевтические композиции по данному изобретению содержат эффективное модулирующее,регулирующее или ингибирующее количество соединения формулы I и инертный, фармацевтически приемлемый носитель или разбавитель. В одном воплощении фармацевтических композиций предложены такие эффективные уровни соединений формулы (I), которые обеспечивают терапевтическое целебное действие, включая антипролиферативную способность. Под эффективными уровнями понимаются уровни, при которых пролиферация ингибируется или регулируется. Эти композиции приготавливают в стандартной лекарственной форме, целесообразной для способа введения, например парентерального или перорального введения. Соединение формулы (I) можно вводить в традиционной лекарственной форме, приготовленной путем объединения терапевтически эффективного количества агента (например соединения формулы I) в качестве активного ингредиента с соответствующими фармацевтическими носителями или разбавителями согласно традиционным методикам. Эти методики могут включать смешивание, грануляцию и прессование или растворение ингредиентов, как целесообразно, до желаемого препарата. Используемый фармацевтический носитель может быть либо твердым, либо жидким. Примерами твердых носителей являются лактоза, сахароза, тальк, желатин, агар, пектин, аравийская камедь, стеарат магния, стеариновая кислота и тому подобное. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, вода и тому подобное. Аналогично, носитель или разбавитель может включать удерживаемый во времени или высвобождаемый со временем материал, известный в данной области, например глицерилмоностеарат или глицерилдистеарат сам по себе или с воском, этилцеллюлозу,гидроксипропилметилцеллюлозу, метилметакрилат и тому подобное. Может быть использовано множество фармацевтических форм. Так, если используется твердый носитель, то препарат может быть приготовлен в виде таблетки, помещен в твердую желатиновую капсулу в порошковой или гранулированной форме или в форме лепешки или пастилки. Количество твердого носителя может варьировать, но обычно будет составлять от приблизительно 25 мг до приблизительно 1 г. Если используется жидкий носитель, то препарат будет находиться в форме сиропа, эмульсии, мягкой желатиновой капсулы, стерильного инъецируемого раствора или суспензии в ампуле или флаконе, или неводной жидкой суспензии. Для получения стабильной водорастворимой лекарственной формы фармацевтически приемлемую- 21009994 соль соединения формулы (I) можно растворить в водном растворе органической или неорганической кислоты, как например 0,3 М растворе янтарной кислоты или лимонной кислоты. Если растворимой солевой формы нет в наличии, то агент можно растворить в подходящем сорастворителе или в комбинациях сорастворителей. Примеры подходящих сорастворителей включают, но не ограничиваются этим,спирт, пропиленгликоль, полиэтиленгликоль 300, полисорбат 80, глицерин и тому подобное в диапазоне концентраций, варьирующих от 0 до 60% от общего объема. В типичном воплощении соединение формулы I растворяют в ДМСО и разбавляют водой. Композиция может быть представлена в форме раствора солевой формы активного ингредиента в соответствующем водном наполнителе, таком как вода, или изотонический физиологический раствор, или раствор декстрозы. Очевидно, что реальные дозировки агентов, используемых в композициях по этому изобретению,будут варьировать в соответствии с конкретным используемым комплексом, конкретной приготовленной композицией, способом введения и конкретным местом, реципиентом и заболеванием, которое лечат. Оптимальные дозировки для заданного набора условий могут быть установлены специалистами в данной области с использованием традиционных тестов по определению дозировок, принимая во внимание экспериментальные данные для агента. Для перорального введения примерная, обычно используемая суточная доза составляет от приблизительно 0,001 до приблизительно 1000 мг/кг массы тела с курсами лечения, повторяемыми с определенными интервалами. Композиции по изобретению могут быть изготовлены способами, обычно известными для приготовления фармацевтических композиций, например, с использованием традиционных методик, таких как смешивание, растворение, грануляция, изготовление драже, отмучивание, эмульгирование, инкапсулирование, включение или лиофилизация. Фармацевтические композиции могут быть приготовлены традиционным образом с использованием одного или более физиологически приемлемых носителей, которые могут быть выбраны из эксципиентов и вспомогательных веществ, облегчающих технологию переработки активных соединений в препараты, которые могут быть использованы в фармацевтике. Надлежащий препарат зависит от выбранного способа введения. Для инъекции агенты по изобретению могут быть приготовлены в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хенкса, раствор Рингера или забуференный физиологический раствор. Для введения через слизистые в препарате используют вещества, обеспечивающие проницаемость, соответствующие тому барьеру, через который следует пройти. Такие вещества, обеспечивающие проницаемость, в целом известны в данной области. Для перорального введения соединения могут быть легко приготовлены путем объединения соединений с фармацевтически приемлемыми носителями, известными в данной области. Такие носители позволяют изготовить препараты соединений по изобретению в виде таблеток, пилюль, драже, капсул,жидкостей, гелей, сиропов, взвесей, суспензий и тому подобного для перорального приема пациентом,которого лечат. Фармацевтические препараты для перорального применения могут быть получены с использованием твердого эксципиента в смеси с активным ингредиентом (агентом), возможно с измельчением полученной смеси и обработкой смеси гранул после добавления подходящих вспомогательных веществ, если нужно, для получения таблеток или сердцевин драже. Подходящие эксципиенты включают: наполнители, такие как сахара, в том числе лактоза, сахароза, маннит или сорбит; и препараты целлюлозы, например кукурузный крахмал, зерновой крахмал, рисовый крахмал, картофельный крахмал, желатин, камедь, метилцеллюлоза, гидроксипропилметил-целлюлоза, натрий-карбоксиметилцеллюлоза или поливинилпирролидон (PVP). При желании могут быть добавлены разрыхляющие агенты, такие как перекрестно сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, например альгинат натрия. Сердцевины драже предложены с подходящими покрытиями. Для этой цели можно использовать концентрированные растворы сахаров, которые могут возможно содержать гуммиарабик, поливинилпирролидон, гель карбопол, полиэтиленгликоль и/или диоксид титана, лаковые растворы и подходящие органические растворители или смеси растворителей. К таблеткам или покрытиям для драже могут быть добавлены красящие вещества или пигменты для идентификации или определения различных комбинаций агентов. Фармацевтические препараты, которые могут быть использованы перорально, включают заполняемые под давлением капсулы, изготовленные из желатина, а также мягкие герметично укупоренные капсулы, изготовленные из желатина и пластификатора, например глицерина или сорбита. Заполняемые под давлением капсулы могут содержать агенты в смеси с наполнителями, такими как лактоза, связующими,такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния, и, возможно, стабилизаторами. В мягких капсулах агенты могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Все препараты для перорального введения должны быть в дозировках, подходящих для такого введения. Для трансбуккального введения композициям придают форму таблеток или пастилок, изготовленных традиционными способами. Для введения интраназально или посредством ингаляции соединения для применения по настоящему изобретению удобно доставлять в форме аэрозольного спрея, используя находящиеся под давлением- 22009994 упаковки или небулайзер и подходящий пропеллент, например дихлордифторметан, трихлорфторметан,дихлортетрафторэтан, диоксид углерода или другой подходящий газ. В случае находящегося под давлением аэрозоля стандартная дозировка может быть определена путем обеспечения клапаном с целью доставки отмеренного количества. Капсулы и картриджи из желатина для использования в ингаляторе или инсуффляторе и тому подобном могут быть изготовлены содержащими порошковую смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал. Соединения могут быть приготовлены для парентерального введения путем инъекции, например путем болюс-инъекции или непрерывной инфузии. Препараты для инъекции могут быть представлены в стандартной лекарственной форме, например в ампулах или в многодозовых контейнерах, с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных наполнителях, и могут содержать агенты для приготовления препарата, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Фармацевтические препараты для парентерального введения включают водные растворы агентов в водорастворимой форме. Кроме того, суспензии агентов могут быть приготовлены в виде соответствующих масляных суспензий для инъекций. Подходящие липофильные растворители или наполнители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, увеличивающие вязкость суспензии, такие как натрий-карбоксиметилцеллюлоза, сорбит или декстран. Возможно, суспензия также может содержать подходящие стабилизаторы или агенты,увеличивающие растворимость соединений, с целью приготовления высоко концентрированных растворов. Для введения в глаз агент доставляют в фармацевтически приемлемом офтальмологическом наполнителе, так чтобы обеспечить контакт соединения с поверхностью глаза в течение периода времени, достаточного для проникновения соединения в роговицу и внутренние области глаза, например переднюю камеру, заднюю камеру, стекловидное тело, внутриглазную жидкость, жидкую часть стекловидного тела,роговицу, радужную оболочку/ресницы, хрусталик, сосудистую оболочку глаза/сетчатку и склеру. Фармацевтически приемлемым офтальмологическим наполнителем может быть мазь, растительное масло или инкапсулирующий материал. Соединение по изобретению также может быть инъецировано непосредственно внутрь жидкой части стекловидного тела или во внутриглазную жидкость. Кроме того, агенты можно вводить в сочетании с другими приемлемыми способами лечения офтальмологических заболеваний, такими как фотодинамическая терапия (PDT). Альтернативно, агенты могут быть в порошковой форме для разведения в подходящем разбавителе,например стерильной апирогенной воде, перед применением. Соединения также могут быть приготовлены в ректальных композициях, таких как суппозитории или удерживающие клизмы, например содержащие традиционные суппозиторные основы, такие как масло какао или другие глицериды. В дополнение к описанным выше препаратам агенты также могут быть приготовлены в виде депопрепарата. Такие препараты пролонгированного действия можно вводить путем имплантации (например подкожно или внутримышечно) или посредством внутримышечной инъекции. Так, например, соединения могут быть приготовлены с подходящими полимерными или гидрофобными материалами (например в виде эмульсии в приемлемом масле) или с ионообменными смолами либо в виде умеренно растворимых производных, например в виде умеренно растворимой соли. Типичным фармацевтическим носителем для гидрофобных соединений является система сорастворителей, содержащая бензиловый спирт, неполярное поверхностно-активное вещество, смешиваемый с водой органический полимер и водную фазу. Система сорастворителей может представлять собой систему VPD сорастворителей. VPD представляет собой раствор, содержащий 3% (мас./об.) бензилового спирта, 8% (мас./об.) неполярного поверхностно-активного вещества полисорбата 80 и 65% (мас./об.) полиэтиленгликоля 300, доведенный до объема абсолютным этанолом. Система VPD сорастворителей(VPD:5W) содержит VPD, разбавленный 1:1 5%-ной декстрозой в водном растворе. Эта система сорастворителей хорошо растворяет гидрофобные соединения и сама проявляет низкую токсичность при системном введении. Как и следовало ожидать, пропорции системы растворителей можно значительно варьировать без нарушения характеристик ее растворимости и токсичности. Кроме того, можно варьировать индивидуальные компоненты-сорастворители: например вместо полисорбата 80 можно использовать другие низкотоксичные неполярные поверхностно-активные вещества; можно варьировать размер фракции полиэтиленгликоля; полиэтиленгликоль можно заменить другими биосовместимыми полимерами, например поливинилпирролидоном; и можно заменить декстрозу другими сахарами или полисахаридами. Альтернативно, для гидрофобных фармацевтических соединений можно использовать другие системы доставки. Липосомы и эмульсии являются известными примерами наполнителей или носителей для доставки гидрофобных лекарств. Также могут быть использованы некоторые органические растворители, такие как диметилсульфоксид, хотя и ценой более высокой токсичности. К тому же, соединения могут быть доставлены с использованием системы непрерывного высвобождения, такой как полупроницаемые матрицы твердых гидрофобных полимеров, содержащие терапевтический агент. Различные ма- 23009994 териалы непрерывного высвобождения определены и известны специалистам в данной области. Капсулы непрерывного высвобождения могут, в зависимости от их химической природы, высвобождать соединения в течение промежутка времени от нескольких недель вплоть до более 100 суток. В зависимости от химической природы и биологической стабильности терапевтического реагента могут быть использованы дополнительные стратегии белковой стабилизации. Фармацевтические композиции также могут содержать подходящие твердофазные или гелеобразные носители или эксципиенты. Примеры таких носителей или эксципиентов включают карбонат кальция, фосфат кальция, сахара, крахмалы, производные целлюлозы, желатин и такие полимеры, как полиэтиленгликоли. Некоторые из соединений по изобретению могут быть предложены в виде солей с фармацевтически совместимыми противоионами. Фармацевтически совместимые соли могут быть образованы со многими кислотами, включая соляную, серную, уксусную, молочную, винную, яблочную, янтарную и так далее. Соли имеют тенденцию к большей растворимости в водных или других протонных растворителях, чем соответствующие формы в виде свободных оснований. Агенты по изобретению могут быть полезны в комбинации с известными противораковыми терапиями, такими как: агенты, взаимодействующие с ДНК, такие как цисплатин или доксорубицин; ингибиторы топоизомеразы II, такие как этопозид; ингибиторы топоизомеразы I, такие как СРТ-11 или топотекан; агенты, взаимодействующие с тубулином, такие как паклитаксел, доцетаксел или эпотилоны; гормональные агенты, такие как тамоксифен; ингибиторы тимидилатсинтазы, такие как 5-фторурацил; и антиметаболиты, такие как метотрексат. Их можно вводить вместе или последовательно и, когда вводят последовательно, то агенты можно вводить либо до, либо после введения известного противоракового или цитотоксического агента. Термин химиотерапевтический агент, как он использован в данном изобретении, включает, например, гормональные агенты, антиметаболиты, агенты, взаимодействующие с ДНК, агенты, взаимодействующие, с тубулином, и другие, такие как аспарагиназа или гидроксимочевины. Агенты, взаимодействующие с ДНК, включают алкилирующие агенты, такие как цисплатин, циклофосфамид, алтретамин; агенты, повреждающие цепь ДНК, такие как блеомицин; интеркалирующие ингибиторы топоизомеразы II, например дактиномицин и доксорубицин; неинтеркалирующие ингибиторы топоизомеразы II, такие как этопозид и тенипозид; и, например, пликамидин, связывающийся в малом желобке ДНК. Алкилирующие агенты могут образовывать ковалентные химические аддукты с клеточной ДНК,РНК или молекулами белков либо с меньшими по размерам аминокислотами, глутатионом, либо с подобными химическими соединениями. Примеры типичных алкилирующих агентов включают, но не ограничиваются этим, азотистые иприты, такие как хлорамбуцил, циклофосфамид, изофамид, мехлорэтамин, мелфалан, урацил иприт; азиридин, такой как тиотепа; метансульфонатные сложные эфиры, такие как бусульфан; нитрозомочевины, такие как кармустин, ломустин, стрептозоцин; платиновые комплексы, такие как цисплатин, карбоплатин; биоредуктивный алкилирующий агент, такой как митомицин, и прокарбазин, дакарбазин и алтретамин. Агенты, разрывающие цепь ДНК, включают, например, блеомицин. Ингибиторы ДНК-топоизомеразы II могут включать интеркалирующие агенты, например следующие: амсакрин, дактиномицин, даунорубицин, доксорубицин (адриамицин), идарубицин и митоксантрон; а также неинтеркалирующие агенты, такие как этопозид и тенипозид. Примером соединения, связывающегося в малом желобке ДНК, является пликамицин. Как правило, антиметаболиты вмешиваются в процесс образования нуклеиновых кислот и, следовательно, в процесс роста клеток посредством одного из двух основных механизмов. Некоторые лекарства ингибируют процесс образования дезоксирибонуклеозидтрифосфатов, являющихся предшественниками синтеза ДНК, таким образом ингибируя репликацию ДНК. Примеры этих соединений представляют собой аналоги пуринов или пиримидинов, и они включаются в пути нуклеотидного анаболизма. Эти аналоги затем заменяют в ДНК или РНК их нормальные дубликаты. Антиметаболиты, полезные в качестве химиотерапевтических агентов, включают, но не ограничиваются этим: фолатные антагонисты, такие как метотрексат и триметрексат; пиримидиновые антагонисты, такие как фторурацил, фтордезоксиуридин, СВ 3717, азацитидин, цитарабин и флоксуридин; пуриновые антагонисты, такие как меркаптопурин, 6-тиогуанин, флударабин, пентостатин; и ингибиторы рибонуклеотидредуктазы, такие как гидроксимочевина. Агенты, взаимодействующие с тубулином, действуют посредством связывания со специфическими сайтами на тубулине, белке, который полимеризуется с образованием микротрубочек в клетке. Микротрубочки представляют собой критические единицы клеточной структуры, и они необходимы для клеточного деления. Эти терапевтические агенты препятствуют образованию микротрубочек. Примеры агентов, взаимодействующих с тубулином, включают винкристин и винбластин, оба являющиеся алкалоидами, и паклитаксел (таксол). Гормональные агенты также полезны в лечении рака и опухолей, но очень редко в случае Вклеточных злокачественных новообразований. Они применяются в случае чувствительных к гормонам- 24009994 опухолей и обычно происходят из природных источников. Гормональные агенты включают, но не ограничиваются этим, эстрогены, конъюгированные эстрогены и этинилэстрадиол и диэтилстилбестерол,хлортрианизен и иденестрол; прогестины, такие как гидроксипрогестерона капроат, медроксипрогестерон и мегестрол; и андрогены, такие как тестостерон, тестостерона пропионат; флуокстиместерон и метилтестостерон. Кортикостероиды надпочечников получают из природного кортизола или гидрокортизона надпочечников и используют для лечения В-клеточных злокачественных новообразований. Их используют изза их противоспалительного действия, а также способности некоторых из них ингибировать митотическое деление и останавливать синтез ДНК. Эти соединения включают, но не ограничиваются этим, преднизон, дексаметазон, метилпреднизолон и преднизолон. Гормональные агенты высвобождения лютеинизирующего гормона или антагонисты гонадотропинрилизинг-гормона используются в первую очередь для лечения рака предстательной железы. Они включают лейпролида ацетат и госерелина ацетат. Они предотвращают биосинтез стероидов в яичках. Антигормональные антигены включают, например, антиэстрогенные агенты, такие как тамоксифен,антиандрогенные агенты, такие как флутамид; и антиадреноагенты, такие как митотан и аминоглутетимид. Другие агенты включают гидроксимочевину (которая, по-видимому, действует главным образом путем ингибирования фермента рибонуклеотид-редуктазы) и аспарагиназу (фермент, который превращает аспарагин в аспарагиновую кислоту и, таким образом, ингибирует синтез белка). Агентами, используемыми в раковой терапии, являются антитела, меченные радиоактивными изотопами, в том числе Zevalin (IDEC Pharmaceuticals Corp.) и Bexxar (Corixa, Inc.), но не ограничиваются этим; применение любого другого радиоактивного изотопа (например, 90Y и 131I), связанного с антителом или фрагментом антитела, которые распознают антиген, экспрессирующийся неоплазмой; внешнее направленное излучение или любой другой способ применения радиоактивного излучения для лечения пациента. Кроме того, агентами, используемыми в раковой терапии, являются цитотоксины, включая, но не ограничиваясь этим, антитело или фрагмент антитела, связанные с цитотоксином, или любой другой способ селективной доставки цитотоксического агента в опухолевую клетку. Кроме того, агентами, используемыми в раковой терапии, являются селективные способы разрушения ДНК или любой способ доставки тепла к опухолевым клеткам, включая, только в качестве примера,наночастицы. Кроме того, агентом, используемыми в раковой терапии, является применение немеченных антител или фрагментов антител, способных убивать или истощать опухолевые клетки, включая, только в качестве примера, Rituxan (IDEC Pharmaceuticals Corp.) и Herceptin (Genentech). Агенты могут быть получены с использованием реакционных путей и схем синтеза, которые описаны ниже, с применением общих методик, известных в данной области, с использованием легко доступных исходных материалов. Получение предпочтительных соединений по настоящему изобретению подробно описано в следующих далее примерах, однако среднему специалисту будет понятно, что описанные химические реакции можно легко адаптировать для получения ряда других антипролиферативных средств или протеинкиназных ингибиторов по изобретению. Например, синтез не представленных в качестве примеров соединений по изобретению может быть успешно осуществлен посредством модификаций, очевидных специалистам в данной области, например посредством соответствующей защиты мешающих групп, путем замены на другие подходящие реагенты, известные в данной области, или путем проведения стандартных модификаций реакционных условий. Альтернативно, будут очевидны и другие реакции, описанные в данном изобретении или известные в данной области, как имеющие применимость для получения других соединений по изобретению. Подробное описание изобретения Соединения формулы (I) могут действовать как антагонисты VEGFR2. Не ограничиваясь какойлибо конкретной теорией, полагают, что связанные кольца обеспечивают благоприятное пространственное заполнение и электростатическую комплементарность в активном центре белка-мишени: наличие хинолиновой группировки дает структурные преимущества, проиллюстрированные введением соединенных посредством простой эфирной связи солюбилизирующих групп в положении 6 или 7 хинолинового кольца (изображенного ниже): Кроме того, и без связи с какой-либо конкретной теорией полагают, что физико-химические изменения, вытекающие из введения заместителей по положениям 6 и 7 хинолинового кольца, включают, но не ограничиваются этим: повышенную растворимость в воде и селективность (в отношении FGF) полу- 25009994 ченных соединений и благоприятное изменение в фармакокинетических, динамических и метаболических (PDM) характеристиках. В описанных ниже примерах, если не указано иначе, все значения температуры приведены в градусах по шкале Цельсия и все доли и проценты даны по массе. Реагенты приобретали у коммерческих поставщиков, таких как Aldrich Chemical Company или Lancaster Synthesis Ltd., и использовали без дальнейшей очистки, если не указано иначе. Тетрагидрофуран(ТГФ), N,N-диметилформамид (ДМФА), дихлорметан, толуол и диоксан были приобретены в Aldrich в надежно запечатанных бутылках и использованы по мере получения. Все растворители очищали с применением стандартных способов, хорошо известных специалистам в данной области, если не указано иначе. Приведенные ниже реакции обычно проводили при положительном давлении аргона или азота либо с применением осушительного патрона при температуре окружающей среды (если не указано иначе) в безводных растворителях, и реакционные колбы были оснащены резиновыми мембранами для введения субстратов и реагентов с помощью шприца. Стеклянную посуду сушили в сушильном шкафу и/или нагреванием. Аналитическую тонкослойную хроматографию (ТСХ) проводили на стеклянных пластинахAnaltech (0,25 мм), покрытых силикагелем 60 F 254, и элюировали смесями растворителей с соответствующими отношениями (об./об.), указанными, где необходимо. Реакции оценивали посредством ТСХ и останавливали, исходя из расходования исходного материала. Визуализацию ТСХ пластин проводили с использованием аэрозольного реагента на основе параанисового альдегида либо реагента на основе фосфомолибдатной кислоты (Aldrich Chemical; 20 мас.% в этаноле) и активировали теплом. Обработку обычно проводили, удваивая реакционный объем добавлением реакционного растворителя или растворителя для экстракции и затем промывая указанными водными растворами с использованием 25 об.% от объема экстракции, если не указано иначе. Растворы продуктов сушили над безводным Na2SO4 перед фильтрацией и выпариванием растворителей при пониженном давлении на роторном испарителе, и указывалось, что растворители удалены в вакууме. Колоночную флэш-хроматографию (Still et al., J. Org. Chem., 43, 2923 (1978 проводили с использованием флэшсиликагеля марки Baker (47-61 мкм) и соотношения силикагель/неочищенный материал приблизительно от 20:1 до 50:1, если не указано иначе. Гидрогенолиз проводили под давлением, указанным в примерах,или при атмосферном давлении. Спектры 1 Н-ЯМР регистрировали на приборе Bruker, действующем при 300 МГц, а спектры 13 СЯМР регистрировали, работая при 75 МГц. Спектры ЯМР получали в растворах CDCl3 (приведены в млн 1), используя хлороформ в качестве ссылочного стандарта (7,25 млн-1 и 77,00 млн-1), или CD3OD (3,4 и 4,8 млн-1 и 49,3 млн-1), или внутренний стандарт тетраметилсилан (0,00 млн-1), как целесообразно. При необходимости применяли другие растворители для ЯМР. Когда сообщается о множественности пиков, используются следующие сокращения: s (синглет), d (дублет), t (триплет), m (мультиплет), br (уширенный),dd (дублет дублетов), dt (дублет триплетов). Константы взаимодействия, когда приведены, представлены в герцах (Гц). Инфракрасные (ИК) спектры регистрировали на спектрометре Perkin-Elmer FT-IR в виде чистых масел, в виде KBr таблеток или в виде растворов в CDCl3, и когда приведены, представлены в волновых числах (см-1). Масс-спектры получали с использованием LS/MS или электрораспыления. Все точки плавления (т.пл.) не скорректированы. Общие схемы синтеза, используемые для получения хинолиновых аналогов Схема I. Общий способ получения 4-хлорхинолиновых аналогов (I-F)- 26009994 На этой схеме R представляет собой заместитель R6, как он определен для формулы (I). Ссылка: 1) У. Am. Chem. Soc, 68, 1204-1208 (1946); 2) J. Am. Chern. Soc, 68, 113-116,1946.A. Получение соединения I-D. Смесь замещенного анилина I-A (1 экв.) и диэтил(этоксиметилен)малоната I-B (1 экв.) помещали в круглодонную колбу и нагревали в масляной бане. Когда температура масляной бани достигала 135 С,образовывался EtOH, и его собирали с использованием холодильника. Реакционную смесь нагревали при 160 С в течение 40 мин, получая соединение I-C. Реакционную колбу удаляли из масляной бани. В колбу добавляли фениловый эфир (приблизительно два объема реакционной смеси). Реакционную колбу помещали в масляную баню, которая была предварительно нагрета до 270 С. Реакционную смесь перемешивали и нагревали до 240-245 С (температура реагентов внутри колбы) в течение 15 мин. Реакционную колбу удаляли из нагревающей бани и содержимое колбы медленно выливали в гексан. Соединение I-D собирали фильтрацией и промывали гексаном для удаления фенилового эфира. Выходы реакций, начиная от соединения I-A и до соединения I-D, обычно находились в диапазоне от 60 до 90%.B. Получение соединения I-Е. Раствор соединения I-D (5 г) и KOH (3 экв.) в 60 мл смеси H2O/OH(СН 2)2 ОН (1:1) помещали в герметично закрытый сосуд (сосуд ХР-500 Plus). Реакционную смесь нагревали в микроволновом реакторе(MARS 5 Microwave System) при 200 С под давлением 220-240 ф/кв. дюйм (1516,9-1654,8 кПа) в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры и выливали в H2O (100 мл). Раствор подкисляли 2 н. HCl до рН 6, насыщали NaCl и экстрагировали ТГФ (3200 мл). Объединенный масляный слой промывали рассолом и концентрировали, получая соединение I-Е (выход 80%).C. Получение Соединения I-F. Соединение I-Е растворяли в чистом POCl3 (избыток). Раствор нагревали до температуры дефлегмации в течение 2 ч. Избыточное количество POCl3 удаляли выпариванием под вакуумом. Остаток подщелачивали NH4OH и экстрагировали EtOAc. Органический слой концентрировали. Остаток очищали колоночной хроматографией, используя смесь от 3:1 до 1:1 гексан/EtOAc и получая соединение I-F (7090%). Схема II. Общий способ получения (хинолин-4-ил)окси-1-бензофурановых (или бензотиофеновых,или индоловых) аналогов (II-С).(1,5-2 экв.) в безводном ДМСО нагревали до 120-130 С в течение 2 ч. Темно-коричневый раствор экстрагировали EtOAc. Органический слой промывали рассолом, сушили (MgSO4) и концентрировали. Остаток очищали колоночной хроматографией на силикагеле, используя 2-5% МеОН в CH2Cl2 и получая соединение II-С с выходом 50-90%. Схема III. Общий способ получения (индол-5-ил)хинолин-4-амина (III-С) Раствор 4-хлорхинолина III-А (1 экв.), 5-амино-N,2-диметил-1 Н-индол-1-карбоксамида III-В (1 экв.) и HCl в диоксане (1,0 экв.) в смешанном растворителе EtOH/ClCH2CH2Cl (1:1) нагревали до 80-90 С в течение 2-6 ч. Раствор экстрагировали EtOAc. Органический слой промывали рассолом, сушили (MgSO4) и концентрировали. Остаток очищали колоночной хроматографией на силикагеле, используя 2-5% МеОН в CH2Cl2 и получая соединение III-С с выходом 50-90%. Схема IV. Общий способ получения карбоксамидных аналогов (IV-B)(1) Способ IV(1). Соединение IV-A (1 экв.) нагревали до температуры дефлегмации в чистом SOCl2 (избыток) в течение 2 мин. Избыточное количество SOCl2 удаляли выпариванием под вакуумом. Остаток растворяли в дихлорметане. К этому раствору добавляли Et3N (3 экв.) и соответствующий амин. Раствор перемешивали при комнатной температуре в течение 30 мин, экстрагировали EtOAc, промывали (рассол) и концентрировали. Остаток очищали колоночной хроматографией на силикагеле, используя 2-10% MeOH/(2) Способ IV(2). К раствору соединения IV-А (1 экв.) в дихлорметане при комнатной температуре добавляли оксалилхлорид (5 экв.). Раствор перемешивали в течение 1 ч и концентрировали под вакуумом. Остаток растворяли в дихлорметане. К этому раствору добавляли Et3N (3 экв.) и соответствующий амин. Раствор перемешивали при комнатной температуре в течение 30 мин, экстрагировали EtOAc, промывали (рассол) и концентрировали. Остаток очищали колоночной хроматографией на силикагеле, используя 2-10%(3) Способ IV(3). К раствору соединения IV-A (1 экв.) в ДМФА при комнатной температуре добавляли Et3N (1,5 экв.) и HATU (1,2 экв.). После перемешивания в течение 10 мин к данному раствору добавляли соответствующий амин. Раствор перемешивали при комнатной температуре в течение 30 мин, экстрагировалиEtOAc, промывали (рассол) и концентрировали. Остаток очищали колоночной хроматографией на силикагеле, используя 2-10% MeOH/CH2Cl2, или ВЭЖХ (20-70% CH3CN/H2O), получая соединение IV-B. Примеры Пример 1. Получение N-(2-метил-1H-индол-5-ил)-7-(трифторметил)хинолин-4-амина. Это соединение получали согласно схеме синтеза, изображенной и описанной ниже.(EtOH/дихлорэтан, 1:1,6 мл) нагревали до 90 С в герметично закрытой пробирке в течение ночи. Реакционную смесь концентрировали и растворяли в 2 мл ДМСО. Раствор очищали посредством ВЭЖХ (DionexSystem, 20-60% CH3CN/H2O в течение 30 мин). Получали 40 мг N-(2-метил-1H-индол-5-ил)-7(трифторметил)хинолин-4-амина 1. 1 Н-ЯМР (300 МГц, ДМСО-d6)млн-1 2.50 (s, 3H), 6.26 (s, 1H), 6.75 (d, J= 5.46 Гц, 1 Н), 7.08 (d, J = 8.48 Гц, 1H), 7.46 (m, 2 Н), 7.87 (d, J = 8.85 Гц, 1 Н), 8.24 (s, 1H), 8.54 (d, J = 5.27 Гц, 1 Н), 8.77 (s, 1H), 9.32(s, 1H), 11.14 (s, 1H). LC/MS (жидкостная хроматография/масс-спектрометрия) (APCI (химическая ионизация при атмосферном давлении), положит.): 342,1 (М+Н). Пример 2. Получение 8-хлор-N-(2-метнл-1 Н-индол-5-ил)хинолин-4-амина- 28009994 Это соединение получали способами, аналогичными способам, описанным в примере 1. Н-ЯМР (300 МГц, ДМСО-d6)млн-1 2.58 (s, 3H), 6.33 (s, 1H), 6.78 (d, J = 5.46 Гц, 1H), 7.16 (m, 1H),7.53 (m, 1 Н), 7.62 (d, J = 7.35 Гц, 1 Н), 8.04 (d, J = 7.35 Гц, 1 Н), 8.59 (m, 2 Н), 9.21 (s, 1 Н), 11.21 (s, 1 Н). Это соединение получали с использованием способов, аналогичных способам, описанным в примере 1 и на схеме III. 1 Н-ЯМР (300 МГц, ДМСО-d6)млн-1 2.15 (s, 3H), 5.89 (s, 1H), 6.32 (m, 1H), 6.73 (d, J = 8.10 Гц, 1H),7.09 (d, J = 6.97 Гц, 2 Н), 7.23 (s, 1 Н), 7.40 (d, J = 8.10 Гц, 1 Н), 7.59 (s, 1 Н), 8.11 (m, 2 Н), 8.64 (s, 1H), 10.76 Это соединение получали с использованием способов, аналогичных способам, описанным в примере 1 и на схеме III. 1 Н-ЯМР (300 МГц, ДМСО-d6)млн-1 2.44 (s, 3H), 2.83 (s, 3H), 7.40 (m, 1H), 7.54 (m, 1 Н), 7.74 (s,1H), 7.85 (s, 1H), 8.12 (s, 1 Н), 8.46 (s, 1H), 8.53 (d, J = 9.42 Гц, 1 Н), 9.88 (s, 1H). LC/MS (APCI, положит.): 366,1 (М+Н). Пример 5. Получение 6-гидрокси-N,2-диметил-1-бензофуран-3-карбоксамида Это соединение получали согласно схеме синтеза, изображенной и описанной ниже:I2 (40,9 г; 161,1 ммоль) растворяли в CHCl3 (850 мл) с перемешиванием в течение 1 ч. Раствор медленно добавляли в реакционную смесь 3-метоксифенола 5-А (20 г; 161,1 ммоль) и трифторацетата серебра в 200 мл CHCl3 в течение 1,5 ч. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Твердые вещества удаляли путем фильтрации. Фильтрат промывали 5%-ным Na2S2O3 (500 мл), насыщенным NaHCO3, рассолом, сушили над MgSO4 и концентрировали. Неочищенную смесь растирали с тетрахлоридом углерода, получая 2-йод-5-метоксифенол 5-В (13,6 г) в виде твердого вещества белого цвета. Оставшиеся неочищенные продукты очищали с помощью колоночной хроматографии на силикагеле, элюируя CH2Cl2, с получением 28,2 г соединения 5-В. Раствор соединения 5-В (14,6 г; 58,5 ммоль), CuI (0,56 г; 2,9 ммоль), N,N,N',N'-тетраметилгуанидина(74 мл; 585 ммоль) и дихлорбис(трифенилфосфин)палладия(II) (3,9 г; 5,5 ммоль) в 200 мл безводного ДМФА охлаждали до -78 С. Через него в течение 25 мин продували газообразный пропин. Помещали баллон для улавливания пропина. Реакционную смесь перемешивали в течение 17 ч, позволяли температуре повыситься от -78 С до комнатной температуры. Раствор выливали в 200 мл воды и экстрагировалиEtOAc, промывали водой, рассолом и сушили над MgSO4. С помощью колоночной хроматографии на силикагеле с элюцией смесью гексан/этилацетат (9:1) получали 6-метокси-2-метил-1-бензофуран 5-С (4,4 г; выход 46%). Суспензию AlCl3 (18 г; 135 ммоль) в дихлорметане (250 мл) охлаждали до 0 С. К этой суспензии добавляли оксалилхлорид (12 мл; 135 ммоль) и перемешивали в течение 30 мин. Затем в течение 10 мин добавляли раствор соединения 5-С (4,38 г; 27 ммоль) в 100 мл дихлорметана. Ледяную баню убирали. Реакционную смесь оставляли перемешиваться в течение 2 ч при комнатной температуре. Реакционную смесь выливали в смесь насыщенного NaCl и льда и разделяли фазы. Водный слой экстрагировалиCH2Cl2. Объединенный органический слой сушили над MgSO4 и концентрировали, получая неочищенную смесь соединения 5-D (6,5 г). Полученное неочищенное соединение 5-D (6,5 г) без очистки растворяли в 50 мл ТГФ. К этому раствору добавляли раствор метиламина (68 мл; 2,0 М в ТГФ). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь экстрагировали EtOAc, промывали рассолом, сушили (MgSO4), концентрировали и очищали с помощью колоночной хроматографии на силикагеле,элюируя смесью CH2Cl2/EtOAc (2:1), с получением соединения 5-Е (3,38 г; выход 57%, исходя из соединения 5-С). Раствор соединения 5-Е (3,38 г; 15,4 ммоль) в 50 мл дихлорметана охлаждали до -5 С. К этому раствору добавляли BBr3 (31 мл; 30,8 ммоль) в CH2Cl2 (1,0 М). Раствор перемешивали при -5 С в течение 1 ч. Добавляли дополнительно 15 мл раствора BBr3, и реакционную смесь перемешивали в течение 1 ч при 0 С. Раствор выливали в смесь насыщенного NaHCO3 и льда. Затем отделяли органический слой. Водный слой экстрагировали EtOAc. Объединенный органический слой промывали (рассол), сушили над Это соединение получали согласно схеме синтеза, изображенной и описанной ниже: Смесь 3-йоданилина 6-А (10 г; 45,6 ммоль) и диэтил(этоксиметилен)малоната 6-В (10 г; 45,6 ммоль) нагревали в масляной бане до 150 С в течение 40 мин. Реакционную смесь медленно, с перемешиванием выливали в 500 мл EtOH. Диэтил-[(3-йодфенил)амино]метиленмалонат 6-С (14,5 г; выход 88%) собирали в виде белого осадка путем фильтрации. Соединение 6-С (14,5 г) помещали в круглодонную колбу, оборудованную ловушкой для сбораEtOH, образующегося во время реакции. В колбу добавляли фениловый эфир (60 мл). После нагревания суспензии до 230 С раствор становился прозрачным и образовывался EtOH. Реакционную смесь оставляли стоять при 240-250 С в течение 45 мин, охлаждали до 160 С и медленно выливали в 600 мл гексана. Этил-4-гидрокси-7-йодхинолин-3-карбоксилат 6-D (11,1 г; выход 87%) выпадал в осадок, который отфильтровывали, промывали гексаном (2 раза) и сушили. Соединение 6-D (6,0 г) обрабатывали 20% LiOH (100 мл) з смешанном растворителе МеОН (100 мл)
МПК / Метки
МПК: A61K 31/435, C07D 401/14, C07D 407/14, A61P 35/00, C07D 409/14, C07D 409/12, C07D 401/12, C07D 407/12
Метки: новые, хинолиновые, производные
Код ссылки
<a href="https://eas.patents.su/30-9994-novye-hinolinovye-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Новые хинолиновые производные</a>
Предыдущий патент: Производные [[ 2-(амино-3,4-диоксо-1-циклобутен-1-ил)амино ]алкил]кислоты, применяемые для лечения боли
Следующий патент: Стабилизированные жидкие композиции интерферона, не содержащие человеческий сывороточный альбумин
Случайный патент: Уборочный агрегат












