Бициклические [3.1.0] производные в качестве ингибиторов переносчиков глицина
Формула / Реферат
1. Соединение формулы
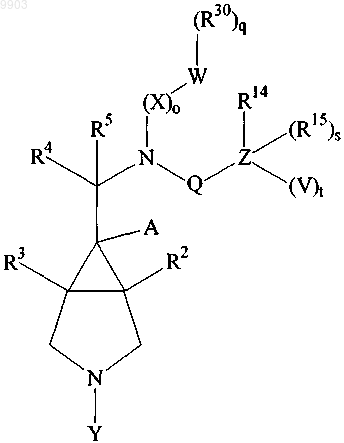
(I)
где Y представляет собой (R100)k-R1-(R6)m;
k равно 0 или 1;
I равно 0 или 1;
m равно 1 или 2;
o равно 1;
q равно 0, 1, 2, 3 или 4;
s равно 0 или 1;
t равно 0 или 1;
R100 представляет собой -С(=О)- или -SO2-;
R1 представляет собой -(C1-C6)алкил или (CH2)I-(C6-C10арил);
R6 могут быть одинаковыми или разными и независимо выбраны из H, -(C1-C6)алкил-В или
-CR7R8R9;
В представляет собой H;
R7, R8 и R9, каждый независимо, представляют собой H или (C1-C4)алкил;
R2 и R3, каждый независимо, представляют собой H;
R4 и R5, каждый независимо, представляют собой H;
А представляет собой H;
X представляет собой -С(=О) или -SO2;
W представляет собой 5-7-членный гетероарил или гетероциклил;
R30 представляет собой -(C1-C4)алкил;
Q представляет собой связь или -CH-(R31)r, где R31 представляет собой H;
Z представляет собой фенил или 5-7-членный гетероарил;
R14 представляет собой F, Cl, Br, I, H или -NR16R17;
R15 представляет собой -(C1-C3)алкил, -(C1-C3)алкокси, -F, -Br, -Cl, -I или -OH;
V представляет собой 5-7-членный гетероциклоалкил, 5-7-членный гетероциклоалкил, замещенный 1 или 2 группами C=O или 1, 2 или 3 (C1-C5)алкильными группами; или
R16 и R17 вместе с атомом азота, к которому они присоединены, образуют 4-7-членное гетероциклоалкильное кольцо, возможно содержащее от 1 до 3 дополнительных гетероатомов, независимо выбранных из N, S и О, и содержащее C=O, причем указанное гетероциклоалкильное кольцо возможно и независимо замещено 1-3 заместителями, независимо выбранными из (C1-C4)алкила;
или его фармацевтически приемлемые соли.
2. Соединение по п.1, стереохимия которого такая, как в формуле
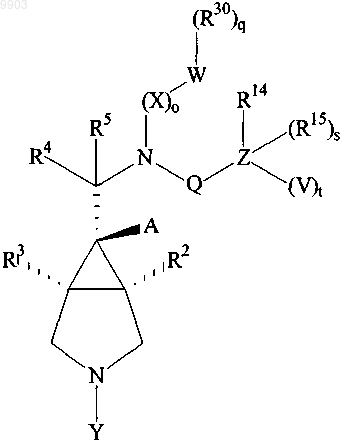
(II)
3. Соединение по п.1, стереохимия которого такая, как в формуле
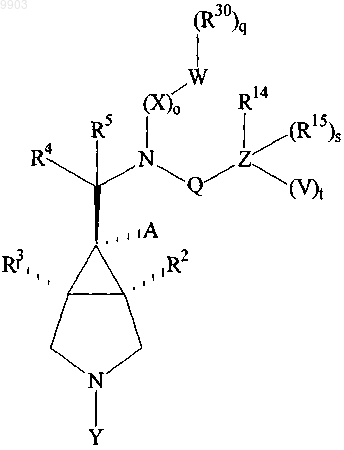
(III)
4. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Текст
009903 Предшествующий уровень техники Настоящее изобретение относится к бициклическим [3.1.0] аминам, к содержащим их фармацевтическим композициям и к их применению в лечении расстройств центральной нервной системы, когнитивных расстройств, шизофрении, деменции и других расстройств у млекопитающих, в том числе людей. Эти соединения проявляют активность как ингибиторы переносчика глицина типа 1. Шизофрения, прогрессирующее неврологическое заболевание, проявляется на своих ранних стадиях в виде расстройств мышления, таких как галлюцинации, параноидный бред и аномальные формы мышления, по совокупности известные как позитивные симптомы. Эти легко распознаваемые симптомы дали этому заболеванию историческое название сумасшествие. По мере прогрессирования заболевания более явными становятся негативные симптомы, такие как социальный аутизм и ангедония, и когнитивные симптомы, такие как деменция. Только приблизительно третья часть пациентов с шизофренией может быть с успехом вылечена и возвращена обществу, а остальных, как правило, помещают в специальное лечебное учреждение. Нагрузка на общество этого разрушительного заболевания и урон, который оно наносит членам семей пациентов, страдающих этим заболеванием, делают его одним из самых дорогостоящих из всех заболеваний ЦНС. Фармакологическое лечение шизофрении традиционно включало блокаду дофаминной системы,которая считается ответственной за ее позитивные симптомы. Однако такое лечение не учитывает негативные и когнитивные аспекты заболевания. Считается, что другой нейромедиаторной системой, играющей роль в шизофрении, является глутаматная система, основная возбуждающая медиаторная система в головном мозге. Эта гипотеза основывается на том наблюдении, что блокада глутаматной системы такими соединениями, как PCP (ангельская пыль), может воспроизводить многие симптомы шизофрении, в том числе ее позитивные, негативные и когнитивные аспекты. Если при шизофрении имеется дефицит глутаматергической передачи, усиление глутаматной системы, и в частности рецептора NMDA(N-метил-d-аспартат), может быть благоприятным. Несмотря на то что глутамат является основным агонистом рецепторов NMDA, глицин необходим в качестве коагониста для установления тонуса этого рецептора в отношении его ответной реакции на глутамат. Усиление этого тонуса путем увеличения воздействия глицина, возможно, приводит к усилению NMDA-нейротрансмиссии и обеспечивает потенциальную пользу в лечении шизофрении. Конкретный механизм усиления глицинергического тонуса NMDA-рецептора описан не так давно Бергероном с соавторами (Bergeron, et al., Proc. Natl. Acad. Sci. USA. 95, 15730, (1998, чья статья включена в данное описание посредством ссылки. Эта группа ученых показала, что специфический и сильнодействующий ингибитор переносчика глицина типа 1 (GlyT1), ответственного за высвобождение глицина в синапсе по рецептору NMDA, названный NFPS (WO 97/45115), может усиливать функцию рецепторов NMDA. Например, NFPS увеличивал постсинаптический ток, управляемый рецепторомNMDA, причем этот эффект блокировался как специфическим антагонистом NMDA-сайта, так и антагонистом глицинового сайта. Эта работа показывает, что даже если уровни глицина в головном мозге высокие относительно количества, необходимого для действия в качестве коагониста рецептора NMDA,GlyT1 эффективно высвобождает глицин в синапсе, и что ингибирование GlyT1 может усиливать функцию рецептора NMDA. Настоящее изобретение предусматривает ингибиторы GlyT1 в качестве средства для лечения таких расстройств или состояний, как шизофрения, благодаря усилению ими глутаматергической нейротрансмиссии. Краткое описание сущности изобретения Настоящее изобретение относится к соединениям формулыR6 могут быть одинаковыми или разными и независимо выбраны из H, галогено, -(C1-C6)алкил-В,(C1-C7)алкокси-D, (C2-C4)алкенокси, (C1-C6)алкил-OH, -OH, CN, -NO2, -CR7R8R9, -NR20R21,-NHCOалкил(C1-C3), NHSO2 алкил(C1-C3), C(=O)OR22, -R23-C(=O)OR22, -C(=O)NH2, фенил-Е, фенокси-F,морфолина, -NR20R21, арила, гетероарила, -S-R24 и -S02-R25;-NR R и -NHC(=O)(C1-C3)алкил, где указанные алкильные группы возможно замещены OH, OCH3,NH2, NHC(=O)(C1-C3)алкил, или R7 и R8 вместе с атомом углерода, к которому они присоединены, возможно образуют (C3-C7)циклоалкильное кольцо или (C4-C7)гетероциклоалкильное кольцо, которое содержит 1-3 гетероатома, выбранные из N, О, S, и возможно содержит группу C=O;R20 и R21 могут быть соединены посредством 4-7 атомов углерода, при этом от одного до трех указанных атомов углерода возможно могут быть заменены О, N или S с образованием гетероциклоалкильного кольца; илиR20 и R21 могут быть соединены посредством 3-7 атомов, выбранных из C, N, O или S, с образованием 5-10-членного гетероарильного кольца;R26 и R27, каждый независимо, представляют собой H или (C1-C3)алкил или R26 и R27 могут быть соединены посредством 4-7 атомов углерода с образованием гетероциклоалкильного кольца;R4 и R5, каждый независимо, представляют собой H или (C1-C3)алкил, или R4 и R5, взятые вместе,могут образовывать двойную связь с кислородом с образованием (C=O), или R4 и R5 соединены с 2-4 атомами углерода с образованием 3-5-членного карбоциклического кольца; А представляет собой H или (C1-C3)алкил-(R28)n;R28 независимо представляет собой (C1-C3)алкокси, -OH, -NR12R13 или -NHC(=O)(C1-C4)алкил;R12 и R13 могут быть соединены посредством 4-7 атомов углерода с образованием гетероциклоалкильного кольца;R31 независимо представляет собой H или -(C1-C3)алкил;(R )v либо R16 и R17 вместе с атомом азота, к которому они присоединены, образуют 4-7-членное гетеро-2 009903 циклоалкильное кольцо, возможно содержащее от 1 до 3 дополнительных гетероатомов, независимо выбранных из N, S и O, и содержащее C=O, причем указанное гетероциклоалкильное кольцо возможно и независимо замещено 1-3 заместителями, независимо выбранными из (C1-C4)алкила, OH, (C1-C4)алкокси,NH2, -NH(C=O)алкил, -NC1-C3)алкил)2, -C(=O)CH3, CONH2, CO2H, CH2OH, CH2Oалкил(C2-C4) и 5-7-членного гетероциклоалкила;R34 и R35, взятые вместе, могут образовывать мостик, содержащий 1-2 атома углерода; или их фармацевтически приемлемым солям. Это изобретение также относится к способу лечения расстройства или состояния, выбранного из психоза, шизофрении, кондуктивного расстройства, дезорганизованного расстройства поведения, биполярного расстройства, психотических эпизодов тревоги, тревоги, ассоциированной с психозом, психотических расстройств настроения, таких как тяжелое большое депрессивное расстройство; расстройств настроения, ассоциированных с психотическими расстройствами, такими как острый маниакальный синдром или депрессия, ассоциированная с биполярным расстройством, и расстройств настроения, ассоциированных с шизофренией, поведенческими проявлениями умственной отсталости, кондуктивным расстройством и аутистическим расстройством; двигательных расстройств, таких как синдром Туретта, акинетический-ригидный синдром, двигательные расстройства, ассоциированные с болезнью Паркинсона,поздней дискинезией и другими дискинезиями, вызванными употреблением лекарственных средств и связанными с нейродегенерацией; синдрома дефицита внимания с гиперактивностью; когнитивных расстройств, таких как деменции (в том числе возрастная деменция и сенильная деменция альцгеймеровского типа) и расстройств памяти, у млекопитающего, включающему введение млекопитающему, нуждающемуся в таком лечении, количества соединения формулы (I) или его фармацевтически приемлемой соли, эффективного для лечения такого расстройства или состояния. Это изобретение также относится к фармацевтической композиции для лечения расстройства или состояния, выбранного из психоза, шизофрении, кондуктивного расстройства, дезорганизованного расстройства поведения, биполярного расстройства, психотических эпизодов тревоги, тревоги, ассоциированной с психозом, психотических расстройств настроения, таких как тяжелое большое депрессивное расстройство; расстройств настроения, ассоциированных с психотическими расстройствами, такими как острый маниакальный синдром или депрессия, ассоциированная с биполярным расстройством, и расстройств настроения, ассоциированных с шизофренией, поведенческими проявлениями умственной отсталости, кондуктивным расстройством и аутистическим расстройством; двигательных расстройств, таких как синдром Туретта, акинетический-ригидный синдром, двигательные расстройства, ассоциированные с болезнью Паркинсона, поздней дискинезией и другими дискинезиями, вызванными употреблением лекарственных средств и связанными с нейродегенерацией; синдрома дефицита внимания с гиперактивностью; когнитивных расстройств, таких как деменции (в том числе возрастная деменция и сенильная деменция альцгеймеровского типа) и расстройств памяти, у млекопитающего, в том числе человека, содержащей соединение формулы (I) или его фармацевтически приемлемую соль в количестве, эффективном для лечения такого расстройства или состояния. Это изобретение также относится к способу лечения расстройства или состояния, выбранного из психоза, шизофрении, кондуктивного расстройства, дезорганизованного расстройства поведения, биполярного расстройства, психотических эпизодов тревоги, тревоги, ассоциированной с психозом, психотических расстройств настроения, таких как тяжелое большое депрессивное расстройство; расстройств настроения, ассоциированных с психотическими расстройствами, такими как острый маниакальный синдром или депрессия, ассоциированная с биполярным расстройством, и расстройств настроения, ассоциированных с шизофренией, поведенческими проявлениями умственной отсталости, кондуктивным расстройством и аутистическим расстройством; двигательных расстройств, таких как синдром Туретта, акинетический-ригидный синдром, двигательные расстройства, ассоциированные с болезнью Паркинсона,поздней дискинезией и другими дискинезиями, вызванными употреблением лекарственных средств и связанными с нейродегенерацией; синдрома дефицита внимания с гиперактивностью; когнитивных расстройств, таких как деменции (в том числе возрастная деменция и сенильная деменция альцгеймеровского типа) и расстройств памяти, у млекопитающего, в том числе человека, включающему введение млекопитающему, нуждающемуся в таком лечении, ингибирующего перенос глицина количества соединения формулы (I) или его фармацевтически приемлемой соли. Это изобретение также относится к фармацевтической композиции для лечения расстройства или состояния, выбранного из психоза, шизофрении, кондуктивного расстройства, дезорганизованного расстройства поведения,биполярного расстройства, психотических эпизодов тревоги;-3 009903 тревоги, ассоциированной с психозом, психотических расстройств настроения, таких как тяжелое большое депрессивное расстройство; расстройств настроения, ассоциированных с психотическими расстройствами, такими как острый маниакальный синдром или депрессия, ассоциированная с биполярным расстройством, и расстройств настроения, ассоциированных с шизофренией, поведенческими проявлениями умственной отсталости,кондуктивным расстройством и аутистическим расстройством; двигательных расстройств, таких как синдром Туретта, акинетический-ригидный синдром, двигательные расстройства, ассоциированные с болезнью Паркинсона, поздней дискинезией и другими дискинезиями, вызванными употреблением лекарственных средств и связанными с нейродегенерацией; синдрома дефицита внимания с гиперактивностью; когнитивных расстройств, таких как деменции (в том числе возрастная деменция и сенильная деменция альцгеймеровского типа), и расстройств памяти у млекопитающего, в том числе человека,содержащей соединение формулы (I) или его фармацевтически приемлемую соль в количестве, ингибирующем перенос глицина. Настоящее изобретение также включает меченные изотопом соединения, идентичные соединениям формулы (I), но у которых один или более атомов заменены атомом, имеющим атомную массу или массовое число, отличающуюся(ееся) от атомной массы или массового числа, обычно встречающихся в природе. Примерами изотопов, которые могут быть введены в соединения по настоящему изобретению, являются изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, например 2H, 3H,13 С, 11 С,14 С, 15N, 18O,17 О, 31 Р, 32 Р, 35S, 18F и 36Cl соответственно. Соединения по настоящему изобретению,их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, входят в объем данного изобретения. Некоторые меченные изотопом соединения по настоящему изобретению, например соединения, в которые введены такие радиоактивные изотопы, как 3H и 14 С, полезны в исследованиях по распределению лекарственного средства и/или субстрата в тканях. Изотопы тритий и 14 С особенно полезны для этой цели по причине легкости их введения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, может дать некоторые терапевтические преимущества,вытекающие из более высокой метаболической стабильности, например увеличение времени полувыведения in vivo или понижение требований по дозировке, и, следовательно, может быть предпочтительным в некоторых случаях. Обычно меченные изотопом соединения формулы (I) по данному изобретению и их пролекарства могут быть получены по методикам, описанным ниже на схемах и/или в примерах и подготовительных примерах, с заменой немеченого реагента легко доступным меченым реагентом. Подробное описание изобретения Термин алкил, как он использован в данном описании изобретения, если не указано иное, охватывает насыщенные одновалентные углеводородные радикалы, имеющие прямые, разветвленные или циклические группировки или их комбинации. Примерами алкильных групп являются, без ограничения, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, 3 этилбутил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, норборнил и т.п. Термин галогено, как он использован в данном описании изобретения, означает хлоро, фторо,йодо или бромо. Термин алкокси, как он использован в данном описании изобретения, означает алкил-О-, где алкил такой, как определено выше. Термин лечение, как он использован в данном описании изобретения, относится к реверсированию, ослаблению, торможению прогрессирования или предупреждению расстройства или состояния, к которому применяется такой термин, или к одному или более симптомам такого состояния или расстройства. Термин лечение, как он использован в данном описании изобретения, также относится к акту лечения, определенного непосредственно выше. Термин мостик, как он использован в данном описании изобретения, относится к мостику, содержащему 1 или 2 атома углерода, связывающему два головных атома мостика в циклической системе с образованием бициклического соединения. Используемое в данном описании изобретения выражение реакционно-инертный растворитель относится к системе растворителей, компоненты которой не взаимодействуют с исходными веществами,реагентами или промежуточными соединениями продуктов, неблагоприятно воздействуя на выход целевого продукта. Соединения формулы (I) могут иметь оптические центры и, следовательно, могут существовать в разных энантиомерных конфигурациях. Формула (I), которая изображена выше, охватывает все энантиомеры, диастереомеры и другие стереоизомеры соединений, изображенных на структурной формуле (I), а также рацемические и другие их смеси. Индивидуальные изомеры могут быть получены известными способами, такими как разделение оптических изомеров, оптически селективная реакция или хроматографическое разделение, при получении конечного продукта или его промежуточного.-4 009903 Другое воплощение изобретения относится к соединениям формулы (I), стереохимия которых такая, как в формуле(II) Еще одно воплощение изобретения относится к соединениям формулы (I), стереохимия которых такая, как в формуле(III) Еще одно воплощение изобретения относится к соединениям формулы (I), где примеры C6-C10 арила включают замещенный и незамещенный фенил, инденил, инданил и нафтил; примеры гетероциклоалкила включают гетероциклил и гетероциклические группировки указанного гетероциклил-(C1-C8)алкила-,которые выбраны из насыщенных или ненасыщенных неароматических моноциклических или бициклических кольцевых систем, где указанные моноциклические кольцевые системы содержат от четырех до семи кольцевых атомов углерода, из которых от одного до трех возможно могут быть заменены О, N,C=O или S; примеры гетероарила включают пиридинил, пиридазинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, хинолил, изохинолил, тетразолил, фурил, тиенил, изоксазолил, тиазолил,оксазолил, изотиазолил, пирролил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил,индолизинил, фталазинил, триазинил, изоиндолил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензтиофенил, бензотриазолил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил, дигидрохинолил, тетрагидрохинолил, дигидроизохинолил, тетрагидроизохинолил,бензофурил, фуропиридинил, пирролопиримидинил и азаиндолил. В определениях, приведенных в данном описании изобретения выше, Y может представлять собой либо H, либо (R100)kR1-(R6)m, где k равно 0 или 1. Понятно, что когда k равно 0, R100 представляет собой связь, так что R1 присоединен непосредственно к атому азота бициклического кольца. Как определено в данном описании изобретения, R1 представляет собой мостиковую группу, соединяющую атом N бициклического кольца с R6. Часть R1, которая присоединена непосредственно к R6, может быть моно-, ди- или тризамещенной радикалом R6 в зависимости от того, равно ли m единице, двум или трем соответственно. Например, когда m равно 2, Y представляет собой (R100)k-R1-(R6)2. Соединения формулы (I), приведенной выше, и их фармацевтически приемлемые соли, могут быть получены по приведенным ниже реакционным схемам 1-8, которые обсуждаются в данном описании изобретения ниже. Если не указано иное, А, В, D, Q, V, W, X, Y, Z, R1-R35 и R100 такие, как определено выше. Выделение и очистку продуктов выполняют стандартными способами, известными химику средней квалификации. Соединения формулы (I), приведенной выше, и их промежуточные соединения, показанные на приведенных ниже реакционных схемах, могут быть выделены и очищены общепринятыми способами, такими как перекристаллизация или хроматографическое разделение. Поскольку соединения формулы (I) по данному изобретению могут содержать основные заместите-5 009903 ли, они способны образовывать множество разных солей с различными неорганическими и органическими кислотами. Несмотря на то, что такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто бывает желательно сначала выделить из реакционной смеси основное соединение в виде фармацевтически неприемлемой соли, затем просто превратить ее в соединение в виде свободного основания путем обработки щелочным реагентом и после этого превратить свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты основных соединений по данному изобретению легко образуются путем обработки основного соединения,по существу, эквивалентным количеством выбранной неорганической или органической кислоты в водном растворителе или в подходящем органическом растворителе, таком как метанол или этанол. После тщательного выпаривания растворителя легко получается желаемая твердая соль. Кислоты, используемые для получения фармацевтически приемлемых солей присоединения кислоты вышеупомянутых основных соединений по данному изобретению, представляют собой кислоты, которые образуют нетоксичные соли присоединения кислоты, т.е. соли, содержащие фармацевтически приемлемые анионы, например соли гидрохлорид, гидробромид, гидройодид, нитрат, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, лактат, цитрат или кислый цитрат, тартрат или битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат,п-толуолсульфонат и памоат (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат. Соединения по настоящему изобретению проявляют значительную ингибирующую перенос глицина активность и, следовательно, полезны в лечении целого ряда клинических состояний, которые характеризуются дефицитом глутаматерической нейротрансмиссии у субъектов-млекопитающих, в частности у людей. Такие состояния включают позитивныеи негативные симптомы шизофрении и других видов психоза и когнитивные дефициты. Соединения по данному изобретению можно вводить млекопитающим как пероральным, парентеральным (например, подкожным, внутривенным, внутримышечным, интрастернальным и инфузионных методами), ректальным, интраназальным, так и местным путем. В общем, эти соединения наиболее желательно вводить людям в дозах приблизительно от 1 до приблизительно 2000 мг в сутки, хотя неизбежно будут иметь место вариации в зависимости от массы и состояния субъекта, которого лечат, и выбранного конкретного пути введения. Однако наиболее желательно использовать уровень дозировки приблизительно от 0,1 до приблизительно 20 мг на 1 кг массы тела в сутки. Тем не менее, еще могут иметь место варианты в зависимости от вида животного, которого лечат, и его индивидуальной ответной реакции на указанное лекарство, а также от типа выбранного фармацевтического препарата и от периода и промежутка времени, в течение которого такое введение осуществляют. В некоторых случаях более адекватными могут быть уровни дозировок ниже нижнего предела вышеуказанного диапазона, а в других случаях можно использовать еще большие дозы, не вызывая каких-либо вредных побочных эффектов,при условии, что такие более высокие уровни доз сначала разделяют на несколько небольших доз для введения на протяжении суток. В одном воплощении соединения по данному изобретению вводят в качестве дополнительного терапевтического вместе с известными антипсихотическими средствами, например геодоном (Geodon). Соединения по настоящему изобретению можно вводить одни или в комбинации с фармацевтически приемлемыми носителями или разбавителями любым из указанных выше путей, и такое введение можно проводить в однократной дозе или в многократных дозах. Более конкретно, новые терапевтические агенты по изобретению можно вводить в широком разнообразии различных лекарственных форм,т.е. они могут быть объединены с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, пастилок, лепешек, леденцов, порошков, спреев, кремов, бальзамов, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий, инъекционных растворов, эликсиров, сиропов и тому подобного. Такие носители включают твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители и так далее. Более того, в пероральные фармацевтические композиции могут быть добавлены подходящие подсластители и/или корригенты. В общем, терапевтически эффективные соединения по данному изобретению в таких лекарственных формах присутствуют в концентрации в пределах приблизительно от 5% до приблизительно 70% по массе. Для перорального введения можно использовать таблетки, содержащие различные эксципиенты,такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикальция фосфат и глицин, наряду с различными разрыхлителями, такими как крахмал и предпочтительно кукурузный, картофельный или крахмал из тапиоки, альгиновая кислота и некоторые комплексные силикаты, вместе со связывающими веществами для гранулирования, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Дополнительно, часто в целях таблетирования очень полезны смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также можно использовать в качестве наполнителей в желатиновых капсулах. Предпочтительные в этом отношении вещества также включают лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии и/или эликсиры, активный ингредиент объединяют с различными подсластителями или корригентами, красящим веществом или красителями и, если так желательно, с эмульгирующими и/или суспендирующими агентами, а также вме-6 009903 сте с таким разбавителями, как вода, этанол, пропиленгликоль, глицерин и различные их комбинации. Для парентерального введения можно использовать растворы соединения по настоящему изобретению либо в кунжутном или кокосовом масле, либо в водном пропиленгликоле. При необходимости водные растворы должны быть, соответственно, забуферены (предпочтительно pH более 8), а жидкий разбавитель сначала сделан изотоническим. Такие водные растворы подходят для внутривенных инъекций. Масляные растворы подходят для внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех этих растворов в стерильных условиях без труда может быть выполнено по стандартным фармацевтическим методикам, хорошо известным специалистам в данной области. Кроме того, соединения по настоящему изобретению также можно вводить местно при лечении воспалительных состояний кожи, и это может быть сделано предпочтительно с помощью кремов, желе, гелей, паст, мазей и тому подобного в соответствии с обычной фармацевтической практикой. Соединения по настоящему изобретению анализировали на их активность в ингибировании обратного захвата глицина в синаптосомах сначала получением синаптосом и затем измерением активности обратного захвата нейромедиатора, как описано далее, и результаты анализов представлены в табл. 1. Самцов крыс Sprague Dawley обезглавливали и извлекали головной мозг. Цельный головной мозг вырезали и помещали в охлажденный во льду сахарозный буфер; 1 г в 20 мл (320 мМ сахароза, содержащая 1 мг/мл глюкозы, 0,1 мМ EDTA (этилендиаминтетрауксусная кислота) и доведенная до pH 7,4 Tris основанием). Ткань гомогенизировали в стеклянной пробирке для гомогенизации с тефлоновым пестиком при 350 об/мин, используя гомогенизатор Поттера. Гомогенат центрифугировали при 1000g в течение 10 мин при 4 С. Полученный супернатант повторно центрифугировали при 17000g в течение 20 мин при 4 С. Конечный осадок ресуспендировали в соответствующем объеме сахарозного буфера, содержащего 5 мМ аланина, с достижением менее чем 10% захвата. Анализы по захвату проводили в 96-луночных матричных планшетах. Каждая лунка содержала по 25 мкл растворителя, ингибитора или 10 мМ глицина (для неспецифического захвата), по 200 мкл[3H]-глицина (конечная концентрация 40 нМ), приготовленного в модифицированном буфере Кребса,содержащем 5 мМ аланина и глюкозу (1 мг/мл), и по 25 мкл синаптосом. Планшеты затем инкубировали при комнатной температуре в течение 15 мин. Инкубацию останавливали фильтрованием черезGF/B-фильтры, используя 96-луночный харвестер Brandel Cell. Фильтры промывали модифицированным буфером Кребса и считывали либо на жидкостном сцинтилляционном счетчике, либо на LKB Beta Plate счетчике. Было обнаружено, что соединения по изобретению, проанализированные этим методом анализа, обладают значительной активностью в ингибировании обратного захвата глицина в синаптосомах,демонстрируя значения IC50, более эффективные чем 10 мкМ. Настоящее изобретение иллюстрируется примерами, показанными в табл. 1 и 2 и в подготовительных примерах. Однако следует иметь в виду, что изобретение не ограничено конкретными подробностями этих примеров. Точки плавления были измерены на приборе для измерения точек плавления Buchimicro, и они не скорректированы. Инфракрасные (ИК) спектры поглощения регистрировали на инфракрасном спектрометре Shimazu (IR-470). 1H- и 13 С-спектры ядерного магнитного резонанса (ЯМР) регистрировали в CDCl3 на ЯМР-спектрометре Varian (Unity, 400 МГц для 1H, 100 МГц для 13 С), если не указано иное. Положения пиков выражены в миллионных долях (млн-1) по нисходящей от тетраметилсилана. Формы пиков обозначены следующим образом: s - синглет; d - дублет; t - триплет; m - мультиплет;br - широкий. Фармацевтическая композиция для лечения расстройства или состояния, выбранного из психоза,шизофрении, кондуктивного расстройства, дезорганизованного расстройства поведения, биполярного расстройства, психотических эпизодов тревоги, тревоги, ассоциированной с психозом, психотических расстройств настроения, выбранных из тяжелого большого депрессивного расстройства; расстройств настроения, ассоциированных с психотическими расстройствами, выбранными из острого маниакального синдрома и депрессии, ассоциированной с биполярным расстройством, и расстройств настроения, ассоциированных с шизофренией; поведенческих проявлений умственной отсталости, кондуктивного расстройства и аутистического расстройства; двигательных расстройств, выбранных из синдрома Туретта,акинетического-ригидного синдрома, двигательных расстройств, ассоциированных с болезнью Паркинсона, поздней дискинезией и другими дискинезиями, вызванными употреблением лекарственных средств и связанными с нейродегенерацией; синдрома дефицита внимания с гиперактивностью; когнитивных расстройств, выбранных из деменций, возрастной деменций и сенильной деменций альцгеймеровского типа; и расстройств памяти, у млекопитающего, содержащая количество соединения по п.1 формулы изобретения, эффективное для лечения такого расстройства или состояния. В процессе осуществления любой из приведенных ниже последовательностей синтеза может быть необходимо и/или желательно защитить чувствительные или реакционноспособные группы на любой из участвующих молекул. Этого можно достичь с помощью традиционных защитных групп, например описанных в Т.W. Greene, Protective Groups in Organic Chemistry, John WileySons, 1981 и Т.W. Greene and-7 009903 Соединения формулы (I), приведенной выше, и их фармацевтически приемлемые соли могут быть получены согласно приведенным ниже реакционным схемам 1-7, которые обсуждаются в данном описании изобретения ниже. Если не указано иное, A, B, D, Q, V, W, X, Y, Z, R1-R35 и R100 такие, как определено выше. Выделение и очистку продуктов выполняют стандартными способами, известными химику обычной квалификации. Приведенные ниже схемы представляют собой типичные примеры способов получения соединений формулы (I). Схема 1 иллюстрирует способ получения соединений, имеющих основную структуру формулы (I),где A представляет собой водород, X представляет собой C=O или SO2, W представляет собой 2-тиофен,Q представляет собой одинарную связь или метиленовую группу, Y представляет собой H, R2 и R3 представляют собой H, a Z, R14, R15 и V такие, как определено выше. Согласно схеме 1 соединение формулы (I) [SynLett, 1996, 1097] может быть обработано (BOC)2O в присутствии подходящего основания, такого как триэтиламин, в растворителях, таких как CH2Cl2, с получением желаемого карбамата формулы (II). Окисление первичного спирта в условиях Сверна (Swern) с использованием DMSO (диметилсульфоксида) и оксалилхлорида в присутствии подходящего основания,такого как триэтиламин (TEA) или диизопропилэтиламин (DIEA), в растворителях, таких как CH2Cl2 или 1,2-дихлорэтан (DCE), при температуре в пределах от -78 С до комнатной температуры, предпочтительно приблизительно при комнатной температуре дает соответствующий альдегид (не изображен). Другие подходящие реагенты для окисления для этого превращения включают TPAP/NMO (перрутенат тетрапропиламмония/4-метилморфолина N-оксид) или РСС (хлорхромат пиридиния). Обработка альдегида соответственно замещенным амином или анилином формулы (III) и подходящим восстановителем, таким как NaCNBH3, в растворителе, таком как MeOH, при температуре в пределах от -5 С до комнатной температуры, предпочтительно приблизительно при комнатной температуре,приводит к получению желаемого амина формулы (IV). Другие подходящие восстановители для этой реакции включают NaBH4 или NaHB(OAc)3 в растворителях, таких как MeOH, CH2Cl2 или DCE. Другие подходящие условия для этого превращения включают обработку соответствующего альдегида аминным реагентом (III) в CH2Cl2 или DCE в присутствии молекулярных сит 4 и основания, такого как TEA, при комнатной температуре с последующей обработкой NaHB(OAc)3. Схема 1 Соединения формулы (VI) могут быть получены путем обработки амина формулы (IV) соответственно замещенным хлорангидридом кислоты или сульфонилхлоридом формулы (V) в присутствии подходящего основания, такого как DIEA, пиридин или TEA, в растворителях, таких как DCE или CH2Cl2,при температуре в пределах от комнатной температуры до приблизительно температуры дефлегмации,предпочтительно приблизительно при комнатной температуре, с получением соответствующего соединения формулы (VI). Наконец, соединения формулы (VII) могут быть получены путем обработки карбамата формулы (VI) TFA (трифторуксусной кислотой) в растворителях, таких как CH2Cl2 или DCE, при температуре от 0 С до приблизительно комнатной температуры, предпочтительно приблизительно при комнатной температуре с получением соответствующего амина формулы (VII). Схема 2 иллюстрирует способ получения соединений, имеющих основную структуру формулы (I),где A представляет собой водород, X представляет собой C=O или SO2, W представляет собой 2-тиофен,Q представляет собой одинарную связь или метиленовую группу, R100 представляет собой метилен (CH2) или замещенный метилен, R2 и R3 представляют собой H, a Z, R14, R15, R1, R6, m, V и Y такие, как опреде-8 009903 лено выше. Согласно приведенной ниже схеме 2 соединения формулы (VIII) могут быть получены путем обработки амина формулы (VII), соответственно, замещенным альдегидом или кетоном и восстановителем,таким как NaHB(OAc)3, в растворителях, таких как CH2Cl2 или DCE, при температуре от 0 С до приблизительно комнатной температуры, предпочтительно приблизительно при комнатной температуре с получением соответствующего амина формулы (VIII). Другие подходящие условия этого способа включают обработку амина формулы (VII) альдегидом в толуоле приблизительно при температуре дефлегмации с последующей обработкой с использованием NaBH4 в растворителях, таких как MeOH, до образования соответствующего амина формулы (VIII). Кроме того, обработка амина формулы (VII) альдегидом иNaCNBH3 в растворителе, таком как MeOH, приводит к получению соответствующего амина формулы Схема 2 Схема 3 иллюстрирует способ получения соединений, имеющих основную структуру формулы (I),где A представляет собой водород, X представляет собой C=O или SO2, W представляет собой 2-тиофен,Q представляет собой одинарную связь или метиленовую группу, R100 представляет собой C=O или SO2,R2 и R3 представляют собой H, a Z, R14, R15, R1, R6, V и Y такие, как определено выше. Согласно приведенной ниже схеме 3 соединения формулы (VIII), где R100=C=O, могут быть получены путем обработки соединений формулы (VII) соответственно замещенным хлорангидридом кислоты(R100=C=O) формулы (IX) в присутствии подходящего основания, такого как DIEA, в растворителях, таких как CH2Cl2 или DCE, при температуре от 0 С до приблизительно комнатной температуры, предпочтительно приблизительно при комнатной температуре до образования соответствующих соединений формулы (VIII). Кроме того, соединения формулы (VIII), где R100=SO2, могут быть получены путем обработки соединений формулы (VII) соответственно замещенным сульфонилхлоридом (R100=SO2) формулы (IX) в присутствии подходящего основания, такого как DIEA или TEA, в растворителях, таких какCH2Cl2 или DCE, при температуре в пределах от комнатной температуры до приблизительно температуры дефлегмации, предпочтительно приблизительно при температуре дефлегмации до образования соединений формулы (VIII). Схема 3 Схема 4 иллюстрирует способ получения соединений, имеющих основную структуру формулы (I),где A представляет собой водород, X представляет собой C=O, Q представляет собой одинарную связь или метиленовую группу, R100 представляет собой C=O, CH2 или SO2, R2 и R3 представляют собой H, aW, q, R30, Z, R14, R15, R1, R6, V и Y такие, как определено выше. Согласно приведенной схеме 4 соединения формулы (XII) могут быть получены путем обработки соединений формулы (X) соответственно замещенным хлорангидридом кислоты формулы (XI) в присутствии подходящего основания, такого как пиридин, DIEA или TEA, в растворителях, таких как CH2Cl2 или DCE, при температуре от 0 С до приблизительно комнатной температуры, предпочтительно приблизительно при комнатной температуре до образования соответствующих соединений формулы (XII). Схема 5 иллюстрирует способ получения соединений, имеющих основную структуру формулы (I),где А представляет собой водород, X представляет собой метилен (CH2), Q представляет собой одинарную связь или метиленовую группу, R100 представляет собой C=O или SO2, R2 и R3 представляют собойH, a W, o, q, R30, Z, R14, R15, R1, R6, V и Y такие, как определено выше. Согласно схеме 5 соединения формулы (X) могут быть обработаны соответствующим основанием,таким как NaH или KH, и соответственно замещенным алкилирующим агентом формулы (XIII), где L представляет собой подходящую уходящую группу, такую как Cl, Br, I, OMs, OTs, в растворителях, таких как THF (тетрагидрофуран) или эфир, при температуре от 0 С до приблизительно комнатной температуры, предпочтительно приблизительно при комнатной температуре до образования соединений формулы (XIV). Схема 5 Схема 6 иллюстрирует способ получения соединений, имеющих основную структуру формулы (I),где А представляет собой водород, Q представляет собой одинарную связь или метиленовую группу, R100 представляет собой C=O, CH2 или SO2, R2 и R3 представляют собой H, а X, W, q, R30, Z, R14, R15, R1, R6, V и Y такие, как определено выше. Согласно схеме 6 обработка соединения формулы (XV) соответственно замещенным первичным или вторичным амином (HNR16R17), подходящим катализатором, таким как ацетат палладия(II) и BINAP,и основанием, таким как трет-бутоксид натрия, в растворителях, таких как толуол, при температуре в пределах от комнатной температуры до приблизительно температуры дефлегмации, предпочтительно приблизительно при температуре дефлегмации, приводит к получению желаемого соединения формулы Альтернативно, соединения формулы (XVI), где группа Z является гетероарильной группировкой,такой как пиридиновая группа, могут быть получены альтернативным способом, описанным ниже. Согласно схеме 7 обработка соединения формулы (XVII), где галоген представляет собой бромо или хлоро,неразбавленного, соответственно замещенным первичным или вторичным амином (HNR16R17) при температуре от 50 до приблизительно 180 С, предпочтительно приблизительно при 150 С приводит к получению желаемого соединения формулы (XVI). Альтернативные условия этой реакции могут включать- 10009903 обработку соединений формулы (XVII) аминным реагентом (HNR16R17) в растворителях, таких как DMF(диметилформамид) или DMP (диметилфталат), при температуре в пределах от комнатной температуры до приблизительно температуры дефлегмации до образования соответствующих соединений формулы Следует заметить, что на приведенных выше схемах R6 представляет собой H. Однако настоящее изобретение предполагает схемы, когда R6 является иным, чем H, как определено в данном описании изобретения. Химические превращения, показанные на приведенных выше схемах, применимы в тех случаях, когда R6 является иным, чем водород. Однако если какой-либо из заместителей в R6 взаимодействует с реагентами или промежуточными соединениями, то R6 может быть защищен защитной группой с использованием методов, известных специалистам в данной области, таких как методы, описанные выше. Приведенные ниже примеры иллюстрируют настоящее изобретение. Должно быть понятно, однако,что данное изобретение, как оно полностью описано здесь и как оно изложено в формуле изобретения, не ограничивается деталями приведенных ниже примеров. Примеры Подготовительный пример 1. трет-Бутиловый эфир 6-гидроксиметил-3-аза-бицикло[3.1.0]гексан-3 карбоновой кислоты. К раствору (3-аза-бицикло[3.1.0]гекс-6-ил)метанол-HCl (11,8 г; 78,7 ммоль) в 350 мл безводногоCH2Cl2 при комнатной температуре добавляли Et3N (32,9 мл; 236 ммоль), а затем порциями добавляли(BOC)2O (18,9 г; 86,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Смесь промывали насыщенным NaHCO3, водой, рассолом и сушили над безводным MgSO4. Смесь фильтровали и концентрировали при пониженном давлении с получением неочищенного вещества, которое очищали флэш-хроматографией с использованием 10% MeOH/EtOAc. Содержащие продукт фракции собирали и концентрировали с получением целевого продукта (15,6 г). 400 МГц 1H ЯМР (CDCl3):3,42-3,56 (m, 4H), 3,24-3,37 (m, 2H), 1,72 (brs, 1H), 1,37-1,41 (m, 10H),0,87-0,93 (m, 1H);MS (M+1) 213,2. Подготовительный пример 2. трет-Бутиловый эфир 6-[(3-фтор-4-морфолин-4-ил-фениламино)метил]-3-аза-бицикло[3.1.0]гексан-3-карбоновой кислоты. К перемешиваемому раствору оксалилхлорида (0,49 мл; 5,63 ммоль) в 30 мл безводного CH2Cl2 при-78 С по каплям добавляли DMSO (0,87 мл; 12,2 ммоль). Через 10 мин добавляли трет-бутиловый эфир 6-гидроксиметил-3-аза-бицикло[3.1.0]гексан-3-карбоновой кислоты (1,0 г; 4,69 ммоль) в 10 мл безводного CH2Cl2. После перемешивания смеси в течение 30 мин добавляли триэтиламин (3,24 мл; 23,4 ммоль) и смесь оставляли медленно нагреваться до 0 С в течение 1 ч. Смесь концентрировали, полученное твердое вещество переносили в насыщенный NaHCO3 и EtOAc, слои разделяли и водный слой экстрагировали EtOAc. Объединенные органические слои сушили, фильтровали и концентрировали с получением неочищенного альдегида, который использовали на следующей стадии без очистки. К перемешиваемому раствору полученного выше альдегида (991 мг; 4,69 ммоль) в 30 мл MeOH добавляли 3-фтор-4-морфолиноанилин (920 мг; 4,69 ммоль), AcOH (0,38 мл; 6,56 ммоль) и NaCNBH3(295 мг; 4,69 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 90 мин. Смесь концентрировали при пониженном давлении и полученное вещество переносили в насыщенныйNaHCO3 и экстрагировали CH2Cl2. Объединенные органические слои сушили над безводным MgSO4,фильтровали и концентрировали при пониженном давлении. Полученный неочищенный материал очищали флэш-хроматографией с использованием 50% EtOAc/гексаны. Содержащие продукт фракции собирали и концентрировали с получением 1,3 г целевого амина. 400 МГц 1H ЯМР (CDCl3):6,74-6,81 (m, 1H), 6,30-6,42 (m, 2H), 3,81-3,83 (m, 4H), 3,61 (brs, 1H),3,59 (d, J=10,8 Гц, 1H), 3,51 (d, J=10,8 Гц, 1H), 3,32 (t, J=9,5 Гц, 2H), 2,93 (brs, 6H), 1,40 (s, 11H), 0,87-0,92- 11009903 Подготовительный пример 3. трет-Бутиловый эфир 6-[(3-фтор-4-морфолин-4-ил-фенил)-(тиофен 2-карбонил)амино]метил-3-аза-бицикло[3.1.0]гексан-3-карбоновой кислоты. К перемешиваемому раствору полученного выше трет-бутилового эфира 6-[(3-фтор-4-морфолин-4 ил-фениламино)метил]-3-аза-бицикло[3.1.0]гексан-3-карбоновой кислоты (500 мг; 1,28 ммоль) в 10 млDCE при комнатной температуре добавляли DIEA (0,33 мл; 1,92 ммоль) и 2-тиофенкарбонилхлорид(0,21 мл; 1,92 ммоль). Через 2 ч добавляли насыщенный NaHCO3 и эту смесь экстрагировали CH2Cl2. Объединенные экстракты сушили над безводным MgSO4, фильтровали и концентрировали при пониженном давлении. Полученное неочищенное вещество переносили в 50% EtOAc/гексаны и твердое вещество белого цвета отфильтровывали. Оставшийся фильтрат концентрировали при пониженном давлении с получением 640 мг целевого продукта. 400 МГц 1H ЯМР (CDCl3):7,26-7,28 (т, 1H), 6,83-7,15 (m, 4H), 6,76-6,78 (m, 1H), 3,79-3,85 (m, 5H),3,54-3,59 (m, 1H), 3,44 (d, J=11,0 Гц, 1H), 3,39 (d, J=11,0 Гц, 1H), 3,21-3,26 (m, 2H), 3,08-3.10 (m, 4H), 1,361,38 (m, 11H), 0,81-0,86 (m, 1H);MS (M+1). Подготовительный пример 4. (3-Аза-бицикло[3.1.0]гекс-6-илметил)-(3-фтор-4-морфолин-4-илфенил)амид тиофен-2-карбоновой кислоты, соль с трифторуксусной кислотой. К перемешиваемому раствору полученного выше трет-бутилового эфира 6-[(3-фтор-4-морфолин 4-ил-фенил)-(тиофен-2-карбонил)амино]метил-3-аза-бицикло[3.1.0]гексан-3-карбоновой кислоты(640 мг; 1,28 ммоль) в 6 мл CH2Cl2 при комнатной температуре добавляли 6 мл TFA. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали при пониженном давлении, переносили в толуол и снова концентрировали с получением 854 мг целевого продукта. 400 МГц 1H ЯМР (CDCl3):9,06 (brs, 1H), 8,62 (brs, 1H), 7,33-7,35 (m, 1H), 7,21-7,25 (m, 1H), 6,947,11 (m, 2H), 6,88-6,92 (m, 1H), 6,81-6,84 (m, 1H), 3,89-3,91 (m, 4H), 3,72 (d, J=7,05 Гц, 2H), 3,39-3,46 (m,4H), 3,16-3,18 (m, 4H), 1,77 (brs, 2H), 1,35-1,37 (m, 1H);MS (M+1) 402,1. Пример 1. (3-Бензил-3-аза-бицикло[3.1.0]гекс-6-илметил)-(3-фтор-4-морфолин-4-ил-фенил)амид тиофен-2-карбоновой кислоты. К перемешиваемому раствору полученной выше (3-аза-бицикло[3.1.0]гекс-6-илметил)-(3-фтор-4 морфолин-4-ил-фенил)амида тиофен-2-карбоновой кислоты соли с трифторуксусной кислотой (100 мл; 0,16 ммоль) в 4 мл CH2Cl2 при комнатной температуре добавляли бензальдегид (0,02 мл; 0,24 ммоль) иNaHB(OAc)3 (50 мг; 0,24 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакцию гасили добавлением насыщенного NaHCO3, слои разделяли, и водный слой экстрагировали CH2Cl2. Объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали при пониженном давлении. Полученное неочищенное вещество очищали флэшхроматографией с использованием 75% EtOAc/гексаны. Содержащие продукт фракции собирали и концентрировали с получением 32 мг целевого продукта. 400 МГц 1H ЯМР (CDCl3):7,17-7,29 (m, 6H), 6,94-6,98 (m, 4H), 6,78-6,80 (m, 1H), 3,86-3,88 (m, 4H),3,65 (d, J=7,47 Гц, 2H), 3,52 (brs, 2H), 3,09-3,12 (m, 4H), 2,86-2,88 (m, 2H), 2,26-2,28 (m,2H), 1,63 (brs, 1H),1,47 (brs, 1H), 1,21-1,25 (m, 1H);MS (M+1) 492,2. Общая методика получения соединений формулы (VIII) восстановительным алкилированием. К перемешиваемому раствору 1,0 экв. соединения формулы (VII) в метиленхлориде (0,2 М) при комнатной температуре добавляли соответственно замещенный альдегид (2,0 экв.), уксусную кислоту(2,0 экв.) и триацетоксиборгидрид натрия (2,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение вплоть до 24 ч. Смесь затем гасили добавлением насыщенного раствора бикарбоната натрия и экстрагировали метиленхлоридом. Объединенные органические слои сушили над безводным MgSO4 и концентрировали при пониженном давлении. Полученное неочищенное вещество очищали флэш-хроматографией с получением целевых третичных аминов с выходом 40-95%. Приведенные ниже соединения были получены по приведенной выше методике примера 1, начиная с соответствующего исходного амина формулы (VII) и соответствующего альдегида. Кроме того, фармацевтически приемлемые соли соединений, перечисленных ниже, могут быть получены следующим образом. К перемешиваемому раствору соединения общей формулы (VIII) (полученному, как описано выше в примере 1; 1,0 экв.) в подходящем растворителе, таком как метилэтилкетон, метиленхлорид/метанол(1:1) или метанол (0,1 М), при комнатной температуре добавляли соответствующую кислоту, например соляную, лимонную, п-толуолсульфоновую, метансульфоновую или бензолсульфоновую кислоты(2-3 экв.) одной порцией. Полученную смесь перемешивали при комнатной температуре в течение вплоть до 18 ч, и за это время образовывался осадок. После фильтрования твердого вещества и сушки при пониженном давлении были получены целевые соли.- 19009903 перемешивали при комнатной температуре в течение 1 ч, гасили насыщенным NaHCO3 и экстрагировалиCH2Cl2. Объединенные экстракты сушили над безводным MgSO4, фильтровали и концентрировали. Полученное неочищенное вещество очищали флэш-хроматографией, используя 75% EtOAc/гексаны. Содержащие продукт фракции собирали и концентрировали с получением 50 мг прозрачного бесцветного масла. 400 МГц 1H ЯМР (CDCl3):7,25-7,28 (m, 3H), 7,14-7,16 (m, 2H), 6,82-6,92 (m, 4H), 6,76-6,78 (m, 1H),4,02-4,09 (m, 1H), 3,84-3,91 (m, 5H), 3,48-3,54 (m, 2H), 3,37-3,44 (m, 2H), 3,08-3,11 (m, 4H), 2,60 (q, 2H),1,45 (s, 2H), 1,16-1,19 (m, 3H), 0,82-0,85 (m, 1H);MS (M+1) 534,2. Общая методика получения соединений формулы (VIII), где R100=C=O, с использованием хлорангидрида кислоты. К перемешиваемому раствору 1,0 экв. соединения формулы (VII) в метиленхлориде (0,2 М) при комнатной температуре добавляли DIEA (2,8 экв.), а затем хлорангидрид кислоты формулы (IX)(1,1 экв.). Реакционную смесь перемешивали при комнатной температуре в течение вплоть до 24 ч. Смесь затем гасили добавлением насыщенного раствора бикарбоната натрия и экстрагировали метиленхлоридом. Объединенные органические слои сушили над безводным MgSO4 и концентрировали при пониженном давлении. Полученное неочищенное вещество очищали флэш-хроматографией с получением целевого третичного амина с выходом 35-95%. Указанные ниже соединения были получены по описанной выше методике примера 2, начиная с соответствующего исходного амина формулы (VII) и соответствующего хлорангидрида кислоты формулы (IX). Кроме того, фармацевтически приемлемые соли соединений, перечисленных ниже, могут быть получены следующим образом. К перемешиваемому раствору соединения общей формулы (VIII) (полученного как описано выше в примере 2; 1,0 экв.) в подходящем растворителе, таком как метилэтилкетон,метиленхлорид/метанол (1:1) или метанол (0,1 М), при комнатной температуре добавляли соответствующую кислоту, например соляную, лимонную, п-толуолсульфоновую, метансульфоновую или бензолсульфоновую кислоты (1,0 экв.) одной порцией. Полученную смесь перемешивали при комнатной температуре в течение вплоть до 18 ч, и за это время образовывался осадок. После фильтрования твердого вещества и сушки при пониженном давлении были получены целевые соли.[3-(4-трет-Бутил-бензолсульфонил)-3-аза-бицикло[3.1.0]гекс-6-илметил]-(3-фтор-4 морфолин-4-ил-фенил)амид тиофен-2-карбоновой кислоты. К перемешиваемому раствору (3-аза-бицикло[3.1.0]гекс-6-илметил)-(3-фтор-4-морфолин-4-илфенил)амида тиофен-2-карбоновой кислоты (60 мг; 0,15 ммоль) в 3 мл DCE добавляли DIEA (0,026 мл; 0,45 ммоль), DMAP (каталитическое количество) и 4-трет-бутил-бензолсульфонилхлорид (0,10 мл; 0,45 ммоль). Полученную смесь нагревали до 80 С в течение 1,5 ч, охлаждали до комнатной температуры и гасили насыщенным NaHCO3. Слои разделяли, водный слой экстрагировали CH2Cl2, и объединенные органические слои сушили и концентрировали. Полученное неочищенное вещество очищали флэшхроматографией, используя 40% EtOAc/гексаны. Содержащие продукт фракции собирали и концентрировали с получением 70 мг белой пены. 400 МГц 1H ЯМР (CDCl3):7,62-7,66 (m, 2H), 7,47-7,50 (m, 2H), 7,29-7,31 (m, 1H), 6,79-6,95 (m, 5H),3,87-3,89 (m, 4H), 3,68 (d, J=7,47 Гц, 2H), 3,46 (d, J=9,13 Гц, 2H), 3,13-3,15 (m, 4H), 2,94-2,96 (m, 2H), 1,64MS (М+1) 598,2. Общая методика получения соединений формулы (VIII), где R100=SO2, с использованием сульфонилхлорида. К перемешиваемому раствору 1,0 экв. соединения формулы (VII) в DCE (0,2 М) при комнатной температуре добавляли DIEA (3,0 экв.), а затем сульфонилхлорид формулы (IX) (3,0 экв.). Реакционную смесь нагревали при 80 С в течение вплоть до 18 ч. Смесь затем охлаждали до комнатной температуры,гасили добавлением насыщенного раствора бикарбоната натрия и экстрагировали метиленхлоридом. Объединенные органические слои сушили над безводным MgSO4 и концентрировали при пониженном- 23009903 давлении. Полученное неочищенное вещество очищали флэш-хроматографией с получением целевого третичного амина с выходом 55-95%. Указанные ниже соединения были получены по описанной выше методике примера 3, начиная с соответствующего исходного амина формулы (VII) и соответствующего сульфонилхлорида формулы(IX). Кроме того, фармацевтически приемлемые соли соединений, перечисленных ниже, могут быть получены следующим образом. К перемешиваемому раствору соединений общей формулы (VIII) (полученных, как описано выше в примере 3; 1,0 экв.) в подходящем растворителе, таком как метилэтилкетон, метиленхлорид/метанол(1:1) или метанол (0,1 М), при комнатной температуре добавляли соответствующую кислоту, например соляную, лимонную, п-толуолсульфоновую, метансульфоновую или бензолсульфоновую кислоты(1,0 экв.) одной порцией. Полученную смесь перемешивали при комнатной температуре в течение вплоть до 18 ч, и за это время образовывался осадок. После фильтрования твердого вещества и сушки при пониженном давлении получали целевые соли.MeOH при комнатной температуре добавляли 4-этил-бензальдегид (18,5 мл; 135 ммоль) и NaCNBH3(8,5 г; 135 ммоль). После перемешивания в течение 3 ч реакционную смесь концентрировали при пониженном давлении, переносили в воду, обрабатывали 1 М NaOH и разбавляли CH2Cl2. Слои разделяли,водный слой экстрагировали CH2Cl2 и объединенные органические слои сушили и концентрировали при пониженном давлении. Неочищенное вещество растворяли в CH2Cl2, обрабатывали 1 М HCl и концентрировали. Это вещество переносили в воду и экстрагировали Et2O, водный слой подщелачивали, используя NH4OH, и экстрагировали CH2Cl2. Объединенные экстракты сушили, фильтровали и концентрировали при пониженном давлении с получением 22,4 г целевого амина. 400 МГц 1H ЯМР (CDCl3):7,14-7,16 (m, 2H), 7,08-7,10 (m, 2H), 3,54 (s, 2H), 3,38-3,40 (m, 2H), 2,95- 29009903 Подготовительный пример 6. [3-(4-Этил-бензил)-3-аза-бицикло[3.1.0]гекс-6-илметил]-(3-фтор-4 морфолин-4-ил-фенил)амин. К перемешиваемому раствору оксалилхлорида (0,45 мл; 5,19 ммоль) в 25 мл безводного CH2Cl2 при-78 С по каплям добавляли DMSO (0,79 мл; 11,2 ммоль). Через 10 мин добавляли [3-(4-этил-бензил)-3 аза-бицикло[3.1.0]гекс-6-ил]метанол (1,0 г; 4,32 ммоль) в 10 мл безводного CH2Cl2. После перемешивания смеси в течение 30 мин добавляли триэтиламин (3,01 мл; 21,6 ммоль), и смесь оставляли медленно нагреваться до 0 С в течение 1 ч. Смесь концентрировали, полученное твердое вещество переносили в насыщенный NaHCO3 и EtOAc, слои разделяли, и водный слой экстрагировали EtOAc. Объединенные органические слои сушили, фильтровали и концентрировали с получением неочищенного альдегида,который использовали на следующей стадии без очистки. К перемешиваемому раствору неочищенного альдегида (1,32 г; 5,75 ммоль) в 40 мл MeOH добавляли 3-фтор-4-морфолиноанилин (1,1 г; 5,75 ммоль), AcOH (0,46 мл; 8,05 ммоль) и NaCNBH3 (361 мг; 5,75 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 60 мин. Смесь концентрировали при пониженном давлении и полученное вещество переносили в насыщенный NaHCO3 и экстрагировали CH2Cl2. Объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали при пониженном давлении. Полученное неочищенное вещество очищали флэшхроматографией с использованием градиента 10-25% изопропанола/гексаны. Содержащие продукт фракции собирали и концентрировали с получением 1,55 г целевого амина. 400 МГц 1H ЯМР (CDCl3):7,18-7,20 (m, 2H), 7,12-7,14 (m, 2H), 6,80-6,84 (m, 1H), 6,29-6,35 (m, 2H),3,84-3,86 (m, 4H), 3,62 (brs, 1H), 3,53-3,57 (m, 2H), 3,00 (d, J=8,70 Гц, 2H), 2,95-2,97 (m, 4H), 2,85 (d,J=7,05 Гц, 2H), 2,63 (q, 2H), 2,38 (d, J=8,40 Гц, 2H), 1,59 (s, 1H), 1,26-1,30 (m, 2H), 1,23 (t, 3H);MS (M+1) 410,2. Указанные ниже соединения были получены по описанной выше методике подготовительного примера 6.[3-(4-Этил-бензил)-3-аза-бицикло[3.1.0]гекс-6-илметил]-(3-фтор-4-морфолин-4-илфенил)амид бензо[b]тиофен-2-карбоновой кислоты. К перемешиваемому раствору полученного выше [3-(4-этил-бензил)-3-аза-бицикло[3.1.0]гекс-6 илметил]-(3-фтор-4-морфолин-4-ил-фенил)амина (50 мг; 0,12 ммоль) в 2 мл DCE при комнатной температуре добавляли DIEA (0,03 мл; 0,18 ммоль) и 2-бензтиофенкарбонилхлорид (0,02 мл; 0,18 ммоль). Через 1 ч добавляли насыщенный NaHCO3 и эту смесь экстрагировали CH2Cl2. Объединенные экстракты сушили над безводным MgSO4, фильтровали и концентрировали при пониженном давлении. Полученное неочищенное вещество переносили в 50% EtOAc/гексаны и твердое вещество белого цвета отфильтровывали. Оставшийся фильтрат концентрировали при пониженном давлении с получением 58 мг целевого продукта. 400 МГц 1H ЯМР (CDCl3):7,60-7,68 (m, 2H), 7,24-7,31 (m, 2H), 7,08-7,18 (m, 5H), 6,99-7,02 (m, 2H),6,86-6,91 (m, 1H), 3,82-3,88 (m, 4H), 3,68 (d, J=7,47 Гц, 2H), 3,50 (brs, 2H), 3,10-3,12 (m, 4H), 2,88 (brd,J=7,47 Гц, 2H), 2,49 (q, 2H), 2,28, (brs, 2H), 1,49 (brs, 1H), 1,22-1,24 (m, 2H), 1,19 (t, 3H);MS (M+1) 570,2. Указанные ниже соединения были получены по описанной выше методике примера 4, начиная с соответствующего исходного амина формулы (X) и соответствующего хлорангидрида кислоты формулы(XI). Кроме того, фармацевтически приемлемые соли соединений, перечисленных ниже, могут быть получены следующим образом. К перемешиваемому раствору соединений общей формулы (XII) (полученных, как описано выше в примере 4; 1,0 экв.) в подходящем растворителе, таком как метилэтилкетон, метиленхлорид/метанол(1:1) или метанол (0,1 М), при комнатной температуре добавляли соответствующую кислоту, например соляную, лимонную, п-толуолсульфоновую, метансульфоновую или бензолсульфоновую кислоты(1,0 экв.) одной порцией. Полученную смесь перемешивали при комнатной температуре в течение вплоть до 18 ч, и за это время образовывался осадок. После фильтрования твердого вещества и сушки при пониженном давлении получали целевые соли.
МПК / Метки
МПК: A61K 31/5375, C07D 413/12
Метки: бициклические, переносчиков, 3.1.0, качестве, производные, ингибиторов, глицина
Код ссылки
<a href="https://eas.patents.su/30-9903-biciklicheskie-310-proizvodnye-v-kachestve-ingibitorov-perenoschikov-glicina.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические [3.1.0] производные в качестве ингибиторов переносчиков глицина</a>
Предыдущий патент: Модуляторы рецепторов андрогенов
Следующий патент: Оксатиинкарбоксамиды
Случайный патент: Створка для пластмассового окна












