Ненуклеозидные ингибиторы обратной транскриптазы
Номер патента: 9478
Опубликовано: 28.02.2008
Авторы: Хэматейк Роберт, Ким Хонгву, Де Ла Роса Марта А., Шоу Стефания, Яо Наньхуа, Гунич Эсмир, Кох Йунг-Хио, Хун Чжи, Жирарде Жан-Люк, Чжан Чжицзюн, Нилар Шахул
Формула / Реферат
1. Способ лечения пациента, инфицированного ВИЧ, включающий введение пациенту фармацевтической композиции, содержащей соединение в дозе, эффективной, чтобы снизить вирусную репродукцию, причем соединение имеет структуру в соответствии с формулой (А) или формулой (В)
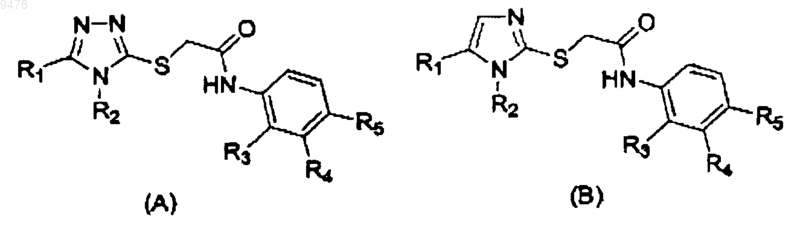
в которых R1 представляет необязательно замещенный C1-C10алкил, галоген или CF3,
R2 представляет необязательно замещенный циклоалкил, необязательно замещенный арил, необязательно замещенный хинолин или необязательно замещенный изохинолин;
R3, R4 и R5 независимо представляют водород, галоген, необязательно замещенный C1-C10алкил, S-C1-C10алкил, CF3, гетероцикл, NR'R", S(O)2R' или C(O)R', и в которых R' и R" независимо представляют NH2, NH-C1-C10алкил, NH-ацил, N-C1-C10алкилацил, N(C1-C10алкил)2, O-C1-C10алкил, ацил, арил, гетероцикл, или R' и R" образуют кольцо,
где необязательный заместитель или заместители выбраны из C1-C10алкила, CF3, C1-C10алкокси, галогена или NR'R'', где R' и R'' независимо представляют Н или C1-C10алкил, и
указанный гетероцикл представляет насыщенную, частично насыщенную или полностью ненасыщенную или ароматическую карбоциклическую группу, содержащую простое кольцо или сложные конденсированные кольца, которые включают по крайней мере один гетероатом, выбранный из S, О или N.
2. Соединение, которое имеет структуру в соответствии с формулой
HET-W-C(R1)(R2)-С(Y)-N(R4R5)
в которой HET содержит дизамещенный 1,2,4-триазол или дизамещенный имидазол, причем по крайней мере один заместитель HET является замещенным арилом, а замещенный арил ковалентно связан с азотом HET;
W означает О, S, S(О), S(O)2, NH, NR1 или СН2;
R1 и R2 независимо представляют водород, C1-C10алкил, С2-С10алкенил, С2-С10алкинил, галоген, ОН, SH, NH2, N3, O-C1-C10алкил или СН2ОН;
Y означает О, S или NR3, в котором R3 представляет собой водород, C1-C10алкил, C2-C10алкенил, C2-C10алкинил или гидрокси, O-C1-C10алкил или СН2ОН;
R4 представляет собой водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил; и
R5 является ортозамещенным фенилом, который необязательно дополнительно замещен,
где необязательный заместитель или заместители выбраны из C1-C10алкила, CF3, C1-C10алкокси, галогена или NR'R'', где R' и R'' независимо представляют Н или C1-C10алкил.
3. Соединение по п.2, в котором R1, R2 и R4 являются водородом и в котором один заместитель HET является необязательно замещенным C1-C10алкилом или галогеном.
4. Соединение по п.3, в котором Y означает О.
5. Соединение, которое имеет структуру в соответствии с формулой (А) или (В)
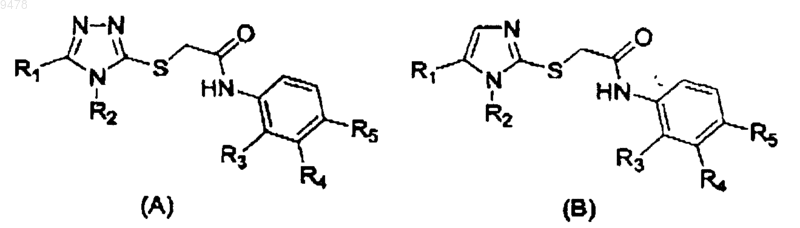
в которых R1 представляет необязательно замещенный C1-C10алкил или галоген,
R2 выбирают из группы, состоящей из монозамещенного фенила, дизамещенного фенила, тризамещенного фенила, монозамещенного нафтила, дизамещенного нафтила, тризамещенного нафтила, монозамещенного хинолина, дизамещенного хинолина, тризамещенного хинолина, монозамещенного изохинолина, дизамещенного изохинолина и тризамещенного изохинолина; и
R3, R4 и R5 независимо представляют собой водород, галоген, необязательно замещенный C1-C10алкил, S-C1-C10алкил, CF3, гетероцикл, NR'R", S(O)2R' или C(O)R', и в которой R' и R" независимо представляют NH2, NH-C1-C10алкил, NH-ацил, N-C1-C10алкилацил, N(C1-C10алкил)2, O-C1-C10алкил, ацил, арил, гетероцикл или R' и R'' образуют кольцо,
где необязательный заместитель или заместители выбраны из C1-C10алкила, CF3, C1-C10алкокси, галогена или NR'R'', где R' и R'' независимо представляют Н или C1-C10алкил, и
указанный гетероцикл представляет насыщенную, частично насыщенную или полностью ненасыщенную или ароматическую карбоциклическую группу, содержащую простое кольцо или сложные конденсированные кольца, которые включают по крайней мере один гетероатом, выбранный из S, О или N.
6. Соединение по п.5, в котором по крайней мере один из заместителей замещенного арила представляет необязательно замещенный C1-C10алкил, CF3, C1-C10алкокси, галоген или NR'R", где R' и R" являются Н или C1-C10алкилом.
7. Соединение по п.6, в котором по крайней мере один из R4 и R5 не является водородом.
Текст
009478 Данная заявка является частичным продолжением ожидающей рассмотрения международной патентной заявки PCT/US02/26816, которая была подана 08/23/2002 и которая включена в описание цитированием. Область техники Областью изобретения является ингибирование ферментов и особенно ингибирование обратной транскриптазы in vitro и in vivo. Уровень техники Многочисленные способы лечения (ВИЧ) известны в данной области, и из их числа фармацевтически активные соединения, ингибиторы обратной транскриптазы, обеспечивают значительный терапевтический эффект у многих пациентов, инфицированных ВИЧ. Например, ламивудин (ЗТС) или зидовудин(AZT) являются относительно хорошо переносимыми антиретровирусными лекарственными средствами. Однако в последнее время появились многочисленные вирусные штаммы со значительной резистентностью к названным соединениям. Для преодоления резистентности, по крайней мере до некоторой степени, можно применять новые нуклеозидные ингибиторы (отдельно или в комбинации с другими нуклеозидными ингибиторами), типичные альтернативные лекарственные средства включают в себя ставудин(d4T), диданозин (ddI), комбивир (комбинация ламивудина и зидовудина) и тризивир (комбинация ЗТС,AZT и абакавира). К сожалению, развитие резистентности к одному нуклеозидному ингибитору также может сопровождаться резистентностью (по крайней мере до некоторой степени) к другому нуклеозидному ингибитору, что часто влечет за собой переключение на другой класс фармацевтически активных молекул. В таких случаях пациент может получать ингибитор протеаз (например, секвинавир, индинавир, нельфинавир и так далее) обычно в сочетании с другими антиретровирусными средствами. Однако относительно сложная схема введения таких комбинаций часто оказывается организационной и финансовой проблемой для многих пациентов, и часто пациенты дают согласие на лечение реже, чем следует. В несколько лучше переносимой сочетанной терапии нуклеозидные ингибиторы можно комбинировать с ненуклеозидными ингибиторами. Ненуклеозидные ингибиторы (например, невирапин, делавирдин, эфавиренз) представляют собой структурно относительно неоднородную группу соединений и, как полагают, связываются в ненуклеозидном кармане обратной транскриптазы, тем самым значительно повышая противовирусную эффективность при применении ингибиторов нуклеозидного типа. Оказывается, что, хотя применение ненуклеозидных ингибиторов обеспечивает многообещающий новый класс противовирусных лекарственных средств, еще остаются некоторые неблагоприятные моменты. Например, стоимость современных известных ненуклеозидных ингибиторов является относительно высокой, а одиночная мутация в вирусной обратной транскриптазе может индуцировать перекрестную резистентность к обширному классу ненуклеозидных ингибиторов обратной транскриптазы. Кроме того, существует только ограниченное число ненуклеозидных ингибиторов, подходящих для лечения инфицированного ВИЧ пациента. Таким образом, хотя различные композиции и способы для ингибирования обратной транскриптазы и особенно транскриптазы из ВИЧ известны в данной области, все или почти все из них обладают одним или более недостатками. Кроме того, ВИЧ характеризуется относительно высокой частотой мутаций,которые часто приводят к резистентности к лекарственным средствам при современных способах лечения. Поэтому все еще существует потребность в обеспечении новыми композициями и способами для ингибирования обратных транскриптаз. Краткое описание изобретения Данное изобретение направлено на создание способов и композиций для ингибирования обратной транскриптазы, причем различные карбониламидные соединения действуют как ингибиторы транскриптазы. В одном аспекте рассматриваемого изобретения способ ингибирования обратной транскриптазы включает в себя стадию, на которой ингибитор обратной транскриптазы представлен соединением,имеющим структуру HET-L-C(Y)NR1R2, в которой HET содержит 5- или 6-членный кольцевой гетероцикл, L является линкером, в котором по крайней мере два атома образуют единую цепь, в которой один из двух атомов ковалентно связан с HET, а другой из двух атомов ковалентно связан с атомом карбонила,Y означает кислород, серу или NH, R1 выбирают из группы, состоящей из водорода, галогена и метила,или R1 образует кольцо с R2 через цепь из 1-5 атомов; и R2 выбирают из группы, состоящей из замещенного или незамещенного арила, циклоалканила, циклоалкенила и замещенного или незамещенного гетероцикла. В особо предпочтительных способах HET представляет собой замещенный триазол или имидазол, и даже оказывается более предпочтительным, когда замещенный триазол или имидазол замещают первым заместителем (например, метилом) и вторым заместителем (например, толуолом), причем по крайней мере один из первого и второго заместителей включает в себя группу арила. Кроме того, вообще является предпочтительным, что L представляет собой -X1-CR3R4-, причем X1 выбирают из группы, состоящей из S, О, S (О), S(O)2, NH, NR3 и CR3R4; и в которой R3 и R4 независимо представляют собой водород, галоген, низший алкил, низший циклоалкил, низший алкенил, низший алкинил, NH2, ОН и SH. В других-1 009478 предпочтительных аспектах L выбирают из группы, состоящей из -S-CH2-, -S(O)-CH2-, -S(O)2-CH2-, -OCH2-, NHCH2, N(Me)CH2 и -СН 2-СН 2-, и/или Y означает О. В других предпочтительных соединениях таких способов R1 является водородом, a R2 представляет собой замещенный арил или гетероарил и более предпочтительно R2 содержит орто-замещенный фенил, в котором заместитель является галогеном или метилом. Особо рассматриваемые способы включают в себя способы, в которых обратная транскриптаза является обратной транскриптазой ВИЧ, а наиболее предпочтительны способы, в которых обратная транскриптаза ВИЧ является резистентной к ненуклеозидному аналогу ингибитора обратной транскриптазы. Предлагаемые способы можно осуществлять in vivo и/или in vitro, и они, кроме того, могут включать в себя стадию, когда обратная транскриптаза присутствует со вторым ингибитором (например, ненуклеозидный ингибитор обратной транскриптазы и нуклеозидный ингибитор обратной транскриптазы). Поэтому полагают, что способ лечения пациента, инфицированного ВИЧ, может включать в себя стадию, на которой фармацевтическую композицию, содержащую соединение структуры I, вводят пациенту в дозе, эффективной для снижения репродукции вируса, причем структура I представляет собойHET-L-C(Y)NR1R2, в которой HET содержит гетероцикл, L является линкером, в котором по крайней мере два атома образуют единую цепь, в которой один из двух атомов ковалентно связан с HET, а другой из двух атомов ковалентно связан с атомом карбонила, Y является кислородом, серой или NH, R1 выбирают из группы, состоящей из водорода, галогена и метила, или R1 образует кольцо с R2 через цепь из 1-5 атомов, a R2 выбирают из группы, состоящей из замещенного или незамещенного арила, циклоалканила,циклоалкенила и замещенного или незамещенного гетероцикла. В отношении особо предпочтительных заместителей применимы такие же соображения, которые приведены выше. Следовательно полагают, что фармацевтическая композиция должна включать в себя соединение структуры HET-L-C(Y)NR1R2 (с заместителями, которые описаны выше), в которой соединение присутствует в концентрации эффективной для ингибирования обратной транскриптазы в клетке пациента при введении пациенту. В еще других рассматриваемых аспектах предмета изобретения соединение имеет общую структуруHET-W-C(R1)(R2)-С(Y)-N(R4R5), в которой HET включает в себя азотсодержащий замещенный гетероцикл, W означает О, S(О), S(O)2, NH, NR1 или СН 2, R1 и R2 независимо представляют собой водород,низший алкил, низший циклоалкил, низший алкенил, низший алкинил, галоген, ОН, SH, NH2, N3, Оалкил или СН 2 ОН, Y означает О, S или NR3, где R3 означает водород, низший алкил, низший алкенил,низший алкинил или гидрокси, О-алкил или СН 2 ОН, R4 представляет собой водород, низший алкил,низший алкенил или низший алкинил, или R4 образует кольцо с R5 через цепь из 1-5 атомов, a R5 выбирают из группы, состоящей из замещенного или незамещенного арила, циклоалканила, циклоалкенила и замещенного или незамещенного гетероцикла. В еще одном аспекте изобретения соединение имеет общую структуру HET-S-C(R1) (R2)-С(Y)N(R4R5), в которой HET включает в себя азотсодержащий замещенный гетероцикл, R1 и R2 независимо представляют собой водород, низший алкил, низший циклоалкил, низший алкенил, низший алкинил,галоген, ОН, SH, NH2, N3, O-алкил или СН 2 ОН и при условии, что R1 и R2 не являются водородом в одно и то же время, Y означает O, S или NR3, где R3 представляет собой водород, низший алкил, низший алкенил, низший алкинил или гидрокси, O-алкил или CH2OH, R4 представляет собой водород, низший алкил,низший алкенил или низший алкинил, или R4 образует кольцо с R5 через цепь из 1-5 атомов, a R5 выбирают из группы, состоящей из замещенного или незамещенного арила, циклоалканила, циклоалкенила и замещенного или незамещенного гетероцикла. В других аспектах предмета изобретения соединение имеет общую структуру HET-W-C(R1)(R2)C(Y)-N(R4R5), в которой HET включает в себя азотсодержащий замещенный гетероцикл, отличный от триазола, W означает O, S(O), S(O)2, NH, N(Me) или СН 2, R1 и R2 независимо представляют собой водород, низший алкил, низший алкенил, низший алкинил, галоген, ОН, SH, NH2, N3, O-алкил или СН 2 ОН, Y означает O, S или NR3, где R3 означает водород, низший алкил, низший алкенил, низший алкинил или гидрокси, O-алкил или СН 2 ОН, R4 представляет собой водород, низший алкил, низший алкенил или низший алкинил, или R4 образует кольцо с R5 через цепь из 1-5 атомов, a R5 выбирают из группы, состоящей из замещенного или незамещенного арила, циклоалканила, циклоалкенила и замещенного или незамещенного гетероцикла. Различные объекты, особенности, аспекты и преимущества данного изобретения станут более очевидными из следующего подробного описания предпочтительных воплощений изобретения вместе с сопровождающими рисунками, в которых одинаковые числа изображают одинаковые компоненты. Подробное описание Было установлено, что обратную транскриптазу и особенно обратную транскриптазу ВИЧ можно ингибировать многочисленными соединениями, которые включают в себя карбониламидный фрагмент. Следовательно, представлены способы и композиции, которые ингибируют обратную транскриптазу invitro и in vivo. Кроме того, особо обсуждаемые способы включают в себя способы лечения пациента, инфицированного ВИЧ, и, в частности, рассматриваемые композиции включают выбранные карбониламидные соединения и их фармакологические композиции.-2 009478 Используемый в описании термин галоген относится к фтору, брому, хлору или иоду, который обычно ковалентно связан с другим атомом (например, углеродом). Используемый термин гидроксил относится к группе -ОН. Используемый также в описании термин карбонильный атом имеет отношение к атому углерода, с которым ковалентно связаны три атома, причем один из трех атомов связан с атомом углерода посредством двойной связи (которая частично может быть делокализована). Таким образом, особо рассматриваемые карбонильные атомы включают в себя атомы углерода в группе карбоксамида, группе карбоксамидина и группе тиокарбоксамида. Используемый в описании термин алкил имеет отношение к углеводороду с циклической, разветвленной или прямой цепью, в котором все связи углерод-углерод являются одинарными связями, а термин низший алкил относится к алкилу с циклической, разветвленной или прямой цепью из одного до десяти атомов углерода (например, метил, этил, н-пропил, и-пропил, н-бутил, трет-бутил, и-бутил(или 2-метилпропил), циклопропилметил, и-амил, н-амил, гексил и так далее). Используемый в описании термин циклоалкил относится к циклической или полициклической группе алкила, содержащей от 3 до 15 атомов углерода. Что касается полициклических групп, названные группы могут быть сложными конденсированными кольцами, в которых одно из периферических колец может быть ароматическим (например, инданил, тетрагидронафталин и так далее). Аналогично, используемый в описании термин алкенил имеет отношение к алкилу, в котором по крайней мере одна связь углерод-углерод является двойной связью. Таким образом, термин низший алкенил включает в себя все алкенилы, содержащие от одного до десяти атомов углерода. Используемый термин циклоалкенил относится к циклической или полициклической группе, содержащей от 3 до 15 атомов углерода и по крайней мере одну двойную связь. Аналогично, используемый в описании термин алкинил имеет отношение к алкилу или алкенилу, в котором по крайней мере одна связь углеродуглерод является тройной связью. Таким образом, термин низший алкинил включает в себя все алкинилы, содержащие от одного до десяти атомов углерода. Также используемый в описании термин алкокси имеет отношение к группе -OR, в которой R представляет собой низший алкил, замещенный низший алкил, ацил, арил, замещенный арил, арилалкил,замещенный арилалкил, гетероарилалкил, циклоалкил, замещенный циклоалкил, циклогетероалкил или замещенный циклогетероалкил. Аналогично термин арилокси относится к группе -OAr, в которой Ar означает группу арила, замещенного арила, гетероарила или замещенного гетероарила. Кроме того, термины арил и Ar используют в описании взаимозаменяемо, и они имеют отношение к ароматической карбоциклической группе, содержащей по крайней мере одно ароматическое кольцо (например, фенил или бифенил) или сложные конденсированные кольца, в которых по крайней мере одно кольцо является ароматическим (например, 1,2,3,4-тетрагидронафтил, нафтил, антрил или фенантрил). Аналогично, термины гетероцикл или гетероциклическое кольцо используют в описании взаимозаменяемо, и они относятся к насыщенной, частично или полностью ненасыщенной или ароматической карбоциклической группе, содержащей простое кольцо (например, морфолино, пиридил или фурил) или сложные конденсированные кольца (например, нафтпиридил, хиноксалил, хинолинил или индолизинил), которые содержат по крайней мере один гетероатом в кольце(ах). Используемый термин гетероатом относится к атому, отличному от углерода (например, S, О или N), который возможно замещен, например, водородом, галогеном, низшим алкилом, алкокси, низшим алкилтио, трифторметилом,амино, амидо, карбоксилом, гидроксилом, арилом, арилокси, гетероциклом, гетероарилом, замещенным гетероарилом, нитро, циано, алкилтио, тиолом, сульфамидо и так далее. Таким образом, термин гетероарил относится к гетероциклу, в котором по крайней мере одно гетероциклическое кольцо является ароматическим. Используемый еще в описании термин замещенный означает, что атом водорода, который ковалентно связан с группой или атомом (или свободная электронная пара или электронная пара двойной связи атома) замещают ковалентно связанным неводородным заместителем, включающим в себя гидроксил, тиол, алкилтиол, галоген, алкокси, амино, амидо, нитро, карбоксил, циклоалкил, гетероцикл, циклогетероалкил, ацил, карбоксил, арил, арилокси, гетероарил, арилалкил, гетероарилалкил, алкил, алкенил, алкинил и циано. Используемый в описании термин пролекарство имеет отношение к модификации рассматриваемых соединений, при которой модифицированное соединение проявляет меньшую фармакологическую активность (по сравнению с немодифицированным соединением) и при которой модифицированное соединение превращается в клетке-мишени (например, Т-клетке) или органе-мишени (например, лимфатическом узле) снова в немодифицированную форму. Например, превращение рассматриваемых соединений в пролекарства может быть полезным, когда активное лекарственное средство является слишком токсичным для безопасного системного введения или когда рассматриваемое соединение плохо всасывается в пищеварительном тракте, или когда организм разрушает рассматриваемое соединение до достижения им мишени. Используемый также в описании термин ингибирование обратной транскриптазы имеет отношение к снижению образование ДНК из матричной РНК или ДНК обратной транскриптазой, причем снижение может быть достигнуто непосредственно или косвенно различными способами. Например, прямое-3 009478 ингибирование включает в себя суицид, конкурентное и неконкурентное ингибирование, аллостерическое ингибирование или связывание ингибитора в ненуклеозидном кармане. Примеры непрямого ингибирования включают в себя истощение нуклеозидов для синтеза ДНК, индукцию или содействие конформационным изменениям и так далее. Используемый в описании термин "снижение [или "чтобы снизить"] репродукции вируса" означает,что титр вируса в образце снижается, причем снижение может включать в себя различные способы,включая частичное или полное ингибирование вирусной репликации, частичное или полное ингибирование процессинга или сборки вирусного белка, вход вируса в инфицированную клетку или выход из нее и/или выведение вируса из системы посредством иммунного ответа на вирус. Рассматриваемые соединения Вообще полагают, что все соединения формулы (I) подходят для применения в изобретении:(I) где HET содержит замещенный или незамещенный гетероцикл, который может быть или не быть ароматическим; L является линкером, в котором по крайней мере два атома образуют единую цепь, причем один из двух атомов ковалентно связан с гетероциклом, а другой из двух атомов ковалентно связан с атомом углерода карбонила; Y означает О, S или NR3; R1 и R3 независимо выбирают из группы, состоящей из водорода, галогена и возможно замещенного алкила, алкенила или алкинила (предпочтительно низшего алкила); a R2 выбирают из группы, состоящей из замещенного или незамещенного арила, циклоалкила, циклоалкенила и замещенного или незамещенного гетероцикла (который может содержать одну или более двойных связей и который, кроме того, может быть ароматическим). Что касается гетероцикла, оказывается предпочтительным, что по крайней мере один, а обычно более предпочтительно по крайней мере два из гетероатомов являются азотом, и что два гетероатома связаны друг с другом в гетероцикле ковалентной связью. Следовательно, особенно подходящие гетероциклы включают в себя кольцевую систему триазола (наиболее предпочтительно 1,2,4-триазол) или имидазола. В альтернативных аспектах, однако, подходящие гетероциклы также могут включать в себя 5- и 6 членные кольца, содержащие по крайней мере один гетероатом (например, О, N или S), причем такие кольца к тому же могут быть соединены или слиты по крайней мере с одним другим кольцом (которое может содержать или не содержать гетероатом). Особенно предпочтительные гетероциклы, кроме того, включают в себя по крайней мере один и даже более предпочтительно по крайней мере два заместителя, причем подходящие заместители независимо включают в себя замещенный и/или незамещенный арил, замещенный и/или незамещенный алкил,замещенный и/или незамещенный алкенил, замещенный и/или незамещенный алкинил, при этом каждый из двух заместителей еще может содержать один или более гетероатомов. Однако даже в более предпочтительных аспектах рассматриваемые гетероциклы будут содержать низший алкил (и наиболее предпочтительно метил, атом галогена или трифторметил) в качестве одного заместителя и замещенный или незамещенный фенил (например, галогенированный или толуил) или замещенный или незамещенный хинолин в качестве другого заместителя. Следовательно, особенно предпочтительные гетероциклы должны иметь структуру в соответствии с формулой (II) в которой R1 и R2 независимо представляют собой водород, галоген, низший алкил, циклоалкил, алкенил,алкинил, арил, гетероарил, алкарил (все из которых могут быть замещенными), ОН, SH, NO2, NR1R2 (с R1 и R2, которые описаны непосредственно выше), СF3, N3 и/или O-алкил, а X означает N или CR1 (с R1 который описан непосредственно выше). В других рассматриваемых аспектах следует иметь в виду, что структура и химическая природа подходящих линкеров может значительно варьировать. Например, когда требуется, чтобы линкер имел относительно высокую жесткость (например, ограничен по крайней мере одной, а более обычно двумя степенями свободного вращения), подходящие линкеры могут включать в себя двойную и/или тройную связь, или содержать один или более атомов в плоской конфигурации (например, ароматическая, сопряженная или карбонильная структура). С другой стороны, когда требуется, чтобы линкер проявлял гибкость, по крайней мере до некоторой степени, подходящие линкеры могут включать в себя группу алкила или атом кислорода или серы. Таким образом, подходящие линкеры также могут содержать различные гетероатомы, а особенно предпочтительными гетероатомами являются кислород или сера (при различных состояниях окисления). Следовательно, рассматриваемые линкеры включают в себя в частности те линкеры, в которых по крайней мере два атома образуют единую цепь (посредством ковалентной связи), в которой один из двух-4 009478 атомов ковалентно связан с гетероциклом (предпочтительно с атомом углерода HET), а другой из двух атомов ковалентно связан с атомом углерода карбонила рассматриваемых соединений. Таким образом,особо предпочтительные линкеры должны иметь структуру в соответствии с формулой (III)-X1-CR3R4 в которой X1 является гетероатомом и наиболее предпочтительно S, S (О), S(O)2, О или NR5, где R5 предпочтительно представляет собой водород или замещенный или незамещенный алкил (наиболее предпочтительно низший алкил). Альтернативно, X1 также может содержать атом углерода и, таким образом,может иметь структуру -(CR5R6)n-, в которой n соответствует диапазону между единицей и пятью и в которой R3, R4, R5 и R6 независимо представляют собой водород, галоген, низший алкил, низший алкенил, низший алкинил, NH2, ОН и/или SH. Поэтому, подходящие линкеры будут включать в себя линкеры, имеющие структуру -S-CH2-, -S(O)-CH2-, -S(O)2-CH2-, -O-CH2-, -NHCH2-, -N(CH3)CH2 и -СН 2-СН 2-. Кроме того, следует оценивать, что атом углерода карбонила формулы (I) может быть ковалентно связан с различными атомами/группами Y, а особенно подходящие группы Y включают в себя те группы, в которых Y означает О (чтобы образовать карбоксамид), S (чтобы образовать тиокарбоксамид) и NR(чтобы образовать карбоксамидин), в которых R может быть водородом или замещенным или незамещенным низшим алкилом. Подходящий альтернативный R включает в себя все те группы, которые (образуют с N или) обеспечивают донорную или акцепторную группу водородной связи. Следовательно, Y формулы (I) может представлять собой О, S или NR с R, который описан выше, особенно включающий в себя водород, низший алкил, низший алкенил, низший алкинил или гидрокси, О-алкил или СН 2 ОН. Подобным же образом, и в отношении соединений формулы (I), природа заместителей R1 и R2 атома азота, который ковалентно связан с карбонильным углеродом, может значительно варьировать, а все известные заместители вторичных аминов рассмотрены в описании. Поэтому R1 и R2 в формуле (I) независимо могут представлять собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил,все из которых, кроме того, могут содержать один или более гетероатомов. Однако вообще предпочтительно, когда один из R1 и R2 является относительно небольшим (например, водород, метил, трифторметил и так далее), тогда как другой из R1 и R2 содержит арильную группу. Особо предпочтительные арильные группы должны быть замещенными, наиболее предпочтительно в орто-положении и, кроме того, могут содержать заместитель в пара-положении (например, орто-замещенный фенил с галогеном или метилом в виде заместителя). Поэтому особо предпочтительный R1 будет включать в себя водород и низший алкил (которые, кроме того, могут быть замещены [например, трифторметил]), тогда как особенно предпочтительный R2 включает в себя арил, циклоалкил, циклоалкенил, гетероарил и гетероцикл. В одном особенно предпочтительном аспекте гетероцикл ковалентно связывают с линкером через группу, отличную от -S-или -O-, а линкер имеет относительно короткую и относительно гибкую структуру -W-C(R1)(R2)-. Следовательно, рассматриваемые соединения будут иметь структуру в соответствии с формулой (IV)(IV) в которой HET является таким, как описано для формулы (I) выше, и в которой C(Y)-N(R4R5) является таким, как C(Y)-N(R1R2) в формуле (I) выше. Что касается W, в основном полагают, что подходят все группы и/или атомы, отличные от -S- и -O-, а особенно предпочтительные группы включают в себя S(О),S(O)2, NH, NR1 и СН 2. Особо предпочтительные R1 и R2 являются относительно небольшими радикалами, и оказывается особенно предпочтительным, когда R1 и R2 независимо представляют собой низший алкил, низший алкенил, низший алкинил (все из которых, кроме того, могут быть замещенными), водород, галоген, ОН, SH, NH2, N3, О-алкил или СН 2 ОН. Альтернативно, когда требуется, чтобы гетероцикл был ковалентно связан с линкером через -S-, -Оили другую группу, и когда линкер относительно короткий и гибкий, рассматриваемые соединения могут иметь структуру в соответствии с формулой (V)HET-W-C(R1) (R2)-С(Y)-N(R4R5) (V) в которой HET, R1, R2, R4 и R5 описаны так, как в формуле (IV) выше, и в которой W и Y определены так,как в формуле (I) выше за исключением того, что Y не означает О. В еще другом рассматриваемом аспекте особо предпочтительные соединения включают в себя соединения, в которых гетероциклическое основание представляет собой дизамещенный 1,2,4-триазол или дизамещенный имидазол, а подходящие соединения могут иметь структуру в соответствии с формулой(VI) в которой HET содержит дизамещенный 1,2,4-триазол или дизамещенный имидазол, в которой по крайней мере один из заместителей HET представляет собой замещенный арил и в которой замещенный арил ковалентно связан с азотом HET; в которой W означает О, S, S(О), S(O)2, NH, NR1 или СН 2, в которой Y характеризуют также, как для формулы (I) выше, и в которой R1, R2, R4 и R5 независимо являются такими, как описано выше для формулы (IV). Таким образом, особо предпочтительные соединения будут иметь структуру в соответствии с формулами А или В в которых R1 представляет собой низший алкил (возможно замещенный), галоген или CF3, R2 возможно замещают циклоалкилом, замещенным или незамещенным арилом, замещенным или незамещенным хинолином или возможно замещенным изохинолином, a R3, R4 и R5 независимо представляют собой водород, галоген, возможно замещенный алкил, S-алкил, CF3, гетероцикл, NR'R", S(O)2R', P(O)R'R",OP(O)R'R" или С(O)R', в которых R' и R" независимо представляют собой NH2, NH-алкил, NH-ацил, Nалкилацил, N-(алкил)2, О-алкил, ацил, арил, алкил, гетероцикл или R' и R" образуют кольцо. R3 и R4 могут быть одинаковыми или разными или даже могут быть соединены вместе через цепь из двух до четырех атомов углерода. Аналогично, R5 может быть таким, как R3, a более предпочтительно может отличаться от R3. Например, R4 или R5 независимо могут иметь структуру, которая представлена ниже: Таким образом, орто-замещенный фенил в соединениях формул A и В, кроме того, может содержать по крайней мере один из мета- и пара-заместителей (например, как описывают в виде R3 непосредственно выше). В особо предпочтительных соединениях в соответствии с формулами А или В R2 выбирают из группы, состоящей из монозамещенного фенила, дизамещенного фенила, тризамещенного фенила, монозамещенного нафтила, дизамещенного нафтила, тризамещенного нафтила, монозамещенного хинолина,дизамещенного хинолина, тризамещенного хинолина, монозамещенного изохинолина, дизамещенного изохинолина и тризамещенного изохинолина. Наиболее предпочтительно заместителем(ями) замещенного арила является возможно замещенный низший алкил, CF3, низший алкокси, галоген или NR'R", где R' и R" независимо представляют собой Н или низший алкил. Кроме того, также еще следует признать, что в рассматриваемых соединениях карбоксамидную группу -C(Y)-NR1R2 можно замещать фрагментом оксазола. Такое замещение может быть благоприятным для усиления одного или более фармакокинетических/динамических свойств и, как полагают, сохранения общих стереохимических конфигураций, по крайней мере, в отношении атомов/групп, взаимодействующих с обратной транскриптазой. Способы биоизостерического замещения описывают George A.Patani и Edmond J. LaVoie, Bioisosterism: A rational approach in drug design, Chem. Rev. 1996, 96, 31473176, или Preben H. Olsen, The use of bioisosteric groups in lead optimization, Current Opinion in Drug DiscoveryDevelopment 2001, 4, 471-478, оба включены в описание цитированием. Синтез и модификации различных оксазолов описывают Toshikazu Ibata and Yasushi Isogami, Formation and reaction of oxazoles. Synthesis of N-substituted 2-(aminomethyl)oxazoles, Bull. Chem. Soc. Jpn 1989,62, 618-620, or in Toshikazu Ibata and Ryohei Sato, The acid catalyzed decomposition of diazo compounds. I.Jpn 1979, 52, 3597-3600, эти и другие источники, известные в данной области, можно использовать в качестве рекомендаций для получения рассматриваемых соединений, в которых карбоксамидную группу замещают фрагментом оксазола. Синтез рассматриваемых соединений Следует особо учитывать то, что некоторые из рассматриваемых соединений поставляются коммерчески различными источниками, и все из коммерчески поставляемых соединений подходят для применения в изобретении. Однако многие из рассматриваемых соединений не поставляются коммерчески, а синтез некоторых из таких соединений можно проводить, следуя протоколу, в основном описанному в патенте США 5939462, который включен в описание цитированием. Однако следует признать, что также имеются многочисленные альтернативные способы синтеза для получения обсуждаемых соединений, и следующие типичные способы могут быть предложены в качестве рекомендаций для обычных специалистов-практиков в данной области. Например, в одном способе синтеза подходящий замещенный амин (например, первичный или вторичный амин) взаимодействует с активированными карбонилсодержащими соединениями (предпочтительно карбонилгалогенид), причем карбонилсодержащее соединение, кроме того, содержит уходящую группу (и наиболее предпочтительно бром). После образования карбониламида продукт реакции взаимодействует с нуклеофильной группой(например, ОН, SH или NR1R2 с R1 и R2, которые независимо включают в себя водород, алкил и так да-6 009478 лее, что отмечено для формулы (I) выше) второго реагента, замещая уходящую группу, чтобы образовать требуемое соединение, что изображено на схеме 1, ниже.R1 и R2 на схеме 1 могут представлять собой любой подходящий заместитель и, как обычно полагают, соответствующие R1 и R2 независимо включают в себя водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, все из которых, кроме того, могут содержать один или более гетероатомов. Однако обычно предпочтительно, что один из R1 и R2 является относительно небольшим (например, водород, метил, трифторметил и так далее), тогда как другой из R1 и R2 содержит арильную группу. Особо предпочтительные арильные группы следует замещать, наиболее предпочтительно в орто-положении, и они могут содержать еще заместитель в пара-положении (например, орто-замещенный фенил с галогеном или метилом в качестве заместителя). Поэтому особо предпочтительный R1 будет включать водород и низший алкил (который может быть еще замещен), тогда как R2 может быть выбран из группы, состоящей из арила, гетероарила, циклоалкила, циклоалкенила и гетероцикла. Аналогично полагают, что выбор уходящих групп L1 и L2 будет зависеть, по крайней мере, до некоторой степени от особого выбора амина и/или HET-ХН, и рассматривают все подходящие уходящие группы. Однако особенно предпочтительно, что L1 и L2 являются галогенидом и наиболее предпочтительно бромом. Альтернативно, L1 также может представлять собой ОН или О-ацил. Что касается R3 иR4, к ним относятся те же соображения, которые описаны выше для R3 и R4 в формуле (III). Y может представлять собой О, S или NR с R, который описан выше. X в HET-ХН обычно является гетероатомом или СН 2 и наиболее предпочтительно S, S (О), S(O)2 или О. HET может представлять собой любой гетероцикл, а особенно подходящие гетероциклы включают в себя гетероциклы, описанные выше. Подходящие растворители включают в себя простые эфиры, спирты и углеводороды (возможно галогенированные) и выбор подходящих растворителей будет зависеть, по крайней мере частично, от химической природы определенного реагента. Кроме того, в отношении катализатора и/или основания, использованных в описанной выше реакции, учитывают те же соображения, которые изложены Connell et al. (патент США 5939462). Альтернативно, синтез может следовать общему протоколу, который представлен на схеме 2, по которому рассматриваемые соединения получают из двух отдельно полученных предшественников. Первый предшественник, содержащий замещенный гетероцикл, можно получать, следуя протоколу, подобному протоколам, представленным ниже в разделе, озаглавленном Примеры. Аналогично, второй предшественник, содержащий замещенный арил, можно получать, следуя протоколу, подобному протоколам, представленным ниже в разделе, озаглавленном Примеры. Соединение полученных таким образом предшественников друг с другом обычно проводят в DMF с карбонатом калия. Схема 2 Когда замещенный гетероцикл замещают гетероарилом или арилом, и для этого случая нет коммерчески поставляемого соответствующего тиосемикарбазида, и когда арил содержит орто-замещенный хлорфенил, способ синтеза, который описан в схеме 3 ниже, можно использовать, следуя способам, подобным протоколам, представленным в разделе, озаглавленном Примеры. Схема 3 В другом типичном способе синтеза, где замещенный гетероцикл замещают замещенной ароматической группой, и для такого случая нет коммерчески поставляемой соответствующей аминоформы, способ синтеза, который описан в схеме 4 ниже, можно использовать, следуя способу, подобному протоколам, представленным в разделе, озаглавленном Примеры. Схема 4 Альтернативно, когда замещенный гетероцикл замещают замещенной гетероциклической ароматической группой, и для такого случая нет коммерчески поставляемого соответствующего амино, можно применять способ синтеза, который описан в схеме 5 ниже, который по существу следует способу, подобному протоколам, представленным ниже в разделе, озаглавленном Примеры. Схема 5 Также следует учитывать, что карбоксамид линкерного фрагмента можно получать из коммерчески недоступного замещенного анилина, а типичный способ синтеза описан в схеме 6, который по существу следует способу, подобному протоколам, представленным ниже в разделе, озаглавленном Примеры. Схема 6 В других рассматриваемых типичных способах для получения соединений согласно изобретению подходящие группы HET также можно замещать галогеном. Один типичный синтез соединений с такими замещенными галогеном HET-фрагментами описан в схеме 7, которая в основном следует способу, подобному протоколам, представленным ниже в разделе, озаглавленном Примеры. Схема 7 Когда гетероцикл представляет собой имидазол, можно применять способ синтеза, подобный способу, описанному в схеме 8 ниже, который в основном придерживается способа, такого как в протоколах, представленных ниже в разделе, озаглавленном Примеры. Схема 8 Альтернативно, когда триазол замещают CF3, можно применять способ синтеза, описанный в схеме 9 ниже, который по существу следует подобным способам, таким как в протоколах, представленных ниже в разделе, озаглавленном Примеры. Схема 9 Когда требуется, чтобы рассматриваемые соединения содержали группу оксазола вместо карбоксамидной группы, синтез можно осуществлять так, как схематично изображено на схеме 10, при этом фрагмент оксазола может быть образован на группе, эквивалентной радикалу R2 формулы (I), и фрагмент оксазола с R2-эквивалентным радикалом затем ковалентно связывают с гетероциклическим основанием замещенного триазола. Схема 10 В других обсуждаемых аспектах, и особенно когда рассматриваемые соединения содержат кислотную или основную группу, следует учитывать, что может быть получена соответствующая соль (и предпочтительно фармакологически приемлемая соль). Например, когда рассматриваемые соединения содержат основную группу, может быть получена аддитивная соль кислоты. Аддитивные соли кислот таких основных соединений можно получать по стандартному способу в подходящем растворителе из соединения и избытка кислоты, включая хлористо-водородную, бромисто-водородную, серную, фосфорную, уксусную, малеиновую, янтарную или метансульфоновую кислоту. Подобным образом, если рассматриваемые соединения содержат кислотную группу, щелочные аддитивные соли можно получать(например, при обработке кислого соединения избытком щелочного реагента, такого как гидроксид, карбонат или алкоксид, содержащего соответствующий катион. Подходящие катионы включают в себя Na+,K+, Са 2+ или NH4+). Фармацевтические композиции, содержащие рассматриваемые соединения Когда рассматриваемые соединения вводят в фармакологическую композицию, полагают, что соответствующие соединения могут быть приготовлены в смеси с фармацевтически подходящим носителем. Например, рассматриваемые соединения можно вводить перорально в виде фармакологически подходящих солей (см. выше) или внутривенно в физиологическом солевом растворе (например, забуференным приблизительно до рН от 7,2 до 7,5). Обычные буферы, такие как фосфаты, бикарбонаты или цитраты,можно использовать для этой цели. Конечно, любой специалист в данной области может изменять препараты в пределах рекомендаций данного описания, чтобы получить многочисленные препараты для определенного способа введения. В частности, рассматриваемые соединения можно модифицировать,чтобы сделать их более растворимыми в воде или другом носителе, что, например, легко может быть достигнуто в результате незначительных модификаций (получение соли, сложного эфира и так далее),которые вполне соответствуют квалификации обычного специалиста в данной области. Также обычный специалист в данной области способен изменять способ введения и схему приема определенного соединения для того, чтобы корректировать фармакокинетику данных соединений для максимально благоприятного эффекта у пациента. В случае некоторых фармацевтических стандартных форм можно готовить пролекарственные формы рассматриваемых соединений для различных целей, включая снижение токсичности, повышение специфичности к органу-мишени или клетке-мишени и так далее. Любой из обычных специалистов в данной области сможет понять, как легко модифицировать данные соединения в пролекарственные формы, чтобы способствовать доставке активных соединений в заданный участок в организме хозяина или пациента (см. выше). Любой из специалистов в данной области также сможет воспользоваться благоприятными фармакокинетическими параметрами пролекарственных форм, когда применимо, для доставки данных соединений в таргетированный участок в организме хозяина или пациента, чтобы увеличить до предела предполагаемое действие соединения. Кроме того, рассматриваемые соединения можно вводить самостоятельно или в комбинации с другими средствами для лечения ВИЧ, а определенные предлагаемые дополнительные соединения могут включать в себя нуклеозидные ингибиторы обратной транскриптазы (например, ламивудин, зидовудин,ставудин, абакавир, тенофовир или диданозин), ненуклеозидные ингибиторы обратной транскриптазы(например, невирапин, делавирдин, эфавиренз), протеазные ингибиторы (например, секвинавир, индинавир, нельфинавир), ингибиторы слияния (например, энфувиртид), антагонист CCR5, иммунотерапевтические средства (например, рибавирин IL-2), активную, пассивную и/или терапевтическую вакцину. Сочетанные терапии согласно данному изобретению включают в себя введение по крайней мере одного соединения данного изобретения или его функционального производного и по крайней мере одного другого фармацевтически активного ингредиента. Активный ингредиент(ы) и фармацевтически активные- 11009478 средства можно вводить раздельно или вместе, и, если вводят раздельно, введение можно проводить одновременно или отдельно в любом порядке. Количества активного ингредиента(ов) и фармацевтически активного средства(в) и относительный расчет времени введения следует подбирать для достижения требуемого сочетанного терапевтического эффекта. Поэтому полагают, что фармацевтическая композиция может содержать соединение структурыHET-L-C(Y)NR1R2, в которой HET содержит предпочтительно замещенный гетероцикл, L является линкером, в котором по крайней мере два атома образуют единую цепь, причем один из двух атомов ковалентно связан с гетероциклом, а другой из двух атомов ковалентно связан с атомом карбонила, Y означает О, S или NR3, R1 и R3 независимо выбирают из группы, состоящей из водорода, галогена и низшего алкила, R2 выбирают из группы, состоящей из замещенного или незамещенно арила, циклоалканила,циклоалкенила и замещенного или незамещенного гетероцикла, и в которой соединение присутствует в концентрации эффективной, чтобы ингибировать обратную транскриптазу и/или репликацию ВИЧ в клетке пациента при введении пациенту. В отношении подходящих концентраций рассматриваемых соединений в фармацевтических композициях следует оценивать, что обычный специалист в данной области сможет установить количество соединения для достижения ингибирования обратной транскриптазы и/или репликации ВИЧ. Например,ингибирование репликации ВИЧ в клетке (обычно в Т-клетке, инфицированной ВИЧ) можно контролировать in vitro, используя культуру крови и анализ, включающий определение люциферазы, которые описывают ниже. Альтернативно, ингибирование обратной транскриптазы можно контролировать invivo, используя RT-PCR (ПЦР-ОТ), чтобы определить количество копий ДНК и/или РНК вируса в крови или лимфатических узлах (содержащих инфицированные ВИЧ клетки). Однако обычно полагают, что подходящие концентрации будут достигать концентраций в сыворотке между 1 нМ (в некоторых случаях даже между 0,01 нМ и 1 нМ) и 100 мкМ. В особо предпочтительных соединениях HET представляет собой замещенный триазол или имидазол, и даже более предпочтительным является то, что замещенный триазол или имидазол замещают первым заместителем (например, метилом, CF3 или галогеном) и вторым заместителем (например, толуилом,нафтилом или хинолином), и при этом по крайней мере один из первого и второго заместителей включает в себя замещенную группу фенила. Кроме того, обычно оказывается предпочтительным, когда линкерL имеет структуру -X1-CR3R4-, для которой X1 выбирают из группы, состоящей из СН 2, S, О, S(О), S(O)2,NH, NR3 и CR3R4 и в которой R3 и R4 независимо представляют собой водород, галоген, низший алкил,низший алкенил, низший алкинил, NH2, ОН и SH. Таким образом, особо предпочтительные линкеры включают в себя такие линкеры, в которых L означает -S-CH2-, -S(O)-CH2-, -S(O)2-CH2-, -О-СН 2-, -NHCH2-, -N(Me)-CH2 или -CH2-СН 2-. Кроме того, особенно подходящие заместители для R1 и R2 атома азота включают в себя водород и замещенный арил, соответственно, а особо предпочтительный R2 является орто-замещенным фенилом (в котором орто-заместителем является галоген, CF3 или метил). Следовательно, особенно предпочтительные фармацевтические композиции будут содержать рассматриваемые соединения согласно структурам А или В, ниже в которых R1 представляет собой возможно замещенный низший алкил, CF3, галоген или водород, в которой R2 представляет собой циклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероцикл, a R3 является низшим алкилом или галогеном. В случае еще одного аспекта изобретения следует понимать, что рассматриваемые соединения можно использовать в виде фармацевтического продукта для лечения вирусной (и особенно ретровирусной) инфекции у млекопитающего (обычно человека). Поэтому полагают, что подходящий фармацевтический продукт будет содержать рассматриваемые соединения и инструкции для введения соединения пациенту, инфицированному ретровирусом, в соответствии с протоколом, который позволяет снизить вирусную репродукцию ретровирусов. Например, соединения можно вводить в дозировках для перорального или парентерального введения (infra), тогда как соответствующие инструкции для введения соединения обычно будут содержать упаковочный вкладыш или рецептурную информацию. Альтернативно, предлагаемая инструкция также может включать в себя специальный график лечения, адаптированный для определенной схемы лечения (например, когда рассматриваемые соединения вводят одновременно в сочетанной терапии) или брошюры поставщиков или другие рекламные публикации. Рассматриваемые в описании протоколы включают в себя все известные формы введения, чтобы снизить титр вируса у пациента или даже удалить полностью вирус у пациента.- 12009478 Предлагаемые способы применения Установлено (относительно экспериментов и данных смотри ниже в разделе под названием Примеры), что рассматриваемые соединения in vitro и in vivo оказывают значительное ингибиторное действие на обратную транскриптазу, а особенно на обратную транскриптазу ВИЧ. Следовательно, предлагают способ ингибирования обратной транскриптазы, при котором обратная транскриптаза присутствует с соединением формулы (I)HET-L-C(Y)NR1R2 (I) в которой HET предпочтительно включает в себя замещенный гетероцикл; L является линкером, в котором по крайней мере два атома образуют единую цепь, в которой один из двух атомов ковалентно связан с гетероциклом, а другой из двух атомов ковалентно связан с атомом углерода карбонила; Y означает О,S или NR3; R1 и R3 независимо выбирают из группы, состоящей из водорода, галогена и возможно замещенного низшего алкила; a R2 выбирают из группы, состоящей из замещенного или незамещенного арила, циклоалкила, циклоалкенила и замещенного или незамещенного гетероцикла. В особо предпочтительных аспектах предлагаемых способов гетероцикл включает в себя азотсодержащий гетероцикл, а наиболее предпочтительно - замещенный триазол или имидазол. Тогда как заместитель или заместители рассматриваемых гетероциклов могут значительно варьировать, обычно оказывается предпочтительным, когда замещенный триазол или имидазол включает в себя первый и второй заместители, причем первый заместитель является относительно небольшим (например, метил, трифторметил, нитро, амино, галоген, гидрокси или тиогруппа), а второй заместитель содержит ароматическую систему (и наиболее предпочтительно замещенный нафтил, замещенный фенил или замещенный хинолин). Что касается ароматической системы, было показано, что, если ароматическая система содержит группу фенила, особенно сильное ингибирование может быть достигнуто, когда группа фенила имеет заместитель в орто-положении. Такие же наблюдения были сделаны для соединений, содержащих группу нафтила или группу хинолина. Кроме того, полагают, что природа и определенная структура линкера, соединяющего гетероцикл с углеродом карбонила, могут значительно варьировать, и обычно полагают, что линкер может допускать стерическую подвижность или может ориентировать гетероцикл в относительно закрепленном положении относительно карбонильной группы. Например, когда линкер является относительно подвижным,полагают, что все ковалентные связи между атомами, которые образуют единую цепь, чтобы соединить гетероцикл с углеродом карбонила, являются одинарными связями. Конечно, следует понимать, что валентный угол между такими атомами будет зависеть, по крайней мере, до некоторой степени от химической природы атомов. Поэтому относительно прямые углы (например, где атомом является О и S) рассматривают так же, как и непрямые углы (например, где атомом является С или Р). С другой стороны, когда линкер обладает достаточно большой жесткостью, соответствующие линкеры могут содержать два или более атомов (в единой цепи атомов, которая соединяет гетероцикл с углеродом карбонила), которые ковалентно связаны друг с другом через двойную или тройную связь. Поэтому, такие линкеры могут включать в себя цепи ненасыщенных углеводородов с прямой или разветвленной цепью или ароматические кольца. Альтернативно, рассматриваемые линкеры также могут содержать циклоалкильные группы. Кроме того, подходящие линкеры еще могут включать в себя различные функциональные группы, чтобы обеспечить определенные физико-химические свойства, включая донорную или акцепторную группу водородной связи, полярную или неполярную группу, ионную группу или липофильную группу. Таким образом, подходящие линкеры могут содержать от 2 до 20 (и даже больше) атомов, которые могут или не могут включать в себя гетероатомы. Следовательно, особо предпочтительные линкеры могут иметь структуру -X1-CR3R4-, в которой X1 выбирают из группы, состоящей из S, О, S(O), S(O)2, NH, NR3 и CR3R4, и в которой R3 и R4 независимо представляют собой водород, галоген, низший алкил, низший алкенил, низший алкинил, NH2, ОН и SH. Еще более предпочтительные линкеры будут включать в себя линкеры, выбранные из группы -S-CH2-, -S(O)CH2-, -S(O)2-CH2-, -O-CH2-, -NH-CH2-, -N(Me)CH2- и -СН 2-СН 2-. В других аспектах предпочтительных способов углерод карбонила может быть ковалентно связан с кислородом, серой или NH или группой NR, причем R может быть выбран из группы, состоящей из водорода, галогена и низшего алкила. Следовательно, рассматриваемые соединения могут содержать группу карбоксамида, (замещенную) группу карбоксамидина или группу тиокарбоксамида. В следующих аспектах предпочтительных способов R1 и R2 могут значительно варьировать и все группы R1 и R2, рассматриваемые выше в разделе, озаглавленном Рассматриваемые соединения, считаются подходящими для применения в изобретении. Однако в основном предпочтительно, что R1 является водородом, a R2 представляет собой замещенный арил (и наиболее предпочтительно, что R2 содержит орто-замещенный фенил, причем орто-заместителем является галоген, SCH3, CF3 или метил). Кроме того, следует оценивать, что предлагаемые способы ингибирования обратной транкриптазы не ограничиваются определенной обратной транскриптазой, и следует понимать, что все известные обратные транскриптазы подходят для практического применения изобретения. Однако особенно предпочтительно, когда обратная транскриптаза является вирусной обратной транскриптазой, а в особо предпочтительных аспектах вирусная обратная транскриптаза является обратной транскриптазой ВИЧ. Кроме- 13009478 того, установлено, что такие обратные транскриптазы могут ингибироваться, даже если обратная транскриптаза, по крайней мере, частично резистентна к ненуклеозидному аналогу ингибитора обратной транскриптазы. Используемое выражение "по крайней мере, частично резистентна к ненуклеозидному аналогу ингибитора обратной транскриптазы" означает, что "по крайней мере, частично резистентная" обратная транскриптаза ингибируется ранее известными ненуклеозидными ингибиторами обратной транскриптазы в меньшей степени, чем нерезистентная обратная транскриптаза (см. раздел, озаглавленный Примеры). Что касается стадии презентирования обратной транскриптазы, полагают, что все способы презентации подходят и включают в себя многочисленные презентации in vitro и in vivo. Например, когда презентация обратной транскриптазы с рассматриваемыми соединениями происходит in vitro, следует учитывать, что обратная транскриптаза может быть в растворителе или содержаться на твердой фазе (и возможно в присутствии матрицы РНК или ДНК, кофакторов и нуклеотидов и так далее). Предлагаемые растворители включают в себя растворители, которые предварительно характеризуют (например, буфер обратной транскриптазы), а также растворители, в которых точный химический состав является чрезвычайно сложным (например, клеточный лизат). Подходящие твердые фазы включают в себя гели, полимерные гранулы, стенки микропланшета и так далее. Кроме того, отдельно обсуждаемая презентация invitro также включает в себя презентацию, при которой обратную транскриптазу заключают в клетку (инфицированную ВИЧ или трансфицированную и трансформированную, чтобы продуцировать рекомбинантную обратную транскриптазу), и при которой клетка является средой, которая содержит предлагаемые соединения. Таким образом, презентация in vitro включает в себя все способы презентации, при которых обратная транскриптаза находится в той же среде, что и рассматриваемые соединения. Следовательно, рассматриваемые соединения можно добавлять в буфер, среду или другой растворитель, в котором присутствует обратная транскриптаза, и добавление рассматриваемых соединений включает в себя добавление в растворенной форме, а также добавление в твердой форме. Что касается отдельной формы (например, в виде раствора в определенном растворителе), в которой рассматриваемые соединения добавляют в среду,обычный специалист в данной области легко сможет установить подходящую форму. Аналогично, соответствующую концентрацию может легко определить специалист в данной области без чрезмерного экспериментирования (например, используя данные IC50 как руководство). Аналогично, обсуждаемые презентации in vivo включают в себя все способы добавления рассматриваемых соединений в подходящем препарате в среду, которая содержит обратную транскриптазу, и особо предлагаемые среды включают в себя млекопитающих, инфицированных ретровирусом, а наиболее предпочтительно инфицированных ВИЧ. Следовательно, особо предпочтительные презентации invivo включают в себя введение фармацевтических композиций, содержащих рассматриваемые соединения, пациенту, который инфицирован вирусом ВИЧ. Таким образом, соответствующее введение может быть пероральным и/или парентеральным (системным) введением, а также введением ex vivo в цельную кровь или ее компоненты с повторным введением, по крайней мере, части цельной крови или ее компонентов. Типовые фармацевтические композиции описаны выше в разделе, озаглавленном Фармацевтические композиции, содержащие рассматриваемое соединение. Поэтому описан способ лечения пациента, инфицированного ВИЧ, при котором фармацевтическую композицию, содержащую соединение формулы (I), вводят пациенту в дозе, эффективной, чтобы снизить репродукцию вируса, причем формула (I) представляет собой HET-L-C(Y)NR1R2, в которой HET предпочтительно содержит замещенный гетероцикл, L является линкером, в котором по крайней мере два атома образуют единую цепь, в которой один из двух атомов ковалентно связан с гетероциклом, а другой из двух атомов ковалентно связан с атомом карбонила, Y представляет собой кислород, серу, NH или NR(с R, который описан выше), R1 выбирают из группы, состоящей из водорода, галогена и метила, a R2 выбирают из группы, состоящей из замещенного или незамещенного арила, циклоалканила, циклоалкенила и замещенного или незамещенного гетероцикла. В отношении особо предпочтительных структур применимы те же соображения, которые приведены выше в разделе, озаглавленном Рассматриваемые соединения. Поэтому особо предпочтительные соединения для лечения пациента, инфицированного ВИЧ,включают в себя соединения, в которых HET является замещенным триазолом или имидазолом, и/или L выбирают из группы, состоящей из -S-CH2-, -S(O)-CH2-, -S(O)2-СН 2-, -О-СН 2-, -NH-CH2-, -N(Me)CH2- и-СН 2-СН 2-, в которых Y означает кислород. В других предпочтительных соединениях для способов лечения R1 является водородом, a R2 представляет собой замещенный арил. Таким образом, особо предпочтительные соединения для лечения ВИЧ-инфекции включают в себя соединения структур А или В в которых R1 представляет собой низший алкил, галоген или CF3, R2 представляет собой циклоалкил,замещенный арил или незамещенный арил, замещенный хинолин или незамещенный хинолин, a R3 означает низший алкил, S-алкил, CF3 или галоген. Что касается системы доз, полагают, что дозировки преимущественно будут зависеть от используемого определенного соединения (например, определенной растворимости, эффективности, биодоступности и/или метаболического профиля), и следует понимать,что специалист в данной области легко сможет определить надлежащую дозировку или диапазон доз. Аналогично, снижение репродукции вируса можно контролировать, используя различные способы, хорошо известные в данной области. Например, размножение вируса можно оценивать, используя количественную ПЦР-ОТ, чтобы определить количество вирусных копий в отдельном биологическом образце(например, в цельной крови). Конечно, следует понимать, что при необходимости рассматриваемые соединения можно превращать в пролекарственную форму, чтобы увеличить специфичность в отношении инфицированной клетки, уменьшить вредную активность в неинфицированных клетках, повысить биодоступность и так далее,а подходящие препараты для введения, способы и протоколы хорошо известны в данной области (см. также выше). Показательные подходящие протоколы для превращения рассматриваемых соединений в соответствующие пролекарственные формы можно обнаружить в Francisca Lopez, Rui Moreira and Jimas possible prodrug derivatives. International Journal of Pharmaceutics, 1987, 37, 87-95, or in Joseph H. Chan,Benzophenones as inhibitors of reverse transcriptase. WO 02/070470, все из которых включены в описание цитированием. Примеры Следующие эксперименты представлены только для иллюстрации показательных аспектов изобретения, их не следует рассматривать как ограничение предмета изобретения. 5-Метил-4-фенил-4 Н-1,2,4-триазол-3-тиол: Суспензию 4-фенил-3-тиосемикарбазида (10 г, 59,8 ммоль) в диметилацетамид-диметилацетали (30 мл, 205 ммоль) нагревали в открытой колбе на паровой бане в течение 1,5 ч. Удаление растворителя и флэш-хроматография остатка (2% метанол/дихлорметан) позволили получить смесь 5-метил-4-фенил 4 Н-1,2,4-триазол-3-тиола и 3-метил-5-метилтио-4-фенил-4 Н-1,2,4-триазола.N-(2-Бром-4-метилфенил)-2-хлорацетамид 2-Бром-4-метилфенил (500 мг, 2,69 ммоль) добавляли к смеси хлорацетилхлорида (0,14 мл, 2,69 ммоль) и диизопропилметиламина (0,47 мл, 2,69 ммоль) в дихлорметане (16 мл). После 4 ч перемешивания смесь разбавляли этилацетатом и промывали 1N хлористо-водородной кислотой, водой и насыщенным водным раствором хлорида натрия и высушивали над MgSO4. Удаление растворителя в вакууме позволило получить требуемое соединение.N-(2-Бром-4-метилфенил)-2-(5-метил-4-фенил-4 Н-[1,2,4]триазол-3-ил-сульфанил)ацетамид Смесь 5-метил-4-фенил-4 Н-1,2,4-триазол-3-тиола (200 мг, 1,05 ммоль), карбоната калия (153,6 мг,1,1 ммоль) и N-(2-бром-4-метилфенил)-2-хлорацетамида (273,5 мг, 1,05 ммоль) в N,Nдиметилформамиде (5 мл) перемешивали в течение ночи. Полученную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали водой, насыщенным водным раствором хлорида натрия и высушивали над MgSO4. Удаление растворителя в вакууме и флэш-хроматография остатка дали требуемое соединение. 4-Метилнитронафталин. Азотную кислоту (9,6 мл) медленно добавляли к чистому 1-метилнафталину (3 г, 21 ммоль) при 0 С. Затем добавляли воду (20 мл), а водный слой экстрагировали бензолом (40 мл). Органический слой промывали гидроксидом натрия, высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали методом колоночной хроматографии (90% гексан/10% этилацетат), чтобы получить 2,82 г продукта в виде желтого твердого вещества (выход 72%). 4-Метиламинонафталин: К раствору 4-метилнитронафталина (1 г, 5,3 ммоль) в этаноле (80 мл) добавляли Ni Ренея (0,9 г) и смесь перемешивали 4 ч в атмосфере водорода (5 фунтов/дюйм 2). Затем катализатор отфильтровывали, а растворитель удаляли в вакууме, чтобы получить неочищенное указанное в заглавии соединение (772 мг,выход 92%) в виде желтого масла, которое использовали на следующей стадии без дальнейшей очистки. Этилацетимидат-тиосемикарбазон. К раствору гидрохлорида этилацетимидата (1 г, 8,1 ммоль) в диметилформамиде (16 мл) добавляли тиосемикарбазид (738 мг, 8,1 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч. Затем воду добавляли к реакционной смеси до тех пор, пока не образовывался осадок (продукт) (1,16 г,89%). 5-Метил-4-(4-метилнафталин-1-ил)-4 Н-[1,2,4]триазол-3-тиол. Раствор этилацетимидата-тиосемикарбазона (488 мг, 3,02 ммоль), диметилформамида (4 мл) и 4 метиламинонафталина (475 мг, 3,02 ммоль) нагревали с обратным холодильником в течение 3 ч. После выпаривания растворителя добавляли раствор 1N гидроксида натрия (10 мл) и смесь перемешивали в течение 20 мин при 40 С. Реакционную смесь затем экстрагировали эфиром, чтобы удалить побочные продукты. Полученный водный слой обрабатывали 10% раствором хлористо-водородной кислоты до тех пор, пока продукт не выпадал в осадок (435 мг, 56%).(49 мг, 0,19 ммоль) и карбонат калия (30 мг, 0,22 ммоль) и смесь перемешивали в течение 18 ч при комнатной температуре. Добавляли воду и водный слой экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия и концентрировали. Полученный остаток очищали методом колоночной хроматографии (90% дихлорметан/10% метанол), чтобы получить 65 мг указанного в заглавии соединения, выход 87%. 4-Этилнитронафталин: Азотную кислоту (9,6 мл) медленно добавляли к чистому 1-этилнафталину (3 г, 19,2 ммоль) при 0 С. Затем добавляли воду (20 мл) и водный слой экстрагировали бензолом (40 мл). Органический слой промывали гидроксидом натрия, высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали методом колоночной хроматографии (90% гексан/10% этилацетат), чтобы получить 3,2 г указанного в заглавии продукта в виде желтого твердого вещества (выход 84%). 4-Этиламинонафталин: К раствору 4-этилнитронафталина (1 г, 4,9 ммоль) в этаноле (80 мл) добавляли Ni Ренея (0,9 г) и смесь перемешивали 4 ч в атмосфере водорода (5 фунт/дюйм 2). Затем отфильтровывали катализатор, а растворитель удаляли в вакууме, чтобы получить желтое масло, которое очищали методом колоночной хроматографии (95% гексан/5% этилацетат), чтобы получить указанный в заглавии продукт в виде желтого твердого вещества (800 мг, выход 94%).- 16009478 5-Метил-4-(4-этилнафталин-1-ил)-4 Н-[1,2,4]триазол-3-тиол: Раствор этилацетимидата тиосемикарбазона (1,94 г, 12,0 ммоль), диметилформамида (10 мл) и 4 этиламинонафталина (1,35 г, 12,0 ммоль) нагревали с обратным холодильником в течение 3 ч. После выпаривания растворителя добавляли раствор 1N гидроксида натрия (25 мл) и смесь перемешивали в течение 20 мин при 40 С. Затем реакционную смесь экстрагировали эфиром, чтобы удалить побочные продукты. Полученный водный слой обрабатывали 10% раствором хлористо-водородной кислоты до тех пор, пока требуемый продукт не выпадал в осадок (1,48 г, 46%).N-(2-Хлорпиридин-3-ил)-2-[4-(4-этилнафталин-1-ил)-5-метил-4 Н-[1,2,4]триазол-3-ил-сульфанил]ацетамид К раствору 5-метил-4-(4-этилнафталин-1-ил)-4 Н-[1,2,4]триазол-3-тиола (50 мг, 0,19 ммоль) в диметилформамиде (1,5 мл) добавляли N-(2-хлорпиридин-3-ил)-2-хлорацетамид (полученный из 2-хлорпиридин-3-ил-амина) (39 мг, 0,19 ммоль) и карбонат калия (28 мг, 0,22 ммоль) и смесь перемешивали 18 ч при комнатной температуре. Добавляли воду, а водный слой экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия и концентрировали. Полученный остаток очищали методом колоночной хроматографии (90% дихлорметан/10% метанол), чтобы получить требуемый продукт 4-Метил-5,6,7,8-тетрагидронафталин-1-ил-амин. К раствору 4-метилнитронафталина (1,1 г, 5,9 ммоль) в этаноле (80 мл) добавляли Ni Ренея (0,9 г) и смесь перемешивали 3 дня в атмосфере водорода (50 фунтов/дюйм 2). Затем катализатор отфильтровывали, а растворитель удаляли в вакууме, чтобы получить неочищенное требуемое соединение (750 мг, 79%) в виде желтого масла, которое использовали на следующей стадии без дальнейшей очистки. 5-Метил-4-(4-метил-5,6,7,8-тетрагидронафталин-1-ил)-4 Н-[1,2,4]-триазол-3-тиол. Раствор этилацетимидат-тиосемикарбазона (500 мг, 3,1 ммоль), диметилформамида (4 мл) и 4 метиламинонафталина (500 мг, 3,1 ммоль) нагревали с обратным холодильником в течение 3 ч. После выпаривания растворителя добавляли раствор 1N гидроксида натрия (10 мл) и смесь перемешивали в течение 20 мин при 40 С. Затем реакционную смесь экстрагировали эфиром, чтобы удалить побочные продукты. Полученный водный слой обрабатывали 10% раствором хлористо-водородной кислоты до тех пор, пока продукт не выпадал в осадок (349,4 мг, 43,5%).N-(2-Хлорпиридин-3-ил)-2-[5-метил-4-(4-метил-5,6,7,8-тетрагидронафталин-1-ил)-4 Н-[1,2,4]триазол-3-ил-сульфанил]ацетамид: К раствору 5-метил-4-(4-метил-5,6,7,8-тетрагидронафталина-1-ил)-4 Н-[1,2,4]триазол-3-тиола (50 мг,0,19 ммоль) в диметилформамиде (1,5 мл) добавляли N-(2-хлор-пиридин-3-ил)-2-хлорацетамид (полученный из 2-хлорпиридин-3-ил-амина) (39 мг, 0,19 ммоль) и карбонат калия (28 мг, 0,22 ммоль) и смесь перемешивали 18 ч при комнатной температуре. Добавляли воду, а водный слой экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия и концентрировали. Полученный остаток очищали методом колоночной хроматографии (90% дихлорметан/10% метанол), чтобы получить требуемое соединение (35 мг, выход 40%). 2,4-Диметил-1-нитронафталин. Азотную кислоту (9,6 мл) медленно добавляли к чистому 2,4-диметилнафталину (3 г, 19,2 ммоль) при 0 С. Затем добавляли воду (20 мл), а водный слой экстрагировали бензолом (40 мл). Органический слой промывали гидроксидом натрия, высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали методом колоночной хроматографии (90% гексан/10% этилацетат), чтобы получить 3,459 г 13 в виде желтого твердого вещества (выход 89%). 2,4-Диметилнафталин-1-ил-амин. К раствору 2,4-диметил-1-нитронафталина (1 г, 4,9 ммоль) в этаноле (80 мл) добавляли Ni Ренея(0,9 г) и смесь перемешивали 18 ч в атмосфере водорода (атмосферное давление). Затем катализатор от- 17009478 фильтровывали, а растворитель удаляли в вакууме, чтобы получить неочищенное требуемое соединение,которое очищали методом колоночной хроматографии (90% гексан/10% этилацетат), чтобы получить чистый требуемый амин (822 мг, выход 97%). 4-(2,4-Диметилнафталин-1-ил)-5-метил-4 Н-[1,2,4]триазол-3-тиол. Раствор этилацетимидат-тиосемикарбазона (500 мг, 3,1 ммоль), диметилформамида (4 мл) и 2,4 диметилнафталин-1-иламина (534 мг, 3,1 ммоль) нагревали с обратным холодильником в течение 3 ч. После выпаривания растворителя добавляли раствор 1N гидроксида натрия (10 мл) и смесь перемешивали в течение 20 мин при 40 С. Затем реакционную смесь экстрагировали эфиром, чтобы удалить побочные продукты. Полученный водный слой обрабатывали 10% раствором хлористо-водородной кислоты до тех пор, пока продукт не выпадал в осадок (284 мг, 34%).N-(2-Бромфенил)-2-[4-(2,4-диметилнафталин-1-ил)-5-метил-4 Н-[1,2,4]триазол-3-ил-сульфанил]ацетамид: К раствору 4-(2-диметилнафталин-1-ил)-5-метил-4 Н-[1,2,4]триазол-3-тиола (50 мг, 0,19 ммоль) в диметилформамиде (1,5 мл) добавляли N-(2-бромфенил)-2-хлорацетамид (полученный из 2 броманилина) (47 мг, 0,19 ммоль) и карбонат калия (2 8 мг, 0,21 ммоль) и смесь перемешивали 18 ч при комнатной температуре. Добавляли воду, а водный слой экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия и концентрировали. Полученный остаток очищали методом колоночной хроматографии (90% дихлорметан/10% метанол), чтобы получить требуемое соединение (49 мг, выход 58%). 4,7-Диметил-1-нитронафталин. Азотную кислоту (5 мл) медленно добавляли к чистому 1,6-диметилнафталину (1 г, 6,4 ммоль) при 0 С. Затем добавляли воду (20 мл) и водный слой экстрагировали бензолом (40 мл). Органический слой промывали гидроксидом натрия, высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали методом колоночной хроматографии (90% гексан/10% этилацетат), чтобы получить 1,0 г требуемого продукта в виде желтого твердого вещества (выход 78%). 4,7-Диметилнафталин-1-иламин. К раствору 4,7-диметил-1-нитронафталина (1 г, 4,9 ммоль) в этаноле (80 мл) добавляли Ni Ренея(0,9 г) и смесь перемешивали 18 ч в атмосфере водорода (атмосферное давление). Затем катализатор отфильтровывали, а растворитель удаляли в вакууме. Неочищенную смесь очищали методом колоночной хроматографии (90% гексан/10% этилацетат), чтобы получить очищенный требуемый амин (434 мг, выход 52%). 4-(4,7-Диметилнафталин-1-ил)-5-метил-4 Н-[1,2,4]триазол-3-тиол. Раствор этилацетимидат-тиосемикарбазона (400 мг, 2,48 ммоль), диметилфорамида (6 мл) и 4,7 диметилнафталин-1-ил-амина (425 мг, 2,48 ммоль) нагревали с обратным холодильником в течение 3 ч. После выпаривания растворителя добавляли раствор 1N гидроксида натрия (10 мл) и смесь перемешивали в течение 20 мин при 40 С. Реакционную смесь затем экстрагировали эфиром, чтобы удалить побочные продукты. Полученный водный слой обрабатывали 10% раствором хлористо-водородной кислоты до тех пор, пока требуемый продукт не выпадал в осадок (370 мг, выход 55%).N-(2-Хлор-4-сульфамоилфенил)-2-[4-(4,7-диметилнафталин-1-ил)-5-метил-4 Н-[1,2,4]триазол-3-илсульфанил]ацетамид: К раствору 4-(4,7-диметилнафталин-1-ил)-5-метил-4 Н-[1,2,4]триазол-3-тиола (50 мг, 0,19 ммоль) в диметилформамиде (1,5 мл) добавляли N-(2-хлор-4-сульфамоилфенил)-2-хлорацетамид (44 мг, 0,19 ммоль) и карбонат калия (28 мг, 0,20 ммоль) и смесь перемешивали 18 ч при комнатной температуре. Добавляли воду, а водный слой экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия и концентрировали. Полученный остаток очищали методом колоночной хроматографии(90% дихлорметан/10% метанол), чтобы получить требуемый продукт (34,3 мг, выход 39%).- 18009478 2,5-Диметил-8-нитрохинолин. К суспензии 2-нитро-5-метиланилина (3 г, 19,8 ммоль) в хлористо-водородной кислоте (12 мл) добавляли по каплям ацетальдегид при комнатной температуре и смесь перемешивали при указанной температуре в течение 15 мин и при 68 С в течение дополнительного часа. Реакционную смесь охлаждали до комнатной температуры, выливали в ледяную воду и нейтрализовали гидроксидом аммония, чтобы образовался желтый осадок (3,64 г, выход 89%). 2,5-Диметилхинолин-8-ил-амин: К раствору 2,5-диметил-8-нитрохинолина (2 г, 9,9 ммоль) в этаноле (160 мл) добавляли Ni Ренея(1,8 г) и смесь перемешивали 18 ч в атмосфере водорода (атмосферное давление). Катализатор затем отфильтровывали, а растворитель удаляли в вакууме. Неочищенную смесь очищали методом колоночной хроматографии (90% гексан/10% этилацетат), чтобы получить очищенный требуемый амин (1,5 г, выход 88%). 4-(2,5-Диметилхинолин-8-ил)-5-метил-4 Н-[1,2,4]триазол-3-тиол. Раствор этилацетимидат-тиосемикарбазона (1,7 г, 10,7 ммоль), диметилформамида (12 мл) и 2,5 диметилхинолин-8-ил-амина (1,8 г, 10,7 ммоль) нагревали с обратным холодильником в течение 3 ч. После выпаривания растворителя добавляли раствор 1N гидроксида натрия (10 мл) и смесь перемешивали в течение 20 мин при 40 С. Реакционную смесь затем экстрагировали эфиром, чтобы удалить побочные продукты. Полученный водный слой обрабатывали 10% раствором хлористо-водородной кислоты до тех пор, пока продукт не выпадал в осадок (465 мг, выход 17%).N-(2-Хлорпиридин-3-ил)-2-[4-(2,5-диметилхинолин-8-ил)-5-метил-4 Н-[1,2,4]триазол-3-ил-сульфанил]ацетамид К раствору 4-(2,5-диметилхинолин-8-ил)-5-метил-4 Н-[1,2,4]триазол-3-тиола (50 мг, 0,18 ммоль) в диметилформамиде (1,5 мл) добавляли N-(2-хлорпиридин-3-ил)-2-хлорацетамид (полученный из 2-хлорпиридин-3-ил-амина) (37 мг, 0,18 ммоль) и карбонат калия (28 мг, 0,22 ммоль) и смесь перемешивали 18 ч при комнатной температуре. Добавляли воду, а водный слой экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия и концентрировали. Полученный остаток очищали методом колоночной хроматографии (90% дихлорметан/10% метанол), чтобы получить требуемый продукт 2,5,7-Триметилхинолин. К суспензии 3,5-диметиланилина (5 г, 41,2 ммоль) в хлористо-водородной кислоте (20 мл) добавляли по каплям ацетальдегид при 0 С и смесь перемешивали при указанной температуре в течение 15 мин,а затем при 70 С в течение 18 ч. Реакционную смесь затем охлаждали до комнатной температуры, выливали в ледяную воду, нейтрализовали гидроксидом аммония и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4 и концентрировали в вакууме. Колоночная хроматография остатка(гексан/этилацетат) (6:1) давала требуемый хинолин (3,95 г, выход 56%). 2,5,7-Триметил-8-нитрохинолин. Серную кислоту (21,8 мл) добавляли к чистому 2,5,7-триметилхинолину (4 г, 23,4 ммоль) при 0 С. Затем порциями добавляли нитрат калия (2,6 г, 25,7 ммоль) и реакционную смесь перемешивали при 0 С в течение 30 мин, а затем при комнатной температуре в течение 1 ч. Реакционную смесь затем выливали на лед, нейтрализовали гидроксидом аммония и экстрагировали дихлорметаном. Органический слой высушивали над сульфатом натрия и концентрировали при пониженном давлении. Колоночная хроматография остатка (гексан/этилацетат) (3:1) давала 3,63 г требуемого хинолина с выходом 72%. 2,5,7-Триметилхинолин-8-ил-амин. 2,5,7-Триметил-8-нитрохинолин (3,63 г, 16,8 ммоль) и дитионит натрия (14 г, 80,6 ммоль) нагревали с обратным холодильником в 50% водном этаноле (400 мл) в течение 4 ч. Смесь подщелачивали 1 МNaOH, а затем экстрагировали эфиром. Объединенные органические слои высушивали над сульфатом натрия и концентрировали при пониженном давлении, чтобы получить требуемое соединение (1,65 г,выход 54%). 5-Метил-4-(2,5,7-триметилхинолин-8-ил)-4 Н-[1,2,4]триазол-3-тиол. Раствор этилацетимидат-тиосемикарбазона (1,4 г, 8,8 ммоль), диметилформамида (10 мл) и 2,5,7 триметилхинолин-8-ил-амина (1,64 г, 8,8 ммоль) нагревали с обратным холодильником в течение 3 ч. После выпаривания растворителя добавляли раствор 1N гидроксида натрия (10 мл) и смесь перемешивали в течение 20 мин при 40 С. Реакционную смесь затем экстрагировали эфиром, чтобы удалить побоч- 19009478 ные продукты. Полученный водный слой обрабатывали 10% раствором хлористо-водородной кислоты до тех пор, пока продукт не выпадал в осадок (879 мг, выход 35%).N-(2-Метил-4-сульфамоилфенил)-2-[5-метил-4-(2,5,7-триметилхинолин-8-ил)-4 Н-[1,2,4]триазол-3 ил-сульфанил]-ацетамид К раствору 5-метил-4-(2,5,7-триметилхинолин-8-ил)-4 Н-[1,2,4]триазол-3-тиола (50 мг, 0,19 ммоль) в диметилформамиде (1,5 мл) добавляли N-(2-метил-4-сульфамоилфенил)-2-хлорацетамид (47 мг, 0,19 ммоль) и карбонат калия (28 мг, 0,21 ммоль) и смесь перемешивали 18 ч при комнатной температуре. Добавляли воду, а водный слой экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия и концентрировали. Полученный остаток очищали методом колоночной хроматографии(90% дихлорметан/10% метанол), чтобы получить требуемый продукт (65 мг, выход 73%). 5-Хлор-2-метил-8-нитрохинолин. Хлористо-водородную кислоту (12 мл) добавляли при 0 С в колбу, содержащую 2-нитро-5 хлоранилин (3 г, 17,4 ммоль), затем по каплям добавляли ацетальдегид (3 мл, 52,2 ммоль) при 0 С и смесь перемешивали при указанной температуре в течение 15 мин, а затем при 75 С в течение 3 ч. Реакционную смесь затем охлаждали до комнатной температуры, выливали в ледяную воду, нейтрализовали гидроксидом аммония и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4 и концентрировали в вакууме, чтобы получить 1,69 г нитрохинолина с выходом 44%, который использовали на следующей стадии без дальнейшей очистки. Диметил-(2-метил-8-нитрохинолин-5-ил)амин. К раствору 5-хлор-2-метил-8-нитрохинолина (680 мг, 3,1 ммоль) в диметилформамиде (3 мл) добавляли диметиламин (2 М, МеОН) (16 мл, 31 ммоль) при комнатной температуре и реакционную смесь перемешивали в течение 4 дней при 40 С. Затем реакционную смесь концентрировали и очищали методом колоночной хроматографии (гексан/этилацетат) (3:1), чтобы получить требуемый амин, 557 мг, с выходом 78%. 2-Метил-5-диметиламино-8-аминохинолин. Диметил-(2-метил-8-нитрохинолин-5-ил)амин (556 мг, 2,4 ммоль) и дитионит натрия (2,09 г, 12 ммоль) нагревали с обратным холодильником в 50% водном этаноле (60 мл) в течение 1 ч. Смесь подщелачивали 1 М NaOH, а затем экстрагировали эфиром. Объединенные органические слои высушивали над сульфатом натрия и концентрировали при пониженном давлении, чтобы получить требуемое соединение(450 мг, выход 94%). 4-(5-Диметиламино-2-метилхинолин-8-ил)-5-метил-4 Н-[1,2,4]-триазол-3-тиол. Раствор этилацетимидат-тиосемикарбазона (361 мг, 2,2 ммоль), диметилформамида (4 мл) и 2 метил-5-диметиламино-8-аминохинолина (449 мг, 2,2 ммоль) нагревали с обратным холодильником в течение 3 ч. После выпаривания растворителя добавляли раствор 1N гидроксида натрия (10 мл) и смесь перемешивали в течение 20 мин при 40 С. Реакционную смесь затем экстрагировали эфиром, чтобы удалить побочные продукты. Полученный водный слой обрабатывали 10% раствором хлористо-водородной кислоты до тех пор, пока продукт не выпадал в осадок (170 мг, выход 25%).N-(2-Хлорпиридин-3-ил)-2-[4-(5-диметиламино-2-метилхинолин-8-ил)-5-метил-4 Н-[1,2,4]триазол-3 ил-сульфанил]ацетамид: К раствору 4-(5-диметиламино-2-метилхинолин-8-ил)-5-метил-4 Н-[1,2,4]триазол-3-тиола (50 мг,0,17 ммоль) в диметилформамиде (1,5 мл) добавляли N-(2-хлорпиридин-3-ил)-2-хлорацетамид (полученный из 2-хлорпиридин-3-ил-амина) (35 мг, 0,17 ммоль) и карбонат калия (25 мг, 0,18 ммоль) и смесь перемешивали 18 ч при комнатной температуре. Добавляли воду, а водный слой экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия и концентрировали. Полученный остаток очищали методом колоночной хроматографии (90% дихлорметан/10% метанол), чтобы получить требуемый продукт (63 мг, выход 79%). 4-Хлор-2-метокси-5-метил-8-нитрохинолин. 2,4-Дихлор-5-метилхинолин (1 г, 3,9 ммоль) нагревали с обратным холодильником в метоксиде натрия (0,5 М, МеОН) (8 мл, 3,9 ммоль) в течение 1 ч. Реакционную смесь затем охлаждали, выливали в холодную воду и фильтровали, чтобы получить 875 мг требуемого хинолина с выходом 89%. 4-Хлор-2-метокси-5-метилхинолин-8-ил-амин. 4-Хлор-2-метокси-5-метил-8-нитрохинолин (875 мг, 3,5 ммоль) и дитионит натрия (3 г, 17,3 ммоль) нагревали с обратным холодильником в 50% водном этаноле (120 мл) в течение 1 ч. Смесь подщелачивали 1 М NaOH, а затем экстрагировали эфиром. Объединенные органические слои высушивали над сульфатом натрия и концентрировали при пониженном давлении, чтобы получить требуемое соединение (410 мг, выход 53%). 4-(4-Хлор-2-метокси-5-метилхинолин-8-ил)-5-метил-4 Н-[1,2,4]-триазол-3-тиол. Раствор этилацетимидат-тиосемикарбазона (283 мг, 1,75 ммоль), диметилформамида (4 мл) и 4 хлор-2-метокси-5-метилхинолин-8-ил-амина (2,83 мг, 1,75 ммоль) нагревали с обратным холодильником в течение 3 ч. После выпаривания растворителя добавляли раствор 1N гидроксида натрия (10 мл) и смесь перемешивали в течение 20 мин при 40 С. Реакционную смесь затем экстрагировали эфиром, чтобы удалить побочные продукты. Полученный водный слой обрабатывали 10% раствором хлористо-водородной кислоты до тех пор, пока продукт не выпадал в осадок (170 мг, выход 25%). 2-[4-(4-Хлор-2-метокси-5-метилхинолин-8-ил)-5-метил-4 Н-[1,2,4]-триазол-3-ил-сульфанил]-N-(2 метил-4-сульфамоилфенил)ацетамид: К раствору 4-(4-хлор-2-метокси-5-метилхинолин-8-ил)-5-метил-4 Н-[1,2,4]триазол-3-тиола (50 мг,0,16 ммоль) в диметилформамиде (1,5 мл) добавляли N-(2-метил-4-сульфамоилфенил)-2-хлорацетамид(33 мг, 0,16 ммоль) и карбонат калия (25 мг, 0,18 ммоль) и смесь перемешивали 18 ч при комнатной температуре. Добавляли воду, водный слой экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия и концентрировали. Полученный остаток очищали методом колоночной хроматографии (90% дихлорметан/10% метанол), чтобы получить требуемое соединение (42 мг, выход 49%). Производные триазола 5-метоксиметил-4-фенил-4 Н-[1,2,4]триазол-3-тиол В 100-мл круглодонную колбу загружали 4-фенилтиосемикарбазид (500 мг, 2,99 ммоль) в 20 мл абсолютного этанола. В полученную гетерогенную реакционную смесь добавляли этилметоксиацетат (214 мкл, 2,99 ммоль), а впоследствии 0,5 М метоксид натрия в метаноле (11,96 мл, 5,98 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 36 ч в атмосфере аргона. Растворитель удаляли с помощью роторного испарителя после того, как добавляли 1 мл уксусной кислоты. Полученные твердые частицы очищали методом колоночной флэш-хроматографии смесью 5% метанол в дихлорметане. Получали серого цвета твердые частицы (64%, 361 мг). В 10-мл круглодонную колбу загружали 5-метоксиметил-4-фенил-4 Н-[1,2,4]триазол-3-тиол (44,1 мг,0,2 ммоль), 2-хлор-N-(2-хлорфенил)ацетамид (49,4 мг, 0,2 ммоль) и карбонат калия (30,4, 0,22 ммоль) в 2 мл сухого DMF. Полученный гетерогенный раствор перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли с помощью вакуумного роторного испарителя, получая маслянистый остаток. Остаток очищали препаративной TLC (ТСХ), используя 5% МеОН в дихлорметане, чтобы получить белые твердые частицы (62 мг, 79%). В 50-мл круглодонную колбу загружали п-толуидин (1,65 г, 10 ммоль) и 1,1-бис(метилтио)-2 нитроэтен (1,07 г, 10 ммоль) в 25 мл абсолютного EtOH. Реакционную смесь кипятили с обратным холодильником в течение 5 ч. Затем после охлаждения до комнатной температуры получали твердые частицы. Полученные твердые частицы промывали 20 мл EtOH (1,64 г, 73%). Твердые частицы использовали на следующей стадии без дальнейшей очистки. В 100-мл круглодонную колбу загружали (1-метилсульфанил-2-нитровинил)-п-толиламин (5,62 г,25,08 ммоль) в 60 мл EtOH. В полученную реакционную смесь шприцем добавляли безводный гидразин(1,88 мл, 60,2 ммоль) при комнатной температуре. Реакционную смесь кипятили с обратным холодильником в течение 5 ч. После охлаждения смеси до комнатной температуры твердые частицы выпадали из раствора в осадок. Полученные твердые частицы фильтровали через фильтровальную бумагу, затем промывали 30 мл EtOH, получая желтые твердые частицы (4,30 г, 74%). 3-Метил-5-нитрометил-4-п-толил-4 Н-[1,2,4]триазол В 100-мл круглодонную колбу загружали (1-гидразино-2-нитровинил)-п-толиламин (4,3 г, 18,5 ммоль) в 60 мл EtOH. В полученную реакционную смесь добавляли триэтилортоацетат (6,76 мл, 37,0 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 4 ч. Растворитель удаляли выпариванием на роторном испарителе, а затем полученный остаток очищали методом колоночной флэш-хроматографии в смеси н-гексана и этилацетата (1:1). Получали очень густое чистое маслянистое соединение (3,7 г, 86%). С-(5-Метил-4-п-толил-4 Н-[1,2,4]триазол-3-ил)метиламин В 100-мл реакционный сосуд Парра загружали 3-метил-5-нитро-4-п-толил-4 Н-[1,2,4]триазол (350 мг, 1,43 ммоль), 10% Pd-С (200 мг) в 40 мл МеОН. Реакционную смесь встряхивали в течение 20 ч при давлении 30 фунтов/дюйм 2. Реакционную смесь фильтровали через целит, а затем фильтрат концентрировали при пониженном давлении до бледно-желтого масла (280 мг, 97%). Остаток использовали на следующей стадии без дальнейшей очистки. 1-(3-Бромфенил)-3-(5-метил-4-п-толил-4 Н-[1,2,4]триазол-3-ил-метил)мочевина В 25-мл круглодонную колбу загружали С-(5-метил-4-п-толил-4 Н-[1,2,4]триазол-3-ил)метиламин(56 мг, 0,28 ммоль) в сухом хлористом метилене (5 мл). В полученный раствор добавляли 3-бромфенилизоцианат (52 мкл, 0,42 ммоль). Реакционную смесь перемешивали 15 ч при комнатной температуре. Растворитель удаляли выпариванием на роторном испарителе, получая коричневый остаток. Остаток очищали методом препаративной ТСХ с 5% МеОН в хлористом метилене, получая 30 мг белых твердых частиц (27%). Производные имидазола 1-(4-Диметиламинонафталин-1-ил)-3-проп-2-инил-тиомочевина В 100-мл круглодонную колбу загружали 4-диметиламино-1-нафтилизотиоцианат (6,70 ммоль) в 20 мл бензола. В полученный раствор шприцем добавляли пропаргиламин (7,37 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли выпариванием на роторном испарителе, получая светло-коричневые твердые частицы. Твердые частицы (1,29 г, 95%) промывали 100 мл н-гексана, а затем твердые частицы использовали на следующей стадии без дальнейшей очистки. 1-(4-Диметиламинонафталин-1-ил)-5-метил-1 Н-имидазол-2-тиол В 50-мл круглодонную колбу загружали 1-(4-диметиламинонафталин-1-ил)-3-проп-2-инилтиомочевину (160 мг, 0,56 ммоль) в 10 мл МеОН. В полученную смесь шприцем добавляли 25%MeOH/MeONa (1 мл) в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. В реакционную смесь добавляли уксусную кислоту (1 мл), а растворитель удаляли выпариванием на роторном испарителе, получая белые твердые частицы. Твердые частицы очищали методом колоночной флэш-хроматографии смесью гексана и этилацетата (1:2), чтобы получить 50 мг чистых белых твердых частиц (31%). В 10-мл круглодонную колбу загружали 1-(4-диметиламинонафталин-1-ил)-5-метил-1 Н-имидазол 2-тиол (100 мг, 0,35 ммоль), карбонат калия (53,21 мг, 0,39 ммоль) в 3 мл DMF. В полученную смесь добавляли 2-хлор-N-(2-хлорпиридин-3-ил)ацетамид (72,05 мг, 0,35 ммоль), а затем реакционную смесь перемешивали в течение 16 ч. Растворитель удаляли выпариванием на роторном испарителе, получая маслянистый остаток. Остаток очищали методом колоночной флэш-хроматографии в смеси н-гексана и этилацетата (1:1), чтобы получить 136 мг чистого продукта (86%). Сложный трет-бутиловый эфир [1-(метоксиметилкарбамоил)этил]карбаминовой кислоты В 250-мл круглодонную колбу загружали Вос-Аlа-ОН (1,89 г, 10 ммоль) в 50 мл хлористого метилена. В полученную смесь добавляли EDC (2,10 г, 11 ммоль) в одной порции. Реакционную смесь перемешивали при комнатной температуре в течение 10 мин. В смесь добавляли раствор смеси DIPEA (3,83 мл, 22 ммоль) и гидрохлорид N, O-диметил-гидроксиламина (1,07 г, 11 моль) в 20 мл хлористого метилена. Реакционную смесь перемешивали в течение 14 ч. Органический слой промывали 50 мл водной НС 1,а затем 50 мл насыщенного водного NaHCO3. Органический слой высушивали над безводным сульфатом натрия. Растворитель удаляли выпариванием на роторном испарителе, получая желто-красное масло (5,3 г, 53%), которое использовали на следующей стадии без дальнейшей очистки. Сложный трет-бутиловый эфир (1-метил-2-оксопропил)карбаминовой кислоты В 100-мл круглодонную колбу загружали сложный трет-бутиловый эфир [1-(метоксиметилкарбамоил)этил)карбаминовой кислоты (1,23 г, 5,29 ммоль) в 30 мл хлористого метилена. В реакционную смесь шприцем добавляли 3,0 М бромид метилмагния (5,30 г, 15,9 ммоль). Реакционную смесь пере- 23009478 мешивали при комнатной температуре в течение 30 мин. Реакционную смесь гасили 100 мл 25% водного раствора хлорида аммония, разбавляя органический слой 100 мл этилацетата. Объединенный органический слой высушивали над безводным сульфатом натрия, а затем растворитель удаляли выпариванием на роторном испарителе, получая желто-коричневое масло (561 мг, 57%). Неочищенный продукт использовали на следующей стадии без дальнейшей очистки. 4,5-Диметил-1-п-толил-1 Н-имидазол-2-тиол В 50-мл круглодонную колбу загружали сложный трет-бутиловый эфир (1-метил-2-оксопропил)карбаминовой кислоты (370 мг, 2,0 ммоль) в 10 мл 25% трифторуксусной кислоты в хлористом метилене. Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли выпариванием на роторном испарителе, получая темно-коричневый остаток. Затем остаток повторно растворяли в 20 мл хлористого метилена. К полученной смеси добавляли смесь п-толилизотиоцианата иDIEA (2,8 мл, 8 ммоль) в 10 мл хлористого метилена. Полученную смесь перемешивали при комнатной температуре в течение 18 ч. Органический слой промывали 50 мл насыщенного водного раствора хлорида аммония. Органический слой высушивали над безводным сульфатом натрия, получая бледно-желтый остаток. Остаток очищали с помощью флэш-хроматографии на силикагеле смесью н-гексана и этилацетата (1:1), чтобы получить 40 мг белых твердых частиц (10%). В 10-мл круглодонную колбу загружали 4,5-диметил-1-п-толил-1 Н-имидазол-2-тиол (40 мг, 0,18 ммоль), N-(2-бромфенил)-2-хлорацетамид (45,3 мг, 0,18 ммоль) и карбонат калия (25 мг, 0,18 ммоль) в 3 мл DMF. Реакционную смесь перемешивали при комнатной температуре 14 ч. Растворитель удаляли при пониженном давлении, получая желтый маслянистый остаток. Остаток очищали хроматографией на силикагеле смесью этилацетата и н-гексана (1:1), чтобы получить 18 мг белых твердых частиц (23%). Тест-система для определения ингибирования обратной транскриптазы ВИЧ-1 Рассматриваемые соединения тестировали в отношении ингибиторной активности против вируса иммунодефицита человека типа 1 (ВИЧ-1), применяя высокопроизводительный клеточный анализ с использованием экспрессирующей ВИЧ-1 люциферазы светляка в качестве гена-репортера и гликопротеина оболочки, псевдотипированного вирусом везикулярного стоматита (VSV-G). Экспериментальные процедуры по существу были теми, которые описаны Connor et al. in Journal of Virology (1996), 70: 53065311 (Characterization of the functional properties of env genes from long-term survivors of human immunodeficiency virus type 1 infection), and Popik et al. in Journal of Virology (2002), 76: 4709-4722 (Human immunodeficiency virus type 1 uses lipid raft-colocalized CD4 and chemokine receptors for productive entry into CD4+T cells). Следует особо учитывать, что вирус содержит две введенные мутации в гене RT (K103N иY181C, произведенные методом ПЦР-мутагенеза), что делает вирус высокорезистентным к распространенным ненуклеозидным лекарственным средствам в отношении ВИЧ-1. Вирусные штаммы получали котрансфекцией плазмидной ДНК, кодирующей VSV-G, с вектором pNL4-3Env(-)Luc(+) в клетки 293 Т. Через 64 ч после трансфекции среду, содержащую вирус, собирали центрифугированием и хранили замороженной при -80 С. Клетки HeLa инфицировали вирусом, псевдотипированным VSV-G, в присутствии тестируемых соединений в 384-луночном титрационном микропланшете. Через сорок восемь часов после инициации инфекции к клеткам добавляли буфер для лизиса и реагент для анализа люциферазы (Promega) и определяли активность люциферазы, оценивая появляющуюся в результате люминесценцию, используя люменометр LJL. Так как ген люциферазы вносили в вирусный геном, уровень его экспрессии прямо отражает уровень вирусной репликации в присутствии соединения. Чтобы оценить активность соединений против дикого типа ВИЧ-1, линию клеток HeLa-JC53, которая экспрессирует высокие уровни CD4 и CCR5 (см., например, Platt et al., in Journal of Virology (1998),72: 2855-2864: Effect of CCR5 and CD4 cell surface concentrations on infection by macrophagetropic isolatesof human immunodeficiency virus type 1), модифицировали выделением стабильной клеточной линии, которая экспрессирует люциферазу под контролем промотора ВИЧ-1 (длинный концевой повтор, т.е.,LTR). Инфицирование ВИЧ-1 описанной линии клеток стимулирует транскрипцию люциферазы с про- 24009478 мотора ВИЧ-1, и уровень экспрессии люциферазного гена пропорционален уровню вирусной репликацииa reporter cell line for the detection and quantitation of a single cycle of HIV and SIV replication). Способы инфицирования вирусом, тестирования соединений и определения активности люциферазы были такими же, как и для VSV-G-псевдотипированного ВИЧ-1. Использовали два подхода, чтобы оценить цитотоксичность позитивных соединений, выявленных при вирусном анализе ВИЧ-1. В первом подходе использовали другую модифицированную линию клеток HeLa-JC53, которая конститутивно экспрессирует высокий уровень люциферазы без вирусной инфекции. Уровень экспрессии люциферазы в этих клетках служил индикатором клеточной репликации в присутствии соединений. Способы тестирования соединений и определения активности люциферазы были теми же, которые использовали для исследования вирусной инфекции. В другом анализе токсичности использовали клетки HeLa-JC53 и коммерческий набор для анализа MTS (Promega), с помощью которого определяли митохондриальную функцию клеток. Результаты В табл. 1 ниже представлены величины ингибиторной активности типичных соединений в отношении ВИЧ. Ингибиторная активность представлена как ЕС 50 в мкМ, a IC50 указана в мкМ для дикого типа обратной транскриптазы ВИЧ. Ингибиторную активность при концентрациях менее 10 мкМ обозначали как А, ингибиторную активность при концентрациях от 10 мкМ до 100 мкМ обозначали как В и ингибиторную активность при концентрациях выше 100 мкМ обозначали как С. Таблица 1 Что касается отдельных соединений, внесенных в список как соединения ID 1-52, в табл. 2 ниже изображены заместители для соответствующих соединений, основанные на структуре, которая приведена выше табл. 2. Структуры соединений ID 3, 10, 22 и 25 изображены ниже табл. 2. В табл. 3 ниже представлены величины ингибиторной активности типичных соединений в отноше- 30
МПК / Метки
МПК: A61K 31/4709, C07D 249/08, C07D 401/12, C07D 401/14, C07D 401/04, C07D 233/84, A61K 31/4196
Метки: ненуклеозидные, транскриптазы, обратной, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-9478-nenukleozidnye-ingibitory-obratnojj-transkriptazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ненуклеозидные ингибиторы обратной транскриптазы</a>
Предыдущий патент: Производные циклопропила в качестве антагонистов рецептора nk3
Следующий патент: Модуляторы сск-1 рецепторов
Случайный патент: Способы получения пиразоло[3,4-d]пиримидиновых эфиров












