Ненуклезидные ингибиторы обратной транскриптазы
Номер патента: 9178
Опубликовано: 28.12.2007
Авторы: Тхавонекхам Боункхам, Ландри Серж, Маленфан Эрик, О'мира Джеффри, Йоаким Кристиан, Нод Жюли, Симоно Брюно
Формула / Реферат
1. Соединение, представленное формулой I

в котором
R2 выбирают из ряда, включающего Н, галоген;
R4 обозначает Н или CH3;
R5 обозначает Н или СН3;
R11 обозначает Н, С1-С4алкил или С3-С4циклоалкил;
А обозначает соединяющую цепь C1-С3алкила;
В обозначает О;
n обозначает 0 или 1;
причем, когда n обозначает 0, кольцо С обозначает фенил, замещенный (C1-С6)алкилом; и
Е выбирают из ряда, включающего:
(I) CONR12R13, где R12 и R13, каждый независимо друг от друга обозначает Н, SO2C1-C6алкил, С1-С6
алкил-СООН, С1-С6алкил-С3-С7циклоалкил, где циклоалкил замещен СООН;
(II) CONHNR14R15, где R14 и R15, каждый независимо друг от друга обозначает Н или С1-С6алкил, необязательно замещенный СООН;
(III) NR16COR17, где R16 обозначает Н, или С1-С6алкил, замещенный СООН или фенил-СООН; и R17 обозначает С2-С4алкенил-СООН, С3-С7циклоалкил-СООН, NHC1-С6алкил-СООН; С1-С6алкил, необязательно замещенный СООН; или С1-С6алкил-С3-С7ациклоалкил, где циклоалкил замещен СООН;
(IV) NR18SO2C1-C6алкил, где R18 обозначает Н;
(V) SO2NR19R20, где R19 обозначает Н и R20 обозначает С1-С6алкил, замещенный COOH;
или когда n обозначает 1, то кольцо С означает фенил, необязательно замещенный 1-2 заместителями, выбранными из галогена и С1-С6алкила, необязательно замещенного ОН; и
Е обозначает простую связь или соединяющую группу, выбранную из ряда, включающего
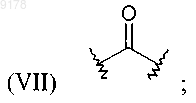
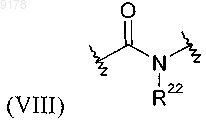
где R22 обозначает Н или С1-С6алкил;

где R23 обозначает Н или С1-С6алкил;

где R24 обозначает Н или С1-С6алкил;
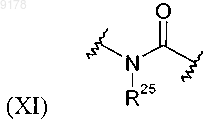
где R25 обозначает Н;
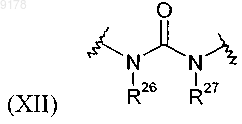
где R26 и R27, каждый обозначает Н;
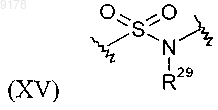
где R29 обозначает Н и
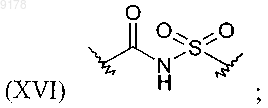
и
кольцо D обозначает фенил, необязательно замещенный 1-3 заместителями, выбранными из галогена, NH2, NO2, COOH, ОН, (С1-С6)алкокси и (С1-С6)алкила, необязательно замещенного СООН или ОН; или
кольцо D обозначает 5- или 6-членный гетероцикл, имеющий от 1 до 4 гетероатомов, выбранных из группы, включающей О, N и S, причем этот гетероатом необязательно замещен 1-2 заместителями, выбранными из галогена, NH2, СООН, ОН, COO(C1-С6)алкила и (С1-С6)алкила, необязательно замещенного СООН;
или его соль.
2. Соединение по п.1, в котором
R2 выбирают из ряда, включающего Н, галоген;
когда n обозначает 0, Е выбирают из ряда, включающего:
(I) CONR12R13, где R12 и R13, каждый независимо друг от друга обозначает Н, SO2C1-C6алкил, С1-С6
алкилСООН, С1-С6алкил-С3-С7циклоалкил, где циклоалкил замещен СООН;
(II) CONHNR14R15, где R14 и R15, каждый независимо друг от друга обозначает Н или С1-С6алкил, необязательно замещенный СООН;
(III) NR16COR17, где R16 обозначает Н, или С1-С6алкил, замещенный СООН или фенилСООН; и R17 обозначает С2-С4алкенилСООН, С3-С7циклоалкил-СООН, NHC1-С6алкилСООН; С1-С6алкил, необязательно замещенный СООН; или С1-С6алкил-С3-С7циклоалкил, где циклоалкил замещен СООН; и
(IV) NR18SO2C1-C6алкил, где R18 обозначает Н; или
когда n обозначает 1, то Е обозначает простую связь или соединяющую группу, выбранную из ряда, включающего
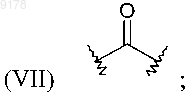
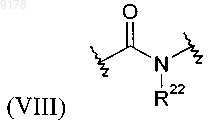
где R22 обозначает Н или С1-С6алкил;
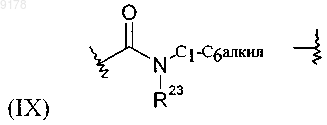
где R23 обозначает Н или С1-С6алкил;
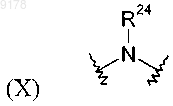
где R24 обозначает Н или С1-С6алкил;
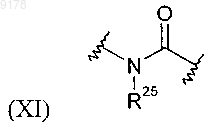
где R25 обозначает Н;
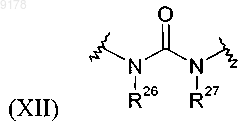
где R26 и R27, каждый обозначает Н;
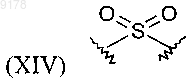
и
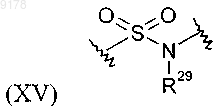
где R29 обозначает Н; и
кольцо D необязательно замещено галогеном, NH2, NO2, COOH, ОН, С1-С6алкокси и С1-С6алкилом, необязательно замещенным СООН или ОН.
3. Соединение формулы I по п.1, в котором
А обозначает -СН2-СН2-;
В обозначает О;
R2 обозначает Н или галоген;
R4 обозначает Н;
R5 обозначает CH3;
R11 обозначает Н, Et или С3-С4циклоалкил;
когда n обозначает 0, то кольцо С обозначает фенил, замещенный С1-С6алкилом, и когда n обозначает 1, то кольцо С обозначает фенил, необязательно замещенный 1 или 2 заместителями, выбранными из ряда, включающего галоген и С1-С6алкил, необязательно замещенный ОН;
кольцо D обозначает фенил, необязательно замещенный 1-3 заместителями, выбранными из ряда, включающего галоген, NH2, NO2, СООН, ОН, С1-С6алкокси, С1-С6алкил, необязательно замещенный СООН или ОН; или
кольцо D обозначает тиофен, фуран, тиазол, оксазол, изоксазол, пиразол, триазол, имидазол, пиридин, пиридин-N-оксид, пиридинон, пиримидин или тетразол, каждый из которых необязательно может быть замещен 1 или 2 заместителями, выбранными из ряда, включающего галоген, NH2, COOH, ОН, С1-С6алкил, необязательно замещенный СООН.
4. Соединение по п.3, в котором
R2 обозначает Н, F или Cl;
R11 обозначает Et или циклопропил;
n обозначает 0 и
кольцо С обозначает фенил, замещенный С1-С6акилом; или
n обозначает 1 и
кольцо С обозначает

или
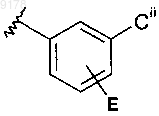
где Ci обозначает С1-С6алкил и Cii обозначает Н, галоген или С1-С6алкил; и
кольцо D выбирают из ряда, включающего
фенил, необязательно замещенный 1-3 заместителями, выбранными из ряда, включающего СООН, ОН, С1-С6алкил-СООН, или С1-С6алкил(ОН)-СООН, C1-С6алкил, галоген, С1-С6алкокси, NH2 и NO2;
тиофен, фуран или тиазол, каждый из которых необязательно замещен 1-2 заместителями, выбранными из ряда, включающего СООН, NH2 и С1-С6алкил, необязательно замещенный СООН;
имидазол, необязательно замещенный 1 или 2 С1-С6алкильными заместителями;
пиразол, необязательно замещенный 1-2 заместителями, выбранными из ряда, включающего СООН, С1-С6алкил, необязательно замещенный СООН;
триазол, замещенный СООН;
изоксазол, необязательно замещенный СООН;
оксазол;
пиридин или пиридин-N-оксид, каждый необязательно замещенный 1-2 заместителями, выбранными из ряда, включающего СООН, С1-С6алкил, галоген, NH2 и ОН;
пиримидин;
пиридинон, необязательно замещенный 1-2 заместителями, выбранными из ряда, включающего С1-С6алкил, необязательно замещенный СООН; или
тетразол.
5. Соединение по п.4, в котором
R2 обозначает Н;
R11 обозначает Et;
Ci обозначает CH3 и Cii обозначает Н, Cl или CH3;
кольцо D выбирают из ряда, включающего
фенил, необязательно замещенный 1 или 2 заместителями, выбранными из ряда, включающего СООН, СН2СООН, СН2СН2СООН, СН3, F, Cl, OCH3, NO2, NH2 и ОН;
тиофен, фуран или тиазол, каждый из которых может быть незамещен или моно- или дизамещен заместителями, выбранными из ряда, включающего СООН, -СН2-СООН или NH2;
имидазол, который может быть незамещен или монозамещен CH3;
пиразол, который может быть незамещен или моно- или дизамещен заместителями, выбранными из ряда, включающего CH3, СООН или -СН2-СООН;
пиридин или пиридин-N-оксид, каждый из которых может быть моно- или дизамещен заместителями, выбранными из ряда, включающегоCH3, Cl, NH2 или ОН; и
пиридинон, монозамещенный на атоме азота -СН2-СООН.
6. Соединение по п.5, в котором кольцо D обозначает

где Di обозначает СООН, СН2СООН, СН2СН2СООН, F или Cl и Dii обозначает СООН, ОН, NH2, F, Cl, СН2СООН, СН2СН2СООН, при условии, что Di и Dii, оба не обозначают СООН.
7. Соединение по п.6, в котором Di обозначает СООН, -СН2СООН, CH3, F или Cl и Dii обозначает ОН, NH2, F, Cl, -СН2СООН или СООН.
8. Соединение по п.5, в котором кольцо D обозначает фенил, монозамещенный СООН, СН2СООН или СН2СН2СООН.
9. Соединение по п.1 или по одному из пп.3-8, в котором n обозначает 0, Е выбирают из ряда, включающего CONHSO2C1-C6алкил, CONHC1-C6алкил-СООН или CONHC1-C6алкил-С3-С7циклоалкил-СООН; CONHNH2, CONHNHCH3 или CONHNHCH2COOH; NR16COR17, где R16 обозначает Н или С1-С6
алкил, замещенный СООН или фенил-СООН; и R17 обозначает С2-С4алкенил-СООН, С3-С7циклоалкил-СООН, NHC1-C6алкил-СООН; С1-С6алкил-С3-С7ациклоалкил-СООН; или С1-С6алкил, необязательно замещенный СООН; NHSO2CH3; SO2NHCH2COOH.
10. Соединение по п.9, в котором Е находится в пара-положении.
11. Соединение по п.1 или по одному из пп.3-10, в котором n обозначает 1 и Е обозначает простую связь или соединяющую группу, выбранную из ряда, включающего -С(О)-; -C(O)-N(R22)-, где R22 обозначает Н или CH3; -C(O)-N(R23)-C1-С6алкил-, где R23 обозначает Н или CH3; -N(R24)-, где R24 обозначает Н или CH3; -NH-С(О)-; -NH-C(O)-NH-; -SO2-; -SO2-NH- и -C(O)-NH-SO2-.
12. Соединение по п.11, в котором Е обозначает соединяющую группу, выбранную из ряда, включающего -C(O)-N(R22)-, где R22 обозначает Н или СН3; -N(R24)-, где R24 обозначает Н или СН3; и NH-C(O)-.
13. Соединение по п.12, в котором Е находится в пара-положении.
14. Способ лечения или предупреждения ВИЧ-инфекции, заключающийся в том, что пациенту вводят ингибирующее ВИЧ количество соединения формулы I по одному или нескольким из пп.1-13 или его фармацевтически приемлемой соли.
15. Способ лечения или предупреждения ВИЧ-инфекции, заключающийся в том, что вводят соединение формулы I по одному или нескольким из пп.1-13 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель в сочетании с антиретровирусным лекарственным средством.
16. Способ предупреждения переноса ВИЧ-1 от матери к ребенку, заключающийся в том, что вводят матери до родов соединение формулы I по одному или нескольким из пп.1-13 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
17. Применение соединения формулы I по одному или нескольким из пп.1-13 или его фармацевтически приемлемой соли для приготовления лекарственного средства, предназначенного для лечения или предупреждения ВИЧ-инфекции.
Текст
009178 Область техники, к которой относится изобретение Изобретение относится к новым соединениям и их фармацевтически приемлемым солям, их применению индивидуально или в сочетании с другими терапевтическими агентами для лечения или профилактики ВИЧ-инфекции и к фармацевтическим композициям, содержащим такие соединения. Предпосылки создания изобретения Заболевание, известное как синдром приобретенного иммунодефицита (СПИД), вызывается вирусом иммунодефицита человека (ВИЧ), прежде всего штаммом, известным как ВИЧ-1. Для репликации ВИЧ в клетке-хозяине информация, содержащаяся в вирусном геноме, должна быть интегрирована в ДНК клетки-хозяина. Однако ВИЧ представляет собой ретровирус, т.е. вирус, у которого генетическая информация считывается с РНК. Таким образом, цикл репликации ВИЧ включает стадию транскрипции вирусного генома (РНК) с образованием ДНК, этот процесс является обратным по отношению к нормальному процессу транскрипции. Транскрипция вирусной РНК с образованием ДНК происходит с помощью фермента, называемого обратной транскриптазой (ОТ). Вирион ВИЧ содержит копию ОТ вместе с вирусной РНК. Известно, что обратная транскриптаза обладает тремя ферментативными функциями: она действует в качестве РНК-зависимой ДНК-полимеразы, в качестве рибонуклеазы и ДНК-зависимой ДНК-полимеразы. В качестве РНК-зависимой ДНК-полимеразы ОТ осуществляет транскрипцию копии одноцепочечной ДНК вирусной РНК. В качестве рибонуклеазы ОТ расщепляет исходную вирусную РНК и высвобождает ДНК, полученную непосредственно на матрице исходной РНК. Наконец, в качестве ДНК-зависимой ДНК-полимеразы ОТ создает вторую комплементарную цепь ДНК, используя первую цепь ДНК в качестве матрицы. Две цепи образуют двухцепочечную ДНК, которая интегрируется в геном клетки-хозяина с помощью другого фермента, называемого интегразой. Соединения, которые обладают способностью ингибировать ферментативные функции обратной транскриптазы ВИЧ-1, могут ингибировать репликацию ВИЧ-1 в инфицированных клетках. Такие соединения можно применять для предупреждения или лечения вызванной ВИЧ-1 инфекции у больных людей, как это установлено при использовании известных ингибиторов ОТ, таких как 3'-азидо-3'дезокситимидин (AZT), 2',3'-дидезоксиинозин (ddI), 2',3'-дидезоксицитидин (ddC), d4T, 3TC, невирапин,делавирдин, эфавиренц и абакавир, которые в настоящее время являются основными лекарственными средствами, разрешенными для применения при лечении СПИД. Как и при любой антивирусной терапии, применение ингибиторов ОТ для лечения СПИД, в конечном итоге, приводит к снижению чувствительности вируса к конкретному лекарственному средству. Устойчивость (пониженная чувствительность) к таким лекарственным средствам является результатом мутаций, затрагивающих сегмент обратной транскриптазы гена pol. К настоящему времени определены характеристики нескольких мутантных штаммов ВИЧ и установлено, что устойчивость к известным терапевтическим агентам обусловлена мутациями в гене ОТ. Одними из наиболее часто встречающихся в клинических условиях мутантами являются мутант Y181C, в котором остаток тирозина (Y) в кодоне 181 заменен на остаток цистеина (С), и K103N, в котором остаток лизина (K) в положении 103 заменен на остаток аспарагина (N). Другие мутанты, которые возникают с увеличивающейся частотой при лечении с использованием известных антивирусных лекарственных средств, представляют собой мутанты с одной мутацией V106A, G190A, Y188C и P236L; и мутанты с двумя мутациями K103N/Y181C, K103N/P225H,K103N/V108I и K103N/L100I. Продолжающееся применение антивирусных соединений для лечения и предупреждения ВИЧ-инфекции, несомненно, будет приводить к увеличению случаев возникновения новых устойчивых штаммов ВИЧ. Таким образом, существует насущная потребность в создании новых ингибиторов ОТ, которые обладают различными параметрами эффективности в отношении различных мутантов. Соединения, имеющие трициклические структуры, которые являются ингибиторами ВИЧ-1, описаны в U.S. No. 5366972. Другие ингибиторы обратной транскриптазы ВИЧ-1 описаны у Hargrave и др., J.Med. Chem., 34, (1991), с. 2231. В U.S. No. 5705499 описаны 8-арилалкил- и 8-арилгетероалкил-5,11-дигидро-6 Н-дипиридо[3,2 В:2',3'-Е][1,4]диазепины в качестве ингибиторов ОТ. В WO 01/96338 и US 6420359 описаны диазепиновые структуры, содержащие хинолиновые и хинолин-N-оксидные заместители, в качестве ингибиторов ОТ. Приведенные в качестве примеров соединения обладают активностью в отношении штаммов ВИЧ дикого типа (WT), мутантных штаммов с одной и двумя мутациями. В WO 02/076982 и WO 03/011862 описаны также диазепиновые структуры, содержащие заместители, которые структурно отличаются от предлагаемых в настоящем изобретении. Краткое изложение сущности изобретения В изобретении предложены новые соединения, которые являются эффективными ингибиторами ОТ ВИЧ-1 дикого типа (WT) и мутантных штаммов с двумя мутациями. Предпочтительно соединения, предлагаемые в настоящем изобретении, являются эффективными ингибиторами важного с клинической точки зрения мутантного штамма с двумя мутациями K103N/Y181C. Первым объектом изобретения является соединение, представленное формулой IR11 обозначает Н, С 1-С 4 алкил, С 3-С 4 циклоалкил и С 1-С 4 алкил-С 3-С 4 циклоалкил; А обозначает соединяющую цепь С 1-С 3 алкила; В обозначает О или S;n обозначает 0 или 1; причем когда n обозначает 0, то кольцо С обозначает 6- или 10-членный арил или 5- или 6-членный гетероцикл, который содержит 1-4 гетероатома, выбранных из О, N и S, где арил и гетероцикл необязательно могут быть замещены 1-4 заместителями, выбранными из ряда, включающего галоген и C1-С 6 алкил, необязательно замещенный ОН; и Е выбирают из ряда, включающего(I) CONR12R13, где R12 и R13, каждый независимо друг от друга обозначает Н, SO2C1-C6 алкил, С 1 С 6 алкил-СООН, С 1-С 6 алкил-С 3-С 7 циклоалкил, где циклоалкил необязательно может быть замещен СООН;(II) CONHNR14R15, где R14 и R15, каждый независимо друг от друга обозначает Н или C1-С 6 алкил,необязательно замещенный СООН;(III) NR16COR17, где R16 обозначает Н или С 1-С 6 алкил, необязательно замещенный СООН или С 6 С 10 арил-СООН; и R17 обозначает С 2-С 4 алкенил-СООН, С 3-С 7 циклоалкил-СООН, NHC1-С 6 лкил-СООН; С 1-С 6 алкил, необязательно замещенный СООН; или С 1-С 6 алкил-С 3-С 7 ациклоалкил, где циклоалкил необязательно может быть замещен СООН;(VI) SO2R21, где R21 обозначает С 1-С 6 алкил; или когда n обозначает 1, то кольцо С имеет указанное выше значение; и Е обозначает простую связь или соединяющую группу, выбранную из ряда, включающего и кольцо D обозначает 6- или 10-членный арил или 5- или 6-членный гетероцикл, который содержит 1-4 гетероатома, выбранных из О, N и S, где арил и гетероцикл необязательно могут быть замещены 1-5 заместителями, выбранными из ряда, включающего галоген, NH2, NO2, COOH, ОН, COOC1-С 6 алкил, С 1 С 6 алкокси, С 2-С 4 алкенил-СООН, С 3-С 7 циклоалкил-СООН и С 1-С 6 алкил, необязательно замещенный СООН или ОН; или его соль или пролекарство. Вторым объектом изобретения является фармацевтическая композиция, предназначенная для лечения или предупреждения ВИЧ-инфекции, которая содержит представленное в настоящем описании соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Третьим объектом изобретения является способ лечения или предупреждения ВИЧ-инфекции, заключающийся в том, что пациенту вводят ингибирующее ВИЧ количество соединения формулы I, его фармацевтически приемлемой соли или фармацевтической композиции, представленных в настоящем описании. Четвертым объектом изобретения является способ лечения или предупреждения ВИЧ-инфекции,заключающийся в том, что вводят соединение формулы I, представленное в настоящем описании, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель в сочетании с антиретровирусным лекарственным средством. Пятым объектом изобретения является способ предупреждения перинатальной передачи ВИЧ-1 от матери к ребенку, заключающийся в том, что матери перед родами вводят представленное в настоящем описании соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Шестым объектом изобретения является применение указанного в настоящем описании соединения формулы I для приготовления лекарственного средства, предназначенного для лечения или предупреждения ВИЧ-инфекции. Подробное описание изобретения Определения Если не указано иное, то в описании используются следующие определения. В контексте настоящего описания понятия "С 1-С 4 алкил" и "С 1-С 6 алкил" индивидуально или в соче-3 009178 тании с другим радикалом обозначают ациклические с прямой или разветвленной цепью алкильные радикалы, содержащие от 1 до 4 или от 1 до 6 атомов углерода, соответственно. Примерами таких радикалов являются метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, гексил, 1-метилэтил, 1 метилпропил, 2-метилпропил, 1,1-диметилэтил. В контексте настоящего описания понятия "С 3-С 4 циклоалкил" и "С 3-С 7 циклоалкил" индивидуально или в сочетании с другим радикалом обозначают насыщенные циклические углеводородные радикалы,содержащие от 3 до 4 или от 3 до 7 атомов углерода, соответственно. Примерами таких радикалов являются циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. В контексте настоящего описания понятия "С 1-С 6 алкокси" или "OC1-С 6 алкил" используются взаимозаменяемо и обозначают ациклические алкильные радикалы, содержащие от 1 до 6 атомов углерода,ковалентно связанные с атомом кислорода. В контексте настоящего описания понятие "6- или 10-членный арил" индивидуально или в сочетании с другим радикалом обозначает ароматический радикал, содержащий 6 или 10 атомов углерода, например фенил или нафтил. В контексте настоящего описания понятие "гетероцикл" или "Het" индивидуально или в сочетании с другим радикалом обозначает одновалентный радикал, полученный путем удаления атома водорода из 5-, 6- или 7-членного насыщенного или ненасыщенного (включая ароматический) гетероцикла, который содержит 1-4 гетероатома, выбранных из азота, кислорода и серы. Кроме того, "Het" в контексте настоящего описания обозначает указанный выше гетероцикл, сконденсированный с одним или несколькими другими циклами, которые представляют собой гетероцикл или любой другой цикл. Гетероциклы могут нести заместители. Примеры заместителей включают (но не ограничиваясь ими) галогены, амины, гидразины и N-оксидогруппы. Примерами пригодных гетероциклов являются пирролидин, тетрагидрофуран, тиазолидин, пиррол, тиофен, диазепин, 1 Н-имидазол, изоксазол, тиазол, тетразол, пиперидин, 1,4-диоксан, 4-морфолин, пиридин, пиримидин, тиазоло[4,5-b]пиридин, хинолин или индол или следующие гетероциклы: В контексте настоящего описания понятие "гало" обозначает атом галогена и включает фтор, хлор,бром и йод. В контексте настоящего описания понятие "галоалкил" обозначает указанный выше алкил, в котором каждый атом водорода можно последовательно замещать атомом галогена, например CH2Br или CF3. В контексте настоящего описания понятие "фармацевтически приемлемая соль" обозначает соли,которые получены из фармацевтически приемлемых оснований и являются нетоксичными. Примерами пригодных оснований могут служить холин, этаноламин и этилендиамин. Подразумевается, что под объем изобретения подпадают также Na+-, K+- и Са-соли (см. также Birge S.M. и др., Pharmaceutical salts, J.Pharm. Sci., 66 (1977), cc. 1-19, публикация включена в настоящее описание в качестве ссылки). В контексте настоящего описания понятие "пролекарство" обозначает фармакологически приемлемые производные, из которых в результате биотрансформации образуется активное лекарственное средство, относящееся к соединениям формулы I. Примерами таких производных являются (но не ограничиваясь ими) сложные эфиры и амиды (см. Goodman и Gilman, The Pharmacological Basis of Therapeutics, 9-е изд., изд-во McGraw-Hill, Int. Ed., "Biotransformation of Drugs", 1995, cc. 11-16, публикация включена в настоящее описание в качестве ссылки). Предпочтительные варианты осуществления изобретения Предпочтительно соединения, предлагаемые в настоящем изобретении, имеют следующую формулу: Предпочтительно R2 выбирают из Н, С 1-С 4 алкила, галогена, галоалкила, ОН или С 1-С 6 алкокси. Более предпочтительно R2 обозначает Н, Me, OMe или галоген. Наиболее предпочтительно R2 обозначает Н, F или Cl. Еще более предпочтительно R2 обозначает Н. Предпочтительно R4 обозначает Н. Предпочтительно R5 обозначает Me. Предпочтительно R11 обозначает Н, Et или С 3-С 4 циклоалкил. Более предпочтительно R11 обозначает-4 009178 заместителями, выбранными из ряда, включающего галоген и С 1-С 4 алкил, необязательно замещенный ОН. Предпочтительно также кольцо С представляет собой фенил, необязательно замещенный 1-2 заместителями, выбранными из ряда, включающего галоген и С 1-С 6 алкил. Более предпочтительно кольцо С представляет собой фенил, необязательно замещенный С 1-С 6 алкилом. Кроме того, когда n=0, предпочтительно Е выбирают из ряда, включающего(III) NR16COR17, где R16 обозначает Н или С 1-С 6 алкил, необязательно замещенный СООН или (С 6 С 10)арил-СООН; и R17 обозначает (С 2-С 4)алкенил-СООН, (С 3-С 7)циклоалкил-СООН, NH(C1-C6)алкилСООН; (С 1-С 6)алкил-(С 3-С 7)циклоалкил-СООН; или (С 1-С 6)алкил, необязательно замещенный СООН;(III) NR16COR17, где R16 обозначает Н или С 1-С 6 алкил, необязательно замещенный СООН или (С 6 С 10)арил-СООН; и R17 обозначает (С 2-С 4)алкенил-СООН, (С 3-С 7)циклоалкил-СООН, NH(C1-C6)алкилCOOH; (С 1-С 6)алкил-(С 3-С 7)циклоалкил-СООН; или (С 1-С 6)алкил, необязательно замещенный СООН;(IV) NHSO2Me. Кроме того, когда n=0, предпочтительно Е находится в пара-положении. В альтернативном варианте, когда n=1, предпочтительно кольцо С представляет собой фенил, необязательно замещенный 1 или 2 заместителями, выбранными из ряда, включающего галоген и (С 1 С 6)алкил, необязательно замещенный ОН. В альтернативном варианте, когда n=1, предпочтительно кольцо С представляет собой фенил, необязательно замещенный 1 или 2 заместителями, выбранными из ряда, включающего галоген и (С 1 С 6)алкил. Более предпочтительно кольцо С представляет собой где Ci обозначает С 1-С 6 алкил и Cii обозначает Н, галоген или С 1-С 6 алкил. Предпочтительно Ci обозначает СН 3. Предпочтительно Cii обозначает Н, Cl или CH3. Наиболее предпочтительно Cii обозначает Н. Когда n=1, Е обозначает простую связь или соединяющую группу, выбранную из где R29 обозначает Н или С 1-С 6 алкил. В альтернативном варианте Е предпочтительно обозначает простую связь или соединяющую группу, выбранную из Наиболее предпочтительно Е представляет собой соединяющую группу, выбранную из Когда n=1, предпочтительно Е находится в пара-положении. Предпочтительно кольцо D представляет собой фенил или 5- или 6-членный гетероцикл, несущий 1-4 гетероатома, выбранных из ряда, включающего О, N и S, где фенил и гетероцикл необязательно могут быть замещены 1-4 заместителями, выбранными из ряда, включающего галоген, NH2, NO2, СООН,ОН, COOC1-C6 алкил, С 1-С 6 алкокси, С 2-С 4 алкенил-СООН; С 3-С 7 циклоалкил-СООН; или С 1-С 6 алкил, необязательно замещенный СООН или ОН. В альтернативном варианте кольцо D предпочтительно представляет собой фенил или 5- или 6 членный гетероцикл, несущий 1-4 гетероатома, выбранных из ряда, включающего О, N и S, где фенил и гетероцикл необязательно могут быть замещены 1-4 заместителями, выбранными из ряда, включающего галоген, NH2, NO2, СООН, ОН, С 1-С 6 алкокси, С 2-С 4 алкенил-СООН; С 3-С 7 циклоалкил-СООН; или С 1 С 6 алкил, необязательно замещенный СООН или ОН. Более предпочтительно кольцо D представляет собой фенил, необязательно замещенный 1-3 заместителями, выбранными из ряда, включающего СООН, ОН, С 1-С 6 алкил-СООН или С 1-С 6 алкил-ОНСООН, С 1-С 6 алкил, галоген, С 1-С 6 алкокси, NH2 или NO2. Еще более предпочтительно кольцо D представляет собой фенил, необязательно замещенный 1 или 2 заместителями, выбранными из ряда, включающего СООН, СН 2 СООН, СН 2 СН 2 СООН, CH3, F, Cl,OMe, NO2, NH2 или ОН. Наиболее предпочтительно кольцо D представляет собой-7 009178 не обозначают СООН. Предпочтительно Di обозначает СООН, -СН 2 СООН, Me, F или Cl. Предпочтительно Dii обозначает ОН, NH2, F, Cl, -СН 2 СООН или СООН. Еще более предпочтительно кольцо D представляет собой фенил, монозамещенный СООН,СН 2 СООН или СН 2 СН 2 СООН в пара- или мета-положении. В альтернативном предпочтительном варианте кольцо D представляет собой тиофен, фуран, тиазол,оксазол, изоксазол, пиразол, триазол, имидазол, пиридин, пиридин-N-оксид, пиридинон, пиримидин или тетразол, каждый из которых необязательно может быть замещен 1-2 заместителями, выбранными из ряда, включающего галоген, NH2, СООН, ОН, С 1-С 6 алкокси, С 1-С 6 алкил, необязательно замещенный СООН или ОН. В альтернативном предпочтительном варианте кольцо D представляет собой тиофен, фуран, тиазол,оксазол, изоксазол, пиразол, триазол, имидазол, пиридин, пиридин-N-оксид, пиридинон или пиримидин,каждый из которых необязательно может быть замещен, как указано выше. Еще в одном альтернативном предпочтительном варианте кольцо D представляет собой тиофен,фуран или тиазол, каждый из которых необязательно замещен 1-3 заместителями, выбранными из NH2,СООН и С 1-С 6 алкила, необязательно замещенного СООН. Более предпочтительно тиофен, фуран или тиазол являются незамещенными или моно- или дизамещенными СООН, -СН 2-СООН или NH2. Еще в одном альтернативном предпочтительном варианте кольцо D представляет собой имидазол,необязательно замещенный 1-2 С 1-С 6 алкильными заместителями. Более предпочтительно имидазол является незамещенным или монозамещенным Me. В следующем альтернативном предпочтительном варианте кольцо D представляет собой пиразол,необязательно замещенный 1-2 заместителями, выбранными из ряда, включающего СООН, С 1-С 6 алкил,необязательно замещенный СООН. Более предпочтительно пиразол является незамещенным или моноили дизамещенным Me, СООН или -СН 2-СООН. В альтернативном предпочтительном варианте кольцо D представляет собой триазол, замещенный СООН. В альтернативном предпочтительном варианте кольцо D представляет собой изоксазол, необязательно замещенный СООН. В альтернативном предпочтительном варианте кольцо D представляет собой оксазол. В альтернативном предпочтительном варианте кольцо D представляет собой пиридин или пиридинN-оксид, необязательно замещенный 1-3 заместителями, выбранными из ряда, включающего СООН, С 1 С 6 алкил, галоген, NH2 или ОН. Более предпочтительно пиридин или пиридин-N-оксид являются моноили дизамещенными Me, Cl, NH2 или ОН. Наиболее предпочтительно кольцо D представляет собой пиридин-N-оксид. В альтернативном предпочтительном варианте кольцо D представляет собой пиримидин. В альтернативном предпочтительном варианте кольцо D представляет собой пиридинон, необязательно замещенный 1-2 заместителями, выбранными из ряда, включающего С 1-С 6 алкил, необязательно замещенный СООН. Более предпочтительно пиридинон является монозамещенным на атоме азота группой -СН 2-СООН. В альтернативном предпочтительном варианте кольцо D представляет собой тетразол. Предпочтительными вариантами осуществления настоящего изобретения являются также каждое из конкретных соединений, перечисленных в табл. 1-4. Антивирусная активность Соединения, предлагаемые в настоящем изобретении, являются эффективными ингибиторами обратной транскриптазы ВИЧ-1 дикого типа, а также важного с клинической точки зрения несущего две мутации фермента K103N/Y181C. Соединения могут служить также эффективными ингибиторами, например, несущих одну мутацию ферментов Y181C, V106A и Y188C. При введении в виде пригодных лекарственных средств их можно применять для лечения СПИД,состояния, предшествующего синдрому приобретенного иммунодефицита (ARC) и родственных заболеваний, связанных с ВИЧ-1-инфекцией. Таким образом, следующим объектом изобретения является способ лечения инфекции, вызываемой ВИЧ-1, который заключается в том, что человеку, инфицированному ВИЧ-1, вводят терапевтически эффективное количество описанного выше нового соединения формулы I. Помимо указанного выше применения для лечения и профилактики соединение можно применять также для предупреждения перинатальной передачи ВИЧ-1 от матери к ребенку путем введения соединения матери перед родами. Соединения формулы I можно вводить в виде однократной дозы или в виде разделенных доз оральным или парентеральным путем. Пригодная оральная доза соединения формулы I может составлять примерно от 0,5 мг до 3 г в день. Предпочтительно оральная доза соединения формулы I составляет примерно от 100 до 800 мг в день для пациента весом 70 кг. В случае композиций для парентерального введения пригодная стандартная доза может составлять от 0,1 до 250 мг соединения, предпочтительно от 1 до 200 мг. Однако следует иметь в виду, что вводимая доза может варьироваться от пациента к пациенту и доза для каждого конкретного пациента зависит от решения лечащего врача, который в качестве критерия при назначении соответствующей дозы должен учитывать размер и состояние пациента, а также реакцию-8 009178 пациента на лекарственное средство. Если соединения, предлагаемые в настоящем изобретении, вводят оральным путем, то их можно вводить в качестве лекарственных средств в форме фармацевтических композиций, которые содержат их в сочетании с совместимым фармацевтическим носителем. Такой носитель может представлять собой инертный органический или неорганический носитель, пригодный для орального введения. Примерами таких носителей являются вода, желатин, тальк, крахмал, стеарат магния, аравийская камедь, растительные масла, полиалкиленгликоли, вазелин и т.п. Соединения формулы I можно применять в сочетании с антиретровирусным лекарственным средством, известным специалисту в данной области, в качестве комбинированного лекарственного средства для одновременного, раздельного или последовательного введения для лечения или предупреждения ВИЧ-инфекции у индивидуума. Примеры антиретровирусных лекарственных средств, которые можно применять при комбинированном лечении с использованием соединений формулы I, включают (но не ограничиваясь ими) нуклеозидные/нуклеотидные ингибиторы обратной транскриптазы (такие, как АЗТ и тенофовир), ненуклеозидные ингибиторы обратной транскриптазы (такие, как невирапин), ингибиторы протеазы (такие, как ритановир), ингибиторы вирусного слияния (такие, как Т-20), антагонисты CCR5L-870,810), ингибиторы тирозинаминотрансферазы (ТАТ), другие находящиеся на стадии исследования лекарственные средства (такие, как PRO-542, BMS-806, ТМС-114 или AI-183), противогрибковые или антибактериальные агенты (такие, как флуконазол), и иммуномодуляторы (такие, как левамизол). Кроме того, соединение формулы I можно применять в сочетании с другим соединением формулы I. Фармацевтические композиции можно приготавливать стандартным методом, и конечные лекарственные формы могут представлять собой твердые лекарственные формы, например таблетки, драже,капсулы и т.п., или жидкие лекарственные формы, например растворы, суспензии, эмульсии и т.п. Фармацевтические композиции можно подвергать стандартным фармацевтическим обработкам, таким как стерилизация. Кроме того, фармацевтические композиции могут содержать стандартные вспомогательные вещества, такие как консерванты, стабилизаторы, эмульгаторы, корригенты, смачивающие агенты,буферы, соли для изменения осмотического давления и т.п. Твердый носитель, который можно применять, представляет собой, например, крахмал, лактозу, маннит, метилцеллюлозу, микрокристаллическую целлюлозу, тальк, диоксид кремния, вторичный кислый фосфат кальция и высокомолекулярные полимеры (такие, как полиэтиленгликоль). Для парентерального применения соединение формулы I можно вводить в виде водного или неводного раствора, суспензии или эмульсии в фармацевтически приемлемом масле или смеси жидкостей,которые могут содержать бактериостатические агенты, антиоксиданты, консерванты, буферы или другие растворенные вещества, придающие раствору изотоничность с кровью, загустители, суспендирующие агенты или иные фармацевтически приемлемые добавки. Такие добавки включают, например, тартратный, нитратный и ацетатный буферы, этанол, пропиленгликоль, полиэтиленгликоль, комплексообразующие агенты (такие, как ЭДТК), антиоксиданты (такие, как бисульфит натрия, метабисульфит натрия и аскорбиновая кислота), высокомолекулярные полимеры (такие, как жидкие полиэтиленоксиды) для регулирования вязкости и полиэтиленовые производные ангидридов сорбита. При необходимости можно добавлять также консерванты, такие как бензойная кислота, метил- или пропилпарабен, бензалконийхлорид и другие производные четвертичного аммония. Соединения, предлагаемые в изобретении, можно вводить также в виде растворов для назального введения, и они могут содержать помимо соединений, предлагаемых в настоящем изобретении, пригодные буферы, агенты для регулирования тоничности, противомикробные консерванты, антиоксиданты и повышающие вязкость агенты в водном носителе. Примерами повышающих вязкость агентов являются поливиниловый спирт, производные целлюлозы, поливинилпирролидон, полисорбаты или глицерин. Противомикробные консерванты, которые можно добавлять, включают бензалконийхлорид, тимерозал,хлорбутанол или фенилэтиловый спирт. Кроме того, соединения, предлагаемые в изобретении, можно вводить в виде суппозитория. Методология и синтез В примерах реакционных схем, описанных в WO 01/96338, содержание которой включено в настоящее описание в качестве ссылки, приведены многочисленные методы синтеза трициклического ядра,и они проиллюстрированы ниже. Соединения, предлагаемые в настоящем изобретении, специалист в области химического органического синтеза может получать на основе своих знаний. Примеры реакционных схем проиллюстрированы на схемах 1-8. Заместители R2, R4, R5 и R11 имеют значения, указанные в настоящем описании. На схемах 1-3 проиллюстрированы методы получения арил- и гетероарилфенолов. В целом, метод заключается в том, что защищенный фенол 1(i) можно подвергать реакции сочетания с гетероциклом или арилом, например, с помощью реакции сочетания Сузуки, получая соединение 1(ii), в котором при необходимости можно удалять защитные группы, получая соединение 1(v). В альтернативном варианте фенол 1(iv) можно подвергать реакции сочетания с арильным или гетероциклическим производным 1(iii), получая соединение 1(v). Схема 2 В целом, метод заключается в том, что -бромметилкетон 2(i) конденсируют с соответствующим реагентом, например формамидом или RaCSNH2, получая соответствующие гетероциклические соединения 2(ii), 2(iii) или 2(v). При необходимости в гетероцикл можно вводить защитные группы перед конденсацией со спиртом 4(i), получая соединение 2(iv), как описано ниже. В альтернативном варианте гетероциклический фрагмент можно вводить при образовании гетероцикла in situ. Альдегид 3(i) можно конденсировать с NH2OH, получая соединение 3(ii). Путем дальнейшей конденсации с алкинильным производным получают гетероцикл 3(ii), у которого затем можно удалять защитные группы, получая соединение 3(iv). На схеме 4 представлен общий метод сочетания замещенных фенолов с трициклическим ядром. Схема 4 Как правило, фенол 1(v) можно конденсировать со спиртом 4(i) с помощью, например, реакции типа Мицунобу, получая соединение 4(ii). После этого гетероциклический фрагмент можно подвергать дальнейшей модификации, например, путем окисления или можно удалять защитные группы у гетероцикла с получением соединений формулы I. На схемах 5-8 представлен альтернативный вариант сочетания трициклического ядра с фенолами,несущими заместители, которые являются предшественниками E-D-фрагмента соединений формулы I. Схема 5 В альтернативном варианте содержащее бор соединение 5(i) можно конденсировать со спиртом 4(i),получая соединение 5(ii). После этого гетероциклический или арильный фрагмент можно вводить с помощью реакции сочетания Сузуки, получая соединение 4(ii). В альтернативном варианте соединение 6(ii), где Z обозначает либо альдегид, либо галоген, можно получать с помощью описанной выше реакции конденсации. Затем гетероциклический фрагмент можно вводить путем непосредственного сочетания, получая соединение 6(iii), или путем синтеза in situ, получая соединение 6(iv). Схема 7 В альтернативном варианте соединения 4(i) и 7(i) можно конденсировать с помощью реакции Мицунобу, получая соединение 7(ii). После этого можно применять реакции сочетания, омыление или модификацию функциональных групп для превращения соединения 7(ii) в соединения формулы I. Схема 8- 12009178 В другом примере соединение 8(i) можно превращать в соответствующий амин с помощью катализируемой палладием реакции аминирования с последующим удалением или модификацией функциональных групп, получая соединения формулы I. В альтернативном варианте амин в соединении 8(ii) можно превращать в соединения формулы I с помощью нескольких реакций удаления защитных групп и/или модификации функциональных групп. С помощью описанного ниже анализа с использованием обратной транскриптазы (ОТ) соединения можно тестировать в отношении их способности ингибировать РНК-зависимую ДНК-полимеразную активность ОТ ВИЧ-1. Таким путем было проведено тестирование некоторых конкретных соединений, которые описаны в приведенных ниже примерах и табл. 1-4. Результаты тестирования приведены в табл. 5 в виде значений IC50 (нМ) и ЕС 50 (нМ). Примеры Ниже изобретение более подробно проиллюстрировано на примерах, не ограничивающих его объем. Все реакции проводили в атмосфере азота или аргона, если не указано иное. Температуры даны в градусах Цельсия. Проценты или соотношения для растворов представляют собой об./об.-соотношения, если не указано иное. Сокращения или символы, используемые в описании, имеют следующие значения.BINAP 2,2'-бис(Дифенилфосфино)-1,1'-бинафтил бис-трис-Пропан 1,3-бистрис(Гидроксиметил)метиламинопропан ДЦК Дициклогексилкарбодиимид ДЭАД Диэтилазодикарбоксилат ДЭПК Диэтилпирокарбонат ДИАД Диизопропилазодикарбоксилат ДИЭА Диизопропилэтиламин ДМАП 4-(Диметиламино)пиридин ДМФ Диметилформамид ДМСО ДиметилсульфоксидDppf 1,1'-бис(Дифенилфосфино)ферроцен ДТТ Дитиотреитол ЭДТА ЭтилендиаминтетраацетатGHS Восстановленный глутатион ЖХВР Жидкостная хроматография высокого разрешенияiPr Изопропил МХПБК Метахлорперпербензойная кислотаMeCN Ацетонитрил МеОН Метанол МЭС 2-(н-Морфолино)этансульфоновая кислота ММСО Предельное значение пропускамой через фильтр молекулярной массыPh Фенил ДСН-ПААГ Гель-электрофорез в полиакриламидном геле в присутствии додецилсульфа натрия ТБЭ трис-Борат ЭДТА ТБТУ Тетрафторборат 2-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония ТФК Трифторуксусная кислота ТГФ Тетрагидрофуран УМФ Уридин-5'-монофосфат УТФ Уридин-5'-трифосфат Синтез В следующих примерах проиллюстрированы способы получения соединений, предлагаемых в изобретении. Пример 1 (соединение 1013). 4'-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е](7,70 г, 38,3 ммоля) и KOAc (10,9 г, 114 ммолей) в ДМСО (200 мл) дегазировали с помощью аргона в течение 10 мин. Затем добавляли PdCl2dppf (в виде комплекса с CH2Cl2 (1:1), 2,50 г, 3,06 ммоля) и реакционную смесь нагревали до 80C в течение 24 ч. Реакционную смесь разбавляли водой и экстрагировали С 6 Н 6(3). Объединенные органические слои промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 95:5), получая указанное в заголовке соединение (5,1 г, выход 54%) в виде бесцветного масла. б) Метил-4'-метокси-3'-метил[1,1'-бифенил]-3-карбоксилат. К дегазированной (аргон, 10 мин) смеси, содержащей 2-(4-метокси-3-метилфенил)-4,4,5,5-тетраметил-1,3,2-диоксоборолан (500 мг, 2,01 ммоля), 3-бромбензойную кислоту (446 мг, 2,22 ммоля) и 1 М водный раствор Na2CO3 (6,3 мл) в ДМСО (20 мл), добавляли PdCl2dppf (в виде комплекса с CH2Cl2 (1:1),132 мг, 0,16 ммоля). Реакционную смесь нагревали до 80C в течение 12 ч. Охлажденную смесь подкисляли 1 н. водным раствором HCl и экстрагировали EtOAc. Органический слой промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Образовавшуюся неочищенную кислоту растворяли в Et2O (150 мл) и обрабатывали избытком эфирного раствора CH2N2(примерно 0,6 М). Смесь концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 20:1), получая указанное в заголовке соединение (350 мг, выход 68%). в) Метил-4'-гидрокси-3'-метил[1,1'-бифенил]-3-карбоксилат. 1,0 М раствор BBr3 в CH2Cl2 (3,4 мл, 3,40 ммоля) добавляли к охлажденному на льду раствору метил-4'-метокси-3'-метил-[1,1'-бифенил]-3-карбоксилата (345 мг, 1,35 ммоля) в CH2Cl2 (13 мл). Реакционную смесь перемешивали при 25C в течение 2 ч, затем охлаждали до 0C. Добавляли МеОН (5 мл) и смесь перемешивали при 0C в течение 15 мин, затем экстрагировали CH2Cl2 (2). Объединенные органические слои промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (EtOAc:гексан, от 10 до 15%), получая указанное в заголовке соединение (278 мг, выход 85%) в виде твердого вещества белого цвета. г) Метил-4'-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил) этокси]-3'-метил[1,1'-бифенил 1-3-карбоксилат. Раствор ДЭАД (65 мкл, 0,41 ммоля) в ТГФ (0,15 мл) добавляли в течение 2 ч к охлажденному на льду раствору, содержащему 11-этил-5,11-дигидро-8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'е][1,4]диазепин-6-он (100 мг, 0,34 ммоля, полученный согласно методам, описанным в WO 01/96338, которая включена в настоящее описание в качестве ссылки), метил-4'-гидрокси-3'-метил-[1,1'-бифенил]-4 карбоксилат (100 мг, 0,41 ммоля) и PPh3 (108 мг, 0,41 ммоля), в ТГФ (4,0 мл). Реакционную смесь перемешивали при 25C в течение 16 ч. Добавляли дополнительное количество ДЭАД (30 мкл, 0,19 ммоля) и реакционную смесь перемешивали при 25C в течение 16 ч, затем концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (толуол:EtOAc, 85:15), получая указанное в заголовке соединение (136 мг, выход 78%) в виде твердого вещества белого цвета. д) 4'-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]3'-метил[1,1'-бифенил]-3-карбоновая кислота. 1 н. водный раствор NaOH (0,78 мл, 0,78 ммоля) добавляли к раствору метил-4'-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3'-метил[1,1'-бифенил]-3-карбоксилата (136 мг, 0,26 ммоля) в ТГФ (2 мл) и МеОН (1,0 мл). Смесь перемешивали при 25C в течение 1 ч. Образовавшийся раствор подкисляли 1 н. водным раствором HCl и смесь экстрагировали EtOAc (3). Объединенные органические слои промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении, получая указанное в заголовке соединение 1013 (108 мг, выход 77%) в виде твердого вещества белого цвета. Пример 2 (соединение 1034). 4-Амино-4'-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-илэтокси]-3'-метил[1,1'-бифенил]-3-карбоновая кислота. а) 2-(4-Гидрокси-3-метилфенил)-4,4,5,5-тетраметил-1,3,2-диоксоборолан. Смесь, содержащую бис(пинаколато)диборан (19,6 г, 77,0 ммолей), 4-бром-2-метилфенол (12,00 г,64,2 ммоля) и KOAc (18,9 г, 192 ммоля) в ДМСО (300 мл), дегазировали аргоном в течение 1 ч. Затем добавляли PdCl2dppf (в виде комплекса с CH2Cl2, 1:1, 7,04 г, 9,6 ммоля) и реакционную смесь нагревали до 80C в течение 10 ч. Реакционную смесь разбавляли EtOAc (1 л) и образовавшийся раствор промывали водой (3500 мл) и соляным раствором (500 мл), сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 4:1),получая указанное в заголовке соединение (6,76 г, выход 45%) в виде масла желтого цвета. б) 2-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилфенил-4,4,5,5-тетраметил-1,3,2-диоксоборолан. ДИАД (1,93 мл, 9,80 ммоля) добавляли по каплям к раствору, содержащему 11-этил-5,11-дигидро-8(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (2,44 г, 8,19 ммоля), 2-(4-гидрокси-3-метилфенил)-4,4,5,5-тетраметил-1,3,2-диоксоборолан (2,30 г, 9,83 ммоля) и PPh3 (2,58 г, 9,82 ммоля) в ТГФ (33 мл), при 25C. Реакционную смесь перемешивали при 25C в течение 72 ч. Смесь концентри- 14009178 ровали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc,3:2), получая указанное в заголовке соединение (3,11 г, выход 74%) в виде пены белого цвета. в) 4-Амино-4'-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8 ил)этокси]-3'-метил[1,1'-бифенил]-3-карбоновая кислота. Смесь, содержащую 2-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилфенил-4,4,5,5-тетраметил-1,3,2-диоксоборолан (160 мг, 0,31 ммоля), метил 5-бром-2-аминобензоат (143 мг, 0,62 ммоля) и K3PO4 (247 мг, 1,17 ммоля) в 1,4-диоксане (10 мл), дегазировали с помощью N2 в течение 30 мин. Затем добавляли PdCl2(dppf) (в виде комплекса с CH2Cl2 (1:1),28,5 мг, 34,8 мкмоля) и dppf (21,6 мг, 38,9 мкмоля) и реакционную смесь нагревали в атмосфере N2 до 80C в течение 16 ч. Охлажденную смесь концентрировали при пониженном давлении и остаток растворяли в EtOAc (50 мл). Органический слой промывали водой (10 мл) и соляным раствором (10 мл), сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (EtOAc:гексан, 1:1). Образовавшийся сложный метиловый эфир растворяли в МеОН (2 мл) и ТГФ (2 мл) и добавляли 1 н. водный раствор NaOH (2,0 мл, 2,0 ммоля). Смесь перемешивали при 25C в течение 18 ч, затем концентрировали при пониженном давлении. Оставшийся водный раствор разбавляли 1 н. водным раствором NaOH (50 мл) и образовавшийся раствор промывали Et2O (15 мл). Водный слой подкисляли с помощью 1 н. водного раствора HCl и экстрагировали EtOAc (330 мл). Объединенные органические слои промывали водой (15 мл) и соляным раствором (15 мл), сушили (MgSO4),фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью ЖХВР с обращенной фазой (колонка типа CombiPrep ODS-AQ 5020 мм, 5 мкм, 120 А, MeCN/вода + 0,10% ТФК),получая указанное в заголовке соединение 1034 (60 мг) в виде твердого вещества желтого цвета. Кислоту обрабатывали 0,1 н. водным раствором NaOH (1,14 мл, 1 экв.) в воде/MeCN (3:1, 5 мл) и образовавшийся раствор замораживали и лиофилизировали, получая натриевую соль указанного в заголовке соединения 1034 (56 мг, выход 33%) в виде твердого вещества белого цвета. Пример 3 (соединение 1041). 3-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'е][1,4]диазепин-8-ил)этокси]-3-метилфенил-5-изоксазолкарбоновая кислота. а) 4-(Метоксиметокси)-3-метилбензальдегид. К раствору 4-гидрокси-3-метилбензальдегида (900 мг, 6,61 ммоля) в CH2Cl2 (19 мл) добавляли Et3N(5,90 мл, 42,3 ммоля) и простой метилхлорметиловый эфир (2,00 мл, 26,3 ммоля). Реакционную смесь перемешивали при 25C в течение 16 ч. Реакционную смесь разбавляли EtOAc и промывали последовательно 1 н. водным раствором HCl, насыщенным водным раствором NaHCO3, водой и соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 4:1), получая указанное в заголовке соединение (630 мг,выход 53%) в виде прозрачного масла. б) Оксим 4-(метоксиметокси)-3-метилбензальдегида.Et3N (1,68 мл, 12,0 ммолей) и гидрохлорид гидроксиламина (320 мг, 4,64 ммоля) добавляли к раствору 4-(метоксиметокси)-3-метилбензальдегида (620 мг, 3,44 ммоля) в 1,4-диоксане (12 мл). Реакционную смесь облучали ультразвуком в течение 10 мин и перемешивали при 25C в течение 3 дней. Реакционную смесь разбавляли EtOAc и промывали последовательно водой и соляным раствором, сушили(MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 3:1), получая указанное в заголовке соединение (580 мг, выход 86%) в виде прозрачной смолы. в) Этил-3-[4-(метоксиметокси)-3-метилфенил]-5-изоксазолкарбоксилат. Этилпропиолат (0,60 мл, 5,88 ммоля) и 6% (мас./об.) раствор NaOCl в воде (10,8 мл) добавляли к раствору оксима 4-(метоксиметокси)-3-метилбензальдегида (570 мг, 2,92 ммоля) в ТГФ (12 мл). Реакционную смесь перемешивали при 25C в течение 2 ч, затем разбавляли EtOAc. Образовавшийся раствор промывали последовательно 10%-ным водным раствором Na2S2O3, водой и соляным раствором, сушили(MgSO4), фильтровали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (745 мг, выход 88%) в виде твердого вещества желтого цвета. г) Этил-3-(4-гидрокси-3-метилфенил)-5-изоксазолкарбоксилат. Раствор этил-3-[4-(метоксиметокси)-3-метилфенил]-5-изоксазолкарбоксилата (725 мг, 2,49 ммоля) и 4 н. водный раствор HCl (6 мл) в ТГФ (10 мл) перемешивали при 25C в течение 16 ч. Реакционную смесь разбавляли EtOAc и последовательно промывали водой и соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (434 мг,выход 70%) в виде твердого вещества желтого цвета. д) Этил-3-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил) этокси]-3-метилфенил-5-изоксазолкарбоксилат. ДЭАД (55 мкл, 0,35 ммоля) добавляли в течение 30 мин к раствору, содержащему 11-этил-5,11 дигидро-8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (70,0 мг, 0,23 ммоля),этил-3-(4-гидрокси-3-метилфенил)-5-изоксазолкарбоксилат (86,5 мг, 0,35 ммоля) и PPh3 (91,8 мг, 0,35 ммоля) в ТГФ (2 мл) при 25C. Реакционную смесь перемешивали при 25C в течение 18 ч. Смесь концентриро- 15009178 вали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (CH2Cl2:EtOAc,10:1), получая указанное в заголовке соединение (55 мг, выход 45%). е) 3-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилфенил-5-изоксазолкарбоновая кислота. Раствор, содержащий этил-3-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилфенил-5-изоксазолкарбоксилат (50,0 мг, 0,090 ммоля), и 1 н. водный раствор NaOH (0,90 мл, 0,90 ммоля) в ТГФ (2 мл) и МеОН (0,5 мл) перемешивали при 25C в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении, подкисляли 4 н. водным раствором HCl и экстрагировали EtOAc (1) и CH2Cl2 (1). Объединенные органические слои промывали водой и соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Образовавшийся твердый продукт растирали со смесью EtOAc/гексан, получая указанное в заголовке соединение(40 мг, выход 85%) в виде твердого вещества светло-желтого цвета. 1 н. раствор NaOH (78 мкл, 0,078 ммоля) добавляли к раствору указанного в заголовке соединения (39,0 мг, 0,078 ммоля) в ТГФ (3 мл). Через 45 мин смесь концентрировали. Остаток растворяли в воде и MeCN, затем раствор замораживали и лиофилизировали, получая соответствующую натриевую соль указанного в заголовке соединения 1041 (40,5 мг,выход 100%) в виде твердого вещества белого цвета. Пример 4 (соединение 1046). 5-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е]Pd(PPh3)4 (69,3 мг, 0,06 ммоля) добавляли к дегазированному (путем пропускания N2 в течение 15 мин) раствору, содержащему 4-бром-2-метилфенол (225 мг, 1,20 ммоля), 2-формилфуран-5-бороновую кислоту (177 мг, 1,26 ммоля) и водный 0,4 М Na2CO3 (6 мл) в MeCN (12 мл). Смесь нагревали до температуры дефлегмации в течение 12 ч. Горячую смесь фильтровали и осадок на фильтре промывали MeCN (6 мл). Фильтрат концентрировали до половины объема и разбавляли EtOAc. Образовавшийся раствор промывали водой и соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 7:3), получая указанное в заголовке соединение (115 мг, выход 47%) в виде твердого вещества желтого цвета. б) 11-Этил-5,11-дигидро-8-2-[4-(5-формил-2-фуранил)-2-метилфенокси]этил-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. ДИАД (107 мкл, 0,54 ммоля) добавляли по каплям к раствору, содержащему 11-этил-5,11-дигидро 8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (135 мг, 0,45 ммоля), 5-(4-гидрокси-3-метилфенил)-2-фуранкарбоксальдегид (110 мг, 0,54 ммоля) и PPh3 (143 мг, 0,54 ммоля) в ТГФ (4 мл),при 25C. Реакционную смесь перемешивали при 25C в течение 18 ч. Смесь концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 3:2), получая указанное в заголовке соединение (147 мг, выход 67%) в виде пены светло-желтого цвета. в) 5-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилфенил-2-фуранкарбоновая кислота. Раствор NaClO2 (13,7 мг, 0,15 ммоля) в воде (0,5 мл) добавляли в течение 10 мин к охлажденному на льду раствору, содержащему 11-этил-5,11-дигидро-8-2-[4-(5-формил-2-фуранил)-2-метилфенокси]этил-5 метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (57,0 мг, 0,12 ммоля), сульфаминовую кислоту (16,7 мг,0,17 ммоля) и водный раствор NaH2PO4 (63,2 мг, 0,46 ммоля в 0,5 мл воды) в 1,4-диоксане (2 мл). Смесь перемешивали при 0C в течение 15 мин, затем добавляли Na2SO3 (17,3 мг, 0,14 ммоля). Через 15 мин реакционную смесь подкисляли (до рН 4) 1 н. водным раствором HCl и экстрагировали CH2Cl2 (50 мл). Органический слой промывали водой (15 мл) и соляным раствором (15 мл), сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью ЖХВР с обращенной фазой (колонка типа CombiPrep ODS-AQ 5020 мм, 5 мкм, 120 А, MeCN/вода + 0,10% ТФК), получая указанное в заголовке соединение 1046 (34 мг). Кислоту обрабатывали 1 н. водным раствором NaOH (67 мкл, 1 экв.) в воде(15 мл) и MeCN (10 мл) и образовавшийся раствор замораживали и лиофилизировали, получая натриевую соль указанного в заголовке соединения 1046 (33 мг, выход 53%) в виде твердого вещества белого цвета. Пример 5 (соединение 1047). 5-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'е][1,4]диазепин-8-ил)этокси]фенил-2-метил-3-фуранкарбоновая кислота. а) Этил 5-(4-аминофенил)-2-метил-3-фуранкарбоксилат. Смесь, содержащую этил-2-метил-5-(4-нитрофенил)-3-фуранкарбоксилат (500 мг, 1,82 ммоля), порошкообразное железо (325 меш, 811 мг, 14,5 ммоля) и 1 н. водный раствор HCl (0,36 мл, 0,36 ммоля) вEtOH (5 мл), нагревали до температуры дефлегмации в течение 2 ч. Реакционную смесь фильтровали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (396 мг, выход 89%) в виде масла коричневого цвета. б) Этил-5-(4-гидроксифенил)-2-метил-3-фуранкарбоксилат. Раствор NaNO2 (111 мг, 1,61 ммоля) в воде (1 мл) добавляли в течение 5 мин к охлажденной на льду суспензии этил-5-(4-аминофенил)-2-метил-3-фуранкарбоксилата (395 мг, 1,61 ммоля) в 1 М водном растворе H2SO4 (12 мл). Реакционную смесь перемешивали при 0C в течение 20 мин, затем нагревали до- 16009178 90C в течение 1 ч. Охлажденную смесь экстрагировали EtOAc. Органический слой промывали водой (2) и соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении,получая указанное в заголовке соединение (78 мг, выход 20%) в виде твердого вещества белого цвета. в) Этил-5-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил) этокси]фенил-2-метил-3-фуранкарбоксилат. ДИАД (60 мкл, 0,31 ммоля) добавляли по каплям к раствору, содержащему 11-этил-5,11-дигидро-8(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (75,8 мг, 0,25 ммоля), этил-5-(4 гидроксифенил)-2-метил-3-фуранкарбоксилат (75 мг, 0,30 ммоля) и PPh3 (80,0 мг, 0,30 ммоля) в ТГФ (3 мл),при 25C. Реакционную смесь перемешивали при 25C в течение 48 ч. Смесь концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 3:2), получая указанное в заголовке соединение (64 мг, выход 48%) в виде масла желтого цвета. г) 5-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]фенил-2-метил-3-фуранкарбоновая кислота. Смесь, содержащую этил-5-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]фенил-2-метил-3-фуранкарбоксилат (64,0 мг, 0,12 ммоля) и 1 н. водный раствор NaOH (2,00 мл, 2,00 ммоля) в МеОН (2 мл) и ТГФ (2 мл), перемешивали при 25C в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли водой и образовавшийся раствор промывали Et2O (3). Водный слой подкисляли с помощью 1 н. водного раствора HCl(рН 3) и экстрагировали EtOAc. Органический слой промывали водой, соляным раствором, сушили(MgSO4), фильтровали и концентрировали при пониженном давлении. Указанное в заголовке соединение(53 мг, 0,11 ммоля) суспендировали в воде (5 мл) и обрабатывали 0,1 н. водным раствором NaOH (1,06 мл,0,11 ммоля). Смесь разбавляли MeCN (2 мл) и образовавшийся раствор замораживали и лиофилизировали, получая соответствующую натриевую соль указанного в заголовке соединения 1047 (50 мг, выход 79%) в виде твердого вещества светло-желтого цвета. Пример 6 (соединение 1076). 11-Этил-5,11-дигидро-5-метил-8-2-[2-метил-4-(4-метил-3-пиридинил)фенокси]этил-6H-дипиридо[3,2-b:2',3'-e][1,4]диазепин-6-он. Смесь, содержащую 2-4-[2-(этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е]диазепин 8-ил)этокси]-3-метилфенил-4,4,5,5-тетраметил-1,3,2-диоксоборолан (200 мг, 0,39 ммоля), 3-бром-4-метилпиридин (86,9 мг, 0,51 ммоля) и K3PO4 (248 мг, 1,17 ммоля) в 1,4-диоксане (8,0 мл), дегазировали с помощью N2 в течение 45 мин. Затем добавляли PdCl2(dppf) (в виде комплекса с CH2Cl2, 1:11, 28,4 мг,38,9 мкмоля) и dppf (21,6 мг, 38,9 мкмоля) и реакционную смесь перемешивали в атмосфере N2 в трубе высокого давления при 100C в течение 16 ч. Охлажденную смесь, разбавленную EtOAc (25 мл), фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью экспрессхроматографии (от EtOAc:гексан, 4:1, до EtOAc), получая указанное в заголовке соединение 1076 (154 мг,выход 82%) в виде твердого вещества белого цвета. Пример 7 (соединение 1077). 11-Этил-5,11-дигидро-5-метил-8-2-[2-метил-4-(4-метил-1-оксидо-3 пиридинил)фенокси]этил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. Раствор, содержащий 5,11-дигидро-11-этил-5-метил-8-2-[2-метил-4-(4-метил-3-пиридинил)фенокси]этил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (114 мг, 0,24 ммоля) и МХПБК (62,6 мг, 0,31 ммоля) в CH2Cl2 (10 мл), перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли EtOAc (50 мл) и образовавшийся раствор промывали 10%-ным водным раствором Na2S2O3 (310 мл),водным раствором NaHCO3 (310 мл), водой (10 мл) и соляным раствором (10 мл), затем сушили(MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии, получая указанное в заголовке соединение 1077 (55 мг, выход 47%) в виде твердого вещества белого цвета. Пример 8 (соединение 1090). 11-Этил-5,11-дигидро-5-метил-8-2-[4-(4-пиридинил)фенокси]этил 6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. а) 4-[4-(Фенилметокси)фенил]пиридин.Pd(PPh3)4 (10,0 мг, 0,01 ммоля) добавляли к дегазированной (N2) смеси, содержащей 4-(фенилметокси)фенилбороновую кислоту (230 мг, 1,01 ммоля), гидробромид 4-бромпиридина (194 мг, 1,00 ммоль),1 М водный раствор Na2CO3 (4,0 мл), в MeCN (4 мл). Реакционную смесь нагревали до 85C в течение 5 ч. Охлажденную суспензию фильтровали и образовавшееся твердое вещество промывали водным раствором MeCN. Фильтрат экстрагировали с помощью CH2Cl2. Органический слой сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (EtOAc) и объединяли с полученным фильтрацией твердым продуктом, в результате чего получали указанное в заголовке соединение (247 мг, выход 94%) в виде твердого вещества белого цвета. б) 4-(4-Гидроксифенил)пиридин. Раствор, содержащий 4-[4-(фенилметокси)фенил]пиридин (120 мг, 0,46 ммоля), Pd(OH)2/C (20 мас.%,10 мг) и 1,0 М водный раствор HCl (0,5 мл) в МеОН (20 мл), перемешивали в атмосфере водорода (50 фунтов/кв.дюйм) в течение 17 ч при 25C. Катализатор удаляли фильтрацией, добавляли Et3N (0,1 мл) и фильтрат концентрировали при пониженном давлении. Остаток обрабатывали горячим ТГФ. Образовав- 17009178 шуюся суспензию фильтровали и фильтрат концентрировали при пониженном давлении, получая указанное в заголовке соединение (69 мг, выход 88%) в виде твердого вещества бежевого цвета. в) 11-Этил-5,11-дигидро-5-метил-8-2-[4-(4-пиридинил)фенокси]этил-6H-дипиридо[3,2-b:2',3'-е][1,4] диазепин-6-он. Раствор ДИАД (96,9 мкл, 0,50 ммоля) в ТГФ (0,5 мл) добавляли по каплям к раствору, содержащему 11-этил-5,11-дигидро-8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (100 мг,0,33 ммоля), 4-(4-гидроксифенил)пиридин (61,0 мг, 0,36 ммоля) и PPh3 (132 мг, 0,50 ммоля), в ТГФ (5,0 мл),при 25C. Смесь перемешивали при 25C в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали с помощью экспресс-хроматографии (от EtOAc до EtOAc:ТГФ,4:1), получая указанное в заголовке соединение 1090 (70 мг, выход 46%). Пример 9 (соединение 1091). 11-Этил-5,11-дигидро-5-метил-8-2-[4-(1-оксидо-4-пиридинил)фенокси]этил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. Раствор, содержащий 11-этил-5,11-дигидро-5-метил-8-2-[4-(4-пиридинил)фенокси]этил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (45,0 мг, 0,10 ммоля) и МХПБК (37,0 мг, 0,18 ммоля) в CH2Cl2 (7 мл),перемешивали при 25C в течение 2 ч. Смесь концентрировали при пониженном давлении и остаток очищали с помощью ЖХВР с обращенной фазой (колонка типа CombiPrep ADS-AQ 5020 мм, 5 мкм, 120 A,MeCN + 0,10% ТФК/вода + 0,10% ТФК), получая указанное в заголовке соединение 1091 (25 мг, выход 54%) в виде твердого вещества белого цвета. Пример 10 (соединение 1093). 8-2-[4-(2-Амино-4-тиазолил)-2-метилфенокси]этил-11-этил-5,11 дигидро-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. а) 4-(2-Амино-4-тиазолил)-2-метилфенол. Тиомочевину (79,8 мг, 1,05 ммоля) добавляли к раствору 2-бром-1-(4-гидрокси-3-метилфенил)этанона (200 мг, 0,87 ммоля) в 1,4-диоксане (15 мл). Реакционную смесь перемешивали при 25C в течение 24 ч. Образовавшуюся суспензию фильтровали и твердый продукт промывали 1,4-диоксаном и сушили при пониженном давлении. Твердый продукт суспендировали в воде (30 мл), добавляли буферный раствор с рН 7 (15 мл) и смесь экстрагировали EtOAc (350 мл). Объединенные органические слои промывали последовательно водой (20 мл) и соляным раствором (20 мл), сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 1:1), получая указанное в заголовке соединение (180 мг, выход 100%). б) 8-2-[4-(2-Амино-4-тиазолил)-2-метилфенокси]этил-11-этил-5,11-дигидро-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. ДЭАД (192 мг, 1,10 ммоля) добавляли по каплям к охлажденному на льду раствору, содержащему 11-этил-5,11-дигидро-8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (274 мг,0,92 ммоля), 4-(2-амино-4-тиазолил)-2-метилфенол (190 мг, 0,92 ммоля) и PPh3 (289 мг, 1,10 ммоля) в ТГФ (10 мл). Реакционную смесь перемешивали при 25C в течение 2 ч, затем концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (колонка типа CombiPrepADS-AQ 5020 мм, 5 мкм, 120 A, MeCN + 0,10% ТФК /вода + 0,10% ТФК), получая трифторацетат указанного в заголовке соединения 1093 (119 мг, выход 27%) в виде твердого вещества белого цвета. Пример 11 (соединение 1094). 11-Этил-5,11-дигидро-8-2-[4-(1H-имидазол-4-ил)-2-метилфенокси] этил-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. а) 2-Метил-4-[1-(трифенилметил)-1H-имидазол-4-ил]фенол. Раствор 2-бром-1-(4-гидрокси-3-метилфенил)этанона (400 мг, 1,75 ммоля) в формамиде (10 мл) перемешивали при 190C в течение 5 ч. Избыток формамида удаляли путем дистилляции при пониженном давлении. Остаток растворяли в EtOAc (50 мл) и образовавшийся раствор промывали последовательно буферным раствором с рН 7,0 (10 мл), водой (10 мл) и соляным раствором (10 мл), затем сушили(MgSO4), фильтровали и концентрировали при пониженном давлении. Раствор, содержащий остаток,Et3N (0,88 мг, 8,73 ммоля) и трифенилметилхлорид (584 мг, 2,10 ммоля) в ДМФ (10 мл), перемешивали при 60C в течение 3 ч. Реакционную смесь охлаждали до 25C, подкисляли с помощью 1,0 н. водного раствора HCl и разбавляли EtOAc (200 мл). Образовавшуюся смесь промывали последовательно водой(350 мл) и соляным раствором (50 мл), затем сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 1:1), получая указанное в заголовке соединение (514 мг, выход 71%). б) 11-Этил-5,11-дигидро-8-2-2-метил-4-[1-(трифенилметил)-1H-имидазол-4-ил]феноксиэтил-5 метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. ДЭАД (90,7 мкл, 0,58 ммоля) добавляли по каплям к раствору, содержащему 11-этил-5,11-дигидро 8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (143 мг, 0,48 ммоля), 2-метил 4-[1-(трифенилметил)-1H-имидазол-4-ил]фенол (200 мг, 0,48 ммоля) и PPh3 (151 мг, 0,58 ммоля) в ТГФ(10 мл), при 25C. После перемешивания в течение 2 ч при 25C смесь концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (CH2Cl2:MeOH, 95:5), получая указанное в заголовке соединение (180 мг, выход 54%). в) 11-Этил-5,11-дигидро-8-2-[4-(1H-имидазол-4-ил)-2-метилфенокси]этил-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. Раствор, содержащий 11-этил-5,11-дигидро-8-2-2-метил-4-[1-(трифенилметил)-1H-имидазол-4 ил]феноксиэтил-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (180 мг, 0,26 ммоля) и трифторуксусную кислоту (8,0 мл) в CH2Cl2 (8,0 мл), перемешивали при 25C в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью ЖХВР с обращенной фазой (колонка типа CombiPrep ADS-AQ 5020 мм, 5 мкл, 120 A, MeCN + 0,10% ТФК /вода + 0,10% ТФК), получая трифторацетат указанного в заголовке соединения 1094 (82 мг, выход 70%) в виде твердого вещества белого цвета. Пример 12 (соединение 1095). 11-Этил-5,11-дигидро-5-метил-8-2-[2-метил-4-(1-метил-1H-имидазол-4-ил)фенокси]этил-6H-дипиридо [3,2-b:2',3'-е][1,4] диазепин-6-он. 60%-ную дисперсию NaH в масле (10,5 мг, 0,26 ммоля) добавляли к охлажденому на льду раствору соединения 1094 (54,5 мг, 0,12 ммоля) в ТГФ (3,0 мл). Через 30 мин добавляли MeI (37 мг, 0,26 ммоля) и смесь перемешивали при 25C в течение 2 ч. К реакционной смеси добавляли несколько капель АсОН. Смесь концентрировали при пониженном давлении и очищали с помощью ЖХВР с обращенной фазой(колонка типа CombiPrep ADS-AQ 5020 мм, 5 мкм, 120 А, MeCN + 0,10% ТФК/вода + 0,10% ТФК), получая трифторацетат указанного в заголовке соединения 1095 (31 мг, выход 56%), который содержал 31% изомера 1-метил-1 Н-имидазол-5-ила. Пример 13 (соединение 1096). 11-Этил-5,11-дигидро-8-2-[4-(1H-имидазол-2-ил)-2-метилфенокси] этил-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. а) 11-Этил-8-[2-(4-формил-2-метилфенокси)этил]-5,11-дигидро-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. Раствор ДИАД (395 мкл, 2,15 ммоля) в ТГФ (0,8 мл) добавляли по каплям к раствору, содержащему 11-этил-5,11-дигидро-8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (430 мг,1,44 ммоля), 4-гидрокси-3-метилбензальдегид (200 мг, 1,47 ммоля) и PPh3 (564 мг, 2,15 ммоля) в ТГФ (15 мл),при 25 С. Смесь перемешивали при 25 С в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали с помощью экспресс-хроматографии (EtOAc:толуол, 1:3), получая указанное в заголовке соединение (385 мг, выход 64%). б) 11-Этил-5,11-дигидро-8-2-[4-(1H-имидазол-2-ил)-2-метилфенокси]этил-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. Раствор, содержащий 11-этил-8-[2-(4-формил-2-метилфенокси)этил]-5,11-дигидро-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (107 мг, 0,26 ммоля), глиоксал (40 мас.%, 0,20 мл, 1,25 ммоля),15 М водный раствор NH4OH (3,0 мл) и NaOAc (84,0 мг, 1,02 ммоля) в МеОН (6,0 мл), перемешивали при 25 С в течение 21 ч. Добавляли 1,0 М водный раствор Na2CO3 и смесь экстрагировали EtOAc (2). Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (от EtOAc до EtOAc:ТГФ, 7:3), получая указанное в заголовке соединение 1096 (30 мг, выход 26%) в виде твердого вещества светло-желтого цвета. Пример 14 (соединение 1097). 11-Этил-5,11-дигидро-5-метил-8-2-[2-метил-4-(1-метил-1H-имидазол-2-ил)фенокси]этил-6H-дипиридо[3,2-b:2',3'-e][1,4]диазепин-6-он. Смесь, содержащую 11-этил-5,11-дигидро-8-2-[4-(1H-имидазол-2-ил)-2-метилфенокси]этил-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (20,0 мг, 0,04 ммоля), 5 М водный раствор NaOH (15 мкл,0,05 ммоля) и MeI (10 мкл, 0,16 ммоля) в MeCN (2,0 мл), перемешивали при 25 С в течение 1 ч. Смесь концентрировали при пониженном давлении, сливали на воду и экстрагировали EtOAc (2). Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью ЖХВР с обращенной фазой (колонка типа CombiPrep ADS-AQ 5020 мм,5 мкм, 120 A, MeCN + 0,10% ТФК/вода + 0,10% ТФК), получая трифторацетат указанного в заголовке соединения 1097 (6,0 мг, выход 30%) в виде твердого вещества белого цвета. Пример 15 (соединение 1098). 11-Этил-5,11-дигидро-8-2-[4-(1H-имидазол-1-ил)-2-метилфенокси] этил-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. а) 8-[2-(4-Бром-2-метилфенокси)этил]-11-этил-5,11-дигидро-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4] диазепин-6-он. Раствор ДИАД (0,44 мл, 2,40 ммоля) в ТГФ (1,0 мл) добавляли по каплям к охлажденному на льду раствору, содержащему 11-этил-5,11-дигидро-8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4] диазепин-6-он (480 мг, 1,61 ммоля), 4-бром-2-метилфенол (318 мг, 1,70 ммоля) и PPh3 (629 мг, 2,40 ммоля) в ТГФ (20 мл), при 25 С. Смесь перемешивали при 0 С в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 7:3),получая указанное в заголовке соединение (437 мг, выход 58%) в виде твердого вещества белого цвета. б) Этил-5,11-дигидро-8-2-[4-(1H-имидазол-1-ил)-2-метилфенокси]этил-5-метил-6H-дипиридо[3,2b:2',3'-е][1,4]диазепин-6-он. Раствор, содержащий 8-[2-(4-бром-2-метилфенокси)этил]-11-этил-5,11-дигидро-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (30 мг, 0,06 ммоля), имидазол (7,0 мг, 0,10 ммоля), CuBr (2 мг, 0,014 ммоля) и CsCO3 (23 мг, 0,07 ммоля) в нитробензоле (0,8 мл), дегазировали в вакууме и в атмосфере аргона. Раствор нагревали до 180 С и выдерживали в течение 36 ч. Смесь разбавляли CH2Cl2 и фильтровали. Обра- 19009178 зовавшийся раствор промывали водой, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (от EtOAc до ТГФ:EtOAc, 1:3) и последующей ЖХВР с обращенной фазой (колонка типа CombiPrep ODS-AQ 5020 мм, 5 мкм, 120 A,MeCN + 0,10% ТФК/вода + 0,10% ТФК), получая трифторацетат указанного в заголовке соединения 1098(28 мг, выход 77%) в виде смолы желтого цвета. Пример 16 (соединение 1099). 11-Этил-5,11-дигидро-5-метил-8-2-[2-метил-4-(4-оксазолил)фенокси]этил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он. а) 4-(4-Оксазолил)-2-метилфенол. Раствор 2-бром-1-(4-гидрокси-3-метилфенил)этанона (200 мг, 0,87 ммоля) в формамиде (10 мл) нагревали до 110 С в течение 24 ч. Избыток формамида удаляли путем дистилляции при пониженном давлении. Образовавшийся остаток распределяли между буферным раствором с рН 7,0 (10 мл) и EtOAc (50 мл). Органический слой промывали водой (10 мл) и соляным раствором (10 мл), сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 1:1), получая указанное в заголовке соединение (51 мг, выход 33%). б) 11-Этил-5,11-дигидро-5-метил-8-2-[2-метил-4-(4-оксазолил)фенокси]этил-6H-дипиридо[3,2-b:2',3'e][1,4]диазепин-6-он. ДЭАД (51,0 мг, 0,29 ммоля) добавляли по каплям к раствору, содержащему 11-этил-5,11-дигидро-8(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (72,8 мг, 0,24 ммоля), 4-(4-оксазолил)-2-метилфенол (51,0 мг, 0,29 ммоля) и PPh3 (76,8 мг, 0,29 ммоля) в ТГФ (4 мл), при 25 С. После перемешивания в течение 2 ч при 25 С смесь концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (CH2Cl2:ацетон, 95:5), получая указанное в заголовке соединение 1099 (23,3 мг, выход 21%) в виде твердого вещества светло-желтого цвета. Пример 17 (соединение 2001). 3'-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'e][1,4]диазепин-8-ил)этокси][1,1'-бифенил]-4-карбоновая кислота. а) Метил-3'-гидрокси-[1,1'-бифенил]-4-карбоксилат. 0,4 М водный раствор Na2CO3 (21,7 мл) добавляли к раствору, содержащему 3-бромфенол (500 мг,2,89 ммоля) и 4-борбензойную кислоту (480 мг, 2,89 ммоля) в MeCN (14,5 мл). Смесь дегазировали аргоном (10 мин), затем добавляли Pd(PPh3)4 (168 мг, 0,14 ммоля). Реакционную смесь нагревали до 90 С в течение 12 ч. Охлажденную смесь подкисляли с помощью 1 н. водного раствора HCl и экстрагировалиEtOAc. Органический слой промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Раствор остатка в Et2O (150 мл) обрабатывали избытком эфирного раствора CH2N2 (примерно 0,6 М), затем концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 85:15), получая указанное в заголовке соединение(375 мг, выход 57%) в виде твердого вещества желтого цвета. б) Метил 3'-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-e][1,4]диазепин-8-ил) этокси][1,1'-бифенил]-4-карбоксилат. Раствор ДЭАД (84 мкл, 0,54 ммоля) в ТГФ (0,5 мл) добавляли в течение 2 ч к охлажденному на льду раствору, содержащему 11-этил-5,11-дигидро-8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4] диазепин-6-он (100 мг, 0,34 ммоля), метил-3'-гидрокси-[1,1'-бифенил]-4-карбоксилат (123 мг, 0,54 ммоля) и PPh3 (141 мг, 0,54 ммоля) в ТГФ (3,4 мл). Реакционную смесь перемешивали при 25 С в течение 12 ч и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (толуол:EtOAc, 85:15), получая указанное в заголовке соединение (74 мг, выход 43%) в виде смолообразного твердого вещества белого цвета. в) 3'-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-e][1,4]диазепин-8-ил)этокси][1,1'-бифенил]-4-карбоновая кислота. 1 н. водный раствор NaOH (3,0 мл, 3,00 ммоля) добавляли к раствору, содержащему метил-3'-[2-(11 этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси][1,1'-бифенил]-4 карбоксилат (74 мг, 0,15 ммоля), в смеси 2:1 ТГФ и МеОН (3,4 мл). Смесь перемешивали при 25 С в течение 2 ч. Образовавшийся раствор подкисляли 1 н. водным раствором HCl и смесь экстрагировалиEtOAc (3). Объединенные органические слои промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении, получая указанное в заголовке соединение 2001(35 мг, выход 49%) в виде твердого вещества белого цвета. Пример 18 (соединение 3001). 4-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилбензоиламинобензойная кислота. а) Метил 4-гидрокси-3-метилбензоат. Раствор, содержащий 4-гидрокси-3-метилбензойную кислоту (5,13 г, 33,7 ммоля) и 12 н. водный раствор HCl (1,0 мл) в МеОН (100 мл), нагревали до температуры дефлегмации в течение 16 ч. Охлажденную реакционную смесь концентрировали при пониженном давлении и остаток растворяли в EtOAc. Образовавшийся раствор промывали насыщенным водным раствором NaHCO3 и соляным раствором, сушили (MgSO4),фильтровали и концентрировали при пониженном давлении. Остаток растирали со смесью гексан:EtOAc(9:1), получая указанное в заголовке соединение (4,70 г, выход 84%) в виде твердого вещества бежевого цвета.- 20009178 б) Метил 4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил) этокси]-3-метилбензоат. Раствор ДИАД (250 мкл, 1,27 ммоля) в ТГФ (1 мл) добавляли по каплям к раствору, содержащему 11-этил-5,11-дигидро-8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (346 мг,1,16 ммоля), метил-4-гидрокси-3-метилбензоат (212 мг, 1,27 ммоля) и PPh3 (333 мг, 1,27 ммоля), в ТГФ (5 мл),при 25 С. Реакционную смесь перемешивали при 25 С в течение 1 ч. Смесь концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 1:1), получая указанное в заголовке соединение (471 мг, выход 91%) в виде твердого вещества белого цвета. в) 4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]3-метилбензойная кислота. Раствор, содержащий метил-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4] диазепин-8-ил)этокси]-3-метилбензоат (471 мг, 1,05 ммоля) и 1 н. водный раствор NaOH (5,0 мл, 5,0 ммоля) в МеОН (10 мл) и ТГФ (5 мл), нагревали до 50 С в течение 5 ч. К охлажденной реакционной смеси добавляли 1 н. водный раствор HCl (6 мл). Образовавшуюся суспензию фильтровали и твердый продукт промывали водой и сушили, получая указанное в заголовке соединение (382 мг, выход 83%) в виде твердого вещества белого цвета. г) 4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]3-метилбензоилхлорид.(COCl)2 (25 мкл, 0,87 ммоля) и ДМФ (10 мкл) добавляли к раствору, содержащему 4-[2-(11-этил 6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилбензойную кислоту (52,8 мг, 0,12 ммоля) в CH2Cl2 (5 мл). Реакционную смесь нагревали до температуры дефлегмации в течение 1 ч. Охлажденную смесь концентрировали при пониженном давлении, получая указанное в заголовке соединение (55 мг, выход 100%), которое использовали без дальнейшей очистки. д) Метил-4-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8 ил)этокси]-3-метилбензоиламинобензоат. Раствор, содержащий 4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилбензоилхлорид (47,0 мг, 0,11 ммоля), метил-4-аминобензоат (15,8 мг, 0,11 ммоля) и Et3N (15,3 мкл, 0,11 ммоля) в CH2Cl2 (4 мл), перемешивали при 25 С в течение 5 ч. Реакционную смесь разбавляли EtOAc и образовавшийся раствор промывали последовательно насыщенным водным раствором NaHCO3 и соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 1:1), получая указанное в заголовке соединение (45 мг, выход 76%) в виде твердого вещества белого цвета. е) 4-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилбензоиламинобензойная кислота. Смесь, содержащую метил-4-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'е][1,4]диазепин-8-ил)этокси]-3-метилбензоиламинобензоат (43,0 мг, 0,076 ммоля) и 1 н. водный растворNaOH (0,5 мл, 0,5 ммоля) в MeCN (4 мл) и воде (0,2 мл), перемешивали при 25 С в течение 48 ч. Реакционную смесь концентрировали при пониженном давлении и оставшуюся водную фазу подкисляли 1 н. водным раствором HCl. Образовавшуюся суспензию фильтровали и выделившийся твердый продукт сушили,получая указанное в заголовке соединение 3001 (22 мг). Соответствующую натриевую соль получали путем обработки 1 н. водным раствором NaOH (18 мг, выход 42%) в виде твердого вещества белого цвета. Пример 19 (соединение 3004). 4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'е][1,4]диазепин-8-ил)этокси]-3-метил-N-(1-оксидо-4-пиридинил)бензамид. а) 4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]3-метил-N-(4-пиридинил)бензамид. Раствор, содержащий 4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилбензоилхлорид (47,4 мг, 0,11 ммоля), 4-аминопиридин (9,88 мг, 0,11 ммоля) иEt3N (15,3 мкл, 0,11 ммоля) в CH2Cl2 (4 мл), перемешивали при 25 С в течение 5 ч. Реакционную смесь разбавляли EtOAc и образовавшийся раствор промывали последовательно насыщенным водным раствором NaHCO3 и соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (58 мг, выход 100%) в виде бесцветного масла. б) 4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]3-метил-N-(1-оксидо-4-пиридинил)бензамид. Раствор, содержащий 4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метил-N-(4-пиридинил)бензамид (52,0 мг, 0,10 ммоля) и 80% МХПБК (35 мг, 0,16 ммоля) в CH2Cl2 (4 мл), перемешивали при 25 С в течение 4 ч. Добавляли насыщенный водный раствор NaHCO3 и разделяли фазы. Органический слой сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью ЖХВР с обращенной фазой (колонка типа CombiPrep ODSAQ 5020 мм, 5 мкм, 120 А) с использованием градиента смеси MeCN/вода, содержащей ТФК (0,06%),получая указанное в заголовке соединение 3004 (19 мг, выход 36%) в виде твердого вещества белого цвета. Пример 20 (соединение 3022). 4-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2- 21009178b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилфениламинобензойная кислота. а) 1,1-Диметилэтил N-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилфенилкарбамат. Раствор ДИАД (258 мкл, 1,31 ммоля) в ТГФ (4 мл) добавляли в течение 2 ч к раствору, содержащему 11 этил-5,11-дигидро-8-(2-гидроксиэтил)-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (300 мг, 1,01 ммоля), 1,1-диметилэтил N-(4-гидрокси-3-метилфенил)карбамат (225 мг, 1,01 ммоля) и PPh3 (343 мг, 1,31 ммоля) в ТГФ (12 мл), при 25 С. Реакционную смесь перемешивали при 25 С в течение 1 ч. Смесь концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, от 7:3 до 1:1), получая указанное в заголовке соединение (230 мг, выход 45%) в виде твердого вещества белого цвета. б) 11-Этил-5,11-дигидро-8-[2-(4-амино-2-метилфенокси)этил]-5-метил-6H-дипиридо[3,2-b:2',3'-е][1,4] диазепин-6-он. Смесь, содержащую 1,1-диметилэтил N-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилфенилкарбамат (540 мг, 1,07 ммоля) и 4 н. HCl в 1,4 диоксане (5,0 мл, 20 ммолей), перемешивали при 25 С в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в воде (6 мл) и образовавшийся раствор промывалиEtOAc. Водный слой подщелачивали (рН 9) с помощью 2 н. водного раствора NaOH и смесь экстрагировали EtOAc. Органический слой сушили (MgSO4), фильтровали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (398 мг, выход 92%) в виде пены бежевого цвета. в) Этил 4-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8 ил)этокси]-3-метилфениламинобензоат. Дегазированную смесь, содержащую 11-этил-5,11-дигидро-8-[2-(4-амино-2-метилфенокси)этил]-5 метил-6H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он (100 мг, 0,25 ммоля), этил-4-бромбензоат (61,0 мкл,0,37 ммоля), трет-BuONa (36,0 мг, 0,37 ммоля), Pd2(dba)3 (2,5 мг, 2,7 мкмоля) и (+/-)-BINAP (5,0 мг, 8,0 мкмолей) в толуоле (8 мл), нагревали до 105 С в атмосфере азота в течение 48 ч. Охлажденную реакционную смесь разбавляли EtOAc, фильтровали через небольшую пробку из диатомовой земли и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (гексан:EtOAc, 1:1),получая указанное в заголовке соединение (55 мг, выход 40%) в виде твердого вещества белого цвета. г) 4-4-[2-(11-Этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]3-метилфениламинобензойная кислота. Раствор, содержащий этил-4-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'е][1,4]диазепин-8-ил)этокси]-3-метилфениламинобензоат (55,0 мг, 0,10 ммоля) и 1 н. водный раствор LiOH(1,0 мл, 1,0 ммоль) в ТГФ (3 мл) и МеОН (1 мл), перемешивали при 25 С в течение 18 ч. Реакционную смесь подкисляли (рН 6,5) с помощью 1 н. водного раствора HCl и экстрагировали EtOAc (2). Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью ЖХВР с обращенной фазой (колонка типа CombiPrep ODS-AQ 5020 мм, 5 мкм,120 А) с использованием градиента смеси MeCN/вода, содержащей ТФК (0,06%). Образовавшийся твердый продукт (трифторацетат) растворяли в EtOAc и раствор экстрагировали 1,0 н. водным раствором HCl(2). Значение рН объединенных водных слоев доводили до 6,0-6,5 с помощью 1 н. водного раствора NaOH и образовавшийся раствор экстрагировали EtOAc (2). Объединенные органические слои сушили (MgSO4),фильтровали и концентрировали при пониженном давлении. Остаток (17 мг, 32 мкмоля) суспендировали в MeCN (3 мл), добавляли 0,02 н. водный раствор NaOH (1,62 мл, 32 мкмоля) и смесь облучали ультразвуком до получения гомогенного раствора. Раствор замораживали и лиофилизировали, получая натриевую соль указанного в заголовке соединения 3022 (15 мг, выход 29%) в виде твердого вещества белого цвета. Пример 21 (соединение 4011). Гидразид 4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4]диазепин-8-ил)этокси]-3-метилбензойной кислоты. Раствор, содержащий метил-4-[2-(11-этил-6,11-дигидро-5-метил-6-оксо-5H-дипиридо[3,2-b:2',3'-е][1,4] диазепин-8-ил)этокси]-3-метилбензоат (55,0 мг, 0,12 ммоля) и гидразин (130 мкл, 4,14 ммоля) в EtOH (10 мл),нагревали до температуры дефлегмации в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью ЖХВР с обращенной фазой (колонка типа CombiPrepODS-AQ 5020 мм, 5 мкм, 120 А) с использованием градиента смеси MeCN/вода, содержащей ТФК(50,0 мг, 0,11 ммоля), ДМАП (24 мг, 0,19 ммоля) и MeSO2NH2 (55 мг, 0,58 ммоля) в ТГФ (5 мл). После перемешивания при 25 С в течение 72 ч реакционную смесь подкисляли 1 н. водным раствором HCl и экстрагировали EtOAc. Органический слой промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью экспресс-хроматографии (смесь EtOAc:гексан, от 50 до 100%, содержащая 1% АсОН), получая указанное в заголовке соединение 4013 (25 мг, выход 42%).
МПК / Метки
МПК: C07D 243/00, A61K 31/55, C07D 471/14, C07D 221/00, A61P 31/18
Метки: обратной, транскриптазы, ингибиторы, ненуклезидные
Код ссылки
<a href="https://eas.patents.su/30-9178-nenuklezidnye-ingibitory-obratnojj-transkriptazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ненуклезидные ингибиторы обратной транскриптазы</a>
Предыдущий патент: Способ выделения акрилонитрила или метакрилонитрила
Следующий патент: Вакцина на основе вирусоподобных частиц вируса папилломы человека 16 и вируса папилломы человека 18 l 1
Случайный патент: Повторно закрываемый разливочный элемент для составных картонно-пластиковых упаковок жидких продуктов, и способ его сборки












