4,4-дизамещенные 3,4-дигидро-2(1н)-хиназолиноны, полезные в качестве ингибиторов обратной транскриптазы вич
Формула / Реферат
1. Соединение формулы (I)
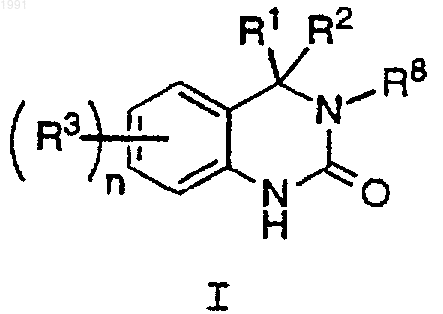
или его стереоизомер, или фармацевтически приемлемая соль,
где R1 обозначает C1-3-алкил, замещенный 1-7 атомами галогена;
R2 выбран из C1-5-алкила, замещенного 1-2 R4, С2-5-алкенила, замещенного 1-2 R4, и С2-5-алкинила, замещенного одним R4;
R3 каждый независимо выбран из C1-4-алкила, ОН, C1-4-алкокси, F, Cl, Br, I, NR5R5a, NO2, CN, C(O)R6, NHC(O)R7 и NHC(О)NR5R5a;
альтернативно, если присутствуют два заместителя R3 и они присоединены к соседним атомам углерода, то они могут соединяться с образованием -ОСН2О-;
R4 выбран из С3-5-циклоалкила, замещенного 0-2 R3, фенила, замещенного 0-5 R3 и 5-6-членной гетероциклической системы, содержащей 1-3 гетероатома, выбранных из О, N и S, замещенной 0-2 R3;
R5 и R5a независимо выбраны из Н и C1-3-алкила;
R6 выбран из Н, ОН, C1-4-алкила, C1-4-алкокси и NR5R5a;
R7 выбран из C1-3-алкила и C1-3-алкокси;
R8 выбран из Н, С3-5-циклоалкила и C1-3-алкила и
n выбран из 0,1, 2, 3 и 4.
2. Соединение по п.1, в котором
R1 обозначает C1-3-алкил, замещенный 1-7 атомами галогена;
R2 выбран из C1-5-алкила, замещенного одним R4, С2-5-алкенила, замещенного одним R4, и С2-5-алкинила, замещенного одним R4;
R3 каждый независимо выбран из C1-4-алкила, ОН, C1-4-алкокси, F, Cl, Br, I, NR5R5a, NO2, CN, C(O)R6, NHC(O)R7 и NHC(O)NR5R5a;
альтернативно, если присутствуют два заместителя R3 и они присоединены к соседним атомам углерода, то они могут соединяться с образованием -ОСН2О-;
R4 выбран из С3-5-циклоалкила, замещенного 0-2 R3, фенила, замещенного 0-2 R3 и 5-6-членной гетероциклической системы, содержащей 1-3 гетероатома, выбранных из О, N и S, замещенной 0-1 R3;
R5 и R5a независимо выбраны из Н и С3 и С2Н5;
R6 выбран из Н, ОН, СН3, C2H5, ОСН3, ОС2Н5 и NR5R5a;
R7 выбран из СН3, С2Н5, ОСН3 и ОС2Н5;
R8 выбран из Н, циклопропила, СН3 и С2Н5; и
n выбран из 0,1, 2 и 3.
3. Соединение по п.2, в котором
R1 выбран из СF3 и С2F5;
R2 выбран из C1-3-алкила, замещенного одним R4, С2-3-алкенила, замещенного одним R4, и С2-3-алкинила, замещенного одним R4;
R3 каждый независимо выбран из C1-3-алкила, ОН, C1-3-алкокси, F, Cl, Br, I, NR5R5a, NO2, CN, C(O)R6, NHC(O)R7 и NHC(О)NR5R5a;
альтернативно, если присутствуют два заместителя R3 и они присоединены к соседним атомам углерода, то они могут соединяться с образованием -ОСН2О-;
R4 выбран из С3-5-циклоалкила, замещенного 0-2 R3, фенила, замещенного 0-2 R3 и 5-6-членной гетероциклической системы, содержащей 1-3 гетероатома, выбранных из О, N и S, замещенной 0-1 R3;
R5 и R5a независимо выбраны из Н, СН3 и С2Н5;
R6 выбран из Н, ОН, СН3, С2Н5, ОСН3, OC2H5 и NR5R5a;
R7 выбран из СН3, С2Н5, ОСН3 и ОС2Н5;
R8 выбран из Н, СН3 и С2Н5 и
n выбран из 0,1 и 2.
4. Соединение по п.3, в котором
R1 обозначает СF3;
R2 выбран из C1-3-алкила, замещенного одним R4, С2-3-алкенила, замещенного одним R4, и С2-5-алкинила, замещенного одним R4;
R3 каждый независимо выбран из C1-3-алкила, ОН, C1-3-алкокси, F, Cl, NR5R5a, NO2, CN, C(O)R6, NHC(O)R7 и NHC(О)NR5R5a;
альтернативно, если присутствуют два заместителя R3 и они присоединены к соседним атомам углерода, то они могут соединяться с образованием -ОСН2О-;
R4 выбран из циклопропила, замещенного 0-1 R3, фенила, замещенного 0-2 R3, и 5-6-членной гетероциклической системы, содержащей 1-3 гетероатома, выбранных из О, N и S, замещенной 0-1 R3, где гетероциклическая система выбрана из 2-пиридила, 3-пиридила, 4-пиридила, 2-фуранила, 3-фуранила, 2-тиенила, 3-тиенила, 2-оксазолила, 2-тиазолила, 4-изоксазолила и 2-имидазолила;
R5 и R5a независимо выбраны из Н, СН3 и С2Н5;
R6 выбран из Н, ОН, СН3, С2Н5, ОСН3, OC2H5 и NR5R5a;
R7 выбран из СН3, С2Н5, ОСН3 и OC2Н5;
R8 выбран из Н, СН3 и С2Н5 и
n выбран из 1 и 2.
5. Соединение по п.4, имеющее формулу Iа
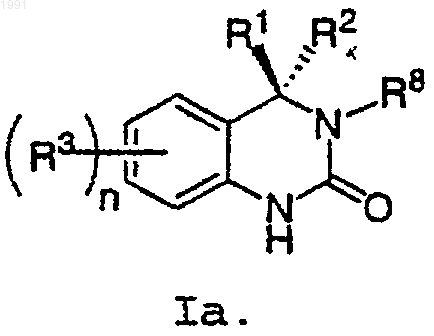
6. Соединение по п.4, имеющее формулу Ib
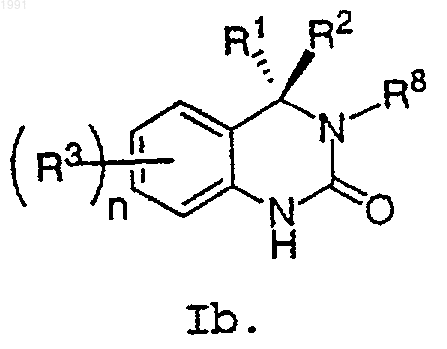
7. Соединение по п.1, выбранное из
(+/-)-6-хлор-4-циклопропилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-6-хлор-4-(2-пиридил)этинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-6-хлор-4-фенилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-4-циклопропилэтинил-6-метокси-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-6-метокси-4-(2-пиридил)этинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-6-метокси-4-фенилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-4-циклопропилэтинил-5,6-дифтор-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-5,6-дифтор-4-(2-пиридил)этинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-5,6-дифтор-4-фенилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-4-циклопропилэтинил-6-фтор-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-6-фтор-4-(2-пиридил)этинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-6-фтор-4-фенилэтинил-4-трифторметил-3,4-дигидро-2(1)-хиназолинона;
(+/-)-6-фтор-4-(2'-2-пиридил)этил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-6-фтор-4-фенилэтил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(-)-6-хлор-4-циклопропилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+)-6-хлор-4-циклопропилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+)-4-циклопропилэтинил-5,6-дифтор-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(-)-4-циклопропилэтинил-5,6-дифтор-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+)-Е-4-циклопропилэтенил-5,6-дифтор-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона; и
(-)-6-хлор-4-Е-циклопропилэтенил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона,
или его фармацевтически приемлемая соль.
8. Соединение формулы II
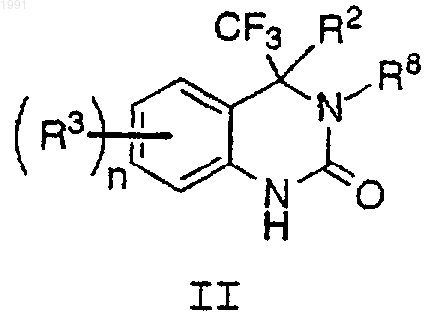
или его стереоизомер или фармацевтически приемлемая соль,
где R2 обозначает Cу C-R4a;
R3 выбран из C1-4-алкила, ОН, C1-4-алкокси, F, Cl, Вr, I, NR5R5a, NO2, CN, C(O)R6, NHC(O)R7 и NHC(O)NR5R5a;
R4a выбран из метила, этила, н-пропила, изопропила, изобутила, трет-бутила и изопентила;
R5 и R5a независимо выбраны из Н и C1-3-алкила;
R6 выбран из Н, ОН, C1-4-алкила, C1-4-алкокси и NR5R5a;
R7 выбран из C1-3-алкила и C1-3-алкокси;
R8 выбран из Н, С3-5-циклоалкила и C1-3-алкила и
n выбран из 0, 1, 2, 3 и 4.
9. Соединение по п.8, в котором
R2 обозначает Cу C-R4a;
R3 выбран из C1-4-алкила, ОН, C1-4-алкокси, F, Cl, Вr, I, NR5R5a, NO2, CN, C(O)R6, NHC(O)R7;
R4a выбран из метила, этила, н-пропила, изопропила, изобутила, трет-бутила и изопентила;
R5 и R5a независимо выбраны из Н, СН3 и С2Н5;
R6 выбран из Н, ОН, СН3, С2Н5, ОСН3, ОС2Н5 и NR5R5a;
R7 выбран из СН3, С2Н5, ОСН3 и ОС2Н5;
R8 выбран из Н, циклопропила, СН3 и С2Н5 и
n выбран из 0, 1 и 2.
10. Соединение по п.9, имеющее формулу IIа
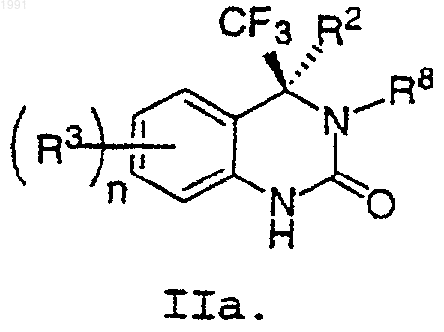
11. Соединение по п.9, имеющее формулу IIb
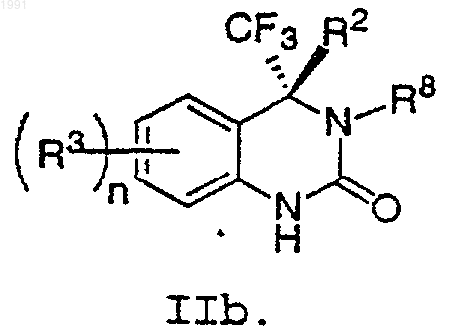
12. Соединение по п.8, выбранное из
(+/-)-6-хлор-4-изопропилэтинил-4-трифторметил-3,4-дигидро-2(1Н) -хиназолинона;
(+/-)-6-хлор-4-этилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-4-изопропилэтинил-6-метокси-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-5,6-дифтор-4-изопропилэтинил-4-тифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-5,6-дифтор-4-этилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона ;
(+/-)-5,6-дифтор-4-изопентил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-6-фтор-4-изопропилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+/-)-6-фтор-4-этилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(-)-5,6-дифтор-4-изопропилэтинил-4-трифторметил-3,4-дигидро-2(1Н)-хиназолинона;
(+)-5,6-дифтор-4-изопропилэтинил-4-трифторметил-3,4-дигидро-2(1H)-хиназолинона;
(-)-5,6-дифтор-4-этилэтинил-4-трифторметил-3,4-дигидро-2(1H)-хиназолинона; и
(+)-5,6-дифтор-4-этилэтинил-4-трифторметил-3,4-дигидро-2(1H)-хиназолинона,
или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.1-12 или его фармацевтически приемлемой соли.
14. Способ лечения инфекции ВИЧ, включающий введение хозяину, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по любому из пп.1-12 или его фармацевтически приемлемой соли.
15. Способ лечения инфекции ВИЧ, включающий введение в комбинации хозяину, нуждающемуся в этом, терапевтически эффективного количества
(a) соединения по любому из пп.1-12 или его стереоизомерных форм, смесей стереоизомерных форм или его фармацевтически приемлемых солей и
(b) по меньшей мере, одного соединения, выбранного из группы, включающей ингибиторы обратной транскриптазы ВИЧ и ингибиторы протеазы ВИЧ.
16. Способ по п.15, в котором ингибитор обратной транскриптазы выбран из AZT, ЗТС, ddI, ddC, d4T, делавирдина, производных TIBO, BI-RG-587, невирапина, L-697 661, LY 73497, Ro 18,893, ловирида, тровирдина, МКС-442 и HBY 097, а ингибитор протеазы выбран из саквинавира, ритонавира, индинавира, VX-478, нелфинавира, KNI-272, CGP-61755, U-140690 и АВТ-378.
17. Способ по п.16, в котором ингибитор обратной транскриптазы выбран из AZT и ЗТС, и ингибитор протеазы выбран из саквинавира, нелфинавира, ритонавира и индинавира.
18. Фармацевтический набор для лечения инфекции ВИЧ, который содержит терапевтически эффективное количество
(a) соединения по любому из пп.1-12 или его стереоизомерных форм, смесей стереоизомерных форм или его фармацевтически приемлемых солей и
(b) по меньшей мере, одного соединения, выбранного из группы, состоящей из ингибиторов обратной транскриптазы ВИЧ и ингибиторов протеазы ВИЧ, в одном или нескольких стерильных контейнерах.
Текст
1 Данное изобретение относится в общем к 4,4-дизамещенным 3,4-дигидро-2(1 Н)-хиназолинонам, которые полезны в качестве ингибиторов обратной транскриптазы ВИЧ, фармацевтическим композициям и диагностическим наборам,содержащим их, способам применения их для лечения вирусной инфекции или в качестве тест-стандартов или реагентов и промежуточным продуктам и способам их получения. Предпосылки создания изобретения Два различных ретровируса, вирус иммунодефицита человека (ВИЧ) типа 1 (ВИЧ-1) или типа 2 (ВИЧ-2), этиологически связывают с иммуносупрессивным заболеванием, синдромом приобретенного иммунодефицита (СПИДом). ВИЧ-серопозитивные индивидуумы являются сначала бессимптомными, но обычно развивается СПИД-ассоциированный комплекс (ARC) и затем СПИД. Пораженные индивидуумы обнаруживают тяжелую иммуносупрессию, которая предрасполагает их к ослаблению и в конце концов к фатальным инфекциям, вызываемым условно-патогенными микроорганизмами. Заболевание СПИД представляет собой конечный результат вируса ВИЧ-1 или ВИЧ-2 после его собственного сложного жизненного цикла. Жизненный цикл вириона начинается с присоединения самого вириона к иммунной клетке Т-4-лимфоциту человека посредством связывания гликопротеина на поверхности защитной оболочки вириона с гликопротеиномCD4 на лимфоците. После прикрепления вирион сбрасывает свою гликопротеиновую оболочку,проникает в мембрану клетки-хозяина и обнажает его РНК. Фермент вириона, обратная транскриптаза, запускает процесс транскрибирования этой РНК в одноцепочечную ДНК. Вирусная РНК разрушается и образуется вторая цепь ДНК. Теперь двухцепочечная ДНК интегрируется в гены клетки человека и эти гены используются для репродукции вируса. В этот момент РНК-полимераза транскрибирует интегрированную ДНК в вирусную РНК. Вирусная РНК транслируется в слитый полипротеин-предшественник gag-pol. Затем этот полипротеин расщепляется протеазным ферментом ВИЧ с образованием зрелых вирусных белков. Таким образом, протеаза ВИЧ ответственна за регуляцию каскада событий расщепления, которые приводят к созреванию вирусных частиц до вируса, который обладает полной инфекционностью. Типичный ответ иммунной системы человека, убивание вторгшегося вириона, является затрудненным, так как этот вирус инфицирует и убивает Т-клетки иммунной системы. Кроме того, обратная транскриптаза вируса, фермент,используемый в создании новой частицы вириона, является не очень специфическим и вызывает ошибки транскрипции, которые приводят к непрерывно меняющимся гликопротеинам на поверхности защитной оболочки вируса. Эта 2 потеря специфичности снижает эффективность иммунной системы, поскольку антитела, специфически продуцируемые против одного гликопротеина, могут быть бесполезными против другого, уменьшая, следовательно, количество доступных антител для борьбы с этим вирусом. Вирус продолжает репродуцироваться, в то время как ответ иммунной системы продолжает ослабляться. В конце концов ВИЧ в значительной степени господствует над иммунной системой организма, позволяя развиваться инфекциям условно-патогенных микроорганизмов, и без введения антивирусных агентов, иммуномодуляторов или и тех и других может наступить смерть. Имеется, по меньшей мере, три критические точки в жизненном цикле вируса, которые были идентифицированы как возможные мишени для антивирусных лекарственных средств:(1) первоначальное прикрепление вириона к сайту Т-4-лимфоцита или макрофага,(2) транскрипция вирусной РНК в вирусную ДНК (обратная транскриптаза, ОТ) и(3) процессинг белка gag-pol протеазой ВИЧ. Ингибирование вируса во второй критической точке, в процессе транскрипции вирусной РНК в вирусную ДНК, обеспечило ряд современных терапевтических методик, используемых в лечении СПИДа. Эта транскрипция должна происходить для репродукции вириона,поскольку гены вириона кодируются в РНК, а клетка-хозяин считывает только ДНК. Путем введения лекарственных средств, которые блокируют обратную транскриптазу от завершения образования вирусной ДНК, репликация ВИЧ-1 может быть остановлена. Ряд соединений, которые препятствуют репликации вируса, были разработаны для лечения СПИДа. Например, было показано, что нуклеозидные аналоги, такие как 3'-азидо-3'дезокситимидин (AZT), 2',3'-дидезоксицитидин(ddC), 2',3'-дидезокситимидинен (d4T), 2',3'дедезоксиинозин (ddI) и 2',3'-дидезокси-3'тиацитидин (ЗТС) являются относительно эффективными в остановке репликации ВИЧ на стадии обратной транскриптазы (ОТ). Активной областью исследований является обнаружение ненуклеозидных ингибиторов обратной транскриптазы ВИЧ. В качестве примера, было обнаружено, что некоторые бензоксазиноны и хиназолиноны являются активными в ингибировании обратной транскриптазы ВИЧ,предупреждении или лечении инфекции ВИЧ и лечении СПИДа. В U.S. 5 519 021 описаны ингибиторы обратной транскриптазы, которые являются бензоксазинонами формулы 3 В ЕР 0 530 994 и WO 93/04047 описаны ингибиторы обратной транскриптазы ВИЧ, которые являются хиназолинонами формулы А где G обозначает различные группы, R3 и R4 могут быть Н, Z может быть О, R2 может быть незамещенным алкилом, незамещенным алкенилом, незамещенным алкинилом, незамещенным циклоалкилом, незамещенным гетероциклом и необязательно замещенным арилом, и R1 может быть различными группами, в том числе замещенным алкилом. В WO 95/12583 также описаны ингибиторы обратной транскриптазы ВИЧ формулы А. В этой публикации G обозначает различные группы, R3 и R4 могут быть Н, Z может быть О, R2 является замещенным алкенилом или замещенным алкинилом и R1 является циклоал-килом,алкинилом, алкенилом или циано. WO 95/13273 иллюстрирует асимметричный синтез одного из соединений WO 95/12583, (S)-(-)-6-хлор-4 циклопропил-3,4-дигидро-4-2-пиридил) этинил)-2(1 Н)-хиназолинона. Методики синтеза для получения хиназолинонов, подобных описанным выше, описаны в деталях в следующих ссылках: Houpis et al,Tetr. Lett. 1994, 35(37), 6811-6814; Tucker et al.,J. Med. Chem. 1994, 37, 2437-2444 и Huffman et где R обозначает фенил, карбоциклическое кольцо или гетероциклическое кольцо. Соединения этого вида не рассматриваются как часть данного изобретения. Даже при достигнутом успехе в разработке ингибиторов обратной транскриптазы было обнаружено, что пациенты с ВИЧ могут становиться резистентными к одному ингибитору. Таким образом, желательна разработка дополнительных ингибиторов для дальнейшей борьбы с инфекцией ВИЧ. Сущность изобретения Таким образом, одним объектом данного изобретения являются новые ингибиторы обратной транскриптазы. Другим объектом данного изобретения является новый способ лечения инфекции ВИЧ,включающий введение хозяину, нуждающемуся в таком лечении, терапевтически эффективного количества, по меньшей мере, одного из соединений данного изобретения или его фармацевтически приемлемой соли. 4 Другим объектом данного изобретения является новый способ лечения инфекции ВИЧ,включающий введение хозяину, нуждающемуся в таком лечении, терапевтически эффективной комбинации (а) одного из соединений данного изобретения и (b) одного или нескольких соединений, выбранных из группы, состоящей из ингибиторов обратной транскриптазы ВИЧ и ингибиторов протеазы ВИЧ. Еще одним объектом данного изобретения являются фармацевтические композиции с ингибирующей обратную транскриптазу активностью, содержащие фармацевтически приемлемый носитель и терапевтически эффективное количество, по меньшей мере, одного из соединений данного изобретения или его фармацевтически приемлемой соли. Еще одним объектом данного изобретения является способ ингибирования ВИЧ, присутствующего в образце жидкости тела, включающий обработку образца жидкости тела эффективным количеством соединения данного изобретения. Еще одним объектом данного изобретения является набор или контейнер, содержащий, по меньшей мере, одно из соединений данного изобретения в количестве, эффективном для использования в качестве стандарта или реагента в тесте или анализе для определения способности потенциального фармацевтического средства ингибировать обратную транскриптазу ВИЧ, рост ВИЧ или и то, и другое. Эти и другие объекты, которые станут очевидными из следующего подробного описания, были достигнуты открытием авторами изобретения того факта, что соединения формулы где R1, R2, R3 и R8 имеют определенные ниже значения, их стереоизомерные формы, смеси стереоизомерных форм или фармацевтически приемлемые соли являются эффективными ингибиторами обратной транскриптазы. Подробное описание предпочтительных вариантов изобретения[1] Таким образом, в первом варианте,данное изобретение относится к новому соединению формулы I или его стереоизомеру или фармацевтически приемлемой соли, гдеR3 каждый независимо выбран из C1-4 алкила, ОН, C1-4-алкокси, F, Cl, Вr, I, NR5R5a,NO2, CN, C(O)R6, NHC(O)R7 и NHC(О)NR5R5a; альтернативно, если присутствуют два заместителя R3 и они присоединены к соседним атомам углерода, то они могут соединяться с образованием -ОСН 2 О-;R5 и R5a независимо выбраны из Н и C1-3 алкила;[2] В предпочтительном варианте, данное изобретение относится к новому соединению формулы I, гдеR3 каждый независимо выбран из C1-4 алкила, ОН, C1-4-алкокси, F, Cl, Br, I, NR5R5a,NO2, CN, C(O)R6, NHC(O)R7 и NHC(О)NR5R5a; альтернативно, если присутствуют два заместителя R3 и они присоединены к соседним атомам углерода, то они могут соединяться с образованием -ОСН 2 О-;R5 и R5a независимо выбраны из Н и СН 3 и С 2 Н 5;R7 выбран из СН 3; С 2 Н 5, ОСН 3 и ОС 2 Н 5;[3] В более предпочтительном варианте,данное изобретение относится к новому соединению формулы I, гдеR3 каждый независимо выбран из C1-3 алкила, ОН, C1-3-алкокси, F, Cl, Br, I, NR5R5a,NO2, CN, C(O)R6, NHC(O)R7 и NHC(О)NR5R5a; альтернативно, если присутствуют два заместителя R3 и они присоединены к соседним атомам углерода, то они могут соединяться с образованием -OCH2O-;R5 и R5a независимо выбраны из Н, СН 3 и С 2 Н 5;R7 выбран из СН 3, C2H5; ОСН 3 и ОС 2 Н 5;[4] В еще более предпочтительном варианте, данное изобретение относится к новому соединению формулы I, гдеR3 каждый независимо выбран из C1-3 алкила, ОН, C1-3-алкокси, F, Cl, NR5R5a, NO2,CN, C(O)R6, NHC(O)R7 и NHC(O)NR5R5a; альтернативно, если присутствуют два заместителя R3 и они присоединены к соседним атомам углерода, то они могут соединяться с образованием -ОСН 2 О-;R4 выбран из циклопропила, замещенного 0-1 R3, фенила, замещенного 0-2 R3 и 5-6 членной гетероциклической системы, содержащей 1-3 гетероатома, выбранных из О, N и S,замещенной 0-1 R3, где гетероциклическая система выбрана из 2-пиридила, 3-пиридила, 4 пиридила, 2-фуранила, 3-фуранила, 2-тиенила,3-тиенила, 2-оксазолила, 2-тиазолила, 4 изоксазолила и 2-имидазолила;R5 и R5a независимо выбраны из Н и СН 3 и С 2 Н 5;R7 выбран из СН 3, С 2 Н 5, ОСН 3, и ОС 2 Н 5;[5] В следующем предпочтительном варианте, соединение имеет формулу Iа[6] Еще в одном предпочтительном варианте, соединение имеет формулу Ib(-)-6-хлор-4-Е-циклопропилэтенил-4 трифторметил-3,4-дигидро-2(1 Н)-хиназолинон или его фармацевтически приемлемую соль.[8] Во втором варианте, данное изобретение относится к новому соединению формулы II или его стереоизомеру или фармацевтически приемлемой соли гдеR5 и R5a независимо выбраны из Н и C1-3 алкила;[9] В другом предпочтительном варианте,данное изобретение относится к новому соединению формулы II, гдеR5 и R5a независимо выбраны из Н, СН 3 и С 2 Н 5;R7 выбран из СН 3, С 2 Н 5, ОСН 3 и ОС 2 Н 5;[10] Еще в одном предпочтительном варианте, соединение имеет формулу IIа[11] Еще в одном предпочтительном варианте, соединение имеет формулу IIb[12] В следующем более предпочтительном варианте соединение формулы II выбрано из группы, включающей(+)-5,6-дифтор-4-этилэтинил-4 трифторметил-3,4-дигидро-2(1H)-хиназолинон или его фармацевтически приемлемую соль. В третьем варианте данное изобретение относится к новой фармацевтической композиции, содержащей фармацевтически приемлемый 9 носитель и терапевтически эффективное количество соединения формулы I и II или его фармацевтически приемлемой соли. В четвертом варианте данное изобретение относится к новому способу лечения инфекции ВИЧ, включающему введение хозяину, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулыI или II или его фармацевтически приемлемой соли. В пятом варианте данное изобретение относится к новому способу лечения инфекции ВИЧ, включающему введение, в сочетании, хозяину, нуждающемуся в таком лечении, терапевтически эффективного количества:(b) по меньшей мере, одного соединения,выбранного из группы, включающей ингибиторы обратной транскриптазы ВИЧ и ингибиторы протеазы ВИЧ. В другом предпочтительном варианте, ингибитор обратной транскриптазы выбран изAZT, ЗТС, ddI, ddC, d4T, делавирдина, производных TIBO, BI-RG-587, невирапина, L-697 661, LY 73497, Ro 18893, ловирида, тровирдина,МКС-442 и HBY 097, а ингибитор протеазы выбран из саквинавира, ритонавира, индинавира,VX-478, нелфинавира, KNI-272, CGP-61755, U140690 и АВТ-378. В еще более предпочтительном варианте,ингибитор обратной транскриптазы выбран изAZT и ЗТС, а ингибитор протеазы выбран из саквинавира, ритонавира, нелфинавира и индинавира. И в еще более предпочтительном варианте,ингибитором обратной транскриптазы являетсяAZT. В следующем предпочтительном варианте,ингибитором протеазы является индинавир. В шестом варианте, данное изобретение относится к фармацевтическому набору, для лечения инфекции ВИЧ, который содержит терапевтически эффективное количество:(b) по меньшей мере, одного соединения,выбранного из группы, включающей ингибиторы обратной транскриптазы ВИЧ и ингибиторы протеазы ВИЧ, в одном или нескольких стерильных контейнерах. В седьмом варианте данное изобретение относится к новому способу ингибирования ВИЧ, присутствующего в образце жидкости тела, включающему обработку этого образца жидкости тела эффективным количеством соединения формулы I или II. В восьмом варианте данное изобретение относится к новому набору или контейнеру,содержащему соединение формулы I или II в количестве, эффективном для применения в качестве стандарта или реагента в тесте или анализе для определения способности потенциального фармацевтического средства ингибиро 001991 10 вать обратную транскриптазу ВИЧ, рост ВИЧ или и то, и другое. Определения Используемые в описании следующие термины и выражения имеют указанные значения. Должно быть понятно, что соединения данного изобретения содержат асимметрически замещенный атом углерода и могут быть выделены в оптически активной или рацемической формах. В данной области хорошо известно, как получить оптически активные формы, например, разделением рацемических форм или при помощи синтеза из оптически активных исходных материалов. Все хиральные, диастереомерные, рацемические формы и все геометрические изомерные формы структуры имеются в виду,если специально не указаны определенная стереохимия или изомерная форма. Предполагается, что способы данного изобретения должны применяться на практике, по меньшей мере, в мультиграммовом, килограммовом, мультикилограммовом или в промышленном масштабе. Мультиграммовый масштаб,как используется здесь, предпочтительно, представляет собой масштаб, в котором, по меньшей мере, одно исходное вещество присутствует в количестве 10 или более граммов, более предпочтительно, по меньшей мере, в количестве 50 или более граммов, даже более предпочтительно в количестве, по меньшей мере, 100 или более граммов. Мультикилограммовый масштаб,как используется здесь, означает масштаб, в котором используют более одного килограмма,по меньшей мере, одного исходного вещества. Промышленный масштаб, как используется здесь, означает масштаб, который отличается от лабораторного масштаба и который является достаточным для производства продукта, достаточного либо для клинических тестов, либо для доставки потребителям. Используемый здесь термин алкил включает насыщенные алифатические углеводородные группы как с разветвленной, так и с прямой цепью, имеющие указанное число атомов углерода. Примеры алкила включают, но не ограничиваются ими, метил, этил, н-пропил,изопропил, н-бутил, втор-бутил, трет-бутил, нпентил и втор-пентил. Галогеналкил включает насыщенные алифатические углеводородные группы, как с разветвленной, так и с прямой цепью, имеющие указанное число атомов углерода, замещенные одним или более атомами галогена (например, -CvFw, где v=1-3 и w=1(2v+l. Примеры галогеналкила включают, но не ограничиваются ими, трифторметил, трихлорметил, пентафторэтил и пентахлорэтил. Алкокси обозначает алкильную группу, определенную выше, с указанным числом атомов углерода, присоединенную через кислородный мостик. Примеры алкокси включают, но не ограничиваются ими, метокси, этокси, нпропокси, изопропокси, н-бутокси, втор 11 бутокси, трет-бутокси, н-пентокси и вторпентокси. Циклоалкил включает насыщенные кольцевые группы, такие как циклопропил, циклобутил или циклопентил. Алкенил включает углеводородные цепи прямой или разветвленной конфигурации с одной или несколькими ненасыщенными связями углерод-углерод, которые могут располагаться в любой стабильной точке вдоль цепи, такие как этенил, пропенил и т.д. Алкинил включает углеводородные цепи прямой или разветвленной конфигурации с одной или более тройными связями углеродуглерод, которые могут располагаться в любой стабильной точке вдоль цепи, такие как этинил,пропинил и т.д. Гало или галоген как используется здесь, относится к фтору, хлору, брому и иоду. Термин противоион используют для обозначения небольших, отрицательно заряженных молекул, таких как хлорид, бромид, гидроксид,ацетат, сульфат и т.п. Используемый здесь термин арил или ароматический остаток обозначает ароматическую часть молекулы, содержащую указанное число атомов углерода, такую как фенил или нафтил. Используемый здесь термин карбоцикл или карбоциклический остаток предназначен для обозначения любого стабильного 35-членного моноциклического кольца, которое может быть насыщенным или частично ненасыщенным. Примеры таких карбоциклов включают, но не ограничиваются ими, циклопропил,циклопентил, циклогексил, фенил, бифенил,нафтил, инданил, адамантил или тетрагидронафтил (тетралин). Используемый здесь термин гетероцикл или гетероциклическая система предназначен для обозначения стабильного 5-6-членного моноциклического гетероциклического кольца,которое является насыщенным, частично ненасыщенным или ненасыщенным (ароматическим) и которое состоит из атомов углерода и из 1-3 гетероатомов, независимо выбранных из группы, состоящей из N, О и S. Гетероатомы азота и серы могут быть необязательно окисленными. Гетероциклическое кольцо может быть присоединено к его боковой группе по любом гетероатому или атому углерода, что приводит к стабильной структуре. Описанные здесь гетероциклические кольца могут быть замещенными по атому углерода или по атому азота, если полученное соединение является стабильным. Если нет других указаний, азот в гетероцикле может необязательно быть кватернизированным. Предпочтительно, чтобы, когда общее число атомов S и О в гетероцикле превышает 1, эти гетероатомы не являлись соседними относительно друг друга. Предпочтительно, чтобы общее число атомов S и О в гетероцикле не превышало 1. Используемый здесь термин ароматическая гетероциклическая система предназначен для обозначения стабильного 5-6 001991 12 членного моноциклического гетероциклического ароматического кольца, которое состоит из атомов углерода и из 1-3 гетероатомов, независимо выбранных из группы, состоящей из N, О и S. Предпочтительно общее число атомов S и О в ароматическом гетероцикле не превышает 1. Примеры гетероциклов включают, но не ограничиваются ими, 2-пирролидонил, 2 Нпирролил, 4-пиперидонил, 6 Н-1,2,5-тиадиазинил, 2 Н,6 Н-1,5,2-дитиазинил, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, изоксазолил, морфолинил, оксадиазолил,1,2,3-оксалиазолил, 1,2,4-оксадиазолил, 1,2,5 оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, пиперазинил, пиперидинил,птеридинил, пиперидонил, 4-пиперидонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, пирролил, тетрагидрофуранил, 6 Н-1,2,5-тиадиазинил, 1,2,3-тиадиазолил,1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4 тиадиазолил, тиазолил, тиенил, тиенотиазолил,тиенооксазолил, тиеноимидазолил, тиофенил,триазинил, 1,2,3-триазолил, 1,2,4-триазолил,1,2,5-триазолил и 1,3,4-триазолил. Предпочтительные гетероциклы включают в себя, но не ограничиваются ими, пиридинил, фуранил, тиенил, пирролил, пиразолил, имидазолил и оксазолидинил. Также включены конденсированные кольцевые и спиросоединения, содержащие,например, вышеупомянутые гетероциклы. Используемый здесь термин ингибитор обратной транскриптазы ВИЧ предназначен для обозначения как нуклеозидных, так и ненуклеозидных ингибиторов обратной транскриптазы ВИЧ (ОТ). Примеры нуклеозидных ингибиторов ОТ включают, но не ограничиваются ими,AZT, ddC, ddI, d4T и ЗТС. Примеры ненуклеозидных ингибиторов ОТ включают, но не ограничиваются ими, делавирдин (Pharmacia и Upjohn U90152S), производные TIBO, BI-RG-587,невирапин (Boehringer Ingelheim), L-697661, LY 73497, Ro 18893 (Roche), ловирид (Janssen), тровирдин (Lilly), MKC-442 (Triangle) и HBY 097(Hoechst). Используемый здесь, ингибитор протеазы ВИЧ предназначен для обозначения соединений, которые ингибируют протеазу ВИЧ. Примеры включают, но не ограничиваются ими,саквинавир (Roche, Ro31-8959), ритонавир (Abbott, ABT-538), индинавир (Merck, МК-639),VX-478 (Vertex/Glaxo Wellcome), нелфинавирUpjohn) и АВТ-378. Дополнительные примеры включают циклические ингибиторы протеазы,описанные в WO 93/07128, WO 94/19329, WO 94/22840 и заявке РСТUS 96/03426. Используемый здесь термин фармацевтически приемлемые соли относится к производным описанных соединений, когда исходное 13 соединение модифицировано получением его солей с кислотами или основаниями. Примеры фармацевтически приемлемых солей включают,но не ограничиваются ими, соли минеральных или органических кислот основных остатков,таких как амины; соли со щелочами или органическими кислотами кислотных остатков, таких как карбоновые кислоты; и т.п. Фармацевтически приемлемые соли включают общепринятые нетоксичные соли или соли четвертичного аммония исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, такие общепринятые нетоксичные соли включают соли,образованные из неорганических кислот, таких как хлористоводородная, бромистоводородная,серная, сульфамовая, фосфорная, азотная кислота и т.п.; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая,сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая,этандисульфоновая, щавелевая, изэтионовая и т.п. Фармацевтически приемлемые соли данного изобретения могут быть синтезированы из исходного соединения, которое содержит основную или кислотную группу, общепринятыми химическими способами. Обычно такие соли могут быть получены реакцией свободной кислоты или свободного основания этих соединений со стехиометрическим количеством подходящих основания или кислоты в воде или в органическом растворителе или в их смеси; обычно предпочтительны неводные среды, подобные эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу. Перечни подходящих солей можно найти в Remington 's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton,PA, 1985, p. 1418, описание которой включено здесь в качестве ссылки. Фраза фармацевтически приемлемые применяется здесь в отношении соединений,материалов, композиций и/или дозированных лекарственных форм, которые, с точки зрения медицинской практики, пригодны для применения в контакте с тканями человека и животных без избыточной токсичности, раздражения, аллергической реакции или иных проблем или осложнений, соразмерно с разумным соотношением пользы/риска. Пролекарства включают любые ковалентно связанные носители, которые высвобождают активное исходное лекарственное средство формулы (I) или других формул или соединения данного изобретения in vivo при введении такого Пролекарства субъекту-млекопитающему. Пролекарства соединения данного изобретения,например, формулы (I), получают модификаци 001991 14 ей функциональных групп, присутствующих в этом соединении, таким образом, что эти модификации расщепляются, либо обычным манипулированием, либо in vivo, до исходного соединения. Пролекарства включают соединения данного изобретения, в которых гидрокси- или аминогруппа связана с любой группой, которые,при введении пролекарства субъекту - млекопитающему, расщепляются с образованием свободной гидроксигруппы или свободной аминогруппы, соответственно. Примеры пролекарств включают, но не ограничиваются ими, ацетатные, формиатные и бензоатные производные функциональных спиртовых групп или аминогрупп в соединениях данного изобретения и т.д. Термины стабильное соединение и стабильная структура используют для соединения,которое является достаточно устойчивым при выделении до приемлемой степени чистоты из реакционной смеси и приготовлении его в виде эффективного терапевтического агента. Только стабильные соединения рассматриваются данным изобретением. Термин замещенный используют для указания, что один или несколько водородов у атома, указанного в выражении с использованием термина замещенный, заменены группой,выбранной из указанных групп, при условии,что не превышается нормальная валентность указанного атома и что это замещение приводит к стабильному соединению. Когда заместитель представляет собой кетогруппу (т.е. =0), замещаются 2 водорода у этого атома. Термин терапевтически эффективное количество предназначено для обозначения количества соединения данного изобретения или количества комбинации соединений, заявленных в качестве эффективных для ингибирования инфекции ВИЧ или для лечения симптомов инфекции ВИЧ у хозяина. Эта комбинация соединений предпочтительно является синергитической комбинацией. Синергизм, как описано,например, Chou and Talalay, Adv. Enzyme Regul. 22:27-55 (1984), имеет место, когда эффект (в этом случае, ингибирование репликации ВИЧ) соединений при введении в комбинации больше, чем аддитивный эффект этих соединений при введении отдельно в виде единственных агентов. Как правило, синергитический эффект наиболее четко демонстрируется при субоптимальных концентрациях соединений. Синергизм может быть выражен в более низкой цитотоксичности, увеличенном антивирусном действии или в некотором другом полезном эффекте комбинации в сравнении с эффектом индивидуальных компонентов. Синтез Соединения данного изобретения могут быть получены рядом способов, хорошо известных специалистам в области органического синтеза. Соединения данного изобретения могут быть синтезированы с использованием спосо 15 бов, описанных ниже, вместе со способами синтеза, известными в области синтетической органической химии, или их вариаций, как это понятно специалистам в этой области. Предпочтительные способы включают, но не ограничиваются ими, способы, описанные ниже. Каждая из ссылок, указанных ниже, включена в качестве ссылки. Схема 1 Схема 1 иллюстрирует способ получения кетоанилинов из подходящим образом замещенной 2-аминобензойной кислоты. Эту кислоту превращают в ее N-метокси-N-метиламидное производное, которое затем может быть замещено с получением R1-замещенного кетона. Кетоанилины являются приемлемыми промежуточными продуктами для заявленных здесь соединений. Схема 2 Схема 2 описывает другой способ получения кетоанилинов, на этот раз из подходящим образом замещенного анилина. После иодинирования и защиты аминогруппы, такая группа, как трифторметил, может быть введена с использованием сильного основания и этилтрифторацетата. Удаление защитной группы дает кетоанилин. Дополнительные способы получения кетоанилинов известны специалистам в этой области, например, Houpis et al, Tetr. Lett. 1994, 35(37), 6811-6814, которая включена сюда в качестве ссылки. Схема 3 Другой способ получения 2-трифторацетиланилинов показан на схеме 3. После образования защищенного анилина амид восстанавливают и присоединяют трифторметильную группу. Окисление окислителем, таким как 16 МnO2, дает приемлемый промежуточный продукт. Схема 4 При помощи общего способа, подробно представленного на схеме 4, можно получить соединения данного изобретения. Кетоанилин 1,который может быть получен способами, описанными на схемах 1 и 2, обрабатывают триметилсилилизоцианатом в сухом тетрагидрофуране в присутствии диметиламинопиридина и затем фторидом тетрабутиламмония с получением гидроксимочевины 2. Затем гидроксимочевину 2 дегидратируют дегидратирующим агентом, таким как молекулярные сита 4, в кипящем с обратным холодильником толуоле или ксилолах с получением кетимина 3. Замещенную ацетиленовую группу R2 присоединяют обработкой кетимина 3 ацетиленидом лития,который получают в отдельном сосуде реакцией соответствующего замещенного ацетилена с нбутиллитием в сухом тетрагидрофуране, с получением 4,4-дизамещенного 3,4-дигидро-2(1 Н)хиназолинона 4, соединения формулы I. Ацетиленовая (тройная) связь соединения 4 может быть восстановлена, например, каталитическим гидрированием, с получением соответствующей алкенильной группы (не показано) или насыщенного соединения 5. Другие группы R2 могут быть также введены непосредственно реакцией имина 3 с литиатом R2Li или реагентом Гриньяра R2MgX в присутствии или в отсутствие кислоты Льюиса в качестве катализатора, такой как ВF3-эфират. См. также Huffman et al, J. Org. Chem. 1995, 60,1590-1594, содержание которой включено сюда в качестве ссылки. В некоторых случаях, один энантиомер соединения формулы I или II может проявлять преобладающую активность в сравнении с другим. При необходимости, разделение рацемического материала может быть достигнуто при помощи ЖХВD с применением хиральной колонки, как описано в примерах 27-34 (схема 4),или разделением с использованием разделяющего агента, такого как хлорангидрид камфоновой кислоты, как описано в Thomas J. Tucker, etal, J. Med. Chem. 1994, 37, 2437-2444. Хиральное соединение формулы I может быть также непо 17 средственно синтезировано с использованием хирального катализатора или хирального лиганда, например, как описано в Mark A. Huffman, etal, J. Org. Chem. 1995, 60, 1590-1594. Другие признаки изобретения станут очевидными из следующего описания конкретных примеров, которые даны для иллюстрации изобретения, но не предназначены для ограничения его объема. Примеры Аббревиатуры, используемые в примерах,расшифровываются следующим образом: С градусы Цельсия, д -дублет, дд -дублет дублетов, экв - эквивалент или эквиваленты,г - грамм или граммы, мг - миллиграмм или миллиграммы, мл - миллилитр или миллилитры, Н - водород или водороды, ч - час или часы, м - мультиплет, М - молярный, мин- минута или минуты, МГц - мегагерц, MSмасс-спектроскопия, ямр или ЯМР -ЯМРспетроскопия, т - триплет, ТСХ - тонкослойная хроматография, EDAC - гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, DIPEA - диизопропилэтиламин, TBAF фторид тетрабутиламмония, LAH - литийалюминийгидрид и TEA - триэтиламин. Пример 1. Получение (+/-)-6-хлор-4 циклопропилэтинил-4-трифторметил-3,4 дигидро-2(1 Н)-хиназолинона (R4 = циклопропил) Стадия 1. Синтез II-а из I-а. К раствору соединения I-а (4,55 г, 20,2 ммоль) в безводном ТГФ (40 мл) добавляли диметиламинопиридин (0,25 г, 2,02 ммоль) и триметилсилилизоцианат (6,05 г, 7,11 мл, 52,5 ммоль). Смесь перемешивали при комнатной температуре в течение приблизительно 16 ч,затем добавляли фторид тетрабутиламмония (21 мл 1 М раствора в ТГФ). Густую суспензию разбавляли дополнительным количеством ТГФ (20 мл) и перемешивали при комнатной температуре в течение 0,5 ч. ТГФ удаляли при пониженном давлении, остаток помещали в EtOAc (100 мл) и промывали последовательно 1 н. НСl (70 мл), насыщенным водным раствором NaHCO3(70 мл) и насыщенным водным NaCl (50 мл). Органическую фазу сушили над МgSO4, фильтровали и концентрировали при пониженном давлении с получением светложелтого твердого вещества. Желтый цвет удаляли растиранием с гексаном с получением II-а (5,09 г, 94%) в виде белого твердого вещества. 1m/e 266 (MH+, 100). Стадия 2. Синтез III-а из II-a. Суспензию II-a (5,09 г, 19,1 ммоль) в толуоле (150 мл), содержащую молекулярные сита 4 А (приблизительно 100 мг), кипятили с обратным холодильником в течение 16 ч. Полученный прозрачный желтый раствор охлаждали до комнатной температуры, осажденные твердые вещества растворяли в ацетоне и молекулярные сита удаляли фильтрованием в вакууме. Фильтрат концентрировали при пониженном давлении и растирали с гексанами с получением III-а (4,25 г, 89%) в виде желтого твердого вещества. 1(м, 2 Н), 7,61 (д, J=8,8 Гц, 1 Н); 19F-ЯМР (282 МГц, ацетон-d6)-67,88. Стадия 3. Синтез IV-a из III-a. Раствор циклопропилацетилена (13,0 мл 30 мас.% раствора в смеси толуол/ТГФ/гексаны,59,0 ммоль) в безводном ТГФ (118 мл) охлаждали до -78 С, обрабатывали н-BuLi (32,8 мл 1,6 М раствора в гексанах, 52,4 ммоль), нагревали до 0 С в бане со льдом и выдерживали в течение 0,5 ч. К раствору III-a (3,12 г, 12,6 ммоль) в безводном ТГФ (66 мл) при -70 С добавляли ацетиленид лития на протяжении приблизительно 10 мин. Затем добавляли эфират трифторида бора (0,89 г, 0,80 мл, 6,28 ммоль) с последующим удалением охлаждающей бани. Реакции давали достичь комнатной температуры и перемешивали при комнатной температуре в течение 4 ч перед гашением 1 М лимонной кислотой (100 мл). Смесь концентрировали при пониженном давлении до 1/2 первоначального объема, разбавляли EtOAc (200 мл), водную фазу удаляли и органическую фазу последовательно промывали насыщенным водным раствором NаНСО 3 (100 мл) и насыщенным водным NaCl (100 мл). Органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный материал очищали флэш-хроматографией (3%MeOH/CH2Cl2) с получением густого желтого масла, из которого получали кристаллическийIV-a (R4 = циклопропил) (3,85 г, 97%) в виде белого твердого вещества. Т.пл. 86,6-88 С. 1 19 Пример 2. Получение (+/-)-6-хлор-4 изопропилэтинил-4-трифторметил-3,4-дигидро 2(1H)-хиназолинона (R4 = изопропил). Раствор III-a (50 мг, 0,201 ммоль) обрабатывали ацетиленидом лития, полученным из 3 метил-1-бутина (62 мг, 93 мл, 0,905 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали флэш-хроматографией (35% EtOAc/гексаны) с получение 26 мг (41%) целевого продукта. 1C14H12ClF3N2O: 317,066851, найдено 317,069433; 317 (MH+, 43), 334 (M+NH4+, 100). Пример 3. Получение (+/-)-6-хлор-4-(2 пиридил)этинил-4-трифторметил-3,4-дигидро 2(1H)-хиназолинона (R4 = 2-пиридил). Раствор III-a (100 мг, 0,402 ммоль) обрабатывали ацетиленидом лития, полученным из 2 этинилпиридина (0,19 г, 1,81 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали ЖХВД (2,5% MeOH/CH2Cl2) с получением 85 мгC16H9ClF3N3O0,125 Н 2 О: С, 54,3; Н, 2,56; N,11,9; найдено: С, 54,71; Н, 3,03, N, 11,3. Пример 4. Получение (+/-)-6-хлор-4 этилэтинил-4-трифторметил-3,4-дигидро-2(1 Н)хиназолинона (R4 = этил). Раствор III-a (100 мг, 0,402 ммоль) обрабатывали ацетилени-дом лития, полученным из 1 бутина (109 мг, 2,01 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали ЖХВД (2,5% 20 Раствор III-a (100,мг, 0,402 ммоль) обрабатывали ацетиленидом лития, полученным из фенилацетилена (185 мг, 1,8 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали ЖХВД (2,5% МеОН/СН 2 Сl2) с получением 54 мг Стадия 1. Синтез VI-a из V-a. Раствор V-a (0,50 г, 2,28 ммоль) обрабатывали диметиламинопиридином и триметилсилилизоцианатом, как описано для стадии 1 примера 1, с получением 0,58 г (97%) целевого продукта; 1F-ЯМР (282 МГц, ацетон-d6)-85,99. Стадия 2. Синтез VII-a из VI-a. Раствор VI-a (0,58 г, 2,21 ммоль) кипятили в толуоле с обратным холодильником как описано для стадии 2 примера 1, с получением 0,50 г (93%) целевого продукта: 1F-ЯМР (282 МГц, ацетон-d6)-68,08. Стадия 3. Синтез VIII-a из VII-a. Раствор VII-a (100 мг, 0,410 ммоль) обрабатывали ацетиленидом лития, полученным из циклопропилацетилена (0,41 мл 30 мас.% раствора в смеси толуол/ТГФ/гексаны, 1,85 ммоль) в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали ЖХВД (2,5% МеОН/СН 2 Сl2) с получением 103 мг (81%) целевого продукта. 1MS (CI) m/е рассчитано для С 15 Н 14F3N2 О 2: 311,100738, найдено 311,099970; 311 (МН+,100). Пример 7. Получение (+/-)-4-изопропилэтинил-6-метокси-4-трифторметил-3,4-дигидро 2(1 Н)-хиназолинона (R4= изопропил). Раствор VII-a (100 мг, 0,410 ммоль) обрабатывали ацетиленидом лития, полученным из 3-метил-1-бутина (126 мг, 0,19 мл, 1,85 ммоль) в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали флэш-хроматографией (2,5% МеОН/СН 2 Сl2) с получением 30 мг (24%) целевого продукта: т.пл.228-229 С; 1C15H15F3N2O2: С 57,69; Н 4,84; N 8,97; найдено: С 57,74; Н 5,01; N 8,57. Пример 8. Получение (+/-)-6-метокси-4-(2 пиридил)этинил-4-трифторметил-3,4-дигидро 2(1 Н)-хиназолинона (R4 = 2-пиридил). Раствор VII-а (100 мг, 0,410 ммоль) обрабатывали ацетиленидом лития, полученным из 2-этинилпиридина (0,19 г, 1,85 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали флэш-хроматографией (2,5% MeOH/CH2Cl2) с получением 56 мг (39%) целевого продукта: 1MS (CI) m/e рассчитано для C17H13F3N3O2: 348,095987, найдено 348,095629; 348 (МН+,100); Элементный анализ: рассчитано для С 17 Н 12F3N3O20,25 С 3 Н 6 О: 58,92; Н 3,76; N 11,61; найдено: С 59,38; Н 4,04; N 11,35. Пример 9. Получение (+/-)-6-метокси-4 фенилэтинил-4-трифторметил-3,4-дигидро 2(1 Н)-хиназолинона (R4 = фенил). Раствор VII-a (100 мг, 0,410 ммоль) обрабатывали ацетиленидом лития, полученным из фенилацетилена (0,19 г, 1,85 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали флэшхроматографией (2,5% MeOH/CH2Cl2) с получе 19 Стадия 1. Синтез Х-а из IХ-а. Раствор IХ-а (6,46 г, 28,7 ммоль) обрабатывали диметиламинопиридином и триметилсилилизоцианатом, как описано для стадии 1 примера 1, с получением 6,74 г (88%) целевого продукта. 1F-ЯМР (282 МГц, ацетон-d6)-86,6 (д,17,2, 3), -137,52-137,68 (м, 1), -148,47-148,59 (м,1). Стадия 2. Синтез XI-a из Х-а. Раствор Х-а (6,74 г, 25,1 ммоль) кипятили в ксилолах с обратным холодильником, как описано для стадии 2 примера 1, с заменой толуола на ксилолы, с получением 6,3 г (100 %) целевого продукта. 1F-ЯМР (282 МГц, ацетон-d6)-70,7 (д,38,7, 3), -136,72 (с, 1), -146,47-146,57 (м, 1). Стадия 3. Синтез XII-a из XI-a. Раствор XI-a (6,28 г, 25,1 ммоль) обрабатывали ацетиленидом лития, полученным из циклопропилацетилена (24,9 мл 30 мас.% раствора в смеси толуол/ТГФ/гексаны, 0,113 моль),в соответствии с методикой стадии 3 примера 1. Полученное неочищенное желтое масло растворяли в ацетоне и концентрировали при пониженном давлении с получением желтого твердого вещества. Кристаллизация из ацетона давала 5,98 г (75%) целевого вещества. Т. пл. 86,588,5 С.C14H9F5N2O: С 53,17; Н 2,88; N 8,87; найдено: С 53,30; Н 3,16; N 8,53. Пример 11. Получение (+/-)-5,6-дифтор-4 изопропилэтинил-4-трифторметил-3,4-дигидро 2(1 Н)-хиназолинона (R4 = изопропил). Раствор XI-a (7,24 г, 28,9 ммоль) обрабатывали ацетиленидом лития, полученным из 3 метил-1-бутина (8,87 г, 13,3 мл, 0,130 моль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали флэш-хроматографией (2,5% MeOH/CH2Cl2) с получением желтого масла. Кристаллизация из ацетона давала 6,77 г (74%) целевого продукта. Т. пл. 79-80 С. 1MS (CI) m/e рассчитано для C14H12F5N2O: 319,086979, найдено 319,087376; 319 (МН+,100), 336 (М + NH4+, 76). Пример 12. Получение (+/-)-5,6-дифтор-4(2-пиридил) этинил-4-трифторметил-3,4-дигидро-2(1 Н)-хиназолинона (R4 = 2-пиридил). Раствор ХI-а (100 мг, 0,40 ммоль) обрабатывали ацетиленидом лития, полученным из 2 этинилпиридина (0,19 г, 1,80 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали флэшхроматографией (4% МеОН/СН 2 Сl2) с получением 83 мг (59%) целевого продукта. Т. пл. 219220 С. 1 24 Пример 13. Получение (+/-)-5,6-дифтор-4 этилэтинил-4-трифторметил-3,4-дигидро-2(1 Н)хиназолинона (R4 = 2-этил). Раствор ХI-а (100 мг, 0,400 ммоль) обрабатывали ацетиленидом лития, полученным из 1 бутина (97 мг, 1,80 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали ЖХВД (2,5%C13H9F5N2O: С, 51,33; Н, 2,98; N, 9,22; найдено: С, 51,00; Н, 2,79; N, 8,99. Пример 14. Получение (+/-)-5,6-дифтор-4 фенилэтинил-4-трифторметил-3,4-дигидро 2(1H)-хиназолинона (R4 = фенил). Раствор XI-a (100 мг, 0,400 ммоль) обрабатывали ацетиленидом лития, полученным из фенилацетилена (0,18 г, 0,20 мл, 1,80 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали ЖХВД (2,5% MeOH/CH2Cl2) с получением 92 мгMS (CI) m/e рассчитано для С 17 Н 10F5N2O: 353,071329, найдено 353,071716; 353 (МН+, 42),370 (М+NH4+, 100). Пример 15. Получение (+/-)-5,6-дифтор-4 изопентил-4-трифторметил-3,4-дигидро-2(1H)хиназолинона (R4 = изопропил). Синтез XIII-a из XII-a. Раствор XIII-a (R4 = изопропил) (26 мг, 82 ммоль) в этаноле (1 мл) и EtOAc (0,5 мл) обрабатывали 10% Pd на угле (35 мг) под Н 2 (1 амт) в течение 16 ч. Катализатор удаляли вакуумфильтрованием через целит и фильтровальный осадок промывали EtOAc. Объединенные фильтраты концентрировали при пониженном давлении с получением 26 мг (100%) целевого продукта. Дополнительная очистка не требовалась. 1 Стадия 1. Синтез XV-a из XIV-a. Раствор XIII-a (3,07 г, 14,8 ммоль) обрабатывали диметиламинопиридином и триметилсилилизоцианатом, как описано для стадии 1 примера 1, с получением 2,81 г (76%) целевого продукта. Стадия 2. Синтез XVI-a из XV-a. Раствор XV-a (6,74 г, 25,1 ммоль) кипятили в толуоле с обратным холодильником, как описано для стадии 2 примера 1, с получением 0,73 г (94%) целевого продукта. Стадия 3. Синтез XVII-а из XVI-a. Раствор XVI-a (100 мг, 0,431 ммоль) обрабатывали ацетиленидом лития, полученным из циклопропилацетилена (1,43 мл 30 мас.% раствора в смеси толуол/ТГФ/гексаны, 1,94 ммоль) в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищалиMS (CI) m/e рассчитано для C14H11F4N2O: 299,080751, найдено 299,079976; 299 (MH+,100). Пример 18. Получение (+/-)-6-фтор-4 изопропилэтинил-4-трифторметил-3,4-дигидро 2(1 Н)-хиназолинона (R4 = изопропил). Раствор XVI-a (100 мг, 0,431 ммоль) обрабатывали ацетиленидом лития, полученным из 3-метил-1-бутина (0,13 г, 0,20 мл, 1,94 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали ЖХВД (2,5% MeOH/CH2Cl2) с получением 24 мгMS (301) m/e рассчитано для C14H13F4N2O: 301,096401, найдено 301,096235; 301 (МН+,100). Пример 19. Получение (+/-)-6-фтор-4-(2 пиридил)этинил-4-трифторметил-3,4-дигидро 2(1 Н)-хиназолинона (R4 = 2-пиридил). Раствор XVI-a (100 мг, 0,431 ммоль) обрабатывали ацетиленидом лития, полученным из 2-этинилпиридина (0,20 г, 1,94 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали ЖХВД (2,5% MeOH/CH2Cl2) с получением 65 мгMS (CI) m/e рассчитано для С 16 Н 10F4N3 О: 336,076000, найдено 336,074156; 336 (МН+, 25). Пример 20. Получение (+/-)-6-фтор-4 этилэтинил-4-трифторметил-3,4-дигидро-2(1H)хиназолинона (R4 = этил). Раствор XVI-a (100 мг, 0,431 ммоль) обрабатывали ацетиленидом лития, полученным из 1-бутина (0,10 г, 1,94 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали ЖХВД (2,5% МеОН/СН 2 Сl2) с получением 40 мг (33%) целевого продукта. Т. пл. 190 С. 1MS (CI) m/e рассчитано для C13H11F4N2O: 287,080751, найдено 287,080740; 287 (МН+,100). Пример 21. Получение (+/-)-6-фтор-4 фторфенилэтинил-4-трифторметил-3,4-дигидро 2(1H)-хиназолинона (R4 = фенил). Раствор XVI-а (100 мг, 0,431 ммоль) обрабатывали ацетиленидом лития, полученным из фенилацетилена (0,20 г, 0,21 мл, 1,94 ммоль), в соответствии с методикой стадии 3 примера 1. Полученный неочищенный материал очищали ЖХВД (2,5% MeOH/CH2Cl2) с получением 41 мгMS (CI) m/e рассчитано для C17H11F4N2O: 335,080751, найдено 335,082057; 335 (МН+, 74),352 (МH+NH4+, 100). Пример 22. Получение (+/-)-6-фтор-4 изопентил-4-трифторметил-3,4-дигидро-2(1 Н)хиназолинона (R4 = изопропил). Синтез XVIII-а из XVII-а. Раствор XVII-а (R4 = изопропил) (26 мг, 87 ммоль) в этаноле (1 мл) и EtOHc (0,5 мл) обрабатывали 10% Pd на угле в атмосфере Н 2 в соответствии с методикой примера 15 с получением 15 мг (58%) целевого продукта. Дополнительная очистка не требовалась. Т.пл. 179 С. 1MS (CI) m/e рассчитано для C14H17F4N2O: 305,127707, найдено 305,126790; 305 (МН+,100). Пример 23. Получение (+/-)-6-фтор-4-(2'-2 пиридил)этил-4-трифторметил-3,4-дигидро 2(1H)-хиназолинона (R4 = 2-пиридил). Раствор XVII-a (R4 = 2-пиридил) (33 мг, 99 ммоль) в этаноле (1 мл) и EtOAc (0,5 мл) обрабатывали 10% Pd на угле в атмосфере H2 в соответствии с методикой примера 15 с получением 10 мг (30%) целевого продукта. Дополнительная очистка не требовалась. Т. пл. 88 С. 1MS (CI) m/e рассчитано для C16H14F4N3O: 340,107300, найдено 340,107719; 340 (МH+,100). Пример 24. Получение (+/-)-4-бутил-6 фтор-4-трифторметил-3,4-дигидро-2(1H)хиназолинона (R4 = этил). Раствор XVII-а (R4 = этил) (24 мг, 84 ммоль) в этаноле (1 мл) и EtOAc (0,5 мл) обрабатывали 10% Pd на угле в атмосфере Н 2 в соответствии с методикой примера 15 с получением 24 мг (100 %) целевого продукта. Дополнительная очистка не требовалась. Т. пл. 198 С. 1 Н-ЯМР (300 МГц, ацетон-d6)7,03-6,97MS (CI) m/e рассчитано для C13H15F4N2O: 291,112051, найдено 291,112227; 291 (МН+,100). Пример 25. Получение (+/-)-6-фтор-4 фенилэтил-4-трифторметил-3,4-дигидро-2(1H)хиназолинона (R4 = фенил). Раствор XVII-а (R4 = фенил) (30 мг, 90 ммоль) в этаноле (1 мл) и EtOAc (0,5 мл) обрабатывали 10% Pd на угле в атмосфере Н 2 в соответствии с методикой примера 15 с получением 20 мг (67%) целевого продукта. Дополнительная очистка не требовалась. Т. пл. 98 С. 1MS (CI) m/e рассчитано для C17H15F4N2O: 339,112051, найдено 339,110781; 339 (МН+,100). Пример 26. Получение (+/-)-6-фтор-4 метилпропаргил-4-трифторметил-3,4-дигидро 2(1 Н)-хиназолинона (R4 = метил). Синтез ХIХ-а из XVI-a. Раствор 2-бутина (94 мг, 1,75 ммоль) в безводном ТГФ (3,5 мл) охлаждали до 0 С, обрабатывали HBuLi (0,97 мл 1,6 М раствора в гексанах, 1,55 ммоль) и выдерживали в течение 0,5 ч. К раствору XVI-a (90 мг, 0,388 ммоль) в безводном ТГФ (1,9 мл) при -78 С добавляли литийанион на протяжении 5 мин с последующим добавлением эфирата трифторида бора (25 мл,0,194 ммоль). Охлаждающую баню удаляли и смеси давали нагреться до комнатной температуры. После 16 ч при комнатной температуре реакцию гасили добавлением 1 М лимонной кислоты (10 мл), разбавляли EtOAc (50 мл), фазы разделяли и органическую фазу промывали последовательно насыщенным водным раствором(20 мл). Полученный материал очищали ЖХВД Примеры 27 и 28. Получение (-)-6-хлор-4 циклопропилэтинил-4-трифторметил-3,4 дигидро-2(1 Н)-хиназолинона (пример 27) и (+)6-хлор-4-циклопропилэтинил-4-трифторметил 3,4-дигидро-2(1 Н)-хиназолинона (пример 28). Разделение IV-b,с из IV-a (R4 = циклопропил). Хиральная ЖХВД, с использованием колонки Chiralcel OD, 3% изопропанола, 5% СН 2 Сl2 гексанов, при температуре окружающей среды со скоростью тока 1,0 мл/мин и детектированием при 250 нм давала отделение IV-b от(пример 30). Разделение XII-b,c из XII-a (R4 = циклопропил). Хиральная ЖХВД, с использованием колонки Chiralpak AD, 5% воды и 95% метанола,при температуре окружающей среды со скоростью тока 0,8 мл/мин и детектированием при 250 нм давала отделение XII-b от ХII-с с энантиомерными избытками 100% и 99%, соответственно. XII-b: Т. пл. 187 С; []D25 +1,46(+)-5,6-дифтор-4-изопропилэтинил-4-трифторметил-3,4-дигидро-2(1 Н)-хиназолинона (пример 32) Разделение XII-b,с из XII-a (R4 = изопропил). Хиральная ЖХВД, с использованием колонки Chiralpak AD, 5% воды и 95% метанола,при температуре окружающей среды со скоро 001991 30 стью тока 0,5 мл/мин и детектированием при 250 нм давала отделение XII-b от XII-c с энантиомерными избытками 100% и 99%, соответственно.XII-b: Т. пл. 155 С; []D25 -2,14 (с=0,280,МеОН). XII-c: Т. пл. 98 С []D25+4,45 (с=0,292,МеОН). Примеры 33 и 34. Получение (-)-5,6 дифтор-4-этилэтинил-4-трифторметил-3,4 дигидро-2(1 Н)-хиназолинона (пример 33) и (+)5,6-дифтор-4-этилэтинил-4-трифторметил-3,4 дигидро-2(1 Н)-хиназолинона (пример 34). Разделение XII-b,с из XII-a (R4 = этил). Хиральная ЖХВД, с использованием колонки AS, 20% этанола и 80% гексанов, при температуре окружающей среды со скоростью тока 1,0 мл/мин и детектированием при 250 нм давала отделение XII-b от XII-c с энантиомерными избытками 100% и 99%, соответственно. К суспензии кетимина (300 мг, 1,20 ммоль) в безводном ТГФ (11 мл) при -78 С последовательно добавляли предварительно охлажденный(0 С) раствор силил-защищенного ацетиленида лития (5,40 ммоль) и BF3.0Et2 (0,60 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили добавлением 1 М лимонной кислоты и разбавляли EtOAc. Фазы разделяли, органическую фазу промывали водой, насыщенным водным раствором NаНСО 3 и насыщенным воднымNaCl. Органические экстракты сушили над МgSO4, фильтровали и концентрировали. Материал очищали ЖХВД с обычной фазой (колонка 41,4 мм Rainin Dynamax с использованием диоксида кремния 60 А 25 мл/мин): 2,5% МеОН/СН 2 Сl2 в течение 24 мин, увеличение до 30% MeOH/CH2Cl2 на протяжении 4 мин, 30%MeOH/CH2Cl2 в течение 10 мин и обратное снижение до 2,5% МеОН/СН 2 Сl2 на протяжении 2 мин. Выход защищенных промежуточных 31 продуктов составлял 47% и 32%, соответственно. Промежуточный продукт примера 35. Т. пл. 62,9-64 С; 1C19H24F5N2O2Si: m/z 435,152723, найдено 435,151149; 435 (МН+, 94), 452 (M+NH4+, 100); Анал. рассчитано для С 19H23F5N2O2Si: С,52,52; Н, 5,35; N, 6,46; найдено; С, 52,65; Н, 5,29; N, 6,31. Промежуточный продукт примера 36. 1 НЯМР (300 МГц, ацетон-d6)8,96 (шс, 1 Н), 7,50C19H23F5N2O2Si: С, 52,52; Н, 5,35; N, 6,46; найдено: С, 52,54; Н, 5,34; N, 6,69. К раствору защищенного промежуточного продукта для примера 35 (0,56 ммоль) в ТГФ(1,1 мл) добавляли TBAF (0,62 мл 1,0 М раствора в ТГФ). Полученную смесь перемешивали при комнатной температуре в течение 1 ч, разбавляли EtOAc, промывали 1 н. НСl, насыщенным водным раствором NаНСО 3 и насыщенным водным NaCl. Органический экстракт сушили над MgSO4, фильтровали и концентрировали. Материал очищали ЖХВД с обычной фазой(колонка 41,4 мм Rainin Dynamax с использованием диоксида кремния 60 А 25 мл/мин): 2,5% MeOH/CH2Cl2 в течение 24 мин, увеличение до 30% МеОН/СН 2 Сl2 на протяжении 4 мин,30% MeOH/CH2Cl2 в течение 10 мин и обратное снижение до 2,5% MeOH/CH2Cl2 на протяжении 2 мин. Соединение примера 35 выделяли с выходом 82%. Пример 35. Т. пл. 190-192 С; 1 32 Соединение примера 36 синтезировали аналогичным образом с получением указанного в заголовке соединения с выходом 88%. Т. пл. 190-191 С. 1MS (CI) рассчитано для C13H10F5N2O2: m/z 321,066244, найдено 321,065983; 321 (МН+, 58); 338 (M+NH4+, 100); Элементный анализ: рассчитано для С 13 Н 9F5N2O2: С, 48,76; Н, 2,83; N, 8,76; найдено: С, 48,84; Н, 2,76; N, 8,63. Пример 37. Получение (+)-4-Е-циклопропилэтенил-5,6-дифтор-4-трифторметил-3,4 дигидро-2(1 Н)-хиназолинона. К раствору XII-b (200 мг, 0,632 ммоль) в безводном ТГФ (1,3 мл) при комнатной температуре добавляли раствор литийалюминийгидрида (1,3 мл 1,0 М раствора в ТГФ). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили добавлением 10% NaOH (3 мл) и воды (3 мл). Смесь разбавляли EtOAc (30 мл) и фазы разделяли. Органическую фазу промывали насыщенным водным раствором NaCl, сушили надMgSO4, фильтровали и концентрировали. Указанное в заголовке соединение очищали ЖХВД с обычной фазой (колонка 41,4 мм Rainin Dynamax с использованием диоксида кремния 60 А); 2,5% MeOH/CH2Cl2 в течение 24 мин, увеличение до 30% MeOH/CH2Cl2 на протяжении 4 мин, 30% MeOH/CH2Cl2 в течение 10 мин и обратное снижение до 2,5% MeOH/CH2Cl2 на протяжении 2 мин. Т.пл 80-83 С. 1C14H11F5N2O: С 52,84; Н 3,48; N 8,80; найдено: С 53,02; Н 3,48; N 8,61. Пример 38. Получение (-)-6-хлор-4-Ециклопропилэтенил-4-трифторметил-3,4 дигидро-2(1 Н)-хиназолинона. Указанное в заголовке соединение получали, как описано в примере 37 (с IV-b в качестве исходного материала), за исключением того, что его очищали с использованием колонки Chiralcel OD при скорости тока 1,5 мл/мин в смеси 0,5% EtOH/20% CH2Cl2/79,5% гексаны. Т. пл. 87-89 С. Если нет других указаний, стереохимия (+/-). Если нет других указаний, стереохимия (+/-).
МПК / Метки
МПК: A61P 31/18, C07D 239/80, A61K 31/517
Метки: полезные, транскриптазы, качестве, вич, 4,4-дизамещенные, 3,4-дигидро-2(1н)-хиназолиноны, обратной, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-1991-44-dizameshhennye-34-digidro-21n-hinazolinony-poleznye-v-kachestve-ingibitorov-obratnojj-transkriptazy-vich.html" rel="bookmark" title="База патентов Евразийского Союза">4,4-дизамещенные 3,4-дигидро-2(1н)-хиназолиноны, полезные в качестве ингибиторов обратной транскриптазы вич</a>
Предыдущий патент: Фармацевтические композиции
Следующий патент: Способ защиты от подделки носителя информации
Случайный патент: Запорно-пломбировочное устройство












