Замещенные производные 4-фенил-4-[1н-имидазол-2-ил] пиперидина для снижения ишемического повреждения
Номер патента: 7657
Опубликовано: 29.12.2006
Авторы: Херэйгерс Поль Йоаннес Людовикус, Фернандес-Гадеа Франсиско Хавьер, Боргерс Марсель Й.М., Ленартс Йозеф Элизабет, Янссенс Франс Эдуард, Мерт Тео Франс, Гомес-Санчес Антонио, Фламенг Виллем
Формула / Реферат
1. Применение соединения общей формулы (I)
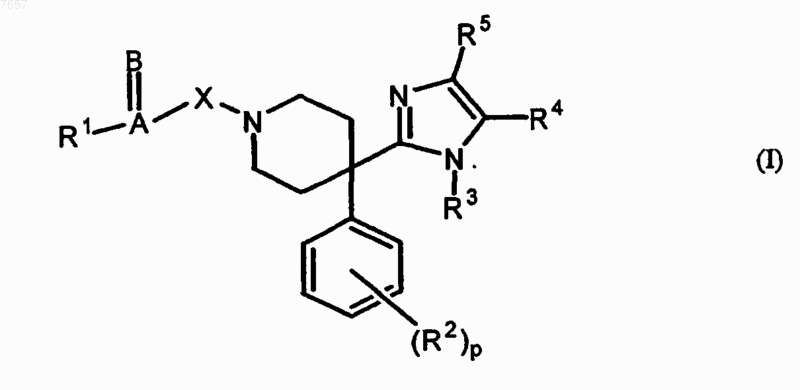
его фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм, его таутомерных форм и его N-оксидных форм, где
А=В представляет С=O, C=N-R6, где R6 представляет собой водород или циано, C=S, SO2 и C=CR7R8, где каждый R7 и R8 независимо представляет собой водород, нитро;
X представляет собой ковалентную связь или -СН2-;
R1 представляет собой водород, гидрокси, алкилокси, Ar-алкилокси, алкил, полигалогеналкил, алкилоксиалкил, Ar-алкил, Ar, пиперазинила, пирролила, тиазолила, пирролидинила или NR9R10, где каждый R9 и R10 независимо представляет водород, алкил, Ar, Ar-алкил, пиридинил или алкилоксикарбонилалкил, или А=В и R1 вместе образуют бензоксазолил, тиазолил, бензотиазолил, бензимидазолил и пиримидинил;
R2 представляет алкилокси или галоген;
R3 представляет собой алкил, Ar-алкил, Ar-карбонил, Ar-алкенил, пиридинилалкил или изоксазолалкил;
R4, R5 представляет собой водород;
р представляет собой целое число, равное 0 или 1; причем
алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный (циклоалкильный) радикал, содержащий от 3 до 7 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, содержащий от 3 до 7 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода; в котором каждый атом углерода необязательно может быть замещен оксо;
алкенил представляет собой алкильный радикал, определенный выше, содержащий одну или более двойных связей;
Ar представляет собой гомоцикл, выбранный из группы фенила и нафтила, каждый необязательно замещенный одним или более заместителями, каждый заместитель независимо выбран из группы гидрокси, алкилокси, фенилокси, полигалогеналкилокси, галогена, алкила, гидроксиалкила, полигалогеналкила, карбокси, алкилоксикарбонила, диалкиламинокарбонила, фенила, нитро, алкилтио или SO2-CH3;
галоген представляет собой заместитель, выбранный из группы фтора, хлора, брома;
полигалогеналкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, содержащий от 3 до 7 атомов углерода, в котором один или более атомов углерода замещены одним или более атомами галогена;
каждый моноциклический и бициклический гетероциклический радикал, необязательно, замещен по атому углерода и/или гетероатому алкилом или пиридинилом;
для получения лекарственного средства для снижения ишемического повреждения сердца у млекопитающего.
2. Применение по п.1, отличающееся тем, что X представляет собой ковалентную связь.
3. Применение по пп.1 и 2, отличающееся тем, что R3 выбран из группы фенилалкила и нафтила, каждый независимо замещенный по меньшей мере одним заместителем, выбранным из группы галогена, алкилоксикарбонила, гидрокси, алкилокси и диалкиламинокарбонила.
4. Применение по п.1, в котором А=В представляет собой С=O или SO2, R1 представляет собой алкилокси, алкилоксиалкил, Ar или NR9R10, где каждый R9 и R10 независимо представляет собой водород или Ar; или А=В и R1 вместе образуют бензоксазолильный радикал; р равно нулю, R3 представляет собой бензил, необязательно замещенный гидрокси, алкилом или алкилоксикарбонилом, и каждый R4 и R5 представляет собой водород.
5. Применение по п.1, отличающееся тем, что соединение выбрано из группы
1-этоксикарбонил-4-фенил-4-[1-(фенилметил)-1Н-имидазол-2-ил]пиперидин;
1-пропилоксикарбонил-4-фенил-4-[1-(фенилметил)-1Н-имидазол-2-ил]пиперидин;
1-этоксикарбонил-4-фенил-4-[1-[(4-гидроксифенил)метил]-1Н-имидазол-2-ил]пиперидин;
1-этоксикарбонил-4-фенил-4-[1-(1-фенилэтил)-1Н-имидазол-2-ил]пиперидин;
1-изопропилоксикарбонил-4-фенил-4-[1-(фенилметил)-1Н-имидазол-2-ил]пиперидин;
1-этоксикарбонил-4-фенил-4-[1-[[4-(метоксикарбонил)фенил]метил]-1Н-имидазол-2-ил]пиперидин;
1-бензоил-4-фенил-4-[1-(фенилметил)-1Н-имидазол-2-ил]пиперидин;
1-(метоксиацетил)-4-фенил-4-[1-(1-фенилэтил)-1Н-имидазол-2-ил]пиперидин;
4-[[2-(1-бензоил-4-фенил-4-пиперидинил)-1Н-имидазол-1-ил]метил]метилбензоат;
4-[[2-[1-(2-бензоксазолил)-4-фенил-4-пиперидинил]-1Н-имидазол-1-ил]метил]метилбензоат;
1-бензоил-4-фенил-4-[1-(1-фенилэтил)-1Н-имидазол-2-ил]пиперидин;
1-этоксикарбонил-4-фенил-4-[1-[1-[4-(этоксикарбонил)фенил]этил]-1Н-имидазол-2-ил]пиперидин и
N,4-дифенил-4-[1-(фенилметил)-1Н-имидазол-2-ил]-1-пиперидинсульфонамид и
[4-(1-бензил-1Н-имидазол-2-ил)-4-фенилпиперидин-1-ил]уксусная кислота.
6. Применение соединения по любому из пп.1-5 для получения лекарственного средства для индукции кардиопротекторного действия у млекопитающего.
7. Применение по п.6, отличающееся тем, что млекопитающим является человек.
Текст
007657 Настоящее изобретение относится к производным 4-фенил-4-[1 Н-имидазол-2-ил]пиперидина для снижения ишемического повреждения органа, а также к фармацевтическим композициям, включающим указанные производные пиперидина, и применению указанных производных пиперидина для профилактики и лечения ишемического повреждения органа, в особенности для снижения ишемического повреждения сердца и мозга. В объеме данной заявки ишемия определяется как снижение или утрата притока крови к ткани и связанное с этим снижение или утрата, например, снабжения кислородом ткани. В объеме данной заявки ишемическое повреждение определяется как неблагоприятные эффекты,связанные с возникновением ишемии, такие, как ишемический некроз или инфаркт. Предполагается, что метаболические события, лежащие в основе такой дегенерации клеток и гибели клеток, включают недостаточность энергии из-за снижения АТФ; ацидоз клеток; высвобождение глутамата; приток ионов кальция; стимуляцию деградации мембранных фосфолипидов и последующую аккумуляцию свободных жирных кислот; и образование свободных радикалов. Существует увеличивающаяся потребность в соединениях, которые могут обеспечивать защиту от ишемии и ее неблагоприятных побочных эффектов. Недавно было обнаружено, что некоторые высокоспецифичные агонисты дельта-2 рецептора опиоидов могут обеспечивать существенную фармакологическую защиту от индуцированной ишемии миокарда путем, сходным с имеющим место при ишемической предподготовке (IPC) (Govindaswami et al., inProceedings of the 11th International Hibernation Symposium 2000, pp. 377-384, Springer-Verlag, Berlin, Germany). Ишемическая предподготовка описывает феномен как короткий период предподготовки сердца к ишемии, в результате которой последующий период ишемии вызывает меньшее повреждение. В свою очередь, это ведет к меньшему инфаркту миокарда и меньшей аритмии. Механизм, как полагают, основывается на модификации функции (открытии) митохондриального чувствительного к АТФ K-канала(митоKАТФ). Одним из известных дельта-2 агонистов является DADLE (D-Ala2-D-leu5-энкефалин), который, как было показано, вызывает тот же эффект, что и предподготовка ишемии органа. Таким образом,способ действия как предподготовки ишемии, так и химических соединений, следует рассматривать в качестве триггера активации более глубокого или защищающего клетку пути. Поскольку дельтарецепторы опиоидов обнаруживаются в большинстве тканей, включая ткань сердца и мозга, можно ожидать, что соединения, проявляющие защитное действие в отношении ишемии, например ткани сердца,должны оказывать такое же действие в отношении ткани мозга и также, например, в отношении ткани легких, почек или печени. В настоящее время существуют две основные области терапии, в которых ишемия играет важную роль: ишемия сердца и ишемия мозга или удар. Ишемия сердца Хирургия сердца всегда связана с контролируемым наложением одного или более случаев ишемии и реперфузии. При традиционной хирургии сердца сердце останавливают и охлаждают раствором для остановки сердца для снижения потребления кислорода миокардом, в результате чего возможно продлить период ишемии сердца без слишком сильного повреждения. Однако для этого требуется поддержание циркуляции крови с помощью системы экстракорпоральной циркуляции, которая имеет несколько существенных недостатков: она вызывает значительную воспалительную реакцию организма, она вызывает микроэмболию, и она серьезно нарушает систему свертывания и фибринолиза крови. Более того,микроэмболия и циркуляция без пульсации во время операции с экстракорпоральной циркуляцией являются причиной субоптимальной перфузии жизненно важных органов, таких как мозг, почки и кишечник. Это ведет, например, к повышенному анаэробному метаболизму (повышение лактата в постоперационный период), нарушению функции почек и спутанности сознания. Благодаря разработке в последние несколько лет местных (механических) стабилизаторов для предотвращения указанных выше недостатков была проведена хирургия коронарных сосудов без применения экстракорпоральной циркуляции. Недостатком, однако, является то, что сердце остается нормотермическим и должно выполнять механическую работу при наличии местной ишемии. В настоящее время во всем мире более 30% хирургии коронарных сосудов проводят без применения экстракорпоральной циркуляции. Для данного применения был бы чрезвычайно полезен кардиопротекторный агент. Такой агент должен быть способен оказывать защитное действие на ткань миокарда с использованием базового клеточного механизма, тем самым, продлевая период вынужденной ишемии. Кроме того, существует область потенциального применения для сохранения донорского сердца,которая все еще является проблематичной, поскольку приемлемый период ишемии все еще ограничивается периодом от 4 до 6 ч. Кроме того, для хирургии сердца с необходимым комплексным восстановлением при длительных периодах сердечной ишемии между операциями может быть благоприятным кардиопротекторный агент в дополнение к применяемой в настоящее время остановке сердца. В целом существует потенциальная область применения при всех хирургических и чрескожных процедурах вмешательства, при которых последствия ишемии-реперфузии, испытываемые любым органом, играют важную роль, как, например, при трансплантационной хирургии, хирургии аневризмов, сосудистой хирургии, для обструктивного сосудистого заболевания, и чрескожных вмешательствах в сте-1 007657 нозные коронарные, сонные и периферические артерии. В частности, существует область потенциального применения для больных перед их анестезией по любой причине, при которой возникают условия пониженного снабжения органов кровью, такой как,например, при устойчивой или неустойчивой стенокардии, или при условиях, которые могут быть вызваны гемодинамическими эффектами анестезии, такими как падение кровяного давления, а также для больных во время первых часов после возникновения сердечного приступа перед окончательным образованием сгустков крови. Ишемия мозга Выживание и правильное функционирование мозга более других органов организма зависит от относительно постоянного снабжения содержащей кислород кровью. Хотя мозг составляет лишь 2% от массы тела, мозг получает 15% сердечного выброса крови и потребляет 20% кислорода, используемого организмом. Кроме того, постоянное снабжение кровью необходимо для обеспечения мозга глюкозой,основным энергетическим субстратом, используемым мозгом для получения высокоэнергетических фосфатов, таких, как АТФ (см., например, WO 96/27380 (Interneuron Pharmaceuticals, Inc В объеме данной заявки ишемия мозга определяется как прекращение или снижение кровотока в артериях, питающих мозг, обычно в результате свертывания крови (тромба) или другой причины (эмболии), перекрывающих артерии, приводящих к ишемическому удару. Как здесь определяется, ишемический удар представляет собой синдром, вызванный различными причинами, такими, как атеросклеротическое цереброваскулярное заболевание, такое как, например, гипоперфузия и артериогенная эмболия; заболевание с повышенной проницаемостью артерий; кардиогенная эмболия, такая, как, но не ограничиваясь этим, фибрилляция предсердий, заболевание клапанов и тромбы желудочка; криптогенный удар; и другими более необычными причинами, такими как, например, протромбозные состояния, расслоения,артериит, мигрень или сосудистый спазм и злоупотребление лекарствами (см., например, CardiovascularThrombosis: Thrombocardiology and Thromboneurology, edited by M. Verstraete, V. Fuster and E.J. Topol.,Second Edition, Lippincot-Raven Publishers, Philadelphia, 1998). Удар занимает третье место в причинах смерти в США, и каждый год возникает приблизительно 500000 новых случаев. Во всем мире удар занимает первое место как причина смерти из-за особенно высокой частоты удара, наблюдаемого в Азии. Ишемический удар является наиболее обычной формой удара и отвечает за приблизительно 85% всех ударов. Существует потенциальная область применения при профилактике удара в определенных случаях,например, во время хирургической операции, когда имеется риск случая ишемии, для снижения ишемического повреждения в случае удара, для снижения степени инфаркта мозга вследствие ишемии мозга и для лечения ишемического удара, в частности, для немедленного лечения удара после возникновения удара. Предшествующий уровень техники В патенте WO 99/04795 (Toray Industries Inc.) раскрыты некоторые производные тетрациклического пиридина и пиразина, обладающие фармакологическим профилем агониста дельта-рецептора опиоидов и их применение для снижения ишемического повреждения органа. Раскрытые в нем соединения структурно не связаны с соединениями настоящего изобретения. В патенте WO 00/37470 (Janssen Pharmaceutica N.V.) раскрыт ряд производных 4-фенил-4-[1Hимидазол-2-ил]пиперидина, однако они не входят в объем данного изобретения и применяются в качестве промежуточных продуктов для синтеза антигистаминных соединений. Описание изобретения В данной заявке описывается новая группа соединений, основанных на замещенном производном 4 фенил-4-[1 Н-имидазол-2-ил]пиперидина, которая имеет важные клинические приложения в отношении снижения ишемического повреждения органа у млекопитающего, в особенности ткани сердца и мозга, в частности, для профилактики осложнений и последствий заболеваний коронарной артерии у млекопитающего путем индукции кардиопротекторного действия. Задачей настоящего изобретения является создание агента для снижения ишемического повреждения органа у млекопитающего, который включает в качестве активного ингредиента замещенное производное 4-фенил-4-[1 Н-имидазол-2-ил]пиперидина общей формулы (I) его фармацевтически приемлемые аддитивные соли кислоты и основания, его стереохимически-2 007657 изомерные формы, его таутомерные формы и его N-оксидные формы, где А=В представляет С=O, C=N-R6, где R6 представляет собой водород или циано, C=S, SO2 иC=CR7R8, где каждый R7 и R8 независимо представляет собой водород, нитро;X представляет собой ковалентную связь или -СН 2-;R2 представляет собой алкилокси или галоген;p представляет собой целое число, равное 0 или 1; причем алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный (циклоалкильный) радикал, содержащий от 3 до 7 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, содержащий от 3 до 7 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода, в котором каждый атом углерода необязательно может быть замещен оксо; алкенил представляет собой алкильный радикал, определенный выше, содержащий одну или более двойных связей;Ar представляет собой гомоцикл, выбранный из группы фенила и нафтила, каждый необязательно замещенный одним или более заместителями, каждый заместитель независимо выбран из группы гидрокси, алкилокси, фенилокси, полигалогеналкилокси, галогена, алкила, гидроксиалкила, полигалогеналкила, карбокси, алкилоксикарбонила, диакиламинокарбонила, фенила, нитро, алкилтио или SO2-CH3; галоген представляет собой заместитель, выбранный из группы фтора, хлора, брома; полигалогеналкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, содержащий от 3 до 7 атомов углерода, в котором один или более атомов углерода замещены одним или более атомами галогена; каждый моноциклический и бициклический гетероциклический радикал,необязательно, замещен по атому углерода и/или гетероатому алкилом или пиридинилом. В объеме данной заявки алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный (циклоалкильный) радикал, содержащий от 3 до 7 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, содержащий от 3 до 7 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу,содержащему от 1 до 6 атомов углерода; в котором каждый атом углерода необязательно может быть замещен амино, нитро, тио, гидрокси, оксо, циано, формилом или карбокси. Предпочтительно алкил представляет собой метил, этил, пропил, изопропил, бутил, трет-бутил, циклопропил, циклопентил, циклогексил, циклoгeксилметил и циклогексилэтил. В объеме данной заявки алкенил представляет собой алкильный радикал, как определено выше, содержащий одну или более двойных связей. Предпочтительно алкенил представляет собой этенил и пропенил. В объеме данной заявки Ar представляет собой гомоцикл, выбранный из группы фенила и нафтила,каждый необязательно замещенный одним или более заместителями, каждый заместитель независимо выбран из группы гидрокси, алкилокси, алкилкарбонилокси, фенилокси, фенилкарбонилокси, галогена,циано, алкила, полигалогеналкила, алкилоксиалкила, формила, галогенформила, карбокси, алкилкарбонила, алкилоксикарбонила, аминокарбонила, моно- или диалкиламинокарбонила, фенилалкила, фенила,нитро, амино, моно- или диалкиламино, тио, алкилтио или SO2-CH3. Предпочтительно Ar представляет собой нафтил или фенил, каждый необязательно замещенный гидрокси, метилокси, этилокси, фенилокси, тригалогенметилокси, галогеном, метилом, трифторметилом, хлорформилом, карбокси, метилоксикарбонилом, этилоксикарбонилом, диэтиламинокарбонилом, фенилом, нитро, метилтио, трифторметилокси или SО 2-С 1-3 алкилом. В объеме данной заявки галоген представляет собой заместитель, выбранный из группы фтора, хлора, брома и йода, а полигалогеналкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, содержащий от 3 до 7 атомов углерода, где один или более атомов углерода замещены одним или более атомами галогена. Предпочтительно галоген представляет собой бром, фтор или хлор и предпочтительно полигалогеналкил представляет собой трифторметил. В объеме данной заявки Het представляет собой гетероциклический радикал, выбранный из группыHet1, Het2 и Het3. Het1 представляет собой алифатический моноциклический гетероциклический радикал,-3 007657 выбранный из группы пирролидинила, диоксолила, имидазолидинила, пирразолидинила, пиперидинила,диоксида, морфолинила, дитианила, тиоморфолинила, пиперазинила и тетрагидрофуранила. Het2 представляет собой полуароматический моноциклический гетероциклический радикал, выбранный из группы 2 Н-пирролила, пирролинила, имидазолинила и пирразолинила. Het3 представляет собой ароматический моноциклический гетероциклический радикал, выбранный из группы пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила, пиридазинила или триазинила; или ароматический бициклический гетероциклический радикал, выбранный из группы хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила и бензотиенила; каждый моноциклический и бициклический гетероциклический радикал может быть необязательно замещен по атому углерода и/или гетероатому галогеном, гидрокси, алкилокси, алкилом, Ar, Ar-алкилом или пиридинилом. Предпочтительной группой соединений являются соединения согласно формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы,их таутомерные формы и их N-оксидные формы, в которых А=В выбран из группы С=O, C=N-R6, где R6 представляет собой водород или циано, C=S, S=O, SO2 и C=R7R8, где каждый R7 и R8 независимо представляет собой водород, нитро или алкил. Другой предпочтительной группой соединений являются соединения согласно формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, их таутомерные формы и их N-оксидные формы, в которых R1 выбран из группы алкилокси, Arалкилокси, алкила, полигалогеналкила, алкилоксиалкила, Ar-алкила, Het-алкила, Ar, пиперазинила, пирролила, тиазолила, пирролидинила и NR9R10, где каждый R9 и R10 независимо представляет собой водород, алкил, Ar, Ar-алкил, пиридинил или алкилоксикарбонилалкил. Другой предпочтительной группой соединений являются соединения согласно формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, их таутомерные формы и их N-оксидные формы, в которых А=В и R1 вместе образуют радикал,выбранный из группы Het2 и Het3. Более предпочтительно А=В и R1 вместе образуют радикал, выбранный из группы бензоксазолила, тиазолила, бензотиазолила, бензимидазолила и пиримидинила. Еще одной предпочтительной группой соединений являются соединения согласно формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, их таутомерные формы и их N-оксидные формы, в которых X представляет собой ковалентную связь или -СН 2-часть. Предпочтительно X представляет собой ковалентную связь. Еще одной предпочтительной группой соединений являются соединения согласно формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, их таутомерные формы и их N-оксидные формы, в которых R2 представляет собой алкилокси или галоген. Еще одной предпочтительной группой соединений являются соединения согласно формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, их таутомерные формы и их N-оксидные формы, в которых R3 выбран из группы фенилалкила и нафтила, каждый независимо замещенный по меньшей мере одним заместителем, выбранным из группы галогена, алкилоксикарбонила, гидрокси, алкилокси и диалкиламинокарбонила. Когда R3 представляет собой алкил, то предпочтительно алкил представляет собой циклогексилметил. Еще одной предпочтительной группой соединений являются соединения согласно формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, их таутомерные формы и их N-оксидные формы, в которых А=В представляет собой С=O илиSO2, R1 представляет собой алкилокси, алкилоксиалкил, Ar или NR9R10, где каждый R9 и R10 независимо представляет собой водород или Ar; или А=В и R1 вместе образуют бензоксазолильный радикал; р равно нулю, R3 представляет собой бензил, необязательно замещенный гидрокси, алкилом или алкилоксикарбонилом, и каждый R4 и R5 представляет собой водород. Более конкретно следующие соединения являются наиболее предпочтительными соединениями: 1-этоксикарбонил-4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидин; 1-пропилоксикарбонил-4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидин; 1-этоксикарбонил-4-фенил-4-[1-[(4-гидроксифенил)метил]-1 Н-имидазол-2-ил]пиперидин; 1-этоксикарбонил-4-фенил-4-[1-(1-фенилэтил)-1 Н-имидазол-2-ил]пиперидин; 1-изопропилоксикарбонил-4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидин; 1-этоксикарбонил-4-фенил-4-[1-4-(метоксикарбонил)фенил]метил]-1 Н-имидазол-2-ил]пиперидин; 1-бензоил-4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидин; 1-(метоксиацетил)-4-фенил-4-[1-(1-фенилэтил)-1 Н-имидазол-2-ил]пиперидин; 4-2-(1-бензоил-4-фенил-4-пиперидинил)-1 Н-имидазол-1-ил]метил]метилбензоат; 4-2-[1-(2-бензоксазолил)-4-фенил-4-пиперидинил]-1 Н-имидазол-1-ил]метил]метилбензоат; 1-бензоил-4-фенил-4-[1-(1-фенилэтил)-1 Н-имидазол-2-ил]пиперидин; 1-этоксикарбонил-4-фенил-4-[1-[1-[4-(этоксикарбонил)фенил]этил]-1 Н-имидазол-2-ил]пиперидин иN,4-дифенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]-1-пиперидинсульфонамид. Фармацевтически приемлемые аддитивные соли кислоты определяются как включающие терапевтически активные нетоксичные формы аддитивных солей кислоты, которые могут образовывать соединения согласно формуле (I). Указанные аддитивные соли кислоты могут быть получены обработкой основной формы соединений согласно формуле (I) подходящими кислотами, например, неорганическими кислотами, например, галогенводородной кислотой, в частности, хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например, уксусной кислотой, гидроксиуксусной кислотой, пропановой кислотой, молочной кислотой, виноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, миндальной кислотой,метансульфокислотой,этансульфокислотой,бензолсульфокислотой,птолуолсульфокислотой, цикламовой кислотой, салициловой кислотой, п-аминосалициловой кислотой и памоевой кислотой. Соединения согласно формуле (I), содержащие протоны кислоты, могут быть также превращены в их терапевтически активные нетоксичные формы аддитивных солей основания обработкой подходящими органическими и неорганическими основаниями. Подходящие формы солей основания включают,например, соли аммония, соли щелочных и щелочно-земельных металлов, в частности, соли лития, натрия, калия, магния и кальция, соли органических оснований, например соли бензатина, N-метил-Dглюкамина, гибрамина, и соли аминокислот, например, аргинина и лизина. Напротив, указанные формы аддитивных солей указанной кислоты или основания могут быть превращены в свободные формы обработкой подходящим основанием или кислотой. Применяемый в объеме данной заявки термин "аддитивная соль" также включает сольваты, которые могут образовывать соединения согласно формуле (I), а также их соли. Такими сольватами являются, например, гидраты и алкоголяты. Применяемый здесь термин "стереохимически изомерные формы" обозначает все возможные изомерные формы, которые могут иметь соединения формулы (I). Если это не отмечено или указано иначе,химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм,причем указанные смеси содержат все диастереомеры и энантиомеры базовой молекулярной структуры. Более конкретно стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь либо цис-, либо транс-конфигурацию. Стереохимически изомерные формы соединений формулы (I) также включены в объем данного изобретения. В соответствии с конвенциями по CAS-номенклатуре, когда в молекуле имеется два стереогенных центра с известной абсолютной конфигурацией, обозначения R или S приписывают (на основе правила последовательности Кана-Ингольда-Прелога) к хиральному центру с наименьшим порядковым числом,референтному центру. Конфигурация второго стереогенного центра указывается с помощью относительных обозначений [R,R] или [R,S], где R всегда указывается как референтный центр, и [R,R] указывает центры с той же хиральностью, a [R,S] указывает центры иной хиральности. Например, если хиральный центр в молекуле с наименьшим порядковым числом имеет S-конфигурацию, а второй центр является R, стерео обозначение должно быть обозначено как S-[R,S]. Если применяют и : положение заместителя с наибольшим приоритетом на асимметричном атоме углерода в кольцевой системе,содержащей наименьший номер кольца, условно всегда находится в положении по отношению к средней плоскости, определяемой кольцевой системой. Положение заместителя с наибольшим приоритетом на другом асимметричном атоме углерода в кольцевой системе относительно положения заместителя с наибольшим приоритетом на референтном атоме обозначают как , если он находится на той же стороне от средней плоскости, определяемой кольцевой системой, или , если он находится на другой стороне от средней плоскости, определяемой кольцевой системой. Заявители обращают внимание на то, что замещенный атом углерода в 4-м положении пиперидинильной части является ахиральным атомом; следовательно, соединения формулы (I) могут лишь содержать, по меньшей мере, один стереогенный центр в своей структуре за счет хирального заместителя R1,R2, R3, R4 или R5. Таутомерные формы соединений формулы (I) предназначены для включения тех соединений формулы (I), в которых, например, енольная группа превращена в кетогруппу (кетоенольная таутомеризация).N-оксидные формы соединений согласно формуле (I) предназначены для включения тех соединений формулы (I), в которых один или несколько атомов азота до так называемого N-оксида, в частности,те N-оксиды, в которых азот пиперидинильной части и/или имидазолильной части окислен. Соединения формулы (I), получаемые в способах, описанных ниже, могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены один от другого с помощью способов, известных в данной области техники. Рацемические соединения формулы (I) могут быть превращены в соответствующие диастереомерные солевые формы с помощью реакции с подходящей хи-5 007657 ральной кислотой. Затем указанные диастереомерные солевые формы разделяют, например, с помощью селективной или фракционной кристаллизации и из них высвобождают энантиомеры с помощью щелочей. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с применением хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ, предлагаемых так, что реакция происходит стереоспецифично. Предпочтительно, чтобы, если желателен конкретный стереоизомер, указанное соединение синтезировалось бы с помощью стереоспецифичных способов получения. В данных способах должны успешно применяться энантиомерно чистые исходные вещества. Изобретение также включает производные соединения (обычно называемые "пролекарствами") фармакологически активных соединений согласно изобретению, которые разрушаются in vivo с образованием соединений согласно изобретению. Пролекарства обычно (но не всегда) обладают более низкой эффективностью в отношении рецептора-мишени по сравнению с соединениями, до которых они деградируют. Пролекарства особенно пригодны, когда желаемое соединение обладает химическими или физическими свойствами, которые делают его введение затрудненным или неэффективным. Например, желаемое соединение может быть лишь слабо растворимым, оно может плохо транспортироваться через эпителий слизистых, или оно может обладать нежелательно коротким полупериодом жизни в плазме. Дополнительное обсуждение пролекарств можно найти в Stella V. J. et al., "Prodrugs", Drug Delivery Systems, 1985, pp. 112-176, and Drugs, 1985, 29, pp. 455-473. Пролекарственные формы фармакологически активных соединений согласно изобретению должны быть обычно соединениями согласно формуле (I), их фармацевтически приемлемыми аддитивными солями кислоты или основания, их стереохимически изомерными формами, их таутомерными формами и их N-оксидными формами, содержащими кислотную группу, которая этерифицирована или амидирована, включаемыми в такие этерифицированные кислотные группы являются группы формулы -COORx,где Rx представляет собой C1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают группы формулы -CONRyRz, где Ry представляет собой Н, C1-6 алкил,фенил или бензил, a Rz представляет собой -ОН, Н, C1-6 алкил, фенил или бензил. Соединения согласно изобретению, содержащие аминогруппу, могут быть дериватизированы кетоном или альдегидом, таким как формальдегид, с образованием основания Манниха. Данное основание обычно гидролизуется в водном растворе с кинетикой первого порядка. Предпочтительно, чтобы органом было сердце, мозг, печень, легкое или почка, а млекопитающим был человек. Более конкретно, предпочтительное осуществление настоящего изобретения относится к агенту для снижения ишемического повреждения сердца млекопитающего, который включает в качестве эффективного ингредиента соединение согласно формуле (I), его фармацевтически приемлемые аддитивные соли кислоты или основания, его стереохимически изомерные формы, его таутомерные формы и его Nоксидные формы. Предпочтительно, чтобы млекопитающим был человек. Состояниями, имеющими отношение к ишемическому повреждению сердца, являются, например,синдром коронарной ишемии, стенокардия, нестабильная стенокардия, стенокардия после инфаркта миокарда, инфаркт миокарда, острый инфаркт миокарда, кардиозащита при традиционной хирургии с кардиопульмонарным шунтированием (СРВ), а также сердечная хирургия без шунтирования, не относящаяся к сердцу хирургия у человека с известной болезнью коронарных артерий (CAD) или с наличием ее риска и коронарным рестенозом после РТСА. В объеме данной заявки ишемическое повреждение должно интерпретироваться как любое повреждение любой части сердца, включая коронары, и включающее прямое повреждение клеток из-за, например, отсутствия кислорода, а также как косвенные повреждения. Более конкретно, предпочтительное осуществление настоящего изобретения относится к агенту для снижения ишемического повреждения мозга млекопитающего, который включает в качестве эффективного ингредиента соединение согласно формуле (I), его фармацевтически приемлемые аддитивные соли кислоты или основания, его стереохимически изомерные формы, его таутомерные формы и его Nоксидные формы. Предпочтительно, чтобы млекопитающим был человек. Состояниями, имеющими отношение к удару, являются, например, атеросклеротическое цереброваскулярное заболевание, такое как, например, гипоперфузия и артериогенные эмболии; заболевание с повышенной проницаемостью артерий; кардиогенная эмболия, такая, как, но не ограничиваясь этим, фибрилляция предсердий, заболевание клапанов и тромбы желудочка; криптогенный удар; и другие более необычные причины, такие как, например, протромбозные состояния, расслоения, артериит, мигрень или сосудистый спазм и злоупотребление лекарствами. Ишемическое повреждение интерпретируется как-6 007657 любое повреждение любой части мозга, включая прямое повреждение клеток из-за, например, отсутствия кислорода, и косвенные повреждения, например, увеличение внутричерепного давления. Более конкретно, предпочтительное осуществление настоящего изобретения относится к агенту для индукции кардиопротекторного действия у млекопитающего, который включает в качестве эффективного ингредиента соединение согласно формуле (I), его фармацевтически приемлемые аддитивные соли кислоты или основания, его стереохимически изомерные формы, его таутомерные формы, его Nоксидные формы и их пролекарства. Под кардиопротекторным действием понимается действие, при котором ткань сердца более защищена от ишемии по сравнению с незащищенной тканью сердца. В других предпочтительных осуществлениях органом является легкое, печень или почка. Изобретение также относится к фармацевтической композиции для снижения ишемического повреждения органа млекопитающего, включающей фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения согласно формуле (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм, его таутомерных форм, его N-оксидных форм и их пролекарств. Предпочтительно, чтобы органом было сердце, мозг, печень, легкое или почка, а млекопитающим был человек. Более конкретно, предпочтительное осуществление настоящего изобретения относится к фармацевтической композиции для снижения ишемического повреждения сердца млекопитающего, к фармацевтически приемлемому носителю и в качестве активного ингредиента к терапевтически эффективному количеству соединения согласно формуле (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, его стереохимически изомерным формам, его таутомерным формам, его Nоксидным формам и их пролекарствам. Предпочтительно, чтобы млекопитающим был человек. Более конкретно, предпочтительное осуществление настоящего изобретения относится к фармацевтической композиции для снижения ишемического повреждения мозга млекопитающего, включающей фармацевтически приемлемый носитель и в качестве активного ингредиента соединение согласно формуле (I), его фармацевтически приемлемые аддитивные соли кислоты или основания, его стереохимически изомерные формы, его таутомерные формы, его N-оксидные формы и их пролекарства. Предпочтительно, чтобы млекопитающим был человек. Другое предпочтительное осуществление данного изобретения относится к фармацевтической композиции для индукции кардиопротекторного действия у млекопитающего, включающей фармацевтически приемлемый носитель и в качестве активного ингредиента соединение согласно формуле (I), его фармацевтически приемлемые аддитивные соли кислоты или основания, его стереохимически изомерные формы, его таутомерные формы, его N-оксидные формы и их пролекарства. Предпочтительно, чтобы млекопитающим был человек. Другое предпочтительное осуществление данного изобретения относится к фармацевтической композиции в форме кардиоплегического раствора, содержащего эффективное количество соединения согласно формуле (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм, его таутомерных форм, его N-оксидных форм, их пролекарств и подходящий носитель. В другом предпочтительном осуществлении соединения согласно изобретению могут быть введены в сочетании, либо одновременно, либо последовательно, с антитромбозным агентом и/или ангиогенным фактором роста. В качестве антитромбозного агента может быть выбран любой агент, для которого известен такой эффект, например, но не ограничиваясь этим, антагонист гликопротеина IIb/Ixia, ингибитор тромбина, ингибитор фактора Ха, ингибитор пути тканевого фактора, антагонист рецептора тромбина или низкомолекулярный гепарин. В качестве ангиогенного ростового фактора может быть выбран ростовой фактор эндотелия сосудов (VEGF), такой, как описанные в патенте GB-2332 373 А (MerckCo,Inc.), содержание которого включено в настоящую заявку в качестве ссылки, или, например, как раскрыто в патенте WO 98/07832 (Ludwig Institute for Cancer research) или патенте WO 98/49300 (CollateralTherapeutics). Преимуществом указанного выше осуществления является то, что снижается риск острого коронарного ишемического синдрома у больных с риском указанного синдрома. Больные с риском включают тех, кто страдает начальными симптомами коронарного ишемического синдрома и кто в связи с этим более вероятно по сравнению с другими, кто не страдает такими симптомами, подвержен последующему тромбозу и ишемическому повреждению ткани. Особенно рассматриваются больные, которые страдают коронарным инфарктом и которым вводят фармацевтическую композицию согласно указанному выше осуществлению в первые 6 ч после наступления инфаркта и перед наступлением у них окончательного образования сгустков крови. Указанное выше осуществление далее обеспечивает больному снижение вероятности последующего образования сгустка при сниженном повреждении ткани и при повышенном восстановлении ткани. Рассматриваются также больные, подвергающиеся тромболитическому лечению при периферической артериальной окклюзии или в целом для лечения тромбоза, вызванного отрывом тромба и обструкцией черепного кровеносного сосуда. Изобретение, следовательно, также относится к фармацевтической композиции для лечения млекопитающего, которое перенесло случай ишемии, включающей эффективное количество соединения со-7 007657 гласно изобретению и, по меньшей мере, второй терапевтический агент, включающий антитромбозный агент и/или ангиогенный фактор роста или их соответствующие фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, их таутомерные формы, их Nоксидные формы и их пролекарства и подходящий носитель, а также к применению соединения согласно изобретению для получения лекарства для снижения ишемического повреждения сердца, включающего соединение согласно изобретению и второй терапевтический агент, включающий антитромбозный агент и/или ангиогенный фактор роста. В частности, соединение согласно формуле (I), его фармацевтически приемлемые аддитивные соли кислоты или основания, его стереохимически изомерные формы, его таутомерные формы, его Nоксидные формы и его пролекарства и их композиции могут также иметь высокий потенциал для консервации донорского органа. Агент для снижения ишемического повреждения органа у млекопитающего согласно настоящему изобретению можно вводить как таковой. Однако он обычно может вводиться в различных фармацевтических формах введения. В качестве подходящих композиций могут быть приведены все композиции,обычно применяемые для системно вводимых лекарств. Для получения фармацевтических композиций данного изобретения эффективное количество конкретного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента соединяют в однородной смеси с фармацевтически приемлемым носителем, причем данный носитель может принимать множество форм в зависимости от формы препарата, желаемой для введения. Данные фармацевтические композиции желательны в подходящих единицах лекарственной формы, в частности, для введения путем парентеральной инъекции или инфузии. Например, при получении композиций может быть применена любая обычная фармацевтическая среда. Для парентеральных композиций носитель обычно должен включать стерильную воду, по меньшей мере, в большей части, хотя могут быть включены другие ингредиенты, например, для обеспечения растворимости. Могут быть получены, например, растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть также получены суспензии для инъекций, в случае которых могут быть применены подходящие жидкие носители, суспендирующие агенты и т.п. Включаются также препараты в твердой форме,которые предназначены для превращения непосредственно перед применением в жидкую форму препаратов. В зависимости от способа введения фармацевтическая композиция должна предпочтительно включать от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.% активного ингредиента и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.% фармацевтически приемлемого носителя, от общего веса композиции. Дозы выбирают подходящим образом в зависимости от таких факторов, как симптомы, возраст,масса тела и способы введения, но в случае парентерального введения, такого как инъекции взрослым,может вводиться от 0,01 мг до 1,0 г соединения согласно изобретению в день, либо за один раз, либо при распределении на несколько введений. В случае перорального введения взрослым может быть введено от 0,1 мг до 3 г соединения согласно изобретению в день либо за один раз, либо при распределении на несколько введений. Фармацевтическая композиция может дополнительно содержать различные другие ингредиенты,известные в данной области техники, например, стабилизирующий агент, буферирующий агент, эмульгирующий агент, регулирующий вязкость агент, поверхностно-активное вещество или консервант. Предпочтительно, фармацевтическую композицию вводят внутривенно, например, путем инфузии(продолжительное внутривенное введение) или болюсным введением. Кроме того, настоящее изобретение также относится к применению соединения формулы (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм, его таутомерных форм, его N-оксидных форм и его пролекарств, а также к любым их фармацевтическим композициям, упоминавшимся выше, для получения лекарства для снижения ишемического повреждения органа у млекопитающего. Предпочтительно, чтобы органом было сердце, мозг, печень, легкое или почка, а млекопитающим был человек. Более конкретно предпочтительное осуществление настоящего изобретения относится к применению соединения формулы (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм, его таутомерных форм, его N-оксидных форм и его пролекарств, а также любых его фармацевтических композиций, упоминавшихся выше, для получения лекарства для снижения ишемического повреждения сердца у млекопитающего, предпочтительно человека. Более конкретно предпочтительное осуществление настоящего изобретения относится к применению соединения формулы (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм, его таутомерных форм, его N-оксидных форм и его пролекарств, а также любых его фармацевтических композиций, упоминавшихся выше, для получения лекарства для снижения ишемического повреждения мозга у млекопитающего, предпочтительно человека. Более того, настоящее изобретение также относится к применению соединения формулы (I), его-8 007657 фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм, его таутомерных форм, его N-оксидных форм и его пролекарств, а также любых его фармацевтических композиций, упоминавшихся выше, для получения лекарства для индукции кардиопротекторного действия у млекопитающего, предпочтительно человека. Более того, настоящее изобретение также относится к применению соединения формулы (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм, его таутомерных форм, его N-оксидных форм и его пролекарств, а также любых его фармацевтических композиций, упоминавшихся выше, для получения лекарства для лечения млекопитающего,которое испытало случай ишемии, включающему введение эффективного количества соединения согласно изобретению и по меньшей мере второго терапевтического агента, включающего антитромбозный агент и/или ангиогенный фактор роста или их соответствующие фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, их таутомерные формы, их Nоксидные формы и их пролекарства и подходящий носитель. Изобретение также относится к способу снижения ишемического повреждения органа, в частности,сердца и/или мозга, у млекопитающего, в частности, человека, или к способу индукции кардиопротекторного действия у млекопитающего, включающему стадию введения указанному млекопитающему,нуждающемуся в таком лечении, терапевтически эффективного количества соединения согласно формуле (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм, его таутомерных форм, его N-оксидных форм и его пролекарств, а также любых его фармацевтических композиций, упоминавшихся выше. Кроме того, настоящее изобретение также относится к применению соединения формулы (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм, его таутомерных форм, его N-оксидных форм и его пролекарств, а также любых его фармацевтических композиций, упоминавшихся выше, для получения лекарства для профилактики и/или лечения случая ишемии сердца или мозга у млекопитающего. Соединения согласно изобретению обычно могут быть получены с помощью последовательных стадий, каждая из которых известна специалистам. В частности, соединения согласно формуле (I-a) могут быть получены путем взаимодействия промежуточного соединения формулы (II) в соответствии со схемой (1) реакции, реакции, которую проводят в подходящем реакционно-инертном растворителе, таком как толуол, в присутствии подходящего основания, такого как триэтиламин. В схеме (1) реакции все переменные определены как в формуле (I), a W1 вместе с частью, к которой он присоединен, эквивалентен R1; примерами W1 являются алкил, Ar или Het. Примером W1OC(=O)Cl является хлорформиат. Схема 1 Соединения согласно формулам (I-a), (I-b), (I-c), (I-d), (I-е), (I-f), (I-g) и (I-h) могут быть также получены путем взаимодействия промежуточного продукта формулы (III) согласно любой из реакций, показанных на схеме реакции (2). В указанных реакциях все переменные определены как в формуле (I), a W1 вместе с частью, к которой он присоединен, эквивалентен R1; примерами W1 являются алкил, Ar или Het. Реакцию (a) проводят в подходящем растворителе, таком как дихлорметан, и с применением ВОС 2 О. Реакцию традиционно проводят в течение нескольких часов при кипячении с обратным холодильником. Реакцию (b) проводят в подходящем растворителе, таком как ТГФ. Реакцию обычно проводят в течение от одного до нескольких часов при комнатной температуре. Реакцию (c) проводят в подходящем растворителе, таком как дихлорметан, в присутствии подходящего основания, такого как Et3N, при комнатной температуре в течение 1 ч. Реакцию (d) проводят в подходящем растворителе, таком как ТГФ или ДМФА при комнатной температуре в течение нескольких часов без необходимости в основании. Реакцию (е) проводят либо в ацетоне при кипячении с обратным холодильником, либо в ДМФА в присутствии подходящего основания, такого как карбонат калия, и она может обычно проводиться при 80 С. Реакцию (f) проводят в подходящем растворителе, таком как дихлорметан, в присутствии подходящего основания, такого как триэтиламин, и при комнатной температуре в течение от приблизительно 30-9 007657 до 120 мин. Реакцию (g) проводят в подходящем растворителе, таком как ацетонитрил при кипячении с обратным холодильником в течение 24 ч. Реакцию (h) проводят при различных условиях в зависимости от R1; например, когда R1=CF3, реакцию проводят в присутствии триэтиламина в дихлорметане при -78 С в течение 1 ч. Для R1=NH2 реакцию проводят в диоксане в течение 12 ч при температуре кипячения с обратным холодильником. ДляR1=CH3 реакцию проводят в дихлорметане при комнатной температуре в течение 3 ч в присутствии триэтиламина. Реакцию (i) проводят в подходящем растворителе, таком как изопропанол, при температуре кипячения с обратным холодильником в течение 12-36 ч. Реакцию (j) проводят в подходящем растворителе, таком как ацетонитрил при температуре кипячения с обратным холодильником в течение 24 ч. Соединения согласно формуле (I-c) могут быть также получены путем взаимодействия промежуточного соединения формулы (IV) с галогенидом (соль галоидводородной кислоты). В указанной реакции все переменные определяются как в формуле (I). Реакцию проводят с основанием, таким как NaH(60% в минеральном масле) и в реакционно-инертном растворителе, таком, как ДМФА или ТГФ.- 11007657 Исходное вещество и промежуточные соединения согласно формулам (II), (III) и (IV) являются соединениями, которые либо имеются в продаже, либо могут быть получены в соответствии с общепринятыми процедурами реакций, широко известных в данной области техники. Промежуточные соединения формулы (II) могут быть получены в соответствии со следующей схемой (4) реакций, где все переменные определены как в формуле (I): Схема 4 Реакционная схема 4 включает стадию (а), на которой ацетилхлорид показанного типа взаимодействует с замещенным первичным амином, например, бензиламином, в присутствии подходящего основания, такого, как Et3N, и в подходящем реакционно-инертном растворителе, таком, как дихлорметан. Реакцию можно удобно проводить при комнатной температуре. На следующей стадии (b) аддукт, полученный на стадии (а), кипятят с обратным холодильником с SOCl2, после чего полученный продукт вводят в реакцию с подходящим образом замещенным 2,2-диметоксиэтиламином в реакционно-инертном растворителе, таком как ДМФА, например, при комнатной температуре (стадия с). На стадии (d) аддукт, полученный на стадии (с), циклизуют в НС с получением замещенной имидазолильной части. Промежуточные соединения формулы (III) могут быть получены из соединений согласно формуле(I-c) путем избирательного восстановления алкилоксикарбонильной части пиперидинильной части в соответствии со следующей реакцией: Реакцию проводят в присутствии подходящего основания, такого как KОН, в подходящем реакционно-инертном растворителе, таком как 2-пропанол, и при температуре кипячения с обратным холодильником. Промежуточные соединения согласно формуле (IV) могут быть получены гидрированием соединений согласно формуле (I-с) в соответствии со следующей реакцией: где все переменные определены как в формуле (I). Реакцию проводят в присутствии катализатора,такого как Pd/C (10%), в метаноле при умеренно повышенной температуре. Очевидно, что в предшествующих и последующих реакциях продукты реакции могут быть выделены из реакционной среды и, если это необходимо, дополнительно очищены в соответствии со способами,широко известными в данной области техники, такими как экстракция, кристаллизация и хроматография. Очевидно далее, что продукты реакции, которые существуют в более чем одной энантиомерной форме,могут быть выделены из их смеси с помощью известных способов, в частности, препаративной хроматографией, такой, как препаративная ВЭЖХ. Следующие примеры иллюстрируют настоящее изобретение без его ограничения. Экспериментальная часть Абсолютная стереохимическая конфигурация стереогенного(ых) атома(ов) углерода в некоторых соединениях не была экспериментально определена. В данных случаях стереохимически изомерная форма, которая была выделена первой, обозначается как "А", а вторая как "В" без дополнительной ссылки на действительную стереохимическую конфигурацию. Однако указанные "А" и "В" изомерные формы могут быть однозначно охарактеризованы специалистом в данной области техники с применением известных в технике способов, таких как, например, дифракция рентгеновских лучей. Способ выделения подробно описан ниже. Здесь далее ДМФА обозначает N,N-диметилформамид, ТГФ обозначает тетрагидрофуран и"DIPE" обозначает диизопропиловый эфир. А. Получение промежуточных соединений Пример А 1. 1-Метил-4-фенил-4-пиперидинкарбонилхлорид (0,49 моль) добавляли порциями при комнатной температуре к перемешиваемой смеси бензолметанамина (0,49 моль) и N,N-диэтилэтанамина (1,223 моль) в СН 2 Сl2 (2500 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. ДобавлялиK2CO3 (150 г) и H2O. Смесь перемешивали и разделяли на слои. Водный слой экстрагировали СН 2 Сl2. Объединенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 144 г (95%) 1-метил-4-фенил-N-(фенилметил)-4-пиперидинкарбоксамида (промежуточное соединение 1). Пример А 2. Смесь промежуточного соединения 1 (0,47 моль) в SOCl2 (750 мл) перемешивали и кипятили с обратным холодильником в течение 1 ч. Растворитель выпаривали. Дважды добавляли толуол и вновь выпаривали. Выход: 190 г (100%) N-[хлор-(1-метил-4-фенил-4-пиперидинил)метилен]бензолметанамина моногидрохлорида (промежуточное соединение 2). Пример A3. Смесь промежуточного соединения 2 (0,47 моль) в ДМФА (750 мл) охлаждали на бане со льдом. По каплям добавляли 2,2-диметоксиэтанамин (0,54 моль), растворенный в ДМФА. Смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали. Выход: 210 г (100%) N-(2,2 диметоксиэтил)-1-метил-4-фенил-N'-(фенилметил)-4-пиперидинкарбоксимидамида дигидрохлорида(промежуточное соединение 3). Пример А 4. Смесь промежуточного соединения 3 (0,47 моль) в 6 н. НСl (1500 мл) перемешивали до образования мутного раствора, затем промывали СН 2 Сl2 (900 мл), перемешивали при 80 С в течение 1 ч, охлаждали,подщелачивали 50% раствором NaOH и экстрагировали CH2Cl2. Органический слой отделяли, сушили(MgSO4), фильтровали, и растворитель упаривали. Остаток кристаллизовали из CH3CN. Осадок отфильтровывали и сушили. Выход: 38,3 г (25%) 1-метил-4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2 ил]пиперидина (промежуточное соединение 4). Пример А 5. Смесь соединения 1 (0,089 моль) в метаноле (250 мл) гидрировали при 50 С с Pd/C 10% (3 г) в качестве катализатора. После поглощения водорода (1 экв.) катализатор отфильтровывали, и фильтрат упаривали. Остаток кристаллизовали из CH3CN. Осадок отфильтровывали и сушили. Выход: 23,89 г (90%) этил 4-фенил-4-(1 Н-имидазол-2-ил)-1-пиперидинкарбоксилата (промежуточное соединение 5). Пример А 6. Смесь промежуточного соединения 5 (0,026 моль) и KOH (0,26 моль) в 2-пропаноле (150 мл) пере- 13007657 мешивали и кипятили с обратным холодильником в течение 10 ч. Растворитель выпаривали. Остаток собирали в Н 2O, и смесь экстрагировали СН 2 Сl2. Органический слой отделяли, сушили, фильтровали, и растворитель выпаривали. Выход: 9,4 г 4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидина (промежуточное соединение 6). Пример А 7. Реакцию проводили в атмосфере N2. Смесь промежуточного продукта 5 (0,0033 моль) в ДМФА (5 мл) и ТГФ (5 мл) добавляли по каплям к раствору NaH, 60% в минеральном масле (0,004 моль) в ТГФ (10 мл), перемешиваемому при комнатной температуре. Смесь перемешивали в течение 1 ч при комнатной температуре. Затем по каплям добавляли раствор 4-(ацетилокси)бензолметанола (0,004 моль) в ТГФ и полученную реакционную смесь экстрагировали СН 2 Сl2. Отделенный органический слой сушили(Na2SO4), фильтровали, и растворитель выпаривали. Остаток очищали быстрой открытой колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/(CH3OH/NH3) 95/5). Чистые фракции собирали, и растворитель выпаривали. Выход: 1,33 г этил 4-фенил-4-[1-4-метилкарбокси)фенилметил)-1 Н-имидазол-2 ил]-1-пиперидинкарбоксилата (промежуточное соединение 7). В. Получение целевых соединений Пример B1. Смесь промежуточного соединения 4 (0,05 моль) и N,N-диэтилэтанамина (0,15 моль) в толуоле (750 мл) перемешивали при 100 С. По каплям добавляли этилхлорформиат (0,25 моль), и реакционную смесь перемешивали и кипятили с обратным холодильником в течение 1 ч и затем охлаждали. Смесь выливали в водный раствор K2 СO3 (35 г K2CO3). Слои разделяли. Водный слой экстрагировали СН 2 Сl2. Отделенный органический слой сушили (MgSO4), фильтровали, и растворитель выпаривали. Остаток очищали на силикагеле на стеклянном фильтре (элюент: CH2Cl2/C2H5OH/NH3 98/2). Желаемые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из CH3CN, отфильтровывали и сушили. Выход: 16,7 г (86%) этил 4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]-1-пиперидинкарбоксилата (соединение 1). Пример B2. Получение соединения 2 Бензоилхлорид (0,0023 моль) добавляли к смеси промежуточного соединения 6 (0,0019 моль) иN,N-диэтилэтанамина (0,0024 моль) в СН 2 Сl2 (15 мл), перемешиваемой при комнатной температуре. Реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Добавляли воду. Слои разделяли. Водный слой экстрагировали СН 2 Сl2. Объединенные органические слои сушили (Na2SO4),фильтровали, и растворитель выпаривали. Остаток очищали быстрой открытой колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/(CH3OH/NH3) 98/2). Чистые фракции собирали, и растворитель выпаривали. Остаток перекристаллизовали из н-гексана, отфильтровывали и сушили. Выход: 0,42 г (52%) соединения 2; т.пл. 122,7 С. Реакцию проводили в атмосфере N2. Раствор промежуточного продукта 5 (0,0054 моль) в ДМФА(10 мл) и ТГФ (10 мл) добавляли по каплям к NaH (0,00624 моль) в ТГФ (30 мл), и смесь перемешивали при комнатной температуре в течение 1 ч. Затем по каплям добавляли метил 4-(бромметил)бензоат(0,00624 моль) в ТГФ (5 мл), и реакционную смесь перемешивали при 60 С в течение 3 ч. Добавляли во- 14007657 ду, и смесь экстрагировали СН 2 Сl2. Объединенные органические слои сушили (Na2SO4), фильтровали, и растворитель выпаривали. Остаток очищали быстрой открытой колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/(CH3OH/NH3) 98/2). Желаемые фракции собирали, и растворитель выпаривали. Остаток кристаллизовали из DIPE, отфильтровывали и сушили. Выход: 1,7 г (70%) соединения 3; т.пл. 149,1 С Пример B4. Получение соединения 4 Смесь промежуточного соединения 6 (0,0059 моль) и(0,0059 моль) в CH3CN (70 мл) перемешивали и кипятили с обратным холодильником в течение 24 ч. Растворитель выпаривали. Добавляли воду. Смесь экстрагировали СН 2 Сl2. Отделенный органический слой сушили (Na2SO4, безводный), фильтровали, и растворитель выпаривали. Остаток кристаллизовали из DIPE, отфильтровывали и перекристаллизовывали из CH3CN, отфильтровывали и сушили. Выход: 0,33 г соединения 4; т.пл. 84,2 С. Пример B5. Получение соединения 5 Смесь соединения 4 (0,0001 моль) в НСl 6 н. (22,8 мл) перемешивали и кипятили с обратным холодильником в течение 4 ч. Реакционную смесь подщелачивали и затем экстрагировали CH2Cl2. Отделенный органический слой сушили (Na2SO4, безводный), фильтровали, и растворитель выпаривали. Остаток перекристаллизовывали из DIPE, отфильтровывали и сушили. Выход: 0,24 г (62%) соединения 5. Пример B6. Получение соединения 6 Изоцианатбензол (0,0094 моль) добавляли по каплям к промежуточному соединению 6 (0,0094 моль) в ТГФ (50 мл), и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Добавляли воду, и данную смесь экстрагировали CH2Cl2. Отделенный органический слой сушили(Na2SO4), фильтровали, и растворитель выпаривали. Твердый остаток промывали 2-пропаноном, отфильтровывали и сушили. Выход: 2,7 г (68%) соединения 6. Пример В 7. Получение соединения 7- 15007657 в ТГФ (10 мл), и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Добавляли воду, и данную смесь экстрагировали СН 2 Сl2. Отделенный органический слой сушили (Na2SO4),фильтровали, и растворитель выпаривали. Остаток (0,4 г) очищали с помощью ВЭЖХ на силикагеле Смесь соединения 3 (0,002 моль) и LiOH (0,02 моль) в ТГФ (11 мл) и Н 2O (11 мл) перемешивали при комнатной температуре в течение 24 ч. Добавляли воду. рН смеси доводили до 6, и затем смесь экстрагировали CH2Cl2. Органический слой отделяли, сушили, фильтровали, и растворитель выпаривали. Остаток промывали СН 2 Сl2. Выход: 0,72 г (83%) соединения 8; т.пл. 251,6 С. Реакцию проводили в атмосфере N2. Раствор NaH 60% (0,000642 моль) в ДМФА (2 мл) перемешивали при комнатной температуре. По каплям добавляли раствор соединения 6 (0,000642 моль) в ДМФА(8 мл), и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли CH3I(0,001284 моль) и реакционную смесь перемешивали при 60 С в сосуде Парра под давлением в течение 2 ч. Растворитель выпаривали. Остаток очищали высокоэффективной жидкостной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 98/2). Желаемые фракции собирали и растворитель выпаривали. Выход: 0,14 г (49%) соединения 9. с) Получение соединения 10 К раствору соединения 7 (0,000404 моль) в ТГФ (5 мл), перемешиваемому при 0 С, по каплям добавляли LiAlH4 1M в ТГФ (0,000444 моль). Реакционную смесь перемешивали в течение 30 мин при 0 С. Смесь обрабатывали 10% водным раствором NH4Cl и экстрагировали EtOAC. Отделенный органический слой сушили (Na2SO4), фильтровали, и растворитель выпаривали. Остаток очищали с помощью СС-ТСХ на хроматотроне (элюент: CH2Cl2/CH3OH 96/4). Желаемые фракции собирали, и растворитель выпаривали. Остаток кристаллизовали из СН 3 ОН/Н 2 О, отфильтровывали и сушили. Выход: 0,020 г (10%) соединения 10.(0,001423 моль). Полученную суспензию перемешивали в течение 18 ч при комнатной температуре. Растворитель выпаривали. Остаток собирали водой и экстрагировали смесью EtOAC и 1-бутанола. Органи- 16007657 ческий слой отделяли, сушили (Na2SO4), фильтровали, и растворитель выпаривали. Остаток собирали 1 н. НСl и затем экстрагировали EtOAC. Органический слой отделяли, промывали насыщенным раствором соли, сушили (Na2SO4), фильтровали, и растворитель выпаривали. Остаток кристаллизовали изEt2O/CH2Cl2, отфильтровывали и сушили. Выход: 0,16 г (51%) соединения 11. Пример B9. К смеси промежуточного соединения 7 (0,0018 моль) в ТГФ (10 мл) и Н 2O (10 мл) добавляли LiOH(0,018 моль). Реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Добавляли воду. Добавляли СН 2 Сl2. Реакционную смесь экстрагировали. Органический слой отделяли, сушили(Na2SO4), фильтровали, и растворитель выпаривали. Белый твердый остаток промывали метанолом и СН 2 Сl2, затем сушили. Выход: 0,54 г этил 4-фенил-4-[1-(4-гидроксифенилметил)-1 Н-имидазол-2-ил]-1 пиперидинкарбоксилата (соединение 12). Были получены следующие перечисленные в табл. 1-5 соединения: С. Фармакологические примеры Фармакологические свойства оценивали по связыванию радиолиганда, а также анализом связывания ГТФS для отдельных соединений на клонированных ,иопиоидных рецепторах человека, экс- 28007657 прессированных в линии клеток млекопитающего. Сигнализацию второго посредника измеряли на мембранных препаратах посредством стимуляции связывания [35S]ГТФS. В данном функциональном тесте исследовали агонистические и антагонистические свойства соединений. В качестве референтного агониста применяли DPDPE D-Pen2,5)энкефалин), а в качестве референтного антагонистаопиоидного рецептора применяли налтриндол (Malatynska E., Wang Y., Knapp R.J.,Santoro G., Li X., Waite S., Roeske W.R., Yamamura H.I.: Humanopioid receptor: a stable cell line for functional studies of opioids. NeuroReport 6, 613-616, 1995) и (Portoghese P.S., Sultana M., Takemori A.E.: Naltrindole, a highly selective and potent non-peptideopioid receptor antagonist. Eur. J. Pharmacol. 146, 185-186,1988), a U69593 и нор-биналторфимин (nor-BNI) применяли дляопиоидного рецептора в качестве референтного агониста и антагониста соответственно. Дляопиоидного рецептора в качестве референтного агониста применяли морфин, а в качестве референтного антагониста использовали налоксон (Alt A.,Mansour A., Akil H., Medzihradsky F., Traynor J.R., Woods J.H.: Stimulation of guanosine-5'-O-(3[35S]thio)triphosphate binding by endogenous opioids acting at a cloned Mu receptor. J. Pharmacol. Exp. Ther. 286, 282-288, 1998) и (Smart D., Hirst R.A., Hirota K., Grandy D.K, Lambert D.G.: The effects of recombinantC1. Материалы и методы Клеточная культура Клетки СНО, стабильно трансфецированныеилиопиоидным рецептором, культивировали в среде Игла, модифицированной по Дульбекко (DMEM)/питательной среде Хама F12 (в соотношении 1:1) с добавкой 10% инактивированной нагреванием плодной сыворотки телят и раствора антибиотиков, содержащего 100 МЕ/мл пенициллина G, 100 мкг/мл стрептомицина сульфата, 110 мкг/мл пировиноградной кислоты и 300 мкг/мл L-глутамина. Для С 6 глиомных клеток, стабильно трансфецированныхопиоидным рецептором, требовалась среда DMEM, обогащенная 10% инактивированной нагреванием плодной сывороткой телят и раствором антибиотиков, описанным выше. Получение мембран Мембраны получали в виде суммарных фракций частиц. Все линии клеток культивировали до 90% конфлуентности на 145-мм чашках Петри и обрабатывали 5 мМ бутиратом натрия за 24 ч до сбора. Культуральную среду удаляли и клетки промывали холодным забуференным фосфатом физиологическим раствором (ЗФР без Са 2+ и Мg2+), соскребали с чашек в 50 мМ Трис-HCl буфере, рН 7,4 и собирали центрифугированием (10 мин при 16000 об/мин при 4 С). Осадок клеток ресуспендировали в гипотоническом 5 мМ Трис-HCl буфере, рН 7,4 и повторно гомогенизировали с помощью гомогенизатора UltraTurrax. Гомогенат центрифугировали при 18000 об/мин в течение 20 мин при 4 С. Конечный осадок ресуспендировали в 50 мМ Трис-HCl буфере, рН 7,4 и хранили в виде аликвот при -70 С. Определение белка проводили с помощью набора Biorad для анализа белка (Bradford) с применением бычьего сывороточного альбумина (БСА) в качестве стандарта (Bradford, M.M.: A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochem. 72: 248-254, 1976). С 2. Связывание радиолиганда Для выявления оптимальных условий анализа для данных подтипов рецепторов опиоидов в их соответствующих клеточных мембранах млекопитающих были проведены предварительные эксперименты по связыванию радиолиганда. Конкурентное ингибирование [3 Н]DPDPE соединениями проводили при концентрации радиолиганда 2 нМ (Kd=1,7 нМ) и варьирующих концентрациях синглета соединений, охватывающих, по меньшей мере, величину в 3 порядка вокруг величины pIC50. Для конкурентного связывания с рецепторамииприменяли,соответственно, [3H]U69593 (Kd=0,4 нМ) и [3 Н] DAMGO (Kd=0,6 нМ) в концентрации 1 нМ. Мембраны оттаивали на льду и разводили 50 мМ Трис-HCl буфером, рН 7,4. Дляопиоидного рецептора в данный буфер инкубации добавляли 2 мМ МgСl2, 1 мМ ЭДТА и 0,1% БСА. Неспецифическое связывание определяли в присутствии 1 мкМ налтриндола, спирадолина и декстроморамида для ,иопиоидных рецепторов, соответственно. Было обнаружено, что инкубация в течение 1 ч при 25 С является оптимальной для анализа конкурентного связывания для всех трех подтипов рецепторов. Анализ проводили в конечном объеме 500 мкл. Реакцию останавливали быстрой фильтрацией через UniFilter-96, GF/B при пониженном давлении с применением Filtermate 196 (Packard). Количество радиоактивности, связанной на ячейке фильтра, определяли после высушивания фильтра и добавления сцинтиллятора (Microscint-O; Packard) с помощью жидкостного сцинтилляционного счетчика. С 3. Связывание [35S]ГТФS Определение связывания [35S]ГТФS с G-белками проводили модифицированным способом Lazareno (Lazareno S.: Measurement of agonist-stimulated [35S]GTPS binding to cell membranes. Meth. Molec.Biol. 106, 231-243, 1999). В предварительных экспериментах по связыванию [35S]ГТФS условия анализа были оптимизиро- 29007657 ваны, что привело к выбору следующих буферов: 20 мМ Hepes с 100 мМ NaCl, содержащего 3 мкМ ГДФ и 1 мМ MgCl2 дляопиоидного рецептора мембран СНО, содержащего 10 мкМ ГДФ и 1 мМ MgCl2 дляопиоидного рецептора клеточных мембран глиомы C6 и 10 мкМ ГДФ и 0,3 мМ MgCl2 дляопиоидного рецептора мембран СНО. Смеси для тестирования содержали 10 мкг мембранного белка. К разведенным мембранам дополнительно добавляли 10 мкг/мл сапонина в качестве поверхностноактивного вещества для обеспечения максимального проникновения [35S]ГТФS в мембраны. Для тестирования агонистической активности 175 мкл разведенных мембран предварительно инкубировали в описанном выше буфере с 25 мкл буфера и 25 мкл соединения в различных концентрациях в суммарном объеме 225 мкл. Для антагонистической активности 25 мкл добавляемого буфера заменяли референтным агонистом для стимуляции базального уровня. Для всех трех линий клеток применяли концентрацию 300 нМ DPDPE, U69593 и морфина для их соответствующих подтипов рецепторов. После 20 минутного периода предварительной инкубации при 37 С добавляли 25 мкл [35S]ГТФS до конечной концентрации 0,25 нМ, и тестируемые смеси дополнительно инкубировали в течение 20 мин при 37 С. Связанный и свободный [35S]ГТФS разделяли быстрой фильтрацией через UniFilter-96, GF/B при пониженном давлении с применением Filtermate 196 (Packard). Количество радиоактивности, связанной на ячейке фильтра, определяли после высушивания фильтра и добавления сцинтиллятора (Microscint-O; Packard) с помощью жидкостного сцинтилляционного счетчика. Базальное связывание [35S]ГТФS измеряли в отсутствие соединений. Стимуляцию агонистом рассчитывали в виде процентного увеличения над базальным уровнем. Сигмоидные кривые зависимости ответа от концентрации агониста в отношении связывания [35S]ГТФS и кривые ингибирования антагонистом стимулированного агонистом связывания [35S]ГТФS анализировали с помощью нелинейной регрессии с применением программы GraphPad Prism. Данные получали из независимых экспериментов, и точки с различными концентрациями оценивали по двум параллельным определениям. С 4. Результаты Все соединения согласно изобретению показали величину рIC50, равную, по меньшей мере, 6 для дельта опиоидного рецептора и величину рIC50, равную 6 или ниже для обоих мю и каппа рецепторов. Перечисленные в табл. 6 соединения показали величину рIС 50 от 7 до 8 для дельта опиоидного рецептора и величину рIC50, равную 6 или ниже для обоих мю и каппа рецепторов. Перечисленные в табл. 7 соединения показали величину рIC50 выше 8 для дельта опиоидного рецептора и величину рIC50, равную 6 или ниже для обоих мю и каппа рецепторов. Избирательность в отношении дельта опиоидного рецептора по сравнению с мю опиоидным рецептором составляет 600.
МПК / Метки
МПК: A61K 31/454, A61P 9/10
Метки: ишемического, пиперидина, 4-фенил-4-[1н-имидазол-2-ил, замещенные, повреждения, снижения, производные
Код ссылки
<a href="https://eas.patents.su/30-7657-zameshhennye-proizvodnye-4-fenil-4-1n-imidazol-2-il-piperidina-dlya-snizheniya-ishemicheskogo-povrezhdeniya.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные 4-фенил-4-[1н-имидазол-2-ил] пиперидина для снижения ишемического повреждения</a>
Предыдущий патент: Клонированный штамм вируса осповакцины, способ его получения и применение штамма в качестве вакцины
Следующий патент: Высококремнеземистый шабазит, его синтез и его применение при превращении кислородсодержащих веществ в олефины
Случайный патент: Арабиногалактан для повышения приобретенного иммунного ответа












