Антагонисты cxcr3
Номер патента: 7538
Опубликовано: 27.10.2006
Авторы: Джонсон Майкл Дж., Хуанг Алан Кси, Лиу Дживен, Медина Джулио К., Жу Лиушенг, Маркус Эндрю П., Ли Ан-Ронг
Формула / Реферат
1. Соединение, имеющее формулу
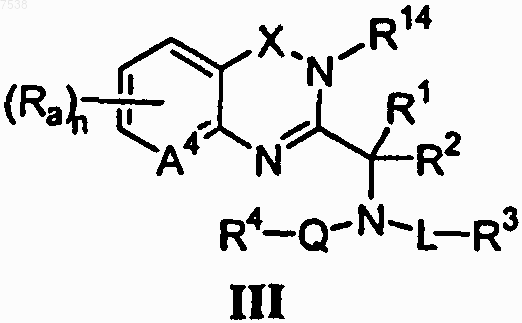
или его фармацевтически приемлемая соль или пролекарство, где
А4 означает С или N;
X означает -С(О)-, -СН2- или связь;
R1 и R2, каждый независимо, выбраны из группы, включающей Н и (С1-С4)алкил;
R3 выбран из группы, включающей (C1-C8)алкокси, амино, (C1-C8)алкиламино, ди(C1-C8)ал-киламино, (C2-C8)гетероалкил, (C3-C9)гетероциклил, (C1-C8)ациламино, амидино, уреидо, циано, гетероарил, -CONR9R10 и -CO2R11;
R4 представляет собой замещенный или незамещенный бензил, где упомянутые заместители выбраны из группы, включающей галоген, галоген(С1-С4)алкил, галоген(C1-C4)алкокси, циано, нитро и фенил;
каждый R9, R10 и R11 независимо выбран из группы, включающей Н и (C1-C8)алкил;
R14 представляет собой замещенный или незамещенный фенил, пиридил и пиримидинил;
Q означает -С(О)-;
L означает (C1-C8) алкилен;
нижний индекс n означает целое число от 0 до 4; и
каждый Ra независимо выбран из группы, включающей галоген, -OR', -R' и -CN, где R' выбран из группы, состоящей из Н или (C1-C8)алкила.
2. Соединение по п.1, где А4 означает С.
3. Соединение по п.1, где А4 означает N.
4. Соединение по п.1, где X означает -С(О)-.
5. Соединение по п.1, где R3 является (C1-C8)ациламино.
6. Соединение по п.1, где R14 выбран из группы, состоящей из замещенного фенила, замещенного пиридила, замещенного тиазолила и замещенного тиенила, причем заместитель выбран из группы, состоящей из циано, галогена, (C1-C8)алкокси, (C1-C8)алкила, (C2-C8)гетероалкила, CONH2, метилендиокси и этилендиокси.
7. Соединение по п.1, где R14 представляет собой замещенный фенил, причем заместитель выбран из группы, состоящей из циано, галогена, (C1-C8)алкокси, (C1-C8)алкила, (C2-C8)гетероалкила, CONH2, метилендиокси и этилендиокси.
8. Соединение по п.1, причем R1 выбран из группы, состоящей из метила, этила и пропила, и R2 представляет собой водород.
9. Соединение по п.1, где каждый R1 и R2 представляет собой метил.
10. Соединение по п.1, где L представляет собой (C1-C4)алкилен.
11. Соединение по п.1, где R3 выбран из (C1-C8)алкокси, (С3-С9)гетероциклил и гетероарила.
12. Соединение по п.1, где R3 означает гетероарил.
13. Соединение по п.1, где R3 выбран из группы, состоящей из замещенного или незамещенного пиридила и замещенного или незамещенного имидазолила.
14. Соединение по п.1, где R1 и R2, каждый независимо, выбран из группы, состоящей из водорода, метила и этила; R14 означает фенил; L означает метилен, этилен или пропилен; и R3 выбран из группы, состоящей из замещенного или незамещенного пиридила и замещенного или незамещенного имидазолила.
15. Соединение по п.1, где указанное соединение выбрано из группы, включающей
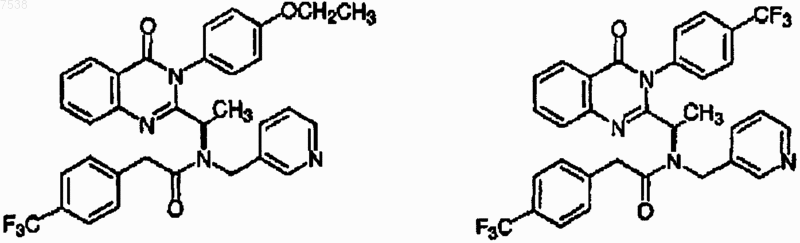
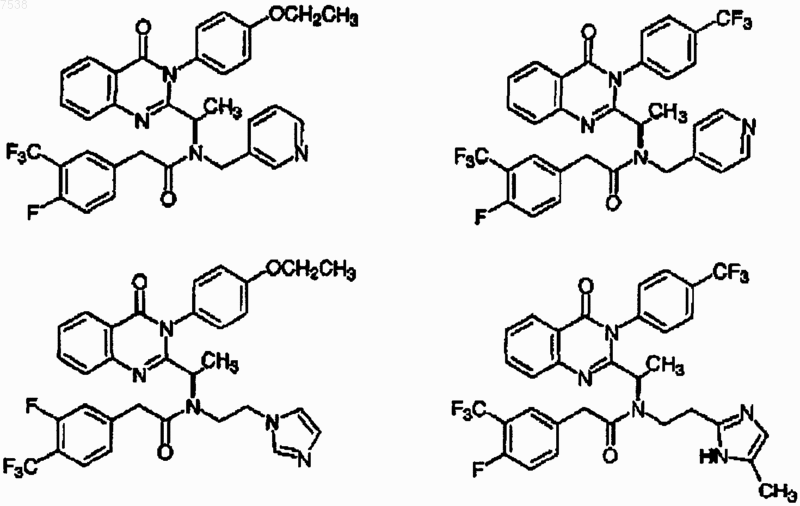
или его фармацевтически приемлемая соль, изомер или пролекарство.
16. Соединение по п.1, где указанное соединение выбрано из группы, включающей
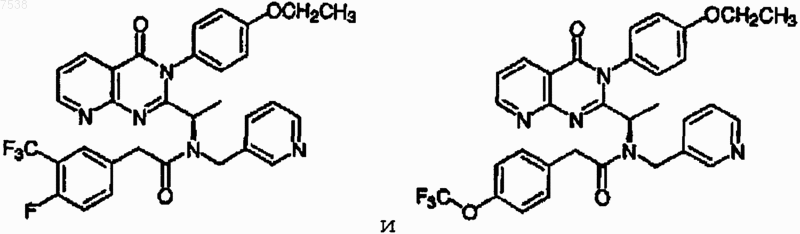
или его фармацевтически приемлемая соль, изомер или пролекарство.
17. Фармацевтическая композиция в качестве антагониста CXCR3, содержащая соединение по пп.1, 15 или 16 и фармацевтически приемлемый носитель или разбавитель.
18. Способ модуляции функции CXCR3 в клетке, включающий контактирование указанной клетки с соединением по пп.1, 15 и 16.
19. Способ модуляции функции CXCR3 в клетке, включающий контактирование белка CXCR3 с соединением по пп.1, 15 и 16.
Текст
007538 Перекрестные ссылки на родственные заявки По данной заявке испрашивается приоритет по предварительным заявкам США 60/255241, поданной 11 декабря 2000, и 60/296499, поданной 6 июня 2001, содержания которых включены здесь в качестве ссылки. Предпосылки к созданию изобретения Хемокины являются хемотаксическими цитокинами, которые высвобождаются широким разнообразием клеток для привлечения макрофагов, Т-клеток, эозинофилов, базофилов и нейтрофилов к местам воспаления (см. Schall, Cytokine, 3:165-183 (1991), Schall, et al., Curr. Opin. Immunol., 6:865-873 (1994) иMurphy, Rev. Immun., 12:593-633 (1994. Помимо стимуляции хемотаксиса хемокинами селективно могут быть индуцированы другие изменения в клетках-респондерах, включая изменения в форме клеток,временные повышения внутриклеточной концентрации свободных ионов кальция ([Ca2+])i, гранулоэкзоцитоз, стимуляцию интегрина, образование биологически активных липидов (напр. лейкотриенов) и воспаление дыхательных путей, связанное с активацией лейкоцитов. Таким образом, хемокины являются ранними спусковыми механизмами воспалительной реакции, вызывающими высвобождение воспалительного медиатора, хемотаксис и транссудацию в местах инфекции или воспаления. Существуют четыре класса хемокинов, СХС, СС, С и СХ 3 С, в зависимости от того, разделены ли первые два цистеина единственной аминокислотой (С-Х-С), являются ли они соседними (СС), имеют ли находящуюся в недостатке цистеиновую пару (С) или разделены тремя аминокислотами(СХ 3 С). -Хемокины, такие как интерлейкин-8 (IL-8), активный белок, стимулирующий рост меланомы,(MGSA), и фактор 1, выделенный из стромальных клеток (SDF-1), являются хемотаксическими, главным образом для нейтрофилов и лимфоцитов, тогда как -хемокины, такие как RANTES, MIP-1, MIP1, моноцитарный хемотаксический белок-1 (MCP-1), МСР-2, МСР-3 и эотаксин, являются хемотаксическими для макрофагов, Т-клеток, эозинофилов и базофилов (Deng, et al., Nature, 381:661-666 (1996. Хемокин С лимфотактин проявляет специфичность по отношению к лимфоцитам (Kelner, et al., Science, 266:13951399 (1994, в то время как хемокин СХ 3 С фракталкин обнаруживает специфичность по отношению к лимфоцитам и моноцитам (Bazan, et al., Nature, 385:640-644 (1997. Находящиеся на поверхности клеток, специфически связывающие хемокины, принадлежащие к семейству белков из семи трансмембранных доменов, связанных с G-белком (см. Horuk, Trends Pharm. Sci.,15:159-165 (1994 названы "рецепторами хемокина". При связывании их родственных лигандов рецепторы хемокина передают внутриклеточный сигнал через ассоциированный гетеротримерный белок G,результатом чего является быстрое повышение внутриклеточной концентрации кальция. Существуют по меньшей мере двенадцать рецепторов хемокина человека, которые связывают -хемокины или дают ответную реакцию на них со следующей характерной картиной: CCR1 (или "CKR-1" или "CC-CKR-1")CCR9 TECK (Zaballos, et al, J. Immunol, 162:5671-5675 (1999, D6 MIP-1 бета, RANTES и МСР-3 (Nibbs,et al., J. Biol. Chem., 272:32078-32083 (1997 и антиген группы крови Даффи RANTES, MCP-1 (Chaudhun,et al., J. Biol. Chem., 269:7835-7838 (1994. Рецепторы хемокина, такие как CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7,CCR8, CCR9, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CX3CR1 и XCR1, признаны важными медиаторами воспалительных и иммунорегуляторных расстройств и болезней, включая астму и аллергические заболевания, а также аитоиммунные патологии, такие как ревматоидный артрит и атеросклероз. Рецептор хемокина CXCR3 экспрессируется, главным образом в Т-лимфоцитах, и его функциональная активность может быть измерена оценкой кальция в цитозоле или хемотаксисом. Рецептор ранее относили к GPR9 или CKR-L2. Его хромосомное местоположение необычно среди рецепторов хемокина,будучи отнесенным к Xq13. Лигандами, которые были идентифицированы, как имеющие селективность и высокую степень сродства, являются хемокины СХС, IP10, MIG и ITAC. Высокоселективная экспрессия CXCR3 делает его идеальной мишенью для вмешательства для прерывания несвойственного продвижения Т-клеток. Клиническим показанием для такого вмешательства являются опосредуемые Т-клетками аутоиммунные заболевания, такие как рассеянный склероз, ревматоидный артрит и диабет I типа. Несвойственная инфильтрация Т-клеток бывает также при псориазе и других патогенных кожных воспалительных состояниях, хотя болезни могут быть не истинными аутоиммунными расстройствами. В этом отношении, промотирование экспрессии IP-10 в кератиноцитах является общепринятым признаком кожных иммунопатологий. Ингибирование CXCR3 может быть полезным для уменьшения отторжения при трансплантации органа. Эктопическая экспрессия CXCR3 в неко-1 007538 торых опухолях, особенно в субпопуляциях злокачественных В-клеток, указывает на то, что селективные ингибиторы CXCR3 могут иметь ценность в иммунотерапии опухолей, особенно для уменьшения метастаза. Ввиду клинической важности CXCR3, определение соединений, которые модулируют функциюCXCR3, представляет собой привлекательный путь для разработки новых терапевтических агентов. Такие соединения предложены здесь. Краткое описание изобретения Данное изобретение относится к соединениям, которые могут использоваться для лечения или профилактики некоторых воспалительных и иммунорегулярных расстройств и заболеваний, включая астму и аллергические заболевания, а также аутоиммунные патологии, такие как ревматоидный артрит и атеросклероз. Соединения, предложенные здесь, имеют общую формулу (I) где X означает связь, -С(О)-, -C(R5)(R6)-, -C(R5)=, -S(O)-, -S(O)2- или -N=; Z означает связь, -N=, -O-,-S-, -N(R17)- или -C(R7)=, при условии, что X и Z не оба являются связью; L означает связь, C(O)-(C1C8)алкилен, (C1-C8)алкилен или (C2-C8)гетероалкилен; Q означает связь, (C1-C8)алкилен, (C2C8)гетероалкилен, -С (О)-, -ОС(О)-, -N(R8)C(O)-, -CH2CO-, -CH2SO- или -CH2SO2-, и необязательно L и Q могут быть связаны вместе с образованием 5- или 6-членной гетероциклической группы, имеющей от 1 до 3 гетероатомов. Символы R1 и R2 независимо означают Н, (C1-C8)алкил, (C1-C8)гетероалкил, арил или гетероарил, или необязательно объединены с образованием 3-8-членного кольца, имеющего от 0 до 2 гетероатомов в кольце, и необязательно R2 и L могут быть связаны вместе с образованием 5- или 6 членной гетероциклической группы, имеющей от 1 до 4 гетероатомов. Символ R3 означает гидрокси, (C1C8)алкокси, амино, (C1-C8)алкиламино, ди(C1-C8)алкиламино, (C2-C8)гетероалкил, (C3-C9)гетероциклил,(C1-C8)ациламино, амидино, гуанидино, уреидо, циано, гетероарил, -CONR9R10 или -CO2R11. Символ R4 означает (C1-C20)алкил, (С 2-С 20)гетероалкил, гетероарил, арил, гетероарил(C1-C6)алкил, гетероарил(С 2 С 6)гетероалкил, арил(C1-C6)алкил или арил(C2-C6)гетероалкил. Символы R5 и R6 независимо означают Н,(C1-C8)алкил, (C2-C8)гетероалкил, гетероарил или арил, или необязательно R5 и R6 объединены с образованием 3-7-членного кольца. Символы R7 и R8 независимо означают Н, (C1-C8)алкил, (C2-C8)гетероалкил,гетероарил или арил. Символы R9, R10 и R11, каждый, независимо, означают Н, (C1-C8)алкил, (C2C8)гетероалкил, гетероарил, арил, гетероарил(C1-C6)алкил, гетероарил(C2-C8)гетероалкил, арил(C1C8)алкил или арил(C2-C8)гетероалкил. Что касается составляющих членов кольца, Y1, Y2, Y3 и Y4, то символы Y1 и Y2 независимо означают -C(R12)=, -N=, -O-, -S- или -N(R13)-. Символ Y3 означает N или С, где атом углерода принимает участие в образовании двойной связи либо с Z, либо с Y4; и Y4 означает -N(R14)-, -C(R14)=, -N= или -N(R14)-С(R15) (R16)-. В указанных группах символ R12 означает Н, галоген, гидрокси, амино, алкиламино, диалкиламино, (C1-C8)алкил, (C2-C8)гетероалкил, гетероарил и арил, или необязательно, когда Y1 и Y2, оба, означают -C(R12)=, две группы R12 могут быть объединены с образованием замещенного или незамещенного 5-6-членного циклоалкила, гетероциклоалкила, арила или гетероарила; или необязательно, когда Y1 означает -C(R12)= и X означает -C(R5)= или -C(R5)(R6)-, R12 и R5 могут быть объединены с образованием замещенного или незамещенного 5-6-членного циклоалкила, гетероциклоалкила, арила или гетероарила. Дополнительно, символ R13 означает Н, (C1-C8)алкил, (C2-C8)гетероалкил, гетероарил, арил, гетероарил(C1-C6)алкил, гетероарил(C2-C8)гетероалкил, арил(C1-C8)алкил или арил(C2-C8)гетероалкил. СимволR14 означает (C1-C8)алкил, (C2-C8)гетероалкил, арил(C1-C8)алкил, арил(C2-C8)гетероалкил, гетероарил(C1C8)алкил, гетероарил(C2-C8)гетероалкил, гетероарил и арил; R15 и R16 независимо выбраны из Н, (C1C8)алкила и (C2-C8)гетероалкила; и R17 выбран из Н, (C1-C8)алкила, (C2-C8)гетероалкила, гетероарила,арила, гетероарил(C1-C6)алкила, гетероарил(C2-C8)гетероалкила, арил(C1-C8)алкила и арил(C2-C8)гетероалкила, или необязательно, когда Y2 означает -С(R12)= или -N(R13)-, R17 может быть объединен с R12 или R13 с образованием замещенного или незамещенного 5-6-членного циклоалкила, гетероциклоалкила,арила или гетероарила; при условии, что, когда Y3-содержащая кольцевая система является кольцевой системой хиназолинона или хинолинона, и R4-Q-означает замещенный или незамещенный (С 5-С 15)алкил,тогда R3-L- является иным, чем замещенный или незамещенный (C2-C8)алкилен или замещенный или незамещенный (C2-C8)гетероалкилен, присоединенный к -NR'R", где R и R" независимо выбраны из группы, включающей водород и (C1-C8)алкил, или необязательно объединены с атомом азота, к которому каждый из них присоединен, с образованием 5-, 6- или 7-членного кольца. Если не указано иного, то подразумевается, что соединения, представленные указанной формулой,включают их фармацевтически приемлемые соли и пролекарства.-2 007538 Данное изобретение относится также к фармацевтическим композициям, содержащим соединение формулы I и фармацевтически приемлемый наполнитель или носитель. Данное изобретение относится также к способам лечения или профилактики воспалительного или иммунного состояния или расстройства, заключающимся во введении субъекту, при необходимости такого лечения или профилактики, терапевтически эффективного количества соединения формулы I. Данное изобретение относится также к способам лечения или профилактики состояния или расстройства, опосредуемого рецептором хемокина CXCR3, содержащим введение субъекту, при необходимости такого лечения или профилактики, терапевтически эффективного количества соединения формулы I. Данное изобретение относится также к способам модуляции CXCR3, включающим контактирование клетки с соединением формулы I. Данное изобретение, кроме того, относится к способам модуляции CXCR3, включающим контактирование белка CXCR3 с соединением формулы I. Краткое описание фигур На фиг. 1 показана общая схема синтеза рацемических замещенных хиназолинонов по изобретению. На фиг. 2 - общий синтез замещенных хинолинов по изобретению. На фиг. 3 - общий синтез замещенных нафталинов по изобретению. На фиг. 4 - общий синтез энантиомерно обогащенных замещенных хиназолинонов и 8-азахиназолинонов по изобретению. На фиг. 5 - общий синтез замещенных бензимидазолов по изобретению. На фиг. 6 - синтез двух региоизомерных замещенных тиазолов по изобретению. На фиг. 7 - общий синтез замещенных бензотиофенов по изобретению. На фиг. 8 - общий синтез замещенных имидазолов по изобретению. На фиг. 9 - общий синтез замещенных триазолинонов по изобретению. На фиг. 10 - общий синтез замещенных пурин-6-онов по изобретению. На фиг. 11 - общий синтез региоизомерных (см. фиг. 1) замещенных хиназолинонов по изобретению. На фиг. 12 - примерные структуры некоторых соединений по изобретению. На фиг. 13 - примерный синтез 8-азахиназолинонов по изобретению. На фиг. 14-18 - пути синтеза примерных соединений по изобретению. На фиг. 19 представлена таблица, показывающая антагонистическую активность CXCR3 для примеров соединений по изобретению. Подробное описание изобретения Определения Термин "алкил", сам по себе или как часть другого заместителя означает, если не указано иного, насыщенный углеводородный радикал с линейной или разветвленной цепью, имеющий обозначенное число атомов углерода (напр., C1-C10 означает содержание от 1 до 10 атомов углерода). Примеры насыщенных углеводородных радикалов включают группы, такие как метил, этил, н-пропил, изопропил, н-бутил,трет-бутил, изобутил, втор-бутил, гомологи и изомеры, например, н-пентил, н-гексил, н-гептил, н-октил и тому подобное. Термин "алкилен" сам по себе или как часть другого заместителя, означает двухвалентный радикал,производный от алкана, как, например, -СН 2 СН 2 СН 2 СН 2-, и, кроме того, включает те группы, которые описаны ниже как "гетероалкилен". Обычно алкильная (или алкиленовая)группа будет иметь от 1 до 24 атомов углерода, причем в данном изобретении предпочтительны такие группы, которые содержат 10 или менее атомов углерода. "Низший алкил" или "низший алкилен" означает алкильную или алкиленовую группу с более короткой цепью, обычно имеющую восемь или менее атомов углерода или более. Термины "алкокси", "алкиламино" и "алкилтио" (или тиоалкокси) использованы в их обычном смысле и относятся к тем алкильным группам, которые присоединены к остальной части молекулы через атом кислорода, аминогруппу или атом серы, соответственно. Подобно этому термин диалкиламино относится к аминогруппе, имеющей две присоединенные алкильные группы, которые могут быть одинаковыми или разными. Термин "гетероалкил", сам по себе или в сочетании с другим термином, означает, если не указано иного, стабильный углеводородный радикал с линейной или разветвленной цепью, состоящий из определенного числа атомов углерода и от одного до трех гетероатомов, выбранных из группы, включающей О,N, Si и S, и где атомы азоты и серы, необязательно, могут быть окисленными, и гетероатом азота, необязательно может быть кватернизованным. Гетероатом(ы) О, N и S могут располагаться в любом положении на гетероалкильной группе. Гетероатом Si может располагаться в любом положении на гетероалкильной группе, включая положение, при котором алкильная группа присоединена к остальной части молекулы. Примеры включают -СН 2-СН 2-О-СН 3, -СН 2-CH2-NH-CH3, -СН 2-СН 2-N(СН 3)-СН 3, -CH2-S-CH2CH3, -CH2-CH2, -S(O)-СН 3, -CH2-CH2-S(O)2-СН 3 и -Si(CH3)3. Вплоть до двух гетероатомов могут быть последовательными так как, например, в -CH2-NH-OCH3 и -СН 2-O-Si(СН 3)3. Когда использован префикс,такой как (C2-C8) по отношению к гетероалкильной группе, число атомов углерода (2-8 в данном приме-3 007538 ре), как подразумевается, включает также гетероатомы. Например, С 2-гетероалкильная группа означает,что она включает, например, -СН 2 ОН (один атом углерода и один гетероатом, замещающий атом углерода) и -CH2SH. Термин "гетероалкилен", сам по себе или как часть другого заместителя, означает двухвалентный радикал, производный гетероалкильной группы, представленный, например, -CH2-CH2-SCH2CH2- и -СН 2-S-CH2-CH2-NH-CH2-. В гетероалкиленовых группах гетероатомы могут также занимать один или оба конца цепи (напр., алкиленокси, алкилендиокси, алкиленамино, алкилендиамино и тому подобное). Кроме того, для связывающих групп алкилена и гетероалкилена никакая ориентация связывающих групп не подразумевается. Термины "циклоалкил" и "гетероциклоалкил", сами по себе или в сочетании с другими терминами,означают, если не указано иного, циклические версии "алкила" и "гетероалкила", соответственно. Дополнительно в гетероциклоалкиле гетероатом может занимать положение, при котором гетероцикл присоединен к остальной части молекулы. Примеры циклоалкила включают циклопентил, циклогексил, 1 циклогексенил, 3-циклогексенил, циклогептил и тому подобное. Примеры гетероциклоалкила включают 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3 морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил,1-пиперазинил, 2-пиперазинил и тому подобное. Термины "гало" или "галоген," сами по себе или как часть другого заместителя, означают, если не указано иного, атом фтора, хлора, брома или йода. Дополнительно, термины, такие как "галогеналкил," означают, что они включают моногалогеналкил и полигалогеналкил. Например, термин "галоген(С 1 С 4)алкил" означает, что он включает трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и тому подобное. Термин "арил" означает, если не указано иного, полиненасыщенный, обычно ароматический, углеводородный заместитель, который может состоять из одного кольца или из нескольких колец (вплоть до трех колец), которые конденсированы или связаны ковалентно. Термин "гетероарил" относится к арильным группам (или кольцам), которые содержат от нуля до четырех гетероатомов, выбранных из N, О и S,где атомы азота и серы необязательно окислены, и атом(ы) азота необязательно кватернизован. Гетероарильная группа может быть присоединена к остальной части молекулы через гетероатом. Неограничительные примеры арил- и гетероарильных групп включают фенил, 1-нафтил, 2-нафтил, 4-дифенил, 1 пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил,4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2 тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4 пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1 изохинолинил, 5-изохинолинил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил, и 6-хинолил. Заместители для каждой из указанных кольцевых систем арила и гетероарила выбраны из группы приемлемых заместителей, описанных ниже. Для краткости, термин "арил", когда его используют в сочетании с другими терминами (напр., арилокси, арилтиокси, арилалкил) включает кольца и арила, и гетероарила, которые определены выше. Так,термин "арилалкил" означает, что он включает те радикалы, где арильная группа присоединена к алкильной группе (напр., бензил, фенетил, пиридилметил и тому подобное), включая те алкильные группы, где атом углерода (напр., метиленовой группы) замещен, например, атомом кислорода (напр., феноксиметил,2-пиридилоксиметил, 3-(1-нафтилокси)пропил и тому подобное). Каждый из указанных терминов (напр., "алкил", "гетероалкил", "арил" и "гетероарил") означает, что он охватывает как замещенные, так и незамещенные формы указанного радикала. Предпочтительные заместители для каждого типа радикала приведены ниже. Заместителями для радикалов алкила и гетероалкила (включая те группы, которые часто называют как алкилен, алкенил, гетероалкилен, гетероалкенил, алкинил, циклоалкил, гетероциклоалкил, циклоалкенил, и гетероциклоалкенил) могут быть разнообразные группы, выбранные из следующего: -OR', =O, =NR', =N-OR', -NR'R", -SR',-галоген, -SiR'R"R"', -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R", -NR"C(O)R', -NR'-C(O)NR"R'",-NR"C(O)2R', -NH-C(NH2)=NH, -NR'С(NH2)=NH, -NH-C(NH2)=NR', -S(O)R', -S(O)2R', -S (O)2NR'R", -CN и-NO2 в количестве в пределах от нуля до (2m'+1), где m' означает общее число атомов углерода в таком радикале.R', R" и R'", каждый, независимо, означает Н, незамещенный (C1-C8)алкил и гетероалкил, незамещенный арил,арил, замещенный 1-3 атомами галогена, алкокси- или тиоалкоксигруппами, или арил-(С 1-С 4) алкильные группы. Когда R' и R" присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием 5-, 6- или 7-членного кольца. Например, -NR'R", как подразумевается, включает 1-пирролидинил и 4-морфолинил. Из приведенного выше обсуждения заместителей специалисту должно быть понятно, что термин"алкил", в его самом широком смысле, подразумевает включение групп, таких как галогеналкил (напр., -CF3 и CH2CF3) и ацил (напр., -С(O)СН 3, -C(O)CF3, -C(O)CH2OCH3 и тому подобное). Предпочтительно, алкильные группы должны иметь 0-3 заместителя, более предпочтительно 0, 1 или 2 заместителя, если не указано иного. Подобным образом, заместители арил- и гетероарильных групп изменяются и выбраны из таких,как: -галоген, -OR1, -OC(O)R', -NR'R", -SR', -R', -CN, -NO2, -CO2R', -CONR'R", -C(O)R', -OC(O)NR'R",-NR"C(O)R', -NR"C(O)2R', -NR'-C(O)NR"R"', -NH-C(NH2)=NH, -NR'C (NH2) =NH, -NH-C (NH2) =NR',-S(O)R', -S(O)2R', -S(O)2NR'R", -N3, -CH(Ph)2, перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкил, в количест-4 007538 ве в пределах от нуля до суммарного числа открытых валентностей на ароматической кольцевой системе,и где R', R" и R"' независимо выбраны из Н, (C1-C8)алкила и гетероалкила, незамещенного арила и гетероарила, (незамещенный арил)-(С 1-С 4)алкила и (незамещенный арил)окси-(C1-C4)алкила. Два заместителя на соседних атомах кольца арила или гетероарила необязательно могут быть замещены заместителем формулы -Т-С(О)-(CH2)q-U-, где Т и U независимо означают -NH-, -O-, -СН 2- или ординарную связь, и q означает целое число от 0 до 2. В качестве варианта, два заместителя на соседних атомах кольца арила или гетероарила необязательно могут быть замещены заместителем формулы -А(СН 2)r-В-, где А и В независимо представляют собой -СН 2-, -O-, -NH-, -S-, -S(O)-, -S(O)2-, -S(O)2NR'- или простую связь, и r означает целое число от 1 до 3. Одна из простых связей образованного таким образом нового кольца необязательно может быть заменена на двойную связь. В качестве варианта, два заместителя на соседних атомах кольца арила или гетероарила необязательно могут быть замещены заместителем формулы - (СН 2)s-X-(CH2)t, где s и t независимо означают целые числа от 0 до 3, и X означает -O-,-NR'-, -S-, -S(O)-, -S(O)2- или -S(O)2NR'-. Заместитель R' в -NR'- и -S(O)2NR'- выбран из водорода и незамещенного (C1-C6)алкила. Используемый здесь термин "гетероатом" означает, что он включает кислород (О), азот (N), серу (S) и кремний (Si). Термин "фармацевтически приемлемые соли" означает, что он включает соли активных соединений, которые получены с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных заместителей, имеющихся у соединений, описанных здесь. Когда соединения по данному изобретению содержат относительно кислотные функциональные группы, могут быть получены аддитивные соли с основанием путем контактирования свободной формы таких соединений с достаточным количеством желательного основания или неразбавленного, или в подходящем инертном растворителе. Примеры фармацевтически приемлемых аддитивных солей с основанием включают соли натрия, калия,кальция, аммония, органического амина или магния или подобную соль. Когда соединения по данному изобретению содержат функциональные группы относительно основного характера, могут быть получены аддитивные соли с кислотой путем контактирования свободной формы таких соединений с достаточным количеством желательной кислоты либо неразбавленной, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых аддитивных солей с кислотой включают соли, полученные с неорганическими кислотами, такие как гидрохлорид, гидробромид, нитрат, карбонат, моногидрокарбонат, фосфат, моногидрофосфат, дигидрофосфат, сульфат, моногидросульфат, гидроиодид или соли фосфористой кислоты или тому подобное, а также соли, полученные с относительно нетоксичными органическими кислотами, такими как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная,янтарная, пробковая, фумаровая, миндальная, фталевая, бензолсульфоновая, п-толуолсульфоновая, лимонная, винная, метансульфоновая и тому подобное. Также включенными являются соли аминокислот,такие как аргинат и тому подобное, и соли органических кислот, таких как глюкуроновая или галактуроновая кислота и тому подобное (смотри, например, Berge, et al. (1977) J. Pharm. Sci. 66:1-19). Некоторые специфические соединения по данному изобретению содержат функциональные группы как основного характера, так и кислотные, что позволяет превращать такие соединения в аддитивные соли или с основанием, или с кислотой. Используемые здесь термины "лечить" или "лечение" относятся к способу облегчения или ограничения прогрессирования болезни и/или сопровождающих ее симптомов. Используемые здесь термины"предотвращать", "предупреждение" или "профилактика" относятся к способу защиты субъекта от заболевания. Свободные формы соединений могут быть регенерированы путем взаимодействия соли с основанием или с кислотой и выделением исходного соединения обычным способом. Свободная форма соединения отличается от различных солевых форм некоторыми физическими свойствами, такими как растворимость в полярных растворителях, но в ином отношении соли эквивалентны свободной форме соединения для целей данного изобретения. Помимо солевых форм данное изобретение относится к соединениям, которые находятся в виде пролекарства. Пролекарства соединений, описанных здесь, - это соединения, которые легко подвергаются химическим изменениям в физиологических условиях, обеспечивая соединения по данному изобретению. В качестве варианта, пролекарства могут быть преобразованы в соединения по данному изобретению химическими или биохимическими методами в среде ex vivo. Например, пролекарства могут медленно преобразовываться в соединения по данному изобретению, когда они помещены в резервуар пластыря для чрескожного введения с подходящим ферментом или химическим реагентом. Пролекарства часто являются полезными, потому что в некоторых ситуациях их можно легче вводить, чем материнское соединение. Они, например, могут быть доступными при оральном введении, тогда, когда само соединение не доступно. Пролекарство может также иметь улучшенную, по сравнению с самим лекарственным соединением, растворимость в фармакологических композициих. Известно широкое разнообразие пролекарственных производных, таких как те, для которых можно уверенно предположить гидролитическое расщепление или окислительную активацию пролекарства. Например, без ограничения, пролекарством могло бы быть соединение по данному изобретению, которое вводят в виде сложного эфира ("пролекар-5 007538 ства"), но затем оно метаболически гидролизуется до карбоновой кислоты, активного начала. Дополнительные примеры включают пептидильные производные соединения по изобретению. Некоторые соединения по данному изобретению могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. Как правило, сольватированные формы эквивалентны несольватированным формам и входят в сферу действия данного изобретения. Некоторые соединения по данному изобретению могут существовать в многочисленных кристаллических или аморфных формах. Как правило, все физические формы эквивалентны для применений,предполагаемых данным изобретением, и должны рассматриваться в объеме данного изобретения. Некоторые соединения по данному изобретению имеют асимметричные атомы углерода (оптические центры) или двойные связи; рацематы, диастереомеры, геометрические изомеры и отдельные изомеры все должны рассматриваться как входящие в сферу действия данного изобретения. Соединения по данному изобретению могут также содержать необычные соотношения атомных изотопов при одном или нескольких атомах, образующих такие соединения. Например, соединения могут быть мечены радиоактивными изотопами, такими как, например, тритий (3 Н), йод-125 (125I) или углерод-14 (14 С). Меченные радиоактивным изотопом соединения могут использоваться в качестве терапевтических агентов, например, средств для лечения рака, реагентов для исследования, например, реагентов анализа связывания, и диагностических агентов, например, агентов визуализации in vivo. Все изотопные вариации соединений по данному изобретению, будь-то радиоактивные или нет, должны рассматриваться в объеме данного изобретения. Воплощение изобретения Данное изобретение относится к соединениям и способам, применимым для модуляции активности рецептора хемокина, в частности CXCR3. Соответственно, соединениями по данному изобретению являются те, которые ингибируют по меньшей мере одну функцию или характеристику белка CXCR3 млекопитающего, например, белка CXCR3 человека. Способность соединения ингибировать такую функцию может быть продемонстрирована в анализе связывания (напр., связывания лиганда или связывания агониста), анализе передачи сигнала (напр., активация белка G млекопитающего, индукция быстрого и временного увеличения концентрации свободного кальция в цитозоле) и/или ответной функции клеток(напр. стимуляция хемотаксиса, экзоцитоза или высвобождение медиатора воспаления лейкоцитами). Соединения Данное изобретение относится к соединениям, которые могут использоваться в качестве антагонистов CXCR3, имеющих особенную полезность для лечения или профилактики воспаления. Предложенные здесь соединения имеют общую формулу (I) где X означает связь, -С (О)-, -C(R5)(R6)-, -C(R5)=, -S(O)-, -S(O)2- или -N=; Z означает связь, -N=, -O-, -S-,-N(R17)- или -C(R7)=, при условии, что X и Z не оба являются связью; L означает связь, С(О)-(C1C8)алкилен, (C1-C8)алкилен или (C2-C8)гетероалкилен; Q означает связь, (C1-C8)алкилен, (C2C8)гетероалкилен, -С(О)-, -ОС(О)-, -N(R8)C(O)-, -CH2CO-, -CH2SO- или -CH2SO2-; и необязательно L и Q могут быть связаны вместе с образованием 5- или 6-членной гетероциклической группы, имеющей от 1 до 3 гетероатомов. Символы R1 и R2 независимо означают Н, (C1-C8)алкил, (C2-C8)гетероалкил, арил или гетероарил, или необязательно объединены с образованием 3-8-членного кольца, имеющего от 0 до 2 гетероатомов в кольце, и необязательно R2 может быть связан вместе с L с образованием 5- или 6 членной гетероциклической группы, имеющей от 1 до 4 гетероатомов. Символ R3 означает гидрокси, (C1C8)алкокси, амино, (C1-C8)алкиламино, ди(C1-C8)алкиламино, (C2-C8)гетероалкил, (C3-C9)гетероциклил,(C1-C8)ациламино, амидино, гуанидино, уреидо, циано, гетероарил, -CONR9R10 или -CO2R11. Символ R4 означает (C1-C20)алкил, (С 2-С 20)гетероалкил, гетероарил, арил, гетероарил(C1-C6)алкил, гетероарил(С 2 С 6)гетероалкил, арил(C1-C6)алкил или арил(С 2-С 6)гетероалкил. Символы R5 и R6 независимо означают Н,(C1-C8)алкил, (C2-C8)гетероалкил, гетероарил или арил, или необязательно R5 и R6 объединены с образованием 3-7-членного кольца. Символы R7 и R8 независимо означают Н, (C1-C8)алкил, (С 2-С 8)гетероалкил,гетероарил или арил. Символы R9, R10 и R11, каждый, независимо, означают Н, (C1-C8)алкил, (C2C8)гетероалкил, гетероарил, арил, гетероарил(C1-C6)алкил, гетероарил(C2-C8)гетероалкил, арил(C1C8)алкил или арил(C2-C8)гетероалкил. Что касается составляющих кольца, Y1, Y2, Y3 и Y4, то символы Y1 и Y2 независимо означают 12-C(R )=, -N=, -O-, -S-, или -N(R13)-. Символ Y3 означает N или С, где атом углерода принимает участие в образовании двойной связи или с Z, или с Y4; и Y4 означает -N(R14)-, -C(R14)=, -N= или -N(R14)С(R15)(R16)-. В указанных группах символ R12 означает Н, галоген, гидрокси, амино, алкиламино, диалки-6 007538 ламино, (C1-C8)алкил, (C2-C8)гетероалкил, гетероарил и арил, или необязательно, когда Y1 и Y2 оба означают -C(R12)=, две группы R12 могут быть объединены с образованием замещенного или незамещенного 5-6-членного циклоалкила, гетероциклоалкила, арила или гетероарила; или необязательно, когда Y1 означает -C(R12)= и X означает -C(R5)= или -C(R5)(R6)-, R12 и R5 могут быть объединены с образованием замещенного или незамещенного 5-6-членного циклоалкила, гетероциклоалкила, арила или гетероарила. Дополнительно, символ R13 означает Н, (C1-C8)алкил, (C2-C8)гетероалкил, гетероарил, арил, гетероарил(C1-C6)алкил, гетероарил (C2-C8)гетероалкил, арил(C1-C8)алкил или арил(C2-C8)гетероалкил. Символ R14 означает (C1-C8)алкил, (C2-C8)гетероалкил, арил(C1-C8)алкил, арил(C2-C8)гетероалкил, гетероарил(C1C8)алкил, гетероарил(C2-C8)гетероалкил, гетероарил и арил; R15 и R16 независимо выбраны из Н, (C1C8)алкила и (C2-C8)гетероалкила; и R17 выбран из таких, как Н, (C1-C8)алкил, (C2-C8)гетероалкил, гетероарил, арил, гетероарил(C1-C6)алкил, гетероарил(C2-C8)гетероалкил, арил(C1-C8)алкил и арил(C2C8)гетероалкил, или, необязательно, когда Y2 означает -C(R12)= или -N(R13)-, R17 может быть объединен сR12 или R13 с образованием замещенного или незамещенного 5-6-членного циклоалкила, гетероциклоалкила, арила или гетероарила; при условии, что, когда Y3-содержащая кольцевая система является кольцевой системой хиназолинона или хинолинона и R4-Q-является замещенным или незамещенным (С 5 С 15)алкилом, тогда R3-L- является иной группой, чем замещенный или незамещенный (C2-C8)алкилен или замещенный или незамещенный (С 2-С 8)гетероалкилен, присоединенный к -NR'R", где R' и R" независимо выбраны из группы, включающей водород и (C1-C18)алкил, или необязательно объединены с атомом азота, к которому каждый из них присоединен, с образованием 5-, 6- или 7-членного кольца. Воплощения, представленные указанной формулой, могут быть осуществлены путем замены кольцевой системы с узлами X, Z, Y1, Y2, Y3 и Y4, соответствующей "структурой", где точки присоединения представлены точками присоединения группы R14 и атома углерода, несущего группы R1 и R2: Например, кольцевая система или "структура" означает то, что она включает следующее (включая их замещенные версии), где кольцо "А" выбрано из таких воплощений, которые показаны как Другими кольцевыми структурами А являются шестичленные кольца (без дополнительных конденсированных колец) и они включают В других воплощениях кольцевыми структурами А являются пятичленные кольца (без дополнительных конденсированных колец) и они включают, например Обычно заместители кольца (показанные как R и R' группы в указанных пятичленных кольцах, но не показанные в системах конценсированных колец или шестичленных кольцах выше) предназначаются,чтобы обеспечивать электронный и/или дополнительный гидрофобный или гидрофильный характер молекуле, чтобы привести все физические характеристики в соответствие с характеристиками наиболее предпочтительных соединений в сериях (см. примеры). В каждой из указанных групп воплощений, R14 предпочтительно означает замещенную или незамещенную арильную группу или замещенную или незамещенную гетероарильную группу. Более предпочтительно, арил- или гетероарильные группы будут иметь от 0 до 3 заместителей. Еще более предпочтительно, 1 или 2 заместителя. Арил- и гетероарильные группы предпочтительно выбраны из таких, как фенил, замещенный фенил, пиридил, замещенный пиридил, тиазолил, замещенный тиазолил, пиримидинил, замещенный пиримидинил, тиенил и замещенный тиенил. Для таких воплощений, имеющих один заместитель, заместитель предпочтительно должен быть в пара-положении по отношению к точке присоединения гетероциклической структуры. В наиболее предпочтительных воплощениях, заместители выбраны из таких, как циано, галоген, (C1-C8)алкокси, (C1-C8)алкил, (C2-C8)гетероалкил, СОNН 2, метилендиокси и этилендиокси. Возвращаясь к формуле I, в одной группе предпочтительных воплощений, X означает -С(О)-. В другой группе, Z означает -N=. Еще в одной группе предпочтительных воплощений, Y1 и Y2, каждый,означают -C(R12)=, где две группы R12 объединены с образованием конденсированного 6-членного арила или гетероарила. Особенно предпочтительными являются те воплощения, которые объединяют указанные предпочтительные группы. Соответственно, в одной группе особенно предпочтительных воплощений X означает -С(О)-; Z означает -N=; Y3 означает С; и Y1 и Y2, каждый, означают -C(R12)=, где две группы R12 объединены с образованием конденсированного 6-членного замещенного или незамещенного арила или гетероарила. В других отдельных, но предпочтительных воплощениях, L означает (C1-C8) алкилен; Q означает-С(О)-, R4 означает (С 5-С 15)алкил, замещенный или незамещенный фенил или дифенил; R3 означает (C1C8)алкокси, (C1-C8)алкиламино, ди(C1-C8)алкиламино, (C2-C8)гетероалкил, (С 3-С 9)гетероциклил, (C1C8)ациламино, циано, гетероарил, -CONR9R10 или -CO2R11; R1 и R2 , каждый, независимо, означают Н или(С 1-С 4)алкил; Y3 означает С, и атом углерода участвует в двойной связи с Z; и Y3-содержащая кольцевая система выбрана из следующих: хинолин, хиназолин, нафталин, хинолинон, хиназолинон, триазолинон,пиримидин-4-он, бензимидазол, тиазол, имидазол, пиридин, пиразин и бензодиазепин. Еще другие предпочтительные воплощения могут быть определены в соответствии с кольцевой структурой А. Например, одну группу предпочтительных воплощений образуют те, в которых X означает -С(О)-; Z означает -N=; Y3 означает С; и Y1 и Y2, каждый, означают -C(R12)=. Более предпочтительно,две группы R объединены с образованием конденсированного 6-членного замещенного или незамещенного арила или гетероарила. Особенно предпочтительными являются те воплощения, где Y4 означает-N(R14)- или -C(R14)=, где группа R14 означает замещенный или незамещенный арил или гетероарил. В другой группе предпочтительных воплощений, X означает -C(R5)(R6)-; Y4 означает -N(R14)-, где R14 означает замещенный или незамещенный арил или гетероарил; Y3 означает С; Z означает -N=; и Y1 и Y2, каждый, означают -C(R12) =. В другой группе предпочтительных воплощений X означает -C(R5)=; Y4 означает -C(R14)=, где R14 означает замещенный или незамещенный арил или гетероарил; Y3 означает С; Z означает -N=; и Y1 и Y2, каждый, означают -C(R12)=. В другой группе предпочтительных воплощений, X означает связь; Y4 означает -N(R14)-, где R14 означает замещенный или незамещенный арил или гетероарил; Y3 означает С; Z означает -N=; и Y1 и Y2, каждый, означают -C(R12)=. В другой группе предпочтительных воплощений, X означает -C(R5)=; Y4 означает -C(R14)=, где R14 означает замещенный или незамещенный арил или гетероарил; Y3 означает С; Z означает -C(R7)=; и Y1 и Y2, каждый, означают-C(R12)=. В другой группе предпочтительных воплощений, X означает связь; Z означает -N= или -N(R17)-;Y4 означает -C(R14)=, где R14 означает замещенный или незамещенный арил или гетероарил; Y1 выбран из группы, включающей -O-, -S- и -N(R13)-; и Y2 означает -C(R12)=. В этой группе воплощений дополнительно предпочтительны такие соединения, где Y1 означает -О- и Z означает -N=; соединения, где Y1 означает -S- и Z означает -N=; и соединения, где Y1 означает -N(R13)- и Z означает -N=. В другой группе предпочтительных воплощений, X означает -SO2-; Y4 означает -N(R14)=, где R14 означает замещенный-8 007538 или незамещенный арил или гетероарил; Y3 означает С; Z означает -N= или -C(R7)=; и Y1 и Y2, каждый,означают -C(R12)=. В другой группе предпочтительных воплощений, X означает связь; Z означает -O-, -Sили -N(R17)-; Y1 означает -N= или -N(R13)-; Y2 означает -C(R12)=; и Y4 означает -C(R14)=, где R14 означает замещенный или незамещенный арил или гетероарил. Особенно предпочтительными воплощениями в этой группе являются те, в которых Y1 означает -N= и Z означает -O-; те, в которых Y1 означает -N= и Z означает -S-; и те, в которых Z означает -N(R17)-. В другой группе предпочтительных воплощений, X означает связь; Y1 означает -N(R13)- или =N-; Y2 означает -C(R12)=; Y3 означает С; Y4 означает -C(R14)=, гдеR14 означает замещенный или незамещенный арил или гетероарил; и Z означает -N(R17)- или =N-, при условии, что Y1 и Z не являются оба =N-. В другой группе предпочтительных воплощений, X означает связь; Y1 и Y2, каждый, независимо, означают -C(R12)=; Y3 означает С; Y4 означает -C(R14)=, где R14 означает замещенный или незамещенный арил или гетероарил; и Z означает -N(R17)-, О или S. Более предпочтительно, две группы R12 объединены с образованием конденсированного 5- или 6-членного замещенного или незамещенного арила или гетероарила. В другой группе предпочтительных воплощений, X означает -С (О)-; Y1 означает -N(R13)-; Y2 означает -N=; Y3 означает С; Y4 означает -N(R14)-, где R14 означает замещенный или незамещенный арил или гетероарил; и Z означает связь. В другой группе предпочтительных воплощений, X означает -С(О)-; Z означает -N(R17)-, где R17 означает замещенный или незамещенный арил или гетероарил; Y1 и Y2, каждый, независимо, означают -C(R12)=; Y3 означает С; и Y4 означает -N=. В другой группе предпочтительных воплощений, X и Z означают -N=, Y1 и Y2, каждый,независимо, означают -C(R12)=; Y3 означает С; и Y4 означает -C(R14)=, где R14 означает замещенный или незамещенный арил или гетероарил. В другой группе предпочтительных воплощений, где X означает-С(О)-; Y4 означает -N(R14)-С(R5)(R6)-; где R14 означает замещенный или незамещенный арил или гетероарил; Y1 и Y2, каждый, независимо, означают -C(R12)=; Y3 означает С; и Z означает -N=. В каждой из указанных групп предпочтительных воплощений R1 наиболее предпочтительно означает Н. В одной особенно предпочтительной группе воплощений кольцо А означает конденсированную 6,6 или 6,5-членную кольцевую систему, имеющую указанные азотные составляющие (см. формулу II). В формуле II каждый из A1, A2, A3 и А 4 означает независимо С или N. Предпочтительно не более,чем два из А 1-А 4 означают N. Кроме того, X означает -СО-, -СН 2- или связь; R1 и R2, каждый, независимо,означают Н или (С 1-С 4)алкил; R14 означает замещенный или незамещенный фенил, пиридил, тиазолил,тиенил или пиримидинил; Q означает -СО-; L означает (C1-C8)алкилен; нижний индекс n означает целое число от 0 до 4; и каждый Ra независимо выбран из галогена, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2,-CO2R', -CONR'R", -C(O)R', -OC(O)NR'R", -NR"C(O)R', -NR"C(O)2R', -NR'-C(O)NR"R'", -NH-C(NH2)=NH,-NR'C(NH2)=NH, -NHC(NH2)=NR', -S(O)R', -S(O)2R', -S(O)2NR'R", -N3, -CH(Ph)2, перфтор (С 1-С 4)алкокси,и перфтор(С 1-С 4)алкила, где R', R" и R'", каждый, независимо, выбраны из Н, (C1-C8)алкила, (С 2 С 8)гетероалкила, незамещенного арила, незамещенного гетероарила, (незамещенного арила)-(С 1 С 4)алкила и (незамещенный арил)окси-(C1-C4)алкила. Остальные символы, R3 и R4, имеют значения (и предпочтительные группы) указанные выше. Еще более предпочтительно, соединение имеет формулу (III) где А 4 означает С или N; X означает -СО-, -СН 2- или связь; R1 и R2, каждый, независимо, означают Н или (С 1-С 4) алкил; R14 означает замещенный или незамещенный фенил, пиридил, тиазолил, тиенил или пиримидинил; Q означает -СО-; L означает (C1-C8)алкилен; нижний индекс n означает целое число от 0 до 4; и каждый Ra независимо выбран из группы, включающей галоген, -OR', -OC(O)R', -NR'R", -SR', -R',-CN, -NO2, -CO2R', -CONR'R", -C(O)R', -OC(O)NR'R", -NR"C(O)R', -NR"C(O)2R', -NR'-C(O)NR"R'", -NHC(NH2)=NH, -NR'C(NH2)=NH, -NHC(NH2)=NR', -S(O)R', -S(O)2R', -S(O)2NR'R", -N3, -CH(Ph)2, перфтор(С 1 С 4)алкокси и перфтор(С 1-С 4)алкил, где R', R" и R'", каждый, независимо, выбраны из группы, включающей Н, (C1-C8)алкил, (С 2-С 8)гетероалкил, незамещенный арил, незамещенный гетероарил, (незамещенный арил)-(C1-C4)алкил и (незамещенный арил)окси-(С 1-С 4)алкил. Остальные символы, R3 и R4, имеют значения (и предпочтительные группы), указанные выше. В одной группе предпочтительных воплощений X означает -СО-. В другой группе предпочтитель-9 007538 ных воплощений X означает -СН 2-. Еще в одной группе предпочтительных воплощений X означает связь. Дополнительно предпочтительными соединениями формулы III являются такие, где R1 означает метил, этил или пропил, и R2 означает водород или метил. Более предпочтительно R1 и R2, каждый, означают метил. Еще другими предпочтительными соединениями формулы III являются такие, где R3 выбран из замещенного или незамещенного пиридила или замещенного или незамещенного имидазолила. Предпочтительны также такие соединения формулы III, где R4 означает замещенную или незамещенную бензильную группу, где заместители выбраны из галогена, галоген (C1-C4)алкила, галоген (C1-C4)алкокси,циано, нитро и фенила. Предпочтительной группой для L является (С 1-С 4)алкилен. Предпочтительны также такие соединения формулы III, где R14 выбран из замещенного фенила, замещенного пиридила,замещенного тиазолила и замещенного тиенила, где заместители выбраны из циано, галогена, (C1C8)алкокси, (C1-C8)алкила, (С 2-С 8)гетероалкила, CONH2, метилендиокси и этилендиокси. Еще дополнительно предпочтительны такие соединения, которые объединяют две или более из предпочтительных групп, перечисленных выше. В особенно предпочтительных воплощениях соединений формулы III X означает -СО-; R1 и R2, каждый, независимо, выбраны из группы, включающей Н, метил и этил; R14 выбран из группы, включающей замещенный и незамещенный фенил; Q означает -СО-; L означает метилен, этилен или пропилен, R3 выбран из группы, включающей замещенный или незамещенный пиридил и замещенный или незамещенный имидазолил; R4 означает замещенный или незамещенный бензил, где указанные заместители выбраны из группы, включающей галоген, галоген(С 1-С 4)алкил, галоген(C1-C4)алкокси, циано, нитро и фенил; и каждый Ra выбран из группы, включающей галоген, -OR', -OC(O)R', -NR'R", -SR', -R', -CN,-NO2, -CO2R', -CONR'R", -C(O)R', -NR"C(O)R', -NR'-C(O)NR"R'" , перфтор(С 1-С 4)алкокси и перфтор(С 1 С 4)алкил, где R', R" и R'", каждый, независимо, выбраны из группы, включающей Н, (C1-C8)алкил, (C2C8)гетероалкил, незамещенный арил, незамещенный гетероарил, (незамещенный арил)-(C1-C4)алкил и(незамещенный арил)окси-(C1-C4)алкил. Примерами структур внутри этой предпочтительной группы воплощений являются Получение соединений На фиг. 1-18 показаны разнообразные пути синтеза предложенных здесь соединений. Специалист в этой области техники должен учитывать, что заместители (напр. R', R", R, Riv и т.д.) могут быть заменены до, во время и после получения гетероциклической несущей основы и что могут быть сделаны соответствующие коррективы в условиях осуществления примеров (напр. температуры, растворители и т.д.). Кроме того, специалисту должно быть понятно, что для получения конкретных соединений могут быть необходимы защитные группы, и ему известны условия, совместимые с выбранной защитной группой. Примерные способы и примеры, описанные здесь, являются иллюстрацией данного изобретения и не должны быть истолкованы как ограничивающие сферу его действия. Композиции В другом аспекте данное изобретение относится к фармацевтическим композициям для модулирования активности рецептора хемокина у людей и животных. Композиции содержат соединение по данному изобретению с фармацевтически приемлемым носителем или разбавителем. Используемый здесь в его различных формах термин "модуляция" или модулирование активности рецептора хемокина предназначается для охвата антагонизма, агонизма, частичного антагонизма и/или частичного агонизма активности, связанной с конкретным рецептором хемокина, предпочтительно рецептором CXCR3. Используемый здесь термин "композиция" предназначается для того, чтобы охватывать продукт, содержащий специфические ингредиенты (и в специфических количествах, если указано),а также любой продукт, который является результатом, непосредственно или косвенно, объединения- 10007538 специфических ингредиентов в специфических количествах. Под "фармацевтически приемлемым" подразумевается, что носитель, разбавитель или наполнитель должен быть совместимым с другими ингредиентами композиции и не быть вредными для реципиента. Фармацевтические композиции для введения соединений по данному изобретению обычно могут быть представлены в виде стандартной дозированной формы и могут быть приготовлены каким-либо из способов, хорошо известных в фармации. Все способы включают стадию приведения активного ингредиента в контакт с носителем, который содержит один или несколько вспомогательных ингредиентов. Как правило, фармацевтические композиции получают путем достижения равномерной и тесной связи активного ингредиента с жидким носителем или тонкоизмельченным носителем, или с обоими, и затем,если необходимо, придания продукту формы желательного препарата. В фармацевтическую композицию активное соединение включают в количестве, достаточном, чтобы обеспечить желательное воздействие на течение или состояние болезней. Фармацевтические композиции, содержащие активный ингредиент, могут быть в форме, подходящей для орального применения, например, такой как таблетки, пастилки, лепешки, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы или сиропы или эликсиры. Композиции, предназначенные для орального применения, могут быть получены любым известным в технике способом производства фармацевтических композиций, и такие композиции могут содержать один или несколько агентов, выбранных из группы, состоящей из подслащивателей, ароматизаторов, окрашивающих агентов и консервантов, для того чтобы обеспечить фармацевтически первоклассные и приемлемые по вкусовым ощущениям препараты. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, которые являются подходящими для изготовления таблеток. Этими наполнителями могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и разрыхляющие агенты, например кукурузный крахмал или альгиновая кислота; связующие агенты, например крахмал, желатин или камедь акации, и смазывающие агенты, например стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без покрытия, или они могут быть покрыты путем известных технологий, чтобы задержать разрушение и абсорбцию в желудочно-кишечном тракте и тем самым обеспечить замедленное воздействие в течение более продолжительного периода. Например, может быть использован материал, задерживающий высвобождение, такой как глицерилмоностеарат или глицерилдистеарат. Они могут быть также покрыты методами, описанными в патентах США 4256108, 4166452 и 4265874, чтобы сформировать осмотические терапевтические таблетки для регулируемого высвобождения. Композиции для орального применения могут быть также представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или как мягкие желатиновые капсулы, где активный ингредиент смешан с водной или маслянистой средой, например с арахисовым маслом, жидким парафином или оливковым маслом. Водные суспензии содержат активные материалы в смеси с наполнителями, подходящими для получения водных суспензий. Такими наполнителями являются суспендирующие вещества, например натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и камедь акации; диспергирующими или смачивающими агентами могут быть встречающиеся в природе фосфатиды, например лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например стеарат полиоксиэтилена, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и гексита, такие как моноолеат полиоксиэтиленсорбита, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и ангидридов гексита,например моноолеат полиэтиленангидросорбита. Водные суспензии могут также содержать один или несколько консервантов, например этил- или н-пропил-, п-гидроксибензоат, или один или несколько окрашивающих агентов, один или несколько ароматизирующих агентов и один или несколько подслащивателей, таких как сахароза или сахарин. Масляные суспензии могут быть приготовлены суспендированием активного ингредиента в растительном масле, например в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле,или в минеральном масле, таком как жидкий парафин. Маслянистые суспензии могут содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Подслащиватели такие как те,которые указаны выше, и ароматизирующие агенты могут быть добавлены, чтобы обеспечить приемлемый по вкусу оральный препарат. Эти композиции могут быть предохранены от порчи добавлением антиоксиданта, такого как аскорбиновая кислота. Диспергируемые порошки и гранулы, подходящие для приготовления водной суспензии путем добавления воды, обеспечивают активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или несколькими консервантами. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты представлены теми примерами, которые уже упо- 11007538 минались выше. Могут также присутствовать дополнительные наполнители, например подслащивающие, ароматизирующие и окрашивающие агенты. Фармацевтические композиции по изобретению могут быть также в виде эмульсий масло-в-воде. Масляной фазой может быть растительное масло, например оливковое масло или арахисовое масло, или минеральное масло, например жидкий парафин, или их смеси. Подходящими эмульгаторами могут быть встречающиеся в природе камеди, например камедь акации или трагакантовая камедь, встречающиеся в природе фосфатиды, например соевые, лецитин, и сложные эфиры или неполные сложные эфиры, полученные из жирных кислот и ангидридов гексита, например моноолеат ангидросорбита, и продукты конденсации указанных неполных сложных эфиров с этиленоксидом, например моноолеат полиоксиэтиленангидросорбита. Эмульсии могут также содержать подслащивающие и ароматизирующие агенты. Сиропы и эликсиры могут быть приготовлены с подсластителями, например с глицерином, пропиленгликолем, сорбитом или сахарозой. Такие композиции могут также содержать средство, уменьшающее раздражение, консервант и ароматизирующие и окрашивающие агенты. Фармацевтические композиции могут быть в виде стерильной водной или масляной суспензии для инъекций. Эта суспензия может быть приготовлена в соответствии с известной практикой с использованием тех подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были указаны выше. Стерильным препаратом для инъекций может быть также стерильный раствор или суспензия для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, таком как, например, раствор в 1,3-бутандиоле. К числу приемлемых носителей и растворителей, которые могут быть использованы, относятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того,обычно могут быть использованы стерильные нелетучие масла в качестве растворителя или суспендирующей среды. Для этой цели может быть использовано какое-либо смешанное нелетучее масло, содержащее моно- или диглицериды. Кроме того, при получении препаратов для инъекций находят применение жирные кислоты, такие как олеиновая кислота. Соединения по данному изобретению могут быть также введены в виде суппозиториев для ректального введения лекарства. Такие композиции могут быть приготовлены смешиванием лекарства с подходящим нераздражающим наполнителем, который является твердым при обычных температурах, но жидким при температуре прямой кишки и поэтому будет плавиться в прямой кишке, чтобы высвободить лекарство. Такими материалами являются масло какао и полиэтиленгликоли. Для местного применения могут быть использованы кремы, мази, желе, растворы или суспензии и т.п. Используемый здесь термин "местное применение" включает также применение жидкостей для промывания и полоскания рта. Фармацевтический композиция и способ по данному изобретению могут дополнительно содержать другие терапевтически активные соединения, как отмечено здесь, которые обычно применяют для лечения или профилактики указанных выше патологических состояний. Способы применения В еще одном аспекте, данное изобретение относится к способам лечения СХСR3-опосредуемых состояний или заболеваний введением субъекту с таким заболеванием или состоянием, терапевтически эффективного количества соединения или композиции по изобретению. Понятие "субъект", как определено здесь, включает животных, таких как млекопитающие, включая, но этим не ограничивается, приматов (напр. людей), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей и тому подобное. Используемое здесь выражение "СХСR3-опосредуемое состояние или болезнь" и подобные выражения и термины относятся к состоянию, характеризующемуся несвойственной, меньшей чем или большей чем нормальная, активностью CXCR3. Несвойственная активность CXCR3 может возникать как результат экспрессии CXCR3 в клетках, которые обычно не экспрессируют CXCR3, повышенной экспрессии CXCR3 (ведущей, напр., к воспалительным и иммунорегуляторным нарушениям и болезням), или пониженной экспрессии CXCR3 (ведущей, напр., к конкретным раковым заболеваниям и нарушениям,относящимся к образованию и развитию кровеносных сосудов). Несвойственная функциональная активность CXCR3 может также возникать как результат секреции хемокина клетками, которые обычно не секретируют хемокин СХС, усиленной экспрессии хемокина (ведущей, напр., к воспалительным и иммунорегуляторным нарушениям и болезням), или пониженной экспрессии хемокина. СХСR3-опосредуемое состояние или заболевание может быть полностью или частично опосредовано несвойственной функциональной активностью CXCR3. Однако CXCR3-опосредуемое состояние или заболевание является таким, где модуляция CXCR3 имеет результатом некоторое влияние на основное состояние или заболевание (напр. антагонист CXCR3 имеет результатом некоторое улучшение самочувствия по меньшей мере у некоторых пациентов). Термин "терапевтически эффективное количество" означает количество рассматриваемого соединения, которое будет вызывать биологическую или медицинскую реакцию ткани, системы, животного или человека, который поддается обнаружению исследователем, ветеринаром, практикующим врачом или клиницистом, или которое является достаточным, чтобы предотвратить развитие или облегчить до некоторой степени один или несколько симптомов заболевания, подвергаемого лечению.- 12007538 Болезни и состояния, связанные с воспалением, инфекцией и раком можно лечить данными соединениями и композициями. В одной группе воплощений, болезни или состояния, включая хронические болезни людей или других видов можно лечить ингибиторами функции CXCR3. Эти болезни или состояния включают: (1) воспалительные или аллергические заболевания, такие как системная анафилаксия или реакции гиперчувствительности, лекарственные аллергии, аллергии на укусы насекомых и пищевые аллергии; воспалительные болезни кишечника, такие как болезнь Крона, язвенный колит, илеит и энтерит; вагинит, псориаз и воспалительные дерматозы, такие как дерматит, экзема, атопический дерматит, аллергический контактный дерматит, крапивница, васкулит, спондилоартропатии, склеродермия,астма и респираторные аллергические болезни, такие как аллергический ринит, аллергические болезни легких и тому подобное, (2) аутоиммунные болезни, такие как артрит (ревматоидный или псориатический), рассеянный склероз, системная красная волчанка, диабет типа I, гломерулонефрит и тому подобное, (3) отторжение трансплантата (включая отторжение аллотрансплантата и гомологичную болезнь) и связанные с этим состояния и (4) другие болезни, при которых нежелательные воспалительные реакции должны быть подавлены, напр. атеросклероз, миозит, нейродегенеративные болезни (напр. болезнь Альцгеймера), энцефалит, менингит, гепатит, нефрит, сепсис, саркоидоз, конъюктивит, отит, хроническая обструктивная легочная болезнь, синусит и синдром Бехчета. В другой группе воплощений, болезни или состояния лечат агонистами функции CXCR3. Примеры болезней для лечения агонистами CXCR3 включают разновидности рака, болезни, где играет роль развитие и новообразование сосудов (болезни,относящиеся к образованию опухолей, ретинопатия и дегенерация желтого пятна), инфекционные болезни и иммуносупрессивные болезни. Предпочтительно, данные способы направлены на лечение или предотвращение болезней или состояний, выбранных из таких как нейродегенеративные болезни (напр. болезнь Альцгеймера), рассеянный склероз, системная красная волчанка, ревматоидный артрит, атеросклероз, энцефалит, менингит,гепатит, нефрит, сепсис, саркоидоз, псориаз, экзема, крапивница, диабет типа I, астма, конъюктивит,отит, аллергический ринит, хроническая обструктивная легочная болезнь, синусит, дерматит, воспалительная болезнь кишечника, язвенный колит, болезнь Крона, синдром Бехчета, подагра, рак, вирусные инфекции (напр., ВИЧ), бактериальные инфекции и состояния трансплантации органа или состояния трансплантации кожи. Термин "состояния трансплантации органа" охватывает состояния трансплантации костного мозга и состояния трансплантации цельного органа (напр., почки, печени, легкого, сердца,поджелудочной железы или их сочетания). Болезни и состояния, которые можно лечить данными соединениями и композициями, включают болезни, обычно связанные с (1) воспалительными или аллергическими болезнями, (2) аутоиммунными болезнями, (3) отторжением трансплантата и (4) другими болезнями, где нежелательные воспалительные реакции должны быть подавлены, которые описаны выше. Например, рестеноз, наступающий после такой процедуры, как пластическая операция на сосудах с введенем баллончика, обычно связан с атеросклерозом, и его можно лечить данными соединениями и композициями. В зависимости от болезни, которая требует лечения и состояния субъекта, соединения по данному изобретению могут вводиться оральным, парентеральным путем (например, внутримышечной, интраперитонеальной, внутривенной, ICV, внутриполостной инъекцией или вливанием, подкожной инъекцией или имплантатом), распылением для ингаляции, назальным, вагинальным, ректальным, сублингвальным или местным путями введения и могут быть приготовлены отдельно или вместе в форме подходящих унифицированных дозированных препаратов, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители, подходящие для каждого пути введения. При лечении или профилактике состояний, которые требуют модуляции рецептора хемокина, подходящий уровень дозировки обычно будет от около 0,001 до 100 мг на кг массы тела пациента в сутки,это количество может быть введено одной дозой или несколькими дозами. Предпочтительно, уровень дозировки будет от около 0,01 до около 25 мг/кг в сутки, более предпочтительно от около 0,05 до около 10 мг/кг в сутки. Подходящим уровнем дозировки может быть от около 0,01 до 25 мг/кг в сутки, от около 0,05 до 10 мг/кг в сутки или от около 0,1 до 5 мг/кг в сутки. В этих пределах доза может быть 0,005-0,05,0,05-0,5 или 0,5-5,0 мг в сутки. Для орального введения предпочтительны композиции в форме таблеток,содержащих от 1,0 до 1000 мг активного ингредиента, в частности 1,0, 5,0, 10,0, 15,0, 20,0, 25,0, 50,0,75,0, 100,0, 150,0, 200,0, 250,0, 300,0, 400,0, 500,0, 600,0, 750,0, 800,0, 900,0 и 1000,0 мг активного ингредиента для симптоматического подбора точной дозы для пациента, которому необходимо лечение. Соединения могут быть введены в режиме от 1 до 4 раз в сутки, предпочтительно за один или за два приема в сутки. Следует учесть, однако, что конкретная величина дозы и частота приема для каждого конкретного рациента могут изменяться и будут зависеть от разнообразных факторов, включая активность конкретного используемого соединения, метаболическую устойчивость и продолжительность действия этого соединения, возраст, массу тела, общее состояние здоровья, пол, диету, способ и время введения, скорость выведения, сочетание лекарств, тяжесть конкретного состояния и терапию, которой подвергается реципиент. Соединения по данному изобретению могут быть объединены с другими соединениями, имеющими- 13007538 сходные полезные эффекты для лечения или профилактики воспалительных и иммунных расстройств и болезней, включая астму и аллергические болезни, а также аутоиммунные патологии, такие как ревматоидный артрит и атеросклероз, и те патологии, которые указаны выше. Во многих случаях, композиции,которые включают соединение по изобретению и альтернативный или второй терапевтический агент,имеют дополнительные или синергические эффекты при введении. Например, при лечении или профилактике воспаления данные соединения могут быть использованы вместе или в сочетании с противовоспалительным агентом или аналгетиком, таким как агонист опиата, ингибитором липоксигеназы, таким как ингибитор 5-липоксигеназы, ингибитором циклооксигеназы,таким как ингибитор циклооксигеназы-2, ингибитором интерлейкина, таким как ингибитор интерлейкина-1, антагонистом NMDA, ингибитором оксида азота или ингибитором синтеза оксида азота, нестероидным противовоспалительным агентом или подавляющим цитокин противовоспалительным агентом,например с соединением, таким как ацетаминофен, аспирин, кодеин, фентанил, ибупрофен, индометацин, кеторолак, морфин, напроксен, фенацетин, пироксикам, стероидный аналгетик, суфентанил, сунлиндак, тенидап и тому подобное. Подобно этому данные соединения могут быть введены со средством,облегчающим боль, потенцирующим средством, таким как кофеин, противозастойным средством, таким как фенилефрин, фенилпропаноламин, псевдофедрин, оксиметазолин, эфинефрин, нафазолин, ксилометазолин, пропилгекседрин или леводезоксиэфедрин; средством против кашля, таким как кодеин, гидрокодон, карамифен, карбетапентан или декстрометорфан; с диуретиком и седативным или несадативным антигистамином. Подобным образом, соединения по данному изобретению могут быть использованы в сочетании с другими лекарствами, которые используют для лечения/профилактики/подавления или облегчения болезней или состояний, где применимы соединения по данному изобретению. Такие другие лекарства могут быть введены таким путем и в таком количестве, которые обычно используются для них, одновременно или последовательно с соединением по данному изобретению. Когда соединение по данному изобретению используют одновременно с одним или несколькими другими лекарствами, предпочтительна фармацевтическая композиция, содержащая такие другие лекарства в дополнение к соединению по данному изобретению. Соответственно, фармацевтические композиции по данному изобретению включают и те, которые также содержат один или несколько других активных ингредиентов в дополнение к соединению по данному изобретению. Примеры других активных ингредиентов, которые могут быть объединены с соединением по данному изобретению, включают, но без ограничения указанным: (а) антагонисты VLA-4, (b) стероиды, такие как беклометазон, метилпреднизолон, бетаметазон,преднизон, дексаметазон и гидрокортизон; (с) иммуносупрессанты, такие как циклоспорин (циклоспоринA, Sandimmune, Neoral), такролимус (FK-506, Prograf), рапамицин (сиролимус, Rapamune) и другие иммуносупрессанты типа FK-506 и микофенолят, напр. микофенолят мофетил (CellCept); (d) антигистаминные средства (антагонисты Н 1-гистамина), такие как бромфенирамин, хлорфенирамин, дексхлорфенирамин, трипролидин, клемастин, дифенгидрамин, дифенилпиралин, трипиленнамин, гидроксизин,метдилазин, прометазин, тримепразин, азатадин, ципрогептадин, антазолин, фенирамин периламин, астемизол, терфенадин, лоратидин, цетиризин, фексофенадин, дезкарбоэтоксилоратадин и тому подобное;(е) нестероидные средства против астмы, такие как бета-2-агонисты (тербуталин, метапротеренол, фенотерол, изоэтарин, албутерол, битолтерол и пирбутерол), теофиллин, кромолин натрий, атропин, бромид ипратропия, антагонисты лейкотриена (зафирлукаст, монтелукаст, пранлукаст, иралукаст, побилукаст,SBK-106, 203), ингибиторы биосинтеза лейкотриена (зилеутон, BAY-1005); (f) нестероидные противовоспалительные агенты (NSAIDs), такие как производные пропионовой кислоты (алминопрофен, беноксапрофен, буклоксовая кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флубипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен, напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен,тиапрофеновая кислота и тиоксапрофен), производные уксусной кислоты (индометацин, ацеметацин,аклофенак, клиданак, диклофенак, фенклофенак, фенклозиевая кислота, фентиазак, ибуфенак, изоксерак,окспинак, сулиндак, тиопинак, толметин, цидометацин и зомепирак), производные фенамовой кислоты(флуфенамовая кислота, мефенамовая кислота, нифлуминовая кислота и толфенамовая кислота), производные дифенилкарбоновой кислоты (дифлунизал и флуфенизал), оксикамы (изоксикам, пироксикам,судоксикам и теноксикам), салицилаты (ацетилсалициловая кислота, сульфасалазин) и пиразолоны (апазон, безпиперилон, фепразон, мофебутазон, оксифенбутазон, фенилбутазон); (g) ингибиторы циклооксигеназы-2 (СОХ-2), такие как целекоксиб (Celebrex) и рофекоксиб (Vioxx); (h) ингибиторы фосфодиэстеразы типа IV (PDE-IV); (i) соединения золота, такие как ауранофин и ауротиоглюкоза, (j) другие антагонисты рецепторов хемокина, особенно CCR1, CCR2, CCR3, CCR5, CCR6, CCR8 и CCR10; (k) агенты,снижающие содержание холестерина, такие как ингибиторы редуктазы HMG-CoA (ловастатин, симвастатин и правастатин, флувастатин, аторвастатин и другие статины), вещества, усиливающие экскрецию,(холестирамин и колестипол), никотиновая кислота, производные фенофибриновой кислоты (гемфиброзил, клофибрат, фенофибрат и бензафибрат) и пробукол; (l) антидиабетические агенты, такие как инсулин, сульфонилмочевины, бигуаниды (метформин), ингибиторы -глюкозидазы (акарбоза) и глитазоны(троглитазон и пиоглитазон); (m) препараты интерферона бета (интерферон -1, интерферон -1); (n) этанерцепт (Enbrel), (о) средства для лечения антителами, такие как ортоклон (ОКТ-3), даклизумаб(Zenapax), инфликсимаб (Remicade), базиликсимаб (Simulect) и антитела против лиганда CD-40(напр., MRP-1) и (р) другие соединения, такие как 5-аминосалициловая кислота и ее пролекарства, гидроксихлорохин, D-пеницилламин, антиметаболиты, такие как азатиопрен и 6-меркаптопурин, и цитотоксичные агенты для химиотерапии рака. Массовое отношение соединения по данному изобретению ко второму активному ингредиенту может изменяться и будет зависеть от эффективной дозы каждого ингредиента. Как правило, будет использоваться эффективная доза каждого. Так, например, когда соединение по данному изобретению объединяют с NSAID, массовое отношение соединения по данному изобретению к NSAID обычно будет находится в пределах от около 1000:1 до около 1:1000, предпочтительно от около 200:1 до около 1:200. Сочетания соединения по данному изобретению и других активных ингредиентов также обычно будут находиться в указанных пределах, но в каждом случае должна быть использована эффективная доза каждого активного ингнредиента. Иммуносупрессанты в сфере действия данного изобретения дополнительно включают, но без ограничения указанным, лефлуномид, RAD001, ERL080, FTY720, CTLA-4, средства для лечения антителами,такие как ортоклон (ОКТ 3), даклизумаб (Zenapax) и базиликсимаб (Simulect), и глобулины против тимоцитов, такие как тимоглобулины. В особенно предпочтительных воплощениях данные способы направлены на лечение или профилактику рассеянного склероза с использованием соединения по изобретению либо одного, либо в сочетании со вторым терапевтическим агентом, выбранным из таких, как бетасерон, авонекс, азатиопрен(Imurek, Imuran), капоксон, преднизолон и циклофосфамид. При использовании в сочетании практикующий врач может назначать для введения пациенту сочетание терапевтических агентов, или введение может быть последовательным. Еще в одном из особенно предпочтительных воплощений данные способы направлены на лечение или профилактику ревматоидного артрита, где соединение по изобретению вводят либо одно, либо в сочетании со вторым терапевтическим агентом, выбранным из группы, включающей такие агенты, как метотрексат, сульфасалазин, гидроксихлорохин, циклоспорин А, D-пеницилламин, инфликсимаб(Remicade), этанерцепт (Enbrel), ауранофин и ауротиоглюкоза. Еще в одном из особенно предпочтительных воплощений данные способы направлены на лечение или профилактику состояния трансплантации органа, где соединение по изобретению используют либо одно, либо в сочетании со вторым терапевтическим агентом, выбранным из группы, включающей такие агенты, как циклоспорин A, FK-506, рапамицин, микофенолят, преднизолон, азатиопрен, циклофосфамид и глобулин против лимфоцитов. Еще в одном аспекте данное изобретение относится к способам оценки предполагаемых специфических агонистов или антагонистов функции CXCR3. Соответственно, данное изобретение направлено на применение этих соединений для приготовления и выполнения скрининг-анализов соединений, которые модулируют активность рецептора хемокина CXCR3. Например, соединения по изобретению применимы для изоляции мутантов рецептора, которые являются превосходными инструментами скринига для более сильнодействующих соединений. Более того, соединения по данному изобретению применимы для создания или определения сайта связывания других соединений с рецептором хемокина CXCR3, например, путем конкурентного ингибирования. Соединения по данному изобретению применимы также для оценки предполагаемых специфических модуляторов рецептора хемокина CXCR3 по отношению к другим рецепторам хемокина, включая CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR8,CCR10, CXCR3 и CXCR4. Специалисту будет понятно, что тщательная оценка специфических агонистов и антагонистов указанных рецепторов хемокина затруднена отсутствием доступности непептидильных(метаболически стойких) соединений с высоким сродством связывания для этих рецепторов. Поэтому соединения, предложенные здесь, особенно полезны в этом контексте. Комбинаторные библиотеки предполагаемых агонистов или антагонистов CXCR3 могут быть подвергнуты проверке на фармакологическую активность в анализах in vitro и in vivo. Обычно новые химические сущности с полезными свойствами генерируются путем идентификации химического соединения (называемого "ведущим соединением") с некоторым желательным свойством или активностью, например с активностью модуляции рецептора хемокина CXCR3, создания воплощений ведущего соединения и оценки свойства и активности этих вариантных соединений. Однако современной тенденцией является сокращение масштабов времени для всех аспектов открытия лекарства. Благодаря возможности тестировать большое число объектов быстро и эффективно, методы скрининга с высокой производительностью (HTS) заменяют традиционные методы идентификации ведущего соединения. В одном предпочтительном воплощении методы скринига с высокой производительностью предусматривают обеспечение библиотеки, содержащей большое число потенциальных терапевтических соединений (соединений-кандидатов). Такие "комбинаторные химические библиотеки" затем подвергают скринингу в одном или нескольких анализах, чтобы установить те члены библиотеки (конкретные химические виды или подклассы), которые проявляют желательную характерную активность. Идентифицированные таким образом соединения могут служить обычными "ведущими соединениями", или сами могут быть использованы в качестве потенциальных или актуальных терапевтических средств. Комбинаторная химическая библиотека является коллекцией разнообразных химических соедине- 15007538 ний, созданных или химическим синтезом, или биологическим синтезом путем объединения некоторого числа химических "строительных блоков", таких как реагенты. Например, линейная комбинаторная химическая библиотека, такая как полипептидная (напр. мутеиновая) библиотека формируется объединением набора химических строительных блоков, названных аминокислотами, любым возможным путем для заданной длины соединения (т.е. числа аминокислот в полипептидном соединении). Миллионы химических соединений могут быть синтезированы путем такого комбинаторного смешения химических строительных блоков (Gallop et al, (1994) J. Med. Chem. 37(9): 1233-1251). Приготовление и скриниг комбинаторных химических библиотек хорошо известны специалистам. Такие комбинаторные библиотеки включают, но без ограничения, библиотеки пептидов (смотри, напр.,Патент США 5010175, Furka (1991) Int. J. Pept. Prot. Res. 37:487-493, Houghton et. al. (1991) Nature 354: 84-88), библиотеки пептоидов (публикация РСТWO 91/19735), библиотеки кодированных пептидов(РСТ Publication WO 93/20242), библиотеки статистических биоолигомеров (публикация РСТ WO 92/00091), библиотеки бензодиазепинов (патент США 5288514), библиотеки диверсомеров, таких как гидантоины, бензодиазепины и дипептиды (Hobbs et. al. (1993) Proc. Nat. Acad. Sci. USA 90:6909-6913),библиотеки винилоговых (vinilogous) полипептидов (Hagihara et al. (1992) J. Amer. Chem. Soc. 114:6568),библиотеки непептидильных пептидомиметиков с бета-D-глюкозной структурой (Hirschmann et al. (1992)J. Amer. Chem. Soc. 114:9217-9218), библиотеки аналоговых органических синтезов малых соединений(Chen et. al. (1994) J. Am. Chem. Soc. 116:2661), библиотеки олигокарбаматов (Cho et al. (1993) Science 261:1303) и/или библиотеки пептидилфосфонатов (Campbell et al. (1994) J. Org. Chem. 59:658). См., в основном, Gordon et al. (1994) J. Med. Chem. 37:1385-1401, библиотеки нуклеиновых кислот (см., напр.,Stratagene Corp.), библиотеки пептидных нуклеиновых кислот (смотри, напр., патент США 5539083),библиотеки антител (см., напр., Vaughn et. al (1996) Nature Biotechnology 14(3):309-314), иPCT/US96/10287), библиотеки углеводов (смотри, напр., Liang et al. (1996) Science 274:1520-1522 и патент США 5593853) и библиотеки малых органических молекул (см., напр., бензодиазепины, Baum(1993) CEN an 18, стр. 33; изопреноиды, патент США 5549974; пирролидины, патент США 5525735 и 5519134; морфолиносоединения, патент США 5506337; бензодиазепины, патент США 5288514; и тому подобное). Устройства для приготовления комбинаторных библиотек коммерчески доступны (см., напр., 357MPS, 390 MPS, Advanced Chem Tech, Louisville KY; Symphony, Rainin, Woburn MA; 433A Applied Biosystems, Foster City CA; 9050 Plus, Millipore, Bedford, MA). Несколько хорошо известных автоматизированных систем разработано для химий фаз растворов. Эти системы включают рабочие станции, подобные автоматизированному аппарату для синтеза, разработанному Takeda Chemical Industries, LTD. (Osaka, Japan), и многочисленные автоматизированные системы с использованием роботов-манипуляторов (Zymate II, Zymark Corporation, Hopkinton MA; Orca,Hewlett-Packard, Palo Alto CA), которые воспроизводят ручные операции, осуществляемые химиком при синтезе. Любые из указанных устройств являются подходящими для применения с данным изобретением. Характер и осуществление модификаций указанных устройств (если они требуются) с тем, чтобы они могли работать, как обсуждалось здесь, должны быть очевидны специалистам в этой области. В дополнение, многочисленные комбинаторные библиотеки сами по себе коммерчески доступны (см. напр.,ComGenex, Princeton NJ; Asinex, Moscow, Russia; Tripos, Inc., St. Louis MO; ChemStar, Ltd, Moscow, Russia; 3D Pharmaceuticals, Exton PA; Martek Biosciences, Columbia MD; etc.). Высокопроизводительные анализы на наличие, отсутствие, определение количества и других свойств конкретных соединений могут быть использованы для тестирования комбинаторной библиотеки,которая содержит большое число потенциальных терапевтических соединений (потенциальных соединений-модуляторов). Анализы обычно предназначаются для скрининга больших химических библиотек путем автоматизации стадий анализа и обеспечения соединений из какого-либо обычного источника для анализов, которые обычно проводят параллельно (напр. в форматах микротитра на микротитрационных планшетах в автоматизированных анализах). Предпочтительные анализы определяют усовершенствование или ингибирование функции рецептора CXCR3. Высокопроизводительные системы скрининга коммерчески доступны (см., напр., Zymark Corp.,Hopkinton MA; Air Technical Industries, Mentor OH; Beckman Instruments, Inc., Fullerton CA; Precision Systems, Inc., Natick MA; etc.). Эти системы обычно автоматизируют процедуры полностью, включая все пипетирования проб и реагентов, дозирование жидкости, инкубирования с отсчетом времени и конечные считывания микропланшета в детекторе (детекторах), подходящем для анализа. Эти способные к изменению конфигурации системы обеспечивают высокую производительность и быстрое задействование, а также высокую степень гибкости и приспособляемости для конкретного применения. Производители таких систем предоставляют подробные протоколы для различных высоко производительных систем. Так, например, Zymark Corp. предоставляет технические бюллетени, описывающие системы скрининга для определения модуляции генной транскрипции, связывания лиганда и тому подобное. Примеры Реагенты и растворители, используемые ниже, могут быть получены из коммерческих источников,таких как Aldrich Chemical Co. (Milwaukee, Wisconsin, USA). Спектры 1 Н-ЯМР записывают на ЯМР спек- 16007538 трометре Varian Gemini 400 МГц. Значительные пики табулируют в порядке: число протонов, мультиплетность (s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет; br s, широкий синглет) и постоянная (постоянные) взаимодействия в Герцах (Гц). Масс-спектр электронной ионизации (EI) записывают на масс-спектрометре Hewlett Packard 5989A. Результаты масс-спектрометрии представлены как отношение массы к заряду с последующим указанием относительной распространенности каждого иона (в скобках). В таблицах единственная величина m/е представлена для иона М+Н (или, как отмечено, М-Н), содержащего наиболее традиционные атомные изотопы. Изотопные картины соответствуют ожидаемой формуле во всех случаях. Масс-спектрометрический анализ ионизации электроспреем (ESI) проводят на массспектрометре с ионизацией электроспреем Hewlett-Packard 1100 MSD, используя НР 1 100 ВЭЖХ для доставки образца. Обычно аналит растворяют в метаноле при 0,1 мг/мл и 1 мкл вливают с растворителем для доставки в масс-спектрометр, который сканирует от 100 до 1500 Да. Все соединения могли быть проанализированы в положительном моде ESI с использованием смеси ацетонитрил/вода 1:1 с 1% уксусной кислотой в качестве растворителя для доставки. Соединения, представленные ниже, также могли быть проанализированы в отрицательном моде ESI с использованием 2 мМ NH4OAC в смеси ацетонитрил/вода 1:1 в качестве растворителя для доставки. Пример 1. Синтез соединения 1.01 Синтез соединения 1.01 в шесть стадий из коммерчески доступной антраниловой кислоты обеспечивает пример синтеза 3 Н-хиназолин-4-она методом 1. На схеме 1 представлен обзор пути синтеза, экспериментальные подробности которого приведены далее. Схема 1 2-Пропиониламинобензойная кислота (II). При комнатной температуре к раствору 50,22г антраниловой кислоты (I) (370 ммоль, 1,00 экв.),растворенной в 200 мл сухого ДМФ, добавляют 35,0 мл пропионилхлорида (400 ммоль, 1,10 экв.) по каплям с помощью капельной воронки в течение 1,5 ч. Скорость добавления достаточно медленная, чтобы поддерживать внутреннюю температуру реакционной смеси ниже 38 С. После завершения добавления хлорангидрида гетерогенную реакционную смесь перемешивают в течение 2,5 ч при температуре окружающей среды и затем выливают в 1600 мл воды. Полученную смесь вода/ДМФ с белым осадком тщательно перемешивают при температуре окружающей среды в течение 1 ч, после чего твердое вещество- 17007538 собирают вакуумным фильтрованием, промывают твердое вещество холодной водой (2 х 100 мл). Продукт сушат в вакууме над пентоксидом фосфора в течение ночи, получая 48,04 г белого твердого вещества, т.пл. 120,1 С. 1 Н ЯМР (CDCl3)1,30 (т, 3 Н, J=7,4 Гц), 2,52 (кв., 2 Н, J=7,4 Гц), 7,12 (т, 1 Н, J=7,2 Гц), 7,60 (т, 1 Н,J=7,1 Гц), 8,13 (д, 1 Н, J=6,3 Гц), 8,76 (д, 1 Н, J=7,8 Гц) м.д. MS (ESI-) 192,1 [М-Н]-. 2-Этилбензо[d][1,3]оксазин-4-он (III). Смесь 46,66 г 2-пропиониламинобензойной кислоты (II) (240 ммоль, 1,00 экв.), суспендированной в 180 мл уксусного ангидрида, кипятят с обратным холодильником (внешняя температура 170-180 С, масляная баня) в реакционном сосуде, снабженном дистилляционной насадкой. Уксусную кислоту отгоняют из реакционной смеси (т.кип. 116-118 С) в течение 1,5-2 ч, после чего начинает перегоняться уксусный ангидрид (т.кип. 136-138 С). Реакционную смесь доводят до комнатной температуры и уксусный ангидрид удаляют вакуумной перегонкой; в результате концентрирования реакционного раствора получают светло-желтое твердое вещество. Твердое вещество растирают с гексаном, собирают фильтрованием (3 х 100 мл объемами гексана) и затем сушат в вакууме над пентоксидом фосфора, чтобы получить 33,26 г светло-желтого твердого вещества, т.пл. 83.9 С. 1 Н ЯМР (CDCl3)1,37 (т, 3 Н, J=7,6 Гц), 2,73 (кв., 2 Н, J=7,6 Гц), 7,49 (т, 1 Н, J1=1,1 Гц, J2=7,6 Гц),7,56 (д, 1 Н, J=8,4 Гц), 7,78 (т, 1 Н, J1=1,5 Гц, J2=7,2 Гц), 8,18 (д, 1 Н, J=7,0 Гц) м.д. MS (ESI+) 176,1 [MH]+.(50,9 ммоль, 1,05 экв.) растворяют в 35 мл хлороформа, кипятят с обратным холодильником в течение 12 ч, после чего ТСХ показывает, что уже не остается соединения III (Rf=0,51, 20% ацетон в гексане). Хлороформ удаляют в вакууме и полученное твердое вещество суспендируют в 18 мл этиленгликоля. Добавляют каталитическое количество гидроксида натрия (86 мг, 2,2 ммоль, 0,045 экв.) к смеси, которую нагревают до 140-150 С (внешняя температура, масляная баня). Спустя 10 ч реакционную смесь удаляют от источника тепла и доводят до комнатной температуры, при охлаждении образуется осадок. Полученную охлажденную реакционную смесь подкисляют 2 мл водного 5% раствора соляной кислоты и суспендируют в 20 мл холодной воды. Твердое вещество собирают вакуумным фильтрованием, промывают холодной водой (2 х 50 мл) и холодным изопропиловым спиртом (2 х 50 мл). Высушенное на воздухе твердое вещество подвергают перекристаллизации из изопропилового спирта, получая 10,62 г не совсем белых игольчатых кристаллов, т.пл. 178,3 С. 1 Н ЯМР (CDCl3)1,25 (т, 3 Н, J=7,4 Гц), 2,46 (кв., 2 Н, J=7,4 Гц), 7,26 (д, 2 Н, J=6,4 Гц), 7,27 (д, 2 Н,J=6,4 Гц), 7,48 (т, 1 Н, J=6,8 Гц), 7,73-7,81 (м, 2 Н), 8,27 (д, 1 Н, J=7,96 Гц) м.д. MS (ESI+) 269,1 [MH]+. 2-(1-Бромэтил)-3-(4-фторфенил)-3 Н-хиназолин-4-он (V). К раствору 7,084 г 2-этил-3-(4-фторфенил)-3 Н-хиназолин-4-она (IV) (26,40 ммоль, 1,000 экв.) и 2,60 г ацетата натрия (31,7 ммоль, 1,20 экв.), растворенных в 30 мл ледяной уксусной кислоты при 40 С (внешняя температура; масляная баня), добавляют по каплям через капельную воронку раствор 1,36 мл брома(26,4 ммоль, 1,00 экв.) в 5 мл ледяной уксусной кислоты в течение 60 мин. После завершения добавления раствора брома реакционную смесь перемешивают еще 60 мин, после чего ТСХ показывает отсутствие- 18007538 соединения IV (Rf=0,44; 40% этилацетат в гексане), и гетерогенную смесь выливают в 400 мл воды. Полученную водную кислую смесь с осадком энергично перемешивают при температуре окружающей среды в течение 2 ч. Осадок собирают вакуумным фильтрованием, промывают теплой (около 40 С) водой (2 х 50 мл) и холодным изопропиловым спиртом (50 мл). Твердое вещество сушат в вакууме над пентоксидом фосфора в течение ночи, получая 8,81 г белого твердого вещества, т.пл. 179,8 С. 1 Н ЯМР (CDCl3)2,06 (д, J=0,016p, 3 Н), 4,55 (кв., 0,016 р, 2 Н), 7,16 (ддд, 1 Н, J1=2,4 Гц, J2=4,8 Гц,J3=8,4 Гц), 7,24 (дт, 1 Н, J1=2,8 Гц, J2=8,0 Гц), 7,28 (дт, 1 Н, J1=2,8 Гц, J2=8,4 Гц), 7,51-7,58 (м, 2 Н), 7,807,81 (м, 2 Н), 8,28 (дт, 1 Н, J1=0,8 Гц, J2=8,0 Гц) м.д. MS (ESI+) 348,0 [MH]+. 3-(4-Фторфенил)-2-[1-(2-метоксиэтиламино)этил]-3 Н-хиназолин-4-он (VI). Раствор 242 мг 2-(1-бромэтил)-3-(4-фторфенил)-3 Н-хиназолин-4-она (V) (0,697 ммоль, 1,00 экв.) и 160 мкл 1-амино-2-метоксиэтана (1,81 ммоль, 2,60 экв.) в 5 мл абсолютного этанола кипятят с обратным холодильником в течение 26 ч, затем концентрируют в вакууме, чтобы удалить этанол. Полученную желтую пену распределяют между дихлорметаном и водным насыщенным раствором бикарбоната натрия (по 25 мл каждого). Отделенный водный слой снова экстрагируют дихлорметаном (20 мл). Объединенные органические экстракты сушат над сульфатом натрия, фильтруют и концентрируют в вакууме,чтобы получить желтую пену. Сырой продукт очищают хроматографией на силикагеле (3,5 см н.диам. х 12 см высота), элюируя 5% метанолом в хлороформе. Фракции, содержащие продукт при Rf=0,31, 5% метанол в хлороформе, объединяют и концентрируют в вакууме, чтобы получить 220 мг продукта в виде светло-желтой пены. 1 Н ЯМР (CDCl3)1,26 (д, 3 Н, J=6,4 Гц), 2,35 (ушир.с, 1 Н), 2,54 (ддд, 1 Н, J1=4,4 Гц, J2=6,0 Гц,J3=10,4 Гц), 2,71 (ддд, 1 Н, J1=4,0 Гц, J2=7,2 Гц, J3=11,2 Гц), 3,27 (с, 3 Н), 3,36-3,45 (м, 2 Н), 3,47 (кв., 1 Н,J=6,4 Гц), 7,22-7,26 (м, 4 Н), 7,46 (ддд, 1 Н, J1=l,6 Гц, J2=6,8 Гц, J3=8,0 Гц), 7,71-7,78 (м, 2 Н), 8,25 (дд, 1 Н,J1=l,2 Гц, J2=8,0 Гц) м.д. MS (ESI+) 342,2 [МН]+. Соединение 1.01. К раствору 130 мг 3-(4-фторфенил)-2-[1-(2-метоксиэтиламино)этил]-3 Н-хиназолин-4-она (VI) (0,381 ммоль, 1,00 экв.), 59 мкл триэтиламина (0,419 ммоль, 1,10 экв.) и 2 мг DMAP (16 мкмоль, 0,04 экв.), растворенного в 3 мл 1,4-диоксана, при комнатной температуре добавляют 79 мкл неразбавленного деканоилхлорида (0,381 ммоль, 1,00 экв.); получают бесцветный осадок. Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем концентрируют в вакууме, чтобы удалить диоксан. Полученный концентрат распределяют между дихлорметаном и водным насыщенным раствором бикарбоната натрия (по 20 мл каждого). Отделенный водный слой снова экстрагируют дихлорметаном (15 мл) и объединенные органические экстракты сушат над сульфатом натрия, фильтруют и концентрируют в вакууме, чтобы получить желтое стекловидное масло. Сырой продукт очищают хроматографией на силикагеле (2,5 см н.диам. х 10 см высота), элюируя с градиентом от 20 до 25% этилацетата в гексане. Фракции, содержащие продукт при Rf=0,84, 5% метанол в хлороформе, объединяют и концентрируют в вакууме, чтобы получить 120 мг бесцветного твердого вещества, т.пл. 71,4 С. 1 Н ЯМР (d6-ДМСО; Т=140 С)0,90 (т, 3 Н, J=7,2 Гц), 1,18-1,44 (м, 14 Н), 1,44 (д, 3 Н, J=7,2 Гц), 1,982,08 (м, 2 Н), 3,11 (с, 3 Н), 3,33-3,52 (м, 4 Н), 5,11 (ушир.кв., 1 Н, J=6,0 Гц), 7,32 (ушир.м, 3 Н), 7,49 (ушир.м,1 Н), 7,55 (ддд, 1 Н, J1=1,2 Гц, J2=7,6 Гц, J3=8,0 Гц), 7,73 (д, 1 Н, J=8,0 Гц), 7,85 (ддд, 1 Н, J1=1,2 Гц, J2=7,2 Гц, J3=8,4 Гц), 8,15 (дд, 1 Н, J1=l,6 Гц, J2=8,0 Гц) м.д. При комнатной температуре соединение существует в виде смеси цис/транс ротамеров амида, около 1:1, как определено интегрированием характерных пиков Соединение 1.02 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где 1-(2-аминоэтил)пирролидин используют на стадии е вместо 2(диметиламино)-1-аминоэтана. Данные характеристики соединения 1,02 следующие: бесцветное вязкое масло. Спектр 1 Н ЯМР подобен спектру для соединения 1.01: смесь цис/транс ротамеров амида около 2:1(CDCl3, Т=25 С) характерные резонансные пики при minor 4,78 (кв., 1,0 Н, J=6,8 Гц) и major 5,33 (кв., 1,8 Н,J=7,6 Гц) м.д. МС (ESI+) 535,4 [MH]+. Синтез соединения 1.03. Соединение 1.03 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где 1-(2-аминоэтил)морфолин используют на стадии е вместо 2(диметиламино)-1-аминоэтана. Данные характеристики соединения 1.03 следующие: бесцветное вязкое масло. 1 Н ЯМР (d6-ДМСО; Т=140 С)0,89 (т, 3 Н, J=6,8 Гц), 1,18-1,46 (м, 14 Н), 1,46 (д, 3 Н, J=6,4 Гц),1,98-2,08 (м, 2 Н), 2,23-2,34 (м, 5 Н), 2,47 (ддд, 1 Н J1=6,0 Гц, J2=8,8 Гц, J3=14,4 Гц), 3,31 (ддд, 1 Н, J1=5,6 Гц, J2=8,4 Гц, J3=14,4 Гц), 3,39-3,49 (м, 5 Н), 5,10 (ушир.кв., 1 Н), 7,32 (ушир.м, 3 Н), 7,51 (ушир.м, 1 Н),7,56 (ддд, 1 Н, J1=0,8 Гц, J2=J3=8,0 Гц), 7,72 (д, 1 Н, J=7,6 Гц), 7,86 (ддд, 1 Н, J1=l,6 Гц, J2=7,2 Гц, J3=8,4 Гц),8,15 (дд, 1 Н, J1=0,8 Гц, J2=7,2 Гц) м.д. При комнатной температуре соединение существует в виде смеси цис/транс амида около 4:3 (CDCl3; Т=25 С) характерные резонансные пики при minor 4,77 (кв., 1,0 Н,J=6,4 Гц) и major 5,33 (кв., 1,3 Н, J=6,8 Гц) м.д. МС (EST) 551,5 [МН]+. Синтез соединения 1.04. Соединение 1.04 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где 5-(2-аминоэтил)имидазол используют на стадии е вместо 2(диметиламино)-1-аминоэтана. Данные характеристики соединение 1.04 следующие: бесцветное, вязкое масло. 1 Н ЯМР подобен спектру для соединения 1.01: смесь цис/транс ротамеров амида около 3:1 (CDCl3; Т=25 С) характерные резонансные пики при minor 4,81 (кв., 1,0 Н, J=6,8 Гц) и major 5,05 (кв., 2,7 Н, J=7,2 Гц) м.д. MS (ESI+) 532,3 [MH]+. Соединение 1.05 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где дифенилацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.05 следующие: желтое вязкое масло. 1 Н ЯМР подобен спектру для соединения 1.01: смесь цис/транс ротамеров амида около 2:1 (CDCl3; T=25C) характерные резонансные пики при minor 4,89 (кв., 1,0 Н, J=6,8 Гц) и major 5,32 (кв., 1,8 Н, J=6,8 Гц) м.д. MS (ESI+) 549,2 Соединение 1.06 получают, следуя синтезу 1.01, описанному выше. Способ придерживается последовательности синтеза, где дифенилкарбонилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.06 следующие: белое твердое вещество, т.пл.=147,3 С. 1 Н ЯМР подобен спектру для соединения 1.01: смесь цис/транс ротамеров амида около 3:1 (CDCl3; Т=25 С) как определено интегрированием характерных резонансных пиков при minor 5,02 (ушир.кв., 1,0 Н) и major 5,43 Соединение 1.07 получают, следуя синтезу 1.01, описанному выше. Способ придерживается последовательности синтеза, где 3-(3-аминопропил)-(3 Н)-имидазол используют на стадии е вместо 2(диметиламино)-1-аминоэтана. Данные характеристики соединения 1.07 следующие: бесцветное вязкое масло. 1H ЯМР подобен спектру для соединения 1.01: смесь цис/транс ротамеров амида около 1:1 (CDCl3; Т=25 С), как определено интегрированием характерных резонансных пиков при minor 4,77 (кв., 1,0 Н,J=6,8 Гц) и major 5,28 (кв., 1,1 Н, J=7,6 Гц) м.д. MS (ESI+) 546,3 [MH]+. Синтез соединения 1.08. Соединение 1.08 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где 1-(3-аминопропил)морфолин используют на стадии е вместо 2(диметиламино)-1-аминоэтана. Данные характеристики соединения 1.08 следующие: бледно-желтое- 21007538 стекло. 1 Н ЯМР подобен спектру для соединения 1.01: смесь цис/транс ротамеров амида около 2:1(CDCl3, Т=25 С), как определено интегрированием характерных резонансных пиков при minor 4,77 (кв.,1,0 Н, J=6,4 Гц) и major 5,38 (кв., 1,8 Н, J=7,2 Гц) м.д. MS (ESI+) 565,4 [МН]+. Синтез соединения 1.09. Соединение 1.09 получают, следуя синтезу 1.01, описанному выше. Способ придерживается последовательности синтеза, где дифенилкарбонилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.09 следующие: белое твердое вещество, т.пл.=153,0 1 Н ЯМР (d6 ДМСО; Т=140 С)1,42 (д, 3 Н, J=7,2 Гц), 2,07 (с, 6 Н), 2,26 (ддд, 1 Н, J1=5,6 Гц, J2=9,2 Гц, J3=12,4 Гц), 2,46(ушир.м, 1 Н), 7,56 (ддд, 1 Н, J1=1,2 Гц, J2=7,2 Гц, J3=8,0 Гц), 7,72 (д, 1 Н, J=7,2 Гц), 7,87 (ддд, 1 Н, J1=1,6 Гц, J2=7,2 Гц, J3=8,4 Гц), 8,16 (дд, 1 Н, J1=1,6 Гц, J2=8,0 Гц) м.д. При комнатной температуре, соединение существует в виде смеси цис/транс ротамеров амида около 2:1 (CDCl3; Т=25 С), как определено интегрированием характерных резонансных пиков при minor 4,84 (кв., 1,0 Н, J=6,8 Гц) и major 5,30 (кв., 2,1 Н, J=6,8 Гц) м.д. MS (ESI+) 473,3 [MH]+. Синтез соединения 1.10. Соединение 1.10 получают, следуя синтезу 1.01, описанному выше. Способ придерживается последовательности синтеза, где 5-(2-аминоэтил)имидазол используют на стадии е вместо 2-(диметиламино)1-аминоэтана. Данные характеристики соединения 1.10 следующие: желтое вязкое масло. 1 Н ЯМР подобен спектру для соединения 1.01: смесь цис/транс ротамеров амида около 3:2 (CDCl3; Т=25 С), как определено интегрированием характерных резонансных пиков при minor 4,77 (кв., 1,0 Н, J=6,8 Гц) и major 5,37 Соединение 1.11 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где (4-метилфенил)ацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.11 следующие: белое твердое вещество, т.пл. 188,3 С. 1 Н ЯМР подобен спектру для соединения 1.09: смесь цис/транс ротамеров амида около 2:1(CDCl3; Т=25 С), как определено интегрированием характерных резонансных пиков при minor 5,02 (кв.,1,0 Н, J=6,8 Гц) и major 5,47 (кв., 1,9 Н, J=7,2 Гц) м.д. MS (ESI+) 487,3 [МН]+. Соединение 1.12 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где (4-бромфенил)ацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.12 следующие: бесцветное стекло. 1 Н ЯМР подобен спектру для соединения 1.09: смесь цис/транс ротамеров амида около 2:1 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при minor 4,82 (кв., 1,0 Н, J=7,2 Гц) и major 5,27 К раствору 112 мг бромида цинка (II) (500 мкмоль, 10 экв.) при 0 С добавляют 1,0 мл раствора бромида 1-пропенилмагния в 0,5 мл ТГФ (0,5 М; 500 мкмоль, 10 экв.). Полученную белую мутную смесь перемешивают при 0 С в течение 60 мин перед тем, как добавляют раствор 27 мг соединения 1.12 (49 мкмоль, 1,0 экв.) и 4 мг дихлорида бис-dppf палладия (II) (5 мкмоль, 0,1 экв.), растворенного в 0,5 мл ТГФ, все сразу через канюлю. Реакционную смесь перемешивают при комнатной температуре в течение 14 ч, затем нагревают до 60 С (внешняя температура, масляная баня), чтобы довести реакцию до завершения. Через 2 ч выдерживания при 60 С к охлажденной (0 С) реакционной смеси добавляют 5 мл насыщенного водного раствора хлорида аммония. Водный слой экстрагируют этилацетатом (3 х 15 мл) и объединенные органические фракции сушат над сульфатом магния, фильтруют и концентрируют в вакууме, чтобы получить желтую пленку. Сырой продукт очищают колоночной флэш-хроматографией на силикагеле (3,5 см н.диам. х 10 см высота), элюируя 5% метанолом в хлороформе, чтобы получить 8 мг продуктового олефина в виде бесцветной пленки. Продукт изолируют в виде смеси изомеров олефина,которые разделяют препаративной ВЭЖХ (обращенная фаза, СН 3 СN:Н 2O). Соединение 1.13 элюируется перед транс-изомером олефина 1.14. 1 Н ЯМР подобен спектру для соединения 1.09: смесь цис/транс ротамеров амида около 2:1 (CDCl3; Т=25 С), как определено интегрированием характерных резонансных пиков при major 4,85 (кв., 1,9 Н, J=6,8 Гц) и minor 5,13 (кв., 1,0 Н, J=7,2 Гц) м.д. MS (ESI+) 513,2 [MH]+. Синтез соединения 1.14. Соединение 1.14 получают так же, как соединение 1.12 и изолируют препаративной ВЭЖХ в качестве второго продукта для элюирования. 1 Н ЯМР подобен спектру для соединения 1.09: смесь цис/транс ротамеров амида около 2:1 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при major 4,83 (кв., 1,8 Н, J=7,2 Гц) и minor 5,12 (кв., 1,0 Н, J=7,6 Гц) м.д. MS (ESI+) 513,2 [MH]+. Газообразный водород вводят из баллона в колбу, которая после продувки азотом и его откачивания загружена 4,8 мг соединения 1.13 и 1.14 (9,4 мкмоль, 1,0 экв.) и 5,0 мг палладия на активированном углероде (10 мас.% Pd; 4,7 мкмоль, 0,5 экв.), суспендированного в 2,0 мл метанола при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч, затем фильтруют через прокладку из целита. Фильтрат концентрируют в вакууме, затем очищают колоночной хроматографией на силикагеле (2,0 см н.диам.х 8 см высота), элюируя 5% метанолом в хлороформе. Фракции,содержащие продукт, концентрируют в вакууме, чтобы получить 4,5 мг бесцветной пленки. 1 Н ЯМР подобен спектру для соединения 1.09: смесь цис/транс ротамеров амида около 3:2 (CDCl3; Т=25 С), как определено интегрированием характерных резонансных пиков при major 4,83 (кв., 1,4H, J=6,8 Гц) и minor 5,20 (кв., 1,0 Н, J=7,2 Гц) м.д. MS (ESI+) 515,3 [MH]+. Синтез соединения 1.16. Дегазированную (3 х цикла замораживание-откачивание-оттаивание) двухфазную смесь 7,0 мг соединения 1.12 (49,0 мкмоль, 1,00 экв.), 34,0 мг 4-фторфенилбороновой кислоты (245 мкмоль, 5,00 экв.) и 3,0 мг тетракистрифенилфосфин палладия (0) (2,5 мкмоль, 0,05 экв.) в 3,0 мл толуола и 3,0 мл 2 М водного карбоната натрия нагревают до 100 С (внешняя температура, масляная баня). Через 4 ч МС не показывает никакого остаточного соединения 1.12, и отделенный водный слой экстрагируют 50% этилацетатом в гексане (2 х 15 мл). Объединенные органические экстракты сушат над алкилсульфатом магния,фильтруют и концентрируют в вакууме, чтобы получить желтое масло. Сырой материал очищают хроматографией на силикагеле (3,5 см н.диам.х 12 см высота), элюируя 5% метанолом в хлороформе. Фракции,содержащие продукт, объединяют и концентрируют в вакууме, чтобы получить 27,0 мг продукта в виде бесцветного вязкого масла. 1H ЯМР подобен спектру для соединения 1.09: смесь цис/транс ротамеров амида около 3:2 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при- 24007538 Соединение 1.17 получают, следуя синтезу 1.01, описанному выше. Способ придерживается последовательности синтеза, где 2-метокси-1-аминоэтан используют на стадии е вместо 2-(N,Nдиметиламино)-1-аминоэтана, и дифенилацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.17 следующие: бежевое твердое вещество, т.пл.=153,8 С. 1 Н ЯМР подобен спектру для соединения 1.09: смесь цис/транс ротамеров амида около 2:1 (CDCl3; Т=25 С), как определено интегрированием характерных резонансных пиков при minor 4,89 (кв., 1,0 Н, J=6,4 Гц) и major 5,33 (кв., 1,8 Н, J=6,8 Гц) м.д. MS (ESI+) 536,2 [МН]+. Синтез соединения 1.18. Соединение 1.18 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где 1-(2-аминоэтил)морфолин используют на стадии е вместо 2(N,N-диметиламино)-1-аминоэтана, и дифенилацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.18 следующие: бесцветное вязкое масло. 1 Н ЯМР подобен спектру для соединения 1.09: смесь цис/транс ротамеров амида около 2:1 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при minor 4,88 (кв., 1,0 Н, J=6,8 Гц) и major 5,32 Соединение 1.19 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где 2-этокси-1-аминоэтан используют на стадии е вместо 2-(N,Nдиметиламино)-1-аминоэтана и дифенилацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.19 следующие: светло-желтое стекловидное твердое вещество,т.пл.=150,6 С. 1H ЯМР (d6-ДМСО; Т=140 С)0,98 (т, 3 Н, J=6,8 Гц), 1,43 (д, 3 Н, J=6,8 Гц), 3,29-3,63 (м,8 Н), 5,18 (кв., 1 Н, J=6,0 Гц), 7,20 (д, 2 Н, J=7,6 Гц), 7,27-7,36 (м, 3 Н), 7,41-7,47 (м, 3 Н), 7,49-7,64 (м, 6 Н),7,72 (д, 1 Н, J=8,0 Гц), 7,85 (ддд, 1 Н, J1=l,6 Гц, J2=8,2 Гц, J=8,6 Гц), 8,15 (д, 1 Н, J=8,0 Гц) м.д. При комнатной температуре соединение существует в виде смеси цис/транс ротамеров амида около 2:1 (CDCl3;T=25C), как определено интегрированием характерных резонансных пиков при minor 4,87 (кв., 1,0 Н,J=6,8 Гц) и major 5,33 (кв., 2,1 Н, J=7,2 Гц) м.д. MS (ESI+) 550,2 [MH]+. Синтез соединения 1.20. Соединение 1.20 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где 3-аминопропионитрил используют на стадии е вместо 2-(N,Nдиметиламино)-1-аминоэтана и дифенилацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.20 следующие: бесцветное стекло. 1 Н ЯМР подобен спектру для- 25007538 соединения 1.19: смесь цис/транс ротамеров амида около 1:1 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при А 4,94 (кв., 1,0 Н, J=6,8 Гц) и В 5,14 (кв., 1,0 Н, J=7,6 Гц) м.д. MS (ЕSI+) 530,2 [МН]+. Синтез соединения 1.21. Соединение 1.21 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где 2-изопропокси-1-аминоэтан используют на стадии е вместо 2(N,N-диметиламино)-1-аминоэтана, и дифенилацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.21 следующие: тусклое желтое стекло. 1 Н ЯМР подобен спектру для соединения 1.19: смесь цис/транс ротамеров амида около 3:1 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при minor 4,88 (кв., 1,0 Н, J=6,7 Гц) и major 5,30 (кв.,2,9 Н, J=7,0 Гц) м.д. MS (ESI+) 564,2 [MH]+. Синтез соединения 1.22. Соединение 1.22 получают, следуя синтезу соединения 1.01, описанному выше. Способ придерживается последовательности синтеза, где 2-аминометилпиридин используют на стадии е вместо 2-(N,Nдиметиламино)-1-аминоэтана и дифенилацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.22 следующие: бесцветное стекло. 1 Н ЯМР подобен спектру для соединения 1.19: смесь цис/транс ротамеров амида около 1:1 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при А 5,13 (кв., 1,0 Н, J=6,4 Гц) и В 5,46 (кв., 1,0 Н, J=8,0 Гц) м.д. MS (ESI+) 569,3 [МН]+. Синтез соединения 1.23. Соединение 1.23 получают, следуя синтезу соединения 1.01, описанному выше. Способ 1 придерживается последовательности синтеза, где 2-аминометилпиридин используют на стадии е вместо 2-(N,Nдиметиламино)-1-аминоэтана и дифенилацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.23 следующие: бесцветное стекло. 1 Н ЯМР подобен спектру для соединения 1.19: смесь цис/транс ротамеров амида около 1:1 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при А 5,13 (кв., 1,0 Н, J=6,4 Гц) и В 5,46 (кв., 1,0 Н, J=8,0 Гц) м.д. MS (ESI+) 569,3 [МН]+. Соединение 1.24 получают, следуя синтезу соединения 1.01, описанному выше. Способ 1 придерживается последовательности синтеза, где 3-(3-аминопропил)имидазол используют на стадии е вместо 2(N,N-диметиламино)-1-аминоэтана и дифенилацетилхлорид используют на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.24 следующие: бесцветное масло. 1 Н ЯМР подобен спектру для соединения 1.19: смесь цис/транс ротамеров амида около 1:1 (CDCl3; Т=25 С), как определено интегрированием характерных резонансных пиков при А 4,89 (кв., 1,0 Н, J=6,6 Гц) и В 5,29 (кв., 1,1 Н,J=7,1 Гц) м.д. MS (ESI+) 569,3 [МН]+. Синтез соединения 1.25. К смеси 175 мг соединения 1.19 (318 мкмоль, 1,00 экв.) и 500 мг порошка цинка (7,65 ммоль, 24,0 экв.), суспендированного в 3,0 мл ледяной уксусной кислоты при 40 С (внешняя температура, масляная баня), добавляют около 200 мкл концентрированной водной соляной кислоты (5 капель пипеткой, 18 М; 3,6 ммоль). Полученная бежевая мутная реакционная смесь выделяет газ и ее перемешивают при 40 С в течение 15 мин, затем отделяют декантацией от суспендированных твердых веществ/цинка и нейтрализуют концентрированным водным гидроксидом натрия до рН 12. Водный щелочной раствор экстрагируют дихлорметаном (3 х 20 мл). Объединенные органические экстракты сушат над алкилсульфатом магния, фильтруют и концентрируют в вакууме, чтобы получить бесцветное масло. Сырой материал очищают хроматографией на силикагеле (3,5 см н.диам. х 10 см высота), элюируя 2% метанолом в хлороформе. Фракции, содержащие продукт при Rf=0,52, 10% метанол в хлороформе, объединяют и концентрируют в вакууме, чтобы получить 83 мг бесцветного масла. 1 Н ЯМР подобен спектру для соединения 1.19: смесь цис/транс ротамеров амида около 2:1 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при minor 4,62 (кв., 1,0 Н, J=7,l Гц) и major 5,31 (кв., 2,1 Н, J=7,0 Гц) м.д. Соединение 1.26 получают, следуя синтезу соединения 1.01, описанному выше. Способ 1 придер- 27007538 живается последовательности синтеза, где 2-этокси-1-аминоэтан используют на стадии е вместо 2-(N,Nдиметиламино)-1-аминоэтана и (4-трифторметилфенил)-уксусную кислоту используют с EDC и каталитическим количеством НОВТ на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.26 следующие: бесцветное масло. 1 Н ЯМР подобен спектру для соединения 1.19: смесь цис/транс ротамеров амида около 5:2 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при minor 4,85 (кв., 1,0 Н, J=6,8 Гц) и major 5,33 (кв., 2,6 Н, J=6,8 Гц) м.д. MS (ESI+) 542,2 [МН]+. Синтез соединения 1.27. Соединение 1.27 получают, следуя синтезу соединения 1.01, описанному выше. Способ 1 придерживается последовательности синтеза, где 3-метиламинопиридин используют на стадии е вместо 2-(N,Nдиметиламино)-1-аминоэтана, и (4-трифторметилфенил)-уксусную кислоту используют с EDC и каталитическим количеством НОВТ на стадии f вместо деканоилхлорида. Данные характеристики соединения 1.27 следующие: бесцветное масло. 1 Н ЯМР подобен спектру для соединения 1.19: смесь цис/транс ротамеров амида около 6:5 (CDCl3; T=25C), как определено интегрированием характерных резонансных пиков при minor 4,99 (кв., 1,0 Н, J=6,6 Гц) и major 5,37 (кв., 1,2 Н, J=7,2 Гц) м.д. MS (ESI+) 561,2 [МН]+. Синтез соединения 1.28. Соединение 1.28 получают, следуя синтезу соединения 1.01. MS (ESI+) 533,3, 534,3. 1 Н ЯМР Соединение 1.29 получают, следуя синтезу соединения 1.01. Бесцветное вязкое масло; смесь цис/транс ротамеров амида (1/1), определено 1 Н ЯМР (CDCl3)4,82 (кв., 1 Н, J=7,5 Гц), 5,37 (кв., 1 Н,J=7,5 Гц), MS (ESI + ) 547,2 (МН+). Анал. (C23H28N4O3) рассчитано С 72,49, Н 8,48, N 10,25. Обнаружено С 72,62, Н 8,44, N 10,12.
МПК / Метки
МПК: C07D 401/04, C07D 249/12, C07D 235/14, C07D 471/04, C07D 403/12, C07D 239/91, C07F 7/10, A61K 31/517, C07D 401/12, A61P 29/00, A61P 37/02
Метки: антагонисты, cxcr3
Код ссылки
<a href="https://eas.patents.su/30-7538-antagonisty-cxcr3.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты cxcr3</a>
Предыдущий патент: Азотсодержащие гетероциклические производные, содержащая их фармацевтическая композиция, их применение и способ лечения
Следующий патент: Новые производные пиперазинона для лечения нарушений, связанных с 5-нт2а-рецептором
Случайный патент: Магнитострикционное устройство для определения плотности жидкости












