N-замещенные неарильные гетероциклические антагонисты nmda/nr2b
Номер патента: 5974
Опубликовано: 25.08.2005
Авторы: Мансон Питер М., Макколи Джон А., Ливертон Найджел Дж., Либби Брайан И., Филлипс Брайан, Батчер Джон У., Томпсон Уэйн, Клэйборн Кристофер Ф., Нгуйен Кевин Т., Клэйрмон Дэвид А.
Формула / Реферат
1. Соединение формулы (I)
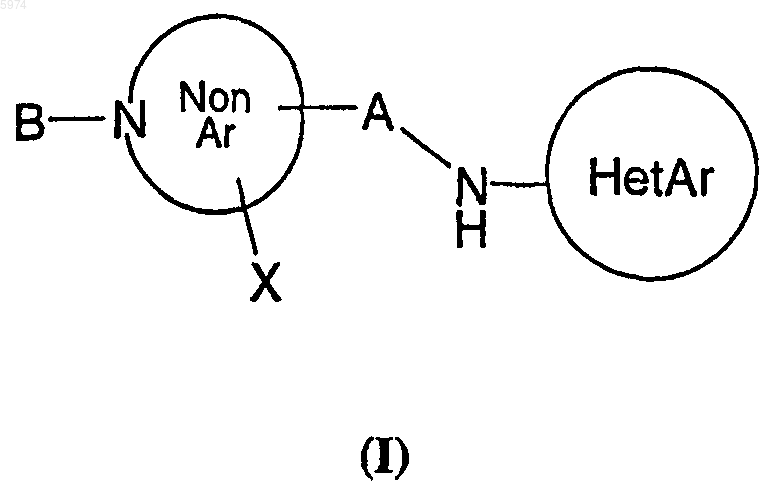
или его фармацевтически приемлемые соли, где
NonAr является неароматическим 5-7-членным кольцом, содержащим 1 или 2 атома азота в кольце, или азабициклооктановым кольцом;
HetAr является 5-6-членным гетероароматическим кольцом, содержащим 1-3 атома азота в кольце, или изоксазолилом, тиазолилом, тиадиазолилом, хинолинилом, хиназолинилом, пуринилом, птеридинилом, бензимидазолилом, пирролопиримидинилом или имидазопиридинилом;
HetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4-алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой;
A является -C0-4алкилом;
B является арил(CH2)0-3-O-C(O)-группой, гетероарил(CH2)1-3-O-C(O)-группой, инданил(CH2)0-3-O-C(O)-группой, арил(CH2)1-3-C(O)-группой, арилциклопропил-C(O)-группой, гетероарилциклопропил-C(O)-группой, гетероарил(CH2)1-3-C(O)-группой, гетероарил(CH2)1-3-группой, арил(CH2)1-3-NH-C(O)-группой, арил(CH2)1-3-NH-C(NCN)-группой, арил(CH2)1-3-SO2-группой, гетероарил(CH2)1-3-SO2-группой, где любой арил или гетероарил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4-алкоксигруппой, трифторметилом, бромом, фтором или хлором; и
X является H, OH, F, C1-4алкилом, C1-4алкоксигруппой, NH2 или X вместе с прилегающей связью является =O,
причем
"арил" означает как многокольцевые системы, так и однокольцевые системы, такие как, например, фенил или нафтил,
"гетероарил" означает кольцевые системы, содержащие в кольце один или несколько атомов кислорода, серы или азота, включая комбинации этих атомов.
2. Соединение по п.1 или его фармацевтически приемлемые соли, где NonAr является неароматическим 6-членным кольцом, содержащим 1 атом азота в кольце, и B является арил(CH2)0-3-O-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4алкоксигруппой, трифторметилом, бромом, фтором или хлором.
3. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является 6-членным гетероароматическим кольцом, содержащим 1 атом азота в кольце, HetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4-алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидрокси C1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
4. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является изоксазолилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
5. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является тиадиазолилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
6. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является 5-членным гетероароматическим кольцом, содержащим 2 атома азота в кольце, HetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4-алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидрокси C1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2 алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
7. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является хинолинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил) NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
8. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является пуринилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил) NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
9. Соединение по п.2 или его фармацевтически приемлемые соли, где
HetAr является 6-членным гетероароматическим кольцом, содержащим 2 атома азота в кольце;
HetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4-алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил) (C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2 алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой;
10. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является тиазолилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
11. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является птеридинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
12. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является пирролопиримидинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2 алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
13. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является имидазопиридинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
14. Соединение по п.2 или его фармацевтически приемлемые соли, где HetAr является бензимидазолилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
15. Соединение по п.1 или его фармацевтически приемлемые соли, где NonAr является неароматическим 6-членным кольцом, содержащим 1 атом азота в кольце, и B является арил(CH2)1-3-SO2-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4алкоксигруппой, трифторметилом, бромом, фтором или хлором.
16. Соединение по п.15 или его фармацевтически приемлемые соли, где HetAr является 6-членным гетероароматическим кольцом, содержащим 2 атома азота в кольце, и HetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4-алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил) HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
17. Соединение по п.15 или его фармацевтически приемлемые соли, где HetAr является хиназолинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
18. Соединение по п.15 или его фармацевтически приемлемые соли, где HetAr является пуринилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил) NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
19. Соединение по п.15 или его фармацевтически приемлемые соли, где HetAr является имидазопиридинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
20. Соединение по п.15 или его фармацевтически приемлемые соли, где HetAr является 6-членным гетероароматическим кольцом, содержащим 1 атом азота в кольце, и HetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4-алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4 алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
21. Соединение по п.1 или его фармацевтически приемлемые соли, где NonAr является неароматическим 5-членным кольцом, содержащим 1 атом азота в кольце, и B является арил(CH2)0-3-O-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4алкоксигруппой, трифторметиыюь, бромом, фтором или хлором.
22. Соединение по п.21 или его фармацевтически приемлемые соли, где HetAr является 6-членным гетероароматическим кольцом, содержащим 2 атома азота в кольце, и HetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-, Si(CH3)3-C-группой или NH2C(O)-группой.
23. Соединение по п.21 или его фармацевтически приемлемые соли, где HetAr является птеридинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
24. Соединение по п.21 или его фармацевтически приемлемые соли, где HetAr является пуринилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил) NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
25. Соединение по п.21 или его фармацевтически приемлемые соли, где HetAr является бензимидазолилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидрокси C1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
26. Соединение по п.1 или его фармацевтически приемлемые соли, где NonAr является азабициклооктановым кольцом и B является арил(CH2)0-3-O-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4алкоксигруппой, трифторметилом, бромом, фтором или хлором.
27. Соединение по п.26 или его фармацевтически приемлемые соли, где HetAr является 6-членным гетероароматическим кольцом, содержащим 1 атом азота в кольце, HetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4-алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
28. Соединение по п.26 или его фармацевтически приемлемые соли, где HetAr является пуринилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-гpyппой, Si(CH3)3-C-группой или NH2C(O)-группой.
29. Соединение по п.26 или его фармацевтически приемлемые соли, где HetAr является 6-членным гетероароматическим кольцом, содержащим 2 атома азота в кольце, и HetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил) HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
30. Соединение по п.1 или его фармацевтически приемлемые соли, где NonAr является азабициклооктановым кольцом и B является арил(CH2)1-3-SO2-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4алкоксигруппой, трифторметилом, бромом, фтором или хлором.
31. Соединение по п.1 или его фармацевтически приемлемые соли, где NonAr является неароматическим 6-членным кольцом, содержащим 1 атом азота в кольце, и B является гетероарил(CH2)1-3-C(O)-группой, где гетероарил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4алкоксигруппой, трифторметилом, бромом, фтором или хлором.
32. Соединение по п.1 или его фармацевтически приемлемые соли, где NonAr является неароматическим 6-членным кольцом, содержащим 1 атом азота в кольце, и B является арил(CH2)1-3-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4алкоксигруппой, трифторметилом, бромом, фтором или хлором.
33. Соединение по п.1 или его фармацевтически приемлемые соли, где NonAr является неароматическим 6-членным кольцом, содержащим 1 атом азота в кольце, и B является арилциклопропил-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4-алкоксигруппой, трифторметилом, бромом, фтором или хлором.
34. Соединение по п.33 или его фармацевтически приемлемые соли, где HetAr является пиридилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
35. Соединение по п.33 или его фармацевтически приемлемые соли, где HetAr является пиразинилюь, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил) NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
36. Соединение по п.33 или его фармацевтически приемлемые соли, где HetAr является пиридазинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
37. Соединение по п.33 или его фармацевтически приемлемые соли, где HetAr является пиримидинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4алкилом, C1-4алкоксигруппой, C2-4алкинилом, трифторметилом, гидроксигруппой, гидроксиC1-4алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4алкил)(C0-4алкил)ом, нитрогруппой, (C1-2алкил)(C1-2алкил)NCH2-группой, (C1-2алкил)HNCH2-группой, Si(CH3)3-C-группой или NH2C(O)-группой.
38. Соединение по п.1 или его фармацевтически приемлемые соли, где NonAr является неароматическим 6-членным кольцом, содержащим 1 атом азота в кольце, и B является гетероарил(CH2)1-3-O-C(O)-группой, где гетероарил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4алкоксигруппой, трифторметилом, бромом, фтором или хлором.
39. Соединение по п.1 или его фармацевтически приемлемые соли, где NonAr является неароматическим 6-членным кольцом, содержащим 1 атом азота в кольце, и B является арил(CH2)1-3-NH-C(NCN)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4алкилом, C3-6циклоалкилом, C1-4алкоксигруппой, трифторметилом, бромом, фтором или хлором.
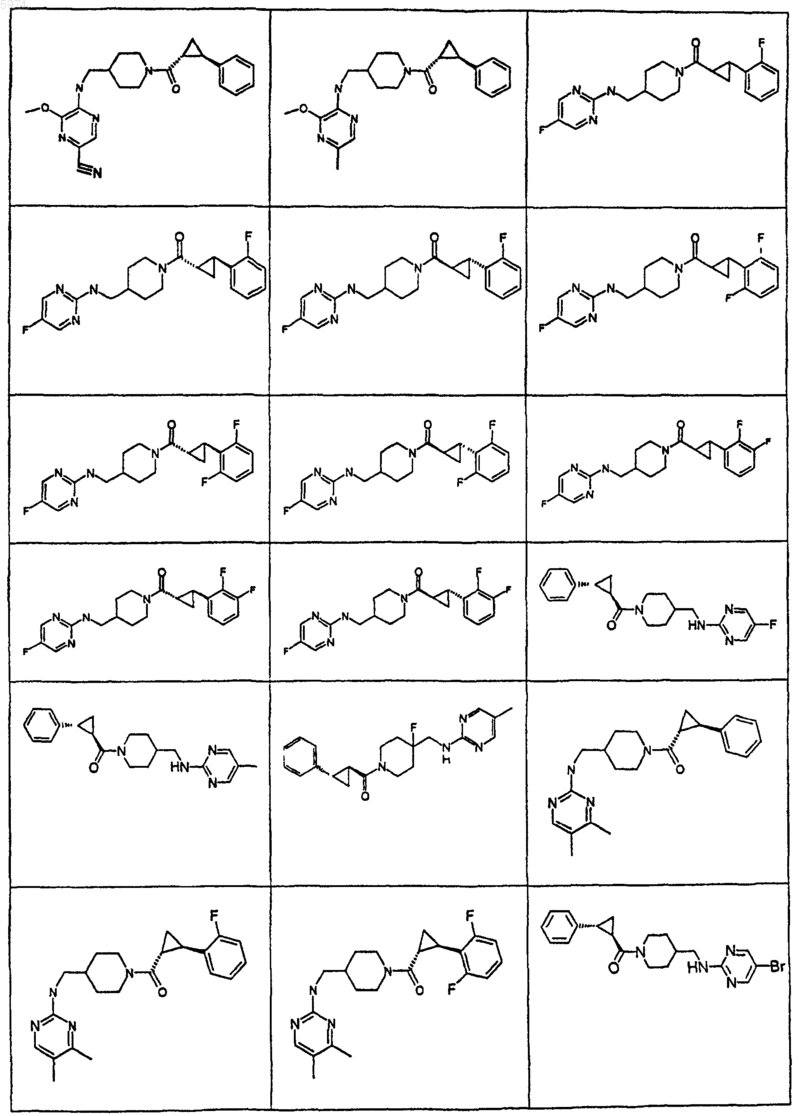
40. Соединение по п.1, где указанное соединение представляет собой
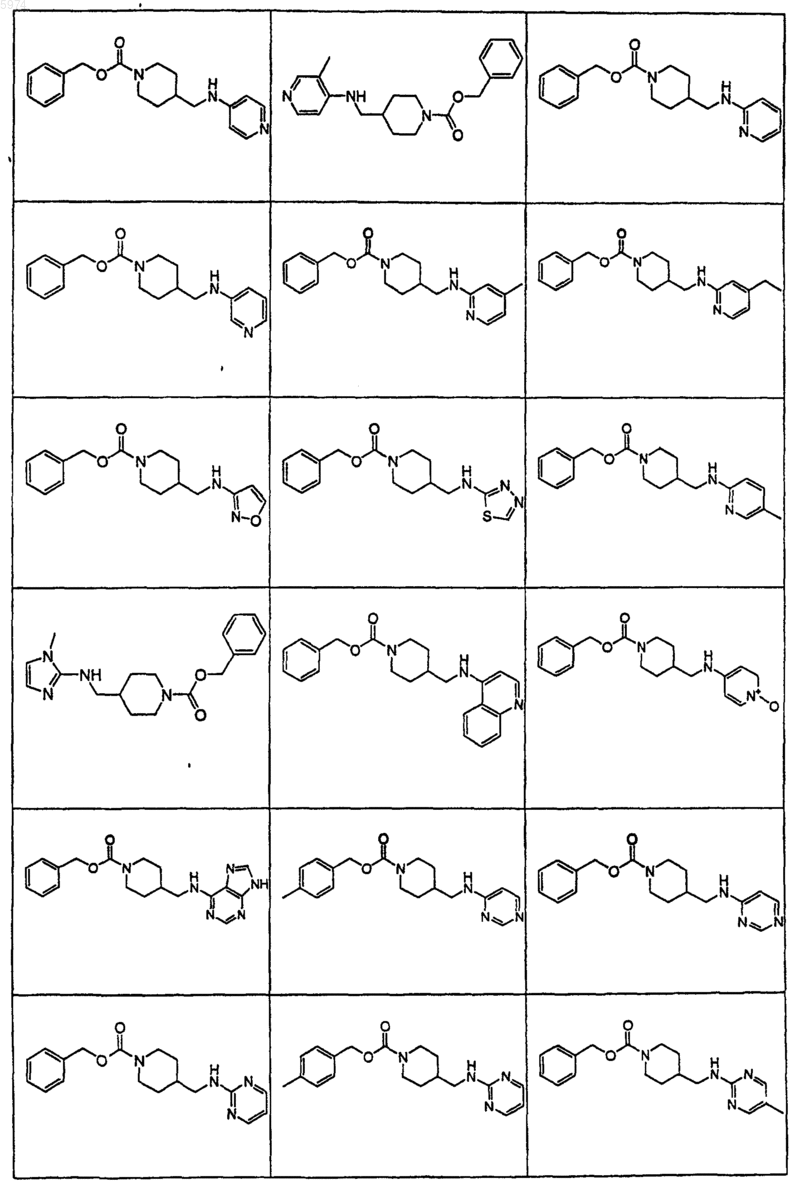
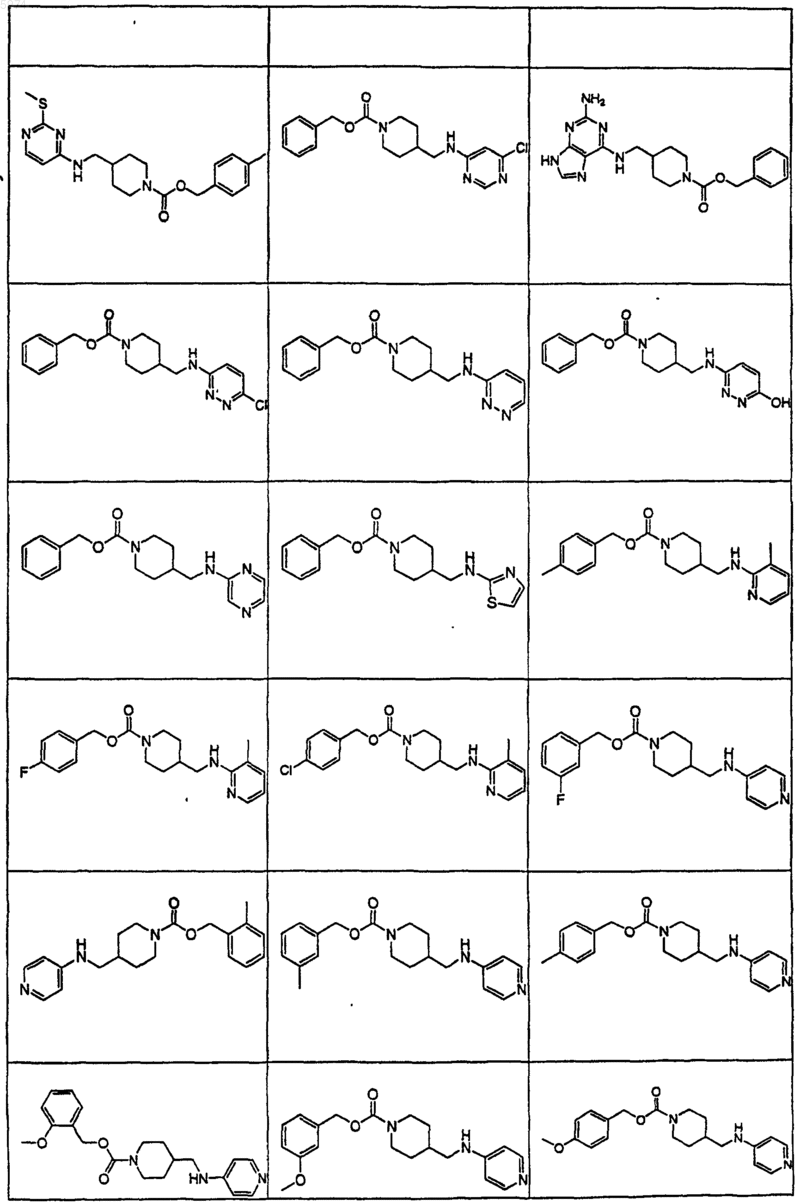
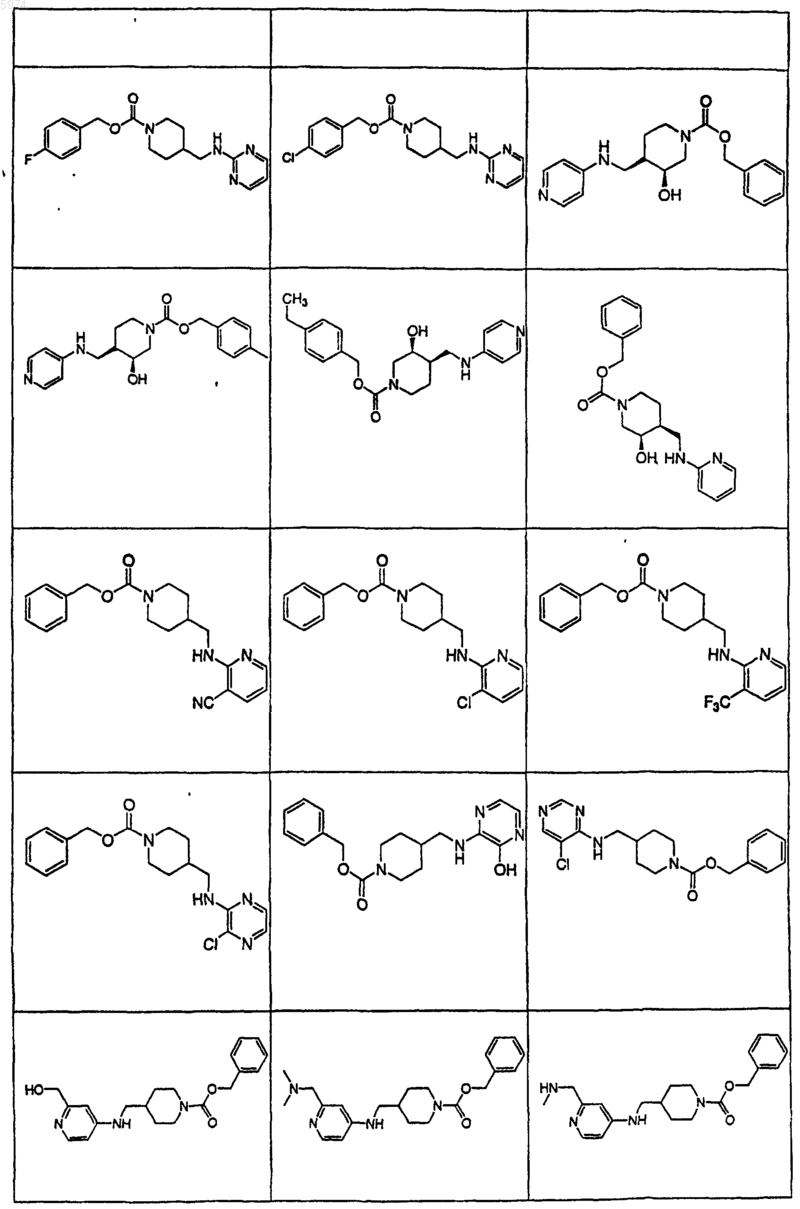
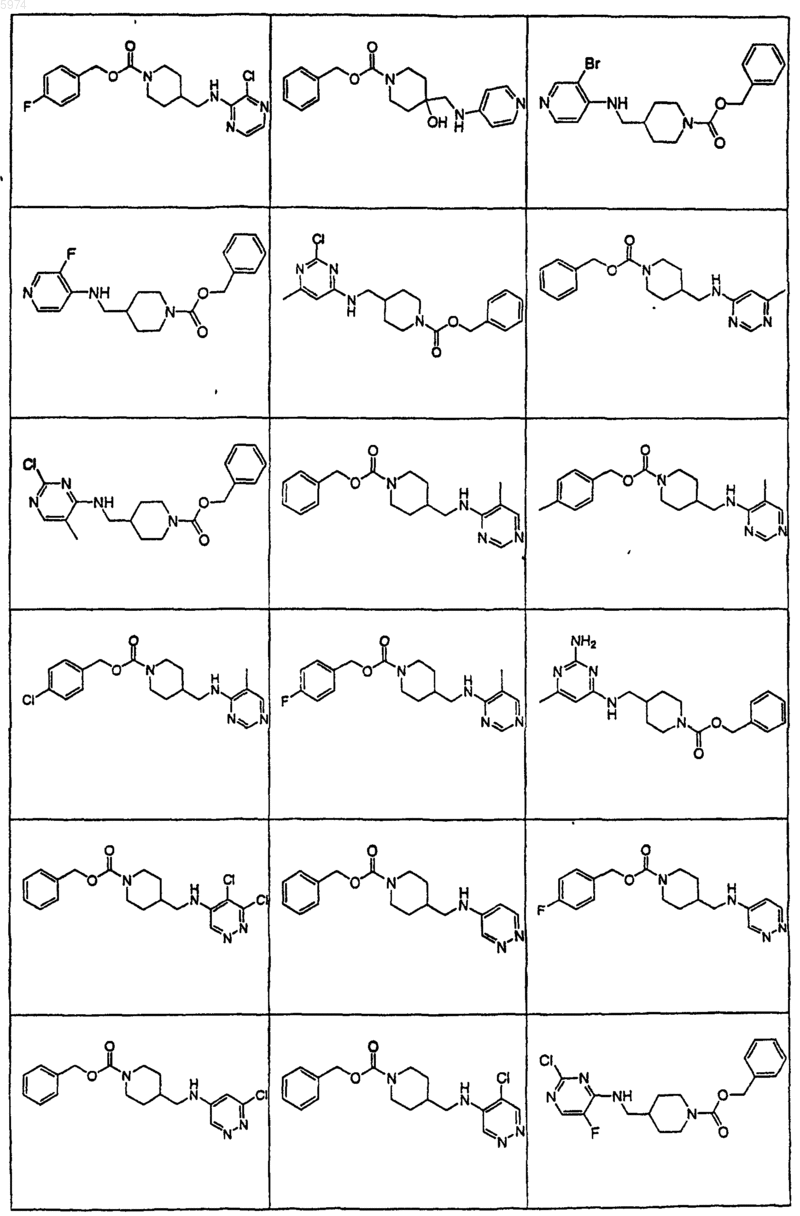
или его фармацевтически приемлемую соль.
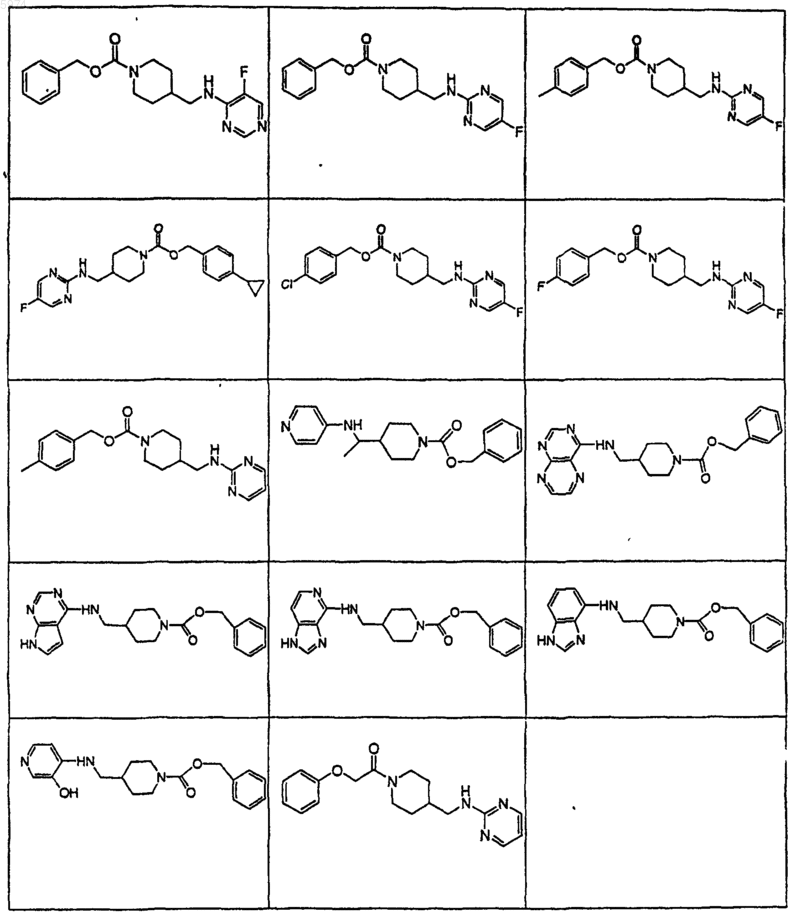
41. Соединение по п.1, где указанное соединение представляет собой
или его фармацевтически приемлемую соль.
42. Соединение по п.1, где указанное соединение представляет собой
или его фармацевтически приемлемую соль.
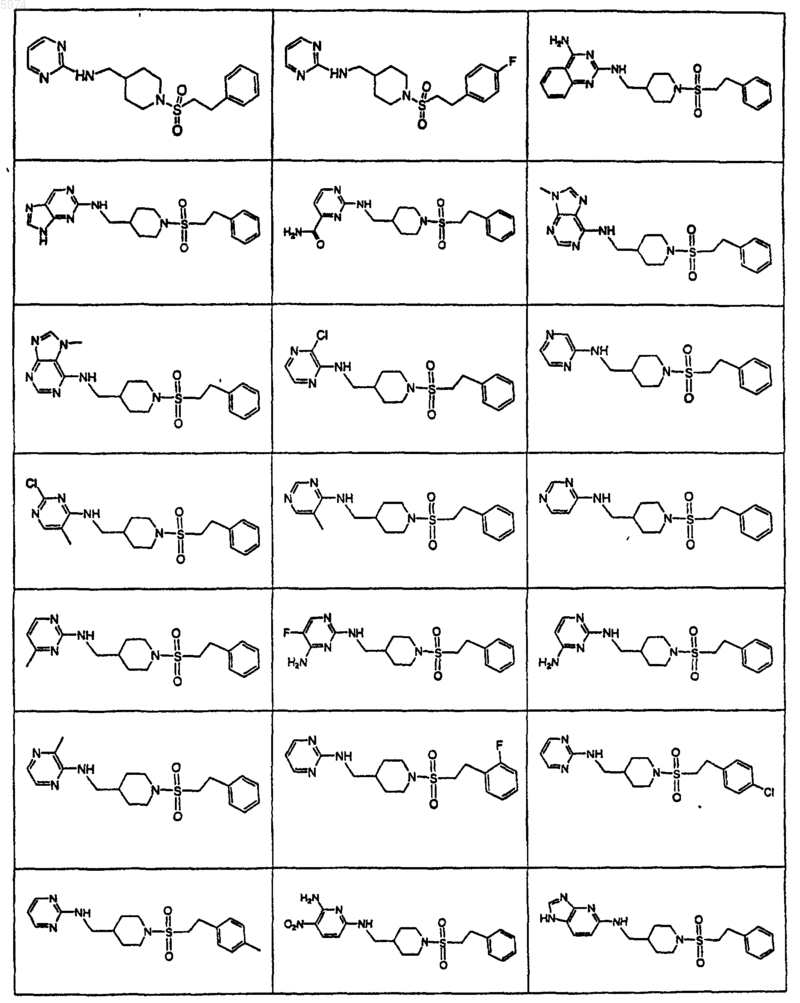
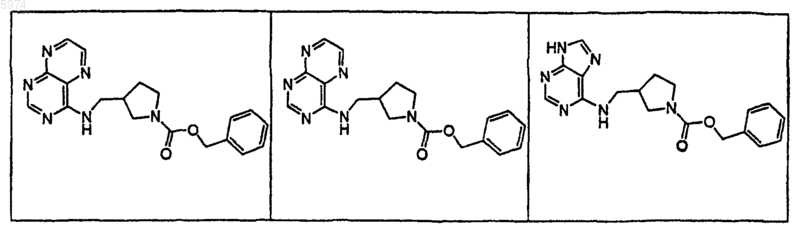
43. Соединение по п.1, где указанное соединение представляет собой
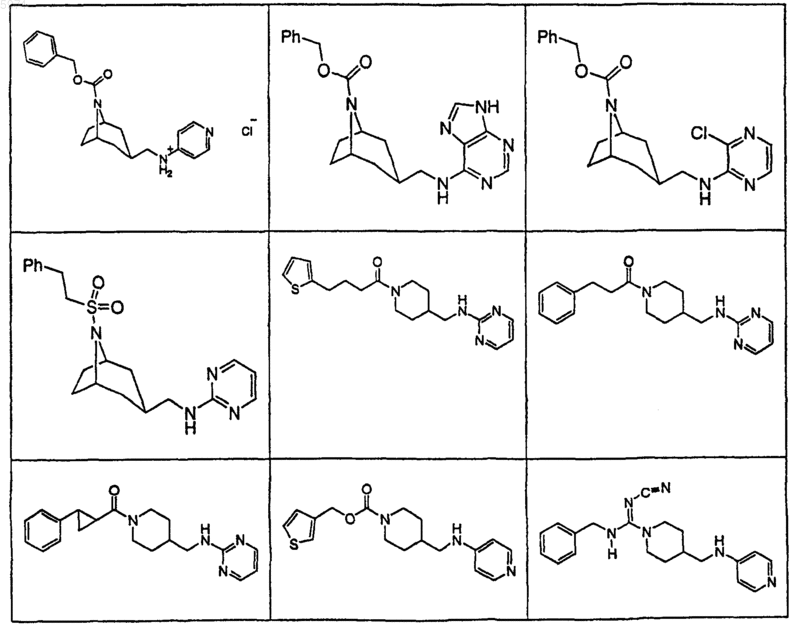
или его фармацевтически приемлемую соль.
44. Соединение по п.1, где указанное соединение представляет собой
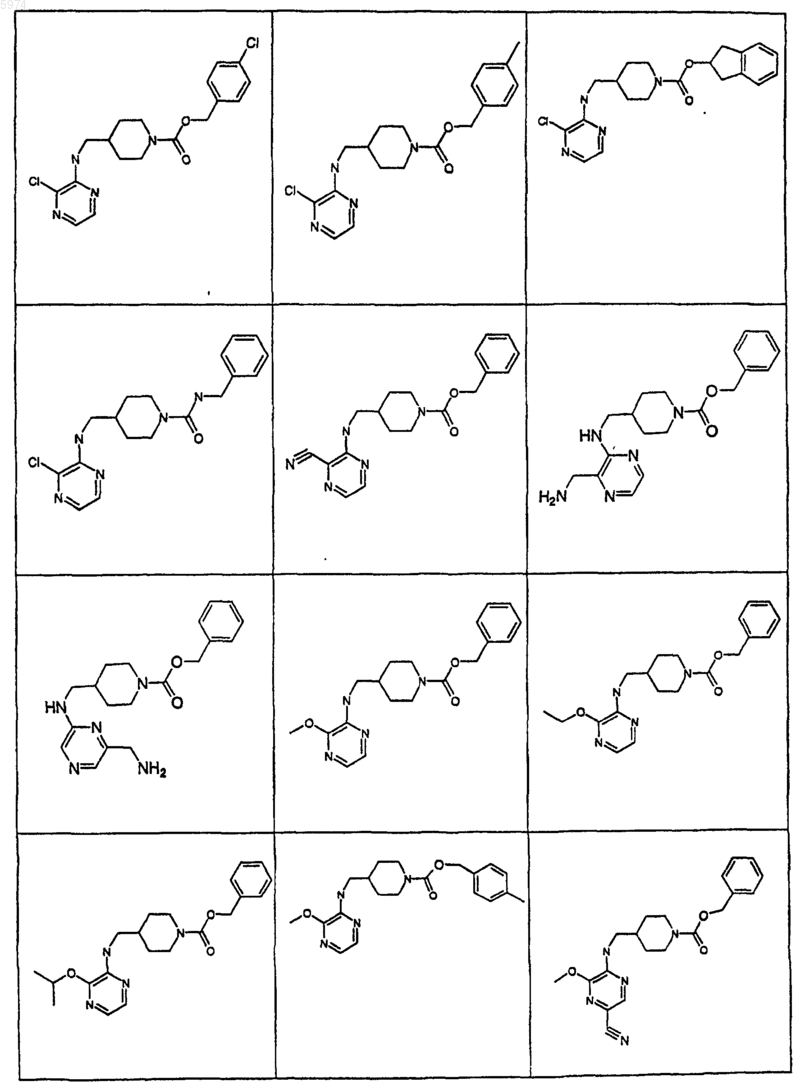
или его фармацевтически приемлемую соль.
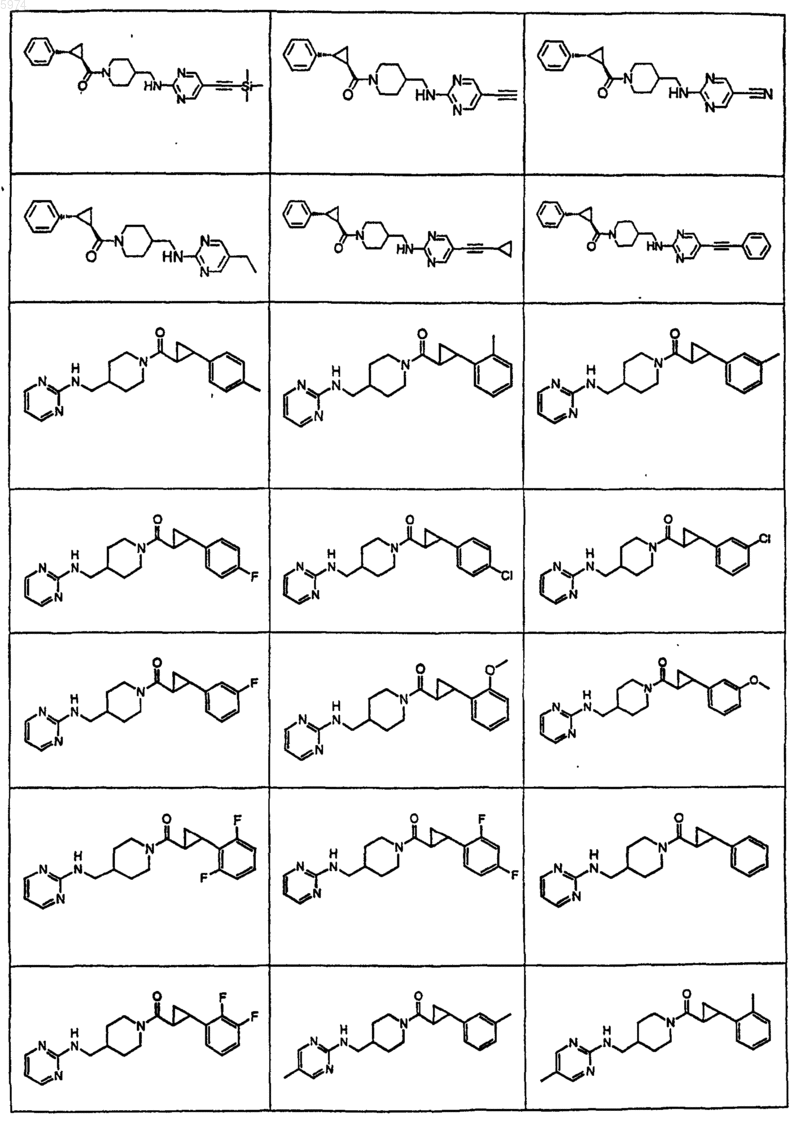
45. Соединение по п.1, где указанное соединение представляет собой
или его фармацевтически приемлемую соль.
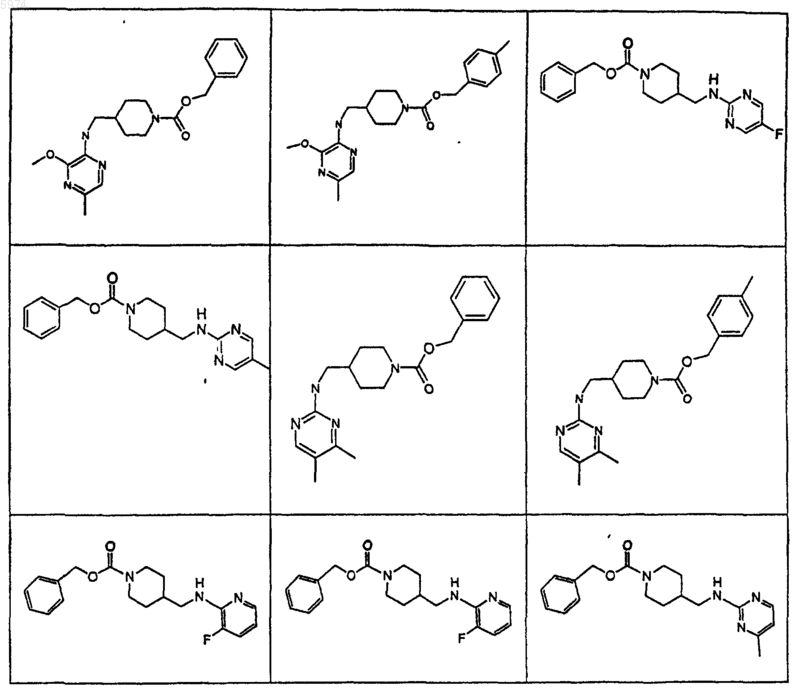
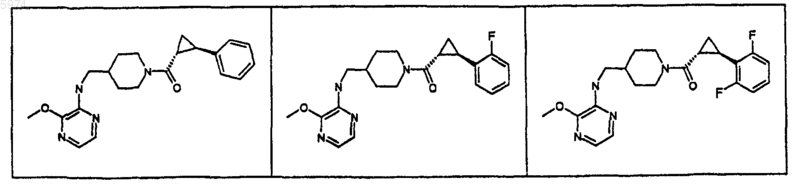
46. Соединение по п.1, где указанное соединение представляет собой
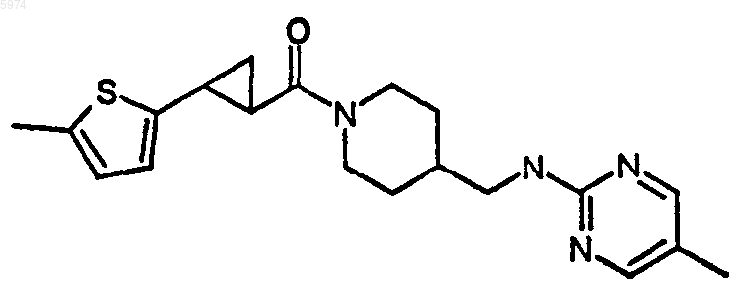
или его фармацевтически приемлемую соль.
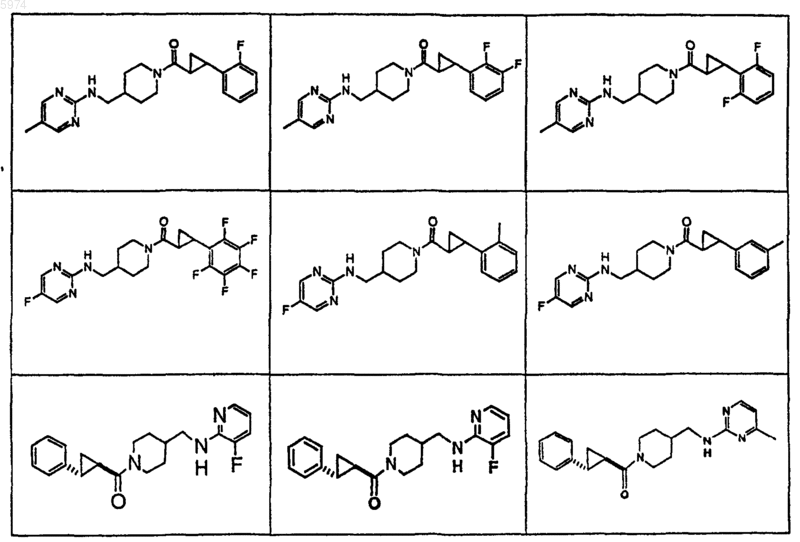
47. Соединение по п.1, где указанное соединение представляет собой
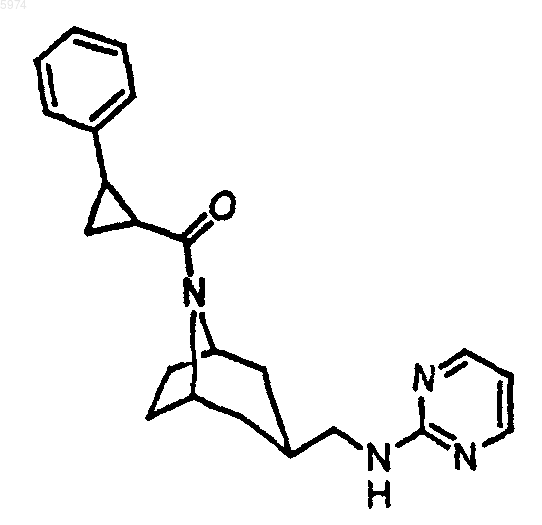
или его фармацевтически приемлемую соль.
48. Фармацевтическая композиция, включающая инертный носитель и эффективное количество соединения по п.1.
49. Фармацевтическая композиция по п.48, применяемая для лечения боли.
50. Фармацевтическая композиция по п.48, применяемая для лечения мигрени, депрессии, тревоги, шизофрении, паркинсонизма или инсульта.
51. Способ лечения боли, включающий стадию введения нуждающемуся в лечении пациенту эффективного количества соединения по п.1.
52. Способ лечения мигрени, депрессии, тревоги, шизофрении, паркинсонизма или инсульта, включающий стадию введения нуждающемуся в лечении пациенту эффективного количества соединения по п.1.
Текст
005974 По данной заявке испрашивается приоритет в соответствии с заявкой на выдачу патента США 60/271100, поданной 23 февраля 2001 года. Предпосылки изобретения Область изобретения Настоящее изобретение относится к N-замещенным неарильным гетероциклическим соединениям. В частности, настоящее изобретение относится к N-замещенным неарильным гетероциклическим соединениям, эффективным в качестве антагонистов NMDA NR2B и применяемым для успокоения боли. Ионы, такие как глутамат, играют ключевую роль в процессах, связанных с хронической болью и связанной с болью нейротоксичностью, воздействуя главным образом через N-метил-D-аспартатные(NMDA) рецепторы. Поэтому ингибирование подобного воздействия путем применения антагонистов ионных каналов, в особенности антагонистов NMDA, может быть полезным при лечении и сдерживании боли. Известные антагонисты NMDA включают кетамин, декстромофан и 3-(2-карбоксипиперазин-4-ил) пропил-1-фосфоновую кислоту (СРР). Несмотря на то, что сообщалось (J.D. Kristensen et al., Pain, 51: 249-253 (1992); Р.К. Eide et al., Pain, 61: 221-228 (1995); D.J. Knox et al., Anaesth. Intensive Care, 23: 620622 (1995); и М.В. Мах et al., Clin. Neuropharmacol., 18: 360-368 (1995 о способности данных соединений симптоматически облегчать боль при ряде невропатий, включая постгерпетическую невралгию, центральную боль при повреждении спинного мозга и фантомную боль, нежелательные побочные эффекты данных соединений препятствуют их широкому применению. Указанные побочные эффекты в аналгезирующей дозе включают психодислептические эффекты, такие как головокружение, головную боль, галлюцинации, дисфорию и нарушения познавательной и двигательной функции. В дополнение, более сильные галлюцинации, седативный эффект и атаксия вызываются дозами, лишь несущественно превышающими аналгезирующие. Поэтому является желательным создание новых антагонистов NMDA, которые не обладали бы нежелательными эффектами или обладали бы меньшими и/или более мягкими побочными эффектами.NMDA-рецепторы являются гетеромерными микросообществами субъединиц, из которых были клонированы два основных семейства субъединиц, обозначаемых как NR1 и NR2. Не основываясь на какой-либо конкретной теории, обычно считается, что в центральной нервной системе (ЦНС) млекопитающих различные функциональные NMDA-рецепторы образуются только путем комбинаций NR1 иNR2 субъединиц, которые соответственно экспрессируют сайты распознавания глицина и глутамата. В свою очередь семейство субъединицы NR2 разделяют на четыре самостоятельных типа: NR2A, NR2B,NR2C и NR2D. В работах Т. Ishii et al., J. Biol. Chem., 268: 2836-2843 (1993) и D.J. Laurie et al., Mol. BrainRes., 51: 23-32 (1997) описано, как различные конечные комбинации образуют множество NMDAрецепторов, различающихся как по физиологическим и фармакологическим свойствам, таким как свойства воротного механизма ионных каналов, чувствительность к магнию, фармакологический профиль,так и по анатомическому распределению. Например, если субъединицы NR1 обнаружены по всему мозгу, то субъединицы NR2 распределены дифференцировано. В частности, считается, что профиль распределения NR2B снижает вероятность возникновения побочных эффектов, обеспечивая облегчение боли. Например, в работе S. Boyce et al., Neuropharmacology, 38: 611-623 (1999) описан обезболивающий эффект избирательных антагонистов NMDANR2B с уменьшенными побочными эффектами. Поэтому является желательным создание новых антагонистов NMDA, мишенью которых являлся бы NR2B рецептор. В патенте США 6020347 и в международной патентной публикации WO 99/25685 описаны производные 4-пиперидинкарбоксамида, замещенного в 4-м положении, которые являются антагонистамиVLA-4 ("Very Late Antigen-4"). В международной патентной публикации WO 01/00207 описаны замещенные соединения пиримидина, которые являются ингибиторами тирозинкиназ. В международной патентной публикации WO 00/61551 описаны соединения оксопиримидиналканоата, которые являются лигандами интегринового рецептора. В международной патентной публикации ЕР 604800 описаны соединения карбоксиалкилфениламинокарбонилфенилпиперидина, которые являются ингибиторами агрегации тромбоцитов крови. В международной патентной публикации ЕР 611660 описаны бензимидазолы,ксантины и их аналоги в качестве ингибиторов агрегации ткани. В международной патентной публикации ЕР 771799 и патенте США 5861396 описаны производные пурин-6-она для лечения заболеваний сердечно-сосудистой и мочеполовой системы. В международной патентной публикации WO 94/21615 описаны соединения бензимидазолпиперидина, используемые в качестве антагонистов допамина D4. В патенте Германии DE 4241632 описаны замещенные производные фенил- или циклогексилкарбоновой кислоты, которые ингибируют агрегацию клеток. Описанные в качестве антагонистов NMDA фенольные соединения описаны в патентах США 5306723 и 5436255, и в международных патентных публикациях WO 91/17156, WO 92/19502, WO 93/02052, WO 96/37226 и ЕР 441506. Бензилпиперидин, замещенный фенолами или имидазолами, описан в работах Z.-L. Zhou et al., J. Medicinal Chemistry, 42: 2993-3000 (1999) и T.F. Gregory et al., Poster 94,218th National Meeting American Chemical Society, New Orleans, Louisiana, August 22-26, 1999. Другие избирательные в отношении NMDA NR2B соединения описаны в европейской патентной публикации ЕР-1 005974 787493 и в работе J.N.C. Kew et al., British J. Pharmacol., 123: 463 (1998). Однако по-прежнему существует необходимость в новых антагонистах NMDA, мишенью для которых является NR2B рецептор. Краткое содержание изобретения Настоящее изобретение относится к N-замещенным неарильным гетероциклическим соединениям,представленным формулой I или их фармацевтически приемлемым солям. Настоящее изобретение также относится к фармацевтическим композициям, включающим данные соединения. Кроме того, настоящее изобретение относится к новым способам лечения боли с применением данных соединений. Подробное описание изобретения Соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 14 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCН 2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-О-С(О)-группой, гетероарил(CH2)1-3-O-С(О)-группой, инданил(CH2)0-3-ОС(О)-группой, арил(CH2)1-3-С(О)-группой, арилциклопропил-С(О)-группой, гетероарилциклопропилС(О)-группой, гетероарил(CH2)1-3-С(О)-группой, гетероарил(CH2)1-3-группой, арил(CH2)1-3-NH-C(О)группой, арил(CH2)1-3-NH-C(NCN)-группой, арил(CH2)1-3-SO2-группой, гетероарил(CH2)1-3-SO2-группой,где любой арил или гетероарил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является C1-4 алкилом, С 3-6 циклоалкилом, C1-4-алкоксигруппой, трифторметилом, бромом,фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В одном аспекте, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил (CH2)0-3-О-С (О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью-2 005974 В воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил (CH2)0-3-O-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В другом воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является изоксазолилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом,гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (C1-2aлкил)HNCH2-гpyппoй, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-О-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является тиадиазолилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом,гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил (CH2)0-3-О-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4-алкоксигруппой,трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил (CH2)0-3-О-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2,или Х вместе с прилегающей связью = О. В другом воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является хинолинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом,гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(C1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил (CH2)0-3-O-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является пуринилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(C1-2 алкил)NСН 2-группой, (C1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил(СН 2)0-3-О-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NСН 2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-О-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью = О. В другом воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является тиазолилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил(СН 2)0-3-О-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является птеридинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом,гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNСН 2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-О-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является пирролопиримидинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой,метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (C1-2 алкил)(С 1-2 алкил)NСН 2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-Сгруппой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-O-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является имидазопиридинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, C2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом,нитрогруппой, (C1-2 алкил)(С 1-2 алкил)NСН 2-группой, (С 1-2 алкил)НNСН 2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил (CH2)0-3-О-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении данного первого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является бензимидазолилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(С 0-4 алкил)ом,нитрогруппой, (C1-2 алкил)(C1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-О-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. Во втором аспекте, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 12 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)1-3-SO2-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В воплощении данного второго аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)1-3-SO2-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В другом воплощении второго аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является хиназолинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом,гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(C1-2 алкил)NCH2-группой, (C1-2 алкил)НNCН 2-группой, Si(СН 3)3-С-группой илиNH2C(O)-группой; А является -С 0-4 алкилом; В является арил(СН 2)1-3-SO2-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении второго аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является пуринилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил(СН 2)1-3-SO2-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью = О. В еще одном воплощении второго аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является имидазопиридинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом,нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NСН 2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил(СH2)1-3-SO2-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью = О. В еще одном воплощении данного второго аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 1-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)1-3-SO2-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или X вместе с прилегающей связью=О. В третьем аспекте, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом,йодом, цианогруппой, метилсульфанилом, аминогруппой, нитрогруппой, (C1-2 алкил)(C1-4 алкил)NCH2 группой, (С 1-2 алкил)НNСН 2-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(СН 2)0-3-О-С(О)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В воплощении данного третьего аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом,йодом, цианогруппой, метилсульфанилом, аминогруппой, нитрогруппой, (C1-2 алкил)(C1-2 алкил)NСН 2 группой, (C1-2 алкил)НNСН 2-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-О-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В другом воплощении данного третьего аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является птеридинилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом,-7 005974 гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNСН 2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил (CH2)0-3-О-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении данного третьего аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является пуринилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-О-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении данного третьего аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является бензимидазолилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(C0-4-алкил)(С 0-4 алкил)ом,нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-О-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью = О. В четвертом аспекте, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 14 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-O-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В воплощении четвертого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(C1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-O-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В другом воплощении четвертого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является пуринилом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является C1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арил (CH2)0-3-О-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В еще одном воплощении четвертого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)0-3-О-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В пятом аспекте, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил (CH2)1-3-SO2-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью= О. В воплощении пятого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4-алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)1-3-SO2-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В шестом аспекте, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (C1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является гетероарил(CH2)1-3-C(O)-группой, где гетероарил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В воплощении шестого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является гетероарил(СН 2)1-3-C(O)-группой, где гетероарил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В седьмом аспекте, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(C1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)1-3-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В воплощении седьмого аспекта, соединения по настоящему изобретению представлены формулойI или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил (CH2)1-3-C(O)-группой, где арил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В восьмом аспекте, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арилциклопропил-С(О)-группой, где арил необязательно замещен 1-5 заместителями,причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4-алкоксигруппой,трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В воплощении восьмого аспекта, соединения по настоящему изобретению представлены формулойI или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 12 алкил)(С 1-2 алкил)NСН 2-группой, (C1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арилциклопропил-С(О)-группой, где арил необязательно замещен 1-5 заместителями,причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4-алкоксигруппой,трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В воплощении восьмого аспекта, соединения по настоящему изобретению представлены формулойI или их фармацевтически приемлемыми солями, гдеHetAr является пиримидинильным кольцом, необязательно замещенным 1 или 2 заместителями,причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой,метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (C1-2 алкил)(С 1-2 алкил)NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-Сгруппой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арилциклопропил-С(О)-группой, где арил необязательно замещен 1-5 заместителями,причем каждый заместитель независимо является С 14 алкилом, С 3-6 циклоалкилом, C1-4-алкоксигруппой,трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В другом воплощении восьмого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является пиразинильным кольцом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой,метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)-NCH2-группой, (С 1-2 алкил)НNCH2-группой, Si(СН 3)3-Сгруппой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арилциклопропил-С(О)-группой, где арил необязательно замещен 1-5 заместителями,причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4-алкоксигруппой,трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью = О. В еще одном воплощении восьмого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является пиридазинильным кольцом, необязательно замещенным 1 или 2 заместителями,причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой,метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NCH2-группой, (C1-2 алкил)НNCH2-группой, Si(СН 3)3-Сгруппой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арилциклопропил-С(О)-группой, где арил необязательно замещен 1-5 заместителями,причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4-алкоксигруппой,трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В другом воплощении восьмого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr является пиридильным кольцом, необязательно замещенным 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 1-4 алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидроксиС 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом, фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом,нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NСН 2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой илиNH2C(О)-группой; А является -С 0-4 алкилом; В является арилциклопропил-С(О)-группой, где арил необязательно замещен 1-5 заместителями,причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4-алкоксигруппой,трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В девятом аспекте, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NСН 2-группой, (C1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NН 2C(O)-группой; А является -С 0-4 алкилом; В является гетероарил(СН 2)1-3-О-C(O)-группой, где гетероарил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В воплощении девятого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (C1-2 алкил)(С 1-2 алкил)NCH2-гpyппoй, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является гетероарил(CH2)1-3-О-C(O)-группой, где гетероарил необязательно замещен 1-5 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, С 1-4 алкоксигруппой, трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. В десятом аспекте, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(C1-2 алкил)NCH2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)1-3-NH-C(NCN)-группой, где арил необязательно замещен 1-5 заместителями,причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4-алкоксигруппой,трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью = О. В воплощении десятого аспекта, соединения по настоящему изобретению представлены формулой I или их фармацевтически приемлемыми солями, гдеHetAr необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо является С 1-4 алкилом, C1-4-алкоксигруппой, С 2-4 алкинилом, трифторметилом, гидроксигруппой, гидрокси С 1-4 алкилом, фтором, хлором, бромом, йодом, цианогруппой, метилсульфанилом, циклопропилэтинилом,фенилэтинилом, гетероарилэтинилом, -N(С 0-4 алкил)(С 0-4 алкил)ом, нитрогруппой, (С 1-2 алкил)(С 1-2 алкил)NСН 2-группой, (С 1-2 алкил)HNCH2-группой, Si(СН 3)3-С-группой или NH2C(О)-группой; А является -С 0-4 алкилом; В является арил(CH2)1-3-NH-C(NCN)-группой, где арил необязательно замещен 1-5 заместителями,причем каждый заместитель независимо является С 1-4 алкилом, С 3-6 циклоалкилом, C1-4-алкоксигруппой,трифторметилом, бромом, фтором или хлором; и Х является Н, ОН, F, С 1-4 алкилом, С 1-4 алкоксигруппой, NH2, или Х вместе с прилегающей связью=О. Как используемый здесь термин алкил, так и другие группы, содержащие в названии префикс алк, как, например, алкокси, алканоил, алкенил, алкинил, и тому подобное, означает углеродные цепи,которые могут быть неразветвленными или разветвленными, или их комбинации. Примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, втор- и трет-бутил, пентил, гексил, гептил, и тому подобное. Термины алкенил, алкинил и другие похожие включают углеродные цепи, содержащие одну ненасыщенную С-С связь. Термин циклоалкил означает не содержащие гетероатомов карбоциклы, и включает как моно-,би- и трициклические насыщенные карбоциклы, так и конденсированные кольцевые системы. Такие конденсированные кольцевые системы могут содержать одно кольцо, которое является частично или полностью ненасыщенным, такое как бензольное кольцо, с образованием конденсированных кольцевых систем, таких как бензоконденсированные карбоциклы. Циклоалкил включает такие конденсированные кольцевые системы, как спироконденсированные кольцевые системы. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, декагидронафталин, адамантан, инданил, инденил, флуоренил, 1,2,3,4-тетрагидронафталин, и тому подобное. Сходным образом, термин циклоалкенил означает не содержащие гетероатомов карбоциклы, содержащие по меньшей мере одну неароматическую С-С двойную связь, и включает как моно-, би- и трициклические частично насыщенные карбо- 13005974 циклы, так и бензоконденсированные циклоалкены. Примеры циклоалкенила включают циклогексил,инденил и тому подобное. Термин циклоалкилокси, если не уточнено дополнительно, включает циклоалкильную группу,соединенную со связующим атомом кислорода. Термин алкокси, если не уточнено дополнительно, включает алкильную группу, соединенную со связующим атомом кислорода. Термин арил, если не уточнено дополнительно, включает как многокольцевые системы, так и однокольцевые системы, такие как, например, фенил или нафтил. Термин арилокси, если не уточнено дополнительно, включает как многокольцевые системы, так и однокольцевые системы, такие как, например, фенил или нафтил, соединенные с местом связывания через связующий атом кислорода. Термин С 0 означает, что углерод не содержится. Так, термин C0-C5 означает, что содержится от нуля до 5 атомов углерода, то есть содержится пять, четыре, три, два, один атом углерода или атомов углерода не содержится. Если атомов углерода не содержится в связующей алкильной группе, связывание осуществляется напрямую. Если атомов углерода не содержится в концевой алкильной группе, концевым является атом водорода. Термин гетеро, если не уточнено дополнительно, включает один или несколько атомов кислорода, серы или азота. Например, гетероциклоалкил или гетероарил включают кольцевые системы, содержащие один или несколько атомов кислорода в кольце, серы или азота, включая комбинации этих атомов. Гетероатомы замещают атомы углерода, содержащиеся в кольца. Так, например, гетероциклоС 5 алкил является пятичленным кольцом, содержащим от пяти до нуля атомов углерода. Примеры гетероарила включают, например, пиридинил, хинолинил, изохинолинил, пиридазинил,пиримидинил, пиразинил, хиноксалинил, фурил, бензофурил, дибензофурил, тиенил, бензтиенил, пирролил, индолил, пиразолил, индазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, бензимидазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил. Термин гетероарилокси, если не уточнено дополнительно, описывает гетероарильную группу, соединенную с местом связывания через связующий атом кислорода. Примеры гетероарил (C1-6)алкила включают, например, фурилметил, фурилэтил, тиенилметил, тиенилэтил, пиразолилметил, оксазолилметил, оксазолилэтил, изоксазолилметил, тиазолилметил, тиазолилэтил, имидазолилметил, имидазолилэтил, бензимидазолилметил, оксадиазолилметил, оксадиазолилэтил,тиадиазолилметил, тиадиазолилэтил, триазолилметил, триазолилэтил, тетразолилметил, тетразолилэтил,пиридинилметил, пиридинилэтил, пиридазинилметил, пиримидинилметил, пиразинилметил, хинолинилметил, изохинолинилметил и хиноксалинилметил. Примеры гетероцикло(С 1) алкила включают, например, азетидинил, пирролидинил, пиперидинил,пиперазинил, морфолинил, тетрагидрофуранил, имидазолинил, пирролидин-2-он, пиперидин-2-он и тиоморфолинил. Примеры арил(C1-6)алкила включают, например, фенил(C1-6)-алкил и нафтил(C1-6)алкил. Примеры гетероцикло(С 3-7)алкилкарбонил(C1-6)алкила включают, например, азетидинилкарбонил(C1-6)алкил, пирролидинилкарбонил(C1-6)алкил, пиперидинилкарбонил(C1-6)алкил, пиперазинилкарбонил(C1-6)алкил, морфолинилкарбонил(C1-6)алкил и тиоморфолинилкарбонил(C1-6)алкил. Термин амин, если не уточнено дополнительно, включает первичные, вторичные и третичные амины. Применяемый термин карбамоил, если не уточнено дополнительно, включает -NHC(О)ОС 1-С 4 алкил и -ОC(O)NHC1-C4 алкил. Термин галоген включает атомы фтора, хлора, брома и йода. Термин необязательно замещенный призван включать и замещенные и незамещенные группы. Так, например, необязательно замещенный арил может представлять собой пентафторфенильное или фенильное кольцо. Кроме того, замещение может быть сделано в любой группе. Например, замещенный арил(C1-6)-алкил включает как замещение в арильной группе, так и замещение в алкильной группе. Описанные здесь соединения содержат одну или несколько двойных связей и могут образовывать как цис/транс изомеры, так и другие конформационные изомеры. Настоящее изобретение включает как все возможные изомеры, так и смеси таких изомеров. Описанные здесь соединения могут иметь один или несколько асимметричных центров и поэтому могут образовывать диастереомеры и оптические изомеры. Настоящее изобретение включает как все возможные диастереомеры, так и их рацемические смеси, их по существу чистые энантиомеры, все возможные геометрические изомеры и их фармацевтически приемлемые соли. Указанная выше формула I представлена без точной стереохимии в определенных положениях. Настоящее изобретение включает все стереоизомеры формулы I и их фармацевтически приемлемые соли. Дополнительно включены как смеси стереоизомеров, так и выделенные специфические стереоизомеры. При выполнении методик синтеза, применяемых для получения таких соединений, или методик рацемизации или эпимеризации, известных специалистам в данной области техники, полученные в данных процессах продукты могут являться смесью стереоизомеров.- 14005974 Термин фармацевтически приемлемые соли относится к солям, полученным из фармацевтически приемлемых нетоксических оснований или кислот. Если соединение по настоящему изобретению является кислотным, его соответственная соль может быть подходящим образом получена из фармацевтически приемлемых нетоксических оснований, включая неорганические основания и органические основания. Соли, полученные из неорганических оснований, включают соли алюминия, аммония, кальция, меди (одновалентной и двухвалентной), железа(III), железа(II), лития, магния, марганца (двухвалентного и трехвалентного), калия, натрия, цинка, и тому подобное. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Соли, полученные из фармацевтически приемлемых органических нетоксических оснований, включают как соли первичных, вторичных и третичных аминов, так и циклических аминов и замещенных аминов, таких как встречающихся в природе и синтетических замещенных аминов. Другие фармацевтически приемлемые органические нетоксические основания, из которых могут быть получены соли, включают ионообменные смолы, такие как, например, аргинин, бетаин,кофеин, холин, N,N'-дибензил-этилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол,этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин, и тому подобное. Если соединение по настоящему изобретению является основным, его соответственная соль может быть подходящим образом получена из фармацевтически приемлемых нетоксических кислот, включая неорганические и органические кислоты. Такие кислоты включают, например, уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромисто-водородную, соляную, изэтионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, паратолуолсульфоновую кислоту, и тому подобное. Особенно предпочтительными являются лимонная, бромисто-водородная, соляная, малеиновая, фосфорная, серная и винная кислоты. Фармацевтические композиции по настоящему изобретению включают в качестве активного ингредиента соединение, представленное формулой I (или его фармацевтически приемлемые соли), фармацевтически приемлемый носитель и, необязательно, другие терапевтические ингредиенты или вспомогательные средства. Композиции включают композиции, пригодные для перорального, ректального, местного и парентерального (включая подкожное, внутримышечное и внутривенное) введения, хотя наиболее подходящий способ введения в каждом конкретном случае должен зависеть от конкретного пациента и природы и тяжести состояний, при которых вводится активный ингредиент. Фармацевтические композиции могут быть подходящим образом представлены в виде дозированной формы и получены при помощи хорошо известных в фармацевтике способов. На практике, при помощи традиционных методик получения фармацевтических препаратов, соединения, представленные формулой I, или их фармацевтически приемлемые соли по настоящему изобретению могут быть объединены в качестве активного ингредиента с фармацевтическим носителем в однородной смеси. Носитель может принимать широкое разнообразие форм в зависимости от желательной для введения формы препарата, например, пероральной или парентеральной (включая внутривенную). Поэтому фармацевтические композиции по настоящему изобретению могут быть представлены в виде раздельных форм, пригодных для перорального применения, таких как капсулы, крахмальных капсул или таблеток, каждая из которых содержит заранее определенное количество активного ингредиента. Дополнительно композиции могут быть представлены в виде порошка, в виде гранул, в виде раствора, в виде суспензии в водной жидкости, в виде неводной жидкости, в виде эмульсии масла в воде или в виде жидкой водомаслянной эмульсии. В дополнение к описанным выше общим дозированным формам, соединение, представленное формулой I, или его фармацевтически приемлемые соли, могут также вводиться посредством контролируемого высвобождения и/или устройств доставки. Композиции могут быть приготовлены любым фармацевтическим способом. В общем, такие способы включают стадия соединения активного ингредиента с носителем, который состоит из одного или нескольких необходимых ингредиентов. В общем, композиции приготавливают путем однообразного и однородного смешивания активного ингредиента с жидкими носителями или с мелкодисперсными твердыми носителями, или и с теми и с другими. Затем продукт может быть формован в желательную форму. Таким образом, фармацевтические композиции по настоящему изобретению могут включать фармацевтически приемлемый носитель и соединение или его фармацевтически приемлемую соль формулыI. Соединения формулы I, или его фармацевтически приемлемые соли, могут также быть включены в фармацевтические композиции в комбинации с одним или несколькими другими терапевтически активными соединениями. Применяемый фармацевтический носитель может быть, например, твердым жидким или газообразным. Примеры твердых носителей включают лактозу, гипс, сахарозу, тальк, желатин, агар, пектин, аравийскую камедь, стеарат магния и стеариновую кислоту. Примерами жидких носителей являются сахарный сироп, арахисовое масло, оливковое масло и вода. Примеры газообразных носителей включают углекислый газ и азот.- 15005974 При приготовлении композиций для дозированного перорального применения может применять любые подходящие фармацевтические среды. Например, для получения жидких препаратов для перорального применения, таких как суспензии, эликсиры и растворы, могут применяться вода, гликоли,масла, спирты, ароматизаторы, консерванты, красители, и тому подобное, в то время как для получения твердых препаратов для перорального применения, таких как порошки, капсулы и таблетки могут применяться такие носители как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, смазки, связующие вещества, разрыхлители, и тому подобное. Вследствие простоты их введения таблетки и капсулы являются предпочтительными формами для дозированного перорального применения, посредством чего применяются твердые фармацевтические носители. Таблетки могут быть необязательно покрыты оболочкой посредством стандартных водных или неводных методик. Таблетка, содержащая соединение по настоящему изобретению, может быть получена путем необязательного прессования или формования с одним или несколькими дополнительными ингредиентами или вспомогательными средствами. Спрессованные таблетки могут быть получены путем прессования активного ингредиента в сыпучей форме, такой как порошок или гранулы, необязательно смешанного со связующим веществом, смазкой, инертным разбавителем, поверхностно-активным или диспергирующим агентом, в подходящем агрегате. Формованные таблетки могут быть получены путем формования смеси порошкообразного соединения, увлажненного жидким инертным разбавителем, в подходящем агрегате. Каждая таблетка предпочтительно содержит приблизительно от 1 мг до 500 мг активного ингредиента, и каждая крахмальная капсула или капсула предпочтительно содержит приблизительно от 1 мг до 500 мг активного ингредиента. Фармацевтические композиции по настоящему изобретению, пригодные для парентерального введения, могут быть приготовлены в виде растворов или суспензий активных соединений в воде. Могут быть включены поверхностно-активные вещества, такие как, например, гидроксипропилцеллюлоза. Также могут быть приготовлены дисперсии в глицероле, жидких полиэтиленгликолях и их смесях в маслах. Дополнительно для предотвращения нежелательного роста микроорганизмов могут быть включены консерванты. Фармацевтические композиции по настоящему изобретению, пригодные для применения в виде инъекций, также включают стерильные водные растворы или дисперсии. Кроме того, композиции могут быть в виде стерильных порошков, для незапланированного приготовления подобных стерильных растворов или дисперсий для применения в виде инъекций. Во всех случаях, окончательная форма для инъекций должна быть стерильна и должна быть действительно жидкой для легкого забора в шприц. Фармацевтические композиции должны быть стабильны в условиях получения и хранения, а потому должны быть предпочтительно защищены от заражения микроорганизмами, такими как бактерии и грибы. Носитель должен быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерол, пропиленгликоль и жидкий полиэтиленгликоль), растительные масла и их подходящие смеси. Фармацевтические композиции по настоящему изобретению могут быть в форме, пригодной для местного применения, такой как, например, аэрозоль, крем, мазь, лосьон, присыпка, и тому подобное. Дополнительно композиции могут быть в форме, пригодной для применения в устройствах для чрезкожного нанесения. Указанные формулы могут быть составлены с использованием соединения формулы I по настоящему изобретению или его фармацевтически приемлемых солей с применением традиционных способов получения. В качестве примера, для получения крема или мази, обладающих желаемой консистенцией, их приготавливают путем смешивания гидрофильного материала и воды приблизительно с 510 мас.% соединения. Фармацевтические композиции по настоящему изобретению могут быть в форме, пригодной для ректального введения, в которой носитель является твердым. Предпочтительно, когда смесь образует свечи для дозированного применения. Пригодные носители включают кокосовое масло и другие материалы, обычно применяемые в данной области техники. Свечи могут быть подходящим образом получены путем смешивания композиции с размягченным или расплавленным носителем (носителями) с последующим охлаждением и заключением в форму. В дополнением к упомянутым выше ингредиентам носителя, описанные выше фармацевтические композиции могут подходящим образом включать один или несколько дополнительных ингредиентов носителя, таких как разбавители, буферные растворы, ароматизаторы, связующие вещества, поверхностно-активные вещества, загустители, смазки, консерванты (включая антиоксиданты), и тому подобное. Кроме того, для придания формуле изотоничности с кровью реципиента могут применяться другие вспомогательные вещества. Композиции, содержащие соединение формулы I или его фармацевтически приемлемые соли, могут также быть приготовлены в форме порошка или жидкого концентрата. Протоколы экспериментов Определение способности выбранных соединений ингибировать активацию NR1A/2B NMDA-рецептора(Метод FLIPR) Способность выбранных соединений ингибировать активацию NR1A/2B NMDA-рецептора определяли по NR1A/2B рецептор-опосредованному выбросу Са 2+ в соответствии со следующей методикой.- 16005974 Транфицированные NR1A/2B рецептором L(tk)-клетки помещали в 96-луночные планшеты в количестве 3 х 106 клеток на планшет и инкубировали в течение 1-2 суток в среде нормального роста (модифицированная по способу Дульбекко среда Игла с пируватом Na, 4500 мг глюкозы, пенициллин/стрептомицин, глутамином, 10% FCS и 0,5 мг/мл генетицина). Экспрессию NR1A/2B в указанных клетках индуцировали добавлением 4 нМ дексаметазона в присутствии 500 мкМ кетамина в течение 1624 ч. После индукции рецептора клетки дважды промывали аналитическим буфером (не содержащим Мg2+ сбалансированным солевым раствором Хенкса (HBSS-Mg2+ free), содержащим 20 мМ HEPES, 0,1%BSA, 2 мМ CaCl2 и 250 мкМ пробенецида) с применением Labsystem Cellwasher. К клеткам в 96 луночной плашке добавляли чувствительный к Са 2+ краситель Fluo-3 (Molecular Probes, Inc.) в концентрации 4 мкМ в аналитическом буфере, содержащем 0,5% FBS и 0,04% pluronic F-127 (Molecular Probes,Inc.), и инкубировали в течение 1 ч при 37 С в темноте. Затем клетки четырежды промывали аналитическим буфером при помощи Cellwasher и оставляли их в 100 мкл буфера. Растворы тестируемых соединений раскапывали при помощи FLIPR (Fluorometric Imaging Plate Reader) в каждую тестируемую лунку для предварительной обработки в течение 2 мин. В течение этого времени регистрировали интенсивность флуоресценции (возбуждение при 488 нм и испускание при 530 нм). Затем в каждую лунку, уже содержащую 150 мкл буфера (содержащего тестируемое соединение или растворитель) при помощиFLIPR добавляли 50 мкл раствора агониста глутамат/глицина (конечная концентрация 1 мкМ/1 мкМ) и непрерывно регистрировали флуоресценцию в течение 10 мин. Конечные значения флуоресценции использовали для определения значения IC50, сравнивая агонист-стимулированный сигнал образца, содержащего только растворитель, с образцом, содержащим клетки, инкубируемые с каждой концентрацией тестируемого соединения. Определение кажущейся константы диссоциации (Ki) соединений с NR1A/NR2B рецепторами человека (анализ связывания). Анализ связывания меченого радиоактивного лиганда проводили при комнатной температуре в 96 луночном титрационном микропланшете в конечном объеме 1 мл в 20 мМ HEPES-буфера (рН 7,4), содержащего 150 мМ NaCl. Приготавливали растворы тестируемых соединений в ДМСО и последовательно разбавляли ДМСО с получением 20 мкл каждого из 10 растворов, различающихся по концентрации в 3 раза. Измеряли неспецифическое связывание (NSB), используя нагретый AMD-1 (конечная концентрация 10 мкМ), и общее связывание (ТВ), используя ДМСО (конечная концентрация 2%). К тестируемым соединениям добавляли раствор NR1A/NR2B рецепторов (конечная концентрация 40 пМ) и меченный тритием AMD-2 (конечная концентрация 1 нМ). После инкубации в течение 3 ч при комнатной температуре образцы фильтровали через фильтры Packard GF/B (предварительно замоченные в 0,05% PEI полиэтиленинине Sigma P-3143) и промывали холодным 20 мМ буферным раствором Hepes (10 раз по 1 мл). После сушки фильтров в вакууме добавляли 40 мкл Packard Microscint-20 и определяли связанную радиоактивность на счетчике Packard TopCount. Методом нелинейных наименьших квадратов определяли кажущуюся константу диссоциации (Ki), максимальный процент ингибирования (% Imax), минимальный процент ингибирования (% Imin) и hill slope (nH), подставляя данные связанного СРМ в приведенное ниже уравнение 1. Уравнение 1 где КD является определенной для рецептора методом горячего насыщения кажущейся константой диссоциации меченого радиоактивного лиганда и SB является специфически связанным лигандом (импульсов/мин.), определенным как разница между ТВ и NSB. Соединения AMD-1 и AMD-2 могут быть синтезированы в соответствии со следующими общими схемами реакций. В соответствии со схемой 1 раствор соответственно замещенного бензонитрила 1 в метаноле при комнатной температуре барботировали хлороводородом. Летучие компоненты удаляли при пониженном давлении, растирали полученный остаток с эфиром и фильтровали с получением желаемого имидата 2. Имидат 2 растворяли в метаноле при температуре окружающей среды, обрабатывали амином 3 при температуре окружающей среды и перемешивали в атмосфере аргона. Летучие компоненты удаляли при пониженном давлении и очищали остаток методом препаративной ВЭЖХ или растирания с эфиром с получением амидина 1 а. Схема 2 В соответствии со схемой 2 при комнатной температуре в атмосфере аргона амин 3 а растворяли в эфире и обрабатывали единой порцией 1 М раствора хлороводорода в эфире (1 экв.). Полученный осадок энергично перемешивали в течение 10 мин. Летучие компоненты удаляли при пониженном давлении. Остаток суспендировали в толуоле, охлаждали до 0 С в атмосфере аргона, по каплям обрабатывали 2 М триметилалюминием (1,05 экв.) и перемешивали в течение 45 мин при комнатной температуре с получением промежуточного продукта 6 (без выделения). Соединение 6 добавляли к раствору нитрила 1 в толуоле. Реакционную смесь нагревали в герметичной трубке до 80 С в течение 18 ч без перемешивания,охлаждали до температуры окружающей среды, наносили на колонку силикагеля и элюировали метанолом/дихлорметаном с получением амидина 4. Получение I125I]AMD-1 Меченный тритием AMD-1 получали в соответствии со следующей процедурой. Смесь гидрохлоридной соли AMD-1 (5 мг, 0,012 ммоль) в диоксане (0,2 мл), содержащей триэтиламин (4 мкл), обрабатывали гексаметилдитином (5 мкл), каталитическим количеством палладиевого катализатора и нагревали до 100 С в течение 45 мин. Реакционную смесь охлаждали до комнатной температуры, фильтровали через стекловатную пробку, промывали в метаноле и концентрировали в вакууме с получением 10,7 мг коричневого масла. Масло растворяли в метиленхлориде и пропускали через небольшую колонку силикагеля, элюируя метиленхлоридом, а затем 5%-ным метанолом/метиленхлоридом. Фракции, содержащие триметилстаннан (Rf 0,26 в 10%-ном метаноле/метиленхлориде) объединяли и концентрировали в вакууме с получением 4,5 мг триметилстаннана в виде чистого бесцветного масла. Затем данное вещество очищали методом ВЭЖХ (CIS Econosil, 10 х 250 мм, 20-ти минутный линейный градиент от 30%MeCN:70% H2O (0,1% ТФУ) до 90% MeCN, 3 мл/мин, 254 нм, время удерживания 15 мин) с получением 3 мг триметилстаннана. В пузырек с Na125I (10 мКи, Amersham) помещали мешалку, йодную затравку (an iodobead), 50 мкл метанола и перемешивали в течение 5 мин при комнатной температуре. Добавляли раствор триметилстаннана (0,1 мг) в 50 мкл метанола, содержащий 5 мкл трифторуксусной кислоты, и перемешивали реакционную смесь в течение 5 мин. Реакцию тушили добавлением 50 мкл гидроксида аммония и очищали методом ВЭЖХ (CIS Vydac protein and peptide column, 4,6 х 250 мм, линейный градиент от 30%MeCN:70% Н 2 О (0,1% ТФУ) до 90% MeCN, 1 мл/мин в течение 20 мин, время удерживания 11 мин). Фракции, содержащие радиоактивный продукт, объединяли и концентрировали в вакууме с получением 989 мКи [125I]AMD-1 со специфической активностью, равной 898 Ки/ммоль, измеренной по УФпоглощению при 272 нм. Синтез меченного тритием AMD-2. Меченный тритием AMD-2 получали в соответствии со следующей процедурой. Фенол AMD-2 (2 мг, 0,008 ммоль) растворяли в диметилформамиде (0,6 мл) и карбонате калия (1,2 мг) в течение 1 ч. При комнатной температуре добавляли специфический высокоактивный меченный тритием метилйодид (50 мКи, 0,0006 ммоль, в 1 мл толуола, American Radiolabeled Chemicals) и перемешивали в течение 2 ч. Для удаления нерастворенного карбоната калия реакционную смесь фильтровали с применением бесшприцевого фильтрирующего устройства PTFE (0,45 мкм), промывали абсолютным этанолом (2 мл, Pharmco) и упаривали объединенные фильтраты досуха на роторном испарителе при комнатной температуре, что также приводило к удалению непрореагировавшего меченного тритием метилйодида. Остаток очищали методом ВЭЖХ на полупрепаративной колонке Phenomenx Luna C8 (Luna 5 micro C8(2), 250 х 10,0 мм),элюируя в течение 20 мин градиентной системой от 20/80 ацетонитрил/вода с 0,1% трифторуксусной кислоты до 100% ацетонитрила с 0,1% трифторуксусной кислоты. Общая радиоактивность продукта составляла 8 мКи. Последующую очистку проводили путем нанесения на колонку Waters C-18 Sep-pak(Waters Sep-Pak PLUS CIS), элюируя водой, а затем абсолютным этанолом. Перед проведением окончательного анализа продукт разбавляли абсолютным этанолом (10 мл). Для соединений по настоящему изобретению методами FLEPR-анализа и анализа связывания определены значения IC50, не превышающие 50 мкМ. Благоприятными являются полученные методамиFLEPR-анализа и анализа связывания значения IC50, не превышающие 5 мкМ. Более благоприятными являются полученные методами FLEPR-анализа и анализа связывания значения IC50, не превышающие 1 мкМ. Еще более благоприятными являются полученные методами FLEPR-анализа и анализа связывания значения IC50, не превышающие 0,1 мкМ. Поэтому показано, что соединения и фармацевтические композиции по настоящему изобретению обладают биологической активностью в качестве антагонистовNMDA NR2B. Соответственно другим аспектом настоящего изобретения является лечение боли, мигрени, депрессии, тревоги, шизофрении, паркинсонизма или припадков - заболеваний, поддающихся лечению посредством ингибирования NMDA NR2B-рецепторов - путем введения эффективного количества соединений по настоящему изобретению. Так, боль можно лечить путем введения один или два раза в сутки соединения по настоящему изобретению в количестве 0,1, 1, 5, 10 или 25 мг на 1 кг массы тела. Мигрень можно лечить путем введения один или два раза в сутки соединения по настоящему изобретению в количестве 0,1, 1, 5, 10 или 25 мг на 1 кг массы тела. Депрессию можно лечить путем введения один или два раза в сутки соединения по настоящему изобретению в количестве 0,1, 1, 5, 10 или 25 мг на 1 кг массы тела. Тревогу можно лечить путем введения один или два раза в сутки соединения по настоящему изобретению в количестве 0,1, 1, 5, 10 или 25 мг на 1 кг массы тела. Шизофрению можно лечить путем введения один или два раза в сутки соединения по настоящему изобретению в количестве 0,1, 1, 5, 10 или 25 мг на 1 кг массы тела. Паркинсонизм можно лечить путем введения один или два раза в сутки соединения по настоящему изобретению в количестве 0,1, 1, 5, 10 или 25 мг на 1 кг массы тела. Инсульт можно лечить путем введения один или два раза в сутки соединения по настоящему изобретению в количестве 0,1, 1, 5, 10 или 25 мг на 1 кг массы тела. Используемые здесь сокращения являются следующими, если не уточнено дополнительно: ВН 3-ТГФ - комплекс боранатетрагидрофурана;MeCN - ацетонитрил; ЯМР - ядерный магнитный резонанс (ЯМР);TEA - триэтиламин; ТФУ - трифторуксусная кислота; ТГФ - тетрагидрофуран. Следующие примеры приведены с целью более полной иллюстрации настоящего изобретения и никак не должны истолковываться в качестве ограничения объема настоящего изобретения. Пример. Соединения по настоящему изобретению могут быть получены с помощью приведенных ниже методик. Промежуточные продукты. Промежуточный продукт 1 а. 4-Метилбензиловый эфир 2,5-диоксопирролидин-1-илового эфира угольной кислоты. Дисукцинимидилкарбонат (5,03 г, 19,65 ммоль) в 30 мл MeCN и 30 мл ДХМ обрабатывали 4 метилбензиловым спиртом (2,4 г, 19,6 ммоль), затем DMAP (1,20 г, 9,82 ммоль). Полученную мутную реакционную смесь осветляли в течение 2 мин, перемешивали в течение ночи при комнатной температуре, затем вливали в 100 мл воды и распределяли. Органический слой сушили над безводным сульфатом натрия и выпаривали растворитель. Полученное таким образом твердое вещество перемешивали с приблизительно 25 мл эфира, фильтровали, промывали небольшим объемом эфира и сушили с получением 4-метилбензилового эфира 2,5-диоксопирролидин-1-илового эфира угольной кислоты в виде белого твердого вещества. Ссылка: Chem. Pharm. Bull., 38(1): 110-115 (1990). Следующие соединения были получены способом, сходным с описанным выше для промежуточного продукта 1 а. Промежуточный продукт 1b. 4-Хлорбензиловый эфир 2,5-диоксопирролидин-1-илового эфира угольной кислоты. Промежуточный продукт 1 с. 4-Фторбензиловый эфир 2,5-диоксопирролидин-1-илового эфира угольной кислоты. Промежуточный продукт 1d. 4-Этилбензиловый эфир 2,5-диоксопирролидин-1-илового эфира угольной кислоты. Промежуточный продукт 1 е. 4-Изопропилбензиловый эфир 2,5-диоксопирролидин-1-илового эфира угольной кислоты. Используя производные угольной кислоты, описанные выше для промежуточных продуктов 1 а-1 е,и в соответствие с методикой, описанной на стадии 1 примера 13, получали следующие промежуточные продукты 2 а-2 е.(801 мг, 4,18 ммоль) и HOAt (569 мг, 4,18 ммоль) и выдерживали в атмосфере азота в течение 4 ч. Реакционную смесь распределяли между насыщенным раствором NаНСО 3 и этилацетатом. Слои разделяли и дважды экстрагировали водный слой этилацетатом. Объединенные органические компоненты промывали водой и насыщенным солевым раствором, затем сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, с получением 1,16 г бензил-4-[(4-пиридиниламино)карбонил]-1-пиперидинкарбоксилата в виде желтого масла, которое использовали без дальнейшей очистки. Стадия 2. Бензил-4-[(4-пиридиниламино)метил]-1-пиперидинкарбоксилат. Амид (17,82 г, 52,50 ммоль), полученный как описано выше на стадии 1, растворяли в ТГФ (50 мл),обрабатывали ВН 3-ТГФ (200 ммоль, 200 мл, 1 М в ТГФ) в течение 10 мин и выдерживали при комнатной температуре в течение 3 ч. Реакционную смесь гасили медленным добавлением 2 н. НСl и интенсивно перемешивали в течение 15 ч. Реакционную смесь подщелачивали добавлением 1 М NaOH и трижды экстрагировали этилацетатом. Объединенные органические компоненты промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением белой пены,которую очищали методом хроматографии на силикагеле (элюируя CH2 Сl2/СН 3 ОН/NН 4OН от 99/1/0,1 до 90/10/1) с получением 11,53 г бензил-4-[(4-пиридиниламино)метил]-1-пиперидинкарбоксилата в виде вязкого бледно-желтого масла. 1 Н ЯМР (НСl соль 400 МГц, CD3OD):8,09 (ушир.с, 1 Н, Pyr-H), 7,97 (ушир.с, 1 Н, Pyr-H), 7,35-7,28 Указанное в заголовке соединение получали, как описано на стадии 1 примера 1, но заменяя 4 аминопиридин 2-аминоимидазолгемисульфатом и получая связывающийся с EDC продукт. Данный продукт нагревали с обратным холодильником в ДМФ-DMA в течение 90 мин, разбавляли этилацетатом,промывали насыщенным раствором NaHCO3, сушили над Na2SO4, фильтровали и затем концентрировали при пониженном давлении. Полученное красное масло очищали методом хроматографии на силикагеле. Проводили взаимодействие 50 мг (ммоль) очищенного продукта с бораном, как описано на стадии 2 примера 1, с получением 26 мг бензил-4-[(1-метил-1 Н-имидазол-2-ил)амино]метил-1-пиперидинкарбоксилата. 1 Бензил-4-[(4-пиридиниламино)карбонил]-1-пиперидинкарбоксилат (пример 1, стадия 1) (615 мг,1,81 ммоль) растворяли в CH2Cl2, обрабатывали mСРВА (3,12 г, 18,10 ммоль) и выдерживали в течение 18 ч. Реакционную смесь разбавляли этилацетатом и промывали насыщенным раствором NaHCO3. Органические компоненты разделяли, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученное масло очищали методом хроматографии на силикагеле с получением бензил-4[(1-оксидо-4-пиридинил)амино]карбонил-1-пиперидинкарбоксилата в виде прозрачного масла. 1 Бензил-4-[(1-оксидо-4-пиридинил)амино]карбонил-1-пиперидинкарбоксилат (62 мг, 0,17 ммоль) восстанавливали бораном, как описано на стадии 2 примера 1, с получением бензил-4-[(1-оксидо-4 пиридинил)амино]метил-1-пиперидинкарбоксилата в виде прозрачного масла. 1 4-Аминометилпиперидин (40 т, 350 ммоль) и бензальдегид (37,3 мл, 368 ммоль) в толуоле (600 мл) нагревали с обратным холодильником в условиях Дина-Старка в течение 2 ч. Полученную реакционную смесь охлаждали до комнатной температуры и добавляли 500 мл дихлорметана. Полученный раствор охлаждали до 5 С и обрабатывали N-(бензилоксикарбонилокси)сукцинимидом (91,7 г, 368 ммоль). Через 10 мин удаляли охлаждающую баню и перемешивали полученную реакционную смесь в течение 1 ч. Растворители выпаривали и перемешивали остаток с 400 мл ТГФ и 400 мл 2 М НСl в течение 1 ч. Для удаления органических компонентов смесь концентрировали и экстрагировали эфиром (3 х 300 мл). Водную фазу доводили до рН 14 добавлением 50% NaOH и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и выпаривали растворитель с получением бензил-4-(аминометил)пиперидин-1-карбоксилата в виде масла. 1- 23005974 Бензил-4-(аминометил)-1-пиперидинкарбоксилат (1,20 г, 4,83 ммоль) и 6-хлорпурин (448 мг, 2,49 ммоль) объединяли в ДМФ (5 мл), обрабатывали единой порцией TEA и выдерживали в атмосфере азота при 100 С в течение 18 ч. Полученную реакционную смесь разбавляли насыщенным раствором NaHCO3 и трижды экстрагировали этилацетатом. Объединенные органические компоненты промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением коричневого масла, которое очищали методом хроматографии на силикагеле (20 г, силикагель 32-60 мкм,элюируя CH2Cl2/CH3OH/NH4OH от 99/1/0,1 до 90/10/1) с получением бензил-4-[(9 Н-пурин-6-иламино) метил]-1-пиперидинкарбоксилата в виде коричневого масла. 1 4-Метилбензиловый эфир 4-[(2-метилсульфанилпиримидин-4-иламино)метил]пиперидин-1-карбоновой кислоты получали, как описано на стадии 2 примера 13, но заменяя 6-хлорпурин 4-хлор-2 метилтиопиримидином и заменяя бензил-4-(аминометил)-1-пиперидинкарбоксилат 4-метилбензил-4(аминометил)-1-пиперидинкарбоксилатом. МС (М+1): 387. Стадия 2. 4-Метилбензил-4-[(4-пиримидиниламино)метил]-1-пиперидинкарбоксилат. 4-Метилбензиловый эфир 4-[(2-метилсульфанилпиримидин-4-иламино)метил]пиперидин-1-карбоновой кислоты (550 мг, 1,42 ммоль) растворяли в EtOH (15 мл) и обрабатывали никелем Ренея (834 мг,14,20 ммоль) при комнатной температуре в течение 3 ч, фильтровали, концентрировали и очищали методом хроматографии на силикагеле с получением соединения примера 14 в виде желтого масла. 1 Указанное в заголовке соединение получали, как описано в примере 13, за исключением того, что в качестве исходных материалов использовали бензил-4-(аминометил)-1-пиперидинкарбоксилат (6,50 г,26,19 ммоль) и 2-хлорпиримидин (990 мг, 8,64 ммоль) без растворителя, с получением указанного в заголовке соединения в виде желтого масла. Указанное в заголовке соединение получали, как описано в примере 13, за исключением того, что в качестве исходных материалов использовали 4-метилбензил-4-(аминометил)-1-пиперидинкарбоксилат Указанное в заголовке соединение получали, как описано в примере 13, за исключением того, что в качестве исходных материалов использовали бензил-4-(аминометил)-1-пиперидинкарбоксилат (298 мг,1,20 ммоль) и 2-хлор-5-метилпиримидин (пример 144, стадия 1) (51 мг, 0,40 ммоль) без растворителя, с получением указанного в заголовке соединения в виде желтого масла. 1 Указанное в заголовке соединение получали, как описано в примере 13, за исключением того, что в качестве исходных материалов использовали 4-метилбензил-4-(аминометил)-1-пиперидинкарбоксилат Указанное в заголовке соединение получали, как описано в примере 13, за исключением того, что в качестве исходных материалов использовали 4,6-дихлорпиримидин (1,26 г, 8,45 ммоль) вместо 6 хлорпурина и добавляли TEA (2,80 мл, 20,13 ммоль) в 10 мл ДМФ. В результате получали указанное в заголовке соединение в виде желтого масла. 1 Указанное в заголовке соединение получали, как описано в примере 13, за исключением того, что в качестве исходных материалов использовали бензил-4-(аминометил)-1-пиперидинкарбоксилат (300 мг,1,21 ммоль) и 4-амино-6-хлорпурин (68 мг, 0,40 ммоль). В результате получали указанное в заголовке соединение в виде желтого масла. 1 Указанное в заголовке соединение получали, как описано в примере 13, за исключением того, что в качестве исходных материалов использовали бензил-4-(аминометил)-1-пиперидинкарбоксилат (1,08 г,4,34 ммоль) и 3,6-дихлорпиридиазин (636 мг, 4,34 ммоль), с получением указанного в заголовке соединения в виде желтого масла. 1 Бензил-4-[(6-хлор-3-пиридазинил)амино]метил-1-пиперидинкарбоксилат (пример 22) (400 мг,1,11 ммоль) растворяли в абсолютном этаноле. Затем добавляли никель Ренея (65 мг, 1,11 ммоль) и перемешивали полученную реакционную смесь в атмосфере водорода (1 атм) в течение 18 ч. Катализатор фильтровали и концентрировали фильтрат при пониженном давлении. Полученное прозрачное масло очищали методом хроматографии на силикагеле с получением указанного в заголовке соединения в виде прозрачного масла. 1 Бензил-4-[(6-хлор-3-пиридазинил)амино]метил-1-пиперидинкарбоксилат (пример 22) (37 мг, 0,10 ммоль) растворяли в уксусной кислоте (5 мл) с ацетатом натрия (82 мг, 1,00 ммоль) и нагревали до 100 С в течение 18 ч. Летучие компоненты удаляли при пониженном давлении и распределяли остаток между насыщенным раствором NаНСО 3 и этилацетатом. Органические компоненты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде прозрачного масла. 1(100 мг, 0,40 ммоль) и аминопиразин (46 мг, 0,48 ммоль) растворяли в толуоле в атмосфере азота и нагревали с обратным холодильником в условиях Дина-Старка в течение 18 ч. Летучие компоненты удаляли в вакууме, остаток растворяли в этаноле и обрабатывали небольшими порциями твердого NaBH4 (76 мг, 2,00 ммоль). Реакционную смесь выдерживали при 20 С в течение 1 ч, а затем тушили добавлением 2 н. НСl. Реакционную смесь подщелачивали добавлением 1 М NaOH и дважды экстрагировали этилацетатом. Объединенные органические компоненты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток очищали методом ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде желтого масла. 1 Указанное в заголовке соединение получали, как описано в примере 25, за исключением того, что в качестве исходных материалов использовали бензил-4-формил-1-пиперидинкарбоксилат (300 мг, 1,21 ммоль) и 2-амино-1,3-тиазол (133 мг, 1,33 ммоль) с получением указанного в заголовке соединения в виде желтого масла. 1 Бензил-4-[(3-метил-2-пиридинил)амино]карбонил-1-пиперидинкарбоксилат получали, как описано в примере 1, за исключением того, что в качестве исходных материалов использовали 1-[(бензилокси) карбонил]-4-пиперидинкарбоновую кислоту (5,00 г, 18,99 ммоль), 2-амино-3-метилпиридин (2,16 г, 19,94 ммоль), EDC (4,37 г, 22,79 ммоль), HOAt (2,71 г, 19,94 ммоль) и ДМФ (3 мл). Бензил-4-[(3-метил-2 пиридинил)амино]карбонил-1-пиперидинкарбоксилат выделяли в виде не совсем белого твердого вещества и использовали без дальнейшей очистки. Стадия 2. (3-Метилпиридин-2-ил)амид пиперидин-4-карбоновой кислоты. Бензил-4-[(3-метил-2-пиридинил)амино]карбонил-1-пиперидинкарбоксилат (5,45 г, 15,42 ммоль),описанный выше на стадии 1, суспендировали в абсолютном этаноле (250 мл) и обрабатывали 10%-ным палладием на угле (1,50 г) и интенсивно перемешивали в течение 18 ч в атмосфере водорода (1 атм). Катализатор отфильтровывали и концентрировали фильтрат при пониженном давлении с получением (3 метилпиридин-2-ил)амида пиперидин-4-карбоновой кислоты в виде желтого масла.(3-Метилпиридин-2-ил)амид пиперидин-4-карбоновой кислоты (100 мг, 0,46 ммоль), описанный выше на стадии 2, и N-[4-(метилбензилокси)карбонилокси]сукцинимид (127 мг, 0,48 ммоль) объединяли в ДМФ при комнатной температуре и интенсивно перемешивали в течение 15 мин. Затем полученную реакционную смесь очищали методом препаративной ВЭЖХ с обращенной фазой с получением 4 метилбензилового эфира 4-(3-метилпиридин-2-илкарбамоил)пиперидин-1-карбоновой кислоты в виде прозрачного масла. Стадия 4. 4-Метилбензиловый эфир 4-[(3-метилпиридин-2-иламино)метил]пиперидин-1-карбоновой кислоты.(65 мг, 0,18 ммоль), описанный выше на стадии 3, обрабатывали 1 М ВН 3-ТГФ (1,80 ммоль, 1,80 мл, 1 М в ТГФ) в течение 10 мин и выдерживали при комнатной температуре в течение 4 ч. Реакционную смесь гасили медленным добавлением 2 н. НСl и интенсивно перемешивали в течение 30 мин. Реакционную смесь подщелачивали добавлением насыщенного раствора NaHCO3 и дважды экстрагировали этилацетатом. Объединенные органические компоненты промывали насыщенным солевым раствором, сушили надNa2SO4, фильтровали и концентрировали в вакууме с получением белой пены, которую очищали методом хроматографии на силикагеле (элюируя CH2Cl2/CH3OH/NH4OH от 99/10/1 до 95/5/0,5) с получением соединения примера 27 в виде желтого масла. 1 Соединение пиперидина (600 мг, 2,74 ммоль), описанное на стадии 2 примера 27, обрабатывали в соответствии со стадиями 3 и 4 примера 27, за исключением того, что на стадии 3 вместо N-[4(метилбензилокси)карбонилокси]сукцинимида использовали N-[4-(фторбензилокси)карбонилокси]сукцинимид (805 мг, 3,01 ммоль) с получением 4-фторбензил-4-[(3-метил-2-пиридинил)амино]метил-1 пиперидинкарбоксилата в виде прозрачного масла. 1 Соединение пиперидина (600 мг, 2,74 ммоль), описанное на стадии 2 примера 21, обрабатывали в соответствии со стадиями 3 и 4 примера 27, за исключением того, что на стадии 3 вместо N-[4-(метилбензилокси) карбонилокси]сукцинимида использовали N-[4-(хлорбензилокси)карбонилокси]сукцинимид Бензил-4-[(4-пиридиниламино)метил]-1-пиперидинкарбоксилат (пример 1) (7 г, 21 ммоль) растворяли в абсолютном этаноле (150 мл) с 10%-ным палладием на угле (700 мг) и перемешивали в атмосфере водорода (1 атм) в течение 2 ч. Катализатор отфильтровывали и концентрировали фильтрат при пониженном давлении с получением N-(4-пиперидинилметил)-4-пиридинамина в виде прозрачного масла,которое использовали без дальнейшей очистки. Стадия 2. 3-Фторбензил-4-[(4-пиридиниламино)метил]-1-пиперидинкарбоксилат. 3-Фторбензиловый спирт (30 мг, 0,24 ммоль) обрабатывали трифосгеном (24 мг, 0,08 ммоль) и N-(4 пиперидинилметил)-4-пиридинамином (50 мг, 0,26 ммоль) и выдерживали при 40 С в течение 45 мин. Полученную реакционную смесь распределяли между 0,5 М NaOH и этилацетатом. Органические компоненты разделяли, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученное масло очищали методом препаративной ВЭЖХ с получением ТФУ-соли соединения примера 30 в виде желтого масла. МС (М+1): 344,36. Соединения следующих примеров 32-36 получали, как описано выше для соединения примера 30,но заменяя 3-фторбензиловый спирт соответственным спиртом. Пример 31. 2-Метилбензил-4-[(4-пиридиниламино)метил]-1-пиперидинкарбоксилат. Бензил-4-[(2-пиримидиниламино)метил]-1-пиперидинкарбоксилат (пример 16) гидрировали, как описано на стадии 1 примера 30. Обрабатывали N-[4-(фторбензилокси)карбонилокси]сукцинимидом, как описано на стадии 3 примера 27, с получением 4-фторбензил-4-[(2-пиримидиниламино)метил]-1 пиперидинкарбоксилата. 1 Боргидрид натрия (40 г) добавляли порциями к перемешиваемому раствору этил-N-бензил-3 оксопиперидин-4-карбоксилатгидрохлорида (23,6 г, 90 ммоль) в метаноле (500 мл) в течение 2 ч. Медленно добавляли воду (300 мл), перемешивали смесь в течение 15 мин и затем выпаривали органические компоненты. Остаток трижды распределяли между ДХМ и водой, объединенные органические слои сушили над безводным сульфатом натрия и выпаривали растворитель с получением 1-бензил-4 гидроксиметилпиперидин-3-ола в виде смеси цис/транс-изомеров, которую использовали на следующей стадии без дальнейшей очистки. МС (М+1): 222. Стадия 2. Бензиловый эфир 3-гидрокси-4-гидроксиметилпиперидин-1-карбоновой кислоты. Раствор 1-бензил-4-гидроксиметилпиперидин-3-ола (13,5 г), описанного выше на стадии 1, в метаноле (450 мл) гидрировали при давлении (50 psi) над 20%-ным гидроксидом палладия на угле (10 г) в течение 48 ч тремя порциями. Объединенные реакционные смеси фильтровали и упаривали фильтрат с получением масла. Масло растворяли в воде (100 мл) и диоксане (100 мл), охлаждали до 5 С и медленно добавляли бензилхлороформат (7,8 мл) с добавлением 1 М NaOH для поддержания рН 10-11. Через 30 мин удаляли охлаждающую баню и перемешивали реакционную смесь в течение 30 мин. Реакционную смесь концентрировали для удаления диоксана и трижды экстрагировали остаток EtOAc. Объединенные экстракты промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и выпаривали растворитель с получением смеси цис/транс-изомеров бензилового эфира 3-гидрокси- 30
МПК / Метки
МПК: A61K 31/444, A61P 29/02, C07D 401/12
Метки: антагонисты, неарильные, гетероциклические, n-замещенные
Код ссылки
<a href="https://eas.patents.su/30-5974-n-zameshhennye-nearilnye-geterociklicheskie-antagonisty-nmda-nr2b.html" rel="bookmark" title="База патентов Евразийского Союза">N-замещенные неарильные гетероциклические антагонисты nmda/nr2b</a>
Предыдущий патент: Применение sarp-1 для лечения и/или предупреждения склеродермии
Следующий патент: Соединения пиперазинилпиразинов в качестве антагонистов серотонин 5-ht2 рецептора
Случайный патент: Железнодорожный полувагон с укрытием и способ укрытия сыпучего груза для перевозки в железнодорожном полувагоне












