Новые производные пиперазинона для лечения нарушений, связанных с 5-нт2а-рецептором
Номер патента: 7539
Опубликовано: 27.10.2006
Авторы: Тор Маркус, Сернеруд Магнус, Нильссон Бьерн, Лундстрем Хелена
Формула / Реферат
1. Соединение общей формулы (I)
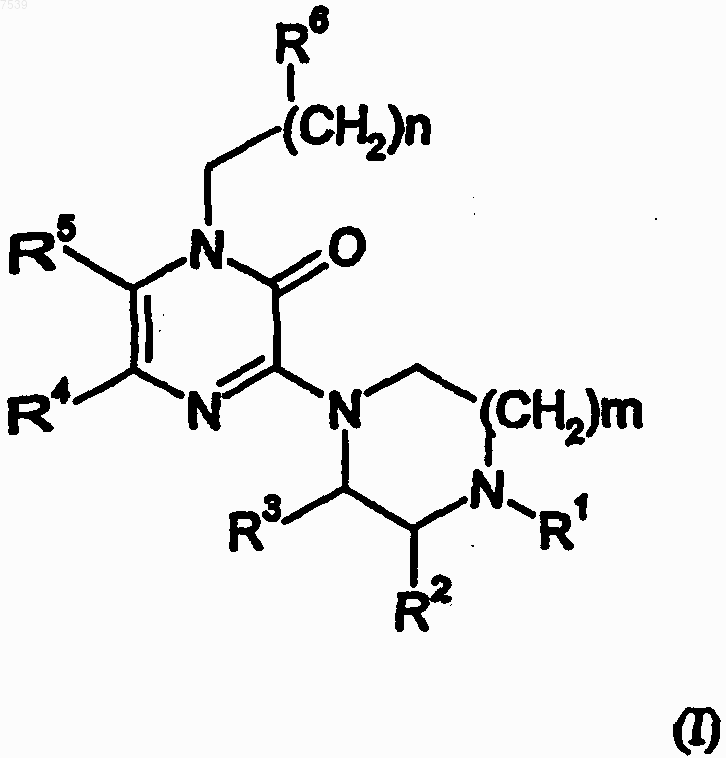
где
m равно 1 или 2;
n равно 0, 1, 2, 3 или 4;
R1 означает Н или C1-6-алкил, арил-С1-С3-алкил, гетероарил-С1-С3-алкил, 2-гидроксиэтил, метокси-С2-С4-алкил, С1-С4-алкоксикарбонил, арилокси-С2-С3-алкил или гетероарилокси-С2-С3-алкил; где
любой арильный или гетероарильный остаток может быть замещен группой С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, галоген, трифторметил, трифторметокси или циано;
каждый из R2 и R3 независимо означает Н или СН3;
каждый из R4 и R5 независимо означает Н, галоген, метил, либо указанные заместители образуют вместе с кольцом, к атомам углерода которого присоединены, ядро 1Н-хиноксалин-2-она; и
R6 означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH, гетероарил-NH, арил, арилкарбонил, гетероарил или гетероарилкарбонил; где
любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, может быть незамещен или замещен одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из группы, включающей арил, арил-С1-2-алкил, арилкарбонил, гетероарил, гетероарил-С1-2-алкил, гетероарилкарбонил, арилокси, гетероарилокси, арилтио, гетероарилтио, ариламино, гетероариламино, С3-6-циклоалкил, С3-6-циклоалкилокси, С3-6-циклоалкилкарбонил, C1-6-алкил, С2-6-алканоил, С2-6-алкинил, С2-6-алкенил или фтор-С2-4-алкилокси, галоген, трифторметил, нитро, циано, трифторметокси, трифторметилтио, C1-С6-алкокси, C1-С6-алкилтио, C1-С6-алкиламино, C1-4-диалкиламино, гидрокси или оксо; где
любой арильный или гетероарильный остаток, в качестве заместителей на ариле или гетероариле, в отдельности или как часть другой группы, в свою очередь, может быть замещен по одному или более положениям, независимым друг от друга, группой, выбранной из группы, включающей C1-4-алкил, C1-4-алкокси, C1-4-алкилтио, галоген, трифторметил, трифторметокси или циано;
и их фармацевтически приемлемые соли, гидраты, геометрические изомеры, таутомеры, оптические изомеры, N-оксиды и пролекарственные формы, при условии, что
R2 и R3 оба одновременно не означают СН3;
когда R1, R2, R4 и R5 означают Н и R3 означает Н или СН3, то R6 не означает 3-пиридилокси, 6-метил-2-нитро-3-пиридилокси или 2-хлор-3-пиридилокси;
когда n=0, то R6 не означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH или гетероарил-NH; и
соединение формулы (I) не означает 1-бензил-3-(4-метилпиперазин-1-ил)-1H-хиноксалин-2-он, где
арил представляет собой ароматические моно- или бициклические циклы с 6-10 атомами углерода в цикле;
гетероарил представляет собой моно- или бициклическую систему ароматических циклов, где только один цикл должен быть ароматическим и указанная гетероарильная составляющая может быть связана с остатком молекулы посредством атома углерода или азота в любом цикле, содержащую от 5 до 10 атомов в моно- или бициклическом цикле, из которых один или более атомов цикла являются отличными от углерода, такими как азот, сера, кислород и селен.
2. Соединение по п.1, где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, замещен одним или двумя негалогеновыми заместителями.
3. Соединение по п.1, где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, замещен по меньшей мере одним галогеновым заместителем.
4. Соединение по п.1, где любой арильный или гетероарильный остаток, замещенный другим арилом или гетероарилом, рассматриваемый в отдельности или как часть другой группы, в свою очередь, замещен по одному положению.
5. Соединение по п.1, где
n=1;
каждый из R1, R2, R3, R4 и R5 означает Н и
R6 означает фенокси, где фенильный цикл указанной феноксигруппы может быть незамещенным или замещен одним, двумя, тремя, четырьмя или пятью заместителями.
6. Соединение по п.5, где фенильный цикл заместителя R6 замещен одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из группы, включающей
галоген,
2-пропенил,
C1-С6-алкил,
C1-С6-алкокси,
трифторметил,
фенил,
фенокси,
бензоил и
С3-6-циклоалкил;
где фенильный, фенокси или бензоильный заместитель, в свою очередь, может быть замещен по одному или более положениям, независимым друг от друга, заместителем, выбранным из группы, включающей C1-4-алкил, C1-4-алкокси, C1-4-алкилтио, галоген, трифторметил, трифторметокси или циано.
7. Соединение по п.6, где фенильный цикл заместителя R6 замещен одним или двумя негалогеновыми заместителями.
8. Соединение по п.6, где галогеновый заместитель означает фтор.
9. Соединение по п.1, где
n=1;
R1 означает метокси-С2-С4-алкил или линейный С1-С4-алкил;
каждый из R2, R3, R4 и R5 означает Н и
R6 означает 2,4,5-трифторфенокси.
10. Соединение по п.1, где
n=1;
каждый из R1, R2, R3, R4 и R5 означает Н и
R6 означает 2-оксо-1,3-бензоксатиол-5-илокси.
11. Соединение по п.1, где
n=0;
каждый из R1, R2, R3, R4 и R5 означает Н и
R6 означает фенил, где указанный фенил может быть замещен галогеном по одному, двум, трем, четырем или пяти положениям.
12. Соединение по п.11, где галоген означает фтор.
13. Соединение по одному из пп.1-12, которое выбрано из группы, включающей
1-[2-(2-фтор-4-нитрофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-{2-[(2-оксо-2H-хромен-7-ил)окси]этил}-3-(1-пиперазинил)-2(1H)-пиразинон,
3-(1-пиперазинил)-1-[2-(2,4,5-трифторфенокси)этил]-2(1H)-пиразинон,
3-(1-пиперазинил)-1-[2-(2,3,5,6-тетрафторфенокси)этил]-2(1H)-пиразинон,
1-[2-(2,3,4,5,6-пентафторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(4-хлор-2-фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(3-цианофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(4-циклопентилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(1,2-бензизоксазол-3-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(3-метоксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(3-н-бутилоксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-([1,1'-бифенил]-3-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
3-(1-пиперазинил)-1-[2-(2,3,4-трифторфенокси)этил]-2(1H)-пиразинон,
1-[2-(2,3-дихлорфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(1,3-бензодиоксол-5-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(2,4-дифторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-{2-[(2-оксо-1,3-бензоксатиол-5-ил)окси]этил}-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(3-гидроксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
3-(1-пиперазинил)-1-[2-(6-хиноксалинилокси)этил]-2(1H)-пиразинон,
1-{2-[3-(N,N-диметиламино)фенокси]этил}-3-(1-пиперазинил)пиразин-2(1H)-он,
3-(1-пиперазинил)-1-{2-[3-(трифторметил)фенокси]этил}-2(1H)-пиразинон,
1-[2-(3-фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(3-нитрофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(3-бензоилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(3,5-дифторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(фенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(2,6-дифторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(2-цианофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(4-трифторметилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(4-бромфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-{4-фенокси(фенокси)}этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(4-фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(4-изопропилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(2,4,5-трихлорфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(2-метилтиофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(3-метоксифенилтио)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-{(4-аллил-2-метокси)фенокси}этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(5,6,7,8-тетрагидронафталин-2-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(2,6-дифторфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон,
1-[2-(4-трифторметилфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон,
1-[2-(4-бромфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон,
1-[2-(фенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон,
1-[2-(2,4,5-трифторфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон,
1-[2-(2,4,5-трифторфенокси)этил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон,
1-[2-(4-фторфенокси)этил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон,
1-[2-(4-изопропилфенокси)этил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон,
1-[2-(2-метилтиофенокси)этил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон,
1-(2,4,5-трифторбензил)-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[3-(2,4,5-трифторфенил)пропил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(1-пиперазинил)-2(1H)-пиразинон,
3-пиперазин-1-ил-1-[2-(2,4,5-трифторфенокси)этил]-1H-хиноксалин-2-он,
1-[2-(2,4,5-трифторфенокси)этил]-3-(4-н-бутил-1-пиперазинил)-2(1H)-пиразинон,
1-[2-(2,4,5-трифторфенокси)этил]-3-[4-(2-метоксиэтил)-1-пиперазинил]-2(1H)-пиразинон,
1-[2-(2,4,5-трифторфенокси)этил]-3-(4-метил-1-пиперазинил)-2(1H)-пиразинон,
1-[2-(2,4,5-трифторфенокси)этил]-3-(4-изопропил-1-пиперазинил)-2(1H)-пиразинон,
1-{2-[(5-метил[1,2,4]триазоло[1,5-а]пиримидин-7-ил)окси]этил}-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[2-(4-цианофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[4-(2,4,5-трифторфенокси)бутил]-3-(1-пиперазинил)-2(1H)-пиразинон,
1-[3-(2,4,5-трифторфенокси)пропил]-3-(1-пиперазинил)-2(1H)-пиразинон,
3-[4-(1-фенилэтил)пиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он,
3-[4-(2-феноксиэтил)пиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он,
3-[4-(2-фенилэтил)пиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он, гидрохлорид,
3-(4-бензилпиперазин-1-ил)-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он, гидрохлорид,
3-[(2R)-2-метилпиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он,
3-пиперазин-1-ил-1-[2-(3-тиенил)этил]пиразин-2(1H)-он,
3-пиперазин-1-ил-1-[2-(2-тиенил)этил]пиразин-2(1H)-он,
1-[2-(1H-индол-3-ил)этил]-3-пиперазин-1-илпиразин-2(1H)-он,
1-[2-(2,3-дигидро-1,4-бензодиоксин-5-илокси)этил]-3-пиперазин-1-илпиразин-2(1H)-он,
1-[2-(фенилтио)этил]-3-пиперазин-1-илпиразин-2(1H)-он,
1-(3-оксо-3-фенилпропил)-3-пиперазин-1-илпиразин-2(1H)-он и
1-[3-(4-фторфенил)-3-оксопропил]-3-пиперазин-1-илпиразин-2(1H)-он
и их фармакологически приемлемые соли и сольваты.
14. Фармацевтическая композиция для профилактики или лечения зависимого от рецептора 5-НТ2А нарушения, включающая в качестве активного ингредиента соединение по любому из пп.1-13 вместе с фармацевтически приемлемым носителем.
15. Способ профилактики или лечения зависимого от рецептора 5-НТ2А нарушения или заболевания, включающий введение нуждающемуся в таком вмешательстве пациенту терапевтически эффективного количества соединения по любому из пп.1-13.
16. Способ по п.15, где нарушение или заболевание выбрано из такого, как стенокардия; феномен Рейно; перемежающаяся хромота; коронарный или периферический вазоспазмы; гипертензия; фибромиалгия; тромботическое осложнение, включая внезапный приступ; расстройства памяти, такие как болезнь Альцгеймера; шизофрения; обсессивно-компульсивное нарушение; приступы дурного настроения; аутизм; тревожное расстройство; депрессивные расстройства, включая депрессию с сопутствующим диабетом; расстройства половой функции; нарушения сна, такие как бессонница и временная остановка дыхания во время сна; боль; наркотическая зависимость; экстрапирамидальные симптомы, например, вызванные нейролептической лекарственной терапией, использующей лекарственные средства, такие как, например, галоперидол и хлорпромазин; болезнь Паркинсона; глаукома, включая глаукому при нормальном давлении; недержание мочи при напряжении, включая недержание мочи при напряжении с сопутствующим диабетом; менопаузальные и постменопаузальные приливы; нарушения бронхоконстрикции, такие как астма и хроническое обструктивное заболевание легких; нарушения приема пищи, такие как нарушения приема пищи по причине пьянства, нервная анорексия и булимия; диабетические осложнения, такие как нефропатия, невропатия и ретинопатия.
17. Применение соединения по любому из пп.1-13 при получении лекарственного средства для профилактики или лечения зависимого от рецептора 5-НТ2А нарушения или заболевания.
18. Применение по п.17, где нарушение или заболевание выбрано из такого, как стенокардия; феномен Рейно; перемежающаяся хромота; коронарный или периферический вазоспазмы; гипертензия; фибромиалгия; тромботическое осложнение, включая внезапный приступ; расстройства памяти, такие как болезнь Альцгеймера; шизофрения; обсессивно-компульсивное нарушение; приступы дурного настроения; аутизм; тревожное расстройство; депрессивные расстройства, включая депрессию с сопутствующим диабетом; расстройства половой функции; нарушения сна, такие как бессонница и временная остановка дыхания во время сна; боль; наркотическая зависимость; экстрапирамидальные симптомы, например, вызванные нейролептической лекарственной терапией, использующей лекарственные средства, такие как, например, галоперидол и хлорпромазин; болезнь Паркинсона; глаукома, включая глаукому при нормальном давлении; недержание мочи при напряжении, включая недержание мочи при напряжении с сопутствующим диабетом; менопаузальные и постменопаузальные приливы; нарушения бронхоконстрикции, такие как астма и хроническое обструктивное заболевание легких; нарушения приема пищи, такие как нарушения приема пищи по причине пьянства, нервная анорексия и булимия; диабетические осложнения, такие как нефропатия, невропатия и ретинопатия.
19. Применение соединения по любому из пп.1-13 в качестве диагностического средства.
20. Способ диагностики зависимого от рецептора 5-НТ2A нарушения или заболевания, включающий введение испытуемому пациенту меченного радиоактивным изотопом соединения формулы (I).
21. Способ получения соединения формулы (I) по любому из пп.1-10 и 13,
где R6 выбран из группы, включающей арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH или гетероарил-NH,
путем взаимодействия соединения следующей формулы (II):
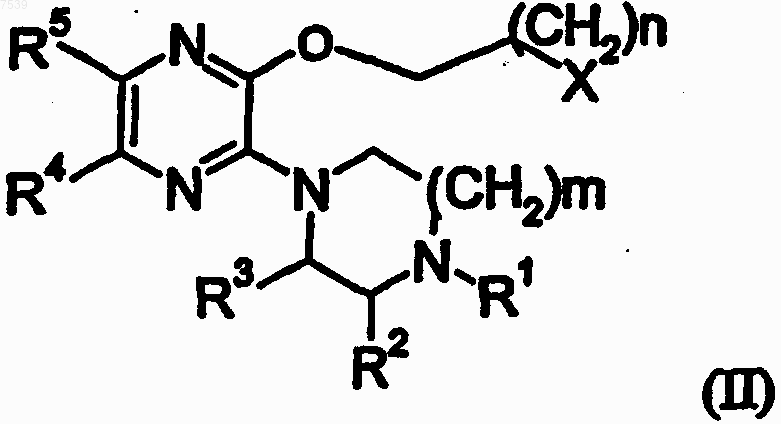
где
m равно 1 или 2;
n равно 1 или 2;
X означает ОН;
R1 означает Н или C1-6-алкил, арил-С1-С3-алкил, гетероарил-С1-С3-алкил, 2-гидроксиэтил, метокси-С2-С4-алкил, C1-С4-алкоксикарбоншы, арилокси-С2-С3-алкил или гетероарилокси-С2-С3-алкил; где
любой арильный или гетероарильный остаток может быть замещен группой С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, галоген, трифторметил, трифторметокси или циано;
каждый из R2 и R3 независимо означает Н или СН3; и
каждый из R4 и R5 независимо означает Н, галоген, метил, либо указанные заместители образуют вместе с кольцом, к атомам углерода которого присоединены, ядро 1Н-хиноксалин-2-она;
с необязательно замещенным фенолом или тиофенолом;
в растворителе арил представляет собой ароматические моно- или бициклические циклы с 6-10 атомами углерода в цикле;
гетероарил представляет собой моно- или бициклическую систему ароматических циклов, где только один цикл должен быть ароматическим и указанная гетероарильная составляющая может быть связана с остатком молекулы посредством атома углерода или азота в любом цикле, содержащую от 5 до 10 атомов в моно- или бициклическом цикле, из которых один или более атомов цикла являются отличными от углерода, такими как азот, сера, кислород и селен.
22. Способ по п.21 для получения соединений формулы (I), где R1 означает Н, где R1 в соответствующем промежуточном соединении формулы (II) означает подходящую защитную группу, выбранную из трет-бутоксикарбонила (t-BOC) или тритила.
23. Способ по любому из пп.21 и 22, где промежуточное соединение формулы (II) выбрано из группы, включающей
2-[3-(4-трет-бутоксикарбонил-3-метил-1-пиперазинил)пиразинилокси]этанол;
трет-бутил-(3R)-4-[3-(2-гидроксиэтокси)пиразин-2-ил]-3-метилпиперазин-1-карбоксилат и
трет-бутил-4-[3-(2-гидроксиэтокси)пиразин-2-ил]-1,4-диазепан-1-карбоксилат.
24. Способ получения соединения формулы (I) по любому из пп.1-13,
где R6 выбран из группы, включающей арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH, гетероарил-NH, арил, арилкарбонил, гетероарил или гетероарилкарбонил, путем взаимодействия соединения следующей формулы (IV)
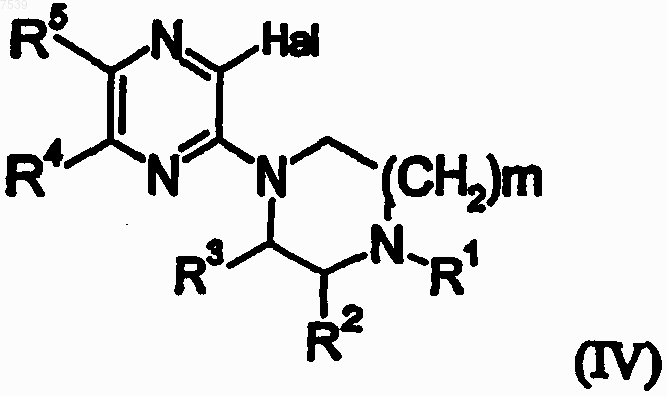
где
m равно 1 или 2;
Hal означает галоген;
R1 означает Н, C1-6-алкил, арил-С1-С3-алкил, гетероарил-C1-С3-алкил, 2-гидроксиэтил, метокси-С2-С4-алкил, C1-C4-алкоксикарбонил, арилокси-С2-С3-алкил или гетероарилокси-С2-С3-алкил; где
любой арильный или гетероарильный остаток может быть замещен группой С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, галоген, трифторметил, трифторметокси или циано;
каждый из R2 и R3, независимо, означает Н или СН3 и
каждый из R4 и R5, независимо, означает Н, галоген, метил,
либо указанные заместители образуют вместе с кольцом, к атомам углерода которого присоединены, ядро 1Н-хиноксалин-2-она;
с основной солью щелочного металла или щелочно-земельного металла, в водной среде, при 25-150шС, с получением соединения формулы (V)
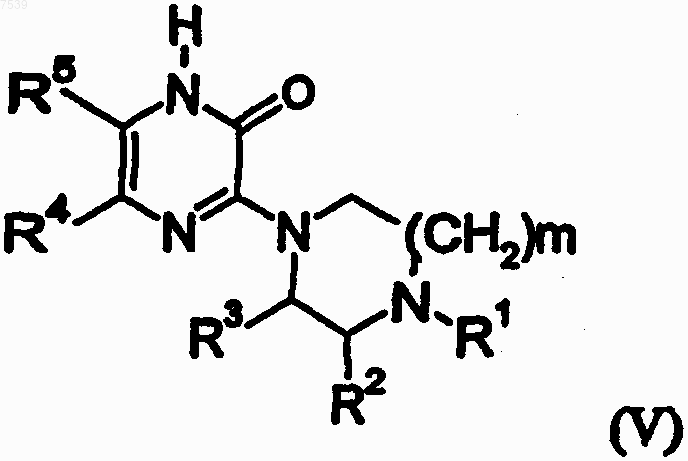
где
m, R1, R2, R3, R4 и R5 определены как для формулы IV, с последующим N-алкилированием соединения формулы (V) путем взаимодействия с соединением формулы (VI)
R6-CH2-(CH2)n-Y (VI),
где
n равно 0, 1, 2, 3 или 4;
Y означает удаляемую группу и
R6 означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH, гетероарил-NH, арил, арилкарбонил, гетероарил или гетероарилкарбонил и
где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, может быть незамещенным или замещен; когда он замещен, могут присутствовать один, два, три, четыре или пять заместителей, предпочтительно один или два для, случая негалогеновых заместителей, и заместители независимо выбраны из группы, включающей арил, арил-С1-2-алкил, арилкарбонил, гетероарил, гетероарил-С1-2-алкил, гетероарилкарбонил, арилокси, гетероарилокси, арилтио, гетероарилтио, ариламино, гетероариламино, С3-6-циклоалкил, С3-6-циклоалкилокси, С3-6-циклоалкилкарбонил, C1-6-алкил, С2-6-алканоил, С2-6-алкинил, С2-6-алкенил или фтор-С2-4-алкилокси, галоген, трифторметил, нитро, циано, трифторметокси, трифторметилтио, C1-С6-алкокси, C1-С6-алкилтио, C1-С6-алкиламино, C1-С4-диалкиламино, гидрокси или оксо;
где любой арильный или гетероарильный остаток, в качестве заместителей на ариле или гетероариле, в отдельности или как часть другой группы, в свою очередь, может быть замещен по одному или более положениям, независимым друг от друга, предпочтительно по одному, группой, выбранной из группы, включающей C1-4-алкил, C1-4-алкокси, C1-4-алкилтио, галоген, трифторметил, трифторметокси или циано;
в присутствии основания, в подходящем растворителе, при повышенной температуре арил представляет собой ароматические моно- или бициклические циклы с 6-10 атомами углерода в цикле;
гетероарил представляет собой моно- или бициклическую систему ароматических циклов, где только один цикл должен быть ароматическим и указанная гетероарильная составляющая может быть связана с остатком молекулы посредством атома углерода или азота в любом цикле, содержащую от 5 до 10 атомов в моно- или бициклическом цикле, из которых один или более атомов цикла являются отличными от углерода, такими как азот, сера, кислород и селен.
25. Способ по п.24 для получения соединений формулы (I), где R1 означает Н, где R1 в соответствующем промежуточном соединении формулы (V) означает подходящую защитную группу, выбранную из трет-бутоксикарбонила (t-BOC) или тритила.
Текст
007539 Родственные заявки По данной заявке испрашивается приоритет по патентной заявке Швеции номер 0202287-9, поданной июля 19, 2002, и заявке на предварительный патент США 60/426240, поданной ноября 14, 2002, содержания которых включены здесь в качестве ссылок. Область техники Настоящее изобретение касается новых соединений, фармацевтических композиций, содержащих указанные соединения, способов их получения, а также применения соединений при получении лекарственного средства. Уровень техники Многие нарушения и состояния центральной нервной системы находятся под влиянием серотонинергической нейромедиаторной системы. Например, серотонин (5-гидрокситриптамин; 5-НТ) вовлечен в ряд нарушений и состояний, возникающих в центральной нервной системе. Серотониновые рецепторы подразделяют на несколько основных классов 5-НТ 1-5-НТ 7. Кроме того, семейство 5-НТ 2 серотониновых рецепторов подразделяют на 5-НТ 2 А, 5-НТ 2B и 5-НТ 2C подтипы рецепторов. В качестве обзоров, касающихся классификации и функциональных характеристик серотониновых рецепторов, смотри, например,Hoyer, D. et al. Pharmacol. Rev. 1994, 46, 157-203; Saxena, P.R. Pharmacol. Ther. 1995, 66, 339-368; Barnes,N.M. et al. Neuropharmacol. 1999, 38, 1083-1152; Roth, B.L. et al. Pharmacol. Ther. 1998, 79, 231-257. Постулируется, что подтип рецептора 5-НТ 2 А, экспрессируемого в головном мозге человека, включая многие участки коры головного мозга, лимбические участки и участки переднего мозга, вовлечен в модуляцию повышенных когнитивных и аффективных функций. Подтип рецептора 5-НТ 2 А также экспрессируется на зрелых тромбоцитах, где опосредует, в частности, агрегацию тромбоцитов, одну из начальных стадий в развитии тромбоза сосудов. Некоторые факты убедительно свидетельствуют о вовлеченности подтипа рецептора 5-НТ 2A в этиологию таких заболеваний, как гипертензия, тромбоз, мигрень,вазоспазм, ишемия, депрессия, состояние тревоги, шизофрения, обсессивно-компульсивное нарушение,расстройства половой функции, нарушения сна и нарушения приема пищи, такие как нервная анорексия. Они также могут быть эффективны в снижении внутриглазного давления и быть полезны для лечения глаукомы (ср., Т. Mano et al. и Н. Takaneka et al., Invest. Ophthalmol. Vis Sci. 1995, 36, 719 и 734 соответственно). Показано, что соединение (+)(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанол (известное также как М-100907) является эффективным антагонистом рецепторов 5-НТ 2A человека, что описано в WO 91/18602. Кроме того, считается, что подтип рецептора 5-НТ 2 А вовлечен в урологические расстройства, такие как диабетическая нефропатия и недержание мочи при напряжении (диабетическая нефропатия, см. Ishimura, E. et al. Nephron 1997, 76, 227-229; недержание мочи при напряжении, включая сопутствующий диабет, см. Kodama, M. et al. Int. J. Urol 2000, 7, 231-235 и Ichiyanagi, N. et al. J. Urol. 2002, 168, 303-307). Соединения, оказывающие влияние на рецептор 5-HT2A, также обладают терапевтическими возможностями в отношении лечения нарушений, подобных указанным выше. Раскрытие содержания информации Описаны различные классы соединений, действующих на рецептор 5-НТ 2 А как антагонисты. Например, 4-арил- или 4-гетероарилпиперазины, такие как описаны в J. Med. Chem. 1991, 34, 2477, Chem.Pharm. Bull. 1987, 35, 1919, Bioorg. Med. Chem. Lett. 1997, 7, 1635-1638 и Arch. Pharm. 1995, 328, 659-666. Другие классы соединений, упоминаемых как действующие в качестве антагонистов 5-НТ 2 А, описаны вWO 0114332, WO 0004017, WO 0043362, WO 0107434, WО 0107435 и WO 0151469. Еще один класс антагонистов 5-НТ 2 А представлен производными N-аралкилпиперидинметанола, описанными в патенте США 5169096, включающими вышеупомянутый М-100907. Класс антагонистов 5-НТ 2 А, описанный в патенте США 5169096, заявлен как полезный для лечения различных болезненных состояний, таких как нервная анорексия, вариантная стенокардия, феномен Рейно, коронароспазмы, гипертензия, профилактического лечения мигрени, сердечно-сосудистых заболеваний, таких как гипертензия, заболевание периферических сосудов, тромботические осложнения, внезапные кардиопульмональные нарушения и аритмии,и обладает анестезирующими свойствами. Смотри также, патенты США 4877798 (фибромиалгия); патент США 4908369 (бессонница); патент США 5106855 (глаукома); патент США 6004980 (состояние тревоги, феномен Рейно, сердечная аритмия; экстрапирамидальные симптомы; злоупотребление лекарственными средствами, анорексия, фибромиалгия); ЕР 337136 (лечение экстрапирамидальных побочных эффектов, вызванных нейролептической терапией). В патенте США 513414 9 наряду с другими показаниями для психотического заболевания, такого как шизофрения и маниакальный синдром, описано применение М-100907. Употребление М-100907 для лечения различных неврологических нарушений развития, таких как аутизм и синдром дефицита внимания с гиперактивностью, описано в WO 99/56750. Употребление М-100907 и соответствующих пролекарств для лечения симптомов деменции,таких как болезнь Альцгеймера, описано в WO 01/89498. Употребление М-100907 для лечения обсессивно-компульсивных нарушений (OCD) описано в патенте США 5618824. Кетансерин, (3-[2-[4-(4-фторбензоил)-1-пиперидинил]этил]-2,4(1H,3 Н-хиназолиндион), является антагонистом 5-НТ 2A, пользующимся постоянным спросом для лечения гипертензии, и запатентованJanssen'oм в ЕР 13612 В. Употребление кетансерина для лечения глаукомы описано в ЕР 522226 (ср.,-1 007539(моно[2-(диметиламино)-1-2-[2-(3-метоксифенил)этил]фенокси]метил]этил]овый эфир бутандикарбоновой кислоты, MCI-9042; Anplag), Mitsubishi, Япония, является антагонистом 5 НТ 2 А, используемым для лечения тромбоэмболии в Японии, и описан в ЕР 72942 В. Употребление сарпогрелата для лечения глаукомы описано Mitsubishi в ЕР 695545 и Senju Pharmaceutical в СА 2144810. Сообщается также, что сарпогрелат терапевтически эффективен при лечении больных диабетом (ср.,Hotta, N. et al. Clin. Drug Invest. 1999, 18, 199-207; Kobori, S. et al. Int. Congr. Ser. 2000, 1209, 283-286). Антагонист 5-НТ 2A амперозид (4-(4,4-бис-(4-фторфенил)бутил)-N-этил-1-пиперазинкарбоксамид) описан как обладающий антипсихотическими свойствами и впервые запатентован Ferrosan, дочерней фирмой Pharmacia в патенте DE 02941880. Применение указанного средства для лечения от наркотической зависимости описано в ассоциированном патенте WO 09216211.Ajinomoto представляет собой разрабатываемый антагонист 5-НТ 2A и ингибитор агрегации тромбоцитов, АТ-1015 (N-[2-4-(5H-дибензо[a,d]циклогептен-5-илиден)пиперидиноэтил]-1-формил-4-пиперидинкарбоксамидмоногидрохлоридмоногидрат) для потенциального применения в лечении тромботических осложнений (ср., European Journal of Pharmacology 2001, 433(2-3), 157-162).Senju Pharmaceuticals описывает в США 5538974 ряд производных 1,5-бензоксатиепина (например,метил-7-метокси-3-оксо-3,4-дигидро-2H-1,5-бензоксатиепин-4-карбоксилат), которые заявлены как антагонисты серотонинового рецептора S2, полезные для лечения глаукомы.WO 00/64441 описывает, среди прочего, ряд известных антагонистов 5-НТ 2A (например, М-100907),употребляемых для терапии или профилактического лечения нарушений, вовлекающих в патологический процесс бронхоконстрикцию. Некоторые структурно схожие соединения с соединениями формулы (I) по настоящему изобретению описаны в J. Med. Chem. 1981, 24, 93-101 и в GB 1440722. Конкретными соединениями являются 3 пиперазин-1-ил-1H-хиноксалин-2-он, 1-метил-3-пиперазин-1-ил-1H-хиноксалин-2-он, 3-(4-метилпиперазин-1-ил)-1H-хиноксалин-2-он и 3-(1-пиперазинил)-1-[2-(диметиламино)этил]-2(1H)-хиноксалинон. 1 Бензил-3-(4-метилпиперазин-1-ил)-1H-хиноксалин-2-он описан в Chem. Pharm. Bull. 1993, 41, 1832-1841.WO 00/76984 описывает простые эфирные соединения пиразинила, связывающие рецептор 5-НТ 2C. Сущность изобретения Настоящее изобретение относится к новому классу антагонистов рецептора 5-НТ 2 А человека общей формулы (I)R1 означает Н или C1-6-алкил, арил-С 1-С 3-алкил, гетероарил-С 1-С 3-алкил, 2-гидроксиэтил, метоксиС 2-С 4-алкил, С 1-С 4-алкоксикарбонил, арилокси-С 2-С 3-алкил или гетероарилокси-С 2-С 3-алкил; где любой арильный или гетероарильный остаток может быть замещен группой С 1-С 4-алкил, С 1-С 4 алкокси, С 1-С 4-алкилтио, галоген, трифторметил, трифторметокси или циано; каждый из R2 и R3 независимо означает Н или СН 3; каждый из R4 и R5 независимо означает Н, галоген, метил, либо указанные заместители образуют вместе с кольцом, к атомам углерода которого присоединены, ядро 1 Н-хиноксалин-2-она; иR6 означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH, гетероарил-NH, арил,арилкарбонил, гетероарил или гетероарилкарбонил; где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, может быть незамещенным или замещенным. Когда он замещен, могут присутствовать один, два, три, четыре или пять заместителей, предпочтительно один или два для случая негалогеновых заместителей, и заместители независимо выбраны из группы, включающей арил, арил-С 1-2-алкил, арилкарбонил, гетероарил,гетероарил-С 1-2-алкил, гетероарилкарбонил, арилокси, гетероарилокси, арилтио, гетероарилтио, ариламино, гетероариламино, С 3-6-циклоалкил, С 3-6-циклоалкилокси, С 3-6-циклоалкилкарбонил, C1-6-алкил,С 2-6-алканоил, С 2-6-алкинил, С 2-6-алкенил или фтор-С 2-4-алкилокси, галоген, трифторметил, нитро, циано,трифторметокси, трифторметилтио, C1-С 6-алкокси, C1-C6-алкилтио, С 1-С 6-алкиламино, C1-4-диалкил-2 007539 амино, гидрокси или оксо; где любой арильный или гетероарильный остаток, в качестве заместителей на ариле или гетероариле, в отдельности или как часть другой группы, в свою очередь, может быть замещен по одному, двум, трем,четырем или пяти положениям, независимым друг от друга, предпочтительно по одному, группой, выбранной из группы, включающей C1-4-алкил, C1-4-алкокси, C1-4-алкилтио, галоген, трифторметил, трифторметокси или циано; и их фармацевтически приемлемые соли, гидраты, геометрические изомеры, таутомеры, оптические изомеры, N-оксиды и пролекарственные формы, при условии, чтоR2 и R3 оба одновременно не означают СН 3; когда R1, R2, R4 и R5 означают Н и R3 означает Н или СН 3, то R6 не означает 3-пиридилокси, 6 метил-2-нитро-3-пиридилокси или 2-хлор-3-пиридилокси; когда n=0, то R6 не означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH или гетероарил-NH; и соединение формулы (I) не означает 1-бензил-3-(4-метил-пиперазин-1-ил)-1H-хиноксалин-2-он. Соединения по настоящему изобретению можно рассматривать как структурные изомеры соединений, представленных формулой (Ib), где X1 означает О, описанных в WO 00/76984. В случае, когда соединения формулы (I) могут быть в виде оптических изомеров, изобретение включает не только рацемическую смесь, но и индивидуальные энантиомеры как таковые. В случае, когда соединения формулы (I) содержат группы, которые могут существовать в таутомерных формах, изобретение включает не только таутомерные формы соединений, но и их смеси. В случае, когда соединения формулы (I) могут существовать в виде геометрических изомеров, изобретение включает не только геометрические изомеры, но и их смеси. Согласно другому аспекту изобретение относится к соединениям вышеуказанной формулы (I) для применения в терапии ряда болезненных состояний. Еще один аспект изобретения касается фармацевтической композиции, включающей соединение вышеуказанной формулы (I) в качестве активного ингредиента предпочтительно вместе с фармацевтически приемлемым носителем и, по желанию, с другими фармакологически активными агентами. Согласно другому аспекту изобретение относится к способу лечения человека или животного, страдающего серотонинзависимым нарушением или заболеванием, в частности, зависимым от рецептора 5 НТ 2A, таким как стенокардия, феномен Рейно, перемежающаяся хромота, коронарный или периферический вазоспазмы, гипертензия, фибромиалгия, тромботическое осложнение (включая внезапный приступ), расстройства памяти, такие как болезнь Альцгеймера; шизофрения; обсессивно-компульсивное нарушение; приступы дурного настроения; аутизм; тревожное расстройство; депрессивные расстройства(включая депрессию с сопутствующим диабетом), расстройства половой функции, нарушения сна, такие как бессонница и временная остановка дыхания во время сна, боль; наркотическая зависимость; экстрапирамидальные симптомы (например, вызванные нейролептической лекарственной терапией, использующей лекарственные средства, такие как, например, галоперидол и хлорпромазин); болезнь Паркинсона; глаукома, включая глаукому при нормальном давлении; недержание мочи при напряжении, включая недержание мочи при напряжении с сопутствующим диабетом; менопаузальные и постменопаузальные приливы; нарушения бронхоконстрикции, такие как астма и хроническое обструктивное заболевание легких; нарушения приема пищи, такие как нарушения приема пищи по причине пьянства, нервная анорексия и булимия; диабетические осложнения, такие как нефропатия, невропатия и ретинопатия. Способ включает введение пациенту (например, млекопитающему, человеку, лошади, собаке или кошке), нуждающемуся в таком лечении (например, идентифицированному как нуждающемуся в таком лечении), эффективного количества одного или более соединений формулы (I)R1 означает Н или C1-6-алкил, арил-С 1-С 3-алкил, гетероарил-С 1-С 3-алкил, 2-гидроксиэтил, метоксиС 2-С 4-алкил, C1-C4-алкоксикарбонил, арилокси-С 2-С 3-алкил или гетероарилокси-С 2-С 3-алкил; где любой арильный или гетероарильный остаток может быть замещен группой С 1-С 4-алкил, С 1-С 4-3 007539 алкокси, С 1-С 4-алкилтио, галоген, трифторметил, трифторметокси или циано; каждый из R2 и R3 независимо означает Н или СН 3; каждый из R4 и R5 независимо означает Н, галоген, метил, либо указанные заместители образуют вместе с кольцом, к атомам углерода которого присоединены, ядро 1 Н-хиноксалин-2-она; иR6 означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH, гетероарил-NH, арил,арилкарбонил, гетероарил или гетероарилкарбонил; где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, может быть незамещенным или замещенным. Когда он замещен, могут присутствовать один, два, три, четыре или пять заместителей, предпочтительно один или два для случая негалогеновых заместителей, и заместители независимо выбран из группы, включающей арил, арил-С 1-2-алкил, арилкарбонил, гетероарил,гетероарил-С 1-2-алкил, гетероарилкарбонил, арилокси, гетероарилокси, арилтио, гетероарилтио, ариламино, гетероариламино, С 3-6-циклоалкил, С 3-6-циклоалкилокси, С 3-6-циклоалкилкарбонил, C1-6-алкил,С 2-6-алканоил, С 2-6-алкинил, С 2-6-алкенил или фтор-С 2-4-алкилокси, галоген, трифторметил, нитро, циано,трифторметокси, трифторметилтио, С 1-С 6-алкокси, С 1-С 6-алкилтио, С 1-С 6-алкиламино, C1-4-диалкиламино, гидрокси или оксо; где любой арильный или гетероарильный остаток, в качестве заместителей на ариле или гетероариле, в отдельности или как часть другой группы, в свою очередь может быть замещен по одному, двум, трем,четырем или пяти положениям, независимым друг от друга, предпочтительно по одному, группой, выбранной из группы, включающей C1-4-алкил, С 1-4-алкокси, C1-4-алкилтио, галоген, трифторметил, трифторметокси или циано; и их фармацевтически приемлемых солей, гидратов, геометрических изомеров, таутомеров, оптических изомеров, N-оксидов и пролекарственных форм, с условием, чтоR2 и R3 оба одновременно не означают СН 3; когда R1, R2, R4 и R5 означают Н и R3 означает Н или СН 3, то R6 не означает 3-пиридилокси, 6 метил-2-нитро-3-пиридилокси или 2-хлор-3-пиридилокси; когда n=0, то R6 не означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH или гетероарил-NH. Другой аспект изобретения касается применения соединений формулы (I) для промышленного получения лекарственного средства, предназначенного для терапии серотонинзависимого нарушения или заболевания, в частности, зависимого от рецептора 5-НТ 2 А, такого как стенокардия, феномен Рейно, перемежающаяся хромота, коронарный или периферический вазоспазмы, гипертензия, фибромиалгия,тромботическое осложнение (включая внезапный приступ), расстройства памяти, такие как болезнь Альцгеймера; шизофрения; обсессивно-компульсивное нарушение; приступы дурного настроения; аутизм; тревожное расстройство; депрессивные расстройства (включая депрессию с сопутствующим диабетом), расстройства половой функции, нарушения сна, такие как бессонница и временная остановка дыхания во время сна, боль; наркотическая зависимость; экстрапирамидальные симптомы (например,вызванные нейролептической лекарственной терапией, использующей лекарственные средства, такие как, например, галоперидол и хлорпромазин); болезнь Паркинсона; глаукома, включая глаукому при нормальном давлении; недержание мочи при напряжении, включая недержание мочи при напряжении с сопутствующим диабетом; менопаузальные и постменопаузальные приливы; нарушения бронхоконстрикции, такие как астма и хроническое обструктивное заболевание легких; нарушения приема пищи,такие как нарушения приема пищи по причине пьянства, нервная анорексия и булимия; диабетические осложнения, такие как нефропатия, невропатия и ретинопатия. Описанные здесь способы могут также включать стадию идентификации потребности больного в лечении вышеуказанного заболевания. Наконец, способ модуляции функции рецептора 5-НТ 2A составляет аспект изобретения. Данное изобретение описывает способ получения соединения формулы (I), где R6 выбран из группы, включающей арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH или гетероарил-NH, путем взаимодействия соединения следующей формулы (II):-4 007539 любой арильный или гетероарильный остаток может быть замещен группой С 1-С 4-алкил, С 1-С 4 алкокси, С 1-С 4-алкилтио, галоген, трифторметил, трифторметокси или циано; каждый из R2 и R3 независимо означает Н или СН 3; каждый из R4 и R5 независимо означает Н, галоген, метил, либо указанные заместители образуют вместе с кольцом, к атомам углерода которого присоединены, ядро 1 Н-хиноксалин-2-она; с необязательно замещенным фенолом или тиофенолом; в растворителе. Настоящее изобретение также описывает способ получения соединения формулы (I), где R6 выбран из группы, включающей: арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH, гетероарил-NH,арил, арилкарбонил, гетероарил или гетероарилкарбонил, путем взаимодействия соединения следующей формулы (IV):R1 означает Н или C1-6-алкил, арил-С 1-С 3-алкил, гетероарил-С 1-С 3-алкил, 2-гидроксиэтил, метоксиС 2-С 4-алкил, С 1-С 4-алкоксикарбонил, арилокси-С 2-С 3-алкил или гетероарилокси-С 2-С 3-алкил; где любой арильный или гетероарильный остаток может быть замещен группой С 1-С 4-алкил, С 1-С 4 алкокси, С 1-С 4-алкилтио, галоген, трифторметил, трифторметокси или циано; каждый из R2 и R3 независимо означает Н или СН 3; каждый из R4 и R5 независимо означает Н, галоген, метил, либо указанные заместители образуют вместе с кольцом, к атомам углерода которого присоединены, ядро 1 Н-хиноксалин-2-она; с основной солью щелочного металла или щелочно-земельного металла, приводящего к получению соединения формулы (V)R1 означает Н или C1-6-алкил, арил-С 1-С 3-алкил, гетероарил-С 1-С 3-алкил, 2-гидроксиэтил, метоксиС 2-С 4-алкил, С 1-С 4-алкоксикарбонил, арилокси-С 2-С 3-алкил или гетероарилокси-С 2-С 3-алкил; где любой арильный или гетероарильный остаток может быть замещен группой С 1-С 4-алкил, С 1-С 4 алкокси, С 1-С 4-алкилтио, галоген, трифторметил, трифторметокси или циано; каждый из R2 и R3 независимо означает Н или СН 3; каждый из R4 и R5 независимо означает Н, галоген, метил, либо указанные заместители образуют вместе с кольцом, к атомам углерода которого присоединены, ядро 1 Н-хиноксалин-2-она; с последующим N-алкилированием соединения формулы (V) путем взаимодействия с соединением формулы (VI)Y означает удаляемую группу иR6 означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH, гетероарил-NH, арил,арилкарбонил, гетероарил или гетероарилкарбонил; и где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, может быть незамещенным или замещенным. Когда он замещен, могут присутствовать один, два, три, четыре или пять заместителей, предпочтительно один или два для случая негалогеновых заместителей, и заместители независимо выбраны из группы, включающей арил, арил-С 1-2-алкил, арилкарбонил, гетероарил, гетероарил-С 1-2-алкил, гетероарилкарбонил, арилокси, гетероарилокси, арилтио, гетероарилтио,ариламино, гетероариламино, С 3-6-циклоалкил, С 3-6-циклоалкилокси, С 3-6-циклоалкилкарбонил, C1-6 алкил, С 2-6-алканоил, С 2-6-алкинил, С 2-6-алкенил или фтор-С 2-4-алкилокси, галоген, трифторметил, нитро,циано, трифторметокси, трифторметилтио, C1-С 6-алкокси, C1-С 6-алкилтио, C1-С 6-алкиламино, С 1-4-диал-5 007539 киламино, гидрокси или оксо; где любой арильный или гетероарильный остаток, в качестве заместителей на ариле или гетероариле, в отдельности или как часть другой группы, в свою очередь, может быть замещен по одному или более положениям, независимым друг от друга,предпочтительно по одному, группой, выбранной из группы, включающей C1-4-алкил, C1-4-алкокси,C1-4-алкилтио, галоген, трифторметил, трифторметокси или циано; в присутствии основания, в подходящем растворителе, при повышенной температуре. Подробное описание изобретения Согласно настоящему изобретению разработан класс новых соединений, которые связывают рецептор 5-HT2A человека. Соединения действуют как рецепторные антагонисты в отношении рецептора 5 НТ 2A человека и, следовательно, могут быть использованы для терапии серотонинзависимых нарушений или заболеваний, в частности зависимых от рецептора 5-НТ 2A. Во-первых, следует пояснить различные термины, используемые раздельно или в комбинации в приведенном выше определении соединений, имеющих общую формулу (I). Выражение "C1-6-алкил" означает линейные или разветвленные алкильные группы с 1-6 атомами углерода. Конкретными C1-6-алкильными группами являются метил, этил, н-пропил, изопропил, третбутил и н-пентил. Производные выражения, такие как "C1-6-алкокси" и "C1-6-алкилтио" созданы, исходя из этого. Характерным примером С 1-4-алкоксикарбонила является трет-бутоксикарбонил. Выражение "С 2-6-алкенил", как использовано здесь, означает линейные и разветвленные алкенильные группы с 2-6 атомами углерода. Типичные примеры включают группы: винил, аллил (2-пропенил),диметилаллил и бутенил. Выражение "С 2-6-алкинил", как использовано здесь, означает линейные или разветвленные алкинильные группы с 2-6 атомами углерода. Типичные примеры включают группы: этинил и пропаргил. Выражение "С 2-6-алканоил", как использовано здесь, означает линейные или разветвленные алканоильные группы с 2-6 атомами углерода. Типичные примеры включают ацетил, пропионил, н-бутаноил. Выражение "С 3-6-циклоалкил" означает циклические алкильные группы с 3-6 атомами углерода. Конкретными С 3-6-циклоалкильными группами являются циклопропил, циклобутил, циклопентил и циклогексил. Под выражением "гетероатом" подразумевают азот, кислород, серу и, в гетероциклических кольцах(включая гетероароматические, а также насыщенные и частично насыщенные гетероциклические кольца), также селен."Оксо" означает, что группа, в особенности арильный или гетероарильный остаток, замещенная оксо, соединена с экзоциклическим атомом кислорода посредством двойной связи."ЖХСД" означает жидкостную хроматографию среднего давления. Термин "основание", как использован здесь, означает реагент, способный в ходе взаимодействия присоединять протоны. Примеры оснований включают карбонатные соли, такие как карбонат калия, бикарбонат калия, карбонат натрия, бикарбонат натрия и карбонат цезия; галогениды, такие как фторид цезия; фосфаты, такие как фосфат калия, дигидрофосфат калия и гидрофосфат калия; гидроксиды, такие как гидроксид лития, гидроксид натрия и гидроксид калия; алкоксиды, такие как трет-бутилат натрия,трет-бутилат калия и трет-бутилат лития; алкиламины, такие как триэтиламин, диизопропиламин и диизопропилэтиламин; гетероциклические амины, такие как 4-диметиламинопиридин, 2,6-лутидин, 1 метилимидазол, пиридин; бициклические амины, такие как 1,8-диазабицикло(4,3,0)ундец-7-ен; и гидриды, такие как гидрид лития, гидрид натрия и гидрид калия. Основание, выбранное для конкретного превращения, зависит от природы исходных материалов, растворителя или растворителей, в которых осуществляют взаимодействие, и температуры, при которой осуществляют взаимодействие. Подразумевается, что термин "арил" включает ароматические циклы (моноциклические или бициклические) с 6-10 атомами углерода в цикле, такие как фенил, 1-нафтил, 2-нафтил, 1,2,3,4 тетрагидронафтил и инданил. Арильная группа может быть связана с остатком молекулы через атом углерода в любом цикле. Термин "гетероарил" означает моно- или бициклическую систему ароматических циклов, где только один цикл должен быть ароматическим и указанная гетероарильная составляющая может быть связана с остатком молекулы посредством атома углерода или азота в любом цикле, содержащую от 5 до 10 атомов в цикле (моно- или бициклическом), из которых один или более атомов цикла являются отличными от углерода, такими как азот, сера, кислород и селен. Примерами таких гетероарильных циклов являются пиррол, имидазол, тиофен, фуран, тиазол, изотиазол, тиадиазол, оксазол, изооксазол, оксадиазол, пиридин, пиразин, пиримидин, пиридазин, пиразол, триазол, тетразол, хроман, изохроман, кумарин,хинолин, хиноксалин, изохинолин, фталазин, циннолин, хиназолин, индол, изоиндол, индолин, изоиндолин, бензотиофен, бензофуран, 2,3-дигидробензофуран, изобензофуран, бензоксазол, 2 Н-хромен, бензизоксазол, 1,3-бензооксатиол, 2,1,3-бензоксадиазол, бензотиазол, 2,1,3-бензотиадиазол, 2,1,3-бензоселенадиазол, бензимидазол, индазол, 2,3-дигидро-1,4-бензодиоксин, 1,3-бензодиоксол, 1,2,3,4-тетрагидрохинолин,3,4-дигидро-2H-1,4-бензоксазин, 1,5-нафтиридин, 1,8-нафтиридин, 3,4-дигидро-2H-пиридо[3,2-b]-1,4-6 007539 оксазин, 2,3-дигидро-1,4-бензоксатиин и 1,2,4-триазоло[1,5-а]пиримидин. Если бициклический арильный или гетероарильный цикл является замещенным, замещение возможно в любом цикле. Галоген включает фтор, хлор, бром или йод, предпочтительно фтор, хлор или бром. Фтор является предпочтительным галогеном, когда составляет часть R6 в качестве заместителя. Где оговорено выше, что арильный и гетероарильный остатки могут быть замещенными (по одному или более положениям), указанное замечание применимо к арилу и гетероарилу как таковому, а также к любым комбинированным группам, содержащим арильный и гетероарильный остатки, таким как гетероарил-С 1-3-алкил и арилкарбонил, и т.д. Термин "N-оксиды" означает, что один или более атомов азота, когда присутствуют в соединении,находятся в форме N-оксида (NO). Термин "пролекарственные формы" означает фармакологически приемлемое производное, такое как карбамат или амид, указанное производное подвергается биопревращению в организме до формы активного лекарственного средства. Ссылка может быть сделана на Goodman and Gilman's, The Pharmacological"Фармацевтически приемлемый" означает полезный для получения фармацевтической композиции,которая является полностью безвредной, нетоксичной и не имеет ни биологических, ни каких-либо других противопоказаний, и включает полезность для применения в ветеринарии, а также использование в производстве фармацевтических средств для человека."Фармацевтически приемлемые соли" означает соли, которые являются фармацевтически приемлемыми, согласно приведенному выше определению, и обладают требуемой фармакологической активностью. Такие соли включают кислотно-аддитивные соли, образованные органическими и неорганическими кислотами, такими как хлористый водород, бромистый водород, йодистый водород, серная кислота,фосфорная кислота, уксусная кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, яблочная кислота, щавелевая кислота, толуолсульфоновая кислота, метансульфоновая кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота, аскорбиновая кислота,трифторуксусная кислота, изэтионовая кислота (т.е. 2-гидроксиэтилсульфоновая кислота) и тому подобное. Выражение "содержащий" означает "включающий, но не ограничиваемый". Так, могут присутствовать другие не упомянутые вещества, добавки или носители."Экстрапирамидальные симптомы" означает симптомы, которые могут проявляться при приеме нейролептических лекарственных средств. Симптомы включают парксионизм-подобный синдром, при котором пациент испытывает мышечную ригидность и подергивания. Некоторые проявляют акатезию и острые дистонические реакции. Выражения "N-t-BOC-производное" или "N-t-BOC-промежуточное соединение", употребляемые в экспериментальном разделе, относятся к соединению формулы (I), где R1 означает трет-бутоксикарбонил(t-BOC). Предпочтительные варианты выполнения представляют собой соединения формулы (I), гдеR6 означает фенокси, фенильный цикл указанной феноксигруппы может быть незамещенным или замещенным. В тех случаях, когда замещенный, могут присутствовать один, два, три, четыре или пять заместителей, которые могут быть одинаковыми или различными, предпочтительно один или два для случая негалогеновых заместителей. Примеры предпочтительных заместителей на указанной феноксигруппе R6 независимо выбран из группы, включающей галоген, 2-пропенил, C1-С 6-алкил, C1-С 6-алкокси,трифторметил, фенил, фенокси, бензоил и С 3-6-циклоалкил; где любой из заместителей, означающих фенил, фенокси или бензоил, в свою очередь может быть замещенным по одному, двум или трем положениям, предпочтительно галогеном. R6 может также быть замещен посредством 2,4,5-трифторфенокси, 3 фторфенокси, 4-фторфенокси, 2,4-дифторфенокси, 2,3,4-трифторфенокси, 2-фтор-4-хлорфенокси, 4 бромфенокси и 2,3-дихлорфенокси. Другим предпочтительным вариантом выполнения изобретения является соединение формулы (I),гдеR6 означает 2,4,5-трифторфенокси. Еще одним предпочтительным вариантом выполнения изобретения является соединение формулы-7 007539 И еще одним предпочтительным вариантом выполнения изобретения является соединение формулыR6 означает фенил, где указанный фенил может быть замещен галогеном, предпочтительно фтором,по одному, двум, трем, четырем или пяти положениям. Еще более предпочтительно R6 означает 2,4,5 трифторфенил. Предпочтительными соединениями вышеуказанной формулы (I) являются 1-[2-(2-фтор-4-нитрофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-2-[(2-оксо-2H-хромен-7-ил)окси]этил-3-(1-пиперазинил)-2(1H)-пиразинон,3-(1-пиперазинил)-1-[2-(2,4,5-трифторфенокси)этил]-2(1H)-пиразинон,3-(1-пиперазинил)-1-[2-(2,3,5,6-тетрафторфенокси)этил]-2(1H)-пиразинон,1-[2-(2,3,4,5,6-пентафторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-хлор-2-фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-цианофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-циклопентилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(1,2-бензизоксазол-3-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-метоксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-н-бутилоксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-([1,1'-бифенил]-3-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,3-(1-пиперазинил)-1-[2-(2,3,4-трифторфенокси)этил]-2(1H)-пиразинон,1-[2-(2,3-дихлорфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(1,3-бензодиоксол-5-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(2,4-дифторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-2-[(2-оксо-1,3-бензоксатиол-5-ил)окси]этил-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-гидроксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,3-(1-пиперазинил)-1-[2-(6-хиноксалинилокси)этил]-2(1H)-пиразинон,1-2-[3-(N,N-диметиламино)фенокси]этил-3-(1-пиперазинил)пиразин-2(1H)-он,3-(1-пиперазинил)-1-2-[3-(трифторметил)фенокси]этил-2(1H)-пиразинон,1-[2-(3-фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-нитрофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-бензоилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3,5-дифторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(фенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(2,6-дифторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(2-цианофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-трифторметилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-бромфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-4-фенокси(фенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-изопропилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(2,4,5-трихлорфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(2-метилтиофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-метоксифенилтио)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-аллил-2-метокси)феноксиэтил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(5,6,7,8-тетрагидронафталин-2-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(2, 6-дифторфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-трифторметилфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-бромфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон,1-[2-(фенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон,1-[2-(2,4,5-трифторфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон,1-[2-(2,4,5-трифторфенокси)этил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон,1-[2-(4-фторфенокси)этил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон,1-[2-(4-изопропилфенокси)этил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон,1-[2-(2-метилтиофенокси)этил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон,1-(2,4,5-трифторбензил)-3-(1-пиперазинил)-2(1H)-пиразинон,1-[3-(2,4,5-трифторфенил)пропил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(1-пиперазинил)-2(1H)-пиразинон,3-пиперазин-1-ил-1-[2-(2,4,5-трифторфенокси)этил]-1H-хиноксалин-2-он,1-[2- (2,4,5-трифторфенокси)этил]-3-(4-н-бутил-1-пиперазинил)-2(1H)-пиразинон,1-[2-(2,4,5-трифторфенокси)этил]-3-[4-(2-метоксиэтил)-1-пиперазинил]-2(1H)-пиразинон,1-[2- (2,4,5-трифторфенокси)этил]-3-(4-метил-1-пиперазинил)-2(1H)-пиразинон,-8 007539 1-[2-(2,4,5-трифторфенокси)этил]-3-(4-изопропил-1-пиперазинил)-2(1H)-пиразинон,1-2-[(5-метил[1,2,4]триазоло[1,5-а]пиримидин-7-ил)окси]этил-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-цианофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[4-(2,4,5-трифторфенокси)бутил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[3-(2,4,5-трифторфенокси)пропил]-3-(1-пиперазинил)-2(1H)-пиразинон,3-[4-(1-фенилэтил)пиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он,3-[4-(2-феноксиэтил)пиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он,3-[4-(2-фенилэтил)пиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он, гидрохлорид,3-(4-бензилпиперазин-1-ил)-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он, гидрохлорид,3-[(2R)-2-метилпиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он,3-пиперазин-1-ил-1-[2-(3-тиенил)этил]пиразин-2(1H)-он,3-пиперазин-1-ил-1-[2-(2-тиенил)этил]пиразин-2(1H)-он,1-[2-(1 Н-индол-3-ил)этил]-3-пиперазин-1-илпиразин-2(1H)-он,1-[2-(2,3-дигидро-1,4-бензодиоксин-5-илокси)этил]-3-пиперазин-1-илпиразин-2(1H)-он,1-[2-(фенилтио)этил]-3-пиперазин-1-илпиразин-2(1H)-он,1-(3-оксо-3-фенилпропил)-3-пиперазин-1-илпиразин-2(1H)-он и 1-[3-(4-фторфенил)-3-оксопропил]-3-пиперазин-1-илпиразин-2(1H)-он,и их фармакологически приемлемые соли и сольваты. Как упомянуто выше, соединения по настоящему изобретению полезны для лечения, включая профилактическое лечение, человека или животного, в том числе, например, домашних животных, от серотонинзависимых, в частности зависимых от рецептора 5-НТ 2A, нарушений или заболеваний, таких как стенокардия; феномен Рейно; перемежающаяся хромота; коронарный или периферический вазоспазмы; гипертензия; фибромиалгия; тромботическое осложнение, включая внезапный приступ; расстройства памяти, такие как болезнь Альцгеймера; шизофрения; обсессивно-компульсивное нарушение; приступы дурного настроения; аутизм; тревожное расстройство; депрессивные расстройства, включая депрессию с сопутствующим диабетом; расстройства половой функции; нарушения сна, такие как бессонница и временная остановка дыхания во время сна; боль; наркотическая зависимость; экстрапирамидальные симптомы (например, вызванные нейролептической лекарственной терапией, использующей лекарственные средства, такие как, например, галоперидол и хлорпромазин); болезнь Паркинсона; глаукома, включая глаукому при нормальном давлении; недержание мочи при напряжении, включая недержание мочи при напряжении с сопутствующим диабетом; менопаузальные и постменопаузальные приливы; нарушения бронхоконстрикции, такие как астма и хроническое обструктивное заболевание легких; нарушения приема пищи, такие как нарушения приема пищи по причине пьянства, нервная анорексия и булимия; диабетические осложнения, такие как нефропатия, невропатия и ретинопатия. Соединения по настоящему изобретению в меченной радиоактивными изотопами форме могут быть использованы в качестве диагностического средства. Способы получения Изобретение также касается способов получения соединений, отвечающих приведенным здесь формулам, состоящих во взаимодействии одного или более соединений по приведенным здесь формулам, включая любые описанные технологические операции. По одному из аспектов изобретение представляет способ получения соединения приведенной здесь формулы (I). Соединения приведенной выше общей формулы (I) могут быть получены общепринятыми способами, либо по аналогии с ними, и, в частности, согласно или аналогично следующим способам. Соединения формулы (I) получают путем взаимодействия соединения структурной формулы (II)R1, R2, R3, R4 и R5 принимают значения, указанные для формулы (I); с 1-10 молярными эквивалентами необязательно замещенного фенола или тиофенола в условия реакции Mitsunobu (ср., Org. Reactions 1992, 42, 335-656 и Tetrahedron Lett. 1995, 36, 3789-3792), что приводит к соединению формулы (I)R1, R2, R3, R4 и R5 и n принимают значения, указанные для формулы (I);R6 выбран из группы, включающей арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH или гетероарил-NH, арил, арилкарбонил, гетероарил или гетероарилкарбонил; где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, может быть незамещенным или замещенным. В тех случаях, когда замещенный, могут присутствовать один,два, три, четыре или пять заместителей, предпочтительно один или два для случая негалогеновых заместителей, и заместители независимо выбраны из группы, включающей арил, арил-С 1-2-алкил, арилкарбонил,гетероарил, гетероарил-С 1-2-алкил, гетероарилкарбонил, арилокси, гетероарилокси, арилтио, гетероарилтио, ариламино, гетероариламино, С 3-6-циклоалкил, С 3-6-циклоалкилокси, С 3-6-циклоалкилкарбонил, C1-6 алкил, С 2-6-алканоил, С 2-6-алкинил, С 2-6-алкенил или фтор-С 2-4 алкилокси, галоген, трифторметил, нитро,циано, трифторметокси, трифторметилтио, С 1-С 6-алкокси, С 1-С 6-алкилтио, С 1-С 6-алкиламино, C1-4-диалкиламино, гидрокси или оксо; где любой арильный или гетероарильный остаток, в качестве заместителей на ариле или гетероариле, в отдельности или как часть другой группы, в свою очередь, может быть замещен по одному или более положениям, независимым друг от друга, предпочтительно по одному, группой, выбранной из группы,включающей С 1-4-алкил, C1-4-алкокси, C1-4-алкилтио, галоген, трифторметил, трифторметокси или циано. Обычно указанную реакцию Mitsunobu проводят в присутствии диэтилазодикарбоксилата (DEAD) или 1,1'-азобис-(N,N-диметил)формамида (TMAD), предпочтительно TMAD, и трифенилфосфина или три-н-бутилфосфина, предпочтительно трифенилфосфина, в растворителе, таком как N,N-диметилформамид (ДМФА), дихлорметан или тетрагидрофуран (ТГФ), в особенности ДМФА, или в подходящей смеси растворителей, такой как смесь ТГФ:ДМФА, при -25-50 С, обычно при комнатной температуре, в течение 1-48 ч. Для соединений формулы (I), где R1 означает Н, R1 в соответствующем промежуточном соединении формулы (II) означает подходящую защитную группу, предпочтительно трет-бутоксикарбонил (t-BOC) или тритил. Промежуточные соединения формулы (II) могут быть получены по методике, описанной в WO 00/76984, и как указано в примерах 73-75. Вышеуказанный способ получения соединения формулы (I) из соединения формулы (II) может приводить к образованию смеси структурных изомеров, содержащей требуемое соединение формулы (I) по настоящему изобретению и соответствующий структурный изомер формулы (Ib), описанный в WO 00/76984. Соотношение структурных изомеров может изменяться в зависимости от используемых экспериментальных условий. Такие соединения могут быть обычно разделены общепринятыми способами,включающими хроматографию, такую как колоночная хроматография на силикагеле или препаративная ЖХВР. Идентичность индивидуальных структурных изомеров может быть установлена спектроскопическими методами, такими как спектроскопия ядерного магнитного резонанса (ЯМР), включая протонную и углеродную ЯМР-спектроскопию (1 Н-ЯМР и 13 С-ЯМР), и инфракрасная спектроскопия (ИК). Альтернативно, соединения формулы (I) могут также быть получены взаимодействием соединения формулы (IV)R1, R2, R3, R4 и R5 принимают значения, указанные для формулы (I); с основной солью щелочного металла или щелочно-земельного металла, например гидроксидом или карбонатом, таким как NaOH или К 2 СО 3, в водной среде, такой как смесь вода:диметилсульфоксид(ДМСО) при 25-150 С, приводящим к получению соединения формулы (V)m и R1, R2, R3, R4 и R5 принимают значения, указанные для формулы (I); с последующим Nалкилированием соединения формулы (V) путем взаимодействия с соединением формулы (VI)R6 означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH, гетероарил-NH, арил,арилкарбонил, гетероарил или гетероарилкарбонил; где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, может быть незамещенным или замещенным. В тех случаях, когда замещенный, могут присутствовать один,два, три, четыре или пять заместителей, предпочтительно один или два, для случая негалогеновых заместителей, и заместители независимо выбраны из группы, включающей арил, арил-С 1-2-алкил, арилкарбонил, гетероарил, гетероарил-С 1-2-алкил, гетероарилкарбонил, арилокси, гетероарилокси, арилтио, гетероарилтио, ариламино, гетероариламино, С 3-6-циклоалкил, С 3-6-циклоалкилокси, С 3-6-циклоалкилкарбонил,C1-6-алкил, С 2-6-алканоил, С 2-6-алкинил, С 2-6-алкенил или фтор-С 2-4-алкилокси, галоген, трифторметил,нитро, циано, трифторметокси, трифторметилтио, C1-С 6-алкокси, C1-С 6-алкилтио, C1-С 6-алкиламино,C1-4-диалкиламино, гидрокси или оксо; где любой арильный или гетероарильный остаток, в качестве заместителей на ариле или гетероариле, в отдельности или как часть другой группы, в свою очередь, может быть замещен по одному или более положениям, независимым друг от друга, предпочтительно по одному, группой, выбранной из группы,включающей C1-4-алкил, C1-4-алкокси, C1-4-алкилтио, галоген, трифторметил, трифторметокси или циано; обычно в присутствии основания, такого как гидрид щелочного металла, такой как гидрид натрия,или трет-бутилата натрия или калия (t-BuONa или t-BuOK), или карбоната калия, или карбоната цезия,или тому подобного, в подходящем растворителе, таком как ТГФ, диоксан, диглим, 1,2-диметоксиэтан,ДМФА, ДМСО или ацетонитрил, целесообразно, при повышенной температуре, обычно, при температуре кипения используемого растворителя. Указанная реакция N-алкилирования может быть проведена в присутствии йодида натрия или йодида калия, в случаях, где Y в формуле (VI) отличен от йода. Для соединений формулы (I), где R1 означает Н, R1 в промежуточном соединении формулы (V) означает подходящую защитную группу, предпочтительно трет-бутоксикарбонил (t-BOC) или тритил. Промежуточные соединения формулы (IV) могут быть получены по методике, описанной в WО 00/76984, и как указано в примере 54, стадия 1 и примере 55, стадия 1. Когда R1 означает азотную защитную группу, такую как трет-бутоксикарбонил (t-BOC) или тритил,последующее снятие N-защиты выполняют общепринятыми способами, такими как способы, описанные в Protective Groups in Organic Synthesis, John WileySons, 1991. Полученное соединение вышеуказанной формулы (I) может быть превращено в другое соединение формулы (I) с помощью способов, хорошо известных из уровня техники. Могут быть введены различные группы, такие как C1-6-алкильные группы для R1 в формуле (I). Условия могут быть такие, как описаны в примере 52, стадия 2; примере 53, стадия 2 и примерах 60-63. Химические реактивы, используемые в вышеуказанных способах синтеза, могут включать, например, растворители, реагенты, катализаторы, агенты для защиты групп и снятия защиты. Описанные выше способы могут также дополнительно включать стадии, либо до, либо после конкретно описанных здесь стадий, для введения или удаления подходящих защитных групп, что позволяет, в конечном счете, синтезировать соединения, отвечающие любой из вышеуказанных формул, их солевые формы, либо композиции, включающие соединения или их солевые формы. Кроме того, различные синтетические стадии могут быть выполнены в альтернативной последовательности с целью получения требуемых соединений. Способы осуществления превращений в синтетической химии и методики применения защитных групп(защита и снятие защиты), полезные для синтеза соответствующих соединений формулы (I), известны из уровня техники и включают, например, способы, описанные в R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rdand Sons (1995) и более поздние издания. Вышеописанный способ может быть выполнен так, чтобы получить соединение по изобретению в форме свободного основания или в виде кислотно-аддитивной соли. Согласно общепринятым способам получения кислотно-аддитивных солей из основных соединений фармацевтически приемлемая кислотно-аддитивная соль может быть получена путем растворения свободного основания в подходящем органическом растворителе и обработкой раствора кислотой. Примерами кислот, образующих аддитивные соли, являются малеиновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, метансульфоновая кислота, уксусная кислота, щавелевая кислота, бензойная кислота, хлористо-водородная кислота, серная кислота, фосфорная кислота и тому подобное. Соединения формулы (I) могут обладать одним или более хиральными атомами углерода и, следовательно, могут быть получены в форме оптических изомеров, например, в виде чистого энантиомера или в виде смеси энантиомеров (рацемат), или в виде смеси, содержащей диастереомеры. Разделение смесей оптических изомеров с целью получения чистых энантиомеров хорошо известно из уровня техники и может, например, быть достигнуто путем фракционированной кристаллизации солей с оптически активными (хиральными) кислотами или хроматографическим разделением на хиральных колонках. Необходимые исходные материалы для получения соединений формулы (I) либо являются известными, либо могут быть получены по аналогии с получением известных соединений. Согласно настоящему изобретению соединения формулы (I) в форме свободных оснований или солей с физиологически приемлемыми кислотами могут выпускаться в соответствующих галеновых формах, таких как композиции для перорального употребления, для инъекции, для введения в виде назального спрея и тому подобного, согласно приемлемым фармацевтическим методикам. Такие фармацевтические композиции по изобретению включают эффективное количество соединений формулы (I) в совокупности с совместимыми фармацевтически приемлемыми материалами-носителями или разбавителями,хорошо известными из уровня техники. Носители могут представлять собой любой инертный материал,органический или неорганический, подходящий для энтерального, чрескожного, подкожного или парентерального введения, такой как вода, желатин, гуммиарабик, лактоза, микрокристаллическая целлюлоза,крахмал, натрийкрахмалгликолят, гидрофосфат кальция, стеарат магния, тальк, коллоидный диоксид кремния и тому подобное. Такие композиции могут также содержать другие фармакологически активные агенты и общепринятые добавки, такие как стабилизаторы, увлажняющие средства, эмульгаторы, корригенты, буферные средства и тому подобные. Композиции по изобретению могут быть, например, получены в твердой или жидкой форме для перорального введения, такой как таблетки, пилюли, капсулы, порошки, сиропы, эликсиры, диспергируемые гранулы, крахмальные облатки, суппозитории и тому подобное, в форме стерильных растворов, суспензий или эмульсий для парентерального введения, спреев, например назального спрея, трансдермальных препаратов, например пластырей и тому подобного. Как указано выше, соединения по изобретению могут быть использованы для лечения серотонинзависимых, в частности зависимых от рецептора 5-НТ 2 А, нарушений и заболеваний человека или животного, таких как стенокардия, феномен Рейно, перемежающаяся хромота, коронарный или периферический вазоспазмы, гипертензия, фибромиалгия, тромботическое осложнение (включая внезапный приступ), расстройства памяти, такие как болезнь Альцгеймера; шизофрения; обсессивно-компульсивное нарушение; приступы дурного настроения; аутизм; тревожное расстройство; депрессивные расстройства(включая депрессию с сопутствующим диабетом), расстройства половой функции, нарушения сна, такие как бессонница и временная остановка дыхания во время сна, боль; наркотическая зависимость; экстрапирамидальные симптомы (например, вызванные нейролептической лекарственной терапией, использующей лекарственные средства, такие как, например, галоперидол и хлорпромазин); болезнь Паркинсона; глаукома, включая глаукому при нормальном давлении; недержание мочи при напряжении, включая недержание мочи при напряжении с сопутствующим диабетом; менопаузальные и постменопаузальные приливы; нарушения бронхоконстрикции, такие как астма и хроническое обструктивное заболевание легких; нарушения приема пищи, такие как нарушения приема пищи по причине пьянства, нервная анорексия и булимия; диабетические осложнения, такие как нефропатия, невропатия и ретинопатия. Настоящее изобретение касается способа лечения или профилактики зависимого от рецептора 5 НТ 2 А нарушения или заболевания. Способ включает введение пациенту (например, млекопитающему,человеку, лошади, собаке или кошке), нуждающемуся в таком лечении, эффективного количества одного или более соединений, отвечающих любой вышеуказанной формуле, солевых форм указанных соединений или композиций, включающих соединения или их солевые формы. Также в рамки объема настоящего изобретения и приложенных пунктов входит способ модуляции(например, ингибирования) активности рецептора 5-НТ 2 А. Вышеуказанные нарушения и заболевания можно лечить с помощью антагонистов 5-НТ 2 А. Способ включает введение нуждающемуся в таком лечении пациенту эффективного количества одного или более соединений, отвечающих любой вышеуказанной формуле, солевых форм указанных соединений или композиций, включающих соединения или их- 12007539 солевые формы. Описанные здесь способы могут также включать стадию идентификации потребности больного в лечении вышеуказанных нарушений или заболеваний. Идентификация может быть проведена по решению пациента или медицинского работника и может быть субъективной (например, заключение специалиста) или объективной (например, оценка посредством теста или диагностического метода)."Эффективное количество" означает количество соединения, оказывающее терапевтическое воздействие на излечиваемого пациента. Терапевтическое воздействие может быть объективным (т.е., оцененным некоторым тестом или маркером) или субъективным (т.е., пациент свидетельствует об эффективности или ощущении эффекта). Для клинического применения соединения по изобретению формулируют в фармацевтические составы для перорального, ректального, парентерального или других способов введения. Обычно количество активных соединений находится в пределах 0,1-95 мас.% от препарата,предпочтительно, в препаратах 0,2-20 мас.% в препаратах для парентерального употребления и предпочтительно в пределах от 1 до 50 мас.% в препаратах для перорального употребления. Типичная доза активного вещества варьируется в широком пределе и зависит от различных факторов, например индивидуальной потребности каждого пациента и способа введения. В целом, пероральные или парентеральные дозировки составляют в пределах от 5 до 1000 мг активного вещества в день,предпочтительно от 50 до 150 мг в день. Уровень дозы, частота введения лекарственного средства, способ введения конкретного соединения изменяются в зависимости от различных факторов, включающих эффективность конкретного используемого соединения, метаболическую устойчивость и длительность воздействия указанного соединения,возраст пациента, массу тела, общее состояние здоровья, пол, диету, способ и время введения, скорость выведения из организма, комбинацию лекарственных средств, тяжесть излечиваемого состояния и переносимость пациентом терапевтического воздействия. Все приведенные здесь ссылки, существующие в печатной, электронной или компьютерной версии либо другой форме, полностью включены здесь в качестве ссылок, охватывающих, но не в порядке ограничения, рефераты, статьи, журналы, публикации, тексты, монографии, web-сайты интернета, базы данных, патенты и патентные публикации. Далее изобретение иллюстрируется следующими примерами, которые, однако, служат только иллюстративным целям и не рассматриваются как ограничивающие рамки объема изобретения и приложенных пунктов. Примеры Общие положения. Спектр ЯМР снимают на спектрометре Bruker DPX 400, Bruker DRX 500, Jeol 270 или на Varian Unity Inova 400. Колоночную хроматографию выполняют на силикагеле Silica gel 60 (230-400 меш., Е. Merck). Очистку с помощью препаративной ВЭЖХ выполняют на колонке YMC OPS-AQ CombiPrep (50 x 20 мм,вн.д., размер частиц 5 мкм, 120 А), используя в качестве элюента различные градиенты смеси ацетонитрил-вода, содержащей 0,1% TFA, при скорости потока 30 мл/мин, применяя аппарат LC/MS GilsonFinnigan, снабженный насосами Gilson, детектором Dynamax UV-1 и детектором Finnigan Mass. Анализы методом аналитической ВЭЖХ с обращенной фазой выполняют на колонке АСЕ С 8 (50 х 4,6 мм), используя различные градиенты смеси ацетонитрил-вода, содержащей 0,005 М ацетата аммония, при скорости потока 1 мл/мин, применяя установку Waters ZQ LC-MS. "Speed-vac" означает Speed-vac PlusSC250DDA или Gene-vac DD-4. Точный массовый анализ выполняют на оборудовании Micromass LCT,используя ионизацию с электрораспылением. Элементный анализ выполняют на приборе MikroKemi AB,Uppsala, Sweden или на Elementar Vario EL в Biovitrum AB, Stockholm, Sweden, и приведенные результаты находятся в пределах 0,4% от теоретических значений. Температуры плавления, если указаны, получены на приборах Biichi Meltingpoint B-545, Electrothermal IA 9000 или Gallenkamp MPD350 и являются неприведенными. Промежуточный продукт 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанол получают, как описано в WO 00/76984, пример 52, стадия 2. Пример 1. 1-[2-(2-Фтор-4-нитрофенокси)этил]-3-(1-пиперазинил)-2(H)-пиразинон, гидрохлорид. 2-Фтор-4-нитрофенол (732 мг, 4,66 ммоль), 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанол (1,375 г, 4,240 ммоль) и трифенилфосфин (1,22 г, 4,66 ммоль) растворяют в ТГФ (8 мл) и добавляют тремя порциями 1,1'-азобис(N,N-диметил)формамид (TMAD; 802 мг, 4,66 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем центрифугируют. Супернатант концентрируют в вакууме. Остаток растворяют в EtOAc и промывают 5% NаНСО 3 и насыщенным раствором соли. Органический слой концентрируют в вакууме и остаток очищают флэш-хроматографией,используя смесь EtOAc/толуол (4:6) в качестве элюента, что дает 451 мг (23%) указанного в заголовке соединения в виде его N-t-BOC-производного. N-t-BOC-промежуточное соединение (440 мг, 0,949 ммоль) обрабатывают смесью трифторуксусная кислота (TFA)/дихлорметан/Н 2O (36:60:4, 3,6 мл) в течение 45 мин. Раствор концентрируют в вакууме и остаток осаждают диэтиловым эфиром. Полученное вещество растворяют в 50% водном МеОН (15 мл) и пропускают через анионообменную смолу (Dowex-1 Х 8, С 1-, 4 г),элюируя 50% водным МеОН. Выпаривание растворителя в вакууме дает указанное в заголовке соединение. Выход: 364 мг (96%); т.пл. 105-108 С; MS-EI m/z 363 (М)+. Анал. (C16H18N5O4F1,1 НСl0,2 Н 2O) С, Н, N.- 13007539 Пример 2. 1-2-[(2-Оксо-2H-хромен-7-ил)окси]этил-3-(1-пиперазинил)-2(1H)-пиразинон, гидрохлорид. Диэтилазодикарбоксилат (DEAD; 0,63 мл, 4,0 ммоль) добавляют за 20 мин к перемешиваемой смеси 7-гидроксикумарина (713 мг, 4,40 ммоль), 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси] этанола (1,29 г, 4,00 ммоль) и трифенилфосфина (1,05 г, 4,00 ммоль) в ТГФ (15 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Удаление растворителя в вакууме и очистка остатка повторной хроматографией на силикагеле с использованием смесей EtOAc/толуол и дихлорметан/МеОН (96:4) в качестве элюентов, соответственно, дает 871 мг (46%) указанного в заголовке соединения в виде его N-t-BOC-производного . N-t-BOC-промежуточный продукт (8 00 мг, 1,71 ммоль) обрабатывают смесью ТFА/дихлорметан/Н 2 О (40:55:5; 4,2 мл) в течение 70 мин. Раствор упаривают и остаток осаждают диэтиловым эфиром. Полученное вещество (843 мг) растворяют в 50% водном МеОН (10 мл) и пропускают через анионообменную смолу (Dowex-1 Х 8, Cl-, 5 г), элюируя 50% водным МеОН. Образующуюся хлористо-водородную соль указанного в заголовке соединения дополнительно очищают хроматографией на обращенно-фазовом силикагеле LiChroprep RP-18 (Merck) (5 х 2,5 см), элюируя 25% ацетонитрилом в 0,02 М НСl. Содержащие продукт фракции объединяют, концентрируют в вакууме и сушат сублимацией, получая 600 мг (85%) указанного в заголовке соединения. MS-EI m/z 368 (М)+. Анал.(Fluka) (1,2 г, 3,6 ммоль) встряхивают в дихлорметане (10 мл) в атмосфере азота около 21 ч. Полимер фильтруют и промывают дихлорметаном. Растворитель выпаривают и остаток растворяют в СНСl3 и промывают 1 М Nа 2 СO3 и насыщенным раствором соли. Удаление растворителя в вакууме и очистка остатка повторной хроматографией на силикагеле с использованием СНСl3 смесь СНСl3/МеОН (98:2) в качестве элюента, дает 791 мг (58%) указанного в заголовке соединения в виде его N-t-BOCпроизводного. N-t-BOC-промежуточный продукт (700 мг, 1,54 ммоль) обрабатывают смесью ТFА/дихлорметан/Н 2 О (42:53:5; 4 мл) и выдерживают при комнатной температуре в течение 50 мин при перемешивании. Раствор концентрируют и остаток осаждают смесью МеОН/диэтиловый эфир. Полученное вещество растворяют в 50% водном МеОН и пропускают через анионообменную смолу (Dowex-1X8, Сl-, 4 г), элюируя 50% водным МеОН. Выпаривание растворителя в вакууме дает указанное в заголовке соединение. Выход: 513 мг (85%); т.пл. 193-195 С; MS-EI m/z 354 (М)+; МСВР m/z вычисл. дляC16H17F3N4O2 (М)+ 354,1304, найдено 354,1301. Анал. (C16H17F3N4O2HCl) С, Н, N. Данное соединение, выделяемое в виде ацетатной соли, получают по методике примера 65 путем замены 2-(4-аллил-2-метоксифенокси)этилметансульфонатa на 2-(2,4,5-трифторфенокси)этилметансульфонат. Пример 4. 3-(1-Пиперазинил)-1-[2-(2,3,5,6-тетрафторфенокси)этил]-2(1H)-пиразинон, гидрохлорид. 2,3,5,6-Тетрафторфенол (556 мг, 3,35 ммоль), 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанол (1,01 г, 3,10 ммоль) и трифенилфосфин (813 мг, 3,10 ммоль) растворяют в ТГФ (10 мл) и добавляют тремя порциями TMAD (533 мг, 3,10 ммоль) за период 50 мин. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Небольшое количество белого осадка фильтруют. Фильтрат упаривают, повторно растворяют в диэтиловом эфире и фильтруют вновь. Фильтрат промывают 5% NаНСО 3 и насыщенным раствором соли, концентрируют в вакууме и остаток очищают флэшхроматографией, используя смесь EtOAc/толуол (3:7, впоследствии 1:4) в качестве элюента. Получают 584 мг (40%) указанного в заголовке соединения в виде его N-t-BOC-производного. N-t-BOCпромежуточное соединение (568 мг, 1,20 ммоль) обрабатывают смесью ТFА/дихлорметан/Н 2 О (42:53:5; 3,1 мл) при комнатной температуре в течение 50 мин, при перемешивании. Раствор упаривают и остаток осаждают смесью МеОН-диэтиловый эфир. Полученный продукт растворяют в 50% водном МеОН и пропускают через анионообменную смолу (Dowex-1 X8, Сl-, 4 г), элюируя 50% водным МеОН. Выпаривание растворителя в вакууме дает указанное в заголовке соединение. Выход: 453 мг (92%); т.пл. 196198 С (разл.); MS-EI m/z 372 (М)+; МСВР m/z вычисл. для C16H16F4N4O2(M)+ 372,1209, найдено 372,1196. Анал. (C16H16F4N4O2HCl) С, Н, N. Пример 5. 1-[2-(2,3,4,5,6-Пентафторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, гидрохлорид. Пентафторфенол (608 мг, 3,30 ммоль), 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанол (1,01 г, 3,10 ммоль) и трифенилфосфин (813 мг, 3,10 ммоль) растворяют в ТГФ (5 мл) и добавляют тремя порциями TMAD (533 мг, 3,10 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Небольшое количество белого осадка фильтруют. Фильтрат концентрируют в вакууме и остаток растворяют в диэтиловом эфире, промывают 5% NaHCO3 и насыщенным раствором соли. Удаление растворителя в вакууме и очистка остатка флэш-хроматографией с использованием смеси толуол/EtOAc (3:7, впоследствии 1:4) в качестве элюента дает 332 мг (22%) указанного в заголовке соединения в виде его N-t-BOC-производного. Указанное вещество (0,677 ммоль) обрабатывают смесьюTFA/дихлорметан/Н 2 О (42:53:5; 1,74 мл) в течение 1 ч. Раствор упаривают и остаток осаждают смесью МеОН/диэтиловый эфир. Полученный продукт растворяют в 50% водном МеОН и пропускают через анионообменную смолу (Dowex-1 Х 8, Сl-, 4 г), элюируя 50% водным МеОН. Выпаривание растворителя- 14007539 в вакууме дает указанное в заголовке соединение. Выход: 275 мг (92%). MS-EI m/z 390 (М)+. МСВР m/z вычисл. для C16H15F5N4O2 (M)+ 390,1115, найдено 390,1106. Анал. (C16H15F5N402HCl) С, Н, N. Пример 6. 1-[2-(4-Хлор-2-фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон. 1,1'-Азобис(N,N-диметил)формамид (TMAD; 0,217 г, 1,26 ммоль) добавляют к перемешиваемой смеси 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (0,324 г, 1,00 ммоль), трифенилфосфина (0,324 г, 1,23 ммоль) и 4-хлорфторфенола (0,217 г, 1,48 ммоль) в ТГФ (1 мл) при комнатной температуре. Спустя 2 ч реакционную смесь концентрируют и с сырого N-t-BOC-производного указанного в заголовке соединения снимают N-защиту с помощью смеси ТFА/дихлорметан/Н 2O (45:50:5). Очистка хроматографией на силикагеле с использованием смеси EtOAc/толуол (4:6) в качестве элюента дает 0,123 г (35%) указанного в заголовке соединения в виде желтого масла. МСВР m/z вычисл. дляC16H18ClFN4O2 (M)+ 352,1102, найдено 352,1098. Пример 7. 1-[2-(3-Цианофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон. Указанное в заголовке соединение получают согласно методике, описанной в примере 6, исходя из 3-цианофенола (0,149 г, 1,25 ммоль). Получают 115 мг (35%) указанного в заголовке соединения в виде желтого твердого вещества: т.пл. 49-52 С. МСВР m/z вычисл. для C17H19N5O2 (М)+ 325,1539, найдено 325,1549. Пример 8. 1-[2-(4-Циклопентилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон. Указанное в заголовке соединение получают согласно методике, описанной в примере 6, исходя из 4-циклопентилфенола (0,203 г, 1,25 ммоль). Получают 30 мг (8%) указанного в заголовке соединения в виде желтого масла. МСВР m/z вычисл. Для C21H28N4O2 (М)+ 368,2212, найдено 368,2193. Пример 9. 1-[2-(1,2-Бензизоксазол-3-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, дигидрохлорид. Указанное в заголовке соединение получают растворением 3-гидроксибензизооксазола (0,324 г, 1,0 ммоль),три-н-бутилфосфина (РBu3; 0,360 мл, 1,46 ммоль), 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (0,324 г, 1,00 ммоль) в ДМФА (1 мл) и добавлением 1,1'-азобис(N,N-диметил)формамида (TMAD; 0,215 г, 1,25 ммоль). Реакционную смесь нагревают в микроволновом реакторе Labwell в течение 1 мин при 75 Вт. N-t-ВОС-производное указанного в заголовке соединения очищают хроматографией на силикагеле, используя смесь МеОН/СНСl3 (5:95) в качестве элюента. Последующее снятие Nзащиты осуществляют, используя смесь ТFА/дихлорметан/Н 2 О (45:50:5). Указанный в заголовке продукт выделяют в виде желтого твердого вещества. Выход: 0,085 г (20%); т.пл. 174-176 С. МСВР m/z вычисл. для C17H19N5O3 (M)+ 341,1488, найдено 341,1496. Пример 10. 1-[2-(3-Метоксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон.TMAD (0,060 г, 0,35 ммоль) растворяют в ТГФ (1 мл) и ДМФА (0,5 мл) и раствор добавляют по каплям к смеси 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (0,100 г, 0,310 ммоль),трифенилфосфина (0,092 г, 0,35 ммоль) и 3-метоксифенола (0,124 г, 1,00 ммоль) в ТГФ (0,5 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре, концентрируют и пропускают через колонку с диоксидом кремния, используя смесь толуол/EtOAc (7:3) в качестве элюента. Растворители удаляют в вакууме и N-t-BOC-производное указанного в заголовке соединения обрабатывают смесью дихлорметан/ТFА/Н 2O (50:45:5; 5 мл) в течение 15 мин. Смесь концентрируют и остаток очищают хроматографией на силикагеле, используя смесь EtOAc/HOAc/MeOH/H2O (20:3:3:2) в качестве элюента. Содержащие продукт фракции концентрируют, промывают, распределяя в смеси дихлорметан/5% водный NaOH, и пропускают через колонку с диоксидом кремния, используя смесь дихлорметан/МеОН (8:2) в качестве элюента, что дает 40 мг (34%) указанного в заголовке соединения в виде масла. МСВР m/z вычисл. для C17H22N4O3 (М)+ 330,1692, найдено 330,1677. Пример 11. 1-[2-(3-н-Бутилоксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон.TMAD (0,0 60 г, 0,35 ммоль) растворяют в ТГФ (1 мл) и ДМФА (0,5 мл) и раствор добавляют по каплям к смеси 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (0,100 г, 0,310 ммоль),трифенилфосфина (0,092 г, 0,35 ммоль) и 3-н-бутилоксифенола (0,166 г, 1,00 ммоль) в ТГФ (0,5 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре, концентрируют и пропускают через колонку с диоксидом кремния, используя смесь толуол/EtOAc (7:3) в качестве элюента. Растворители удаляют в вакууме и N-t-BOC-производное обрабатывают смесью дихлорметан/ТFА/Н 2O(50:45:5; 5 мл) в течение 15 мин. Смесь концентрируют и остаток очищают хроматографией на силикагеле, используя смесь EtOAc/HOAc/MeOH/H2O (20:3:3:2) в качестве элюента. Содержащие продукт фракции концентрируют, промывают, распределяя в смеси дихлорметан/5% водный NaOH, и пропускают через колонку с диоксидом кремния, используя смесь дихлорметан/МеОН (8:2) в качестве элюента, что дает 97 мг (7%) указанного в заголовке соединения. МСВР mz вычисл. для C20H28N4O3 (М)+ 372,2161,найдено 372,2149. Пример 12. 1-[2-([1,1'-Бифенил]-3-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон.TMAD (0,060 г, 0,35 ммоль) растворяют в ТГФ (1 мл) и ДМФА (0,5 мл) и полученный раствор добавляют по каплям к смеси 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (0,100 г,0,31 ммоль), трифенилфосфина (0,0 92 г, 0,35 ммоль) и 3-н-фенилфенола (0,170 г, 1,00 ммоль) в ТГФ (0,5 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре, концентрируют и пропускают через колонку с диоксидом кремния, используя смесь толуол/EtOAc (7:3) в качестве элюента.- 15007539 Растворители удаляют в вакууме и полученное N-t-BOC-производное обрабатывают смесью дихлорметан/ТFА/Н 2O (50:45:5; 5 мл) в течение 15 мин, при перемешивании. Смесь концентрируют и остаток очищают хроматографией на силикагеле, используя смесь EtOAc/HOAc/MeOH/H2O (20:3:3:2) в качестве элюента. Содержащие продукт фракции концентрируют, промывают, распределяя в смеси дихлорметан/5% водный NaOH, и пропускают через колонку с диоксидом кремния, используя смесь дихлорметан/МеОН (8:2) в качестве элюента, что дает 16 мг (16%) указанного в заголовке соединения. МСВР m/z вычисл. для C22H24N4O2 (М)+ 376,1899, найдено 376,1888. Пример 13. 3-(1-Пиперазинил)-1-[2-(2,3,4-трифторфенокси)этил]-2(1H)-пиразинон.TMAD (0,207 г, 1,20 ммоль) добавляют к раствору 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (0,324 г, 1,00 ммоль), трифенилфосфина (0,315 г, 1,20 ммоль) и 2,3,4-трифторфенола (0,296 г, 2,00 ммоль) в ТГФ (1 мл) при комнатной температуре. После перемешивания в течение 2 ч смесь концентрируют в вакууме и пропускают через колонку с диоксидом кремния, используя смесь толуол/EtOAc (7:3) в качестве элюента. Растворители удаляют в вакууме и полученное N-t-BOCпроизводное обрабатывают смесью дихлорметан/ТFА/Н 2O (50:45:5; 5 мл) в течение 15 мин, при перемешивании. Смесь концентрируют и остаток очищают хроматографией на силикагеле, используя смесьEtOAc/HOAc/MeOH/H2O (20:3:3:2) в качестве элюента. Содержащие продукт фракции концентрируют,промывают, распределяя в смеси дихлорметан/5% водный NaOH, и пропускают через колонку с диоксидом кремния, используя смесь дихлорметан/МеОН (8:2) в качестве элюента, что дает 16 мг (17%) указанного в заголовке соединения. МСВР m/z вычисл. для C16H17F3N4O2 (М)+ 354,1304, найдено 354,1321. Пример 14. 1-[2-(2,3-Дихлорфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон.(0,326 г, 2,00 ммоль) в ТГФ (1 мл) при комнатной температуре. После перемешивания в течение 2 ч смесь концентрируют в вакууме и пропускают через колонку с диоксидом кремния, используя смесь толуол/EtOAc (7:3) в качестве элюента. Растворители удаляют в вакууме и полученное N-t-BOC-производное обрабатывают смесью дихлорметан/ТFА/Н 2O (50:45:5; 5 мл) в течение 15 мин, при перемешивании. Смесь концентрируют и остаток очищают хроматографией на силикагеле, используя смесьEtOAc/HOAc/MeOH/H2O (20:3:3:2) в качестве элюента. Содержащие продукт фракции концентрируют,промывают, распределяя в смеси дихлорметан/5% водный NaOH, и пропускают через колонку с диоксидом кремния, используя смесь дихлорметан/МеОН (8:2) в качестве элюента, что дает 60 мг (16%) указанного в заголовке соединения. МСВР m/z вычисл. для C16H18Cl2N4O2 (М)+ 368,0807, найдено 368,0818. Пример 15. 1-[2-(1,3-Бензодиоксол-5-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон.TMAD (0,207 г, 1,20 ммоль) добавляют к раствору 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (0,324 г, 1,00 ммоль), трифенилфосфина (0,315 г, 1,20 ммоль) и сезамола (0,173 г,1,25 ммоль) в ТГФ (1 мл) при комнатной температуре. После перемешивания в течение 2 ч реакционную смесь концентрируют и пропускают через колонку с диоксидом кремния, используя смесь толуол/EtOAc(7:3) в качестве элюента. Растворители удаляют в вакууме и полученное N-t-BOC-производное обрабатывают смесью дихлорметан/ТFА/Н 2 О (50:45:5; 5 мл) в течение 15 мин, при перемешивании. Смесь концентрируют и остаток очищают хроматографией на силикагеле, используя смесь EtOAc/HOAc/MeOH/H2O(20:3:3:2) в качестве элюента. Содержащие продукт фракции концентрируют, промывают, распределяя в смеси дихлорметан/5% водный NaOH, и пропускают через колонку с диоксидом кремния, используя смесь дихлорметан/МеОН (8:2) в качестве элюента, что дает 78 мг (23%) указанного в заголовке соединения. МСВР m/z вычисл. для C17H20N4O4 (M)+ 344,1485, найдено 344,1474. Пример 16. 1-[2-(2,4-Дифторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон.TMAD (0,129 г, 0,750 ммоль) добавляют к раствору 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил) пиразинилокси]этанола (0,200 г, 0,620 ммоль), трифенилфосфина (0,196 г, 1,23 ммоль) и 2,4-дифторфенола (0,160 г, 1,23 ммоль) в ТГФ (1 мл) при комнатной температуре. После перемешивания в течение 2 ч смесь концентрируют и пропускают через колонку с диоксидом кремния, используя смесь толуол/EtOAc(7:3) в качестве элюента. Растворители удаляют в вакууме и полученное N-t-BOC-производное обрабатывают смесью дихлорметан/ТFА/Н 2 О (50:45:5; 5 мл) в течение 15 мин, при перемешивании. Смесь концентрируют и остаток очищают хроматографией на силикагеле, используя смесь EtOAc/HOAc/MeOH/H2O(20:3:3:2) в качестве элюента. Содержащие продукт фракции концентрируют, промывают, распределяя в смеси дихлорметан/5% водный NaOH, и пропускают через колонку с диоксидом кремния, используя смесь дихлорметан/МеОН (8:2) в качестве элюента, что дает 30 мг (14%) указанного в заголовке соединения. МСВР m/z вычисл. для C16H18F2N4O2 (M)+ 336,1398, найдено 336,1392. Примеры 17 и 18. Общая методика.TMAD (0,207 г, 1,20 ммоль) добавляют к смеси, содержащей 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанол (0,325 г, 1,00 ммоль), трифенилфосфин (0,328 г, 1,25 ммоль) и соответствующий фенол (1,25 ммоль). Реакционную смесь перемешивают, пока исходный материал не будет израсходован (по ВЭЖХ: 2-6 ч), затем концентрируют и очищают хроматографией на силикагеле, используя смесь толуол/EtOAc (9:1-1:1) в качестве элюента. N-t-BOC-производное указанного в заголовке соединения обрабатывают смесью дихлорметан/ТFА/Н 2O (50:45:5; 5 мл) в течение 15 мин, при перемеши- 16007539 вании. Смесь концентрируют и остаток очищают хроматографией на силикагеле, используя смесь при градиенте растворителя дихлорметансмесь дихлорметан/МеОН (8:2) в качестве элюента, что дает указанное в заголовке соединение. Пример 17. 1-2-[(2-Оксо-1,3-бензоксатиол-5-ил)окси]этил-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 5 гидрокси-1,3-бензоксатиол-2-она (0,210 г, 1,25 ммоль). Выход: 0,147 г (30%). МСВР m/z вычисл. дляC17H18N4O4S (М)+ 374,1049, найдено 374,1044. Анал. (C17H18N4O4SC2F3HO2) С, Н, N. Пример 18. 1-[2-(3-Гидроксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из резорцинола (0,276 г, 0,250 ммоль). Выход: 0,159 г (37%). МСВР m/z вычисл. для C16H20N4O3 (М)+ 316,1535,найдено 316,1546. Пример 19. 3-(1-Пиперазинил)-1-[2-(6-хиноксалинилокси)этил]-2(1H)-пиразинон, гидрохлорид.TMAD (0,55 г, 3,20 ммоль) добавляют к перемешиваемой смеси 2-[3-(4-трет-бутоксикарбонил-1 пиперазинил)пиразинилокси]этанола (1,00 г, 3,08 ммоль), 6-гидроксихиноксалина (0,45 г, 3,08 ммоль) и трифенилфосфина (0,85 г, 3,24 ммоль) в ТГФ (10 мл) при комнатной температуре. Спустя 20 ч реакционную смесь концентрируют и пропускают через колонку с диоксидом кремния, используя смесь толуол/EtOAc (1:1) в качестве элюента. Хроматографическую процедуру повторяют однократно. Растворители удаляют в вакууме и полученное N-t-BOC-производное обрабатывают смесью дихлорметан/ТFА/Н 2 О (50:45:5; 5 мл) в течение 30 мин, при перемешивании. Реакционную смесь концентрируют,растворяют в 0,1 М водном НСl и промывают толуолом. Водную фазу замораживают и лиофилизуют,растворяют в EtOH и концентрируют, получая 0,843 г (70%) указанного в заголовке соединения. МСВРm/z вычисл. для C18H20N6O2 (М)+ 352,1648, найдено 352,1642. Получен, как описано в J. Org. Chem. 1951, 16, 438-442. Пример 20. 1-2-[3-(N,N-Диметиламино)фенокси]этил-3-(1-пиперазинил)пиразин-2(1H)-он, фумарат. 3-Диметиламинофенол (0,97 г, 3,70 ммоль), трифенилфосфин (0,97 г, 3,70 ммоль) и TMAD (0,64 г,3,70 ммоль) добавляют к перемешиваемому раствору 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (1,2 г, 3,7 ммоль) в сухом ТГФ (10 мл) при комнатной температуре. Спустя 24 ч реакционную смесь фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь толуол/EtOAc (3:1), содержащую 5% триэтиламина, что дает 1,30 г (81%) N-t-ВОС-производного указанного в заголовке соединения в виде масла. Полученное вещество (1,28 г, 2,89 ммоль) растворяют в дихлорметане (5 мл) и добавляют TFA (5 мл). После перемешивания при комнатной температуре в течение 4 ч реакционную смесь концентрируют в вакууме. Остаток растворяют в дихлорметане и раствор промывают последовательно 2 М водным NaOH, H2O и насыщенным раствором соли. Органический слой сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле, используя в качестве элюента смесь EtOAc/MeOH (3,5:0,5),содержащую 5% триэтиламина, что дает 0,35 г свободного основания указанного в заголовке соединения. Полученное вещество (1,03 ммоль) растворяют в сухом МеОН (3 мл) и добавляют по каплям фумаровую кислоту (0,12 г, 1,03 ммоль) в сухом МеОН (3 мл). Добавляют по каплям диэтиловый эфир. Образовавшийся осадок собирают фильтрованием, промывают диэтиловым эфиром, сушат, получают 0,37 гTMAD (129 мг, 0,75 ммоль) добавляют к смеси 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (200 мг, 0,62 ммоль), трифенилфосфина (323 мг, 1,23 ммоль), 3-гидроксибензотрифторида (199 мг, 1,23 ммоль) в ТГФ (1,5 мл). После перемешивания при комнатной температуре в течение 1 ч реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на силикагеле,используя смесь толуол/EtOAc (7:3) в качестве элюента. Содержащие продукт фракции концентрируют и полученное N-t-BOC-производное обрабатывают смесью дихлорметан/ТFА/Н 2 О (50:45:5) в течение 30 мин, при перемешивании. Смесь концентрируют в speed-vac в течение ночи и остаток очищают хроматографией на силикагеле, используя смесь СНСl3/МеОН (9:1) в качестве элюента, что дает 109 мг (49%) указанного в заголовке соединения. МСВР m/z вычисл. для C17H19F3N4O2 (М)+ 368,1460, найдено 368,1465. Примеры 22-25. Общая методика.TMAD (256 мг, 1,5 ммоль) добавляют к смеси 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (400 мг, 1,24 ммоль), трифенилфосфина (646 мг, 2,46 ммоль) и соответствующего фенола (1,23 ммоль) в сухом ТГФ (3 мл) при комнатной температуре. После перемешивания в течение 4 ч,реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на силикагеле, используя смесь толуол/EtOAc (8:2) в качестве элюента. Растворители удаляют в вакууме и полученное Nt-BOC-производное указанного в заголовке соединения обрабатывают смесью дихлорметан/ТFА/Н 2O(50:45:5) в течение 30 мин. Смесь концентрируют в speed-vac в течение ночи. Остаток распределяют в смеси 5 М водный NaOH/дихлорметан и органический слой сушат над К 2 СО 3. Удаление растворителя в- 17007539 вакууме и очистка хроматографией на силикагеле с использованием смеси СНСl3/МеОН (9:1) в качестве элюента дает указанное в заголовке соединение. Пример 22. 1-[2-(3-Фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 3-фторфенола (276 мг, 1,23 ммоль). Выход: 228 мг (58%). МСВР m/z вычисл. для C16H19FN4O2 (M)+ 318,1492,найдено 318,1487. Пример 23. 1-[2-(3-Нитрофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон. Указанное в заголовке соединение получают согласно описанной выше общей методике, исходя из 3-нитрофенола (342 мг, 1,23 ммоль). Выход: 195 мг (46%); т.пл. 171 С. МСВР m/z вычисл. дляC16H19N5O4 (M)+ 345,1437, найдено 345,1420. Пример 24. 1-[2-(3-Бензоилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон. Указанное в заголовке соединение получают согласно описанной выше общей методике, исходя из 3-бензоилфенола (488 мг, 1,23 ммоль). Выход: 120 мг (24%); т.пл. 69-70 С. МСВР m/z вычисл. дляC23H24N4O3 (М)+ 404,1848, найдено 404,1835. Пример 25. 1-[2-(3,5-Дифторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон. Указанное в заголовке соединение получают согласно описанной выше общей методике, исходя изTMAD (103 мг, 0,60 ммоль) добавляют к смеси 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (97 мг, 0,30 ммоль; примеры 26-38) или 2-[3-(4-трет-бутоксикарбонил-3-метил-1-пиперазинил)пиразинилокси]этанола (102 мг, 0,30 ммоль; примеры 39-43); или трет-бутил-4-[3-(2-гидроксиэтокси)пиразин-2-ил]-1,4-диазепан-1-карбоксилата (102 мг, 0,30 ммоль; примеры 44-47), трифенилфосфина (157 мг, 0,60 ммоль) и соответствующего фенола (0,60 ммоль) в ДМФА (3,2 мл). Смесь перемешивают в атмосфере азота при комнатной температуре приблизительно в течение 18 ч. Реакционную смесь фильтруют через шприц с Celite и концентрируют в speed-vac. N-t-BOC-производное указанного в заголовке соединения растворяют в ацетонитриле (1 мл) и очищают препаративной ВЭЖХ. Содержащие продукт фракции объединяют и концентрируют в speed-vac. Снятие N-защиты: N-t-BOC-промежуточный продукт растворяют в дихлорметане (2 мл) и добавляют при 0 С TFA (1 мл), температуре дают подняться до значения комнатной температуры и смесь перемешивают в течение 1 ч. Реакционную смесь концентрируют в speed-vac, получая указанное в заголовке соединение. Получен, как описано в примере 73. Получен, как описано в примере 75. Пример 26. 1-[2-(Фенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из фенола(56 мг, 0,60 ммоль). Выход: 22 мг (18%). Чистота по ВЭЖХ: 100%. МС m/z 301 (М+Н)+. МСВР m/z вычисл. для C16H20N4O2 (M)+ 300,1586, найдено 300,1575. Пример 27. 1-[2-(2,6-Дифторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 2,6 дифторфенола (78 мг, 0,60 ммоль). Выход: 55 мг (41%). Чистота по ВЭЖХ: 99%. МС m/z 337 (М+Н)+. МСВР m/z вычисл. для C16H18F2N4O2 (M)+ 336,1398, найдено 336,1400. Пример 28. 1-[2-(2-Цианофенокси)этил]-3-(1-пиперазинил)-2(1 Н)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 2 цианофенола (71 мг, 0,60 ммоль). Выход: 47 мг (36%). Чистота по ВЭЖХ: 96%. МС m/z 326 (М+Н)+. МСВР m/z вычисл. для C17H19N5O2 (M)+ 325,1539, найдено 325,1536. Пример 29. 1-[2-(4-Трифторметилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 4-трифторметилфенола (97 мг, 0,60 ммоль). Выход: 20 мг (14%). Чистота по ВЭЖХ: 100%. МС m/z 369 (М+Н)+. МСВР m/z вычисл. для C17H19F3N4O2 (М)+ 368,14 60, найдено 368,1465. Пример 30. 1-[2-(4-Бромфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 4 бромфенола (104 мг, 0,60 ммоль). Выход: 29 мг (20%). Чистота по ВЭЖХ: 99%. МС m/z 380 (М+Н)+. МСВР m/z вычисл. для C16H19BrN4O2 (M)+ 378,0691, найдено 378,0680. Пример 31. 1-[2-4-Фенокси (фенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 4 феноксифенола (112 мг, 0,60 ммоль). Выход: 20 мг (13%). Чистота по ВЭЖХ: 96%. МС m/z 393 (М+Н)+. МСВР m/z вычисл. для C22H24N4O3 (M)+ 392,1848, найдено 392,1856. Пример 32. 1-[2-(4-Фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 4 фторфенола (67 мг, 0,60 ммоль). Выход: 36 мг (28%). Чистота по ВЭЖХ: 100%. МС m/z 319 (М+Н)+. МСВР m/z вычисл. для C16H19FN4O2 (М)+ 318,1492, найдено 318,1505.- 18007539 Пример 33. 1-[2-(4-Изопропилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 4-изопропилфенола (82 мг, 0,60 ммоль). Выход: 59 мг (43%). Чистота по ВЭЖХ: 99%. МС m/z 343 (М+Н)+. МСВР m/z вычисл. для C19H26N4O2 (M)+ 342,2056, найдено 342,2062. Пример 34. 1-[2-(2,4,5-Трихлорфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 2,4,5 трихлорфенола (118 мг, 0,60 ммоль). Выход: 2,4 мг (2%). Чистота по ВЭЖХ: 97%. МС m/z 403 (М+Н)+. Пример 35. 1-[2-(2-Метилтиофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 2-метилсульфанилфенола (84 мг, 0,60 ммоль). Выход: 38 мг (36%). Чистота по ВЭЖХ: 97%. МС m/z 347 (М+Н)+. МСВР m/z вычисл. для C17H22N4O2S (М)+ 346,1463, найдено 346,1471. Пример 36. 1-[2-(3-Метоксифенилтио)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 3-метокситиофенола (84 мг, 0,60 ммоль). Выход: 23 мг (22%). Чистота по ВЭЖХ: 85%. МС m/z 347 (М+Н)+. МСВР m/z вычисл. для C17H22N4O2S (М)+ 346,1463, найдено 346,1468. Пример 37. 1-[2-(4-Аллил-2-метокси)феноксиэтил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 4-аллил 2-метоксифенола (99 мг, 0,60 ммоль). Выход: 69 мг (47%). Чистота по ВЭЖХ: 98%. МС m/z 371 (М+Н)+. МСВР m/z вычисл. для C20H26N4O3 (М)+ 370,2005, найдено 370,2013. Пример 38. 1-[2-(5,6,7,8-Тетрагидронафталин-2-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 5,6,7,8-тетрагидронафталин-2-ола (89 мг, 0,60 ммоль). Выход: 26 мг (19%).Чистота по ВЭЖХ: 96%. МС m/z 355 (М+Н)+. МСВР m/z вычисл. для С 20 Н 26N4O2 (М)+ 354,2056, найдено 354,2070. Пример 39. 1-[2-(2,6-Дифторфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 2,6-дифторфенола (78 мг, 0,60 ммоль). Выход: 71 мг (51%). Чистота по ВЭЖХ: 99%. МС m/z 351 (М+Н)+. МСВР m/z вычисл. для C17H20F2N4O2 (М)+ 350,1554, найдено 350,1539. Пример 40. 1-[2-(4-Трифторметилфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 4-трифторметилфенола (97 мг, 0,60 ммоль). Выход: 82 мг (55%). Чистота по ВЭЖХ: 99%. МС m/z 383 (М+Н)+. МСВР m/z вычисл. для C18H21F3N4O2 (M)+ 382,1617, найдено 382,1617. Пример 41. 1-[2-(4-Бромфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 4 бромфенола (104 мг, 0,60 ммоль). Выход: 79 мг (52%). Чистота по ВЭЖХ: 98%. МС m/z 394 (М+Н)+. МСВР m/z вычисл. для C17H21BrN4O2 (M)+ 392,0848, найдено 392,0857. Пример 42. 1-[2-(Фенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из фенола(56 мг, 0,60 ммоль). Выход: 30 мг (32%). Чистота по ВЭЖХ: 100%. МС m/z 315 (М+Н)+. МСВР m/z вычисл. для C17H22N4O2 (М)+ 314,1743, найдено 314,1746. Пример 43. 1-[2-(2,4,5-Трифторфенокси)этил]-3-(3-метил-1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 2,4,5 трифторфенола (89 мг, 0,60 ммоль) . Выход: 25 мг (22%). Чистота по ВЭЖХ: 100%. МС m/z 369 (М+Н)+. МСВР m/z вычисл. для C17H19F3N4O2 (M)+ 368,1460, найдено 368,1473. Пример 44. 1-[2-2,4,5-Трифторфенокси)этил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 2,4,5 трифторфенола (89 мг, 0,60 ммоль). Выход: 56 мг (51%). Чистота по ВЭЖХ: 98%. МС m/z 369 (М+Н)+. МСВР m/z вычисл. для C17H19F3N4O2 (М)+ 368,1460, найдено 368,1454. Пример 45. 1-[2-(4-Фторфенокси)этил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 4 фторфенола (67 мг, 0,60 ммоль). Выход: 65 мг (65%). Чистота по ВЭЖХ: 99%. МС m/z 333 (М+Н)+. МСВР m/z вычисл. для C17H21FN4O2 (M)+ 332,1649, найдено 332,1651. Пример 46. 1-[2-(4-Изопропилфенокси)этил]-3-(1,4-диазепан-1-ил)-2(1 Н)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 4-изопропилфенола (82 мг, 0,60 ммоль). Выход: 49 мг (46%). Чистота по ВЭЖХ: 99%. МС m/z 357 (М+Н)+. МСВР m/z вычисл. для C20H28N4O2 (M)+ 356,2212, найдено 356,2203. Пример 47. 1-[2-(2-Метилтио)феноксиэтил]-3-(1,4-диазепан-1-ил)-2(1H)-пиразинон, трифторацетат. Указанное в заголовке соединение получают согласно описанной выше методике, исходя из 2-метилсульфанилфенола (8 4 мг, 0,60 ммоль). Выход: 51 мг (47%). Чистота по ВЭЖХ: 98%. МС m/z 361 (М+Н)+.NaOH (100 г, 2,50 моль), воды (100 мл) и ДМСО (100 г) при 100 С. После перемешивания в течение 3 ч смеси дают охладиться и распределяют между толуолом (100 г) и водой (200 мл). К водному слою добавляют воду (300 мл), колотый лед (200 г), EtOAc (600 г) и хлорид натрия (100 г). Слои разделяют и водный слой экстрагируют дополнительной порцией EtOAc (600 г). Объединенные органические слои концентрируют в вакууме, что дает 38 г (68%) указанного в заголовке продукта. Данные 1 Н- и 13 С-ЯМР подтверждают указанную структуру. Чистота по ВЭЖХ: 100%. МСВР m/z вычисл. для C13H20N4O3 (М)+ 280,1535, найдено 280,1530. Получен по методике, описанной в WO 00/76984, пример 52, стадия 1. Стадия 2. 1-(2,4,5-Трифторбензил)-3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинон. К раствору 3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (полученного по приведенной выше стадии 1; 1,30 г, 4,66 ммоль) в ТГФ (20 мл) добавляют t-BuOK (0,53 г, 4,66 ммоль) и смесь перемешивают при комнатной температуре в течение 10 мин. Полученный раствор добавляют по каплям к перемешиваемому раствору 2,4,5-трифторбензилбромида (1,20 г, 5,33 ммоль) в ТГФ (20 мл) при комнатной температуре. Спустя 2 ч реакционную смесь охлаждают до 0 С и распределяют между водой (20 мл) и EtOAc (50 мл). Органический слой промывают насыщенным раствором соли (10 мл) и сушат надNa2SO4. Выпаривание растворителя приводит к получению 1,82 г (96%) указанного в заголовке соединения в виде масла, кристаллизующегося при стоянии. Продукт может быть перекристаллизован из третбутилметилового эфира. Чистота по ВЭЖХ: 94%. Анализы 1 Н-ЯМР и МС подтверждают указанную структуру. Стадия 3. 1-(2,4,5-Трифторбензил)-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. К раствору 1-(2,4,5-трифторбензил)-3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона(полученного по приведенной выше стадии 2; 0,50 г, 1,18 ммоль) в дихлорметане (10 мл) добавляют по каплям при 0 С TFA (2 мл). После перемешивания в течение 1 ч при комнатной температуре растворитель и TFA удаляют в вакууме, получая в результате бесцветное масло. Порошкование с диэтиловым эфиром дает белые кристаллы, которые фильтруют после охлаждения смеси до 0 С. Кристаллы промывают охлажденным диэтиловым эфиром и сушат в вакууме при 50 С, что дает 0,50 г (98%) указанного в заголовке соединения. Чистота по ВЭЖХ: 95%. Анализ 1 Н-ЯМР подтверждает указанную структуру. МСВР m/z вычисл. для C15H15F3N4O (М)+ 324,1198, найдено 324,1195. Пример 49. 1-[3-(2,4,5-Трифторфенил)пропил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Стадия 1. 3-(2,4,5-Трифторфенил)пропионовая кислота. 3-(2,4,5-Трифторфенил)акриловую кислоту (3,50 г, 17,3 ммоль) растворяют в ледяной уксусной кислоте (40 мл) и обрабатывают активированным углем (0,5 г). Смесь перемешивают в течение 20 мин,отфильтровывают уголь и промывают ледяной уксусной кислотой (20 мл) . К полученному раствору добавляют катализатор, Pd на угле, (0,45 г, 10% Pd) и смесь перемешивают в атмосфере водорода при атмосферном давлении в течение ночи. Суспензию фильтруют и концентрируют в вакууме. Остаточную уксусную кислоту удаляют путем добавления небольшого количества толуола и последующей концентрации в вакууме. Образующееся масло кристаллизуется при стоянии, и полученный продукт сушат в вакууме при 50 С, получая 3,34 г (95%) указанного в заголовке соединения. Стадия 2. 3-(2,4,5-Трифторфенил)пропан-1-ол. 3-(2,4,5-Трифторфенил)пропионовую кислоту (3,25 г, 16,0 ммоль; со стадии 1) растворяют в ТГФ(15 мл) и охлаждают до 0 С. К полученному раствору добавляют Ме 2SВН 3 (3,2 мл, 32 ммоль) по каплям за 30 мин, и образовавшуюся смесь нагревают затем до 70 С в течение 30 мин. После охлаждения до 0 С добавляют по каплям 6 М водный НСl (20 мл). Смесь нагревают до 70 С в течение 1 ч. После охлаждения до комнатной температуры смесь экстрагируют диэтиловым эфиром (2 х 20 мл) и объединенные органические слои промывают насыщенным раствором соли и сушат над Na2SO4. Упаривание и сушка в вакууме дают указанное в заголовке соединение в виде бесцветной жидкости (3,17 г, 97% чистота по ВЭЖХ), которую непосредственно используют на следующей стадии. Ранее описанный в ЕР 369812. Стадия 3. 3-(2,4,5-Трифторфенил)пропилметансульфонат. Метансульфонилхлорид (0,45 г, 3,88 ммоль) добавляют по каплям к раствору 3-(2,4,5-трифторфенил)пропан-1-ола (0,46 г, 2,41 ммоль; со стадии 2) и триэтиламина (0,71 г, 7,0 ммоль) в дихлорметане(5 мл) при 0 С. Смесь перемешивают при комнатной температуре в течение 2 ч. После полного исчезновения спирта (мониторинг методом ВЭЖХ) добавляют дихлорметан (10 мл) и воду (10 мл). Водную фазу насыщают NaCl и осуществляют экстракцию. Органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме, получая 0,66 г (100%) указанного в заголовке соединения в виде желтого масла. Чистота по ВЭЖХ: 87%. Данный продукт используют непосредственно на следующей стадии.- 20007539 Стадия 4. 1-[3-(2,4,5-Трифторфенил)пропил]-3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинон. К раствору 3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (полученного по примеру 48, стадия 1; 0,53 г, 1,91 ммоль) в ТГФ (10 мл) добавляют t-BuOK (0,21 г, 1,91 ммоль) и смесь перемешивают при комнатной температуре в течение 10 мин. Полученную смесь добавляют по каплям к раствору 3-(2,4,5-трифторфенил)пропилметансульфоната (0,66 г, 2,1 ммоль; со стадии 3) в ТГФ (10 мл). Смесь перемешивают при 35 С в течение 3 дней. Затем раствор охлаждают до 0 С и добавляют воду (20 мл) иEtOAc (25 мл). Водную фазу насыщают NaCl (2 г) и осуществляют экстракцию. После разделения и повторной экстракции EtOAc (15 мл) объединенные органические слои промывают насыщенным раствором соли и сушат над Na2SO4. Концентрация в вакууме дает 0,75 г желтого масла, которое очищают колоночной хроматографией на силикагеле, используя смесь EtOAc/н-гексан (4:1) в качестве элюента. Очистка дает 0,50 г (57%) указанного в заголовке соединения в виде бесцветного масла. Чистота по ВЭЖХ: 91%. Анализы 1 Н-ЯМР и МС подтверждают указанную структуру. Стадия 5. 1-[3-(2,4,5-Трифторфенил)пропил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат.TFA (2 мл) добавляют по каплям к раствору 1-[3-(2,4,5-трифторфенил)пропил]-3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (0,46 г, 1,02 ммоль; со стадии 4) в дихлорметане (10 мл) при 0 С. После перемешивания в течение 1 ч при комнатной температуре растворитель и TFA удаляют в вакууме, получая бесцветное масло. Порошкование с диэтиловым эфиром дает слегка беловатые кристаллы, которые фильтруют после охлаждения смеси до 0 С. Кристаллы промывают охлажденным диэтиловым эфиром и сушат в вакууме при 50 С, что дает 0,38 г (79%) указанного в заголовке соединения. Чистота по ВЭЖХ: 96%. Анализ 1 Н-ЯМР подтверждает указанную структуру. МСВР m/z вычисл. дляC17H19F3N4O (М)+ 352,1511, найдено 352,1524. Пример 50. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Стадия 1. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-(4-трет-бутоксикарбонил-1-пиперазинил)2(1H)-пиразинон. Смесь 3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (4,00 г, 14,3 ммоль; по примеру 48, стадия 1), 2-хлорметил-2,3-дигидробензо[1,4]диоксина (2,60 г, 14,3 ммоль), ДМФА (10 г) и карбоната калия (4,00 г, 28,9 ммоль) нагревают до 120 С в течение 3 ч. К реакционной смеси добавляют воду(100 г) и EtOAc (200 г) и слои разделяют. Органический слой концентрируют, и остаток очищают хроматографией на ЖХСД-колонке, используя в качестве элюента смесь с непрерывным градиентом (0-100%EtOAc в гептане). Очистка дает 0,60 г (15%) указанного в заголовке соединения в виде масла. Анализ 1 НЯМР подтверждает указанную структуру. Стадия 2. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Трифторуксусную кислоту (5 г) добавляют к смеси 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (0,6 г, 1,4 ммоль; со стадии 1) и дихлорметана (20 г). Смесь перемешивают в течение ночи и затем концентрируют в вакууме. К остатку добавляют метил-трет-бутиловый эфир (40 г) и мгновенно образующиеся кристаллы собирают. Получают 0,30 г(48%) указанного в заголовке соединения в виде белых кристаллов. Чистота по ВЭЖХ: 97%. Анализы МС и 1 Н-ЯМР подтверждают указанную структуру. МСВР m/z вычисл. для C17H20N4O3 (М)+ 328,1535,найдено 328,1538. Пример 51. 3-Пиперазин-1-ил-1-[2-(2,4,5-трифторфенокси)этил]-1H-хиноксалин-2-он, трифторацетат. Стадия 1. трет-Бутиловый эфир 4-(3-хлорхиноксалин-2-ил)пиперазин-1-карбоновой кислоты. Ди-трет-бутилдикарбонат (5,8 г, 0,027 моль) добавляют к смеси 2-хлор-3-пиперазин-1-илхиноксалина (6,6 г, 0,027 моль), триэтиламина (5,5 г, 0,054 моль) и дихлорметана (100 г) при 0 С. Смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют толуол (300 г) и воду (100 г) и слои разделяют. Органический слой концентрируют в вакууме, что дает 9,4 г (100%) указанного в заголовке соединения. Анализ 1 Н-ЯМР подтверждает указанную структуру.Oписан в WO 00/76984, пример 162, стадия 1. Стадия 2. трет-Бутиловый эфир 4-(3-оксо-3,4-дигидрохиноксалин-2-ил)пиперазин-1-карбоновой кислоты. трет-Бутиловый эфир 4-(3-хлорхиноксалин-2-ил)пиперазин-1-карбоновой кислоты (10,0 г, 28,7 ммоль; со стадии 1) добавляют к смеси гидроксида натрия (40 г), воды (40 г) и ДМСО (40 г) при 100 С. После перемешивания в течение 1 ч при указанной температуре добавляют воду (200 г) и метил-третбутиловый эфир (1000 г), и хлорид натрия (50 г). Кристаллы, образовавшиеся из органического слоя, собирают фильтрованием и сушат. Получают 4,0 г (42%) указанного в заголовке соединения в виде белых кристаллов. Анализ 1 Н-ЯМР подтверждает указанную структуру. Стадия 3. трет-Бутиловый эфир 4-3-оксо-4-[2-(2,4,5-трифторфенокси)этил]-3,4-дигидрохиноксалин-2-илпиперазин-1-карбоновой кислоты.t-BuOK (1,0 г, 8,9 ммоль) добавляют к смеси трет-бутилового эфира 4-(3-оксо-3,4-дигидрохиноксалин-2-ил)пиперазин-1-карбоновой кислоты (1 г, 9 ммоль; со стадии 2), ТГФ (20 г) и ДМСО (5 г) при комнатной температуре. Полученную смесь добавляют к раствору 2-(2,4,5-трифторфенокси)этилметансуль- 21007539 фоната (2,45 г, 9,00 ммоль; по примеру 54, стадия 4) в ТГФ (20 г). После перемешивания при комнатной температуре в течение ночи к реакционной смеси добавляют воду (100 г) и EtOAc (200 г). Слои разделяют, и органический слой концентрируют в вакууме. Остаток очищают хроматографией на ЖХСДколонке, используя в качестве элюента смесь с непрерывным градиентом (0-100% EtOAc в гептане). Выпаривание растворителя дает 0,5 г указанного в заголовке соединения в виде маслянистых кристаллов (не очищенных). Анализ 1 Н-ЯМР подтверждает указанную структуру. Данный продукт используют непосредственно на следующей стадии. Стадия 4. 3-Пиперазин-1-ил-1-[2-(2,4,5-трифторфенокси)этил]-1H-хиноксалин-2-он, трифторацетат. Трифторуксусную кислоту (5 г) добавляют к смеси трет-бутилового эфира 4-3-оксо-4-[2-(2,4,5 трифторфенокси)этил]-3,4-дигидрохиноксалин-2-илпиперазин-1-карбоновой кислоты (0,5 г, 1 ммоль; со стадии 3) и дихлорметана (20 г). После перемешивания при комнатной температуре в течение 2 ч реакционную смесь концентрируют в вакууме. Остаток очищают хроматографией (преп.-ВЭЖХ), получая 0,12 г (23%) указанного в заголовке соединения. Анализы МС и 1 Н-ЯМР подтверждают указанную структуру. Чистота по ВЭЖХ: 94%. МСВР ml z вычисл. для C20H19F3N4O2 (M)+ 404,1460, найдено 404,1475. Пример 52. 1-[2-(2,4,5-Трифторфенокси)этил]-3-(4-н-бутил-1-пиперазинил)-2(1H)-пиразинон. Стадия 1. н-Бутиловый эфир метансульфоновой кислоты. Метансульфонилхлорид (15,45 г, 0,13 моль) добавляют к смеси н-бутанола (10 г, 0,13 моль), триэтиламина (26,3 г, 0,26 моль) и дихлорметана (150 г) при 10 С. После перемешивания при комнатной температуре в течение ночи к реакционной смеси добавляют воду (100 г) и слои разделяют. Органический слой концентрируют в вакууме при комнатной температуре. Получают 18 г (90%) указанного в заголовке мезилата в виде масла. Анализ 1 Н-ЯМР подтверждает указанную структуру. Ранее описанный в J. Amer. Chem. Soc. 1933, 55, 345-349. Стадия 2. 1-[2-(2,4,5-Трифторфенокси)этил]-3-(4-н-бутил-1-пиперазинил)-2(1H)-пиразинон. Бутиловый эфир метансульфоновой кислоты (0,30 г, 1,97 ммоль; со стадии 1) добавляют к смеси 3(1-пиперазинил)-1-[2-(2,4,5-трифторфенокси)этил]-2(1H)-пиразинона (0,50 г, 1,4 ммоль; из свободного основания по примеру 3) и карбоната калия (0,10 г, 2,8 9 ммоль) в ДМСО (3 г). После перемешивания в течение 3 ч при 60 С к реакционной смеси добавляют воду (50 г) и EtOAc (100 г). Слои разделяют и органический слой концентрируют в вакууме. Остаток очищают хроматографией на ЖХСД-колонке, используя в качестве элюента смесь с непрерывным градиентом (0-100% EtOAc в гептане). Очистка дает 33 мг(8%) указанного в заголовке соединения в виде масла. Анализ 1H-ЯМР подтверждает указанную структуру. Чистота по ВЭЖХ: 100%. МСВР m/z вычисл. для C20H25F3N4O2 (М)+ 410,1930, найдено 410,1920. Пример 53. 1-[2-(2,4,5-Трифторфенокси)этил]-3-[4-(2-метоксиэтил)-1-пиперазинил]-2(1H)пиразинон, трифторацетат. Стадия 1. 2-Метоксиэтиловый эфир метансульфоновой кислоты. Метансульфонилхлорид (15 г, 0,13 моль) добавляют к смеси 2-метоксиэтанола (10 г, 0,13 моль),триэтиламина (26,5 г, 0,26 моль) и дихлорметана (150 г) при 0 С. После перемешивания при комнатной температуре в течение ночи к реакционной смеси добавляют воду (100 г). Слои разделяют и органический слой концентрируют в вакууме при комнатной температуре. Получают 13,1 г (65%) указанного в заголовке мезилата в виде масла. Анализ 1 Н-ЯМР подтверждает указанную структуру. Ранее описанный в Tetrahedron 1995, 51, 4867-4890. Стадия 2. 1-[2-(2,4,5-Трифторфенокси)этил]-3-[4-(2-метоксиэтил)-1-пиперазинил]-2(1H)-пиразинон,трифторацетат. 2-Метоксиэтиловый эфир метансульфоновой кислоты (0,15 г, 0,97 ммоль; со стадии 1) добавляют к смеси 3-(1-пиперазинил)-1-[2-(2,4,5-трифторфенокси)этил]-2(1H)-пиразинона (0,30 г, 0,85 ммоль; из свободного основания по примеру 3) и карбоната калия (0,30 г, 2,17 ммоль) в ДМСО (6 г). После перемешивания при 60 С в течение 3 ч к реакционной смеси добавляют воду (5 г) и EtOAc (30 г). Слои разделяют и органический слой концентрируют в вакууме. Остаток (0,2 г) очищают хроматографией (прел.-ВЭЖХ),что дает 60 мг (13%) указанного в заголовке соединения. Анализы 1 Н-ЯМР и МС подтверждают указанную структуру. Чистота по ВЭЖХ: 95%. Пример 54. 1-[2-(2,4,5-Трифторфенокси)этил]-3-(4-метил-1-пиперазинил)-2(1 Н)-пиразинон. Стадия 1. 1-(3-Хлор-2-пиразинил)-4-метилпиперазин. Смесь 2,3-дихлорпиразина (5,0 г, 34 ммоль), N-метилпиперазина (5,1 г, 51 ммоль) и карбоната калия(7,0 г, 51 ммоль) в ацетонитриле (100 мл) перемешивают при температуре окружающей среды в течение 2 ч. Добавление гексана с последующим фильтрованием и концентрация фильтрата дают 7,3 г сырого продукта в виде оранжевой жидкости. Очистка фильтрованием через диоксид кремния с использованием смеси гептан/EtOAc (3:1) и впоследствии смеси EtOAc/ацетон (1:1) дает 4,1 г (57%) указанного в заголовке соединения в виде желтого масла, затвердевающего при охлаждении. Чистота по ВЭЖХ: 100%. МС m/z 213 (М+Н)+. Описан в WO 00/76984, пример 169, стадия 1. Стадия 2. 3-(4-Метил-1-пиперазинил)-2(1H)-пиразинон. К раствору NaOH (5,4 г, 125 ммоль) в смеси вода/ДМСО (1:1; 15 мл) при 80 С добавляют 1-(3-хлор- 22007539 2-пиразинил)-4-метилпиперазин (получен по приведенной выше стадии 1; 2,5 г, 12 ммоль). После перемешивания в течение 2 ч темно-красный раствор охлаждают до комнатной температуры, экстрагируютEtOAc в течение ночи, получая, после высушивания и удаления растворителя в вакууме, 0,96 г (43%) указанного в заголовке соединения в виде не совсем белого твердого вещества. Чистота по ВЭЖХ: 88%. МС m/z 195 (М+Н)+. МСВР m/z вычисл. для C9H14N4O (M)+ 194,1168, найдено 194,1159. Стадия 3. 2-(2,4,5-Трифторфенокси)этанол.t-BuOK (3,0 г, 27 ммоль) добавляют к смеси 1,2,4,5-тетрафторбензола (2,0 г, 13,3 ммоль) и этиленгликоля (7,5 мл, 133 ммоль) в ДМСО (50 мл) и нагревают до 80 С в течение 1 ч и затем до 60 С в течение ночи. Добавляют EtOAc и полученный раствор промывают несколько раз водой. Органический слой сушат (Na2SO4) и осторожно концентрируют в вакууме при 30 С, получая 1,5 г (содержащего 14% EtOAc) указанного в заголовке соединения в виде белого полутвердого вещества. Анализ ЯМР подтверждает указанную структуру. Данный продукт используют непосредственно на следующей стадии. Стадия 4. 2-(2,4,5-Трифторфенокси)этилметансульфонат. Триэтиламин (1,8 мл, 13,2 ммоль) добавляют к охлажденному (0 С) раствору из смеси 2-(2,4,5 трифторфенокси)этанола (1,3 г, 6,6 ммоль; со стадии 3) и метансульфонилхлорида (0,61 мл, 7,9 ммоль) в дихлорметане (40 мл). После перемешивания в течение 1,5 ч добавляют воду и смесь концентрируют. Остаток растворяют в EtOAc и раствор промывают 1 М KHSO4, затем насыщенным раствором соли, сушат (Na2SO4) и концентрируют, получая 1,78 г (количественный выход) указанного в заголовке соединения в виде оранжевого масла. Анализ ЯМР подтверждает указанную структуру. Данный продукт используют непосредственно на следующей стадии. Стадия 5. 1-[2-(2,4,5-Трифторфенокси)этил]-3-(4-метил-1-пиперазинил)-2(1H)-пиразинон. Смесь 3-(4-метил-1-пиперазинил)-2(1H)-пиразинона (полученного по приведенной выше стадии 2; 0,5 г, 2,6 ммоль) и t-BuOK (440 мг, 3,90 ммоль) в ТГФ (40 мл) перемешивают до тех пор, пока смесь не загустеет (около 10 мин), и затем добавляют раствор 2-(2,4,5-трифторфенокси)этилметансульфоната(0,90 г, 2,2 ммоль; со стадии 4) в ТГФ (10 мл). После перемешивания в течение 5 дней при температуре окружающей среды ВЭЖХ свидетельствует только о 50% конверсии. Затем реакционный раствор нагревают до 60 С в течение ночи, что приводит почти к полной конверсии. Реакционную смесь обрабатывают следующим образом: добавляют воду, ТГФ выпаривают и водную смесь экстрагируют дваждыEtOAc, сушат (Na2SO4) и концентрируют, получая 1,08 г сырого продукта в виде желтого масла. Очистка хроматографией на силикагеле [элюент: 2% МеОН в CHCl3+NH3 (г)] дает указанное в заголовке соединение в виде желтого масла, затвердевающего при охлаждении. Выход: 304 мг (32%). Чистота по ВЭЖХ: 100%. МС m/z 369 (М+Н)+. МСВР m/z вычисл. для C17H19F3N4O2 (М)+ 368,1460, найдено 368,1462. Пример 55. 1-[2-(2,4,5-Трифторфенокси)этил]-3-(4-изопропил-1-пиперазинил)-2(1H)-пиразинон. Стадия 1. 2-Хлор-3-(4-изопропилпиперазин-1-ил)пиразин. Смесь 2,3-дихлорпиразина (5,0 г, 34 ммоль), 1-изопропилпиперазина (6,5 г, 51 ммоль) и карбоната калия (7,0 г, 51 ммоль) в ацетонитриле (100 мл) перемешивают при температуре окружающей среды в течение 2 ч. Добавление гексана с последующим фильтрованием и концентрация фильтрата дают 9,5 г сырого продукта в виде оранжевой жидкости. Очистка фильтрованием через диоксид кремния с использованием смеси гептан/EtOAc (3:1) и впоследствии смеси EtOAc/ацетон (1:1) дает 6,5 г (79%) указанного в заголовке соединения в виде желтого масла, затвердевающего при охлаждении. Чистота по ВЭЖХ: 98%. МС m/z 241 (М+Н)+. МСВР m/z вычисл. для C11H17ClN4 (M)+ 240,1142, найдено 240,1138. Стадия 2. 3-(4-Изопропил-1-пиперазинил)-2(1H)-пиразинон. К раствору NaOH (5,4 г, 125 ммоль) в смеси вода/ДМСО (1:1; 15 мл) добавляют 2-хлор-3-(4-изопропилпиперазин-1-ил)пиразин (2,66 г, 12 ммоль; со стадии 1). После перемешивания при 80 С в течение 2 ч темно-красный раствор охлаждают до комнатной температуры, экстрагируют EtOAc в течение ночи, получая, после высушивания и удаления растворителя в вакууме, 2,6 г (70%) указанного в заголовке соединения в виде белого твердого вещества. Чистота по ВЭЖХ: 87%. МС m/z 223 (М+Н)+. МСВР m/z вычисл. для C11H18N4O (M)+ 222,1481, найдено 222,1489. Стадия 3. 1-[2-(2,4,5-Трифторфенокси)этил]-3-(4-изопропил-1-пиперазинил)-2(1H)-пиразинон. Смесь 3-(4-изопропил-1-пиперазинил)-2(1H)-пиразинона (0,58 г, 2,6 ммоль; со стадии 2) и t-BuOK(440 мг, 3,90 ммоль) в ТГФ (40 мл) перемешивают до тех пор, пока смесь не загустеет (около 10 мин), и затем добавляют раствор 2-(2,4,5-трифторфенокси)этилметансульфоната (0,90 г, 2,2 ммоль; по примеру 54, стадия 4) в ТГФ (10 мл). После перемешивания в течение 5 дней при температуре окружающей среды ВЭЖХ свидетельствует только о 25% конверсии. Затем реакционный раствор нагревают до 60 С в течение ночи, что приводит почти к полной конверсии. Реакционную смесь обрабатывают следующим образом: добавляют воду, ТГФ выпаривают и водную смесь экстрагируют дважды EtOAc, сушат (Na2SO4) и концентрируют, получая 1,18 г сырого продукта в виде желтого масла. Очистка хроматографией на силикагеле (элюент: 2,5% МеОН в CHCl3+NH3 (г дает указанное в заголовке соединение в виде бесцветного масла, затвердевающего при охлаждении. Выход: 120 мг (14%). Чистота по ВЭЖХ: 99%. МС m/z 397 (М+Н)+. МСВР m/z вычисл. для C19H23F3N4O2 (M)+ 396,1773, найдено 396,1771. Пример 56. 1-2-[(5-Метил[1,2,4]триазоло[1,5-а]пиримидин-7-ил)окси]этил-3-(1-пиперазинил)-2(1H)пиразинон, гидрохлорид.DEAD (0,4 85 мкл, 3,08 ммоль) добавляют к перемешиваемому раствору 2-[3-(4-третбутоксикарбонил-1-пиперазинил)пиразинилокси]этанола (1,00 г, 3,08 ммоль), 5-метил-s-триазоло[1,5-а] пиримидин-7-ола (0,465 г, 3,08 ммоль) и трифенилфосфина (0,85 г, 3,24 ммоль) в ТГФ (10 мл). После перемешивания в течение 2 ч реакционную смесь концентрируют, пропуская через колонку с диоксидом кремния и используя смесь толуол/EtOAc (1:1) в качестве элюента. Полученное N-t-BOC-производное указанного в заголовке соединения обрабатывают смесью дихлорметан/ТFА/Н 2O (50:45:5; 10 мл) в течение 45 мин, концентрируют, растворяют в 0,1 М водном НСl и промывают толуолом. Водную фазу концентрируют, получая 0,21 г (17%) указанного в заголовке соединения. Pos-EI-MS обнаруживает ионы М+DEAD (0,520 мл, 3,3 ммоль) добавляют к суспензии 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил) пиразинилокси]этанола (1,00 г, 3,08 ммоль), 4-цианофенола (0,381 г, 3,20 ммоль) и связанного со смолой трифенилфосфина (1,1 г, 3,3 ммоль) в дихлорметане (10 мл) и встряхивают в течение ночи. Реакционную смесь фильтруют, концентрируют и очищают хроматографией на силикагеле, используя смесь толуол/EtOAc (1:1) в качестве элюента, что дает 0,168 г (13%) указанного в заголовке соединения. Анализы 1 Н-ЯМР и МС подтверждают указанную структуру. МСВР m/z вычисл. для C22H27N5O4 (М)+ 425,2063,найдено 425,2075. Стадия 2. 1-[2-(4-Цианофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон, малеат. трет-Бутил-4-4-[2-(4-цианофенокси)этил]-3-оксо-3,4-дигидро-2-пиразинил-1-пиперазинкарбоксилат(0,145 г, 0,34 ммоль; со стадии 1) обрабатывают смесью дихлорметан/ТFА/Н 2O (50:45:5; 5 мл) в течение 30 мин, выливают в 5% водный NaOH и экстрагируют диэтиловым эфиром. Эфирную фазу сушат и концентрируют, получая 0,104 г свободного основания указанного в заголовке соединения. Полученный продукт и малеиновую кислоту (0,037 г, 0,32 ммоль) растворяют в МеОН и концентрируют, получая 0,133 г (88%) указанного в заголовке соединения. Pos-EI-MS обнаруживает ионы М+ +11, подтверждающие указанную структуру. МСВР m/z вычисл. для C17H19N5O2 (М)+ 325,1539, найдено 325,1531. Пример 58. 1-[4-(2,4,5-Трифторфенокси)бутил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Стадия 1. 4-(2,4,5-Трифторфенокси)бутан-1-ол. К смеси 1,4-бутандиола (15 г, 0,17 моль) и t-BuOK (8,0 г, 0,071 моль) добавляют 1,2,4,5-тетрафторбензол (5,0 г, 33 ммоль) и ДМСО (50 г) при 60 С. После перемешивания при указанной температуре в течение 18 ч к реакционной смеси добавляют толуол (2 00 мл), воду (50 мл) и хлорид натрия (10 г). Слои разделяют и органический слой концентрируют в вакууме, получая указанное в заголовке соединение. Данный продукт используют непосредственно на следующей стадии. Стадия 2. 4-(2,4,5-Трифторфенокси)бутиловый эфир метансульфоновой кислоты. Триэтиламин (2,5 мл, 18,2 ммоль) добавляют к охлажденному (0 С) раствору из смеси 4-(2,4,5-трифторфенокси)бутан-1-ола (2,0 г, 9,1 ммоль; со стадии 1) и метансульфонилхлорида (0,77 мл, 10 ммоль) в дихлорметане (40 мл). После перемешивания в течение 1 ч добавляют воду и органическую фазу отделяют, сушат и концентрируют, получая 2,45 г (90%) указанного в заголовке мезилата в виде бесцветного масла. Структура указанного соединения подтверждена анализом 1 Н-ЯМР. Стадия 3. трет-Бутил-4-4-[4-(2,4,5-трифторфенокси)бутил]-3-оксо-3,4-дигидро-2-пиразинил-1-пиперазинкарбоксилат. Смесь 3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (1,20 г, 4,30 ммоль; по примеру 48, стадия 1) и t-BuOK (730 мг, 6,50 ммоль) в ТГФ (10 мл) перемешивают в течение 10 мин и затем добавляют к раствору 4-(2,4,5-трифторфенокси)бутилового эфира метансульфоновой кислоты (1,23 г, 4,3 ммоль; со стадии 2) в ТГФ (50 мл). После перемешивания при комнатной температуре в течение 1 дня ВЭЖХ свидетельствует о приблизительно 30% конверсии. Спустя 3 дня реакционную смесь обрабатывают: добавляют воду, ТГФ выпаривают и водную смесь экстрагируют дважды EtOAc, сушат и концентрируют,получая 2,21 г сырого продукта в виде желтого масла. Анализ ВЭЖХ свидетельствует о соотношении 5/1 между указанным в заголовке продуктом и изомерным О-алкилированным продуктом. Очистка хроматографией на силикагеле с использованием смеси EtOAc/гексан (1/2-1/1) в качестве элюента дает 870 мг(М+Н)+. Данные о распределении основаны на анализе ЯМР. Стадия 4. 1-[4-(2,4,5-Трифторфенокси)бутил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Снимают N-защиту, осуществляя взаимодействие трет-бутил-4-4-[4-(2,4,5-трифторфенокси)бутил]-3-оксо-3,4-дигидро-2-пиразинил-1-пиперазинкарбоксилата (830 мг, 1,80 ммоль; со стадии 3) с TFA(4 мл) в дихлорметане (15 мл) в течение 1,5 ч при комнатной температуре. Выпаривание избытка TFA и растворителя с последующим добавлением диэтилового эфира дает, после фильтрования и промывки диэтиловым эфиром, указанное в заголовке соединение в виде светло-розового твердого вещества. Выход: 800 мг (91%), т.пл. 113,4-116,6 С (разл.). Чистота по ВЭЖХ: 100%. MC m/z 38 3 (М+Н)+. МСВР m/z- 24007539 вычисл. для C18H21F3N4O2 (М)+ 382,1617, найдено 382,1622. Пример 59. 1-[3-(2,4,5-Трифторфенокси)пропил]-3-(1-пиперазинил)-2(1H)-пиразинон, трифторацетат. Стадия 1. 3-(2,4,5-Трифторфенокси)пропан-1-ол. К смеси 1,3-пропандиола (15 г, 0,17 моль) и t-BuOK (8,0 г, 0,071 моль) добавляют 1,2,4,5-тетрафторбензол (5,0 г, 33 ммоль) и ДМСО (50 г) при 60 С. После перемешивания при указанной температуре в течение 18 ч к реакционной смеси добавляют толуол (200 мл), воду (50 мл) и хлорид натрия (10 г). Слои разделяют и органический слой концентрируют в вакууме, получая указанное в заголовке соединение, которое используют непосредственно на следующей стадии. Стадия 2. 3-(2,4,5-Трифторфенокси)пропиловый эфир метансульфоновой кислоты. Триэтиламин (1,36 мл, 9,80 ммоль) добавляют к охлажденному (0 С) раствору из смеси 3-(2,4,5 трифторфенокси)пропан-1-ола (1,0 г, 4,9 ммоль; со стадии 1) и мезилхлорида (0,418 мл, 5,40 ммоль) в дихлорметане (20 мл). После перемешивания в течение 1 ч добавляют воду и органическую фазу отделяют, сушат и концентрируют, получая 1,35 г (97%) указанного в заголовке мезилата в виде бесцветного масла. Стадия 3. трет-Бутил-4-4-[3-(2,4,5-трифторфенокси)пропил]-3-оксо-3,4-дигидро-2-пиразинил-1 пиперазинкарбоксилат. Смесь 3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (0,83 г, 3,0 ммоль; по примеру 48, стадия 1) и t-BuOK (497 мг, 4,4 ммоль) в ТГФ (5 мл) перемешивают в течение 10 мин и затем добавляют к 3-(2,4,5-трифторфенокси)пропиловому эфиру метансульфоновой кислоты (0,80 г, 3,0 ммоль; со стадии 2) в ТГФ (50 мл). После перемешивания при комнатной температуре в течение 1 дня ВЭЖХ свидетельствует о приблизительно 20% конверсии. Спустя 6 дней реакционную смесь обрабатывают: добавляют воду, ТГФ выпаривают и водную смесь экстрагируют дважды EtOAc, сушат и концентрируют, получая 1,33 г сырого продукта в виде желтого масла. Анализ ВЭЖХ свидетельствует о соотношении 1/1 между указанным в заголовке продуктом и изомерным О-алкилированным продуктом. Очистка хроматографией на силикагеле с использованием смеси EtOAc/гексан (1/3-1/1,7) в качестве элюента дает 427 мг(2 мл) в дихлорметане (10 мл) в течение 1,5 ч при комнатной температуре. Выпаривание избытка TFA и растворителя с последующим добавлением диэтилового эфира дает, после фильтрования, промывки диэтиловым эфиром и сушки, указанное в заголовке соединение в виде светло-розового твердого вещества. Выход: 350 мг (73%), т.пл. 100,3-100,9 С (разл.). Чистота по ВЭЖХ: 100%; МС m/z 369 (М+Н)+. МСВРm/z вычисл. для C17H19F3N4O2 (М)+ 368,1460, найдено 368,1466. Пример 60. 3-[4-(1-Фенилэтил)пиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1 Н)-он,гидрохлорид (рацемический). Смесь 3-(1-пиперазинил)-1-[2-(2,4,5-трифторфенокси)этил]-2(1H)-пиразинона (354 мг, 1,00 ммоль; из свободного основания по примеру 3), 1-бром-1-фенилэтана (204 мг, 1,10 ммоль) и К 2 СO3 (276 мг, 2,00 ммоль) в ацетонитриле (10 мл) перемешивают при 30 С в течение ночи. Реакционную смесь фильтруют и концентрируют в вакууме. Остаток очищают на колонке с SiO2, используя смесь дихлорметан/МеОН (95:5) в качестве элюента. Продукт выделяют в виде HCl-соли. Выход: 0,26 г (50%); Чистота по ВЭЖХ: 99%; т.пл. 137-139 С. МСВР вычисл. для C24H25F3N4O2 (М)+ 458,1930, найдено 458,1933. Пример 61. 3-[4-(2-Феноксиэтил)пиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)он, гидрохлорид. Указанное в заголовке соединение получают согласно методике примера 60, исходя из 3-(1-пиперазинил)-1-[2-(2,4,5-трифторфенокси)этил]-2(1H)-пиразинона (0,35 г, 1,0 ммоль; из свободного основания по примеру 3) и 2-бромэтилфенилового эфира (0,22 г, 1,1 ммоль). Выход 0,14 г (27%). Чистота по ВЭЖХ: 99%. МСВР вычисл. для C24H25F3N4O3 (М)+ 474,1879, найдено 474,1887. Пример 62. 3-[4-(2-Фенилэтил)пиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он,гидрохлорид. Указанное в заголовке соединение получают согласно методике примера 60, исходя из 3-(1-пиперазинил)-1-[2-(2,4,5-трифторфенокси)этил]-2(1H)-пиразинона (0,71 г, 2,0 ммоль; из свободного основания по примеру 3) и (2-бромэтил)бензола (0,41 г, 2,2 ммоль). Выход: 0,20 г (20%). Чистота по ВЭЖХ: 96%. МСВР вычисл. для C24H25F3N4O2 (М)+ 458,1930, найдено 458,1928. Пример 63. 3-(4-Бензилпиперазин-1-ил)-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он, гидрохлорид. Указанное в заголовке соединение получают согласно методике примера 60, исходя из 3-(1-пиперазинил)-1-[2-(2,4,5-трифторфенокси)этил]-2(1H)-пиразинона (0,35 г, 1,0 ммоль; из свободного основания по примеру 3) и бензилбромида (0,19 г, 1,1 ммоль) Выход: 0,17 г (35%); Чистота по ВЭЖХ: 99%; т.пл. 214-214,5 С. МСВР вычисл. для C23H23F3N4O2 (М)+ 444,1773, найдено 444,1789. Пример 64. 3-[(2R)-2-Метилпиперазин-1-ил]-1-[2-(2,4,5-трифторфенокси)этил]пиразин-2(1H)-он, три- 25007539 фторацетат. К раствору трет-бутил-(3R)-4-[3-(2-гидроксиэтокси)пиразин-2-ил]-3-метилпиперазин-1-карбоксилата (по примеру 74; 338 мг, 1,00 ммоль), 2,4,5-трифторфенола (178 мг, 1,2 ммоль) и трифенилфосфин(315 мг, 1,20 ммоль) в ТГФ (5 мл) добавляют DEAD (210 мг, 1,2 ммоль) и полученную смесь оставляют перемешиваться при комнатной температуре в течение 4 ч. Смесь концентрируют и остаток пропускают через колонку с диоксидом кремния, используя в качестве элюента растворитель дихлорметансмесь дихлорметан/МеОН (95:5). Очищенный продукт, N-t-BOC-производное указанного в заголовке соединения, растворяют в дихлорметане (5 мл) и добавляют TFA (1 мл). Смесь перемешивают при комнатной температуре в течение 60 ч, концентрируют в вакууме и остаток очищают препаративной ВЭЖХ, получая 125 мг (25%) указанного в заголовке продукта. Чистота по ВЭЖХ: 95%. МСВР m/z вычисл. дляC17H19F3N4O2 (M)+ 368,1460, найдено 368,1448. Пример 65. 1-[2-(4-Аллил-2-метоксифенокси)этил]-3-пиперазин-1-илпиразин-2(1H)-он, малеат. 3-(4-трет-Бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинон (по примеру 48, стадия 1; 3,08 г, 11,0 ммоль) растворяют в ТГФ (20 мл). Добавляют t-BuOK (1,23 г, 11 ммоль) и смесь перемешивают в течение 10 мин при комнатной температуре, после чего добавляют раствор 2-(4-аллил-2-метоксифенокси)этилметансульфоната (3,15 г, 11 ммоль) в ТГФ (15 мл). Полученную смесь оставляют перемешиваться на субботу и воскресенье. Добавляют EtOAc (150 мл) и насыщенный раствор соли (30 мл) и смесь перемешивают в течение нескольких минут. Органический слой сушат Nа 2SО 4 и концентрируют, получая маслянистый остаток, который очищают на колонке с SiO2, элюируя растворителем дихлорметансмесь дихлорметан/ МеОН (97,5:2,5). Фракции, содержащие N-t-BOC-производное указанного в заголовке соединения, объединяют и концентрируют. Получают 1,4 6 г масла, которое повторно растворяют в дихлорметане (60 мл) и добавляют TFA (8 г). После перемешивания в течение 2 ч смесь концентрируют и остаток растворяют в воде, добавляют Nа 2 СО 3 (тв.) и дихлорметан; перемешивают в течение 5 мин; отделяют фазу дихлорметана; сушат (Na2SO4) и концентрируют, получая зеленоватое масло (900 мг). Полученный материал очищают на колонке с SiO2, используя в качестве элюента смесь дихлорметан/МеОН (97,5:2,590:10). Полученный продукт выделяют в виде соли малеиновой кислоты. Выход: 0,46 г (9%). Чистота по ВЭЖХ: 93%; т.пл. 158-160 С; МС m/z 371 (М+Н)+. МСВР m/z вычисл. для C20H26N4O3 (М)+ 370,2005, найдено 370,2005. Данное соединение, в виде соли трифторуксусной кислоты, получают альтернативным способом в примере 37. Получен по общей методике, описанной в примере 76. Пример 66. 3-Пиперазин-1-ил-1-[2-(3-тиенил)этил]пиразин-2(1H)-он, малеат. Указанное в заголовке соединение получают согласно методике примера 65, исходя из 3-(4-третбутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (2,24 г, 8,0 ммоль; по примеру 48, стадия 1), 2-(3 тиенил)этилметансульфоната (1,65 г, 8,00 ммоль) и t-BuOK (1,35 г, 12,0 ммоль). Выход: 0,48 г (20%). Чистота по ВЭЖХ: 96%. МС m/z 291 (М+Н)+. МСВР m/z вычисл. для C14H18N4OS (M)+ 290,1201, найдено 290,1208. Получен по методике примера 76 и ранее описан в J. Am. Chem. Soc. 1987, 109, 1858-1859. Пример 67. 3-Пиперазин-1-ил-1-[2-(2-тиенил)этил]пиразин-2(1H)-он, трифторацетат. Указанное в заголовке соединение получают согласно методике примера 65, исходя из 3-(4-третбутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (2,24 г, 8,0 ммоль; по примеру 48, стадия 1), 2-(2 тиенил)этилметансульфоната (1,65 г, 8,00 ммоль) и t-BuOK (1,35 г, 12,0 ммоль). Выход: 0,62 г (19%). Чистота по ВЭЖХ: 96%. МС m/z 291 (М+Н)+. МСВР m/z вычисл. для C14H18N4OS (M)+ 290,1201, найдено 290,1203. Получен по методике примера 76 и ранее описан в J. Am. Chem. Soc. 1989, 32, 1108-1118. Пример 68. 1-[2-(lH-Индол-3-ил)этил]-3-пиперазин-1-илпиразин-2(1H)-он, трифторацетат. Указанное в заголовке соединение получают согласно методике примера 65, исходя из 3-(4-третбутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (0,93 г, 3,4 ммоль; по примеру 48, стадия 1), 2(индол-3-ил)этилметансульфоната (1,1 г, 3,4 ммоль) и t-BuOK (0,38 г, 3,4 ммоль). Выход: 22 мг (2%). Чистота по ВЭЖХ: 95%. МСВР m/z вычисл. для C18H21N5O (M)+ 323,1746, найдено 323,1754. Получен по методике примера 76. Пример 69. 1-[2-(2,3-Дигидро-1,4-бензодиоксин-5-илокси)этил]-3-пиперазин-1-илпиразин-2(1H)-он,трифторацетат. Указанное в заголовке соединение получают согласно методике примера 65, исходя из 3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (0,72 г, 2,6 ммоль; по примеру 48, стадия 1), 2-(2,3-дигидро-1,4-бензодиоксин-5-илокси)этилметансульфоната (0,86 г, 2,6 ммоль) и t-BuOK (0,29 г, 2,6 ммоль). Выход: 185 мг (15%). Чистота по ВЭЖХ: 99%. МСВР m/z вычисл. для C18H22N4O4 (М)+ 358,1641, найдено 358,1650. Получен по методике примера 76. Соответствующий спирт, 2-(2,3-дигидро-1,4-бензодиоксин-5 илокси)этанол получают по общей методике, описанной в WО 00/76984, пример 91, стадия 1. Пример 70. 1-[2-(Фенилтио)этил]-3-пиперазин-1-илпиразин-2(1H)-он, трифторацетат.- 26007539 Указанное в заголовке соединение получают согласно методике примера 65, исходя из 3-(4-третбутоксикарбонил-1-пиперазинил)-2(1H)-пиразинона (2,41 г, 8,62 ммоль; по примеру 48, стадия 1), 2 фенилсульфанилэтилметансульфоната (2,00 г, 8,62 ммоль) и t-BuOK (0,97 г, 8,62 ммоль). Выход: 80 мг(2%). Чистота по ВЭЖХ: 99%. МСВР m/z вычисл. для C16H20N4OS (M)+ 316,1358, найдено 316,1357. Получен по методике примера 76. Пример 71. 1-(3-Оксо-3-фенилпропил)-3-пиперазин-1-илпиразин-2(1H)-он, трифторацетат. Указанное в заголовке соединение получают согласно методике примера 65, исходя из 3-(4-третбутоксикарбонил-1-пиперазинил)-2(1 Н)-пиразинона (0,56 г, 2,00 ммоль; по примеру 48, стадия 1), промышленно выпускаемого 3-хлор-1-фенилпропан-1-она (0,34 г, 2,0 ммоль) и t-BuOK (0,22 г, 2,0 ммоль). Выход: 0,45 г (52%). Чистота по ВЭЖХ: 97%. МС m/z 313 (М+Н)+. МСВР m/z вычисл. для C17H20N4O2(М)+ 312,1586, найдено 312,1587. Пример 72. 1-[3-(4-Фторфенил)-3-оксопропил]-3-пиперазин-1-илпиразин-2(1 Н)-он, трифторацетат. Указанное в заголовке соединение получают согласно методике примера 65, исходя из 3-(4-трет-бутоксикарбонил-1-пиперазинил)-2(1 Н)-пиразинона (0,56 г, 2,00 ммоль; по примеру 48, стадия 1), промышленно выпускаемого 3-хлор-1-(4-фторфенил)пропан-1-она (0,37 г, 2,0 ммоль) и t-BuOK (0,22 г, 2,0 ммоль). Выход: 0,14 г (15%). Чистота по ВЭЖХ: 98%. МС m/z 331 (М+Н)+. МСВР m/z вычисл. для C17H19FN4O2(M)+ 330,1492, найдено 330,1498. Пример 73 (промежуточный продукт). 2-[3-(4-трет-Бутоксикарбонил-3-метил-1-пиперазинил)пиразинилокси]этанол. Стадия 1. 2-Хлор-3-(3-метилпиперазин-1-ил)пиразин. Смесь 2,3-дихлорпиразина (2,80 г, 18,8 ммоль), рацемического 2-метилпиперазина (1,88 г, 18,8 ммоль) и К 2 СО 3 (3,90 г, 28,2 ммоль) в ацетонитриле (25 мл) нагревают до 65 С в течение 15 ч при перемешивании. Реакционную смесь фильтруют и концентрируют. Сырой продукт очищают флэш хроматографией на силикагеле, используя смесь СНСl3/МеОН (15:1) в качестве элюента, что дает 3,2 г (79%) указанного в заголовке соединения. МС m/z 213 (М+Н)+. Стадия 2. трет-Бутил-4-(3-хлорпиразин-2-ил)-2-метилпиперазин-1-карбоксилат. Триэтиламин (1,82 г, 17,9 ммоль) добавляют к раствору 2-хлор-3-(3-метилпиперазин-1-ил)пиразина(3,18 г, 15,0 ммоль; со стадии 1) в дихлорметане (20 мл) при 0 С. Добавляют по каплям ди-трет-бутилдикарбонат (3,92 г, 17,9 ммоль) в дихлорметане (20 мл) и полученную смесь перемешивают при 0 С в течение 30 мин. Смеси дают нагреться до комнатной температуры и перемешивание продолжают еще 15 ч. Реакционную смесь промывают водой, органический слой сушат над MgSO4 и концентрируют в вакууме,получая 3,12 г (67%) указанного в заголовке соединения. МС m/z 313 (М+Н)+. Стадия 3. 2-[3-(4-трет-Бутоксикарбонил-3-метил-1-пиперазинил)пиразинилокси]этанол. К смеси трет-бутил-4-(3-хлорпиразин-2-ил)-2-метилпиперазин-1-карбоксилата (3,0 г, 9,6 ммоль; со стадии 2) в этиленгликоле (10 мл) и диоксане (30 мл) добавляют t-BuOK (1,18 г, 10,6 ммоль). Полученную смесь перемешивают при 90 С в атмосфере N2, в течение ночи. К светло-коричневой реакционной смеси добавляют воду (10 мл) и экстрагируют дихлорметаном (3 х 20 мл). Органический слой сушат надMgSO4, фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией, используя смесь толуол/EtOAc (2:3) в качестве элюента, получают 3,19 г (98%) указанного в заголовке соединения. Чистота по ВЭЖХ: 99%. МС m/z 339 (М+Н)+. МСВР m/z вычисл. для C16H26N4O4 (М)+ 338,1954,найдено 338,1953. Пример 74 (промежуточный продукт). трет-Бутил-(3R)-4-[3-(2-гидроксиэтокси)пиразин-2-ил]-3 метилпиперазин-1-карбоксилат. Смесь трет-бутил-(3R)-4-(3-хлорпиразин-2-ил)-3-метилпиперазин-1-карбоксилата (35 г, 0,11 моль),этиленгликоля (100 г, 1,61 моль) и t-BuOK (25 г, 0,22 моль) в ДМСО (150 г) перемешивают при 50 С в течение 3 ч. По прошествии указанного времени реакционную смесь распределяют между EtOAc (500 г) и водой (500 г) и добавляют хлорид натрия (20 г). Органический слой концентрируют в вакууме, получая 32,5 г (87%) указанного в заголовке продукта. Чистота по ВЭЖХ: 75%. МСВР m/z вычисл. дляC16H26N4O4 (М)+ 338,1954, найдено 338,1959. Описан в WO 00/76984, пример 172, стадия 2. Пример 75 (промежуточный продукт). трет-Бутил-4-[3-(2-гидроксиэтокси)пиразин-2-ил]-1,4-диазепан-1-карбоксилат. Стадия 1. трет-Бутил-4-(3-хлорпиразин-2-ил)-1,4-диазепан-1-карбоксилат. К перемешиваемой смеси 2,3-дихлорпиразина (1,91 г, 12,8 ммоль) и N-t-BOC-гомопиперазина, (2,57 г,12,8 ммоль) в ацетонитриле (25 мл), добавляют К 2 СO3 (2,65 г, 19,2 ммоль). Смесь нагревают на масляной бане (65 С) в течение ночи. Раствор фильтруют и растворитель выпаривают. Масло содержит белый осадок, поэтому указанное масло растворяют в ацетонитриле и фильтруют вновь. Сырую смесь очищают флэш хроматографией, используя смесь толуол/EtOAc (7:3) в качестве элюента. Анализ 1 Н-ЯМР подтверждает указанную структуру. Выход: 2,13 г (53%). Чистота по ВЭЖХ: 97%. Стадия 2. трет-Бутил-4-[3-(2-гидроксиэтокси)пиразин-2-ил]-1,4-диазепан-1-карбоксилат. К перемешиваемой смеси трет-бутил-4-(3-хлорпиразин-2-ил)-1,4-диазепан-1-карбоксилата (2,5 г,8,0 ммоль; со стадии 1) в этиленгликоле (8 мл) и диоксане (25 мл) добавляют t-BuOK (0,99 г, 8,8 ммоль).- 27007539 Смесь нагревают до 90 С с конденсатором, в атмосфере N2, в течение ночи. К светло-коричневой смеси добавляют воду (10 мл) и экстрагируют дихлорметаном (3 х 20 мл). Органическую фазу сушат надMgSO4. Раствор фильтруют и растворитель выпаривают. Остаток очищают хроматографией на силикагеле, используя смесь толуол/EtOAc (2:3) в качестве элюента. Анализ 1 Н-ЯМР подтверждает указанную структуру. Выход: 1,66 г (61%). Чистота по ВЭЖХ: 100%. МС m/z 339 (М+Н)+. Пример 76. Общая методика получения мезилатов, используемых в примерах 65-70: исходный спирт (1 экв.) и триэтиламин (2 экв.) растворяют в дихлорметане; раствор охлаждают смесью лед/вода; добавляют по каплям при перемешивании метансульфонилхлорид (1,5 экв.); смесь перемешивают при комнатной температуре в течение 1 ч; разбавляют смесь дихлорметаном; промывают водой; сушат над Na2SO4 и концентрируют, получая мезилат. Сырой мезилат содержит остаточный триэтиламин (до 0,6 мол.экв.). Получение фармацевтической композиции Пример. Получение таблеток. Ингредиенты мг/таблетка 1. Активное соединение формулы (I) 10,0 2. Целлюлоза, микрокристаллическая 57,0 3. Гидрофосфат кальция 15,0 4. Натрийкрахмалгликолят 5,0 5. Диоксид кремния, коллоидный 0,25 6. Стеарат магния 0,75 Активный ингредиент 1 смешивают с ингредиентами 2,3,4 и 5 около 10 мин. Затем добавляют стеарат магния, полученную смесь перемешивают около 5 мин и прессуют в форме таблетки с пленочным покрытием или без указанного покрытия. Фармакологические методики Способность соединения по изобретению связывать подтипы специфических рецепторов 5-НТ, или оказывать действие на указанные подтипы рецепторов, может быть установлена использованием известных из уровня техники испытаний in vitro и in vivo. Биологическую активность соединений, полученных в примерах, изучают, используя различные испытания. Испытание на сродство Сродство соединений по примерам к рецептору 5-НТ 2A определяют конкурентными исследованиями, где измеряют, после быстрого фильтрования через фильтры из стекловолокна, способность каждого соединения в ряду последовательных разбавлений вытеснять 3 Н-меченный диэтиламид лизергиновой кислоты (ЛСД), связанный с мембранами, полученными из подвергнутой трансфекции клеточной линии СНО, стабильно экспрессирующей белок рецептора 5-НТ 2A человека. Неспецифическое связывание определяют, используя миансерин (5 мкМ). Величину сродства к рецептору 5-НТ 2A выражают через значения Ki. Результаты, полученные для характерных соединений по изобретению, иллюстрируются приведенной ниже таблице. Значения Ki для соединений по отношению к рецептору 5-НТ 2 А человека находятся в пределах 0,1-1500 нМ. Сродство к рецептору 5-НТ 2A человека СоединениеKi, нМ Пример 2 152 Пример 3 2,2 Пример 11 2,5 Пример 13 29 Пример 23 13 Пример 24 3,6 Пример 29 8 Пример 31 4,4 Пример 62 0,15 Пример 63 1,4 Функциональное испытание in vitro Антагонистическую активность по отношению к рецептору 5-НТ 2A полученных в примерах соединений по настоящему изобретению оценивают по их неспособности к мобилизации внутриклеточного кальция в подвергнутых трансфекции клетках СНО, стабильно экспрессирующих белок рецептора 5 НТ 2 А человека, используя кальций-хелатирующий флуоресцентный краситель FLUO-3 (Sigma, St. Louis,МО, U.S.A.) при концентрации субстрата 1 мкМ. Кроме того, антагонистическая активность указанных соединений по отношению к рецептору 5-НТ 2A может быть установлена по их способности ингибировать 5-НТ-индуцированное высвобождение кальция в подвергнутых трансфекции клетках СНО, стабильно экспрессирующих белок рецептора 5-НТ 2A человека, путем использования кумулятивных методик доза- 28007539 эффект. На основании приведенных экспериментов может быть рассчитана функциональная константа ингибирования Кb. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I)R1 означает Н или C1-6-алкил, арил-С 1-С 3-алкил, гетероарил-С 1-С 3-алкил, 2-гидроксиэтил, метоксиС 2-С 4-алкил, С 1-С 4-алкоксикарбонил, арилокси-С 2-С 3-алкил или гетероарилокси-С 2-С 3-алкил; где любой арильный или гетероарильный остаток может быть замещен группой С 1-С 4-алкил, С 1-С 4 алкокси, С 1-С 4-алкилтио, галоген, трифторметил, трифторметокси или циано; каждый из R2 и R3 независимо означает Н или СН 3; каждый из R4 и R5 независимо означает Н, галоген, метил, либо указанные заместители образуют вместе с кольцом, к атомам углерода которого присоединены, ядро 1 Н-хиноксалин-2-она; иR6 означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH, гетероарил-NH, арил,арилкарбонил, гетероарил или гетероарилкарбонил; где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, может быть незамещен или замещен одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из группы, включающей арил, арил-С 1-2-алкил, арилкарбонил, гетероарил, гетероарил-С 1-2 алкил, гетероарилкарбонил, арилокси, гетероарилокси, арилтио, гетероарилтио, ариламино, гетероариламино, С 3-6-циклоалкил, С 3-6-циклоалкилокси, С 3-6-циклоалкилкарбонил, C1-6-алкил, С 2-6-алканоил, С 2-6 алкинил, С 2-6-алкенил или фтор-С 2-4-алкилокси, галоген, трифторметил, нитро, циано, трифторметокси,трифторметилтио, C1-С 6-алкокси, C1-С 6-алкилтио, C1-С 6-алкиламино, C1-4-диалкиламино, гидрокси или оксо; где любой арильный или гетероарильный остаток, в качестве заместителей на ариле или гетероариле, в отдельности или как часть другой группы, в свою очередь, может быть замещен по одному или более положениям, независимым друг от друга, группой, выбранной из группы, включающей C1-4-алкил, C1-4 алкокси, C1-4-алкилтио, галоген, трифторметил, трифторметокси или циано; и их фармацевтически приемлемые соли, гидраты, геометрические изомеры, таутомеры, оптические изомеры, N-оксиды и пролекарственные формы, при условии, чтоR2 и R3 оба одновременно не означают СН 3; когда R1, R2, R4 и R5 означают Н и R3 означает Н или СН 3, то R6 не означает 3-пиридилокси, 6 метил-2-нитро-3-пиридилокси или 2-хлор-3-пиридилокси; когда n=0, то R6 не означает арилокси, гетероарилокси, арилтио, гетероарилтио, арил-NH или гетероарил-NH; и соединение формулы (I) не означает 1-бензил-3-(4-метилпиперазин-1-ил)-1H-хиноксалин-2-он, где арил представляет собой ароматические моно- или бициклические циклы с 6-10 атомами углерода в цикле; гетероарил представляет собой моно- или бициклическую систему ароматических циклов, где только один цикл должен быть ароматическим и указанная гетероарильная составляющая может быть связана с остатком молекулы посредством атома углерода или азота в любом цикле, содержащую от 5 до 10 атомов в моно- или бициклическом цикле, из которых один или более атомов цикла являются отличными от углерода, такими как азот, сера, кислород и селен. 2. Соединение по п.1, где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, замещен одним или двумя негалогеновыми заместителями. 3. Соединение по п.1, где любой арильный или гетероарильный остаток, в отдельности или как часть другой группы, замещен по меньшей мере одним галогеновым заместителем. 4. Соединение по п.1, где любой арильный или гетероарильный остаток, замещенный другим ари- 29007539 лом или гетероарилом, рассматриваемый в отдельности или как часть другой группы, в свою очередь,замещен по одному положению. 5. Соединение по п.1, гдеR6 означает фенокси, где фенильный цикл указанной феноксигруппы может быть незамещенным или замещен одним, двумя, тремя, четырьмя или пятью заместителями. 6. Соединение по п.5, где фенильный цикл заместителя R6 замещен одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из группы, включающей галоген,2-пропенил,C1-С 6-алкил,C1-С 6-алкокси,трифторметил,фенил,фенокси,бензоил и С 3-6-циклоалкил; где фенильный, фенокси или бензоильный заместитель, в свою очередь, может быть замещен по одному или более положениям, независимым друг от друга, заместителем, выбранным из группы, включающей C1-4-алкил, C1-4-алкокси, C1-4-алкилтио, галоген, трифторметил, трифторметокси или циано. 7. Соединение по п.6, где фенильный цикл заместителя R6 замещен одним или двумя негалогеновыми заместителями. 8. Соединение по п.6, где галогеновый заместитель означает фтор. 9. Соединение по п.1, гдеR6 означает фенил, где указанный фенил может быть замещен галогеном по одному, двум, трем, четырем или пяти положениям. 12. Соединение по п.11, где галоген означает фтор. 13. Соединение по одному из пп.1-12, которое выбрано из группы, включающей 1-[2-(2-фтор-4-нитрофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-2-[(2-оксо-2H-хромен-7-ил)окси]этил-3-(1-пиперазинил)-2(1H)-пиразинон,3-(1-пиперазинил)-1-[2-(2,4,5-трифторфенокси)этил]-2(1H)-пиразинон,3-(1-пиперазинил)-1-[2-(2,3,5,6-тетрафторфенокси)этил]-2(1H)-пиразинон,1-[2-(2,3,4,5,6-пентафторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-хлор-2-фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-цианофенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(4-циклопентилфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(1,2-бензизоксазол-3-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-метоксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-н-бутилоксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-([1,1'-бифенил]-3-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,3-(1-пиперазинил)-1-[2-(2,3,4-трифторфенокси)этил]-2(1H)-пиразинон,1-[2-(2,3-дихлорфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(1,3-бензодиоксол-5-илокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(2,4-дифторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,1-2-[(2-оксо-1,3-бензоксатиол-5-ил)окси]этил-3-(1-пиперазинил)-2(1H)-пиразинон,1-[2-(3-гидроксифенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,3-(1-пиперазинил)-1-[2-(6-хиноксалинилокси)этил]-2(1H)-пиразинон,1-2-[3-(N,N-диметиламино)фенокси]этил-3-(1-пиперазинил)пиразин-2(1H)-он,3-(1-пиперазинил)-1-2-[3-(трифторметил)фенокси]этил-2(1H)-пиразинон,1-[2-(3-фторфенокси)этил]-3-(1-пиперазинил)-2(1H)-пиразинон,- 30
МПК / Метки
МПК: A61P 15/00, A61P 25/24, A61P 9/00, C07D 295/033, A61P 3/10, A61P 25/28, A61K 31/496, C07D 403/02, A61P 3/04
Метки: нарушений, лечения, пиперазинона, 5-нт2а-рецептором, новые, производные, связанных
Код ссылки
<a href="https://eas.patents.su/30-7539-novye-proizvodnye-piperazinona-dlya-lecheniya-narushenijj-svyazannyh-s-5-nt2a-receptorom.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные пиперазинона для лечения нарушений, связанных с 5-нт2а-рецептором</a>
Предыдущий патент: Антагонисты cxcr3
Следующий патент: Пролекарство ингибитора бета-лактамазы
Случайный патент: Концентрированная гербицидная композиция












